Optimization of Extraction Process and Properties of Protein from Peony Seed Meal
-
摘要: 采用碱溶酸沉法提取牡丹籽粕蛋白,通过单因素和正交试验优化牡丹籽粕蛋白提取工艺,并对牡丹籽粕蛋白的理化性质和功能性质做出测定。结果表明,对蛋白质得率影响因素为:pH>提取时间>提取温度>料液比。在料液比1:20 g/mL、提取温度70 ℃、pH9、提取时间45 min的最佳条件下,牡丹籽粕蛋白的得率为79.83%±1.22%。SDS-PAGE显示,牡丹籽蛋白有五种分子量的蛋白质,分别有两种在15~25 kDa之间,有两种在35~40 kDa之间,有一种在55~70 kDa之间。傅里叶红外显示,牡丹籽粕蛋白中主要为α-螺旋和β-折叠,同时含有分子间氢键和少量碳水化合物。扫描电镜显示,牡丹籽粕蛋白中主要由β-折叠构成。与大豆蛋白、花生蛋白、豌豆蛋白对比发现,牡丹籽粕蛋白具有较好的持油性,达到4.5 g/g,和大豆蛋白相似的起泡性和乳化性。本研究可为牡丹籽粕蛋白在食品工业中的应用提供参考依据。Abstract: Protein from peony seed meal was extracted by alkali dissolution and acid precipitation. The extraction process was optimized by single factor and orthogonal experiments, and the physical and chemical properties and functional properties including isoelectric point, molecular weight, secondary structure, foaming property and foaming stability of the protein were determined. The results showed that the influencing factors on protein yield were: pH>extraction time>extraction temperature>solid-liquid ratio. The optimal extraction conditions were under the optimum conditions of material liquid ratio 1:20 g/mL, extraction temperature 70 ℃, pH9 and extraction time 45 min, the yield of protein from peony seed meal was 79.83%±1.22%. SDS-PAGE showed that there were five kinds of protein with molecular weight, two of which were between 15~25 kDa, two of which were between 35~40 kDa, and one of which was between 55~70 kDa. Fourier infrared spectroscopy showed that the protein in peony seed meal was mainly α-helix and β-folding, containing intermolecular hydrogen bonds and a small amount of carbohydrate. The scanning electron microscope showed that the protein in peony seed meal was mainly composed of β-folding composition. Compared with soybean protein, peanut protein and pea protein, peony seed meal protein had a good oil holding capacity of 4.5 g/g, which was similar to soybean protein in foaming and emulsification. This study can provide a reference for the application of peony seed meal protein in the food industry.
-
Keywords:
- peony seed meal /
- protein /
- extraction process /
- attribute
-
牡丹籽粕为牡丹籽榨油后所形成的副产物,在牡丹籽油生产过程中会产生30%左右的牡丹籽粕[1]。牡丹籽粕中含有大量的蛋白质[2]、多糖[3]、膳食纤维以及少量的油脂[4]、单萜苷类[5]、芪类[6]、三萜[7]、甾醇类、黄酮类和其他类[8-9],这些化合物使牡丹籽粕具有抗氧化[10]、抗癌[11]、抗菌和抗肿瘤[12]等功效。榨油后的牡丹籽粕当前主要被当做饲料或肥料使用,使牡丹籽的综合利用价值未完全发挥[13]。刘普等[14-15]主要研究牡丹籽饼粕中的单萜苷类和低聚芪类的分离、纯化以及含量检测。Shi等[16]主要研究了热缓冲溶液、螯合剂、高浓度和低浓度碱液提取牡丹籽粕多糖的流变性能、理化性质和抗氧化性能[17]。Gong等[18]使用酶法水解牡丹籽粕蛋白,发现牡丹籽粕水解产物可以促进免疫器官发育。牡丹籽粕也被用作发酵酒以及酱油的原料[19-21]。这些研究成果成功展示了牡丹籽粕的综合利用价值。因此,为更进一步地提高牡丹籽的综合利用效率,研究牡丹籽粕的性质势在必行。
植物蛋白在食品中的应用非常广泛,因此其提取及性质研究日益受到关注。植物蛋白的提取技术已经相当成熟,目前最常见的方法有碱溶酸沉法、酶解法、有机溶剂法、盐溶法和反胶束法等。碱溶酸沉法主要是利用蛋白质在碱性环境中其结构变得疏松[22],溶解度提高;当溶液的pH下降时,蛋白质会聚集在一起,形成沉淀。王敏等[2]使用碱溶酸沉法,发现牡丹籽粕蛋白提取率为56.77%,且发现在高温条件、pH3.0~9.0时牡丹籽粕蛋白有良好抗氧化性;李若敏等[23]发现使用酶水解-超声辅助碱溶酸沉法提取牡丹籽粕蛋白的最佳提取工艺为:料液比1:9.8,超声温度49.5 ℃,酶用剂量1.9%,超声时间119 min,在此条件下蛋白质提取率为90.95%。蛋白质的化学和物理特性以及分子结构和大小,这些特性会影响其食品的制造、加工、贮藏和消费[24]。蛋白质的功能特性包括溶解性、持水性和持油性、乳化性、起泡性和凝胶性,主要受原料的类型、加工方法以及蛋白质提取方法影响[25]。但鲜有将牡丹籽粕蛋白的理化性质、功能特性进行较为全面的分析评价的研究。因此,对牡丹籽粕蛋白的理化性质、功能特性开展研究,将有利于牡丹籽的综合利用与加工。
本研究以单因素和正交试验确定牡丹籽粕蛋白提取的最佳工艺参数,并将牡丹籽粕蛋白和三种植物蛋白进行性质对比,包括蛋白质的分子量、二级结构与持水性、持油性、起泡性和乳化性,从而评价牡丹籽粕蛋白功能特性。本文旨在为牡丹籽粕蛋白的科学提取提供理论依据,同时首次为牡丹籽粕蛋白在食品工业中作为优质蛋白的替代品提供系统而全面的数据支撑,实现牡丹籽粕生物利用率的提升。
1. 材料与方法
1.1 材料与仪器
牡丹籽粕 主要含有萜苷类物质和大量蛋白[26],山西省长治市屯留区潞安石圪节智华生物科技有限公司提供;85%磷酸、乙醇、牛血清蛋白、考马斯亮蓝、十二烷基硫酸钠(SDS)、溴化钾、无水乙醇、氢氧化钠、盐酸 均为分析纯,购买于国药集团化学试剂有限公司;大豆蛋白、花生蛋白、豌豆蛋白样品 亿宝莱食品配料有限公司;大豆油 金龙鱼粮油食品股份有限公司;蛋白上样缓冲液(5×)、蛋白Mark(10~180 kDa)、SDS-PAGE凝胶配制试剂盒 碧云天生物技术公司。
AL-204分析天平 梅特勒-托利多仪器(上海)有限公司;ZY-601磁力搅拌恒温水浴锅 上海森地科学仪器设备有限公司;UV2350型紫外可见分光光度计 尤尼柯(上海)仪器有限公司;LGJ-10真空冷冻干燥机 北京博医康实验仪器有限公司;FE20Plus pH计 梅特勒-托利多仪器有限公司;F6-10手持式均质器 上海净信实业发展有限公司;VERTEX70傅里叶变换红外光谱仪 德国Bruker公司;DYPP-44P型电泳仪 北京市六一仪器厂;S-3400N扫描电子显微镜 日本高新那珂事业所。
1.2 实验方法
1.2.1 蛋白质标准曲线的制作
配制牛血清蛋白标准溶液(1 mg/mL),在7支试管中分别加入0、0.01、0.02、0.04、0.06、0.08、0.1 mL的标准溶液,加去离子水至0.1 mL,每个试管中加入考马斯亮蓝溶液5 mL,振荡均匀后静置10 min,595 nm的波长测其吸光值,绘制蛋白质标准曲线。测得结果为y=0.0077x+0.011,R2=0.998。
得率(%)=标曲计算牡丹籽粕蛋白提取量/牡丹籽粕质量×100。
1.2.2 牡丹籽粕蛋白的提取工艺
1.2.2.1 制备流程
利用牡丹籽粕蛋白提取的工艺参数生产蛋白提取液,再用1 mol/L的盐酸调节提取液的pH为4,使牡丹籽粕蛋白充分沉淀,4000 r/min离心5 min,用去离子水将上清液定容到一定体积,考马斯亮蓝法测定蛋白质含量[26]。用去离子水洗涤3次的蛋白质沉淀,然后进行冷冻干燥,制得牡丹籽粕蛋白粉末。
1.2.2.2 单因素实验
称取5 g牡丹籽粕粉,以蒸馏水为提取剂,在温度为70 ℃,提取时间为45 min,pH为8,料液比为1:10、1:15、1:20、1:25、1:30 g/mL,进行单因素实验。
称取5 g牡丹籽粕粉,以蒸馏水为提取剂,在料液比为1:20 g/mL,提取时间为45 min,pH为8,提取温度为40、50、60、70、80 ℃,进行单因素实验。
称取5 g牡丹籽粕粉,以蒸馏水为提取剂,在料液比为1:20 g/mL,温度为70 ℃,提取时间为45 min,用1 mol/L的NaOH将pH调为7、8、9、10、11,进行单因素实验。
称取5 g牡丹籽粕粉,以蒸馏水为提取剂,在料液比为1:20 g/mL,温度为70 ℃,pH为8,提取时间为30、45、60、75、90 min,进行单因素实验。
1.2.2.3 正交试验
以料液比、温度、pH和时间为因素,采用L9(34)表做正交试验(见表1)。用考马斯亮蓝法测定蛋白质含量,根据牡丹籽粕蛋白得率确定最佳提取工艺。
表 1 正交试验因素水平Table 1. Orthogonal experimental factors and levels水平 因素 料液比(g/mL) 温度(℃) pH 时间(min) 1 1:15 60 7 30 2 1:20 70 8 45 3 1:25 80 9 60 1.2.3 牡丹籽粕蛋白与三种常见蛋白的理化性质比较
1.2.3.1 聚丙烯酰胺凝胶电泳的测定
取适量的牡丹籽粕蛋白、大豆蛋白、花生蛋白和豌豆蛋白配制成3 mg/mL的蛋白质溶液,将蛋白质溶液和蛋白上样缓冲液(5×)按照4:1的比例混合,100 ℃水浴3~5 min,使蛋白质充分变性。
按照SDS-PAGE凝胶配制试剂盒中的说明书配制12%的分离胶10 mL,待分离胶在夹板中凝固后,再配制浓缩胶3 mL,凝固后四种蛋白质进行上样处理。先电压为80 V蛋白质浓缩50 min,再电压为120 V蛋白质进行分离1 h。
1.2.3.2 傅里叶变换红外光谱的测定
各取少量四种蛋白质粉末,与溴化钾粉末均匀混合,在研钵中研磨均匀,用10 MPa左右的压力压成透明薄片。使用傅里叶变换红外光谱仪在4000~500 cm−1的波数内进行分析,以透射模式记录光谱,每个光谱32次扫描,分辨率为8 cm−1。
1.2.3.3 扫描电镜的测定
参考Shilpashree等[27]的方法,并稍作修改。在样品盘上贴上导电胶,将少量四种植物蛋白用毛细管均匀地粘合在导电胶上,用洗耳球吹去未黏住的样品,然后放入真空蒸发器中镀上金属膜(2~5次),在真高空下将加速电压调至5 kV,进行电镜扫描。放大倍数为120~130倍。
1.2.4 牡丹籽粕蛋白与三种常见蛋白的功能特性
1.2.4.1 持水性和持油性的测定
取四种植物蛋白各1 g,记为V,在已称重的离心管(V1)中与10 mL蒸馏水混合,玻璃棒搅拌离心管1 min后,静置30 min。再以8000 r/min离心10 min。除去上清液,称量离心管与内容物总重量(V2)[28]。蛋白质持水性计算如下:
持水性(g/g)=V2−(V+V1)V (1) 取四种植物蛋白各0.5 g,记为V,与6 mL大豆油在已称重的离心管(V1)中混合。搅拌1 min,使样品完全分散在大豆油中。静置30 min,样品以8000 r/min离心10 min。用移液管吸取上清液,称量离心管与内容物总重量(V2)[29]。吸油量表示为每克分离蛋白吸收的油克数。蛋白质持油性计算如下:
持油性(g/g)=V2−(V+V1)V (2) 1.2.4.2 起泡性和起泡稳定性的测定
分别制备20 mL浓度为10 mg/mL的四种植物蛋白溶液(V),并用1 mol/L的NaOH将其pH调节至8。将该溶液用恒温磁力搅拌器以800 r/min在30 ℃搅拌30 min,在高速均化器中以10000 r/min均化1 min。将搅打的蛋白质溶液转移到50 mL量筒中,在0 min(V0)和10 min(V1)记录体积[24]。以式(3)计算蛋白质的起泡性,以式(4)计算起泡稳定性。
起泡性(%)=V0−VV×100 (3) 起泡稳定性(%)=V1−VV×100 (4) 1.2.4.3 乳化性和乳化稳定性的测定
乳化性(Emulsifying activity indices,EAI)测定具体参考Taheri等[30]的方法,并稍作修改。将四种植物蛋白溶液(10 mg/mL,浓度:C)用1 mol/L NaOH调节至pH8,并在室温下搅拌30 min。然后,将18 mL蛋白质溶液与2 mL大豆油混匀,然后在10000 r/min的速度下均质1 min。乳液(50 μL)样品在0 min从试管底部移出,并用0.1%十二烷基硫酸钠溶液5 mL稀释。使用分光光度计在500 nm测量均化后0 min(A0)的乳液吸光度值。计算乳化性EAI(m2/g)的公式为:
ESI=2×2.303×A0φ×C (5) 式中,φ为大豆油占乳状液的体积比(0.1)。
乳化稳定性(Emulsion stability indices,ESI)的测定[31],就是将测定EAI后的乳状液样品静置10 min,再测定其乳化性,记为A10。乳化稳定性ESI(min)计算公式为:
ESI=A0×ΔtA0−A10 (6) 式中,Δt为时间间隔(min)。
1.3 数据处理
所有实验均重复三次。所有结果均表示为3次重复的“平均值±标准差”。使用SPSS 20.0对数据进行方差分析,确定差异显著性,图表使用Origin pro 2022及Excel进行绘制。
2. 结果与分析
2.1 牡丹籽粕蛋白提取实验
2.1.1 单因素对蛋白质得率的影响
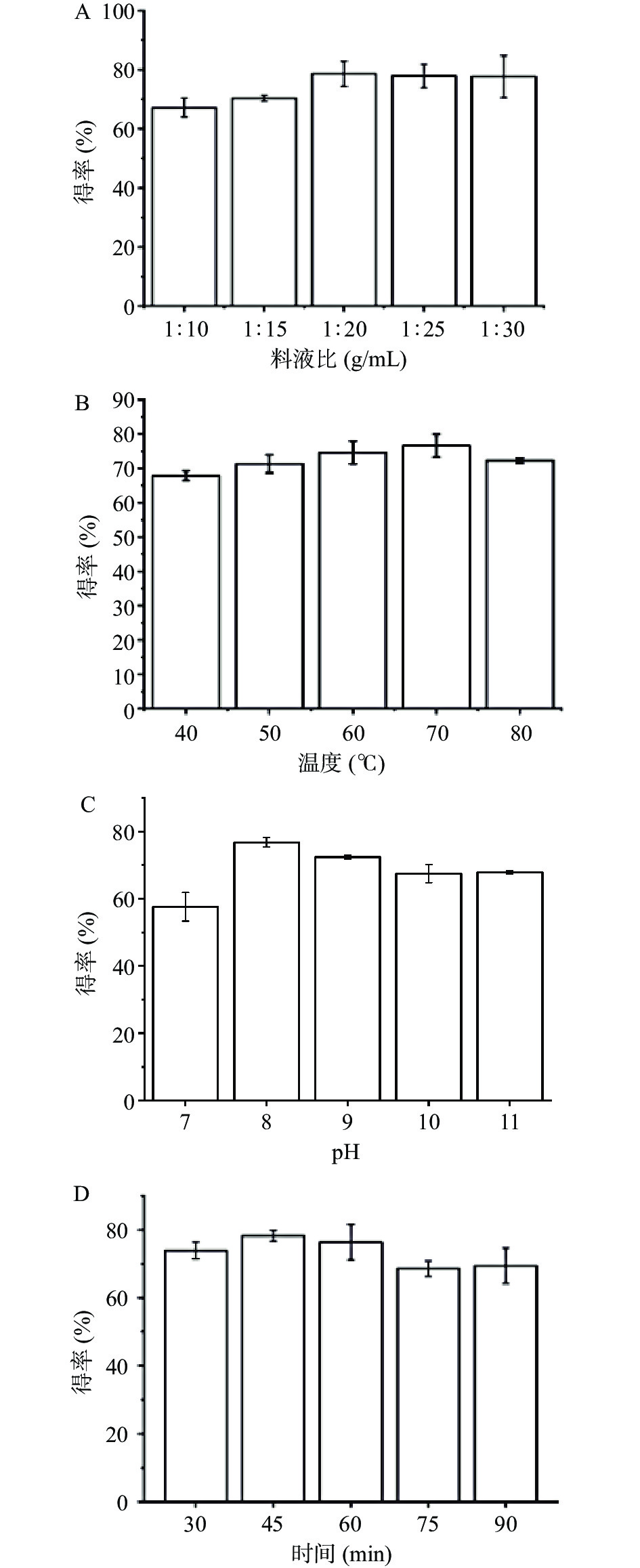
由图1A可知,随料液比的增加,牡丹籽粕蛋白的得率逐渐上升,在1:20 g/mL时达到最高值。可能由于料液比的增加,牡丹籽粕中的纤维素,多糖等大分子因吸收水分而舒展开,从而内部的蛋白质分子释放溶解[32]。当料液比为1:20 g/mL时,牡丹籽粕蛋白得率为78.81%±0.21%。当料液比大于1:20 g/mL时,蛋白质的得率变化缓慢,此时水分使蛋白质得到充分释放。田璇等[33]实验发现在料液比为1:25 g/mL时,获得最高蛋白得率。这可能是由于不同产地的牡丹籽粕吸水能力不同。因此,当料液比为1:20 g/mL时,达到最佳提取条件。
由图1B可知,在温度为70 ℃以下时,伴随温度上升,蛋白质的得率不断提升。原因为温度上升使分子间的运动增加,有助于提升细胞壁的渗透性,更有助于蛋白质的溶解;但是温度继续上升,造成蛋白质的失活,分子间作用力下降,降低其溶解度,蛋白质的得率下降[34]。当温度为70 ℃时,牡丹籽粕蛋白的得率为76.57%±0.04%。此结果与李加兴等[35]结论相似。因此,温度为70 ℃时,达到牡丹籽粕蛋白的最佳提取条件。
溶液pH对牡丹籽粕蛋白提取的影响如图1C所示。图中显示pH处在8时蛋白质的得率最高,达到76.74%±0.01%,可能原因为牡丹籽粕中的碱性蛋白在碱性条件下,蛋白质分子之间的吸引力降低,促进了蛋白质的溶解,从而此条件下得率较高[26]。但当pH为10、11时,蛋白质的得率下降并趋于稳定,原因为强碱会使蛋白质变性,降低了蛋白质的溶解性。因此,当pH8时,达到牡丹籽粕蛋白的最佳提取条件。
由图1D可知,随着提取时间不断延长,牡丹籽粕蛋白的得率先增加再减少趋于稳定。当提取时间为45 min时,蛋白质的得率最高为78.27%±0.02%。在45 min之前,由于提取时间短造成蛋白质没有完全溶出。在60 min之后,由于加热时间过长,使蛋白质变性或部分水解,造成蛋白质的得率有所下降。因此,当提取时间为45 min时,达到牡丹籽粕蛋白的最佳提取条件。
2.1.2 正交试验结果与分析
在单因素实验的基础上,进一步通过正交设计试验优化了牡丹籽蛋白的提取工艺。由表2可以看出,pH对蛋白质的提取效果的影响最大,这与单因素实验结果相吻合,时间、温度和料液比对蛋白质提取的影响次之。正交试验结果表明,当因素组合为A2B2C3D2时,即料液比1:20 g/mL、温度70 ℃、pH9、时间45 min,牡丹籽粕蛋白的得率最高,达到79.83%±1.22%。
表 2 牡丹籽粕蛋白提取的正交试验Table 2. Orthogonal experiment of extraction of protein from peony seed meal实验号 A 料液比 B 温度 C pH D时间 得率(%) 1 1 1 1 1 50.75±0.10 2 1 2 2 2 75.15±0.08 3 1 3 3 3 73.55±0.00 4 2 1 2 3 72.50±0.16 5 2 2 3 1 73.29±0.02 6 2 3 1 2 54.48±0.30 7 3 1 3 2 71.46±0.11 8 3 2 1 3 52.71±0.76 9 3 3 2 1 70.50±0.00 K1 66.483 64.903 52.647 64.847 K2 66.757 67.050 72.717 67.030 K3 64.890 66.117 72.767 66.253 R 1.867 2.147 20.120 2.183 主次水平 C>D>B>A 优化方案 A2B2C3D2 2.2 牡丹籽粕蛋白与三种常见蛋白的理化性质比较分析
2.2.1 聚丙烯酰胺凝胶电泳的分析
四种植物蛋白质的凝胶电泳结果如图2所示,牡丹籽粕蛋白主要含有5种分子量的蛋白质,在15~25 kDa之间有两条蛋白质条带,35~40 kDa之间有两条蛋白质条带,55~70 kDa之间有一条条带,这与Gao等[36]的研究类似;大豆蛋白和豌豆蛋白凝胶电泳的蛋白质条带较为相似,两者具有分子量范围相同的蛋白质条带,并且每个分子量的条带的位置相同,说明大豆蛋白和豌豆蛋白的分子量组成较为类似;花生蛋白的图谱中可以看出4条明显的条带,分布于15~25、35~40和70 kDa附近。比较四种植物蛋白的电泳图,大豆蛋白和豌豆蛋白含有的亚基分子量较大,牡丹籽粕蛋白和花生蛋白的分子量分布有些相似。
2.2.2 傅里叶变换红外光谱的测定
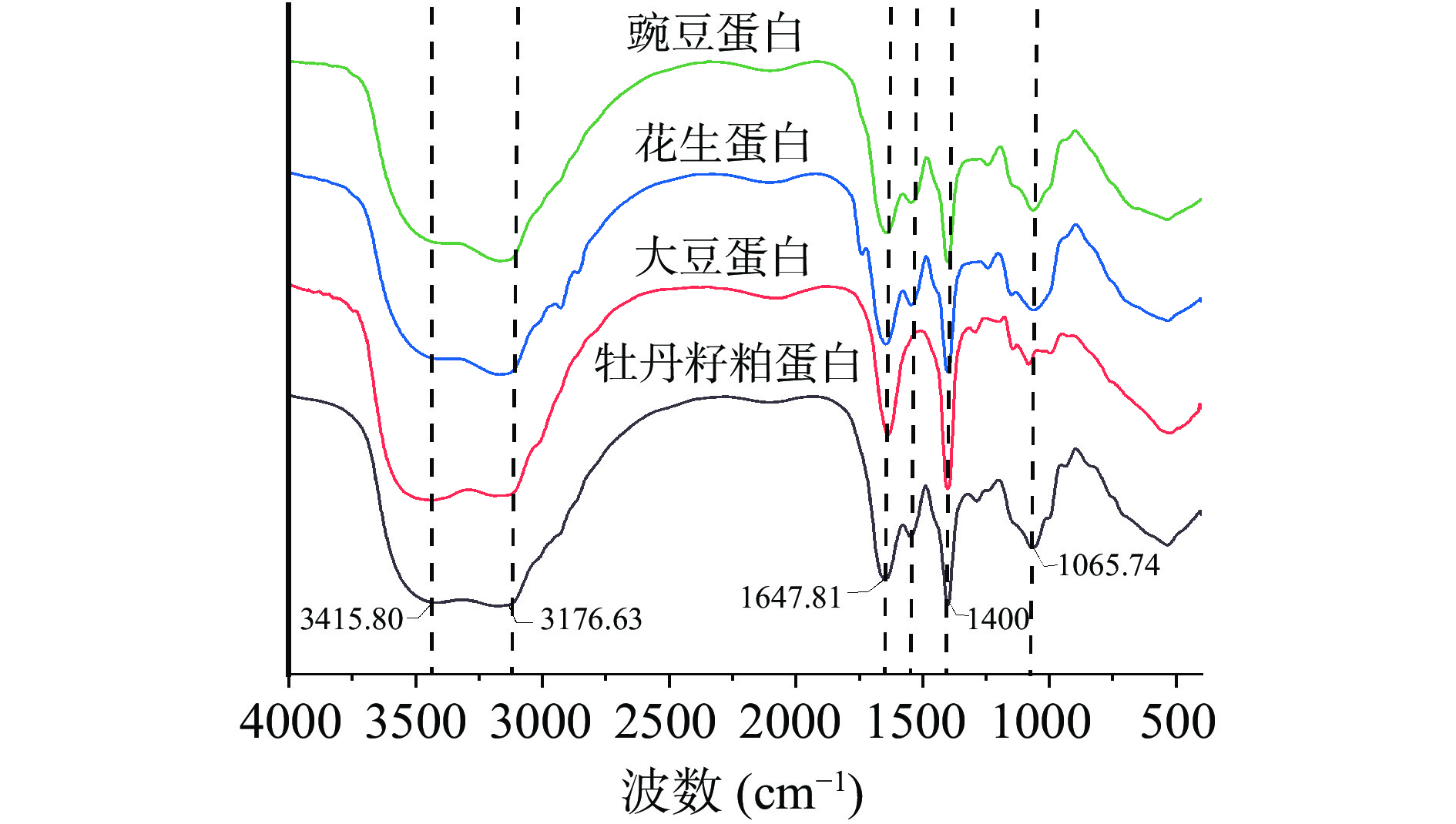
蛋白质的红外光谱具有三组特征吸收谱区:酰胺Ⅰ区(1600~1700 cm−1)、酰胺Ⅱ区(1530~1550 cm−1)和酰胺Ⅲ区(1260~1300 cm−1)。肽键中C=O的伸缩振动和C-N的拉伸振动为酰胺Ⅰ区,主要形成了蛋白质的α-螺旋和β-折叠;酰胺Ⅱ区主要为氨基中的C-N伸缩振动和N-H弯曲振动[37-38]。由图3可以看出,在3415.80 cm−1的吸收峰为分子间氢键的伸缩振动,推测为蛋白质之间形成的氢键;在3176.63 cm−1为N-H间的伸缩振动,可能为蛋白质氨基端的振动;四种蛋白质在酰胺Ⅰ区的吸收峰稍有偏差,其中牡丹籽粕蛋白的吸收峰为1647.81 cm−1,大豆蛋白、花生蛋白和豌豆蛋白的吸收峰分别为1635.32、1643.07、1640.49 cm−1。在酰胺Ⅱ区牡丹籽粕蛋白、花生蛋白和豌豆蛋白的出峰一致,均为1547.45 cm−1,而大豆蛋白未在此区域检测到吸收峰。在1400 cm−1的峰主要为氨基中的N-H弯曲振动。在1065.74 cm−1的峰主要为C-O键的吸收峰,然而蛋白质中含有较少的C-O键,表明蛋白质中含有碳水化合物。
四种植物蛋白的电镜图如图4所示,牡丹籽粕蛋白呈现为碎片状;大豆蛋白主要为球状,还有一些短棒状;花生蛋白和豌豆蛋白为不规则形状,豌豆蛋白的颗粒比花生蛋白的小一些。蛋白质呈现片状,主要是蛋白质的β-折叠造成的[39],因此推测牡丹籽粕蛋白的结构主要为β-折叠。
2.3 牡丹籽蛋白与三种常见蛋白的功能特性分析
2.3.1 持水性和持油性
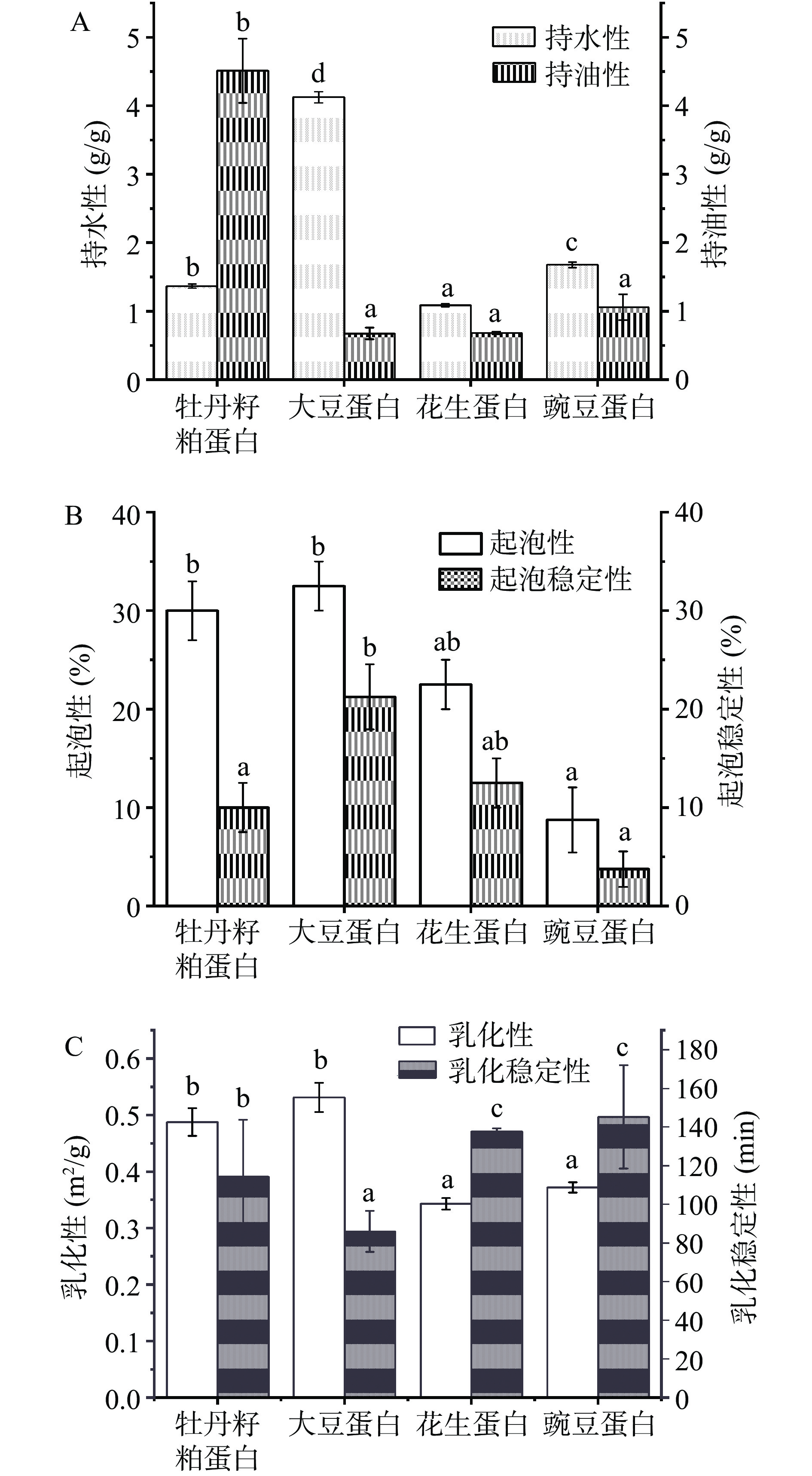
蛋白质的持水性和持油性指在一定量的水和油情况下,蛋白质结合水和油的能力,并对食品的稳定性、质地和风味具有深远的影响。由图5A可知,就持水性而言,四种蛋白的持水性完全不同,其中大豆蛋白的持水性最好为4.13 g/g,牡丹籽粕蛋白和豌豆蛋白次之,分别为1.37 g/g和1.68 g/g,花生蛋白的持水性最差为1.09 g/g。然而对于持油性,牡丹籽粕蛋白具有较好的持油性,而大豆蛋白、花生蛋白和豌豆蛋白的持油性较为类似。由于蛋白质的持油能力与其表面疏水性和疏水性氨基酸含量相关[40],表明牡丹籽粕蛋白可能还有较多的疏水性氨基酸和较强的表面疏水性。
2.3.2 起泡性和起泡稳定性
蛋白质的起泡性和起泡稳定性是蛋白质主要的界面性质,可以反映出蛋白质溶液的表面张力。蛋白质溶液具有较低的表面张力时,蛋白质具有很好的起泡性。由图5B可以看出,牡丹籽粕蛋白和大豆蛋白的起泡性较为一致,分别为30.00%和32.50%;其次为花生蛋白,起泡性为22.50%;豌豆蛋白的起泡性较差,起泡性为8.75%。蛋白质的起泡性与可溶性蛋白含量有关,可溶性蛋白含量越高,蛋白质溶液的起泡性越好[41]。四种蛋白质的起泡稳定性比较,大豆蛋白的起泡稳定性最好,牡丹籽粕蛋白、花生蛋白和豌豆蛋白的起泡稳定性较为类似。
2.3.3 乳化性和乳化稳定性
蛋白质乳化性是指蛋白质能使油与水形成稳定的乳化液而起乳化剂的作用,乳化性主要和蛋白质的结构、分子量大小以及疏水基团的暴露有关。乳化稳定性是指在外界条件发生改变时,蛋白质维持油水混合不分离的乳化特性的抗应变能力[42]。从图5C中可见,四种蛋白质的乳化性都不相同,大豆蛋白的乳化性最好为0.5604 m2/g,牡丹籽粕蛋白次之,乳化性为0.4877 m2/g,豌豆蛋白和花生蛋白的乳化性最差。这可能与大豆蛋白和牡丹籽粕蛋白中不含有大分子量组分有关,这与关海宁等[43]对于越高分子量的大豆蛋白水解肽乳化性反而更低的结论相一致。对乳化稳定性而言,豌豆蛋白的乳化稳定性最好,其次为花生蛋白,牡丹籽粕蛋白和大豆蛋白,这可能归因于牡丹籽粕蛋白的疏水基团过度暴露,表面活性层的平衡被打破,这与傅里叶红外光谱观测到的结论一致。
3. 结论
本文通过单因素和正交试验确定了牡丹籽粕蛋白提取的最佳条件为:料液比1:20 g/mL、温度70 ℃、pH9、时间45 min,此条件下牡丹籽粕蛋白的得率为79.83%±1.22%。牡丹籽粕蛋白主要含有5种分子量的蛋白质,其分子量集中在15~70 kDa之间。在红外光谱中,四种植物蛋白具有酰胺Ⅰ区和酰胺Ⅱ区的相似带区,在酰胺Ⅰ区的吸收峰稍有偏差。在电镜图中牡丹籽粕蛋白为碎片状,可能是蛋白质的β-折叠造成的。与三种植物蛋白相比,牡丹籽粕蛋白具有较好的持油性,起泡性、乳化性稍差于大豆蛋白。
本文对于牡丹籽粕蛋白提取率、结构、理化性质、功能特性等进行了深入探究,为牡丹籽粕蛋白的科学提取提供理论依据,同时为牡丹籽粕蛋白在食品工业中作为优质蛋白的替代品提供数据支持。
-
表 1 正交试验因素水平
Table 1 Orthogonal experimental factors and levels
水平 因素 料液比(g/mL) 温度(℃) pH 时间(min) 1 1:15 60 7 30 2 1:20 70 8 45 3 1:25 80 9 60 表 2 牡丹籽粕蛋白提取的正交试验
Table 2 Orthogonal experiment of extraction of protein from peony seed meal
实验号 A 料液比 B 温度 C pH D时间 得率(%) 1 1 1 1 1 50.75±0.10 2 1 2 2 2 75.15±0.08 3 1 3 3 3 73.55±0.00 4 2 1 2 3 72.50±0.16 5 2 2 3 1 73.29±0.02 6 2 3 1 2 54.48±0.30 7 3 1 3 2 71.46±0.11 8 3 2 1 3 52.71±0.76 9 3 3 2 1 70.50±0.00 K1 66.483 64.903 52.647 64.847 K2 66.757 67.050 72.717 67.030 K3 64.890 66.117 72.767 66.253 R 1.867 2.147 20.120 2.183 主次水平 C>D>B>A 优化方案 A2B2C3D2 -
[1] 乔慧茹. 油用牡丹(凤丹)籽粕酶解多肽的提取及活性研究[D]. 哈尔滨: 东北林业大学, 2021 QIAO H R. Study on extraction and activity of enzymatic polypeptides from peony (Phoenix Peony) seed meal for oil[D]. Harbin: Northeast Forestry University, 2021.
[2] 王敏, 李聪, 舒羽, 等. 油用牡丹籽粕蛋白及其酶解产物的功能性质研究[J]. 中国油脂,2020,45(5):67−71. [WANG M, LI C, SHU Y, et al. Study on the functional properties of peony seed meal protein and its enzymatic hydrolysate[J]. Chinese Grease,2020,45(5):67−71. WANG M, LI C, SHU Y, et al. Study on the functional properties of peony seed meal protein and its enzymatic hydrolysate [J] Chinese Grease, 2020, 45 (5): 67-71
[3] 郭香凤, 史田, 马雪情, 等. 微波辅助提取牡丹籽粕多糖工艺优化及其体外抗氧化活性[J]. 食品工业科技,2018,39(1):167−171. [GUO X F, SHI T, MA X, et al. Optimization of microwave assisted extraction of polysaccharides from peony seed meal and its antioxidant activity in vitro[J]. Science and Technology of Food Industry,2018,39(1):167−171. GUO X F, SHI T, MA X, et al. Optimization of microwave assisted extraction of polysaccharides from peony seed meal and its antioxidant activity in vitro [J] Science and Technology of Food Industry, 2018, 39 (1): 167-171
[4] 昝丽霞, 陈君红, 韩豪, 等. 油用牡丹籽粕营养成分分析研究[J]. 粮食与油脂,2019,32(9):45−47. [ZAN L X, CHEN J H, HAN H, et al. Analysis and study on nutrient composition of oil peony seed meal[J]. Grain and Grease,2019,32(9):45−47. doi: 10.3969/j.issn.1008-9578.2019.09.012 ZAN L X, CHEN J H, HAN H, et al. Analysis and study on nutrient composition of oil peony seed meal [J]. Grain and Grease, 2019, 32 (9): 45-47 doi: 10.3969/j.issn.1008-9578.2019.09.012
[5] 秦爱霞. 牡丹籽粕中芍药苷类成分的分析及大孔吸附树脂提取工艺研究[D]. 保定: 河北农业大学, 2014 QIN A X. Analysis of paeoniflorin in peony seed meal and study on extraction process of macroporous adsorption resin[D]. Baoding: Hebei Agricultural University, 2014.
[6] 姚瑶. 牡丹籽油及剩余物应用与研究进展[J]. 山东化工,2022,51(4):66−68. [YAO Y. Application and research progress of peony seed oil and residue[J]. Shandong Chemical Industry,2022,51(4):66−68. doi: 10.3969/j.issn.1008-021X.2022.04.019 YAO Y. Application and research progress of peony seed oil and residue [J]. Shandong Chemical Industry, 2022, 51 (4): 66-68 doi: 10.3969/j.issn.1008-021X.2022.04.019
[7] LIU P, ZHANG Y, XU Y F, et al. Three new monoterpene glycosides from oil peony seed cake[J]. Industrial Crops & Products,2018,111:371−378.
[8] 吴静义, 曹丹亮, 刘永刚, 等. 牡丹籽粕的化学成分研究[J]. 中医药学报,2014,42(1):9−11. [WU J Y, CAO D L, LIU Y G, et al. Studies on chemical constituents of peony seed meal[J]. Journal of Traditional Chinese Medicine,2014,42(1):9−11. WU J Y, CAO D L, LIU Y G, et al. Studies on chemical constituents of peony seed meal [J]. Journal of Traditional Chinese Medicine, 2014, 42 (1): 9-11
[9] XIAO T, GUO S, ZHANG S S, et al. Chemical characterization of main bioactive constituents in Paeonia ostii seed meal and GC-MS analysis of seed oil[J]. Journal of Food Biochemistry,2020,44(1):e13088.
[10] XIA Z W, JIAN G Z, ZHI J N, et al. Functional and emulsification characteristics of phospholipids and derived o/w emulsions from peony seed meal[J]. Food Chemistry,2022,389:133112. doi: 10.1016/j.foodchem.2022.133112
[11] ZHANG F, SHI J J, THAKUR, K, et al. Anti-cancerous potential of polysaccharide fractions extracted from peony seed dreg on various human cancer cell lines via cell cycle arrest and apoptosis[J]. Frontiers in Pharmacology,2017,8:102.
[12] 施君君. 牡丹籽粕多糖理化特性及抗氧化、抗肿瘤功能研究[D]. 合肥: 合肥工业大学, 2017 SHI J J. Studies on physicochemical properties, antioxidant and anti tumor functions of peony seed meal polysaccharides[D]. Hefei: Hefei University of Technology, 2017.
[13] 宋艳秋. 牡丹籽蛋白的提取、功能特性及应用研究[D]. 长沙: 长沙理工大学, 2015 SONG Y Q. Study on the extraction, functional characteristics and application of peony seed protein[D]. Changsha: Changsha University of Technology, 2015.
[14] 刘普, 张丽娜, 孟文娟, 等. 油用牡丹籽饼粕单萜苷的分离、纯化及结构鉴定[J]. 中国食品学报,2018,18(12):283−294. [LIU P, ZHANG L N, MENG W J, et al. Isolation, purification and structural identification of monoterpene glycosides from peony seed meal for oil[J]. Chinese Journal of Food,2018,18(12):283−294. LIU P, ZHANG L N, MENG W J, et al. Isolation, purification and structural identification of monoterpene glycosides from peony seed meal for oil [J]. Chinese Journal of Food, 2018, 18 (12): 283-294
[15] 刘普, 李小方, 牛亚琪, 等. 油用牡丹籽饼粕低聚茋类化合物提取工艺及活性研究[J]. 中国粮油学报,2016,31(6):79−85,97. [LIU P, LI X F, NIU Y Q, et al. Study on extraction technology and activity of oligostilbenes from peony seed meal for oil[J]. Chinese Journal of Cereals and Oils,2016,31(6):79−85,97. doi: 10.3969/j.issn.1003-0174.2016.06.015 LIU P, LI X F, NIU Y Q, et al. Study on extraction technology and activity of oligostilbenes from peony seed meal for oil[J]. Chinese Journal of Cereals and Oils, 2016, 31 (6): 79-85, 97 doi: 10.3969/j.issn.1003-0174.2016.06.015
[16] SHI J J, ZHANG J G, SUN Y H, et al. The rheological properties of polysaccharides sequentially extracted from peony seed dreg[J]. Int J Biol Macromol, 2016: 760-767.
[17] SHI J J, ZHANG J G, SUN Y H, et al. Physicochemical properties and antioxidant activities of polysaccharides sequentially extracted from peony seed dreg[J]. International Journal of Biological Macromolecules, 2016: 23-30.
[18] GONG Q, DU Z, GUO J. Study on immunoregulation function of peony seed proteolysis product in mice[J]. Journal of Food Biochemistry,2020,44(9):e13353.
[19] 宋王婷, 昝丽霞, 索艳敏, 等. 牡丹籽粕发酵酒工艺优化研究[J]. 粮食与饲料工业,2018(12):28−31. [SONG W T, ZAN L X, SUO Y M, et al. Study on optimization of peony seed meal fermentation process[J]. Grain and Feed Industry,2018(12):28−31. SONG W T, ZAN L X, SUO Y M, ET AL. Study on optimization of peony seed meal fermentation process [J]. Grain and Feed Industry, 2018 (12): 28-31
[20] 胡伊, 于泓鹏, 吴克刚, 等. 牡丹籽粕酱油发酵工艺优化及抗氧化活性研究[J]. 食品与机械,2020,36(6):157−161. [HU Y, YU H P, WU K G, et al. Optimization of soy sauce fermentation process and antioxidant activity of peony seed meal[J]. Food and Machinery,2020,36(6):157−161. HU Y, YU H P, WU K G, et al. Optimization of soy sauce fermentation process and antioxidant activity of peony seed meal[J]. Food and Machinery, 2020, 36 (6): 157-161
[21] 赵贵红, 王波, 李敏, 等. 牡丹籽粕酿造酱油发酵工艺研究[J]. 中国果菜,2022,42(1):38−41, 47. [ZHAO G H, WANG B, LI M, GUO H Y, et al. Study on soy sauce fermentation technology from peony seed meal[J]. Chinese Fruits and Vegetables,2022,42(1):38−41, 47. ZHAO G H, WANG B, LI M, GUO H Y, et al. Study on soy sauce fermentation technology from peony seed meal[J]. Chinese Fruits and Vegetables, 2022, 42 (1): 38-41, 47
[22] 王琳. 核桃粕蛋白的无酸化制备及其性质研究[D]. 乌鲁木齐: 新疆农业大学, 2016 WANG L. Preparation of walnut meal protein without acidification and its properties[D]. Urumqi: Xinjiang Agricultural University, 2016.
[23] 李若敏, 张焕新, 盘赛昆, 等. 牡丹籽粕蛋白提取工艺优化和功能性质分析[J]. 食品工业科技,2023,44(8):197−204. [LI R, ZHANG H X, PAN S K, et al. Optimization of extraction process and functional property analysis of peony seed meal protein[J]. Food Industry Science and Technology,2023,44(8):197−204. LI R, ZHANG H X, PAN S K, et al. Optimization of extraction process and functional property analysis of peony seed meal protein[J]. Food Industry Science and Technology, 2023, 44(8): 197−204. ].
[24] WU H, QIANG W, MA T, et al. Comparative studies on the functional properties of various protein concentrate preparations of peanut protein[J]. Food Research International,2009,42(3):343−348. doi: 10.1016/j.foodres.2008.12.006
[25] RODSAMRAN P, SOTHORNVIT R. Physicochemical and functional properties of protein concentrate from by-product of coconut processing[J]. Food Chemistry,2018,241:364−371. doi: 10.1016/j.foodchem.2017.08.116
[26] YU Z, PU L, JIA Y G, et al. Paeonia veitchii seeds as a promising high potential by-product: Proximate composition, phytochemical components, bioactivity evaluation and potential applications[J]. Industrial Crops and Products,2018,125:248−260. doi: 10.1016/j.indcrop.2018.08.067
[27] SHILPASHREE B G, ARORA S, CHAWLA P, et al. Succinylation of sodium caseinate and its effect on physicochemical and functional properties of protein[J]. LWT-Food Science and Technology,2015,64(2):1270−1277. doi: 10.1016/j.lwt.2015.07.008
[28] BISWAS B, SIT N. Effect of ultrasonication on functional properties of tamarind seed protein isolates[J]. Journal of Food Science and Technology,2020,57(6):2070−2078. doi: 10.1007/s13197-020-04241-8
[29] 宋艳秋, 吴苏喜, 肖志红. 牡丹籽蛋白的制备工艺优化及功能性质评价[J]. 中国油脂,2015,40(7):26−30. [SONG Y Q, WU S X, XIAO Z H. Optimization of the preparation process and evaluation of functional properties of peony seed protein[J]. China Oil Journal,2015,40(7):26−30. SONG Y Q, WU S X, XIAO Z H. Optimization of the preparation process and evaluation of functional properties of peony seed protein [J]. China Oil Journal, 2015, 40 (7): 26-30
[30] TAHERI A, FARVIN K H S, JACOBSEN C, et al. Antioxidant activities and functional properties of protein and peptide fractions isolated from salted herring brine[J] Food Chemistry, 2014, 318-326.
[31] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins: Evaluation of a turbidimetric technique[J]. J Agric Food Chem,1978,26(3):716−723. doi: 10.1021/jf60217a041
[32] 王青, 孙金月, 刘超, 等. 响应曲面法优化提取牡丹籽粕蛋白的工艺及应用研究[J]. 食品工业,2017,38(1):117−121. [WANG Q, SUN J Y, LIU C, et al. Optimization of extraction technology and application of protein from peony seed meal by response surface methodology[J]. Food Industry,2017,38(1):117−121. WANG Q, SUN J Y, LIU C, et al. Optimization of extraction technology and application of protein from peony seed meal by response surface methodology[J]. Food Industry, 2017, 38(1): 117-121].
[33] 田璇, 刘阳, 王兆升, 等. 牡丹籽粕蛋白提取工艺优化及特性分析[J]. 食品工业科技,2023,44(11):187−195. [TIAN X, LIU Y, WANG Z S, et al. Optimization of extraction process and characteristic analysis of protein from peony seed meal[J]. Science and Technology of Food Industry,2023,44(11):187−195. TIAN X, LIU Y, WANG Z S, et al. Optimization of extraction process and characteristic analysis of protein from peony seed meal [J]. Science and Technology of Food Industry, 2023, 44(11): 187−195.
[34] 范三红, 刘艳荣, 原超. 南瓜籽蛋白质的制备及其功能性质研究[J]. 食品科学,2010,31(16):97−100. [FAN S H, LIU Y R, YUAN C. Preparation and functional properties of pumpkin seed protein[J]. Food Science,2010,31(16):97−100. FAN S H, LIU Y R, YUAN C. Preparation and functional properties of pumpkin seed protein [J]. Food Science, 2010, 31(16): 97-100
[35] 李加兴, 房惠芳, 陈选, 等. 牡丹籽粕蛋白提取工艺优化及其等电点分析[J]. 食品与机械,2014,30(3):147−150. [LI J X, FANG H F, CHEN X, et al. Optimization of extraction process of protein from peony seed meal and its isoelectric point analysis[J]. Food and Machinery,2014,30(3):147−150. LI J X, FANG H F, CHEN X, et al. Optimization of extraction process of protein from peony seed meal and its isoelectric point analysis[J]. Food and Machinery, 2014, 30(3): 147-150
[36] GAO L L, LI Y Q, WANG Z S, et al. Physicochemical characteristics and functionality of tree peony (Paeonia suffruticosa Andr) seed protein[J]. Food Chemistry,2018,240:980−988. doi: 10.1016/j.foodchem.2017.07.124
[37] QIAO H, BI X J, ZHANG Y Y, et al. Enzymic polypeptide antioxidant activity and inhibitory activity on α-glucosidase and α-amylase from Paeonia ostii cake[J]. Industrial Crops & Products,2020,146:112158.
[38] WANG Y Y, WANG C Y, WANG S T, et al. Physicochemical properties and antioxidant activities of tree peony (Paeonia suffruticosa Andr.) seed protein hydrolysates obtained with different proteases[J]. Food Chemistry,2020,345(9):128−765.
[39] 李强. 牡丹籽盐溶蛋白提取分离、结构表征及乳化性质研究[D]. 雅安: 四川农业大学, 2018 LI Q. Studies on extraction, separation, structure characterization and emulsification properties of salt soluble protein from peony seeds[D]. Yaan: Sichuan Agricultural University, 2018.
[40] 邓芝串, 张晖, 张超, 等. 籽瓜种子蛋白质的持水及持油性研究[J]. 中国粮油学报,2015,30(9):49−54. [DENG Z C, ZHANG H, ZHANG C, et al. Study on water and oil retention of seed melon protein[J]. Chinese Journal of Cereals and Oils,2015,30(9):49−54. DENG Z C, ZHANG H, ZHANG C, et al. Study on water and oil retention of seed melon protein[J]. Chinese Journal of Cereals and Oils, 2015, 30(9): 49-54
[41] 庞雪风, 何东平, 胡传荣, 等. 牡丹籽蛋白功能特性的研究[J]. 中国粮油学报,2014,29(7):45−48,79. [PANG X F, HE D P, HU C R, et al. Studies on the functional properties of peony seed protein[J]. Chinese Journal of Cereals and Oils,2014,29(7):45−48,79. PANG X F, HE D P, HU C R, et al. Studies on the functional properties of peony seed protein[J]. Chinese Journal of Cereals and Oils, 2014, 29(7): 45-48, 79
[42] 肖连冬, 程爽, 李杰. 大豆分离蛋白起泡性和乳化性影响因素的研究[J]. 中国酿造,2014,33(4):83−86. [XIAO L D, CHENG S, LI J. Study on the factors influencing the foaming and emulsifying properties of soy protein isolate[J]. China Brewing,2014,33(4):83−86. doi: 10.3969/j.issn.0254-5071.2014.04.020 XIAO L D, CHENG S, LI J. Study on the factors influencing the foaming and emulsifying properties of soy protein isolate[J]. China Brewing, 2014, 33 (4): 83-86 doi: 10.3969/j.issn.0254-5071.2014.04.020
[43] 关海宁, 徐筱君, 孙薇婷, 等. 超高压协同酶法条件下不同分子量大豆分离蛋白水解肽乳化性及抗氧化性研究[J]. 食品安全质量检测学报,2022,13(12):3780−3786. [GUAN H N, XU X J, SUN W T. Study on the emulsifying and antioxidant properties of soybean protein isolate hydrolysates with different molecular weights under the condition of ultra-high pressure synergistic enzyme method[J]. Journal of Food Safety and Quality Inspection,2022,13(12):3780−3786. doi: 10.3969/j.issn.2095-0381.2022.12.spaqzljcjs202212006 GUAN H N, XU X J, SUN W T. Study on the emulsifying and antioxidant properties of soybean protein isolate hydrolysates with different molecular weights under the condition of ultra-high pressure synergistic enzyme method[J]. Journal of Food Safety and Quality Inspection, 2022, 13(12): 3780-3786 doi: 10.3969/j.issn.2095-0381.2022.12.spaqzljcjs202212006





 下载:
下载:


 下载:
下载:
