Effect of Interaction between Soy Protein Isolate and Nemipterus virgatus Myosin on Its Gel Properties
-
摘要: 为探究大豆分离蛋白(soybean protein isolate,SPI)与肌球蛋白的相互作用及其对肌球蛋白凝胶特性的影响,本研究以金线鱼肌球蛋白为原料,添加0%~8%(w/w)的SPI制成混合体系并分析其理化特性、光谱特性和凝胶特性。结果显示,添加SPI后,金线鱼肌球蛋白-SPI混合体系的内源荧光强度降低,紫外吸光度、总巯基含量、氢键和疏水相互作用增加,表明SPI和金线鱼肌球蛋白之间存在疏水相互作用、氢键、二硫键等非共价相互作用和共价相互作用,促使金线鱼肌球蛋白构象变化。同时,随着SPI添加量的增加,金线鱼肌球蛋白-SPI混合凝胶的凝胶强度、硬度和β-折叠含量均呈现出先增加后减小的趋势。当SPI的添加量为4%时,金线鱼肌球蛋白-SPI混合体系的总巯基含量和疏水相互作用最大,较对照组分别提升了64.46%和13.53%;加热后金线鱼肌球蛋白-SPI混合凝胶的凝胶强度和硬度值也最高,较对照组分别提升了8.66%和9.21%,且部分α-螺旋转变为β-折叠,凝胶网络结构最致密均匀。因此,适量添加SPI可与金线鱼肌球蛋白通过疏水相互作用、氢键、二硫键等促进蛋白分子的聚集和交联,改善金线鱼肌球蛋白的凝胶特性。Abstract: In this study, myosin isolated from Nemipterus virgatus was added with 0%~8%(w/w)soybean protein isolate (SPI) and the physicochemical, spectroscopic, and gel properties of the composite system were analyzed, in order to investigate the effect of interaction between myosin and SPI on the gel properties of myosin. The results showed that after the addition of SPI, the endogenous fluorescence intensity of the composite system decreased, whereas the ultraviolet absorbance, the total sulfhydryl content, and hydrogen bond as well as hydrophobic interactions increased. These results indicated that there were the hydrophobic interactions, hydrogen bonds, disulfide bonds, and other covalent and non-covalent interactions between SPI and Nemipterus virgatus myosin, which altered the structure and conformation of myosin. Meanwhile, the gel strength, hardness, and β-sheet content of the myosin-SPI composite gels all increased initially and then decreased as the increase addition of SPI. Furthermore, the total sulfhydryl and hydrophobic contents of the myosin-SPI composite system got the highest values when added 4% SPI, which increased by 64.46% and 13.53% compared with the control group, respectively. The gel strength and hardness of the myosin-SPI composite gels were also reached the highest values when added 4% SPI, which increased by 8.66% and 9.21% compared with the control group, respectively. It was also found that a part of α-helices transformed into β-sheets and the gel network was most compact and homogeneous. Therefore, the moderate addition of SPI could promote the aggregation and cross-linking of myosin through the interaction forces such as hydrophobic interactions, hydrogen bonds, and disulfide bonds, and improve the gel properties of myosin.
-
Keywords:
- Nemipterus virgatus myosin /
- soybean protein isolate /
- interaction /
- gel property
-
鱼糜是一种稳定的鱼肉肌原纤维蛋白浓缩物,主要成分为肌球蛋白。鱼糜制品是以鱼糜为原料生产的一种具有高持水性、高黏弹性的凝胶状食品,因其食用方便(无鱼刺)、营养价值高(高蛋白、低脂肪)深受消费者喜爱。金线鱼肉质鲜嫩、营养物质丰富、捕捞量大,其鱼肉加工成的鱼糜具有良好延展性、不易发生凝胶劣化、硬度适中等优点,是加工鱼糜及鱼糜制品的第二大海水鱼种,仅次于阿拉斯加鳕鱼[1-2]。
凝胶性能是评价鱼糜及鱼糜制品品质最重要的性能之一。据现有研究报道,影响鱼糜及鱼糜制品凝胶性的因素有很多,如鱼的种类、生产工艺、外源添加物,其中外源添加物是提高鱼糜凝胶强度常用的方法[3]。常用的外源添加物主要有转谷氨酰胺酶(Transglutaminase,TGase)、动植物蛋白、淀粉、亲水胶体及其它天然产物[4]。其中,植物蛋白广泛应用于鱼糜制品加工中,不仅可以提高鱼糜制品的质量,而且可以替代脂肪、动物蛋白生产出更健康、低脂的双蛋白产品,提升产品的营养价值。常用的植物蛋白有豆类分离蛋白、花生分离蛋白、活性谷蛋白、小麦蛋白等[4-5]。彭晶[6]研究发现添加1.5%的菜籽蛋白能够改善白鲢鱼鱼糜的凝胶特性。Borderías等[7]研究发现添加适量的豌豆分离蛋白能够形成具有良好交联凝胶网络的、更具健康价值的鱼肌原纤维蛋白凝胶。Wang等[8]研究表明适量的花生分离蛋白或鹰嘴豆分离蛋白能改善带鱼肌球蛋白的凝胶特性。
大豆分离蛋白(soybean protein isolate,SPI)主要蛋白质为7S(β-伴大豆球蛋白,140~190 kDa)和11S(大豆球蛋白,300~400 kDa),以其优异的功能特性和低廉的成本在食品工业中得到广泛应用[9],是一种优质蛋白。研究表明,SPI通过与肌肉蛋白相互作用形成致密的三维网络结构,从而提高鱼糜制品的凝胶强度[10]。同时SPI作为一种内源酶抑制剂,可以抑制鱼糜的霉变,改善鱼糜的质构[11]。崔旭海等[12]研究发现添加适量的SPI能有效地改善鲤鱼鱼糜的流变和凝胶特性。武雅琴等[13]研究发现适宜(80 ℃)的热诱导SPI使金枪鱼肌原纤维蛋白的凝胶特性明显改善。Lin等[14]研究发现SPI和花生分离蛋白混合物、SPI和大米分离蛋白混合物能够改善红鲷鱼肌原纤维蛋白的凝胶特性。Mi等[15]研究发现SPI和TG酶复配改善了栉孔扇贝闭壳肌的凝胶特性。目前,大豆分离蛋白在鱼糜制品中的应用研究多集中对鱼糜最终凝胶特性的直接影响方面,而关于大豆分离蛋白-肌球蛋白在未加热条件下的组分相互作用对鱼糜凝胶特性的影响的研究尚不完善。鉴于此,本文以提取的金线鱼肌球蛋白为原料,研究未加热时不同添加量的SPI与金线鱼肌球蛋白之间的相互作用及其对金线鱼肌球蛋白凝胶特性的影响,旨在为高品质鱼糜制品的生产提供一定的参考依据。
1. 材料与方法
1.1 材料与仪器
冰鲜金线鱼 锦州市水产市场,平均尾重(120±10) g;大豆分离蛋白 生物试剂,蛋白质≥85%,北京索莱宝科技有限公司;三磷酸腺苷二钠、牛血清白蛋白标准品 北京索莱宝科技有限公司;马来酸、乙酸镁等其余试剂 均为国产分析纯。
SORVALL Stratos冷冻高速离心机 美国Thermo公司;UV-2550紫外可见光分光光度计 岛津仪器(苏州)有限公司;Fluoromax-4NIR荧光分光光谱仪 法国HORIBA公司;Varian 640-IR傅里叶变换红外光谱仪 德国瓦瑞安公司;NanoBrook粒度及Zeta电位分析仪 美国Brookhaven仪器公司;TA.XT plus质构仪 Stable Micro Systems公司;S-4800冷场发射扫描电镜 日本日立公司;Discovery HR-1流变仪 美国TA仪器有限公司。
1.2 实验方法
1.2.1 金线鱼肌球蛋白的制备
参考Park等[16]的方法并修改。取冰鲜金线鱼背脊肉绞碎成肉糜,加入8倍体积的盐缓冲液A(含0.1 mol/L KCl及20 mmol/L Tris-HCl,pH7.5),均质,反应15 min,3000 r/min离心8 min(4 ℃)。取沉淀加入3倍体积的盐缓冲液B(含0.2 mol/L 乙酸镁、0.45 mol/L KCl、1 mmol/L EGTA、5 mmol/L β-巯基乙醇及20 mmol/L Tris-马来酸,pH6.8),加入三磷酸腺苷二纳至其终浓度为10 mmol/L,均质,4 ℃冰箱中静置80 min,11000 r/min离心15 min(4 ℃)。取上清液加入3倍体积的碳酸氢钾溶液(1 mmol/L),4 ℃冰箱中放置30 min,11000 r/min离心15 min(4 ℃)。取沉淀加入2.5倍体积的盐缓冲液C(含0.5 mol/L KCl、5 mmol/L β-巯基乙醇及20 mmol/L Tris-HCl,pH7.5),4 ℃下反应15 min,加入5倍体积的碳酸氢钾溶液(1 mmol/L),最后加入氯化镁至其终浓度为10 mmol/L,4 ℃静置过夜。第2 d离心(18000 r/min,25 min,4 ℃),得到金线鱼肌球蛋白沉淀(用双缩脲法测定蛋白质浓度,牛血清白蛋白作为标准蛋白制作标准曲线,得到的标准曲线方程为y=0.0499x+0.0008,R2=0.9997)。
1.2.2 金线鱼肌球蛋白-SPI混合样品的制备
参考李政翰[17]的方法并修改。用缓冲液D(0.6 mol/L NaCl-20 mmol/L Tris-HCl,pH7.0)调整金线鱼肌球蛋白浓度为60 mg/mL,以溶液中金线鱼肌球蛋白质量为基准添加0、2%、3%、4%、6%和8%(w/w)的SPI粉,混匀即为混合溶液,4 ℃储藏(3 d内使用)。两段式水浴加热(40 ℃,30 min;93 ℃,20 min)后制得金线鱼肌球蛋白-SPI混合凝胶,冰水冷却后于4 ℃冰箱中静置过夜。
1.2.3 混合溶液平均粒径的测定
用粒度仪测定样品的平均粒径。将添加SPI的金线鱼肌球蛋白浓度用缓冲液D调整至0.5 mg/mL。测定温度25 ℃,每组3个平行。
1.2.4 混合溶液总巯基含量的测定
参考Yongsawatdigul等[18]的方法并修改。取1.5 mL 5 mg/mL的混合溶液加入13.5 mL 50 mmol/L 磷酸盐缓冲液(含8 mol/L 尿素、0.6 mol/L KCl、10 mmol/L EDTA,pH7.0),加入1.5 mL 10 mmol/L DTNB(5,5'-二硫双(2-硝基苯甲酸))溶液,室温下避光反应30 min,412 nm处测定吸光度。总巯基含量按式(1)计算。
T-SH(μmol/10−5g pro)=A×D×100000C×13600 (1) 式中:T-SH为总巯基含量;A为412 nm处的吸光度值;D为稀释倍数;C为蛋白质量浓度,mg/mL。
1.2.5 混合溶液的紫外光谱
将添加SPI的金线鱼肌球蛋白浓度调整为0.5 mg/mL,扫描范围为220~350 nm,扫描速度为高速,采样间隔为1 nm,以缓冲液D为空白。
1.2.6 混合溶液的荧光色谱
用荧光分光光谱仪测定其内源荧光强度,将添加SPI的金线鱼肌球蛋白浓度调整为0.25 mg/mL。激发波长设置为280 nm,发射波长扫描范围为300~420 nm,激发/发射狭缝为2.5 nm/3.0 nm。
1.2.7 凝胶强度的测定
金线鱼肌球蛋白-SPI混合凝胶的凝胶强度用质构仪测定。测定条件:P/5S探头,形变量40%,触发力5 g,测前速度为2 mm/s,测中速度和测后速度均为1 mm/s。每组5个平行。
1.2.8 凝胶质构的测定
将冷却过夜的凝胶切成高度为20 mm的圆柱体,进行TPA分析,主要参数:探头类型:P/50,测前速度为2 mm/s,测中速度和测后速度均为1 mm/s,压缩比为40%,触发力10 g。每组5个平行。
1.2.9 动态流变学性质
参考Sun等[19]的方法并稍作修改。测定条件:金线鱼肌球蛋白质量浓度40 mg/mL、夹板直径40 mm、狭缝间距为0.5 mm。升温阶段以3 ℃/min的速度从25 ℃升温至85 ℃,振荡频率1 Hz,应变0.5%。
1.2.10 凝胶分子间作用力的测定
参考Gómez-Guillén等[20]的方法并稍做修改。称取2 g切碎的混合凝胶样品,分别与10 mL的0.05 mol/L NaCl(SA)、0.6 mol/L NaCl(SB)、0.6 mol/L NaCl+1.5 mol/L尿素(SC)和0.6 mol/L NaCl+8 mol/L尿素(SD)混合,均质,4 ℃放置1 h,8000 r/min、4 ℃离心20 min,使用双缩脲试剂测定上清液的蛋白浓度。SB液和SA液中蛋白质浓度之差、SC液和SB液中蛋白质浓度之差以及SD液和SC液中蛋白质浓度之差分别表示离子键含量、氢键含量和疏水相互作用含量。蛋白质浓度按式(2)计算。
C(mg/mL)=A′−0.00080.0499 (2) 式中:C为蛋白质浓度,mg/mL;A'为540 nm处的吸光度值。
1.2.11 凝胶傅里叶红外光谱的测定
混合蛋白凝胶冷冻干燥后研磨成粉末,将KBr与粉末状样品按100:1的比例混均压片,用红外光谱仪扫描,扫描波数范围为400~4000 cm−1。
1.2.12 凝胶微观结构观察
利用扫描电子显微镜观察凝胶的微观结构,凝胶用手术刀切成3 mm左右厚的薄片,用2.5%的戊二醛溶液浸泡固定12 h,再用0.2 mol/L pH7.2的磷酸盐缓冲液冲洗,然后进行梯度浓度乙醇脱水,15 min/次。将脱水后的样品真空冷冻干燥,冻干的样品进行喷金处理。在扫描电镜下用10 kV的加速电压观察标本。
1.3 数据处理
数据使用IBM SPSS Statistics 25.0和 Origin 9.0进行统计分析和作图,并以“均值±标准差”表示,采用Duncan多重比较检验各均值的差异显著性(P<0.05)。
2. 结果与分析
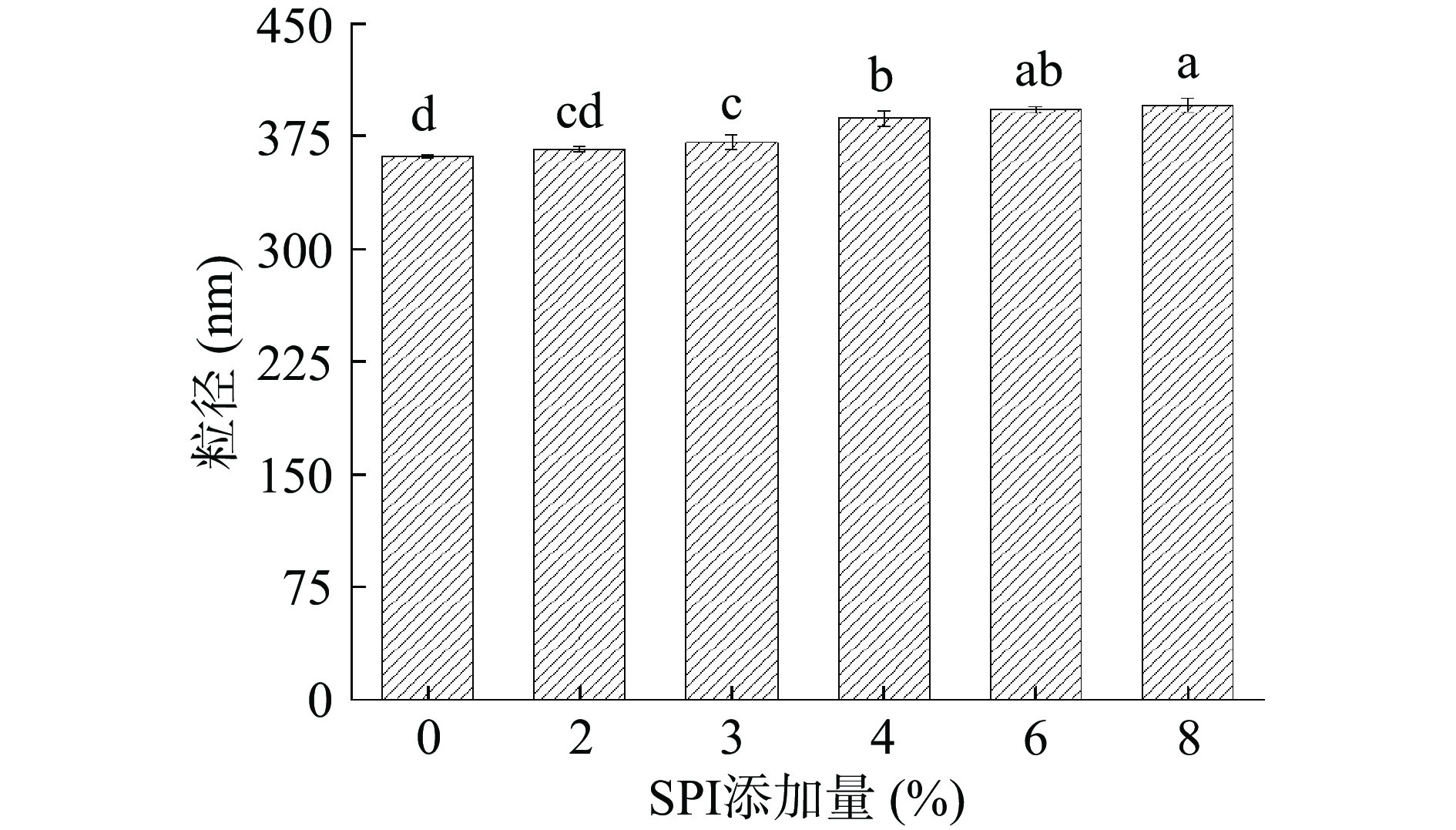
2.1 SPI添加量对金线鱼肌球蛋白-SPI混合溶液平均粒径的影响
粒径是蛋白质聚集体大小的宏观表现。当蛋白质发生变性、聚集时,粒径就会增大。如图1所示,所有试验组的粒径均高于对照组,并且随着SPI添加量的增加粒径逐渐变大。这是因为SPI与金线鱼肌球蛋白发生相互作用,诱导金线鱼肌球蛋白结构发生变化,暴露出更多的疏水基团,蛋白分子通过疏水相互作用、静电相互作用等聚集成簇,使粒径增大[21]。Niu等[22]发现SPI和和肌肉蛋白之间主要通过疏水相互作用、氢键和二硫键产生相互作用,且经过温和加热结合酸处理后的SPI与肌肉蛋白间产生了更强的相互作用。在2%~4%的添加量范围内,粒径增量较大,添加量超过4%以后,粒径增量变小,表明4%添加量时,SPI、金线鱼肌球蛋白间的结合近似饱和。
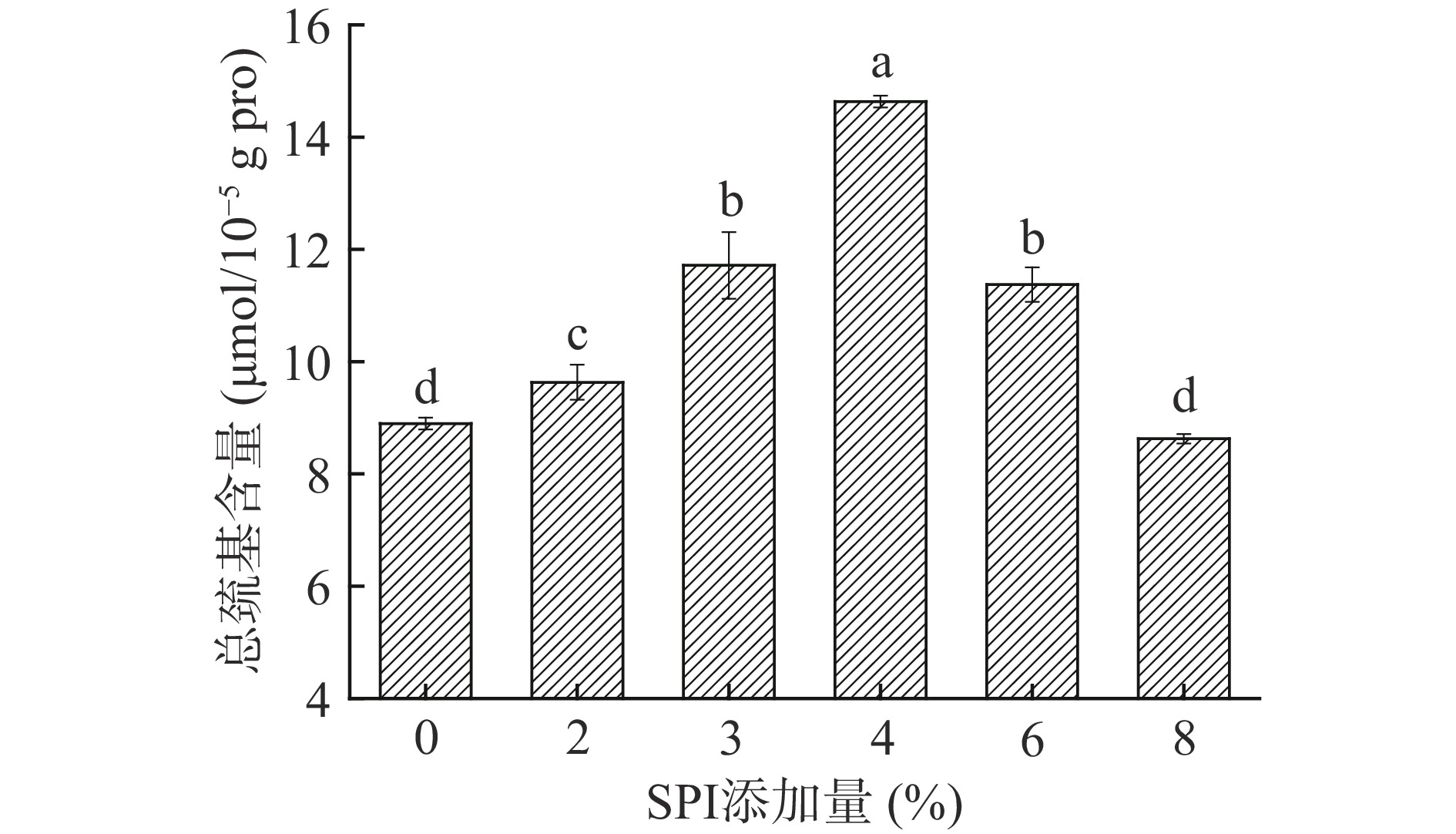
2.2 SPI添加量对金线鱼肌球蛋白-SPI混合溶液总巯基含量的影响
蛋白分子的巯基含量变化趋势在一定程度上表征蛋白三级结构和二硫键的变化。由图2可知,未加热条件下随着SPI添加量的增加,混合溶液的总巯基含量呈现先显著增加后显著减少的趋势(P<0.05)。这可能是因为适量的SPI使金线鱼肌球蛋白三级结构发生变化、蛋白分子变性展开,暴露出更多的活性巯基和隐藏巯基[23];添加过量的SPI又可能将暴露出来的活性巯基和隐藏巯基再次包埋或覆盖,从而使总巯基含量呈现减少趋势。Du等[24]研究发现热处理(> 40℃)导致蛋白质结构的展开,原来位于内部的巯基暴露、交联形成二硫键。在SPI添加量4%时混合溶液的总巯基含量最高,表明添加4% SPI组样品加热后易形成更多的二硫键,这有助于凝胶特性的改善。
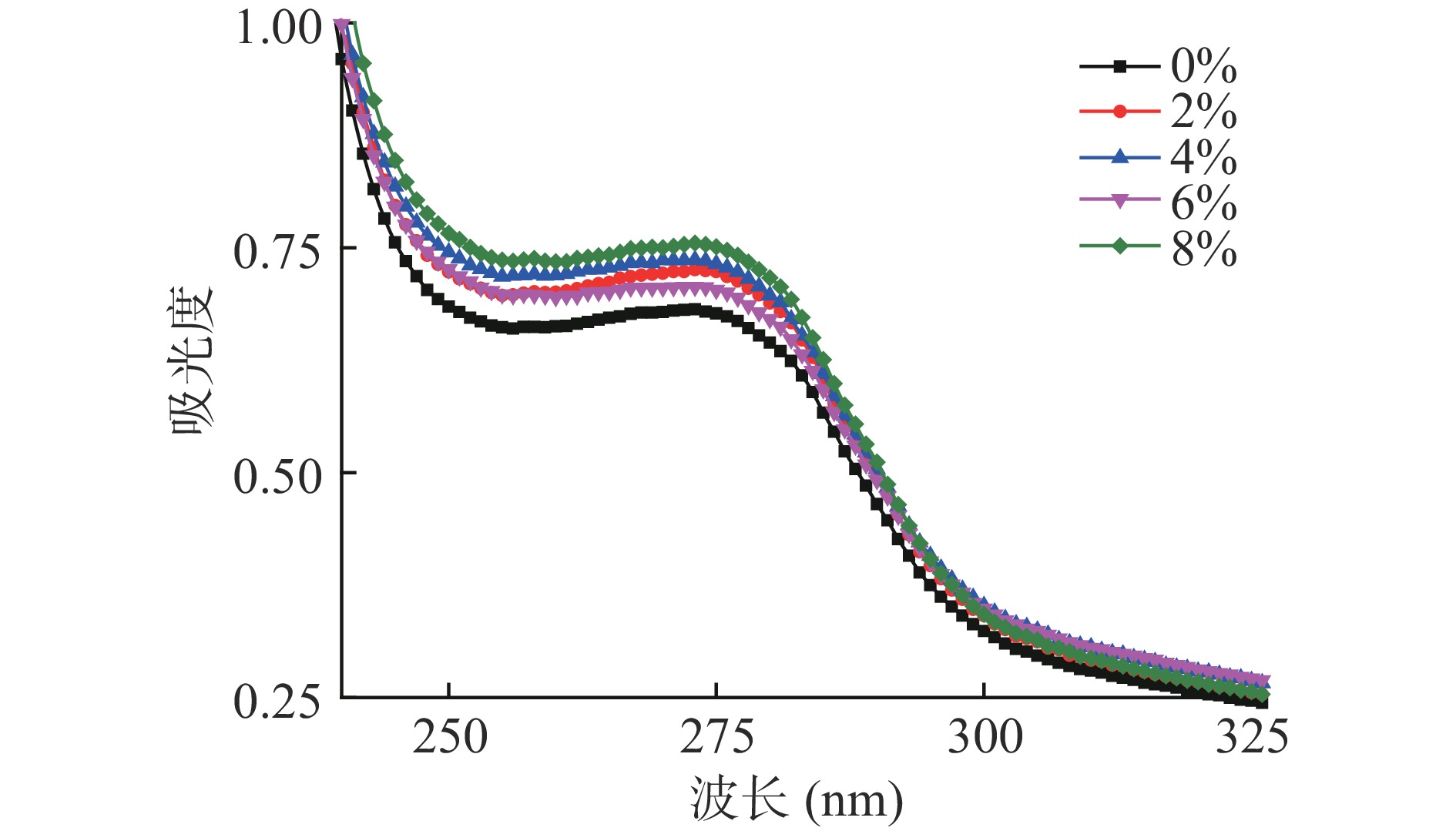
2.3 SPI添加量对金线鱼肌球蛋白-SPI混合溶液紫外光谱的影响
紫外光谱是表征蛋白质三级结构的一种常用方法,大多数蛋白质由于色氨酸和酪氨酸残基对光的吸收在280 nm附近存在吸收峰。由图3可知,混合溶液有一个紫外吸收峰,波长在275 nm左右,该峰峰值的变化与芳香族氨基酸的暴露有关。随着SPI添加量的增加,混合溶液紫外吸收峰值呈现出先上升后下降最后上升的趋势,且SPI添加组的吸光度均高于对照组。表明随着SPI添加量的增加,蛋白之间发生不同程度的交联,蛋白质结构展开,埋藏在内部的发色基团有不同程度的暴露,导致特征峰值有不同程度的升高[25]。其中4%和8%的SPI添加量时峰值较高,说明4%和8%的SPI添加量下蛋白结构展开的程度较高,更多的发色基团暴露在环境中。此外,6%的SPI添加量时吸光度的下降可能是由于形成了高分子量聚合物,导致一些非极性芳香氨基酸残基被部分掩盖[26];8%的SPI添加量时吸光度上升的原因可能是添加的过量的SPI本身所含有的芳香族氨基酸的引入以及蛋白的交联共同作用的结果。
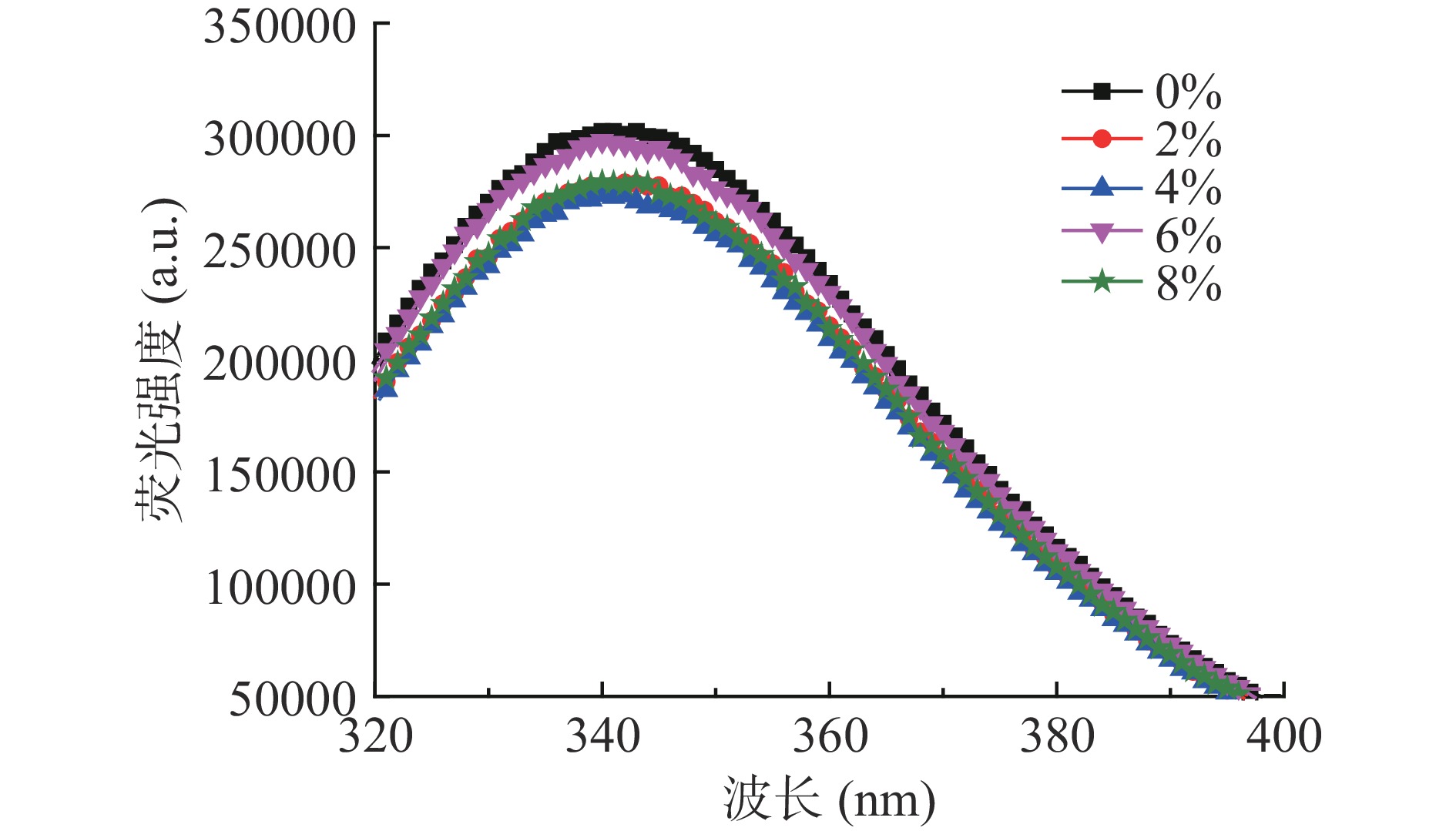
2.4 SPI添加量对金线鱼肌球蛋白-SPI混合溶液内源荧光光谱的影响
内源荧光强度通常用于通过估计受荧光能量影响的芳香族氨基酸残基(主要是色氨酸)的变化来确定蛋白三级结构的变化。由图4可知,添加SPI后,混合溶液的荧光强度均低于对照组,出现荧光猝灭现象。表明SPI与金线鱼肌球蛋白的混合使金线鱼肌球蛋白三级结构发生变化,位于蛋白质内部的芳香族氨基酸分子的侧链基团暴露,金线鱼肌球蛋白分子中色氨酸或酪氨酸残基的微环境发生了改变[27]。此外,随着SPI添加量的增加,混合溶液的荧光强度呈现先下降后上升最后下降的趋势,4% SPI组的内源荧光强度最低,表明4%的SPI与金线鱼肌球蛋白相互作用时,更接近于位于蛋白疏水空腔内自发荧光的氨基酸残基[28]。SPI添加量低于4%时荧光猝灭的主要原因可能是适量的SPI诱导金线鱼肌球蛋白结构展开,暴露出更多的内部芳香族氨基酸残基;6%的SPI添加量时荧光强度的上升可能是由于形成了高分子量聚合物,导致一些非极性芳香氨基酸残基被掩盖;8%的SPI添加量时荧光强度再次下降的原因可能是添加过量的SPI本身所含有的芳香族氨基酸残基的暴露和金线鱼肌球蛋白暴露出的芳香族氨基酸残基共同作用的结果。荧光光谱(图4)与紫外光谱(图3)的结果一致,均证明了SPI的添加使金线鱼肌球蛋白三级结构发生改变,进而影响氨基酸残基的微环境。
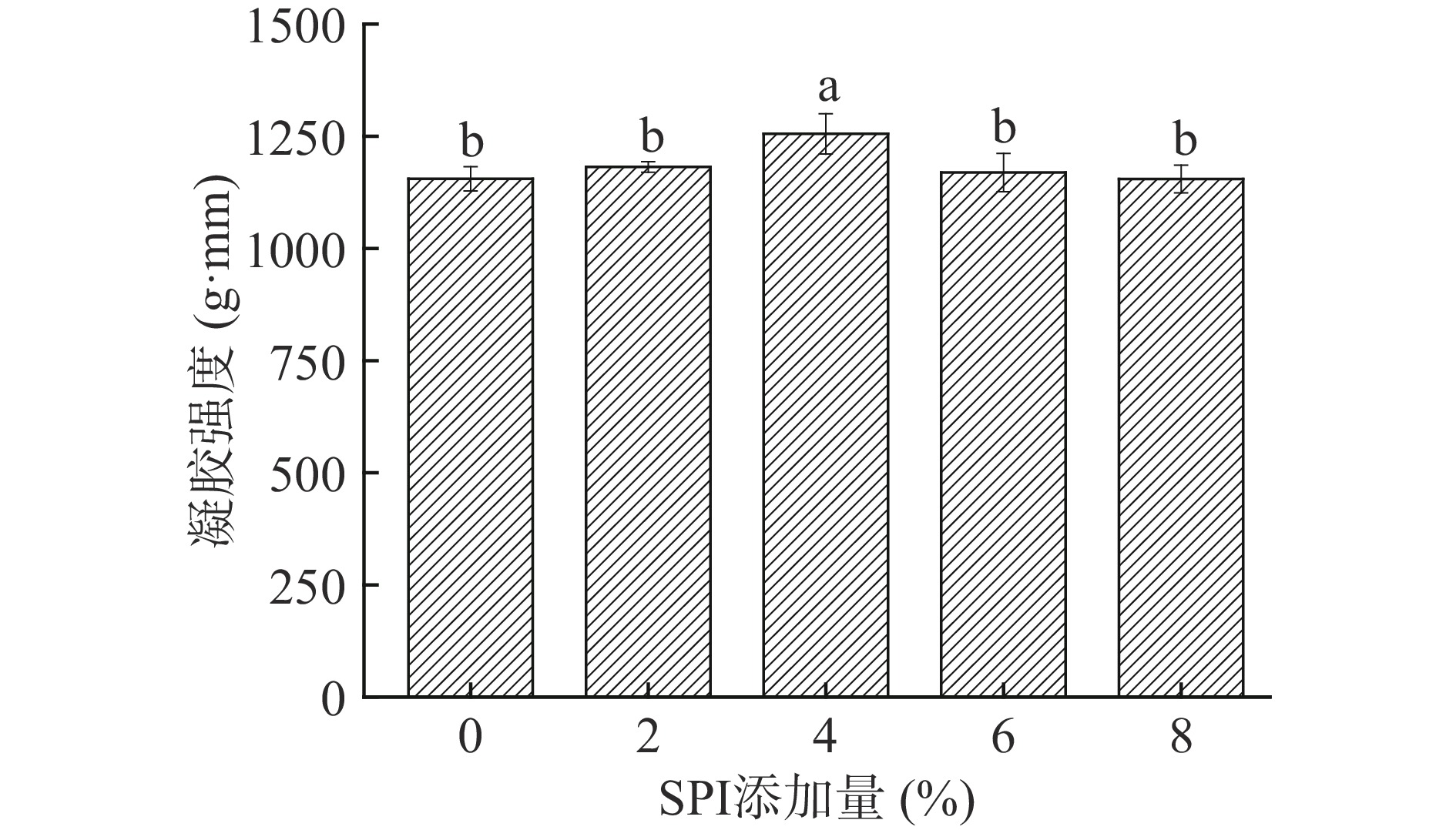
2.5 SPI添加量对金线鱼肌球蛋白凝胶强度的影响
由图5可知,在8%的SPI添加量范围内,金线鱼肌球蛋白凝胶强度随着SPI添加量的增加呈现出先上升后下降的趋势,添加4% SPI组样品的凝胶强度最高(1255.253 g·mm),与对照组(1155.161 g·mm)相比,凝胶强度增加了8.66%。表明适量的SPI能显著提高金线鱼肌球蛋白凝胶强度,原因可能是SPI的填充效应使金线鱼肌球蛋白凝胶的网状结构更加紧密[29],而过多的SPI对金线鱼肌球蛋白的稀释效应或添加过量的SPI可能会阻碍金线鱼肌球蛋白的交联导致混合蛋白整体的凝胶性下降[14]。邓立青等[30]研究发现添加3%的SPI时铜盘鱼鱼糜的凝胶强度最好、崔旭海等[12]研究发现添加适量的外源性蛋白可以提高鲤鱼鱼糜的凝胶强度,和本文的研究结果相似。此外,凝胶强度的变化趋势和图2总巯基含量的变化趋势一致,证实了巯基氧化形成二硫键有利于凝胶特性的改善。
2.6 SPI添加量对金线鱼肌球蛋白凝胶质构特性的影响
如表1所示,0%~4%的SPI添加量范围内,金线鱼肌球蛋白凝胶的硬度随着SPI添加量的增加而逐渐上升,4% SPI添加量时硬度达到最大值569.70 g,之后逐渐下降。与对照组相比,弹性、粘聚性、胶着度、咀嚼度和回复性都呈现出先上升后下降最后略微上升的趋势,于4% SPI添加量时达到最大值。4% SPI添加量之前,质构特性改善的原因可能是SPI对金线鱼肌球蛋白凝胶网络的填充作用[29]和其本身作为内源酶抑制剂能够抑制霉变、改善质构的作用[11];4% SPI添加量之后,质构特性下降的原因可能是过量SPI的添加对金线鱼肌球蛋白产生了较强的稀释作用、阻碍了金线鱼肌球蛋白的交联[14],而8% SPI添加量时金线鱼肌球蛋白凝胶的质构特性又略微得到改善的原因可能是过量的SPI对水分的吸收和加热后形成的SPI聚集体对金线鱼肌球蛋白凝胶基质的强化效应大于SPI对金线鱼肌球蛋白的稀释作用。综上,SPI添加量为4%时,金线鱼肌球蛋白凝胶的质构特性最好,与凝胶强度的结果一致。
表 1 不同添加量SPI对金线鱼肌球蛋白凝胶质构特性的影响Table 1. Effect of different addition of SPI on the texture properties of Nemipterus virgatus myosin gelSPI添加量(%) 硬度(g) 弹性 粘聚性 胶着度(g) 咀嚼度(g) 回复性 0 521.67±20.25b 0.84±0.02b 0.72±0.01b 374.54±11.30c 314.40±7.02c 0.40±0.01a 2 565.72±9.10a 0.84±0.01b 0.72±0.01b 405.24±10.21b 342.16±4.43b 0.40±0.01a 4 569.70±21.81a 0.90±0.01a 0.77±0.03a 438.59±1.48a 394.32±6.59a 0.44±0.03a 6 533.92±9.27b 0.85±0.00b 0.73±0.01ab 389.90±9.28bc 333.53±7.11bc 0.41±0.00a 8 527.01±5.56b 0.86±0.02b 0.75±0.04ab 396.21±19.01bc 341.53±26.43b 0.44±0.03a 注:表中同一列上标字母不同表示差异显著(P<0.05)。 2.7 SPI添加量对金线鱼肌球蛋白动态流变学性质的影响
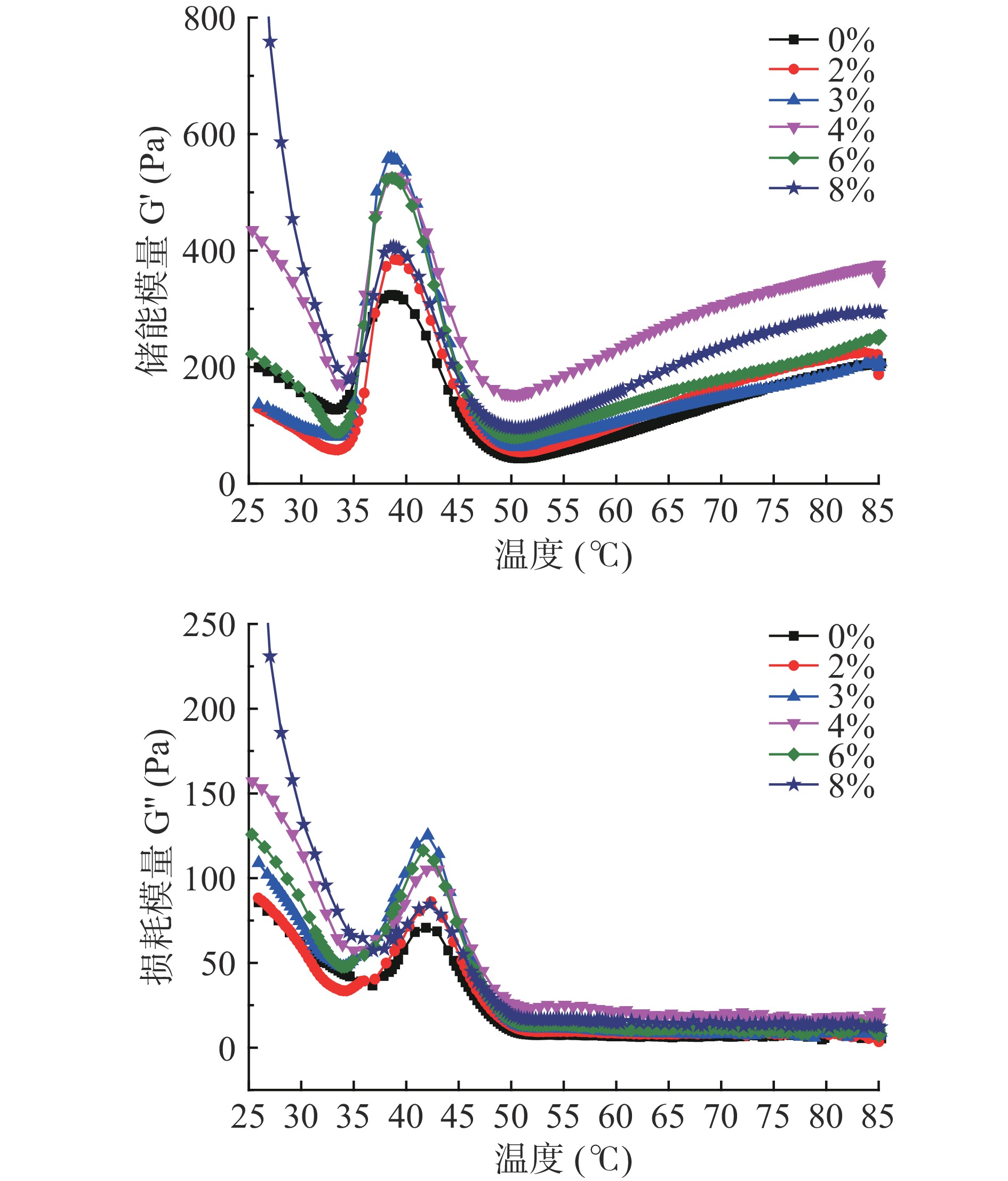
储能模量(G')表示样品的弹性趋势,损耗模量(G'')表示样品的粘性趋势。如图6所示,对照组的G'在38.65 ℃时达到峰值323.952 Pa,表明金线鱼肌球蛋白头部变性形成弹性凝胶网络,50.90 ℃之后随着温度的升高G'缓慢增加,添加SPI组样品的G'变化趋势与对照组基本一致。G''与G'的变化趋势相似,加热过程中,G'值大于G''值,表明金线鱼肌球蛋白形成了弹性凝胶[31]。随着SPI添加量的增加,G'值与G''值都呈先增加后减少最后增加的趋势,且都高于对照组,这可能是由于加热增强了SPI与金线鱼肌球蛋白的变性和交联,形成了高弹性的凝胶网络结构[32]。0%~4%的SPI的添加能结合自由水,填充金线鱼肌球蛋白凝胶网络,从而强化了金线鱼肌球蛋白凝胶基质,使蛋白分子间的相互作用增强;4%添加量之后,G'值与G''值下降的原因可能是过量SPI的添加阻碍了金线鱼肌球蛋白的交联[14],而8% SPI添加量时金线鱼肌球蛋白的G'与G''值再次上升的原因可能是过量的SPI加热后本身所具有的粘弹性对金线鱼肌球蛋白凝胶基质的强化作用大于SPI对金线鱼肌球蛋白的稀释作用。综上,添加4% SPI组样品的G'值与G''值最大,表明添加4% SPI时金线鱼肌球蛋白凝胶的粘弹性最好,此结果和凝胶强度、质构特性的结果一致。
2.8 SPI添加量对金线鱼肌球蛋白凝胶化学作用力的影响
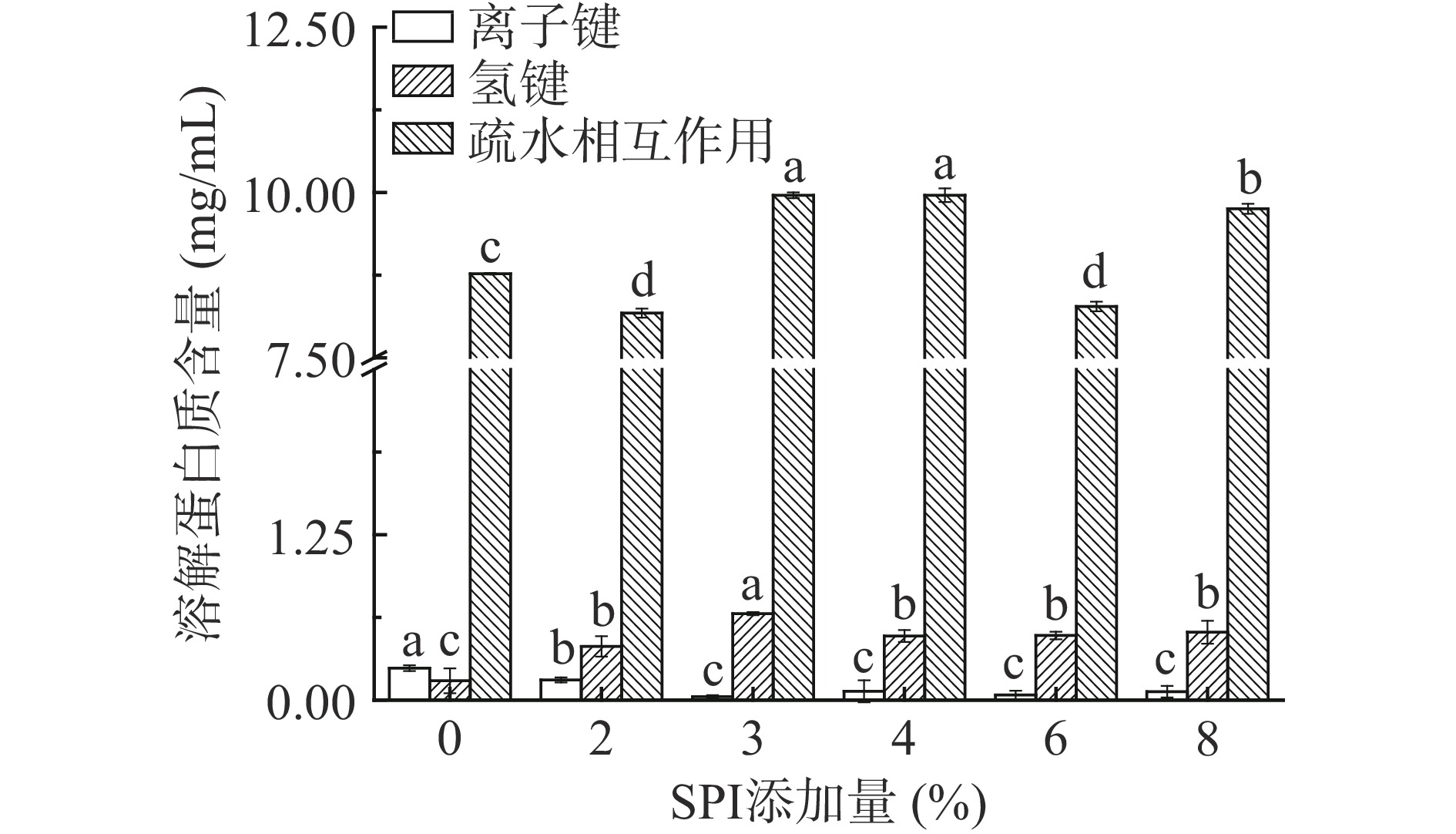
由图7可知,疏水相互作用是维持蛋白构象稳定的主要作用力,离子键占比最小。蛋白质受热变性,离子键断裂、疏水基团暴露,相邻蛋白分子之间疏水部分的结合可以降低凝胶体系熵值,促进蛋白间相互作用,从而增强凝胶强度[17]。氢键主要维持蛋白质的二级结构,它是转变β-折叠的主要驱动力[33]。随着SPI添加量的增加,疏水相互作用呈现出先下降后上升再下将最后上升的趋势,氢键含量呈现出先增加后减少的趋势,离子键含量呈现出先减少后略微增大的趋势。添加SPI后离子键含量减小可能是由于SPI阻止了蛋白质之间和金线鱼肌球蛋白内部离子键的形成,使金线鱼肌球蛋白分散,当加入过多的SPI时,pH值的差异可能会改变氨基酸的电荷分布位点,导致离子键略有增加[34-35];氢键含量增加可能是由于添加的SPI与自由水结合,导致总体蛋白与水分子间的作用增强,氢键增加,而3% SPI添加量之后氢键又减少可能是由于过量的SPI与金线鱼肌球蛋白竞争水分子,使蛋白质与水分子间的作用减弱,氢键减少[36];添加2%和6% SPI时疏水相互作用下降可能是由于SPI吸水后粘度变大,限制了部分蛋白质分子的伸展和分子内部疏水基团的暴露以及6%时过量的SPI对暴露出来的疏水基团的再次埋藏作用,3%~4%适量的SPI的添加促进了金线鱼肌球蛋白分子内部疏水基团的暴露,和巯基变化规律相似,而8%较多过量的SPI添加由于SPI自身可形成凝胶网络,可显著增加疏水相互作用[35]。在0%~8%的SPI添加量范围内,3% SPI添加量时氢键值最大、离子键值最小,4% SPI添加量时疏水相互作用值最大,表明3%~4%的SPI添加量范围内金线鱼肌球蛋白凝胶的化学作用力最有利于蛋白构象的稳定,从而利于金线鱼肌球蛋白凝胶特性的改善,与前面的试验结果一致。
2.9 SPI添加量对金线鱼肌球蛋白凝胶分子构象的影响
红外光谱图中酰胺A振动波段(3500~3250 cm−1)与O-H振动伸缩有关,其吸收峰的变化主要受氢键的影响;酰胺Ⅰ带(1600~1700 cm−1)常与酰胺Ⅲ带(1220~1330 cm−1)结合分析蛋白质的二级结构[37]。由图8可知,在3290 cm−1附近有一个较为明显的吸收峰,这是由蛋白质羟基和 N-H 的伸缩振动引起的[38],添加0%、2%、3%、4%、6%、8% SPI时该峰的波数分别为3293.453、3292.488、3291.524、3291.524、3290.560和3291.524 cm−1。与对照组相比,随着SPI添加量的增加,实验组该峰值对应的波数发生不同程度的降低,表明混合凝胶中氢键增强,与图7结果一致,而增强的氢键是混合蛋白凝胶强度增加的原因之一。添加SPI前后的峰位和峰形基本相同,说明添加SPI没有改变金线鱼肌球蛋白的功能性基团,也没有新的功能性基团生成[17]。
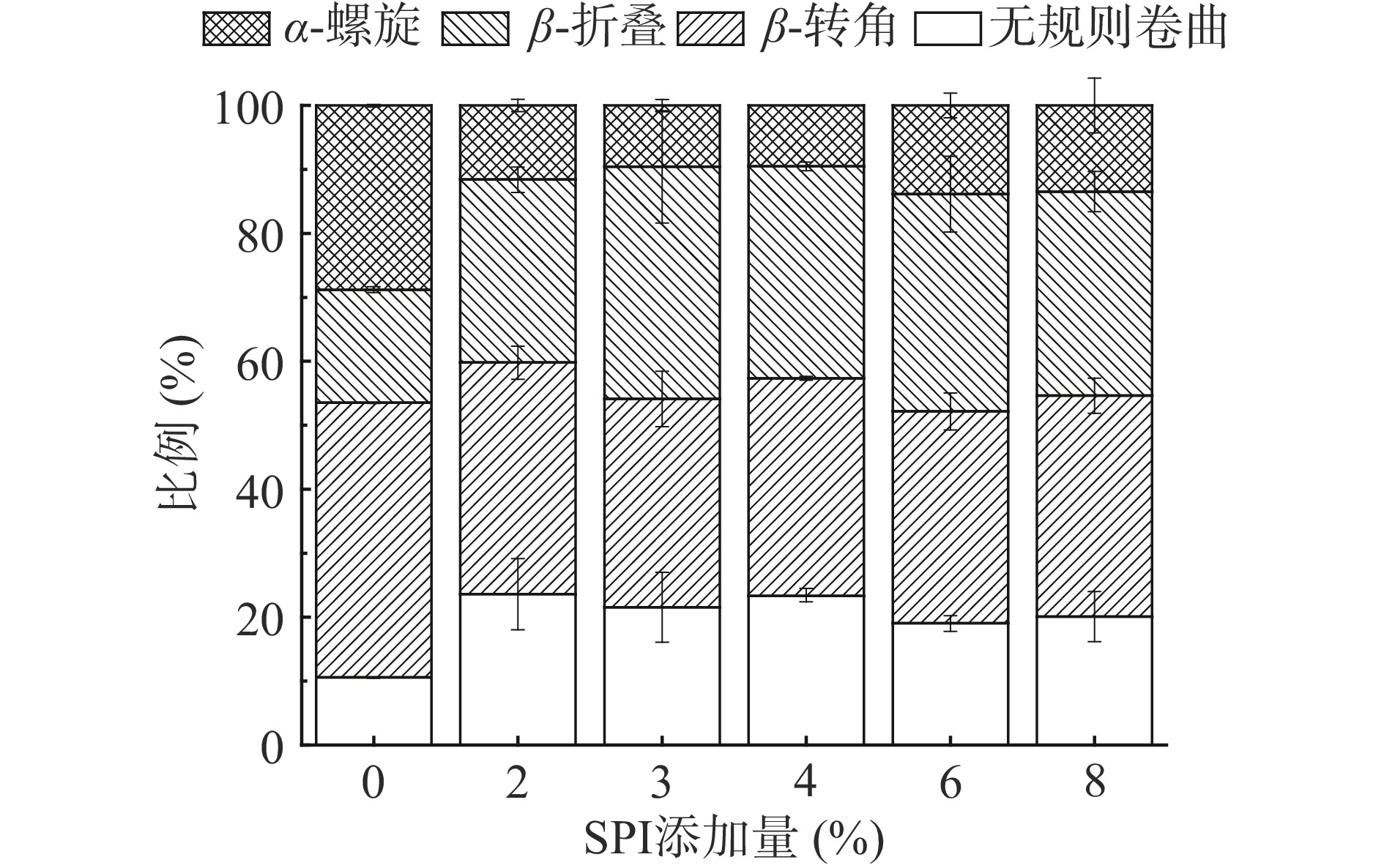
对酰胺Ⅲ带进行傅里叶去卷积、高斯拟合和二阶求导处理,得到的凝胶二级结构含量的变化如图9所示。由图9可知,各组样品的二级结构均是以β-折叠或β-转角为主。与对照组相比,添加SPI后金线鱼肌球蛋白凝胶的α-螺旋和β-转角含量减少,同时伴随着β-折叠和无规则卷曲含量的增加;添加3% SPI时β-折叠含量最高,添加4% SPI时α-螺旋含量最低。这一结果表明,在蛋白质凝胶形成过程中会发生蛋白质二级结构的转化,α-螺旋转化为β-折叠、无规则卷曲,而SPI的添加会增加金线鱼肌球蛋白凝胶β-折叠的含量、降低α-螺旋的含量。在0%~8%的SPI添加量范围内,3%~4%的SPI添加量更有利于α-螺旋向β-折叠的转化,促进形成结构更稳定、质构特性更好的凝胶[39]。
2.10 SPI添加量对金线鱼肌球蛋白凝胶微观结构的影响
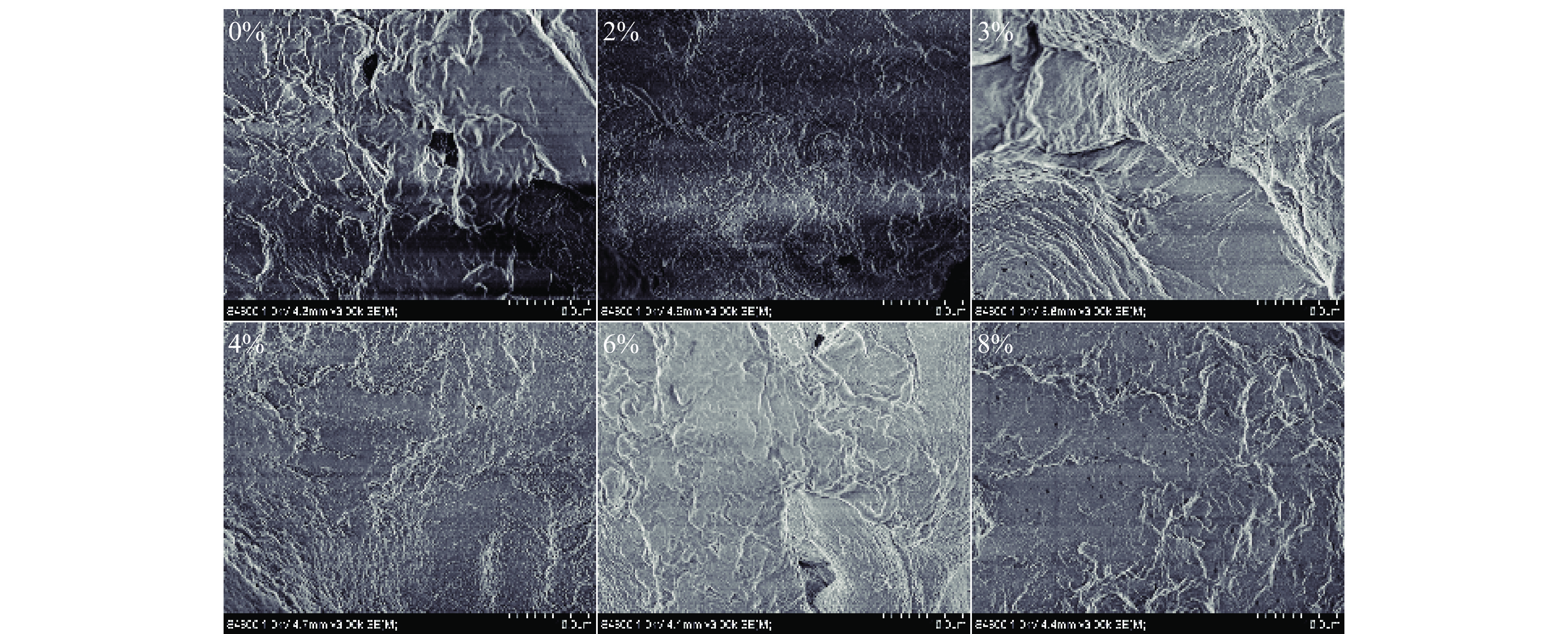
金线鱼肌球蛋白凝胶的微观结构与其凝胶特性密切相关。如图10所示,对照组凝胶有大而不规则的孔洞且表面粗糙。0~4%的添加量范围内,随着SPI添加量的增加,凝胶表面孔洞减少且变得光滑、结构更加致密;4%~8%的添加量范围内随着SPI添加量的增加,凝胶表面再次变得粗糙,孔洞增加但孔径较小。金线鱼肌球蛋白凝胶微观结构的改变可能与SPI对其凝胶网络的修饰有关,适量的SPI会填充在金线鱼肌球蛋白网络中,诱导蛋白质结构展开,暴露出更多的巯基和疏水性基团,并在加热后α-螺旋转化为β-折叠,最终导致凝胶网络结构更加致密均匀,而过量的SPI会黏附在金线鱼肌球蛋白凝胶网络上,形成厚的丝和孔,阻碍金线鱼肌球蛋白的交联。添加4% SPI时,金线鱼肌球蛋白凝胶网络结构最致密均匀,且表面平整,这与凝胶强度、质构特性、总巯基、化学作用力和流变特性的试验结果一致。Lin等[14]研究发现将14%(w/w)的植物蛋白混合物加入肌原纤维蛋白中,形成的混合蛋白凝胶的微观结构更加致密均匀,与本文的结果相似。
3. 结论
本研究分析了未加热条件下SPI和金线鱼肌球蛋白混合体系中的相互作用对金线鱼肌球蛋白凝胶特性的影响。结果表明,向金线鱼肌球蛋白溶液中添加SPI,疏水相互作用、氢键、二硫键等非共价相互作用和共价相互作用发生改变,影响了蛋白的变性,最终改变了金线鱼肌球蛋白的凝胶特性。0~8%的SPI添加量范围内,当SPI的添加量为4%时,SPI与金线鱼肌球蛋白的相互作用最强,混合凝胶具有最佳的凝胶特性和致密均匀的微观结构。因此,适量的SPI能有效诱导金线鱼肌球蛋白与SPI间的相互作用,促进蛋白分子间的交联、聚集,形成致密均匀的凝胶微观结构,从而改善金线鱼肌球蛋白凝胶特性,为高品质鱼糜制品的生产提供参考依据。本研究仅从理化特性、光谱特性、流变特性和凝胶特性方面研究了未加热条件下SPI与金线鱼肌球蛋白的相互作用对其凝胶特性的影响,而关于不同加热温度、加热方式、加热前蛋白聚集程度对蛋白凝胶特性的影响以及分子水平上二者相互作用的机制有待进一步研究。
-
表 1 不同添加量SPI对金线鱼肌球蛋白凝胶质构特性的影响
Table 1 Effect of different addition of SPI on the texture properties of Nemipterus virgatus myosin gel
SPI添加量(%) 硬度(g) 弹性 粘聚性 胶着度(g) 咀嚼度(g) 回复性 0 521.67±20.25b 0.84±0.02b 0.72±0.01b 374.54±11.30c 314.40±7.02c 0.40±0.01a 2 565.72±9.10a 0.84±0.01b 0.72±0.01b 405.24±10.21b 342.16±4.43b 0.40±0.01a 4 569.70±21.81a 0.90±0.01a 0.77±0.03a 438.59±1.48a 394.32±6.59a 0.44±0.03a 6 533.92±9.27b 0.85±0.00b 0.73±0.01ab 389.90±9.28bc 333.53±7.11bc 0.41±0.00a 8 527.01±5.56b 0.86±0.02b 0.75±0.04ab 396.21±19.01bc 341.53±26.43b 0.44±0.03a 注:表中同一列上标字母不同表示差异显著(P<0.05)。 -
[1] LIU J Y, YOSHIDA A, GAO Y L, et al. Purification and characterization of a sarcoplasmic serine proteinase from threadfin bream Nemipterus virgatus muscle[J]. Food Chemistry,2019,284:198−204. doi: 10.1016/j.foodchem.2019.01.024
[2] ZHU Z W, LANIER T C, FARKAS B E. High pressure effects on heat-induced gelation of threadfin bream (Nemipterus spp.) surimi[J]. Journal of Food Engineering,2015,146:23−27. doi: 10.1016/j.jfoodeng.2014.08.021
[3] 鲍佳彤. 外源添加物对未漂洗鲶鱼鱼糜凝胶形成的影响[D]. 天津: 天津农学院, 2020 BAO J T. Effects of exogenous additives on surimi gel formation in unwashed catfish[D]. Tianjin: Tianjin Agricultural University, 2020.
[4] 叶月华, 钱敏, 刘晓艳, 等. 不同外源物质对淡水鱼鱼糜热诱导凝胶特性增效作用的研究进展[J]. 食品与发酵工业,2021,47(12):285−293. [YE Y H, QIAN M, LIU X Y, et al. Research progress on the enhancement effects of different exogenous substances on thermal-induced gel properties of fresh water fish surimi[J]. Food and Fermentation Industries,2021,47(12):285−293. doi: 10.13995/j.cnki.11-1802/ts.026634 Ye Y H, Qian M, Liu X Y, et al. Research progress on the enhancement effects of different exogenous substances on thermal-induced gel properties of fresh water fish surimi[J]. Food and Fermentation Industries, 2021, 47(12): 285-293. doi: 10.13995/j.cnki.11-1802/ts.026634
[5] 王丽丽, 杨文鸽, 徐大伦, 等. 外源添加物对鱼糜及其制品凝胶性能影响的研究[J]. 核农学报,2015,29(10):1985−1990. [WANG L L, YANG W G, XU D L, et al. Effects of exogenous additives on gel properties of surimi and its products[J]. Journal of Nuclear Agricultural Sciences,2015,29(10):1985−1990. doi: 10.11869/j.issn.100-8551.2015.10.1985 WANG L L, YANG W G, XU D L, et al. Effects of exogenous additives on gel properties of surimi and its products[J]. Journal of Nuclear Agricultural Sciences, 2015, 29(10): 1985-1990. doi: 10.11869/j.issn.100-8551.2015.10.1985
[6] 彭晶. 菜籽蛋白的制备及其对白鲢鱼糜凝胶特性的影响[D]. 武汉: 华中农业大学, 2017 PENG J. Study on the preparation of rapeseed protein and its effect on the gelation of silver carp surumi[D]. Wuhan: Huazhong Agricultural University, 2017.
[7] BORDERÍAS A J, TOVAR C A, DOMÍNGUEZ-TIMÓN F, et al. Characterization of healthier mixed surimi gels obtained through partial substitution of myofibrillar proteins by pea protein isolates[J]. Food Hydrocolloids,2020,107:105976. doi: 10.1016/j.foodhyd.2020.105976
[8] WANG H N, ZHANG W, LIU X L, et al. Effects of chickpea and peanut protein isolates on the gelling properties of hairtail (Trichiurus haumela) myosin[J]. LWT-Food Science and Technology,2022,163:113562. doi: 10.1016/j.lwt.2022.113562
[9] CHEN N N, ZHAO M M, CHASSENIEUX C, et al. The effect of adding NaCl on thermal aggregation and gelation of soy protein isolate[J]. Food Hydrocolloids,2017,70:88−95. doi: 10.1016/j.foodhyd.2017.03.024
[10] WANG Z J, LIANG J, JIANG L Z, et al. Effect of the interaction between myofibrillar protein and heat-induced soy protein isolates on gel properties[J]. CyTA-Journal of Food,2015,13(4):527−534.
[11] LUO Y K, SHEN H X, PAN D D, et al. Gel properties of surimi from silver carp (Hypophthalmichthys molitrix) as affected by heat treatment and soy protein isolate[J]. Food Hydrocolloids,2008,22(8):1513−1519. doi: 10.1016/j.foodhyd.2007.10.003
[12] 崔旭海, 毕海丹, 崔晓莹, 等. 不同食用蛋白的添加对鲤鱼鱼糜流变和凝胶特性的影响[J]. 食品工业科技,2018,39(16):195−200, 225. [CUI X H, BI H D, CUI X Y, et al. Effects of the edible protein on rheological and gel properties of carp surimi[J]. Science and Technology of Food Industry,2018,39(16):195−200, 225. doi: 10.13386/j.issn1002-0306.2018.16.035 CUI X H, BI H D, CUI X Y, et al. Effects of the edible protein on rheological and gel properties of carp surimi[J]. Science and Technology of Food Industry, 2018, 39(16): 195-200, 225. doi: 10.13386/j.issn1002-0306.2018.16.035
[13] 武雅琴, 王莉莎, 邹咪, 等. 热诱导大豆分离蛋白对肌原纤维蛋白凝胶特性的影响[J]. 食品与发酵工业,2019,45(10):60−65. [WU Y Q, WANG L S, ZOU M, et al. Effects of heat-induced soy protein isolate on gel properties of myofibrillar proteins[J]. Food and Fermentation Industries,2019,45(10):60−65. doi: 10.13995/j.cnki.11-1802/ts.018951 WU Y Q, WANG L S, ZOU M, et al. Effects of heat-induced soy protein isolate on gel properties of myofibrillar proteins[J]. Food and Fermentation Industries, 2019, 45(10): 60-65. doi: 10.13995/j.cnki.11-1802/ts.018951
[14] LIN D Q, ZHANG L T, LI R J, et al. Effect of plant protein mixtures on the microstructure and rheological properties of myofibrillar protein gel derived from red sea bream (Pagrosomus major)[J]. Food Hydrocolloids,2019,96:537−545. doi: 10.1016/j.foodhyd.2019.05.043
[15] MI H B, ZHAO Y M, LI Y, et al. Combining effect of soybean protein isolate and transglutaminase on the gel properties of Zhikong scallop (Chlamys farreri) adductor muscle[J]. LWT-Food Science and Technology,2021,138:110727. doi: 10.1016/j.lwt.2020.110727
[16] PARK J W, LANIER T C. Scanning calorimetric behavior of tilapia myosin and actin due to processing of muscle and protein purification[J]. Journal of Food Science,1989,54(1):49−51. doi: 10.1111/j.1365-2621.1989.tb08564.x
[17] 李政翰. 玉米淀粉-脂肪酸-带鱼肌球蛋白间的相互作用机制研究[D]. 锦州: 渤海大学, 2020 LI Z H. Interaction mechanism of corn starch-fatty acid-hairtail myosin[D]. Jinzhou: Bohai University, 2020.
[18] YONGSAWATDIGUL J, PARK J W. Thermal denaturation and aggregation of threadfin bream actomyosin[J]. Food Chemistry,2003,83(3):409−416. doi: 10.1016/S0308-8146(03)00105-5
[19] SUN L C, LIN Y C, LIU W F, et al. Effect of pH shifting on conformation and gelation properties of myosin from skeletal muscle of blue round scads (Decapterus maruadsi)[J]. Food Hydrocolloids,2019,93:137−145. doi: 10.1016/j.foodhyd.2019.02.026
[20] GÓMEZ-GUILLÉN M C, BORDERÍAS A J, MONTERO P, et al. Chemical interactions of nonmuscle proteins in the network of sardine (Sardina pilchardus) muscle gels[J]. LWT-Food Science and Technology,1997,30(6):602−608. doi: 10.1006/fstl.1997.0239
[21] SHIMADA M, TAKAI E, EJIMA D, et al. Heat-induced formation of myosin oligomer-soluble filament complex in high-salt solution[J]. International Journal of Biological Macromolecules,2015,73:17−22. doi: 10.1016/j.ijbiomac.2014.11.005
[22] NIU H L, LI Y, HAN J C, et al. Gelation and rheological properties of myofibrillar proteins influenced by the addition of soybean protein isolates subjected to an acidic pH treatment combined with a mild heating[J]. Food Hydrocolloids,2017,70:269−276. doi: 10.1016/j.foodhyd.2017.04.001
[23] CAO Y Y, XIA T L, ZHOU G H, et al. The mechanism of high pressure-induced gels of rabbit myosin[J]. Innovative Food Science & Emerging Technologies,2012,16:41−46.
[24] DU X, ZHAO M, PAN N, et al. Tracking aggregation behaviour and gel properties induced by structural alterations in myofibrillar protein in mirror carp (Cyprinus carpio) under the synergistic effects of pH and heating. Food Chemistry, 2021, 362: 130222.
[25] WANG K Q, LUO S Z, ZHONG X Y, et al. Changes in chemical interactions and protein conformation during heat-induced wheat gluten gel formation[J]. Food Chemistry,2017,214:393−399. doi: 10.1016/j.foodchem.2016.07.037
[26] TANG C H, YANG X Q, CHEN Z, et al. Physicochemical and structural characteristics of sodium caseinate biopolymers induced by microbial transglutaminase[J]. Journal of Food Biochemistry,2005,29(4):402−421. doi: 10.1111/j.1745-4514.2005.00038.x
[27] ZHANG L, WANG P, YANG Z Y, et al. Molecular dynamics simulation exploration of the interaction between curcumin and myosin combined with the results of spectroscopy techniques[J]. Food Hydrocolloids,2020,101:105455. doi: 10.1016/j.foodhyd.2019.105455
[28] ACHARYA D P, SANGUANSRI L, AUGUSTIN M A. Binding of resveratrol with sodium caseinate in aqueous solutions[J]. Food Chemistry,2013,141(2):1050−1054. doi: 10.1016/j.foodchem.2013.03.037
[29] LÜ Y Q, XU L L, SU Y J, et al. Effect of soybean protein isolate and egg white mixture on gelation of chicken myofibrillar proteins under salt/-free conditions[J]. LWT-Food Science and Technology,2021,149:111871. doi: 10.1016/j.lwt.2021.111871
[30] 邓立青. 不同辅料添加量对铜盘鱼鱼糜凝胶强度的影响[J]. 肉类工业,2020,40(8):19−22. [DENG L Q. Effect of the addition amount of different auxiliary material on the gel strength of copper plate fish surimi[J]. Meat Industry,2020,40(8):19−22. DENG L Q. Effect of the addition amount of different auxiliary material on the gel strength of copper plate fish surimi[J]. Meat Industry, 2020, 40(8): 19-22.
[31] ZHOU X X, CHEN T, LIN H H, et al. Physicochemical properties and microstructure of surimi treated with egg white modified by tea polyphenols[J]. Food Hydrocolloids,2019,90:82−89. doi: 10.1016/j.foodhyd.2018.07.031
[32] 于繁千惠, 孔文俊, 韦依侬, 等. 小麦蛋白和谷氨酰胺转氨酶对120 ℃高温处理鱼糜凝胶特性影响的研究[J]. 食品工业科技,2016,37(21):81−85. [YU F Q H, KONG W J, WEI Y N, et al. Effects of wheat protein and transglutaminase on gel properties of surimi heated at 120 ℃ high temperature[J]. Science and Technology of Food Industry,2016,37(21):81−85. YU F Q H, KONG W J, WEI Y N, et al. Effects of wheat protein and transglutaminase on gel properties of surimi heated at 120 ℃ high temperature[J]. Science and Technology of Food Industry, 2016, 37(21): 81-85.
[33] 王聪. 淀粉和亲水胶体对白鲢鱼鱼糜凝胶特性的增效作用研究[D]. 锦州: 渤海大学, 2019 WANG C. Synergistic effect of starch and hydrocolloid on gel properties of silver carp surimi[D]. Jinzhou: Bohai University, 2019.
[34] LI T F, ZHAO J X, HUANG J, et al. Improvement of the quality of surimi products with overdrying potato starches[J]. Journal of Food Quality,2017,2017:1−5.
[35] CHEN J X, DENG T Y, WANG C, et al. Effect of hydrocolloids on gel properties and protein secondary structure of silver carp surimi[J]. Journal of the Science of Food and Agriculture,2020,100(5):2252−2260. doi: 10.1002/jsfa.10254
[36] YUAN L, YU J M, MU J L, et al. Effects of deacetylation of konjac glucomannan on the physico-chemical properties of surimi gels from silver carp (Hypophthalmichthys molitrix)[J]. RSC Advances,2019,9(34):19828−19836. doi: 10.1039/C9RA03517F
[37] 汪坤霞. 莲藕淀粉对鲢鱼鱼糜凝胶特性的影响[D]. 武汉: 华中农业大学, 2017 WANG K X. Effects of lotus starch on gelation properties of silver carp surimi[D]. Wuhan: Huazhong Agricultural University, 2017.
[38] 杨玲玲. 卵白蛋白-大豆分离蛋白对肉糜凝胶特性的影响[D]. 南昌: 江西农业大学, 2020 YANG L L. Effect of ovalbumin-soybean protein isolate on gelation characteristics of meat[D]. Nanchang: Jiangxi Agricultural University, 2020.
[39] 姜鹏飞, 于文静, 朱凯悦, 等. 多糖对罗非鱼鱼糜凝胶化行为的影响[J]. 中国食品学报,2023,23(1):87−99. [JIANG P F, YU W J, ZHU K Y, et al. Effect of polysaccharides on gelation behavior of tilapia surimi[J]. Chinese Journal of Food Science,2023,23(1):87−99. doi: 10.16429/j.1009-7848.2023.01.009 JIANG P F, YU W J, ZHU K Y, et al. Effect of polysaccharides on gelation behavior of tilapia surimi[J]. Chinese Journal of Food Science, 2023, 23(1): 87-99. doi: 10.16429/j.1009-7848.2023.01.009
-
期刊类型引用(2)
1. 赵一萌,索晓雄,刘彩霞,尚彩玲,杜晨晖,闫艳,裴香萍. 药用植物蛋白提取方法及生物活性研究进展. 食品安全质量检测学报. 2024(15): 119-126 .  百度学术
百度学术
2. 邓梓萌,侯鹏颉,刘思迪,崔俊良,刘志勇,尹学东,冷虹薇,廖小军,赵靓. 辣椒籽分离蛋白超滤提取工艺优化及特性表征. 中国调味品. 2024(09): 1-8 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:

 下载:
下载:



