Isolation, Purification, Monosaccharide Composition and Antioxidant Activity of Polysaccharides from Cortex Periplocae
-
摘要: 目的:分离纯化香加皮多糖(Cortex Periplocae Polysaccharides,CPP),并对其进行单糖组成和抗氧化活性研究,以期为香加皮多糖在食品领域的开发和应用提供参考。方法:通过水提醇沉和Sevag法除蛋白得到香加皮粗多糖,经DEAE-52纤维素柱分离纯化得到4种多糖组分CPP0、CPP1、CPP2和CPP3,并对其进行化学成分检测、分子量测定、单糖组成分析、红外光谱和抗氧化活性分析。结果:4种多糖的糖含量分别为82.20%、77.13%、75.23%和72.85%,且都含有糖醛酸;相对分子量分别为685、477、411和572 kDa。4种多糖均为甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖按照不同摩尔比组成的杂多糖。红外光谱表明4种多糖含有β-糖苷键且具有呋喃环。抗氧化实验结果显示4种多糖均具有一定的抗氧化性,总体抗氧化能力顺序为:CPP0>CPP3>CPP1>CPP2。结论:从香加皮中提取得到的4种酸性多糖,糖含量高、相对分子量大且均具有抗氧化活性,其中CPP0组分抗氧化活性最好。Abstract: Objective: In this experiment, polysaccharides from cortex periplocae (CPP) were isolated and purified, and their monosaccharide composition and antioxidant activity were investigated, so as to provide a reference for the development and application of CPP in the food industry. Methods: The crude polysaccharides were obtained by aqueous extraction, alcoholic precipitation and protein removal by Sevag method, and four polysaccharide fractions CPP0, CPP1, CPP2 and CPP3 were separated and purified by DEAE-52 cellulose column. The chemical composition, molecular weight, monosaccharide composition, infrared spectrum and antioxidant activity were analyzed. Results: The sugar contents of these four polysaccharides were 82.20%, 77.13%, 75.23% and 72.85%, respectively, and all of them contained glyoxylate. The relative molecular weights were 685, 477, 411 and 572 kDa, respectively. The four polysaccharides were all heteropolysaccharides composed of mannose, rhamnose, galacturonic acid, glucose, galactose and arabinose in different molar ratios. The infrared spectra showed that four polysaccharides contained β-glycosidic bonds and with furan rings. The antioxidant experiments showed that all four polysaccharides had certain antioxidant properties, and the overall antioxidant capacity was in the following order: CPP0>CPP3>CPP1>CPP2. Conclusion: The four acidic polysaccharides extracted from cortex periplocae have high sugar content, high relative molecular weight, and antioxidant activity, among which CPP0 fraction has the best antioxidant activity.
-
香加皮别名北五加皮、羊奶藤,为萝藦科植物杠柳(Periploca sepium Bge.
)的干燥根皮。据研究显示,香加皮具有强心、抗肿瘤、抗炎及免疫调节作用[1-2],对于慢性心力衰竭也有很好的治疗作用,常作传统中药使用[3]。多糖是一种高分子聚合物,由多个单糖通过糖苷键结合而成[4],主要存在于动植物和微生物中[5]。多糖因其在理化性质方面无毒副作用,而且具有热稳定、缓释性、药理活性以及吸水保湿性等特点[6-8],在食品[9]和医药等[10]领域得到了广泛应用。近年来关于香加皮多糖的研究有了初步进展,段漓童等[11]通过索氏提取器分离得到香加皮多糖,分析香加皮多糖的主要成分是乳糖和甘露糖,但提取得到的多糖含量较低。对于香加皮多糖的结构分析以及抗氧化活性的研究鲜有报道,限制了香加皮多糖的开发与应用。 本课题组前期对河南产地的香加皮通过水提醇沉法以及脱色脱蛋白后得到三种香加皮中性多糖,均由鼠李糖、阿拉伯糖、甘露糖、葡萄糖和半乳糖组成,且具有较强的抗氧化活性[12]。本实验以河北产地的香加皮为原料,通过水提醇沉法得到香加皮粗多糖,并对其纯化后的组分进行化学成分检测、分子量测定、单糖组分测定、红外光谱以及抗氧化活性研究,以期为香加皮多糖的深入开发利用提供参考。
1. 材料与方法
1.1 材料与仪器
香加皮 购自河北保定中药材市场,产地为河北;单糖标准品:甘露糖、鼠李糖、半乳糖醛酸、无水葡萄糖、半乳糖、阿拉伯糖、葡聚糖标准品(纯度≥98%)、纤维素柱DEAE-52 北京索莱宝科技有限公司;DPPH(1,1-二苯基-2-三硝基苯肼)、ABTS(2,2-联氮-二(3-乙基-苯并噻唑啉-6-磺酸)二铵盐) 上海阿拉丁生科科技股份有限公司;乙腈(色谱纯)、浓硫酸、苯酚、氯仿等其他试剂(均为分析纯) 天津市大茂化学试剂厂。
BSZ-160F自动部分收集器 上海之信仪器有限公司;UV-5200紫外可见分光光度计 上海元析仪器有限公司;Nicolet iS 50傅里叶变换红外光谱仪 美国Nicolet 公司;N-1300旋转蒸发仪 上海爱郎有限公司;Scientz-10N/A冷冻干燥机 宁波新芝科技股份有限公司;LC-20AR高效液相色谱仪 日本岛津公司。
1.2 实验方法
1.2.1 香加皮粗多糖的提取
参考王小莉[13]的方法略加改动。将香加皮磨碎后过40目筛,得香加皮粉末。取2 kg香加皮粉末,加入3 L无水乙醇浸泡脱脂,每次6 h,共三次,抽滤,干燥。将蒸馏水按料液比1:5加入,提取温度为60 ℃,提取时间为2 h,共三次,合并提取液,浓缩。离心去沉淀后加入2倍体积的无水乙醇混匀,4 ℃醇沉24 h,离心取沉淀。将沉淀用蒸馏水复溶后于透析袋(Mw=3.5 kDa)中透析72 h,离心,冷冻干燥,即得香加皮粗多糖(Crude Cortex Periplocae Polysaccharides,CCPP)。
CPPP得率(%)=mM×100 式中:m为香加皮粗多糖质量(g);M为香加皮粉末质量(g)。
1.2.2 香加皮粗多糖的分离纯化
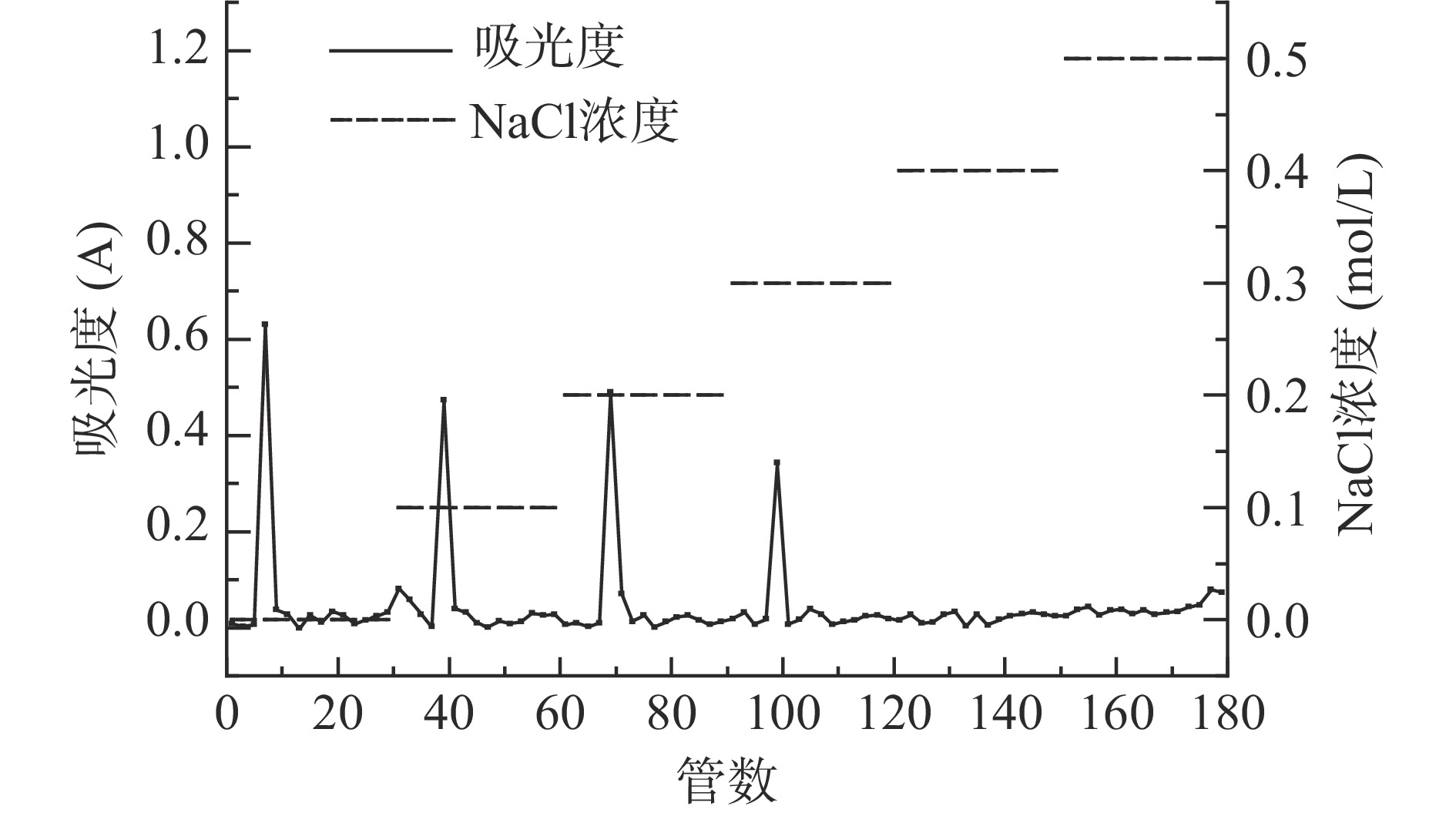
CCPP先使用Sevag法[14]脱蛋白3次后,再通过DEAE-52纤维素层析柱(26 mm×60 cm)进一步分离纯化。脱蛋白后的CCPP用蒸馏水溶解上样,依次用0、0.1、0.2、0.3、0.4、0.5 mol/L的NaCl溶液进行梯度洗脱,洗脱流速为1 mL/min,洗脱液用自动收集器收集,每个梯度收集30管,每管收集10 mL。收集到的多糖溶液采用苯酚-硫酸法隔管检测,以管数为横坐标,吸光度为纵坐标作图得到洗脱曲线。合并单一糖峰,透析、浓缩、冷冻干燥,并计算出香加皮纯多糖(CPP)的得率:
CPP得率(%)=mM×100 式中:m为香加皮纯多糖质量(g);M为香加皮粗多糖质量(g)。
1.2.3 香加皮多糖的化学成分测定
采用苯酚-硫酸法测糖含量[15]。取1 mL 1 mg/mL的样品溶液于试管中,加入1 mL 5%的苯酚溶液和5 mL浓硫酸混匀,于490 nm处测其吸光度。以葡萄糖标准溶液(0、10、20、30、40、50 μg/mL)建立标准曲线,得回归方程为y=0.0085x-0.0131,R2=0.997,根据此方程计算样品中的糖含量。
采用考马斯亮蓝法测蛋白质含量[16]。取1 mL 1 mg/mL的样品溶液于试管中,加入5 mL的考马斯亮蓝溶液混匀,于595 nm处测其吸光度。以牛血清蛋白标准溶液(0、20、40、60、80、100 μg/mL)建立标准曲线,得回归方程为y=0.0133x−0.1084,R2=0.999,根据此方程计算样品中的蛋白质含量。
采用硫酸-咔唑法测糖醛酸含量[17]。取1 mL 1 mg/mL的样品溶液于试管中,在冰水浴中加入3 mL 5 mg/mL的四硼酸钠-硫酸溶液,混匀后于沸水浴中加热5 min,冷却至室温后加入0.1 mL 0.1%咔唑溶液,静置2 h后在530 nm处测定其吸光度。以半乳糖醛酸标准溶液(0、10、20、30、40、50 μg/mL)建立标准曲线,得回归方程为y=0.0164x−0.0952,R2=0.999,根据此方程计算样品中的糖醛酸含量。
1.2.4 香加皮多糖的紫外全波长扫描
将香加皮多糖配制成质量浓度为0.5 mg/mL的水溶液,在200~500 nm波长范围内进行紫外波长扫描。
1.2.5 香加皮多糖均一性和分子质量的测定
参考王少杰等[18]的方法分析香加皮多糖的均一性和分子质量。
色谱条件:采用Shimadzu HPLC系统(配用LC-20AR泵和RID-2410示差折光检测器),示差折光检测器温度40 ℃,色谱柱:Shodex Sugar KS-804(8 mm×300 mm),柱温50 ℃,流动相:超纯水,流速1.0 mL/min,检测时间为33 min。标品为不同分子量(4.32、12.6、73.8、126、289、496 kDa)葡聚糖。
1.2.6 香加皮多糖的单糖组分测定
参考余亦婷等[19]的PMP(1-苯基-3-甲基-5-吡唑啉酮)柱前衍生化-HPLC法并略作修改。
1.2.6.1 多糖的水解
称取10 mg香加皮多糖加入8 mL 2 mol/L的TFA(三氟乙酸)置于试管中,密封后于烘箱中110 ℃水解4 h,反应结束后用旋转蒸发仪蒸干,加甲醇溶液2 mL后蒸干,重复3次以除去TFA,然后用1 mL超纯水复溶得香加皮多糖水解液。
1.2.6.2 多糖水解液的PMP衍生化
配制6种单糖浓度为2 mg/mL的标准溶液,各取1.0 mL置于10 mL容量瓶中,加水定容后混匀。取100 μL混合单糖标准液和100 μL香加皮多糖水解液分别加入100 μL 0.3 mol/L的NaOH溶液和100 μL 0.5 mol/L的PMP甲醇溶液混匀,70 ℃水浴加热反应100 min,冷却至室温后加入100 μL 0.3 mol/L的HCl中和;加超纯水至1 mL,再加入1 mL氯仿,振摇离心后弃去氯仿相,共萃取3次。水相经0.45 μm滤膜过滤后供HPLC进样分析。
1.2.6.3 色谱条件
Shim-pack GIST C18柱(4.6 mm×250 mm,5 μm,Shimadzu),柱温35 ℃,检测波长250 nm,流速1.0 mL/min,进样量20 μL。流动相A为0.05 mmol/L磷酸二氢钾溶液(pH6.8),流动相B为乙腈溶液(等度洗脱,体积比A:B=81:19),检测时间为50 min。
1.2.7 香加皮多糖的红外光谱
称取1 mg香加皮多糖与100 mg溴化钾粉末混合,研磨均匀后用压片机压片,使用红外光谱仪在4000~500 cm−1的范围内进行扫描。
1.2.8 香加皮多糖抗氧化活性的测定
称取不同质量的香加皮多糖,分别配制成0.1、0.25、0.5、0.75、1 mg/mL的水溶液,备用。
1.2.8.1 DPPH自由基清除能力测定
根据文献[20]的方法配制DPPH乙醇溶液。取不同浓度的多糖溶液1 mL,加2 mL DPPH乙醇溶液,对照组用无水乙醇代替DPPH乙醇溶液,空白以同体积蒸馏水代替多糖样品,以VC作阳性对照,混匀后避光反应30 min,于517 nm处测吸光度。
DPPH自由基清除率(%)=(1−A样品−A对照A空白)×100 1.2.8.2 ABTS+自由基清除能力测定
参考程爽等[21]的方法配制ABTS乙醇溶液。取2 mL不同浓度的样品溶液,加4 mL ABTS乙醇溶液,对照组用无水乙醇代替ABTS乙醇溶液,空白以同体积蒸馏水代替多糖样品,混匀后避光反应10 min,于734 nm处测吸光度,以VC作阳性对照。
ABTS+自由基清除率(%)=(1−A样品−A对照A空白)×100 1.2.8.3 OH自由基清除能力测定
OH自由基清除能力的测定根据文献[22]稍作修改。取1 mL不同浓度的多糖溶液分别加入1 mL 6 mmol/L硫酸亚铁溶液、1 mL 6 mmol/L水杨酸乙醇溶液和1 mL 6 mmol/L过氧化氢溶液混合均匀。37 ℃水浴加热反应1 h,冷却后在510 nm检测其吸光度,对照组用蒸馏水代替过氧化氢溶液,空白组用蒸馏水代替样品,以VC作阳性对照。OH自由基清除率的计算公式为:
OH自由基清除率(%)=(1−A样品−A对照A空白)×100 1.2.8.4 还原能力的测定
参考文献[21]测定样品的还原能力。取1 mL不同浓度的样品溶液加入2 mL 1%铁氰化钾溶液和2 mL磷酸盐缓冲液(pH6.6,0.2 mol/L)均匀混合,50 ℃水浴加热30 min。冷却后加入2 mL 10%三氯乙酸溶液,混合均匀后5000 r/min离心10 min,取2 mL上清液,加入2 mL蒸馏水和0.5 mL 1%三氯化铁溶液反应10 min,于700 nm处测吸光度,以VC作阳性对照。吸光度越大,则多糖的还原能力越强。
1.3 数据处理
各实验均重复3次,使用SPSS 26和Origin 2018软件对数据进行显著性差异分析和作图。
2. 结果与分析
2.1 香加皮粗多糖的分离纯化
通过“水提醇沉”法得到香加皮粗多糖的提取率为3.19%。图1为CCPP通过DEAE-52纤维素柱分离得到的梯度洗脱曲线图,以0、0.1、0.2、0.3、0.4和0.5 mol/L的NaCl溶液进行梯度洗脱,共得到4个多糖组分,分别为蒸馏水洗脱的CPP0;0.1 mol/L NaCl溶液洗脱的CPP1;0.2 mol/L NaCl溶液洗脱的CPP2;0.3 mol/L NaCl溶液洗脱的CPP3,得率分别为4.32%、5.26%、3.13%和4.28%。将各多糖组分分别进行收集,透析后经冷冻干燥得到粉末状多糖。其中CPP1为白色粉末,其余各组分均为浅棕色粉末。
2.2 香加皮多糖的化学组成
香加皮多糖各组分的化学成分如表1所示,通过苯酚-硫酸法测得4种多糖的糖含量顺序表现为:CPP0>CPP1>CPP2>CPP3,各组分之间的糖含量差异显著(P<0.05)。除CPP3组分含有少量的蛋白质外,其余各组分均不含蛋白质或蛋白含量低于检出限。香加皮多糖各组分均含有糖醛酸,说明4种多糖均为酸性多糖,其中CPP2组分的糖醛酸含量显著低于其它组分,CPP0组分的糖醛酸含量最高,这与王小莉[13]提取的香加皮多糖为中性多糖不一致,可能与香加皮产地有关。
表 1 香加皮多糖的化学成分分析Table 1. Chemical composition analysis of CPPS编号 糖含量(%) 蛋白含量(%) 糖醛酸含量(%) CPP0 82.20±0.48a − 31.06±0.70a CPP1 77.13±0.71b − 28.29±0.37b CPP2 75.23±0.63c − 23.82±0.24c CPP3 72.85±1.06d 2.5±0.8 29.11±0.37b 注:平均值±标准差;同列不同小写字母表示不同处理间差异显著(P<0.05);“−”表示未检测出。 2.3 香加皮多糖的紫外全波长扫描
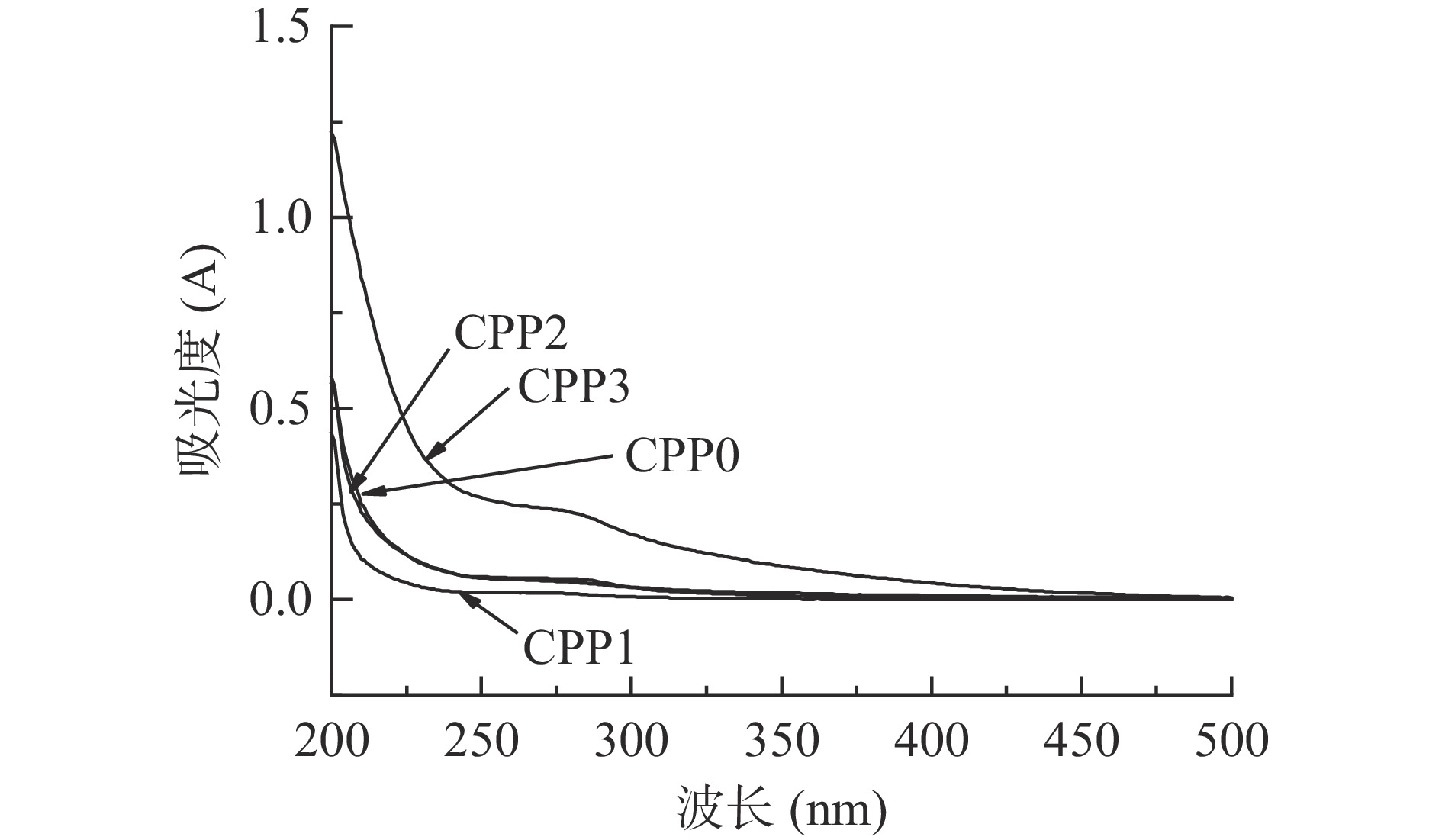
图2为4种多糖在200~500 nm处的紫外扫描图,其中CPP0、CPP1和CPP2在260和280 nm处无明显的吸收峰,表明样品中均不含或含极少量的蛋白质和核酸,纯度较高。而CPP3在280 nm处有小的吸收峰,说明该组分含有少量的蛋白质,这与表1各多糖的化学成分组成相一致。
2.4 香加皮多糖的分子量分析
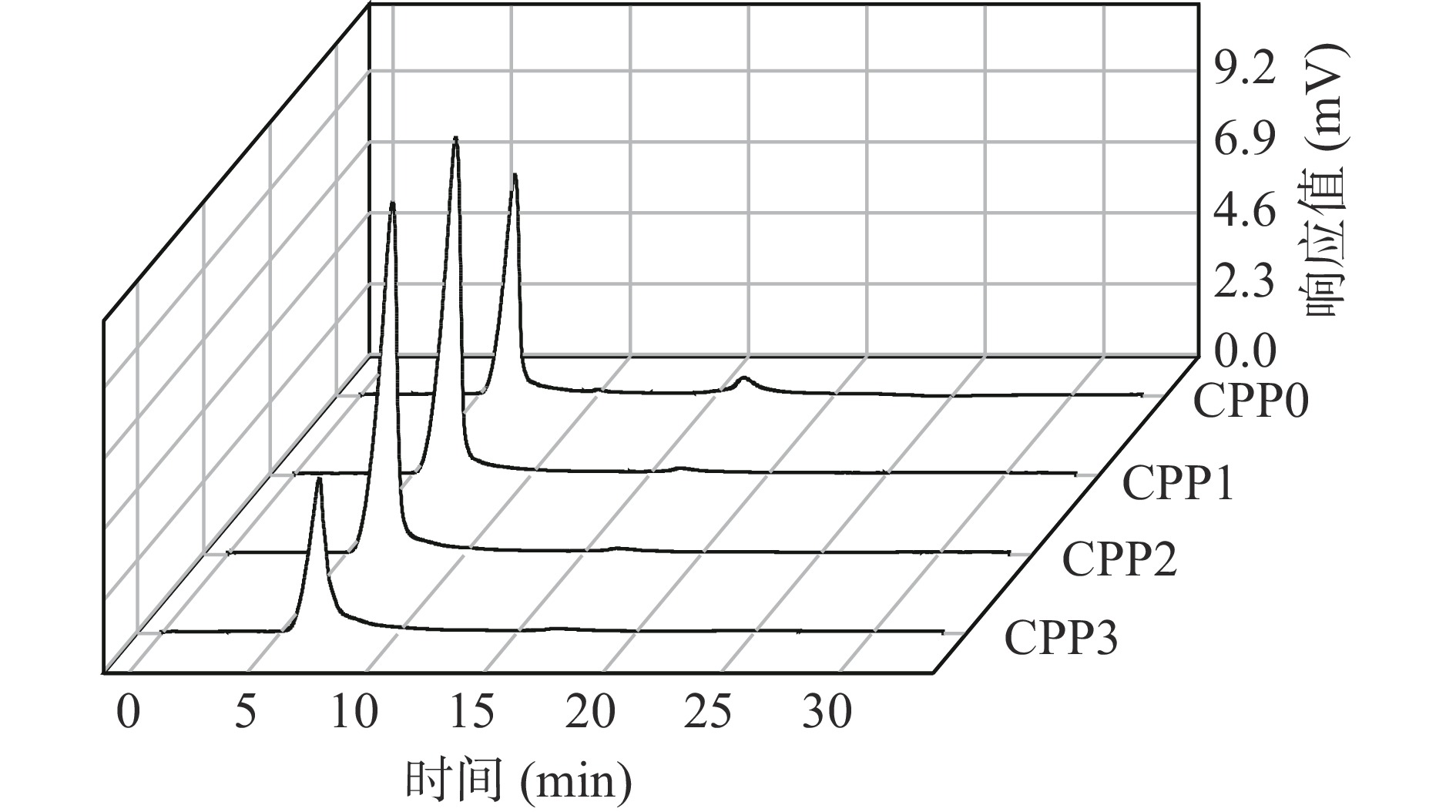
由图3可知,香加皮多糖各个组分均呈单一峰,峰型对称且陡峭,说明4种香加皮多糖均为单一的多糖组分,纯度较高。
以标准葡聚糖分子量的对数值(log Mw)和保留时间(T)所建立的标准曲线为:log Mw=−0.5067T+9.1478,R2=0.9909。CPP0、CPP1、CPP2和CPP3的保留时间分别是6.537、6.846、6.975和6.691 min,代入回归方程可得各多糖分子量分别为685、477、411和572 kDa。与河南产地的香加皮多糖[13]比较可知,本实验所得香加皮多糖分子量偏大许多,可能是因为分离纯化方法不同或是香加皮产地不同,导致分子量差异较大[23],具体原因需要进一步验证。
2.5 香加皮多糖的单糖组成
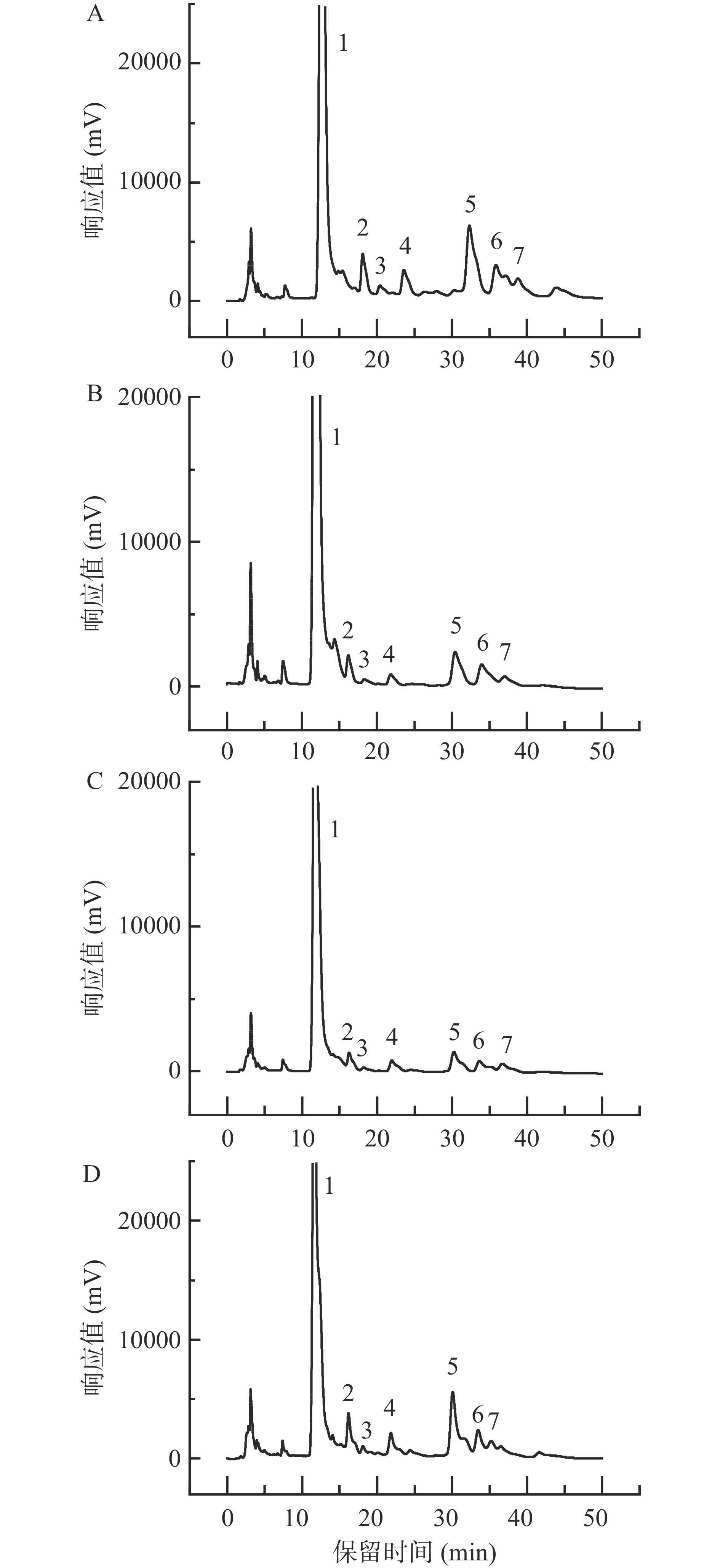
通过HPLC测定香加皮多糖的单糖组成,图4、图5为测定的混合标准品及样品的PMP衍生化色谱图。结果表明,香加皮的4种多糖组分中均含有甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖,但其摩尔比有明显差异。各多糖组分的摩尔比如表2所示,CPP0、CPP2和CPP3均以葡萄糖、甘露糖、鼠李糖和半乳糖为主;CPP1则以葡萄糖和半乳糖为主。4种多糖中葡萄糖含量均为最高,分别占其总摩尔比的39.41%、34.55%、39.78%和32.35%;阿拉伯糖含量较低,分别占其总摩尔比的8.28%、8.36%、6.09%和6.75%。4种多糖中糖醛酸占比分别为10.46%、7.82%、5.38%和8.16%,CPP0糖醛酸含量最高,CPP2糖醛酸含量最低,与表1中测得的糖醛酸含量趋势一致。在王小莉[13]的研究中,香加皮多糖分离出的3种组分均不含糖醛酸,且阿拉伯糖含量较低,与本实验结果不同,这可能是因为产地不同而导致的单糖组成不同[24]。
![]() 图 4 单糖标准品HPLC分析图谱注:1.PMP;2.甘露糖;3.鼠李糖;4.半乳糖醛酸;5.葡萄糖;6.半乳糖;7.阿拉伯糖;图5同。Figure 4. HPLC analysis spectrum of monosaccharide standards表 2 香加皮多糖各组分单糖的摩尔比Table 2. Molar ratios of monosaccharides of CPPS
图 4 单糖标准品HPLC分析图谱注:1.PMP;2.甘露糖;3.鼠李糖;4.半乳糖醛酸;5.葡萄糖;6.半乳糖;7.阿拉伯糖;图5同。Figure 4. HPLC analysis spectrum of monosaccharide standards表 2 香加皮多糖各组分单糖的摩尔比Table 2. Molar ratios of monosaccharides of CPPS编号 甘露糖 鼠李糖 半乳糖醛酸 葡萄糖 半乳糖 阿拉伯糖 CPP0 1.65 1.61 1.25 4.71 1.74 0.99 CPP1 0.76 0.53 0.43 1.90 1.42 0.46 CPP2 0.48 0.57 0.15 1.11 0.31 0.17 CPP3 1.41 1.32 0.58 2.30 1.02 0.48 2.6 红外光谱分析
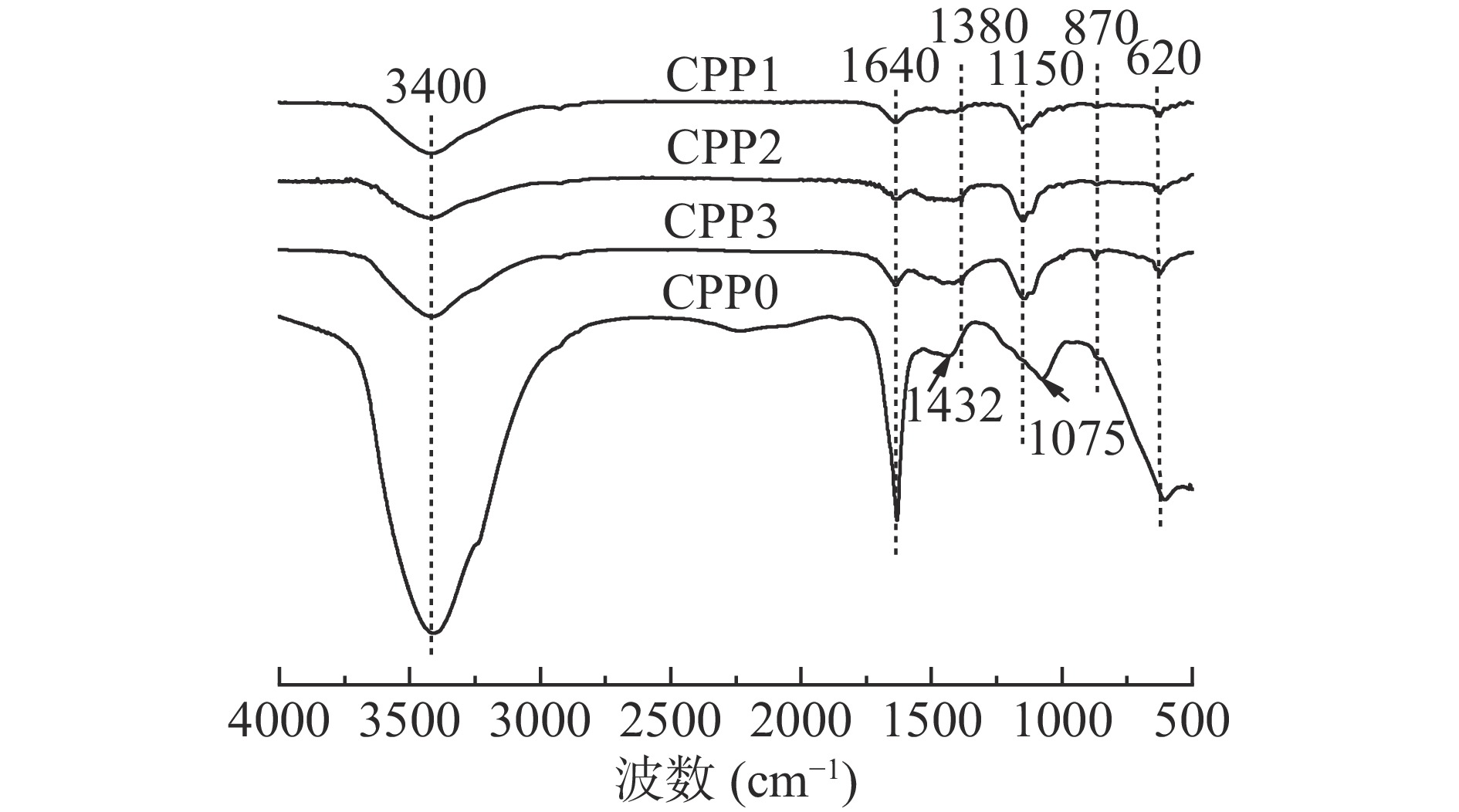
香加皮4种多糖组分的红外光谱图如图6所示,CPP0与CPP1、CPP2和CPP3的红外光谱图差异较大。4种多糖组分在3400 cm−1处的强吸收峰为O-H伸缩振动峰,符合糖类的一般结构特征,其中CPP0在3400 cm−1处强度最大,说明羟基含量最多。1640 cm−1处的吸收峰为C=O的非对称伸缩运动,说明该多糖组分存在糖醛酸;其中CPP0在1640 cm−1处的强度最大,可判断其糖醛酸含量较多,这与化学成分检测和单糖组成结果一致。CPP0在1432 cm−1处的吸收峰与CPP1、CPP2、CPP3在1380 cm−1处的吸收峰均为CH3−的对称变角振动;在1000~1200 cm−1附近的吸收峰为吡喃糖环的C-O-C伸缩振动和C-O-H的变角振动所引起的吸收峰。870 cm−1附近的吸收峰为β-糖苷键的特征峰;620 cm−1附近的吸收峰为呋喃环的特征吸收峰。说明香加皮的4种多糖均是含有β-糖苷键且具有呋喃环的多糖。
2.7 香加皮多糖的抗氧化活性分析
2.7.1 DPPH自由基清除能力
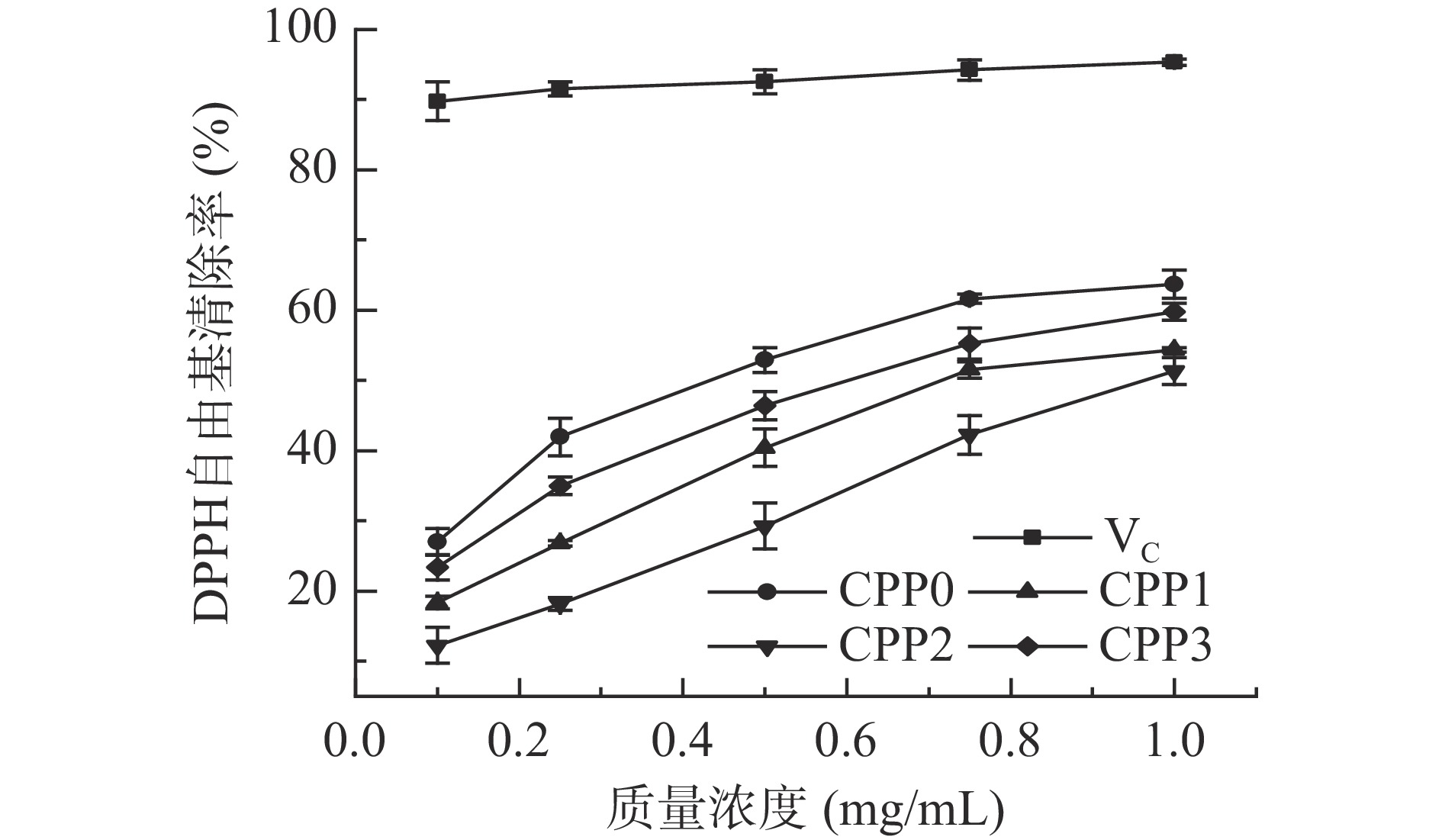
由图7可知,CPP0、CPP1、CPP2和CPP3对DPPH自由基均具有一定的清除能力,其中CPP0对DPPH自由基的清除能力略高于另外3种多糖,但4种多糖的自由基清除能力与VC相比还有一定的差距。当样品浓度为1 mg/mL时,CPP0、CPP1、CPP2和CPP3的清除率分别为63.71%、54.36%、51.37%和59.83%;当样品浓度为0.1~0.75 mg/mL时,其自由基清除率与多糖浓度基本呈线性关系;当样品浓度高于0.75 mg/mL时,DPPH自由基清除能力增加较缓慢。CPP0、CPP1、CPP2和CPP3的IC50值分别为0.43、0.72、0.97和0.60 mg/mL,说明CPP0抗氧化活性最好。有研究表明甘露糖含量与清除DPPH自由基呈正相关[25],香加皮4种多糖组分中甘露糖和阿拉伯糖含量均表现为CPP0>CPP3>CPP1>CPP2,抗氧化能力也表现为此顺序,这与艾于杰[26]研究的茶多糖中阿拉伯糖含量越高,DPPH自由基清除能力越差不符,可能与多糖的空间结构有关,需进一步验证。
2.7.2 ABTS+自由基清除能力
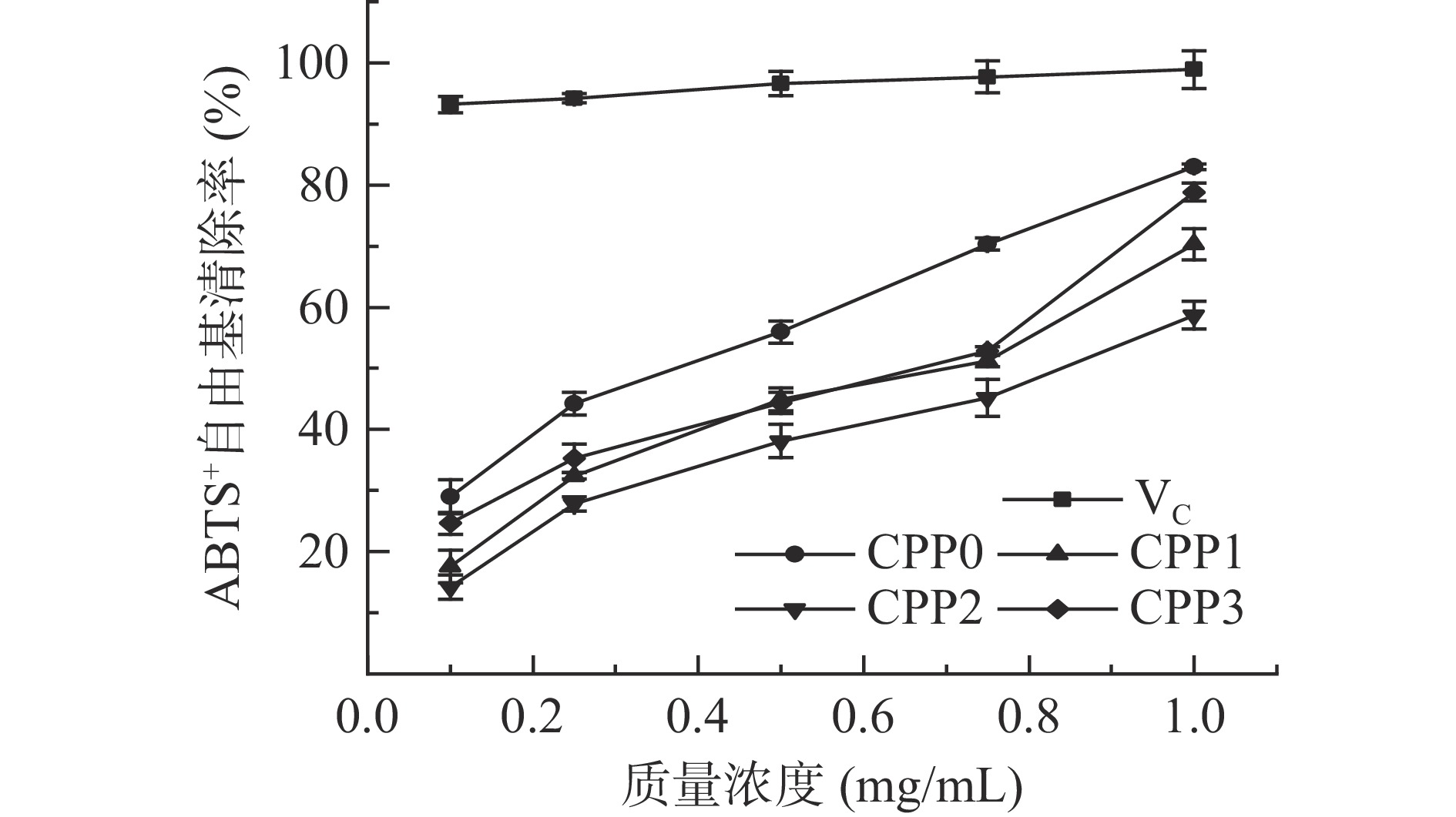
各多糖组分ABTS+自由基清除能力如图8所示,CPP0、CPP1、CPP2和CPP3均可清除ABTS+自由基,且各组分的自由基清除能力与样品浓度存在明显的剂量效应。当质量浓度为1 mg/mL时,CPP0、CPP1、CPP2和CPP3清除率分别为82.96%、70.30%、58.69%和78.83%,均低于 VC;其IC50 值分别为 0.37、0.71、0.85 和 0.68 mg/mL。已有研究表明,分子量对多糖的抗氧化能力有一定的影响,高分子量空间结构相对较稳定,生物活性较高[27]。香加皮的4种多糖组分抗ABTS+自由基活性顺序为CPP0>CPP3>CPP1>CPP2,说明分子量越高,香加皮多糖的抗氧化能力越强,与Xu等[28]研究一致。
2.7.3 OH自由基清除能力
由图9可知,当多糖质量浓度为0.1~1 mg/mL时,多糖质量浓度越大,OH自由基清除率越高,但其清除能力远远低于VC。样品浓度为1 mg/mL时,各多糖组分的清除率达到最大值,分别为65.24%、53.99%、50.30%和57.90%。CPP0、CPP1、CPP2和CPP3的IC50值分别为0.66、0.89、0.99和0.78 mg/mL,CPP2的OH自由基清除率最低。有研究表明,多糖之所以可以清除OH自由基,是因为多糖中的糖醛酸可以和亚铁离子相结合,抑制OH自由基的生成[29]。本实验中糖醛酸含量顺序为CPP0>CPP3>CPP1>CPP2,与抗氧化顺序一致,这与凌洁玉等[30]研究结果相吻合。据文献可知,三七多糖[31]和茯苓多糖[32]在质量浓度为1 mg/mL时其对OH自由基清除率分别为15.04%和25.12%,低于同质量浓度下香加皮多糖的OH自由基清除率。
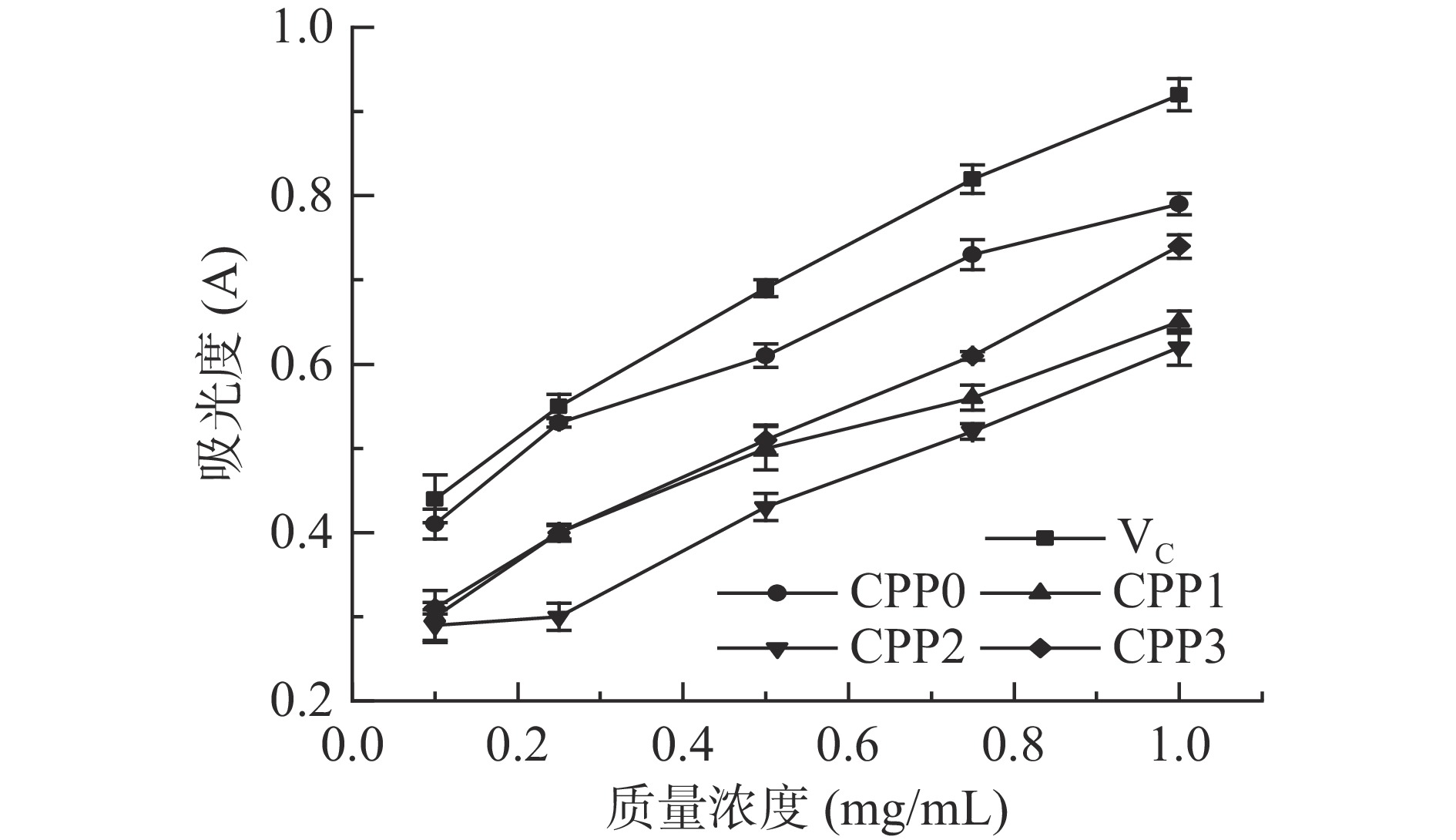
2.7.4 还原能力
各多糖组分的还原能力如图10所示,吸光度表示多糖的还原能力,还原力越强,表明其抗氧化性越好[33]。在0.1~1 mg/mL的测试范围内,各组分的还原能力随多糖质量浓度的增大而增强。当样品质量浓度为0.1、0.25和0.5 mg/mL时,CPP1和CPP3的还原能力无明显差异;在浓度为0.5~1 mg/mL时,CPP3的还原能力略高于CPP1。在质量浓度为1 mg/mL时,CPP0、CPP1、CPP2、CPP3和VC的吸光度分别为0.789、0.649、0.616、0.741和0.921,说明还原能力强弱顺序为VC>CPP0>CPP3>CPP1>CPP2。CPP2的还原能力低于CPP0、CPP1和CPP3,可能是CPP2各种单糖含量较低所致[34]。
综上所述,香加皮多糖具有一定的抗氧化能力,但对不同的自由基或离子抗氧化能力不同,因此在对香加皮多糖进行抗氧化能力评价时,要综合多种抗氧化方法。4种多糖在浓度为1 mg/mL时对于不同的自由基清除能力均表现出一致性,其中纯水洗脱的CPP0清除DPPH自由基、ABTS+自由基、OH自由基以及还原能力均表现出较高的活性,CPP3和CPP1次之,CPP2相对较弱。而王小莉[13]研究的香加皮多糖的抗氧化性则是高浓度NaCl洗脱的组分强于纯水洗脱的组分,这可能是由于产地不同而导致的分子量和单糖组成不同,因此需要开展不同产地的相关研究。
3. 结论
本实验通过“水提醇沉”法得到香加皮粗多糖,粗多糖经Sevag法脱蛋白和DEAE-52纤维素柱分离纯化后得到4种多糖组分CPP0、CPP1、CPP2和CPP3。通过对4种多糖组分分析可得,CPP0、CPP1、CPP2和CPP3中糖含量和糖醛酸含量存在差异,分子量分别为685、477、411和572 kDa。单糖组成结果表明4种多糖均为甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖按照不同摩尔比组成的杂多糖。红外光谱分析可知4种多糖均含有β-糖苷键且具有呋喃环。抗氧化结果表明CPP0、CPP1、CPP2和CPP3对DPPH自由基、ABTS+自由基以及OH自由基均具有一定的清除作用,其中CPP0的清除率最好;还原能力大小表现为CPP0>CPP3>CPP1>CPP2。上述研究结果可为香加皮多糖的开发和应用提供参考,抗氧化能力强弱的影响因素仍需进一步探究。
-
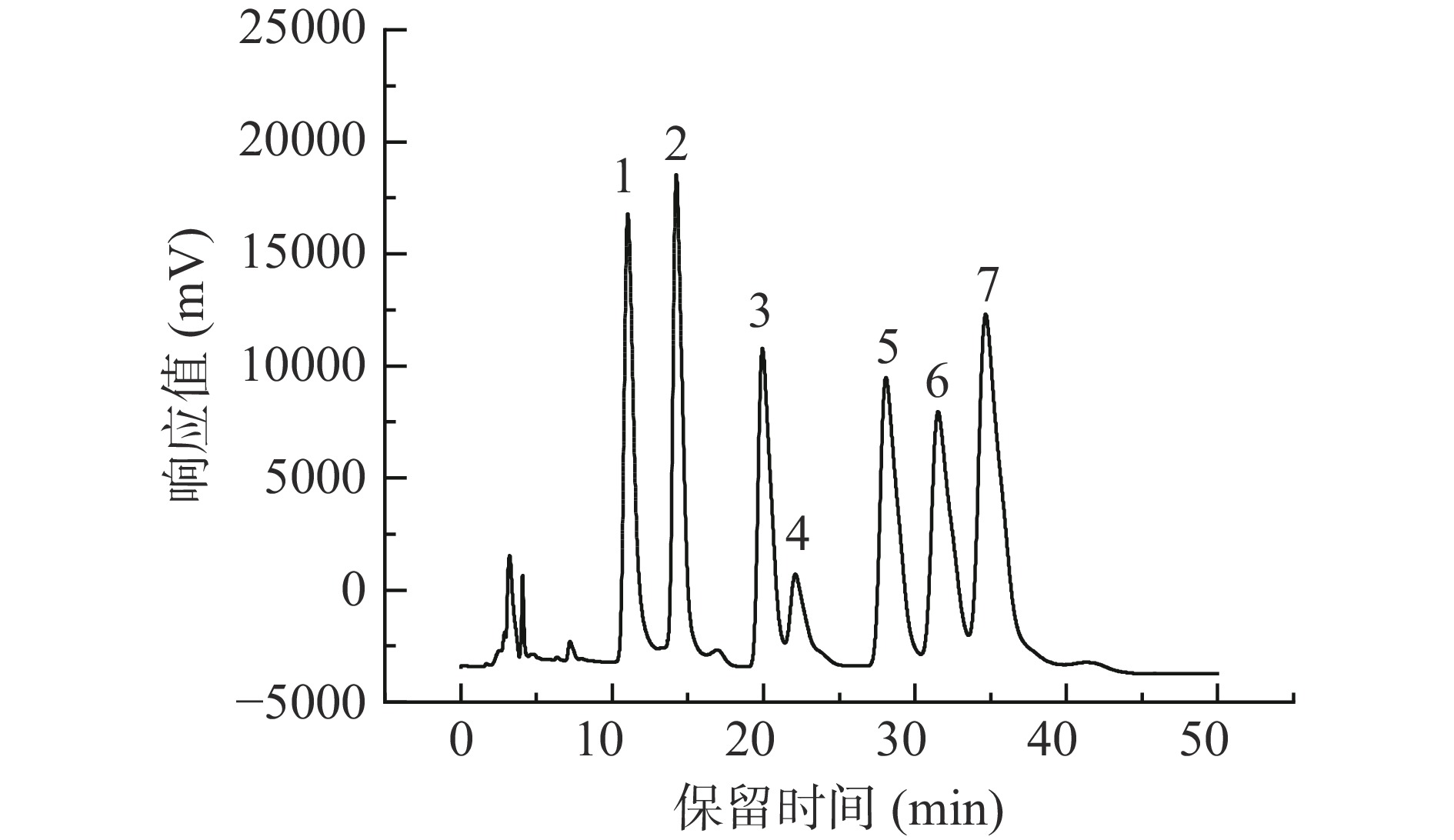
图 4 单糖标准品HPLC分析图谱
注:1.PMP;2.甘露糖;3.鼠李糖;4.半乳糖醛酸;5.葡萄糖;6.半乳糖;7.阿拉伯糖;图5同。
Figure 4. HPLC analysis spectrum of monosaccharide standards
表 1 香加皮多糖的化学成分分析
Table 1 Chemical composition analysis of CPPS
编号 糖含量(%) 蛋白含量(%) 糖醛酸含量(%) CPP0 82.20±0.48a − 31.06±0.70a CPP1 77.13±0.71b − 28.29±0.37b CPP2 75.23±0.63c − 23.82±0.24c CPP3 72.85±1.06d 2.5±0.8 29.11±0.37b 注:平均值±标准差;同列不同小写字母表示不同处理间差异显著(P<0.05);“−”表示未检测出。 表 2 香加皮多糖各组分单糖的摩尔比
Table 2 Molar ratios of monosaccharides of CPPS
编号 甘露糖 鼠李糖 半乳糖醛酸 葡萄糖 半乳糖 阿拉伯糖 CPP0 1.65 1.61 1.25 4.71 1.74 0.99 CPP1 0.76 0.53 0.43 1.90 1.42 0.46 CPP2 0.48 0.57 0.15 1.11 0.31 0.17 CPP3 1.41 1.32 0.58 2.30 1.02 0.48 -
[1] 徐硕, 金鹏飞, 徐文峰, 等. 中药香加皮的研究进展[J]. 西北药学杂志,2017,32(1):118−121. [XU S, JIN P F, XU W F, et al. Advances on Chinese herbal medicine Periplocae cortex[J]. Northwest Pharmaceutical Journal,2017,32(1):118−121. doi: 10.3969/j.issn.1004-2407.2017.01.032 XU S, JIN P F, XU W F, et al. Advances on Chinese herbal medicine Periplocae cortex[J]. Northwest Pharmaceutical Journal, 2017, 32(1): 118-121. doi: 10.3969/j.issn.1004-2407.2017.01.032
[2] 李金楠, 赵丽迎, 于静, 等. 香加皮化学成分的研究[J]. 中成药,2010,32(9):1552−1556. [LI J N, ZHAO L Y, YU J, et al. Chemical constituents of the root barks of Periploca sepium[J]. Chin Tradit Pat Med,2010,32(9):1552−1556. doi: 10.3969/j.issn.1001-1528.2010.09.028 LI J N, ZHAO L Y, YU J, et al. Chemical constituents of the root barks of Periploca sepium[J]. Chin. Tradit. Pat. Med, 2010, 32: 1552-1556. doi: 10.3969/j.issn.1001-1528.2010.09.028
[3] 杨雪, 李梦雨, 颜昌钖, 等. 香加皮的化学成分与药理作用研究进展及质量标志物的预测分析[J]. 中国中药杂志,2020,45(12):2772−2783. [YANG X, LI M Y, YAN C Y, et al. Research progress on chemical composition and pharmacological effects of Periplocae cortex and predictive analysis on Q-marker[J]. China Journal of Chinese Materia Medica,2020,45(12):2772−2783. doi: 10.19540/j.cnki.cjcmm.20200327.202 YANG X, LI M Y, YAN C Y, et al. Research progress on chemical composition and pharmacological effects of Periplocae cortex and predictive analysis on Q-marker[J]. China Journal of Chinese Materia Medica, 2020, 45(12): 2772-2783. doi: 10.19540/j.cnki.cjcmm.20200327.202
[4] CHEN S H, HUANG H L, HUANG G L. Extraction, derivatization and antioxidant activity of cucumber polysaccharide[J]. International Journal of Biological Macromolecules,2019,140:1047−1053. doi: 10.1016/j.ijbiomac.2019.08.203
[5] WANG M, ZHU P, ZHAO S, et al. Characterization, antioxidant activity and immunomodulatory activity of polysaccharides from the swollen culms of Zizania latifolia[J]. International Journal of Biological Macromolecules,2017,95:809−817. doi: 10.1016/j.ijbiomac.2016.12.010
[6] LIU F, MA C, MC CLEMENTS D J, et al. Development of polyphenol-protein-polysaccharide ternary complexes as emulsifiers for nutraceutical emulsions: Impact on formation, stability, and bioaccessibility of β-carotene emulsions[J]. Food Hydrocolloids,2016,61:578−588. doi: 10.1016/j.foodhyd.2016.05.031
[7] HU B, CHEN Q, CAI Q, et al. Gelation of soybean protein and polysaccharides delays digestion[J]. Food Chemistry,2017,221:1598−1605. doi: 10.1016/j.foodchem.2016.10.132
[8] 王笑月, 刘效兰, 薛燕, 等. 黄精及其复配植物多糖提取工艺优化及人体保湿评价[J]. 食品工业科技,2018,39(5):221−225, 240. [WANG X Y, LIU X L, XUE Y, et al. Optimization of process extraction for polysaccharides of Polygonatum and its prescription and evaluation of moisture retention capacity of human body[J]. Science and Technology of Food Industry,2018,39(5):221−225, 240. doi: 10.13386/j.issn1002-0306.2018.05.042 WANG X Y, LIU X L, XUE Y, et al. Optimization of process extraction for polysaccharides of Polygonatum and its prescription and evaluation of moisture retention capacity of human body[J]. Science and Technology of Food Industry, 2018, 39(5): 221-225+240. doi: 10.13386/j.issn1002-0306.2018.05.042
[9] KONTOGIORGOS V. Polysaccharides at fluid interfaces of food systems[J]. Advances in Colloid and Interface Science,2019,270:28−37. doi: 10.1016/j.cis.2019.05.008
[10] BARCLAY T G, DAY C M, PETROVSKY N, et al. Review of polysaccharide particle-based functional drug delivery[J]. Carbohydrate Polymers,2019,221:94−112. doi: 10.1016/j.carbpol.2019.05.067
[11] 段漓童, 刘正猛, 劳风云, 等. 香加皮多糖分离提取及含量测定[J]. 中国煤炭工业医学杂志,2007(7):766−768. [DUAN L T, LIU Z M, LAO F Y, et al. Isolation, extraction and determination of Cortex periplocae polysaccharides[J]. Chinese Journal of Coal Industry Medicine,2007(7):766−768. doi: 10.3969/j.issn.1007-9564.2007.07.016 DUAN L T, LIU Z M, LAO F Y, et al. Isolation, extraction and determination of s Cortex periplocae polysaccharides[J]. Chinese Journal of Coal Industry Medicine, 2007(7): 766-768. doi: 10.3969/j.issn.1007-9564.2007.07.016
[12] WANG X L, ZHANG Y F, LIU P F, et al. Purification, characterization, and antioxidant activity of polysaccharides isolated from Cortex periplocae[J]. Molecules,2017,22(11):1866. doi: 10.3390/molecules22111866
[13] 王小莉. 香加皮多糖提取纯化及其在烟草中的保润增香效应研究[D]. 郑州: 河南农业大学, 2018 WANG X L. Extraction and purification of Cortex periplocae polysaccharides and their use in tobacco moisture retention and flavor enhancement[D]. Zhengzhou: Henan Agricultural University, 2018.
[14] 曾凡珂, 李伟, 曹庸, 等. 金樱子多糖提取、纯化及生理活性研究进展[J]. 食品工业科技,2019,40(7):307−312. [ZENG F K, LI W, CAO Y, et al. Research progress on extraction, purification and physiological activities of polysaccharides from Rosa laevigata Michx[J]. Science and Technology of Food Industry,2019,40(7):307−312. doi: 10.13386/j.issn1002-0306.2019.07.053 ZENG F K, LI W, CAO Y, et al. Research progress on extraction, purification and physiological activities of polysaccharides from Rosa laevigata Michx[J]. Science and Technology of Food Industry, 2019, 40(7): 307-312. doi: 10.13386/j.issn1002-0306.2019.07.053
[15] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry,1956,28(3):350−356. doi: 10.1021/ac60111a017
[16] 王艾平, 周丽明. 考马斯亮蓝法测定茶籽多糖中蛋白质含量条件的优化[J]. 河南农业科学,2014,43(3):150−153. [WANG A P, ZHOU L M. Determination of protein content in Camellia oleifera seed polysaccharides by Coomassie brilliant blue method[J]. Journal of Henan Agricultural Sciences,2014,43(3):150−153. doi: 10.3969/j.issn.1004-3268.2014.03.033 WANG A P, ZHOU L M. Determination of protein content in Camellia oleifera seed polysaccharides by Coomassie brilliant blue method[J]. Journal of Henan Agricultural Sciences, 2014, 43(3): 150-153. doi: 10.3969/j.issn.1004-3268.2014.03.033
[17] 任珍芸, 陈晓航, 王玺, 等. 硫酸-咔唑微孔板法检测肺炎链球菌荚膜多糖中糖醛酸含量[J]. 微生物学免疫学进展,2017,45(2):36−41. [REN Z Y, CHEN X H, WANG X, et al. Determination of uronic acid content in pneumococcal polysaccharide by sulfate-carbazole method in microplate[J]. Progress in Microbiology and Immunology,2017,45(2):36−41. REN Z Y, CHEN X H, WANG X, et al Determination of uronic acid content in pneumococcal polysaccharide by sulfate-carbazole method in microplate[J]. Progress in Microbiology and Immunology, 2017, 45(2): 36-41.
[18] 王少杰, 巴娟, 张勇军, 等. 白术多糖的分子量及其单糖组成分析[J]. 中国兽药杂志,2019,53(5):26−32. [WANG S J, BA J, ZHANG Y J, et al. Analysis of molecular weight and monosaccharide composition of Atractylodes macrocephala polysaccharides[J]. Chinese Journal of Veterinary Drug,2019,53(5):26−32. WANG S J, BA J, ZHANG Y J, et al. Analysis of molecular weight and monosaccharide composition of Atractylodes macrocephala polysaccharides[J]. Chinese Journal of Veterinary Drug, 2019, 53(5): 26-32.
[19] 余亦婷, 皮文霞, 谢辉, 等. PMP柱前衍生化-HPLC法分析不同生长年限黄芪中6种单糖的含量[J]. 中国药房,2021,32(12):1448−1452. [YU Y T, PI W X, XIE H, et al. Content determination of 6 kinds of monosaccharide in Astragalus membranaceus with different growth years by pre-column derivatization-HPLC[J]. China Pharmacy,2021,32(12):1448−1452. doi: 10.6039/j.issn.1001-0408.2021.12.07 YU Y T, PI W X, XIE H, et al. Content determination of 6 kinds of monosaccharide in Astragalus membranaceus with different growth years by pre-column derivatization-HPLC[J]. China Pharmacy, 2021, 32(12): 1448-1452. doi: 10.6039/j.issn.1001-0408.2021.12.07
[20] SHEN S, JIA S, WU Y, et al. Effect of culture conditions on the physicochemical properties and antioxidant activities of polysaccharides from Nostoc flagelliforme[J]. Carbohydrate Polymers,2018,198:426−433. doi: 10.1016/j.carbpol.2018.06.111
[21] 程爽, 贺斐, 付龙洋, 等. 冬凌草硒多糖的制备及其抗氧化活性分析[J]. 精细化工,2021,38(10):2064−2071. [CHENG S, HE P, FU L Y, et al. Preparation of selenium polysaccharide from Rabdosia rubescens and analysis of its antioxidant activity[J]. Fine Chemicals,2021,38(10):2064−2071. doi: 10.13550/j.jxhg.20210320 CHENG S, HE P, FU L Y, et al. Preparation of selenium polysaccharide from Rabdosia rubescens and analysis of its antioxidant activity[J]. Fine Chemicals, 2021, 38(10): 2064-2071. doi: 10.13550/j.jxhg.20210320
[22] 宋丽丽, 闻格, 霍姗浩, 等. 小黄姜多糖的分离纯化及其结构特征及抗氧化活性研究[J]. 食品与发酵工业,2020,46(12):73−79. [SONG L L, WEN G, HUO S H, et al. Isolation, purification, structural characterization and antioxidant activity of polysaccharide from Zingiber officinale Roscoe[J]. Food and Fermentation Industries,2020,46(12):73−79. doi: 10.13995/j.cnki.11-1802/ts.023519 SONG L L, WEN G, HUO S H, et al. Isolation, purification, structural characterization and antioxidant activity of polysaccharide from Zingiber officinale Roscoe[J]. Food and Fermentation Industries, 2020, 46(12): 73-79. doi: 10.13995/j.cnki.11-1802/ts.023519
[23] 徐雯雯, 陆春霞, 肖潇, 等. 桑黄多糖的提取纯化技术及药理作用研究进展[J]. 蚕学通讯,2022,42(3):20−30. [XU W W, LU C X, XIAO X, et al. Research progress on the extraction and purification technology and pharmacological effects of polysaccharides from Sanghuangporus[J]. Newsletter of Sericultural Science,2022,42(3):20−30. doi: 10.3969/j.issn.1006-0561.2022.03.005 XU W W, LU C X, XIAO X, et al. Research progress on the extraction and purification technology and pharmacological effects of polysaccharides from Sanghuangporus [J]. Newsletter of Sericultural Science, 2022, 42(3): 20-30. doi: 10.3969/j.issn.1006-0561.2022.03.005
[24] 闫征, 郝利民, 张黎明, 等. 3种不同产地灵芝子实体主要化学成分比较[J]. 食品科学,2019,40(6):240−246. [YAN Z, HAO L M, ZHANG L M, et al. Comparison of main chemical constituents in Ganoderma lucidum fruiting bodies collected from three producing regions[J]. Food Science,2019,40(6):240−246. doi: 10.7506/spkx1002-6630-20180620-396 YAN Z, HAO L M, ZHANG L M, et al. Comparison of main chemical constituents in Ganoderma lucidum fruiting bodies collected from three producing regions[J]. Food Science, 2019, 40(6): 240-246. doi: 10.7506/spkx1002-6630-20180620-396
[25] WANG L, LIU H M, Xie A J, et al. Chinese quince (Chaenomeles sinensis) seed gum: Structural characterization[J]. Food Hydrocolloids,2018,75:237−245. doi: 10.1016/j.foodhyd.2017.08.001
[26] 艾于杰. 抗氧化活性茶多糖构效关系研究[D]. 武汉: 华中农业大学, 2019 AI Y J. Study on the conformational relationship of antioxidant active tea polysaccharides[D]. Wuhan: Huazhong Agricultural University, 2019.
[27] LI F, GAO J, XUE F, et al. Extraction optimization, purification and physicochemical properties of polysaccharides from Gynura medica[J]. Molecules,2016,21(4):397. doi: 10.3390/molecules21040397
[28] XU Z, LI X, FENG S, et al. Characteristics and bioactivities of different molecular weight polysaccharides from Camellia seed cake[J]. International Journal of Biological Macromolecules,2016,91:1025−1032. doi: 10.1016/j.ijbiomac.2016.06.067
[29] 胡彦波, 翟丽媛, 刘扬, 等. 薇菜多糖的分离纯化及体外抗氧化活性[J]. 食品科学,2022,43(1):59−66. [HU Y B, ZHAI L Y, LIU Y, et al. Isolation, purification and antioxidant activity of polysaccharides from Osmunda japonica[J]. Food Science,2022,43(1):59−66. doi: 10.7506/spkx1002-6630-20210426-373 HU Y B, ZHAI L Y, LIU Y, et al. Isolation, purification and antioxidant activity of polysaccharides from Osmunda japonica[J]. Food Science, 2022, 43(1): 59-66. doi: 10.7506/spkx1002-6630-20210426-373
[30] 凌洁玉, 周文轩, 庄志雄, 等. 鲊辣椒多糖组分变化初步分析及抗氧化活性研究[J]. 东北农业科学,2022,47(3):145−149. [LING J Y, ZHOU W X, ZHUANG Z X, et al. Analysis of components and antioxidant activity of Fermented cayenne polysaccharides[J]. Journal of Northeast Agricultural Sciences,2022,47(3):145−149. LING J Y, ZHOU W X, ZHUANG Z X, et al. Analysis of components and antioxidant activity of Fermented cayenne polysaccharides[J]. Journal of Northeast Agricultural Sciences, 2022, 47(3): 145-149.
[31] 伍晓萍, 代玉玲, 张玲, 等. 三七多糖吸湿、保湿性能及体外抗氧化活性[J]. 昆明医科大学学报,2022,43(5):1−6. [WU X P, DAI Y L, ZHANG L, et al. Studies on moisture-absorption-retention and antioxidant activity of Panax notoginseng polysaccharides in vitro[J]. Journal of Kunming Medical University,2022,43(5):1−6. doi: 10.12259/j.issn.2095-610X.S20220514 WU X P, DAI Y L, ZHANG L, et al. Studies on moisture-absorption-retention and antioxidant activity of Panax notoginseng polysaccharides in vitro[J]. Journal of Kunming Medical University, 2022, 43(5): 1-6. doi: 10.12259/j.issn.2095-610X.S20220514
[32] 孙明杰, 张越, 姚亮, 等. 茯苓多糖的分离纯化、组成及其抗氧化活性研究[J]. 安徽中医药大学学报,2022,41(1):86−91. [SUN M J, ZHANG Y, YAO L, et al. Isolation, purification, composition, and antioxidant activity of Poria cocos polysaccharides[J]. Journal of Anhui University of Chinese Medicine,2022,41(1):86−91. doi: 10.3969/j.issn.2095-7246.2022.01.017 SUN M J, ZHANG Y, YAO L, et al. Isolation, purification, composition, and antioxidant activity of Poria cocos polysaccharides[J]. Journal of Anhui University of Chinese Medicine, 2022, 41(1): 86-91. doi: 10.3969/j.issn.2095-7246.2022.01.017
[33] 董 扬, 郝利民, 刘宇琪, 等. 不同破壁方法对灵芝孢子粗多糖抗氧化活性的影响[J]. 食品科学,2017(17):101−106. [DONG Y, HAO L M, LIU Y Q, et al. Extracts and biological activities of Sporodem-broken spores of Ganoderma lucidum[J]. Food Science,2017(17):101−106. doi: 10.7506/spkx1002-6630-201717017 DONG Y, HAO L M, LIU Y Q, et al. Extracts and biological activities of Sporodem-broken spores of Ganoderma lucidum[J]. Food Science, 2017(17): 101-106. doi: 10.7506/spkx1002-6630-201717017
[34] 冯湘沅, 成莉凤, 谢纯良, 等. 不同品种黄麻叶多糖的理化特征及抗氧化活性研究[J]. 天然产物研究与开发,2020,32(8):1278−1284. [FENG X Y, CHENG L F, XIE C L, et al. Study on the physicochemical characteristics and antioxidant activities of polysaccharides from different varieties of jute leaves[J]. Natural Product Research and Development,2020,32(8):1278−1284. doi: 10.16333/j.1001-6880.2020.8.002 FENG X Y, CHENG L F, XIE C L, et al. Study on the physicochemical characteristics and antioxidant activities of polysaccharides from different varieties of jute leaves[J]. Natural Product Research and Development, 2020, 32(8): 1278-1284. doi: 10.16333/j.1001-6880.2020.8.002
-
期刊类型引用(5)
1. 杜汶清,张佳敏,刘琰艳,唐丽,白婷,任春平,吉莉莉. 低温真空长时煮制时间对猪肉肌原纤维蛋白结构和特性的影响. 中国调味品. 2025(01): 78-84 .  百度学术
百度学术
2. 周寅涛,冯绍彪,水珊珊,刘智禹,张宾. 真空低温慢煮加工对中华管鞭虾肌肉品质的影响. 食品工业科技. 2024(07): 108-118 .  本站查看
本站查看
3. 梁宏,王一帆,管纹萱,范馨茹,赵前程,李萌. 即烹扇贝冷冻预制菜的质构特性及营养品质评价分析. 食品安全质量检测学报. 2024(05): 23-33 .  百度学术
百度学术
4. 肖猛,李杨,彭毅秦,刘强,王岚,陈兴华,丁捷. 川西藏区牦牛酸醡肉在番茄汤锅中的应用及风味特征分析. 中国调味品. 2024(07): 52-59 .  百度学术
百度学术
5. 王国文,释永超,孙欣洁,于方芳,谢显红,李行. 基于温度优化的低温慢煮多元食材适用性工艺研究. 家电科技. 2024(06): 86-93+99 .  百度学术
百度学术
其他类型引用(1)










 下载:
下载:

 下载:
下载:



