Dynamic Analysis of Microbial Community and Selection of Different Genera During Fermentation of Shanxi Vinegar
-
摘要: 本研究利用高通量测序对山西陈醋发酵过程中的微生物群落组成进行了探讨,并分析了酒精发酵和醋酸发酵这两大发酵阶段的菌群变化。结果表明,对于细菌群落结构,醋曲(R1)、酒精发酵阶段(R2)和醋酸发酵阶段(R3)中的主要菌门为厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),R1中的主要优势菌属为魏斯氏菌属(Weissella),R2中主要优势菌属起初为魏斯氏菌属(Weissella),发酵后期逐渐乳杆菌属(Lactobacillus)占优势,R3中占绝对优势的菌属由最初的乳杆菌属(Lactobacillus)转变为醋杆菌属(Acetobacter),对于真菌群落结构,R1、R2和R3中的主要菌门为子囊菌门(Ascomycota)和担子菌门(Basidiomycota),R1中的主要优势菌属为伊萨酵母属(Issatchenkia),曲霉属(Aspergilus)和米勒酵母属(Millerozyma),R2中处于绝对优势菌属为伊萨酵母属(Issatchenkia),且在此阶段呈上升趋势,R3中伊萨酵母属(Issatchenkia)仍然是主要菌属,在此阶段呈现出先上升后下降的趋势,相对丰度最高达到81.3%。R2与R3有6个显著差异菌属,分别为葡萄球菌属(Staphylococcus)、芽孢杆菌属(Bacillus)、肠球菌属(Enterococcus)、明串珠菌属(Leuconostoc)、土芽孢杆菌属(Geobacillus)和曲霉属(Aspergillus)。综上,山西陈醋不同发酵阶段的微生物群落结构具有差异性,并随着发酵进行不断变化。Abstract: In this study, the microbial community composition of Shanxi vinegar fermentation was analyzed through high-throughput sequencing, and the changes of microbial community in the two major fermentation stages of alcoholic fermentation and acetic acid fermentation were investigated. The results showed that Firmicutes and Proteobacteria were the main phyla in Cuqu (R1), alcoholic fermentation (R2) and acetic acid fermentation (R3) for the bacterial community structure. The dominant genus in R1 was Weissella. In R2, the dominant genus was Weissella at the beginning, and gradually Lactobacillus dominated at the later stage of fermentation. The dominant genus in R3 was changed from the initial Lactobacillus to Acetobacter. For the fungal community structure, the main phyla in R1, R2 and R3 were Ascomycota and Basidiomycota, and the dominant genera in R1 were Issatchenkia, Aspergilus and Millerozyma. In R2, Issatchenkia was the absolute dominant genus, which was on the rise at this stage. In R3, Issatchenkia was still the dominant genus and showed a first rise and then a decline at this stage, with the highest relative abundance reaching 81.3%. There were six genera with significant differences between R2 and R3, namely Staphylococcus, Bacillus, Enterococcus, Leuconostoc, Geobacillus and Aspergillus. In conclusion, the microbial community structure of Shanxi vinegar in different fermentation stages was different and changed with the fermentation.
-
Keywords:
- high-throughput sequencing /
- Shanxi vinegar /
- microbial community /
- microbial changes
-
食醋作为一种调味品,其生产历史悠久,因有护肝[1-2]、抗氧化[3]等功效,深受我国人民的喜爱。山西陈醋采用固态发酵方式,发酵过程中微生物生长繁殖与其代谢活动,以及特有蒸、酵、熏、淋、晒等加工工艺,使山西陈醋含有丰富的营养与呈味物质[4-5],形成酸、绵、香、甜、鲜等标志风味。山西陈醋酿造是一个开放式,多微发酵的过程,大量微生物参与这一过程并不断进行演替,对陈醋的品质发挥重要作用[6],有报道指出分析微生物群落结构和多样性是揭示酿造过程代谢机理的重要手段[7]。因此,研究陈醋酿造过程中微生物动态变化对提高和改善食醋品质具有重要意义。
目前,通过分离培养[8]和聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophorsis,PCR-DGGE)[9]等方法研究陈醋酿造过程中的微生物已经较成熟。但这些方法存在着一定缺陷,如分离培养方法由于培养环境与微生物实际生存环境不一样等因素,不能使样品中所有微生物都分离出来[9],PCR-DGGE存在分辨率低、识别物种少等问题[10]。随着高通量测序技术的普及与应用,不仅提升了研究微生物群落组成的覆盖率和效率[11],也极大地拓宽了人们对微生物群落组成和演替的认识。在食醋领域通过高通量测序方法分析微生物群落的研究逐渐增加,在晒醋[12-14]、永春老醋[6]、浙江玫瑰醋[15]、镇江香醋[16]、凉州熏醋[17]等均有应用。高通量测序技术在陈醋中的应用也有报道,梦燕华[18]和崔宁波[19]应用高通量测序技术分别研究了陈醋酿造过程中的细菌多样性和真菌多样性,Zhu等[20]研究了酿造过程中的醋酸发酵阶段的微生物变化,Nie等[21]系统探讨了陈醋整个酿造阶段的细菌和真菌多样性。这些研究为认识陈醋酿造过程中微生物群落变化发挥了重要作用。
与之前的研究相比,本实验选取山西陈醋发酵所用醋曲和发酵过程中的醋醅为研究对象,利用高通量测序技术不仅系统研究了山西陈醋发酵过程中细菌和真菌群落动态变化,同时也做了延伸,对酒精发酵阶段和醋酸发酵阶段的差异菌属进行了探讨,为找出山西陈醋酒精酿造阶段和醋酸酿造阶段的标志微生物,以及下一步建立相应的快检方法和微生物标准体系来检验陈醋发酵有无异常提供了理论基础和保障。
1. 材料与方法
1.1 材料与仪器
醋曲、醋醅 于2021年4月~5月,在山西省阳泉市某醋厂采集同一生产批次使用的醋曲和醋醅样品;Phusion® High-Fidelity PCR Master Mix with GC Buffer New England Biolabs公司;GeneJET胶回收试剂盒 Thermo Scientific公司;CTAB基因组DNA提取试剂盒 北京百奥莱博科技有限公司;NaH2PO4、Na2HPO4 均为分析纯,天津博迪化工股份有限公司。
H2100R型台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;YXQ-LS型立式压力蒸汽灭菌器 上海博讯实业有限公司;MX-S型涡旋混合仪 北京佳航博创科技有限公司;S.SW-CJ-1FD型净化工作台 上海跃进医疗器械有限公司;SC-3614型低速离心机 安徽中科中佳科学仪器有限公司;NanoBio 200型超微量分光光度计 奥普天成(厦门)科技有限公司;凝胶成像系统 北京博奥晶典生物技术有限公司;T100型PCR扩增仪 美国Bio-rad公司。
1.2 实验方法
1.2.1 样品采集
醋曲样品(C0):生产所用曲块粉碎之后,采用5点取样法,充分混匀后取500 g置于无菌密封袋中,−80 ℃冰箱保存备用。
醋醅样品:分别取发酵第1 d(C1)、第3 d(C2)、第5 d(C3)、第7 d(C4)、第10 d(C5)、第13 d(C6)、第16 d(C7)、第20 d(C8)、第25 d(C9)醅样,取样点位置为醋醅表面下35 cm,采样500 g置于无菌密封袋中,−80 ℃冰箱保存备用。
1.2.2 样品预处理
样品前处理方法参照文献[22]进行,每个样品设置3个平行处理。
1.2.3 样品总DNA提取
采用CTAB法对样品进行总DNA提取,将得到的总DNA通过1.0%琼脂糖凝胶进行电泳检测,琼脂糖凝胶电泳检测参数如下:Marker上样量2 μL,样品上样量3 μL,电泳时间40 min,琼脂糖浓度1.0%,电压100 V。
1.2.4 PCR扩增和高通量测序
检测DNA的纯度和浓度合格后,以基因组DNA为模板,采用引物341F(5'-CCTACGGGNGGCWGCAG-3')/805R(5'-GACTACHVGGGTATCTAATCC-3')和1737F(5'-GGAAGTAAAAGTCGTAACAAGG-3')/2043R(5'-GCTGCGTTCTTCATCGATGC-3')分别对细菌16S rDNA V3~V4区和真菌ITS1区基因序列进行PCR扩增。PCR扩增体系30 μL:Phusion Master Mix(2×)15 µL,Primer(2 µmol/L)3 µL,gDNA(1 ng/µL)10 µL,ddH2O 2 µL。反应程序:98 ℃预变性1 min;98 ℃ 10 s,50 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃,5 min。扩增结束后,用2%琼脂糖凝胶电泳检测,产物用GeneJET胶回收试剂盒回收。检测合格的扩增产物通过北京诺禾致源科技股份有限公司Illumina NovaSeq 6000平台进行高通量测序。
1.3 数据处理
下机数据首先去除barcode和引物序列,使用FLASH(V1.2.11)软件进行双端测序reads拼接。Fastp(V0.23.0)软件进行质控;Usearch(10.0.259)软件去除嵌合体;利用QIIME2(版本 2021.8)软件进行OTU(Operational Taxonomic Unit)划分并进行物种注释和Alpha多样性分析;T-test通过R软件(3.6.3)来实现;采用SPSS(IBM23)软件进行显著性分析。
2. 结果与分析
2.1 Alpha多样性分析
采用Chao1指数和Simpson指数对山西陈醋发酵过程中微生物多样性进行分析。由表1可知,分析比较Chao1指数可以看出,C1样品与其他样品相比,细菌群落和真菌群落的Chao1指数最大,说明醋曲样品中所包含的细菌和真菌群落物种数最多;C2样品的Chao1指数比C1样品小,推测原因可能是由于发酵初期微生物不能完全适应发酵环境,生长和繁殖受限所致[13]。分析比较Simpson指数可以看出,细菌Simpson指数在0.587±0.072~0.918±0.213波动,真菌Simpson指数在0.494±0.115~0.827±0.549波动,变化幅度虽然不大,但也说明真菌和细菌群落结构在发酵过程中发生变化[14]。从这两个指数可以看出,山西陈醋发酵所用醋曲和醋醅的微生物群落的多样性和丰富度具有差异性。
表 1 细菌和真菌Alpha多样性指数Table 1. Bacterial and fungal Alpha diversity index样品 细菌 真菌 Chao1指数 Simpson指数 Chao1指数 Simpson指数 C0 77.000±13.587h 0.587±0.072h 50.375±14.689j 0.776±0.144b C1 130.500±14.677a 0.838±0.032d 414.143±16.987a 0.827±0.549a C2 127.000±9.465b 0.916±0.071a 80.200±9.731g 0.612±0.212d C3 126.000±12.998b 0.918±0.213a 157.000±15.675b 0.649±0.090c C4 126.000±5.657b 0.858±0.219bc 119.000±11.907d 0.589±0.301f C5 120.000±11.877c 0.863±0.167b 94.000±10.330f 0.512±0.097g C6 114.000±16.904d 0.853±0.069c 68.000±8.990i 0.494±0.115h C7 88.000±15.993g 0.821±0.089e 125.000±11.227c 0.655±0.079c C8 91.000±10.056f 0.781±0.138f 101.321±14.095e 0.598±0.110e C9 110.000±18.854e 0.774±0.324g 78.986±9.330h 0.612±0.220d 注:同列不同字母表示差异显著(P<0.05)。 2.2 不同发酵阶段Venn图分析
参考相关文献并结合本实验发酵工艺及过程将样品分为三组[17]。由于醋曲为糖化发酵剂[23],富含的微生物是陈醋发酵的原动力,醋曲作为微生物发酵的起点,将醋曲样品(C0)设为组R1、酒精发酵阶段(C1~C4)设为组R2、醋酸发酵阶段(C5~C9)设为组R3。
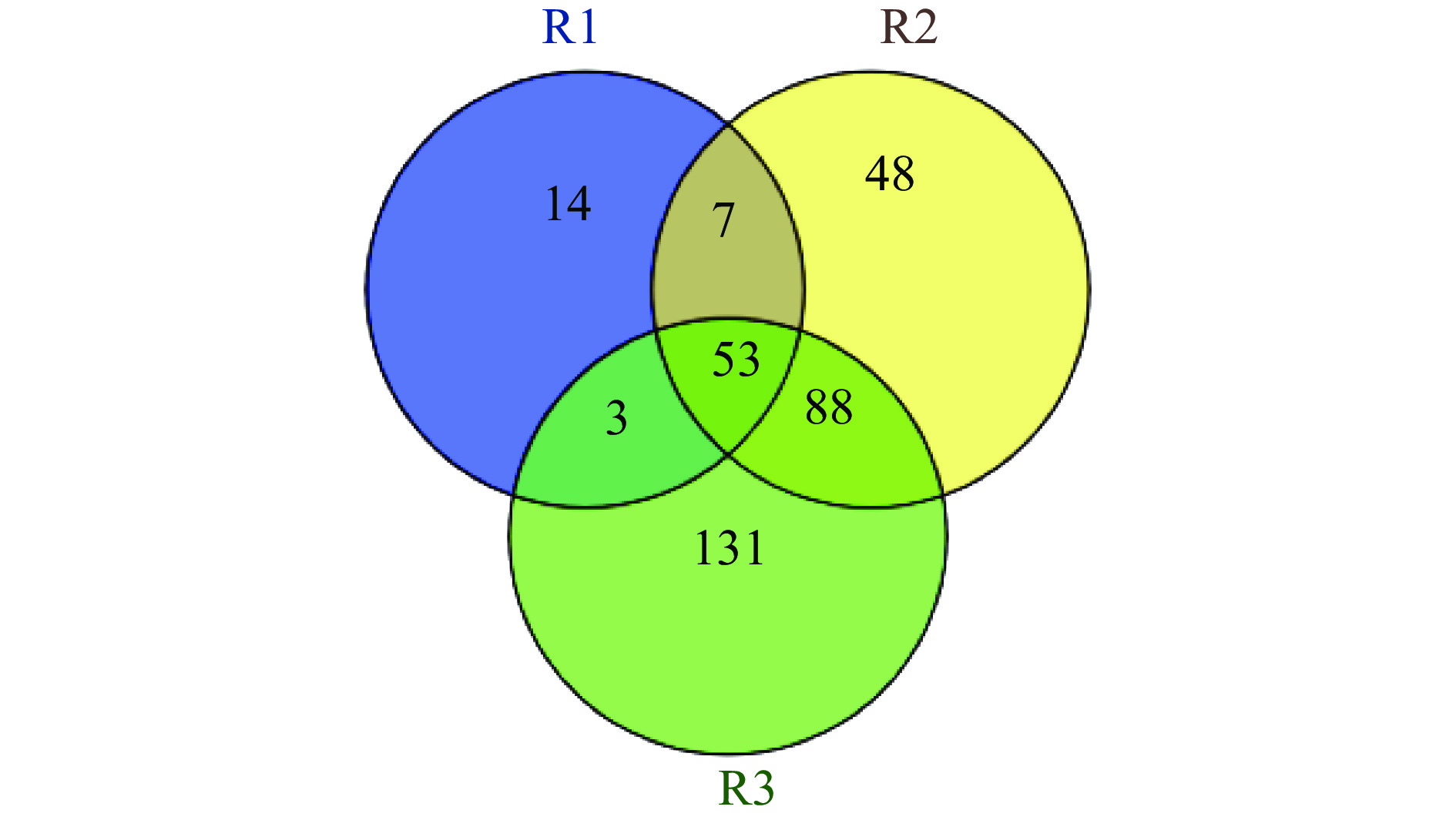
由图1可知,在整个发酵过程中共检测得到细菌OTU数为344个,不同阶段的细菌OTU数为R1(77)<R2(196)<R3(275),存在于R1、R2和R3中特有细菌OTU数分别为14、48、131个,三个阶段共有细菌OTU数为53个,R1和R2共有的细菌OTU数为60个,R2和R3共有的细菌OTU数最多,为141个,R1和R3共有的细菌OTU数最少,为56个。三个阶段中,醋曲样品中获得的细菌OTU数最少,随着发酵的进行,细菌OTU数逐渐增加,R2细菌OTU数达到了R1两倍多,这可能是因为酒精发酵时,加入其它的原料,从而引入新的菌种[13]。其次,随着酒精发酵的进行不断涌现出新的菌种。在R3组中细菌OTU数最多,独有细菌OTU数也最多。这表明参与醋酸发酵阶段的细菌种类最为丰富,可能由于随着发酵进行,一些数量低的微生物逐渐适应发酵环境而不断富集,达到了被高通量测序检测的阈值。
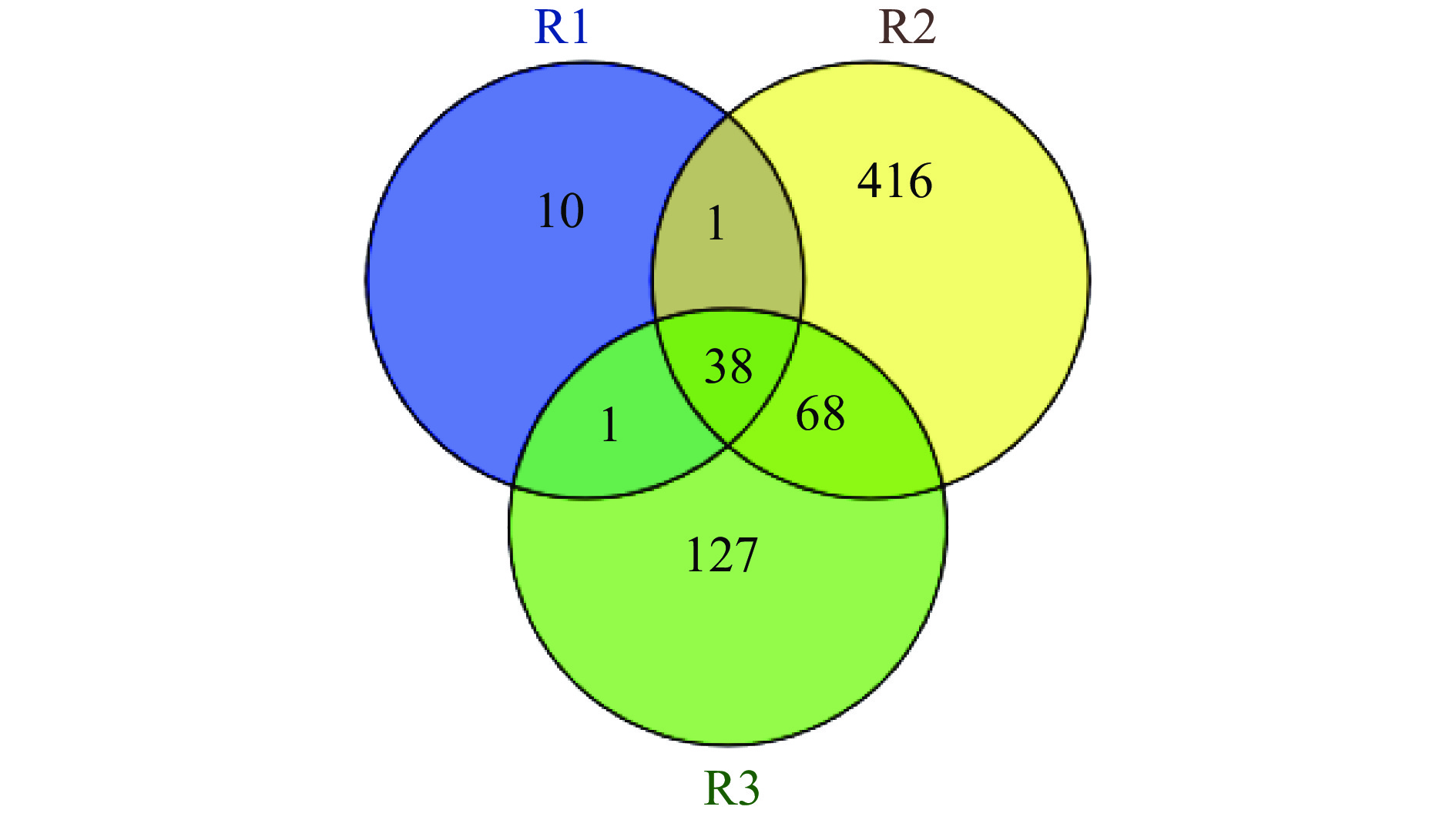
由图2可知,在整个发酵过程中共检测得到真菌OTU数为661个,不同阶段的真菌OTU数为R1(50)<R3(234)<R2(523),分别存在于R1、R2和R3中特有的真菌OTU数为10、416、127个,三个阶段共有的真菌OTU数为38个。R1和R2,R1和R3共有的真菌OTU数均为39个,R2和R3共有的真菌OTU数最多,为106个。三个阶段中,醋曲样品中获得的真菌OTU数最少,酒精发酵阶段中真菌OTU数最多达到峰值。这是因为经过前期的糖化作用,酒精发酵阶段养料充足,适合真菌生长繁殖,所以会使真菌种类数增多[15]。
2.3 山西陈醋发酵过程中细菌群落结构演替分析
2.3.1 基于门水平细菌群落结构演替分析
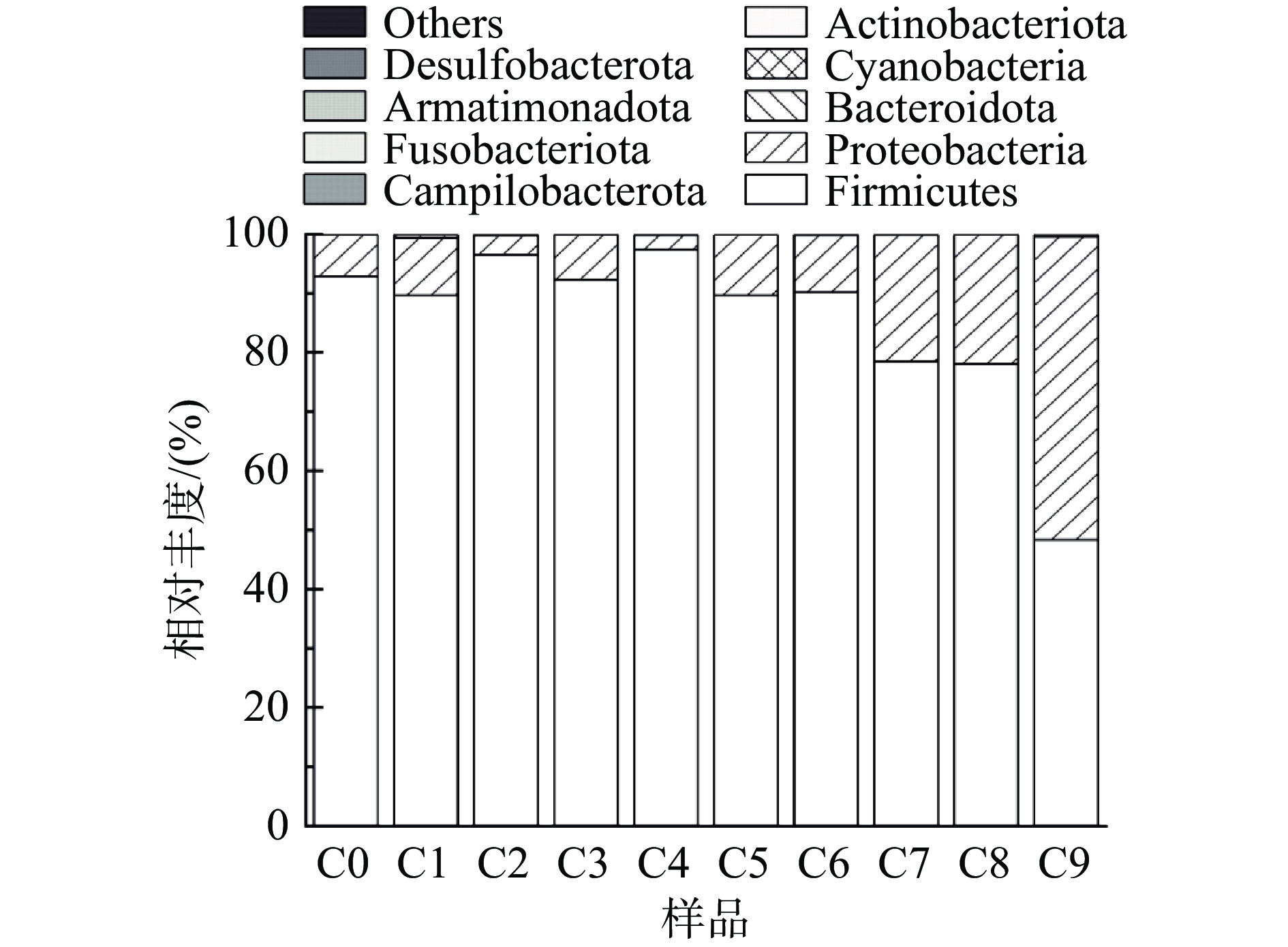
由图3可知,不管是在醋曲样品(C0)还是醋醅样品(C1~C9)中,优势菌门均为厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),在发酵阶段一直存在,且这两个菌门在每个样本中相对丰度之和都达到了98%以上,其中,除了在C9节点中占主导地位的细菌菌门是变形菌门(Proteobacteria)外,其余样本都是厚壁菌门(Firmicutes)占主导地位,且在C4节点中厚壁菌门(Firmicutes)的相对丰度达到最大值,为96.5%。厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)在酒精发酵阶段,整体变化幅度不大,而在醋酸发酵阶段,厚壁菌门(Firmicutes)呈下降趋势。这一细菌含量变化规律与浙江玫瑰醋[15]研究结果类似,分析原因可能是山西陈醋在醋酸发酵前期阶段,每天都会定时翻醅来提供氧气,而变形菌门(Proteobacteria)中包含许多好氧型细菌[24],翻醅就为这些细菌提供了有利生长环境,使其相对丰度在醋酸发酵阶段呈上升趋势,随着发酵时间的延长逐渐占据主导地位,这与永春老醋发酵过程中变形菌门(Proteobacteria)的研究结果相似[6]。
2.3.2 基于属水平细菌群落结构演替分析
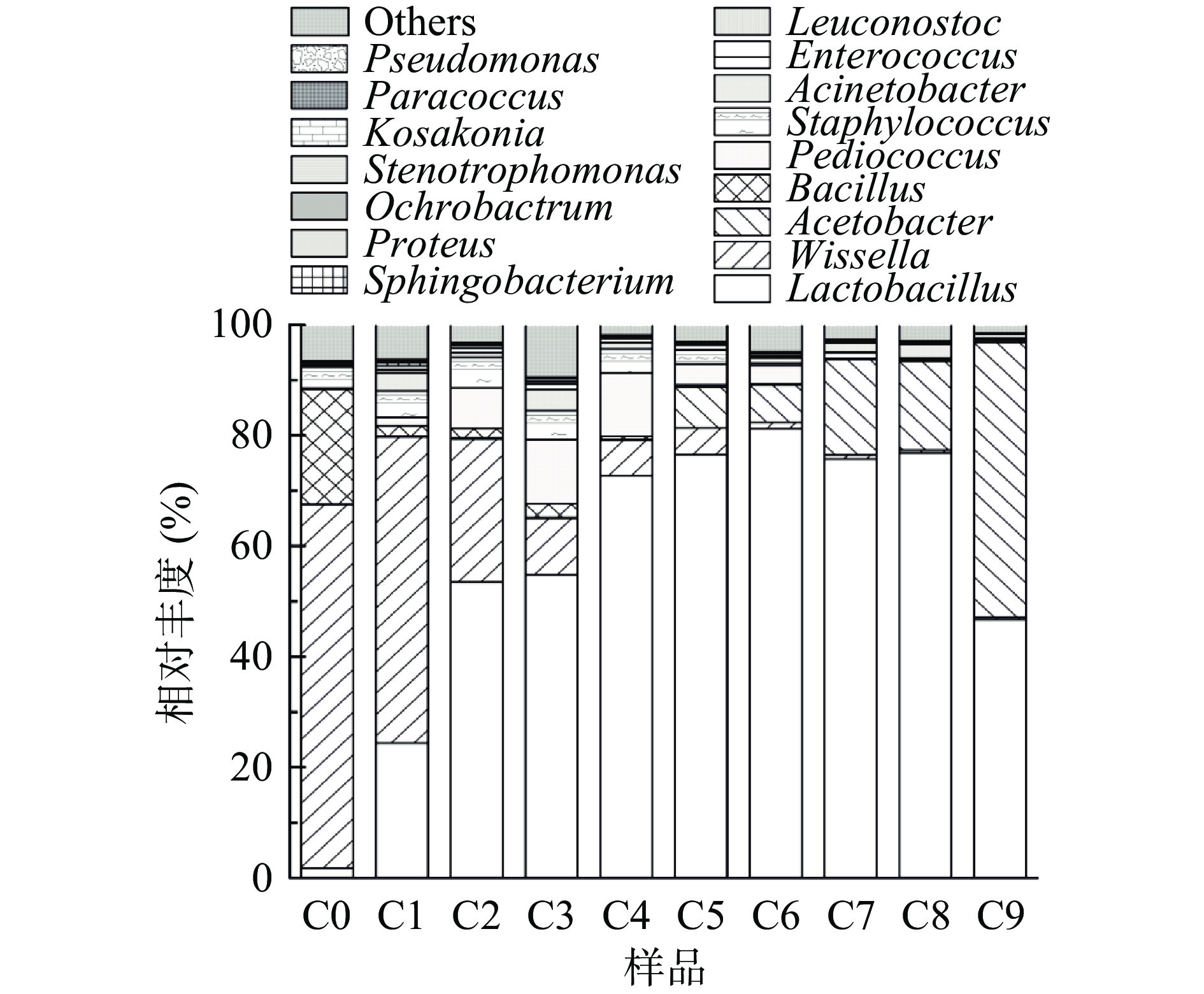
如图4,在醋曲(C0)中,优势物种为芽孢杆菌属(Bacillus)和魏斯氏菌属(Weissella),其相对丰度分别为20.7%和60.7%,还有少量的醋杆菌属(Acetobacter)、乳杆菌属(Lactobacillus)、葡萄球菌属(Staphylococcus)被检出,分别占0.1%、1.8%和3.8%。魏斯氏菌属(Weissella)有产β-葡糖苷酶的特性,能够降解发酵原料中的纤维素[25]。同时它还具有产乳酸、产抑菌物质等[26]特性。小麦是山西陈醋制曲中的主要原料之一,富含淀粉和纤维素[27],这为魏斯氏菌属(Weissella)的生长繁殖创造了有利条件,在制曲发酵过程中促使其成为绝对优势菌属。芽孢菌属(Bacillus)可赋予大曲丰富的酶系,如α-淀粉酶、蛋白酶等[28],还会代谢产生许多氨基酸物质,如L-酪氨酸等物质[29],对曲香的形成具有重要作用。
在酒精发酵阶段(C1~C4),乳杆菌属(Lactobacillus)和魏斯氏菌属(Weissella)表现出此消彼长的变化趋势。魏斯氏菌属(Weissella)主要来源于醋曲,在此阶段呈现出持续下降的趋势,相对丰度从55.3%下降到6.4%,而乳杆菌属(Lactobacillus)相对丰度从24.4%上升到72.7%,表现出增长的趋势,逐渐成为优势菌群。片球菌属(Pediococcus)整体占比不大。但是,在此阶段,随着发酵的进行,其相对丰度不断增加。葡萄球菌属(Staphylococcus)、醋杆菌属(Acetobacter)和芽孢杆菌属(Bacillus)在此阶段也被检出,相对丰度整体变化幅度不大,说明这些菌属在此阶段处于相对稳定状态。其中,葡萄球菌属(Staphylococcus)是最常见的一类致病菌,可分泌毒素和酶引起假膜性肠炎等疾病[30],分析结果发现,随着发酵的进行,其相对丰度最终下降到0.07%,含量极低。乳酸菌大部分是兼性厌氧或厌氧菌[31],其代谢产物乳酸可以改善和调节陈醋风味,在发酵中还有调节菌群结构的作用[32],在酒精发酵时,会把发酵缸内的原料进行压实,这样除了表层接触空气外,内部基本处于无氧状态,适合乳酸菌生长繁殖,随着酒精发酵的不断进行,发酵缸内的原料逐渐被利用,整个体系处于高乙醇环境,促使不耐高乙醇环境的细菌死亡[15],乳杆菌属(Lactobacillus)则不断成为占据主导地位的绝对优势菌属。
在醋酸发酵阶段(C5~C9),乳杆菌属(Lactobacillus)一直是优势菌属,其相对丰度表现出先上升后下降的趋势。在C6发酵节点其相对丰度达到最大值,为81.2%;C8到C9时期,乳杆菌属(Lactobacillus)相对丰度下降,占比由76.8%下降到48.3%。魏斯氏菌属(Weissella)在此阶段一直下降,由4.8%下降到0.4%。这一结果表明随着发酵进行魏斯氏菌属(Weissella)逐渐无法适应酿造环境。醋杆菌属(Acetobacter)相对丰度随着发酵的进行不断上升,由C5节点的7.4%增加到C9节点的49.7%而成为整个体系的优势菌属,这与镇江香醋醋酸发酵过程中醋杆菌属(Acetobacter)变化趋势一致[16]。此外,不动杆菌属(Acinetobacter)、明串珠菌属(Leuconostoc)等菌属也被检出,这些菌属虽然相对丰度很低,但始终稳定存在于整个发酵过程中。有报道表明,不动杆菌属(Acinetobacter)中有部分致病菌可以长期存在于医疗环境以及器械中,感染人体大脑、呼吸道等部位后,可引起脑膜炎、肺炎等相关疾病[33],部分非致病菌可以分泌产生维生素和磷脂[34]等营养物质。明串珠菌属(Leuconostoc)中存在一小部分感染后使人引起败血症等疾病的致病菌[35],部分非致病菌可以代谢产生多种酸和醇[36]等风味物质。在本山西陈醋酿造工艺中,当酒精发酵结束后,会在每个发酵缸内接入发酵第3 d的醋醅(引醅),之后几天只是小面积的翻醅,内部相对来说仍是处于无氧环境,乳杆菌属(Lactobacillus)依旧可以生长,所以相对丰度会出现短期的上升,引醅之后,每天就会进行大面积的翻醅,确保醅料松散能够通氧,同时发酵液中的酸度值也不断降低,抑制乳杆菌属(Lactobacillus)的生长,使其相对丰度下降,而醋杆菌属(Acetobacter)是一类好养型菌属,其代谢产生的醋酸是山西陈醋中有机酸的主要成分,每天的翻醅通氧有利于其生长代谢[18],所以相对丰度逐渐升高而起到主导作用,成为影响陈醋品质的优势菌属。
2.4 山西陈醋发酵过程中真菌群落结构演替分析
2.4.1 基于门水平真菌群落结构演替分析
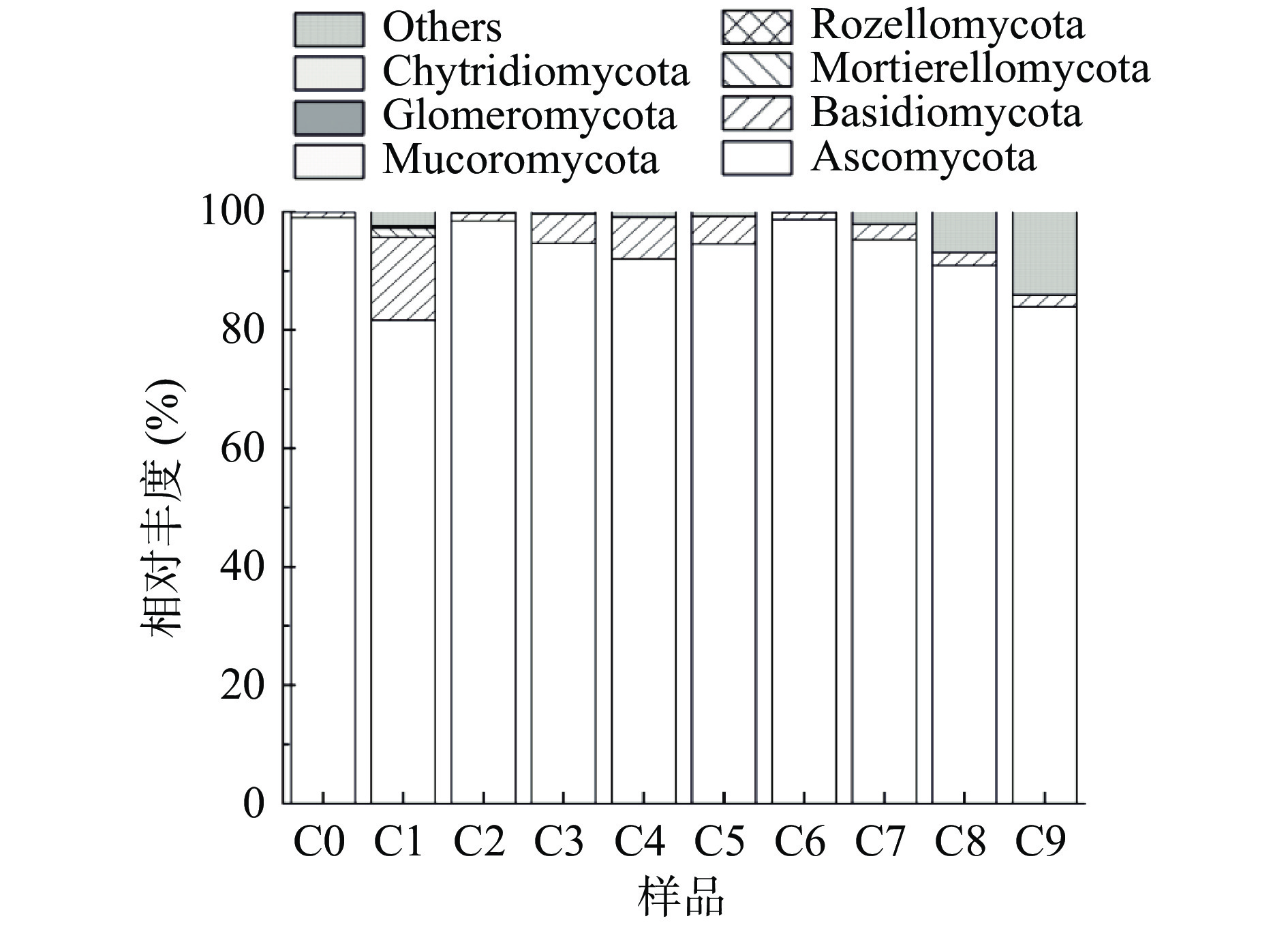
图5为真菌在门水平的时序动态变化。在整个过程中共检出7个真菌门,其中优势菌门为子囊菌门(Ascomycota)和担子菌门(Basidiomycota),子囊菌门(Ascomycota)在醋曲和之后的发酵过程中一直处于绝对优势地位,在醋曲(C0)中含量最高,相对丰度达到了98.9%。担子菌门(Basidiomycota)在C1节点迅速繁殖,相对丰度达到最高,为14.1%,在此后的发酵过程中,担子菌门(Basidiomycota)相对丰度虽有所减少,但一直稳定存在。这一结果表明该菌门真菌能够适应陈醋酿造环境,且对陈醋的酿造产生影响。
2.4.2 基于属水平真菌群落结构演替分析
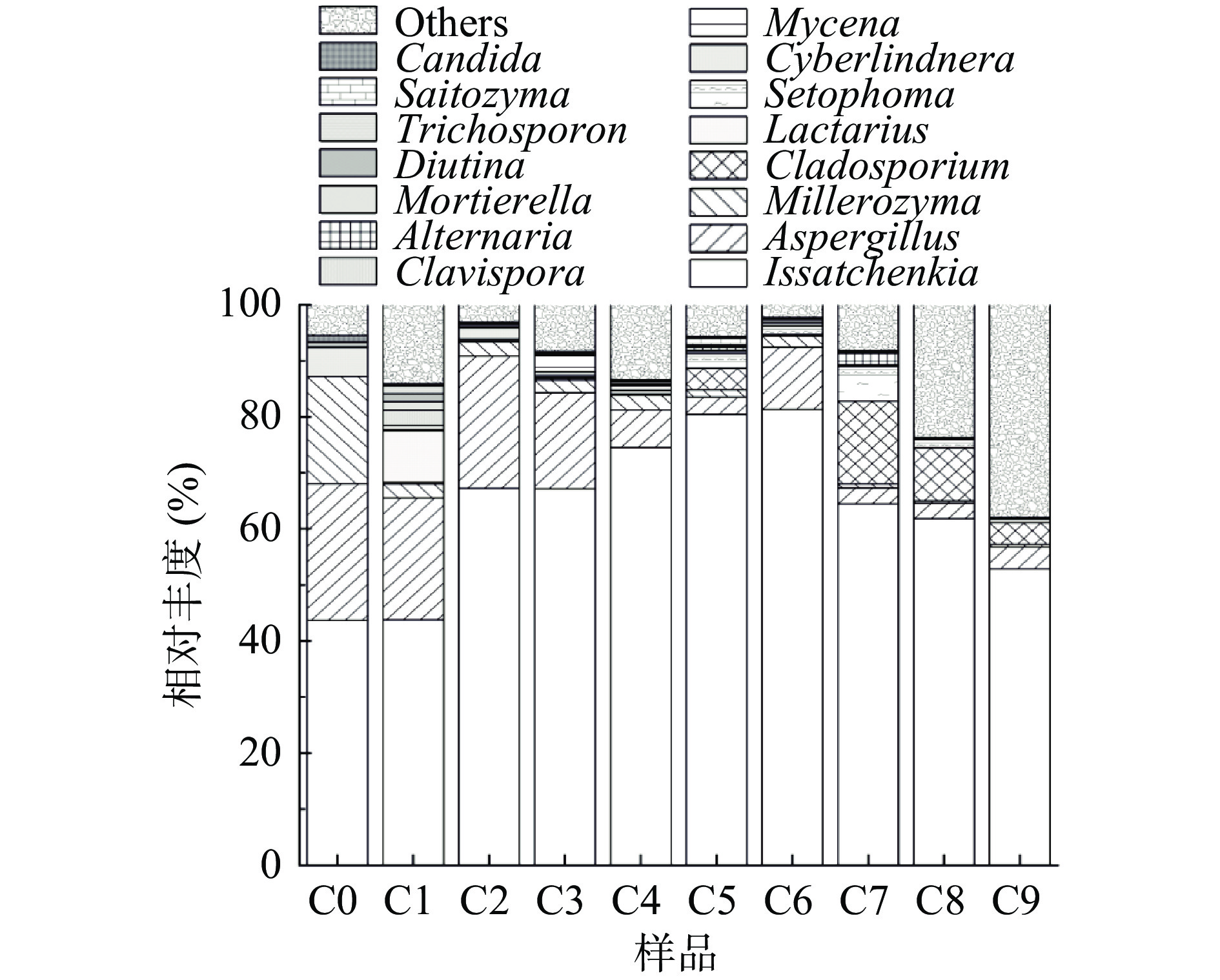
如图6,在醋曲(C0)中,优势菌属为伊萨酵母属(Issatchenkia)、曲霉属(Aspergilus)和米勒酵母属(Millerozyma),相对丰度分别为43.7%、24.4%和19.1%。这一结果与清香型大曲相似,在清香型大曲发酵过程中伊萨酵母属(Issatchenkia)和东方伊萨酵母菌(Issatchenkla orientalis)为绝对优势菌种[37]。此外,曲霉属(Aspergilus)在大曲的发酵成熟时期起着重要的作用[26],根据之前的报道,利用高通量测序分析大米曲、糯米曲、玉米曲、小麦曲和高粱曲的真菌群落结构时,曲霉属在这五种曲中都有被检出[38],与本研究结果相近。
在酒精发酵阶段(C1~C4),伊萨酵母属(Issatchenkia)和曲霉属(Aspergilus)仍然是主要的优势菌属。伊萨酵母属(Issatchenkia)在酒精发酵前期(C1和C2)呈现上升趋势,相对丰度由43.8%上升到67.2%,之后进入稳定期,无明显变化。现有报道指出,酵母菌属(Saccharomyces)是陈醋酒精发酵阶段的主要真菌菌属[19,21],与本研究结果有差异,推断原因可能为陈醋生产所用原料不同所致。伊萨酵母属(Issatchenkia)是一种比较重要的非酿酒酵母,因在发酵时具有耐乙醇、耐酸和耐高温以及能代谢产乙醇和乙酸乙酯的特点[39]而受到人们关注,发酵前期原料相对充分,有利于酵母代谢,所以该菌属迅速繁殖,出现短暂上升,随着发酵的进行,微生物适应了体系的环境,便会趋于稳定[40]。曲霉属(Aspergilus)在此阶段波动变化,相对丰度维持在6.7%~23.6%之间,该菌属能够产生糖化酶、淀粉酶[41-42],对原料中的淀粉起到很好的糖化作用,相关研究表明曲霉属(Aspergilus)还与异戊醇、异丁醇、乙酸乙酯等风味物质有关[43]。此外,小菇属(Mycena)只有在这个阶段被检出,小菇属真菌最主要的作用是用于人工栽培天麻的萌发真菌类群,近些年,因具有食用、药用价值而被人们所关注[44]。
在醋酸发酵阶段(C5~C9),伊萨酵母属(Issatchenkia)仍然是主要菌属,在此阶段呈现出先上升后下降的趋势,在C6发酵节点,相对丰度达到峰值,占比为81.3%。由于霉菌的细胞壁结构为:外层β-葡聚糖,中层糖蛋白,内层几丁质;酵母的细胞壁结构为:内层为葡聚糖层,中间层主要由蛋白质组成,外层为甘露聚糖层,在酸性条件下这种“三明治型”细胞壁结构仍能稳定存在而不被破坏[45],所以,伊萨酵母属(Issatchenkia)和曲霉属(Aspergilus)在醋酸发酵阶段仍能存在。小菇属(Mycena)在此阶段并未检出,可能醋酸发酵阶段的高酸性环境并不适合其生长繁殖,还有一些相对丰度虽然较低的菌属,但是适应环境的能力较强,在整个发酵过程中都有被检出,如米勒酵母属(Millerozyma)、枝孢属(Cladosporium)、棒孢酵母属(Clavispora)、假丝酵母属(Candidia)等,这些菌属在酿造中也发挥了作用,如枝孢属(Cladosporium)可以产纤维素酶[46],假丝酵母属(Candidia)有很好的发酵能力和耐酒精能力,可以水解还原糖生成乙醇,乙酸乙酯和柠檬酸等物质[47]。
2.5 两大发酵阶段差异菌属筛选
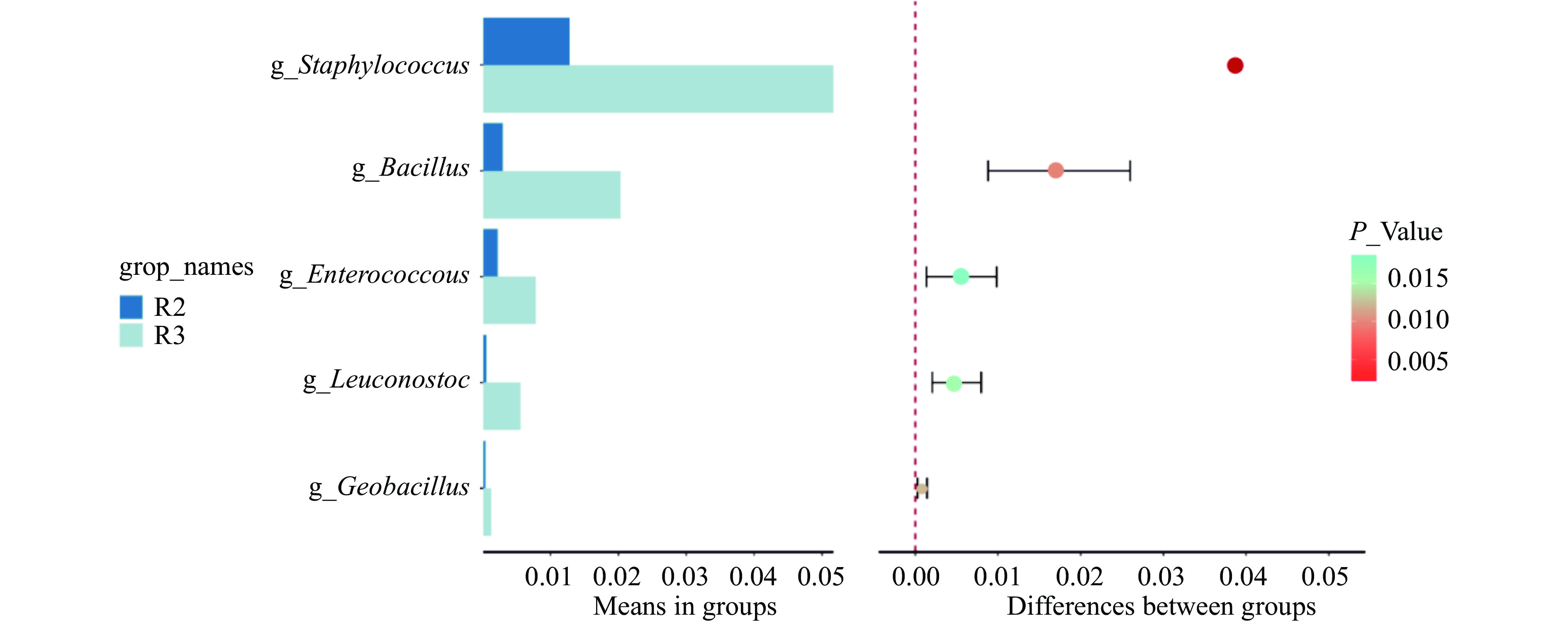
据之前报道,Zhu等[20]将山西陈醋醋发酵阶段分为前期、中期和末期三个时期,并找出这三个时期的差异显著细菌菌属,进一步加深了人们对醋酸发酵阶段的认识。目前对酒精发酵阶和醋酸发酵阶段的潜在差异菌属的研究较少。针对这一关键问题,本研究进行组间T-test分析,将进一步研究找出这两大酿造阶段的潜在差异显著菌属。由图7和图8可知,两大发酵阶段(R2表示酒精发酵阶段,R3表示醋酸发酵阶段)在属水平共发现6个差异显著菌属,其中包括5个细菌菌属和1个真菌菌属,分别为葡萄球菌属(Staphylococcus)、芽孢杆菌属(Bacillus)、肠球菌属(Enterococcus)、明串珠菌属(Leuconostoc)、土芽孢杆菌属(Geobacillus)和曲霉属(Aspergillus)。
3. 结论
本研究通过以山西陈醋发酵所用醋曲和醋醅为研究对象,利用高通量测序技术对样本细菌16S rDNA V3~V4区域和真菌ITS1区域进行检测,从而对山西陈醋酿造过程中的微生物动态变化进行探究。结果表明,在醋曲(R1)中,主要的细菌菌属为芽孢杆菌属(Bacillus)和魏斯氏菌属(Weissella),主要真菌菌属为伊萨酵母属(Issatchenkia)、曲霉属(Aspergilus)和米勒酵母属(Millerozyma)。其中,芽孢杆菌属(Bacillus)和魏斯氏菌属(Weissella)为醋曲赋予了α-淀粉酶、蛋白酶等丰富的霉系,对曲香的形成发挥了重要的作用。因此,在制作醋曲时应注重对这些菌属的检测以保证醋曲的质量。在酒精发酵阶段(R2),乳杆菌属(Lactobacillus)逐渐减少,魏斯氏菌属(Weissella)逐渐增多,伊萨酵母属(Issatchenkia)和曲霉属(Aspergilus)是主要的真菌菌属,特别地,小菇属(Mycena)仅在此阶段被检出,其在酒精发酵的代谢机理不明确,仍需进一步探讨。在醋酸发酵阶段(R3),乳杆菌属(Lactobacillus)和醋杆菌属(Acetobacter)是主要细菌菌属,伊萨酵母属(Issatchenkia)仍然是主要真菌菌属,枝孢属(Cladosporium)、假丝酵母属(Candidia)等菌属虽然相对丰度较低,却存在于整个发酵过程,对陈醋的品质发挥作用,后续进一步重视对这些低丰度菌属的研究。通过T-test分析发现,葡萄球菌属(Staphylococcus)、芽孢杆菌属(Bacillus)、肠球菌属(Enterococcus)、明串珠菌属(Leuconostoc)、土芽孢杆菌属(Geobacillus)和曲霉属(Aspergillus)为酒精发酵阶段和醋酸发酵阶段的差异菌属,为下一步建立快检方法奠定了基础,也为山西陈醋产品的发展和品质革新提供了理论支撑。
-
表 1 细菌和真菌Alpha多样性指数
Table 1 Bacterial and fungal Alpha diversity index
样品 细菌 真菌 Chao1指数 Simpson指数 Chao1指数 Simpson指数 C0 77.000±13.587h 0.587±0.072h 50.375±14.689j 0.776±0.144b C1 130.500±14.677a 0.838±0.032d 414.143±16.987a 0.827±0.549a C2 127.000±9.465b 0.916±0.071a 80.200±9.731g 0.612±0.212d C3 126.000±12.998b 0.918±0.213a 157.000±15.675b 0.649±0.090c C4 126.000±5.657b 0.858±0.219bc 119.000±11.907d 0.589±0.301f C5 120.000±11.877c 0.863±0.167b 94.000±10.330f 0.512±0.097g C6 114.000±16.904d 0.853±0.069c 68.000±8.990i 0.494±0.115h C7 88.000±15.993g 0.821±0.089e 125.000±11.227c 0.655±0.079c C8 91.000±10.056f 0.781±0.138f 101.321±14.095e 0.598±0.110e C9 110.000±18.854e 0.774±0.324g 78.986±9.330h 0.612±0.220d 注:同列不同字母表示差异显著(P<0.05)。 -
[1] XIA T, ZHANG J, YAO J H, et al. Shanxi aged vinegar prevents alcoholic liver injury by inhibiting CYP2E1 and NADPH oxidase activities[J]. Journal of Functional Foods,2018,47:575−584. doi: 10.1016/j.jff.2018.06.018
[2] XIA T, ZHANG B, DUAN W H, et al. Hepatoprotective efficacy of Shanxi aged vinegar extract against oxidative damage in vitro and in vivo[J]. Journal of Functional Foods,2019,60:103448. doi: 10.1016/j.jff.2019.103448
[3] XIE X L, ZENG Y, LIU X, et al. Antioxidant activity of Chinese Shanxi aged vinegar and its correlation with polyphenols and flavonoids during the brewing process[J]. Journal of Food Science,2017,82(10):2479−2486. doi: 10.1111/1750-3841.13914
[4] HONG Z, ZHU H, FALCONE P M, et al. Effect of ageing on rheological properties and quality of Shanxi aged vinegar[J]. IOP Conference Series: Earth and Environmental Science,2020,615(1):012096. doi: 10.1088/1755-1315/615/1/012096
[5] 杨宇霞, 韩建欣, 李婷, 等. 山西老陈醋两种风味物质含量变化分析[J]. 中国调味品,2020,45(6):160−162,169. [YANG Y X, HAN J X, LI T, et al. Analysis on the content changes of two flavor substances in Shanxi aged vinegar[J]. China Condiment,2020,45(6):160−162,169. doi: 10.3969/j.issn.1000-9973.2020.06.036 [6] 王俊奇, 黄卫红, 李双彤, 等. 永春老醋不同生产阶段细菌和真菌多样性动态变化特征分析[J]. 食品与发酵工业,2021,47(2):38−44. [WANG J Q, HUANG W H, LI S T, et al. Dynamic changes of bacterial and fungal diversities in Yongchun aged vinegar during production and storage[J]. Food and Fermentation Industries,2021,47(2):38−44. [7] 姚亚林, 邓杰, 任志强, 等. 不同品温大曲及其曲房空气的细菌群落变化规律和相关性[J]. 现代食品科技,2021,37(3):62−69. [YAO Y L, DENG J, REN Z Q, et al. Variations and correlation between bacterial communities in Daqu and the workshop air at different temperatures[J]. Modern Food Science and Technology,2021,37(3):62−69. [8] 赵馨仪, 范冰倩, 郑宇, 等. 山西老陈醋醋醅中产酸菌的分离、鉴定及醇酸耐受分析[J]. 中国酿造,2021,40(1):128−132. [ZHAO X Y, FAN B Q, ZHENG Y, et al. Isolation, identification of acid-producing bacteria from Shanxi aged vinegar cupei and their alcohol tolerance ablity analysis[J]. China Brewing,2021,40(1):128−132. doi: 10.11882/j.issn.0254-5071.2021.01.024 [9] 刘聪. 山西老陈醋醋醅中微生物多样性分析及高粱单宁对真菌生长的影响[D]. 太原: 山西大学, 2019. LIU C. Analysis of microbial diversity in vinegar grains of Shanxi aged vinegar and effects of sorghum tannin on fungal growth[D]. Taiyuan: Shanxi University, 2019.
[10] 刘雄. 中、高温大曲固态发酵过程微生物菌群结构变化的研究[D]. 广州: 华南理工大学, 2017. LIU X. Study on the structural changes of microflora during solid state fermentation of Daqu at medium and high temperature[D]. Guangzhou: South China University of Technology, 2017.
[11] DEVIRGILIIS C, BARILE S, PEROZZI G. Antibiotic resistance determinants in the interplay between food and gut microbiota[J]. Genes Nut,2011,6(3):275−284. doi: 10.1007/s12263-011-0226-x
[12] 李荣源, 卢红梅, 秦兴, 等. 高通量测序分析赤水晒醋各生产阶段微生物群落结构变化[J]. 食品科学,2020,41(24):78−86. [LI R Y, LU H M, QIN X, et al. The changes of microbial community structure in different production stages of Chishui vinegar were analyzed by high-throughput sequencing[J]. Food Science,2020,41(24):78−86. doi: 10.7506/spkx1002-6630-20191022-228 [13] 冯洁雅, 张桂容, 蔡吉, 等. 基于高通量测序解析四川晒醋固态发酵过程中细菌群落变化[J]. 食品工业科技,2021,42(19):135−143. [FENG J Y, ZHANG G R, CAI J, et al. Analysis of bacterial community changes in Sichuan sun vinegar solid-state fermentation process based on high-throughput equencing[J]. Science and Technology of Food Industry,2021,42(19):135−143. [14] 张桂容, 冯洁雅, 蔡吉, 等. 四川晒醋固态发酵过程中理化因子与真菌群落结构的动态变化规律[J]. 食品工业科技,2022,43(9):131−138. [ZHANG G R, FENG J Y, CAI J, et al. Effects of precise temperature treatment on the browning, physiological and quality of fresh cut lotus root[J]. Science and Technology of Food Industry,2022,43(9):131−138. doi: 10.13386/j.issn1002-0306.2021080149 [15] 方冠宇. 浙江玫瑰醋搅拌工艺及发酵过程中微生物与风味物质相关性研究[D]. 杭州: 浙江工商大学, 2019. FANG G Y. Study on the relationship between microorganisms and flavor substances in the stirring process and fermentation of Zhejiang rose vinegar[D]. Hangzhou: Zhejiang Gong Shang University, 2019.
[16] 王宗敏. 镇江香醋醋酸发酵阶段菌群结构变化与风味物质组成之间的相关性研究[D]. 无锡: 江南大学, 2016. WANG Z M. Study on the correlation between the composition of flavor substances and the change of bacterial community structure during acetic acid fermentation of Zhenjiang balsamic vinegar[D]. Wuxi: Jiangnan University, 2016.
[17] 赵风琴. 凉州熏醋传统酿造过程主要功能微生物群落演替对四甲基吡嗪的影响[D]. 兰州: 甘肃农业大学, 2016. ZHAO F Q. Effects of microbial community succession on tetramethylpyrazine in traditional brewing process of Liangzhou fumigated vinegar[D]. Lanzhou: Gansu Agricultural University, 2016.
[18] 孟燕华. 利用高通量测序技术分析传统食醋酿造过程中的细菌多样性[D]. 太原: 山西大学, 2019. MENG Y H. High throughput sequencing technology was used to analyze the bacterial diversity in the brewing process of traditional vinega[D]. Taiyuan: Shanxi University, 2019.
[19] 崔宁波. 利用DNA高通量测序技术分析生料酿醋过程中的真菌多样性[D]. 太原: 山西大学, 2019. CUI N B. High throughput DNA sequencing technology was used to analyze the diversity of fungi in the process of raw vinegar making[D]. Taiyuan: Shanxi University, 2019.
[20] ZHU Y P, ZHANG F F, ZHANG C N, et al. Dynamic microbial succession of Shanxi aged vinegar and its correlation with flavor metabolites during different stages of acetic acid fermentation[J]. Scientific Reports,2018,8(1):1−10.
[21] NIE Z Q, ZHENG Y, XIE S K, et al. Unraveling the correlation between microbiota succession and metabolite changes in traditional Shanxi aged vinegar[J]. Scientific Reports,2017,7(1):9240. doi: 10.1038/s41598-017-09850-6
[22] 沈才萍, 李德林, 沈才洪, 等. 酒醅微生物DNA提取预处理方法研究[J]. 四川理工学院学报 ( 自然科学版 ) ,2013,26(3):16−20. [SHEN C P, LI D L, SHEN C H, et al. Pretreatment method study of DNA extraction from fermented grains microbial[J]. Journal of Sichuan University of Science & Engineering (Natural Science Edition),2013,26(3):16−20. [23] 张娇娇, 李婧, 范冰倩, 等. 红曲米醋制曲过程中微生物群落演替及其对生化指标的影响[J]. 中国酿造,2019,38(12):36−42. [ZHANG J J, LI J, FAN B Q, et al. Microbial community succession during koji making process of red koji rice vinegar and its effects on biochemical indexes[J]. Chinag Brewing,2019,38(12):36−42. doi: 10.11882/j.issn.0254-5071.2019.12.008 [24] 宁亚丽, 吴跃, 何嫱, 等. 基于高通量测序技术分析朝鲜族传统米酒及其酒曲中微生物群落多样性[J]. 食品科学,2019,40(16):107−114. [NING Y L, WU Y, HE Q, et al. Analysis of microbial community diversity in Korean traditional rice wine and koji based on high-throughput sequencing technology[J]. Food Science,2019,40(16):107−114. doi: 10.7506/spkx1002-6630-20180917-173 [25] 王海娟, 戴雨珂, 潘渠. 魏斯氏菌的研究现状[J]. 成都医学院学报,2014,9(6):747−750. [WANG H J, DAI Y K, PAN Q. Research status of Weisseria[J]. Journal of Chengdu Medical College,2014,9(6):747−750. doi: 10.3969/j.issn.1674-2257.2014.06.027 [26] 张天震, 孙晓琪, 刘丹彤, 等. 山西老陈醋大曲细菌群落结构及多样性研究[J]. 中国食品学报,2021,21(5):323−330. [ZHANG T Z, SUN X Q, LIU D T, et al. Study on bacterial community structure and diversity of Daqu in Shanxi aged vinegar[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(5):323−330. [27] 马兰香, 毛永逊, 王秀芹, 等. 我国特色小麦培育现状及发展前景[J]. 新农业,2021(16):36. [MA L X, MAO Y X, WANG X Q, et al. Present situation and development prospect of characteristic wheat cultivation in China[J]. New Agricultural,2021(16):36. [28] 王进龙. 山西老陈醋大曲中芽孢杆菌的分离鉴定及特性研究[D]. 太谷: 山西农业大学, 2016. WANG J L. Isolation, identification and characterization of Bacillus from Shanxi aged vinegar Daqu[D]. Taigu: Shanxi Agricultural University, 2016.
[29] 姚元锋. L-酪氨酸代谢平台构建及其在丹参素合成中的应用[D]. 天津: 天津大学, 2013. YAO Y F. Construction of L-tyrosine metabolic platform and its application in danshansu synthesis[D]. Tianjin: Tianjin University, 2013.
[30] 高晓民. 葡萄球菌属的临床检测研究[J]. 世界最新医学信息文摘,2014,14(7):166,168. [GAO X M. Study on clinical detection of Staphylococcus[J]. World Latest Medicine,2014,14(7):166,168. [31] G NZLE M G. Lactic metabolism revisited: Metabolism of lactic acid bacteria in food fermentations and food spoilage[J]. Current Opinion in Food Science,2015,2:106−117. doi: 10.1016/j.cofs.2015.03.001
[32] 邢敏钰, 杜海, 徐岩. 芝麻香型白酒发酵过程中乳酸菌多样性及其演替规律[J]. 微生物学通报,2018,45(1):19−28. [XING M J, DU H, XU Y. Diversity and succession of lactic acid bacteria during sesame-flavor liquor fermentation[J]. Microbiology China,2018,45(1):19−28. [33] 曾旋. 不动杆菌属分子生物学菌种鉴定技术及其临床应用研究[D]. 衡阳: 南华大学, 2018. ZENG X. Study on molecular biological species identification of Acinetobacter and its clinical application[D]. Hengyang: Universty of South China, 2018.
[34] LUIS N B J, HUGO J I, ENRIQUE B A, et al. An optimization study of solid-state fermentation: Xanthophylls extraction from marigold flowers[J]. Appl Microbiol Biot,2004,65(4):383−390. doi: 10.1007/s00253-004-1615-5
[35] 李芬. 明串珠菌致新生儿败血症1例并文献分析[J]. 检验医学与临床,2020,17(20):3071−3072. [LI F. One case of neonatal septicemia caused by Candida albicans and literature analysis[J]. Laboratory Medicine and Clinic,2020,17(20):3071−3072. doi: 10.3969/j.issn.1672-9455.2020.20.053 [36] 熊涛. 果蔬益生菌发酵关键技术与产业化应用[J]. 饮料工业,2016,19(5):71−73. [XIONG T. Key technology and industrial application of fruit and vegetable probiotics fermentation[J]. Beverage Industry,2016,19(5):71−73. doi: 10.3969/j.issn.1007-7871.2016.05.023 [37] 兰玉倩, 樊丹敏, 刘志磊, 等. 应用PCR-DGGE指纹技术解析清香型大曲生产过程中酵母群落结构[J]. 中国酿造,2012,31(10):156−159. [LAN Y Q, FAN D M, LIU Z L, et al. Analysis of yeast community structure during Fen-flavor Daqu production with PCR-DGGE technology[J]. Chinag Brewing,2012,31(10):156−159. doi: 10.3969/j.issn.0254-5071.2012.10.042 [38] 李媛媛, 罗碧霞, 张兰兰, 等. 不同粮食曲的理化特性及其微生物群落结构[J]. 食品与发酵工业,2020,46(10):74−79. [LI Y Y, LUO B X, ZHANG L L, et al. Physicochemical characteristics and microbial community structure of different grain koji[J]. Food and Fermentation Industries,2020,46(10):74−79. [39] 彭俊, 杨团元, 刘蒲临, 等. 白酒酿造酒醅与周边土壤中酵母菌多样性及东方伊萨酵母发酵特性比较[J]. 中国酿造,2019,38(8):77−84. [PENG J, YANG T Y, LIU P L, et al. Comparison of the diversity of yeast in fermented grains and surrounding soil and the fermentation characteristics of Oriental Issa yeast[J]. China Brewing,2019,38(8):77−84. doi: 10.11882/j.issn.0254-5071.2019.08.016 [40] 韩兴林, 崔磊, 常强, 等. 浓香白酒发酵过程中酒醅微生物结构分析[J]. 酿酒,2021,48(1):81−86. [HAN X L, CUI L, CHANG Q, et al. Analysis of microbe structure in fermented grains of Luzhou-flavor liquor during fermentation[J]. Liquor Making,2021,48(1):81−86. [41] LI P, LIN W F, LIU X, et al. Effect of bioaugmented inoculation on microbiota dynamics during solid-state fermentation of Daqu starter using autochthonous of Bacillus, Pediococcus, Wickerhamomyces and Saccharomycopsis[J]. Food Microbiology,2017,61:83−92. doi: 10.1016/j.fm.2016.09.004
[42] HUANG Y H, YI Z L, JIN Y L, et al. Metatranscriptomics reveals the functions and enzyme profiles of the microbial community in Chinese Nong-Flavor liquor starter[J]. Frontiers in Microbiology,2017,8:17−47.
[43] 牟穰, 毛健, 孟祥勇, 等. 黄酒酿造过程中真菌群落组成及挥发性风味分析[J]. 食品与生物技术学报,2016,35(3):303−309. [MOU R, MAO J, MENG X Y, et al. Analysis of fungi diversity and volatile flavor compounds in Chinese rice wine fermentation process[J]. Journal of Food Science and Biotechnolog,2016,35(3):303−309. doi: 10.3969/j.issn.1673-1689.2016.03.013 [44] 程立君, 段相程, 胡志芳, 等. 天麻共生萌发菌栽培种生产工艺条件优化[J]. 安徽农学通报,2016,22(6):17−18. [CHENG L J, DUAN X C, HU Z F, et al. Optimization of production process of germinating bacteria of Gastrodia elata[J]. Anhui Agricultural Science Bulletin,2016,22(6):17−18. doi: 10.3969/j.issn.1007-7731.2016.06.008 [45] 邓永建. 酿醋微生物群落结构变化与醋醅氧含量的相关性研究[D]. 无锡: 江南大学, 2020. DENG Y J. Study on the relationship between the composition of vinegar microbe community and the content of oxygen in vinegar[D]. Wuxi: Jiangnan University, 2020.
[46] 张华姣, 王永宏, 韩立荣, 等. 枝状枝孢菌F4-1液体发酵产纤维素酶及部分酶学性质研究[J]. 西北农业学报,2012,21(9):149−153. [ZHANG H J, WANG Y H, HAN L R, et al. Cellulase production and some enzymatic properties of Cladosporium F4-1 liquid ferentation[J]. Acta Agriculturae Boreali-Occidentalis Sinica,2012,21(9):149−153. doi: 10.7606/j.issn.1004-1389.2012.09.028 [47] 战吉宬, 曹梦竹, 游义琳, 等. 非酿酒酵母在葡萄酒酿造中的应用[J]. 中国农业科学,2020,53(19):4057−4069. [ZHAN J C, CAO M Z, YOU Y L, et al. Research advance on the application of Non-Saccharomyces in wine making[J]. Scientia Agricultura Sinica,2020,53(19):4057−4069. doi: 10.3864/j.issn.0578-1752.2020.19.018





 下载:
下载:

 下载:
下载:



