Determination of Thymol in Honey by Ultra Performance Liquid Chromatography with Fluorescence Detector
-
摘要: 建立了超高效液相色谱-荧光检测法测定蜂蜜中百里香的残留量的检验方法。用40%乙腈-水溶液提取蜂蜜中的百里香酚,经离心、上清液过滤后,以0.1%甲酸水溶液-乙腈为流动相进行梯度洗脱,采用Accucore aQ色谱柱(150 mm×2.1 mm,2.6 μm)分离,荧光检测器检测(激发波长274 nm,发射波长297 nm),外标法定量。结果表明,百里香酚在0.01~3.00 μg/mL范围内线性关系良好,决定系数(R2)为0.9999,在蜂蜜基质中的平均加标回收率在87.4%~106.9%之间,变异系数在0.7%~7.3%之间,定量限为0.10 mg/kg。利用该方法测定了48份市售蜂蜜样品,仅有1份样品存在百里香酚残留。本研究建立的方法简单、迅速、可靠,适用于蜂蜜中百里香酚残留的批量筛查和定量测定。Abstract: The presented method was developed to determine the concentration of thymol residues in honey by ultra performance liquid chromatography with a fluorescence detector. The thymol in honey was extracted by 40% acetonitrile-water solution. After centrifugation and filtration, the separation of thymol was performed on an Accucore aQ liquid chromatography column (150 mm×2.1 mm, 2.6 μm) with the gradient elution of acetonitrile and water (containing 0.1% formic acid) as mobile phases, and quantitated by external standard method with fluoresce detector (excitation wavelength 274 nm, emission wavelength 297 nm). A good linear relationship (R2=0.9999) was observed with concentration ranging from 0.01 μg/mL to 3.00 μg/mL. The average recovery of thymol was from 87.4% to 106.9%, the coefficient of variation was between 0.7% and 7.3%, and the limit of quantification was 0.10 mg/kg. The developed method was applied to determine residual thymol in 48 commercial honey samples, and the thylmol was only detected in one sample. The presented method is simple, quick, reliable, and suitable to be used for batch screening and quantitative determination of residual thymol in honey.
-
Keywords:
- honey /
- thymol /
- ultra performance liquid chromatography /
- fluorescence method /
- residue
-
百里香酚(Thymol)又名麝香草酚,是香芹酚(Carvacrol)的同分异构体,普遍存在于百里香属植物及其提取精油中[1],具有抗菌、消炎、抗肿瘤、抗氧化、抗病毒等功效[2-4],是一种低毒的天然单萜酚[5]。百里酚的抑螨率高、对蜂群伤害率低,可有效防控蜂巢瓦螨[6],在养蜂业广泛使用。欧盟认为百里香酚属于无毒性兽药[7],美国、加拿大和澳洲还未规定其最大残留限量(Maximum residue limit,MRL)。日本将百里香酚纳入寄生虫驱虫剂管理,规定蜂蜜中百里香酚的限量值为30 mg/kg[8]。此外,由于百里香酚具有强烈的辛辣气味,人类对其味觉阈值介于1.1~1.3 mg/kg之间[9],为避免过量百里香酚残留改变蜂蜜自身风味,瑞士规定蜂蜜中百里香酚的最大残留量为0.8 mg/kg[10]。国内尚无针对蜂蜜中百里香酚的检测标准,对蜂蜜等产品中百里香酚残留检测方法的报道较少。我国是蜂产品生产第一大国[11],为了保障市场销售产品的质量安全,促进蜂产品出口贸易的顺利进行,建立一种能够简单、快捷、准确测定蜂蜜中百里香酚的分析方法十分必要。
目前,针对百里香酚的分析方法主要有电化学法[12-14]、气相色谱法[15-18]、液相色谱法[19-21]等。其中,电化学法尚处于理论研究阶段,应用范围有限;气相色谱法使用的火焰离子化检测器灵敏度较低[22],需要配合预浓缩[23],或配套价格昂贵的质谱检测器[24]、普及率低的顶空进样器[25]等特殊设备才能获得满意的测定效果;而且由于蜂蜜中葡萄糖、果糖[26]占60%~80%,使用气相色谱常用的有机溶剂提取时,基质中的糖类易析出造成沉淀、结块,降低提取效率,影响了气相法的普及。液相法使用的含水提取剂和流动相与蜂蜜高糖基质的兼容性更高,但也受限于二极管阵列检测器(Diode array detector,DAD)的低灵敏度[27],仍需要借助质谱[28]或特殊前处理方式[29]才能到达足够的灵敏度。荧光检测器(Fluorescence detector,FLD)因具有选择性好、灵敏度高的优点,已被报道用于百里香酚残留的测定[30]。但是,现有文献中对前处理和分离条件的优化讨论有限,未充分考虑到复杂基质中强保留物质(如:微量蛋白、蜂蜡等)的洗脱,关键是不能区分常见酚类异构体(如:香芹酚等)的干扰,难以实现实际样品中百里香酚的高通量准确定性、定量分析。本研究拟采用超高效液相色谱-荧光检测技术对蜂蜜中百里香酚残留进行检测。通过优化前处理方法、色谱分离与检测条件,建立一种简单、可靠,技术指标能够满足出口蜂蜜中百里香酚残留量测定的标准方法,为蜂蜜中百里香酚残留量的监控提供有效的技术支撑。
1. 材料与方法
1.1 材料与仪器
蜂蜜(雪脂莲蜜、椴树蜜、玄参蜜、洋槐蜜和百花蜜) 市场购买获得;百里香酚 标准品,纯度99.69%,德国Dr. Ehrenstorfer公司;丹皮酚、丁香酚、异丁香酚和香芹酚 纯度大于99.0%,上海阿拉丁公司;乙腈、甲醇 色谱纯,美国Thermo公司;甲酸 分析纯,广州化学试剂厂;实验室用水为超纯水。
Acquity UPLC超高超效液相色谱仪(配备DAD及FLD)、Oasis PRiME HLB净化柱(3 mL,60 mg) 美国Waters公司;QuEChERS dSPE净化管(含600 mg MgSO4,100 mg PSA,40 mg C18) 上海CNW公司;ME203E分析天平 感量0.001 g,瑞士梅特勒-托利多公司;CP225 D分析天平 感量为0.01 mg,德国Sartorius公司;2600TH超声清洗器 上海安谱公司;Allegra X-30R高速离心机 德国贝克曼公司;MS 3涡旋振荡器 德国IKA公司;Milli-Q Aca-demic超纯水制备仪 美国密理博公司。
1.2 实验方法
1.2.1 标准溶液配制
准确称取20.0 mg(精确至0.1 mg)百里香酚标准品,用甲醇溶解、混匀并定容至10 mL容量瓶,得到浓度为2.00 g/L的标准储备液,再准确量取0.250 mL百里香酚标准储备溶液,用甲醇稀释并定容至50 mL,得到浓度为10.0 µg/mL的标准中间液,于4 ℃冰箱中避光保存,临用时准确量取百里香酚标准中间溶液,用40%乙腈水溶液稀释,依次配制成质量浓度为0.01、0.05、0.10、0.50、1.00、2.00、3.00 µg/mL的标准系列溶液。
1.2.2 样品前处理
准确称取蜂蜜样品2.5 g(精确到0.001 g)于25 mL具塞比色管中,加入乙腈-水(v/v=40:60)溶液定容,振荡5 min后,用8000 r/min离心5 min,取上清液过0.45 μm有机相滤膜,供上机测定。
1.2.3 净化方法
1.2.3.1 净化柱净化
依次用3 mL乙腈和3 mL水对PRiME HLB柱进行活化,取1.2.2步骤中所得上清液3 mL上柱,用3 mL水进行淋洗,弃去全部淋出液,抽干。然后用3 mL乙腈进行洗脱。将洗脱液在40 ℃下氮吹至近干,加入40%乙腈-水溶液溶解残渣并定容至3 mL,取上清液过0.45 μm有机相滤膜,供上机测定[31]。
1.2.3.2 净化管净化
取1.2.2步骤中所得上清液5 mL,置于QuEChERS dSPE净化管中涡旋混合3 min,在4 ℃条件下,8000 r/min离心5 min。上清液过0.45 μm有机相滤膜,供上机测定[32]。
1.2.4 仪器条件
Thermo Accucore aQ液相色谱柱(150 mm×2.1 mm×2.6 μm);流动相A为0.1%甲酸水,流动相B为乙腈,洗脱梯度为0~6.5 min,60% A;6.5~7.0 min,60%~10% A;7.0~9.0 min,10% A;9.0~9.1 min,10%~60% A;9.1~12.0 min,60% A;流速为0.3 mL/min;柱温为40 ℃;进样量为5 μL;DAD测定波长为274 nm;FLD激发波长为274 nm,发射波长为297 nm。
1.2.5 测定
分别吸取百里香酚标准系列溶液及样品提取液注入液相色谱,在1.2.4条件下测定。以浓度为横坐标,峰面积为纵坐标制作标准曲线,由标准曲线得到试样中百里香酚的浓度,根据保留时间定性,峰面积定量。
1.3 数据处理
实验数据通过沃特世Empower 3.0软件采集,导出原始数据后采用SPSS 25统计软件与Excel 2016软件进行单因素试验图形绘制与分析(单变量,一般线性模型;置信值95%,P<0.05为显著性差异)。前处理和分析条件优化中的回收率的计算均采用3个平行样品取平均值计算,精密度选择低、中、高3个浓度,每个浓度梯度取连续采集6次数据的峰面积进行相对标准偏差RSD值的计算。
2. 结果与分析
2.1 前处理方法的优化
2.1.1 提取溶剂的选择
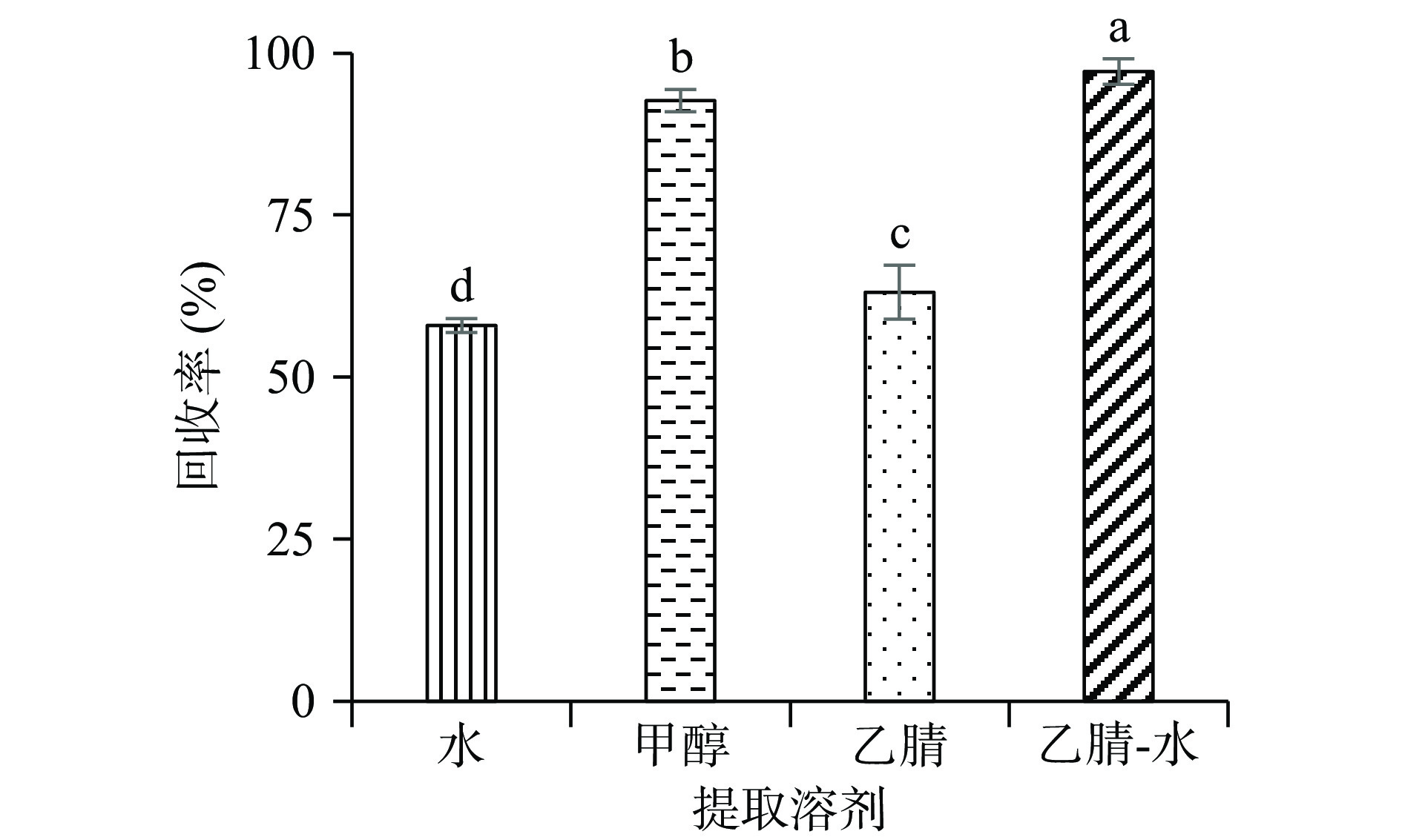
在空白蜂蜜样品中加入10.0 mg/kg百里香酚标准品,采用水、甲醇、乙腈及乙腈-水(v/v=40:60)等4种提取溶剂进行回收率实验,结果见图1。实验表明,乙腈-水的回收率最高,达97.2%;甲醇的回收率为92.7%,乙腈和水的回收率分别为63.1%和58.0%。使用SPSS 25软件对提取溶剂种类及回收率情况进行显著性分析,4种提取溶剂之间具有显著性差异(P<0.05)。此外,甲醇提取液会带入较多的干扰杂质影响后续色谱分离效果。经综合考虑,最终选择乙腈-水作为提取溶剂。
2.1.2 净化方式的选择
在空白蜂蜜样品中加入10.0 mg/kg百里香酚标准品,并测定回收率,液液萃取法(LLE)、PRiME HLB固相萃取(SPE)和QuEChERS法等3种净化方式的回收结果见图2。使用SPSS 25软件进行显著性分析,结果表明QuEChERS法与其他两组方式存在显著性差异(P<0.05),LLE法与SPE法之间不存在显著性差异(P>0.05)且平均回收率明显优于QuEChERS法。但是SPE法需要经过复杂的操作,效率较低且需消耗大量有机溶剂。综合考虑实验操作简便性和提取净化效率,最终采用乙腈-水(v/v=40:60)液液萃取的直接净化方式。
2.2 分离条件的优化
2.2.1 色谱柱的选择
蜂蜜中除百里酚香外还可能含有丹皮酚、丁香酚、异丁香酚和香芹酚等其他天然驱虫效果的精油成份[33],其中香芹酚和百里香酚为同分异构体。因此,需要充分考虑其他天然酚类对百里香酚测定的影响,以避免实际样品检测中出现定性不准确。实验考察了五氟苯基(PFP)柱、普通C18柱、亲水作用(hilic)柱和极性封端(aQ)柱对百里香酚及其干扰物的分离效果,以提高百里香酚分析检测的准确性和可靠性,结果见图3。结果表明,aQ柱对5种酚类物质的分离效果最佳,且对香芹酚和百里香酚的选择性不同,峰型尖锐,有利于对百里香酚的定性定量测定,故选用aQ柱作为百里香酚测定的色谱柱。
![]() 图 3 4种色谱柱对酚类混合物(1.0 µg/mL)的分离色谱图注:峰1:丹皮酚;峰2:丁香酚;峰3:异丁香酚;峰4:香芹酚;峰5:百里香酚;图4同。Figure 3. Chromatograms of 4 kinds of chromatographic column for mixed phenolic compounds at 1.0 µg/mL
图 3 4种色谱柱对酚类混合物(1.0 µg/mL)的分离色谱图注:峰1:丹皮酚;峰2:丁香酚;峰3:异丁香酚;峰4:香芹酚;峰5:百里香酚;图4同。Figure 3. Chromatograms of 4 kinds of chromatographic column for mixed phenolic compounds at 1.0 µg/mL2.2.2 流动相的选择
本研究选取甲醇-水、甲醇-0.1%甲酸水、乙腈-水和乙腈-0.1%甲酸水等4种流动相考察其对天然酚类化合物的识别和分离能力(见图4)。结果表明,不同有机相对5种酚类物质的分离效果影响较大,选用乙腈作为流动相对香芹酚和百里香酚的分离效果明显优于使用甲醇的流动相。
此外,实际样品测试中还发现不同类型蜂蜜中百里香酚的保留时间会因基质pH不同出现漂移,在流动相内加酸可有效降低此现象的发生。但百里香酚的荧光响应强度随酸浓度的增加出现降低。本研究使用不同甲酸比例的水溶液做流动相A,评估百里香酚保留时间及不同酸浓度下峰面积相对于不加酸时峰面积的变化率,结果如图5所示。当甲酸含量在0%~0.2%时峰面积变化缓慢,当甲酸含量大于0.2%时百里香酚峰面积降低明显加快,因此在流动相中选择加入0.2%以下的甲酸,试验过程中发现0.1%甲酸浓度亦能保证百里香酚保留时间的稳定性。综合考虑分离效果、提取溶剂和实验操作稳定性,最终选择0.1%甲酸水-乙腈作为本研究的流动相。
2.2.3 有机相比例的确定
在实际蜂蜜样品分析测定中,最大的干扰来自于百里香酚的同分异构体香芹酚,流动相比例对香芹酚和百里香酚的分离度起着重要作用。实验通过优化流动相中乙腈和水的比例进一步考察了香芹酚和百里香酚的分离度,结果如图6所示。结果表明,随着流动相中乙腈比例的增加,香芹酚和百里香酚分离度逐渐降低,当乙腈浓度达45%时,两者恰好达到基线分离(R=1.5)。为确保同分异构体的分离效果和结果的准确度,实验最终选择40%的乙腈浓度作为流动相起始比例。
2.2.4 检测波长的选择
将百里香酚制成1.00 μg/mL标准溶液,使用DAD确定百里香酚的最大吸收波长为220 nm,第二吸收波长为274 nm,结果如图7所示;使用FLD对其最佳激发和发射波长进行优化,得到百里香酚荧光检测的最佳激发和发射波长分别为274 nm和297 nm,结果如图8所示。
2.3 方法学验证
2.3.1 线性关系、范围和定量限
实验以百里香酚响应值的峰面积为纵坐标(Y),以百里香酚溶液的质量浓度为横坐标(X),绘制标准工作曲线,得到百里香酚的线性范围、线性回归方程和决定系数;以仪器3倍信噪比对应的百里香酚浓度作为仪器检出限,以10倍信噪比对应的百里香酚浓度作为仪器定量限,结果见表1。结果表明,百里香酚在0.01~3.00 µg/mL线性范围内决定系数(R2)达0.9999,线性关系良好,方法的LOD和LOQ分别为0.03 mg/kg和0.10 mg/kg。
表 1 百里香酚的线性范围、线性回归方程、决定系数、检出限和定量限Table 1. Linear range, linear equation, correlation coefficients, limit of detection (LOD) and limit of quantitation (LOQ) of thymol线性范围
(µg/mL)线性方程 决定系数
(R2)检出限
(mg/kg)定量限
(mg/kg)0.01~3.00 y=1.537×107x−3196 0.9999 0.03 0.10 2.3.2 回收率与精密度
实验选取雪脂莲蜜、椴树蜜、玄参蜜、洋槐蜜和百花蜜等5种代表性蜂蜜空白样品作为基质,在本方法定量限、日本最大残留限量及瑞士标准要求等3个水平进行加标回收实验,加标量分别为0.1、0.8、30 mg/kg,结果见表2。结果表明,在5种蜂蜜样品基质中的平均加标回收率为87.4%~106.9%,方法精密度为0.7%~7.3%。
表 2 百里香酚的加标回收率和精密度(n=6)Table 2. Spiked recoveries and relative standard deviations (RSDs) of thymol (n=6)基质种类 添加浓度(mg/kg) 平均加标回收率(%) 精密度(%) 雪脂莲蜜 0.1 98.1 5.7 0.8 98.3 3.2 30 96.9 0.8 椴树蜜 0.1 89.5 4.3 0.8 100.3 2.1 30 87.4 0.9 玄参蜜 0.1 106.9 6.0 0.8 96.4 2.1 30 91.1 1.8 洋槐蜜 0.1 95.2 5.8 0.8 103.2 1.3 30 89.5 0.8 百花蜜 0.1 98.8 7.3 0.8 96.8 1.5 30 96.7 0.7 2.3.3 实际样品分析
利用所建立的方法对市场上销售的48批次蜂蜜样品进行检测,其中包含养殖场原料蜂蜜15个、混合花种蜂蜜13个、单一花种蜂蜜20个。结果显示,仅有1个百花蜜样品检出百里香酚残留,浓度为0.20 mg/kg,其典型色谱图如图9所示。
3. 结论
本研究建立了一种蜂蜜中百里香酚残留量的高效液相色谱-荧光检测器检测方法,对提取溶剂、净化方式和分析条件进行优化并对整个实验过程的稳健性进行了方法学验证。该方法的定量限为0.10 mg/kg,百里香酚在0.10~30.0 mg/kg添加水平下,回收率为87.4%~106.9%,方法精密度为0.7%~7.3%,目标峰可与其同分异构干扰物达到基线分离。通过对市售蜂蜜产品的测试,仅一个批次样品检出微量百里香酚残留,说明国内市场蜂蜜样品中百里香酚残留水平很低。本方法操作简单、选择性好,抗干扰性强,可满足日常工作中对蜂蜜中百里香酚残留量测定的需要,能为我国蜂产品质量安全风险评价提供技术补充,有利于促进出口和保障国民身体健康。
-
图 3 4种色谱柱对酚类混合物(1.0 µg/mL)的分离色谱图
注:峰1:丹皮酚;峰2:丁香酚;峰3:异丁香酚;峰4:香芹酚;峰5:百里香酚;图4同。
Figure 3. Chromatograms of 4 kinds of chromatographic column for mixed phenolic compounds at 1.0 µg/mL
表 1 百里香酚的线性范围、线性回归方程、决定系数、检出限和定量限
Table 1 Linear range, linear equation, correlation coefficients, limit of detection (LOD) and limit of quantitation (LOQ) of thymol
线性范围
(µg/mL)线性方程 决定系数
(R2)检出限
(mg/kg)定量限
(mg/kg)0.01~3.00 y=1.537×107x−3196 0.9999 0.03 0.10 表 2 百里香酚的加标回收率和精密度(n=6)
Table 2 Spiked recoveries and relative standard deviations (RSDs) of thymol (n=6)
基质种类 添加浓度(mg/kg) 平均加标回收率(%) 精密度(%) 雪脂莲蜜 0.1 98.1 5.7 0.8 98.3 3.2 30 96.9 0.8 椴树蜜 0.1 89.5 4.3 0.8 100.3 2.1 30 87.4 0.9 玄参蜜 0.1 106.9 6.0 0.8 96.4 2.1 30 91.1 1.8 洋槐蜜 0.1 95.2 5.8 0.8 103.2 1.3 30 89.5 0.8 百花蜜 0.1 98.8 7.3 0.8 96.8 1.5 30 96.7 0.7 -
[1] 刘欢, 赵巨堂, 罗海涛, 等. 提取方法对百里香精油化学成分和抗氧化活性的影响[J]. 食品工业科技,2022,43(19):333−341. [LIU H, ZHAO J T, LUO H T, et al. Effect of different extraction methods on chemical constituents and antioxidant activity of essential oil from Thymus vulgaris L J]. Science and Technology of Food Industry,2022,43(19):333−341.
[2] 李旭领, 郭月婷, 王一佳, 等. 药用植物挥发油的抗菌作用及机制研究进展[J]. 动物医学进展,2022,43(5):97−101. [LI X L, GUO Y T, WANG Y J, et al. Progress on antimicrobial effects and mechanisms of volatile oils from medicinal plants[J]. Progress in Veterinary Medicine,2022,43(5):97−101. doi: 10.3969/j.issn.1007-5038.2022.05.019 [3] 崔醒, 朱秋劲, 侯瑞, 等. 丁香酚、香芹酚和百里香酚对禾谷镰刀菌的抑菌活性及机制[J/OL]. 食品科学: 1−14 [2022-07-24]. http://kns.cnki.net/kcms/detail/11.2206.TS.20220414.1359.094.html CUI X, ZHU J Q, HOU R, et al. Antibacterial activity and mechanism of eugenol,carvacrol and thymol against Fusarium graminearum[J/OL]. Food Science:1−14. [2022-07-24]. http://kns.cnki.net/kcms/detail/11.2206.TS.
[4] 靳盼盼, 刘亚文, 刘旖旎, 等. 百里香酚对食源阴沟肠杆菌生物膜形成的抑制作用[J]. 食品工业科技,2019,40(22):104−109, 114. [JIN P P, LIU Y W, LIU Y N, et al. Inhibition of biofilm formation of Foodborne-enterobacter cloacae by thymol[J]. Science and Technology of Food Industry,2019,40(22):104−109, 114. [5] KACHUR K, SUNTRES Z. The antibacterial properties of phenolic isomers, carvacrol and thymol[J]. Critical Reviews in Food Science and Nutrition,2020,60(18):3042−3053. doi: 10.1080/10408398.2019.1675585
[6] 胡福良, 朱威, 李英华. 香精油的抗蜂螨作用及其在蜂群中的应用[J]. 昆虫知识,2005(4):375−378. [HU F L, ZHU W, LI Y H. Use of essential oils for controlling Varroa destructor in honey bee colonies[J]. Entomological Knowledge,2005(4):375−378. [7] REGULATION H. Council Regulation (EEC) No 2377/90 of 26 June 1990 laying down a community procedure for the establishment of maximum residue limits of veterinary medicinal products in foodstuffs of animal origin[J]. Official JL,1990,224:0001−0008.
[8] 日本厚生劳动省. 生食発0822第5号[S]. 食药事务和卫生委员会, 平成30年8月22日 Ministry of Health, Labor and Welfare of Japan, Life Hygiene and Food Safety Regulations 0822 No. 5 [S]. Pharmaceutical Affairs and Food Sanitation Council, August 22, 2018.
[9] BOGDANOV S, KILCHENMANN V, FLURI P, et al. Influence of organic acids and components of essential oils on honey taste[J]. Am Bee J,1999,139(1):61−63.
[10] BOGDANOV S, KILCHENMANN V, IMDORF A, et al. Residues in honey after application of thymol against Varroa using the Frakno Thymol Frame[J]. Am Bee J,1998,138(8):610−611.
[11] 李瑞珍, 方兵兵, 刘世丽. 世界蜂蜜生产、贸易与消费发展态势分析[J]. 中国食物与营养,2021,27(8):15−20. [LI R Z, FANG B B, LIU S L. Analysis on the development trend of world honey production, trade and consumption[J]. Food and Nutrition in China,2021,27(8):15−20. doi: 10.3969/j.issn.1006-9577.2021.08.003 [12] TONELLO N, MORESSI M B, ROBLEDO S N, et al. Square wave voltammetry with multivariate calibration tools for determination of eugenol, carvacrol and thymol in honey[J]. Talanta,2016,158:306−314. doi: 10.1016/j.talanta.2016.05.071
[13] AGHAMOHSENI B, HASSANINEJAD-DARZI S K, ASADOLLAHI-BABOLI M. A new sensitive voltammetric determination of thymol based on MnY nanozeolite modified carbon paste electrode using response surface methodology[J]. Microchemical Journal,2019,145:819−832. doi: 10.1016/j.microc.2018.11.045
[14] ZIYATDINOVA G, ZIGANSHINA E, CONG P N, et al. Voltammetric determination of thymol in oregano using CeO2-modified electrode in Brij® 35 micellar medium[J]. Food Analytical Methods,2017,10(1):129−136. doi: 10.1007/s12161-016-0562-y
[15] 董茂锋, 韩薇, 白冰, 等. 气相色谱法测定饲料香味剂中香芹酚和百里香酚的含量[J]. 上海农业学报,2015,31(3):79−81. [DONG M F, HAN W, BAI B, et al. Determination of carvacrol and thymol contents in feed aromatizer by gas chromatography[J]. Acta Agriculturae Shanghai,2015,31(3):79−81. [16] 宫玲玲, 李会荣. 气相色谱法同步测定饲料添加剂中百里香酚、香芹酚的研究[J]. 中国饲料,2014(2):38−40. [GONG L L, LI H R. Determination of thymol and carvacrol in feeds by gas chromatograpahy[J]. China Feed,2014(2):38−40. doi: 10.3969/j.issn.1004-3314.2014.02.021 [17] 罗成江, 周炜, 侯轩, 等. 气相色谱法测定香味剂中桉油精肉桂醛百里香酚及香芹酚的含量[J]. 中国兽医杂志,2019,55(2):113−115. [LUO C J, ZHOU W, HOU X, et al. Determination of eucalyptol, cinnamaldehyde, thymol and carvacrol contents in fodder flavouring matter by gas chromatography[J]. Chinese Journal of Veterinary Medicine,2019,55(2):113−115. [18] ANTIH J, HOUDKOVA M, URBANOVA K, et al. Antibacterial activity of Thymus vulgaris L. essential oil vapours and their GC/MS analysis using solid-phase microextraction and syringe headspace sampling techniques[J]. Molecules,2021,26(21):6553. doi: 10.3390/molecules26216553
[19] 王晓峰. 高效液相色谱法测定食品包装薄膜中的香芹酚和百里香酚[J]. 食品安全导刊,2021(24):140−141. [WANG X F. High performance liquid chromatography method for rapid detection of carvacrol and thymol in active food packaging film[J]. China Food Safety Magazine,2021(24):140−141. [20] 张玮, 李会荣, 宫玲玲. 高效液相色谱法测定混合型饲料添加剂中肉桂醛、丁香酚、香芹酚和百里香酚含量[J]. 饲料研究,2020,43(2):64−69. [ZHANG W, LI H R, GONG L L. Study on the determination of cinnamaldehyde, eugenol, carvacrol and thymol in mixed feed additives by liquid chromatograph[J]. Feed Research,2020,43(2):64−69. [21] 窦茂鑫, 赵迪, 侯永清, 等. 饲料添加剂百里香油中百里香酚和香芹酚含量的测定[J]. 中国饲料,2013(7):39−40. [DOU M X, ZHAO D, HOU Y Q, et al. Determination of the content of thymol and carvacrol in feed additives[J]. China Feed,2013(7):39−40. [22] TSIGOURI A, PASSALOGLOU-KATRALI M, SABATAKOU O. Determination of eucalyptol camphor menthol and thymol in greek thyme honey by GC-FID[J]. Acta Alimentaria,2008,37(2): 181−189. doi: 10.1556/AAlim.2007.0032
[23] NOZAL M J, BERNAL J L, JIMENEZ J J, et al. Extraction of thymol, eucalyptol, menthol, and camphor residues from honey and beeswax: Determination by gas chromatography with flame ionization detection[J]. Journal of Chromatography A,2002,954(1−2):207−215. doi: 10.1016/S0021-9673(02)00153-X
[24] ARES A M, NOZAL M J, BERNAL J L, et al. Simultaneous determination of carvacrol and thymol in bee pollen by using a simple and efficient solvent extraction method and gas chromatography-mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis,2020,181:113124. doi: 10.1016/j.jpba.2020.113124
[25] BADERTSCHER R, KILCHENMANN V, LINIGER A, et al. Determination of 1,4-dichlorobenzene, naphthalene and thymol residues in honey using static headspace coupled with GC-MS[J]. Journal of Api Product and Api Medical Science,2010,2:87−92. doi: 10.3896/IBRA.4.02.3.01
[26] 中华人民共和国卫生部. GB 14963-2011 食品安全国家标准 蜂蜜[S]. 北京: 中国标准出版社 Ministry of Health of the People's Republic of China. GB 14963-2011 National food safety standard honey[S]. Beijing: China Standard Press.
[27] MARTEL A C, ZEGGANE S. Determination of acaricides in honey by high-performance liquid chromatography with photodiode array detection[J]. Journal of Chromatography A,2002,954(1−2):173−180. doi: 10.1016/S0021-9673(02)00126-7
[28] SÁNCHEZ L M, RAMOS M J G, DEL MAR GÓMEZ-RAMOS M, et al. Presence, persistence and distribution of thymol in honeybees and beehive compartments by high resolution mass spectrometry[J]. Environmental Advances,2021,5:100085. doi: 10.1016/j.envadv.2021.100085
[29] GHOBADLOO P A, HAMIDI S, NEMATI M, et al. Ultrasound assisted dispersive solid phase microextraction of thymol and carvacrol in pharmaceutical products using graphene oxide as an adsorbent prior to analysis by high performance liquid chromatography[J]. Current Pharmaceutical Analysis,2020,16(5):578−584. doi: 10.2174/1573412915666190220102628
[30] 黄学者, 贾光群, 魏红跃, 等. 超高效液相色谱-紫外/荧光法检测蜂蜜中百里香酚含量[J]. 食品安全质量检测学报,2020,11(20):7220−7226. [HUANG X Z, JIA G Q, WEI H Y, et al. Determination of thymol content in honey by ultra performance liquid chromatography-ultraviolet/fluorescence method[J]. Journal of Food Safety & Quality,2020,11(20):7220−7226. [31] 张晓华, 吕敏明, 郑晶晶, 等. 化学计量学二阶校正方法结合高效液相色谱用于蜂蜜中10种酚酸类物质的快速定量分析[J]. 色谱,2020,38(5):572−580. [ZHANG X H, LÜ M M, ZHENG J J, et al. Fast high-performance liquid chromatography quantification of ten phenolic acids in honey using chemometric second-order calibration method[J]. Chinese Journal of Chromatography,2020,38(5):572−580. [32] 吴升德, 谷群远, 沈校校, 等. 蜂蜜中农药残留检测前处理和分析方法研究进展[J]. 中国蜂业,2021,72(12):58−60. [WU D S, GU Y Q, SHEN X X, et al. Research progress of pretreatment and analytical methods on pesticide residues in honey[J]. Apiculture of China,2021,72(12):58−60. doi: 10.3969/j.issn.0412-4367.2021.12.032 [33] 胡福良, 朱威, 李英华. 香精油抗蜂螨作用的研究进展[J]. 养蜂科技,2004(5):21−23, 25. [HU F L, ZHU W, LI Y H. The recent advances in essential oils for the control of Varroa jacobsoni[J]. Apicultural Science and Technology,2004(5):21−23, 25.





 下载:
下载:








 下载:
下载:



