Isolation and Identification of Dominant Spoilage Biogenic Amine Producing Bacteria from Refrigerated Skipjack Tuna and Analysis of Their Production Ability
-
摘要: 为探究鲣鱼中优势腐败产胺菌的种类,从冷藏的鲣鱼中筛选出3种优势腐败产胺菌,通过16S rDNA分子鉴定技术对菌株进行鉴定为荧光假单胞菌(Pseudomonas fluorescens)、弗氏柠檬酸杆菌(Citrobacter freundii)和嗜水气单胞菌(Aeromonas hydrophila),将鉴定出的优势腐败产胺菌接种至无菌鱼肉中4 ℃条件下贮藏,通过测定菌落总数和挥发性盐基氮(TVB-N)变化,以腐败代谢产物产量因子(YTVB-N/CFU)分析3种优势腐败产胺菌对鲣鱼的致腐能力,并通过样品中生物胺的含量比较3种优势腐败产胺菌的产胺能力。结果表明:在贮藏8 d后接种荧光假单胞菌、弗氏柠檬酸杆菌和嗜水气单胞菌组的菌落总数分别达到8.36、8.27和8.13 lg CFU/g,TVB-N值分别为28.21、30.30和31.29 mg/100 g,3种优势腐败产胺菌对鲣鱼的致腐能力大小为嗜水气单胞菌>弗氏柠檬酸杆菌>荧光假单胞菌。接种荧光假单胞菌组、弗式柠檬酸杆菌组和嗜水气单胞菌组的组胺含量分别为196.23、83.43和261.22 mg/kg,3组样品中总生物胺含量为嗜水气单胞菌>荧光假单胞菌>弗氏柠檬酸杆菌。综合比较得出,嗜水气单胞菌对4 ℃冷藏鲣鱼致腐产胺能力最强,本研究增加对冷藏鲣鱼中优势腐败产胺菌种类的了解并提供了部分理论基础。Abstract: In order to explore the types of dominant spoilage biogenic amine-producing bacteria in skipjack tuna, three dominant bacteria were screened from refrigerated skipjack tuna. The strains were identified by 16S rDNA molecular identification technology, which were Pseudomonas fluorescens, Citrobacter freundii and Aeromonas hydrophila. The dominant spoilage biogenic amine-producing bacteria were inoculated onto sterile fish and stored at 4 ℃. By measuring the total number of colonies and the value of volatile base nitrogen (TVB-N), we used the yield factor (YTVB-N/CFU) of spoilage metabolites to analyze the spoilage ability of the three dominant spoilage biogenic amine-producing bacteria. The production ability of bacteria was compared by detecting the content of biogenic amines in the samples. The results showed that the total number of colonies in the groups inoculated with P. fluorescens, C. freundii and A. hydrophila were 8.36, 8.27 and 8.13 lg CFU/g at the end of storage, respectively. The TVB-N values reached 28.21, 30.30 and 31.29 mg/100 g, respectively. The spoilage ability of the three dominant spoilage amine-producing bacteria were A. hydrophila>C. freundii>P. fluorescence. On the 8th day of storage, the histamine contents of the P. fluorescens, C. freundii and A. hydrophila groups reached 196.23, 83.43 and 261.22 mg/kg, respectively. The total biogenic amine contents of the three groups of samples at the end of storage were A. hydrophila>P. fluorescens>C. freundii. The combined comparison concluded that A. hydrophila had the highest spoilage biogenic amine-producing ability in skipjack tuna. This study increased the knowledge and provided a partial theoretical basis for the dominant spoilage biogenic amine producing species in refrigerated skipjack tuna.
-
鲣鱼(Katsuwonus pelamis)属于鲭科鲣属,主要分布在太平洋、印度洋、大西洋热带和亚热带海域,其营养价值丰富,常用来做成生鱼片、罐头、木鱼花等食品,畅销日本、欧洲等地[1]。鲣鱼肉质蛋白含量高,脂肪含量低,富含多不饱和脂肪酸,方便人体吸收和利用[2]。然而鲣鱼在运输、加工和贮藏过程中极易受到微生物的影响,引起腐败变质与生物胺的积累,使鲣鱼营养价值降低并影响其质量安全[3]。
鲣鱼腐败变质是一系列复杂的过程,其中微生物是引起鱼肉腐败变质的主要原因之一,部分微生物在水产品中生长占优势并可加速水产品腐败变质进程,这类微生物称为优势腐败菌[4]。优势腐败菌可以产生大量的腐败代谢产物,还可分解脂肪和蛋白质并产生难闻异味加速水产品腐败变质,其腐败活性较其他微生物强[5]。鱼类及鱼类制品中富含丰富的蛋白质,微生物产生的氨基酸脱羧酶可将鱼肉中游离的氨基酸转化为生物胺[6]。生物胺是一类含氮化合物,常存在于动植物体和食品中,同时生物胺具有稳定性,普通加热及冷冻等加工方式无法破坏分解[7]。据研究表明,人体摄入过量生物胺会引发呕吐、头疼、荨麻疹等过敏性中毒反应[8],国内外常有因摄入过量生物胺而导致中毒的案例,其中组胺的毒性最大,因此我国在GB 2733-2015《食品安全国家标准 鲜、冻动物性水产品》[9]中规定青皮红肉海水鱼的组胺含量不得超过400 mg/kg,而其他海水鱼类则不超过200 mg/kg。Jskelinen等[10]研究发现,在冷藏鲑鱼中的优势腐败菌是发光杆菌属,假单胞菌属是黄鳍金枪鱼的优势腐败菌。Lakshmanan等[11]研究了冷藏鱼虾中产胺菌的生成情况,结果发现气单胞菌属和假单胞菌属是鱼虾的主要产胺菌。Kuley等[12]的研究发现,柠檬酸杆菌不仅可使鱼腐败变质还可产生生物胺。鱼肉中由于腐败菌和产胺菌的存在,不仅会降低鱼本身营养价值还会对消费者身体健康造成危害。
针对以上问题,本研究筛选并探究鲣鱼中的优势腐败产胺菌,实验采用普通平板计数琼脂培养基与改良的Niven’s生物胺筛选培养基对低温贮藏的鲣鱼进行优势腐败产胺菌的筛选,并利用16S rDNA分子技术对菌株进行鉴定并构建系统发育树。将分离得到的3株优势腐败产胺菌接回无菌鱼肉中并在4 ℃下贮藏,对比实验组的菌落总数、TVB-N值和生物胺含量,同时对腐败代谢产物产量因子YTVB-N/CFU进行计算,比较3株菌的致腐产胺能力。本研究通过比较鲣鱼中优势菌株的致腐产胺能力,为把控鲣鱼贮藏加工流通过程中的品质保证提供理论数据支撑。
1. 材料与方法
1.1 材料与仪器
鲣鱼 广州市沣洋食品有限公司,4 ℃低温冷藏条件下运回实验室;水浸鲣鱼罐头 日本Hagoromo公司,水浸鲣鱼罐头在加工过程中经过高温灭菌处理,为无菌状态;平板计数琼脂培养基(plate count agar, PCA)、胰蛋白胨大豆琼脂培养基(trypticase soy agar, TSA)、胰蛋白胨大豆肉汤培养基(tryp-ticase soy broth,TSB) 广东环凯微生物科技有限公司;细菌基因组提取试剂盒 天根生化科技有限公司;PCR产物磁珠法纯化试剂盒 上海硕美生物科技有限公司;琼脂糖 厦门太阳马生物工程有限公司;乙腈、甲酸、二氯甲烷 麦克林生化科技公司;0.22 μm一次性针头过滤器 上海阿拉丁生化科技股份有限公司;7 种生物胺的标准品(组胺、尸胺、腐胺、酪胺、色胺、苯乙胺和1,7-二氨基庚烷,纯度≥98%) 美国Sigma-Aldrich公司;改良的Niven’s生物胺筛选培养基(1 L):准确称取5 g蛋白胨、5 g酵母粉、质量分数各0.2%游离氨基酸(L-组氨酸、色氨酸、酪氨酸、精氨酸、L-鸟氨酸盐酸盐、L-苯丙氨酸和赖氨酸)、20 g琼脂 广东环凯微生物科技有限公司;5 g氯化钠、1 g碳酸钙 麦克林生化科技公司;0.06 g溴甲酚紫 上海源叶生物科技有限公司;使用1 mol/L盐酸调pH至5.1,121 ℃高压灭菌15 min。
SQ510C立式压力蒸汽灭菌器 日本Yamato公司;SPX智能型生化培养箱 宁波江南仪器厂;IN612C低温培养箱 日本Yamato公司;CEBO-24高通量组织研磨仪 上海测博生物有限公司;TDZ5-WS离心机 长沙湘仪仪器有限公司;DYY-8C电泳仪 北京六一仪器厂;9700 PCR仪、3730XL 测序仪 美国应用生物系统公司;TQ-S Micro超高效液相色谱串联质谱仪 美国Waters公司;Milli-Q纯水系统 美国Millipore公司;KjeltecTM 2300全自动凯氏定氮仪 丹麦福斯集团公司。
1.2 实验方法
1.2.1 鲣鱼优势腐败产胺菌的筛选
称取25 g冷藏鲣鱼肉,加入225 mL无菌生理盐水,拍打混合均匀后取1 mL液体,用0.1 mol/L磷酸盐缓冲液进行梯度稀释,吸取1 mL稀释液涂布于PCA培养基上,25 ℃恒温培养24 h,挑取不同单菌落,分离纯化2~3代,将菌株接种在Niven’s生物胺筛选培养基上,选取颜色变化明显的菌株,分离纯化2~3代,25 ℃培养24 h后放于4 ℃冰箱备用[13]。
1.2.2 菌株的鉴定与系统发育树的构建
提取基因组DNA对细菌进行16S扩增,以27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492(5′-TACGGCTACCTTGTTACGACTT-3′)作为引物进行扩增目的基因,PCR扩增:96 ℃预变性5 min,96 ℃持续变性20 s,45 ℃退火20 s,72 ℃延伸30 s,进行35个循环,最后72 ℃延伸10 min。扩增后的产物进行1.0%琼脂糖凝胶检测,观察条带性状,最后将纯化后PCR产物测序,测序结果进行NCBI-BLAST比对,选取数株同源性较高的菌株,使用MEGA 5软件构建鲣鱼优势腐败菌的系统发育树。
1.2.3 优势腐败产胺菌致腐能力的分析
1.2.3.1 菌悬液的制备与菌株的接种
从纯化后的平板上挑取菌落接到TSB中,25 ℃培养18~20 h。将电子秤、无菌称量皿和称量勺等工具放于超净台中紫外灭菌30 min以上,在无菌操作台中称取100 g鲣鱼肉放于无菌袋中,分别接荧光假单胞菌、弗氏柠檬酸杆菌和嗜水气单胞菌鱼肉中,在无菌操作台中封好无菌袋4 ℃下贮藏,空白实验组是未接种菌株的无菌鱼肉,每天进行取样测定实验组的菌落总数、TVB-N值和生物胺含量。
1.2.3.2 腐败菌生长情况的测定
称取5 g鱼肉于45 mL生理盐水中,拍打混合均匀后吸取100 μL均质样液,使用0.1 mol/L磷酸盐缓冲液进行逐级稀释,稀释后的菌液涂布于TSA上,25 ℃培养48 h后计数。
1.2.3.3 TVB-N的测定
参照GB 5009.228-2016《食品安全国家标准—食品中挥发性盐基氮的测定》[14],使用凯氏定氮法对样品进行TVB-N值测定。
1.2.3.4 腐败菌腐败能力的分析
参照许振伟等[15]的方法中腐败代谢产物产量因子YTVB-N/CFU的计算公式:
YTVB−N/CFU=(TVB−N)i−(TVB−N)0Ni−N0 式中:(TVB-N)0、(TVB-N)i—初始点、贮藏期终点的TVB-N值(mg N/100 g);N0、Ni—初始点、贮藏期终点的菌落数(CFU/g)。
1.2.4 优势腐败产胺菌产胺能力的分析
称取2 g鱼肉于50 mL离心管中并放入2颗钢球,加入5 mL 0.2%酸化乙腈和100 μL内标液(1,7-二氨基庚烷)混合均匀,研磨10 min后,以4000 r/min转速离心10 min,取上清液,重复以上操作,收集上清液定容至10 mL后进行氮吹,加入1 mL复溶液和3 mL二氯甲烷,涡旋1 min后以10000 r/min转速离心10 min,取上清液过0.22 μm的滤膜,用超高效液相色谱串联质谱仪检测生物胺,并使用1,7-二氨基庚烷作为内标物质计算生物胺含量[16]。
1.3 数据处理
使用MEGA 11软件(MEGA有限公司)构建系统发育树,数据处理结果均以“平均值±标准偏差”表示,数据统计分析使用IBM SPSS Statistics 25软件,采用Microsoft Office Excel 2019软件处理实验数据,使用Origin 2021软件绘图。
2. 结果与分析
2.1 16S rDNA分析结果
从PCA和Niven’s生物胺筛选培养基中挑取颜色变化较为明显的单菌落,随机分离筛选出8株菌,将筛选出的菌株分别编号为T1、T2、T3、T4、T5、T6、T7和T8,对这8株菌进行16S全长序列PCR扩增,利用1.0%的琼脂糖凝胶电泳,检测16S rDNA扩增产物,电泳图谱见图1。由图可知,扩增后的8株菌在1000和2000 bp之间出现清晰的荧光条带,并且无拖尾现象,可用于后续测序使用。
2.2 菌株的鉴定与系统发育树的构建
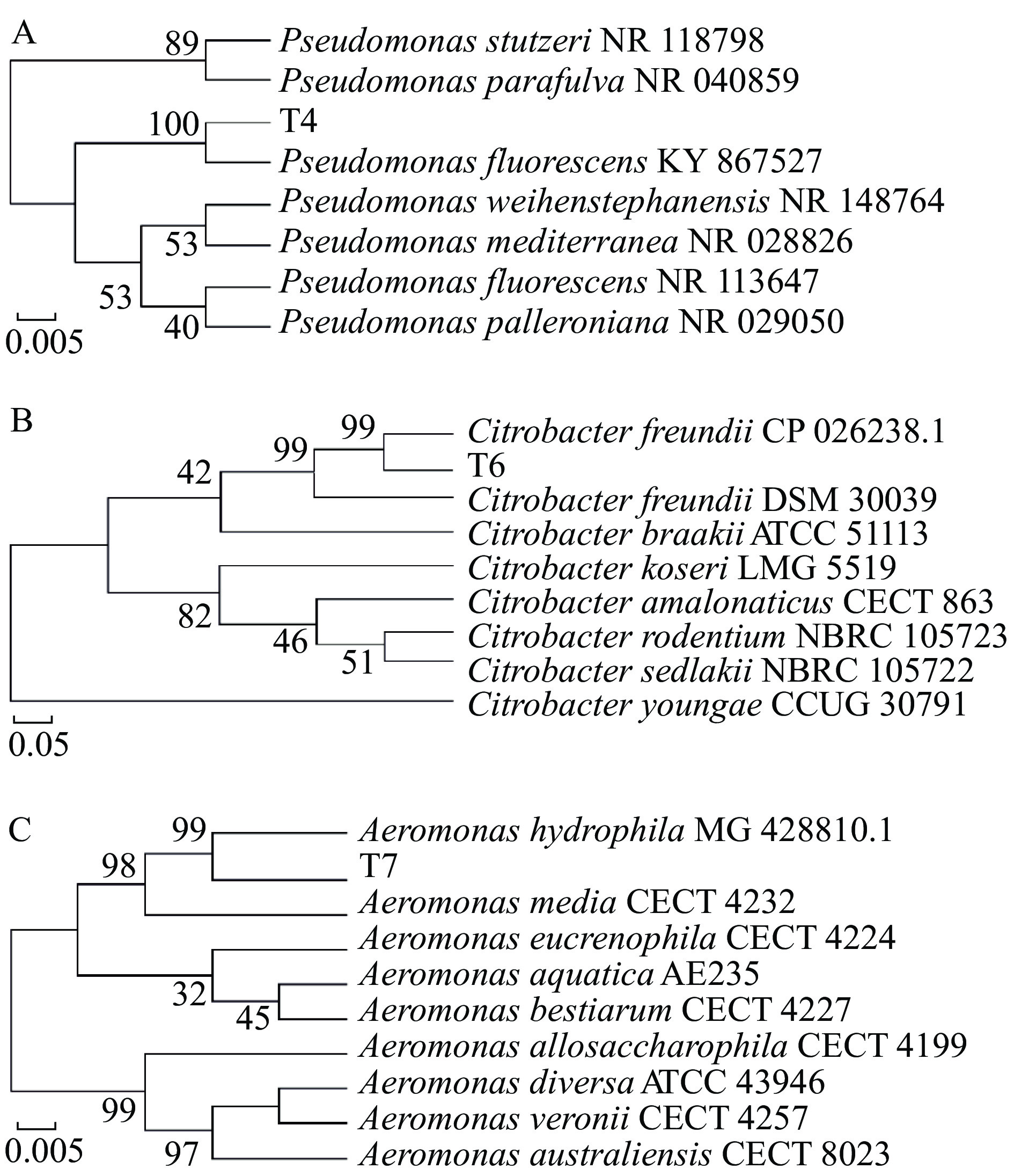
考虑到优势腐败产胺菌在冷藏鲣鱼中仍会生长繁殖,因此预实验把8株菌放于4 ℃培养箱中观察其生长变化,最后发现有3株菌具有嗜冷性,这3株菌的编号分别为T4、T6和T7,将3株菌扩增后的16S rDNA序列与NCBI数据库进行比对后,将3株菌的测序结果用MEGA 11软件构建成系统发育树,如图2所示,发育树显示T4属于假单胞菌属,且与荧光假单胞菌亲源关系最近相似性为100%,T6属于柠檬酸杆菌属且弗式柠檬酸杆菌相似性达99%,T7属于气单胞菌属与嗜水气单胞菌亲源关系最近,其相似性为99%。假单胞菌是食品中常见的嗜冷性致腐菌,Xie等[17]研究了荧光假单胞菌对鲑鱼的致腐能力分析,研究表明荧光假单胞菌会导致鲑鱼中腐败产物累积。弗式柠檬酸杆菌也被证实是一种致病致腐的有害微生物[18],聂芳红等[19]发现冻罗非鱼片大肠菌群主要为弗氏柠檬酸杆菌。嗜水气单胞菌是一种食源性病原体,经研究证实嗜水气单胞菌会对人类健康造成危害[20],Bo等[21]研究发现海产品中致腐和致病性革兰氏阴性菌主要有嗜水气单胞菌、鲍曼不动杆菌、假单胞菌和肠杆菌等26种菌。据系统发育树可看出实验最终筛选出来的3株菌分别是荧光假单胞菌、弗式柠檬酸杆菌和嗜水气单胞菌,这3株菌均为革兰氏阴性菌,能够在低温下可继续生长,是水产品常见的腐败菌。
2.3 鲣鱼优势腐败产胺菌致腐能力的分析
2.3.1 菌落总数变化分析
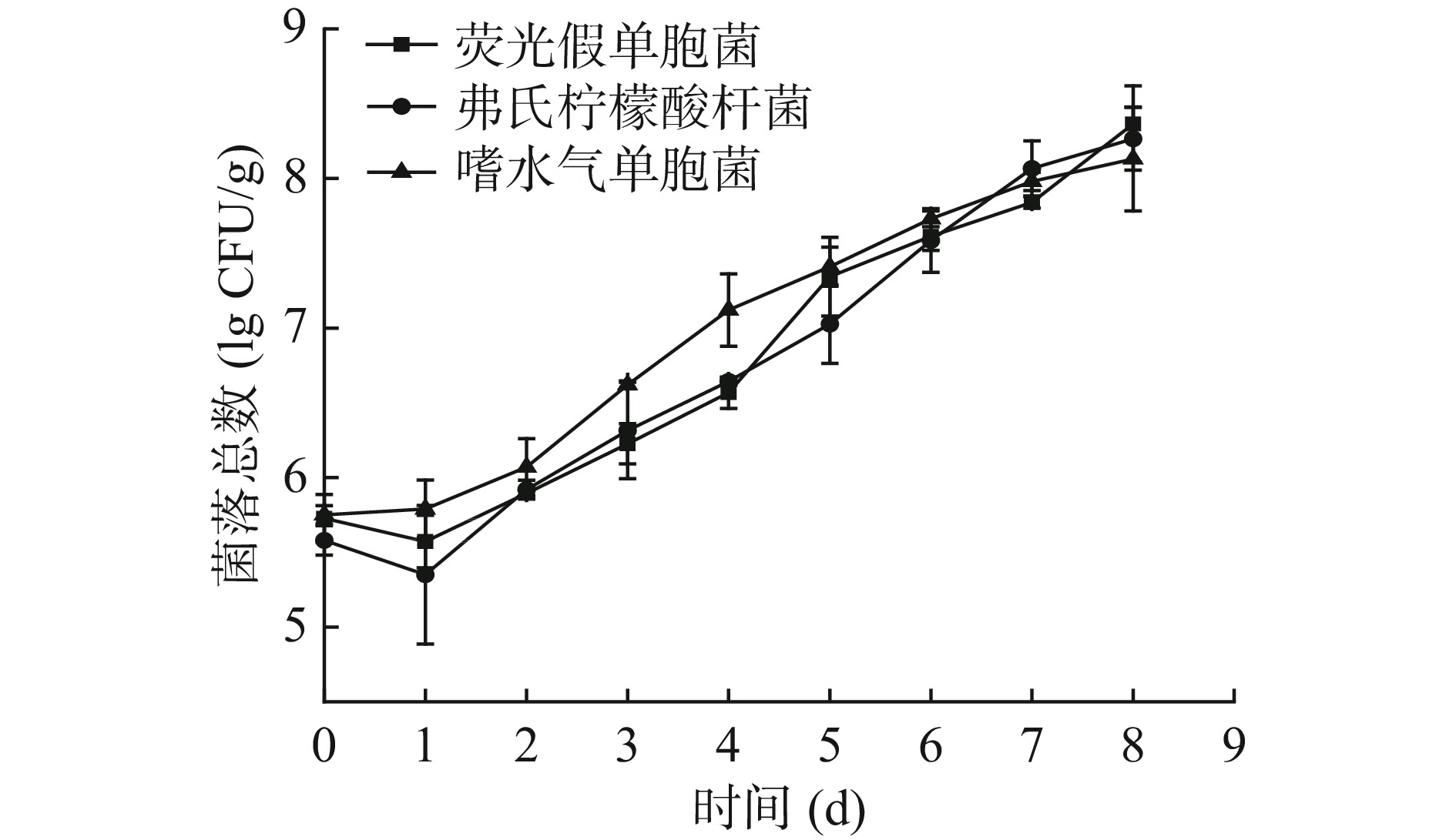
微生物生长繁殖是引起鲣鱼腐败变质的主要原因,使用优势腐败菌在鱼肉中的生长情况可作为衡量菌株致腐能力的指标之一。3组接种优势腐败产胺菌的菌落总数变化如图3所示,接种荧光假单胞菌、弗氏柠檬酸杆菌和嗜水气单胞菌的初始菌落总数分别为5.73、5.58 lg CFU/g和5.75 lg CFU/g,由于空白对照组是未接入任何菌的无菌鱼肉,其菌落总数值为0。在4 ℃贮藏期间,优势腐败菌利用鱼肉中的营养物质生长繁殖,随着氧气和营养成分的消耗,会造成腐败代谢产物的累积。从图中可看出,随着贮藏时间的增加,3组接种优势腐败产胺菌的菌落总数值也逐渐增加,说明这3株菌在4 ℃的贮藏条件下在鱼肉中仍可生长并对其造成影响。在贮藏前5 d中,接种嗜水气单胞菌组的生长情况比接种荧光假单胞菌组和弗式柠檬酸杆菌组生长较快,在贮藏期后期3组菌的菌落总数值相差不大。在第8 d贮藏结束时,接种荧光假单胞菌、弗氏柠檬酸杆菌和嗜水气单胞菌组的菌落总数分别增长到8.36、8.27和8.13 lg CFU/g,结果表明3株优势腐败产胺菌在冷藏鲣鱼中的生长状况良好。
2.3.2 TVB-N值的变化分析
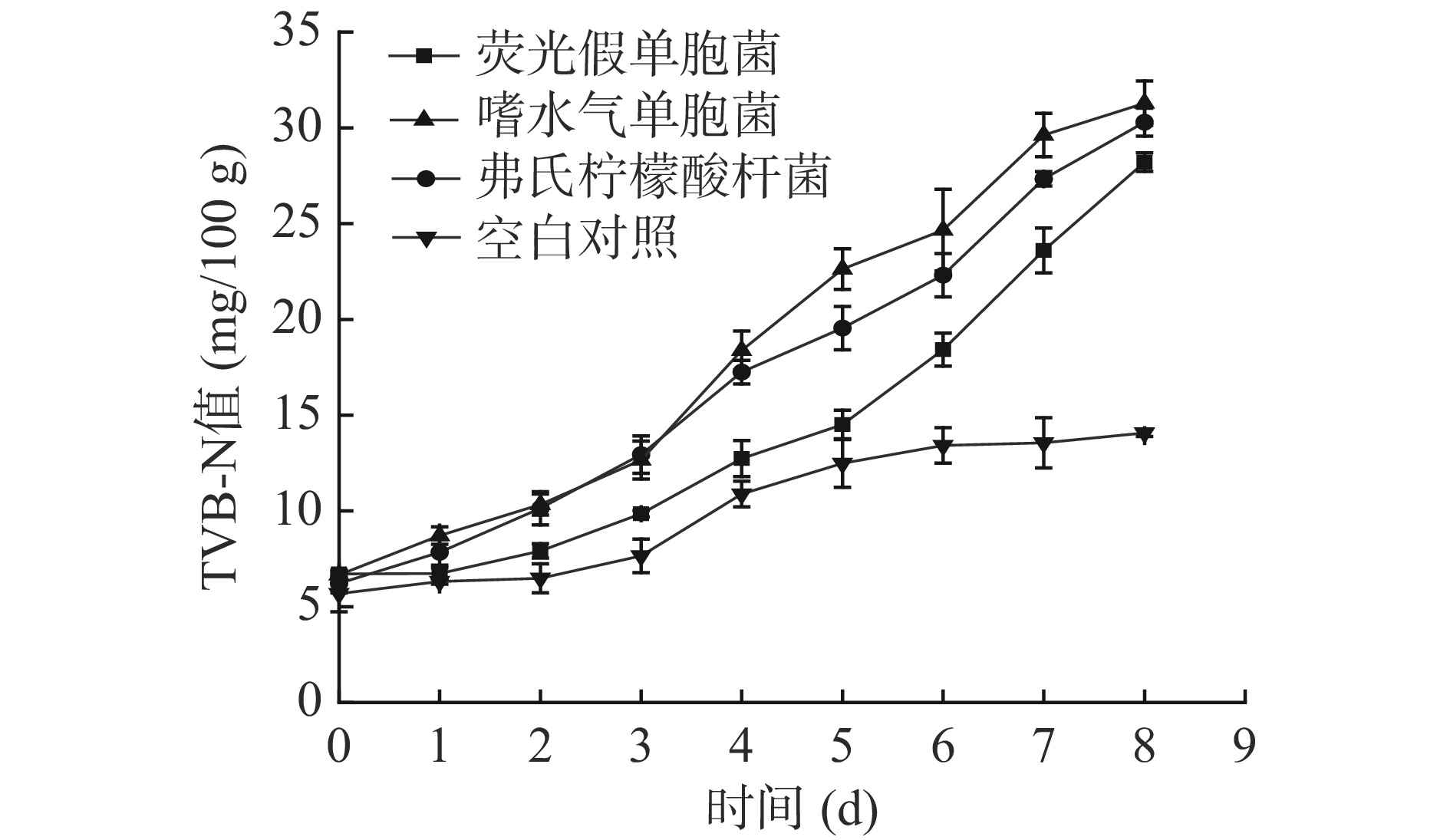
TVB-N是评价水产品新鲜程度的一个重要指标,在水产品贮藏期间,其体内蛋白质等含氮物质在微生物和酶的作用下,分解成胺和氨类等盐基氮类物质,TVB-N值越高,代表鱼肉中蛋白质降解程度越严重[22]。由图4可知,接种3组优势腐败产胺菌的TVB-N值在鲣鱼贮藏期间逐渐增加,在贮藏初期,接种荧光加单胞菌组、弗式柠檬酸杆菌组和嗜水气单胞菌组的TVB-N值分别为6.71、6.22和6.67 mg/100 g。空白对照组的TVB-N值也随着贮藏时间的增加,有小幅度的增长,可能是鱼肉在无菌袋中进行了氧化分解,但和另外3组实验组相比值很低。从图中看出,接种嗜水气单胞菌组的TVB-N值在3组样品中增长最快,这可能是因为在贮藏前期嗜水气单胞菌的菌落总数增长较快,使得其TVB-N值也相对较高。GB/T 18108-2019《鲜海水鱼通则》[23]中规定海产品中的TVB-N值≤30 mg/100 g,接种弗式柠檬酸杆菌组和嗜水气单胞菌组在贮藏结束时TVB-N值分别达到了30.30和31.29 mg/100 g,2组TVB-N值均超过了国标限量,接种荧光假单胞菌组TVB-N值最终达到28.21 mg/100 g,结果表明嗜水气单胞菌在鲣鱼中TVB-N的产量大于弗氏柠檬酸杆菌和荧光假单胞菌。Wang等[24]在嗜水气单胞菌、杰氏假单胞菌和腐败希瓦氏菌对无菌草鱼片的致腐能力研究中发现嗜水气单胞菌产生的TVB-N值最高。嗜水气单胞菌是水产品中常见的人-兽-鱼共患的致病菌,对水产业造成了较大的经济损失[25],由实验研究可得出,嗜水气单胞菌对鲣鱼还具有一定的致腐性,可以加快鱼肉的腐败变质过程。
2.3.3 腐败代谢产物产量因子的分析
腐败代谢物产量因子YTVB-N/CFU即货架期终点时单位数量腐败菌产生的腐败代谢产物量[26],不同的腐败菌生长和代谢情况不同,结合菌落总数和TVB-N值计算出YTVB-N/CFU可对优势腐败菌的致腐能力进行综合比较。许多研究者使用YTVB-N/CFU值来比较腐败菌的致腐能力,于淑池等[27]比较冷藏卵形鲳鲹优势腐败菌的致腐能力,Xie等[17]比较荧光假单胞菌在不同温度下对鲑鱼致腐能力的强弱。本实验以YTVB-N/CFU为鲣鱼中优势腐败产胺菌的致腐能力评价指标,结果如表1所示。接种3组优势腐败产胺菌中嗜水气单胞菌组的YTVB-N/CFU是最高,为1.48×10−7 mg/CFU,其次是弗氏柠檬酸杆菌组和荧光假单胞菌组,YTVB-N/CFU值分别为1.20×10−7 mg/CFU和8.39×10−8 mg/CFU,嗜水气单胞菌组YTVB-N/CFU值是荧光假单胞菌组的1.76倍,是弗式柠檬酸杆菌组的1.23倍,由表中计算结果可得优势腐败产胺菌对鲣鱼的致腐能力为嗜水气单胞菌>弗氏柠檬酸杆菌>荧光假单胞菌。
表 1 鲣鱼接种3种优势腐败产胺菌致腐因子的比较Table 1. Comparison of yield factors in skipjack tuna inoculated with 3 dominant spoilage biogenic amine-producing bacteria菌名 菌落总数(CFU/g) 腐败代谢产物含量(mg N/100 g) 腐败代谢产物产量因子(mg/CFU) N0 Ni (TVB-N)0 (TVB-N)i YTVB-N/CFU 荧光假单胞菌 5.57×105 2.60×108 6.71 28.21 8.39×10−8 弗氏柠檬酸杆菌 3.87×105 2.00×108 6.22 30.30 1.20×10−7 嗜水气单胞菌 5.63×105 1.7×108 6.67 31.29 1.48×10−7 2.4 鲣鱼优势腐败产胺菌产胺能力的分析
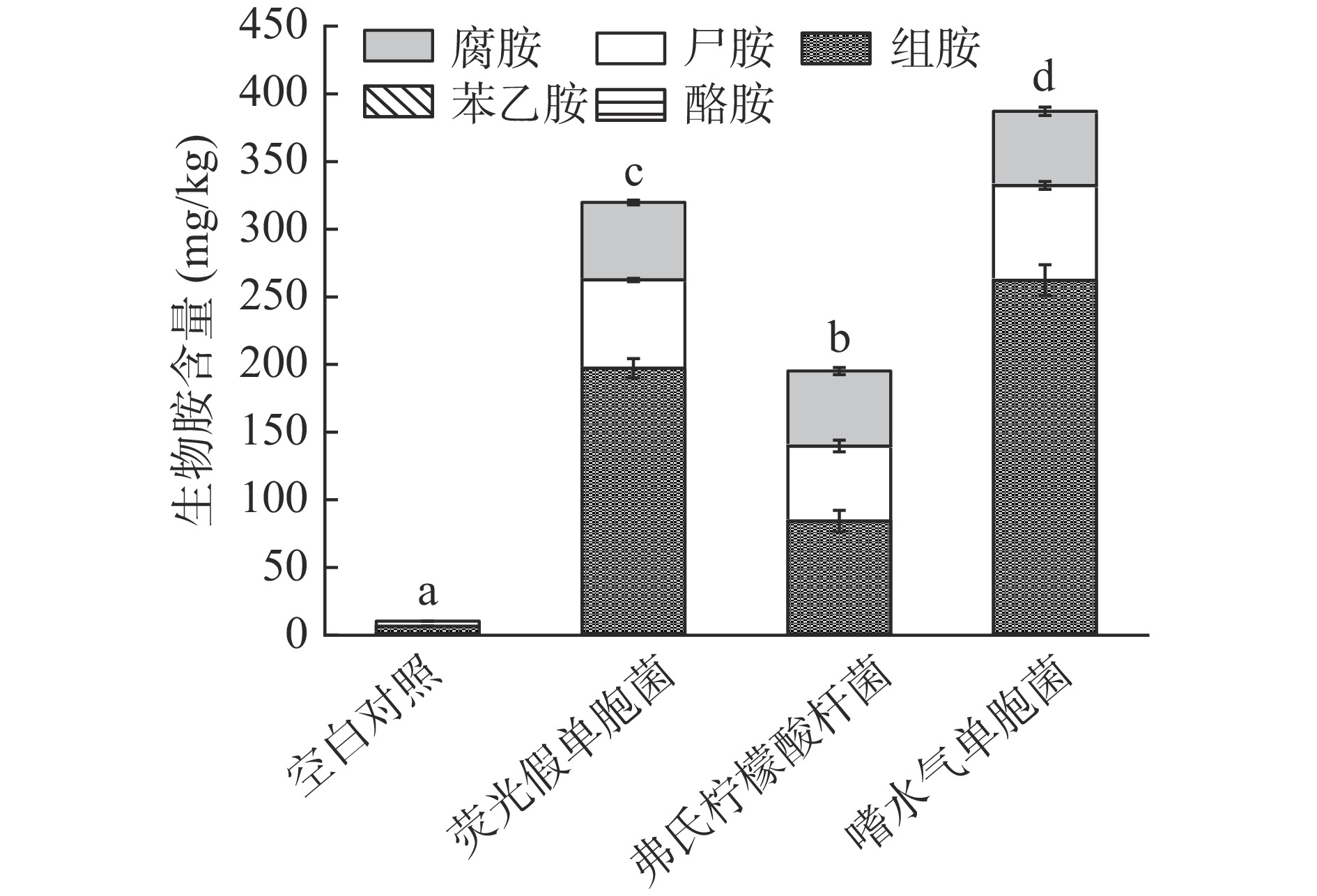
鲣鱼含有丰富的营养物质,适合优势腐败产胺菌快速生长繁殖,在产胺菌和氨基酸脱羧酶的共同作用下造成生物胺积累[28],鱼肉中游离的组氨酸、鸟氨酸和赖氨酸会脱羧形成组胺、尸胺和腐胺,通常可以用生物胺含量来衡量鱼类产品的质量安全及其腐败程度[29]。本实验使用超高效液相色谱串联质谱的方法检测实验组生物胺的含量,结果如表2所示。由表可知,3组接菌样品的组胺、尸胺和腐胺含量随着贮藏时间显著增加(P<0.05),接种嗜水气单胞菌的组胺含量上升最快,在贮藏结束时,组胺含量达到261.22 mg/kg,其次是荧光假单胞菌组,贮藏结束时其组胺含量为196.23 mg/kg。贮藏结束时,接种荧光假单胞菌组、弗氏柠檬酸杆菌组和嗜水气单胞菌组的尸胺含量分别为65.35、55.49和69.99 mg/kg,腐胺的含量也分别达到57.22、55.39和54.81 mg/kg。将4组样品的总生物胺含量进行汇总,结果如图5所示,由图中可明显看出接种嗜水气单胞菌组的总生物胺含量最高,其次是荧光假单胞菌组,最后是弗式柠檬酸杆菌组,由于酪胺和苯乙胺的含量相对较少,在图中无法明显看出。由生物胺检测结果综合比较来看,在鲣鱼中嗜水气单胞菌的产胺能力强于荧光假单胞菌和弗氏柠檬酸杆菌。组胺是红肉鱼中常见的生物胺,并且影响鱼肉质量与安全,Kim等[30]研究发现从太平洋鲭鱼中分离出的假单胞菌、发光菌、气单胞菌3种产胺菌均能在冷藏温度生长并生成组胺,说明许多产胺菌在低温条件下仍能生长。尸胺和腐胺常见于腐败水产品中,虽然毒性较组胺低,但也会对人体造成一系列不良反应并且同时可增强组胺的毒性,尸胺与腐胺与鱼肉腐败密切相关,通常情况下鱼肉腐败程度越高其生物胺的含量越高,说明优势腐败产胺菌的致腐能力和产胺能力可能也存在相关性。
表 2 鲣鱼接种3种优势腐败产胺菌的生物胺含量Table 2. Biogenic amines content of 3 dominant spoilage biogenic amine-producing bacteria inoculated to skipjack tuna菌株 时间(d) 生物胺含量 (mg/kg) 色胺 酪胺 苯乙胺 组胺 尸胺 腐胺 空白对照 0 ND ND 0.28±0.02d 0.67±0.01a 1.95±0.15a ND 1 ND ND 0.23±0.00c 0.88±0.00a 2.44±0.16b ND 2 ND ND 0.24±0.00c 0.86±0.00a 3.16±0.17c ND 3 ND ND 0.19±0.00c 1.57±0.01b 5.11±0.27f ND 4 ND ND 0.17±0.01a 1.79±0.06bc 5.49±0.04f ND 5 ND ND 0.18±0.02ab 1.99±0.23c 4.65±0.02e ND 6 ND ND 0.17±0.00a 2.13±0.26d 4.43±0.29e ND 7 ND 0.43±0.34a 0.23±0.00c 3.35±0.10e 3.52±0.41cd ND 8 ND 0.74±0.02b 0.49±0.01e 5.40±0.13f 3.74±0.20d ND 荧光假单胞菌 0 ND ND 0.28±0.04c 7.53±0.42a 2.65±0.27a ND 1 ND ND 0.25±0.03c 9.31±1.16a 4.46±0.40a 0.21±0.09a 2 ND ND 0.18±0.05ab 5.68±1.06a 4.77±0.65a 5.73±0.95b 3 ND ND 0.23±0.03bc 17.95±0.96ab 5.27±0.24a 10.29±1.12c 4 ND ND 0.16±0.02a 27.50±1.59b 23.50±2.42b 16.95±1.38d 5 ND ND 0.16±0.04a 45.58±3.82c 33.72±2.60c 26.46±3.28e 6 ND 0.48±0.18a 0.17±0.01a 76.99±0.57d 45.43±4.36d 33.10±0.32f 7 ND 0.75±0.06c 0.26±0.02c 138.83±4.88e 54.34±0.59e 45.89±1.36g 8 ND 0.69±0.16b 0.27±0.02c 196.23±7.21f 65.35±1.21f 57.22±1.71h 弗氏柠檬酸杆菌 0 ND ND 0.24±0.01bcd 8.26±0.76a 3.11±0.22a ND 1 ND ND 0.24±0.03bcd 9.22±0.59a 5.60±0.33a 0.30±0.22a 2 ND ND 0.15±0.02ab 5.94±0.70a 11.02±0.84b 3.34±0.99ab 3 ND ND 0.27±0.12d 14.08±0.62a 15.74±3.12c 8.67±0.86b 4 ND ND 0.16±0.02abc 18.27±4.86ab 20.60±2.68d 18.45±1.27c 5 ND ND 0.14±0.02a 28.71±1.63bc 28.69±3.41e 26.26±6.18d 6 ND 0.49±0.03b 0.16±0.02abc 38.10±6.54c 39.71±1.53f 38.33±3.94e 7 ND 0.28±0.47a 0.24±0.01bcd 50.67±2.66d 43.93±3.52g 45.45±0.93f 8 ND 0.61±0.28c 0.25±0.03cd 83.43±7.92e 55.49±4.24h 55.39±2.65g 嗜水气单胞菌 0 ND ND 0.24±0.03ab 8.98±0.58a 3.80±0.37a ND 1 ND ND 0.22±0.02ab 14.50±1.62a 5.60±0.22a 0.30±0.09a 2 ND ND 0.14±0.04a 36.74±3.59b 13.50±2.68b 4.67±0.33b 3 ND ND 0.20±0.01ab 53.12±1.67c 19.58±3.09c 8.34±1.07c 4 ND ND 0.26±0.05bc 71.69±6.00d 28.58±0.37d 13.40±2.81d 5 ND ND 0.34±0.04c 107.84±2.96e 35.21±2.22e 22.63±2.63e 6 ND ND 0.63±0.12d 149.78±4.97f 45.48±1.96f 32.13±1.08f 7 ND ND 0.78±0.07e 204.29±7.48g 58.76±2.00g 45.84±3.69g 8 ND 0.25±0.04 0.86±0.04e 261.22±11.42h 69.99±2.83h 54.81±3.01h 注:ND表示未检出,同列不同小写字母表示同一组别不同贮藏时间之间存在显著性差异(P<0.05)。 3. 结论
本实验使用PCA和Niven’s生物胺筛选培养基筛选鲣鱼中优势腐败产胺菌,研究筛选到8株菌,经过预实验最终挑选出3株优势腐败产胺菌,通过16S rDNA鉴定结果显示3株菌分别是荧光假单胞菌、弗氏柠檬酸杆菌和嗜水气单胞菌。将3株菌接种到无菌鲣鱼罐头中,分析比较4 ℃下优势腐败产胺菌对鲣鱼的致腐能力和产胺能力。通过测定菌落总数、TVB-N值和计算比较YTVB-N/CFU得出,嗜水气单胞菌对鲣鱼的致腐能力强于弗氏柠檬酸杆菌和荧光假单胞菌,通过检测不同接菌样品的生物胺含量显示嗜水气单胞菌在鲣鱼中产胺能力最强,综合分析比较可得,嗜水气单胞菌对鲣鱼的致腐产胺能力大于弗氏柠檬酸杆菌和荧光假单胞菌。本研究进一步了解鲣鱼中优势腐败产胺菌,并分析比较出对鲣鱼品质影响最大的是嗜水气单胞菌,为比较鲣鱼中优势腐败产胺菌的致腐产胺能力提供数据理论依据。
-
表 1 鲣鱼接种3种优势腐败产胺菌致腐因子的比较
Table 1 Comparison of yield factors in skipjack tuna inoculated with 3 dominant spoilage biogenic amine-producing bacteria
菌名 菌落总数(CFU/g) 腐败代谢产物含量(mg N/100 g) 腐败代谢产物产量因子(mg/CFU) N0 Ni (TVB-N)0 (TVB-N)i YTVB-N/CFU 荧光假单胞菌 5.57×105 2.60×108 6.71 28.21 8.39×10−8 弗氏柠檬酸杆菌 3.87×105 2.00×108 6.22 30.30 1.20×10−7 嗜水气单胞菌 5.63×105 1.7×108 6.67 31.29 1.48×10−7 表 2 鲣鱼接种3种优势腐败产胺菌的生物胺含量
Table 2 Biogenic amines content of 3 dominant spoilage biogenic amine-producing bacteria inoculated to skipjack tuna
菌株 时间(d) 生物胺含量 (mg/kg) 色胺 酪胺 苯乙胺 组胺 尸胺 腐胺 空白对照 0 ND ND 0.28±0.02d 0.67±0.01a 1.95±0.15a ND 1 ND ND 0.23±0.00c 0.88±0.00a 2.44±0.16b ND 2 ND ND 0.24±0.00c 0.86±0.00a 3.16±0.17c ND 3 ND ND 0.19±0.00c 1.57±0.01b 5.11±0.27f ND 4 ND ND 0.17±0.01a 1.79±0.06bc 5.49±0.04f ND 5 ND ND 0.18±0.02ab 1.99±0.23c 4.65±0.02e ND 6 ND ND 0.17±0.00a 2.13±0.26d 4.43±0.29e ND 7 ND 0.43±0.34a 0.23±0.00c 3.35±0.10e 3.52±0.41cd ND 8 ND 0.74±0.02b 0.49±0.01e 5.40±0.13f 3.74±0.20d ND 荧光假单胞菌 0 ND ND 0.28±0.04c 7.53±0.42a 2.65±0.27a ND 1 ND ND 0.25±0.03c 9.31±1.16a 4.46±0.40a 0.21±0.09a 2 ND ND 0.18±0.05ab 5.68±1.06a 4.77±0.65a 5.73±0.95b 3 ND ND 0.23±0.03bc 17.95±0.96ab 5.27±0.24a 10.29±1.12c 4 ND ND 0.16±0.02a 27.50±1.59b 23.50±2.42b 16.95±1.38d 5 ND ND 0.16±0.04a 45.58±3.82c 33.72±2.60c 26.46±3.28e 6 ND 0.48±0.18a 0.17±0.01a 76.99±0.57d 45.43±4.36d 33.10±0.32f 7 ND 0.75±0.06c 0.26±0.02c 138.83±4.88e 54.34±0.59e 45.89±1.36g 8 ND 0.69±0.16b 0.27±0.02c 196.23±7.21f 65.35±1.21f 57.22±1.71h 弗氏柠檬酸杆菌 0 ND ND 0.24±0.01bcd 8.26±0.76a 3.11±0.22a ND 1 ND ND 0.24±0.03bcd 9.22±0.59a 5.60±0.33a 0.30±0.22a 2 ND ND 0.15±0.02ab 5.94±0.70a 11.02±0.84b 3.34±0.99ab 3 ND ND 0.27±0.12d 14.08±0.62a 15.74±3.12c 8.67±0.86b 4 ND ND 0.16±0.02abc 18.27±4.86ab 20.60±2.68d 18.45±1.27c 5 ND ND 0.14±0.02a 28.71±1.63bc 28.69±3.41e 26.26±6.18d 6 ND 0.49±0.03b 0.16±0.02abc 38.10±6.54c 39.71±1.53f 38.33±3.94e 7 ND 0.28±0.47a 0.24±0.01bcd 50.67±2.66d 43.93±3.52g 45.45±0.93f 8 ND 0.61±0.28c 0.25±0.03cd 83.43±7.92e 55.49±4.24h 55.39±2.65g 嗜水气单胞菌 0 ND ND 0.24±0.03ab 8.98±0.58a 3.80±0.37a ND 1 ND ND 0.22±0.02ab 14.50±1.62a 5.60±0.22a 0.30±0.09a 2 ND ND 0.14±0.04a 36.74±3.59b 13.50±2.68b 4.67±0.33b 3 ND ND 0.20±0.01ab 53.12±1.67c 19.58±3.09c 8.34±1.07c 4 ND ND 0.26±0.05bc 71.69±6.00d 28.58±0.37d 13.40±2.81d 5 ND ND 0.34±0.04c 107.84±2.96e 35.21±2.22e 22.63±2.63e 6 ND ND 0.63±0.12d 149.78±4.97f 45.48±1.96f 32.13±1.08f 7 ND ND 0.78±0.07e 204.29±7.48g 58.76±2.00g 45.84±3.69g 8 ND 0.25±0.04 0.86±0.04e 261.22±11.42h 69.99±2.83h 54.81±3.01h 注:ND表示未检出,同列不同小写字母表示同一组别不同贮藏时间之间存在显著性差异(P<0.05)。 -
[1] 童铃, 金毅, 徐坤华, 等. 3种鲣鱼背部肌肉的营养成分分析及评价[J]. 南方水产科学,2014,10(5):51−59. [TONG L, JIN Y, XU K H, et al. Analysis of nutritional components in back muscle of skipjacks[J]. South China Fisheries Science,2014,10(5):51−59. doi: 10.3969/j.issn.2095-0780.2014.05.008 [2] 李海波, 杨雪, 白冬, 等. 鲣鱼 (Katsuwonus pelamis) 肌肉蛋白在热处理过程中的营养变化及功能性评价[J]. 海洋与湖沼,2017,48(1):155−160. [LI H B, YANG X, BAI D, et al. The nutrinent content and evaluation of skipjack's back muscle before and after poached[J]. Oceanologia Et Limnologia Sinica,2017,48(1):155−160. [3] 刘爱芳, 谢晶, 钱韻芳. 冷藏金枪鱼优势腐败菌致腐败能力[J]. 食品科学,2018,39(3):7−14. [LIU A F, XIE J, QIAN Y F. Spoilage potential of dominant spoilage bacteria from chilled tuna (Thunnus obesus)[J]. Food Science,2018,39(3):7−14. doi: 10.7506/spkx1002-6630-201803002 [4] 励建荣, 杨兵, 李婷婷. 水产品优势腐败菌及其群体感应系统研究进展[J]. 食品科学,2015,36(19):5. [LI J R, YANG B, LI T T. Advances in quorum sensing of dominant spoilage bacteria from aquatic products[J]. Food Science,2015,36(19):5. [5] 冯豪杰, 蓝蔚青, 臧一宇, 等. 优势腐败菌对暗纹东方鲀冷藏期间品质变化影响及致腐能力分析[J]. 食品科学,2022,43(1):1191−1197. [FENG H J, LAN W Q, ZANG Y Y, et al. Effects of dominant spoilage bacteria on quality change in obscure pufferfish (Takifugu obscurus) during cold storage and analysis of their spoilage ability[J]. Food Science,2022,43(1):1191−1197. doi: 10.7506/spkx1002-6630-20210131-363 [6] 刘光明, 梁一巍, 李传勇, 等. 海洋中上层鱼类产品中生物胺的调查与控制[J]. 中国食品学报,2019,19(8):1−12. [LIU G M, LIANG Y W, LI C Y, et al. Investigation and control of biogenic amines in marine pelagic fishes products[J]. Journal of Chinese Institute of Food Science and Technology,2019,19(8):1−12. [7] HOUICHER A, BENSID A, REGENSTEIN J M, et al. Control of biogenic amine production and bacterial growth in fish and seafood products using phytochemicals as biopreservatives: A review[J]. Food Bioscience,2020,39(2):100807.
[8] ZOGUL F, HAMED I. The importance of lactic acid bacteria for the prevention of bacterial growth and their biogenic amines formation: A review[J]. Critical Reviews in Food Science & Nutrition,2017:1.
[9] 国家卫生和计划生育委员会. GB 2733-2015 食品安全国家标准 鲜、冻动物性水产品[S]. 北京:中国标准出版社, 2016. National Health and Family Planning Commission. GB 2733-2015 National food safety standard fresh and frozen aquatic products of animal origin[S]. Beijing: China Standards Press, 2016.
[10] JSKELINEN E, JAKOBSEN L, HULTMAN J, et al. Metabolomics and bacterial diversity of packaged yellowfin tuna (Thunnus albacares) and salmon (Salmo salar) show fish species-specific spoilage development during chilled storage[J]. International Journal of Food Microbiology,2018:293.
[11] LAKSHMANAN R, SHAKILA R J, JEYASEKARAN G. Survival of amine-forming bacteria during the ice storage of fish and shrimp[J]. Food Microbiology,2002,19(6):617−625. doi: 10.1006/fmic.2002.0481
[12] KULEY E, DURMUS M, BALIKCI E, et al. Fish spoilage bacterial growth and their biogenic amine accumulation: Inhibitory effects of olive by-products[J]. International Journal of Food Properties,2016,20(5-8):1029−1043.
[13] WANG H, LUO Y, HUANG H, et al. Microbial succession of grass carp (Ctenopharyngodon idellus) filets during storage at 4 ℃ and its contribution to biogenic amines' formation[J]. International Journal of Food Microbiology,2014,190:66−71. doi: 10.1016/j.ijfoodmicro.2014.08.021
[14] 中华人民共和国国家卫生和计划生育委员会. GB 5009.228-2016 食品安全国家标准 食品中挥发性盐基氮的测定[S]. 北京:中国标准出版社, 2017. National Health and Family Planning Commission of the People's Republic of China. GB 5009.228-2016 National food safety standards Determination of volatile basic nitrogen in food[S]. Beijing: China Standards Press, 2017.
[15] 许振伟, 李学英, 杨宪时, 等. 海水鱼优势腐败菌腐败能力分析[J]. 食品与机械,2011,27(4):71−74. [XU Z W, LI X Y, YANG X S, et al. Analysis on spoilage ability of dominant spoilage bacteria from marine fish[J]. Food & Machinery,2011,27(4):71−74. doi: 10.3969/j.issn.1003-5788.2011.04.019 [16] 刘洋帆, 李绪鹏, 冯阳, 等. 超高效液相色谱-串联质谱法测定鲣鱼中的生物胺[J]. 食品与发酵工业: 1−9 [2022-09-17]. DOI: 10.13995/j.cnki.11-1802/ts.029408. LIU Y F, LI X P, FENG Y, et al. UPLC-MS/MS method for detection of biogenic amines in skipjack tuna[J]. Food and Fermentation Industries: 1−9 [2022-09-17]. DOI: 10.13995/j.cnki.11-1802/ts.029408.
[17] XIE J, ZHANG Z, YANG S P. et al. Study on the spoilage potential of Pseudomonas fluorescens on salmon stored at different temperatures[J]. Journal of Food Science and Technology,2018,55(1):217−225. doi: 10.1007/s13197-017-2916-x
[18] SETTANNI L, MICELIA, FRANCESCA N, et al. Microbiological investigation of Raphanus sativus L. grown hydroponically in nutrient solutions contaminated with spoilage and pathogenic bacteria[J]. International Journal of Food Microbiology,2013,160(3):344−352. doi: 10.1016/j.ijfoodmicro.2012.11.011
[19] 聂芳红, 谢日东, 雷晓凌, 等. 湛江水产品中大肠菌群的分离鉴定与分类研究[J]. 广东农业科学,2014,41(6):166−170. [NIE F H, XIE R D, LEI X L, et al. Isolation, identification and classification of E. coliforms from aquatic products in Zhanjiang[J]. Guangdong Agricultural Sciences,2014,41(6):166−170. doi: 10.3969/j.issn.1004-874X.2014.06.043 [20] ERDEM B, KARIPTAS E, KAYA T, et al. Factors influencing antibacterial activity of chitosan against Aeromonas hydrophila and Staphylococcus aureus[J]. International Current Pharmaceutical Journal,2016,5(5):45−48. doi: 10.3329/icpj.v5i5.27316
[21] BO H K, FERNA N N I C, BARROS V Z J, et al. Species differentiation of seafood spoilage and pathogenic gram-negative bacteria by MALDI-TOF mass fingerprinting[J]. Journal of Proteome Research,2010,9(6):3169−3183. doi: 10.1021/pr100047q
[22] 励建荣, 李婷婷, 李学鹏. 水产品鲜度品质评价方法研究进展[J]. 北京工商大学学报(自然科学版),2010,28(6):1−8. [LI J R, LI T T, LI X P. Advances in methods for evaluating freshness of aquatic products[J]. Journal of Beijing Technology and Business University: Natural Science Edition,2010,28(6):1−8. [23] 国家市场监督管理总局, 中国国家标准化管理委员会. GB/T 18108-2019 食品安全国家标准 鲜海水鱼通则[S]. 北京:中国标准出版社, 2019. State Administration for Market Regulation, Standardization Administration of the People's Republic of China. GB/T 18108-2019 National food safety standard General rules of fresh marine fish[S]. Beijing: China Standards Press, 2019.
[24] WANG H, LIU X C, et al. Spoilage potential of three different bacteria isolated from spoiled grass carp (Ctenopharyngodon idellus) fillets during storage at 4 ℃[J]. LWT-Food Science & Technology,2017:10−17.
[25] KAUFMANN M, KLINGER C. [Methods in Molecular Bio-logy] Functional genomics volume 815 | | multiple-gene silencing using antisense RNAs in Escherichia coli[J]. Journal of Marine Science and Engineering, 2022, 10.1007/978-1-61779-424-7(Chapter 23): 307−319.
[26] 钱韻芳, 杨胜平, 谢晶, 等. 气调包装凡纳滨对虾特定腐败菌致腐败能力研究[J]. 中国食品学报,2015,15(1):85−91. [QIAN Y F, YANG S P, XIE J, et al. Studies on the putrefaction potential of the specific spoilage organisms from modified atmosphere packaged Litopenaeus vannamei[J]. Journal of Chinese Institute of Food Science and Technology,2015,15(1):85−91. [27] 于淑池, 杨毅, 冯紫蓝, 等. 冷藏卵形鲳鲹优势腐败菌的分离鉴定及致腐能力分析[J]. 食品工业科技, 2021, 42(1): 101-109. YU S C, YANG Y, FENG Z L, et al. Isolation and identification of dominant spoilage bacteria in Trachinotus ovatus during chilled storage and their spoilage capability[J]. Science and Technology of Food Industry, 2021, 42(1): 101-109.
[28] 王光强, 俞剑燊, 胡健, 等. 食品中生物胺的研究进展[J]. 食品科学,2016,37(1):269−278. [WANG G Q, YU J S, HU J, et al. Progress in research on biogenic amines in foods[J]. Food Science,2016,37(1):269−278. doi: 10.7506/spkx1002-6630-201601046 [29] LIERKA P. Biogenic amines in fish, fish products and shellfish: A review[J]. Food Additives & Contaminants,2011,28(11):1547−1560.
[30] KIM S H, FIELD K G, CHANG D S. Identification of bacteria crucial to histamine accumulation in pacific mackerel during storage[J]. Journal of Food Protection,2001,64(10):1556−1564. doi: 10.4315/0362-028X-64.10.1556
-
期刊类型引用(12)
1. 于梓芃,李宁阳,弓志青,王文亮,贾凤娟,崔文甲,徐宗海,宋莎莎,李永生. 食用菌呈味物质及其检测技术、应用的研究进展. 食品工业科技. 2024(02): 373-379 .  本站查看
本站查看
2. 陈梦,胡浩,管征,蒋伊琪,钟晴,陈运娇,曹庸,李晓青. 余甘子提取物与四种中药提取物复配的促消化效果的研究. 中国食品添加剂. 2024(02): 9-15 .  百度学术
百度学术
3. 王熙,姜文,代朋,徐舒愉,胡颖,勾瑶. 功能性饼干的有效成分及保健功能. 安徽农学通报. 2024(05): 84-86 .  百度学术
百度学术
4. 南新梅,冯昊天,李亚兰,贾秀珍,杜进睿,刘艳,尹小静,马国文,李昊虬,吴珺. 茯苓山药联合豆乳对斑马鱼酒精性肝病的防护作用. 现代中医药. 2024(03): 111-115 .  百度学术
百度学术
5. 谭岸,王智诚,袁铭,胡浩,曹庸,温林凤. 余甘子提取物及其复配物改善大鼠的功能性消化不良症状. 现代食品科技. 2024(04): 1-7 .  百度学术
百度学术
6. 陈絮蒙,田星,郭亦杰,尹珑桦,唐志平,曾嵘. 不同比例酸枣仁-茯苓水提物对大鼠焦虑样行为的影响. 食品工业科技. 2023(02): 408-416 .  本站查看
本站查看
7. 李尽哲,张弛,盛思佳,柳凤凤,祝浩杰,黄雅琴. 花脸香蘑山药菌质饮料的配方优化及其抗氧化活性. 食品工业科技. 2023(05): 195-203 .  本站查看
本站查看
8. 夏楠,杨丽军,徐迪,张冬冬. 茯苓饼干配方对其品质的影响研究. 农产品加工. 2023(04): 23-26 .  百度学术
百度学术
9. 孙庆,李娟,赵伟,姚血明. 基于数据挖掘龙运光治疗绝经前后诸证的用药规律及学术思想. 贵州中医药大学学报. 2023(03): 59-63+87 .  百度学术
百度学术
10. 邓晰文,彭新安,林倩如,候韬,徐璐,曹庸,贺丽苹. 余甘子提取物及其复配物对功能性消化不良小鼠的改善作用. 现代食品科技. 2023(05): 8-13 .  百度学术
百度学术
11. 马征,李娜,吴黎明. 猴头菇多糖活性物质对疲劳恢复和抗氧化能力的影响. 分子植物育种. 2023(16): 5510-5516 .  百度学术
百度学术
12. 王小建,李果,孙秋枝,曾晓. 茯苓多糖对仔猪生长性能、养分表观消化率及免疫功能的影响. 中国饲料. 2023(18): 37-40 .  百度学术
百度学术
其他类型引用(2)






 下载:
下载:
 下载:
下载:



