Probiotic Fermented Beverage Based on Kiwifruit Residue and Analysis of Its Nutritional Quality and Flavor
-
摘要: 为减少猕猴桃果渣资源浪费,采用植物乳杆菌发酵猕猴桃果渣以制备果饮。通过单因素实验考察料液比、接种量、初始(total soluble solid,TSS)、发酵时间对产品感官评分与活菌数的影响,据此以感官评分为响应值对发酵工艺进行响应面试验优化,进一步分析该产品发酵期间的营养品质、抗氧化活性及风味的变化。结果表明,猕猴桃果渣果饮的最佳发酵工艺为:初始TSS 12.4%、接种量3.3%、发酵时间36 h,所得产品感官评分87.17分;营养品质分析表明:随着发酵时间延长,活菌数、可溶性蛋白和总酸含量升高,总酚含量先降后升,类黄酮含量无明显变化,总糖、抗坏血酸含量降低;最佳工艺下ABTS+·清除率、DPPH·清除率和铁还原力比未发酵时分别增高9.59%、6.89%、4.08%。发酵36 h产品综合营养品质达到最佳。此外,顶空气相色谱-离子迁移谱(HS-GC-IMS)分析表明发酵的前24 h是风味物质转变阶段,发酵36 h为产品风味形成重要节点,而发酵48 h会积累不愉悦气味物质。其中,酮类、酯类物质相对含量升高,醛类、醇类物质相对含量降低。进一步研究发现发酵促使果香与焦甜香先降后升,发酵香增加,特征香和生青香降低;发酵36 h时嗅香评分(31.00)最高,主体香气由生青香转变为发酵香。综上,采用最佳工艺(发酵36 h)得到的产品感官优良、营养丰富、风味馥郁;但其发酵进程对产品整体品质影响较大,需严格控制。Abstract: To reduce the waste of resources, kiwifruit residue was fermented by Lactobacillus plantarum to prepare the beverage. The effects of solid-liquid ratio, inoculation volume, initial TSS and fermentation time on sensory score and viable count of the product were investigated by single-factor experiments. On these grounds, the fermentation process was optimized by response surface methodology with the sensory score as the response value. Furthermore, the changes in its nutritional quality, antioxidant activity and flavor during fermentation were analyzed. Results showed that, the optimal fermentation process of kiwifruit residue beverage was as follows: Initial TSS 12.4%, inoculation volume 3.3%, fermentation time 36 h, and the sensory score of the product was 87.17 scores. The nutritional quality assay showed that, as time fermentation, the viable count and the contents of soluble protein and total acid increased, total phenol content initially decreased and then increased, flavonoids content had no significant difference, and the contents of total sugar and ascorbic acid decreased. Under the optimum process, ABTS+· scavenging rate, DPPH· scavenging rate as well as iron reduction increased by 9.59%, 6.89%, and 4.08%, respectively. After 36 h fermentation, the product reached the best comprehensive nutritional quality. In addition, the assay of headspace-gas chromatography-ion mobility spectroscopy (HS-GC-IMS) showed that the first 24 h of fermentation was the transformation stage of flavor compounds, and 36 h was an important node in the flavor formation, while the compounds with pungent odor were over-accumulated after 48 h fermentation. Among them, the relative contents of ketones and esters increased, while the relative contents of aldehydes and alcohols decreased. Further study found that, during fermentation, the fruit aroma and caramel aroma decreased first and then increased, the fermentation aroma increased, and the characteristic aroma as well as green aroma decreased. The olfactory sensory score (31.00) was the highest at 36 h, and the main aroma changed from green aroma to fermented aroma. To sum up, the product under the optimal process conditions (fermentation 36 h) had excellent sensory and was rich in nutrition and flavor, while the fermentation process had a great impact on the overall quality of the product and was required to be strictly controlled.
-
猕猴桃(Actinidia chinensis)是一种多年生藤本植物,原产于中国,在陕西、贵州、湖北、广西等许多省份广泛分布[1]。其果实富含多种生物活性化合物,具有良好的保健功能,深受人们喜爱[2-3]。由于其采后易软化腐烂,除鲜食外常用于果汁、果酒、果脯等食品的加工。然而,猕猴桃在加工过程中会产生大量的皮渣、籽渣等加工残留物,除少量用于动物饲料外,大部分未得到充分利用[4]。猕猴桃资源浪费约占总产量的18% [5],造成了经济和环境问题。事实上,猕猴桃果渣可能比果肉有更高的营养价值。它不仅是膳食纤维[5]、果胶[6]等功能成分的良好来源,而且富含酚类[5]、类黄酮[7]、抗坏血酸[8]等营养活性物质。此外,猕猴桃果渣具有优良的抗氧化活性,对羟自由基和超氧阴离子等都有较好的清除效果[9]。因此,猕猴桃果渣可能是一种极有潜力的功能性食品原料。
近年来,随着人们对益生菌潜在作用的了解,越来越多的果蔬发酵饮料进入市场。发酵饮料的诸多益处通常归因于益生元或益生菌效应[10]。益生菌将果蔬原有的糖类和蛋白质等成分代谢转化为有机酸、氨基酸、核苷酸及其他挥发性或非挥发性物质,从而赋予产品独特的口感与风味[11]。同时,益生菌发酵可以诱导植物细胞壁结构分解,进而释放各种生物活性物质或诱导其合成,改善产品的营养品质[12]。这些生物活性物质往往赋予产品特殊的功能性,如抗氧化、降胆固醇和降血脂等[11]。其中,植物乳杆菌是一种广泛用于食品发酵的益生菌[13-14]。刘畅等[15]发现番茄汁经植物乳杆菌发酵后总酚和总黄酮含量及抗氧化能力显著提升。Filannino等[16]采用植物乳杆菌发酵石榴汁,发酵后鞣花酸和挥发性脂肪酸等含量提升,褐变指数降低,色泽得到改善,且具有良好的抗菌和免疫调节功能。许多常见果蔬副产物都通过发酵提高其感官、风味、营养等特性,如蓝莓果渣发酵果饮[13]、刺梨果渣发酵酵素[17]和苹果果渣发酵果饮[18]等。
目前,猕猴桃果渣高值化利用问题尚未得到妥善解决,资源浪费情况依旧严峻。发酵不仅可以提高果渣的可食性,还有利于维持或增强其营养物质与功能特性,进而提高其市场价值。但当前有关猕猴桃果渣发酵的研究鲜有报道。因此,本研究采用植物乳杆菌对猕猴桃全果榨汁后的剩余果渣进行发酵,以制备发酵饮品,通过单因素和响应面试验探究其最佳发酵工艺,并对其发酵期间的理化特性、营养活性物质、抗氧化能力与挥发性风味物质进行分析,以期为提高猕猴桃果渣利用度与附加值提供参考。
1. 材料与方法
1.1 材料与仪器
猕猴桃果渣 为全果榨汁后的剩余副产物,包括果皮、果肉和籽,采自江山市塘源口乡神农猕猴桃专业合作社;植物乳杆菌(Lactobacillus plantarum,336636) 由北京北纳创联生物技术研究院提供;标准品N-ketones C4~C9 国药集团化学试剂北京有限公司;氯化钠、白砂糖、氢氧化钠 均为食品级,北京鼎国昌盛生物技术有限责任公司;牛血清蛋白、L-抗坏血酸、考马斯亮蓝、1,1-二苯-1-苦基苯肼(1,1-diphenyl-2-picryhydrazyl,DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)等 均为分析纯,国药集团化学试剂北京有限公司。
FlavourSpec®食品风味分析与质量控制系统(配有顶空气相色谱(headspace-gas chromatography,HS-GC)、离子迁移谱(ion mobility spectroscopy,IMP)和Laboratory Analytical Viewer(LAV)软件与GC×IMS Library Search Software定性软件) 德国G.A.S公司;UV-9000紫外-可见分光光度计 上海元析仪器有限公司;XMTD-8222水浴锅、SHP-150恒温培养箱 上海精宏实验设备有限公司;SW-CJ-2FD超净工作台 苏州苏净仪器自控设备有限公司;TD2102电子天平 江苏金诺仪表有限公司;PHS-3C-02 pH计 衢州艾普计量仪器有限公司。
1.2 实验方法
1.2.1 菌悬液制备
将菌种于MRS肉汤培养基(pH5.7±0.2),37 ℃、黑暗环境中活化两次。将活化好的植物乳杆菌接种于MRS肉汤培养基中,37 ℃培养24 h,4000 r/min离心10 min,用生理盐水洗涤两次。调整菌悬液至OD600=0.6,约7.5 lg CFU/mL,备用。
1.2.2 猕猴桃果渣发酵饮料制备
据工艺优化结果,将猕猴桃果渣与水按料液比1:15混匀,加入蔗糖调整TSS为12.4%(初始TSS为3.8%),用食品级氢氧化钠调整pH为5.5±0.5(初始pH3.5),85 ℃灭菌15 min。按3.3%接种量接种植物乳杆菌菌悬液,于37 ℃、黑暗环境中发酵48 h(最优发酵时间再延长12 h),每12 h取样一次,测定活菌数。过滤得到猕猴桃果渣发酵饮料,测定其营养品质指标及挥发性风味物质。
1.2.3 单因素实验
1.2.3.1 料液比
固定初始TSS为10%、接种量3%,发酵36 h,考察猕猴桃果渣与水的料液比(1:6、1:9、1:12、1:15、1:18)对产品感官与活菌数的影响。
1.2.3.2 接种量
固定料液比1:12、初始TSS为10%,发酵36 h,考察接种量(1%、2%、3%、4%、5%)对产品感官与活菌数的影响。
1.2.3.3 发酵时间
固定料液比1:12、初始TSS为10%、接种量3%,考察发酵时间(12、24、36、48、60 h)对产品感官与活菌数的影响。
1.2.3.4 初始TSS
固定料液比1:12、接种量3%,发酵36 h,考察初始TSS(6%、8%、10%、12%、14%)对产品感官与活菌数的影响。
1.2.4 响应面优化试验
根据Box-Behnken试验设计原理[19]采用Design-Expert 12进行Box-Behnken试验设计与分析。据单因素实验结果,选择接种量、发酵时间和发酵液初始TSS,以感官评分作为响应值,进行响应面分析。Box-Behnken试验因素水平设计见表1。
表 1 Box-Behnken 试验设计因素水平Table 1. Factors and levels of Box-Behnken design因素 水平 编码 −1 0 1 初始TSS(%) A 10 12 14 接种量(%) B 2 3 4 发酵时间(h) C 24 36 48 1.2.5 菌落总数测定
以无菌水对样品进行不同倍数稀释,采用平板涂布计数法测定。
1.2.6 感官评价
参考张秀玲等[20]的方法,由12名提前接受感官评价训练的人员组成品评小组(6男,6女,年龄在20~30岁之间),据表2标准对猕猴桃果渣发酵果饮进行感官评定。分数越高表示该样品的优质感官特性越强,较差感官特性越弱。
表 2 感官评分标准Table 2. Sensory scoring criteria项目 分值(分) 优质特性 较差特性 色泽 20 呈淡黄绿色,均匀,有光泽(11~20分) 色调不均,无光泽(0~10分) 组织状态 20 澄清透明,无沉淀和悬浮物(11~20分) 浑浊,有沉淀或悬浮物(0~10分) 滋味 30 爽口,酸甜适宜(16~30分) 过酸,过甜,苦涩(0~15分) 香气 30 馥郁,愉悦,和谐,果香浓厚(16~30分) 寡淡,有刺激气味(0~15分) 1.2.7 嗅香感官评定
参考Zhao等[21]的方法,采用定量描述性感官评价法进行嗅香评定,选取10点制,0~9(0=没味道,9=味道最强)。由10名受过专业培训的评价人员(5男,5女,年龄在20~30岁之间),对特征香、发酵香、生青香、焦甜香、果香进行评分。
1.2.8 品质指标测定
1.2.8.1 pH测定
采用手持pH计测定。
1.2.8.2 总酸测定
采用自动滴定电位分析仪进行,乳酸的换算系数为0.09(g/mmol)。
1.2.8.3 总糖测定
采用苯酚-硫酸法测定[22]。取0.25 mL稀释500倍的样品或不同浓度的葡萄糖标准液,先后加入0.09 g/mL苯酚溶液0.75 mL和浓硫酸2.5 mL,混匀,室温下反应30 min后于485 nm处测定吸光度值。以吸光度值为纵坐标(y),葡萄糖含量(µg)为横坐标(x),绘制标准曲线为y=0.0078x+0.1109(R2=0.9932),据此分析样品中总糖含量(g/mL)。
1.2.8.4 可溶性蛋白测定
采用考马斯亮蓝法测定[23]。取1 mL发酵液或不同浓度的牛血清蛋白标准溶液,加入100 µg/mL考马斯亮蓝G-250溶液5 mL,混匀,室温下反应2 min,测定595 nm处的吸光度值。以吸光度值为纵坐标(y),牛血清蛋白含量(µg)为横坐标(x),绘制标准曲线为y=0.0019x+0.4804(R2=0.9970),据此分析样品中可溶性蛋白含量(g/mL)。
1.2.8.5 总酚测定
参考Silva等[24]的Folin-Ciocalteu法。取1 mL稀释两倍的发酵液或不同浓度的没食子酸标准液与5 mL福林酚混匀反应5 min,加入4 mL 7.5%的碳酸钠和4 mL蒸馏水,混匀后于75 ℃反应10 min,测定760 nm处的吸光度值。以吸光度值为纵坐标(y),牛没食子酸含量(µg)为横坐标(x),绘制标准曲线为y=0.0077x+0.0554(R2=0.9992)。样品中的总酚含量以单位体积中含有的没食子酸当量表示(µg/mL)。
1.2.8.6 类黄酮含量测定
参考Yan等[13]的方法,将0.5 mL样品或不同浓度的芦丁标准液、2 mL 30%乙醇和0.15 mL 5%亚硝酸钠混匀反应5 min,之后加入10%的硝酸铝溶液0.15 mL混匀反应6 min,再加入1 mol/L氢氧化钠2 mL,并采用30%乙醇定容至5 mL,反应10 min后于510 nm处测定吸光度值。以吸光度值为纵坐标(y),芦丁含量(µg)为横坐标(x),绘制标准曲线为y=0.0024x−0.0045(R2=0.9976)。样品中类黄酮含量以单位体积含有的芦丁含量计(µg/mL)。
1.2.8.7 抗坏血酸含量测定
参考Fazio等[25]的方法,取0.5 mL发酵液或不同浓度的抗坏血酸标准液与1.5 mL的50 g/L的三氯乙酸和1 mL无水乙醇混匀,加入0.4%的磷酸-乙醇溶液0.5 mL、5 g/L的红菲咯啉溶液1 mL和0.3 g/L三氯化铁-乙醇溶液0.5 mL,混匀后于30 ℃反应1 h,在534 nm处测定吸光度值。以吸光度值为纵坐标(y),抗坏血酸含量(µg)为横坐标(x),绘制标准曲线为y=0.003x+0.0608(R2=0.9988),据此分析样品中抗坏血酸含量(µg/mL)。
1.2.8.8 Fe3+还原力(ferric reducing antioxidant power,FRAP)测定
参考刘梦培等[26]的方法测定。将0.5 mL发酵液与2.5 mL 1%的铁氰化钾混匀后于50 ℃反应20 min,加入10%的三氯乙酸2.5 mL,混匀后取2.5 mL加入去离子水2.5 mL和0.1%三氯化铁0.5 mL,混匀后反应30 min,结果以反应体系在700 nm的吸光度表示。
1.2.8.9 ABTS+·清除率测定
参考Wang等[8]的方法。分别取0.1 mL发酵液和蒸馏水加入到1 mL ABTS应用液中反应5 min,于734 nm测定吸光度值,并分别记为A1和A2;取0.1 mL发酵液加入到1 mL蒸馏水中反应5 min,于734 nm测得吸光度值记为A0。ABTS+·清除率的计算公式为:
ABTS+⋅清除率(%)=(1−A1−A2A0)×100 1.2.8.10 DPPH·清除率测定
参考Thaipong等[27]的方法。分别取0.5 mL发酵液和无水乙醇与0.5 mL DPPH溶液混合反应30 min,于517 nm处测定吸光度值,并分别记为Ab和Ac;取0.5 mL发酵液与DPPH溶液混合反应30 min,记734 nm处测得吸光度值为As。DPPH·清除率的计算公式为:
DPPH⋅清除率(%)=(1−Ab−AcAs)×100 1.2.9 挥发性风味物质分析
参考Zhao等[21]的方法,略作修改。2 mL发酵样品置于20 mL顶空瓶中进行孵化。孵化温度:45 ℃;孵化时间:20 min;加热方式:震荡加热(500 r/min);进样量:500 μL;顶空进样针温度:80 ℃。气相色谱温度:40 ℃;色谱柱:MXT-5毛细管柱(15 m×0.53 mm);载气:N2(纯度≥99.99%);载气流量:2 mL/min,5 min;10 mL/min,5 min;50 mL/min,5 min;150 mL/min,5 min。迁移管温度:45 ℃;漂移气:N2(纯度≥99.99%);漂移气流速:150 mL/min。校正参考:N-ketones C4~C9(用以计算挥发性化合物的保留指数)。
1.3 数据处理
采用Excel 2016整理数据,SPSS 20.0进行单因素方差分析(ANOVA)统计分析和Duncan多重范围检验(P<0.05),Origin 2018绘制数据图。挥发性风味物质结果分析采用仪器自带软件LAV软件与GC×IMS Library Search软件进行定性分析、指纹图谱分析。
2. 结果与分析
2.1 单因素实验
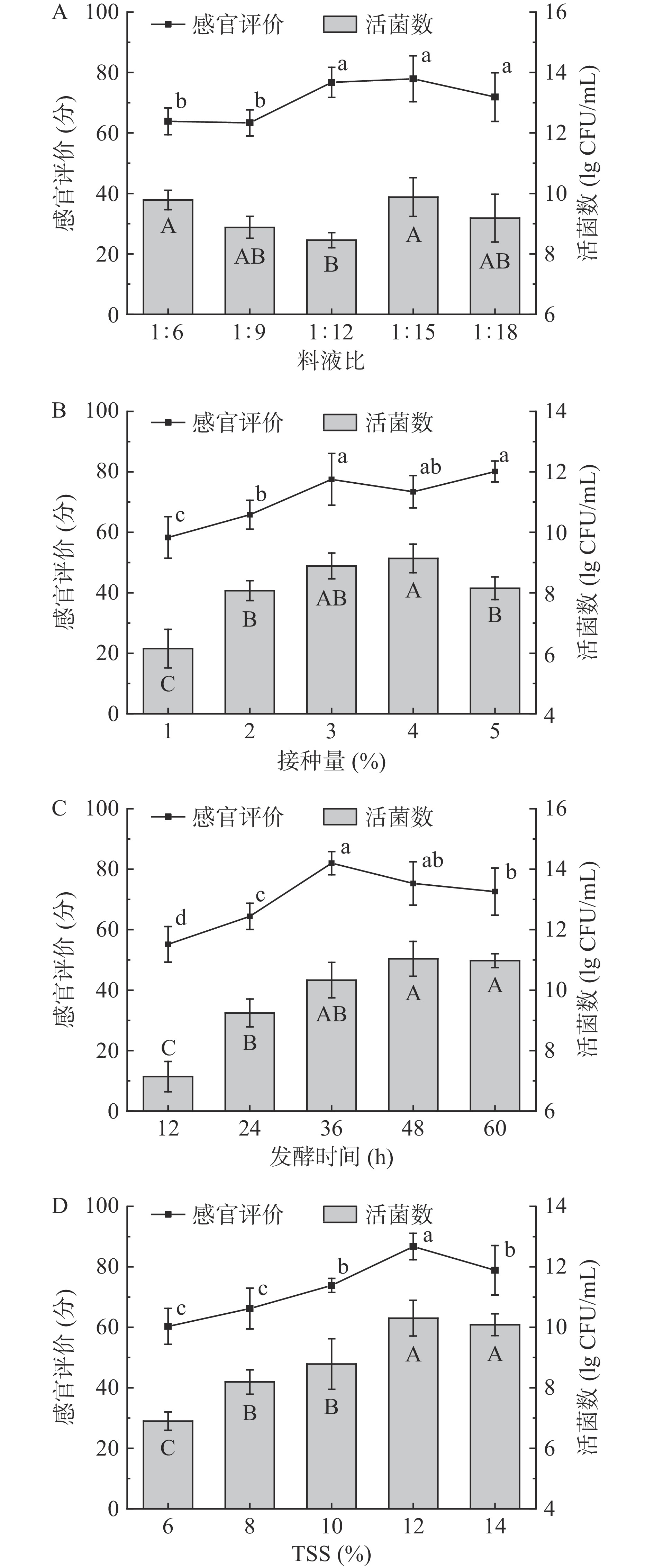
如图1A所示,随料液比减小,活菌数先减后增,当料液比为1:15时活菌数最多,但与1:6、1:9和1:18时无显著差异(P>0.05);感官评分随料液比减小而升高,当料液比为1:12、1:15与1:18时评分无显著差异(P>0.05),均优于其它组别。综上,确定猕猴桃果渣与水按1:15发酵。
图1B中的结果表明:植物乳杆菌菌悬液接种量为1%~5%之间时,菌落数先增后减,同时感官评分增高。接种量为3%时菌落数与感官评分均与最高值无显著差异(P>0.05),因此选择接种量3%为最佳发酵水平。
随着发酵时间延长,活菌数不断增加,发酵36 h之后活菌数无显著差异(图1C)(P>0.05)。感官评分随发酵时间延长先升高后降低,发酵36 h时评分最高,高达82.00分(图1C)。因此,选择发酵36 h为最佳发酵水平。
初始TSS由6%增至14%时,活菌数与感官评分均呈现先上升后下降的趋势,当初始TSS为12%时,活菌数(10.30 lg CFU/mL)与感官评分(86.72分)均达到最高值(图1D)。因此,选择初始TSS 12%为最佳发酵水平。
2.2 响应面优化试验
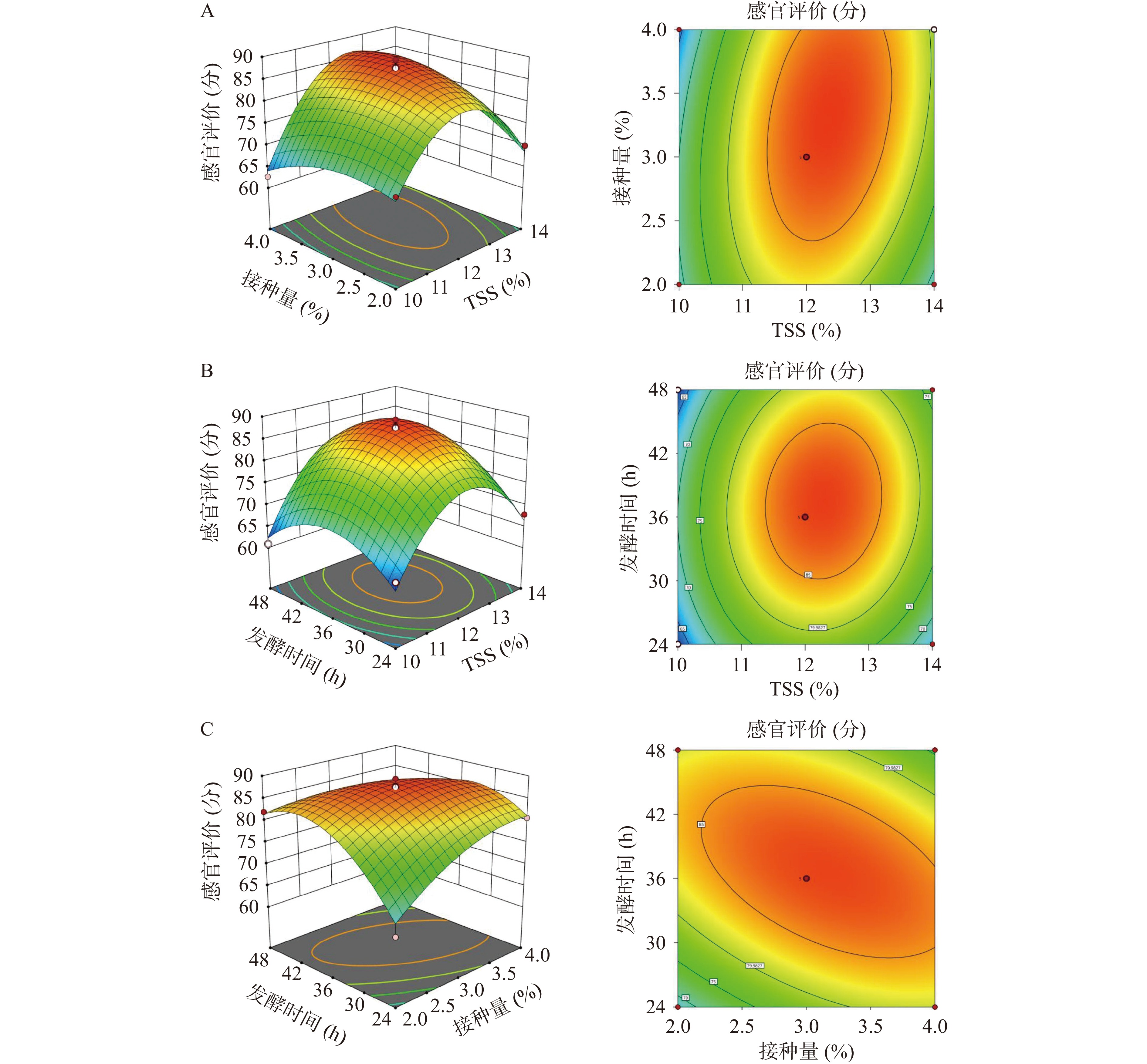
根据Box-Behnken中心试验设计原理和单因素实验结果,以初始TSS(A)、接种量(B)、发酵时间(C)三个因素为自变量,以综合得分(Y)为响应值,优化猕猴桃果渣发酵工艺,结果如表3所示。并建立二次多元回归方程为:
表 3 Box-Behnken试验设计及结果Table 3. Design and results of Box-Behnken experiment实验号 A B C 感官评分(分) 实测值 预测值 1 −1 −1 0 69.83 68.87 2 1 0 −1 67.83 66.42 3 −1 1 0 62.67 64.04 4 0 1 −1 80.67 81.13 5 0 0 0 89.33 87.47 6 0 0 0 86.83 87.47 7 0 −1 1 82.00 81.54 8 1 1 0 78.33 79.29 9 0 0 0 87.50 87.47 10 1 0 1 71.5 73.33 11 −1 1 1 77.17 74.38 12 0 0 0 87.83 87.47 13 1 −1 0 70.00 68.63 14 0 −1 −1 65.33 68.12 15 0 0 0 85.83 87.47 16 −1 0 1 60.83 62.25 17 −1 0 −1 64.33 62.50 Y=87.47+3.75A+1.46B+1.67C+3.87AB+2.15AB+1.79AC−5.04BC−13.71A2−3.55B2−7.63C2。
回归模型方差分析结果如表4所示。模型(P<0.01)极显著,失拟项(P>0.05)不显著,模型校正决定系数R2=0.9423>0.9,表明94.23%的响应值变化来源于所选变量。因此,该模型能够拟合实验结果,可以预测猕猴桃果渣发酵饮料的感官得分。方程一次项仅A(P=0.0028<0.01)极显著,B(P=0.1242>0.05)与C(P=0.0861>0.05)不显著。但A2与C2与BC极显著(P=0.0037<0.01),AB显著(P=0.0135<0.05),B2显著(P=0.0178<0.05);表明各因素对响应值的影响存在相互作用。F值A>C>B,表明各因素对猕猴桃果渣发酵饮料感官影响大小顺序为:初始TSS>发酵时间>接种量。
表 4 回归模型方差分析Table 4. Analysis of variance of regression equation平方和 自由度 平均值 F P 模型 1507.29 9 167.48 30.02 <0.0001** A 112.50 1 112.5 20.17 0.0028** B 17.01 1 17.01 3.05 0.1242 C 22.22 1 22.22 3.98 0.0861 AB 60.06 1 60.06 10.77 0.0135* AC 12.84 1 12.84 2.30 0.173* BC 101.67 1 101.67 18.23 0.0037** A² 791.72 1 791.72 141.92 <0.0001** B² 52.94 1 52.94 9.49 0.0178* C² 245.07 1 245.07 43.93 0.0003** 残差 39.05 7 5.58 失拟 32.36 3 10.79 6.45 0.0518 纯误差 6.69 4 1.67 总离差 1546.34 16 注:“*”表示显著,P<0.05;“**”表示极显著,P<0.01。 响应面曲面越陡、等高线图形越趋向椭圆表明因素间交互越显著[15]。如图2所示,初始TSS(A)和接种量(B)、初始TSS(A)和发酵时间(C)之间的响应面曲面较陡,等高线图比较趋近椭圆,表明两者交互作用比较显著。接种量(B)和发酵时间(C)之间的响应面曲面最陡、等高线图趋于椭圆,交互作用最显著。
2.3 验证试验
根据响应面试验得到的发酵猕猴桃果渣饮料制备的最优工艺为:发酵液初始TSS 12.36%,植物乳杆菌接种量3.27%,发酵时间36.48 h。考虑到实际生产操作,将最佳工艺参数修改为:初始TSS 12.4%,植物乳杆菌接种量3.3%,发酵时间36 h。进行3次重复验证实验,实际测得得感官评分为87.17±4.67分,与预测值88.03无显著差异(P>0.05)。因此,该模型能够可靠地优化猕猴桃果渣发酵饮料的制备工艺。
2.4 营养品质分析
2.4.1 主要品质指标分析
为更好的把握发酵进程,对发酵期间产品的营养品质进行分析,结果如表5所示。猕猴桃果渣发酵36 h内活菌数显著增加(P<0.05),36 h后无显著变化(P>0.05)。同时,随着发酵进行,总糖含量持续显著下降(P<0.05),总酸含量持续显著增加(P<0.05)。乳酸菌生长繁殖过程中,不断消耗糖类物质,并大量产生乳酸、乙酸等有机酸[28]。因而,随着发酵时间延长,pH不断下降(表5)。由于低pH,发酵后期大多数食物腐生菌生长得到抑制[29]。此外,发酵36 h内可溶性蛋白含量升高,36 h后含量有所下降;这与活菌数变化趋势相似,可能是菌体密度的改变影响了可溶性蛋白的产生与分解。
表 5 发酵对猕猴桃果渣主要品质指标的影响Table 5. Effect of fermentation on the main quality indicators of kiwifruit residue发酵时间(h) 0 12 24 36 48 活菌数(lg CFU/mL) 6.26±0.38a 7.18±0.16b 8.52±0.07c 9.92±0.49d 10.10±0.56d pH 5.58±0.11e 3.81±0.03d 3.38±0.01c 3.23±0.03b 3.11±0.03a 总酸(mg/mL) 0.48±0.15e 1.25±0.01d 2.29±0.07c 2.93±1.20b 3.61±0.09a 总糖(mg/mL) 147.62±1.42a 134.89±3.58b 117.39±1.91c 104.19±1.54d 96.17±1.71e 可溶性蛋白(μg/mL) 196.08±13.54c 280.29±2.54b 286.51±3.61bc 296.30±3.70a 285.31±8.20bc 总酚(μg/mL) 55.19±2.99b 46.06±1.39c 52.26±2.21b 65.70±5.37a 63.81±3.67a 类黄酮(μg/mL) 147.89±22.10a 127.61±10.64a 125.56±6.50a 144.33±7.01a 133.67±10.69a 抗坏血酸(μg/mL) 146.11±3.65a 134.98±3.18b 132.67±7.98b 127.38±6.97bc 119.96±6.45c 注:不同字母表示不同发酵时间样品间差异显著(P<0.05)。 酚酸、类黄酮和抗坏血酸等活性物质作为强抗氧化剂有益于人体健康,大量存在于猕猴桃果皮、果肉中[7-8]。这些酚类等活性物质经微生物加工后更易被人体消化吸收[30]。研究表明猕猴桃果渣发酵过程中总酚含量先降后升,发酵36 h总酚含量(65.70 μg/mL)最高(表5)。类黄酮含量在不同发酵阶段变化并不显著。此外,发酵过程中抗坏血酸含量持续下降。原因可能是抗坏血酸极易受到温度、pH等因素影响而被氧化[31]。
综上,猕猴桃果渣发酵36 h内活菌数与酚酸等活性物质含量显著提高,发酵过久会导致营养品质下降。
2.4.2 抗氧化能力分析
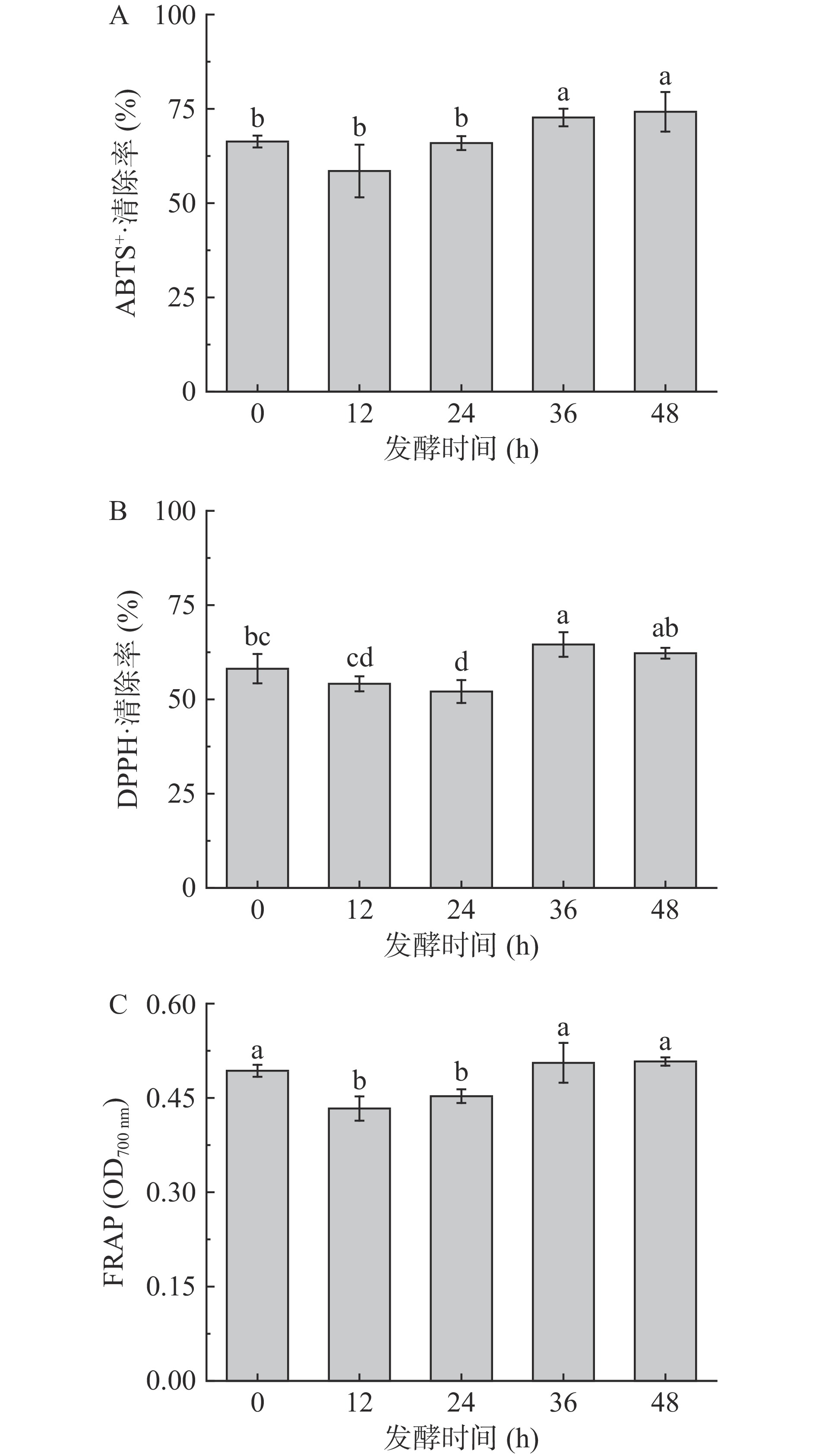
一般来说,益生菌发酵过程中活性物质得到释放,可以提高产品的抗氧化活性[31-32]。本研究发现发酵24 h内ABTS+·清除率无显著差异(P>0.05),发酵36与48 h清除率分别比未发酵组提高9.59%与11.87%(图3A)。DPPH·清除能力也呈先降后升趋势,36 h达到最大值64.00%,比未发酵组高6.89%(图3B)。FRAP先降后升,发酵36 h比未发酵时增高4.08%,但与未发酵时无显著差异(图3C)(P>0.05)。DPPH·清除力和FRAP与总酚和类黄酮含量变化趋势相似,可能与总酚和类黄酮的抗氧化活性有关[17]。因此,适当发酵能够提高猕猴桃果渣的抗氧化能力,发酵36 h抗氧化能力达到最佳水平。
2.5 挥发性风味物质分析
2.5.1 挥发性风味物质种类与含量
HS-GC-IMS分析结果如表6所示:共测得挥发性风味物质80种,其中定性61种化合物,包括酮类10种、醛类13种、醇类14种、酯类12种、烷烯类3种、呋喃类3种以及乙酸、二甲基硫和乙二醇二甲醚,并检测到3-羟基-2-丙酮、丙醛、庚醛的二聚体。不同发酵过程中挥发性风味物质种类基本一致,但是含量有所差异。其中,戊醛、庚醛、甲基异丁基甲醇、正丁醇、叶醇、异戊二烯、2,5-二甲基呋喃等含量较高的风味物质随着发酵进行含量逐渐降低,这些物质多伴有刺激味或者生青香[33-34];而丙酮、3-羟基-2-丁酮、丙醛、糠醛、正己醇、丙酮醇、丁酸乙酯、丙烯酸乙酯、肉豆蔻酸甲酯、1,2-二乙氧基乙烷等在植物乳杆菌作用下含量逐渐增多,这些物质多以果香、奶香、醇香为特征[19,33]。这些物质的含量差异可能直接影响到产品的风味。类似地,尚凡贞等[35]指出新鲜猕猴桃加工成果脯后主要挥发性风味物质由2-己烯醛变为己酸乙酯,赋予产品果香、脂香等风味。此外,Zhao等[21]研究指出猕猴桃的果香属性与丁酸乙酯呈正相关,草香气可能主要来自2-己烯醛和己醇等,而丁酸乙酯等酯类物质是甜味的主要的贡献者。这些结果表明发酵极可能通过调节挥发性化合物的种类与含量,直接影响到猕猴桃果渣饮料的风味。
表 6 发酵对猕猴桃果渣挥发性风味物质种类与含量的影响Table 6. Effect of fermentation on the species and contents of volatile flavor compounds in kiwifruit residue类别 序号 中文名称 保留
指数相对含量(%) 特征[19−21,33−37] 0 h 12 h 24 h 36 h 48 h 酮类 1 丙酮 469.0 2.45±0.62 3.26±0.07 4.28±0.04 5.67±0.12 5.85±0.08 薄荷香 2 3-巯基-2-丁酮 811.4 0.57±0.02 0.51±0.01 0.59±0.00 0.55±0.03 0.46±0.02 青香、葱韭味 3 3-羟基-2-丁酮 696.3 0.52±0.08 1.34±0.06 1.37±0.05 1.28±0.06 1.33±0.02 牛奶香气 4 3-羟基-2-丁酮二聚体 695.1 0.24±0.01 0.99±0.03 0.97±0.03 1.02±0.05 1.03±0.04 牛奶香气 5 2-戊酮 675.5 1.32±0.01 0.79±0.04 1.26±0.06 1.70±0.03 1.85±0.02 有丙酮气味 6 3-戊酮 665.1 0.87±0.12 0.86±0.06 1.18±0.04 1.22±0.08 1.41±0.04 微香 7 4-甲基-2-戊酮 740.5 0.36±0.01 0.28±0.03 0.33±0.02 0.25±0.01 0.22±0.00 – 8 环己酮 885.5 0.46±0.02 0.06±0.01 0.06±0.00 0.07±0.00 0.06±0.02 刺激性臭味 9 2,3-戊二酮 665.6 4.64±0.13 3.95±0.06 3.86±0.07 3.32±0.02 2.84±0.02 焦糖香 10 2,3-丁二酮 610.2 0.64±0.05 0.56±0.03 0.86±0.02 0.94±0.03 1.03±0.03 白脱油香 11 甲基庚烯酮 978.7 0.23±0.01 0.21±0.01 0.22±0.02 0.23±0.01 0.22±0.01 柠檬草香 醛类 12 丙醛 769.8 3.46±0.19 4.24±0.18 4.17±0.35 4.36±0.07 4.66±0.12 稀释后果香 13 丙醛二聚体 813.3 0.82±0.01 0.86±0.08 0.8±0.03 0.91±0.04 0.97±0.03 稀释后果香 14 丁醛 632.8 0.54±0.02 0.38±0.02 0.14±0.02 0.27±0.01 0.25±0.07 刺激味 15 2-甲基丁醛 676.0 0.99±0.05 1.00±0.04 0.71±0.09 0.95±0.10 0.77±0.09 稀释后可可香 16 戊醛 675.3 3.67±0.11 1.63±0.24 0.32±0.07 0.44±0.09 0.30±0.07 刺激味 17 异戊醛 646.0 0.93±0.01 0.91±0.03 1.18±0.01 1.3±0.01 1.40±0.04 苹果香、桃香 18 正己醛 819.8 0.29±0.01 0.21±0.02 0.19±0.02 0.13±0.01 0.11±0.01 青草味 19 庚醛 888.5 1.59±0.10 0.41±0.07 0.39±0.04 0.47±0.08 0.47±0.06 甜草本香 20 庚醛二聚体 888.0 0.39±0.02 0.06±0.01 0.06±0.01 0.06±0.01 0.07±0.01 甜草本香 21 辛醛 995.1 0.17±0.03 0.15±0.02 0.16±0.01 0.17±0.01 0.22±0.00 甜橙香 22 苯甲醛 945.3 0.36±0.01 0.36±0.00 0.29±0.03 0.27±0.02 0.31±0.01 苦杏仁香 23 2-已烯醛 844.3 3.42±0.05 3.63±0.08 3.64±0.01 3.57±0.02 3.70±0.02 草本香 24 反式-2-戊烯醛 738.6 2.99±0.03 2.97±0.05 2.83±0.04 2.55±0.01 2.36±0.03 – 25 反式-2-庚烯醛 945.3 0.27±0.02 0.24±0.00 0.17±0.01 0.16±0.01 0.13±0.01 辛辣味、脂香 26 糠醛 863.2 0.42±0.02 2.31±0.06 2.30±0.02 2.18±0.09 2.32±0.06 果香 醇类 27 甲基异丁基甲醇 783.8 6.82±0.12 3.67±0.41 3.74±0.22 4.12±0.35 3.76±0.36 刺激气味 28 2-硝基乙醇 665.9 2.52±0.08 2.53±0.06 2.39±0.04 2.18±0.02 2.05±0.01 辛辣气味 29 丙醇 578.0 0.65±0.02 0.44±0.02 0.38±0.01 0.34±0.01 0.33±0.01 醇香 30 正丁醇 646.0 2.40±0.06 1.16±0.03 0.88±0.02 0.97±0.04 1.05±0.10 杂醇油味 31 异丁醇 646.2 0.35±0.00 0.13±0.02 0.19±0.03 0.22±0.01 0.27±0.02 刺激味 32 3-甲基-2-丁醇 673.4 0.29±0.02 0.43±0.03 0.46±0.03 0.36±0.01 0.30±0.01 果香 33 正戊醇 753.7 1.37±0.03 1.66±0.04 1.81±0.01 1.82±0.02 1.79±0.03 杂醇油味 34 异戊醇 719.2 0.23±0.01 0.54±0.02 0.75±0.01 0.73±0.02 0.75±0.02 苹果白兰地香 35 3-甲基-1-戊醇 838.2 0.73±0.02 0.68±0.01 0.74±0.02 0.69±0.01 0.59±0.01 – 36 正己醇 862.3 0.05±0.01 1.01±0.02 1.10±0.01 1.06±0.01 1.06±0.02 脂香、甜果香 37 丙酮醇 631.7 1.51±0.06 2.19±0.04 1.82±0.09 1.94±0.04 2.26±0.04 醇香、甜香 38 2,3-丁二醇 782.5 0.34±0.03 0.46±0.02 0.47±0.01 0.52±0.00 0.58±0.01 果香 39 叶醇 841.0 7.32±0.10 7.55±0.18 7.03±0.06 6.24±0.04 5.63±0.09 青草香 40 桉叶油醇 1018.4 0.36±0.01 0.23±0.01 0.25±0.01 0.25±0.02 0.25±0.01 药香、樟脑味 酯类 41 乙酸乙酯 594.3 6.47±0.62 6.65±0.55 6.37±0.32 6.44±0.23 5.68±0.23 果香 42 乙酸丙酯 651.2 0.78±0.05 0.90±0.02 1.01±0.01 0.95±0.02 0.99±0.04 芳香 43 乙酸丁酯 801.3 0.18±0.01 0.25±0.02 0.38±0.02 0.41±0.01 0.88±0.01 果香 44 乙酸仲丁酯 758.5 1.84±0.05 1.92±0.04 2.00±0.02 2.02±0.01 2.06±0.02 果香 45 乙酸异戊酯 844.9 0.27±0.01 0.30±0.01 0.31±0.01 0.32±0.00 0.33±0.01 香蕉香 46 丙酸乙酯 691.8 0.37±0.02 0.32±0.01 0.34±0.01 0.3±0.01 0.28±0.01 果香、酒香 47 2-甲基丙酸乙酯 742.2 0.61±0.02 0.51±0.03 0.68±0.01 0.58±0.02 0.53±0.02 果香 48 丁酸乙酯 787.3 1.29±0.05 2.55±0.19 2.83±0.12 2.56±0.14 2.58±0.10 果香、菠萝香 49 2-甲基丁酸乙酯 844.8 0.09±0.01 0.13±0.01 0.18±0.03 0.22±0.01 0.27±0.00 苹果香 50 3-甲基丁酸乙酯 835.4 0.16±0.01 0.18±0.01 0.22±0.01 0.23±0.02 0.26±0.02 苹果香、酒香 51 丙烯酸乙酯 677.4 0.19±0.13 0.59±0.02 1.45±0.04 1.51±0.11 1.75±0.10 辛辣味 52 肉豆蔻酸甲酯 297.8 0.97±0.03 1.04±0.06 1.35±0.13 1.53±0.03 1.58±0.09 蜜香、鸢尾香 烷烯类 53 1,1-二乙氧基乙烷 857.3 0.58±0.04 0.69±0.01 0.69±0.03 0.72±0.00 0.77±0.02 芳香 54 反-1,2-二氯乙烯 572.1 1.00±0.00 0.60±0.04 0.20±0.01 0.22±0.02 0.19±0.01 辛辣味 55 异戊二烯 594.6 0.30±0.02 0.41±0.02 0.36±0.02 0.36±0.01 0.39±0.00 芳香 呋喃类 56 2-乙基呋喃 742.9 0.47±0.07 0.55±0.02 0.55±0.02 0.63±0.07 0.65±0.02 豆香、焦甜香 57 2-戊基呋喃 981.6 0.21±0.05 0.08±0.01 0.07±0.01 0.08±0.01 0.07±0.02 豆香、青香 58 2,5-二甲基呋喃 736.7 2.33±0.03 2.19±0.04 1.87±0.02 1.46±0.01 1.18±0.01 – 其他 59 乙酸 581.3 0.24±0.02 0.53±0.01 0.79±0.06 0.99±0.04 1.24±0.04 酸香 60 二甲基硫 515.4 1.08±0.05 0.56±0.00 0.87±0.07 0.69±0.02 0.59±0.03 刺激味 61 乙二醇二甲醚 631.9 0.79±0.02 0.38±0.01 0.13±0.01 0.09±0.01 0.09±0.02 醚味 注:数据均以“平均值±标准偏差”表示,“–”表示无香气特征或香气特征不清晰。 2.5.2 挥发性风味物质指纹图谱
为更直观的表示挥发性风味物质的变化,对其进行指纹图谱分析,结果如图4所示。环己酮、庚醛和2-戊基呋喃等(绿框内物质)几乎仅存在于未发酵的样品中;反-2-庚烯醛、2,5-二甲基呋喃和4-甲基-二戊酮等(黄框内物质)在发酵24 h时大量减少。这与Tang等[36]研究结果相似,特征香气的损失主要发生在初级发酵阶段。丁酸乙酯、丁二酮和3-羟基-2-丁酮等(白框内物质)是在发酵12 h新形成的,之后含量不断增多。丙酮醇、正戊醇和乙酸丙酯等(红框内物质)在发酵12 h含量迅速上升。3-戊酮、2,3-丁二醇和3-甲基丁酸乙酯等物质(紫框内物质)在发酵24 h后大量产生。延长发酵至48 h,丙烯酸乙酯(辛辣味)和异丁醇(刺激味)等(橙框内物质)大幅增加。综合来看,发酵前24 h是主要的风味物质转变阶段,发酵36 h是产品风味形成重要节点,而发酵48 h有不良风味物质产生和累积。
2.5.3 风味物质分类及嗅香感官分析
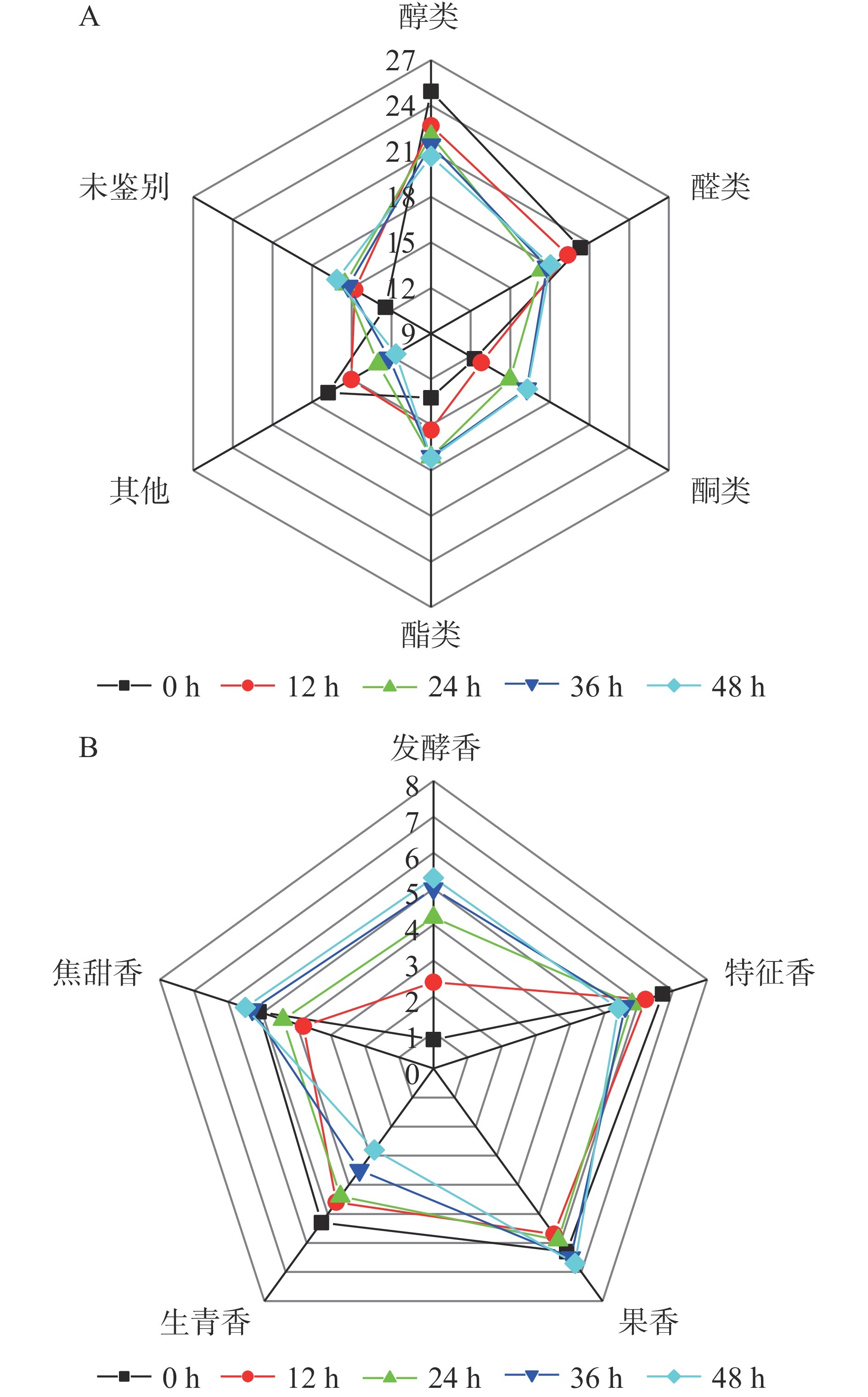
随着发酵进行,醛类、醇类等物质含量降低,酮类、酯类物质含量升高(图5A)。酮类、醛类、醇类、酯类物质在发酵0和36 h时相对含量分别为12.30%、20.31%、24.94%、13.22%和16.25%、17.79%、21.44%、17.07%。其中,醇类物质是主体风味物质。乙酸仲丁酯(果香)和丁酸乙酯(菠萝香)等酯类与3-羟基-2-丁酮(奶香)等酮类物质阈值较低,对产品风味有重要贡献。丙醛、2-甲基丁醛等醛类物质浓度高时可能带有刺激味,稀释后有特殊香气,这些醛类物质的降低可能对产品风味更有利[37]。嗅香评定结果表明:发酵48 h内发酵香持续增加,特征香和生青香持续降低,果香与焦甜香先降后升(图5B)。发酵0、12、24、36和48 h嗅香感官总分分别为25.60、26.50、29.20、31.00、30.40。主体香气特征由青香转变为发酵香。因此,最佳工艺条件下发酵的猕猴桃果渣在保留了部分特征风味物质的同时,还产生了许多独特的风味物质,使得产品风味更加馥郁、浓厚。
3. 结论
植物乳杆菌发酵猕猴桃果渣制备果饮的最佳工艺为:果渣与水按料液比1:15混合,初始TSS 12.4%、接种量3.3%、发酵36 h;感官评分可达87.17分,改善了猕猴桃果渣的感官特性。营养品质分析表明:发酵使得产品活菌数升高,可溶性蛋白和总酸含量降低,总酚含量先降后升,类黄酮含量得以维持,总糖、抗坏血酸含量降低,最佳工艺下营养品质显著提高;发酵36 h时ABTS+·清除率、DPPH·清除率和FRAP分别比未发酵时增高9.59%、6.89%、4.08%;GC-MS结果分析表明:发酵24 h内是产品风味转化阶段,发酵36 h是产品风味形成重要节点,发酵48 h不愉悦气味物质累积增多。其中,醛类和醇类物质含量降低,酮类和酯类物质含量升高;醇类物质为主体风味物质。此外,发酵促使果香与焦甜香先降后升,发酵香增加,特征香和生青香降低;主体风味由青香转为发酵香,36 h嗅香评分为31.00达到最佳水平。因此,优化工艺下发酵的猕猴桃果渣果饮营养丰富、风味馥郁,但发酵进程控制不当会产生负面影响,研究结果为猕猴桃果渣资源的高值化利用及规模化生产和品质控制提供了参考。
-
表 1 Box-Behnken 试验设计因素水平
Table 1 Factors and levels of Box-Behnken design
因素 水平 编码 −1 0 1 初始TSS(%) A 10 12 14 接种量(%) B 2 3 4 发酵时间(h) C 24 36 48 表 2 感官评分标准
Table 2 Sensory scoring criteria
项目 分值(分) 优质特性 较差特性 色泽 20 呈淡黄绿色,均匀,有光泽(11~20分) 色调不均,无光泽(0~10分) 组织状态 20 澄清透明,无沉淀和悬浮物(11~20分) 浑浊,有沉淀或悬浮物(0~10分) 滋味 30 爽口,酸甜适宜(16~30分) 过酸,过甜,苦涩(0~15分) 香气 30 馥郁,愉悦,和谐,果香浓厚(16~30分) 寡淡,有刺激气味(0~15分) 表 3 Box-Behnken试验设计及结果
Table 3 Design and results of Box-Behnken experiment
实验号 A B C 感官评分(分) 实测值 预测值 1 −1 −1 0 69.83 68.87 2 1 0 −1 67.83 66.42 3 −1 1 0 62.67 64.04 4 0 1 −1 80.67 81.13 5 0 0 0 89.33 87.47 6 0 0 0 86.83 87.47 7 0 −1 1 82.00 81.54 8 1 1 0 78.33 79.29 9 0 0 0 87.50 87.47 10 1 0 1 71.5 73.33 11 −1 1 1 77.17 74.38 12 0 0 0 87.83 87.47 13 1 −1 0 70.00 68.63 14 0 −1 −1 65.33 68.12 15 0 0 0 85.83 87.47 16 −1 0 1 60.83 62.25 17 −1 0 −1 64.33 62.50 表 4 回归模型方差分析
Table 4 Analysis of variance of regression equation
平方和 自由度 平均值 F P 模型 1507.29 9 167.48 30.02 <0.0001** A 112.50 1 112.5 20.17 0.0028** B 17.01 1 17.01 3.05 0.1242 C 22.22 1 22.22 3.98 0.0861 AB 60.06 1 60.06 10.77 0.0135* AC 12.84 1 12.84 2.30 0.173* BC 101.67 1 101.67 18.23 0.0037** A² 791.72 1 791.72 141.92 <0.0001** B² 52.94 1 52.94 9.49 0.0178* C² 245.07 1 245.07 43.93 0.0003** 残差 39.05 7 5.58 失拟 32.36 3 10.79 6.45 0.0518 纯误差 6.69 4 1.67 总离差 1546.34 16 注:“*”表示显著,P<0.05;“**”表示极显著,P<0.01。 表 5 发酵对猕猴桃果渣主要品质指标的影响
Table 5 Effect of fermentation on the main quality indicators of kiwifruit residue
发酵时间(h) 0 12 24 36 48 活菌数(lg CFU/mL) 6.26±0.38a 7.18±0.16b 8.52±0.07c 9.92±0.49d 10.10±0.56d pH 5.58±0.11e 3.81±0.03d 3.38±0.01c 3.23±0.03b 3.11±0.03a 总酸(mg/mL) 0.48±0.15e 1.25±0.01d 2.29±0.07c 2.93±1.20b 3.61±0.09a 总糖(mg/mL) 147.62±1.42a 134.89±3.58b 117.39±1.91c 104.19±1.54d 96.17±1.71e 可溶性蛋白(μg/mL) 196.08±13.54c 280.29±2.54b 286.51±3.61bc 296.30±3.70a 285.31±8.20bc 总酚(μg/mL) 55.19±2.99b 46.06±1.39c 52.26±2.21b 65.70±5.37a 63.81±3.67a 类黄酮(μg/mL) 147.89±22.10a 127.61±10.64a 125.56±6.50a 144.33±7.01a 133.67±10.69a 抗坏血酸(μg/mL) 146.11±3.65a 134.98±3.18b 132.67±7.98b 127.38±6.97bc 119.96±6.45c 注:不同字母表示不同发酵时间样品间差异显著(P<0.05)。 表 6 发酵对猕猴桃果渣挥发性风味物质种类与含量的影响
Table 6 Effect of fermentation on the species and contents of volatile flavor compounds in kiwifruit residue
类别 序号 中文名称 保留
指数相对含量(%) 特征[19−21,33−37] 0 h 12 h 24 h 36 h 48 h 酮类 1 丙酮 469.0 2.45±0.62 3.26±0.07 4.28±0.04 5.67±0.12 5.85±0.08 薄荷香 2 3-巯基-2-丁酮 811.4 0.57±0.02 0.51±0.01 0.59±0.00 0.55±0.03 0.46±0.02 青香、葱韭味 3 3-羟基-2-丁酮 696.3 0.52±0.08 1.34±0.06 1.37±0.05 1.28±0.06 1.33±0.02 牛奶香气 4 3-羟基-2-丁酮二聚体 695.1 0.24±0.01 0.99±0.03 0.97±0.03 1.02±0.05 1.03±0.04 牛奶香气 5 2-戊酮 675.5 1.32±0.01 0.79±0.04 1.26±0.06 1.70±0.03 1.85±0.02 有丙酮气味 6 3-戊酮 665.1 0.87±0.12 0.86±0.06 1.18±0.04 1.22±0.08 1.41±0.04 微香 7 4-甲基-2-戊酮 740.5 0.36±0.01 0.28±0.03 0.33±0.02 0.25±0.01 0.22±0.00 – 8 环己酮 885.5 0.46±0.02 0.06±0.01 0.06±0.00 0.07±0.00 0.06±0.02 刺激性臭味 9 2,3-戊二酮 665.6 4.64±0.13 3.95±0.06 3.86±0.07 3.32±0.02 2.84±0.02 焦糖香 10 2,3-丁二酮 610.2 0.64±0.05 0.56±0.03 0.86±0.02 0.94±0.03 1.03±0.03 白脱油香 11 甲基庚烯酮 978.7 0.23±0.01 0.21±0.01 0.22±0.02 0.23±0.01 0.22±0.01 柠檬草香 醛类 12 丙醛 769.8 3.46±0.19 4.24±0.18 4.17±0.35 4.36±0.07 4.66±0.12 稀释后果香 13 丙醛二聚体 813.3 0.82±0.01 0.86±0.08 0.8±0.03 0.91±0.04 0.97±0.03 稀释后果香 14 丁醛 632.8 0.54±0.02 0.38±0.02 0.14±0.02 0.27±0.01 0.25±0.07 刺激味 15 2-甲基丁醛 676.0 0.99±0.05 1.00±0.04 0.71±0.09 0.95±0.10 0.77±0.09 稀释后可可香 16 戊醛 675.3 3.67±0.11 1.63±0.24 0.32±0.07 0.44±0.09 0.30±0.07 刺激味 17 异戊醛 646.0 0.93±0.01 0.91±0.03 1.18±0.01 1.3±0.01 1.40±0.04 苹果香、桃香 18 正己醛 819.8 0.29±0.01 0.21±0.02 0.19±0.02 0.13±0.01 0.11±0.01 青草味 19 庚醛 888.5 1.59±0.10 0.41±0.07 0.39±0.04 0.47±0.08 0.47±0.06 甜草本香 20 庚醛二聚体 888.0 0.39±0.02 0.06±0.01 0.06±0.01 0.06±0.01 0.07±0.01 甜草本香 21 辛醛 995.1 0.17±0.03 0.15±0.02 0.16±0.01 0.17±0.01 0.22±0.00 甜橙香 22 苯甲醛 945.3 0.36±0.01 0.36±0.00 0.29±0.03 0.27±0.02 0.31±0.01 苦杏仁香 23 2-已烯醛 844.3 3.42±0.05 3.63±0.08 3.64±0.01 3.57±0.02 3.70±0.02 草本香 24 反式-2-戊烯醛 738.6 2.99±0.03 2.97±0.05 2.83±0.04 2.55±0.01 2.36±0.03 – 25 反式-2-庚烯醛 945.3 0.27±0.02 0.24±0.00 0.17±0.01 0.16±0.01 0.13±0.01 辛辣味、脂香 26 糠醛 863.2 0.42±0.02 2.31±0.06 2.30±0.02 2.18±0.09 2.32±0.06 果香 醇类 27 甲基异丁基甲醇 783.8 6.82±0.12 3.67±0.41 3.74±0.22 4.12±0.35 3.76±0.36 刺激气味 28 2-硝基乙醇 665.9 2.52±0.08 2.53±0.06 2.39±0.04 2.18±0.02 2.05±0.01 辛辣气味 29 丙醇 578.0 0.65±0.02 0.44±0.02 0.38±0.01 0.34±0.01 0.33±0.01 醇香 30 正丁醇 646.0 2.40±0.06 1.16±0.03 0.88±0.02 0.97±0.04 1.05±0.10 杂醇油味 31 异丁醇 646.2 0.35±0.00 0.13±0.02 0.19±0.03 0.22±0.01 0.27±0.02 刺激味 32 3-甲基-2-丁醇 673.4 0.29±0.02 0.43±0.03 0.46±0.03 0.36±0.01 0.30±0.01 果香 33 正戊醇 753.7 1.37±0.03 1.66±0.04 1.81±0.01 1.82±0.02 1.79±0.03 杂醇油味 34 异戊醇 719.2 0.23±0.01 0.54±0.02 0.75±0.01 0.73±0.02 0.75±0.02 苹果白兰地香 35 3-甲基-1-戊醇 838.2 0.73±0.02 0.68±0.01 0.74±0.02 0.69±0.01 0.59±0.01 – 36 正己醇 862.3 0.05±0.01 1.01±0.02 1.10±0.01 1.06±0.01 1.06±0.02 脂香、甜果香 37 丙酮醇 631.7 1.51±0.06 2.19±0.04 1.82±0.09 1.94±0.04 2.26±0.04 醇香、甜香 38 2,3-丁二醇 782.5 0.34±0.03 0.46±0.02 0.47±0.01 0.52±0.00 0.58±0.01 果香 39 叶醇 841.0 7.32±0.10 7.55±0.18 7.03±0.06 6.24±0.04 5.63±0.09 青草香 40 桉叶油醇 1018.4 0.36±0.01 0.23±0.01 0.25±0.01 0.25±0.02 0.25±0.01 药香、樟脑味 酯类 41 乙酸乙酯 594.3 6.47±0.62 6.65±0.55 6.37±0.32 6.44±0.23 5.68±0.23 果香 42 乙酸丙酯 651.2 0.78±0.05 0.90±0.02 1.01±0.01 0.95±0.02 0.99±0.04 芳香 43 乙酸丁酯 801.3 0.18±0.01 0.25±0.02 0.38±0.02 0.41±0.01 0.88±0.01 果香 44 乙酸仲丁酯 758.5 1.84±0.05 1.92±0.04 2.00±0.02 2.02±0.01 2.06±0.02 果香 45 乙酸异戊酯 844.9 0.27±0.01 0.30±0.01 0.31±0.01 0.32±0.00 0.33±0.01 香蕉香 46 丙酸乙酯 691.8 0.37±0.02 0.32±0.01 0.34±0.01 0.3±0.01 0.28±0.01 果香、酒香 47 2-甲基丙酸乙酯 742.2 0.61±0.02 0.51±0.03 0.68±0.01 0.58±0.02 0.53±0.02 果香 48 丁酸乙酯 787.3 1.29±0.05 2.55±0.19 2.83±0.12 2.56±0.14 2.58±0.10 果香、菠萝香 49 2-甲基丁酸乙酯 844.8 0.09±0.01 0.13±0.01 0.18±0.03 0.22±0.01 0.27±0.00 苹果香 50 3-甲基丁酸乙酯 835.4 0.16±0.01 0.18±0.01 0.22±0.01 0.23±0.02 0.26±0.02 苹果香、酒香 51 丙烯酸乙酯 677.4 0.19±0.13 0.59±0.02 1.45±0.04 1.51±0.11 1.75±0.10 辛辣味 52 肉豆蔻酸甲酯 297.8 0.97±0.03 1.04±0.06 1.35±0.13 1.53±0.03 1.58±0.09 蜜香、鸢尾香 烷烯类 53 1,1-二乙氧基乙烷 857.3 0.58±0.04 0.69±0.01 0.69±0.03 0.72±0.00 0.77±0.02 芳香 54 反-1,2-二氯乙烯 572.1 1.00±0.00 0.60±0.04 0.20±0.01 0.22±0.02 0.19±0.01 辛辣味 55 异戊二烯 594.6 0.30±0.02 0.41±0.02 0.36±0.02 0.36±0.01 0.39±0.00 芳香 呋喃类 56 2-乙基呋喃 742.9 0.47±0.07 0.55±0.02 0.55±0.02 0.63±0.07 0.65±0.02 豆香、焦甜香 57 2-戊基呋喃 981.6 0.21±0.05 0.08±0.01 0.07±0.01 0.08±0.01 0.07±0.02 豆香、青香 58 2,5-二甲基呋喃 736.7 2.33±0.03 2.19±0.04 1.87±0.02 1.46±0.01 1.18±0.01 – 其他 59 乙酸 581.3 0.24±0.02 0.53±0.01 0.79±0.06 0.99±0.04 1.24±0.04 酸香 60 二甲基硫 515.4 1.08±0.05 0.56±0.00 0.87±0.07 0.69±0.02 0.59±0.03 刺激味 61 乙二醇二甲醚 631.9 0.79±0.02 0.38±0.01 0.13±0.01 0.09±0.01 0.09±0.02 醚味 注:数据均以“平均值±标准偏差”表示,“–”表示无香气特征或香气特征不清晰。 -
[1] 张杨, 谢惠波. 野生猕猴桃奶含片生产工艺研究[J]. 食品科学技术学报,2017,35(6):62−66. [ZHANG Y, XIE H B. Study on wild kiwi fruit milk tablets production technology[J]. Journal of Food Science and Technology,2017,35(6):62−66. doi: 10.3969/j.issn.2095-6002.2017.06.010 [2] KIM A N, KIM H J, CHUN J, et al. Degradation kinetics of phenolic content and antioxidant activity of hardy kiwifruit (Actinidia arguta) puree at different storage temperatures[J]. LWT-Food Science and Technology,2018,89:535−541. doi: 10.1016/j.lwt.2017.11.036
[3] PARK Y S, NAMLESNIK J, EARASIPL K, et al. Bioactive compounds and the antioxidant capacity in new kiwi fruit cultivars[J]. Food Chemistry,2014,165:354−361. doi: 10.1016/j.foodchem.2014.05.114
[4] CUO C X, QIN J P, ZHANG S Q, et al. Purification of polyphenols from kiwi fruit peel extracts using macroporous resins and high-performance liquid chromatography analysis[J]. International Journal of Food Science and Technology, 2018, 53: 1486−1493.
[5] YULIARTI O, GOH K K T, MATLA-M L, et al. Extraction and characterization of pomace pectin from gold kiwifruit (Actinidia chinensis)[J]. Food Chemistry,2015,187:290−296. doi: 10.1016/j.foodchem.2015.03.148
[6] KHEIRKHAB H, BAROUTIAN S, QUEK S Y. Evaluation of bioactive compounds extracted from Hayward kiwifruit pomace by subcritical water extraction[J]. Food and Bioproducts Processing,2019,115:143−153. doi: 10.1016/j.fbp.2019.03.007
[7] AIRES A, CARVALHO R. Kiwi fruit residues from industry processing: Study for a maximum phenolic recovery yield[J]. Journal of Food Science and Technology,2020,57(11):4265−4276. doi: 10.1007/s13197-020-04466-7
[8] WANG Y T, LI L X, LIU H, et al. Bioactive compounds and in vitro antioxidant activities of peel, flesh and seed powder of kiwi fruit[J]. International Journal of Food Science and Technology,2018,53(9):2239−2245. doi: 10.1111/ijfs.13812
[9] 谭强来, 曾臻, 武晓丽, 等. 几种果渣提取物抗氧化能力的比较研究[J]. 中国食物与营养,2019,25(4):49−52. [TAN Q L, ZEN Z, WU X L R, et al. Antioxidant activity comparison of several fruit pomace extracts[J]. Food and Nutrition in China,2019,25(4):49−52. doi: 10.3969/j.issn.1006-9577.2019.04.010 [10] TUNDIS R. Contribution of bioactive compounds from Mediterranean plant foods in promoting health effects: A profile of Rosa Tundis[J]. Food Frontiers,2021,2(1):91−92. doi: 10.1002/fft2.68
[11] 陈子琪, 郜海燕, 房祥军, 等. 植物乳杆菌发酵香菇不同部位风味物质变化研究[J]. 中国食品学报,2020,20(8):130−139. [CHEN Z Q, GAO H Y, FANG X J, et al. Studies on the changes of flavor substances in different parts of Lentinus edodes fermented by Lactobacillus plantarum[J]. Journal of Chinese Institute of Food Science and Technology,2020,20(8):130−139. [12] KATINA K, LAITILA A, JUVONEN R, et al. Bran fermentation as a means to enhance technological properties and bioactivity of rye[J]. Food Microbiology,2007,24(2):175−186. doi: 10.1016/j.fm.2006.07.012
[13] YAN Y H, ZHANG F, CHAI Z Y, et al. Mixed fermentation of blueberry pomace with L. rhamnosus GG
and L. plantarum-1 : Enhance the active ingredient, antioxidant activity and health-promoting benefits[J]. Food and Chemical Toxicology,2019,131:110541. doi: 10.1016/j.fct.2019.05.049 [14] CHEN Z Q, GAO H Y, WU W J, et al. Effects of fermentation with different strains on the umami taste of Shiitake mushroom (Lentinus edodes)[J]. LWT- Food Science and Technology,2021,141(9):110889.
[15] 刘畅, 左常洲, 彭菁, 等. 响应面优化植物乳杆菌发酵番茄汁工艺优化及其品质评估[J]. 食品工业科技,2022,43(10):246−253. [LIU C, ZUO C Z, PENG J, et al. Response surface optimization of the fermentation process of tomato juice by Lactobacillus plantarum and its quality evaluation[J]. Science and Technology of Food Industry,2022,43(10):246−253. [16] FILANNINO P, AZZI L, CAVOSKI I, et al. Exploitation of the health-promoting and sensory properties of organic pomegranate (Punica granatum L.) juice through lactic acid fermentation[J]. International Journal of Food Microbiology,2013,163(2−3):184−192. doi: 10.1016/j.ijfoodmicro.2013.03.002
[17] 刘晓燕, 谢丹, 马立志, 等. 刺梨果渣发酵前后活性成分及抗氧化能力的比较研究[J]. 食品科技,2021,46(2):16−24. [LIU X Y, XIE D, MA L Z, et al. Comparative study on active components and antioxidant capacity of Rosa roxburghii Tratt. fruit residue before and after fermentation[J]. Food Science and Technology,2021,46(2):16−24. doi: 10.13684/j.cnki.spkj.2021.02.003 [18] 徐云菲. 寒富苹果果渣发酵果饮加工工艺研究[D]. 沈阳: 沈阳农业大学, 2018. XU Y F. Study on processing technology of fermented fruit beverage from Hanfu apple pomace[D]. Shenyang: Shenyang Agricultural University, 2018.
[19] YANG J S, MU T H, MA M M. Optimization of ultrasound-microwave assisted acid extraction of pectin from potato pulp by response surface methodology and its characterization[J]. Food Chemistry,2019,289:351−359. doi: 10.1016/j.foodchem.2019.03.027
[20] 张秀玲, 汲润, 李凤凤, 等. 不同发酵工艺对蓝靛果酒功能性及香气成分影响[J/OL]. 食品科学, 2022: 1−15[2021-08-27]. ZHANG X L, JI R, LI F F, et al. Effects of different fermentation processes on the functional and aroma components of Lonicera edulis wine[J/OL]. Food Science, 2022: 1−15 [2021-08-27].
[21] ZHAO Y, ZHAN P, TIAN H L, et al. Insights into the aroma profile in three kiwifruit varieties by HS-SPME-GC-MS and GC-IMS coupled with DSA[J]. Food Analytical Methods,2021,14(5):1033−1042. doi: 10.1007/s12161-020-01952-8
[22] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 58−60. CAO J K, JIANG W B, ZHAO Y M. Experiment guidance of postharvest physiology and biochemistry of fruits and vegetables[M]. Beijing: China Light Industry Press, 2007: 58−60.
[23] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1−2):248−254. doi: 10.1016/0003-2697(76)90527-3
[24] SILVA M M M D, SILVA E P, GARCIA L, et al. Bioactive compounds and nutritional value of Cagaita (Eugenia dysenteric) during its physiological development[J]. eFood,2020,1(4):1−9.
[25] FAZIO A, CHIARA L T, MARIA C C, et al. Effect of addition of pectins from jujubes (Ziziphus jujuba Mill.) on vitamin C production during heterolactic fermentation[J]. Molecules,2020,25(11):2706. doi: 10.3390/molecules25112706
[26] 刘梦培, 铁珊珊, 王璐, 等. 发酵条件对杜仲茶组分及抗氧化性的影响[J]. 食品科技, 2018, 43(2): 10-108. LIU M P, TIE S S, WANG L, et al. The influence of fermentation conditions on the composition and antioxidant capacity of Eucommia ulmoides tea[J]. Food Science and Technology, 2018, 43(2): 105-108.
[27] THAIPONG K, BOONPRAKOB U, CROSBY K, et al. Comparison of ABTS, DPPH, FRAP, and ORAC assays for estimating antioxidant activity from guava fruit extracts[J]. Journal of Food Composition and Analysis,2006,19(6-7):669−675. doi: 10.1016/j.jfca.2006.01.003
[28] CHEN Z Q, FANG X J, WU W J, et al. Effects of fermentation with Lactiplantibacillus plantarum GDM1.191 on the umami compounds in shiitake mushrooms (Lentinus edodes)[J]. Food Chemistry,2021,364:130398. doi: 10.1016/j.foodchem.2021.130398
[29] COSTA M G M, FONTELES T V, JESUS A L T D, et al. Sonicated pineapple juice as substrate for L. casei cultivation for probiotic beverage development: Process optimisation and product stability[J]. Food Chemistry,2013,139(1−4):261−266. doi: 10.1016/j.foodchem.2013.01.059
[30] GIZEM C, KOEN V, LUIGI L, et al. Interaction of dietary polyphenols and gut microbiota: Microbial metabolism of polyphenols, influence on the gut microbiota, and implications on host health[J]. Food Frontiers,2020,1(2):109−133. doi: 10.1002/fft2.25
[31] YANG C P, FUJITA S, ASHRAFUZZAMAN M, et al. Purification and characterization of polyphenol oxidase from banana (Musa sapientum L.) pulp.[J]. Journal of Agricultural and Food Chemistry,2000,48(7):2732−2735. doi: 10.1021/jf991037+
[32] ADEBO O A, MEAZA I G M, TORRES M D. Impact of fermentation on the phenolic compounds and antioxidant activity of whole cereal grains: A mini review[J]. Molecules, 2020, 25(4): 927−945.
[33] WANG Z N, FENG Y Z, YANG N N, et al. Fermentation of kiwifruit juice from two cultivars by probiotic bacteria: Bioactive phenolics, antioxidant activities and flavor volatiles[J]. Food Chemistry,2022,373(PB):131455.
[34] GARCIA, QWEK S-Y, STEVENSON R J, et al. Characterisation of bound volatile compounds of a low flavour kiwifruit species: Actinidia eriantha[J]. Food Chemistry,2012,134(2):655−661. doi: 10.1016/j.foodchem.2012.02.148
[35] 尚凡贞, 刘瑞玲, 吴伟杰, 等. 无糖益生菌猕猴桃脯工艺优化及其营养风味分析[J]. 食品工业科技,2021,42(19):226−237. [SHANG F Z, LIU R L, WU W J, et al. Process optimization of sugar-free probiotic preserved kiwifruit and analysis of nutritional flavor[J]. Science and Technology of Food Industry,2021,42(19):226−237. [36] TANG Z S, ZENG X A, BRENNAN M A, et al. Characterization of aroma profile and characteristic aromas during lychee wine fermentation[J]. Journal of Food Processing and Preservation,2019,43(8):e14003.
[37] LENG P, HU H W, CUI A H, et al. HS-GC-IMS with PCA to analyze volatile flavor compounds of honey peach packaged with different preservation methods during storage[J]. LWT-Food Science and Technology,2021,149:111963. doi: 10.1016/j.lwt.2021.111963





 下载:
下载:



 下载:
下载:



