Preparation and in Vitro Digestibility of Pumpkin Peel Polysaccharide Chromium (III) Complex
-
摘要: 采用热水浸提法提取南瓜皮多糖,将南瓜皮多糖与三价铬离子复合得到多糖铬,以螯合率为指标,考察铬与多糖质量比、pH、温度和时间等单因素对多糖铬合成的影响,通过响应面法优化多糖铬的制备工艺;利用体外模拟胃肠道消化试验测定南瓜皮多糖铬中铬的生物接受率。结果表明,南瓜皮多糖铬的最佳制备工艺为:铬与多糖质量比0.08:1,温度60 ℃,pH6.8,在该试验条件下,南瓜皮多糖铬的螯合率为99.23%±0.12%;体外模拟消化试验表明在胃液中南瓜皮多糖铬的溶解率比较稳定,在肠液中的透析率高于氯化铬。试验表明,南瓜皮多糖铬中铬离子的生物接受率较高,具有潜在的应用意义。Abstract: In the study, pumpkin peel polysaccharide was extracted by hot water extraction, and a novel pumpkin peel polysaccharide chromium (III) [PPP-Cr(III)] complex was synthesized combined with trivalent chromium ions. Using the chelation rate as the evaluation index, the effects of the mass fraction between chromium and polysaccharide, reaction pH, reaction temperature and reaction time on the synthesis of PPP-Cr(III) complex were studied, the extraction conditions of PPP-Cr(III) complex was optimized by the response surface methodology, and the bioaccessibility of trivalent chromium ions in the PPP-Cr(III) complex was determined by in vitro simulated gastrointestinal digestion. The response surface analysis results showed that the optimum preparation conditions were as follows: The mass fraction between chromium and polysaccharide was 0.08:1, the reaction temperature was 60 ℃ and the reaction pH was 6.8, respectively, with the experimental chelation rate was 99.23%±0.12%. In addition, in vitro simulated gastrointestinal digestion studies showed that the solubility of PPP-Cr(III) complex in synthetic stomach conditions were stable and the dialysis rate of PPP-Cr(III) complex were higher than those of chromium chloride. Therefore, PPP-Cr(III) complex was a new potential type of chelate due to its high bioaccessibility of trivalent chromium ions.
-
Keywords:
- pumpkin peel /
- polysaccharide /
- chromium /
- digestion in vitro
-
南瓜广泛种植于世界各地,具有降血糖、抗氧化、抗肿瘤等作用[1-5],深加工过程会产生大量南瓜皮副产物,大量丢弃造成了资源浪费和环境污染[6-7]。南瓜皮富含多糖,从南瓜皮中提取多糖,可以促进南瓜资源的综合利用,提高其工业附加值[8]。目前关于南瓜多糖的研究大多集中于提取工艺优化、结构解析及生物活性评价等方面,有关南瓜多糖与金属离子螯合的研究较少。
三价铬离子是葡萄糖耐量因子的重要组成,可以加速葡萄糖在体内的利用,具有降血糖作用[9-10]。但该形式会影响铬的吸收利用,研究表明与有机物复合后的铬更易被吸收,因此开发一种具有生物活性的新型有机铬产品具有重要意义[11]。多糖结构中含有羟基、羧基等基团,可以与三价铬离子以配位键结合,形成多糖铬复合物,能够更好地被人体利用。多糖金属离子复合物既保持了天然多糖的生物活性,又可发挥金属元素的生理作用[12]。目前已报道的可与铬进行复合的多糖有黄芪多糖、灰树花多糖、灵芝多糖、苦瓜多糖、桦褐孔菌多糖和海藻多糖等[12-17],这些研究多集中于多糖铬的螯合工艺及降血糖、降血脂等生物活性的分析,但有关铬与南瓜多糖螯合产物的制备和消化过程中的生物接受率的研究较少。
本研究从南瓜皮中提取南瓜皮多糖,采用单因素法和响应面法确定南瓜皮多糖与三价铬离子的最佳螯合工艺,并研究南瓜皮多糖铬的体外消化特性,为南瓜皮多糖铬的高效制备与新型补铬产品的开发提供理论依据。
1. 材料与方法
1.1 材料与仪器
爱碧斯南瓜皮 山东省烟台市莱阳市孟宇食品有限公司提供;氯化铬 分析纯,天津市凯通化学试剂有限公司;三价铬标准溶液(1000 μg/mL) 北京北方伟业计量技术研究院;无水乙醇、氢氧化钠 分析纯,天津市科密欧化学试剂有限公司;盐酸 优级纯,天津市科密欧化学试剂有限公司;硝酸 UP级,苏州晶瑞化学股份有限公司;人工胃液、人工肠液 福州飞净生物科技有限公司;透析袋 怡康科贸生物试剂耗材实验有限公司。
电感耦合等离子体质谱7800(ICP-MS-7800) 美国安捷伦公司;Multiwave PRO微波消解仪 奥利地安东帕公司;FD-304冷冻干燥机 济南骏德仪器有限公司;DKZ-2B电热恒温振荡水槽 上海一恒科技仪器有限公司;SECURA224-ICN型电子天平 赛多利斯科学仪器有限公司;S210 pH计 梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 南瓜皮多糖的制备
称取新鲜南瓜皮1 kg,切碎,加入去离子水6 L,水提90 min,过滤后收集滤液,重复提取一次;合并滤液,浓缩,加入4倍体积的无水乙醇进行醇沉,收集沉淀并复溶,Sevag法除蛋白后醇沉,冷冻干燥得南瓜皮多糖。苯酚-硫酸法[18]测得南瓜皮多糖含量为77.79%。
1.2.2 南瓜皮多糖铬复合物的制备
称取一定质量的南瓜皮多糖溶于200 mL去离子水中,与一定浓度的氯化铬溶液等体积混合,调节混合液pH,在一定温度下反应一段时间。反应完毕后,加入4倍体积的无水乙醇,醇沉,离心10 min,沉淀复溶后透析48 h,冷冻干燥得南瓜皮多糖铬。
1.2.3 单因素试验
1.2.3.1 铬与多糖质量比对螯合率的影响
将不同质量比(0.01:1,0.05:1,0.1:1,0.2:1,0.5:1,1:1)的南瓜皮多糖与铬混合液调整反应pH为7,在70 ℃振荡120 min,加入4倍体积的无水乙醇,醇沉,使用电感耦合等离子体质谱仪测定上清液中铬离子含量,计算螯合率,考察铬与多糖质量比对螯合率的影响。
1.2.3.2 反应温度对螯合率的影响
固定铬与多糖质量比为0.2:1,反应pH为7,将混合液在不同温度(50、60、70、80、90 ℃)下振荡120 min,醇沉后测定上清液中铬离子含量,相关步骤按照“1.2.3.1”操作,考察反应温度对螯合率的影响。
1.2.3.3 反应pH对螯合率的影响
固定铬与多糖质量比为0.2:1,调节不同pH(6、7、8、9、10)后将混合液在70 ℃振荡120 min,醇沉后测定上清液中铬离子含量,相关步骤按照“1.2.3.1”操作,考察反应pH对螯合率的影响。
1.2.3.4 反应时间对螯合率的影响
固定铬与多糖质量比为0.2:1,反应pH为7,将混合液在70 ℃分别振荡不同时间(60、90、120、150、180、210 min),醇沉后测定上清液中铬离子含量,相关步骤按照“1.2.3.1”操作,考察反应时间对螯合率的影响。
1.2.4 响应面优化试验
以单因素结果为基础,选择对南瓜皮多糖铬螯合率影响显著的铬与多糖质量比、反应温度和反应pH进行三因素三水平的响应面试验,以螯合率为响应值,因素水平表见表1。
表 1 响应面设计因素及水平Table 1. Response surface analysis factor and level coding table水平 因素 A 铬与多糖质量比 B 反应温度(℃) C 反应pH −1 0.01:1 50 6 0 0.05:1 60 7 1 0.1:1 70 8 1.2.5 螯合率的计算
螯合率(%)=初始铬含量−上清液中铬含量初始铬含量×100 1.2.6 铬含量的计算
1.2.6.1 铬标曲的绘制
利用三价铬标准溶液配制浓度分别为0.1、0.2、0.4、0.6、0.8、1.0 µg/mL的铬溶液。电感耦合等离子体质谱仪测定,仪器操作条件参考GB 5009.268-2016。以铬元素浓度(X,μg/mL)为横坐标,响应信号值(Y)为纵坐标,绘制标准曲线。测得标准曲线方程为Y=32.1232X+0.0063,R2=0.9998。
1.2.6.2 铬含量的测定
称取南瓜皮多糖铬0.02 g,加7 mL浓硝酸浸泡过夜,微波消解,分别于120 ℃消解3 min,180 ℃消解10 min,爬升时间5 min,赶酸1 h,冷却后转移到50 mL容量瓶中,去离子水定容,稀释50倍后用电感耦合等离子体质谱仪测定。
1.2.7 体外消化试验
参考文献[19-20]并稍作修改,对南瓜皮多糖铬和氯化铬进行体外模拟消化试验。向5 mg/mL的南瓜皮多糖铬和铬溶液中添加1 mol/L的盐酸溶液调节pH至2,加入等体积模拟胃液,混匀后在37 ℃的水浴分别振荡反应0、30、60、90、120、150、180、210、240 min,在95 ℃沸水浴中灭酶处理10 min,在4 ℃条件下保存备用。
取模拟胃液消化120 min后的南瓜皮多糖铬和氯化铬溶液,冷却至室温后加入1 mol/L的NaOH调节pH至7,将等体积模拟肠液混入均匀,转入透析袋中,在37 ℃的恒温水浴震荡器中分别反应1、2、4、6、8 h后,反应后在95 ℃沸水浴中灭酶处理10 min,在4 ℃条件下保存备用。
1.2.7.1 铬离子溶解率的测定
向消化后的溶液中加入4倍体积的无水乙醇醇沉,5000 r/min离心10 min后取上清液,测定铬离子含量,按照下列公式计算:
溶解率(%)=SY×100 式中:S表示上清液中铬离子的浓度,µg/mL;Y表示样品中铬离子的浓度,µg/mL。
1.2.7.2 透析率的测定
将消化后的溶液取样,采用电感耦合等离子体质谱仪测定铬离子含量,按照下列公式计算:
透析率(%)=T×VY×M×100 式中:T表示透析液铬离子的浓度,µg/mL;V表示透析液体积,mL;Y表示样品中铬离子的含量,µg/g;M表示样品的质量,g。
1.3 数据处理
实验平行三次,结果用平均值±标准差表示;利用Design Expert 8.0.6软件中的Box-Bohnken法优化试验方案并处理数据,采用SPSS 26.0软件对数据进行差异性显著分析(Duncan法,n=3,P<0.05);采用Origin 2019软件绘图。
2. 结果与分析
2.1 单因素试验结果
2.1.1 铬与多糖质量比对螯合率的影响
由图1可知,随着铬与多糖质量比的增大,螯合率呈现先升高后下降的趋势。当质量比为0.05:1时,螯合率达到最大值为92.22%。当质量比大于0.05:1时,螯合率降低,这种变化可能是因为南瓜皮多糖分子中的结合位点暴露减少,导致螯合率不高[21],故选择铬与多糖质量比为0.05:1为最佳。
2.1.2 反应温度对螯合率的影响
由图2可知,反应温度在50~60 ℃时螯合率呈递增的趋势,当温度为60 ℃时,螯合率达到最高,为77.33%。随着温度的继续升高,螯合率下降,这可能是因为温度会影响分子之间的碰撞频率,当温度过高时,多糖分子与铬离子运动过快,解析速率高于结合速率[22]。因此,温度选择60 ℃为最佳。
2.1.3 反应pH对螯合率的影响
由图3可知,随着pH的增大,螯合率呈现先升高后下降的趋势。当pH小于7时,螯合率随pH的增大而增加,在pH为7时螯合率达到最大值;随着pH继续增大,南瓜皮多糖与铬离子的螯合率下降,这可能是因为酸性条件下H+与铬离子竞争在多糖上的结合位点;碱性条件下,部分铬离子因碱性环境溶解度下降,导致螯合率下降[23]。因此,选择pH为7为最佳。
2.1.4 反应时间对螯合率的影响
由图4可知,反应时间在60~180 min以内时,南瓜皮多糖铬的螯合率趋于平稳状态,随着时间的延长,螯合率保持在71%左右,可发现时间对螯合率的影响较小,因此可将反应时间作为次要考虑因素,不作为响应面优化的参数。
2.2 响应面优化试验
2.2.1 响应面试验结果
在单因素试验的结果上,选择铬与多糖质量比、反应温度、反应pH进行三因素三水平响应面优化试验,试验设计及结果见表2,回归方程方差分析见表3。由表3可知,模型P<0.01,表明模型极显著,失拟项P=0.3123>0.05,表明不显著,R2=0.9233,R2Adj=0.8247,表明模型的拟合效果较好。以南瓜皮多糖铬的螯合率(%)为响应值,运用Design-Expert 8.0.6软件对试验结果进行回归拟合,得到的回归方程为:Y=96.17+10.65A+4.97B+2.62C−8.21AB−5.54AC−4.62BC−9.15A2−4.69B2−3.36C2。根据回归方程及方差分析可知,影响螯合率的主次顺序为铬与多糖质量比>反应温度>反应pH,此外,一次项A及二次项A2对螯合率的影响极显著,一次项B及交互项AB对螯合率的影响显著。一次项C、交互项AC、BC及二次项B2、C2对螯合作用影响不显著。
表 2 响应面试验设计及结果Table 2. Experimental design and results for response surface实验组 A 铬与多糖质量比 B 反应温度 C 反应pH 螯合率(%) 1 0 0 0 93.05 2 1 0 1 93.62 3 0 1 −1 97.68 4 0 −1 1 85.23 5 −1 1 0 83.23 6 −1 0 1 80.12 7 1 −1 0 97.19 8 0 −1 −1 70.69 9 1 0 −1 98.42 10 1 1 0 85.39 11 0 0 0 89.15 12 −1 −1 0 63.53 13 0 0 0 99.36 14 −1 0 −1 62.5 15 0 0 0 99.42 16 0 0 0 93.41 17 0 1 1 93.73 表 3 回归方程方差分析Table 3. Analysis of variance of regression equations方差来源 自由度 平方和 均方 F值 P值 显著性 模型 9 2131.48 236.83 9.37 0.0038 ** A 1 908.23 908.23 35.92 0.0005 ** B 1 196.23 196.23 7.76 0.0271 * C 1 54.52 54.52 2.16 0.1855 AB 1 271.12 271.12 10.72 0.0136 * AC 1 123.52 123.52 4.88 0.0628 BC 1 85.47 85.47 3.38 0.1086 A2 1 341.80 341.80 13.52 0.0079 ** B2 1 92.53 92.53 3.66 0.0973 C2 1 47.47 47.47 1.88 0.2130 残差 7 177.01 25.29 失拟项 3 97.98 32.66 1.65 0.3123 不显著 纯误差 4 79.02 19.76 总和 16 2308.49 注:*P<0.05,影响显著;**P<0.01,影响极显著。 2.2.2 三维响应面图和二维等高线图分析
铬与多糖质量比和反应温度、铬与多糖质量比和反应pH、反应温度和反应pH的交互作用的响应面图和等高线图分别如图5所示。在铬与多糖质量比和反应温度的交互作用中,铬与多糖质量比方向的响应面更陡峭,等高线更加密集,而在反应温度方向的响应面较为平缓,等高线较为稀疏,表明铬与多糖质量比对螯合率的影响更显著。在铬与多糖质量比和反应pH的交互作用中,铬与多糖质量比方向的响应面更陡峭,等高线更加密集,而在反应pH方向的响应面较为平缓,等高线较为稀疏,表明铬与多糖质量比对螯合率的影响更显著。在反应温度和反应pH的交互作用中,反应温度方向的响应面更陡峭,等高线更加密集,而在反应pH方向的响应面较为平缓,等高线较为稀疏,表明反应温度对螯合率的影响更显著。
2.2.3 优化工艺验证试验
通过模型预测得到南瓜皮多糖铬复合物的最佳合成条件为:铬与多糖质量比0.08:1,温度60.94 ℃,pH6.84,南瓜皮多糖铬复合物的理论最大螯合率为99.33%。考虑实际情况,将条件调整为铬与多糖质量比0.08:1,温度60 ℃,pH6.8,在此条件下,南瓜皮多糖铬复合物螯合率为99.23%±0.12%,与模型预测值相近,相差0.10%。可选用该模型。
2.3 南瓜皮多糖铬和氯化铬的体外消化特性
2.3.1 南瓜皮多糖铬和氯化铬在模拟胃液中的消化情况
南瓜皮多糖铬和氯化铬在胃液中的铬离子溶解率如图6所示。从图6中可以看出,氯化铬在胃液中的溶解率较高,在30~150 min内,溶解率先下降后上升,150 min时溶解率达到最大值39.92%,随着反应的进行溶解率呈现先下降后上升再下降的趋势,推测前期铬离子会与胃液中的胃蛋白酶结合使所得铬离子溶解率较低,后期在酸性环境下解离速度大于结合速度,导致胃液中浓度上升[24-26]。南瓜皮多糖铬的铬离子溶解率随时间的增加而增大,但远小于氯化铬中铬离子的溶解率,这可能是因为南瓜皮多糖铬对胃液具有抗消化性[27-28],因此解析程度较弱,缓释性较好。
2.3.2 南瓜皮多糖铬和氯化铬在模拟肠液中的消化与吸收情况
南瓜皮多糖铬和氯化铬在肠液中的消化情况见图7。在1~6 h内,随着反应时间的增加,氯化铬的铬离子溶解率显著下降(P<0.05),当反应结束时溶解率为0.9%,主要是因为在弱碱性环境下铬离子生成铬沉淀,导致溶解率降低[29]。南瓜皮多糖铬的铬离子在肠液中的溶解率低于胃液,溶解率低于氯化铬,含量趋势为先上升后保持稳定,南瓜皮多糖铬在碱性环境下溶解率不高,但因为糖的保护作用没有引起铬离子含量下降。
南瓜皮多糖铬和氯化铬在肠液中的透析率随反应时间的变化见图8。南瓜皮多糖铬的透析率在0.2%~1.0%之间且随时间的延长而增加,这与Garcia等[30]发现饮食中铬的透析率在0.4%~1.6%之间的结果接近。南瓜皮多糖铬的透析率大于氯化铬在肠液中的透析率,原因推测为多糖及其消化产物与铬离子结合,具有一定的保护作用,提高了铬离子的透过率[31]。结果表明,南瓜皮多糖铬的生物接受率高于氯化铬,与Disilvestro等[32]发现吡啶甲酸铬比氯化铬利用率更高的结果类似。
3. 结论
本研究建立了南瓜皮多糖铬复合物制备工艺,考察了铬与多糖质量比、温度、pH和时间对南瓜皮多糖铬螯合率的影响。根据单因素和响应面试验,确定了对螯合率影响顺序依次是质量比、温度、pH,最佳工艺条件为铬与多糖质量比0.08:1,温度60 ℃,pH6.8,螯合率为99.23%±0.12%,优化后的工艺可用于南瓜皮多糖铬的制备。体外消化模拟试验表明,南瓜皮多糖铬在胃肠液中的溶解率低于氯化铬,在胃液酸性环境中具有一定缓释效果,在肠液中的透析率高于氯化铬,因此南瓜皮多糖铬具有较高的生物接受率。本研究为新型补铬产品的开发和南瓜皮的综合利用提供参考。
-
表 1 响应面设计因素及水平
Table 1 Response surface analysis factor and level coding table
水平 因素 A 铬与多糖质量比 B 反应温度(℃) C 反应pH −1 0.01:1 50 6 0 0.05:1 60 7 1 0.1:1 70 8 表 2 响应面试验设计及结果
Table 2 Experimental design and results for response surface
实验组 A 铬与多糖质量比 B 反应温度 C 反应pH 螯合率(%) 1 0 0 0 93.05 2 1 0 1 93.62 3 0 1 −1 97.68 4 0 −1 1 85.23 5 −1 1 0 83.23 6 −1 0 1 80.12 7 1 −1 0 97.19 8 0 −1 −1 70.69 9 1 0 −1 98.42 10 1 1 0 85.39 11 0 0 0 89.15 12 −1 −1 0 63.53 13 0 0 0 99.36 14 −1 0 −1 62.5 15 0 0 0 99.42 16 0 0 0 93.41 17 0 1 1 93.73 表 3 回归方程方差分析
Table 3 Analysis of variance of regression equations
方差来源 自由度 平方和 均方 F值 P值 显著性 模型 9 2131.48 236.83 9.37 0.0038 ** A 1 908.23 908.23 35.92 0.0005 ** B 1 196.23 196.23 7.76 0.0271 * C 1 54.52 54.52 2.16 0.1855 AB 1 271.12 271.12 10.72 0.0136 * AC 1 123.52 123.52 4.88 0.0628 BC 1 85.47 85.47 3.38 0.1086 A2 1 341.80 341.80 13.52 0.0079 ** B2 1 92.53 92.53 3.66 0.0973 C2 1 47.47 47.47 1.88 0.2130 残差 7 177.01 25.29 失拟项 3 97.98 32.66 1.65 0.3123 不显著 纯误差 4 79.02 19.76 总和 16 2308.49 注:*P<0.05,影响显著;**P<0.01,影响极显著。 -
[1] CHEN S, KHAN B M, CHEONG K L, et al. Pumpkin polysaccharides: Purification, characterization and hypoglycemic potential[J]. International Journal of Biological Macromolecules,2019,139:842−849. doi: 10.1016/j.ijbiomac.2019.08.053
[2] LI F, WEI Y L, LIANG L, et al. A novel low-molecular-mass pumpkin polysaccharide: Structural characterization, antioxidant activity, and hypoglycemic potential[J]. Carbohydrate Polymers,2020,251:117090.
[3] 陈雪, 刘金福, 张业尼, 等. 基于细胞氧化应激模型的南瓜多糖与人参皂苷联合抗氧化作用研究[J]. 食品研究与开发,2019,40(8):40−44. [CHEN X, LIU J F, ZHANG Y N, et al. Studies on the combined antioxidant effects of pumpkin polysaccharides and ginsenosides based on cellular oxidative stress model[J]. Food Research and Development,2019,40(8):40−44. doi: 10.3969/j.issn.1005-6521.2019.08.007 CHEN X, LIU J F, ZHANG Y N, et al. Studies on the combined antioxidant effects of pumpkin polysaccharides and ginsenosides based on cellular oxidative stress model[J]. Food Research and Development, 2019, 40(8): 40-44. doi: 10.3969/j.issn.1005-6521.2019.08.007
[4] LU A X, YU M G, FANG Z Y, et al. Preparation of the controlled acid hydrolysates from pumpkin polysaccharides and their antioxidant and antidiabetic evaluation[J]. International Journal of Biological Macromolecules,2019,121:261−269. doi: 10.1016/j.ijbiomac.2018.09.158
[5] 商龙臣, 吴少魏, 张驰, 等. 南瓜硒多糖的制备表征及活性分析[J]. 食品科学,2016,37(19):48−53. [SHANG L C, WU S W, ZHANG C, et al. Preparation, characterization and activity analysis of selenium-containing pumpkin polysaccharide[J]. Food Science,2016,37(19):48−53. doi: 10.7506/spkx1002-6630-201619008 SHANG L C, WU S W, ZHANG C, et al. Preparation, characterization and activity analysis of selenium-containing pumpkin polysaccharide[J]. Food Science, 2016, 37(19): 48-53. doi: 10.7506/spkx1002-6630-201619008
[6] SHEN W X, CHEN C H, GUAN Y Y, et al. A pumpkin polysaccharide induces apoptosis by inhibiting the JAK2/STAT3 pathway in human hepatoma HepG2 cells[J]. International Journal of Biological Macromolecules,2017,104:681−686. doi: 10.1016/j.ijbiomac.2017.06.078
[7] 白小东, 程超, 牛黎莉, 等. 响应面法优化超声波辅助提取南瓜皮中果胶的工艺[J]. 中国食品添加剂,2021,32(4):50−56. [BAI X D, CHENG C, NIU L L, et al. Response surface method to optimize the ultrasonic-assisted extraction process of pectin from pumpkin peel[J]. China Food Additives,2021,32(4):50−56. doi: 10.19804/j.issn1006-2513.2021.04.009 BAI X D, CHENG C, NIU L L, et al. Response surface method to optimize the ultrasonic-assisted extraction process of pectin from pumpkin peel[J]. China Food Additives, 2021, 32(4): 50-56. doi: 10.19804/j.issn1006-2513.2021.04.009
[8] 杨秋明, 宋江峰, 李大婧, 等. 响应面法优化超声波提取南瓜皮叶黄素的工艺研究[J]. 食品工业科技,2018,39(1):149−155. [YANG Q M, SONG J F, LI D J, et al. Optimization of ultrasonic extraction process for lutein from pumpkin peel by response surface methodology[J]. Science and Technology of Food Industry,2018,39(1):149−155. YANG Q N, SONG J F, LI D J, et al. Optimization of ultrasonic extraction process for lutein from pumpkin peel by response surface methodology[J]. Science and Technology of Food Industry, 2018, 39(1): 149-155.
[9] 唐海燕, 肖清贵, 徐红彬, 等. 新型铬化学品——有机铬研究进展[J]. 化工进展,2013,32(9):2205−2215, 2241. [TANG H Y, XIAO Q G, XU H B, et al. Progress of new chromium chemicals: Organic chromium complexes[J]. Chemical Industry and Engineering Progress,2013,32(9):2205−2215, 2241. TANG H Y, XIAO Q G, XU H B, et al. Progress of new chromium chemicals: Organic chromium complexes[J]. Chemical Industry and Engineering Progress, 2013, 32(9): 2205-2215, 2241.
[10] 柴杰. Cr(pic)3衍生物的理化性质、安全性及降糖活性[D]. 太原: 山西大学, 2019. CHAI J. Physiochemical properties, safety and hypoglycemic activity of Cr(pic)3 derivatives[D]. Taiyuan: Shanxi University, 2019.
[11] 唐海燕, 肖清贵, 徐红彬, 等. 有机铬营养生物学研究进展[J]. 食品工业科技,2014,35(12):378−383. [TANG H Y, XIAO Q G, XU H B, et al. Research progress in the nutritional biology of organic trivalent chromium[J]. Science and Technology of Food Industry,2014,35(12):378−383. doi: 10.13386/j.issn1002-0306.2014.12.074 TANG H Y, XIAO Q G, XU H B, et al. Research progress in the nutritional biology of organic trivalent chromium[J]. Science and Technology of Food Industry, 2014, 35(12): 378-383. doi: 10.13386/j.issn1002-0306.2014.12.074
[12] 邓毅, 尹龙萍, 赵爱华, 等. 黄芪多糖铬络合物的合成及其降血糖活性的初步研究[J]. 食品科学,2007(6):317−320. [DENG Y, YIN L P, ZHAO A H, et al. Preliminary study on preparation of astragalus polysaccharide-chromium complex and its hypoglycemic activities in diabetic animal model[J]. Food Science,2007(6):317−320. doi: 10.3321/j.issn:1002-6630.2007.06.077 DENG Y, YIN L P, ZHAO A H, et al. Preliminary study on preparation of astragalus polysaccharide-chromium complex and its hypoglycemic activities in diabetic animal model[J]. Food Science, 2007(6): 317-320. doi: 10.3321/j.issn:1002-6630.2007.06.077
[13] GUO W L, CHEN M, PAN W L, et al. Hypoglycemic and hypolipidemic mechanism of organic chromium derived from chelation of Grifola frondosa polysaccharide-chromium (III) and its modulation of intestinal microflora in high fat-diet and STZ-induced diabetic mice[J]. International Journal of Biological Macromolecules,2020,145:1208−1218. doi: 10.1016/j.ijbiomac.2019.09.206
[14] LI L, XU J X, CAO Y J, et al. Preparation of Ganoderma lucidum polysaccharide-chromium (III) complex and its hypoglycemic and hypolipidemic activities in high-fat and high-fructose diet-induced pre-diabetic mice[J]. International Journal of Biological Macromolecules,2019,140:782−793. doi: 10.1016/j.ijbiomac.2019.08.072
[15] ZHANG C, HUANG M, HONG R, et al. Preparation of a Momordica charantia L. polysaccharide-chromium (III) complex and its anti-hyperglycemic activity in mice with streptozotocin-induced diabetes[J]. International Journal of Biological Macromolecules,2019,122:619−627. doi: 10.1016/j.ijbiomac.2018.10.200
[16] WANG C, CHEN Z Q, PAN Y X, et al. Anti-diabetic effects of Inonotus obliquus polysaccharides-chromium (III) complex in type 2 diabetic mice and its sub-acute toxicity evaluation in normal mice[J]. Food and Chemical Toxicology,2017,108:498−509. doi: 10.1016/j.fct.2017.01.007
[17] 张磊, 曹毓, 彭龙玲, 等. 海藻多糖铬络合物降糖作用的实验研究[J]. 四川生理科学杂志,2002(2):69−71. [ZHANG L, CAO Y, PENG L L, et al. Hypoglycemic effect of algal polysaccharide chromium complex[J]. Sichuan Journal of Physiological Sciences,2002(2):69−71. doi: 10.3969/j.issn.1671-3885.2002.02.008 ZHANG L, CAO L, PENG L L, et al. Hypoglycemic effect of algal polysaccharide chromium complex[J]. Sichuan Journal of Physiological Sciences, 2002(2): 69-71. doi: 10.3969/j.issn.1671-3885.2002.02.008
[18] 王迎香, 唐子惟, 彭腾, 等. 苯酚-硫酸法测定酒蒸多花黄精多糖含量的优化[J/OL]. 食品工业科技: 1−15 [2021-08-28]. https://doi.org/10.13386/j.issn1002-0306.2021010069. WANG Y X, TANG Z W, PENG T, et al. Optimization of phenol-sulfuric acid method for the polysaccharide content of wine-steamed polygonatum cyrtonema Hua[J/OL]. Science and Technology of Food Industry: 1−15 [2021-08-28]. https://doi.org/10.13386/j.issn1002-0306.2021010069.
[19] 徐威, 张碟, 蔡杰, 等. 硒蛋白微胶囊的制备、结构表征及体外消化特性研究[J]. 食品工业科技,2020,41(14):29−35. [XU W, ZHANG D, CAI J, et al. Preparation, structural characterization, and in vitro digestibility of selenoprotein microcapsules[J]. Science and Technology of Food Industry,2020,41(14):29−35. doi: 10.13386/j.issn1002-0306.2020.14.005 XU W, ZHANG D, CAI J, et al. Preparation, structural characterization, and in vitro digestibility of selenoprotein microcapsules[J]. Science and Technology of Food Industry, 2020, 41(14): 29-35. doi: 10.13386/j.issn1002-0306.2020.14.005
[20] 王旭, 王磊, 王强, 等. 酪蛋白酶解产物-锌络合物的结构鉴定及体外消化特性分析[J]. 食品科学,2010,31(7):19−21. [WANG X, WANG L, WANG Q, et al. Structural identification and in vitro digestion characteristics of casein hydrolysate-zinc complex[J]. Food Science,2010,31(7):19−21. WANG X, WANG L, WANG Q, et al. Structural identification and in vitro digestion characteristics of casein hydrolysate-zinc complex[J]. Food Science, 2010, 31(7): 19-21.
[21] GUO W L, SHI F F, LI L, et al. Preparation of a novel Grifola frondosa polysaccharide-chromium (III) complex and its hypoglycemic and hypolipidemic activities in high fat diet and streptozotocin-induced diabetic mice[J]. International Journal of Biological Macromolecules,2019,131:81−88. doi: 10.1016/j.ijbiomac.2019.03.042
[22] QIU J, ZHANG H, WANG Z, et al. Response surface methodology for the synthesis of an Auricularia auriculajudae polysaccharides-CDDP complex[J]. International Journal of Biological Macromolecules,2016,93:333−343. doi: 10.1016/j.ijbiomac.2016.06.066
[23] CHI Y Z, LI Y P, et al. Effect of extraction techniques on properties of polysaccharides from Enteromorpha prolifera and their applicability in iron chelation[J]. Carbohydrate Polymers: Scientific and Technological Aspects of Industrially Important Polysaccharides,2018,181:616−623.
[24] 李勇, 葛向阳. 复合肽螯合锌有效螯合率测定方法研究—凝胶过滤色谱络合滴定法[J]. 中国食品添加剂,2012(3):222−228. [LI Y, GE X Y. The chelating rate of peptide chelating zinc and its determination method by gel filtration chromatography complexometric titration[J]. China Food Additives,2012(3):222−228. doi: 10.3969/j.issn.1006-2513.2012.03.038 LI Y, GE X Y. The chelating rate of peptide chelating zinc and its determination method by gel filtration chromatography complexometric titration[J]. China Food Additives, 2012(3): 222-228. doi: 10.3969/j.issn.1006-2513.2012.03.038
[25] 郝春莉, 黄婧筠, 黄志勇. 模拟胃肠道消化液中小球藻类金属硫蛋白对镉离子的结合作用研究[J]. 化学研究与应用,2021,33(1):62−67. [HAO C L, HUANG J J, HUANG Z Y. Binding effect of MT-like proteins from Chlorella sp. to Cd2+ in simulate gastrointestinal digestive juices[J]. Chemical Research and Application,2021,33(1):62−67. doi: 10.3969/j.issn.1004-1656.2021.01.007 HAO C L, HUANG J J, HUANG Z Y. Binding effect of MT-like proteins from Chlorella sp. to Cd2+ in simulate gastrointestinal digestive juices[J]. Chemical Research and Application, 2021, 33(1): 62-67. doi: 10.3969/j.issn.1004-1656.2021.01.007
[26] 庞忠莉. 牡蛎肽亚铁螯合物的制备及性质研究[D]. 广州: 华南理工大学, 2020. PANG Z L. Study on preparation and properties of oyster peptide ferrous chelate[D]. Guangzhou: South China University of Technology, 2020.
[27] 刘文颖, 谷瑞增, 林峰, 等. 海洋骨胶原低聚肽钙配合物的稳定性[J]. 食品工业科技,2015,36(4):111−115. [LIU W Y, GU R Z, LIN F, et al. Stability of calcium-chelating marine bone collagen oligopeptides[J]. Science and Technology of Food Industry,2015,36(4):111−115. doi: 10.13386/j.issn1002-0306.2015.04.015 LIU W Y, GU R Z, LIN F, et al. Stability of calcium-chelating marine bone collagen oligopeptides[J]. Science and Technology of Food Industry, 2015, 36(4): 111-115. doi: 10.13386/j.issn1002-0306.2015.04.015
[28] 刘文颖, 鲁军, 宋莎莎, 等. 乌鸡低聚肽亚铁螯合物的分离纯化与结构鉴定(英文)[J]. 现代食品科技,2017,33(8):95−102, 79. [LIU W Y, LU J, SONG S S, et al. Isolation and structural identification of iron (II)-chelated oligopeptides from black-bone silky fowl[J]. Modern Food Science and Technology,2017,33(8):95−102, 79. doi: 10.13982/j.mfst.1673-9078.2017.8.015 LIU W Y, LU J, SONG S S, et al. Isolation and structural identification of iron (II)-chelated oligopeptides from black-bone silky fowl[J]. Modern Food Science and Technology, 2017, 33(8): 95-102, 79. doi: 10.13982/j.mfst.1673-9078.2017.8.015
[29] 富天昕, 张舒, 盛亚男, 等. 绿豆多肽锌螯合物的制备及其结构与体外消化的分析[J]. 食品科学,2020,41(4):59−66. [FU T X, ZHANG S, SHENG Y N, et al. Preparation, structure and in vitro digestibility of zinc-chelating mung bean peptide[J]. Food Science,2020,41(4):59−66. doi: 10.7506/spkx1002-6630-20190710-137 FU T X, ZHANG S, SHENG Y N, et al. Preparation, structure and in vitro digestibility of zinc-chelating mung bean peptide[J]. Food Science, 2020, 41(4): 59-66. doi: 10.7506/spkx1002-6630-20190710-137
[30] GARCIA E, CABRERA C, LORENZO M L, et al. Estimation of chromium bioavailability from the diet by an in vitro method[J]. Food Additives & Contaminants,2001,18(7):601−606.
[31] 玄依凡. 乳清蛋白肽—锌离子螯合物的制备及特性研究[D]. 哈尔滨: 哈尔滨工业大学, 2017. XUN Y F. Preparation and charaterization of whey protein peptide-zinc[D]. Harbin: Harbin Institute of Technology, 2017.
[32] DISILVESTRO R A, DY E. Comparison of acute absorption of commercially available chromium supplements[J]. Journal of Trace Elements in Medicine & Biology,2007,21(2):120−124.
-
期刊类型引用(2)
1. 赵一萌,索晓雄,刘彩霞,尚彩玲,杜晨晖,闫艳,裴香萍. 药用植物蛋白提取方法及生物活性研究进展. 食品安全质量检测学报. 2024(15): 119-126 .  百度学术
百度学术
2. 邓梓萌,侯鹏颉,刘思迪,崔俊良,刘志勇,尹学东,冷虹薇,廖小军,赵靓. 辣椒籽分离蛋白超滤提取工艺优化及特性表征. 中国调味品. 2024(09): 1-8 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:

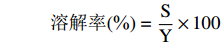
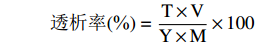








 下载:
下载:



