Optimization of Enzymatic Hydrolysis Process of Immune Active Peptide in Chub Mackerel
-
摘要: 为了优化鲐鱼免疫活性肽的酶法制备工艺,以水解度和小鼠脾淋巴细胞相对增殖率为指标,在单因素实验的基础上,选择酶添加量、酶解时间和酶解温度为考察因素,采用Box-Behnken法进行三因素三水平响应面试验设计,确定鲐鱼免疫活性肽的最佳酶解条件,并对得到的鲐鱼免疫活性肽进行氨基酸组成分析。结果表明,中性蛋白酶为最优蛋白酶,最佳酶解条件为酶添加量8800 U/g、时间7 h、温度52 ℃,验证实验发现在该条件下得到的酶解产物对小鼠脾淋巴细胞相对增殖率为48.11%±2.67%,与回归方程预测值相近。同时鲐鱼免疫活性肽氨基酸含量丰富,其中人体必需氨基酸达45.52%,疏水性氨基酸含量为32.00%。研究结果为鲐鱼免疫活性肽的酶法制备提供了理论依据,为进一步实现鲐鱼资源的高值化利用提供了参考。Abstract: In order to optimize the enzymatic extraction process of chub mackerel immune active peptide, taking the proliferation rate and degree of hydrolysis of mouse spleen lymphocytes as indicators, on the basis of single factor tests, the enzyme addition amount, enzymatic hydrolysis time and enzymatic hydrolysis temperature were selected as the investigation factors, and the Box-Behnken method was used for three factors and three levels response surface test design to determine the best enzymatic preparation process of chub mackerel immune active peptide. The amino acid composition of the obtained immune active peptide of chub mackerel was analyzed. The results showed that neutral protease was the best protease, and the best enzymatic hydrolysis conditions were enzyme addition 8800 U/g, time 7 h and temperature 52 ℃. The verification experiment found that the relative proliferation rate of mouse spleen lymphocytes obtained under these conditions was 48.11%±2.67%, which was close to the predicted value of regression equation. At the same time, chub mackerel immune active peptide was rich in amino acids, including 45.52% essential amino acids and 32.00% hydrophobic amino acids. The results would provide a theoretical basis for enzymatic preparation of immune active peptide for chub mackerel, and a reference for further realization of high value utilization of chub mackerel resources.
-
鲐鱼,又名青占鱼,鲈形目,鲭科,鲐属,其具有分布广、产量高等特点,是北太平洋西部主要的经济鱼类之一,调查研究显示目前鲐鱼主要仍以鲜食为主,仅有少量用于鱼粉加工,其深加工产品与产量相比存在巨大差异[1-3]。
近年来对海洋生物中生物活性物质的研究成为热点,其中便包括获得具有不同生理功能的生物活性肽,如抗氧化肽、ACE抑制肽、免疫活性肽等。海洋鱼类营养价值高,蛋白质含量丰富,一直以来都被视为优质蛋白来源,因此从海洋鱼类蛋白中提取生物活性肽值得更加深入的研究[4-7]。其中免疫活性肽作为一类具有免疫调节功能的生物活性肽,有分子量小、稳定性强、生物活性高等诸多优点[8],同时根据已有研究证明免疫活性肽具有能刺激淋巴细胞增殖,增强巨噬细胞吞噬等多种生理功能,目前已经成为医学研究与保健食品开发领域的研究热点[9-11]。纪丽娜[12]通过酶解金枪鱼头提取得到的免疫活性肽能刺激巨噬细胞增殖和促进巨噬细胞的吞噬功能。侯虎[13]选用胰蛋白酶酶解阿拉斯加鳕鱼获得的免疫活性肽能提高小鼠脾淋巴细胞转化活性以及巨噬细胞的吞噬功能,后利用离子交换色谱、凝胶过滤色谱和反相高效液相色谱进一步纯化活性最高的肽组分,进而得到3种免疫活性肽序列。邓志程[14]采用模拟消化酶解的方式制备马氏珠母贝全脏器免疫活性肽,同时结合超滤、凝胶过滤色谱等技术进行进一步分离纯化,获得了两个免疫活性肽。同时也有一些研究证明通过酶解制备的生物活性肽显示出特定的免疫活性[15-17]。王雪芹[18]通过酶法制备的鲐鱼多肽具有较强的抗氧化性和抗疲劳作用,但是目前将鲐鱼作为蛋白质来源制备免疫活性肽的研究未见报道。
本文以鲐鱼鱼肉为原料,以水解度和小鼠脾淋巴细胞相对增殖率为指标,经单因素实验及响应面法优化鲐鱼免疫活性肽的酶法制备工艺,以期为酶法制备鲐鱼免疫活性肽及进一步研究其免疫活性提供依据,也希望能对后续免疫活性肽的深入研究以及提高海洋低值鱼的利用率提供一些理论参考。
1. 材料与方法
1.1 材料与仪器
新鲜鲐鱼 购于宁波市路林市场;小鼠脾淋巴细胞 购于上海赛百慷生物科技有限公司,由本实验室复苏培养;胰蛋白酶、碱性蛋白酶、酸性蛋白酶、木瓜蛋白酶、中性蛋白酶、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT) 索莱宝生物科技有限公司;磷酸二氢钠、磷酸氢二钠、柠檬酸、三氯乙酸、二甲亚砜(DMSO) 分析纯,国药集团化学试剂有限公司;胎牛血清、RPMI-1640完全培养基 美国Gibco公司。
组织搅碎机 山东九阳公司;AR223CN电子天平 常州奥豪斯仪器有限公司;DKS-24数显恒温水浴锅 常州市伟嘉仪器制造有限公司;超低温高速离心机 日本日立公司;倒置显微镜 日本Olympus公司;PHS-29A数显酸度计 上海虹益仪器有限公司;超净工作台 上海智诚分析仪器制造公司;CO2细胞培养箱 美国Thermo公司;酶标仪 美国Bio-Rad公司;LCJ-25C型冷冻干燥机 北京四环科学仪器厂有限公司产品。
1.2 实验方法
1.2.1 样品预处理
鲐鱼去头去尾,去除内脏,剥除鱼皮,剔去鱼刺,取纯肉搅碎,置于−40 ℃冰箱冷冻备用。
1.2.2 鲐鱼鱼肉基本成分的测定
鲐鱼鱼肉中水分含量测定采用GB 5009.3-2016《食品安全国家标准食品中水分的测定》直接干燥法[19];灰分含量测定采用GB 5009.4-2016《食品安全国家标准 食品中灰分的测定》高温灰化法[20];蛋白质含量测定采用GB 5009.5-2016《食品安全国家标准 食品中蛋白质的测定》中的凯氏定氮法[21];脂肪含量的测定采用GB 5009.6-2016《食品安全国家标准 食品中脂肪的测定》中的索氏提取法[22]。
1.2.3 蛋白酶的筛选
参考胡旭阳[23]的方法,取一定量的鲐鱼鱼肉,以料液比1:5 g/mL加入相应pH缓冲溶液,酶添加量为6000 U/g,在每种蛋白酶的最适条件下酶解6 h。其中木瓜蛋白酶的酶解条件为50 ℃,pH7.0;胰蛋白酶的酶解条件为40 ℃,pH7.0;中性蛋白酶酶解条件为50 ℃,pH7.0;碱性蛋白酶酶解条件为50 ℃,pH10.0;酸性蛋白酶酶解条件为50 ℃,pH3.0。酶解完成后在沸水浴中灭酶15 min,立即冷却至室温,于10000 r/min离心15 min,取上清液。将上清液进行真空冷冻干燥,配制成相应浓度的样液,采用MTT法测定酶解产物对小鼠脾淋巴细胞增殖的影响,筛选最适蛋白酶。
1.2.4 单因素实验
1.2.4.1 不同酶添加量对小鼠脾淋巴细胞增殖率的影响
将酶添加量分别设为2000、4000、6000、8000、10000 U/g,按料液比1:5 g/mL、pH7.0、温度50 ℃,时间6 h进行酶解,测定酶解产物的水解度,并采用MTT法测定小鼠脾淋巴细胞相对增殖率。
1.2.4.2 不同酶解时间对小鼠脾淋巴细胞增殖率的影响
将酶解时间分别设为4、5、6、7、8 h,按料液比1:5 g/mL、pH7.0、温度50 ℃、酶添加量6000 U/g进行酶解,测定酶解产物的水解度,并采用MTT法测定小鼠脾淋巴细胞相对增殖率。
1.2.4.3 不同酶解温度对小鼠脾淋巴细胞增殖率的影响
将酶解温度分别设为30、40、50、60、70 ℃,按料液比1:5 g/mL、pH7.0、酶添加量6000 U/g,时间6 h进行酶解,测定酶解产物的水解度,并采用MTT法测定小鼠脾淋巴细胞相对增殖率。
1.2.5 响应面试验
在单因素实验结果的前提下,以小鼠脾淋巴细胞相对增殖率为指标,选择酶添加量、酶解时间和酶解温度为工艺参数,设计三因素三水平Box-Behnken响应面试验,优化鲐鱼鱼肉免疫活性肽的最佳酶解工艺,试验因素水平如表1所示。
表 1 响应面试验因素与水平设计Table 1. Factor and levels of response surface experiment水平 因素 A时间(h) B温度(℃) C酶添加量(U/g) −1 6.5 45 7000 0 7 50 8000 1 7.5 55 9000 1.2.6 水解度测定
水解度根据式(1)计算。其中氨基酸态氮含量采用GB 5009.235-2016《食品安全国家标准 食品中氨基酸态氮的测定》中的酸度计法测定[24];总氮含量采用GB 5009.5-2016《食品安全国家标准 食品中蛋白质的测定》中的凯氏定氮法测定[21]。
水解度(%)=氨基酸态氮含量总氮含量×100 (1) 1.2.7 小鼠脾淋巴细胞相对增殖率测定
1.2.7.1 小鼠脾淋巴细胞复苏
参考董晓泽[25]的方法并略做修改,从−80 ℃冰箱中将小鼠脾淋巴细胞冻存管取出,立刻置于37 ℃中水浴融解,在超净工作台内将解冻的细胞液全部转移至无菌离心管中,1000 r/min离心5 min,弃去上清液,再加入1 mL配制好的含有10%胎牛血清的RPMI-1640完全培养基,轻轻吹打使之均匀分散。将细胞悬液完全移入T25的无菌培养瓶中,继续加入4 mL含有10%胎牛血清的RPMI-1640完全营养液,轻轻摇动瓶身,使其均匀分布在培养瓶中,放入37 ℃,5% CO2细胞培养箱中培养观察。
1.2.7.2 鲐鱼鱼肉酶解产物对小鼠脾淋巴细胞的影响
参考李志永[26]的方法以MTT法测定小鼠脾淋巴细胞相对增殖率并略做修改,选择对数生长期的细胞进行实验,调整细胞浓度为4×106个/mL。无菌操作条件下,向96孔板中依次接种100 µL细胞悬液和100 µL样液(浓度为500 µg/mL,取冻干后的样品粉末以RPMI-1640完全培养基溶解,经0.22 μm滤膜过滤除菌),以等体积RPMI-1640完全培养基代替样品作空白对照组,每组设5个复孔,并在96孔板最外圈每孔加入200 µL无菌PBS溶液。于37 ℃,5% CO2细胞培养箱中孵育48 h后,在避光条件下每孔加入20 µL MTT溶液(浓度为5 mg/mL,以PBS溶解,0.22 μm滤膜过滤除菌),继续培养4 h,4000 r/min离心5 min,弃去上清,每孔加入100 µL DMSO,振荡5 min,立即用酶标仪于593 nm处测定OD值,根据式(2)计算小鼠脾淋巴细胞相对增殖率。
相对增殖率(%)=A1−A0A0×100 (2) 式中:A1表示实验组在593 nm处的OD值;A0表示空白组在593 nm处的OD值。
1.2.8 氨基酸含量测定
采用响应面优化得到的条件制备鲐鱼免疫活性肽,样品经真空冷冻干燥,保存于−40 ℃冰箱。根据GB 5009.124-2016《食品安全国家标准 食品中氨基酸的测定》[27]的方法,测定分析样品中的氨基酸含量。
1.3 数据处理
所有样品均平行3组。采用Excel进行数据处理及绘图,Design Expert 10.0进行响应面设计,SPSS软件进行数据分析。
2. 结果与分析
2.1 鲐鱼鱼肉基本成分分析
鲐鱼鱼肉基本营养组成成分如表2所示,可以看出鲐鱼鱼肉中基本营养物质含量丰富,其中蛋白质含量高,脂肪含量较低,适用于后续进行酶解制备免疫活性肽的研究。
表 2 鲐鱼鱼肉营养成分组成Table 2. Nutrient composition of chub mackerel meat组分 水分 灰分 蛋白质 脂肪 含量(%) 65.25±0.51 3.64±0.26 25.06±1.05 7.76±0.41 2.2 最适蛋白酶的筛选
选择合适的蛋白酶酶解是提取生物活性肽至关重要的因素,因为不同的蛋白酶具有不同的酶切位点,从而可以影响肽段从蛋白中的释放位点[11]。5种蛋白酶对鲐鱼鱼肉水解度及酶解产物对小鼠脾淋巴细胞相对增殖率的影响如图1所示,由图1可以看出水解度和细胞相对增殖率的变化趋势具有明显差异。从水解度来看,胰蛋白酶的水解度最高,酸性蛋白酶次之,然而这两种蛋白酶的酶解产物的细胞相对增殖率较低,中性蛋白酶的水解度虽然偏低,但是具有最高的细胞相对增殖率,达31.36%,显著高于其他蛋白酶的酶解产物(P<0.05)。因为蛋白酶的种类不同,所获得的酶解产物中的多肽组成也会不同,因此其具有的生物活性也存在较大差异。其中中性蛋白酶可以对C端为芳香族疏水性氨基酸的肽链进行酶切作用[28],同时已有大量研究发现免疫活性肽大多含有疏水性氨基酸,故选择中性蛋白酶为本实验中制备鲐鱼免疫活性肽的最适蛋白酶。
2.3 单因素实验结果
2.3.1 酶添加量对水解度和小鼠脾淋巴细胞相对增殖率的影响
图2所示为酶添加量对鲐鱼鱼肉水解度及酶解产物对小鼠脾淋巴细胞相对增殖率的影响。酶添加量由2000 U/g增加到8000 U/g时,水解度和细胞相对增殖率持续升高,在酶添加量达到8000 U/g时,相对增殖率达到最高为43.32%,水解度为48.88%。这说明酶添加量的增加可以提高底物与酶的作用,从而加速酶解反应。当酶添加量继续增加时,可能因为底物已经充分酶解,酶的作用位点减少,水解度和小鼠脾淋巴细胞相对增殖率不再随着添加量的增多而升高,反而有所下降,这说明适当的蛋白酶添加量,可使酶解产物具有更好的生物活性。酶添加量为8000 U/g时,酶解产物的水解度和细胞相对增殖率显著(P<0.05)高于其他组分,故确定中性蛋白酶的最适酶添加量为8000 U/g。
2.3.2 酶解时间对水解度和小鼠脾淋巴细胞相对增殖率的影响
图3所示为酶解时间对鲐鱼鱼肉水解度及酶解产物对小鼠脾淋巴细胞相对增殖率的影响。时间从4 h升至7 h时,水解度和细胞相对增殖率持续升高,酶解时间为7 h时,细胞相对增殖率达到最高为44.92%,水解度为49.17%。当时间继续延长至8 h时,细胞相对增殖率开始降低,但是水解度与7 h相差不大,这可能是因为酶解时间的延长,蛋白酶活力逐渐下降,故水解度的变化趋势逐渐平缓,但是酶解反应仍在进行,其中一些具有免疫活性的肽链可能会失去活性,导致细胞相对增殖率降低。故确定中性蛋白酶的最适酶解时间为7 h。
2.3.3 酶解温度对水解度和小鼠脾淋巴细胞相对增殖率的影响
图4所示为酶解温度对鲐鱼鱼肉水解度及酶解产物对小鼠脾淋巴细胞相对增殖率的影响。由图4可以看出,随着温度的升高,水解度随之变化,当温度为50 ℃时,水解度达49.75%,显著高于其他温度下的酶解产物(P<0.05)。当温度由30 ℃升高至40 ℃时,细胞相对增殖率升高,50 ℃时,细胞相对增殖率最高,达31.96%。当温度继续升高时,细胞相对增殖率呈下降趋势。这可能是因为在一定范围内,随着温度的升高,蛋白酶活力会增大,有利于酶解反应产生具有免疫活性的肽段[29]。当温度升高至70 ℃时,其水解度和细胞相对增殖率相比50 ℃时明显降低,但是可以看出70 ℃时水解度依然较高,但是细胞相对增殖率偏低,猜测可能是因为70 ℃时酶解反应仍在进行,但长时间在较高温度下进行反应会导致蛋白变性,使酶解产生的肽段失去生物活性。同时根据索莱宝公司提供的产品信息显示,该中性蛋白酶的最适温度为50~55 ℃,与实验结果也较为符合。故确定中性蛋白酶的最适酶解温度为50 ℃。
2.4 响应面试验优化工艺
2.4.1 响应面试验结果
根据Box-Behnken的组合设计原理,采用Design-Expert10.0软件设计3因素3水平共17组实验,其中中心点重复5次实验,以小鼠脾淋巴细胞相对增殖率作为响应值,具体试验设计与结果见表3。对数据进行多元二次回归拟合,建立制备工艺参数回归模型,拟合得到细胞相对增殖率(Y)和酶解时间(A)、酶解温度(B)、酶添加量(C)的回归方程为:Y=41.76+1.25A+2.86B+8.578C−1.01AB+0.42AC+1.58BC−1.78A2−5.94B2−5.58C2。
表 3 响应面试验设计及结果Table 3. Respond surface experimental design and results实验号 A(h) B(℃) C(U/g) 细胞相对增殖率(%) 1 7 55 9000 40.1135 2 7 45 9000 32.8565 3 6.5 55 8000 38.6696 4 7.5 50 7000 25.5415 5 7 50 8000 39.7399 6 6.5 50 9000 42.4189 7 7.5 45 8000 31.4225 8 7 45 7000 23.5225 9 7 50 8000 40.5652 10 7.5 50 9000 48.2001 11 6.5 45 8000 29.3256 12 7 55 7000 24.4534 13 7 50 8000 43.7055 14 6.5 50 7000 21.4503 15 7 50 8000 40.2038 16 7 50 8000 44.5697 17 7.5 55 8000 36.7383 回归系数的显著性分析结果见表4,结果显示,模型的F值为9.73,P值为0.0033<0.05,表明该回归模型显著。失拟项的P值为0.1029,失拟项不显著,说明试验没有失拟因素,可以充分反映试验的实际情况,因此可以确定该回归模型可以对鲐鱼鱼肉中性蛋白酶酶解产物的小鼠脾淋巴细胞增殖率结果进行预测和分析。由表4可知,对结果影响的主次顺序为酶添加量>酶解温度>酶解时间,其中酶添加量对结果的影响极显著。
表 4 回归模型方差分析Table 4. ANOVA of regression equation项目 平方和 自由度 均方 F值 P值 显著性 模型 1001.15 9 111.24 9.73 0.0033 ** A 12.60 1 12.60 1.10 0.3288 B 65.25 1 65.25 5.71 0.0482 * C 588.61 1 588.61 51.49 0.0002 ** AB 4.06 1 4.06 0.35 0.5701 AC 0.71 1 0.71 0.062 0.8098 BC 10.00 1 10.00 0.88 0.3807 A2 13.28 1 13.28 1.16 0.3169 B2 148.66 1 148.66 13.00 0.0087 ** C2 131.02 1 131.02 11.46 0.0117 * 残差 80.02 7 11.43 失拟 60.41 3 20.14 4.11 0.1029 误差 19.61 4 4.90 总和 1081.17 16 R2=0.9260 RAdj2=0.8308 CV=9.52% 注:*:P<0.05为差异显著;**:P<0.01为差异极显著。 2.4.2 响应曲面分析交互作用
模型的响应曲面如图5所示,3组图直观反映了3个因素间的两两交互作用。由图5a曲面的弯曲程度和等高线的封闭情况可以看出,当酶添加量固定不变时,酶解温度和酶解时间的交互作用明显,当酶解时间改变时,酶解温度对细胞相对增殖率的影响表现出不同程度的变化;当酶解温度改变时,酶解时间对细胞相对增殖率的影响也表现出不同程度的变化。当酶解温度固定时,酶添加量与酶解时间对细胞相对增殖率的交互作用如图5b所示,可以看出酶添加量对细胞相对增殖的影响高于酶解时间,随着酶解时间的变化,细胞相对增殖率变化趋势不明显。由图5c可以看出,当酶解时间固定时,酶添加量与酶解温度对细胞增殖率的交互作用明显,其中酶添加量对细胞增殖率的影响高于酶解温度。
通过上述模型对鲐鱼鱼肉免疫活性肽的酶解工艺进行响应面优化分析,软件分析得到的最佳工艺条件为酶解时间7.18 h,酶解温度51.6 ℃、酶添加量8827 U/g,预测的细胞相对增殖率为45.99%。考虑到实际操作情况,对上述优化条件进行修正,最终确定优化条件为酶解时间7 h、酶解温度52 ℃、酶添加量8800 U/g,在此条件下测得细胞相对增殖率为48.11%±2.67%,所得实际值与模型预测值接近,证明应用该模型优化提取鲐鱼鱼肉免疫活性肽是准确可行的。
2.5 氨基酸组成分析
鲐鱼免疫活性肽的氨基酸组成如表5所示。由表可知,鲐鱼免疫活性肽检测的16种氨基酸中谷氨酸含量最高,天冬氨酸次之,同时赖氨酸、亮氨酸、组氨酸、丙氨酸的含量也较高,其中人体必需氨基酸含量占总氨基酸的45.52%。目前已有研究表明天冬氨酸和谷氨酸在粒细胞和巨噬细胞中起着多种作用,可为免疫细胞供能。亮氨酸能增强免疫细胞杀伤活力,增加对致病因子的清除能力[30]。同时也有众多研究表明生物活性肽的免疫活性与其所含的疏水性氨基酸有着密不可分的关系,当肽链含有较多疏水性氨基酸时,多肽表面具有较强的疏水性作用,可增强多肽对自由基的亲和力,使多肽的抗氧化能力有所提升,进而增强免疫活性[31]。王凯凯[32]对绿豆免疫活性肽的氨基酸序列进行分析时发现其中疏水性氨基酸对绿豆肽的免疫活性起着重要作用。张亚飞[33]研究发现小麦蛋白具有免疫活性的肽段中疏水性氨基酸占有较大的比例。杨磊[34]对螺旋藻免疫活性肽进行氨基酸组成分析,结果显示其中疏水性氨基酸含量为23.66%。从表5数据可以看出鲐鱼免疫活性肽中的疏水性氨基酸含量占总氨基酸的32.00%,相比已有的一些研究结果,鲐鱼免疫活性肽的疏水性氨基酸含量更加丰富。
表 5 鲐鱼免疫活性肽的氨基酸组成Table 5. Amino acid composition of immunoactive peptides from chub mackerel氨基酸种类 含量(g/100 g) 占比(%) 天冬氨酸(Asp) 3.38 10.61 苏氨酸(Thr*) 1.82 5.71 丝氨酸(Ser) 1.38 4.34 谷氨酸(Glu) 4.58 14.40 甘氨酸(Gly) 1.55 4.86 丙氨酸(Ala) 2.02 6.33 半胱氨酸(Cys) 0.38 1.18 缬氨酸(Val*) 1.68 5.27 蛋氨酸(Met) 0.90 2.82 异亮氨酸(Ile*) 1.52 4.77 亮氨酸(Leu*) 2.67 8.39 酪氨酸(Tyr) 1.32 4.14 苯丙氨酸(Phe*) 1.4 4.57 赖氨酸(Lys*) 3.00 9.43 组氨酸(His*) 2.35 7.38 精氨酸(Arg) 1.85 5.81 必需氨基酸总量 14.49 45.52 疏水性氨基酸总量 10.19 32.00 氨基酸总量 31.84 100.00 注:*为必需氨基酸;疏水性氨基酸含量为Ala、Val、Met、Ile、Leu、Phe6种氨基酸总和。 3. 结论
本实验通过酶法制备鲐鱼免疫活性肽,确定提取鲐鱼免疫活性肽的最佳蛋白酶为中性蛋白酶,在单因素实验的基础上,以小鼠脾淋巴细胞相对增殖率为评价指标,利用Design-Expert 10.0软件进行响应面试验分析,结果表明利用中性蛋白酶制备鲐鱼免疫活性肽的最优酶解条件为酶解时间7 h、酶解温度52 ℃、酶添加量8800 U/g,进行重复验证实验,该条件下测得小鼠脾淋巴细胞相对增殖率达48.11%±2.67%,最后对得到的鲐鱼免疫活性肽进行氨基酸组成分析,结果显示其氨基酸含量丰富,其中人体必需氨基酸达45.52%,疏水性氨基酸含量为32.00%。
随着对免疫活性肽的研究越来越深入,发现采用酶解法制备免疫活性肽是安全有效的,但是同时也存在着许多难题,因为蛋白质经过酶解之后的组成成分十分复杂,酶解产物中含有大量不同分子量的肽段和游离氨基酸,因此后续仍需选择合适的方法进行进一步分离纯化。本实验结果为后期进一步分离纯化得到鲐鱼免疫活性肽奠定基础,以期为鲐鱼的高值化利用及免疫活性肽保健食品的开发提供理论依据。
-
表 1 响应面试验因素与水平设计
Table 1 Factor and levels of response surface experiment
水平 因素 A时间(h) B温度(℃) C酶添加量(U/g) −1 6.5 45 7000 0 7 50 8000 1 7.5 55 9000 表 2 鲐鱼鱼肉营养成分组成
Table 2 Nutrient composition of chub mackerel meat
组分 水分 灰分 蛋白质 脂肪 含量(%) 65.25±0.51 3.64±0.26 25.06±1.05 7.76±0.41 表 3 响应面试验设计及结果
Table 3 Respond surface experimental design and results
实验号 A(h) B(℃) C(U/g) 细胞相对增殖率(%) 1 7 55 9000 40.1135 2 7 45 9000 32.8565 3 6.5 55 8000 38.6696 4 7.5 50 7000 25.5415 5 7 50 8000 39.7399 6 6.5 50 9000 42.4189 7 7.5 45 8000 31.4225 8 7 45 7000 23.5225 9 7 50 8000 40.5652 10 7.5 50 9000 48.2001 11 6.5 45 8000 29.3256 12 7 55 7000 24.4534 13 7 50 8000 43.7055 14 6.5 50 7000 21.4503 15 7 50 8000 40.2038 16 7 50 8000 44.5697 17 7.5 55 8000 36.7383 表 4 回归模型方差分析
Table 4 ANOVA of regression equation
项目 平方和 自由度 均方 F值 P值 显著性 模型 1001.15 9 111.24 9.73 0.0033 ** A 12.60 1 12.60 1.10 0.3288 B 65.25 1 65.25 5.71 0.0482 * C 588.61 1 588.61 51.49 0.0002 ** AB 4.06 1 4.06 0.35 0.5701 AC 0.71 1 0.71 0.062 0.8098 BC 10.00 1 10.00 0.88 0.3807 A2 13.28 1 13.28 1.16 0.3169 B2 148.66 1 148.66 13.00 0.0087 ** C2 131.02 1 131.02 11.46 0.0117 * 残差 80.02 7 11.43 失拟 60.41 3 20.14 4.11 0.1029 误差 19.61 4 4.90 总和 1081.17 16 R2=0.9260 RAdj2=0.8308 CV=9.52% 注:*:P<0.05为差异显著;**:P<0.01为差异极显著。 表 5 鲐鱼免疫活性肽的氨基酸组成
Table 5 Amino acid composition of immunoactive peptides from chub mackerel
氨基酸种类 含量(g/100 g) 占比(%) 天冬氨酸(Asp) 3.38 10.61 苏氨酸(Thr*) 1.82 5.71 丝氨酸(Ser) 1.38 4.34 谷氨酸(Glu) 4.58 14.40 甘氨酸(Gly) 1.55 4.86 丙氨酸(Ala) 2.02 6.33 半胱氨酸(Cys) 0.38 1.18 缬氨酸(Val*) 1.68 5.27 蛋氨酸(Met) 0.90 2.82 异亮氨酸(Ile*) 1.52 4.77 亮氨酸(Leu*) 2.67 8.39 酪氨酸(Tyr) 1.32 4.14 苯丙氨酸(Phe*) 1.4 4.57 赖氨酸(Lys*) 3.00 9.43 组氨酸(His*) 2.35 7.38 精氨酸(Arg) 1.85 5.81 必需氨基酸总量 14.49 45.52 疏水性氨基酸总量 10.19 32.00 氨基酸总量 31.84 100.00 注:*为必需氨基酸;疏水性氨基酸含量为Ala、Val、Met、Ile、Leu、Phe6种氨基酸总和。 -
[1] 徐永霞, 孟德飞, 赵洪雷, 等. 即食鲐鱼肉干的调味配方及微波-热风干燥工艺优化[J]. 食品工业科技,2021,42(16):171−176. [XU Y X, MENG D F, ZHAO H L, et al. Optimization of seasoning formula and microwave-hot air drying technology for ready-to-eat dried mackerel[J]. Science and Technology of Food Industry,2021,42(16):171−176. XU Y X, MENG D F, ZHAO H L, et al. Optimization of seasoning formula and microwave-hot air drying technology for ready-to-eat dried mackerel[J]. Science and Technology of Food Industry, 2021, 42(16): 171-176.
[2] 王晓龙. 鲐鱼鱼油提取精制及抗氧化活性研究[D]. 舟山: 浙江海洋大学, 2014. WANG X L. Extraction and purification of fish oil from mackerel processing byproduct and its antioxidant activity[D]. Zhoushan: Zhejiang Ocean University, 2014.
[3] 陈海桂, 王阳光. 酶解鲐鱼蛋白制取功能性鱼蛋白粉加工工艺研究[J]. 现代农业科技,2008(20):227−228. [CHEN H G, WANG Y G. Preparation of functional fish protein powder by enzymatic hydrolysis of mackerel protein[J]. Modern Agricultural Science and Technology,2008(20):227−228. doi: 10.3969/j.issn.1007-5739.2008.20.156 CHEN H G, WANG Y G. Preparation of functional fish protein powder by enzymatic hydrolysis of mackerel protein[J]. Xiandai Nong Ye Keji, 2008(20): 227-228. doi: 10.3969/j.issn.1007-5739.2008.20.156
[4] ROCHA M D, ALEMAN A, BACCAN G, et al. Anti-inflammatory, antioxidant, and antimicrobial effects of underutilized fish protein hydrolysate[J]. Journal of Aquatic Food Product Technology,2018,27(5):592−608. doi: 10.1080/10498850.2018.1461160
[5] 李致瑜. 大黄鱼内脏抗氧化肽的制备, 分离纯化及其理化性质研究[D]. 福州: 福建农林大学, 2016. LI Z Y. Study on the preparation and purification of antioxidant peptides from large yellow croaker viscera protein and its structure and physicochemical properties[D]. Fuzhou: Fujian Agriculture and Forestry University, 2016.
[6] 江锟. 鲈鱼蛋白的酶解工艺优化及活性肽的功能特性研究[D]. 武汉: 华中农业大学, 2013. JIANG K. Studies of bass protein hydrolysis process optimization and active peptide functional properties[D]. Wuhan: Huazhong Agricultural University, 2013.
[7] XU B, YE L, TANG Y, et al. Preparation and purification of an immunoregulatory peptide from Stolephorus chinensis of the East Sea of China[J]. Process Biochemistry,2020,98:151−159. doi: 10.1016/j.procbio.2020.08.011
[8] LOURDES S L, ADRIAN H M, BELINDA V C, et al. Food-derived immunomodulatory peptides[J]. Journal of the Science of Food & Agriculture,2016,96:3631−3641.
[9] LIU P, LIAO W, QI X, et al. Identification of immunomodulatory peptides from zeinhydrolysates[J]. European Food Research and Technology,2020,246(5):931−937. doi: 10.1007/s00217-020-03450-x
[10] MERAM C, YU W L, WU J P. Immunomodulatory and anticancer protein hydrolysates (peptides) from food proteins: A review[J]. Food Chemistry,2018,245:205−222. doi: 10.1016/j.foodchem.2017.10.087
[11] XU Z, MAO T M, HUANG L, et al. Purification and identification immunomodulatory peptide from rice protein hydrolysates[J]. Food and Agricultural Immunology,2019,30(1):150−162. doi: 10.1080/09540105.2018.1553938
[12] 纪丽娜. 金枪鱼头酶解物免疫活性肽的分离及对小鼠腹腔巨噬细胞功能的影响[D]. 湛江: 广东海洋大学, 2012. JI L N. Studies on separation of immune activity peptide from tuna head hydrolysates and its effect on mouse peritoneal macrophages[D]. Zhanjiang: Guangdong Ocean University, 2012.
[13] 侯虎. 鳕鱼免疫活性肽的可控制备及其免疫活性研究[D]. 青岛: 中国海洋大学, 2011. HOU H. The controllable preparation of pollock immunomodulating peptide and its immunity activity[D]. Qingdao: Ocean University of China, 2011.
[14] 邓志程. 马氏珠母贝全脏器免疫活性肽的制备及其免疫活性的研究[D]. 湛江: 广东海洋大学, 2015. DENG Z C. Study on the preparation of Pinctada martensii immunomodulating peptide and its immunity function[D]. Zhanjiang: Guangdong Ocean University, 2015.
[15] 房新平. 牛胎盘免疫活性肽提取与酶法制备研究[D]. 无锡: 江南大学, 2007. FANG X P. Studies on extraction and enzymatic preparation of the immunoactive peptides from bovine placenta[D]. Wuxi: Jiangnan University, 2007.
[16] YANG R Y, ZHANG Z F, PEI X R, et al. Immunomodulatory effects of marine oligopeptide preparation from Chum Salmon (Oncorhynchus keta) in mice[J]. Food Chemistry,2009,113(2):464−470. doi: 10.1016/j.foodchem.2008.07.086
[17] YANG Q, CAI X, HUANG M, et al. A specific peptide with immunomodulatory activity from Pseudostellaria heterophylla and the action mechanism[J]. Journal of Functional Foods,2020,68:103887. doi: 10.1016/j.jff.2020.103887
[18] 王雪芹. 鲐鱼多肽的抗氧化活性与抗疲劳作用研究[D]. 北京: 中国科学院大学, 2014. WANG X Q. Study on the antioxidant activity and antifatigue effect of mackerel peptides[D]. Beijing: University of Chinese Academy of Sciences, 2014.
[19] 中华人民共和国国家卫生和计划生育委员会. GB 5009.3-2016食品安全国家标准 食品中水分的测定[S]. 北京: 中国标准出版社, 2016. National Health and Family Planning Commission of the People's Republic of China. GB 5009.3-2016 National food safety standards. Determination of moisture in food[S]. Beijing: China Standards Press, 2016.
[20] 中华人民共和国国家卫生和计划生育委员会. GB 5009.4-2016食品安全国家标准 食品中灰分的测定[S]. 北京: 中国标准出版社, 2016. National Health and Family Planning Commission of the People's Republic of China. GB 5009.4-2016 National foodsafety standards. Determination of ash content in food[S]. Beijing: China Standards Press, 2016.
[21] 中华人民共和国国家卫生和计划生育委员会. GB 5009.5-2016食品安全国家标准食品 中蛋白质的测定[S]. 北京: 中国标准出版社, 2016. National Health and Family Planning Commission of the People's Republic of China. GB 5009.5-2016 National foodsafety standards. Determination of protein in food[S]. Beijing: China Standards Press, 2016.
[22] 中华人民共和国国家卫生和计划生育委员会. GB 5009.6-2016食品安全国家标准 食品中脂肪的测定[S]. 北京: 中国标准出版社, 2016. National Health and Family Planning Commission of the People's Republic of China. GB 5009.6-2016 Nationalfood safety standards. Determination of fat in food[S]. Beijing: China Standards Press, 2016.
[23] . 胡旭阳. 日本黄姑鱼肉活性肽的制备及其免疫调节作用研究[D]. 舟山: 浙江海洋大学, 2019. HU X Y. Studies on the preparation and immunoregulatory effect of peptides from Nibea japonica[D]. Zhoushan: Zhejiang Ocean University, 2019.
[24] 中华人民共和国国家卫生和计划生育委员会. GB 5009.235-2016食品安全国家标准 食品中氨基酸态氮的测定[S]. 北京: 中国标准出版社, 2016. National Health and Family Planning Commission of the People’s Republic of China. GB 5009.235-2016 National food safety standards. Determination of amino acids nitrogen in food[S]. Beijing: China Standards Press, 2016.
[25] 董晓泽. 日本黄姑鱼皮活性肽的制备及其免疫作用研究[D]. 舟山: 浙江海洋大学, 2019. DONG X Z. Preparation and immunological study of active peptides from Nibea japonica skin[D]. Zhoushan: Zhejiang Ocean University, 2019.
[26] 李志永. 蚕蛹蛋白免疫肽的分离纯化、结构鉴定及功能分析[D]. 镇江: 江苏科技大学, 2019. LI Z Y. Purification, identification, and functional analysis of the novel immunomodulatory peptides from silkworm pupa protein[D]. Zhenjiang: Jiangsu University of Science and Technology, 2019.
[27] 中华人民共和国国家卫生和计划生育委员会. GB 5009.124-2016食品安全国家标准 食品中氨基酸的测定[S]. 北京: 中国标准出版社, 2016. National Health and Family Planning Commission of the People's Republic of China. GB 5009.124-2016 National food safety standards. Determination of amino acids in food[S]. Beijing: China Standards Press, 2016.
[28] 林凯, 韩雪, 张兰威, 等. ACE抑制肽构效关系及其酶法制备的研究进展[J]. 食品科学,2017,38(3):261−270. [LIN K, HAN X, ZHANG L W, et al. Progress in structure-activity relationship and enzymatic preparation of ACE inhibitory peptides[J]. Food Science,2017,38(3):261−270. LIN K, HAN X, ZHANG L W, et al. Progress in structure-activity relationship and enzymatic preparation of ACE inhibitory peptides[J]. Food Science, 2017, 38(3): 261-270.
[29] 屈帅杰, 刘淑集, 苏永昌, 等. 响应面法优化菊黄东方鲀肌肉多肽制备工艺[J]. 食品工业科技,2021,42(12):133−138. [QU S J, LIU S J, SU Y C, et al. Optimization of polypeptides extraction from Takifugu flavidus by response surface methodology[J]. Science and Technology of Food Industry,2021,42(12):133−138. QU S J, LIU S J, SU Y C, et al. Optimization of polypeptides extraction from Takifugu flavidus by response surface methodology[J]. Science and Technology of Food Industry, 2021, 42(12): 133-138.
[30] 程镇燕, 陈韶阳, 乔秀亭. 鱼类功能性氨基酸营养免疫研究进展[J]. 饲料研究,2014(9):53−57. [CHENG Z Y, CHEN S Y, QIAO X T. Research progress on nutritional immunity of functional amino acids in fish[J]. Feed Research,2014(9):53−57. CHENG Z Y, CHEN S Y, QIAO X T. Research progress on nutritional immunity of functional amino acids in fish[J]. Feed Research, 2014(9): 53-57.
[31] LI W, YE S, ZHANG Z, et al. Purification and characterization of a novel pentadecapeptide from protein hydrolysates of Cyclinasinensis and its immunomodulatory effects on RAW264.7 cells[J]. Marine Drugs,2019,17(1):30. doi: 10.3390/md17010030
[32] 王凯凯. 绿豆肽的结构鉴定及对小鼠巨噬细胞免疫活性物质的影响作用研究[D]. 大庆: 黑龙江八一农垦大学, 2016. WANG K K. Structure identification of mung bean peptides and its effect on the immunoreactive substances of macrophage in mice[D]. Daqing: Heilongjiang Bayi Agricultural University, 2016.
[33] 张亚飞. 小麦蛋白Alcalase水解物中免疫活性肽的研究[D]. 无锡: 江南大学, 2008. ZHANG Y F. The study on immunopeptides from alcalase-hydrolyzed wheat proteins[D]. Wuxi: Jiangnan University, 2008.
[34] 杨磊. 螺旋藻活性肽的制备及其免疫调节功能研究[D]. 南宁: 广西大学, 2009. YANG L. Study on preparation of active peptides from spirulina mud and its immune regulating function[D]. Nanning: Guangxi University, 2009.





 下载:
下载:

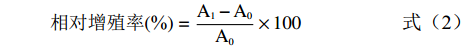





 下载:
下载:
