Research Progress on Anti-inflammatory Activity Mechanism and Structure-activity Relationship of Plant Polysaccharides
-
摘要: 植物多糖是多糖的主要来源之一,具有多种重要的药理活性功能。本文综述了近年来植物多糖在抗炎活性方面的相关研究进展,重点从抗氧化应激、调节细胞因子分泌、调控中性粒细胞、改善肠道菌群和肠黏膜屏障等四个视角阐述了其抗炎机制。进一步分析了植物多糖的平均分子量、单糖组成和糖苷键类型、主链与支链、化学修饰及高级结构与抗炎活性之间的构效关系,最后对植物多糖抗炎活性的研究进行了展望和总结,为其在抗炎药物、食品上的开发应用奠定了理论基础。Abstract: Plant polysaccharides, one of the main sources of polysaccharides, has many important pharmacological functions. This paper reviews the research progress of anti-inflammatory activity of plant polysaccharides in recent years, focusing on the anti-inflammatory mechanism from four perspectives: Antioxidant stress, regulating cytokine secretion, regulating neutrophils, improving intestinal flora and intestinal mucosal barrier. At the same time, this paper also analyzes the structure-activity relationship of anti-inflammatory activity of plant polysaccharides, such as average molecular weight, monosaccharide composition and glycosidic bond types, main chain and side chain, chemical modification and high-level structure, and summarizes the research progress of plant polysaccharide anti-inflammatory activity, which lays a foundation in theory for the further development and application of anti-inflammatory drugs and foods.
-
多糖,又名多聚糖,是由10个以上的单糖组成的一类天然高分子聚合物,分为淀粉多糖和非淀粉多糖,在自然界中分布极广,通过糖苷键将醛糖或酮糖连接而成[1]。如今已经有超过300种多糖被人们从各种天然产物中提取出来,其中,植物类多糖占比较高[2]。植物非淀粉多糖优势较明显,能够通过参与机体生理代谢发挥较广泛的药理作用,如抗氧化、降血糖、免疫调节、抗肿瘤和抗炎等生物活性[3]。因此,近年来对植物多糖的深入研究日趋增多,多糖的抗炎作用也已得到人们的认可,主要的研究集中在药食同源植物多糖,如枸杞多糖[4]、马齿苋多糖[5]和黄芪多糖[6]等,多糖在医学领域对炎症疾病的预防与治疗作用已成为国内外学者的研究热点。
炎症是一种常见的生理反应,在大多数情况下是有益的,受到刺激时可激活免疫系统帮助人体机能恢复正常,是人体的自动防御反应,红、肿、热、痛和功能障碍是其在临床症状上的五个主要表现[7]。但是,当炎症攻击人体自身组织时,对人体是有害的,严重时可致人死亡[8]。对于某些炎症的发病机制仍未明确,更没有彻底的治疗解决方法,只能依靠相关药物来缓解症状,例如溃疡性结肠炎(ulcerative colitis,UC)等[9]。目前,对于炎症的治疗药物主要分为甾体类和非甾体类两种,大部分抗炎药存在治疗周期长、费用高、副作用大、治疗效果不佳等缺点[10]。研究发现,植物多糖在预防和治疗炎症方面具有多途径、多靶点、低毒性、副作用小等独特的优势[11]。本文对植物多糖的抗炎作用、机制以及构效关系进行综述。
1. 植物多糖抗炎机制研究
1.1 抗氧化应激
氧化应激与多种炎症性疾病的发生发展密切相关,其在病理过程中发挥着重要作用。氧化应激主要是指机体产生活性氧(reactive oxygen species,ROS)与消除活性氧之间的动态平衡失调,机体氧化与抗氧化的平衡被打破是导致多种疾病发生的主要原因,如类风湿性关节炎等[12]。炎症会导致中性粒细胞的炎性浸润,然后对机体造成氧化损伤并产生大量自由基,进而加剧炎症反应[13]。展锐等[14]研究发现大枣多糖对DPPH、ABTS和羟基自由基均具有清除能力,同时,体外抗炎活性评价结果显示其仍具有较强的抗炎能力,进一步推断大枣多糖可以通过清除体内过量自由基,调节细胞内抗氧化酶活性,从而干扰炎症反应中的相关靶点,进一步增强其抗炎作用。另外,其他学者通过建立相关的炎症模型,体内评价了不同植物多糖的抗氧化作用以及抗炎活性,并进一步分析了两者的关联。例如,钟敏等[15]观察到高浓度正北芪多糖可显著提高UC小鼠结肠组织的抗氧化能力,升高模型小鼠体内超氧化物歧化酶(superoxide dismutase,SOD)活力,降低一氧化氮合酶(nitric oxide synthase,NOS)活性、丙二醛(malondialdehyde,MDA)含量和一氧化氮(nitric oxide,NO)水平,进而缓解UC的炎症症状。此外,猫爪草多糖也可降低MDA含量以及提高SOD活性,进而修复氧化应激损伤[16]。张晓晓等[17]测定了牛蒡多糖(ASALP)对脂多糖(lipopolysaccharide,LPS)诱导小鼠血清中SOD活性、总抗氧化能力水平和MDA含量的影响,发现LPS+ASALP组的三者水平几乎恢复到对照组水平,结果表明ASALP可能通过降低氧化损伤来减轻炎症。ROS还可以触发NF-κB和MAPK途径,促进炎症介质的表达,从而加重炎症反应[18]。郑岚等[19]通过建立斑马鱼模型,研究发现黑蒜多糖具有显著的体内、体外清除自由基能力以及较明显的体内抗炎作用,结果显示,黑蒜多糖通过降低斑马鱼体内ROS的产生来缓解过氧化损伤和炎症,所以其抗炎机制可能与其干扰ROS介导的信号途径相关。
由上可知,氧化应激与炎症反应之间相互影响、相互作用,但关于炎症机制的氧化应激学说尚未明了,目前只是研究发现部分植物多糖可通过发挥一定的清除自由基和抗氧化作用进而缓解炎症反应,并推测其可能是通过抑制NF-κB和MAPK信号通路来发挥抗炎作用。
1.2 调节细胞因子的分泌
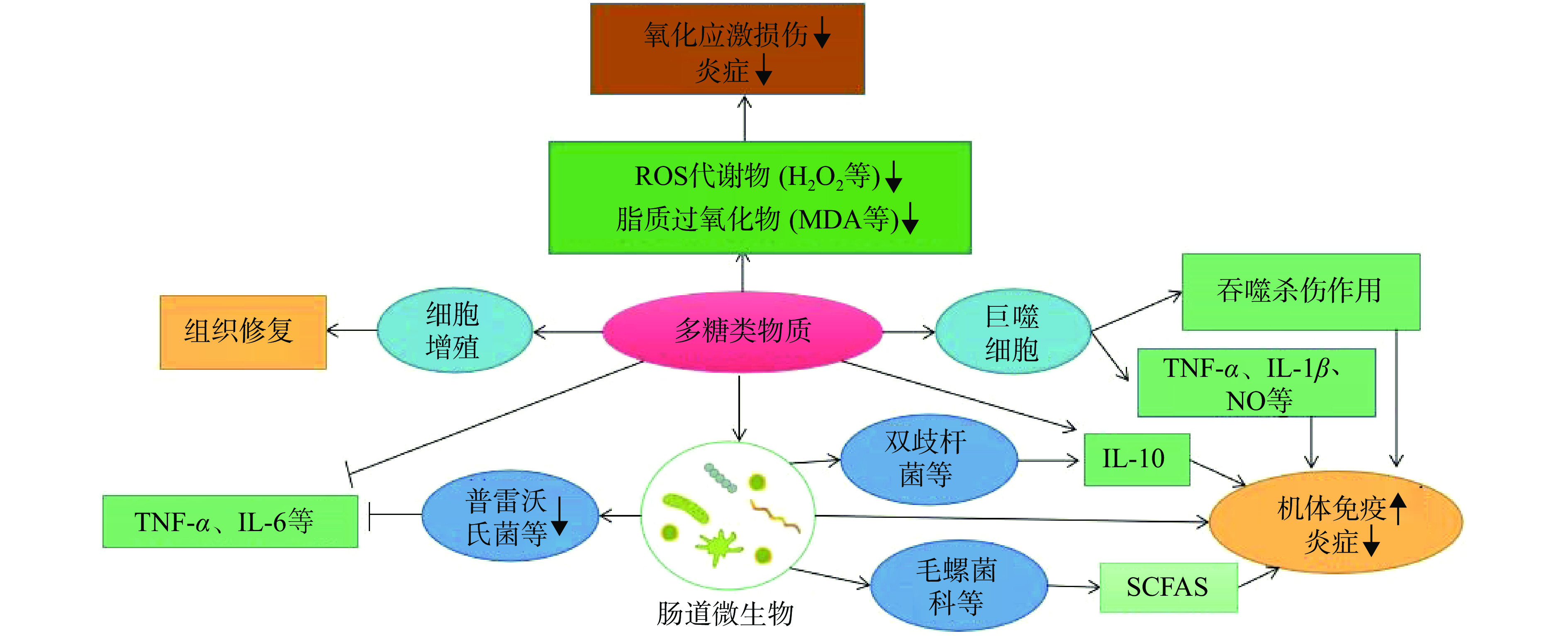
细胞因子是细胞之间相互影响的介质,在炎症的发生和维持中具有重要地位。目前为止,研究植物多糖发挥抗炎作用的细胞因子大多集中于肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-1β(interleukin-1β,IL-1β)和白细胞介素-10(interleukin-10,IL-10)等[20]。巨噬细胞作为炎症发生发展过程的重要角色,当其受到外源体等入侵后会分泌一定的促炎因子和抗炎因子[21],从而发挥抗炎效果,如图1。
通过建立LPS诱导的小鼠腹腔巨噬细胞RAW264.7细胞炎症模型,罗志锋等[22]证实枸杞多糖可显著降低细胞上清液中TNF-α、IL-1β和IL-6的含量,同时,袁雷等[23]发现一种血满草酸性多糖可抑制炎症细胞中促炎因子(IL-1β,IL-6和TNF-α)分泌并促进抗炎因子(IL-10)的产生,两种植物多糖均具有一定的抗炎能力且呈剂量依赖性。王倩等[24]建立了二甲苯致小鼠耳廓肿胀模型,发现只有高剂量的芡茎多糖处理能显著降低模型小鼠耳廓中IL-1β、TNF-α、IL-6的含量并缓解小鼠耳廓肿胀度。研究发现红芪多糖[25]、牛蒡多糖[[17]、鱼腥草多糖[26]等均可通过调控炎症相关细胞因子而表现出较强的体内、体外抗炎活性。
此外,有些学者还研究发现,植物多糖的部分寡糖片段可降低免疫细胞中的炎症因子的表达。Popov等[27]采用酸水解法降解甜椒果胶多糖得到了一种部分被甲基和乙酰基取代的主链为α-D-1,4半乳糖醛酸多糖片段(CA-H),通过小鼠实验,发现CA-H可减少LPS刺激的TNF-α的释放,并增加IL-10的产生。同时,Kuang等[28]也是使用相同降解方法发现一种抗炎效果较好的含半乳糖醛酸含量很高的麻黄多糖片段,但进一步的水解后这一片段便失去了相关免疫活性,故可见多糖的分枝结构或空间构象与其发挥抗炎活性之间具有密切关系。而且半乳糖醛酸寡糖片段的聚合度与其生物活性之间呈一定的正相关[29]。
综上,通过测定细胞因子的水平变化来观察多糖对炎症反应的调控作用是较为常见的方法,深入研究细胞因子在炎症中的变化规律以及从分子水平探讨抗炎机制具有十分重要的意义。植物多糖的部分寡糖片段可干扰炎症因子的表达,但是其构效关系以及特定的信号通路仍需进一步揭示和总结。
1.3 调控免疫细胞
植物多糖能调节多种免疫细胞,其中包括非特异性免疫中的自然杀伤细胞(NK细胞)、巨噬细胞、中性粒细胞等和特异性免疫细胞(如T/B淋巴细胞等)的生长、分化或迁移进而增强机体的细胞免疫活性达到缓解炎症的作用[30]。
研究者发现韩国柑橘皮多糖[31]和马齿苋多糖[32]能有效激发NK细胞活性以及降低促炎因子水平。黄芪多糖可通过改善巨噬细胞形态,恢复巨噬细胞增殖能力,从而改善肠黏膜的损伤及抑制肠道炎症反应[33]。郭艳等[34]实验证实黄芪多糖还可以抑制UC模型大鼠体内辅助型T细胞17的细胞分化,进而控制溃疡性结肠炎的发生发展。中性粒细胞,作为血液非特异性细胞免疫系统中的重要组成部分,是病原体入侵后第一线[35]。在炎症性肠病中,当中性粒细胞移动到肠黏膜位置就会释放ROS、NO等物质产生毒性[36]。孙晓红等[37]对人中性粒细胞进行离体培养并采用LPS诱导成功建立了炎症细胞模型,加入北五味子多糖(NSCP)进行观察,结果显示,NSCP组凋亡百分率显著高于模型组、TNF-α水平较LPS组明显下降,且均与处理时间和浓度呈正相关,因此推断NSCP可缓解炎症细胞因子对中性粒细胞凋亡的抑制作用而表现出一定的抗炎活性。Popov等[38]将蔓越莓多糖应用到结肠炎模型小鼠,观察到多糖参与后降低了小鼠腹腔中性粒细胞的粘附性,抑制了嗜中性粒细胞向肠黏膜的迁移,表明蔓越莓多糖通过减少嗜中性粒细胞的浸润而发挥预防乙酸性结肠炎作用。
综上,植物多糖是通过增强巨噬细胞的吞噬和分泌能力、激活NK细胞活性、促进T/B淋巴细胞的增殖分化以及阻碍中性粒细胞的迁移从而发挥抗炎活性。但是机体免疫细胞类型众多,而且往往是通过多个信号通路间相互作用调节机体免疫,在炎症性肠病的发生、发展及转归中发挥重要作用,因此关于植物多糖对动物免疫调节作用和抗炎活性的关系机制方面仍需进一步研究探索。其中,中性粒细胞与结肠炎的联系较为紧密,然而其具体作用机制尚不明确,有研究表明它不仅可以介导炎症反应[39],还可以参与组织修复[40],因此,对中性粒细胞在炎症性疾病中具体作用和机制的深入研究是必要的。
1.4 改善肠道菌群、肠黏膜屏障
健康者的肠道细菌总数可达百万亿个,肠道菌群的功能强大,与许多疾病的发生和发展息息相关。已有研究证实,植物多糖具有调节肠道菌群比例、改善肠道完整性和修复肠黏膜等功能,如图1。目前,对于多糖-肠道菌群-疾病关系的相关研究越来越多,因人体缺乏水解多糖的相关酶,多种多糖难以被机体直接吸收,进入肠道后可与微生物相互作用,通过改变肠道菌群比例以及被降解产生短链脂肪酸(short-chain fatty acids,SCFAs)进而表现抗炎、抑菌等多种药理活性[13]。由表1可知,与炎症相关的肠道微生物多为普雷沃氏菌、瘤胃球菌、拟杆菌属以及丁酸菌、螺旋菌、乳酸菌、双歧杆菌等,研究证实前者与促炎细胞因子(TNF-α、IL-1β、IL-6等)的表达呈正相关,后者与抗炎细胞因子(IL-10等)的分泌呈正相关[11]。另外,毛螺菌科和考拉杆菌属等能促进SCFAs的生成,有助于调节肠内稳态[41]。而且植物多糖可以缓解结肠炎小鼠肠道黏膜损伤,维护肠道屏障的完整性,据研究报道,肠道菌群与肠黏膜屏障之间具有协同作用[42]。综上,植物多糖可发挥益生元功能促进部分有益菌的繁殖,而肠道菌群又与免疫密不可分,因此,多糖可通过此途径发挥抗炎作用。但是,植物多糖抗炎机制较为复杂,是多靶点多途径综合作用的结果,探究其分子机制十分必要。
表 1 植物多糖对炎症动物模型肠道菌群的影响Table 1. Effects of plant polysaccharides on intestinal microflora in inflammatory animal models多糖名称 模型 作用及机制 参考文献 木枣多糖(ZMP) AOM/DSS诱导大肠癌
小鼠模型增加小鼠粪便中SCFAs的浓度以及双歧杆菌、拟杆菌、
乳酸杆菌等益生菌菌群的数量。[44] 马齿苋多糖 DSS诱导UC小鼠模型 刺激乳酸杆菌、双歧杆菌等部分有益菌群的增殖,抑制肠杆菌、
肠球菌等一些有害菌的生长。[45] 黄芪多糖 TNBS/乙醇法诱导UC大鼠模型 升高双歧杆菌、乳酸杆菌含量,下调肠球菌、肠杆菌数量,
恢复大鼠肠道菌群比例。[46] 黄芪和党参多糖联用 DSS诱导UC小鼠模型 提高异戊酸和丁酸浓度,减轻肠粘膜屏障受损程度,降低梭菌的数量和变形菌门丰度,改善厚壁菌门及拟杆菌门的比例(F/B)。 [47] 金针菇多糖(FVP) DSS诱导UC大鼠模型 降低螺杆菌科丰度、增加毛螺菌科的丰度和乳酸菌的数量,上调F/B值。 [48] 地皮菜多糖 AOM/DSS诱导大肠癌
小鼠模型增加厚壁菌门和毛螺菌科相对丰度、降低拟杆菌门等有害菌相对丰度。 [49] 岩藻多糖 1,2-二甲基苯肼诱导UC
小鼠模型普雷沃氏菌科数量减少,瘤胃菌科和乳杆菌科数量明显增加,丁酸和戊酸数量明显增多。 [50] 魔芋、芦荟、铁皮石斛葡甘露聚糖 DSS诱导UC小鼠模型 增加结肠炎小鼠粪便中SCFAs的浓度,降低拟杆菌门菌群丰度,
升高厚壁菌门和变形菌门数量,同时修复肠黏膜的完整性,
增加肠上皮的屏障防御功能。[51] 正北芪多糖(APS) DSS诱导UC小鼠模型 改善UC小鼠肠黏膜通透性以及修复肠道上皮细胞的完整性。 [15] 紫甘薯根水溶性多糖 LPS诱导炎症小鼠模型 增加毛螺菌科、乳杆菌目和拟杆菌丰度,减少嗜冷杆菌和葡萄球菌的数量。 [52] 牛蒡水溶性多糖(ALP-1) LPS诱导全身炎症
小鼠模型升高粪便中几种益生菌的水平,如乳酸杆菌、另枝菌属、臭杆菌属和考拉杆菌属,抑制拟杆菌属等共生菌的生长,并能显著促进肠道SCFAs的产生。 [41] 注: 偶氮氧化甲烷(AOM);葡聚糖硫酸钠(DSS);三硝基苯磺酸(TNBS)。 2. 植物多糖抗炎构效关系研究
2.1 平均分子量
研究表明植物多糖的分子量大小与其活性功能之间有较大关系[53]。
李苹等[54]使用3.5、50、100、300、1000 kDa的透析袋对醋柴胡粗多糖进行透析,得到6种不同分子量区间的多糖片段,进而研究了6种多糖对RAW264.7细胞的影响,结果表明,醋柴胡多糖可增加细胞吞噬活性,但1000 kDa以上分子量的多糖较其它分子量多糖增加更明显,表明大分子量多糖可在机体炎症反生早期发挥作用,对病原体进行吞噬杀灭。张鑫等[55]分离出9个分子量片段的枸杞多糖,进一步采用谱效灰色关联度分析方法探讨了其中在2~106 kDa分子量之间的7种多糖与抗炎作用之间的关系,结果表明分子量约为34.6 kDa的枸杞多糖片段与抗炎活性相干性最强,推断可能该分子量片段的枸杞多糖在药理活性中表现主要作用。戴玮等[56]采用半仿生提取工艺和水提法得到分子量为521.37、262.50 kDa的霍山石斛多糖,发现二者均可抑制LPS刺激RAW264.7细胞的炎症因子NO和IL-1β的异常分泌,但前者的抑制效果优于后者。刘艳芳[57]研究了不同分子量范围的赤芝多糖组分,并比较了各组分多糖的体内外抗炎活性,结果显示,低分子量组分(3.5×104 g/mol)的抗炎功效强于大分子量多糖组分(1.80×106 g/mol及以上)。
大部分学者认同低分子量多糖药理活性更强的说法,但是如果分子量过低就无法构成与生物活性相关的聚合结构[58]。然而,有些植物多糖反而是大分子量的抗炎活性强于低分子量,这可能也与多糖的链构象等因素有关,因此,多糖种类、分子量与生物活性三者之间的关系较复杂,不同种类多糖能够发挥最佳具体生物活性的分子量分段不同。
2.2 单糖组成、糖苷键类型和位置
由不同种类的单糖和糖苷键类型所构成的多糖,其生物活性存在显著差异。因此,单糖组成和糖苷键的类型和位置,既是研究多糖的基础和前提,也是进一步探究其构效关系的重要组成部分。
单糖组成对多糖的生物活性有显著影响[59],如表2所示,大部分植物多糖主要由阿拉伯糖(L-Arabinose,Ara)、半乳糖(Galactose,Gal)、葡萄糖(Glucose,Glc)、鼠李糖(L-rhamnose monohydrate,Rha)、甘露糖(Mannose,Man)、木糖(Xylose,Xyl)和岩藻糖(Fucose,Fuc)组成。其中,葡聚糖(D-Glc均聚物)已被证明对炎症性疾病具有较强的改善作用[60]。有研究人员通过给感染杀鲑气单胞菌的鲤鱼喂食β-D-1,3连接的葡聚糖,发现这类β-葡聚糖可以显著地下调肠道内皮细胞的TNF-α、IL-1β和IL-6的表达而缓解炎症[61]。此外,那些岩藻糖含量较高的多糖往往表现出显著的抗炎活性。例如,Kang等[62]通过对一种昆布多糖分步纯化,分别得到含有48%、65%、69%和82%的岩藻糖的四种多糖,进一步比较这四种多糖的抗炎活性,发现它们对LPS诱导的RAW264.7巨噬细胞生成NO的水平具有抑制作用,而且抑制效果依次升高。
表 2 植物多糖的抗炎作用机制以及单糖组成和糖苷键结构Table 2. Anti-inflammatory mechanism, monosaccharide composition and glycosidic bond structure of plant polysaccharides多糖名称 模型 抗炎作用机制 单糖组成 糖苷键 参考文献 木枣多糖(ZMP) LPS处理RAW264.7
细胞模型促进IL-10的分泌,减少促炎
细胞因子TNF-α、IL-1、
IL-12和IL-6的产生。Ara、Gal、Glc、Rha和Man;摩尔百分比4.52%、2.64%、1.04%、0.49%和0.41%。 1,4-α-D-GalpA [67] 骏枣多糖(ZJP) LPS刺激RAW264.7
细胞模型抑制NO的产生,降低COX-2、TNF-α、干扰素-γ和IL-17
的表达。Man、Rha、Glc、Gal、Xyl、Ara 1,4-α-D-GalpA [68] 紫锥菊多糖(EPPS-3) LPS诱导脓毒症
小鼠模型降低促炎细胞因子TNF-α
和IL-6的分泌,升高抗炎
因子IL-10含量。Ara、Gal、半乳糖醛酸(GalA)、GlcA、Glc;摩尔比7.80:4.55:2.64:1.00:9.02。 →4)-α-Glcp-(1→、→4)-α-Galp-(1→、T-α-Araf-(1→、→3,4)-β-GalpA-(1→ [69] 辣木根多糖(MRP-1) LPS诱导RAW264.7
细胞模型阻止细胞NO和TNF-α生成
增加,显著降低iNOS的
mRNA表达水平。Rha、Ara、Fru、Xyl、Man、Gal;摩尔比1.5:2.0:3.1:6.0:5.3:1.1。 α-Araf、α-Gly、β-Galp、α-GalpA、β-Gly [70] 太子参多糖
(PHP)DSS诱导UC
小鼠模型减少TNF-α、IL-1β的产生,
改善肠粘膜的完整性,明显
减少中性粒细胞的浸润。Rha、Gal、GalA、Glc、Gal、Ara、Fuc;摩尔比0.055:0.208:0.306:
0.055:0.753:0.594:0.014。→ 6)-GalpA-(1→、→6)-Galp-(1→、→3)-Arap-(1→、Galp-(1→、→3)-Rhap-(1→、Glup-(1→、→3)-Araf-(1→、→2,3,4)-Manp-(1 → 、→ 3,4)-Fucp-(1→ [71] 黄秋葵多糖
(AP1-b)LPS诱导RAW264.7
细胞模型抑制NO的分泌,降低促炎
因子(IL-1β、iNOS和TNF-α)
的水平。Gal、Rha、Glc、Ara、GalA;摩尔比1.98:1.00:0.15:0.32:0.29。 →2)-α-d-Rhap-(1→、→4)-β-d-Galp-(1→、→4)-α-d-GalpA-(1→、→6)-β-d-Galp-(1→、β-d-Glcp-(1→、α-l-Araf-(1→ [72] 板蓝根多糖(RIWP) LPS刺激小鼠肺泡
巨噬细胞模型抑制NO、PGE2、TNF-α、
IL-6生成的增加。Glc、Gal、Ara;摩尔比2.0:1.1:1.0。 [73] 注: 环氧合酶-2(COX-2);诱导型一氧化氮合酶(iNOS);前列腺素E2(PGE2)。 糖苷键的类型和位置可能影响多糖的抗炎活性。多糖发挥抗炎活性与机体的免疫调节密切相关,已有研究证实,β-(1→3),(1→6)糖苷键被认为在增强免疫调节作用中起重要作用[63]。例如,Wei等[64]以狭叶香蒲为原料,提取并分离纯化得到两种多糖(PTA-1、PTA-2),其中,PTA-2由葡萄糖(66.7%)和鼠李糖(33.3%)组成,PTA-1由β-(1,3)糖苷键组成。然后通过建立LPS刺激的RAW264.7巨噬细胞模型,发现PTA-2干预后细胞TNF-α水平下降,IL-6水平显著降低,ROS表达下调,表明PTA-2具有抗炎作用。同时,Jen等[65]比较了五种不同由β-糖苷键连接的水溶性蘑菇和植物多糖的体外抗炎活性得出结论,含β-(1→3,1→6)糖苷键的多糖具有更强的抗炎活性。另外,一种主要由Ara、Rha和葡萄糖醛酸(Glucose Acid,GlcA)以(1→4)糖苷键连接的豆渣水溶性多糖也表现出较强的体外抗炎作用[66]。目前,一般认为β构型的多糖活性较高[58]。由表2可以看出,一般具有(1→3)、(1→4)和(1→6)糖苷键的多糖都表现出一定的生物活性;同时发现Gal和Glc的含量占比相对较高,因此,可以猜测二者与植物多糖抗炎作用可能相关。
2.3 主链与支链
一般来说,支链较主链的分子作用小,而且它可以调节多糖的空间构型,因此,其分支度、长度和取代位置对多糖的药理活性有较大影响。分支复杂程度较高的多糖其抗炎活性普遍强于单个分支链的多糖[74],但并非分支度越高抗炎活性越好,张超[75]对三棱多糖的几个多糖组分进行部分酸水解处理,发现多糖支链和分子量的减小反而促进了多糖的抗炎效果。已有研究表明,以β-(1→3)-D-葡聚糖为主链的多糖具有更强的生物活性,但支链上必须有β-(1→6)键[76]。Neyrinck等[77]发现分子量在4500~5500 kDa之间的带有1,6分支的β-D-1,3连接的葡聚糖对LPS诱导的小鼠肝损伤具有显著的抗炎作用。根据表3可知,不同植物多糖的主链与支链差异较大,但均具有较高的复杂度。有研究表明,分支度较高的多糖在抗炎活性方面高于单一支链多糖,既可调节相关细胞因子的释放又可抑制NO的产生[78]。侧链的存在与发挥抗炎活性密切相关,但是关于植物多糖主链和侧链与其具有抗炎作用的构效关系尚不完全清楚。
表 3 植物多糖的抗炎作用机制及其主链、支链组成Table 3. Anti-inflammatory mechanism, main chain and branch chain composition of plant polysaccharides多糖名称 模型 抗炎作用机制 主链和支链 参考文献 车前子多糖
(PSP-B9)LPS诱导RAW264.7
细胞模型呈浓度依赖性地抑制NO分泌。 主链由1,3,6-Man、1,4,-Man、1,6-Gal、1,4-Araf等组成,同时,1,6-Glc、1,4-Fuc、1,3,4-Rha等位于支链上。 [79] 三棱多糖
(RSDA-2)LPS诱导RAW264.7
细胞模型显著抑制炎症因子iNOS、
IL-1β和TNF-α的mRNA表达。主链由(1→2、1→3)-β-D-Xylp和(1→3)-α-D-Arap组成,支链由T-α-L-Xylf、T-β-D-Glcp、T-α-D-Galp、(1→4)-β-L-Arap和(1→4)-β-D-Xylp组成。 [75] 秋葵多糖
(AP1-b、AP2-c)LPS诱导RAW264.7
细胞模型抑制NO的产生,降低TNF-α、
IL-1β、iNOS的mRNA表达。AP1-b的主链由→4)-β-D-Rhap、(1→、→4)-β-D-Galp和(1→、→6)-β-D-Galp组成,支链为α-L-Araf和β-D-Glcp;AP2-c的主链为→3,4)-α-D-Rhap、(1→、→4)-β-D-Galp,支链则是β-D-Glcp-(1→。 [80] 龙眼果肉多糖
(LPIIa)LPS诱导RAW264.7
细胞模型抑制TNF-α、IL-6、NO、PGE2
的产生,并抑制iNOS和COX-2
基因的表达。骨架由(1→3,4)-连接-α-Rhap、(1→4)-连接-β-Galp、(1→6)-连接-β-Galp和(1→3,6)-连接-β-Galp组成,在Rha的O-4和Gal的O-3处有分支,由α-Araf、β-Galp和α-Glcp的侧链组成。 [81] 菝葜多糖
(SCLP1、SCLP3-2)LPS诱导RAW264.7
细胞模型抑制细胞产生NO、
IL-6和TNF-α。SCLP1主链为1,4连接的α-Glcp,中间穿插着1,2连接的α-Glcp和Manp,分支为1,6连接的α-Glcp;SCLP3-2以α-1,4连接的GalA为主链,该主链被部分甲酯化和轻微乙酰化,侧链为α-Rhap,β-Galp和α-Araf组成。 [82] 紫花苜蓿果胶多糖
(APPS)LPS诱导RAW264.7
细胞模型抑制IL-1β、IL-6和
COX-2基因表达。→2)-α-L-Rhap-(1→4)-α-D-GalpA-(1→为主链,由L-阿拉伯糖基和D-半乳糖基寡糖单元形成侧链。 [83] 果胶辣椒多糖
(CA-2)LPS诱导小鼠模型 减少TNF-α的释放,
并增加IL-10的产生。主链含有1,4-α-D-GalA,部分被甲基和O-乙酰酯基取代。 [27] 紫甘薯多糖(ASPP) LPS诱导RAW264.7
细胞/小鼠模型减少IL-6、IL-1β和TNF-α的分泌。 主链由1,4-连接的Glcp组成,侧链连接到O-6位置。 [84] 2.4 化学修饰
多糖取代基的存在与否和种类差异对其药理活性也有影响,可通过对多糖进行羧甲基化、硫酸化、乙酰化、硒化等分子修饰方法,增强其抗炎活性。
袁雷等[23]对血满草多糖进行硫酸化修饰,探究了二者对LPS诱导的RAW264.7细胞炎性反应的影响,发现两种多糖均可显著抑制促炎因子IL-1β,IL-6和TNF-α的分泌,并提高抗炎因子IL-10的含量,但在高浓度(1600 μg/mL)情况下,多糖改性后的抗炎作用明显增强,甚至接近阴性对照组的治疗效果。王筱霏[85]发现黄芪多糖经硫酸化修饰后体外抗炎效果得到增强,即相同剂量条件下,硫酸化多糖在减少炎症因子(TNF-α、IL-1β、IL-8)的分泌和增强紧密连接蛋白(ZO-1、occludin)的表达方面显著强于未修饰多糖。此外,同一多糖浓度下,硒化乌拉尔甘草多糖作用于LPS刺激下细胞体外炎症模型的抗炎效果优于未硒化多糖[86]。
通过化学方法可对多糖取代基团进行添加或消除,但是并不是所有的改性方法都可以增强多糖原本较弱的药理活性或者激发其原本不具有的活性。近年来,对活性多糖改性的研究成为热点,关于多糖改性后的具体结构变化与活性之间的构效关系仍需深入的阐释。
2.5 高级结构
植物多糖的高级结构对生物活性的影响远远大于初级结构。
赵宏等[79]采用原子力显微镜法对具有体外抗炎活性的车前子多糖(PSP-B9)进行研究,发现其分子链较短,且3D结构显示其表面有若干不规则密集的凸起。X-射线衍射法分析表明枸杞多糖(LEP)形成具有非晶态结构的半晶态聚合物,可抑制卡拉胶诱导的小鼠炎症反应[87]。目前,对于三螺旋结构多糖的抗炎活性研究主要集中于真菌类多糖。例如,刘晓菲等[88]通过刚果红试验和圆二色谱法检测发现羧甲基茯苓多糖具有三螺旋结构,且能够发挥显著的体外抗炎活性。同时,赤芝多糖也表现出较好的体内外抗炎活性,在水溶液体系中也具有三螺旋结构[54]。然而,刘玮等[89]发现姬松茸多糖没有三螺旋构象,但仍表现出一定的体外抗炎作用。研究表明,三螺旋结构是多糖具有药理活性的重要空间构型,如果多糖的三螺旋结构遭到破坏,那么其药理作用效果将会显著下降[90]。而且适当的分子量和三螺旋链构象均有利于三螺旋多糖生物活性的提高[91]。目前关于具有抗炎活性植物多糖结构的研究大部分仍停留在一级结构,而空间结构与生物活性关系的研究主要集中在抗氧化和抗肿瘤方面,因此,探究并阐释植物多糖抗炎活性与高级结构之间的构效关系有重要意义。
3. 总结与展望
植物多糖来源广泛,且不同种类、不同产地、不同部位、不同提取纯化方法都会得到初级结构甚至高级结构存在差异的多糖,进而影响其生物活性。目前的研究认为人体缺少多糖水解酶,机体不能直接吸收和消化多糖,而是通过进入肠道后一方面被微生物降解为单糖以及生成某些代谢物进一步发挥重要作用;另一方面,认为多糖具有益生元作用,通过改善肠道菌群的比例而达到治疗部分疾病的作用。
多糖的抗炎作用作为其多种药理活性之一,众多学者已经通过体外和体内实验对多糖的抗炎效果进行了评价。体外炎症主要采用LPS诱导的RAW264.7细胞建立模型,动物实验大部分集中于急性DSS/TNBS诱导小鼠或大鼠结肠炎模型的研究。通过测定促炎和抗炎炎症因子的分泌以及观察炎症症状和相关部位的组织切片情况,对不同多糖的抗炎效果进行评价。众多研究表明,植物多糖主要通过下调炎症相关NF-κB和MAPK信号通路中相关蛋白的磷酸化水平,调控炎症因子TNF-α和IL-1β基因转录,降低促炎因子IL-6分泌并升高抗炎因子IL-10含量以及降低蛋白iNOS和COX-2的表达量,从而起到治疗炎症的作用[92]。但是,大部分对于抗炎机制的研究仍停留在表面,对于分子水平和基因层次的研究较少。而且多糖的抗炎机制往往是通过多途径、多靶点等方式来实现,与机体免疫调节和肠道菌群密不可分。因此,进一步研究揭示多糖在治疗结肠炎及调节肠道菌群方面的潜在作用机制具有十分重要的意义。
目前,对于植物多糖一级结构的研究较多,但是仍需进一步剖析多糖初级结构甚至高级结构和抗炎之间的联系。例如,确定不同种类多糖发挥抗炎活性的具体分子量区间,并探究此区间多糖片段的抗炎作用方式,可能直接作用于免疫系统或间接作用于肠道微生物;研究抗炎活性多糖的单糖、糖链构型及构象,揭示其发挥抗炎活性的必要结构;讨论多糖主链和支链的抗炎作用机制差异,如侧链可能与细胞表面起作用,而主链可能通过其它途径起作用,以及通过改变侧链分支度对抗炎活性的影响;多糖高级结构的解析与药理活性的关系研究是未来的重点和趋势,仍存在许多问题亟待解决,例如,是多糖三螺旋构象还是其中的单链发挥抗炎作用;植物多糖三螺旋结构与抗炎活性之间具体的作用机制,如巨噬细胞NO的生成和部分免疫因子的表达与多糖三螺旋构象密切相关,而干扰素的合成则与三螺旋结构不相关[93]。因此,采用多种技术联用、新兴技术的应用以及计算机模拟空间构象等方法深层次测定多糖的高级结构是必要的。此外,利用不同技术对多糖进行结构修饰,改善其结构特性,增强其抗炎活性,使植物多糖开发成治疗炎症性疾病的药物分子成为可能。
-
表 1 植物多糖对炎症动物模型肠道菌群的影响
Table 1 Effects of plant polysaccharides on intestinal microflora in inflammatory animal models
多糖名称 模型 作用及机制 参考文献 木枣多糖(ZMP) AOM/DSS诱导大肠癌
小鼠模型增加小鼠粪便中SCFAs的浓度以及双歧杆菌、拟杆菌、
乳酸杆菌等益生菌菌群的数量。[44] 马齿苋多糖 DSS诱导UC小鼠模型 刺激乳酸杆菌、双歧杆菌等部分有益菌群的增殖,抑制肠杆菌、
肠球菌等一些有害菌的生长。[45] 黄芪多糖 TNBS/乙醇法诱导UC大鼠模型 升高双歧杆菌、乳酸杆菌含量,下调肠球菌、肠杆菌数量,
恢复大鼠肠道菌群比例。[46] 黄芪和党参多糖联用 DSS诱导UC小鼠模型 提高异戊酸和丁酸浓度,减轻肠粘膜屏障受损程度,降低梭菌的数量和变形菌门丰度,改善厚壁菌门及拟杆菌门的比例(F/B)。 [47] 金针菇多糖(FVP) DSS诱导UC大鼠模型 降低螺杆菌科丰度、增加毛螺菌科的丰度和乳酸菌的数量,上调F/B值。 [48] 地皮菜多糖 AOM/DSS诱导大肠癌
小鼠模型增加厚壁菌门和毛螺菌科相对丰度、降低拟杆菌门等有害菌相对丰度。 [49] 岩藻多糖 1,2-二甲基苯肼诱导UC
小鼠模型普雷沃氏菌科数量减少,瘤胃菌科和乳杆菌科数量明显增加,丁酸和戊酸数量明显增多。 [50] 魔芋、芦荟、铁皮石斛葡甘露聚糖 DSS诱导UC小鼠模型 增加结肠炎小鼠粪便中SCFAs的浓度,降低拟杆菌门菌群丰度,
升高厚壁菌门和变形菌门数量,同时修复肠黏膜的完整性,
增加肠上皮的屏障防御功能。[51] 正北芪多糖(APS) DSS诱导UC小鼠模型 改善UC小鼠肠黏膜通透性以及修复肠道上皮细胞的完整性。 [15] 紫甘薯根水溶性多糖 LPS诱导炎症小鼠模型 增加毛螺菌科、乳杆菌目和拟杆菌丰度,减少嗜冷杆菌和葡萄球菌的数量。 [52] 牛蒡水溶性多糖(ALP-1) LPS诱导全身炎症
小鼠模型升高粪便中几种益生菌的水平,如乳酸杆菌、另枝菌属、臭杆菌属和考拉杆菌属,抑制拟杆菌属等共生菌的生长,并能显著促进肠道SCFAs的产生。 [41] 注: 偶氮氧化甲烷(AOM);葡聚糖硫酸钠(DSS);三硝基苯磺酸(TNBS)。 表 2 植物多糖的抗炎作用机制以及单糖组成和糖苷键结构
Table 2 Anti-inflammatory mechanism, monosaccharide composition and glycosidic bond structure of plant polysaccharides
多糖名称 模型 抗炎作用机制 单糖组成 糖苷键 参考文献 木枣多糖(ZMP) LPS处理RAW264.7
细胞模型促进IL-10的分泌,减少促炎
细胞因子TNF-α、IL-1、
IL-12和IL-6的产生。Ara、Gal、Glc、Rha和Man;摩尔百分比4.52%、2.64%、1.04%、0.49%和0.41%。 1,4-α-D-GalpA [67] 骏枣多糖(ZJP) LPS刺激RAW264.7
细胞模型抑制NO的产生,降低COX-2、TNF-α、干扰素-γ和IL-17
的表达。Man、Rha、Glc、Gal、Xyl、Ara 1,4-α-D-GalpA [68] 紫锥菊多糖(EPPS-3) LPS诱导脓毒症
小鼠模型降低促炎细胞因子TNF-α
和IL-6的分泌,升高抗炎
因子IL-10含量。Ara、Gal、半乳糖醛酸(GalA)、GlcA、Glc;摩尔比7.80:4.55:2.64:1.00:9.02。 →4)-α-Glcp-(1→、→4)-α-Galp-(1→、T-α-Araf-(1→、→3,4)-β-GalpA-(1→ [69] 辣木根多糖(MRP-1) LPS诱导RAW264.7
细胞模型阻止细胞NO和TNF-α生成
增加,显著降低iNOS的
mRNA表达水平。Rha、Ara、Fru、Xyl、Man、Gal;摩尔比1.5:2.0:3.1:6.0:5.3:1.1。 α-Araf、α-Gly、β-Galp、α-GalpA、β-Gly [70] 太子参多糖
(PHP)DSS诱导UC
小鼠模型减少TNF-α、IL-1β的产生,
改善肠粘膜的完整性,明显
减少中性粒细胞的浸润。Rha、Gal、GalA、Glc、Gal、Ara、Fuc;摩尔比0.055:0.208:0.306:
0.055:0.753:0.594:0.014。→ 6)-GalpA-(1→、→6)-Galp-(1→、→3)-Arap-(1→、Galp-(1→、→3)-Rhap-(1→、Glup-(1→、→3)-Araf-(1→、→2,3,4)-Manp-(1 → 、→ 3,4)-Fucp-(1→ [71] 黄秋葵多糖
(AP1-b)LPS诱导RAW264.7
细胞模型抑制NO的分泌,降低促炎
因子(IL-1β、iNOS和TNF-α)
的水平。Gal、Rha、Glc、Ara、GalA;摩尔比1.98:1.00:0.15:0.32:0.29。 →2)-α-d-Rhap-(1→、→4)-β-d-Galp-(1→、→4)-α-d-GalpA-(1→、→6)-β-d-Galp-(1→、β-d-Glcp-(1→、α-l-Araf-(1→ [72] 板蓝根多糖(RIWP) LPS刺激小鼠肺泡
巨噬细胞模型抑制NO、PGE2、TNF-α、
IL-6生成的增加。Glc、Gal、Ara;摩尔比2.0:1.1:1.0。 [73] 注: 环氧合酶-2(COX-2);诱导型一氧化氮合酶(iNOS);前列腺素E2(PGE2)。 表 3 植物多糖的抗炎作用机制及其主链、支链组成
Table 3 Anti-inflammatory mechanism, main chain and branch chain composition of plant polysaccharides
多糖名称 模型 抗炎作用机制 主链和支链 参考文献 车前子多糖
(PSP-B9)LPS诱导RAW264.7
细胞模型呈浓度依赖性地抑制NO分泌。 主链由1,3,6-Man、1,4,-Man、1,6-Gal、1,4-Araf等组成,同时,1,6-Glc、1,4-Fuc、1,3,4-Rha等位于支链上。 [79] 三棱多糖
(RSDA-2)LPS诱导RAW264.7
细胞模型显著抑制炎症因子iNOS、
IL-1β和TNF-α的mRNA表达。主链由(1→2、1→3)-β-D-Xylp和(1→3)-α-D-Arap组成,支链由T-α-L-Xylf、T-β-D-Glcp、T-α-D-Galp、(1→4)-β-L-Arap和(1→4)-β-D-Xylp组成。 [75] 秋葵多糖
(AP1-b、AP2-c)LPS诱导RAW264.7
细胞模型抑制NO的产生,降低TNF-α、
IL-1β、iNOS的mRNA表达。AP1-b的主链由→4)-β-D-Rhap、(1→、→4)-β-D-Galp和(1→、→6)-β-D-Galp组成,支链为α-L-Araf和β-D-Glcp;AP2-c的主链为→3,4)-α-D-Rhap、(1→、→4)-β-D-Galp,支链则是β-D-Glcp-(1→。 [80] 龙眼果肉多糖
(LPIIa)LPS诱导RAW264.7
细胞模型抑制TNF-α、IL-6、NO、PGE2
的产生,并抑制iNOS和COX-2
基因的表达。骨架由(1→3,4)-连接-α-Rhap、(1→4)-连接-β-Galp、(1→6)-连接-β-Galp和(1→3,6)-连接-β-Galp组成,在Rha的O-4和Gal的O-3处有分支,由α-Araf、β-Galp和α-Glcp的侧链组成。 [81] 菝葜多糖
(SCLP1、SCLP3-2)LPS诱导RAW264.7
细胞模型抑制细胞产生NO、
IL-6和TNF-α。SCLP1主链为1,4连接的α-Glcp,中间穿插着1,2连接的α-Glcp和Manp,分支为1,6连接的α-Glcp;SCLP3-2以α-1,4连接的GalA为主链,该主链被部分甲酯化和轻微乙酰化,侧链为α-Rhap,β-Galp和α-Araf组成。 [82] 紫花苜蓿果胶多糖
(APPS)LPS诱导RAW264.7
细胞模型抑制IL-1β、IL-6和
COX-2基因表达。→2)-α-L-Rhap-(1→4)-α-D-GalpA-(1→为主链,由L-阿拉伯糖基和D-半乳糖基寡糖单元形成侧链。 [83] 果胶辣椒多糖
(CA-2)LPS诱导小鼠模型 减少TNF-α的释放,
并增加IL-10的产生。主链含有1,4-α-D-GalA,部分被甲基和O-乙酰酯基取代。 [27] 紫甘薯多糖(ASPP) LPS诱导RAW264.7
细胞/小鼠模型减少IL-6、IL-1β和TNF-α的分泌。 主链由1,4-连接的Glcp组成,侧链连接到O-6位置。 [84] -
[1] 王恒禹, 刘玥, 姜猛, 等. 多糖在食品工业中的应用现状[J]. 食品科学,2013,34(21):431−8. [WANG H Y, LIU Y, JIANG M, et al. Application status of polysaccharides in food industry[J]. Food Science,2013,34(21):431−8. [2] 贺寅. 龙眼多糖制备工艺及其抗氧化活性研究[D]. 北京: 中国农业科学院, 2011: 10−82. HE Y. Study on preparation and antioxidant activity of longan polysaccharides[D]. Beijing: Chinese Academy of Agricultural Sciences, 2011: 10−82.
[3] 邹胜, 徐溢, 张庆. 天然植物多糖分离纯化技术研究现状和进展[J]. 天然产物研究与开发,2015,27(8):1501−1509. [ZOU S, XU Y, ZHANG Q. Review on extraction and purification technology of polysaccharides from natural plants[J]. Natural Product Research and Development,2015,27(8):1501−1509. [4] 冯晨, 于洋. 枸杞多糖对LPS诱导BV2小胶质细胞的抗炎活性及NF-κB信号通路的调控作用[J]. 食品工业科技,2021,42(3):304−309, 319. [FENG C, YU Y. Effects of Lycium barbarum polysaccharides on anti-inflammatory and NF-κB signaling pathway induced by LPS in BV2 microglia[J]. Science and Technology of Food Industry,2021,42(3):304−309, 319. [5] 范文涛, 王攀红, 王倩. 马齿苋多糖对溃疡性结肠炎大鼠肠组织IL-6/STAT3及NF-κB的影响[J]. 中国应用生理学杂志,2018,34(3):263−267. [FAN W T, WANG P H, WANG Q. Effects of Portulaca polysaccharides on IL-6/STAT3 and NF-κB in intestinal tissue of rats with ulcerative colitis[J]. Chin J Appl Physiol,2018,34(3):263−267. doi: 10.12047/j.cjap.5540.2018.062 [6] 刘丹华, 张瑞莉, 田旭, 等. 黄芪多糖在LPS诱导的DF-1细胞炎症反应中的抗炎作用及其调节机制[J]. 中国兽医学报,2021,41(1):143−149. [LIU D H, ZHANG R L, TIAN X, et al. Anti-inflammatory effect of Astragalus polysaccharides on LPS-induced DF-1 cell inflammation and its regulatory mechanism[J]. Chinese Journal of Veterinary Science,2021,41(1):143−149. [7] XU J, YI M, DING L, et al. A review of anti-inflammatory compounds from marine fungi, 2000-2018[J]. Marine Drugs,2019,17(11):636−659. doi: 10.3390/md17110636
[8] GALLI S J, TSAI M, PILIPONSKY A M. The development of allergic inflammation[J]. Nature,2008,454(7203):445−454. doi: 10.1038/nature07204
[9] 燕玉奎, 郭玫, 王志旺, 等. 中药多糖治疗溃疡性结肠炎的实验研究进展[J]. 甘肃科技,2019,35(13):119−122. [YAN Y K, GUO M, WANG Z W, et al. Advances in experimental research on the treatment of ulcerative colitis with polysaccharide from traditional Chinese medicine[J]. Gansu Science and Technology,2019,35(13):119−122. doi: 10.3969/j.issn.1000-0952.2019.13.040 [10] WEI W C, SUNG P J, DUH C Y, et al. Anti-inflammatory activities of natural products isolated from soft corals of Taiwan between 2008 and 2012[J]. Marine Drugs,2013,11(10):4083−4126. doi: 10.3390/md11104083
[11] 陈国伟, 邱春红, 田灵敏, 等. 食源性天然产物中多糖干预炎症性肠病的研究进展[J]. 食品科学,2019,40(13):281−287. [CHEN G W, QIU C H, TIAN L M, et al. Recent progress in food-derived natural polysaccharide intervention in inflammatory bowel disease[J]. Food Science,2019,40(13):281−287. doi: 10.7506/spkx1002-6630-20180619-371 [12] 许家栋, 上官嬿婉, 徐孟杰, 等. 类风湿关节炎的氧化应激与SOD抗氧化研究进展[J]. 风湿病与关节炎,2016,5(7):65−70. [XU J D, SHANGGUAN Y W, XU M J, et al. Research progress of oxidative stress and SOD antioxidation in rheumatoid arthritis[J]. Rheumatism and Arthritis,2016,5(7):65−70. [13] REN Y L, GENG Y, DU Y, et al. Polysaccharide of Hericium erinaceus attenuates colitis in C57BL/6 mice via regulation of oxidative stress, inflammation-related signaling pathways and modulating the composition of the gut microbiota[J]. The Journal of Nutritional Biochemistry,2018,57(57):67−76.
[14] 展锐, 邵金辉. 大枣多糖抗氧化及抗炎活性的研究[J]. 现代食品科技,2017,33(12):38−43. [ZHAN R, SHAO J H. Antioxidant and anti-inflammatory activities of polysaccharide from Zizyphus jujuba Mill[J]. Modern Food Science & Technology,2017,33(12):38−43. [15] 钟敏, 李昕宇, 郝佳美, 等. 正北芪多糖对结肠炎小鼠的抗炎作用研究[J]. 食品工业科技,2021,42(16):325−330. [ZHONG M, LI X Y, HAO J M, et al. Anti-inflammatory effect of Astragalus polysaccharide from astragali radix on mice with ulcerative colitis[J]. Science and Technology of Food Industry,2021,42(16):325−330. [16] 朱辉. 猫爪草多糖抗炎作用机制的实验研究[J]. 科技风,2021(13):173−175. [ZHU H. Experimental study on anti inflammatory mechanism of Ranunculus ternatus polysaccharide[J]. Technology Wind,2021(13):173−175. [17] 张晓晓, 柴智, 冯进, 等. 牛蒡多糖的提取及生物活性研究进展[J]. 食品与发酵工业,2021,47(6):280−288. [ZHANG X X, CHAI Z, FENG J, et al. Extraction and biological activity of Arctium lappa L. polysaccharides[J]. Food and Fermentation Industries,2021,47(6):280−288. [18] YOUNIS T, KHAN M R, SAJID M, et al. Fraxinus xanthoxyloides leaves reduced the level of inflammatory mediators during in vitro and in vivo studies[J]. BMC Complementary Alternative Medicine,2016,16(1):230−246.
[19] 郑岚, 马耀宏, 孟庆军, 等. 黑蒜多糖的斑马鱼体内抗氧化、抗炎症活性分析[J]. 中国食品学报,2020,20(8):65−75. [ZHENG L, MA Y H, MENG Q J, et al. Antioxidant and anti-inflammatory activities of black garlic polysaccharide in zebrafish[J]. Journal of Chinese Institute of Food Science and Technology,2020,20(8):65−75. [20] KIDD B L, URBAN L A. Mechanisms of inflammatory pain[J]. Narnia,2001,87(1):3−11.
[21] LIU F Y, ZHANG X F, LING P X, et al. Immunomodulatory effects of xanthan gum in LPS-stimulated RAW264.7 macrophages[J]. Carbohydrate Polymers,2017,169:65−74. doi: 10.1016/j.carbpol.2017.04.003
[22] 罗志锋, 陆思名, 黎攀, 等. 遗传算法优化超高压辅助复合酶提取枸杞多糖工艺及其抗炎活性研究[J]. 粮食与油脂,2021,34(1):114−122. [LUO Z F, LU S M, LI P, et al. Study on optimization of extraction process of Lycium barbarum polysaccharides by ultrahigh-pressure assisted complex enzyme and anti-inflammatory activity[J]. Cereals & Oils,2021,34(1):114−122. doi: 10.3969/j.issn.1008-9578.2021.01.031 [23] 袁雷, 钟政昌, 刘瑜, 等. 血满草酸性多糖分离纯化、硫酸化修饰及抗炎活性研究[J]. 分析试验室,2020,39(6):649−653. [YUAN L, ZHONG Z C, LIU Y, et al. Study on purification, sulfation modification and anti-inflammatory activity of acidic polysaccharide from Sambucus adnata Wall[J]. Chinese Journal of Analysis Laboratory,2020,39(6):649−653. [24] 王倩, 吴啟南, 吴达维, 等. 芡茎多糖单糖组成及抗炎活性[J]. 中成药, 2019, 41(8): 1982−1986. WANG Q, WU Q N, WU D W, et al. Monosaccharide composition and anti-inflammatory activity of Euryale ferox stem polysaccharide[J]. Chinese Traditional Patent Medicine 2019, 41(8): 1982−1986.
[25] 贾妙婷, 李成义, 孙天雄, 等. 红芪多糖药理作用研究新进展[J]. 中药药理与临床,2020,36(6):235−239. [JIA M T, LI C Y, SUN T X, et al. Research progress of ginsenosides on regulating nervous system function[J]. Pharmacology and Clinics of Chinese Materia Medica,2020,36(6):235−239. [26] 宋也好, 游慧婷, 姚于飞, 等. 鱼腥草多糖的研究进展[J]. 食品工业科技,2021,42(9):382−387. [SONG Y H, YOU H T, YAO Y F, et al. Research progress of Houttuynia cordata polysaccharide[J]. Science and Technology of Food Industry,2021,42(9):382−387. [27] POPOV S V, OVODOVA R G, GOLOVCHENKO V V, et al. Chemical composition and anti-inflammatory activity of a pectic polysaccharide isolated from sweet pepper using a simulated gastric medium[J]. Food Chemistry,2010,124(1):309−315.
[28] KUANG H X, XIA Y G, YANG B Y, et al. Screening and comparison of the immunosuppressive activities of polysaccharides from the stems of Ephedra sinica Stapf[J]. Carbohydrate Polymers,2011,83(2):787−95. doi: 10.1016/j.carbpol.2010.08.056
[29] 李健军. 柑橘果胶多糖可控性降解和寡糖片段的分离分析及其活性研究[D]. 西安: 西北大学, 2011: 72−80. LI J J. The study on the controlled degradation of Citrus pectic polysaccharide and the purification and activity of oligogalactronic acid fragments[D]. Xi’an: Northwest University, 2011: 72−80.
[30] 杨许花, 赵梦潇, 陈红, 等. 植物多糖免疫调节作用机制研究进展[J]. 食品安全质量检测学报,2021,12(13):5349−5355. [YANG X H, ZHAO M X, CHEN H, et al. Advances in research on the mechanism of immunomodulatory effects of plant polysaccharides[J]. Journal of Food Safety & Quality,2021,12(13):5349−5355. [31] LEE M H, KIM M, KIM M, et al. Consumption of dairy yogurt with the polysaccharide rhamnogalacturonan from the peel of the Korean citrus hallabong enhances immune function and attenuates the inflammatory response[J]. Food & Function,2016,7(6):2833−2839.
[32] 孟祥乐, 薛磊, 张振巍, 等. 马齿苋多糖对环磷酰胺模型小鼠免疫功能的影响[J]. 中国新药杂志,2017,26(11):1296−1300. [MENG X L, XUE L, ZHANG Z W, et al. Effect of Portulaca oleracea polysaccharide on immunological function in mice with cyclophosphamide-induced immunosuppression[J]. Chinese Journal of New Drugs,2017,26(11):1296−1300. [33] 鹿秀云, 岳海洋, 刘億, 等. 黄芪多糖对结肠炎小鼠树突状细胞表面共刺激分子表达的调节作用[J]. 中成药,2018,40(10):2296−2298. [LU X Y, YUE H Y, LIU Y, et al. Regulation of Astragalus polysaccharides on the expression of costimulatory molecules on dendritic cells of colitis mice[J]. Chinese Traditional Patent Medicine,2018,40(10):2296−2298. doi: 10.3969/j.issn.1001-1528.2018.10.037 [34] 郭艳, 孙春锋, 万橱根, 等. 黄芪多糖对实验性溃疡性结肠炎大鼠Th17相关细胞因子的影响[J]. 中华中医药学刊,2013,31(6):1375−1377. [GUO Y, SUN C F, WAN C G, et al. Effects of Astragalus polysaccharides on Th17 cell of experimental colitis in rats[J]. Chinese Archives of Traditional Chinese Medicine,2013,31(6):1375−1377. [35] SCHMIDT E P, LEE W L, ZEMANS R L, et al. On, around, and through: Neutrophil endothelial interactions in innateim-munity[J]. Physiology,2011,26(5):334−347. doi: 10.1152/physiol.00011.2011
[36] 曹旭, 张武剑, 李桃. 中性粒细胞和微粒在炎症性肠病中促凝机制的研究进展[J]. 医学综述,2019,25(7):1297−1301. [CAO X, ZHANG W J, LI T et al. Advances in the study of procoagulant activity of neutrophils and particulates in inflammatory bowel disease[J]. Medical Recapitulate,2019,25(7):1297−1301. doi: 10.3969/j.issn.1006-2084.2019.07.010 [37] 孙晓红, 李嘉仪, 李洪涛, 等. 北五味子多糖对脂多糖诱导中性粒细胞炎症的抑制作用[J]. 吉林大学学报(医学版),2017,43(5):928−931. [SUN X H, LI J Y, LI H T, et al. Inhibitory effect of north-Schisandra chinensis polysaccharide on neutrophil induced by lipopolysaccharide[J]. Journal of Jilin University (Medicine Edition),2017,43(5):928−931. [38] POPOV S V, MARKOV P A, NIKITINA I R, et al. Preventive effect of a pectic polysaccharide of the common cranberry Vaccinium oxycoccos L. on acetic acid-induced colitis in mice[J]. World Journal of Gastroenterology,2006,12(41):6646−6651. doi: 10.3748/wjg.v12.i41.6646
[39] COLGAN S P. Neutrophils and inflammatory resolution in the mucosa[J]. Semin Immunol,2015,27(3):177−183. doi: 10.1016/j.smim.2015.03.007
[40] WÉRA O, LANCELLOTTI P, OURY C. The dual role of neutrophils in inflammatory bowel diseases[J]. Journal of Clinical Medicine,2016,5(12):118. doi: 10.3390/jcm5120118
[41] ZHANG N F, WANG Y, KAN J, et al. In vivo and in vitro anti-inflammatory effects of water-soluble polysaccharide from Arctium lappa[J]. International Journal of Biological Macromolecules,2019,135:717−724. doi: 10.1016/j.ijbiomac.2019.05.171
[42] 邱霞, 张健, 李可昌, 等. 肠道菌群与植物多糖相关性研究进展[J]. 中国食物与营养,2021,27(1):54−57,20. [QIU X, ZHANG J, LI K C, et al. Research progress on the correlation between intestinal flora and plant polysaccharides[J]. Food and Nutrition in China,2021,27(1):54−57,20. doi: 10.3969/j.issn.1006-9577.2021.01.011 [43] NIE Y, LIN Q L, LUO F J. Effects of non-starch polysaccharides on inflammatory bowel disease[J]. International Journal of Molecular Sciences,2017,18(7):1372. doi: 10.3390/ijms18071372
[44] JI X L, PENG Q, YUAN Y P, et al. Extraction and physicochemical properties of polysaccharides from Ziziphus Jujuba cv. Muzao by ultrasound-assisted aqueous two-phase extraction[J]. International Journal of Biological Macromolecules,2018,108:541−549. doi: 10.1016/j.ijbiomac.2017.12.042
[45] 冯澜, 李绍民, 代立娟, 等. 马齿苋多糖对溃疡性结肠炎小鼠肠黏膜细胞因子及肠道菌群的影响[J]. 中国微生态学杂志,2015,27(2):139−142. [FENG L, LI S M, DAI L J, et al. Effects of polysaccharides from Portulaca oleracea L. on intestinal mucosal cytokines and intestinal flora in mice with ulcerative colitis[J]. Chinese Journal of Microecology,2015,27(2):139−142. [46] 梁金花, 郑科文, 金大伟. 黄芪多糖对溃疡性结肠炎大鼠肠道菌群调节作用的研究[J]. 中国中医药科技,2012,19(4):331−332. [LIANG J H, ZHENG K W, JIN D W. Regulation of Astragalus polysaccharides on intestinal flora in rats with ulcerative colitis[J]. Chinese Journal of Traditional Medical Science and Technology,2012,19(4):331−332. doi: 10.3969/j.issn.1005-7072.2012.04.028 [47] TANG S, LIU W, ZHAO Q Q, et al. Combination of polysaccharides from Astragalus membranaceus and Codonopsis pilosula ameliorated mice colitis and underlying mechanisms[J]. Journal of Ethnopharmacology,2020,164:113−280.
[48] 叶菊风. 金针菇多糖预防炎症性肠病的作用机制及其主要成分的鉴定和功能研究[D]. 广州: 南方医科大学, 2019: 30−54. YE J F. Potential mechanism of Flammulina velutipes polysaccharide in preventing inflammatory bowel diseases, structure characterization and the biological effects of its main component[D]. Guangzhou: Southern Medical University, 2019: 30−54.
[49] 郭敏. 地皮菜活性多糖的制备及其抗大肠癌效应研究[D]. 太原: 山西大学, 2019: 74−88. GUO M. Preparation and anti-colorectal cancer efficacy evaluation of the polysaccharides from Nostoc commune Vaucher[D]. Taiyuan: Shanxi University, 2019: 74−88.
[50] XUE M L, LIANG H, JI X Q, et al. Effects of fucoidan on gut flora and tumor prevention in 1, 2-dimethylhydrazine-induced colorectal carcinogenesis.[J]. The Journal of Nutritional Biochemistry,2020,82:108396. doi: 10.1016/j.jnutbio.2020.108396
[51] 张柳婧. 三种不同来源葡甘露聚糖对炎症小鼠肠道健康的影响[D]. 南昌: 南昌大学, 2019. ZHANG L J. The effects of three glucomannans on gut health in colitis mice[D]. Nanchang: Nanchang University, 2019.
[52] SUN J, GOU Y R, LIU J, et al. Anti-inflammatory activity of a water-soluble polysaccharide from the roots of purple sweet potato[J]. RSC Advances,2020,10(65):39673−39686. doi: 10.1039/D0RA07551E
[53] ZHANG R, ZHANG X X, TANG Y X, et al. Composition, isolation, purification and biological activities of Sargassum fusiforme polysaccharides: A review[J]. Carbohydrate Polymers,2020,228:115−381.
[54] 李苹, 卢柏林, 邓时贵, 等. 不同分子量醋柴胡多糖对RAW264.7巨噬细胞抗炎免疫活性的影响[J]. 中国现代应用药学,2020,37(10):1153−1156. [LI P, LU B L, DENG S G, et al. Study on anti-inflammatory and immunomodulatory activity of vinegar bupleuri radix polysaccharides with different molecular weight on RAW264.7 macrophage[J]. Chinese Journal of Modern Applied Pharmacy,2020,37(10):1153−1156. [55] 张鑫, 刘洋, 程亚茹, 等. 枸杞多糖分子量分布测定与抗炎活性关联研究[J]. 北京中医药大学学报,2020,43(11):959−964. [ZHANG X, LIU Y, CHENG Y R, et al. Molecular weight distribution of Lycium barbarum polysaccharides and its relation with anti-inflammatory activity[J]. Journal of Beijing University of Traditional Chinese Medicine,2020,43(11):959−964. doi: 10.3969/j.issn.1006-2157.2020.11.011 [56] 戴玮, 罗建平. 霍山石斛多糖的半仿生提取工艺优化与抗炎活性评价[J]. 安徽农业科学,2018,46(23):151−154. [DAI W, LUO J P. Optimization on semi-bionic extraction technology of polysaccharides from Dendrobium huoshanense and evaluation on its anti-inflammatory activity[J]. Journal of Anhui Agricultural Sciences,2018,46(23):151−154. doi: 10.3969/j.issn.0517-6611.2018.23.046 [57] 刘艳芳. 赤芝多糖结构和构象表征及其免疫调节构效关系研究[D]. 无锡: 江南大学, 2018: 44−85. LIU Y F. Structure and conformation characterization of polysaccharide from Ganoderma lucidum and the structure-activity relationship on immunoregulation[D]. Wuxi: Jiangnan University, 2018: 44−85.
[58] 刘淑贞, 周文果, 叶伟建, 等. 活性多糖的生物活性及构效关系研究进展[J]. 食品研究与开发,2017,38(18):211−218. [LIU S Z, ZHOU W G, YE W J, et al. Research advance on biological activity and structure-activity relationships of bioactive polysaccharide[J]. Food Research and Development,2017,38(18):211−218. [59] JI X L, PENG Q, WANG M. Anti-colon-cancer effects of polysaccharides: A mini-review of the mechanisms[J]. International journal of Biological Macromolecules,2018,114:1127−1133. doi: 10.1016/j.ijbiomac.2018.03.186
[60] DU B, LIN C Y, BIAN Z X, et al. An insight into anti-inflammatory effects of fungal beta-glucans[J]. Trends in Food Science & Technology,2015,41(1):49−59.
[61] FALCO A, FROST P, MIEST J, et al. Reduced inflammatory response to Aeromonas salmonicida infection in common carp (Cyprinus carpio L.) fed with β-glucan supplements[J]. Fish and Shellfish Immunology,2012,32(6):1051−1057. doi: 10.1016/j.fsi.2012.02.028
[62] KANG S M, KIM K N, LEE S H, et al. Anti-inflammatory activity of polysaccharide purified from AMG-assistant extract of Ecklonia cava in LPS-stimulated RAW 264.7 macrophages[J]. Carbohydrate Polymers,2011,85(1):80−85. doi: 10.1016/j.carbpol.2011.01.052
[63] WANG Z J, LUO D H, LIANG Z Y. Structure of polysaccharides from the fruiting body of Hericium erinaceus Pers[J]. Carbohydrate Polymers,2004,57(3):241−247. doi: 10.1016/j.carbpol.2004.04.018
[64] WEI H, SHI Y Q, YUAN Z X, et al. Isolation, identification, and anti-inflammatory activity of polysaccharides of Typha angustifolia[J]. Biomacromolecules,2021,22(6):2451−2459. doi: 10.1021/acs.biomac.1c00235
[65] JEN C I, SU C H, LAI M N, et al. Comparative anti-inflammatory characterization of selected fungal and plant water soluble polysaccharides[J]. Food Science and Technology Research,2021,27(3):453−462. doi: 10.3136/fstr.27.453
[66] LE B, PHAM T N A, YANG S H. Prebiotic potential and anti-inflammatory activity of soluble polysaccharides obtained from soybean residue[J]. Foods, 2020, 9(12): 1-13.
[67] JI X L, PENG Q, LI H Y, et al. Chemical characterization and anti-inflammatory activity of polysaccharides from Zizyphus jujube cv. Muzao[J]. International Journal of Food Engineering, 2017, 13(7): 20160382.
[68] ZHAN R, XIA L, SHAO J H, et al. Polysaccharide isolated from Chinese jujube fruit (Zizyphus jujuba cv. Junzao) exerts anti-inflammatory effects through MAPK signaling[J]. Journal of Functional Foods,2018,40:461−470. doi: 10.1016/j.jff.2017.11.026
[69] LI Q, YANG F F, HOU R R, et al. Post-screening characterization of an acidic polysaccharide from Echinacea purpurea with potent anti-inflammatory propertiesin vivo[J]. Food & Function,2020,11(9):7576−7583.
[70] CUI C, CHEN S, WANG X Y, et al. Characterization of Moringa oleifera roots polysaccharide MRP-1 with anti-inflammatory effect[J]. International Journal of Biological Macromolecules,2019,132:844−851. doi: 10.1016/j.ijbiomac.2019.03.210
[71] YOU S Y, LIU X W, XU G T, et al. Identification of bioactive polysaccharide from Pseudostellaria heterophylla with its anti-inflammatory effects[J]. Journal of Functional Foods,2021,78:104353. doi: 10.1016/j.jff.2021.104353
[72] 刘晓霞. 黄秋葵花果胶类多糖的提取工艺及其性质的研究[D]. 杭州: 浙江大学, 2014: 50−60. LIU X X. Extraction and characterization of pectic polysaccharide from okra flower[D]. Hangzhou: Zhejiang University, 2014: 50−60.
[73] DU Z J, LIU H, ZHANG Z L, et al. Antioxidant and anti-inflammatory activities of Radix Isatidis polysaccharide in murine alveolar macrophages[J]. International Journal of Biological Macromolecules,2013,58:329−335. doi: 10.1016/j.ijbiomac.2013.04.037
[74] 刘袆帆, 郭烁璇, 林映妤, 等. 石斛多糖的构效关系研究进展[J]. 现代食品科技,2021,37(1):308−338. [LIU Y F, GUO S X, LIN Y Y, et al. The relationship between the structure and function of Dendrobium polysaccharides: A review[J]. Modern Food Science and Technology,2021,37(1):308−338. [75] 张超. 三棱多糖的化学结构及其生物活性研究[D]. 合肥: 合肥工业大学, 2020: 20−50. ZHANG C. Study on the chemical structure and biological activities of polysaccharides from Sparganium stoloniferum[D]. Hefei: Hefei University of Technology, 2020: 20−50.
[76] WASSER S. Medicinal mushrooms as a source of antitumor and immunomodulating polysaccharides[J]. Applied Microbiology and Biotechnology,2002,60(3):258−274. doi: 10.1007/s00253-002-1076-7
[77] NEYRINCK A M, MOUSON A, DELZENNE N M. Dietary supplementation with laminarin, a fermentable marine β (1-3) glucan, protects against hepatotoxicity induced by LPS in rat by modulating immune response in the hepatic tissue[J]. International Immunopharmacology,2007,7(12):1497−506. doi: 10.1016/j.intimp.2007.06.011
[78] WANG L, CHEN C, ZHANG B, et al. Structural characterization of a novel acidic polysaccharide from Rosa roxburghii Tratt fruit and its α-glucosidase inhibitory activity[J]. Food & Function,2018,9(7):3974−3985.
[79] 赵宏, 柴桂芳, 孙延平, 等. 车前子多糖PSP-B9的结构及抑制RAW264.7产生NO活性研究[J]. 辽宁中医杂志,2019,46(3):598−601. [ZHAO H, CHAI G F, SUN Y P, et al. Study on the structure of polysaccharide psp-b9 from Plantago asiatica and its inhibition of NO production by RAW264.7[J]. Liaoning Journal of Traditional Chinese Medicine,2019,46(3):598−601. [80] 叶云芳. 木质化秋葵多糖的分离纯化、结构鉴定及抗炎活性研究[D]. 合肥: 合肥工业大学, 2020: 30−57. YE Y F. Extraction and purification, structure identification and anti-inflammatory activity of polysaccharide from lignified okra (Abelmoschus esculentus L. Moench)[D]. Hefei: Hefei University of Technology, 2020: 30−57.
[81] BAI Y J, JIA X C, HUANG F, et al. Structural elucidation, anti-inflammatory activity and intestinal barrier protection of longan pulp polysaccharide LPIIa[J]. Carbohydrate Polymers,2020:246.
[82] ZHANG Y, PAN X L, RAN S Q, et al. Purification, structural elucidation and anti-inflammatory activity in vitro of polysaccharides from Smilax china L[J]. International Journal of Biological Macromolecules,2019,139:233−243. doi: 10.1016/j.ijbiomac.2019.07.209
[83] CHEN L, LIU J, ZHANG Y Q, et al. Structural, thermal, and anti-inflammatory properties of a novel pectic polysaccharide from alfalfa (Medicago sativa L.) stem[J]. Journal of Agricultural and Food Chemistry,2015,63(12):3219−28. doi: 10.1021/acs.jafc.5b00494
[84] CHEN H, SUN J, LIU J, et al. Structural characterization and anti-inflammatory activity of alkali-soluble polysaccharides from purple sweet potato[J]. International Journal of Biological Macromolecules,2019,131:484−494. doi: 10.1016/j.ijbiomac.2019.03.126
[85] 王筱霏. 黄芪多糖及其硫酸化修饰产物体内外抗炎活性研究[D]. 西安: 西北农林科技大学, 2014: 20−30. WANG X F. Study on anti-inflammatory activities of Astragalus polysaccharides and their sulphation modification products in vitro and in vivo[D]. Xi'an: Northwest A&F University, 2014: 20−30.
[86] 连科讯. 硒化新疆乌拉尔甘草多糖抗炎免疫调节作用研究[D]. 石河子: 石河子大学, 2018: 36−55. LIAN K X. Studies on anti inflammatory and immunomodulatory effects of selenzing Glycyrrhiza uralensis polysaccharide in Xinjiang[D]. Shihezi: Shihezi University, 2018: 36−55.
[87] RJEIBI I, FERIANI A, BEN S A, et al. Lycium europaeum Linn as a source of polysaccharide with in vitro antioxidant activities and in vivo anti-inflammatory and hepato-nephroprotective potentials[J]. Journal of Ethnopharmacology,2018,225:116−127. doi: 10.1016/j.jep.2018.06.036
[88] 刘晓菲, 胡双飞, 张学武. 一种羧甲基茯苓多糖的结构及生物活性[J]. 现代食品科技,2018,34(7):42−49. [LIU X F, HU S F, ZHANG X W. et al. Structure and bioactivities of a carboxymethyl polysaccharide from pachyman[J]. Modern Food Science and Technology,2018,34(7):42−49. [89] 刘玮, 杨继国, 任杰, 等. 姬松茸多糖ABD的结构表征及抗炎活性研究[J]. 现代食品科技,2017,33(5):27−32. [LIU W, YANG J G, REN J, et al. Structure characterization and anti inflammatory activity of polysaccharide ABD from Agaricus blazei murill[J]. Modern Food Science and Technology,2017,33(5):27−32. [90] XU X J, XU J, ZHANG Y Y, et al. Rheology of triple helical lentinan in solution: Steady shear viscosity and dynamic oscillatory behavior[J]. Food Hydrocolloids,2007,22(5):735−741.
[91] 刘青业, 许小娟. 三螺旋多糖的链结构与功能研究进展[J]. 功能高分子学报,2016,29(2):134−152. [LIU Q Y, XU X J. Recent progress in chain conformation and function of triple helical polysaccharides[J]. Journal of Founctional Polymers,2016,29(2):134−152. [92] 苗晶囡, 邱军强, 李海霞, 等. 天然多糖对肠道菌群调节作用的研究进展[J]. 中国食物与营养,2019,25(12):52−58. [MIAO J N, QIU J Q, LI H X, et al. Natural polysaccharides exhibit various biological activities by targeting gut microbiota[J]. Food and Nutrition in China,2019,25(12):52−58. doi: 10.3969/j.issn.1006-9577.2019.12.011 [93] ZHANG M, CUI S W, CHEUNG P C K. Antitumor polysaccharides from mushrooms: A review on their isolation process, structural characteristics and antitumor activity[J]. Trends in Food Science Technology,2007,18:4−19. doi: 10.1016/j.jpgs.2006.07.013





 下载:
下载:
 下载:
下载:
