Enzymatic Preparation and Sequence Analysis of Antioxidant Peptides from Chicken Lung
-
摘要: 在家禽屠宰工业中鸡肺一般用作低值饲料,为了增加鸡肺的附加值,本文测定了鸡肺的基本化学成分,并通过酶解的方式制备了抗氧化肽。首先以1,1-二苯基-2-三硝基苯肼(1, 1-diphenyl-2-picrylhydrazyl,DPPH)和肽含量为指标,利用单因素实验探索了酶的种类、pH、酶添加量、酶解时间对鸡肺抗氧化肽活性的影响。在此基础上,通过Box-Behnken响应曲面试验优化了胃蛋白酶酶解制备鸡肺抗氧化肽的最优反应条件,得到主要影响因素为pH、酶添加量、酶解时间(P<0.05),拟合出最优酶解条件为pH3.60,酶添加量4200 U/g,酶解时间5 h,验证试验的DPPH·清除率和粗肽含量分别为94.96%和88.42%。与未经酶解的鸡肺匀浆上清液相比,酶解得到的粗肽液游离氨基酸含量显著升高(P<0.05)。超滤产物中<3 kDa组分抗氧化能力最强,该组分分子量<1000 Da的比例为86.70%,液质联用(liquid chromatography-mass spectrometry/mass spectrometry,LC-MS/MS)测序发现疏水残基比≥50%的肽段高达60.97%,Val和Leu占肽链N端出现频率的48.78%。研究结果可为屠宰副产物鸡肺的综合利用提供理论依据和技术支持。Abstract: Chicken lung is generally utilized as a low-value feed in poultry slaughtering industry. In order to increase the added value of chicken lung, this study determined the proximate chemical composition of chicken lung and prepared antioxidant peptide by enzymatic hydrolysis. Firstly, using 1, 1-diphenyl-2-picrylhydrazyl (DPPH) scavenging rate and crude peptide content as indexes, the effects of the kinds of enzyme, pH, enzyme supplemental levels and hydrolysis time on antioxidant peptide activity were investigated by single factor experiment. Secondly, based on the results, Box-Behnken response surface designed was used to optimize the reaction conditions for enzymatic hydrolysis of chicken lung antioxidant peptide. The main influencing factors were pH, enzyme supplemental levels and hydrolysis time (P<0.05). The optimal conditions were obtained as follows: pH3.60, enzyme supplemental levels 4200 U/g, hydrolysis time 5 h. The DPPH· scavenging rate and crude peptide content in the validation test were 94.96% and 88.42%, respectively. Thirdly, compared with the supernatant of chicken lung homogenate, the free amino acid content of the crude peptide increased significantly (P<0.05). Finally, among the ultrafiltration products, the <3 kDa component had the strongest antioxidant capacity while the proportion of molecular weight <1000 Da was 86.70%. Liquid chromatography-mass spectrometry/mass spectrometry (LC-MS/MS) sequencing revealed that peptides with water residue ratio ≥50% were 60.97%. Meanwhile, Val and Leu accounted for 48.78% of the total N-terminal frequency of occurrence from peptide. The present results could provide theoretical and technical support for the comprehensive utilization of chicken lung.
-
我国是仅次于美国的世界第二大肉类生产国和消费国,肉鸡出栏量和消费量一直呈现持续上升趋势。根据中国畜牧业协会公布的数据,2019年我国出栏白羽肉鸡44亿羽,黄羽肉鸡49亿羽,淘汰蛋鸡11亿羽,817肉杂鸡18亿羽。《2020年白羽肉鸡联盟成员企业屠宰量排名》显示2020年屠宰白羽肉鸡35.5亿羽[1-2]。鸡肺作为肉鸡屠宰加工过程中的副产品,每只鸡平均鸡肺重量为10~12 g,目前主要作为低值饲料供应给养殖户或直接作为废弃物处理,未能得到高值化和产业化利用,造成了资源浪费和环境污染等问题。目前国内外关于鸡肺利用的文献极少,国内关于鸡肺的研究主要集中在胶原蛋白的提取、稳定性、微观结构、凝胶乳化性研究方面[3–5]。国外报道多为禽流感病毒感染鸡肺的全基因组宿主基因表达分析[6]、细胞分离鉴定及敏感性[7]等方面。目前国内外鲜有关于鸡肺提取生物活性物质并加以利用的案例,因此选择合适的方式对鸡肺实现综合利用十分迫切。
研究表明机体产生的自由基会对核酸、脂质和蛋白质等物质的结构和功能造成氧化损伤,引起老年痴呆症等衰老疾病的产生[8]。同时在食品加工过程中产生的自由基会促使脂质氧化过程的进行[9],产生丙二醛等脂肪氧化产物,造成食品风味、感官品质的劣变,降低食用价值的同时还会对人体造成不利影响。目前工业用抗氧化剂主要是VC、VE等物质以及二丁基羟基甲苯(butylated hydroxyltoluene,BHT)、丁基羟基茴香醚(butylated hydroxyanisole,BHA)等,前者属于天然抗氧化剂,来源较为广泛;但是光、热稳定性较差易分解,后者抗氧化效果好,但是长期使用会对人体产生一定的毒副作用[10]。利用蛋白质含量较高的屠宰副产物鸡肺制备天然来源的抗氧化肽是一种良好的选择,目前抗氧化肽的制备主要集中于酶解法、微生物发酵法以及化学合成法、基因重组法[11]处理天然动植物原料,其中酶解法由于反应条件温和、效率高等优点,广泛应用于副产物制备生物活性肽,该方法制备的抗氧化肽在肉制品保鲜与自由基清除方面已显示出良好效果[12]。
本研究首先测定了鸡肺的化学组成,从基本营养成分和含量较高的金属元素等角度补充了目前关于鸡肺基本成分资料的空白。针对目前国内外关于副产物制备抗氧化肽的工艺优化过程主要局限于关注自由基清除率变化的问题,本文提出了采用DPPH·清除率和粗肽含量双指标,从自由基清除能力和肽产率两个角度共同评价酶解过程。此外,通过比较酶解前后游离氨基酸的组成和含量,从较深层面分析酶解后抗氧化能力较强的原因。在取得的优化工艺基础上,采用超滤对抗氧化肽进行纯化,选择自由基清除能力较强的部分进行分子量分布与肽序列测定,利用热图进行肽段末端氨基酸残基出现频率分析。本文研究将为鸡肺生物活性肽的应用提供理论依据和实际参考。
1. 材料与方法
1.1 材料与仪器
鸡肺 取自818肉杂鸡,0.9~1.1 kg,公鸡,日龄40~45 d,屠宰掏膛后立即收集,新兴县温氏佳丰食品有限公司;胃蛋白酶(1.5×105 U/g)、木瓜蛋白酶(8×105 U/g)、碱性蛋白酶(2×105 U/g)、复合蛋白酶(1.2×105 U/g)、DPPH(1,1-二苯基-2-三硝基苯肼)、ABTS(2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐) 上海源叶生物科技有限公司;细胞色素C(MW12384)、抑肽酶(MW6500)、杆菌肽(MW1422)、乙氨酸-乙氨酸-酪氨酸-精氨酸(MW451)、乙氨酸-乙氨酸-乙氨酸(MW189)均为标准品 Sigma公司;总抗氧化能力测试试剂盒(FRAP法) 碧云天公司;其他试剂 均为分析纯。
FOSS Kjeltec8400凯氏定氮仪 瑞典福斯公司;DH-9240A烘箱 上海浦东荣丰科学仪器有限公司;SX-G30103马弗炉 天津中环电炉股份有限公司;PE900T原子吸收光谱仪 美国珀金埃尔默公司;HH-6孔电热恒温水浴锅 绍兴市苏珀仪器有限公司;PD 500高速均质机 英国普律玛仪器有限公司;S2-Food Kit型pH计 瑞士梅特勒托得多公司;Vortex-2涡旋混匀仪 上海沪析实业有限公司;MS304TS/02电子天平 梅特勒-托利多仪器(上海)有限公司;INFINITE 200 PRO酶标仪 瑞士帝肯公司;Allegar-64R型离心机 美国贝克曼库尔特公司;SCIENTZ-10N冷冻干燥机 宁波新芝生物科技有限公司;7310全自动氨基酸分析仪 赛卡姆(北京)科学仪器有限公司;LC-20AT高效液相色谱仪 日本岛津公司;Thermo Scientific QE HF质谱仪 美国赛默飞公司。
1.2 实验方法
1.2.1 鸡肺抗氧化肽酶解工艺
参考文献方法[13]并稍作修改,鸡肺清水浸泡5 min沥水后剪去气管和大体积脂肪块,冲洗3次去除表面杂质并绞碎,加入去离子水调料液比为1:3(w:w),倒入烧杯匀浆(10000 r/min,20 s,重复3次),调pH后放入水浴锅预热10 min后加蛋白酶保持恒温水解(水解过程中用1 mol/L的稀盐酸和NaOH溶液调节pH),酶解完成后将反应液pH调至7.0随后沸水浴10 min灭酶,酶解液冰浴、离心取上清液(10000 r/min,15 min),取上清测DPPH·清除率与肽含量。
1.2.2 单因素实验
1.2.2.1 酶的选择
参考表1,根据前期预实验结果,在酶解程度较为完全的条件下,将四种蛋白酶:复合蛋白酶、碱性蛋白酶、胃蛋白酶、木瓜蛋白酶在其最适pH和温度下[14]按照酶添加量6000 U/g,料液比1:3(w/w),酶解时间6 h进行酶解,结束后取离心(10000 r/min, 15 min)上清液测定DPPH·清除率和粗肽含量,选择DPPH·清除率和粗肽含量均最高的蛋白酶进行后续的单因素和响应面试验。
表 1 不同蛋白酶最适pH和温度Table 1. Optimal pH and temperature for different proteases名称 最适pH 最适温度(℃) 复合蛋白酶 6.0 50 碱性蛋白酶 9.0 60 胃蛋白酶 3.0 37 木瓜蛋白酶 6.0 45 1.2.2.2 pH的选择
以料液比1:3(w:w)、温度37 ℃、酶添加量6000 U/g、酶解时间4 h为基本条件,分别研究不同的pH(1.5、2.5、3.5、4.5、5.5)对鸡肺抗氧化肽的DPPH·清除率、粗肽含量的影响。
1.2.2.3 酶添加量的选择
以料液比1:3(w:w)、温度37 ℃、pH3.5、酶解时间4 h为基本条件,分别研究不同的酶添加量(2000、4000、6000、8000、10000 U/g)对鸡肺抗氧化肽的DPPH·清除率、粗肽含量的影响。
1.2.2.4 酶解时间的选择
以料液比1:3(w:w)、温度37 ℃、pH3.5、酶添加量6000 U/g为基本条件,分别研究不同的酶解时间(1、2、4、6、8 h)对鸡肺抗氧化肽的DPPH·清除率、粗肽含量的影响。
1.2.3 Box-Behnken响应面试验
在单因素实验的基础上,选取pH(A)、酶添加量(B)、酶解时间(C)为试验因子,以DPPH·清除率和粗肽含量为响应值,采用Box-Behnken的中心组合试验设计进行三因素三水平的试验设计,响应面设计中因素及水平见表2。
表 2 响应面设计因素及水平Table 2. Response surface design factors and levels水平 A(pH) B (酶添加量,U/g) C(酶解时间,h) −1 2.5 2000 4 0 3.5 4000 6 1 4.5 6000 8 1.2.4 抗氧化肽超滤分离
分别采用3和10 kDa的超滤管对鸡肺抗氧化肽粗品进行超滤分离,将肽粗品溶解于去离子水中,配制浓度为10 mg/mL的溶液。15 mL超滤管上样10 mL,4000 r/min离心15 min,分别收集分子量>10 kDa,3~10 kDa和<3 kDa的组分冷冻干燥,并稀释成2 mg/mL的溶液进行抗氧化指标的测定,选择抗氧化能力最强的组分进行分子量分布测定和肽序列测定。
1.2.5 基本化学成分测定
含水量:参照GB 5009.3-2016《食品中水分的测定总蛋白质含量》第一法 直接干燥法;总蛋白:参照GB 5009.5-2016《食品中蛋白质的测定》第一法 凯氏定氮法;脂肪:参照GB 5009.6-2016《食品中脂肪的测定》第一法 索氏抽提法;灰分:参照GB 5009.4-2016《食品中灰分的测定》第一法 食品中总灰分的测定;钾、钠:参照GB 5009.91-2017《食品中钾、钠的测定》第一法 火焰原子吸收光谱法。
1.2.6 抗氧化指标
1.2.6.1 DPPH·清除率的测定
参考Liu等[15]的方法进行,将DPPH用95%的乙醇溶液溶解后,配制成0.2 mmol/L的DPPH溶液。样品组为1 mL DPPH溶液与1 mL粗肽液的混合液,对照组为1 mL DPPH溶液与1 mL 95%乙醇溶液的混合液,空白组为1 mL粗肽液和1 mL 95%乙醇溶液的混合液。室温25 ℃避光反应30 min后,测定其在517 nm处的吸光值,粗肽液的DPPH·清除能力计算见式(1):
DPPH⋅清除能力(%)=(1−A样品−A空白A对照−A空白)×100 (1) 1.2.6.2 铁离子还原能力(Ferric ion reducing antioxidant power,FRAP)
使用总抗氧化能力测试试剂盒(FRAP法)测定,操作按照说明书进行。
1.2.6.3 ABTS+·清除率的测定
参考Zakrys等[16]的方法,ABTS溶液与氧化剂等体积混合配制ABTS工作液,室温避光放置12~16 h。用磷酸盐缓冲液稀释工作液,取200 μL上述工作液与10 μL样品混匀,室温反应4 min,于734 nm处测定吸光度,以超纯水作为空白对照。ABTS+·清除率计算公式如下:
ABTS+⋅清除率(%)=A0−A1A0×100 (2) 式中:A0为超纯水与ABTS工作液的吸光度; A1为样品溶液与ABTS工作液的吸光度
1.2.7 肽含量的测定
参考Luan等[17]的方法并稍作改进,采用邻苯二甲醛法(OPA法)测定粗肽含量,邻苯二甲醛混合溶液的配制方法为80 mg邻苯二甲醛溶于1 mL甲醇中,依次加入50 mL四硼酸钠溶液(0.1 mol/L)、5 mL十二烷基硫酸钠(20%,w/w)、200 μL β-巯基乙醇,去离子水定容至100 mL,试剂现用现配。取150 μL浓度为1 mg/mL的粗肽溶液,加入2.0 mL邻苯二甲醛混合试剂,剧烈混匀后室温避光反应2 min后测定反应液在340 nm波长处的吸光值。用胰蛋白胨作为标准蛋白,配制浓度为0~1 mg/mL梯度的标准溶液,分别测定吸光值,以蛋白浓度为横坐标,吸光值为纵坐标绘制标准曲线,计算出鸡肺粗肽粉中的多肽含量,计算方式见公式(3):
肽含量(%)=(标准曲线对应的浓度1mg/mL)×100 (3) 1.2.8 酶解前后氨基酸组成分析
酶解前后样品按照GB 5009.124-2016《食品中氨基酸的测定》方法进行氨基酸组成分析。其中表格数据鸡肺列为根据酶解前液体的氨基酸含量与稀释倍数折算而成,酶解前液体为鸡肺匀浆处理后离心取上清液,酶解后上清液为酶解液离心取上清液进行测定。
1.2.9 肽分子量分布测定
采用高效液相色谱仪测定鸡肺抗氧化肽的肽分子量分布[18]。配制1 mg/mL的标准品溶液:乙氨酸-乙氨酸-乙氨酸(MW 189)、乙氨酸-乙氨酸-酪氨酸-精氨酸(MW 451)、杆菌肽(MW 1422)、抑肽酶(MW 6500)、细胞色素C(MW 12384),上样量10 μL,经TSKgel凝胶色谱柱等度洗脱,流动相组成:乙腈:水:三氟乙酸=40:60:0.1(v:v:v),柱温30 ℃,流速0.5 mL/min,绘制标准品与洗脱时间之间的标准曲线。样品液经过0.22 μm滤膜过滤,在与标品同样的条件下洗脱,参考标曲计算样品的分子量分布。
1.2.10 LC-MS/MS 鉴定肽段
肽粉用超纯水复溶后采用3 kDa的超滤管进行超滤,离心结束后收集滤液,进行脱盐、挥干,产物使用液相色谱-串联质谱结构(LC-MS/MS)进行测定。LC-MS/MS系统由Thermo EASY nLc-Thermo scientific QE HF组成,色谱柱为PepMap RSLC C18。
根据Xing等[19]的方法,流动相设置如下:A相(0.1%甲酸),B相(0.1%甲酸,80%乙腈),样品流速为350 nL/min,洗脱过程为:0~7 min(97% A,3% B),7~46 min(92% A,8% B),46~51 min(68% A,32% B),51~56 min(56% A,44% B),56~60.10 min(1% A,99% B),60.10~70 min(97% A,3% B)。选择6个一级质谱中的最高峰进行碎片扫描,使用Peaks Studio X对肽段进行从头测序(De novo),选择具有高置信度(95%~99%)的序列进行分析。
进行热图分析时,氨基酸肽端出现频率用式(4)表示:
氨基酸肽端出现频率=N端(或C端)某种氨基酸出现次数N端(或C端)各氨基酸出现的总次数 (4) 1.3 数据处理
实验重复三次,数据以平均值±标准偏差表示,采用IBM SPSS Statistics 25软件(IBM,USA)进行单因素方差分析、独立样本T检验,如果方差分析效应显著,采用Duncan’s法进行多重比较,显著水平设为P<0.05,应用Design-Expert 8.0.6(Stat-Ease,USA)进行响应曲面优化试验设计和结果分析,运用Origin 2021b(OriginLab Co, Northampton, MA, USA)绘制柱状图、折线图与热图。
2. 结果与分析
2.1 鸡肺基本化学组成分析
鸡肺(湿样)经测定各组分含量见表3。由表3可以看出,通过与李小勇[20]研究得到的猪肺基本成分进行比较发现,鸡肺中水分含量为81.45 g/100 g,与猪肺含水量(83.10 g/100 g)相比,两者含量接近;鸡肺蛋白质含量较高,为14.00 g/100 g,脂肪和灰分含量较低,分别为2.50和0.94 g/100 g,是作为蛋白酶解提取生物活性肽的良好原料。鸡肺蛋白质含量高于猪肺(12.20 g/100 g)而脂肪含量低于猪肺(3.90 g/100 g),基本营养成分较猪肺更适合进行蛋白酶解。对于含量较高的矿物质钾和钠元素,它们在新鲜鸡肺中的含量均高于猪肺(分别为210和81.40 mg/100 g),整体营养价值较高。
表 3 鸡肺基本化学成分Table 3. Proximate chemical composition of chicken lung基本成分 含量 水分 81.45±1.63(g/100 g) 总蛋白 14.00±0.04(g/100 g) 脂肪 2.50±0.02(g/100 g) 灰分 0.94±0.03(g/100 g) 钾 223.06±4.24(mg/100 g) 钠 106.49±1.49(mg/100 g) 2.2 酶解条件的单因素实验
2.2.1 酶的选择
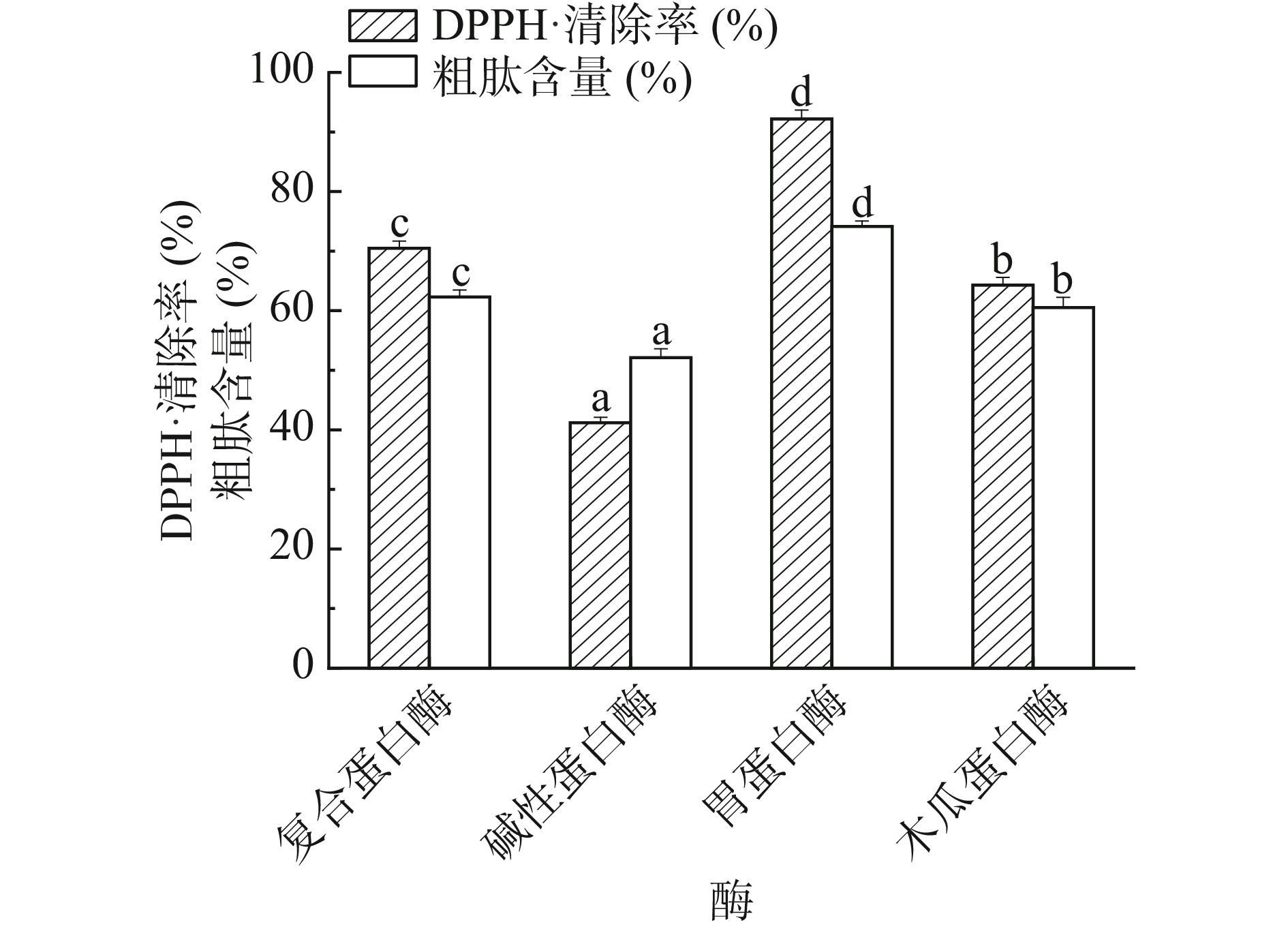
不同蛋白酶有不同的酶切位点,在酶解过程中,不同蛋白酶的选择会对酶解产物的氨基酸组成造成很大的影响,进而会导致产物的抗氧化能力和粗肽含量存在一定的差异[21],因此需要选择合适的蛋白酶对底物进行酶解。如图1所示,四种蛋白酶酶解产物的DPPH·清除能力和粗肽含量为:胃蛋白酶>复合蛋白酶>木瓜蛋白酶>碱性蛋白酶,其中胃蛋白酶酶解产物的DPPH·清除能力显著高于其他三种蛋白酶酶解产物(P<0.05),达到了92.20%,粗肽含量达到了74.15%。王璐莎等[8]在研究酶解鸭肉制备抗氧化肽时同样发现胃蛋白酶酶解产物拥有最高的肽含量和抗氧化能力,因此以胃蛋白酶作为酶解反应中的酶进行后续研究。胃蛋白酶作为内源性蛋白酶,具有一定的氨基酸特异性,其酶切位点主要在氨基端或羧基端为Phe、Tyr、Trp和Leu的肽键部位[22]。研究表明Trp和Tyr因分别含有吲哚基和酚羟基作为电子供体,从而产生较好的自由基清除作用[23]。
2.2.2 pH的选择
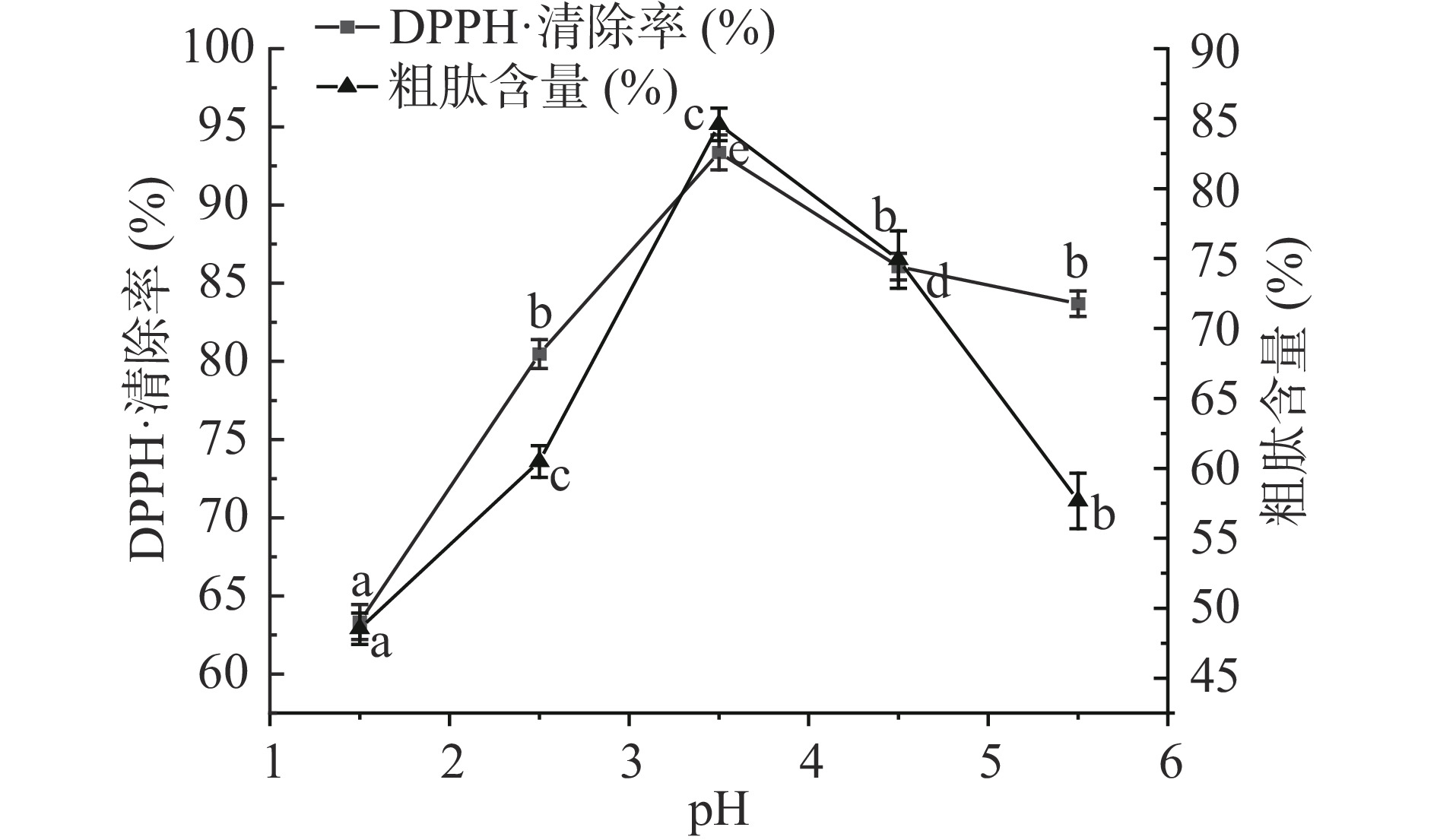
本研究探索了酶解过程中不同pH对鸡肺酶解产物的DPPH·清除率与粗肽含量的影响,由图2可以看出,pH对两者均具有显著影响(P<0.05)。当pH为1.5~3.5时,随着pH的增加,DPPH·清除率和粗肽含量显著增加,最高值分别为93.37%和84.59%,随后两者都有下降趋势。其原因在于蛋白酶作为生物活性物质,具有发挥作用的最适pH范围,过酸或过碱的环境会造成蛋白酶活性减弱或消失,基团电离作用导致酶分子催化基团和底物分子上有关基团的改变,因此只有处在适宜的pH范围内才能有效切断肽键,释放出具有抗氧化能力的小分子肽段[24]。因此,综合考虑选择pH3.5作为响应面0水平。
2.2.3 酶添加量的选择
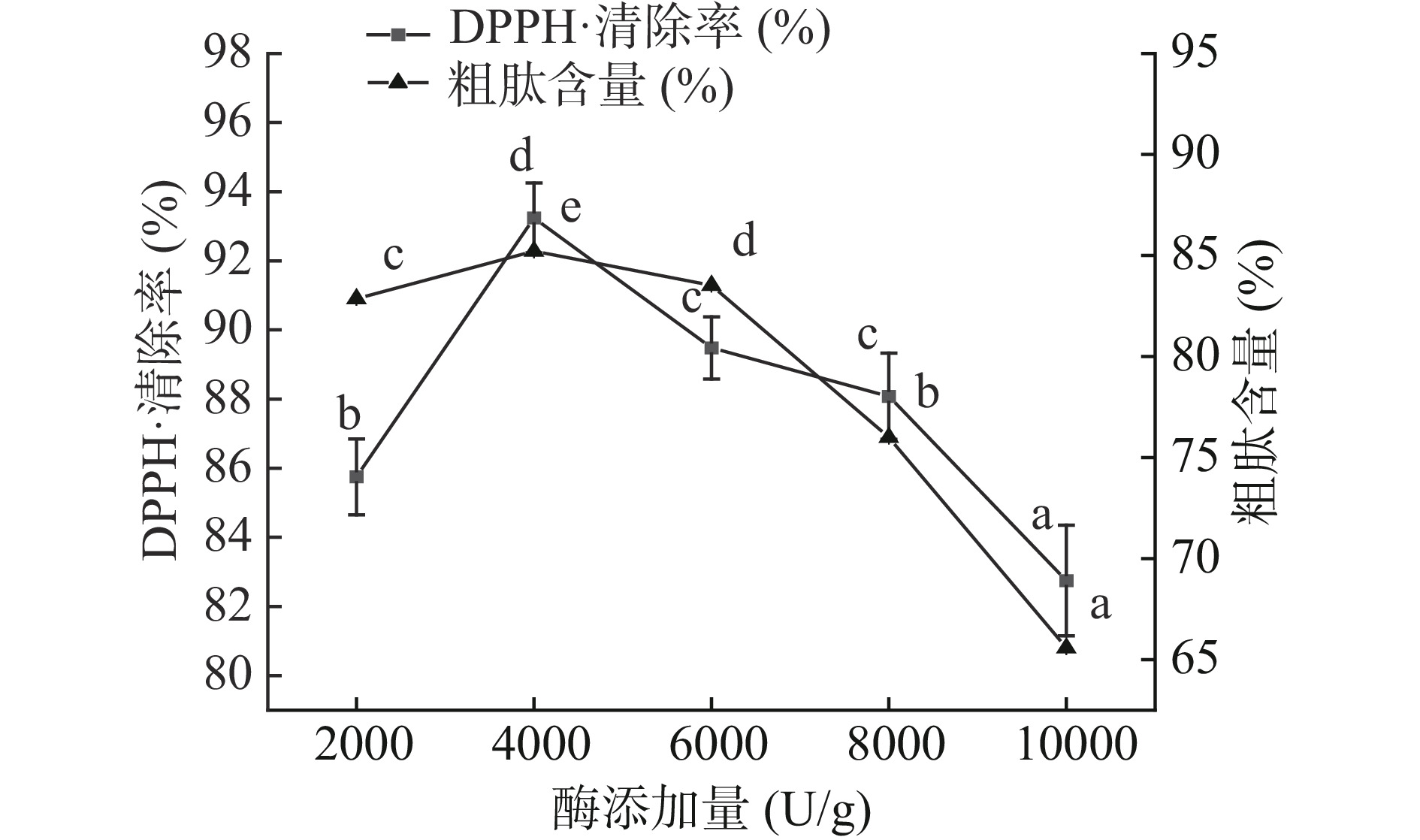
酶和底物的比例是影响酶促反应的主要因素,因此酶添加量是影响底物酶解的重要条件。如图3所示,随着酶添加量的增加(2000~4000 U/g),DPPH·清除率和粗肽含量均显著增加(P<0.05),最高分别达到93.24%和85.21%,在底物浓度一定时,随着酶添加量的增加,分子中更多活性基团与蛋白酶得到充分接触,进而加快反应速率,蛋白质被酶解为具有抗氧化能力的小分子多肽,从而使整个体系的肽含量与自由基清除能力增加。徐兆刚等[24]研究表明当酶添加量到达一定程度时,继续增加蛋白酶的用量,会导致底物饱和,具有抗氧化作用的肽段被进一步水解为无活性的小分子肽或氨基酸,导致体系的自由基清除能力和粗肽含量均显著下降。综合上述分析,选择4000 U/g作为响应面0水平。
2.2.4 酶解时间的选择
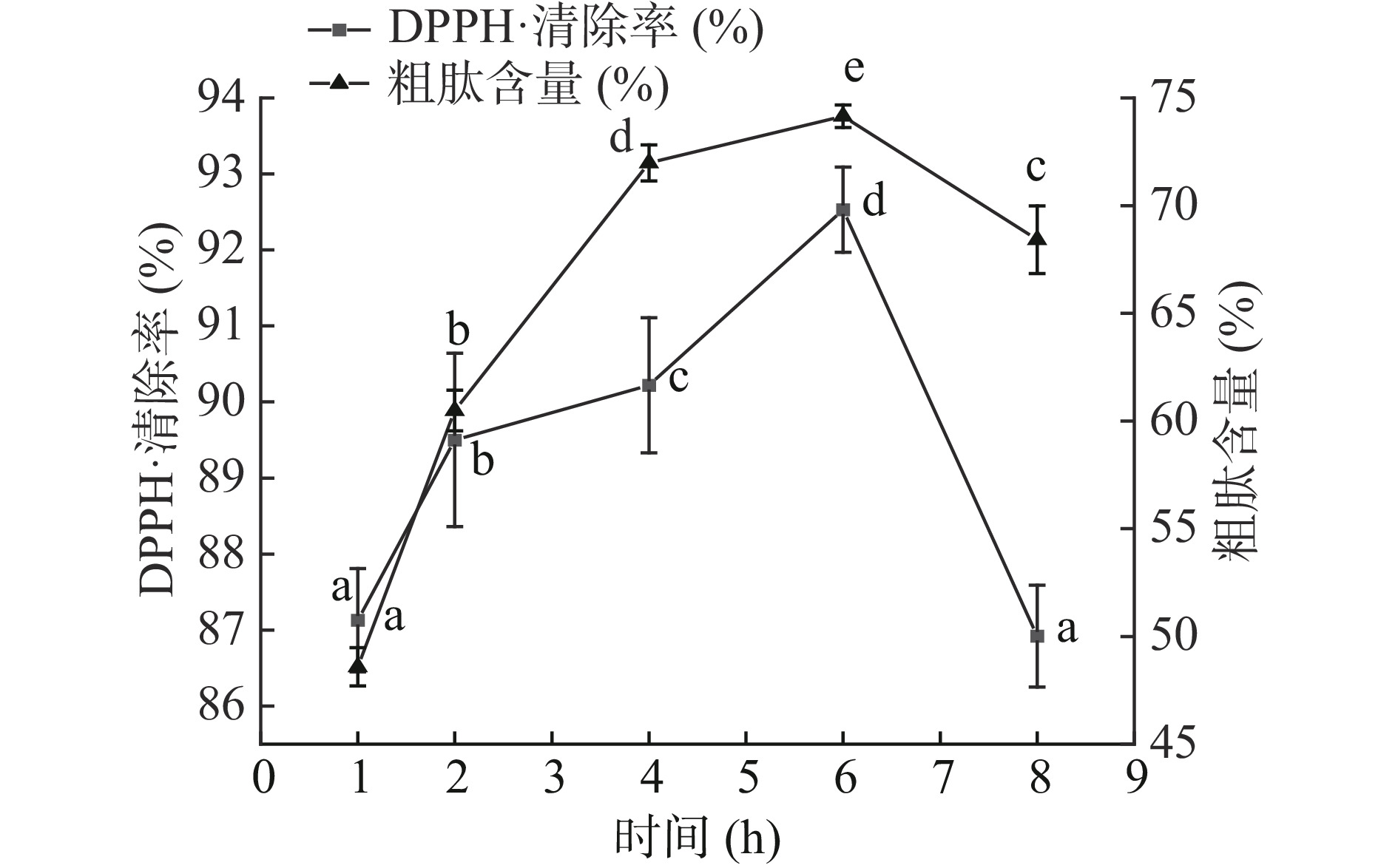
蛋白酶只有在适宜条件下进行一定时间的酶解,才能充分释放游离氨基酸和肽段,发挥产物应有的生理功能。由图4可知,不同酶解时间对DPPH·清除率和粗肽含量均有显著影响(P<0.05),且两者趋势一致。当酶解1~6 h时,随着酶解时间的延长,DPPH·清除率和粗肽含量均显著增加,在6 h时分别达到92.53%和74.15%,6 h后两者均显著下降。其原因可能在于反应初期,底物质量浓度较高,蛋白酶与底物蛋白有充足的位点相互结合,蛋白质空间结构发生改变,暴露出较多的酶切位点有利于蛋白酶进行酶切[25-26]。当酶解时间过长时,蛋白质过度水解,同时小分子多肽灵活性高,优先成为蛋白酶切作用位点的选择,导致具有抗氧化能力的多肽结构遭到破坏,水解成为游离氨基酸[10,27]。综上,选择6 h作为响应面0水平。
2.3 响应面试验结果
2.3.1 回归模型的建立和方差分析
利用Design Expert软件对pH、酶添加量、酶解时间进行三因素三水平Box Behnken试验,响应面试验设计及结果如表4所示。对实验结果进行方差分析,对数据进行多元回归拟合,得到DPPH·清除率(Y1)与肽含量(Y2)对pH(A)、酶添加量(B)、酶解时间(C)的二次响应曲面回归方程如下:
表 4 响应曲面试验设计与结果Table 4. Design program and experimental results of RSM实验号 编码 Y1 DPPH·
清除率(%)Y2 粗肽含量
(%)A B C 1 1 0 −1 90.23 83.01 2 −1 1 0 81.02 45.19 3 0 0 −1 92.05 81.56 4 0 −1 1 88.76 75.46 5 0 0 0 94.22 84.50 6 1 −1 0 86.51 77.32 7 0 0 0 94.50 86.75 8 −1 0 −1 82.77 49.80 9 1 0 1 83.05 70.12 10 −1 0 1 82.36 51.59 11 0 0 0 94.86 87.86 12 0 −1 −1 88.32 80.51 13 0 0 1 81.85 78.49 14 0 0 0 94.67 86.57 15 −1 −1 0 79.48 44.48 16 1 1 0 80.39 80.41 17 0 0 0 94.31 84.92 Y1=94.51+1.82A−0.97B−2.17C−1.91AB−1.69AC−2.66BC−7.90A2−4.76B2−2.01C2
Y2=86.12+14.98A+0.98B−2.40C+0.59AB−3.67AC+0.50BC−19.82A2−4.45B2−2.67C2
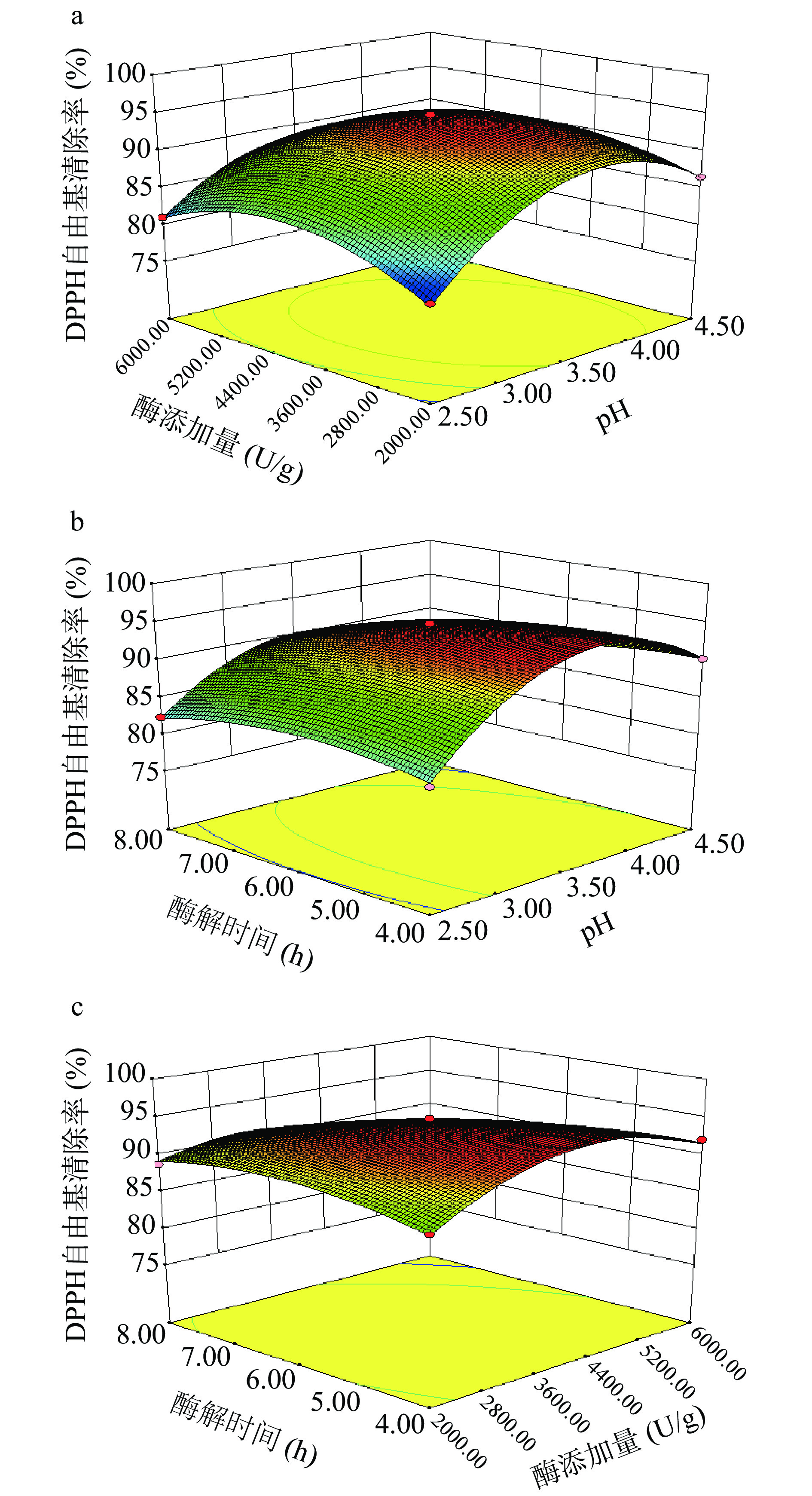
酶解产物对DPPH·清除率的回归方程方差分析见表5。结果显示回归方程模型中因变量与自变量之间存在极显著关系,模型整体P<0.0001,说明该模型极显著。根据回归方程中一次项的均方可知,影响酶解过程中产物对DPPH·清除率的因素重要性排序为:时间(C)>pH(A)>酶添加量(B),且三者均对模型具有极显著影响(P<0.01)。失拟项P=0.0588>0.05不显著,表明未知因素对试验结果的影响较小,残差主要来自于随机误差[28]。在本模型中,决定系数R2=0.9972,校正拟合度R2Adj=0.9936,期望拟合度R2pred=0.9628,校正拟合度和期望拟合度相差不大,且模型的信噪比为43.61,表明模型与试验拟合程度较好,可以用此模型来进行较为准确的预测分析。
表 5 DPPH·清除率试验结果方差分析Table 5. ANOVA for DPPH· scavenging rate变异来源 平方和 自由度 均方 F值 P值 模型 533.20 9 59.24 278.57 <0.0001** A 26.46 1 26.46 124.43 <0.0001** B 7.53 1 7.53 35.39 0.0006** C 37.63 1 37.53 176.93 <0.0001** AB 14.67 1 14.67 68.97 <0.0001** AC 11.46 1 11.46 53.88 0.0002** BC 28.30 1 28.30 133.08 <0.0001** A2 262.93 1 262.93 1236.31 <0.0001** B2 95.39 1 95.39 448.53 <0.0001** C2 16.96 1 16.96 79.77 <0.0001** 残差 1.49 7 0.21 失拟 1.22 3 0.41 5.96 0.0588 总变异 534.69 16 注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01);表6同。 图5能够直观反映当固定一个因素为中心点水平时,其他各因变量的交互作用对DPPH·清除率的影响,从曲面图结合投影可知,当曲面弯曲程度越大,等高线越接近椭圆形时,说明各因素之间的交互作用越强,各因素之间的等高线均呈椭圆形,说明因素之间相关性较强,对模型具有极显著的影响(P<0.01),与方差分析结果一致。从图5中可知,固定酶解时间为中心点水平,当酶添加量较少时,随着pH的升高,产物对DPPH·清除率呈上升趋势,当酶添加量较多时,随着pH的升高产物对DPPH·清除率先上升后下降。固定pH、酶添加量为中心点时也能得到相同的结论。
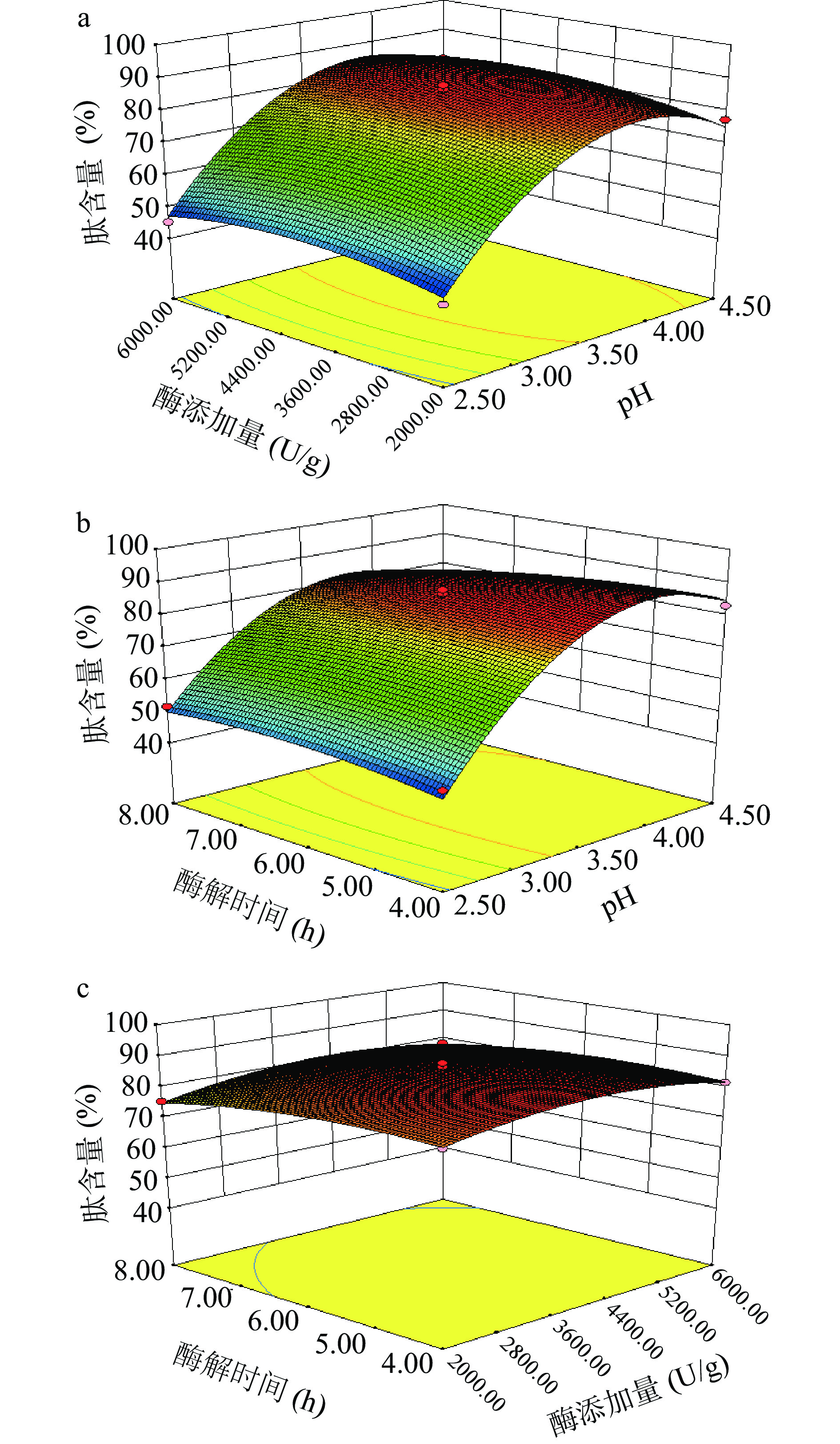
酶解产物对粗肽含量的回归方程方差分析见表6。结果显示回归方程模型中因变量与自变量之间存在极显著关系,模型整体P<0.0001,说明该模型极显著。根据回归方程中一次项的均方可知,影响酶解过程中肽含量的因素重要性排序为:pH(A)>酶解时间(C)>酶添加量(B),且pH和酶解时间对模型具有显著影响(P<0.05)。失拟项P=0.0586>0.05不显著,模型整体较为准确。在本模型中,决定系数R2=0.9889,校正拟合度R2Adj=0.9747,预测拟合度R2pred=0.8518,且模型的信噪比为21.07,表明模型与试验拟合程度较好,可以用此模型来进行较为准确的预测分析。
表 6 肽含量试验结果方差分析Table 6. ANOVA for peptide content变异来源 平方和 自由度 均方 F值 P值 模型 3754.26 9 417.14 69.35 <0.0001** A 1794.01 1 1794.01 298.26 <0.0001** B 7.76 1 7.76 1.29 0.2934 C 46.18 1 46.18 7.68 0.0277* AB 1.42 1 1.42 0.24 0.6423 AC 53.88 1 53.88 8.96 0.0201* BC 0.98 1 0.98 0.16 0.6985 A2 1654.45 1 1654.45 275.06 <0.0001** B2 83.29 1 83.29 13.85 0.0074** C2 29.96 1 29.96 4.98 0.0608 残差 42.10 7 6.01 失拟 34.41 3 11.47 5.97 0.0586 总变异 3796.36 16 图6能够直观反映各因变量的交互作用对粗肽含量的影响,从3D曲面图结合投影可知,pH和酶解时间椭圆坡度较陡,弯曲程度较大,因素之间相关性较强,对模型具有显著影响(P<0.05)。从图中可知,固定酶解时间为中心点水平,当酶添加量较少时,随着pH的升高,产物的粗肽含量呈上升趋势,当酶添加量较多时,随着pH的升高产物的粗肽含量先上升后下降。固定pH、酶添加量为中心点时也能得到相同的结论。Wang等[29]发现羟自由基清除率随着三氯乙酸(trichloroacetic acid,TCA)可溶性蛋白含量增加而变大,原因在于随着水解过程的进行,蛋白水解生成的小肽暴露出能与氧化剂发生反应的氨基酸残基,进而表现为抗氧化活性的增加,说明体系的抗氧化能力与小肽含量呈正相关关系。
2.3.2 验证试验
结合两套响应曲面进行优化分析,得到在酶解参数为温度37 ℃,料液比1:3(w:w)的条件下,以DPPH·清除率和粗肽含量均最大作为评价指标,确定胃蛋白酶的最优酶解工艺为pH3.64,酶添加量4197.53 U/g,酶解时间5.01 h。为方便实际操作将其修正为pH3.60,酶添加量4200 U/g,酶解时间5 h。在此条件下进行验证试验得到DPPH·清除率及肽含量为94.96%±0.15%和88.42%±0.23%,与预测值95.27%和88.64%无显著性差异(P>0.05),表明预测值与实际值之间拟合性较好,模型可行。
2.4 酶解前后氨基酸组成分析
根据表7数据对酶解前后样品液的氨基酸组成进行分析,鸡肺样品酶解后,绝大多数游离氨基酸含量均显著上升(P<0.05),表明在胃蛋白酶的作用下,鸡肺中蛋白质在上述优化得到的适宜条件下被水解,生成小分子多肽的同时释放出了游离氨基酸。食物蛋白来源的生物活性肽其功能性与氨基酸的组成、序列及长度有密切关系[30]。前人研究表明,抗氧化肽发挥抗氧化作用主要取决于分子较小的疏水性氨基酸[31]和芳香族氨基酸[32],前者具有的亲核侧链以及后者具有的芳香族侧链能够作为电子供体提供氢原子,阻断自由基链式反应,表现出一定的自由基清除能力。从表中可以看到酶解后样品该类氨基酸含量均显著高于酶解前样品(P<0.05),疏水性氨基酸含量占氨基酸总量的44.88%,疏水性氨基酸的存在能够增强小分子肽在脂肪体系中的溶解性,疏水与亲水基团使短肽分布在油水界面,加强肽与脂肪酸间的互相作用,对脂溶性的DPPH·显示出清除作用。
表 7 酶解前后样品游离氨基酸组成Table 7. Free amino acid composition of samples before and after enzymatic hydrolysis氨基酸种类 相对含量(mg/g样品) 鸡肺 酶解前液体 酶解后上清液 天冬氨酸(Asp) ND ND 0.42±0.02* 谷氨酸(Glu) 1.24±0.08 0.31±0.02 0.85±0.03* 丝氨酸(Ser) ND ND 0.12±0.01* 甘氨酸(Gly) 0.60±0.04 0.15±0.01 0.25±0.03* 组氨酸(His) ND ND 0.18±0.02* 精氨酸(Arg) 1.28±0.20 0.32±0.05 0.32±0.05 苏氨酸(Thr) ND ND ND 丙氨酸(Ala) 0.64±0.08 0.16±0.02 0.35±0.03* 脯氨酸(Pro) 0.48±0.08 0.12±0.02 0.13±0.02 酪氨酸(Tyr) ND ND 0.22±0.01* 缬氨酸(Val) 0.52±0.04 0.13±0.01 0.24±0.01* 蛋氨酸(Met) ND ND 0.26±0.03* 半胱氨酸(Cys) ND ND 0.52±0.01* 异亮氨酸(Ile) ND ND 0.13±0.01* 亮氨酸(Leu) 0.68±0.12 0.17±0.03 0.72±0.06* 苯丙氨酸(Phe) ND ND 0.32±0.05* 赖氨酸(Lys) ND ND 0.28±0.03* 疏水氨基酸 2.32±0.12 0.58±0.04 2.15±0.21* 总量 5.40±0.40 1.35±0.10 4.79±0.24* 注:对酶解前后的样品液采用独立样本T检验;同行“*”表示差异显著(P<0.05);ND表示未检出;鸡肺的游离氨基酸含量通过酶解前样品液与水的体积比折算而成。 2.5 超滤法纯化酶解液及其组分抗氧化活性评价
多肽不同分子量的组分具有不同的抗氧化能力,通常认为分子质量小的多肽相比于分子量大的肽具有更强的抗氧化能力[33]。为了获得具有更高抗氧化活性的组分,有必要对酶解产物进行进一步的纯化。超滤技术利用膜的截留分子量不同,使得不同分子量范围的组分分离,具有简单高效的特点,广泛应用于多肽和蛋白的分离纯化中[34]。不同分子量的超滤分级产物在浓度为2 mg/mL时的抗氧化能力见表8,由表可知分子量<3 kDa组分的DPPH·、ABTS+·清除能力和FRAP均显著优于其他两个组分(P<0.05)。Onuh等[35]研究发现,与大分子肽相比,小分子肽具有更强的转移电子或与自由基结合的能力,与本研究一致。鉴于<3 kDa的组分抗氧化能力最强,选择该部分进行肽分子量分布与肽序鉴定研究。
表 8 超滤后不同组分的抗氧化活性Table 8. Antioxidant activities of different peptide fractions after ultrafiltration分子量 DPPH·清除能力(%) FRAP(μmol TE/g) ABTS+·清除能力(%) <3 kDa 66.55±1.41c 30.72±0.47c 56.80±0.51c 3~10 kDa 32.39±1.63b 17.48±0.26b 35.31±0.44b >10 kDa 21.55±2.50a 16.46±0.26a 24.08±0.19a 注:同列不同小写字母表示差异显著(P<0.05)。 2.6 肽分子量分布
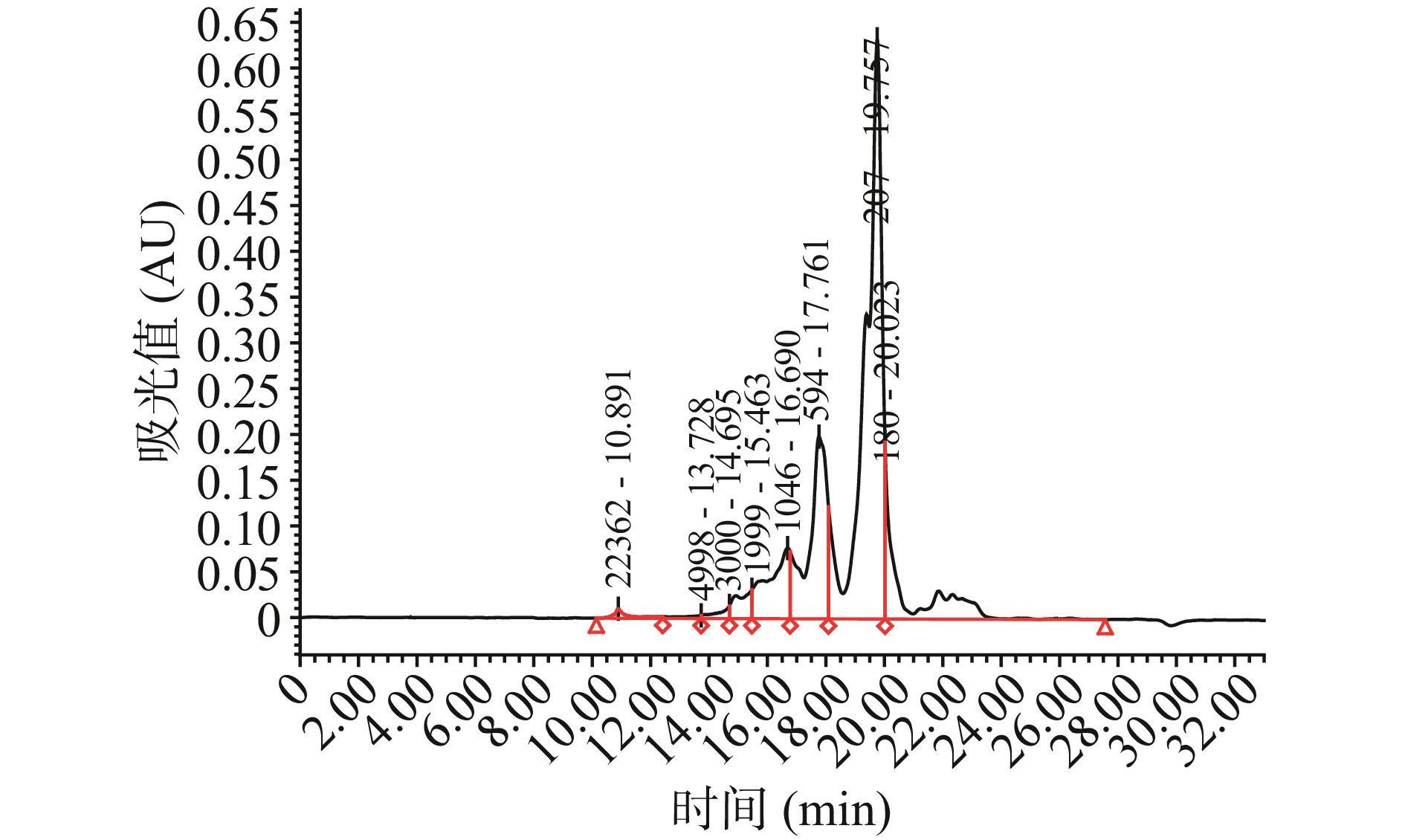
肽分子量分布能够反映多肽分子量的相对集中程度,是反映酶解与纯化程度的重要指标。采用高效液相系统配合凝胶色谱法相较于十二烷基硫酸钠-聚丙稀酰胺凝胶电泳(SDS-PAGE)法能够更准确地体现多肽在各个分子量范围的相对含量[36]。图7为液相色谱洗脱图,经过超滤后的鸡肺抗氧化肽分子量范围见表9,其中<3 kDa的组分分子量范围及相对含量为:3000~2000 Da(2.48%)、2000~1000 Da(8.87%)、1000~500 Da(18.70%)、500~180 Da(55.44%)、<180 Da(12.56%)。从表中数据可知分子量<1000 Da的组分高达86.70%,表明酶解程度彻底,生成了较多低分子寡肽。Samaranayaka等[37]指出,大多数食物来源的抗氧化肽的分子量处于500~1800 Da之间。王璐莎在研究鸭肉蛋白源抗氧化肽时也表明分子量为500~2000 Da的寡肽拥有高于多肽的抗氧化能力[38]。由此可推断鸡肺肽抗氧化能力较强与其分子量较低密切相关。
表 9 鸡肺抗氧化肽分子量分布Table 9. Molecular weight distribution of peptide from chicken lung分子量范围(Da) 峰面积百分比λ220 nm(%) >10000 0.77±0.12 10000~5000 0.36±0.03 5000~3000 0.82±0.15 3000~2000 2.48±0.14 2000~1000 8.87±0.32 1000~500 18.70±1.56 500~180 55.44±2.69 <180 12.56±1.21 2.7 LC-MS/MS肽序测定与热图分析
为了进一步明确鸡肺抗氧化肽的氨基酸序列、肽序长度、分子量等信息,探索抗氧化能力与其之间的相互关系,对超滤后的鸡肺肽进行LC-MS/MS序列测定,总质子流图和肽序信息见图8和表10。研究发现,大多数食源性抗氧化肽的分子量介于500~1800 Da,由2~20个氨基酸组成[39]。从表10中数据可知,鸡肺抗氧化肽的肽段绝大部分位于700~1800 Da,由5~17个氨基酸组成。除了较低的分子量以外,多肽的抗氧化活性还与疏水性氨基酸的比例密切相关。疏水性氨基酸主要包含Ala、Pro、Val、Leu、Ile、Trp、Met和Phe[40-41]。疏水性氨基酸在溶液体系中的存在能够提高肽段在脂质体系中的溶解度,加强肽段与脂溶性自由基如DPPH·的相互作用[42]。鸡肺抗氧化肽片段整体疏水性较高,其中疏水残基比≥50%的片段高达60.97%,与<3 kDa的组分具有最强的DPPH·清除能力相对应。
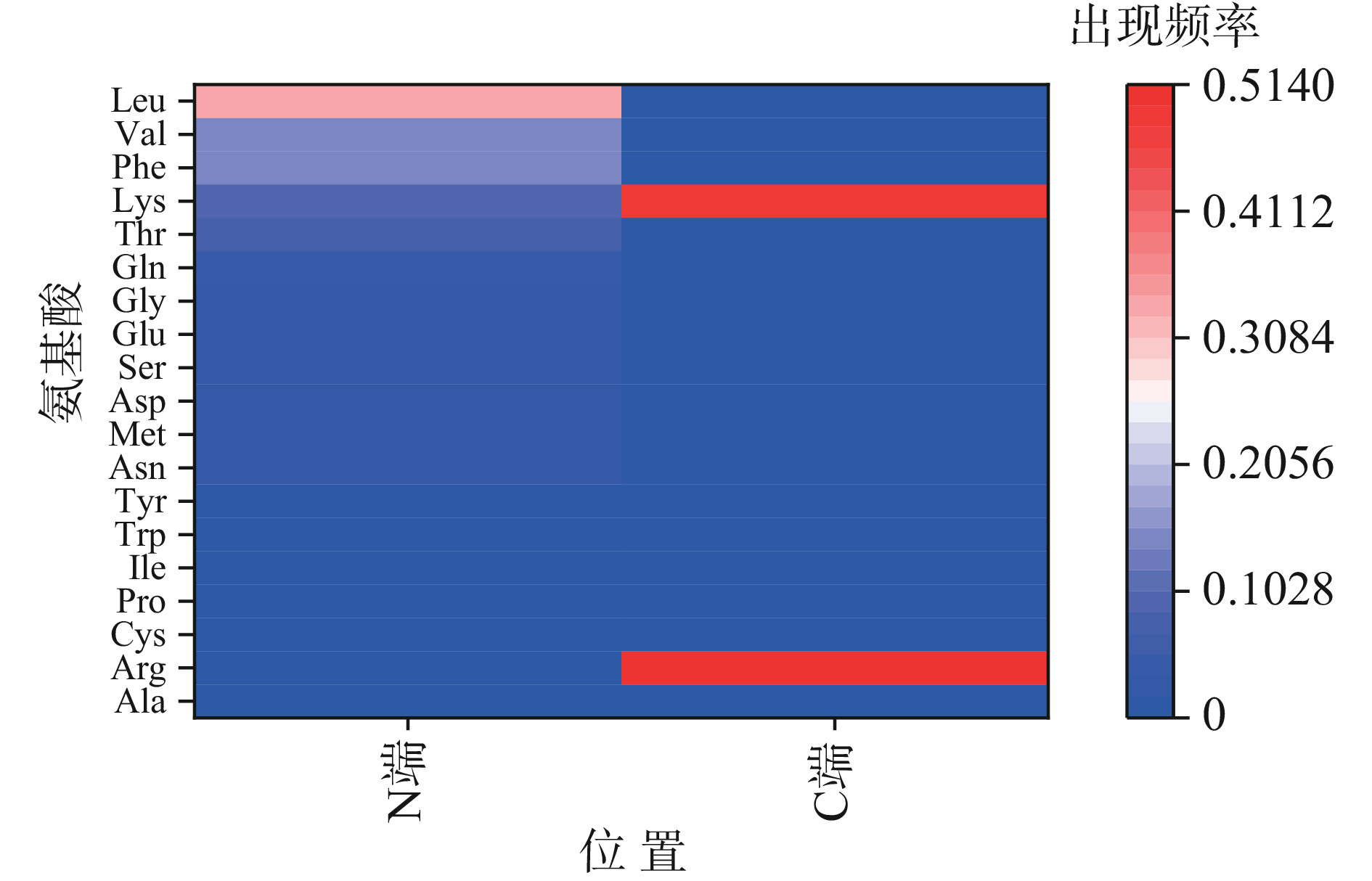
表 10 鸡肺肽组成分析Table 10. Analysis of peptide composition from chicken lung序号 肽序列 长度 疏水残基比(%) 分子量(Da) 质荷比(m/z) 1 SSPTALLGVHMR 12 41.67 1267.67 634.84 2 FTVHMR 6 50.00 789.39 395.70 3 LYEETRRLVK 10 20.00 1305.74 653.87 4 LPWDLK 6 66.67 770.43 386.22 5 LLVHMR 6 66.67 767.44 384.72 6 VQHEELPLPLSK 12 50.00 1388.76 695.39 7 TSFGDAVKAR 10 40.00 1050.54 526.28 8 LAWQLK 6 66.67 757.44 379.73 9 VAWQLK 6 66.67 743.43 372.72 10 FAVKNLDNLK 10 50.00 1160.65 387.89 11 DLPWFR 6 66.67 832.42 417.22 12 EPSSNMPWFGK 11 36.36 1278.57 640.29 13 LVVHMR 6 66.67 753.43 377.72 14 VVVHMR 6 66.67 739.41 370.71 15 LVKNLDNLK 9 44.44 1055.63 528.82 16 FLVHMR 6 66.67 801.43 401.72 17 VPFLPR 6 83.33 727.43 364.73 18 FSFPNR 6 50.00 766.37 384.19 19 KLDWNLLK 8 50.00 1028.60 515.31 20 TSFGDAVKRADNLNK 15 33.33 1634.83 818.42 21 FGVLLR 6 50.00 703.43 352.72 22 VTNWDDMEKLWHGPCK 16 37.50 1957.88 979.96 23 KLTTPTYGDLAHR 13 30.77 1471.77 736.89 24 TLAAPHVFR 9 66.67 1010.56 506.29 25 LLWGVK 6 66.67 714.44 358.23 26 LLDNLK 6 50.00 714.42 358.22 27 LLWLR 5 80.00 699.44 350.73 28 LLWQLK 6 66.67 799.49 400.75 29 VTSFGWVKNLDLNK 14 42.86 1619.86 540.96 30 KPPTDPSKVR 10 40.00 1165.64 389.56 31 LWGKVGR 7 42.86 814.48 408.24 32 KMGDANLDNLGALQK 15 40.00 1628.81 815.42 33 NGLLARHR 8 37.50 951.53 476.77 34 LLWLR 5 80.00 699.44 350.73 35 MPWFK 5 80.00 707.34 354.68 36 QTSFGDAVKNLDRAK 15 33.33 1648.85 825.44 37 QLQAWEKANHR 11 36.36 1395.70 698.85 38 GFVGWR 6 50.00 720.37 361.19 39 FLWQLK 6 66.67 833.47 417.75 40 LTVHMR 6 50.00 755.41 378.71 41 LTSFGDAVKNLDNLTNK 17 35.29 1848.95 925.49 氨基酸的排列顺序也会对肽段的抗氧化能力产生影响[43–45],当疏水性氨基酸中的Val、Leu、Ile、Ala尤其是Val和Leu出现在N端时,肽段通常表现出优异的抗氧化能力[46]。从图9可得到不同氨基酸残基在肽段N端(C端)的出现频率,N端出现频率较高的氨基酸为:Leu、Val、Phe、Lys,C端仅出现两种氨基酸残基:Arg、Lys,值得注意的是共有20个肽段N端出现了Val和Leu,占到了N端总出现频率的48.78%,说明鸡肺抗氧化肽具有良好的抗氧化潜力。Dong等[21]发现不同的氨基酸残基具有不同的抗氧化能力,金属离子的还原与螯合主要与≥15个氨基酸长度的肽链和酸性氨基酸(Glu、Asp)、碱性氨基酸(His、Arg、Lys)相关,由此推测TSFGDAVKRADNLNK、VTNWDDMEKLWHGPCK、KMGDANLDNLGALQK等肽段赋予了鸡肺肽一定的铁还原能力。此外,Zheng等[47]发现ABTS+·的清除仅与Cys和Tyr有关,因此考虑鸡肺的ABTS+·清除能力与肽段LYEETRRLVK、VTNWDDMEKLWHGPCK、KLTTPTYGDLAHR有关。
3. 结论
本研究测定了鸡肺的基本成分,其中蛋白质含量为14.00 g/100 g,适合进行酶解。通过单因素实验确定了影响胃蛋白酶酶解鸡肺制备抗氧化肽自由基清除能力和粗肽含量的pH、时间和酶添加量。在此基础上利用响应面试验优化酶解工艺,最优条件为pH3.60,酶添加量4200 U/g,酶解时间5 h。在此条件下进行验证试验的DPPH·清除率和粗肽含量分别为94.96%和88.42%。鸡肺酶解后疏水性氨基酸含量显著增加(P<0.05)。超滤产物中<3 kDa的组分(主要分布于180~2000 Da)抗氧化能力最强。液质联用结果显示鸡肺肽疏水性氨基酸残基比>50%,Val、Leu占N端总出现频率的48.78%。综上所述,酶解制备的鸡肺肽整体分子量较小,抗氧化效果好,研究结果希望为内脏等副产品制备生物活性肽提供理论依据和技术支持。
-
表 1 不同蛋白酶最适pH和温度
Table 1 Optimal pH and temperature for different proteases
名称 最适pH 最适温度(℃) 复合蛋白酶 6.0 50 碱性蛋白酶 9.0 60 胃蛋白酶 3.0 37 木瓜蛋白酶 6.0 45 表 2 响应面设计因素及水平
Table 2 Response surface design factors and levels
水平 A(pH) B (酶添加量,U/g) C(酶解时间,h) −1 2.5 2000 4 0 3.5 4000 6 1 4.5 6000 8 表 3 鸡肺基本化学成分
Table 3 Proximate chemical composition of chicken lung
基本成分 含量 水分 81.45±1.63(g/100 g) 总蛋白 14.00±0.04(g/100 g) 脂肪 2.50±0.02(g/100 g) 灰分 0.94±0.03(g/100 g) 钾 223.06±4.24(mg/100 g) 钠 106.49±1.49(mg/100 g) 表 4 响应曲面试验设计与结果
Table 4 Design program and experimental results of RSM
实验号 编码 Y1 DPPH·
清除率(%)Y2 粗肽含量
(%)A B C 1 1 0 −1 90.23 83.01 2 −1 1 0 81.02 45.19 3 0 0 −1 92.05 81.56 4 0 −1 1 88.76 75.46 5 0 0 0 94.22 84.50 6 1 −1 0 86.51 77.32 7 0 0 0 94.50 86.75 8 −1 0 −1 82.77 49.80 9 1 0 1 83.05 70.12 10 −1 0 1 82.36 51.59 11 0 0 0 94.86 87.86 12 0 −1 −1 88.32 80.51 13 0 0 1 81.85 78.49 14 0 0 0 94.67 86.57 15 −1 −1 0 79.48 44.48 16 1 1 0 80.39 80.41 17 0 0 0 94.31 84.92 表 5 DPPH·清除率试验结果方差分析
Table 5 ANOVA for DPPH· scavenging rate
变异来源 平方和 自由度 均方 F值 P值 模型 533.20 9 59.24 278.57 <0.0001** A 26.46 1 26.46 124.43 <0.0001** B 7.53 1 7.53 35.39 0.0006** C 37.63 1 37.53 176.93 <0.0001** AB 14.67 1 14.67 68.97 <0.0001** AC 11.46 1 11.46 53.88 0.0002** BC 28.30 1 28.30 133.08 <0.0001** A2 262.93 1 262.93 1236.31 <0.0001** B2 95.39 1 95.39 448.53 <0.0001** C2 16.96 1 16.96 79.77 <0.0001** 残差 1.49 7 0.21 失拟 1.22 3 0.41 5.96 0.0588 总变异 534.69 16 注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01);表6同。 表 6 肽含量试验结果方差分析
Table 6 ANOVA for peptide content
变异来源 平方和 自由度 均方 F值 P值 模型 3754.26 9 417.14 69.35 <0.0001** A 1794.01 1 1794.01 298.26 <0.0001** B 7.76 1 7.76 1.29 0.2934 C 46.18 1 46.18 7.68 0.0277* AB 1.42 1 1.42 0.24 0.6423 AC 53.88 1 53.88 8.96 0.0201* BC 0.98 1 0.98 0.16 0.6985 A2 1654.45 1 1654.45 275.06 <0.0001** B2 83.29 1 83.29 13.85 0.0074** C2 29.96 1 29.96 4.98 0.0608 残差 42.10 7 6.01 失拟 34.41 3 11.47 5.97 0.0586 总变异 3796.36 16 表 7 酶解前后样品游离氨基酸组成
Table 7 Free amino acid composition of samples before and after enzymatic hydrolysis
氨基酸种类 相对含量(mg/g样品) 鸡肺 酶解前液体 酶解后上清液 天冬氨酸(Asp) ND ND 0.42±0.02* 谷氨酸(Glu) 1.24±0.08 0.31±0.02 0.85±0.03* 丝氨酸(Ser) ND ND 0.12±0.01* 甘氨酸(Gly) 0.60±0.04 0.15±0.01 0.25±0.03* 组氨酸(His) ND ND 0.18±0.02* 精氨酸(Arg) 1.28±0.20 0.32±0.05 0.32±0.05 苏氨酸(Thr) ND ND ND 丙氨酸(Ala) 0.64±0.08 0.16±0.02 0.35±0.03* 脯氨酸(Pro) 0.48±0.08 0.12±0.02 0.13±0.02 酪氨酸(Tyr) ND ND 0.22±0.01* 缬氨酸(Val) 0.52±0.04 0.13±0.01 0.24±0.01* 蛋氨酸(Met) ND ND 0.26±0.03* 半胱氨酸(Cys) ND ND 0.52±0.01* 异亮氨酸(Ile) ND ND 0.13±0.01* 亮氨酸(Leu) 0.68±0.12 0.17±0.03 0.72±0.06* 苯丙氨酸(Phe) ND ND 0.32±0.05* 赖氨酸(Lys) ND ND 0.28±0.03* 疏水氨基酸 2.32±0.12 0.58±0.04 2.15±0.21* 总量 5.40±0.40 1.35±0.10 4.79±0.24* 注:对酶解前后的样品液采用独立样本T检验;同行“*”表示差异显著(P<0.05);ND表示未检出;鸡肺的游离氨基酸含量通过酶解前样品液与水的体积比折算而成。 表 8 超滤后不同组分的抗氧化活性
Table 8 Antioxidant activities of different peptide fractions after ultrafiltration
分子量 DPPH·清除能力(%) FRAP(μmol TE/g) ABTS+·清除能力(%) <3 kDa 66.55±1.41c 30.72±0.47c 56.80±0.51c 3~10 kDa 32.39±1.63b 17.48±0.26b 35.31±0.44b >10 kDa 21.55±2.50a 16.46±0.26a 24.08±0.19a 注:同列不同小写字母表示差异显著(P<0.05)。 表 9 鸡肺抗氧化肽分子量分布
Table 9 Molecular weight distribution of peptide from chicken lung
分子量范围(Da) 峰面积百分比λ220 nm(%) >10000 0.77±0.12 10000~5000 0.36±0.03 5000~3000 0.82±0.15 3000~2000 2.48±0.14 2000~1000 8.87±0.32 1000~500 18.70±1.56 500~180 55.44±2.69 <180 12.56±1.21 表 10 鸡肺肽组成分析
Table 10 Analysis of peptide composition from chicken lung
序号 肽序列 长度 疏水残基比(%) 分子量(Da) 质荷比(m/z) 1 SSPTALLGVHMR 12 41.67 1267.67 634.84 2 FTVHMR 6 50.00 789.39 395.70 3 LYEETRRLVK 10 20.00 1305.74 653.87 4 LPWDLK 6 66.67 770.43 386.22 5 LLVHMR 6 66.67 767.44 384.72 6 VQHEELPLPLSK 12 50.00 1388.76 695.39 7 TSFGDAVKAR 10 40.00 1050.54 526.28 8 LAWQLK 6 66.67 757.44 379.73 9 VAWQLK 6 66.67 743.43 372.72 10 FAVKNLDNLK 10 50.00 1160.65 387.89 11 DLPWFR 6 66.67 832.42 417.22 12 EPSSNMPWFGK 11 36.36 1278.57 640.29 13 LVVHMR 6 66.67 753.43 377.72 14 VVVHMR 6 66.67 739.41 370.71 15 LVKNLDNLK 9 44.44 1055.63 528.82 16 FLVHMR 6 66.67 801.43 401.72 17 VPFLPR 6 83.33 727.43 364.73 18 FSFPNR 6 50.00 766.37 384.19 19 KLDWNLLK 8 50.00 1028.60 515.31 20 TSFGDAVKRADNLNK 15 33.33 1634.83 818.42 21 FGVLLR 6 50.00 703.43 352.72 22 VTNWDDMEKLWHGPCK 16 37.50 1957.88 979.96 23 KLTTPTYGDLAHR 13 30.77 1471.77 736.89 24 TLAAPHVFR 9 66.67 1010.56 506.29 25 LLWGVK 6 66.67 714.44 358.23 26 LLDNLK 6 50.00 714.42 358.22 27 LLWLR 5 80.00 699.44 350.73 28 LLWQLK 6 66.67 799.49 400.75 29 VTSFGWVKNLDLNK 14 42.86 1619.86 540.96 30 KPPTDPSKVR 10 40.00 1165.64 389.56 31 LWGKVGR 7 42.86 814.48 408.24 32 KMGDANLDNLGALQK 15 40.00 1628.81 815.42 33 NGLLARHR 8 37.50 951.53 476.77 34 LLWLR 5 80.00 699.44 350.73 35 MPWFK 5 80.00 707.34 354.68 36 QTSFGDAVKNLDRAK 15 33.33 1648.85 825.44 37 QLQAWEKANHR 11 36.36 1395.70 698.85 38 GFVGWR 6 50.00 720.37 361.19 39 FLWQLK 6 66.67 833.47 417.75 40 LTVHMR 6 50.00 755.41 378.71 41 LTSFGDAVKNLDNLTNK 17 35.29 1848.95 925.49 -
[1] 张怡, 赵婉丽, 姜常宜, 等. 2020年全球肉鸡生产、贸易及产业经济发展研究[J]. 中国家禽,2021,43(5):62−69. [ZHANG Y, ZHAO W L, JIANG C Y, et al. Global broiler production, trade and industrial economic development research in 2020[J]. China Poultry,2021,43(5):62−69. ZHANG Y, ZHAO W L, JIANG C Y, et al. Global broiler production, trade and industrial economic development research in 2020[J]. China Poultry, 2021, 43(5): 62-69.
[2] 瞿丞, 贺稚非, 李少博, 等. 我国肉鸡生产加工现状与发展趋势[J]. 食品与发酵工业,2019,45(8):258−266. [QU C, HE Z F, LI S B, et al. Current status and development trend of processing and producing broilers in China[J]. Food and Fermentation Industries,2019,45(8):258−266. QU C, HE Z F, LI S B, et al. Current status and development trend of processing and producing broilers in China[J]. Food and Fermentation Industries, 2019, 45(8): 258–266.
[3] 杨恒, 陈银基, 邹烨, 等. 两种方法提取的鸡肺胶原蛋白性质及保湿性研究[J]. 食品工业科技,2021,41(17):1−13. [YANG H, CHEN Y J, ZOU Y, et al. Properties and moisture retention of chicken lung collagen by two extraction methods[J]. Science and Technology of Food Industry,2021,41(17):1−13. YANG H, CHEN Y J, ZOU Y, et al. Properties and moisture retention of chicken lung collagen by two extraction methods[J]. Science and Technology of Food Industry, 2021, 41(17): 1-13.
[4] 潘佳昕, 杨恒, 时海波, 等. 高效酶提取鸡肺明胶及其结构与性质的研究[J]. 食品与生物技术学报,2021,40(1):75−81. [PAN J X, YANG H, SHI H B, et al. Study on structure and properties of chicken lung gelatin prepared by efficient enzymatic extraction[J]. Journal of Food and Biotechnology,2021,40(1):75−81. doi: 10.3969/j.issn.1673-1689.2021.01.010 PAN J X, YANG H, SHI H B, et al. Study on structure and properties of chicken lung gelatin prepared by efficient enzymatic extraction[J]. Journal of Food and Biotechnology, 2021, 40(1): 75–81. doi: 10.3969/j.issn.1673-1689.2021.01.010
[5] 杨恒, 时海波, 邹烨, 等. 超声波辅助酸提鸡肺胶原蛋白的持油性和乳化性[J]. 江苏农业学报,2019,35(4):940−947. [YANG H, SHI H B, ZOU Y, et al. The oil-holding capacity and emulsifying properties of collagen from chicken lung extracted by ultrasonic-assisted acid method[J]. Journal of Jiangsu Agricultural Sciences,2019,35(4):940−947. doi: 10.3969/j.issn.1000-4440.2019.04.027 YANG H, SHI H B, ZOU Y, et al. The oil-holding capacity and emulsifying properties of collagen from chicken lung extracted by ultrasonic-assisted acid method[J]. Journal of Jiangsu Agricultural Sciences, 2019, 35(4): 940-947. doi: 10.3969/j.issn.1000-4440.2019.04.027
[6] RANAWARE P B, MISHRA A, VIJAYAKUMAR P, et al. Genome wide host gene expression analysis in chicken lungs infected with avian influenza viruses[J]. PloS One,2016,11(4):e0153671. doi: 10.1371/journal.pone.0153671
[7] KHATRI M, O’BRIEN T D, GOYAL S M, et al. Isolation and characterization of chicken lung mesenchymal stromal cells and their susceptibility to avian influenza virus[J]. Developmental and Comparative Immunology,2010,34(4):474−479. doi: 10.1016/j.dci.2009.12.008
[8] 王璐莎, 张首玉, 黄明, 等. 鸭肉蛋白源抗氧化肽的酶法制备工艺[J]. 食品科学,2015,36(7):90−96. [WANG L S, ZHANG S Y, HUANG M, et al. Preparation of antioxidant peptides derived from duck meat by enzymatic hydrolysis[J]. Food Science,2015,36(7):90−96. doi: 10.7506/spkx1002-6630-201507017 WANG L S, ZHANG S Y, HUANG M, et al. Preparation of antioxidant peptides derived from duck meat by enzymatic hydrolysis[J]. Food Science, 2015, 36(7): 90-96. doi: 10.7506/spkx1002-6630-201507017
[9] 刘文营, 乔晓玲, 成晓瑜, 等. 天然抗氧化剂对广式腊肠感官品质及挥发性风味物质的影响[J]. 中国食品学报,2019,19(2):206−215. [LIU W Y, QIAO X L, CHENG X Y, et al. Effect of natural antioxidant on sensory quality and volatile flavor substances of cantonese style sausage[J]. Chinese Journal of Food Science,2019,19(2):206−215. LIU W Y, QIAO X L, CHENG X Y, et al. Effect of natural antioxidant on sensory quality and volatile flavor substances of cantonese style sausage[J]. Chinese Journal of Food Science, 2019, 19(2): 206-215.
[10] CHEUNG I W Y, CHEUNG L K Y, TAN N Y, et al. The role of molecular size in antioxidant activity of peptide fractions from Pacific hake (Merluccius productus) hydrolysates[J]. Food Chemistry,2012,134(3):1297−1306. doi: 10.1016/j.foodchem.2012.02.215
[11] AGRAWAL H, JOSHI R, GUPTA M. Purification, identification and characterization of two novel antioxidant peptides from finger millet (Eleusine coracana) protein hydrolysate[J]. Food Research International,2019,120:697−707. doi: 10.1016/j.foodres.2018.11.028
[12] 陈卫明. 含抗氧化肽的即食贻贝鱼糕工艺研究[D]. 福州: 福建农林大学, 2016. CHEN W M. Study on the technology of instant mussel cake containing antioxidant peptide[D]. Fuzhou: Fujian Agriculture and Forestry University, 2016.
[13] 张晓娟. 猪肺中有效生物活性物质的提取、分离与性质研究[D]. 绵阳: 西南科技大学, 2015. ZHANG X J. Study on extraction, isolation and properties of effective bioactive substances from pig lung[D]. Mianyang: Southwest University of Science and Technology, 2015.
[14] 李芳, 侯伟伟, 任海波, 等. 超声辅助酶解鹰嘴豆蛋白制备抗氧化肽的研究[J]. 食品研究与开发,2015,36(13):35−38. [LI F, HOU W W, REN H B, et al. Study on ultrasonic-assisted enzymatic hydrolysis of chickpea protein to prepare anti-oxidative peptide[J]. Food Research and Development,2015,36(13):35−38. doi: 10.3969/j.issn.1005-6521.2015.13.010 LI F, HOU W W, REN H B, et al. Study on ultrasonic-assisted enzymatic hydrolysis of chickpea protein to prepare anti-oxidative peptide[J]. Food Research and Development, 2015, 36(13): 35-38. doi: 10.3969/j.issn.1005-6521.2015.13.010
[15] LIU D M, CHEN X, HUANG J C, et al. Generation of bioactive peptides from duck meat during post-mortem aging[J]. Food Chemistry,2017,237:408−415. doi: 10.1016/j.foodchem.2017.05.094
[16] ZAKRYS-WALIWANDER P I, O’SULLIVAN M G, O’NEILL E E, et al. The effects of high oxygen modified atmosphere packaging on protein oxidation of bovine M. longissimus dorsi muscle during chilled storage[J]. Food Chemistry,2012,131(2):527−532. doi: 10.1016/j.foodchem.2011.09.017
[17] LUAN X X, FENG M Q, SUN J. Effect of Lactobacillus plantarum on antioxidant activity in fermented sausage[J]. Food Research International,2021,144:110351. doi: 10.1016/j.foodres.2021.110351
[18] 刘伯业. 小麦蛋白低苦味肽的制备及其脱苦机理研究[D]. 无锡: 江南大学, 2017. LIU B Y. Preparation and mechanism of wheat protein low bitterness peptide[D]. Wuxi: Jiangnan University, 2017.
[19] XING L J, LIU R, GAO X G, et al. The proteomics homology of antioxidant peptides extracted from dry-cured Xuanwei and Jinhua ham[J]. Food Chemistry,2018,266:420−426. doi: 10.1016/j.foodchem.2018.06.034
[20] 李小勇. 猪肺中胶原蛋白的提取及理化特性研究[D]. 重庆: 西南大学, 2007. LI X Y. Study on the extraction and physicochemical properties of collagen from pig lung[D]. Chongqing: Southwest University, 2007.
[21] DONG S Y, ZENG M Y, WANG D F, et al. Antioxidant and biochemical properties of protein hydrolysates prepared from silver carp (Hypophthalmichthys molitrix)[J]. Food Chemistry,2008,107(4):1485−1493. doi: 10.1016/j.foodchem.2007.10.011
[22] 芦鑫, 贾聪, 高锦鸿, 等. 体外模拟消化芝麻蛋白产生抗氧化肽的分离纯化与构效研究[J]. 核农学报,2021,35(4):891−901. [LU X, JIA C, GAO J H, et al. Separation, purification, structure-activity relationship of antioxidant peptides derived from in vitro gastrointestinal digestion of sesame protein[J]. Journal of Nuclear Agricultural Sciences,2021,35(4):891−901. doi: 10.11869/j.issn.100-8551.2021.04.0891 LU X, JIA C, GAO J H, et al. Separation, purification, structure-activity relationship of antioxidant peptides derived from in vitro gastrointestinal digestion of sesame protein[J]. Journal of Nuclear Agricultural Sciences, 2021, 35(4): 891-901. doi: 10.11869/j.issn.100-8551.2021.04.0891
[23] 李亚会, 李积华, 吉宏武, 等. 远东拟沙丁鱼抗氧化肽的分离纯化及结构解析[J]. 中国食品学报,2021,21(2):229−238. [LI Y H, LI J H, JI H W, et al. Isolation, purification and structural analysis of antioxidant peptides from Sardinops sagax[J]. Chinese Journal of Food Science,2021,21(2):229−238. LI Y H, LI J H, JI H W, et al. Isolation, purification and structural analysis of antioxidant peptides from Sardinops sagax[J]. Chinese Journal of Food Science, 2021, 21(2): 229-238.
[24] 徐兆刚, 董周永, 徐敏, 等. 响应面优化酶法制备河蚌蛋白抗氧化肽[J]. 中国食品学报,2017,17(3):120−126. [XU Z G, DONG Z Y, XU M, et al. Enzymatic preparation of antioxidant peptides from freshwater mussel’s protein by response surface methodology[J]. Chinese Journal of Food Science,2017,17(3):120−126. XU Z G, DONG Z Y , XU M, et al. Enzymatic preparation of antioxidant peptides from freshwater mussel’s protein by response surface methodology[J]. Chinese Journal of Food Science, 2017, 17(3): 120-126.
[25] LIU Q, KONG B H, XIONG Y L, et al. Antioxidant activity and functional properties of porcine plasma protein hydrolysate as influenced by the degree of hydrolysis[J]. Food Chemistry,2010,118(2):403−410. doi: 10.1016/j.foodchem.2009.05.013
[26] SEO H W, JUNG E Y, GO G, et al. Optimization of hydrolysis conditions for bovine plasma protein using response surface methodology[J]. Food Chemistry,2015,185:106−111. doi: 10.1016/j.foodchem.2015.03.133
[27] 罗晓慧. 珠蚌抗氧化肽的加工工艺研究[D]. 南昌: 南昌大学, 2012. LUO X H. Study on the processing technology of antioxidant peptide from mussel[D]. Nanchang: Nanchang Unniversity, 2012.
[28] 焦雯姝, 关嘉琦, 史佳鹭, 等. 响应面法优化乳酸乳球菌KLDS4.0325产叶酸的培养基成分及发酵条件[J]. 食品科学,2020,41(6):123−130. [JIAO W S, GUAN J Q, SHI J L, et al. Optimization of eedium composition and fermentation conditions for folate production by Lactococcus lactis KLDS4.0325 by response surface methodology[J]. Food Science,2020,41(6):123−130. doi: 10.7506/spkx1002-6630-20190318-210 JIAO W S, GUAN J Q, SHI J L, et al. Optimization of eedium composition and fermentation conditions for folate production by lactococcus lactis KLDS4.0325 by response surface methodology[J]. Food Science, 2020, 41(6): 123-130. doi: 10.7506/spkx1002-6630-20190318-210
[29] WANG Q K, LI W, HE Y H, et al. Novel antioxidative peptides from the protein hydrolysate of oysters (Crassostrea talienwhanensis)[J]. Food Chemistry,2014,145:991−996. doi: 10.1016/j.foodchem.2013.08.099
[30] CHALAMAIAH M, YU W L, WU J P. Immunomodulatory and anticancer protein hydrolysates (peptides) from food proteins: A review[J]. Food Chemistry,2018,245:205−222. doi: 10.1016/j.foodchem.2017.10.087
[31] CHEN H M, MURAMOTO K, YAMAUCHI F, et al. Antioxidant activity of designed peptides based on the antioxidative peptide isolated from digests of a soybean protein[J]. Journal of Agricultural and Food Chemistry,1996,44(9):2619−2623. doi: 10.1021/jf950833m
[32] 冯美琴, 孙健, 余頔. 发酵剂对发酵香肠蛋白质降解及多肽抗氧化能力的影响[J]. 食品科学,2020,41(20):97−104. [FENG M Q, YU D, SUN J. Effect of starter cultures on protein degradation and antioxidant capacity of peptides from fermented sausages[J]. Food Science,2020,41(20):97−104. doi: 10.7506/spkx1002-6630-20200521-251 FENG M Q, YU D, SUN J. Effect of starter cultures on protein degradation and antioxidant capacity of peptides from fermented sausages[J]. Food Science, 2020, 41(20): 97-104. doi: 10.7506/spkx1002-6630-20200521-251
[33] LEE S-J, CHEONG S H, KIM Y-S, et al. Antioxidant activity of a novel synthetic hexa-peptide derived from an enzymatic hydrolysate of duck skin by-products[J]. Food and Chemical Toxicology,2013,62:276−280. doi: 10.1016/j.fct.2013.08.054
[34] 徐兆刚. 河蚌抗氧化肽的制备及其特性研究[D]. 长春: 吉林大学, 2016. XU Z G. Preparation and characterization of antioxidant peptides from Mussel[D]. Changchun: Jilin University, 2016.
[35] ONUH J O, GIRGIH A T, ALUKO R E, et al. In vitro antioxidant properties of chicken skin enzymatic protein hydrolysates and membrane fractions[J]. Food Chemistry,2014,150:366−373. doi: 10.1016/j.foodchem.2013.10.107
[36] BLACKSHEAR P J. Systems for polyacrylamide gel electrophoresis methods in enzymology[J]. Academic Press,1984:237−255.
[37] SAMARANAYAKA A G P, LI-CHAN E C Y. Food-derived peptidic antioxidants: A review of their production, assessment, and potential applications[J]. Journal of Functional Foods,2011,3(4):229−254. doi: 10.1016/j.jff.2011.05.006
[38] 黄明, 王璐莎. 动物蛋白源抗氧化肽的研究进展[J]. 中国农业科学,2013,46(22):4763−4773. [HUANG M, WANG L S. A review of the antioxidant peptides derived from animal protein[J]. Scientia Agricultura Sinica,2013,46(22):4763−4773. doi: 10.3864/j.issn.0578-1752.2013.22.014 HUANG M, WANG L S. A review of the antioxidant peptides derived from animal protein[J]. Scientia Agricultura Sinica, 2013, 46(22): 4763–4773. doi: 10.3864/j.issn.0578-1752.2013.22.014
[39] SARBON N M, BADII F, HOWELL N K. Purification and characterization of antioxidative peptides derived from chicken skin gelatin hydrolysate[J]. Food Hydrocolloids,2018,85:311−320. doi: 10.1016/j.foodhyd.2018.06.048
[40] CAO C C, FENG M Q, SUN J, et al. Screening of lactic acid bacteria with high protease activity from fermented sausages and antioxidant activity assessment of its fermented sausages[J]. CyTA - Journal of Food,2019,17(1):347−354. doi: 10.1080/19476337.2019.1583687
[41] ZAREI M, EBRAHIMPOUR A, ABDUL-HAMID A, et al. Identification and characterization of papain-generated antioxidant peptides from palm kernel cake proteins[J]. Food Research International,2014,62:726−734. doi: 10.1016/j.foodres.2014.04.041
[42] AGRAWAL H, JOSHI R, GUPTA M. Isolation, purification and characterization of antioxidative peptide of pearl millet (Pennisetum glaucum) protein hydrolysate[J]. Food Chemistry, 2016, 204: 365–372.
[43] MEJRI L, VÁSQUEZ-VILLANUEVA R, HASSOUNA M, et al. Identification of peptides with antioxidant and antihypertensive capacities by RP-HPLC-Q-TOF-MS in dry fermented camel sausages inoculated with different starter cultures and ripening times[J]. Food Research International,2017,100:708−716. doi: 10.1016/j.foodres.2017.07.072
[44] FERNÁNDEZ M, MARTÍN A, BENITO M J, et al. Influence of starter cultures on the generation of antioxidant nitrogen compounds in Iberian dry-fermented sausages[J]. International Journal of Food Science & Technology,2016,51(2):435−443.
[45] LIU R, XING L J, FU Q Q, et al. A review of antioxidant peptides derived from meat muscle and by-products[J]. Antioxidants,2016,5(3):32. doi: 10.3390/antiox5030032
[46] HAMID T, AHMAD A, JAMSHIDKHAN C. An antioxidant peptide derived from Ostrich (Struthio camelus) egg white protein hydrolysates[J]. Food Research International,2012,49(1):105−111. doi: 10.1016/j.foodres.2012.08.022
[47] ZHENG L, ZHAO M M, XIAO C Q, et al. Practical problems when using ABTS assay to assess the radical-scavenging activity of peptides: Importance of controlling reaction pH and time[J]. Food Chemistry,2016,192:288−294. doi: 10.1016/j.foodchem.2015.07.015





 下载:
下载:





 下载:
下载:
