In vitro Digestion and Fermentation Characteristics of Polysaccharides from Camellia nitidissima Chi
-
摘要: 采用水提醇沉法提取金花茶多糖,并通过DEAE-52纤维素柱层析对其分级纯化;通过模拟人体胃肠道消化模型对金花茶多糖进行体外消化,并检测消化过程中多糖分子量及消化产物中还原糖含量和游离单糖,探索金花茶多糖的消化特性;通过建立人体粪便酵解模型对金花茶多糖进行体外酵解,并测定酵解过程中酵解产物的pH、总糖和还原糖含量、SCFAs含量及乳酸杆菌、双歧杆菌、大肠杆菌的菌落总数,探索金花茶多糖的酵解特性。结果表明:金花茶多糖经DEAE-52纤维素柱层析纯化后,得到多糖级分TPS1、TPS2和TPS3。体外消化过程中,模拟唾液、模拟肠液没有改变TPS1、TPS2和TPS3的分子量,消化产物中还原糖含量也未见显著变化;而模拟胃液致使TPS1、TPS2和TPS3的分子质量略微降低,且还原糖含量由0.129±0.016、0.155±0.026、0.147±0.017 mmol/L增加为0.223±0.018、0.319±0.013、0.294±0.030 mmol/L;体外消化结束后未检测到游离单糖产生。体外酵解过程中,添加了TPS1、TPS2和TPS3的酵解液组的pH相较空白对照组均明显降低,总糖消耗率分别为91.4%、89.0%、94.5%,且还原糖含量在0~18 h期间升高,18~8 h期间降低;乙酸、丙酸、丁酸的浓度相较对照组都得到明显提升,增加倍数TPS3组>TPS2组>TPS1组;另外,TPS1、TPS2和TPS3均能够促进乳酸杆菌、双歧杆菌的增殖,并抑制大肠杆菌的生长,且益生效果TPS3>TPS2>TPS1。综上,金花茶多糖在体外消化模型中不易被消化,并能够被人体肠道菌群分解利用,产生大量乙酸、丙酸、丁酸等,具有潜在的益生作用,且TPS3较TPS2、TPS1具有更好的益生效果。Abstract: Polysaccharides were isolated from Camellia nitidissima Chi by water extraction and alcohol precipitation, then the polysaccharide extract was separated and purified by using DEAE-52 cellulose chromatography column. The digestion characteristics of the polysaccharides were studied in vitro by employing a simulated upper gastrointestinal model and analyzing molecular weight, reducing sugar and free monosaccharide ontents of digested products at different digestion times. The fermentation characteristics of polysaccharides were studied in vitro by using human fecal fermentation model and analyzing pH, total sugar, reducing sugar and short chain fatty acid content, as well as the Lactobacillus, Bifidobacterium and Escherichia coli number. The results showed that, TPS1, TPS2, and TPS3 were obtained after purification of the polysaccharide from Camellia nitidissima Chi. During in vitro digestion, the molecular weight of TPS1, TPS2, TPS3 and the reducing sugar content did not changed by simulated saliva and simulated intestinal juice. Simulated gastric juice caused a slight decrease in the molecular weight of TPS1, TPS2, and TPS3, and the content of reducing sugar increased from 0.129±0.016, 0.155±0.026, 0.147±0.017 mmol/L to 0.223±0.018, 0.319±0.013, 0.294±0.030 mmol/L. Free monosaccharides were not detected during the digestion. During the fermentation process, the pH of the group added with TPS1, TPS2, and TPS3 was significantly lower than that of the blank control group, the sugar consumption rate was 91.4%, 89.0%, 94.5%, and the reducing sugar content increased during 0~18 h, reduced during 18~48 h. Compared with the blank control group, the levels of acetic acid, propionic acid, and butyric acid were all significantly increased and the order of increasing multiple size was TPS3>TPS2>TPS1. Further, TPS1, TPS2 and TPS3 could promote the growth of Lactobacillus and Bifidobacterium, inhibit the growth of Escherichia coli, and the order of probiotic effects was TPS3>TPS2>TPS1. In summary, the polysaccharides were isolated from Camellia nitidissima Chi were not digested in vitro, and could be used by fecal microflora to produce a large amount of acetic acid, propionic acid and butyric acid, which had potential probiotic effects. And TPS3 had better probiotic effects than TPS2 and TPS1.
-
多糖是一类广泛存在于多种动植物及微生物中的生物大分子,通常由10个以上的单糖通过糖苷键链接而成[1]。多糖作为具有天然活性的高分子聚合物,如何被人体消化及利用以发挥其功能活性逐渐成为近年来多糖领域的研究热点。由于内窥镜[2]、磁共振成像[2]、动物模型[3]等体内研究价格昂贵且探索范围有限,体外消化模型和粪便酵解方法的建立能够更简便、更可控、更直观地展现食物消化及吸收过程。研究表明,非淀粉类多糖并不会被唾液降解,部分植物多糖会在胃液、肠液中部分降解[4-7]。因此,这类多糖能够较为完整地通过消化系统到达大肠,且肠道微生物能够较完全地利用多糖,从而促进益生菌增殖、抑制致病菌生长,并产生对人体有益的短链脂肪酸(Short-chain fatty acids, SCFAs)[8]。SCFAs对人体具有诸多功能作用,不仅能被肠道上皮细胞提供能量,维持电解质平衡[9],还具有抗炎[10]、预防肥胖[11]、预防糖尿病[12]、预防非酒精性脂肪肝[13]、预防结肠癌[14]等重要作用。
金花茶(Camellia nitidissima Chi)属山茶科山茶属,是我国特有属种的植物,主要分布于广西壮族自治区防城港市[15]。研究表明,金花茶多糖具有护肝[16]、降血脂[17]、抗氧化活性[18]等功能活性。目前,尚未有对金花茶多糖体外消化及酵解特性的研究报道。多糖结构的完整性是多糖在大肠中发挥功能活性的基础,而肠道微生物对多糖的分解是人体利用多糖的重要途径。因此,研究金花茶多糖的消化及酵解对金花茶功能作用的发挥尤为重要。本文建立了体外消化模型及人体粪便酵解方法,探讨分级纯化后的金花茶多糖体外消化及酵解特性,旨在为金花茶多糖益生元产品的开发提供理论依据。
1. 材料与方法
1.1 材料与仪器
金花茶叶干制品 广西桂人堂金花茶产业集团股份有限公司提供;无水乙醇 成都市科隆化学品有限公司;唾液淀粉酶(1000 U/mg)、胃蛋白酶(500 U/mg)、胰蛋白酶(200 U/mg) 西格玛奥德里奇有限公司;乙酸、丙酸、丁酸标准品 色谱纯,西格玛奥德里奇有限公司;单糖标准品(甘露糖、核糖、鼠李糖、葡萄糖糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖) 色谱纯,西格玛奥德里奇有限公司;葡聚糖标准品(MW1000、MW5000、MW12000、MW25000、MW80000、MW150000、MW270000、MW410000、MW670000) 色谱纯,西格玛奥德里奇有限公司;3,5-二硝基水杨酸、胆盐、偏磷酸 上海源叶生物科技有限公司;MRS琼脂培养基、BBL琼脂培养基、伊红美蓝琼脂培养基 索莱宝科技有限公司;厌氧袋、厌氧产气袋、厌氧指示剂 日本三菱气体化学株式会社;新鲜粪便 源自6名身体健康、年龄在20~25之间、没有消化疾病、三个月内没有服用过抗生素的志愿者(3名女性、3名男性);所有分离用有机溶剂 均为国产分析纯。
HC-3108R型高速冷冻离心机 安徽中科中佳科学仪器有限公司;TLE204E型电子天平 梅特勒-托利多仪器上海有限公司;ST3100型pH计 奥豪斯仪器(常州)有限公司;光栅型多功能微孔板检测仪(酶标仪) 奥地利TECAN公司;HPP-9272型恒温培养箱 北京东联哈尔仪器制造有限公司;Agilent 7980B型气象色谱仪 安捷伦科技有限公司。
1.2 实验方法
1.2.1 金花茶多糖提取工艺
将金花茶干叶制品剪切碾碎,热水浸提后(料液比1:55,时间2.5 h,温度92 ℃),旋蒸仪浓缩(浓缩比10:1),以4倍体积无水乙醇醇沉处理。将醇沉后的样品离心(8500 r/min,15 min),取沉淀加水复溶得到金花茶粗多糖溶液,旋蒸仪悬蒸去除溶液中残留的乙醇,并采用Sevage试剂脱除游离蛋白,采用聚酰胺树脂吸附脱色。将处理后的样品溶液离心(8500 r/min,15min),取上清液透析后冷冻干燥,得到金花茶粗多糖,备用。
1.2.2 金花茶多糖的分离纯化
1.2.2.1 金花茶多糖DEAE-52纤维素柱层析
参照田晓春[19]的方法并稍作修改。将150 mg金花茶粗多糖溶于10 mL超纯水中,离心后取上清液沿壁加入2.6 cm×60 cm的DEAE-52 纤维素层析柱中,依次采用去离子水,0.1、0.2、0.3、0.4、0.5 mol/L的NaCl溶液依次进行梯度洗脱,并采用苯酚硫酸法[20]测定其吸光度,以管数为横坐标,吸光度为纵坐标绘制洗脱曲线。收集同一峰洗脱液,浓缩后透析并冻干,获得纯化后的金花茶多糖级分,并计算回收率。回收率计算公式如下:
C(%)=mM×100 式中:C表示回收率,%;m表示回收样品质量,g;M表示上样量,g。
1.2.2.2 金花茶多糖的理化指标分析
参照郑朋朋等[20]的方法,采用苯酚硫酸法测定总糖含量;参照王佳等[21]的方法,采用硫酸咔唑法测定糖醛酸含量;参照王艾平[22]的方法,采用考马斯亮蓝法测定蛋白质含量;参照夏甜天等[23]的方法,采用福林酚法测定多酚含量;参照李环等[24]的方法,采用DNS法测定还原糖含量。
1.2.2.3 金花茶多糖的分子量测定和单糖测定
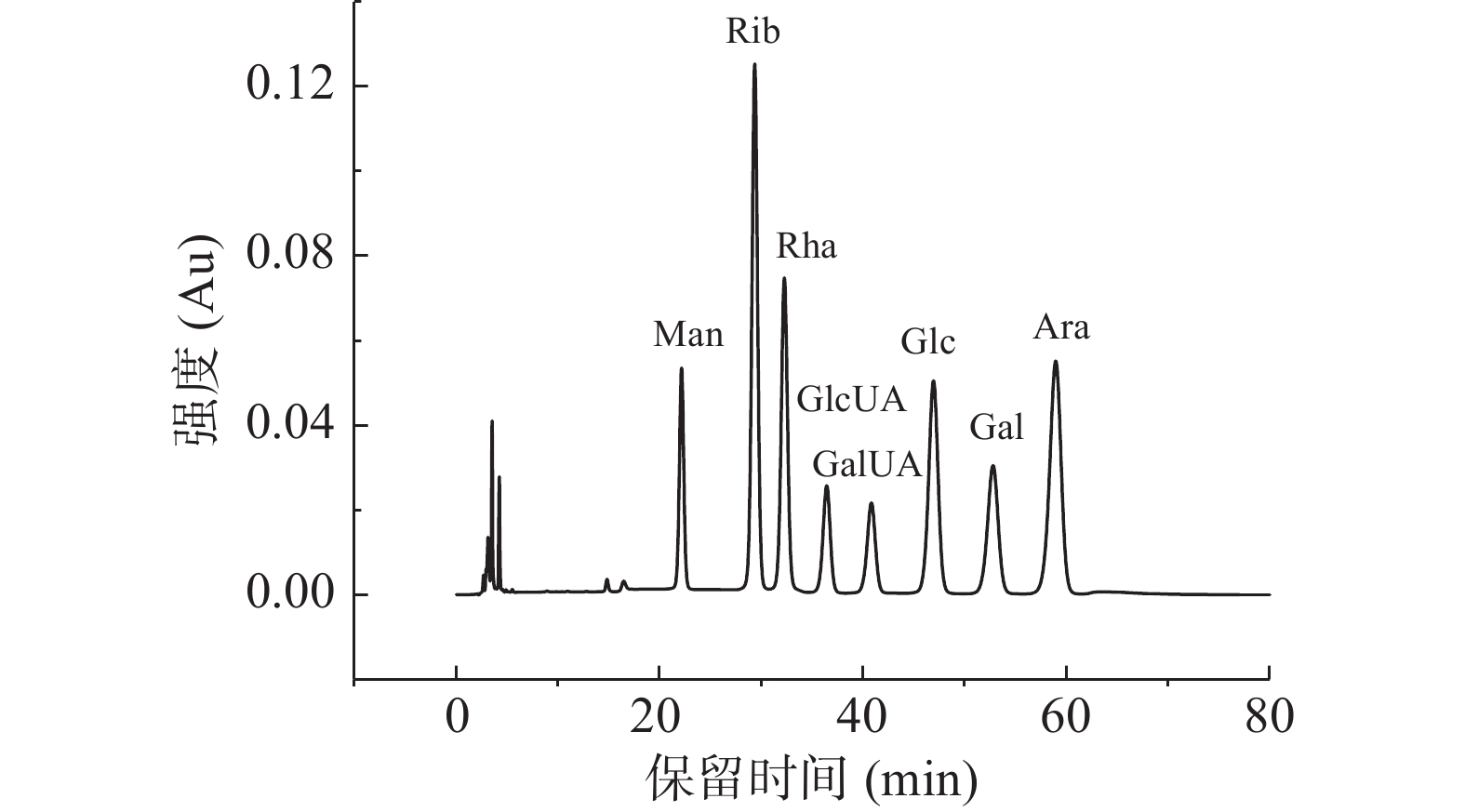
参照贾金霞等[25]的方法,采用高效凝胶色谱法测定金花茶多糖的分子量。色谱条件如下:色谱柱为TSKgel G400PWXL,检测器为RID-10A示差检测器,柱温为常温,流动相为超纯水,流速为0.5 mL/min。参照王贵春等[26]的方法,采用PMP柱前衍生高效液相色谱法检测单糖组成。色谱条件如下:色谱柱为VenusilMP-C18,采用Agilent 1200色谱系统,测定波长为250 nm,柱温为30 ℃,流量为1 mL/min,流动相为0.05 mol/L磷酸盐缓冲剂乙腈(83:17,v/v),样本数量为15 μL,持续时间为80 min。
1.2.3 金花茶多糖的体外消化
体外消化模型与模拟消化液的配制参照文献[27]方法建立。取冷冻干燥后的金花茶多糖样品配置成1 mg/mL的溶液50 mL备用。
1.2.3.1 模拟口腔消化
取5 mL多糖溶液与模拟唾液按比例1:1在试管中混合(wt/wt),将试管与厌氧产气袋、厌氧指示剂一并放入厌氧袋中,密封并用封口夹封口。无氧条件下厌氧指示剂呈粉红色。避光培养5 min(37 ℃, pH7.0),取样品检测多糖分子量、还原糖含量及游离单糖。
1.2.3.2 模拟胃消化
将模拟唾液消化后的消化产物与模拟胃液按比例1:1混合(wt/wt),按1.2.3.1相同条件,避光培养2 h(37 ℃,pH3.0)。取样品检测多糖分子量、还原糖含量及游离单糖。
1.2.3.3 模拟小肠消化
将模拟胃液消化后的消化产物与模拟肠液按比例1:1混合(wt/wt),按1.2.3.1相同条件,避光培养2 h(37 ℃,pH7.0),取样品检测多糖分子量、还原糖含量及游离单糖。
1.2.4 金花茶多糖的体外发酵
1.2.4.1 肠菌液制备
将收集的粪便混合均质,添加10倍体积磷酸缓冲液(1 mmol/L,pH7.0)充分混合,过滤并收集滤液,备用。
1.2.4.2 配制发酵培养基
基础发酵液配制参照Ramnani等[28]的方法,调配完成的培养基超声溶解后,装入锥形瓶中高压蒸汽灭菌(121 ℃,20 min)后保存备用。
1.2.4.3 体外发酵
参照Olano等[29]的方法并稍作修改。取0.5 mL肠菌液加入到10 mL基础培养基,添加15 mg/mL的金花茶多糖溶液1 mL,混匀后与厌氧产气袋、厌氧指示剂一同放入厌氧袋中,厌氧指示剂呈密封并用封口夹封口,无氧条件下厌氧指示剂呈粉红色。 37 ℃培养,并作不添加多糖的空白对照组,发酵0、6、12、18、24、36、48 h后,依次取出厌氧培养皿,加入20 g/L CuSO4 75 μL终止发酵,−80 ℃低温保存,并测定体外发酵过程中的pH、总糖含量及糖消耗率、还原糖含量、SCFAs含量以及乳酸杆菌、双歧杆菌和大肠杆菌的菌落总数变化。
1.2.5 体外发酵实验中指标的测定
1.2.5.1 pH测定
将酵解不同时间的酵解液混匀,在冰水浴中测定pH。
1.2.5.2 总糖含量及糖消耗率测定
方法同章节1.2.2.2。糖消耗率计算公式如下:
w(%)=C1−C2C1×100 式中:w表示糖消耗率,%;C1表示初始总糖浓度,mg/mL;C2表示某时刻总糖浓度,mg/mL。
1.2.5.3 SCFAs含量测定
参考耿梅梅等[30]的方法,并稍作修改。取2 mL酵解产物12000 r/min离心15 min,加入0.25 mL的25%偏磷酸溶液,过0.22 μm有机相滤膜后,使用气相色谱仪检测SCFAs含量。条件如下:色谱柱为DB-FFAP,进样量1 μL,分流比20:1,进样口温度250 ℃,FID检测器温度280 ℃,程序升温起始温度60 ℃,升温速度以20 ℃·min−1速率升温至220 ℃且保持 6 min,载气为高纯氮气(99.999%),流速0.8 mL/min。
1.2.5.4 乳酸杆菌、双歧杆菌和大肠杆菌的菌落计数
配制MRS琼脂培养基、BBL琼脂培养基、伊红美蓝琼脂培养基分别用于培养乳酸杆菌、双歧杆菌和大肠杆菌。将酵解产物稀释一定倍数,取50 μL置于培养基中,用涂布棒使其均匀分布,在37 ℃厌氧条件下培养24 h后使用平板计数法统计菌落数量。
1.3 数据处理
各试验均重复3次,实验结果以
ˉx ±s表示,采用SPSS 19.0软件试验数据进行差异性显著分析,P<0.05,差异显著,并用Origin 10.0软件绘图。2. 结果与分析
2.1 金花茶多糖的分离纯化
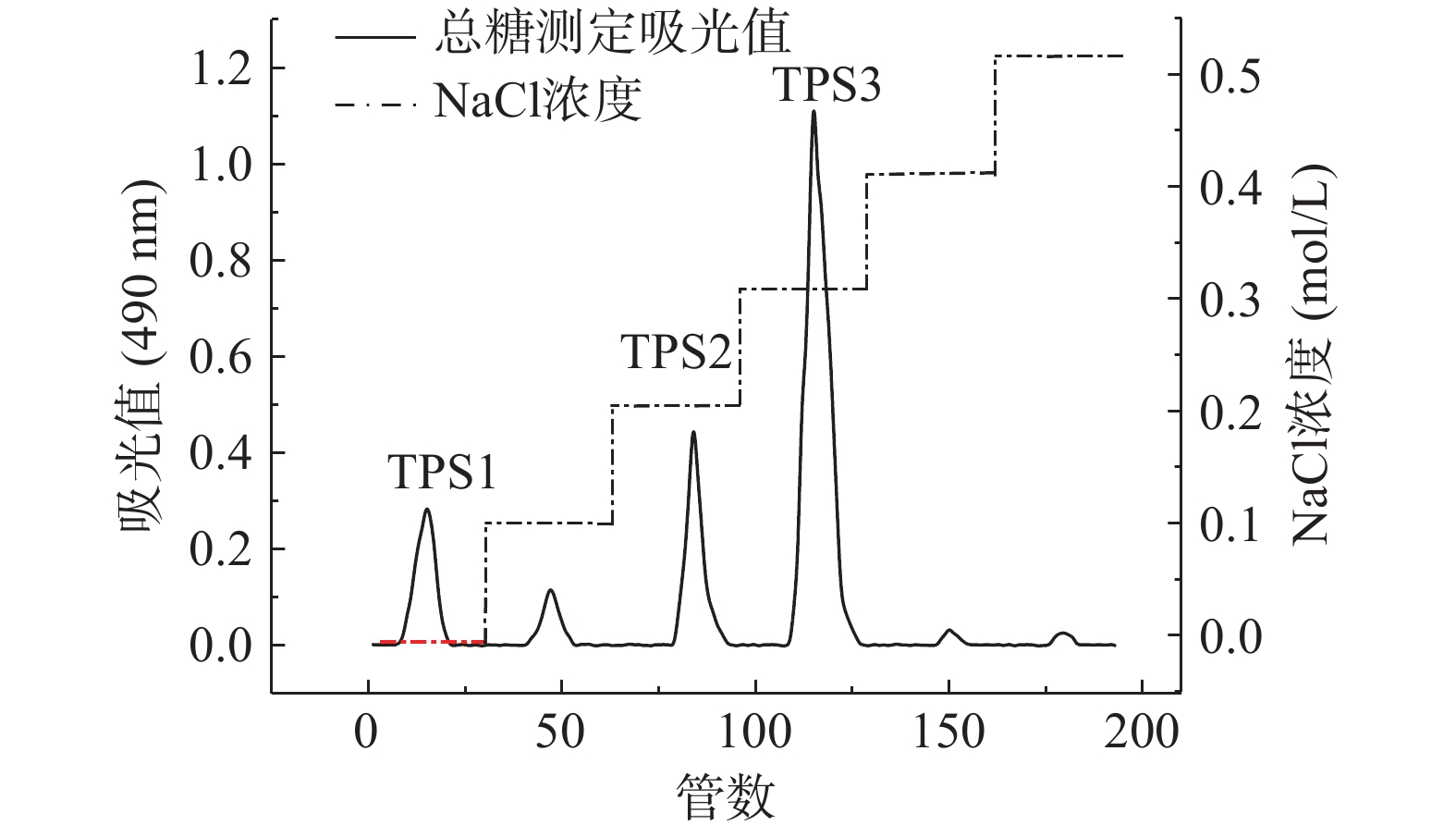
通过DEAE-52纤维素柱层析分离金花茶多糖,得到洗脱曲线图1,可知去离子水洗脱的TPS1、0.2 mol/L NaCl溶液洗脱的TPS2、0.3 mol/L NaCl溶液洗脱的TPS3比例较高。由表1可知,TPS1、TPS2和TPS3的回收率分别为5.85%、29.03%、34.67%。经纯化后,三种多糖级分蛋白质、多酚、还原糖含量都较低。TPS3糖醛酸含量最高,TPS2次之;TPS1中性糖含量较高,糖醛酸含量最低。这可能是因为洗脱溶液NaCl浓度越高,得到的金花茶多糖含有更多的硫酸基、羧基等,糖醛酸含量也更高[31-32]。由表2可知,TPS1主要由甘露糖、葡萄糖、半乳糖组成,是具有两种多糖混合的杂多糖,分子量分别为15.57×104、1.04×104 Da;TPS2、TPS3主要由鼠李糖、半乳糖醛酸、半乳糖、阿拉伯糖组成,分子量分别为42.29×104、66.68×104 Da。由于TPS1是杂多糖且难以另外分离纯化,后续关于TPS1的实验皆采用混合多糖的形式进行,除分子量外不对单独组分作相关分析。
表 1 TPS1、TPS2和TPS3的回收率及化学组成Table 1. Recovery and chemical composition of TPS1, TPS2 and TPS3组分 回收率(%) 总糖(%) 糖醛酸(%) 蛋白质(%) 多酚(%) 还原糖(%) TPS1 5.85±0.16 83.26±1.87 3.36±0.02 1.46±0.13 1.47±0.22 1.91±0.03 TPS2 29.03±0.98 72.82±1.96 24.12±0.45 0.97±0.08 0.52±0.04 1.43±0.20 TPS3 34.67±1.05 65.29±1.42 33.17±0.63 1.82±0.48 0.96±0.15 0.63±0.08 表 2 TPS1,TPS2和TPS3的分子量及单糖组成Table 2. Molecular weight and monosaccharide composition of TPS1, TPS2 and TPS3组分 分子量(Da) 构成单糖(%) 甘露糖 核糖 鼠李糖 葡萄糖醛酸 半乳糖醛酸 葡萄糖 半乳糖 阿拉伯糖 TPS1 15.57×104;
1.04×1044.45 0.26 0.42 − − 24.23 66.59 4.03 TPS2 42.29×104 0.61 − 19.07 0.91 19.18 3.57 25.21 31.30 TPS3 66.68×105 0.81 1.98 28.92 0.81 22.11 1.04 17.48 26.79 2.2 体外消化对金花茶多糖的影响
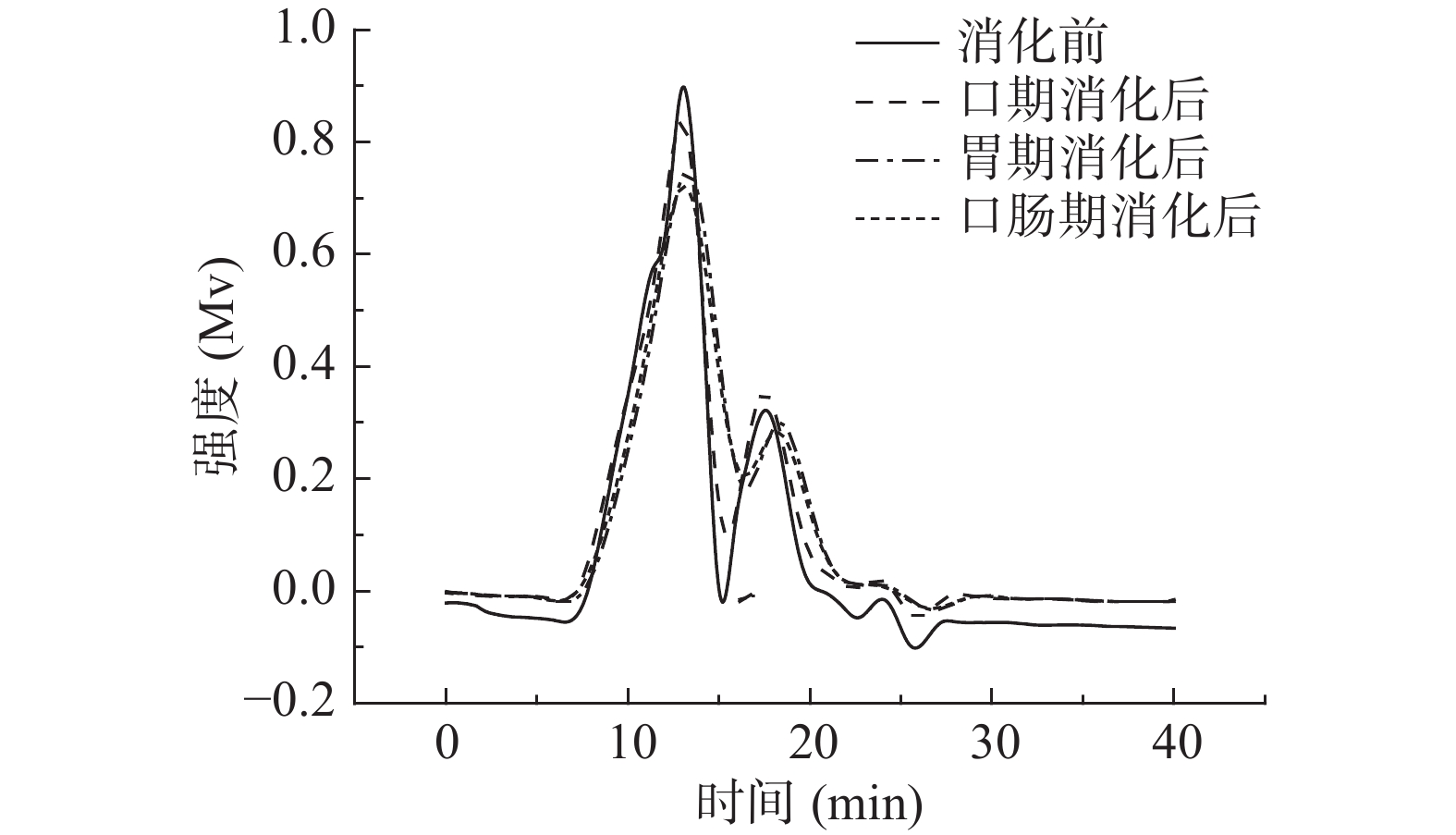
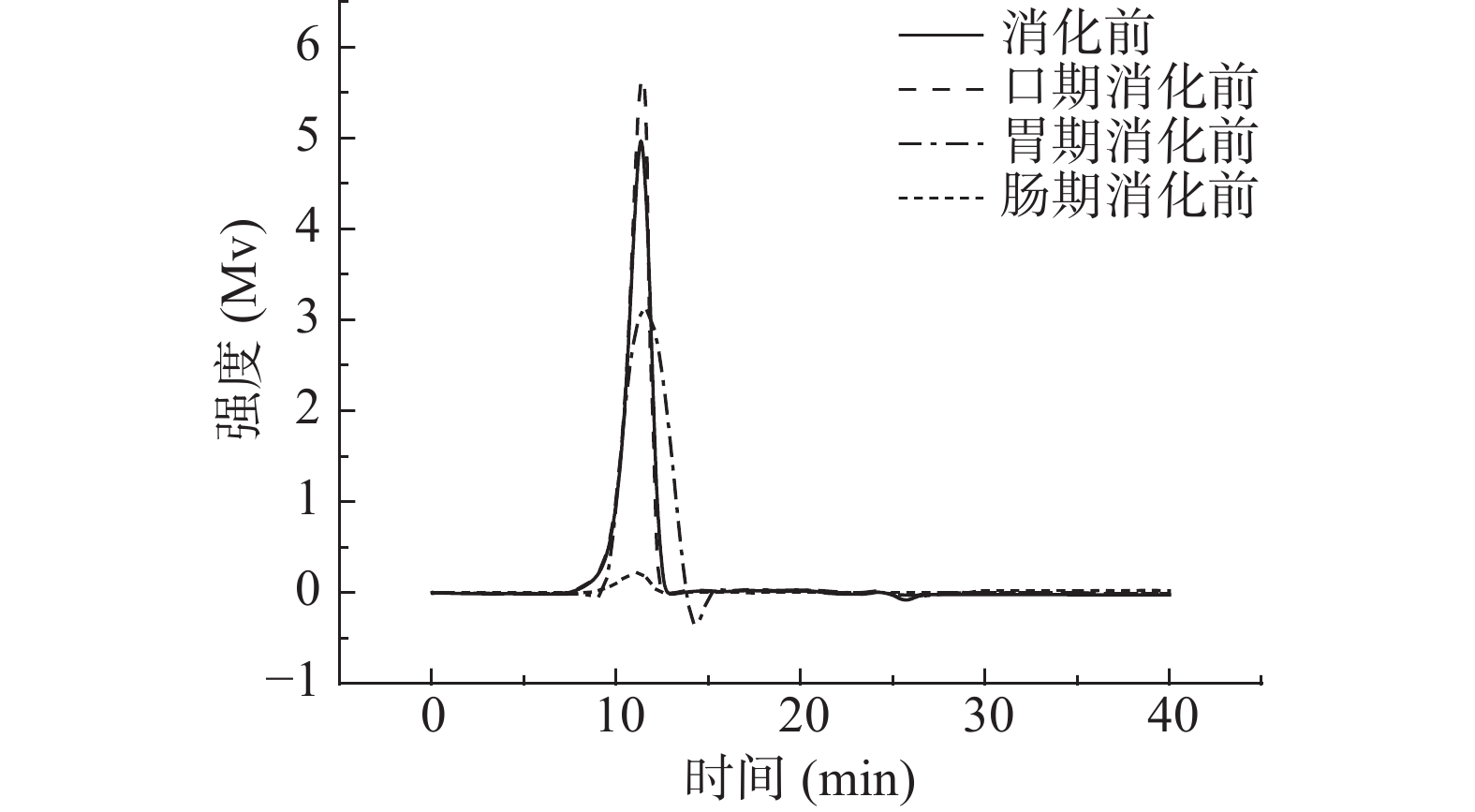
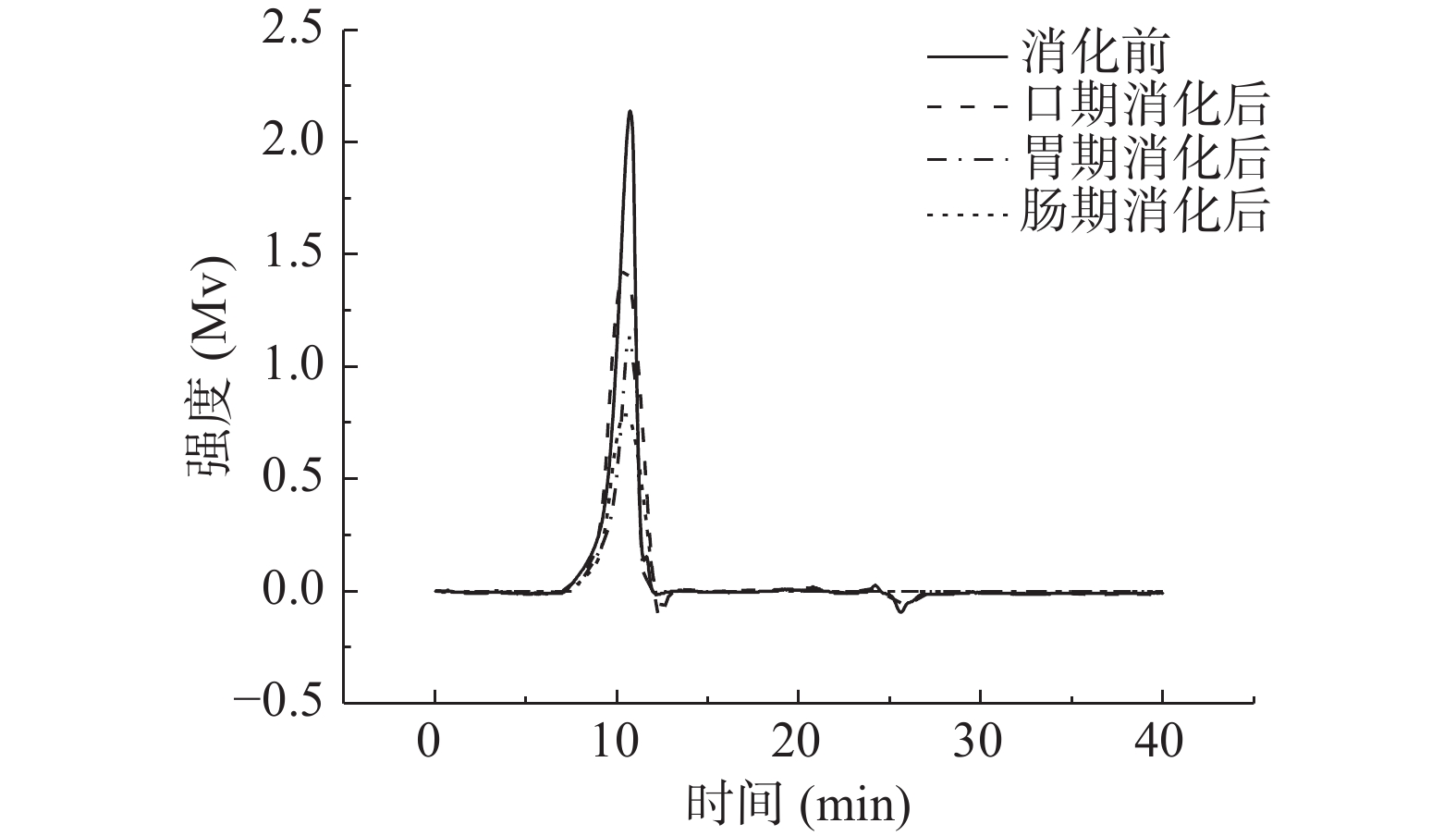
2.2.1 消化产物中金花茶多糖的分子量分析
由图2~图4可知,模拟口腔、模拟胃、模拟小肠消化前后,尽管峰形不完全相同,但出峰时间几乎没有变化。由表3可知,模拟口腔和模拟小肠消化前后,TPS1、TPS2和TPS3的相对分子质量均未产生变化;而模拟胃消化前后,混合杂多糖TPS1的两个多糖组分的分子量,以及TPS2和TPS3的分子量从15.57×104、1.04×104、42.29×104、66.68×104 Da变为15.09×104、0.92×104、41.33×104、65.26×104 Da。可知模拟胃液对金花茶多糖具有一定降解作用,但降解程度不高。研究表明,较低的pH可能会造成多糖的降解和断裂[33],这可能是模拟胃液致使多糖分子量降低的原因之一。
表 3 TPS1、TPS2和TPS3消化前后的分子量变化表Table 3. Molecular weight of TPS1, TPS2 and TPS3 before and after digestion样品 消化前(×104 Da) 口期消化后(×104 Da) 胃期消化后(×104 Da) 肠期消化后(×104 Da) TPS1 15.55±0.03b 15.57±0.07b 15.09±0.10a 15.12±0.09a 1.05±0.05b 1.04±0.02b 0.92±0.08a 0.90±0.11a TPS2 42.12±0.11b 42.29±0.13b 41.33±0.15a 41.29±0.32a TPS3 66.73±0.16b 66.68±0.20b 65.26±0.14a 65.17±0.04a 注:同一行字母不同表示差异显著(P<0.05),相同字母表示没有差异显著(P>0.05);表4同。 2.2.2 消化产物中还原糖含量分析
如表4所示,三种金花茶多糖级分在模拟口腔和模拟小肠消化前后,消化产物中还原糖含量基本没有变化。而经模拟胃消化前后,TPS1、TPS2和TPS3消化产物中还原糖含量由0.129±0.016、0.155±0.026、0.147±0.017 mmol/L增加为0.223±0.018、0.319±0.013、0.294±0.030 mmol/L。还原糖含量的增加说明金花茶多糖的部分糖苷键断裂,更多的还原末端暴露[34]。可知模拟唾液、模拟肠液不能消化金花茶多糖,而胃液能够部分消化金花茶多糖,这与分子量测定结果一致。
表 4 TPS1、TPS2和TPS3消化前后的还原糖含量变化表Table 4. Reducing sugar content of TPS1, TPS2 and TPS3 before and after digestion样品 消化前(mmol/L) 口期消化后(mmol/L) 胃期消化后(mmol/L) 肠期消化后(mmol/L) TPS1 0.131±0.009a 0.129±0.016a 0.223±0.018b 0.238±0.020b TPS2 0.157±0.019a 0.155±0.026a 0.319±0.013b 0.328±0.008b TPS3 0.146±0.021a 0.147±0.017a 0.294±0.030b 0.299±0.014b 2.2.3 消化结束后游离单糖含量分析
图5为单糖标准品的HPLC图谱,图6为添加了TPS1、TPS2和TPS3的体外消化组以及空白对照组在消化结束后的单糖释放情况。由空白对照组的HPLC图谱可知,模拟消化液中并没有碳水化合物。而三种金花茶多糖级分的HPLC色谱图中,只有溶剂峰,且与空白对照组出峰时间一致,且皆未检测出单糖组分。这与闵芳芳等[35]关于青钱柳多糖的体外消化研究结果一致。
2.3 粪便酵解对金花茶多糖的影响
2.3.1 酵解过程中pH的变化
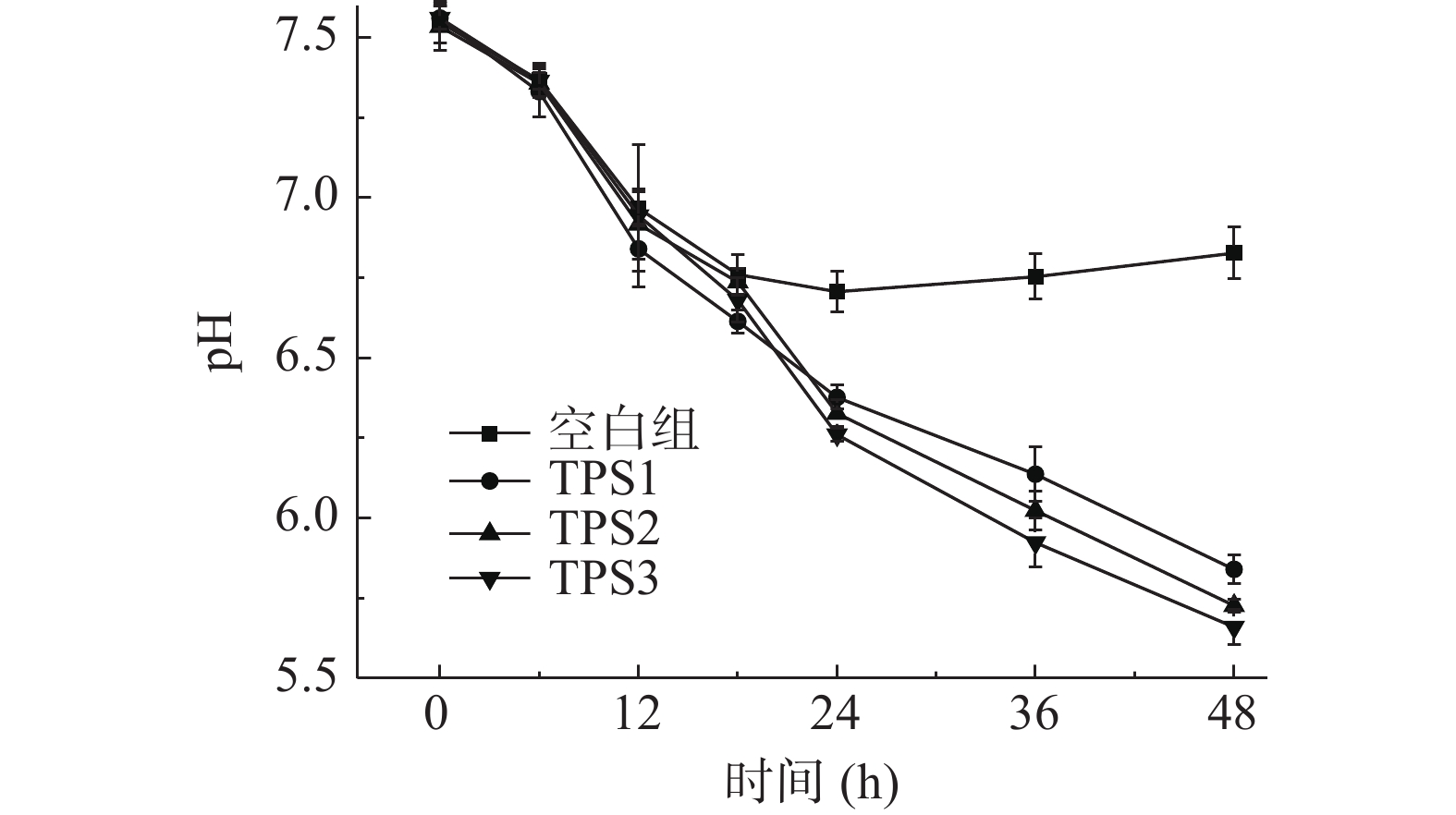
如图7所示,酵解期间(0~48 h),空白对照组的pH呈现先降低后略微升高的趋势。与空白对照组不同,添加了TPS1、TPS2和TPS3的酵解组的pH在酵解期间分别从7.54、7.56、7.50降低至5.84、5.72、5.66。TPS3酵解组的pH下降程度要略大于TPS2与TPS1。pH呈弱酸性与微生物代谢产生SCFAs有关[36]。可知肠道菌群能够利用金花茶多糖,从而代谢产生大量SCFAs,使得酵解产物呈弱酸性。而TPS3相较TPS2与TPS1,促进SCFAs产生的作用更佳。
2.3.2 酵解过程中总糖和还原糖含量的变化
如图8、图9所示,酵解期间(0~48 h),添加了TPS1、TPS2和TPS3的酵解组总糖含量分别从0.85、0.83、0.89 mg/mL降低至0.073、0.091、0.049 mg/mL,总糖消耗率分别为91.4%、89.0%、94.5%;而还原糖含量在0~18 h期间分别从0.091、0.089、0.098 mg/mL增加至0.36、0.41、0.46 mg/mL,后在18~48 h期间降低0.051、0.084、0.040 mg/mL。总糖含量降低说明肠道菌群将金花茶多糖逐步分解吸收;还原糖含量前期增高可能是由于菌群降解多糖导致糖苷键被破坏,更多还原末端被释放出来;而后期这些短链还原糖又被菌群逐步分解利用,导致还原糖含量降低[37-38]。
2.3.3 酵解过程中SCFAs含量的变化
表5为标准溶液中SCFAs的标准曲线。表6~表9分别为空白对照组及添加了TPS1、TPS2和TPS3的酵解液中SCFAs浓度变化。酵解期间(0~48 h),TPS1、TPS2和TPS3酵解液中乙酸浓度分别从2.26±0.11、2.22±0.21、2.31±0.39 mmol/L增加至18.01±0.67、24.11±0.84、29.28±1.37 mmol/L,是对照组的4.1、5.5、6.7倍;丙酸浓度分别从1.38±0.09、1.40±0.17、1.38±0.28 mmol/L增加到8.71±0.44、10.91±0.66、12.61±0.96 mmol/L,是对照组的3.7、4.7、5.4倍;丁酸浓度分别从0.69±0.04、0.71±0.10、0.71±0.09 mmol/L增加到2.63±0.20、3.70±0.88、4.83±0.86 mmol/L,是对照组的2.3、3.2、4.2倍。可知,TPS1、TPS2和TPS3均能促进肠道菌群分解并产生SCFAs,且乙酸含量增加最多;另外,TPS3相较TPS1和TPS2,能够更好地促使肠道菌群产生更多的SCFAs。
表 5 标准溶液中SCFAs的标准曲线Table 5. Calibration curves of different SCFAs in standard solutionSCFAs 标准曲线 R2 浓度范围(mmol/L) 乙酸 y=0.2128x−0.2316 0.9996 4.28~171.33 丙酸 y=0.4103x−0.3755 0.9996 3.28~131.25 丁酸 y=0.5629x−0.3175 0.9997 2.89~115.50 表 6 空白对照组酵解产物中SCFAs含量变化Table 6. Changes of SCFAs content in fermentation products in blank control group时间(h) 乙酸(mmol/L) 丙酸(mmol/L) 丁酸(mmol/L) 0 2.17±0.02a 1.33±0.04a 0.65±0.01a 6 3.72±0.03b 1.47±0.05a 0.74±0.01a 12 5.32±0.11c 2.08±0.08b 1.27±0.03b 18 6.73±0.09d 2.60±0.01c 1.47±0.05c 24 7.20±0.12e 2.79±0.02d 1.59±0.09c 36 5.32±0.18f 2.57±0.11d 1.38±0.12e 48 4.38±0.08g 2.33±0.07f 1.15±0.13f 注:同一列字母不同表示差异显著(P<0.05),相同字母表示没有差异显著(P>0.05);表6~表13同。 表 7 TPS1组酵解产物中SCFAs含量变化Table 7. Changes of SCFAs content in fermentation products in TPS1 group时间(h) 乙酸(mmol/L) 丙酸(mmol/L) 丁酸(mmol/L) 0 2.26±0.11a 1.38±0.09a 0.69±0.04a 6 3.81±0.09b 1.79±0.23b 0.72±0.06a 12 5.32±0.22c 2.45±0.14c 1.76±0.02a 18 9.08±0.34d 3.60±0.27d 1.88±0.11a 24 12.84±0.19e 5.06±0.25e 2.15±0.09b 36 15.66±0.43f 7.01±0.32f 2.43±0.18c 48 18.01±0.67g 8.71±0.44g 2.63±0.20d 表 8 TPS2组酵解产物中SCFAs含量变化Table 8. Changes of SCFAs content in fermentation products in TPS2 group时间(h) 乙酸(mmol/L) 丙酸(mmol/L) 丁酸(mmol/L) 0 2.22±0.21a 1.40±0.17a 0.71±0.10a 6 4.19±0.22b 2.21±0.09b 0.88±0.11a 12 5.79±0.38c 3.08±0.28c 1.90±0.25b 18 10.49±0.19d 4.57±0.47d 2.47±0.38c 24 14.25±0.56e 6.28±0.77e 2.88±0.26d 36 19.42±0.78f 8.71±0.38f 3.27±0.70e 48 24.11±0.84g 10.91±0.66g 3.70±0.88f 表 9 TPS3组酵解产物中SCFAs含量变化Table 9. Changes of SCFAs content in fermentation products in TPS3 group时间(h) 乙酸(mmol/L) 丙酸(mmol/L) 丁酸(mmol/L) 0 2.31±0.39a 1.38±0.28a 0.71±0.09a 6 4.42±0.44b 2.55±0.35b 0.90±0.21b 12 6.73±0.28c 4.08±0.56c 1.98±0.11c 18 13.78±0.77d 6.03±0.27d 2.57±0.17d 24 19.42±0.76e 8.71±0.88e 3.45±0.38e 36 25.05±1.09f 10.66±1.11f 4.26±0.37f 48 29.28±1.37g 12.61±0.96g 4.83±0.86g 2.3.4 酵解过程中乳酸杆菌、双歧杆菌、大肠杆菌的数量变化
表10~表13分别为空白对照组及添加了TPS1、TPS2和TPS3的酵解液中乳酸菌、双歧杆菌、大肠杆菌的菌落总数变化。酵解期间(0~48 h),TPS1、TPS2和TPS3组的乳酸菌数量分别增加了550、1513、2884倍;双歧杆菌数量分别增加了372、1348、1905倍;大肠杆菌数量分别减少为原来的72%、54%、32%。可知TPS1、TPS2和TPS3均可促使乳酸菌和双歧杆菌增殖,并抑制大肠杆菌生长。研究表明,多糖中的半乳糖醛酸能够促进乳酸菌、双歧杆菌等肠道有益菌群的繁殖,从而产生更多的SCFAs,尤其是乙酸[39];而SCFAs浓度的增加降低了肠道环境的pH,较低的pH能够在一定程度上抑制大肠杆菌等致病菌的生长[40]。这可能是TPS3相较TPS2、TPS1,具有更好益生作用的原因之一。
表 10 空白组酵解不同时间酵解液中三种肠道菌菌落总数变化Table 10. Changes in the total number of three intestinal bacteria colonies in the yeast solution at different time of blank control group时间(h) 菌落总数(lg CFU/mL) 乳酸菌 双歧杆菌 大肠杆菌 0 8.34±0.04a 11.66±0.01a 5.31±0.04a 6 8.37±0.01a 11.72±0.02b 6.05±0.02b 12 8.49±0.02b 11.83±0.03c 6.52±0.01c 18 8.65±0.02c 11.94±0.02d 5.87±0.04d 24 8.82±0.03d 12.05±0.01e 5.13±0.03e 36 8.66±0.01e 11.85±0.02f 6.07±0.01f 48 8.26±0.04f 11.44±0.04g 6.87±0.02g 表 11 TPS1组酵解不同时间酵解液中三种肠道菌菌落总数变化Table 11. Changes in the total number of three intestinal bacteria colonies in the yeast solution at different time of TPS1 group时间(h) 菌落总数(lg CFU/mL) 乳酸菌 双歧杆菌 大肠杆菌 0 8.33±0.01a 11.72±0.02a 5.29±0.02a 6 8.73±0.02b 11.78±0.01a 5.95±0.01b 12 9.13±0.02c 12.18±0.03b 5.74±0.01c 18 9.71±0.03d 12.64±0.04c 5.65±0.03d 24 10.05±0.04e 13.07±0.02d 5.41±0.02e 36 10.56±0.01f 13.79±0.02e 5.29±0.02f 48 11.07±0.01g 14.29±0.01f 5.15±0.01g 表 12 TPS2组酵解不同时间酵解液中三种肠道菌菌落总数变化Table 12. Changes in the total number of three intestinal bacteria colonies in the yeast solution at different time of TPS2 group时间(h) 菌落总数(lg CFU/mL) 乳酸菌 双歧杆菌 大肠杆菌 0 8.27±0.02a 11.65±0.01a 5.30±0.01a 6 8.65±0.01b 11.82±0.02b 5.84±0.03b 12 9.29±0.01c 12.47±0.02c 5.69±0.01c 18 9.88±0.03d 13.17±0.02d 5.60±0.02c 24 10.52±0.01e 13.68±0.01e 5.37±0.04d 36 11.01±0.02f 14.05±0.03f 5.21±0.01e 48 11.60±0.02g 14.78±0.01g 5.03±0.02f 表 13 TPS3组酵解不同时间酵解液中三种肠道菌菌落总数变化Table 13. Changes in the total number of three intestinal bacteria colonies in the yeast solution at different time of TPS3 group时间(h) 菌落总数(lg CFU/mL) 乳酸菌 双歧杆菌 大肠杆菌 0 8.19±0.02a 11.54±0.01a 5.40±0.01a 6 8.54±0.01b 11.88±0.02b 5.71±0.03b 12 9.39±0.01c 12.45±0.02c 5.62±0.01c 18 10.17±0.03d 13.03±0.02d 5.42±0.02c 24 10.98±0.01e 13.76±0.01e 5.29±0.04d 36 11.31±0.02f 14.29±0.03f 5.12±0.01e 48 11.64±0.02g 14.82±0.01g 4.91±0.02f 3. 结论
本文通过DEAE-52纤维素柱层析纯化金花茶多糖得到多糖级分TPS1、TPS2和TPS3。TPS1由两种多糖混合的杂多糖,分子量分别为15.57×104、1.04×104 Da,主要由甘露糖、葡萄糖、半乳糖组成;TPS2、TPS3均为均一多糖,分子量分别为42.29×104、66.68×104 Da,主要由鼠李糖、半乳糖醛酸、半乳糖、阿拉伯糖组成。通过体外消化模型发现,TPS1、TPS2和TPS3在模拟口腔、模拟小肠期间,分子量未有明显改变;在模拟胃消化期间,分子量略微降低,有少量还原糖产生;整个消化过程未有游离单糖检出。通过体外酵解方法,发现TPS1、TPS2和TPS3在酵解期间(0~48 h),酵解液的pH、总糖含量均持续降低;还原糖含量在0~18 h期间升高,在18~48 h期间降低。酵解期间结束后,TPS1、TPS2和TPS3酵解液中乙酸浓度是空白对照组的4.1、5.5、6.7倍,丙酸浓度是空白对照组的3.7、4.7、5.4倍,丁酸浓度是空白对照组的2.3、3.2、4.2倍;TPS1、TPS2和TPS3组的乳酸菌数量分别增加了550、1513、2884倍;双歧杆菌的数量分别增加了372、1348、1905倍;大肠杆菌数量分别减少为原来的72%、54%、32%。综上所述,金花茶多糖在体外消化模型中不被消化,并能够被肠道微生物分解利用而产生短链脂肪酸,对乳酸菌、双歧杆菌的增殖有积极作用,对大肠杆菌的生长具有抑制作用,且TPS3相较TPS2、TPS1,具有更好的益生作用。
-
表 1 TPS1、TPS2和TPS3的回收率及化学组成
Table 1 Recovery and chemical composition of TPS1, TPS2 and TPS3
组分 回收率(%) 总糖(%) 糖醛酸(%) 蛋白质(%) 多酚(%) 还原糖(%) TPS1 5.85±0.16 83.26±1.87 3.36±0.02 1.46±0.13 1.47±0.22 1.91±0.03 TPS2 29.03±0.98 72.82±1.96 24.12±0.45 0.97±0.08 0.52±0.04 1.43±0.20 TPS3 34.67±1.05 65.29±1.42 33.17±0.63 1.82±0.48 0.96±0.15 0.63±0.08 表 2 TPS1,TPS2和TPS3的分子量及单糖组成
Table 2 Molecular weight and monosaccharide composition of TPS1, TPS2 and TPS3
组分 分子量(Da) 构成单糖(%) 甘露糖 核糖 鼠李糖 葡萄糖醛酸 半乳糖醛酸 葡萄糖 半乳糖 阿拉伯糖 TPS1 15.57×104;
1.04×1044.45 0.26 0.42 − − 24.23 66.59 4.03 TPS2 42.29×104 0.61 − 19.07 0.91 19.18 3.57 25.21 31.30 TPS3 66.68×105 0.81 1.98 28.92 0.81 22.11 1.04 17.48 26.79 表 3 TPS1、TPS2和TPS3消化前后的分子量变化表
Table 3 Molecular weight of TPS1, TPS2 and TPS3 before and after digestion
样品 消化前(×104 Da) 口期消化后(×104 Da) 胃期消化后(×104 Da) 肠期消化后(×104 Da) TPS1 15.55±0.03b 15.57±0.07b 15.09±0.10a 15.12±0.09a 1.05±0.05b 1.04±0.02b 0.92±0.08a 0.90±0.11a TPS2 42.12±0.11b 42.29±0.13b 41.33±0.15a 41.29±0.32a TPS3 66.73±0.16b 66.68±0.20b 65.26±0.14a 65.17±0.04a 注:同一行字母不同表示差异显著(P<0.05),相同字母表示没有差异显著(P>0.05);表4同。 表 4 TPS1、TPS2和TPS3消化前后的还原糖含量变化表
Table 4 Reducing sugar content of TPS1, TPS2 and TPS3 before and after digestion
样品 消化前(mmol/L) 口期消化后(mmol/L) 胃期消化后(mmol/L) 肠期消化后(mmol/L) TPS1 0.131±0.009a 0.129±0.016a 0.223±0.018b 0.238±0.020b TPS2 0.157±0.019a 0.155±0.026a 0.319±0.013b 0.328±0.008b TPS3 0.146±0.021a 0.147±0.017a 0.294±0.030b 0.299±0.014b 表 5 标准溶液中SCFAs的标准曲线
Table 5 Calibration curves of different SCFAs in standard solution
SCFAs 标准曲线 R2 浓度范围(mmol/L) 乙酸 y=0.2128x−0.2316 0.9996 4.28~171.33 丙酸 y=0.4103x−0.3755 0.9996 3.28~131.25 丁酸 y=0.5629x−0.3175 0.9997 2.89~115.50 表 6 空白对照组酵解产物中SCFAs含量变化
Table 6 Changes of SCFAs content in fermentation products in blank control group
时间(h) 乙酸(mmol/L) 丙酸(mmol/L) 丁酸(mmol/L) 0 2.17±0.02a 1.33±0.04a 0.65±0.01a 6 3.72±0.03b 1.47±0.05a 0.74±0.01a 12 5.32±0.11c 2.08±0.08b 1.27±0.03b 18 6.73±0.09d 2.60±0.01c 1.47±0.05c 24 7.20±0.12e 2.79±0.02d 1.59±0.09c 36 5.32±0.18f 2.57±0.11d 1.38±0.12e 48 4.38±0.08g 2.33±0.07f 1.15±0.13f 注:同一列字母不同表示差异显著(P<0.05),相同字母表示没有差异显著(P>0.05);表6~表13同。 表 7 TPS1组酵解产物中SCFAs含量变化
Table 7 Changes of SCFAs content in fermentation products in TPS1 group
时间(h) 乙酸(mmol/L) 丙酸(mmol/L) 丁酸(mmol/L) 0 2.26±0.11a 1.38±0.09a 0.69±0.04a 6 3.81±0.09b 1.79±0.23b 0.72±0.06a 12 5.32±0.22c 2.45±0.14c 1.76±0.02a 18 9.08±0.34d 3.60±0.27d 1.88±0.11a 24 12.84±0.19e 5.06±0.25e 2.15±0.09b 36 15.66±0.43f 7.01±0.32f 2.43±0.18c 48 18.01±0.67g 8.71±0.44g 2.63±0.20d 表 8 TPS2组酵解产物中SCFAs含量变化
Table 8 Changes of SCFAs content in fermentation products in TPS2 group
时间(h) 乙酸(mmol/L) 丙酸(mmol/L) 丁酸(mmol/L) 0 2.22±0.21a 1.40±0.17a 0.71±0.10a 6 4.19±0.22b 2.21±0.09b 0.88±0.11a 12 5.79±0.38c 3.08±0.28c 1.90±0.25b 18 10.49±0.19d 4.57±0.47d 2.47±0.38c 24 14.25±0.56e 6.28±0.77e 2.88±0.26d 36 19.42±0.78f 8.71±0.38f 3.27±0.70e 48 24.11±0.84g 10.91±0.66g 3.70±0.88f 表 9 TPS3组酵解产物中SCFAs含量变化
Table 9 Changes of SCFAs content in fermentation products in TPS3 group
时间(h) 乙酸(mmol/L) 丙酸(mmol/L) 丁酸(mmol/L) 0 2.31±0.39a 1.38±0.28a 0.71±0.09a 6 4.42±0.44b 2.55±0.35b 0.90±0.21b 12 6.73±0.28c 4.08±0.56c 1.98±0.11c 18 13.78±0.77d 6.03±0.27d 2.57±0.17d 24 19.42±0.76e 8.71±0.88e 3.45±0.38e 36 25.05±1.09f 10.66±1.11f 4.26±0.37f 48 29.28±1.37g 12.61±0.96g 4.83±0.86g 表 10 空白组酵解不同时间酵解液中三种肠道菌菌落总数变化
Table 10 Changes in the total number of three intestinal bacteria colonies in the yeast solution at different time of blank control group
时间(h) 菌落总数(lg CFU/mL) 乳酸菌 双歧杆菌 大肠杆菌 0 8.34±0.04a 11.66±0.01a 5.31±0.04a 6 8.37±0.01a 11.72±0.02b 6.05±0.02b 12 8.49±0.02b 11.83±0.03c 6.52±0.01c 18 8.65±0.02c 11.94±0.02d 5.87±0.04d 24 8.82±0.03d 12.05±0.01e 5.13±0.03e 36 8.66±0.01e 11.85±0.02f 6.07±0.01f 48 8.26±0.04f 11.44±0.04g 6.87±0.02g 表 11 TPS1组酵解不同时间酵解液中三种肠道菌菌落总数变化
Table 11 Changes in the total number of three intestinal bacteria colonies in the yeast solution at different time of TPS1 group
时间(h) 菌落总数(lg CFU/mL) 乳酸菌 双歧杆菌 大肠杆菌 0 8.33±0.01a 11.72±0.02a 5.29±0.02a 6 8.73±0.02b 11.78±0.01a 5.95±0.01b 12 9.13±0.02c 12.18±0.03b 5.74±0.01c 18 9.71±0.03d 12.64±0.04c 5.65±0.03d 24 10.05±0.04e 13.07±0.02d 5.41±0.02e 36 10.56±0.01f 13.79±0.02e 5.29±0.02f 48 11.07±0.01g 14.29±0.01f 5.15±0.01g 表 12 TPS2组酵解不同时间酵解液中三种肠道菌菌落总数变化
Table 12 Changes in the total number of three intestinal bacteria colonies in the yeast solution at different time of TPS2 group
时间(h) 菌落总数(lg CFU/mL) 乳酸菌 双歧杆菌 大肠杆菌 0 8.27±0.02a 11.65±0.01a 5.30±0.01a 6 8.65±0.01b 11.82±0.02b 5.84±0.03b 12 9.29±0.01c 12.47±0.02c 5.69±0.01c 18 9.88±0.03d 13.17±0.02d 5.60±0.02c 24 10.52±0.01e 13.68±0.01e 5.37±0.04d 36 11.01±0.02f 14.05±0.03f 5.21±0.01e 48 11.60±0.02g 14.78±0.01g 5.03±0.02f 表 13 TPS3组酵解不同时间酵解液中三种肠道菌菌落总数变化
Table 13 Changes in the total number of three intestinal bacteria colonies in the yeast solution at different time of TPS3 group
时间(h) 菌落总数(lg CFU/mL) 乳酸菌 双歧杆菌 大肠杆菌 0 8.19±0.02a 11.54±0.01a 5.40±0.01a 6 8.54±0.01b 11.88±0.02b 5.71±0.03b 12 9.39±0.01c 12.45±0.02c 5.62±0.01c 18 10.17±0.03d 13.03±0.02d 5.42±0.02c 24 10.98±0.01e 13.76±0.01e 5.29±0.04d 36 11.31±0.02f 14.29±0.03f 5.12±0.01e 48 11.64±0.02g 14.82±0.01g 4.91±0.02f -
[1] ULLAH S, KHALIL A A, SHAUKAT F, et al. Sources, extraction and biomedical properties of polysaccharides[J]. Foods,2019,8(8):304. doi: 10.3390/foods8080304
[2] KOZIOLEK M, SCHNEIDER F, GRIMM M, et al. Intragastric pH and pressure profiles after intake of the high-caloric, high-fat meal as used for food effect studies[J]. Journal of Controlled Release,2015:220.
[3] MACKIE A R, RAFIEE H, MALCOLM P, et al. Specific food structures supress appetite through reduced gastric emptying rate[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology,2013,304(11):G1038−G1043. doi: 10.1152/ajpgi.00060.2013
[4] 陈培琳, 游卿翔, 常青, 等. 植物多糖消化酵解特性的研究进展[J]. 食品工业科技,2019,40(1):299−304. [CHEN P L, YOU Q X, CHANG Q, et al. Research progress of digestive and fermentation characteristics of plant polysaccharides[J]. Science and Technology of Food Industry,2019,40(1):299−304. [5] HU J, NIE S, MIN F, et al. Artificial simulated saliva, gastric and intestinal digestion of polysaccharide from the seeds of Plantago asiatica L.[J]. Carbohydrate Polymers,2013,92(2):1143−1150. doi: 10.1016/j.carbpol.2012.10.072
[6] 张冠亚, 黄晓君, 聂少平, 等. 体外模拟3种消化液对铁皮石斛多糖的消化作用[J]. 食品科学,2014,35(23):279−283. [ZHANG G Y, HUANG X J, NIE S P, et al. Effects of three digestive juices on the in vitro digestion of Dendrobium officinale polysaccharide[J]. Food Science,2014,35(23):279−283. doi: 10.7506/spkx1002-6630-201423054 [7] WANG C, LI W, CHEN Z, et al. Effects of simulated gastrointestinal digestion in vitro on the chemical properties, antioxidant activity, α-amylase and α-glucosidase inhibitory activity of polysaccharides from Inonotus obliquus[J]. Food Research International,2018,103:280−288. doi: 10.1016/j.foodres.2017.10.058
[8] 戴博, 王广义. 短链脂肪酸对肠道健康的调控机制研究[J]. 广东化工,2020,47(24):54−63. [DAI B, WANG G Y. Regulation mechanism of short chain fatty acids on intestinal health[J]. Guangdong Chemical Industry,2020,47(24):54−63. [9] 周超. 短链脂肪酸(丁酸)通过HIF-1α调节肠上皮细胞自噬在缓解结肠炎中的机制研究[D]. 重庆: 中国人民解放军陆军军医大学, 2020. ZHOU C. SCFAs(butyric acid) regulate autophagy in intestinal epithelial cells and relieve colitis by HIF-1α[D]. Chongqing: Third Military Medical University, 2020.
[10] WENDY C, ERIKA M. Effects of short chain fatty acids on metabolic and inflammatory processes in human health[J]. BBA-Molecular and Cell Biology of Lipids,2021,1866(5):158900. doi: 10.1016/j.bbalip.2021.158900
[11] MSC P L, MD B R Y, PHD M B Y. Gut microbiota and obesity: An opportunity to alter obesity through faecal microbiota transplant(FMT)[J]. Diabetes, Obesity and Metabolism,2019,21(3):479−490. doi: 10.1111/dom.13561
[12] 梁源, 于瑞丽, 尹悦, 等. 肠道菌群及其代谢产物在糖脂代谢中的作用[J]. 生理科学进展,2019,50(5):321−325. [LIANG Y, YU R L, YIN Y, et al. Effects of gut microbiota and its metabolite in glucose and lipid metabolism[J]. Progress in Physiological Sciences,2019,50(5):321−325. doi: 10.3969/j.issn.0559-7765.2019.05.001 [13] MAHIZIR D, BRIFFA J F, WOOD J L, et al. Exercise improves metabolic function and alters the microbiome in rats with gestational diabetes[J]. The FASEB Journal,2020,34(1):1728−1744. doi: 10.1096/fj.201901424R
[14] 周张杰, 蒋海燕, 钟薏, 等. 健脾固肠方通过提高短链脂肪酸产生菌的丰度减轻肠癌小鼠化疗后肠道炎症反应的机制探讨[J]. 中国中医基础医学杂志, 2020, 26(5): 618-621. ZHOU Z J, JIANG H Y, ZHONG Y, et al. Effect of Jianpi Guchang recipe on intestinal inflammatory response after chemotherapy in intestinal carcinoma mice by enhancing abundance of short-chain fatty acid producing bacteria[J]. Journal of Basic Chinese Medicine, 2020, 25(5): 618-621.
[15] 苏宗明, 莫新礼. 我国金花茶组植物的地理分布[J]. 广西植物,1988(1):75−81. [SU Z M, MO X L. Geographical distribution of Camellia nitidissima Chi in China[J]. Guihaia,1988(1):75−81. [16] 黄思茂, 曹后康, 高雅, 等. 金花茶多糖对四氯化碳致小鼠急性肝损伤的保护作用及其机制的研究[J]. 中药药理与临床,2016,32(6):117−120. [HUANG S M, CAO H K, GAO Y, et al. Protective effect and mechanism of polysaccharides of Camellia nitidissima on acute hepatic injury induced by carbon tetrachloride in mice[J]. Pharmacology and Clinics of Chinese Materia Medica,2016,32(6):117−120. [17] 路垚. 金花茶多糖降血脂机理初探及其亲和层析分离技术的研究[D]. 湛江: 广东海洋大学, 2014. LU Y. Premilinary study on the hypolipemic mechanism andaffinity chromatography of polysaccharides from Camellia chrysantha (Hu) Tuyama[D]. Zhanjiang: Guangdong Ocean University, 2014.
[18] 牛广俊, 朱思, 陈清英, 等. 金花茶不同部位多糖的测定及体外抗氧化活性[J]. 中国实验方剂学杂志,2014,20(20):168−172. [NIU G J, ZHU S, CHEN Q Y, et al. Determination polysaccharides and antioxidant activity of different parts of Camellia chrysantha[J]. Chinese Journal of Experimental Traditional Medical Formulae,2014,20(20):168−172. [19] 田晓春. 金花茶多糖的分离纯化及化学结构的研究[D]. 湛江: 广东海洋大学, 2011. TIAN X C. Studies on isolation, purification and structure identification for polysaccharides from Camellia chrysantha(Hu) Tuyama[D]. Zhanjiang: Guangdong Ocean University, 2011.
[20] 郑朋朋, 李珊, 张保, 等. 苯酚硫酸法测定萌发菌HL-003多糖方法的研究[J]. 食品工业科技,2016,37(6):74−77. [ZHENG P P, LI S, ZHANG B, et al. Study on phenol-sulfuric acid method for determination of polysaccharides from germination fungus HL-003[J]. Science and Technology of Food Industry,2016,37(6):74−77. [21] 王佳, 李进霞, 张慧芝, 等. 虎杖多糖乙醇分级纯化及其抗氧化性[J]. 食品工业科技,2019,40(1):92−95. [WANG J, LI J X, ZHANG H Z, et al. Ethanol fractional purification and antioxidant activities of polysaccharides from Polygonum cuspidatum[J]. Science and Technology of Food Industry,2019,40(1):92−95. [22] 王艾平, 周丽明. 考马斯亮蓝法测定茶籽多糖中蛋白质含量条件的优化[J]. 河南农业科学, 2014,43(3):150-153. WANG Aiping, ZHOU Liming. Determination of protein content in camellia oleifera seed polysaccharides by coomassie brilliant blue method[J]. Journal of Henan Agricultural Sciences, 2014,43(3):150-153.
[23] 夏甜天, 曹龙奎. 几种不同提取方法对燕麦总多酚含量的影响[J]. 食品工业科技,2017,38(20):183−189. [XIA T T, CAO L K. Effects of several different extraction methods on total polyphenols content in oat[J]. Science and Technology of Food Industry,2017,38(20):183−189. [24] 李环, 陆佳平, 王登进. DNS法测定山楂片中还原糖含量的研究[J]. 食品工业科技,2013,34(18):75−77. [LI H, LU J P, WANG C J. Study on determination of reducing sugar from haw flakes with DNS colorimetry method[J]. Science and Technology of Food Industry,2013,34(18):75−77. [25] 贾金霞, 任晓婕, 李宝花, 等. 新型铜绿菇多糖的制取、结构性质及其抗氧化活性的研究[J]. 食品工业科技,2020,41(5):188−194. [JIA J X, REN X J, LI B H, et al. Study on the preparation, structure, properties and antioxidant activity of new polysaccharides from Russula aeruginea Lindb. : Fr[J]. Science and Technology of Food Industry,2020,41(5):188−194. [26] 王贵春, 陈雪峰, 刘宁, 等. 柱前衍生化高效液相色谱法分析发菜胞外多糖的单糖组成[J]. 食品工业科技,2015,36(10):59−61. [WANG G C, CHEN X F, LIU N, et al. Analysis of monosaccharide compositions of Nostoc flagelliforme extracellular polysaccharide by pre-column derivation HPLC[J]. Science and Technology of Food Industry,2015,36(10):59−61. [27] BRODKORB A, EGGER L, ALMINGER M, et al. INFOGEST static in vitro simulation of gastrointestinal food digestion[J]. Nature Protocols: Recipes for Researchers,2019,14(4):991−1014.
[28] RAMNANI P, CHITARRARI R, TUOHY K, et al. In vitro fermentation and prebiotic potential of novel low molecular weight polysaccharides derived from agar and alginate seaweeds[J]. Anaerobe,2012,18(1):1−6. doi: 10.1016/j.anaerobe.2011.08.003
[29] OLANO-MARTIN E, MOUNTZOURIS K C, GIBSON G R, et al. In vitro fermentability of dextran, oligodextran and maltodextrin by human gut bacteria[J]. British Journal of Nutrition,2000,83(3):247−255. doi: 10.1017/S0007114500000325
[30] 耿梅梅, 许丽卫, 袁红朝, 等. 气相色谱法测定猪结肠内容物中短链脂肪酸含量[J]. 现代生物医学进展,2015,15(6):1010−1014. [GENG M M, XU L W, YUAN C H, et al. A Determination method based on gas chromatography for analysis of short-chain fatty acids in colonic contents of piglet[J]. Progress in Modern Biomedicine,2015,15(6):1010−1014. [31] GUO M M, TANG H G, YAO H J, et al. Study on the isolation of polysaccharide from purple sweet potato by DEAE-cellulose 52[J]. Advanced Materials Research,2013,690-693:1286−1291. doi: 10.4028/www.scientific.net/AMR.690-693.1286
[32] LEE J S, SYNYTSYA A, KIM H B, et al. Purification, characterization and immunomodulating activity of a pectic polysaccharide isolated from Korean mulberry fruit Oddi(Morus alba L.)[J]. International Immunopharmacology,2013,17(3):858−866. doi: 10.1016/j.intimp.2013.09.019
[33] BRAM D, JORAN V, ANNICK P, et al. Prebiotic effects and intestinal fermentation of cereal arabinoxylans and arabinoxylan oligosaccharides in rats depend strongly on their structural properties and joint presence[J]. Molecular Nutrition & Food Research,2011,55(12):1862−1874.
[34] CHEN J, LIANG R, LIU W, et al. Degradation of high-methoxyl pectin by dynamic high pressure microfluidization and its mechanism[J]. Food Hydrocolloids,2012,28(1):121−129. doi: 10.1016/j.foodhyd.2011.12.018
[35] 闵芳芳, 聂少平, 万宇俊, 等. 青钱柳多糖在体外消化模型中的消化与吸收[J]. 食品科学,2013,34(21):24−29. [MIN F F, NIE S P, WAN Y J, et al. In vitro digestion and absorption of polysaccharide from Cyclocarya paliurus leaves[J]. Food Science,2013,34(21):24−29. [36] 刘松珍, 张雁, 张名位, 等. 肠道短链脂肪酸产生机制及生理功能的研究进展[J]. 广东农业科学,2013,40(11):99−103. [LIU S Z, ZHANG Y, ZHANG M W, et al. Research progress on producing mechanism and physiological functions of intestinal short chain fatty acids[J]. Guangdong Agricultural Sciences,2013,40(11):99−103. doi: 10.3969/j.issn.1004-874X.2013.11.029 [37] 高渊, 刘孟洋, 曹谨玲, 等. 基于体外模型研究广叶绣球菌多糖的酵解特性[J]. 食品科技,2021,46(1):15−20. [GAO Y, LIU M Y, CAO J L, et al. The fermentation characteristics of polysaccharides from Sparassis latifolia based on in vitro model[J]. Food Science and Technology,2021,46(1):15−20. [38] 姚思雯, 何佳丽, 朱科学, 等. 菠萝蜜多糖体外酵解特征研究[J]. 现代食品科技,2019,35(3):87−94. [YAO S W, HE J L, ZHU K X, et al. In vitro fermentation characteristics of polysaccharides from Artocarpus heterophyllus Lam. pulp[J]. Modern Food Science and Technology,2019,35(3):87−94. [39] 陈春. 桑葚多糖的结构鉴定、活性评价及其体外消化酵解[D]. 广州: 华南理工大学, 2018. CHEN C. Structural identification, biological activities evaluation, digestion and fermentation in vitro of polysaccharides from Fructus mori[D]. Zhanjiang: South China University of Technology, 2018.
[40] Besten G D, Eunen K V, Groen A K, et al. The role of short-chain fatty acids in the interplay between diet, gut microbiota, and host energy metabolism[J]. Journal of Lipid Research,2013,54(9):2325−2340. doi: 10.1194/jlr.R036012
-
期刊类型引用(2)
1. 高玮,李若兰,曾婧辉,力娜,宋凯,韩世范,朱瑞芳. 药食同源物质及其非营养素在肺癌防治中的研究进展. 护理研究. 2024(10): 1741-1746 .  百度学术
百度学术
2. 孙佳慧,周援,孙月娥,李春阳,王卫东,张军. 黄芪生物活性成分及在食品中的应用研究进展. 中国食品添加剂. 2023(12): 272-276 .  百度学术
百度学术
其他类型引用(1)








 下载:
下载:



 下载:
下载:



