Quality Evaluation of Prepared Wolfberry with Sodium Sulfite Impregnation under Hot Air Drying
-
摘要: 目的:利用亚硫酸钠防腐抗菌作用,采用0.5%亚硫酸钠浸渍-热空气干燥法加工制备枸杞,以期解决贮存中枸杞粘连、变色变质问题。方法:通过考察枸杞感官、pH、枸杞多糖含量、二氧化硫残留量、总黄酮含量、重金属残留量及体外抗氧化活性等理化指标,对制备枸杞的品质和安全性进行评价。通过糖发酵实验考察在湿热环境中亚硫酸钠浸渍加工枸杞的糖发酵抑制作用。结果:与对照品相比,经亚硫酸钠浸渍加工获得的枸杞制品外观品相优良、抑制糖发酵效果明显;SO2残留量为77 mg/kg,重金属Pb的含量为0.080 mg/kg、As的含量为0.076 mg/kg、Cd的含量为0.024 mg/kg,均符合现行《中国药典》(2020版)与国家标准限量要求。与对照品相比,样品中枸杞多糖仅损耗2.08%。以VC为参照物,对照品、样品中枸杞多糖和总黄酮成分对ABTS自由基清除率的IC50值分别为285.6、322.1、92.17和93.74 µg/mL;清除DPPH自由基的IC50值分别为1090、1468、181.9和182.7 µg/mL。体外抗氧化实验结果表明制备枸杞中营养成分(枸杞多糖、总黄酮)的抗氧化活性保持良好。结论:亚硫酸钠浸渍-热空气干燥枸杞制品具有品质优良、耐储存和食用安全的特点。Abstract: Objective: In this paper, a wolfberry sample with 0.5% sodium sulfite impregnation was prepared under hot air drying processing. Here, sodium sulfite was applied in above-mentioned process as the known antiseptic and antibacterial food additive in order to prevent from the adhesion, discoloration and deterioration of wolfberry during long-term storage. Methods: Afterwards, the quality and safety of the prepared wolfberry were evaluated by multiply indicators, such as the sensory, pH value, the content of Lycium barbarum polysaccharides (LBPs), sulfur dioxide residue, total flavonoid content, heavy metal residues and in vitro antioxidant activities. At the same time, the inhibition effect of sugar fermentation of the prepared wolfberry at a hot and humid environment was also investigated. Results: Compared with the control, the wolfberry impregnated with sodium sulfite possessed excellent physical appearance and obvious inhibition ability of sugar fermentation. Furthermore, the SO2 residuals 77 mg/kg and the content of heavy metals (Pb: 0.080 mg/kg; As: 0.076 mg/kg and Cd: 0.024 mg/kg) in processed wolfberry samples were exclusively conformed to the limit of the current Chinese pharmacopoeia and the relevant national standard. And the LBPs of wolfberry only lost a bit up to 2.08%. Moreover, taking VC as a reference, the IC50 values of ABTS free radical scavenging rates of LBPs and total flavonoids in the control and samples were 285.6, 322.1, 92.17 and 93.74 µg/mL respectively, as well as 1090, 1468, 181.9 and 182.7 µg/mL for IC50 values of DPPH free radical. The in vitro antioxidation experiments showed that the LBPs and total flavonoids of the prepared wolfberry maintained good antioxidant activities. Conclusion: The processed wolfberry adopting sodium sulfite impregnation under hot-air drying showed the outstanding characteristics of excellent quality, long-term storage resistance and safe consumption.
-
Keywords:
- sodium sulfite impregnation /
- hot-air drying /
- wolfberry /
- sugar fermentation /
- quality evaluation
-
新疆枸杞(Lycium dasystemum Pojar.)是我国特色药食两用珍品。具有补益元气、明目滋肝、补肾的功效[1]。枸杞含有多种营养及功效成分如:枸杞多糖[2]、黄酮[3]、类胡萝卜素[4]、氨基酸[5]等,医学研究表明其具有免疫调节、抗肿瘤、抗氧化、降血脂[6]等多种药理与保健作用。新疆昼夜温差大,导致枸杞果实中枸杞多糖(Lycium barbarum polysaccharides, LBPs)含量十分丰富。据报道[7]新疆枸杞中枸杞多糖含量比宁夏枸杞高(每100 g枸杞高出0.6 g枸杞多糖),储存中极易产生“泛糖”现象,发生粘结,尤其在湿热环境中更易腐烂变质[8]。为了延长保质期,很多商家都会对枸杞进行硫磺熏蒸,以促使枸杞干燥分散,保持枸杞外观鲜艳明亮,从而达到长期储存的目的。硫熏枸杞由于工艺落后常导致SO2残留超标,经常食用这类产品会引起胃部不适、咽喉疼痛、诱发哮喘等[9]疾病。长期食用硫熏制品会造成肠道功能紊乱,损害肝脏[10],严重危害人体的健康。亚硫酸钠具有抗氧化和抗菌功能,常用于果酱、啤酒、葡萄酒、薯条、调味酱、果汁、腌肉等食品的防腐。张静林等[11]采用低浓度亚硫酸钠对鲜蒜片浸泡后低温烘干,实验表明亚硫酸钠能有效提高蒜片中主要功能性成分硫代亚磺酸酯的含量,使得大蒜独特的风味持久保留,并能延长蒜片的保质期。然而在枸杞加工贮存中采用亚硫酸钠替代硫熏以达到防腐抗菌、延长保质期的研究尚未见文献报道。
本文采用0.5%亚硫酸钠溶液浸渍新鲜枸杞、破蜡、热风烘干获得枸杞样品。同时依据NY/T 2966-2016枸杞干燥技术[12],采用2%碳酸钠溶液浸泡新鲜枸杞(破蜡),热风干燥获得对照品。以对照品为参照物,通过综合评价指标如:枸杞感官、pH、枸杞多糖含量、二氧化硫残留量、总黄酮含量、重金属残留量和体外抗氧化性能等指标,对亚硫酸钠浸渍加工枸杞制品的质量和安全性进行综合分析和评价,以期为农产品和中药材的干燥加工及相关质量评价研究提供实验依据和技术支撑。
1. 材料与方法
1.1 材料与仪器
新鲜枸杞样 由新疆精河县精杞神企业提供;葡萄糖标准品、芦丁标准品(纯度 > 99%) 德国Dr.Ehrenstorfer GmbH公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2-Azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS) TCI(上海)化成工业发展有限公司;过硫酸钾 国药集团化学试剂有限公司;L-抗坏血酸 美国Sigma公司;苯酚、浓硫酸、盐酸、亚硝酸钠、食品级亚硫酸钠、碳酸钠、氢氧化钠、硝酸铝、无水乙醇等 均为国产分析纯试剂,国药集团化学试剂有限公司。
T6新世纪紫外可见分光光度计 北京普析通用仪器有限公司;pH213台式酸度计 上海迈哲电子科技有限公司;CPA-125电子天平 德国Sartorius公司;RV10旋转蒸发仪 德国IKA公司;XIR高速离心机 德国Heraeus Multifuge公司;半自动凯氏定氮仪K-350(配有耐酸泵及蒸汽调节) 瑞士步琦公司;DHG-9070AD电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;PQX-1000B人工气候箱 宁波东南仪器有限公司;iCAP RQ ICP-MS电感耦合等离子体质谱仪 赛默飞世尔科技中国。
1.2 实验方法
1.2.1 实验样品的制备
1.2.1.1 对照品制备
依据NY/T 2966-2016枸杞干燥技术,稍作改进。采用2%碳酸钠溶液,以料液比为1:10浸渍新鲜枸杞10 min,浸泡后热风60 ℃干燥24 h获得。
1.2.1.2 样品制备
在NY/T 2966-2016枸杞干燥技术的基础上,采用正交法优化实验,得到最佳工艺条件。采用0.5%亚硫酸钠,以料液比为1:10浸渍新鲜枸杞10 min,于60 ℃条件下干燥16 h后,并于室外通风处放置20 h后制备获得。
1.2.2 高温高湿贮藏
将对照品与经亚硫酸钠浸渍加工的枸杞样品于高温高湿条件下(40 ℃、RH(%)=80%)分别放置5、10、15、20和30 d后,考察样品与对照品的质量指标(感官、pH、枸杞多糖含量、SO2残留量、重金属残留量)的变化情况。涉及含量测定的指标,需将每个时间段取出的枸杞制品于60 ℃干燥至恒重后,进行各指标的含量测定。
1.2.3 枸杞制品感官评价
随机拿取各加工枸杞样品嗅辩气味是否正常,有无异味。然后将其平铺于样品盘上,检查各加工枸杞样品的颜色和光泽,以及颗粒的匀整度、洁净度等。
1.2.4 枸杞制品pH测定
各称取枸杞样品和对照品粉末约2 g,将其分别置于烧杯中,加入2~3倍量的水。在水浴60 ℃中加热30 min,过滤,用pH酸度计测定样品滤液的pH。
1.2.5 枸杞多糖的提取与含量测定
1.2.5.1 标准曲线的绘制
精密称取经105 ℃干燥至恒重的葡萄糖标准品5 mg,置于50 mL容量瓶中,用少量水溶解后,加水稀释至刻度,摇匀,即得浓度为0.1 mg/mL的葡萄糖标准品溶液。精密吸取标准品溶液0、0.2、0.4、0.6、0.8、1.0、1.2 mL,分别置于具塞试管中,并加水至2.0 mL,再各精密加入1.0 mL 5%苯酚溶液,摇匀,迅速精密加入5.0 mL浓硫酸,摇匀,放置10 min后,置沸水浴中加热15 min,取出后冷却至室温。另以2.0 mL蒸馏水,加1.0 mL苯酚液、5.0 mL浓硫酸,同上述操作,作为空白对照品[13]。用紫外-可见分光光度法在490 nm处测定吸光度(A值)。以A值为纵坐标,浓度(C)为横坐标。得标准曲线y=9.8456x+0.0102(线性范围2.5~15 µg/mL,R2=0.9976)。
1.2.5.2 枸杞多糖含量测定
称定各加工枸杞粉末1 g,于50 mL离心管中,以料液比为1:30加入蒸馏水,先在超声(40 kHz、100 W)中浸提1 h,然后在90 ℃恒温水浴中浸提1 h后抽滤,将待测液旋蒸浓缩至10 mL,加无水乙醇至溶液中含醇80%,于4 ℃冰箱中放置过夜,离心,取沉淀,加蒸馏水定容至100 mL。取样品溶液0.5 mL,置于具塞试管中,加水至2.0 mL,按照1.2.5.1,自“各精密加入1.0 mL 5%苯酚溶液”起的操作,测定A值[14],并计算供试品溶液中含葡萄糖的质量(mg),枸杞多糖含量依据式(1)计算,可得。
W=250×ρ×fm⋅V×106×100 (式1) 式中:W为每百克枸杞中枸杞多糖的质量,g/100g;ρ为吸取待测液中葡萄糖的质量浓度,µg/mL;f为葡萄糖与多糖的换算因子,3.19;m为试样质量,g;V为吸取待测液的体积,mL。
1.2.6 枸杞中二氧化硫残留量测定
称取5 g枸杞样品粉末于凯氏蒸馏管中,加入6 mol/L的盐酸溶液10 mL,蒸馏7 min后,停止蒸馏,接收瓶预先放入25 mL 20 g/L的乙酸铅吸收液,待接收瓶中溶液体积约为200 mL时,接收管下端离开液面,用少量蒸馏水冲洗插入乙酸铅溶液的装置部分,同时做空白试验[15]。向取下的接收瓶中依次加入10 mL 6 mol/L的盐酸溶液和1 mL 10 g/L淀粉指示剂。摇匀后用碘标准溶液滴定至变蓝且在30 s内不褪色为止,记录滴定时所消耗碘标液的体积[16]。
计算公式如(2):
X=(V−V0)×0.032×C×1000m (式2) 式中:试样中的二氧化硫含量X(以SO2 计)为每千克枸杞中二氧化硫的质量,g/kg;V为滴定样品所用碘标准溶液的体积,mL;V0为空白试验所用碘标准溶液的体积,mL;C为碘标准溶液的浓度,mol/L;0.032为1 mL碘标准溶液相当于二氧化硫的质量,g;m为试样质量,g。
1.2.7 枸杞总黄酮的提取与含量测定
1.2.7.1 标准曲线的绘制
精密称取芦丁标准品5 mg,置于25 mL容量瓶中,用70%乙醇定容至刻度,摇匀,得浓度为0.2 mg/mL的芦丁标准品溶液。精密吸取标准品溶液0.5、1.0、1.5、2.0、2.5、3.0 mL分别置于10 mL容量瓶中,再各精密加入0.5 mL 5%NaNO2溶液摇匀,放置6 min,加入0.5 mL 10%Al(NO3)3溶液摇匀,放置6 min,加2.0 mL 4% NaOH,再用70%乙醇定容,摇匀,放置10 min,于510 nm处测定吸光度[17]。以A值为纵坐标,浓度(C)为横坐标,绘制标准曲线为:y=0.9491x−0.0212(线性范围0.01~0.06 mg/mL,R2=0.9915)。
1.2.7.2 枸杞总黄酮含量测定
枸杞总黄酮成分的提取:各称取约1 g枸杞样品和对照品粉末于50 mL的离心管中,加入10 mL 70%的乙醇,超声辅助提取(40 kHz、100 W)1 h后,抽滤得待测液[18]。
依据文献方法[19],稍作修改。取2.0 mL上述待测液于10 mL容量瓶中,加入0.5 mL 5%NaNO2溶液摇匀,放置6 min,加入0.5 mL 10%Al(NO3)3溶液摇匀,放置6 min,加2.0 mL 4% NaOH,再用70%乙醇定容,摇匀,放置10 min后,于510 nm处测定试样吸光值。根据标准曲线计算试样中总黄酮的含量(μg/g干重,以芦丁计)。
1.2.8 抗氧化活性测定
1.2.8.1 枸杞多糖溶液的制备
体外抗氧化实验所需的枸杞多糖成分的提取测定方法,同上述1.2.5枸杞多糖的提取与含量测定方法。再依据1.2.5.1标准曲线计算出相应浓度,逐级稀释。经逐级稀释后清除ABTS自由基的对照品与样品中枸杞多糖浓度范围为0.1~0.5 mg/mL。经逐级稀释后清除DPPH自由基的对照品和样品中枸杞多糖浓度范围为0.4~2.0 mg/mL。
1.2.8.2 枸杞总黄酮溶液的制备
体外抗氧化实验所需的枸杞总黄酮成分的提取测定方法,同上述1.2.7枸杞总黄酮的提取与含量测定方法,再依据1.2.7.1标准曲线计算出相应浓度,逐级稀释。经逐级稀释后清除ABTS自由基的对照品与样品中枸杞总黄酮浓度范围为0.04~0.2 mg/mL。经逐级稀释后清除DPPH自由基的对照品和样品中枸杞总黄酮浓度范围为0.1~0.5 mg/mL。
1.2.8.3 DPPH自由基清除活性测定
取2.0 mL 1 mmol/L DPPH乙醇溶液分别与不同质量浓度的枸杞多糖溶液、枸杞总黄酮溶液混合,于室温下避光反应30 min后,在波长为517 nm条件下测定其吸光度[20]。枸杞多糖、总黄酮清除DPPH自由基的能力用VC当量表示,单位为µg VC/g dw。标准曲线以VC标准液绘制,得到回归方程y=1.036x+0.1125(线性范围5.0~25.0 µg/mL,R2 = 0.9943)。
1.2.8.4 ABTS自由基清除活性测定
将7 mmol/L ABTS自由基、2.6 mmol/L过硫酸钾溶液等体积混合,避光静置16 h后,用0.2 mol/L磷酸盐缓冲液(pH7.4)稀释至吸光度为0.70±0.02,制得ABTS工作液。取1.0 mL ABTS工作液分别与不同质量浓度的枸杞多糖溶液、总黄酮溶液混合,于室温避光反应6 min,在波长734 nm处测定吸光度[21]。以VC作为阳性对照品,枸杞多糖、总黄酮清除ABTS自由基的能力同样用VC当量表示,单位为µg VC/g dw。以VC质量浓度为横坐标,ABTS清除率为纵坐标绘制标准曲线,得到回归方程y=1.3883x+4.901(线性范围2.5~12.5 µg/mL,R2=0.9913)。
清除率(%)=(A0−A1A0)×100 (式3) 式中:A0为空白样品加DPPH或ABTS溶液的吸光度;A1为样品或对照品与DPPH或ABTS溶液混合后的吸光度。
1.2.9 枸杞制品中微量元素的含量测定
1.2.9.1 ICP-MS 仪器工作参数
雾化气流量:0.77 L/min;辅助气流量:1.2 L/min;等离子体流量:15 L/min;射频功率:1100 W[22]。
1.2.9.2 内标液的配制
准确吸取浓度为10 μg/mL的混合内标溶液1.0 mL,用1%硝酸溶液定容至100 mL容量瓶中。以Sc为内标物测定Cr、Mn、Fe元素,Ge为内标物测定Cu、Zn、As元素,In为内标物测定Cd元素,Bi 为内标物测定Pb元素。
1.2.9.3 标准曲线的绘制
各元素对照品溶液的配制:分别精确吸取浓度为10 μg/mL的各元素混合标准储备液0、100、300、500、750、1000、2000 μL于50 mL容量瓶中,用1%硝酸溶液定容、摇匀,得到系列浓度的标准溶液。
1.2.9.4 枸杞制品的消解和元素定量分析
各称取枸杞样品和对照品约0.2 g分别置于微波消解罐中,加入5.0 mL硝酸,按照微波消解程序消解试样,冷却后取出消解罐,于电热板140~170 ℃赶酸至1.0 mL左右。消解罐放冷后,将消化液转移至10 mL容量瓶中,用少量水洗涤消解罐2~3次,合并洗涤液于容量瓶中,用水定容至刻度,混匀备用[23-25]。同时做试剂空白试验。微波消解程序如下:a:室温~80 ℃,升温5 min,压力为5 atm;b:80~120 ℃,升温5 min,压力为10 atm;c:120~150 ℃,升温2 min,压力为15 atm;d:150~170 ℃,升温5 min,压力为20 atm;e:170~190 ℃,升温18 min,压力为25 atm。试样中各元素含量计算公式如(4):
X=(ρ−ρ0)×V×fm×1000 (式4) 式中:X为试样中待测元素的含量,mg/kg;ρ为试样中待测元素的质量浓度,μg/L;ρ0为空白溶液中待测元素的质量浓度,μg/L;V为试样消化液的定容体积,mL;m为试样质量,g;1000为换算系数。
1.3 数据处理
所有含量测定及抗氧化活性实验中每份样品平行测定3次,结果以平均值±标准偏差(SD)表示。采用IBM SPSS 21.0软件进行数据处理,试验分析图采用Graphpad Prism 8.0绘制。
2. 结果与分析
2.1 质量评价
2.1.1 感官评价
由图1可见,对照品(a)为暗红色,表皮泛白,颗粒饱满,大小均匀,无杂质,有枸杞清香味。经亚硫酸钠溶液浸渍加工的枸杞(b)颜色鲜亮、色泽红润,颗粒干净完整,有枸杞清香气味。对照品(a)经室内放置25 d后(c),观察发现颗粒变小,颜色变暗。相比对照品(c),样品(b)于室内放置25 d后(d),样品颗粒度和颜色无明显变化。亚硫酸钠是一种很好的护色剂[26],在保持枸杞色泽方面具有较为突出的优势。
2.1.2 对照品与样品pH、枸杞多糖含量、SO2残留量、总黄酮含量的比较分析
如表1所示,经亚硫酸钠浸渍加工的枸杞,其pH略高于对照品,研究表明[27]亚硫酸钠溶液提供的碱性环境有利于枸杞表面蜡质层的去除。与对照品相比,样品中枸杞多糖含量略有下降,从8.15 g/100 g下降至7.98 g/100 g,下降了2.08%,据文献报道亚硫酸盐会与糖的醛酮结构发生反应[28],导致多糖含量降低。经检测对照品中总黄酮的含量为185.00 μg/g,样品中的总黄酮含量为134.00 μg/g,二者总黄酮含量差异明显。李朋亮[29]报道了以Na2SO3作为枸杞除蜡剂时,发现枸杞在干制过程中其主要黄酮类成分如:芦丁、槲皮素、山奈酚等的含量均有所下降,与本文报道的结果相一致。推测可能原因为枸杞中的芦丁、槲皮素、山奈酚等黄酮成分中的活泼羰基与亚硫酸钠发生了加成反应,导致黄酮含量的下降。经检测样品中SO2残留量为77 mg/kg,低于2020版《中国药典》[30](150 mg/kg)和现行国家标准的限量要求(100 mg/kg)[31]。
表 1 对照品与样品pH、枸杞多糖含量、SO2残留量、总黄酮含量的比较分析Table 1. Comparison of pH value, LBPs, SO2 residue and total flavonoids between the control and the sample加工方式 pH 枸杞多糖
(g/100 g)总黄酮
(μg/g)SO2残留量
(mg/kg)对照品 5.27±0.01 8.15±0.071 185.00±0.30 / 样品 5.36±0.01 7.98±0.021 134.00±0.15 77±6 2.1.3 对照品与样品体外抗氧化活性测定
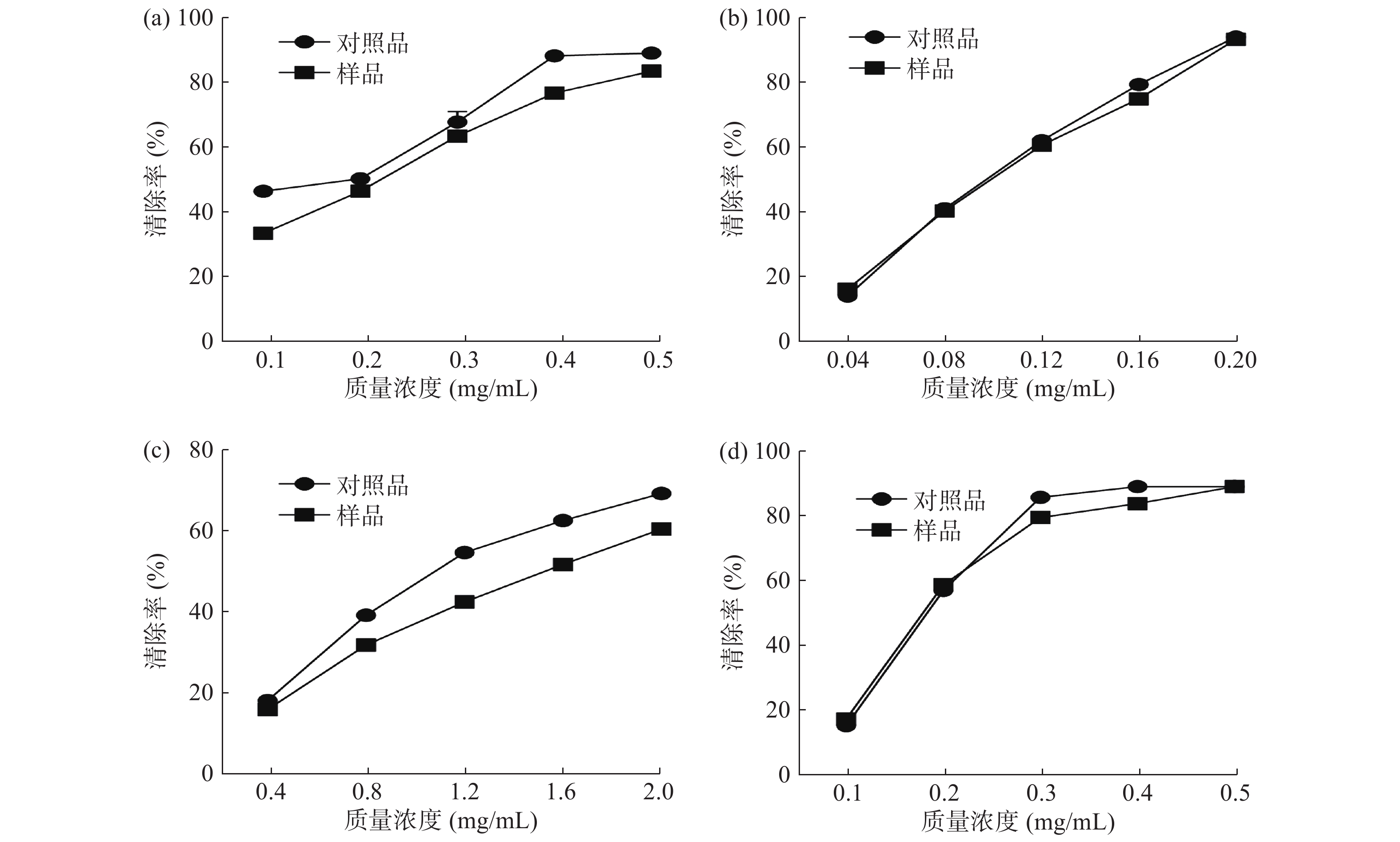
采用DPPH法和ABTS法评价样品与对照品中枸杞多糖和总黄酮成分的体外抗氧化活性。DPPH和ABTS自由基的清除率越高表明该成分的抗氧化活性越强[32]。以VC为阳性参照物,对照品、样品中枸杞多糖浓度为0.5 mg/mL时清除ABTS自由基的能力分别为(65.24±0.11)和(63.77±0.23) µg VC/g;当对照品和样品中总黄酮成分的浓度为0.2 mg/mL时,清除ABTS自由基的能力分别为(64.18±0.02)和(63.68±0.17) µg VC/g。样品中枸杞多糖浓度为2.0 mg/mL时清除DPPH自由基的能力(58.29±0.16)µg VC/g,稍弱于对照品(66.57±0.13) µg VC/g;当对照品和样品的浓度为0.5 mg/mL时,总黄酮成分清除DPPH自由基的能力分别为(85.25±0.03)和(85.21±0.25)µg VC/g。
由表2枸杞多糖、总黄酮成分清除ABTS、DPPH自由基的IC50值可以看出,对照品中枸杞多糖清除ABTS自由基的能力稍强于样品;其清除DPPH自由基的能力与清除ABTS自由基的效果相一致。IC50越低,表明该成分清除ABTS、DPPH自由基的能力越强[33]。相比对照品总黄酮含量185.00 μg/g,样品中总黄酮的含量为134.00 μg/g,但实验结果显示其清除ABTS、DPPH自由基的能力与对照品接近,究其原因可能为样品中残留的亚硫酸根离子参与了各自由基的清除过程。
表 2 不同加工方式枸杞中枸杞多糖、总黄酮成分清除ABTS、DPPH的IC50值Table 2. The IC50 value of LBPs and total flavonoids from Lycium dasystemum Pojar. in different processing methods加工方式 清除ABTS自由基(µg/mL) 清除DPPH自由基(µg/mL) 枸杞多糖 总黄酮 枸杞多糖 总黄酮 对照品 285.6 92.17 1090 181.9 样品 322.1 93.74 1468 182.7 与对照品相比,样品中枸杞多糖、总黄酮成分的含量均略有下降,这一变化反映在图2中其清除ABTS、DPPH自由基的曲线有轻微的下降趋势。体外抗氧化实验结果表明抗氧化曲线的变化趋势与样品中枸杞多糖、总黄酮成分的含量变化结果一致。
2.1.4 对照品和样品中微量元素含量测定
枸杞中所测元素的线性方程、相关系数、线性范围见表 3。结果显示,各元素的相关系数均在 0.990 以上,表明标准曲线线性关系良好。对照品和样品中Cr、Mn、Fe、Cu、Zn、As、Cd、Pb元素的含量如表4所示。经亚硫酸钠浸渍加工的枸杞样品中微量元素Mn、Fe、Cu、Zn含量与对照品无较大差异,有害元素As、Cd、Pb的含量均在国家药典[30]和现行国家标准[31]允许范围内。
表 3 枸杞中微量元素的回归方程、线性范围Table 3. Standard curve and concentration range of trace elements in Lycium dasystemum Pojar.元素 回归方程 相关系数 线性范围(μg/L) 52Cr y=9.496×106x+2.558×105 0.9964 0~400 55Mn y=5.264×106x+1.174×105 0.9948 0~400 57Fe y=2.165×105x+6.972×103 0.9986 0~400 63Cu y=1.194×107x+9.410×104 0.9979 0~400 66Zn y=1.935×106x+8.862×104 0.9937 0~400 75As y=1.047×106x+2.182×104 0.9957 0~400 111Cd y=3.394×106x+8.651×104 0.9971 0~400 208Pb y=5.147×107x+1.175×105 0.9965 0~400 表 4 对照品与样品中微量元素含量的比较分析Table 4. The comparison of trace elements between the control and the sample of Lycium dasystemum Pojar.加工方式 元素含量(μg/kg) 52Cr 55Mn 57Fe 63Cu 66Zn 75As 111Cd 208Pb 对照品 1 9661 79574 9604 13344 74 32 62 样品 1 11788 63546 6243 7290 76 24 80 NY/T 1051-2014
绿色标准[[34]]As:1 mg/kg;Pb: 1 mg/kg;Cd:0.3 mg/kg 2020版《中国药典》 As:2 mg/kg;Pb: 5 mg/kg;Cd:1.0 mg/kg;
Cu:20 mg/kg2.2 高温高湿实验结果
2.2.1 高温高湿放置枸杞制品感官变化的分析比较
枸杞中含有丰富的糖类成分,在贮藏过程中容易出现“泛糖变色”问题,随着储存时间的延长颜色通常由暗红色逐渐转变为褐红色、红棕色甚至棕黑色,严重影响枸杞的外观和营养价值。图3显示,对照品和样品分别于湿热环境中放置5 d时(a和b比较),二者饱满程度相似。对照品(a)呈暗红色,表皮干而肉质饱满;样品(b)呈鲜红色,表皮干且果肉紧实,二者均有枸杞清香味。而放置10 d后(c和d比较),对照品(c)已经开始发生褐变,有淡淡的酸味逸出;而样品(d)表皮颜色局部加深,到15 d时样品才开始发生褐变(见f)。存放20 d后,可以观察到对照品表面出现渗液现象,但样品表面未见渗液。经观察对照品与样品均发生了较深程度的褐变并伴有不同程度的霉斑(g和h比较)。到了30 d时,对照品的渗液更加明显,且能闻见明显的酸味;样品出现轻微的渗液以及轻微的酸味。经观察对照品与样品均已完全发生褐变及霉变(见i和j)。与对照品相比,经亚硫酸钠浸渍加工的枸杞样品更加稳定耐储存。主要原因是亚硫酸钠不仅抑制了酶促褐变反应的发生,而且有效地阻断了枸杞中糖类成分与氨基酸的非酶褐变反应,抑制了褐色物质的生成[35]。同时,也明显地抑制了糖类成分发酵,从而阻止了枸杞变色变质问题的发生。
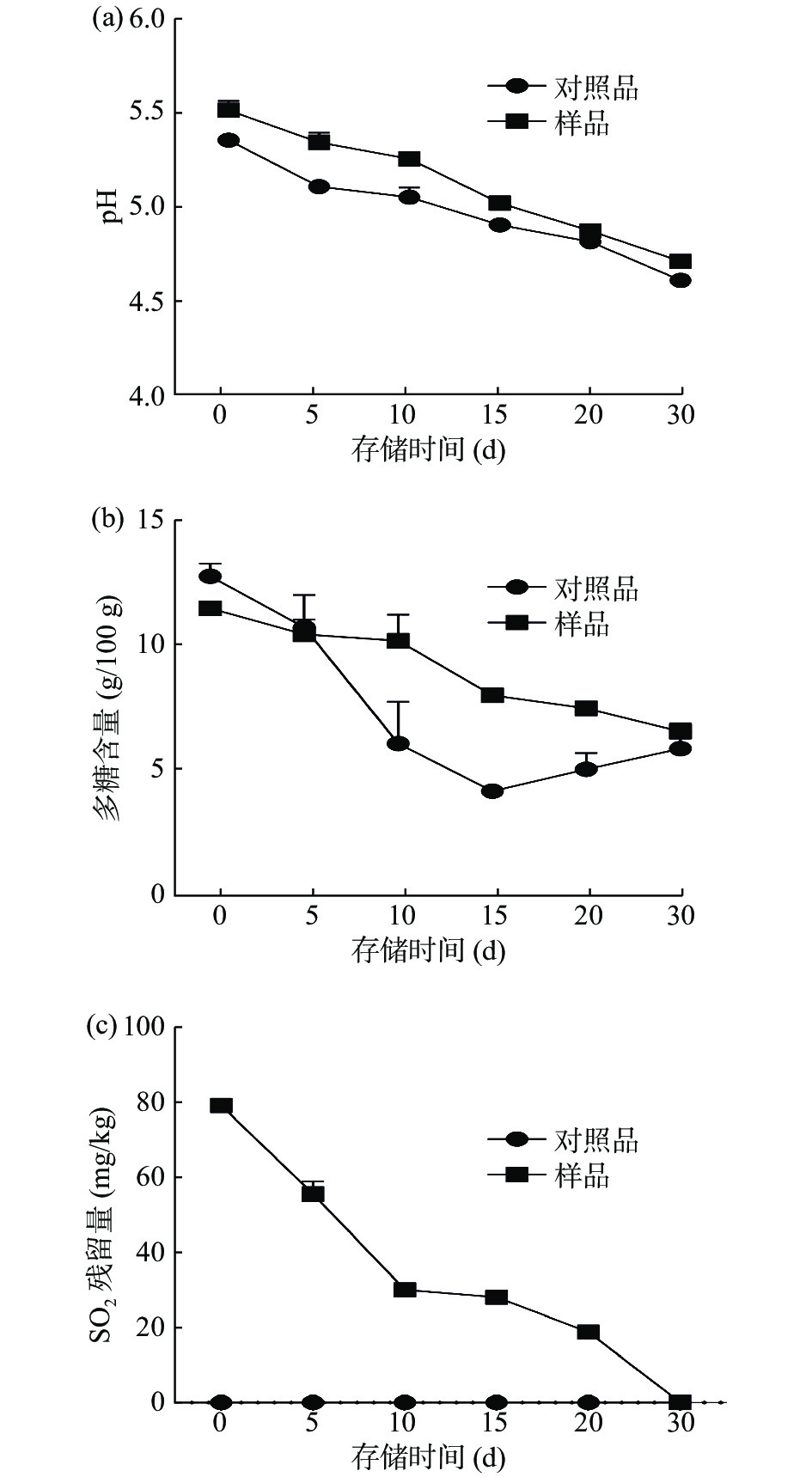
2.2.2 高温高湿放置枸杞pH、枸杞多糖含量、SO2残留量的分析比较
由图4a和4b可知,样品与对照品的pH均随存储时间的延长而降低,但样品的pH下降趋势较对照品缓慢。样品于高温高湿环境中放置30 d时,pH下降了15.04%,枸杞多糖损耗了38.45%。而对照品的pH从5.28降至4.51,下降了14.58%,同时枸杞多糖含量损耗了53.12%。根据枸杞pH和枸杞多糖含量的变化趋势,推测枸杞在湿热环境中长时间放置容易滋生多种微生物,加速多糖类成分不断的发酵,使得酸性产物不断的累积[36],导致枸杞营养损失,pH降低,口感变差。与对照品相比,样品在湿热环境中枸杞多糖损耗较少,且pH下降缓慢,推测其原因为亚硫酸钠有效地阻止了微生物的滋生,从而对枸杞的糖发酵过程起到了显著地抑制作用[37]。而且样品放置5 d后,SO2残留量下降至0.020 g/kg(见图4c),随着存储时间的延长而逐渐降低为零。说明湿热环境可以加快枸杞中SO2的逸出,同样随着时间的延长,枸杞中的枸杞多糖成分也会出现明显的损失。
2.2.3 高温高湿放置枸杞制品中微量元素的含量
如表5所示,样品与对照品于高温高湿环境中放置10 d时,样品与对照品中微量元素的含量变化不明显;到了15 d时,对照品中微量元素的含量出现明显的下降,到达拐点,说明对照品中的微量元素发生了明显的迁移,这可能与对照品枸杞发酵导致渗液相关。随着存储时间延长,对照品与样品中各微量元素均出现上升趋势,推测可能由于滋生微生物所导致。在30 d时,样品中的微量元素Mn、Cu、Zn含量达到最高,分别为15.851、13.645和16.945 mg/kg;而对照品中微量元素Mn、Zn的含量在15 d时降至最低,随后又有所回升,至30 d达到较高水平。与样品相比,对照品更易出现渗糖现象而发生腐败变质,导致各种微量元素随着糖液的渗出而发生迁移,进而致使微量元素发生明显损失。随后,随着发酵程度的加深,微生物滋生量也随之增加,导致各微量元素的回升。如表5所示,经亚硫酸钠浸渍加工的枸杞中的微量元素Mn、Fe、Cu、Zn含量随存储时间的延长而出现较为明显的上升,推测其为滋生微生物所致。样品中有害元素As、Cd、Pb含量稳定,且均在现行国家标准和2020版《中国药典》的安全范围内。
表 5 枸杞样品与对照品中微量元素的含量比较Table 5. Comparison of trace elements between the sample and the control of Lycium dasystemum Pojar.存储时间(d) 元素含量(μg/kg) 52Cr 55Mn 57Fe 63Cu 66Zn 75As 111Cd 208Pb S C S C S C S C S C S C S C S C 5 3 2 7971 11985 45843 75651 10709 8225 12055 10185 77 71 32 22 74 60 10 3 3 10695 13005 63493 62595 7870 10355 12328 12356 76 75 34 12 67 54 15 5 5 12728 7970 85499 65904 8550 5843 10625 7238 75 76 28 26 66 61 20 2 2 13102 13102 79489 79489 10412 10412 11857 11857 74 74 24 11 62 46 30 8 6 15851 11412 72150 69466 13645 5183 16945 13190 76 74 27 23 80 63 注:“S”代表样品;“C”代表对照品。 3. 结论
经亚硫酸钠浸渍加工制得的枸杞外观色泽鲜亮,且长期放置后外观、气味无任何变化;SO2残留量为77 mg/kg;与对照品相比,样品中枸杞多糖仅损耗2.08%,枸杞中的主要活性成分保留率高。样品中重金属Pb的含量为0.080 mg/kg、As的含量为0.076 mg/kg、Cd的含量为0.024 mg/kg,均符合2020版《中国药典》和现行国家标准限量要求。体外抗氧化实验结果表明样品中枸杞多糖清除ABTS和DPPH的能力略有下降,但不明显;样品中总黄酮成分清除ABTS和DPPH的能力与对照品相近,证明样品中的活性成分(枸杞多糖、总黄酮)的抗氧化活性保持良好。相比对照品,样品于高温高湿环境中放置,其pH下降缓慢,枸杞多糖损耗少,表皮长时间保持相对干燥,表明亚硫酸钠浸渍加工的枸杞制品抑制糖发酵作用显著,且能达到延长保质期的目的。综上所述,经亚硫酸钠浸渍加工的枸杞制品具有品质优异、耐储存且食用安全的性能。此项研究不仅有助于制定更加全面的枸杞质量检测指标,而且为农产品及中药材的干燥加工提供了更加科学有效的方法。
-
表 1 对照品与样品pH、枸杞多糖含量、SO2残留量、总黄酮含量的比较分析
Table 1 Comparison of pH value, LBPs, SO2 residue and total flavonoids between the control and the sample
加工方式 pH 枸杞多糖
(g/100 g)总黄酮
(μg/g)SO2残留量
(mg/kg)对照品 5.27±0.01 8.15±0.071 185.00±0.30 / 样品 5.36±0.01 7.98±0.021 134.00±0.15 77±6 表 2 不同加工方式枸杞中枸杞多糖、总黄酮成分清除ABTS、DPPH的IC50值
Table 2 The IC50 value of LBPs and total flavonoids from Lycium dasystemum Pojar. in different processing methods
加工方式 清除ABTS自由基(µg/mL) 清除DPPH自由基(µg/mL) 枸杞多糖 总黄酮 枸杞多糖 总黄酮 对照品 285.6 92.17 1090 181.9 样品 322.1 93.74 1468 182.7 表 3 枸杞中微量元素的回归方程、线性范围
Table 3 Standard curve and concentration range of trace elements in Lycium dasystemum Pojar.
元素 回归方程 相关系数 线性范围(μg/L) 52Cr y=9.496×106x+2.558×105 0.9964 0~400 55Mn y=5.264×106x+1.174×105 0.9948 0~400 57Fe y=2.165×105x+6.972×103 0.9986 0~400 63Cu y=1.194×107x+9.410×104 0.9979 0~400 66Zn y=1.935×106x+8.862×104 0.9937 0~400 75As y=1.047×106x+2.182×104 0.9957 0~400 111Cd y=3.394×106x+8.651×104 0.9971 0~400 208Pb y=5.147×107x+1.175×105 0.9965 0~400 表 4 对照品与样品中微量元素含量的比较分析
Table 4 The comparison of trace elements between the control and the sample of Lycium dasystemum Pojar.
加工方式 元素含量(μg/kg) 52Cr 55Mn 57Fe 63Cu 66Zn 75As 111Cd 208Pb 对照品 1 9661 79574 9604 13344 74 32 62 样品 1 11788 63546 6243 7290 76 24 80 NY/T 1051-2014
绿色标准[[34]]As:1 mg/kg;Pb: 1 mg/kg;Cd:0.3 mg/kg 2020版《中国药典》 As:2 mg/kg;Pb: 5 mg/kg;Cd:1.0 mg/kg;
Cu:20 mg/kg表 5 枸杞样品与对照品中微量元素的含量比较
Table 5 Comparison of trace elements between the sample and the control of Lycium dasystemum Pojar.
存储时间(d) 元素含量(μg/kg) 52Cr 55Mn 57Fe 63Cu 66Zn 75As 111Cd 208Pb S C S C S C S C S C S C S C S C 5 3 2 7971 11985 45843 75651 10709 8225 12055 10185 77 71 32 22 74 60 10 3 3 10695 13005 63493 62595 7870 10355 12328 12356 76 75 34 12 67 54 15 5 5 12728 7970 85499 65904 8550 5843 10625 7238 75 76 28 26 66 61 20 2 2 13102 13102 79489 79489 10412 10412 11857 11857 74 74 24 11 62 46 30 8 6 15851 11412 72150 69466 13645 5183 16945 13190 76 74 27 23 80 63 注:“S”代表样品;“C”代表对照品。 -
[1] 贺天雨, 乐胜锋, 杜宁, 等. 液相色谱法在枸杞甜菜碱含量测定中的应用[J]. 食品安全质量检测学报,2019,10(11):3444−3449. doi: 10.3969/j.issn.2095-0381.2019.11.035 [2] Cui F, Shi C L, Zhou X J. Lycium barbarum polysaccharide extracted from Lycium barbarum leaves ameliorates asthma in mice by reducing inflammation and modulating gut microbiota[J]. Medicinal Food,2020,23(7):1−12.
[3] Ng Z X, Yvonne T T K, Phaik H Y. Comparative analyses on radical scavenging and cytotoxic activity of phenolic and flavonoid content from selected medicinal plants[J]. Natural Product Research,2020,2020:1−6.
[4] Montesano D, Garcia A J, Manes J, et al. Chemoprotective effect of carotenoids from Lycium barbarum L. on SH-SY5Y neuroblastoma cells treated with beauvericin[J]. Food and Chemical Toxicology,2020,141:111414−111422. doi: 10.1016/j.fct.2020.111414
[5] 丁学利. 枸杞干果酒发酵过程中氨基酸组成的变化[J]. 陕西林业科技,2019,47(1):12−15, 22. doi: 10.3969/j.issn.1001-2117.2019.01.003 [6] Masci A, Carradori S, Casadei M A, et al. Lycium barbarum polysaccharides: Extraction, purification, structural characterisation and evidence about hypoglycaemic and hypolipidaemic effects. A review[J]. Food Chemistry,2018,254:377−389. doi: 10.1016/j.foodchem.2018.01.176
[7] 付艳丽, 姜成忠, 王亚菲, 等. 比色法测定不同产地等级枸杞中多糖含量[J]. 黑龙江医药,2002,15(4):253−254. doi: 10.3969/j.issn.1006-2882.2002.04.005 [8] 牛建强. 枸杞的采收制干包装存储[J]. 农村经济与科技,2017,28(4):291, 306. [9] Guo T, Feng W H, Liu X Q, et al. Characterization of the processing of dry Lily (Lilium davidii Duch.) bulbs by mid-infrared spectroscopy[J]. Analytical Letters,2016,49(15):2427−2435. doi: 10.1080/00032719.2016.1151438
[10] Jiang X, Huang L F, Zheng S H, et al. Sulfur fumigation, a better or worse choice in preservation of traditional chinese medicine[J]. Phytomedicine,2013,20(2):97−105. doi: 10.1016/j.phymed.2012.09.030
[11] 张静林, 陶阳, 韩永斌, 等. 亚硫酸钠浸泡预处理对脱水蒜片主要品质指标的影响[J]. 食品科学,2019,40(4):49−55. doi: 10.7506/spkx1002-6630-20170928-412 [12] 中国农业部. NY/T 2966-2016 枸杞干燥技术规范[S]. 北京: 中国标准出版社, 2016. [13] Zhao Q S, Dong B T, Chen J J, et al. Effect of drying methods on physicochemical properties and antioxidant activities of wolfberry (Lycium barbarum)polysaccharide[J]. Carbohydrate Polymers,2015,127:176−181. doi: 10.1016/j.carbpol.2015.03.041
[14] 林海霞, 赵国群, 张桂, 等. 超声波技术在枸杞多糖提取中的应用[J]. 食品研究与开发,2007,28(6):99−101. doi: 10.3969/j.issn.1005-6521.2007.06.029 [15] 李鹏玲, 朱金美, 左国涛, 等. 凯氏蒸馏-滴定法测定蔬菜干制品中的二氧化硫残留量[J]. 食品安全质量检测学报,2019,10(19):6552−6555. [16] 毛琏, 王娣, 张兰天, 等. 凯氏蒸馏-电子滴定器碘滴定法测定食品中的二氧化硫[J]. 中国食品卫生杂志,2016(28):605−609. [17] 禄璐, 米佳, 罗青, 等. 枸杞总黄酮提取工艺优化及其体外抗氧化活性分析[J]. 食品工业科技,2019,40(24):165−171. [18] Sun L J, Zhang J B, Lu X Y, et al. Evaluation to the antioxidant activity of total flavonoids extract from persimmon (Diospyros kaki L.) leaves[J]. Food and Chemical Toxicology,2011,49(10):2689−2696. doi: 10.1016/j.fct.2011.07.042
[19] 陈瑾, 陈晶华, 刘利平, 等. 枸杞叶黄酮提取物的纯化及组成结构分析[J]. 食品工业科技,2019,40(18):28−34, 40. [20] Sridhar K, Charles A L. In vitro antioxidant activity of Kyoho grape extracts in DPPH and ABTS assays: Estimation methods for EC50 using advanced statistical programs[J]. Food Chemistry,2019,275:41−49. doi: 10.1016/j.foodchem.2018.09.040
[21] Pham D C. Optimization of ultrasound-assisted extraction of flavonoids fromCelastrus hindsii leaves using response surface methodology and evaluation of their antioxidant and antitumor activities[J]. BioMed Research International,2020,2020:1−9.
[22] 张建, 田志强, 卢垣宇, 等. 电感耦合等离子体质谱法检测白酒中28种元素[J]. 食品科学,2013,34(22):257−260. [23] Houk R S, Fassel V A. Inductively coupled argon plasma as anion source for mass spectrometric determination of trace elements[J]. Analytical Chemistry,1980,52(14):2283−2289. doi: 10.1021/ac50064a012
[24] Marcinkowska M, Baralkiewicz D. Multielemental speciation analysis by advanced hyphenated technique-HPLC/ICP-MS: A review[J]. Talanta,2016,161:177−204. doi: 10.1016/j.talanta.2016.08.034
[25] Dico G M L, Galvano F. Toxic metal levels in cocoa powder and chocolate by ICP-MS method after microwave-assisted digestion[J]. Food Chemistry,2018,245:1163−1168. doi: 10.1016/j.foodchem.2017.11.052
[26] 李静. 加热方式及亚硫酸钠浓度对花魔芋护色效果的影响[J]. 食品工业,2016,37(9):26−27. [27] 刘瑜, 姚思远, 冉国伟, 等. 脱蜡工艺对枸杞热风干燥时间的影响[J]. 食品工业科技,2015,36(24):211−215. [28] 薛鹏仙, 龙泽荣, 袁辉, 等. 硫熏中药材品质及其毒理学研究进展[J]. 化学通报,2019,82(7):598−605. [29] 李朋亮. 枸杞干制中黄酮类化合物变化规律及其抗氧化活性研究[D]. 银川: 宁夏大学, 2014. [30] 国家药典委员会. 中华人民共和国药典: 四部[M]. 北京: 中国医药科技出版社, 2020: 29-30. [31] 国家卫生和计划生育委员会. GB 2760-2014 食品添加剂使用标准[S]. 北京: 中国标准出版社, 2015. [32] Li C X, Zhao X H, Zuo W F, et al. Phytochemical profiles, antioxidant, and antiproliferative activities of four red- fleshed apple varieties in China[J]. Journal of Food Science,2020,85(3):718−726. doi: 10.1111/1750-3841.15056
[33] Zhao D D, Wei J, Hao J X, et al. Effect of sodium carbonate solution pretreatment on drying kinetics, antioxidant capacity changes, and final quality of wolfberry (Lycium barbarum) during drying[J]. LWT-Food Science and Technology,2019,99:254−261. doi: 10.1016/j.lwt.2018.09.066
[34] 中国农业部. NY/T 1051-2014 枸杞及枸杞制品[S]. 北京: 中国标准出版社, 2014. [35] Yuan X X, Yu Y S, Xu Y J, et al. Changes in quality attributes related to browning during storage of litchi juice fermented by Lactobacillus[J]. Food Research,2019,8(4):1−10. doi: 10.5539/jfr.v8n4p1
[36] Bely M , Stoeckle P , I Masneuf-Pomarède, et al. Impact of mixed Torulaspora delbrueckii-Saccharomyces cerevisiae culture on high-sugar fermentation[J]. International Journal of Food Microbiology,2008,122(3):312−320. doi: 10.1016/j.ijfoodmicro.2007.12.023
[37] Russell N J, Gould G W. Food Preservatives[M]. Kluwer Academic/Plenum, NewYork, 2003, 85−101.
-
期刊类型引用(24)
1. 张娜,刘丽,李璐,吕京京,董益阳. 青胶蒲公英根多酚超声辅助提取工艺优化及其体外抗氧化、降糖活性. 食品工业科技. 2024(17): 200-208 .  本站查看
本站查看
2. 李梅婷,赵泽帆,张晓静,陈宝怡,卢乐怡,张喆,董林欣,王静,肖国丹,张绮玥. 余甘子多酚提取工艺优化研究. 质量安全与检验检测. 2024(04): 85-91 .  百度学术
百度学术
3. 郝晓华,宋雅林,刘可心. 响应面法优化酸提取荷叶中生物碱的工艺研究. 太原师范学院学报(自然科学版). 2024(03): 56-64 .  百度学术
百度学术
4. 李泽洋,黄华,肖善芳,郭松. 半边风多酚提取工艺优化及其抗氧化和抗菌活性研究. 饲料研究. 2024(19): 102-107 .  百度学术
百度学术
5. 李宏,唐中伟,袁建琴,刘亚令,李友莲. 正交设计与响应面法优化甘草多糖提取工艺的研究. 轻工科技. 2023(01): 4-9 .  百度学术
百度学术
6. 张腊腊,胡浩斌,韩明虎,王玉峰,武芸. 响应面优化黄花菜多酚提取工艺及其抗氧化活性研究. 中国食品添加剂. 2023(02): 102-108 .  百度学术
百度学术
7. 郑佳,王军茹,张根生,马书青. 花楸果多酚物质提取及抗氧化性的研究. 中国林副特产. 2023(01): 9-14 .  百度学术
百度学术
8. 赵敏,战祥,徐茜,李泽璠,周立新. 响应面法优化五倍子多酚的提取工艺. 湖北大学学报(自然科学版). 2023(02): 294-300 .  百度学术
百度学术
9. 陈婷,段宙位. 柠檬皮中多酚的超声辅助提取及其抗氧化性研究. 食品科技. 2023(02): 246-252 .  百度学术
百度学术
10. 张园园,刘畅,邵颖,肖付刚. 信阳茶油提取工艺优化及脂肪酸组成分析. 食品研究与开发. 2023(13): 153-159 .  百度学术
百度学术
11. 林志銮,张传海. 多花黄精多酚工艺条件优化及其抗氧化活性评价. 广州化工. 2023(08): 45-49+73 .  百度学术
百度学术
12. 苏泾涵,王改萍,刘玉华,戚亚,彭大庆,李守科,曹福亮. 叶用文冠果总多酚提取工艺及抗氧化活性分析. 南京林业大学学报(自然科学版). 2023(05): 129-137 .  百度学术
百度学术
13. 李科鹏,冯玉会,普开仙,李锐扬,戴应淑,师伟,李琛. 正红菇多酚的提取及抗氧化性能研究. 广州化工. 2023(19): 11-15 .  百度学术
百度学术
14. 张立攀,王俊朋,钱佳英,赵梦瑶,李冰,王春杰,胡桂芳,王法云,王永. 超声辅助法提取牡丹花中总黄酮和总多酚的工艺优化. 食品安全质量检测学报. 2022(02): 567-575 .  百度学术
百度学术
15. 王燕,刘书伟,张田田,侯亚楠,沈梦霞. 槟榔多酚提取工艺的优化. 海南热带海洋学院学报. 2022(02): 25-31 .  百度学术
百度学术
16. 吴卫成,忻晓庭,张程程,刘大群,卢立志,胡宏海,章检明,张治国,郭阳. 番薯叶多酚提取工艺优化及其生物活性研究. 中国食品学报. 2022(05): 189-199 .  百度学术
百度学术
17. 仵菲,买里得尔·叶拉里,白红进. 响应面法优化库尔勒香梨各部位总多酚提取工艺及抗氧化活性研究. 塔里木大学学报. 2022(02): 16-23 .  百度学术
百度学术
18. 王琳,冉佩灵,熊双丽,李安林. 超高压腌制对烤制猪肉品质的影响. 食品工业科技. 2022(15): 19-26 .  本站查看
本站查看
19. 舒玉凤,卢静静,陈旭. 蒲公英多糖提取及其抗氧化活性研究. 现代农业科技. 2022(15): 186-189+193 .  百度学术
百度学术
20. 马妮,刘慧燕,方海田,胡海明,辛世华,杨小萍,刘洪涛. 红枣多酚提取工艺优化、成分及抗氧化活性分析. 食品工业科技. 2022(16): 246-254 .  本站查看
本站查看
21. 舒玉凤,卢静静,陈旭. 超声辅助法提取蒲公英多糖及抗氧化活性研究. 农产品加工. 2022(13): 42-46 .  百度学术
百度学术
22. 张星和,侯洪波,邹章玉,冯李院,汪玉洁. 高黎贡山紫果西番莲果皮中原花青素的提取工艺及其稳定性. 食品研究与开发. 2022(20): 147-155 .  百度学术
百度学术
23. 林宝妹,邱珊莲,吴妙鸿,张帅,李海明,洪佳敏. 嘉宝果果皮多酚提取工艺优化及生物活性测定. 江苏农业科学. 2021(21): 191-196 .  百度学术
百度学术
24. 宋姗姗,杨艾华,王微微,徐东林,杨倩军,陈杨,林子涵,王小敏. 火炭母提取物抗氧化性及稳定性研究. 中国食品添加剂. 2021(12): 23-30 .  百度学术
百度学术
其他类型引用(6)










 下载:
下载:

 下载:
下载:



