Inhibitory Mechanism of Epsilon-poly-L-Lysine against Botrytis cinerea in Apples
-
摘要: 为研究ε-聚赖氨酸(ε-PL)对苹果灰霉病菌Botrytis cinerea的抑制效果及其机制。用不同浓度的ε-PL处理B. cinerea,研究其对B. cinerea的菌落直径、孢子萌发、菌丝生长及对苹果灰霉病防治效果的影响,同时考察B. cinerea细胞通透性、抗氧化酶活性、细胞可溶性蛋白与核酸的泄漏、丙二醛含量及活性氧的变化规律。结果表明:ε-PL对B. cinerea的最小抑菌浓度为400 mg/L,该浓度的ε-PL能有效控制苹果灰霉病;100 mg/L以上的ε-PL能显著抑制B. cinerea孢子萌发和菌丝生长(P<0.05),破坏孢子膜结构,增大孢子细胞的通透性,造成可溶性蛋白与核酸发生泄漏,使孢子形态呈现萎缩干瘪、甚至溶解现象;此外,100 mg/L以上的ε-PL能显著降低B. cinerea的超氧化物歧化酶、多酚氧化酶和过氧化氢酶的活性,升高丙二醛含量(P<0.05)。综上,ε-PL能通过破坏B. cinerea孢子细胞膜结构、增大细胞通透性、抑制抗氧化酶活性、促进活性氧的积累,进而增大孢子膜的脂质过氧化程度,损伤孢子结构,最终抑制苹果灰霉病菌的生长。此项研究可为ε-PL在苹果采后病害防治中的应用打下基础,具有较高的应用价值。Abstract: The aim of the study was to investigate the inhibitory effect and mechanism of ε-poly-L-lysine on Botrytis cinerea causing gray mold in apples. The effects of different concentrations of ε-PL on colony diameter, spore germination, mycelial growth of B. cinerea, and its effect on controlling gray mold in apples were studied. The changes in cell permeability, antioxidant enzyme activities, cellular soluble protein and nucleic acid leakage, malonaldehyde content, and reactive oxygen species of B. cinerea were also investigated. The results showed that the minimum inhibitory concentration of ε-PL against B. cinerea was 400 mg/L, and the concentration of ε-PL could effectively control gray mold in apples. ε-PL concentration above 100 mg/L could significantly inhibit the spore germination and mycelium growth of B. cinerea (P<0.05), damage the spore membrane structure, and cause the leakage of soluble protein and nucleic acid, resulting in atrophic, small, and even dissolving spores. In addition, ε-PL concentration above 100 mg/L could significantly reduce the activities of superoxide dismutase, polyphenol oxidase, and catalase of B. cinerea and increase the content of malonaldehyde (P<0.05). In conclusion, ε-PL could damage the cell membrane structure of B. cinerea spores, increase cell permeability, and inhibit the activities of antioxidant enzymes, promote the accumulation of reactive oxygen species. This increased the degree of lipid peroxidation of the spore membrane, damaged the spore structure, and ultimately inhibited the growth of B. cinerea. This study laid a foundation for applying ε-PL in the prevention and control of postharvest diseases of apples and had high application value.
-
苹果酸甜可口、营养丰富,深受人们喜爱。苹果在采摘和运输中极易受到机械损伤,而被真菌侵染。每年,由B. cinerea侵染苹果引起的灰霉病腐烂,给我国带来了巨大的经济损失[1−2]。目前,国内主要依赖化学杀菌剂来防治苹果灰霉病,效果虽好,但存在环境污染和食品安全问题。为此,研发安全、高效的苹果采后病害防治方法具有较高的应用价值。
ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)是一种天然无毒的多肽化合物,具有较强的抗菌效力,通常由25~35个赖氨酸通过α-碳原子上的羧基和ε-碳原子上氨基脱水缩合而成,进入人体后可分解为人体必需氨基酸——赖氨酸[3−4]。近年来,ε-PL在果蔬采后病害防治领域研究也已有开展。Zhang等[5]研究发现,ε-PL通过激活氨基酸代谢和酚类化合物的生物合成,提高柑橘对采后绿霉病的抗病性。Shu等[6]研究结果表明,500 mg/L的ε-PL能有效控制采后苹果、冬枣和番茄的黑斑病。Jiao等[7]报道了ε-PL能显著抑制草莓、樱桃番茄、葡萄和青椒的灰霉病的发生。刘志恬等[8]研究了ε-PL对梨果实黑斑病菌Alternaria alternata的抑制机理,结果发现ε-PL通过破坏A. alternata孢子细胞膜结构和线粒体完整性来抑制A. alternata的致病性。Li等[9]研究发现,ε-PL通过影响苹果葡萄糖苷酸的积累,减缓组织pH的下降,从而影响扩展青霉的致病性,这是首次从有机酸的角度阐明ε-PL干扰扩展青霉致病性的机理。Wu等[10]研究表明,ε-PL能抑制水果炭疽病菌孢子萌发和芽管伸长,破坏炭疽病菌细胞膜,导致细胞内容物渗漏、细胞膜脂质过氧化和线粒体损伤,从而降低炭疽病菌对水果的致病力。
目前,ε-PL在控制苹果采后灰霉病及其机制方面的研究较为少见,且研究不够深入。本工作采用不同浓度的ε-PL在苹果体内处理B.cinerea,研究其对苹果采后灰霉病防治效果,分别利用PDA和PDB培养基,研究ε-PL对B.cinerea菌落生长、孢子萌发和菌丝生长的影响。采用2',7'-二氯二氢荧光素二乙酸酯(2',7'-Dichlorodihydro Fluorescein Diacetate,DCFH-DA)染色和碘化丙啶(Propidium Iodide,PI)染色结合扫描电镜(Scanning Electron Microscopy,SEM)观察,研究 ε-PL对B.cinerea的活性氧(Reactive Oxygen Species,ROS)释放、细胞膜完整性及菌丝形态的影响,通过测定B.cinerea抗氧化酶活性、丙二醛(Malonaldehyde,MDA)含量、胞外电导率、可溶性蛋白与核酸泄漏情况,进一步验证ε-PL对B.cinerea的ROS释放、细胞膜完整性及细胞通透性的影响。本研究成果将为苹果采后灰霉病的防治提供实验参考,具有较高的实践意义。
1. 材料与方法
1.1 材料与仪器
供试水果为商品熟苹果(Malus×domestica Borkh,cv. Fuji) 采自山东烟台某果园,选择未经化学处理,大小基本一致,无病虫害和未受机械损伤的苹果;NaClO、戊二醛、DCFH-DA、PI 分析纯,淮安科密化学试剂有限公司;ε-PL 化学纯,美国sigma公司;超氧化物歧化酶活性检测试剂盒、多酚氧化酶活性检测试剂盒、过氧化氢酶活性检测试剂盒、MDA检测试剂盒 生工(上海)公司。
JY88-IIN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;D-50型移液器 德国BRAND公司;CFX96型荧光定量PCR仪 美国Biosystems公司;JIDI-16R型冷冻离心机 广州吉迪仪器有限公司;JSF-7001型热场发射扫描电子显微镜 日本电子株式会社;LHP-400型恒温恒湿培养箱 常州普天仪器制造有限公司;HT-1112M型立式恒温摇床 上海赫田科学仪器有限公司;TA-XT2i型物性仪 英国Stable Micro System公司。
1.2 实验方法
1.2.1 材料处理
供试苹果用0.2%(V/V)的NaClO浸洗60 s,无菌水清洗后,备用。供试病原菌是从自然发病的苹果上分离、纯化一株病原菌,经鉴定为B. cinerea。将B. cinerea孢子接种于PDB培养基中,25 ℃振荡培养18 h后,取0.1 mL孢子悬液均匀涂布于PDA表面,25 ℃下继续培养7 d。用无菌钢制角匙轻刮表面孢子,加入无菌水后再用移液器吸取孢子悬液过4层无菌纱布,用血球计数板法测定孢子浓度,并用无菌水调至1×105 spores/mL,备用[11−12]。
1.2.2 ε-PL处理对B. cinerea抑菌活性的测定
将用无菌水配制的ε-PL储备液加入经灭菌并冷却至60 ℃左右的PDA培养基中,使其终浓度为50、100、200和400 mg/L,以无菌水为对照(Control Group,CK),制作平板培养基。用灭菌打孔器在平板中央打一个孔,大小为4 mm×4 mm,每孔接种30 μL浓度为1×105 spores/mL的B. cinerea孢子悬液,于25 ℃下恒温培养4 d,每隔1 d观察菌落生长情况,将48 h内无菌落生长的处理组 ε-PL浓度定为其对B. cinerea的最低抑菌浓度(Minimal Inhibitory Concentration,MIC)[13]。同时,用十字交叉法在平板底面测定菌落直径,菌落直径为实测直径扣除初始打孔孔径。
1.2.3 B. cinerea孢子萌发率和牙管长度的测定
取适量ε-PL加入PDB培养基中,使其终浓度分别为0、50、100、200和400 mg/L,再按照1×105 spores/mL的接种量接种B. cinerea孢子悬液,于25 ℃、160 r/min下振荡培养。在培养9、12和18 h后取样,分别测定孢子萌发量和芽管长度,并按式(1)计算孢子萌发率。随机观察3次,每次观察孢子200个左右,实验重复2次[11−12]。
孢子萌发率(%)=萌发孢子数总孢子数×100 (1) 1.2.4 ε-PL处理后B. cinerea 菌丝形态观察
采用1.2.3培养物,在培养18 h后取样,于10000 r/min下离心2 min,沉淀物用50 mmol/L、pH7.8的无菌磷酸盐缓冲溶液(Phosphate Buffered Solution, PBS)洗涤1次。将收集到的沉淀物于4 ℃下用2.5%的戊二醛溶液避光固定3 h,离心并用上述PBS洗涤3次。依次用60%、90%和100%(V/V)的乙醇溶液浸洗1次,每次2 min[1,11,13]。将样品置于3 mm×5 mm的矩形盖玻片上,再将盖玻片用导电胶固定于SEM样品台上,置于真空冷冻干燥机干燥1 d后喷金,用SEM观察ε-PL对B. cinerea孢子和菌丝形态的影响。
1.2.5 B. cinerea细胞抗氧化酶活性及MDA含量的测定
参照1.2.3方法,将培养6、9、12和18 h后的菌体转移至离心管内,4 ℃、10000 r/min离心2 min,收集菌体,加入相应试剂盒提取液,冰浴下超声破碎菌体(功率200 W、超声时间3 s、间隔10 s、重复30次),于4 ℃、10000 r/min离心10 min,取上清液,按照试剂盒步骤分别测定多酚氧化酶(Polyphenol Oxidase,PPO)、过氧化氢酶(Catalase,CAT)、超氧化物歧化酶(Superoxide Dismutase,SOD)酶活性及MDA含量。
1.2.6 B. cinerea孢子内ROS和细胞膜完整性的测定
参照1.2.3方法,将培养9 h后的培养物转移至离心管内,4 ℃、8000 r/min离心3 min,沉淀用上述PBS洗涤3次,再分别置于10 μmoL/L的DCFH-DA和10 mg/L的PI溶液中,于37 ℃、120 r/min摇床培养箱中避光染色20 min[14−16]。染色结束后,立即在荧光显微镜下观察B. cinerea细胞ROS释放和细胞完整性,随机选择视野拍照,并按式(2)和(3)分别计算孢子ROS释放率和孢子损伤率[16]。
孢子ROS释放率(\%)=释放ROS孢子数孢子总数×100 (2) 孢子损伤率(%)=受损孢子数孢子总数×100 (3) 1.2.7 B. cinerea 孢外电导率和细胞泄漏的测定
参照Pu等[17]和Cui等[18]的方法,略作调整,测定B. cinerea孢外电导率;参考Zhu等[19]和Cai等[20]的方法,略作调整,测定B. cinerea细胞泄露情况。将1×105 spores/mL的B. cinerea孢子悬液按照10%(V/V)的接种量接种于PDB培养基中,于25 ℃、160 r/min下培养3 d。培养物于8000 r/min下离心3 min,收集菌丝体并用上述PBS洗涤3次,转移至100 mL终质量浓度分别为0、100、200和400 mg/L的ε-PL溶液中,于25 ℃、160 r/min下处理5 h,每隔1 h同时取样两份。一份样品用于测定其电导率,另一份样品于8000 r/min下离心3 min,取上清液测定B. cinerea胞外核酸和可溶性蛋白含量。
1.2.8 ε-PL直接处理对苹果灰霉病腐烂的影响
用打孔器在苹果中央均匀打孔4个,大小5 mm×4 mm,处理组苹果每孔分别注入25 μL浓度为400 mg/L的ε-PL,CK采用无菌水,待吸干后,每孔立即接入25 μL浓度为1×105 spores/mL的B. cinerea孢子悬浮液[21−23]。所有供试苹果置于无菌框中,PE膜封闭,并于20 ℃、相对湿度(Relative Humidity,RH)95%下贮存。从第3 d开始,每隔1 d,采用十字交叉法测定伤口腐烂直径,按式(4)统计并计算腐烂率。
腐烂率(%)=腐烂伤口数伤口总数×100 (4) 1.3 数据处理
采用SPSS处理数据,用Duncan多重比较进行方差分析,数据用平均数±标准差表示,P<0.05代表显著差异。每个实验处理使用12个苹果,每个处理设置3个平行,实验重复2次。
2. 结果与分析
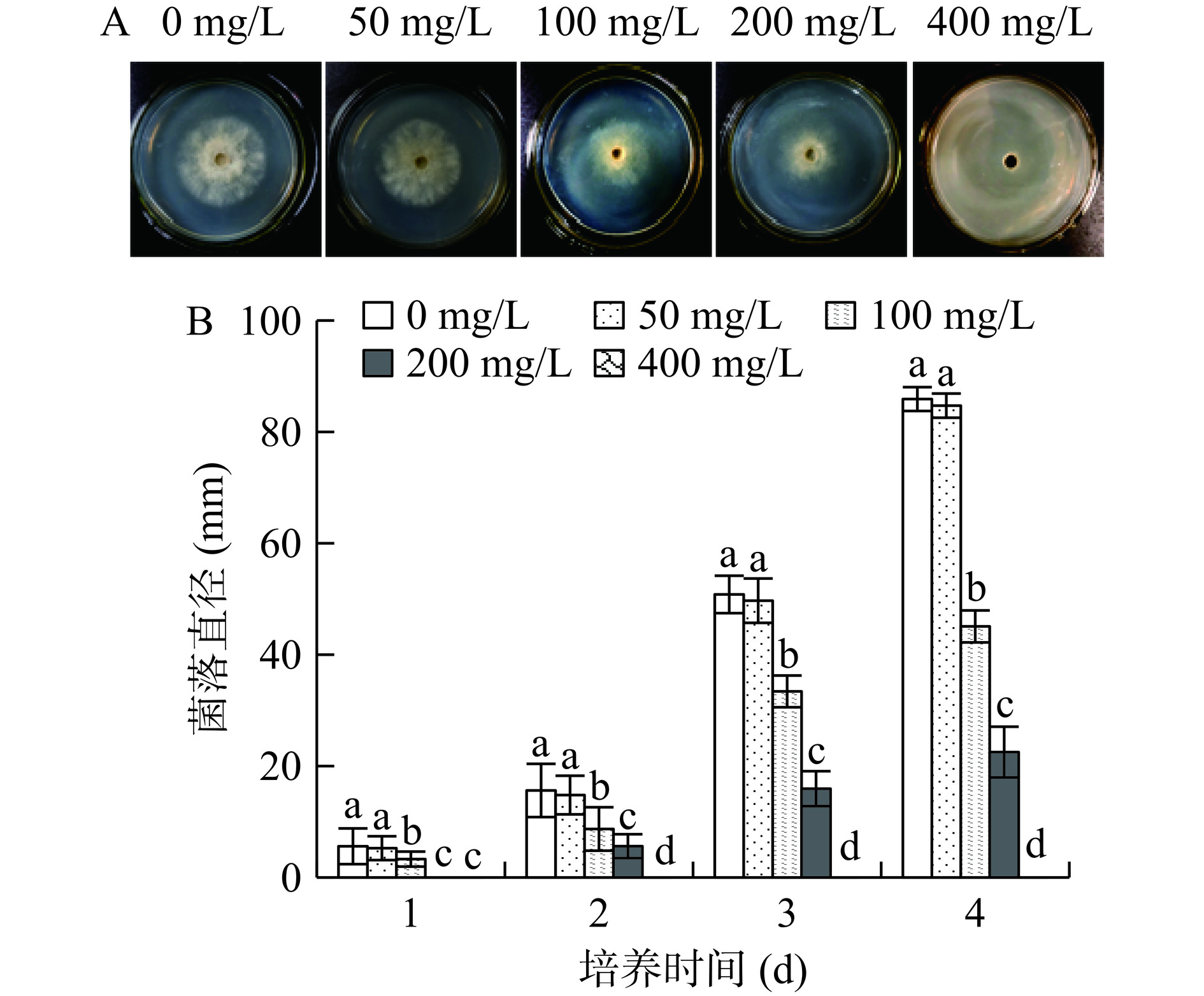
2.1 不同浓度的ε-PL对B. cinerea菌丝生长的抑制效果
图1A是B. cinerea在含不同浓度ε-PL的PDA中培养2 d的菌丝生长情况。由图1A和图1B可知,50 mg/L的ε-PL处理组菌落直径与CK差异不显著(P>0.05),ε-PL浓度为100、200 mg/L的处理组菌落直径显著低于CK(P<0.05),且随着ε-PL浓度的增加,菌落直径越小。从图1B可以看出,浓度在100 mg/L以上的ε-PL对B. cinerea菌丝生长具有显著抑制作用(P<0.05),且随着浓度的增大,ε-PL对B. cinerea菌丝生长的抑制效果不断增强。培养2 d后,400 mg/L的处理组未出现菌落生长,表明ε-PL对B. cinerea的MIC为400 mg/L。
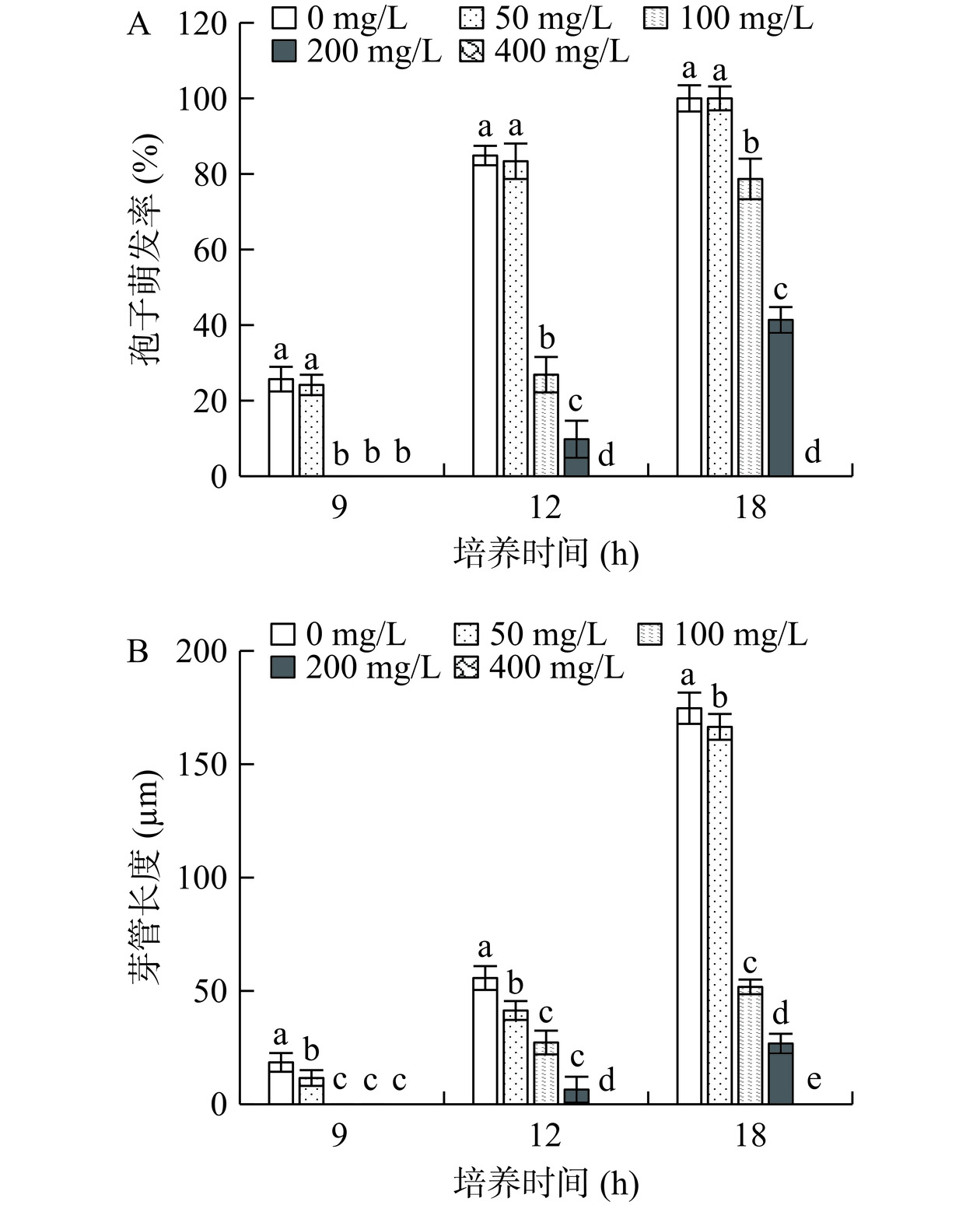
2.2 ε-PL处理对B. cinerea孢子萌发和芽管伸长的影响
为研究ε-PL处理在液体培养基PDB中对B. cinerea的抑制效果,考察其对孢子萌发率和芽管伸长的影响。如图2A所示,50 mg/L的ε-PL处理后的B. cinerea孢子萌发率与CK相比差异不显著(P>0.05)。100、200、400 mg/L的ε-PL能显著抑制B. cinerea孢子萌发(P<0.05),其中400 mg/L的ε-PL处理组B. cinerea孢子未见萌发;在培养18 h后,处理组孢子萌发率相对于CK依次降低了0、21.33%、58.64%和100%。从图2B可以看出,在培养的9、12和18 h,处理组的芽管长度均显著低于CK(P<0.05);在培养18 h后,处理组孢子芽管长度相对于CK依次降低了4.71%、70.36%、84.67%和100%。由此可见,质量浓度为100 mg/L及以上的ε-PL能显著抑制B. cinerea孢子萌发和芽管伸长,400 mg/L的ε-PL能完全抑制B. cinerea孢子萌发和芽管伸长。可能的原因是在PDB培养基中不同浓度的ε-PL处理能不同程度地损伤孢子细胞壁和细胞膜结构,造成孢子细胞内容物部分或全部流失,进而抑制了B. cinerea孢子的萌发和芽管伸长。由于50 mg/L的ε-PL处理对B. cinerea孢子萌发率和菌丝生长的影响与CK相比差异不显著(P>0.05),因此,不再继续研究该浓度ε-PL对后续实验指标的影响。
2.3 ε-PL处理对B. cinerea菌丝形态的影响
图3所示为不同浓度的ε-PL处理18 h后B. cinerea孢子和菌丝形态的SEM图。由图可知,CK的B. cinerea的孢子形态正常,并有部分萌发且芽管表面光滑;100 mg/L的ε-PL处理组较多孢子出现萎缩干瘪现象,结合图2和图3,可见其孢子萌发率显著低于CK(P<0.05);200 mg/L的ε-PL处理组局部基本未发现孢子萌发现象,孢子表面粗燥、干瘪、疑似表面有孢子内容物泄漏[16];400 mg/L的ε-PL处理组所有孢子均未萌发,大多数孢子形态模糊,显现出溶解状态[16],这一结果与Dou等[1]研究的ε-PL体外处理对扩展青霉孢子和菌丝形态的影响的研究结果相一致,表明ε-PL处理能够破坏B. cinerea孢子细胞壁和细胞膜结构,使其部分或完全失去细胞完整性,引起孢子内容物泄漏,造成孢子干瘪,损伤严重的孢子内容物以聚集物的形式附着在降解的孢子上,最终使孢子死亡或生长受到抑制。
2.4 ε-PL处理对B. cinerea细胞抗氧化酶活性及MDA含量的影响
抗氧化酶能有效清除细胞内过量的ROS,使得细胞免受氧化损伤[24]。从图4A可以看出,处理组SOD活性均显著低于CK(P<0.05),ε-PL浓度越大,SOD活性越低,且随着时间延长,活性持续降低,由此可见ε-PL能抑制B. cinerea分泌SOD,浓度越大、时间越长,抑制效果越好。由图4B可知,处理组CAT活性均显著低于CK(P<0.05),且ε-PL浓度越大,处理时间越长,CAT活性越低,可见ε-PL能抑制B. cinerea分泌CAT,400 mg/L的浓度抑制效果最佳。从图4C可以看出,随着处理时间延长,PPO活性不断下降,且各时间点酶活均显著低于CK(P<0.05),其中以400 mg/L处理组酶活最低,这说明ε-PL能抑制B. cinerea分泌PPO,且浓度越大抑制效果越好。MDA是机体内自由基过氧化膜脂质的终产物,能损伤细胞膜,具有细胞毒性,它是反映机体氧化损伤程度的重要指标[25−26]。由图4D可见,处理组的B. cinerea细胞内MDA含量随着处理时间延长而不断上升,且各时间点MDA含量均显著高于CK(P<0.05),其中以400 mg/L处理组MDA含量最高。由此可见,100 mg/L以上的ε-PL能显著抑制B. cinerea细胞内抗氧化酶活性,导致细胞内ROS无法被及时清除,细胞受到氧化损伤,使得MDA含量升高。这与包华等[27]研究胡椒碱对番茄灰霉病菌的抑制作用结果一致,表明上述结果的发生可能与ε-PL能破坏细胞构造,引起细胞损伤,造成抗氧化酶分泌受阻有关。
![]() 图 4 不同浓度的ε-PL对B. cinerea抗氧化酶活性及MDA含量的影响注:同一列折线图上方不同小写字母表示组间差异显著(P<0.05),图6同。Figure 4. Effect of various ε-PL concentrations on antioxidant enzyme activities and MDA content of B. cinerea
图 4 不同浓度的ε-PL对B. cinerea抗氧化酶活性及MDA含量的影响注:同一列折线图上方不同小写字母表示组间差异显著(P<0.05),图6同。Figure 4. Effect of various ε-PL concentrations on antioxidant enzyme activities and MDA content of B. cinerea2.5 ε-PL处理对B. cinerea孢子内ROS和细胞膜完整性的影响
DCFH-DA是一种能穿透细胞膜的染色剂,当其渗透至细胞内时,活细胞可以将其分解成DCFH,并被快速氧化生成绿色荧光产物DCF,通过荧光强弱,可用来检测活细胞的ROS释放量[16,21−22]。PI是一种常见的红色荧光核和染色体复染剂,它只能穿过受损的细菌膜,对死细胞具有渗透性,而对活细胞无渗透性,PI进入死细胞后,可与细胞中DNA结合,产生红色荧光,且荧光强度与DNA的含量呈正比,因此可根据荧光强度来判定细胞损伤情况[16,23,28]。由图5A、5C可知,随着 ε-PL质量浓度的提高,处理组绿色荧光强度逐渐增大,孢子ROS释放率逐渐上升,质量浓度400 mg/L的处理组孢子ROS释放率高达79.17%。由图5B、5D可知,随着 ε-PL质量浓度的提高,处理组红色荧光强度逐渐增大,孢子损伤率也逐渐上升,浓度为400 mg/L的处理组孢子损伤率最高,达77.18%。由此可见,ε-PL处理能引发B. cinerea孢子ROS释放,进而损伤细胞,且B. cinerea孢子ROS释放量和细胞完整性破坏程度与ε-PL处理浓度呈正相关。
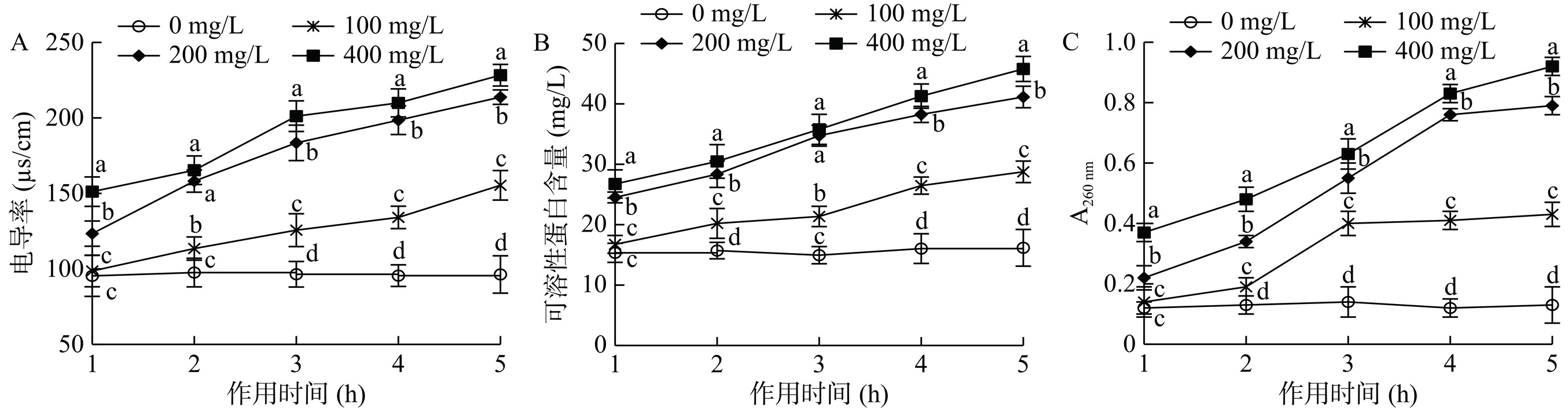
2.6 ε-PL处理对B. cinerea 细胞通透性和细胞泄漏的影响
电导率、可溶性蛋白含量、核酸含量的变化可以间接评价细胞膜的完整性,是反映细胞的受损程度的重要指标[27−30]。由图6可知,经 ε-PL处理后B. cinerea 孢外电导率、可溶性蛋白含量和核酸含量随时间延长不断升高,在作用的第1 h,100 mg/L处理组与CK相比无显著差异(P>0.05),而200 mg/L和400 mg/L处理组在作用时间5 h内电导率、可溶性蛋白含量和核酸含量均显著高于CK(P<0.05),且 ε-PL浓度越大,电导率、可溶性蛋白含量和核酸含量也越大,这说明ε-PL处理破坏了B. cinerea孢子细胞膜完整性,增大了细胞膜的通透性,造成细胞内容物泄漏,这一结果与本研究的SEM观察结果相一致。可见,ε-PL浓度越高,B. cinerea孢子细胞通透性越大,对B. cinerea细胞膜的损伤越大。
2.7 ε-PL直接处理对苹果采后灰霉病的控制效果
由图7可知,400 mg/L的ε-PL直接处理苹果再接种B. cinerea后,ε-PL处理组苹果腐烂率和腐烂直径显著低于CK(P<0.05)。图7B、7C显示,在贮藏的第6 d,苹果腐烂率和腐烂直径达到最大值,处理组苹果腐烂率相对于CK降低了74.64%,腐烂直径降低了73.19%。因此,400 mg/L的ε-PL直接处理苹果,能有效控制苹果采后灰霉病。
3. 讨论与结论
本研究发现,浓度高于100 mg/L的ε-PL对B. cinerea的菌落生长、孢子萌发和菌丝生长具有显著抑制效果(P<0.05),且抑制作用与ε-PL的浓度呈正相关。ε-PL对B. cinerea的MIC为400 mg/L,该浓度的ε-PL能有效控制苹果灰霉病。浓度在100 mg/L以上的ε-PL能破坏B. cinerea孢子膜结构,增大孢子细胞的通透性,使孢子细胞可溶性蛋白与核酸发生泄漏,进而出现形态萎缩干瘪、甚至溶解现象,结合PI染色和SEM结果,发现 ε-PL浓度越大,其对孢子的损伤程度越大。此外,浓度在100 mg/L以上的ε-PL能显著抑制B. cinerea的抗氧化酶SOD、PPO和CAT的活性(P<0.05),使其无法及时清除机体释放过量的ROS,加大孢子膜的脂质过氧化程度,破坏孢子膜结构,最终造成孢子细胞可溶性蛋白与核酸发生泄漏,从而抑制B. cinerea的生长,这与Li等[31]、Liu等[32]和林育钊等[33]的研究结论基本一致。本研究初步探讨了ε-PL抑制苹果灰霉病菌的生理机制,为 ε-PL在苹果采后病害防治中的提供理论基础,有助于ε-PL作为一种安全的食品防腐剂应用于苹果乃至其它水果采后病害防治和贮藏保鲜领域,具有较高的实际应用价值;但对其分子机制研究不够深入,今后将进一步开展 ε-PL对B. cinerea侵染基因表达和分子代谢途径的影响等分子层面的研究。
-
图 4 不同浓度的ε-PL对B. cinerea抗氧化酶活性及MDA含量的影响
注:同一列折线图上方不同小写字母表示组间差异显著(P<0.05),图6同。
Figure 4. Effect of various ε-PL concentrations on antioxidant enzyme activities and MDA content of B. cinerea
-
[1] DOU Y, ROUTLEDGE M N, GONG Y Y, et al. Efficacy of epsilon-poly-L-lysine inhibition of postharvest blue mold in apples and potential mechanisms[J]. Postharvest Biology and Technology,2021,171:111346. doi: 10.1016/j.postharvbio.2020.111346
[2] GE Y H, WEI M L, LI C Y, et al. Reactive oxygen species metabolism and phenylpropanoid pathway involved in disease resistance against Penicillium expansum in apple fruit induced by ε-poly-L-lysine[J]. Journal of the Science of Food and Agriculture,2018,98:5082−5088. doi: 10.1002/jsfa.9046
[3] 王馨渝, 安容慧, 赵安琪, 等. 真空预冷与雾化 ε-聚赖氨酸共处理对采后上海青品质的影响[J]. 食品科学技术学报,2022,40(6):103−115. [WANG X Y, AN R H, ZHAO A Q, et al. Effect of vacuum pre-cooling co-treated with atomized ε-polylysine on postharvest quality of pakchoi[J]. Journal of Food Science and Technology,2022,40(6):103−115.] WANG X Y, AN R H, ZHAO A Q, et al. Effect of vacuum pre-cooling co-treated with atomized ε-polylysine on postharvest quality of pakchoi[J]. Journal of Food Science and Technology, 2022, 40(6): 103−115.
[4] 林育钊, 陈蕾伊, 陈佳怡, 等. ε-聚赖氨酸对西番莲果实采后病害与抗病物质代谢的影响[J]. 食品科学,2024,45(3):142−149. [LIN Y Z, CHEN L Y, CHEN J Y, et al. Effect of ε-poly-L-lysine on postharvest diseases and disease-resistant substance metabolism in passion fruits[J]. Food Science,2024,45(3):142−149.] LIN Y Z, CHEN L Y, CHEN J Y, et al. Effect of ε-poly-L-lysine on postharvest diseases and disease-resistant substance metabolism in passion fruits[J]. Food Science, 2024, 45(3): 142−149.
[5] ZHANG X, DENG Q, WANG W, et al. Epsilon-poly-L-lysine increases disease resistance of citrus against postharvest green mold by activating amino acid metabolism and phenolic compounds biosynthesis[J]. Food Quality and Safety,2023,7:fyad010. doi: 10.1093/fqsafe/fyad010
[6] SHU C, CUI K B, LI Q, et al. Epsilon-poly-L-lysine (ε-PL) exhibits multifaceted antifungal mechanisms of action that control postharvest Alternaria rot[J]. International Journal of Food Microbiology,2021,348:109224. doi: 10.1016/j.ijfoodmicro.2021.109224
[7] JIAO W X, LIU X, CHEN Q M, et al. Epsilon-poly-L-lysine (ε-PL) exhibits antifungal activity in vivo and in vitro against Botrytis cinerea and mechanism involved[J]. Postharvest Biology and Technology,2020,168:111270. doi: 10.1016/j.postharvbio.2020.111270
[8] 刘志恬, 董玉鹏, 李永才, 等. ε-聚赖氨酸对梨果实黑斑病菌 Alternaria alternata的抑制作用及其机理[J]. 食品科学,2021,42(11):213−220. [LIU Z T, DONG Y P, LI Y C, et al. Antifungal effect of ε-polylysine on Alternaria alternata isolated from pears with black spot and its possible mechanism[J]. Food Science,2021,42(11):213−220.] LIU Z T, DONG Y P, LI Y C, et al. Antifungal effect of ε-polylysine on Alternaria alternata isolated from pears with black spot and its possible mechanism[J]. Food Science, 2021, 42(11): 213−220.
[9] LI Y, JIAO W, DU Y, et al. Involvement of organic acid in the control mechanism of ε-poly-L-lysine (ε-PL) on blue mold caused by Penicillium expansum in apple fruits[J]. Horticulturae,2022,8(6):468. doi: 10.3390/horticulturae8060468
[10] WU J, HU J, JIAO W, et al. Inhibitory effect of ε-poly-L-lysine on fruit Colletotrichum gloeosporioides through regulating organic acid metabolism and exerting membrane-targeted antifungal activity[J]. Postharvest Biology and Technology,2023,200:112339. doi: 10.1016/j.postharvbio.2023.112339
[11] RAORANE C J, RAJ V, LEE J H, et al. Antifungal activities of fluoroindoles against the postharvest pathogen Botrytis cinerea:In vitro and in silico approaches[J]. International Journal of Food Microbiology,2022,362:109492. doi: 10.1016/j.ijfoodmicro.2021.109492
[12] ZHAO S X, GUO Y H, WANG Q N, et al. Antifungal effects of lycorine on Botrytis cinerea and possible mechanisms[J]. Biotechnology Letters,2021,43:1503−1512. doi: 10.1007/s10529-021-03128-8
[13] XU Y Y, WEI J Y, WEI Y Y, et al. Tea tree oil controls brown rot in peaches by damaging the cell membrane of Monilinia fructicola[J]. Postharvest Biology and Technology,2021,175:111474. doi: 10.1016/j.postharvbio.2021.111474
[14] SU R H, Li T F, FAN D, et al. The inhibition mechanism of ε-polylysine against Bacillus cereus emerging in surimi gel during refrigerated storage[J]. Journal of the Science of Food and Agriculture,2019,99(6):2922−2930. doi: 10.1002/jsfa.9505
[15] LI J K, LEI H H, SONG H M, et al. 1-Methylcyclopropene (1-MCP) suppressed postharvest blue mold of apple fruit by inhibiting the growth of Penicillium expansum[J]. Postharvest Biology and Technology,2017,125:59−64. doi: 10.1016/j.postharvbio.2016.11.005
[16] 窦勇. ε-聚赖氨酸对苹果采后青霉病的控制及其机制研究[D]. 镇江:江苏大学, 2023. [DOU Y. Investigation of ε-poly-L-lysine inhibition of postharvest blue mold in apples and its potential mechanisms[D]. Zhengjiang:Jiangsu University, 2023.] DOU Y. Investigation of ε-poly-L-lysine inhibition of postharvest blue mold in apples and its potential mechanisms[D]. Zhengjiang: Jiangsu University, 2023.
[17] PU T, SHI J, TAO L H, et al. Mechanism of antifungal activity of piperine against Botrytis cinerea[J]. Chiang Mai Journal of Science,2023,50(2):1−13.
[18] CUI H Y, ZHANG C H, LI C Z, et al. Antimicrobial mechanism of clove oil on Listeria monocytogenes[J]. Food Control,2018,94:140−146. doi: 10.1016/j.foodcont.2018.07.007
[19] ZHU Y L, LI C Z, CUI H Y, et al. Antimicrobial mechanism of pulsed light for the control of Escherichia coli O157:H7 and its application in carrot juice[J]. Food Control,2019,106:106751. doi: 10.1016/j.foodcont.2019.106751
[20] CAI J H, CHEN J, LU G B, et al. Control of brown rot on jujube and peach fruits by trisodium phosphate[J]. Postharvest Biology and Technology,2015,99:93−98. doi: 10.1016/j.postharvbio.2014.08.003
[21] YU D L, ZHA Y Y, ZHONG Z, et al. Improved detection of reactive oxygen species by DCFH-DA:New insight into self-amplification of fluorescence signal by light irradiation[J]. Sensors and Actuators B:Chemical,2021,339:129878. doi: 10.1016/j.snb.2021.129878
[22] REZA-ZALDIVAR E E, BOJORQUEZ-RODRIGUEZ E M, JACOBO-VELAZQUEZ D A. Wounding stress enhances the anti-obesogenic, anti-inflammatory, and antioxidant properties of carrots (Daucus carota)[J]. Journal of Agriculture and Food Research,2024,16:101155. doi: 10.1016/j.jafr.2024.101155
[23] ROSENBERG M, AZEVEDO N F, IVASK A. Propidium iodide staining underestimates viability of adherent bacterial cells[J]. Scientific Reports,2019,9:6483. doi: 10.1038/s41598-019-42906-3
[24] YAO J, GENG X, ZHENG H, et al. Study on the inhibitory mechanism of fig leaf extract against postharvest Fusarium in melon[J]. PeerJ,2024,12:e17654. doi: 10.7717/peerj.17654
[25] ILEA M I M, ZAPATA P J, FERNANDEZ-PICAZO C, et al. Chlorogenic acid as a promising tool for mitigating chilling injury:Cold tolerance and the ripening effect on tomato fruit (Solanum lycopersicum L.)[J]. Plants,2024,13(15):2055. doi: 10.3390/plants13152055
[26] 翁甜, 王昱晴, 龙超安. 香叶醇对柑橘酸腐病菌的抑菌机制[J]. 食品科学,2023,44(1):14−21. [WENG T, WANG Y Q, LONG C A. Inhibitory mechanism of geraniol against Geotrichum citri-aurantii in citrus[J]. Food Science,2023,44(1):14−21.] doi: 10.7506/spkx1002-6630-20220214-087 WENG T, WANG Y Q, LONG C A. Inhibitory mechanism of geraniol against Geotrichum citri-aurantii in citrus[J]. Food Science, 2023, 44(1): 14−21. doi: 10.7506/spkx1002-6630-20220214-087
[27] 包华, 李康, 钟睦琪, 等. 胡椒碱对番茄灰霉病菌抑制作用及其机理研究[J]. 中国农业大学学报,2022,27(9):117−124. [BAO H, LI K, ZHONG M Q, et al. Inhibitory effect of piperine on Botrytis cinerea and its mechanism[J]. Journal of China Agricultural University,2022,27(9):117−124.] BAO H, LI K, ZHONG M Q, et al. Inhibitory effect of piperine on Botrytis cinerea and its mechanism[J]. Journal of China Agricultural University, 2022, 27(9): 117−124.
[28] ZHANG Y, REYMICK O O, DUAN B, et al. Combination of cinnamaldehyde/β-cyclodextrin inclusion complex and L-phenylalanine effectively reduces the postharvest green mold in citrus fruit[J]. Pesticide Biochemistry and Physiology,2024,204:106040.
[29] 张鹏, 康丹丹, 贾晓昱, 等. 精准温控贮藏对西兰花采后品质和生理变化的影响[J]. 食品科学技术学报,2021,39(6):115−125. [ZHANG P, KANG D D, JIA X Y, et al. Effects of precise temperature control storage on postharvest quality and physiological changes of broccoli[J]. Journal of Food Science and Technology,2021,39(6):115−125.] doi: 10.12301/j.issn.2095-6002.2021.06.013 ZHANG P, KANG D D, JIA X Y, et al. Effects of precise temperature control storage on postharvest quality and physiological changes of broccoli[J]. Journal of Food Science and Technology, 2021, 39(6): 115−125. doi: 10.12301/j.issn.2095-6002.2021.06.013
[30] SONG R, WANG X, JIAO L, et al. Epsilon-poly-L-lysine alleviates brown blotch disease of postharvest Agaricus bisporus mushrooms by directly inhibiting Pseudomonas tolaasii and inducing mushroom disease resistance[J]. Pesticide Biochemistry and Physiology,2024,199:105759. doi: 10.1016/j.pestbp.2023.105759
[31] LI H, HE C, LI G, et al. The modes of action of epsilon-polylysine (ε-PL) against Botrytis cinerea in jujube fruit[J]. Postharvest Biology and Technology,2019,147:1−9. doi: 10.1016/j.postharvbio.2018.08.009
[32] LIU C, LIU H, WANG C, et al. Antifungal activity and mechanisms of ε-poly-L-lysine (ε-PL) against Colletotrichum lagenarium in marrow squash[J]. LWT,2024,199:116057. doi: 10.1016/j.lwt.2024.116057
[33] 林育钊, 彭泽甜, 陈洪彬, 等. ε-聚赖氨酸对西番莲果腐病菌可可毛色二孢的抑制作用及其机理[J]. 食品工业科技,2024,45(16):191−200. [LIN Y Z, PENG Z T, CHEN H B, et al. Antifungal effects of ε-poly-L-lysine on Lasiodiplodia theobromae causing fruit rot of Passiflora caerulea L. and its mechanism[J]. Science and Technology of Food Industry,2024,45(16):191−200.] LIN Y Z, PENG Z T, CHEN H B, et al. Antifungal effects of ε-poly-L-lysine on Lasiodiplodia theobromae causing fruit rot of Passiflora caerulea L. and its mechanism[J]. Science and Technology of Food Industry, 2024, 45(16): 191−200.





 下载:
下载:




 下载:
下载:



