Interaction between Ellagic Acid from Pomegranate Peel and Corn Starch and Its Mechanism of Inhibiting Starch Digestibility
-
摘要: 目的:探究鞣花酸的添加对玉米淀粉各种理化特性的影响,并讨论其相互作用的机理及鞣花酸-玉米淀粉复合物消化特性改变的机制。方法:先分析在不同水平鞣花酸存在的条件下,鞣花酸对淀粉糊化特性、流变特性、糊化热特性、溶解度膨胀度的影响;再通过傅里叶变换红外光谱、X射线衍射、核磁共振波谱进行鞣花酸-玉米淀粉复合物结构表征,解释相互作用的机理;进行复合物体外消化指标和酶抑制率实验,探究复合物消化特性改变的机制。结果:鞣花酸的添加使淀粉峰值黏度提高了27.33%,且促进了玉米淀粉的短期回生;鞣花酸的加入导致玉米淀粉储能模量(G')、损耗模量(G'')下降、损耗因子(tanδ)增加,弱化了淀粉糊的凝胶结构;鞣花酸可以增加玉米淀粉的糊化温度,且糊化焓值(ΔH)从10.1 J/g降低至9.34 J/g;鞣花酸还将玉米淀粉的溶解度由6.86%提高到9.65%。此外,X射线衍射图谱显示鞣花酸与玉米淀粉未形成V型包涵体复合物;红外光谱3400 cm−1附近的峰发生红移;核磁共振波谱中OH-3、OH-2和OH-6的化学位移移动到高场,充分说明鞣花酸通过非共价键,尤其是氢键与淀粉相互作用。复合物抗性淀粉含量由54.83%提高到67.39%,并且鞣花酸对ɑ-葡萄糖苷酶显示出明显的剂量依赖型抑制,但是对ɑ-淀粉酶无明显抑制作用。结论:鞣花酸显著改变了玉米淀粉的理化性质,氢键被确定为鞣花酸和玉米淀粉之间主要的相互作用力;淀粉结构的改变和鞣花酸对ɑ-葡萄糖苷酶的抑制能力,导致了复合物消化率的降低。本研究有助于更深入地了解鞣花酸与淀粉相互作用和降低淀粉消化率的机制,并且可为开发新型低血糖指数淀粉基食品提供一定的理论指导。Abstract: Objective: To explore the effect of ellagic acid on the physicochemical properties of corn starch and assess the mechanisms of its interaction and of the change in the digestive properties of the ellagic acid-corn starch complex. Methods: First, the effects of ellagic acid on starch gelatinization viscosity, rheological properties, gelatinization heat properties, and solubility expansion were analyzed using different levels of ellagic acid. The structure of the ellagic acid-corn starch complex was characterized using Fourier transform infrared spectroscopy (FT-IR), X-ray diffraction (XRD), and nuclear magnetic resonance spectroscopy (NMRS) to elucidate the interaction mechanism. The in vitro digestion index and enzyme inhibition rate of the complex were analyzed to explore the mechanism of the change in the digestion characteristics of the complex. Results: The addition of ellagic acid increased the peak viscosity of corn starch by 27.33% and promoted its short-term retrogradation. In addition, the storage and loss moduli of corn starch decreased, loss factor was increased, and gel structure of starch paste was weakened. Ellagic acid increased the gelatinization temperature of corn starch and the gelatinization enthalpy decreased from 10.1 to 9.34 J/g. The solubility of corn starch was also increased from 6.86% to 9.65%. In addition, XRD showed that ellagic acid and corn starch did not form a V-type inclusion complex, whereas FTIR showed that the peak near 3400 cm−1 was red-shifted. In the NMR spectrum, the chemical shifts of OH-3, OH-2, and OH-6 moved to the high field, indicating that ellagic acid interacts with starch through non-covalent bonds, especially hydrogen bonds. The resistant starch content in the complex increased from 54.83% to 67.39%, and ellagic acid exhibited significant dose-dependent inhibition of ɑ-glucosidase; however, no significant inhibitory effect on ɑ-amylase was observed. Conclusions: Ellagic acid significantly altered the physicochemical properties of corn starch, and hydrogen bonding was identified as the primary interaction force between ellagic acid and corn starch. The change in the starch structure and inhibitory ability of ellagic acid on ɑ-glucosidase decreased the digestibility of the complex. This study contributes to a deeper understanding of the mechanism of the interaction between ellagic acid and corn starch and the reduction of starch digestibility. In addition, theoretical guidance is provided for the development of novel starch-based foods with a low glycemic index.
-
淀粉是人类饮食中最常见的食物成分之一,它由直链淀粉和支链淀粉组成,其中直链淀粉是一种由ɑ-1,4-糖苷键连接的线性聚合物,而支链淀粉是由ɑ-1,6和ɑ-1,4-糖苷键组成的支链大分子[1]。它的糊化、回生以及与食品体系中其他物质的相互作用对于许多富含淀粉的食品的质量至关重要[2]。然而天然淀粉由于自身固有的局限性,如水溶性差、糊化性能差、热稳定性差和易消化等特点在很大程度上限制了其在食品工业中的应用。已有的研究结果显示,食品体系中的酚类化合物与淀粉相互作用具有调节淀粉结构的潜力,可以有效改善天然淀粉的物理化学性质和消化性能,对其食品特性和营养特性产生许多有利影响[3−4]。因此,酚类物质与淀粉相互作用的研究具有重要的意义。
多酚是植物的次生代谢产物,广泛分布于植物性食物中,其类别包括酚酸和类黄酮等,对人体健康具有深远的益处[1]。过去研究表明,许多不同的酚类化合物已被添加到淀粉体系中,改变了淀粉的流变、糊化、回生和胶凝等功能特性[3]。He等[5]向苦荞淀粉中加入不同浓度的芦丁和槲皮素,促进了淀粉的糊化,延缓了淀粉的回生,提高了淀粉的热稳定性。陈天鸽等[6]发现添加阿魏酸和没食子酸能显著提高马铃薯淀粉的溶解度,降低马铃薯淀粉的凝沉性、析水率,改变其流变特性。为了可以更好的改善淀粉的功能特性和营养特性,对淀粉-多酚的结构特性进行详细研究以阐明它们的相互作用机制,成为了新的研究热点[7]。许多研究发现,淀粉通过氢键、疏水相互作用以及静电和离子相互作用与酚类化合物相互作用,形成V型包涵体复合物或非V型复合物[3]。而这些复合物复杂的结构又会限制酶降解并减慢消化速率,协同酚类化合物对淀粉消化酶的抑制作用,从而对淀粉的消化行为产生影响,为淀粉基食品提供额外的健康益处[8]。Mu等[9]发现沙棘酚类物质主要通过非共价氢键与淀粉相互作用,导致淀粉理化特性和消化特性的改变。Miao等[10]研究发现花青素与大米淀粉通过非共价相互作用改变淀粉的结构,并且花青素抑制了淀粉消化酶的活性,导致淀粉消化率降低。
鞣花酸(EA)也是一种从植物中提取的天然酚类成分,在石榴皮、刺梨叶中含量较为丰富[11]。鞣花酸与没食子酸、水杨酸等同属于羟基苯甲酸,它们与以咖啡酸和阿魏酸、肉桂酸为代表的羟基肉桂酸同属于酚酸[12]。近年来,大量研究集中在没食子酸[13−14]、咖啡酸[15]和阿魏酸[2]等酚酸可以与玉米淀粉相互作用,改善其理化、结构和消化特性方面。最近,研究人员和消费者都对鞣花酸表现出越来越大的兴趣,因为它具有抗糖尿病、抗糖化和抑制淀粉消化酶活性等显着的健康益处[16−17]。然而,据我们所知,目前关于鞣花酸的研究集中在其提取与生理活性方面,在鞣花酸与淀粉相互作用方面的研究比较匮乏。尽管Chen[18]等人在研究不同结构特性的酚类物质对马铃薯淀粉性能的影响时,报道了鞣花酸对马铃薯淀粉部分结构特性的影响。但其尚未系统全面的阐明鞣花酸对淀粉理化性质和结构特性的影响,此外,鞣花酸调节淀粉消化的机制也尚不清楚。因此本研究的目的是系统全面的表征鞣花酸对天然玉米淀粉理化性质和消化特性的影响,并从淀粉结构及酶抑制方面试图阐明其相互作用导致淀粉理化性质和消化特性改变的机理。
本研究先采用玉米淀粉与不同浓度的鞣花酸相互作用,测定其糊化特性、流变特性、糊化热特性、溶解度膨胀度的变化。进而制备共糊化鞣花酸-玉米淀粉复合物,通过傅里叶变换红外光谱、X射线衍射、核磁共振波谱进行结构表征,探究其相互作用的机理。通过复合物体外消化和酶抑制率实验,进一步讨论了复合物消化特性改变的机制。本研究有助于更深入地了解鞣花酸与玉米淀粉相互作用和降低淀粉消化率的机制,并且可为开发有用的淀粉功能性食品和新型低血糖指数淀粉基食品提供一定的实践参考。
1. 材料与方法
1.1 材料与仪器
石榴皮干 网店购买,原产地为陕西省;无水乙醇、硫酸 成都市科隆化学品有限公司;3,5-二硝基水杨酸 北京索莱宝科技有限公司;N-甲基吡咯烷酮 分析纯,天津市大茂化学试剂厂;玉米淀粉、猪胰ɑ-淀粉酶(9 U/mg)、淀粉类葡萄糖苷酶(100000 U/mg)、ɑ-葡萄糖苷酶(50 U/mg) 上海源叶生物科技有限公司;鞣花酸标准品(纯度98%)、二甲基亚砜(DMSO) 分析纯,溴化钾、氘代二甲基亚砜(DMSO-d6) 光谱纯,上海麦克林生化科技股份有限公司。
10N冷冻干燥机 宁波新芝生物科技股份有限公司;HAAKE MARS 40流变仪 美国热电公司;Infinite E Plex多功能酶标仪 奥地利帝肯实验器材有限公司;Nicolet iS50傅立叶红外光谱仪 美国赛默飞世尔科技公司;A24A10布鲁克D8 X射线衍射仪测角仪、AVANCE III HD500核磁共振波谱仪 德国Bruker公司;差示扫描量热仪 美国TA仪器公司;F16502扫描电子显微镜 荷兰Phenom公司;STA 449F5同步热分析仪 德国NETZSCH公司;RVA-TecMaster 快速黏度测试仪 澳大利亚 Perten公司。
1.2 实验方法
1.2.1 石榴皮鞣花酸的制备
1.2.1.1 提取纯化
参考徐加喜等[19]的方法稍作修改制备鞣花酸粗品。将石榴皮研磨成粉末,过60目筛。取20.0 g石榴皮粉悬浮在100 mL含60%乙醇的水中,300 W、75 ℃超声提取40 min,8000 r/min离心10 min。然后将沉淀再次加入100 mL 60%的乙醇溶液,置于恒温水浴锅中,75 ℃持续搅拌10 min,对不溶残留物进行再次提取。将水提物结合在一起进行离心,取上清液置于60 ℃进行旋转蒸发,得到提取液。向100 mL上述提取液中加入5.5%(v/v)的硫酸,106 ℃持续搅拌4 h。冷却后8000 r/min离心10 min,将所得沉淀物冷冻干燥,得到鞣花酸粗品(纯度为49%)。参考Wang等[20]的方法进行鞣花酸的纯化。称取15 g鞣花酸粗品与300 mL的N-甲基吡咯烷酮混合,50 ℃水浴搅拌10 min,8000 r/min离心10 min,将上清液注入4500 mL去离子水中,15 ℃水浴搅拌17 min。反应完全后8000 r/min离心30 min,用去离子水清洗沉淀2次,真空冷冻干燥,得到纯度为93%的石榴皮鞣花酸。
1.2.1.2 纯度测定
参考刘伟等[21]的方法,使用鞣花酸标准品(纯度98%)制备鞣花酸标准曲线:用0.l mol/L NaOH溶液溶解鞣花酸标准品,并用蒸馏水稀释成质量浓度依次为0.5、2.5、5、7.5、10 µg/mL的对照品溶液。以吸光度y为纵坐标,标准溶液质量浓度x为横坐标,绘制标准曲线,得到线性回归方程为y=0.0273x+0.0664,R2=0.9991。将纯化后的鞣花酸配置成溶液,通过紫外分光光度计在355 nm测定样品吸光度,根据标准曲线回归方程获得鞣花酸的质量浓度c,并根据公式(1)计算鞣花酸纯度[22]。
W(%)=c×vM×100 (1) 式中:W为鞣花酸纯度,%;c为鞣花酸溶液浓度,mg/mL;v为溶液体积,mL;M为鞣花酸质量,mg。
1.2.2 淀粉-鞣花酸体系理化特性测定
1.2.2.1 糊化特性的测定
在RVA罐中加入玉米淀粉和分别占淀粉干基重0%、2%、5%、10%、15%(w/w)的鞣花酸总重2.5 g,再加入20 mL蒸馏水。使用快速黏度分析仪(RVA)分析淀粉糊化特性。将淀粉悬浮液在50 ℃下保持1 min,在3.75 min内加热至95 ℃,再在95 ℃下保持2.5 min,以相同速度冷却至50 ℃,并在50 ℃下保持0.5 min。最终获得淀粉糊化的峰值黏度(PV)、谷值黏度(TV)、终值黏度(FV)、崩解值(BD)和回生值(SB)[23]。
1.2.2.2 动态流变学特性测定
将1.2.2.1制备的淀粉糊冷却至室温,使用流变仪进行动态流变学特性测定。参考Qiu等[24]的方法并稍作修改:将样品平铺在40 mm几何平板上,设置测试参数为1 mm间隙、1%的扫描应变(根据应变扫描试验确定,该应变处于线性粘弹性区域)和0.2~20 Hz的扫描频率,在25 ℃室温进行测试。
1.2.2.3 糊化热特性测定
准确称量玉米淀粉3 mg,分别加入占淀粉干基重0%、2%、5%、10%、15%(w/w)的鞣花酸,加入9 μL蒸馏水,密封,4 ℃下平衡 24 h。以空坩埚作为空白对照,使用差示扫描量热仪,将样品在30 ℃下平衡2 min,然后升温至95 ℃并以10 ℃/min的速率冷却至25 ℃,以确定参数:起始温度(To)、峰值温度(Tp)、终止温度(Tc)及糊化焓(ΔH)[25]。
1.2.2.4 溶解度和膨胀度测定
将0.3 g玉米淀粉与0%、2%、5%、10%、15%(w/w,以淀粉干基计)的鞣花酸在离心管中混合,然后加入20 mL蒸馏水。将混合物在SHZ-88水浴恒温振荡器中以90 ℃和200 r/min水浴震荡30 min。之后将样品冷却至室温并离心,在干燥后记录上清液的重量。公式见式(2)、(3):
溶解度(%)=AW×100 (2) 膨胀度 (g/g)=DW×(1−S) (3) 式中:A为干燥后上清液的重量,g;W为玉米淀粉重量,g;D为离心后沉淀的重量,g;S为溶解度,%。
1.2.3 复合物的制备
参考Han等[7]的方法并稍作修改:将1 g玉米淀粉分别0%、2%、5%、10%、15%(w/w,以淀粉干基计)的鞣花酸混合,加入15 mL蒸馏水,使用恒温磁力搅拌器在温度为90 ℃加热20 min的条件下快速搅拌。冷却至室温于−18 ℃预冷12 h后真空冷冻干燥,得到干燥的样品。干燥样品磨粉后过100目筛,于室温密封保存,用于结构表征测定。
1.2.4 结构表征
1.2.4.1 X-射线衍射(XRD)分析
参考Gao等[26]的方法并稍作修改。简而言之,将样品压平到样品槽上,以1°/min的扫描速率在5°~45°(2θ)的角度范围内进行X射线衍射扫描。其中仪器工作电压为40 kV,工作电流为30 mA。
1.2.4.2 傅里叶红外光谱 (FTIR)检测
参考Han等[27]的方法并稍做修改:将2 mg样品与200 mg干燥溴化钾研磨,制成薄片,在傅里叶红外光谱仪中扫描。其中,扫描参数为500~4000 cm−1波数范围、32次扫描次数和4 cm−1的分辨率。
1.2.4.3 核磁共振氢谱(1HNMR)测定
将12 mg待测样品溶解于0.6 mL的DMSO-D6中,通过0.22 μm的滤膜过滤,然后将混合液转移至5 mm 核磁共振管中,使用核磁共振仪在313 K的温度下收集样品的1HNMR波谱,扫描次数128。使用MestReNova软件对其进行拟合[28]。
1.2.5 石榴皮鞣花酸抑制淀粉消化酶实验
1.2.5.1 ɑ-葡萄糖苷酶抑制试验
根据Wu等[16]的方法,经过一些修改,将50 μL 0.2 mol/L PBS(磷酸盐缓冲液,pH=6.8)与50 μL浓度为0.025、0.1、0.175、0.25、0.325 mg/mL的鞣花酸溶液(用PBS+10%DMSO溶解)和50 μL ɑ-葡萄糖苷酶(1.0 U/mL)合并混合。将混合物在37 ℃下预孵育10 min。然后,加入 100 μL对硝基苯酚-ɑ-d-吡喃葡萄糖苷(pNPG,3 mmol/L),并在37 ℃下反应10 min。最后,750 μL 0.1 mol/L水溶液Na2CO3以终止反应。在405 nm处测量吸光度。抑制率计算见式(4):
抑制率(%)=[1−A样品−A样品对照A空白−A空白对照]×100 (4) 式中:A样品、A样品对照、A空白、A空白对照分别代表样品(酶和抑制剂)和样品对照(PBS和抑制剂)、空白(酶和PBS+10%DMSO)、空白对照(PBS和PBS+10%DMSO)的吸光度。
1.2.5.2 ɑ-淀粉酶抑制试验
将100 μL浓度为0.01~15 mg/mL的鞣花酸溶液与100 μL α-淀粉酶(3.75 U/mL)在0.02 mol/L PBS(pH=6.8)中混合。将混合物在37 ℃下孵育10 min。加入100 μL可溶性淀粉(1%,m/v)后,将混合物在37 ℃下孵育10 min。然后,加入200 μL 3,5-二硝基水杨酸(DNS),并将混合物在100 ℃下孵育5 min。加入3 mL蒸馏水稀释,在540 nm处测量吸光度[16]。抑制率计算公式参考式(4)。
1.2.6 复合物体外消化性测定
参考Ye等[29]的方法,将猪胰腺ɑ淀粉酶(75 mg,9 U/mg)溶解于20 mL 0.2 mol/L的醋酸钠缓冲液(pH5.5)中,并磁力搅拌30 min确保完全溶解。将猪胰腺ɑ淀粉酶溶液以5000 r/min离心5 min,上清液与淀粉类葡萄糖苷酶(0.007 mg,100000 U/mg)混合。样品(100 mg)和10 mL醋酸钠缓冲液(0.2 mo1/L,pH5.5)分散在50 mL离心管,混合物在恒温水浴37 ℃下以120 r/min的速度振荡20 min,然后加入0.75 mL混合酶溶液。立即计时,反应时间分别为20、60和120 min。用沸水浴浸泡10 min后停止反应。冷却至室温并离心后,将上清液稀释至适当浓度。采用3,5-二硝基水杨酸(DNS)法,在540 nm处测定标品葡萄糖含量并绘制葡萄糖标准曲线。公式如下:
RDS(%)=(G20−G0)×0.9M×100 (5) SDS(%)=(G120−G20)×0.9M×100 (6) RS(%)=100−RDS−SDS (7) 式中:RDS、SDS、RS分别为快消化淀粉、慢消化淀粉和抗性淀粉,%;M表示总淀粉质量,mg;G20和G120分别为20 min和120 min内释放的葡萄糖含量,mg。
初始空段落
1.3 数据处理
所有试验均重复三次,得到的结果以平均值±标准差表示,使用IBM SPSS Statistics 22软件ANOVA检验法对数据进行差异性分析(P<0.05),采用Origin 2021软件对实验数据进行制图。
2. 结果与分析
2.1 鞣花酸对玉米淀粉理化性质的影响
2.1.1 鞣花酸对玉米淀粉糊化特性的影响
淀粉样品的糊化特性列于表1中。淀粉的峰值黏度(PV)、终值黏度(FV)、崩解值(BD)和回生值(SB)随着鞣花酸含量的增加而增加,而谷值黏度(TV)却无显著改变。PV反映了淀粉有水加热过程中,颗粒在崩解前吸收水分和膨胀的能力[30]。加入鞣花酸后,PV上升,这与万芊[31]、Han等[7]和Xu等[32]观察到的槲皮素和高聚合度原花青素等不溶性多酚导致淀粉体系的峰值黏度增大的结果相似,这归因于鞣花酸较差的水溶性和其结构上丰富的酚羟基。鞣花酸具有丰富的酚羟基,可以增加淀粉和水分子之间的接触面积,加速淀粉颗粒的溶胀并促进直链淀粉溶出形成直链淀粉-酚络合物,从而导致淀粉的峰值黏度显着增加[32]。此外,Amoako等[33]的研究表明,直链淀粉结构比支链淀粉更有利于与单宁的相互作用。这可能导致鞣花酸与直链淀粉相互作用,抑制直链淀粉对支链淀粉的糊化抑制作用,导致更高的PV。PV和TV之间的差异被定义为BD,它是淀粉糊的热稳定性和机械稳定性的指标[34]。随着鞣花酸加入量的提高,BD显著提高。这可能是由于黏度的增加,导致施加在膨胀颗粒上的剪切力大得多,使颗粒完整性进一步的破坏,引起直链淀粉和低分子量支链淀粉的浸出[35]。
表 1 鞣花酸对玉米淀粉糊化特性的影响Table 1. The effect of ellagic acid on the gelatinization characteristics of corn starch鞣花酸浓度(%) PV(cP) TV(cP) BD(cP) FV(cP) SB(cP) 0 2745.67±7.09d 2180.33±34.24a 565.33±29.54d 2830.33±9.07c 650±41.04d 2 2836.67±11.85d 2173.33±62.13a 663.33±51.52c 2896.67±16.44bc 723.33±46.52c 5 2952±21.38c 2133.33±57.14a 818.67±36.56b 2963.33±26.63ab 830±31.05b 10 3245.33±37.1b 2119±31.8a 1126.33±5.51ab 3018±16.64a 899±16.09a 15 3496±122.2a 2153.33±99.08a 1342.67±23.18a 3015±88.71a 861.67±10.69ab 注:PV:峰值黏度;TV:谷值黏度;BD:崩解值;FV:终值黏度;SB:回生值;同一列不同字母表示具有显著性差异(P<0.05)。 终值黏度(FV)和回生值(SB)分别表示直链淀粉分子在冷却后糊状物的再结合能力,以及淀粉状物糊在冷却后的稳定性,常用来评价淀粉糊短期回生的程度[36]。FV和SB的增加,证明了鞣花酸可以增强淀粉糊的聚集,并在冷却过程中促进淀粉分子的重排和短期回生。然而许多研究发现在没食子酸、咖啡酸、阿魏酸等酚类物质的影响下,玉米淀粉的FV和SB普遍呈下降趋势[2,7,15]。本研究与他们的结果相反,主要归因于鞣花酸在淀粉基质中的溶解度和分布率与其他多酚有显著差异,归根结底是其晶体大小的不同或分子结构的差异[4]。由于鞣花酸较差的水溶性,鞣花酸在疏水作用下可以以结晶态分散到淀粉分子链中,并在淀粉糊的连续相中充当刚性填料,从而提高了其整体黏度,导致FV的增加[5]。而SB的增加更可能是由于糊化的淀粉颗粒释放出大量的直链淀粉和支链淀粉,使鞣花酸能够通过其活性多羟基结构与它们相互作用,从而帮助淀粉重新组装形成凝胶网络[37]。
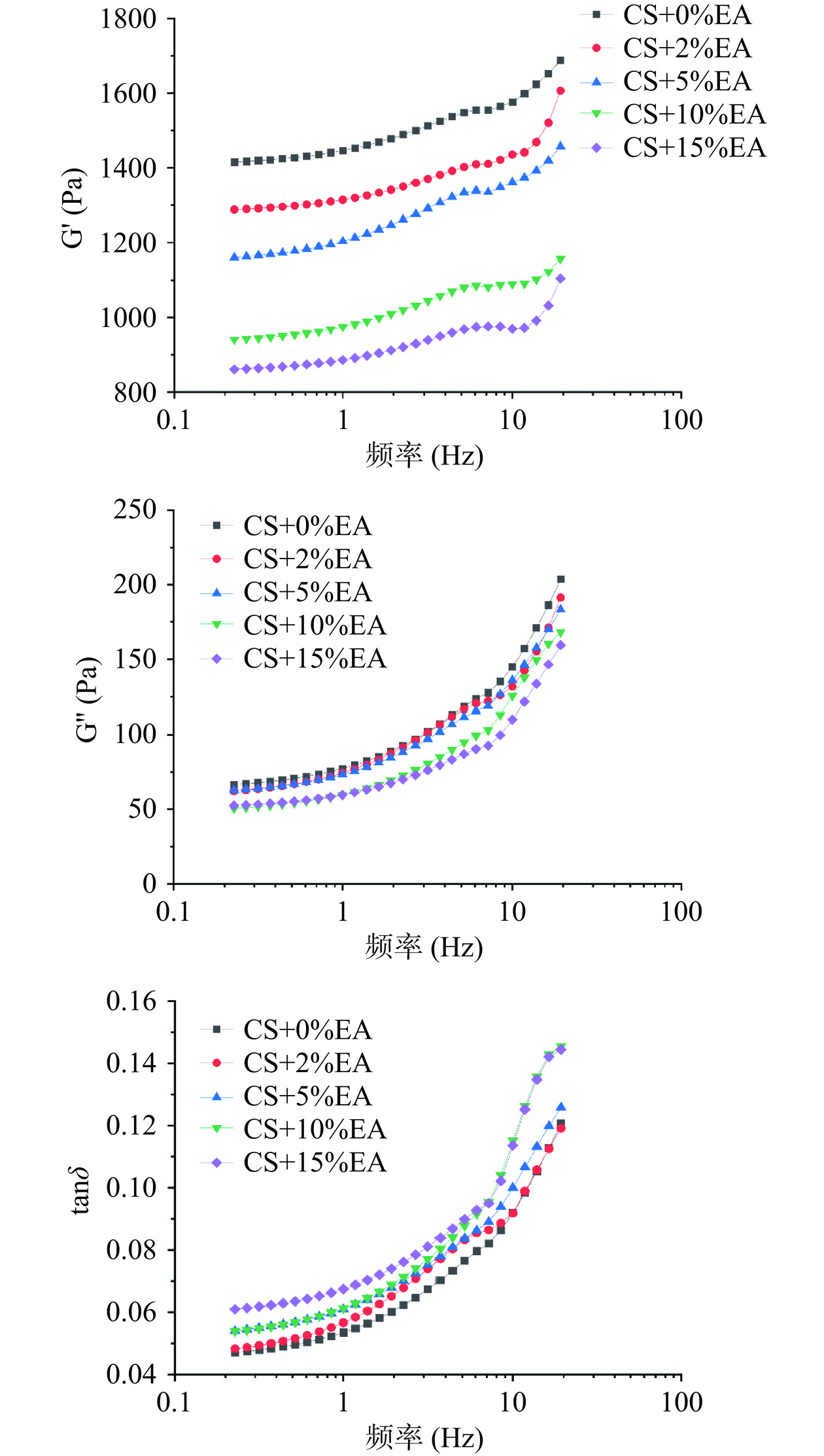
2.1.2 鞣花酸对玉米淀粉动态流变特性的影响
储能模量(G')表示流体在外力的作用下发生形变后恢复原状的能力,损耗模量(G'')是流体阻碍流动的能力。动态流变测试结果如图1所示,所有样品的G'、G''随着频率的增加而逐渐增加,且G′值都比G′′大一个数量级,所有样品均表现为典型的凝胶样行为[4]。与对照组相比鞣花酸的存在导致G′和G′′降低,并且鞣花酸添加量越大,G′和G′′下降程度越大。研究发现,在许多不同的酚类物质的影响下都会出现类似的结果[4,38−40]。一般而言,直链淀粉凝胶系统中链之间的双螺旋产生了更坚固的缠结网络连接,从而增强了淀粉凝胶的稳定性,但多酚的加入会打破这种平衡[38]。附着在淀粉颗粒表面的多酚与溶出的直链淀粉结合,阻碍了直链淀粉的相互连接[41]。加之部分多酚与淀粉可能形成复合物,在淀粉分子之间形成空间位阻,干扰淀粉凝胶网络的生成[40]。
损耗因子(tanδ)表示G''与G'的比值,是衡量材料粘弹性的重要参数。tanδ值越小,说明体系中的弹性行为占主导,样品会产生类似固体的特征;tanδ值越大,说明体系的粘性行为占主导,样品会产生类似液体的特征[42]。如图1所示,加入鞣花酸后,样品的tanδ值随着鞣花酸的不断增加而增加,这表明样品凝胶网络的减弱[43]。进一步说明了鞣花酸的加入,直接导致淀粉分子连接区减少,体系粘性成分增加。这可能是因为鞣花酸和淀粉之间的相互作用限制了直链淀粉的浸出,干扰了网络的形成,从而导致凝胶变弱。这与Gao等[26]的研究结果相一致。
2.1.3 鞣花酸对玉米淀粉糊化热特性的影响
糊化起始温度(To)、糊化峰值温度(Tp)和糊化终值温度(Tc)表示淀粉分子结构从有序结晶态转变为无序凝胶态过程中的温度变化[36]。与天然淀粉相比,加入鞣花酸后样品的糊化温度升高,而糊化焓(ΔH)随着系统中鞣花酸浓度的增加而降低,这与Wang等[44]研究莲花叶类黄酮-淀粉复合物时观察到的结果相似,根据他们的研究结论,这可能是由于鞣花酸中的亲水性-OH基团可能会与淀粉颗粒结合在一起,从而导致淀粉结晶和无定形基质之间的耦合力发生了变化。具体来说,鞣花酸中的-OH与淀粉的氢键相互作用稳定了淀粉结构,延缓了直链淀粉的浸出,并使得鞣花酸和玉米淀粉之间的水分重新分布,进而影响淀粉颗粒中淀粉糊化转化和无定形区水合,进而增加了糊化温度[45−46]。
据报道,糊化焓值(ΔH)主要是由于双螺旋的破坏,而不是结晶度的长程破坏[47]。添加鞣花酸后玉米淀粉ΔH下降,表明预糊化颗粒内分子秩序的减弱和有序双螺旋的损失,说明添加鞣花酸后样品热稳定性下降,这与2.1.1中BD结果相符合。Zheng等[48]在研究中也得到了类似的结论。而ΔH的下降,可能是因为共同糊化过程中鞣花酸与淀粉发生了相互作用,在淀粉链之间引入苯环作为桥梁,影响了淀粉的双螺旋结构,使其只需要较低的能量即可糊化[40,47]。
表 2 鞣花酸对玉米淀粉糊化热特性的影响Table 2. The effect of ellagic acid on the gelatinization heat characteristics of corn starch鞣花酸浓度(%) To(℃) Tp(℃) Tc(℃) ∆H(J/g) 0 66.19±0.14e 71.17±0.09d 77.32±0.18d 10.1±0.1a 2 66.54±0.07d 71.28±0.24cd 77.4±0.22d 10.05±0.04ab 5 67±0.05c 71.62±0.14bc 77.85±0.12c 9.89±0.1b 10 67.28±0.13b 71.94±0.14b 78.41±0.19b 9.69±0.11c 15 68.13±0.13a 72.59±0.29a 79.79±0.16a 9.34±0.09d 注:To:糊化起始温度;Tp:糊化峰值温度;Tc:糊化终值温度;Δ H:糊化焓值;同一列不同字母表示具有显著性差异(P<0.05)。 2.1.4 鞣花酸对玉米淀粉溶解度和膨胀度的影响
淀粉的膨胀能力表明其吸水程度,而溶解度反映其溶解程度。由表3可知,鞣花酸的添加显著提高了淀粉的溶解度(P<0.05),而对淀粉膨胀度没有显著影响(P>0.05)。这说明鞣花酸的加入主要是影响了淀粉分子在水中的溶解行为,使更多的淀粉分子链能够溶解在水中,但对淀粉颗粒本身的吸水膨胀性能没有显著的改变。一方面,加热过程中溶解在水中的鞣花酸酚羟基之间的相互作用会改变水溶液的水活性和离子强度,从而改善淀粉-水相互作用,促进玉米淀粉中可溶性淀粉的溶解[7]。另一方面,鞣花酸具有弱酸性,鞣花酸加入淀粉-水体系中会降低体系的pH,这可能导致玉米淀粉溶解度的增大[49]。而膨胀度未显著改变,这可能是由于鞣花酸在水中的溶解度较差,导致对淀粉和水产生的相互作用不足以影响玉米淀粉的膨胀度。此外,pH对玉米淀粉的溶解度产生的影响也可能较小。Builders等[49]的研究表明,pH的降低虽可以增加虎果淀粉的溶解度,但对膨胀能力的影响很小。
表 3 鞣花酸对玉米淀粉溶解度和膨胀度的影响Table 3. The effect of ellagic acid on the solubility and swelling degree of corn starch鞣花酸浓度(%) 溶解度(%) 膨胀度(%) 0 6.86±0.27e 9.99±0.24a 2 7.31±0.17d 10.02±0.23a 5 8.08±0.09c 10.11±0.24a 10 8.66±0.15b 10.37±0.78a 15 9.65±0.3a 9.89±0.45a 注:同一列不同字母表示具有显著性差异(P<0.05)。 2.2 复合物结构表征
2.2.1 X-射线衍射图谱分析
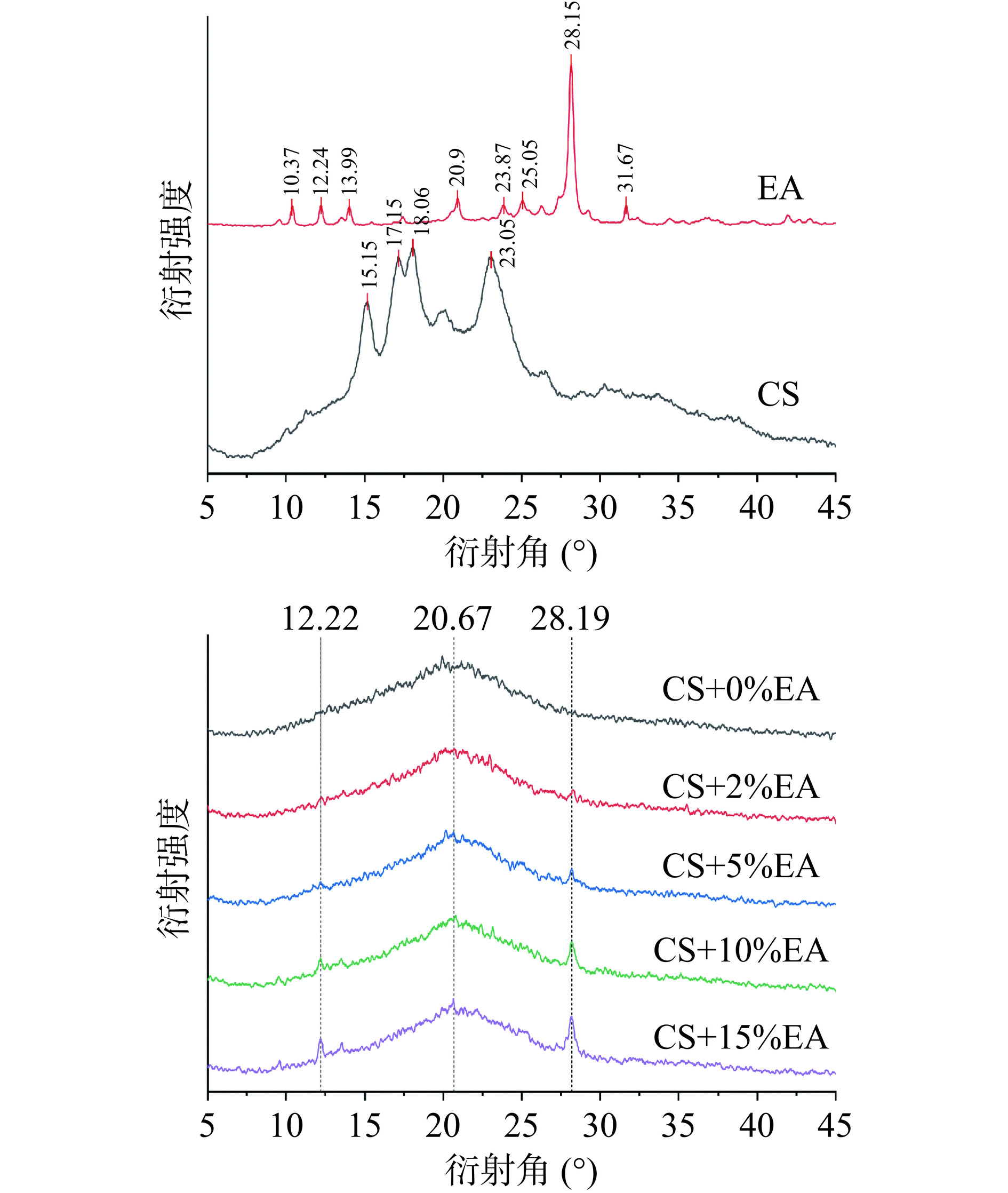
据报道,淀粉与酚类化合物之间可通过两种方式产生非共价相互作用:其一是形成V型包涵体复合物;其二是形成结合力相对较弱的非包合物形式,如氢键和疏水相互作用力等来达成[3]。为了揭示玉米淀粉和鞣花酸之间相互作用的性质,进行了XRD测试分析。结果如图2所示,原玉米淀粉衍射角度在15.15°和23.°附近有两个强衍射峰,17.15°和18.06°附近的衍射峰为连通的双峰,表现出典型的A型衍射图样[50]。鞣花酸在衍射角为10.37°、12.24°、13.99°、20.90°、23.87°、25.05°、28.15°、31.67°处有较强的衍射峰。从图2中可以看出,热处理过程破坏了所有添加鞣花酸和未添加鞣花酸的样品的内部结晶区域,导致与原始淀粉相比,X射线衍射峰强度显著降低。所有XRD光谱均未显示7°、13°和20°处V型包涵体复合物的特征衍射峰,这意味着鞣花酸和淀粉未形成分子内单螺旋包涵体,可能通过非共价相互作用相结合[51]。可能是因为淀粉和多酚必须在有机溶剂、酸或碱存在下以及在严格的温度条件下相互作用足够长的时间才能诱导V型复合物的形成[50]。然而,本研究中使用的共糊化的方法显然不能满足制备V型复合物的要求。淀粉和鞣花酸的表面都具有羟基,因此氢键似乎是最有可能促鞣花酸与淀粉之间相互作用的驱动力。因此,鞣花酸与玉米淀粉并未以V型包涵体复合物存在,更大的可能是通过氢键相互作用形成非包合物。
2.2.2 傅里叶红外光谱分析
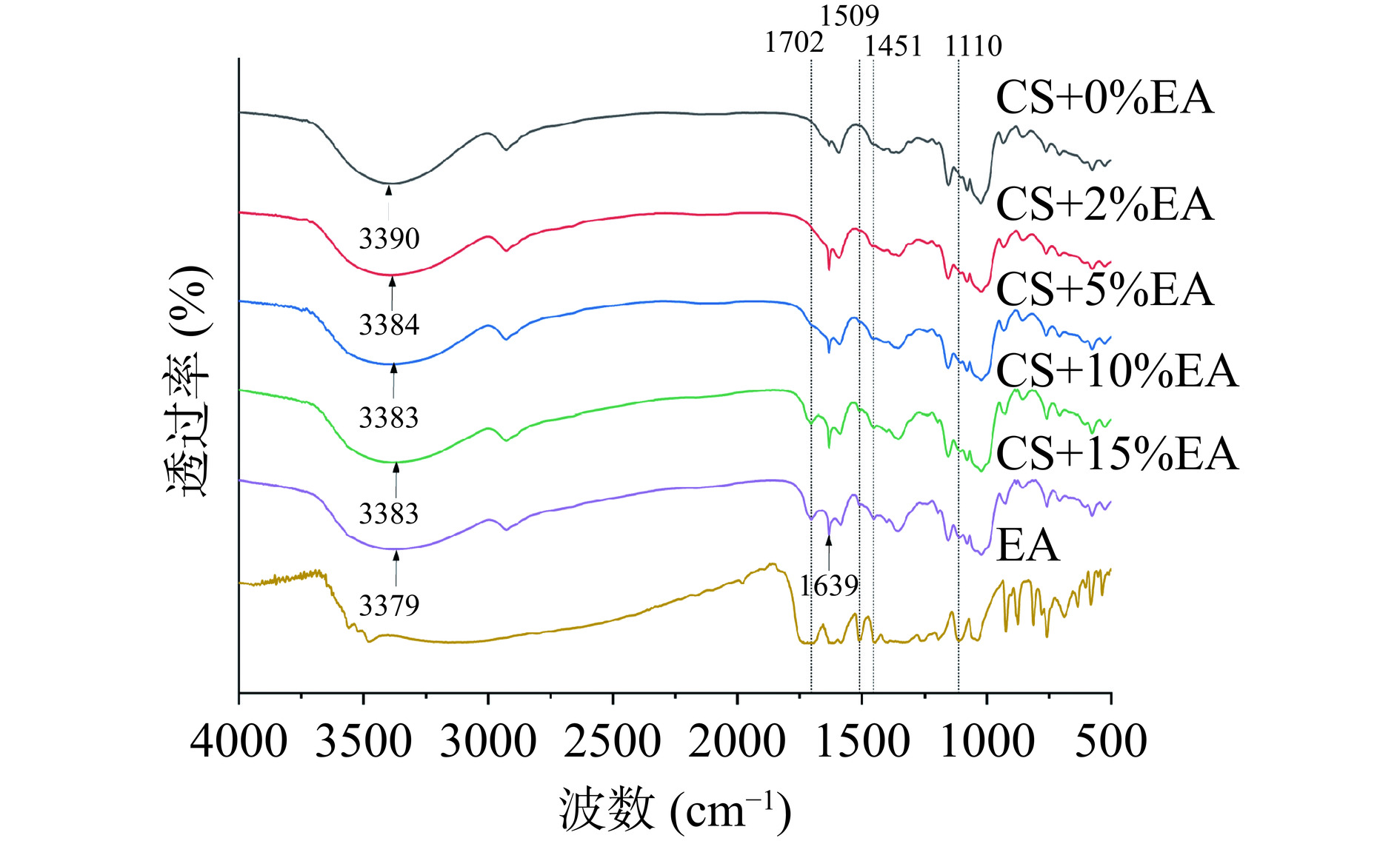
为了进一步验证鞣花酸与玉米淀粉之间的相互作用,通过FTIR对复合物的短程有序结构进行了分析,然后进行反卷积处理。由图3可知,对于糊化玉米淀粉,3390 cm−1的宽峰和2927 cm−1的峰分别归因于O-H伸缩振动峰和CH伸缩振动峰[52]。此外,鞣花酸在1695 cm−1处是C=O伸缩振动峰,1454~1614 cm−1是苯环上的C=C伸缩振动峰,1111~1195 cm−1是的谱带是由于C-O伸缩的酯键[53]。与对照组相比,复合物在1702、1509 cm−1处出现新特征峰,这分别归因于芳香族C=C的弯曲和C=O的伸缩振动,对应于鞣花酸的存在,且发生不同程度的偏移,这说明玉米淀粉与鞣花酸之间的络合作用是由非共价相互作用促进的[54]。加入鞣花酸后,玉米淀粉3400 cm−1附近的代表O-H键伸缩振动的宽峰向低波数方向发生红移,且1635 cm−1带更尖锐,证明了体系中氢键的密度和强度的增加,说明鞣花酸和玉米淀粉之间的非共价相互作用包括氢键[54],并且鞣花酸可以通过相互作用引入更多的水分附着在淀粉上[51]。
在结构分析方面,通常FTIR光谱被用来描述淀粉的短程有序性。研究表明,在1022 cm−1处的吸收峰强度与淀粉无定形区的振动模式相关,而995和1047 cm−1处的吸收峰强度与淀粉结晶区的振动模式有关[7]。通常(1047/1022) cm−1的大小与淀粉的短程有序性呈正相关;而(1022/995) cm−1的大小与结构中氢键数量呈负相关[31]。由表4可知,加入鞣花酸使得(1047/1022) cm−1比值有所升高,表明淀粉的短程有序程度升高,且(1022/995) cm−1比值均有所下降,证明体系中的淀粉分子间氢键数量增多,表明淀粉中的无定形相结构和淀粉分子链之间的距离减少,淀粉分子间氢键的形成增加,复合鞣花酸促进了淀粉短程有序结构的产生[46]。鞣花酸的多羟基结构,可以与玉米淀粉链通过氢键作用力结合,更快的聚集了糊化淀粉体系中无规则的淀粉链,形成以鞣花酸为链接的结构,因此可以作为交联剂或增塑剂增强了分子秩序[13,55]。这导致了2.1.1中的峰值黏度(PV)、终值黏度(FV)和回生值(SB)的升高,也印证了2.1.3中关于糊化温度改变原因的讨论。
表 4 1047/1022 cm−1与1022/995 cm−1的吸收峰峰高比值Table 4. The ratio of absorption peak height between 1047/1022 cm−1 and 1022/995 cm−1样品 R1047/1022 R1022/995 CS+0%EA 0.0917 1.6842 CS+2%EA 0.1359 0.9238 CS+5%EA 0.149 0.86 CS+10%EA 0.1220 0.9248 CS+15%EA 0.1618 0.9401 2.2.3 1HNMR图谱分析
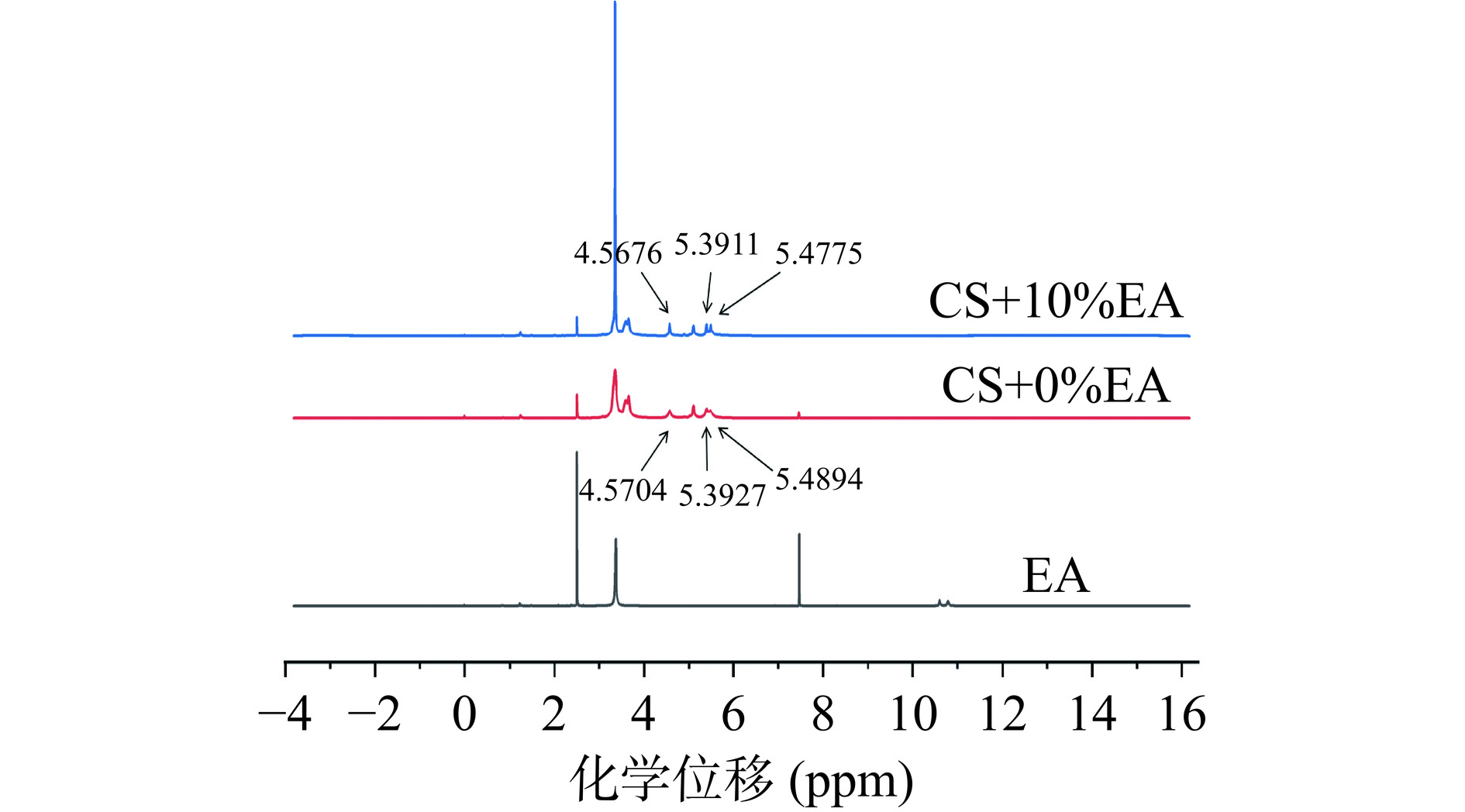
如图4所示,通过分别检测鞣花酸、糊化玉米淀粉(CS+0%EA)和鞣花酸-玉米淀粉复合物(CS+10%EA)的1HNMR光谱,可以在分子水平上探究玉米淀粉和鞣花酸之间的相互作用。每个光谱中,化学位移2.5 ppm和3.3 ppm处的峰分别对应于DMSO-d6和水的信号[56]。鞣花酸在10.79 ppm和10.50 ppm处对应其酚羟基质子峰,在7.47 ppm处对应鞣花酸苯环的特征峰[57]。糊化淀粉在5.3、5.5和4.5 ppm的化学位移可归因于OH-2,OH-3和OH-6的淀粉质子,而5.1和3.1~3.6 ppm的化学位移可归因于淀粉的H-1信号以及H-2,H-3,H-4和H-5信号[58]。复合物在7.46 ppm左右的信号峰对应鞣花酸中的苯环,这可以作为复合物中存在鞣花酸的证据。添加鞣花酸后,复合物在5.4和5.5 ppm处的羟基峰变宽了。且由表5可知,复合物的OH-3、OH-2和OH-6的化学位移移动到高场,这些结果进一步验证了鞣花酸与玉米淀粉之间出现了氢键相互作用,与FTIR结果相一致。Yu等[59]与Maibam等[60]的研究也发现了类似的结果。除此之外,OH-3在所有质子中显示出最大的化学位移,表明鞣花酸与淀粉的OH-3之间优先形成氢键[61]。
2.3 鞣花酸对淀粉消化酶的抑制
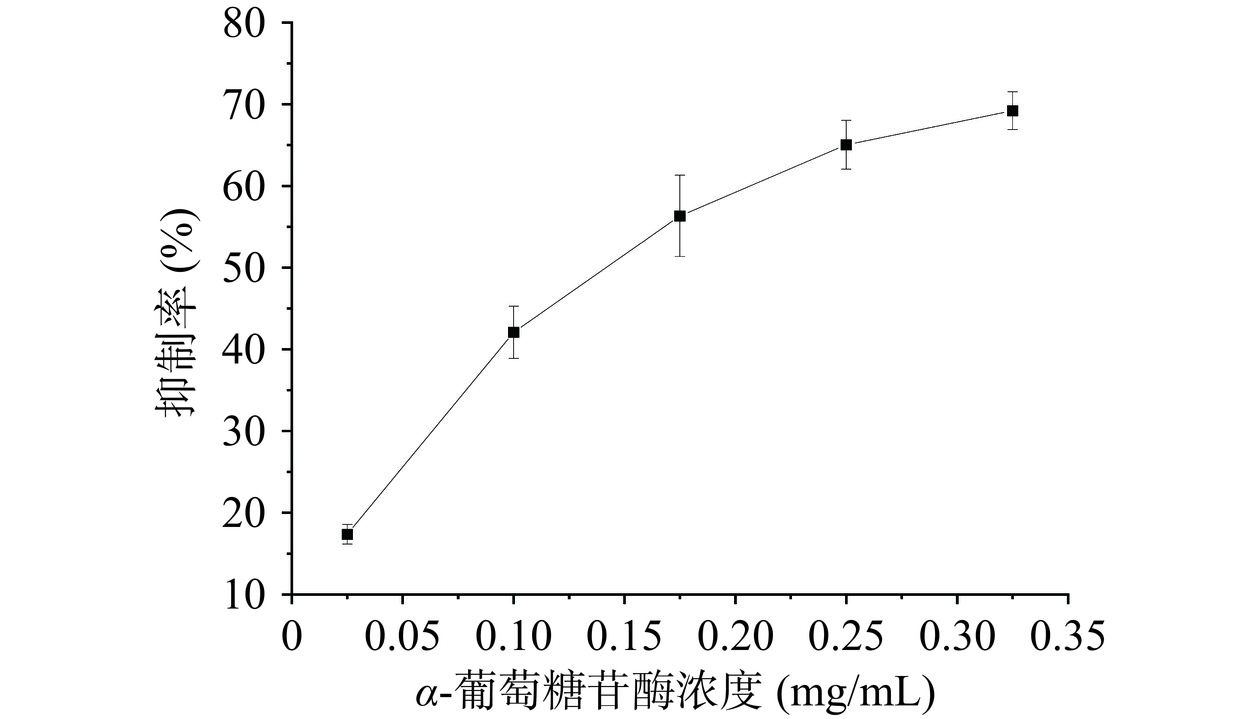
鞣花酸对淀粉消化酶的抑制可以通过IC50体现。如图5所示,鞣花酸在一定质量浓度范围内对ɑ-葡萄糖苷酶表现出明显的抑制作用,并且抑制率随着鞣花酸浓度的增加而增加。通过计算,鞣花酸的IC50值为0.1349 mg/mL。但多次实验研究发现,鞣花酸对ɑ-淀粉酶没有明显的抑制效果。柴子淇[62]探究山楂多酚对淀粉消化酶活性的影响时也发现山楂多酚对ɑ-葡萄糖苷酶显示出明显的剂量依赖型抑制,但是对ɑ-淀粉酶无明显抑制作用。
2.4 鞣花酸对玉米淀粉消化性的影响
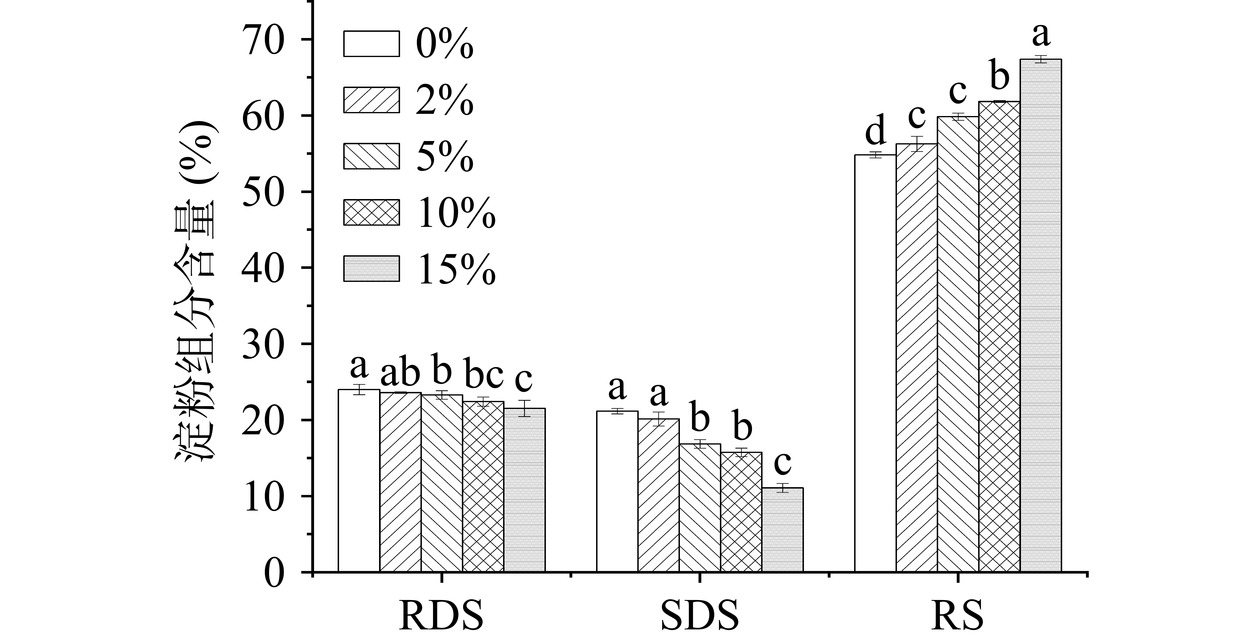
通常,淀粉分为快速消化淀粉(RDS)和缓慢消化淀粉(SDS)和抗性淀粉(RS);RDS和SDS是水解20分钟和再水解100分钟的淀粉,RS是120分钟后未水解的淀粉[63]。如图6所示,鞣花酸的添加影响了玉米淀粉中不同淀粉类型的百分比。随着鞣花酸添加量的增加,RDS和SDS含量降低,RS含量显著增加(P<0.05)。未添加鞣花酸的玉米淀粉RDS含量为24.0%,SDS含量为21.16%,RS含量为54.83%。当鞣花酸添加量提高到15%时,复合物RDS含量为21.53%,SDS含量为11.08%,RS含量为67.39%。这证实了鞣花酸的存在导致淀粉消化率降低,复合物有利于降低人体餐后血糖水平。
淀粉消化率是一个的复杂过程,受淀粉、酚类化合物和消化酶分子之间的相互作用的影响。一方面,许多研究发现,多酚与淀粉通过非共价相互作用形成的复合物被认为是导致淀粉消化率降低的原因之一[10,44]。在2.2.2中我们发现鞣花酸和玉米淀粉复合物形成了有更有序的短程分子结构,这可能促进了RS的形成[13]。此外,鞣花酸与淀粉分子通过氢键相互作用形成了淀粉分子链之间的链接,可能促进了淀粉复杂网络结构的形成,限制水解酶对淀粉链的可及性,且淀粉消化酶无法识别形成的复合物,从而降低了玉米淀粉的消化率[44]。这与Chi等[37]的研究结果一致,他们发现茶多酚通过和直链淀粉的氢键相互作用协助淀粉的重组并形成更复杂的网络结构,从而抑制了淀粉的消化。另一方面,而多酚对淀粉消化酶相互作用并因此抑制其活性,则是另一个可能导致复合物低消化率的原因[8]。如2.3中的分析,鞣花酸对ɑ-葡萄糖苷酶显示出明显的抑制作用。在消化过程中,鞣花酸可以从复合物中释放出来,然后与ɑ-葡萄糖苷酶结合,从而降低淀粉的消化率。总的来说,鞣花酸的存在使淀粉消化率降低,是因为鞣花酸改变淀粉结构特性和抑制淀粉消化酶的协同作用。
3. 结论
综上所述,鞣花酸显著改变了玉米淀粉的理化性质,具体表现在:鞣花酸提高了玉米淀粉的溶解度,增加了淀粉糊的黏度,促进了玉米淀粉的短期回生,增加了淀粉的糊化温度,但弱化了淀粉糊的凝胶结构。通过结构表征分析,XRD光谱未显示V型包涵体复合物的特征衍射峰,FTIR图谱中(1022/995) cm−1比值下降,复合物1HNMR图谱的OH-3、OH-2和OH-6的化学位移移动到高场,表明淀粉理化性质的改变归因于鞣花酸和淀粉之间通过氢键的非共价相互作用。此外,鞣花酸改变淀粉的结构特性和抑制ɑ-葡萄糖苷酶的协同作用导致了鞣花酸-淀粉复合物消化率降低,这为开发新型低血糖指数淀粉基食品提供提供一定的实践参考。未来可以进一步研究鞣花酸对玉米淀粉直链淀粉和支链淀粉消化率的影响以及鞣花酸对ɑ-葡萄糖苷酶的抑制类型和抑制机理,以更深入的探究鞣花酸抑制玉米淀粉消化率的详细机制。
-
表 1 鞣花酸对玉米淀粉糊化特性的影响
Table 1 The effect of ellagic acid on the gelatinization characteristics of corn starch
鞣花酸浓度(%) PV(cP) TV(cP) BD(cP) FV(cP) SB(cP) 0 2745.67±7.09d 2180.33±34.24a 565.33±29.54d 2830.33±9.07c 650±41.04d 2 2836.67±11.85d 2173.33±62.13a 663.33±51.52c 2896.67±16.44bc 723.33±46.52c 5 2952±21.38c 2133.33±57.14a 818.67±36.56b 2963.33±26.63ab 830±31.05b 10 3245.33±37.1b 2119±31.8a 1126.33±5.51ab 3018±16.64a 899±16.09a 15 3496±122.2a 2153.33±99.08a 1342.67±23.18a 3015±88.71a 861.67±10.69ab 注:PV:峰值黏度;TV:谷值黏度;BD:崩解值;FV:终值黏度;SB:回生值;同一列不同字母表示具有显著性差异(P<0.05)。 表 2 鞣花酸对玉米淀粉糊化热特性的影响
Table 2 The effect of ellagic acid on the gelatinization heat characteristics of corn starch
鞣花酸浓度(%) To(℃) Tp(℃) Tc(℃) ∆H(J/g) 0 66.19±0.14e 71.17±0.09d 77.32±0.18d 10.1±0.1a 2 66.54±0.07d 71.28±0.24cd 77.4±0.22d 10.05±0.04ab 5 67±0.05c 71.62±0.14bc 77.85±0.12c 9.89±0.1b 10 67.28±0.13b 71.94±0.14b 78.41±0.19b 9.69±0.11c 15 68.13±0.13a 72.59±0.29a 79.79±0.16a 9.34±0.09d 注:To:糊化起始温度;Tp:糊化峰值温度;Tc:糊化终值温度;Δ H:糊化焓值;同一列不同字母表示具有显著性差异(P<0.05)。 表 3 鞣花酸对玉米淀粉溶解度和膨胀度的影响
Table 3 The effect of ellagic acid on the solubility and swelling degree of corn starch
鞣花酸浓度(%) 溶解度(%) 膨胀度(%) 0 6.86±0.27e 9.99±0.24a 2 7.31±0.17d 10.02±0.23a 5 8.08±0.09c 10.11±0.24a 10 8.66±0.15b 10.37±0.78a 15 9.65±0.3a 9.89±0.45a 注:同一列不同字母表示具有显著性差异(P<0.05)。 表 4 1047/1022 cm−1与1022/995 cm−1的吸收峰峰高比值
Table 4 The ratio of absorption peak height between 1047/1022 cm−1 and 1022/995 cm−1
样品 R1047/1022 R1022/995 CS+0%EA 0.0917 1.6842 CS+2%EA 0.1359 0.9238 CS+5%EA 0.149 0.86 CS+10%EA 0.1220 0.9248 CS+15%EA 0.1618 0.9401 -
[1] DENG N, DENG Z, TANG C, et al. Formation, structure and properties of the starch-polyphenol inclusion complex:A review[J]. Trends in Food Science & Technology,2021,112:667−675.
[2] KARUNARATNE R, ZHU F. Physicochemical interactions of maize starch with ferulic acid[J]. Food Chemistry,2016,199:372−379. doi: 10.1016/j.foodchem.2015.12.033
[3] ZHU F. Interactions between starch and phenolic compound[J]. Trends in Food Science & Technology,2015,43(2):129−143.
[4] WANG L B, WANG L J, LI Z G, et al. Diverse effects of rutin and quercetin on the pasting, rheological and structural properties of Tartary buckwheat starch[J]. Food Chemistry,2021,335:127556. doi: 10.1016/j.foodchem.2020.127556
[5] HE C A, ZHANG Z, LIU H, et al. Effect of rutin and quercetin on the physicochemical properties of Tartary buckwheat starch[J]. Starch - Stä rke,2018,70(1−2):1700038.
[6] 陈天鸽, 李泳娴, 王露, 等. 三种食源性多酚对马铃薯淀粉理化特性的影响[J/OL]. 食品工业科技, 1−15[2025-03-10]. https://doi.org/10.13386/j.issn1002-0306.2024050136. [CHEN T G, LI Y X, WANG L, et al. Effects of three foodborne polyphenols on the physicochemical properties of potato starch[J/OL]. Science and Technology of Food Industry, 1−15[2025-03-10]. https://doi.org/10.13386/j.issn1002-0306.2024050136.] CHEN T G, LI Y X, WANG L, et al. Effects of three foodborne polyphenols on the physicochemical properties of potato starch[J/OL]. Science and Technology of Food Industry, 1−15[2025-03-10]. https://doi.org/10.13386/j.issn1002-0306.2024050136.
[7] HAN X Q, ZHANG M W, ZHANG R F, et al. Physicochemical interactions between rice starch and different polyphenols and structural characterization of their complexes[J]. LWT,2020,125:109227. doi: 10.1016/j.lwt.2020.109227
[8] GIUBERTI G, ROCCHETTI G, LUCINI L. Interactions between phenolic compounds, amylolytic enzymes and starch:an updated overview[J]. Current Opinion in Food Science,2020,31:102−113. doi: 10.1016/j.cofs.2020.04.003
[9] MU J L, WANG L W, LÜ J W, et al. Phenolics from sea buckthorn (Hippophae rhamnoides L.) modulate starch digestibility through physicochemical modifications brought about by starch – Phenolic molecular interactions[J]. LWT,2022,165:113682. doi: 10.1016/j.lwt.2022.113682
[10] MIAO L, XU Y, JIA C H, et al. Structural changes of rice starch and activity inhibition of starch digestive enzymes by anthocyanins retarded starch digestibility[J]. Carbohydrate Polymers,2021,261:117841. doi: 10.1016/j.carbpol.2021.117841
[11] 屈艳君, 王文慧, 曹家南, 等. 鞣花酸的制备及应用研究进展[J]. 中国食物与营养,2022,28(6):39−45. [QU Y J, WANG W H, CAO J N, et al. Research progress on the preparation and application of ellagic acid[J]. Chinese Food & Nutrition,2022,28(6):39−45.] QU Y J, WANG W H, CAO J N, et al. Research progress on the preparation and application of ellagic acid[J]. Chinese Food & Nutrition, 2022, 28(6): 39−45.
[12] NYAMBA I, LECHANTEUR A, SEMDÉ R, et al. Physical formulation approaches for improving aqueous solubility and bioavailability of ellagic acid:A review[J]. European Journal of Pharmaceutics and Biopharmaceutics,2021,159:198−210. doi: 10.1016/j.ejpb.2020.11.004
[13] CHI C D, LI X X, ZHANG Y P, et al. Digestibility and supramolecular structural changes of maize starch by non-covalent interactions with gallic acid[J]. Food & Function,2017,8(2):720−730.
[14] TAN J Q, LI P C, WANG W L, et al. Separation of gallic acid from Cornus officinalis and its interactions with corn starch[J]. International Journal of Biological Macromolecules,2022,208:390−399. doi: 10.1016/j.ijbiomac.2022.03.116
[15] ZHENG Y X, TIAN J H, KONG X L, et al. Physicochemical and digestibility characterisation of maize starch–caffeic acid complexes[J]. LWT,2020,121:108857. doi: 10.1016/j.lwt.2019.108857
[16] WU M X, YANG Q X, WU Y W, et al. Inhibitory effects of acorn (Quercus variabilis Blume) kernel-derived polyphenols on the activities of α-amylase, α-glucosidase, and dipeptidyl peptidase IV[J]. Food Bioscience,2021,43:101224. doi: 10.1016/j.fbio.2021.101224
[17] AHMAD S, ALOUFFI S, KHAN S, et al. Physicochemical characterization of in vitro LDL glycation and its inhibition by ellagic acid (EA):An in vivo approach to inhibit diabetes in experimental animals[J]. BioMed Research International,2022,2022(1):5583298. doi: 10.1155/2022/5583298
[18] CHEN N, FENG Z F, GAO H X, et al. Effects of phenols with different structure characteristics on properties of potato starch:Action rule and molecular mechanism[J]. Journal of Food Processing and Preservation,2022,46(7):e16679.
[19] 徐加喜, 高迪, 朱晓梅, 等. 高温高压条件制备石榴皮鞣花酸的试验研究[J]. 食品工业科技,2017,38(17):174−177. [XU J X, GAO D, ZHU X M, et al. Experimental study on the preparation of ellagic acid from pomegranate peel under high temperature and high pressure conditions[J]. Science and Technology of Food Industry,2017,38(17):174−177.] XU J X, GAO D, ZHU X M, et al. Experimental study on the preparation of ellagic acid from pomegranate peel under high temperature and high pressure conditions[J]. Science and Technology of Food Industry, 2017, 38(17): 174−177.
[20] WANG L, LIAN B L, WU W W, et al. Optimization of ellagic acid purification from pomegranate husk by antisolvent recrystallization[J]. Chemical Engineering & Technology,2018,41(6):1188−1198.
[21] 刘伟, 刘军海. 石榴皮中鞣花酸的提取工艺优化研究[J]. 粮食与油脂,2022,35(3):149−154. [LIU W, LIU H J. Study on the optimization of the extraction process of ellagic acid from pomegranate peel[J]. Grains and Fats,2022,35(3):149−154.] doi: 10.3969/j.issn.1008-9578.2022.03.034 LIU W, LIU H J. Study on the optimization of the extraction process of ellagic acid from pomegranate peel[J]. Grains and Fats, 2022, 35(3): 149−154. doi: 10.3969/j.issn.1008-9578.2022.03.034
[22] 王佳宁. 蓝靛果鞣花酸分离纯化及对脂质过氧化作用的影响研究[D]. 黑龙江:哈尔滨商业大学, 2018. [WANG J N. Separation and purification of ellagic acid from blue indigo fruit and its effect on lipid peroxidation[D]. Heilongjiang:Harbin University of Commerce, 2018.] WANG J N. Separation and purification of ellagic acid from blue indigo fruit and its effect on lipid peroxidation[D]. Heilongjiang: Harbin University of Commerce, 2018.
[23] ZHU F, CAI Y Z, SUN M, et al. Effect of phytochemical extracts on the pasting, thermal, and gelling properties of wheat starch[J]. Food Chemistry,2009,112(4):919−923. doi: 10.1016/j.foodchem.2008.06.079
[24] QIU S, YADAV M P, CHEN H, et al. Effects of corn fiber gum (CFG) on the pasting and thermal behaviors of maize starch[J]. Carbohydrate Polymers,2015,115:246−252. doi: 10.1016/j.carbpol.2014.08.071
[25] 苗兰鸽, 许燕, 赵思明, 等. 花青素对不同直链淀粉含量的淀粉理化特性的影响[J]. 食品工业科技,2020,41(14):22−28. [MIAO L G, XU Y ZHAO S M, et al. Effect of anthocyanins on the physicochemical properties of starch with different amylose contents[J]. Science and Technology of Food Industry,2020,41(14):22−28.] MIAO L G, XU Y ZHAO S M, et al. Effect of anthocyanins on the physicochemical properties of starch with different amylose contents[J]. Science and Technology of Food Industry, 2020, 41(14): 22−28.
[26] GAO S S, LIU H, SUN L J, et al. Rheological, thermal and in vitro digestibility properties on complex of plasma modified Tartary buckwheat starches with quercetin[J]. Food Hydrocolloids,2021,110:106209. doi: 10.1016/j.foodhyd.2020.106209
[27] HAN M J, BAO W J, WU Y W, et al. Insights into the effects of caffeic acid and amylose on in vitro digestibility of maize starch-caffeic acid complex[J]. International Journal of Biological Macromolecules,2020,162:922−930. doi: 10.1016/j.ijbiomac.2020.06.200
[28] LI B, ZHU L B, WANG Y T, et al. Multi-scale supramolecular structure of Pouteria campechiana (Kunth) Baehni seed and pulp starch[J]. Food Hydrocolloids,2022,124:107284. doi: 10.1016/j.foodhyd.2021.107284
[29] YE J P, LUO S J, HUANG A, et al. Synthesis and characterization of citric acid esterified rice starch by reactive extrusion:A new method of producing resistant starch[J]. Food Hydrocolloids,2019,92:135−142. doi: 10.1016/j.foodhyd.2019.01.064
[30] ZHANG Q, DUAN H, ZHOU Y X, et al. Effect of dry heat treatment on multi-structure, physicochemical properties, and in vitro digestibility of potato starch with controlled surface-removed levels[J]. Food Hydrocolloids,2023,134:108062. doi: 10.1016/j.foodhyd.2022.108062
[31] 万芊. 多酚与玉米淀粉的相互作用及其对淀粉消化和加工特性的影响[D]. 无锡:江南大学, 2019. [WAN X. Interaction of polyphenols with corn starch and their effects on starch digestion and processing characteristics[D]. Wuxi:Jiangnan University, 2019.] WAN X. Interaction of polyphenols with corn starch and their effects on starch digestion and processing characteristics[D]. Wuxi: Jiangnan University, 2019.
[32] XU J H, LI X, CHEN J, et al. Effect of polymeric proanthocyanidin on the physicochemical and in vitro digestive properties of different starches[J]. LWT,2021,148:111713. doi: 10.1016/j.lwt.2021.111713
[33] AMOAKO D, AWIKA J M. Polyphenol interaction with food carbohydrates and consequences on availability of dietary glucose[J]. Current Opinion in Food Science,2016,8:14−18. doi: 10.1016/j.cofs.2016.01.010
[34] MADRUGA M S, de ALBUQUERQUE F S M, SILVA I R A, et al. Chemical, morphological and functional properties of Brazilian jackfruit (Artocarpus heterophyllus L.) seeds starch[J]. Food Chemistry,2014,143:440−445. doi: 10.1016/j.foodchem.2013.08.003
[35] MA S P, ZHU P L, WANG M C. Effects of konjac glucomannan on pasting and rheological properties of corn starch[J]. Food Hydrocolloids,2019,89:234−240. doi: 10.1016/j.foodhyd.2018.10.045
[36] HUANG G R, WANG F, YANG R, et al. Characterization of the physicochemical properties of Lipu Colocasia esculenta (L.) Schott starch:A potential new food ingredient[J]. International Journal of Biological Macromolecules,2024,254:127803. doi: 10.1016/j.ijbiomac.2023.127803
[37] CHI C D, LI X X, ZHANG Y P, et al. Modulating the in vitro digestibility and predicted glycemic index of rice starch gels by complexation with gallic acid[J]. Food Hydrocolloids,2019,89:821−828. doi: 10.1016/j.foodhyd.2018.11.016
[38] MAO S F, REN Y M, YE X Q, et al. Regulating the physicochemical, structural characteristics and digestibility of potato starch by complexing with different phenolic acids[J]. International Journal of Biological Macromolecules,2023,253:127474. doi: 10.1016/j.ijbiomac.2023.127474
[39] CHAI Y W, WANG M Z, ZHANG G Y. Interaction between amylose and tea polyphenols modulates the postprandial glycemic response to high-amylose maize starch[J]. Journal of Agricultural and Food Chemistry,2013,61(36):8608−8615. doi: 10.1021/jf402821r
[40] 于美汇. 肉桂酸基酚酸调控淀粉消化性的机制及构效关系研究[D]. 无锡:江南大学, 2023. [YU M H. Study on the mechanism and structure-activity relationship of cinnamic acid-based phenolic acid regulating starch digestibility[D]. Wuxi:Jiangnan University, 2023.] YU M H. Study on the mechanism and structure-activity relationship of cinnamic acid-based phenolic acid regulating starch digestibility[D]. Wuxi: Jiangnan University, 2023.
[41] ZHENG M, SU H, LUO M, et al. Effect of hydrocolloids on the retrogradation of lotus seed starch undergoing an autoclaving–cooling treatment[J]. Journal of Food Science,2019,84(3):466−474. doi: 10.1111/1750-3841.14480
[42] WANG Y Y, GUO J Y, WANG C Y, et al. Effects of konjac glucomannan and freezing on thermal properties, rheology, digestibility and microstructure of starch isolated from wheat dough[J]. LWT,2023,177:114588. doi: 10.1016/j.lwt.2023.114588
[43] TARAHI M, HEDAYATI S, SHAHIDI F. Effects of mung bean (Vigna radiata) protein isolate on rheological, textural, and structural properties of native corn starch:Polymers[Z]. Polymers (Basel), 2022:14(15):3012.
[44] WANG M T, SHEN Q, HU L L, et al. Physicochemical properties, structure and in vitro digestibility on complex of starch with lotus (Nelumbo nucifera Gaertn.) leaf flavonoids[J]. Food Hydrocolloids,2018,81:191−199. doi: 10.1016/j.foodhyd.2018.02.020
[45] LI S, LIU H M, ZHENG Q H, et al. Effects of soluble and insoluble dietary fiber from corn bran on pasting, thermal, and structural properties of corn starch[J]. Starch - Stä rke,2022,74(5-6):2100254.
[46] WANG S Q, WU T H, CUI W J, et al. Structure and in vitro digestibility on complex of corn starch with soy isoflavone[J]. Food Science & Nutrition,2020,8(11):6061−6068.
[47] ZHANG Y J, HU M J, ZHU K X, et al. Functional properties and utilization of Artocarpus heterophyllus Lam seed starch from new species in China[J]. International Journal of Biological Macromolecules,2018,107:1395−1405. doi: 10.1016/j.ijbiomac.2017.10.001
[48] ZHENG Y X, TIAN J H, KONG X L, et al. Proanthocyanidins from Chinese berry leaves modified the physicochemical properties and digestive characteristic of rice starch[J]. Food Chemistry,2021,335:127666. doi: 10.1016/j.foodchem.2020.127666
[49] BUILDERS P F, MBAH C C, ADAMA K K, et al. Effect of pH on the physicochemical and binder properties of tigernut starch[J]. Starch - Stä rke,2014,66(3−4):281−293.
[50] ZUO Y, ZHU F, JIANG S, et al. Differences in structure, physicochemical properties, and in vitro digestibility of three types of starch complexed with tannic acid[J]. Food Hydrocolloids,2024,157:110419. doi: 10.1016/j.foodhyd.2024.110419
[51] LIU B, ZHONG F, YOKOYAMA W, et al. Interactions in starch co-gelatinized with phenolic compound systems:Effect of complexity of phenolic compounds and amylose content of starch[J]. Carbohydrate Polymers,2020,247:116667. doi: 10.1016/j.carbpol.2020.116667
[52] HE T, WANG K, ZHAO L, et al. Interaction with longan seed polyphenols affects the structure and digestion properties of maize starch[J]. Carbohydrate Polymers,2021,256:117537. doi: 10.1016/j.carbpol.2020.117537
[53] 刘玉杰, 季嘉城, 张硕, 等. 刺梨中鞣花酸的分离鉴定及提取工艺的优化[J]. 食品工业科技,2023,44(8):212−220. [LIU Y J, JI J C, ZHANG S, et al. Isolation and identification of ellagic acid in prickly pear and optimization of extraction process[J]. Science and Technology of Food Industry,2023,44(8):212−220.] LIU Y J, JI J C, ZHANG S, et al. Isolation and identification of ellagic acid in prickly pear and optimization of extraction process[J]. Science and Technology of Food Industry, 2023, 44(8): 212−220.
[54] WEI X, XIE H, HU Z, et al. Multiscale structure changes and mechanism of polyphenol-amylose complexes modulated by polyphenolic structures[J]. International Journal of Biological Macromolecules,2024,262:130086. doi: 10.1016/j.ijbiomac.2024.130086
[55] XIAO Q, WAN B, YING R, et al. The physicochemical and in vitro digestion characteristics of Cynanchum auriculatum Royle ex Wight starch-tea polyphenols non-inclusive complex[J]. International Journal of Food Science & Technology,2024,59(5):2971−2982.
[56] IGOUMENIDIS P E, ZOUMPOULAKIS P, KARATHANOS V T. Physicochemical interactions between rice starch and caffeic acid during boiling[J]. Food Research International,2018,109:589−595. doi: 10.1016/j.foodres.2018.04.062
[57] WANG Y, HAN S, HAO Z, et al. Preparation of the black rice starch-gallic acid complexes by ultrasound treatment:Physicochemical properties, multiscale structure, and in vitro digestibility[J]. International Journal of Biological Macromolecules,2024,263:130331. doi: 10.1016/j.ijbiomac.2024.130331
[58] MA Y, CHEN Z, WANG Z, et al. Molecular interactions between apigenin and starch with different amylose/amylopectin ratios revealed by X-ray diffraction, FT-IR and solid-state NMR[J]. Carbohydrate Polymers,2023,310:120737. doi: 10.1016/j.carbpol.2023.120737
[59] YU M, LIU B, ZHONG F, et al. Interactions between caffeic acid and corn starch with varying amylose content and their effects on starch digestion[J]. Food Hydrocolloids,2021,114:106544. doi: 10.1016/j.foodhyd.2020.106544
[60] MAIBAM B D, NICKHIL C, DEKA S C. Preparation, physicochemical characterization, and in vitro starch digestibility on complex of Euryale ferox kernel starch with ferulic acid and quercetin[J]. International Journal of Biological Macromolecules,2023,250:126178. doi: 10.1016/j.ijbiomac.2023.126178
[61] WANG J, YANG H, LUO L, et al. Persimmon leaf polyphenols as potential ingredients for modulating starch digestibility:Effect of starch-polyphenol interaction[J]. International Journal of Biological Macromolecules,2024,270:132524. doi: 10.1016/j.ijbiomac.2024.132524
[62] 柴子淇. 山楂多酚对玉米淀粉理化性质和消化特性的影响[D]. 杭州:浙江大学, 2023. [ZHAI Z Q. Effect of hawthorn polyphenols on physicochemical properties and digestibility of corn starch[D]. Hangzhou:Zhejiang University, 2023.] ZHAI Z Q. Effect of hawthorn polyphenols on physicochemical properties and digestibility of corn starch[D]. Hangzhou: Zhejiang University, 2023.
[63] ENGLYST H N, KINGMAN S M, CUMMINGS J H. Classification and measurement of nutritionally important starch fractions[J]. European Journal of Elinical Nutrition,1992,46,2:S33−S50.





 下载:
下载:
 下载:
下载:



