Effects of Dietary Fiber Concentration of Nano-sized Bamboo Shoots on the Formation of Yogurt Gel Network
-
摘要: 为明确不同浓度纳微化笋膳食纤维对酸奶凝胶形成的影响,以期为高纤维酸奶加工选择纤维添加量提供理论依据。采用超声-压热辅助酶解制备纳微化笋膳食纤维,研究了纤维浓度对乳蛋白粘附及酸奶凝胶网络结构的影响。显微观察发现高浓度(1.50%w/w)纳微化笋膳食纤维可与乳蛋白发生明显粘附,影响酪蛋白聚集颗粒形成。红外光谱结果显示粘附作用归因为酪蛋白氨基与纤维多羟基间的氢键互作。与无纤维酸奶相比,低浓度(0.75%w/w)纳微化笋膳食纤维提高了酸奶的发酵酸度(提高了7.41%)与酸奶的束缚水比例(提高了33.59%),形成稳定的“奶酪状”凝胶;而高浓度纤维因大量粘附干扰了酪蛋白分子排列,增加凝胶模量的损耗正切值(tanδ),不利于酸奶凝胶结构稳定。因此,选择低浓度纤维添加量可有效优化酸奶的加工品质。Abstract: The effect of nano-sized bamboo shoot dietary fiber concentration on gel network of yogurt was studied to provide a theoretical basis for the selection of fiber additions in the processing of high-fibre yogurt. The dietary fiber was degraded by ultrasonic autoclave-assisted enzymatic hydrolysis. The effects of fiber concentration on milk protein adhesion and network structure of yogurt gel were investigated. Microscopic observation showed that high concentration (1.50% w/w) of nano-sized dietary fiber could undergo significant adhesion with milk proteins and affect the formation of casein aggregation particles. Infrared spectroscopy results indicated that the adhesive effect is due to hydrogen bonding between casein amino groups and fibre polyhydroxy structure. Compared to yogurt without fiber, the low concentration (0.75% w/w) of nano-sized dietary fiber increases the fermentation acidity of yogurt by 7.41% and the amount of bound water by 33.59%, forming a stable 'cheese-like' gel. However, the high concentration fiber (1.50% w/w) disrupted the molecular orientation of the casein due to massive adhesion, increasing the loss tangent (tanδ) of the gel modulus, which is not conducive to the structural stability of yogurt gels. Therefore, the choice of a low fibre addition concentration can be effective in the optimization of yogurt processing quality.
-
Keywords:
- bamboo shoot /
- nano-sized dietary fiber /
- yogurt /
- adhesion /
- casein gel
-
高纤酸奶是在酸奶发酵工艺基础上添加可溶性或不溶性膳食纤维,通过巴氏杀菌,乳酸菌等益生菌保温发酵形成的凝乳状制品。高纤酸奶兼具优质蛋白及膳食纤维,具有美味与健康的双重属性,近年来深受消费者喜爱。然而,大部分植物基不溶性膳食纤维具有结晶度高、颗粒感强的原料特点[1],高纤酸奶加工具有凝胶性能弱,纤维相容性差、口感粗糙等缺点[2],限制了酸奶产品创制及市场的可接受程度。因此,通过绿色安全的加工方式降低植物基不溶性膳食纤维的颗粒尺寸,并软化物化质地是解决膳食纤维作为食品配料的关键问题,对实现高纤酸奶品质升级具有重要意义。
纳微化改性是联合高能机械处理与生物酶降解纤维素颗粒尺度的绿色加工方法。植物基膳食纤维经纳微化改性后纤维内部亲水基团暴露,体积溶胀,比表面积显著增大[3−5],可作为天然增稠剂优化凝固型酸奶的凝胶性能,改性的效果取决于纳微化纤维的形态[6]、使用浓度[7]及分散性[8]。Tian等[9]研究发现微射流与纤维素酶结合改性形成的大豆纳微化膳食纤维降低了酪蛋白凝胶孔隙度,提高了凝胶网络强度,有效抑制了凝固型酸奶的乳清析出。Meena等[10]发现,添加体积浓度0.25% w/v超微化菠萝渣不溶性膳食可以延长低温货架酸奶凝胶15天以上。Wang等[11]研究表明,高强度超声结合酶解处理可将90%以上的不溶性膳食纤维转化为可溶性膳食纤维,纳米可溶性膳食纤维可作为益生元替代菊粉提高发酵活菌量,维持货架期酸奶的凝胶品质稳定。
前期实验研究发现,超声压热辅助酶法降解形成的纳微化笋膳食纤维在适宜浓度范围(0.1%~0.9% w/w)内可优化酪蛋白凝胶网络结构,显著降低凝固型酸奶低温货架的乳清析出率,而较高浓度的膳食纤维(质量浓度高于1% w/w)会阻碍酪蛋白的凝胶网络形成[12]。这说明不溶性膳食纤维浓度是影响凝固型酸奶凝胶性能稳定的重要因素。目前,膳食纤维浓度影响酸奶凝胶网络形成的作用机制还未见报道。因此,本研究采用笋加工副产物笋头为原料制备纳微化笋膳食纤维,研究不同浓度纤维对乳蛋白的吸附能力,基于微纤丝与乳体系的粘附状态、基团互作以及酸奶凝胶水分分布变化等角度,解析纳微化笋膳食纤维影响酸奶凝胶网络形成的作用机制。本研究可为膳食纤维干预乳蛋白凝胶网络形成提供理论支持,为高纤酸奶研发选择合适纤维添加量提供参考借鉴。
1. 材料与方法
1.1 材料与仪器
笋头 市售;巴氏鲜奶 长富乳品有限公司提供;乳清蛋白粉、菊粉 食品级,绿城食品配料商城提供;聚单丁烯(消泡剂) 浙江一诺生物科技有限公司提供;碱性蛋白酶(200000 U/g)、纤维素酶(50000 U/g) 江苏锐阳生物科技有限公司提供;罗丹明B 北京索莱宝生物科技有限公司提供;保加利亚乳杆菌、嗜热链球菌、嗜酸乳杆菌 福建长富乳品有限公司提供;细白砂糖 市售;其余乙醇、氢氧化钠等常规试剂均为国产分析纯。
HT-2000CS型超声反应釜 上海霍桐仪器有限公司;T50 digital型分散机 艾卡仪器设备有限公司;LRH-160型生化培养箱 上海一恒科学仪器有限公司;NS1001L型高压均质机 意大利GEA Niro Soavi有限公司;Bettersize2600型激光粒度仪 丹东百特仪器有限公司;ECLIPSE Ts2-FL型荧光显微镜 尼康映像仪器销售(中国)有限公司;Dimension Icon型原子力显微镜 德国布鲁克仪器有限公司;Physical 302 型旋转流变仪 奥地利安东帕仪器有限公司;ICAN9型傅里叶红外光谱仪 天津能谱科技有限公司;Apreo 2C型场发射扫描电镜 美国赛默飞科技有限公司;NMI20-015V-I型低频氢谱核磁共振仪 上海纽迈科技有限公司。
1.2 实验方法
1.2.1 纳微化笋膳食纤维制备
笋头经烘干,粉碎后进行脱蛋白处理,根据超声-压热协同酶解方法[12]进行纳微化笋膳食纤维(nano-sized bamboo dietary fiber,NBDF)制备,具体方法为:脱蛋白的笋头细粉配制为质量浓度为50 g/L的悬浊液,采用超声-压热反应釜处理,压热温度为125 ℃,时间60 min,超声功率800 W。反应结束后调节反应溶液pH5.0,控制温度为55 ℃,加入质量浓度5 g/L的纤维素酶反应8 h以上。采用激光粒度仪测试膳食纤维粒径,控制粒径尺度D50范围在10~30 μm。膳食纤维经冷冻干燥后自封袋封装,保存备用。
1.2.2 凝固型酸奶的加工工艺
1.2.2.1 鲜奶与纤维粉混料
称取800 g 巴氏鲜奶加热至80 ℃,之后依次加入食品配料,包括7.0% 白砂糖、2.5% 乳清粉,0.5% 菊粉,以鲜奶质量分数计),搅拌1~2 min待溶解完全后,基于酸奶与配料总质量分别添加质量分数为0.75% w/w与1.50%w/w的纳微化膳食纤维粉末,继续搅拌混合均匀。加热温度选择考虑到纳微化膳食纤维在该温度下与各配料具有良好的分散性。低浓度(0.75% w/w)纤维酸奶组命名为M/NBDF-L,高浓度(1.50%w/w)纤维酸奶组命名为M/NBDF-H,未添加膳食纤维的酸奶作为对照组,命名为M。
1.2.2.2 乳化与均质
利用乳化分散机对鲜奶混料进行处理(剪切参数:转速5500 r/min、时间3 min),调节压力为20 MPa对乳化后的鲜奶混料均质一次,使体系各物料分散融合均匀。
1.2.2.3 加热杀菌
鲜奶混料水浴加热至中心温度达95 ℃,保持10 min,待杀菌完成后快速冷却至室温。
1.2.2.4 接种及分装
杀菌后鲜奶置于超净工作台中接种乳酸菌混合发酵剂(保加利亚乳杆菌、嗜热链球菌、嗜酸乳杆菌),接种量以酸奶质量共计为100 mg/kg,震荡混匀后分装至无菌的酸奶瓶,每瓶150 mL,旋盖密封。
1.2.2.5 发酵与后熟
鲜奶接种后置于生化培养箱中保持42 ℃,发酵6 h。发酵完成后置于2~6 ℃环境下后熟贮藏1 d,4 ℃冷藏保存。发酵结束后,采用梯度稀释、平板涂布法测试
得到M组、M/NBDF-L组以及M/NBDF-H组酸奶的活菌量均高于108CFU/g。
1.2.3 纳微化笋膳食纤维与牛乳共混的镜像观察
1.2.3.1 荧光染色观察
分别称取纳微化膳食纤维与鲜奶共混,配制成质量浓度分别为0.75%w/w与1.50%w/w的悬浮液。取10 mL热杀菌后的悬浮液冷却至室温,加入200 μL 质量浓度为5 mg/mL的罗丹明B荧光染色剂,涡旋振荡10 s后置于37 ℃培养箱中铝箔纸包裹避光孵化5 min,结束反应溶液10000 r/min离心10 min,倾倒上清液,将沉淀用超纯水清洗2次后涡旋振荡2 min,吸取少量样品悬浮液置于荧光显微镜下观察纳微化笋膳食纤维对蛋白的吸附情况。其中激发波长为405 nm,罗丹明的发射波长为520 nm。
1.2.3.2 原子力显微观察
取10 mL加热杀菌后的鲜奶混料(鲜奶+膳食纤维)冷却至室温,涡旋振荡2 min使其分散均匀后,吸取200 μL样液滴加至洁净的云母片上,氮气吹干,采用原子力显微镜观察纳微化笋膳食纤维与乳蛋白的接触及吸附情况。图像扫描频率为0.5 Hz,扫描分辨率为512×512,图片尺寸为2×2 μm。
1.2.4 高纤酸奶发酵前后红外光谱测试
参考Silva等[13]关于酪蛋白粉末的测试方法。取5 mL加热杀菌后的鲜奶混料进行冷冻干燥用于红外光谱测试。具体方法如下:取20 mg样品粉末于石英撵钵中,加入500 mg光谱纯溴化钾,置于红外灯下快速研磨(减小二氧化碳吸收),模具压片后进行光谱扫描。扫描参数: 波数400~4000 cm−1,分辨率4 cm−1,扫描次数为32次。
1.2.5 酸奶的发酵酸度及涂布性测试
牛乳与不同浓度的笋膳食纤维共混后置于生化培养箱中,控制发酵温度为42 ℃,发酵时间分别为4.0、4.5、5.0、5.5、6.0、6.5 h,测定不同发酵时间点的牛乳酸度及质构涂布性。酸奶酸度的测试方法参照国标GB5009.239-2016《食品酸度的测定》测定酸奶的滴定酸度。采用质构仪对制备得到的凝固型酸奶的质构涂布性进行分析。实验选用锥形探头,下降速度与测试速度恒为1.0 mm/s,触发力为15 g,保持时间为30 s,记录整个过程样品下塌的距离,记录样品的涂布性。
1.2.6 酸奶的扫描电镜测试
采用工具挖勺取出形状规整的5 g高纤酸奶样品进行冷冻干燥,待干燥结束后对半切开样品,将截面置于贴有导电胶的金属载物铜板上,喷金处理3 min,之后转移至扫描电镜腔体中进行测试观察酸奶酪蛋白凝胶网络,测试电压为120 kV,测试倍数为10000倍。
1.2.7 高纤酸奶水分分布测试
采用低频氢谱核磁共振波谱仪测试不同膳食纤维添加量酸奶的水分分布状态[14],测试方法修改如下:取2 g凝固型酸奶于15 mL核磁管,采用CPMG序列进行T2弛豫时间扫描,通过弛豫时间评价纳微化膳食纤维对凝固型酸奶各水分组分的影响。其中,测试环境温度为25 ℃,回声时间为400 μs,回声次数为8000次,间隔时间为8 s,平行测量扫描8次。根据水分体系弛豫吸收峰在横向弛豫时间T2覆盖的峰面积差异,水分大致概分为自由水(T23>100 ms)、不易流动水(100 ms >T22>1 ms)以及结合水(1 ms>T21>0 ms)。
1.2.8 酸奶的流变学性能测试
采用旋转流变仪搭配同心圆筒模具测试不同膳食纤维浓度下酸奶的凝胶强度。测试方式如下:取20 g酸奶置于同心圆筒模具,通过振幅扫描确定酸奶样品共有的线性粘弹区(ε=0.5%),之后平衡样品5 min,设置扫描温度为10 ℃,保持振幅频率为0.1~100 Hz进行频率扫描,记录获得酸奶的储存模量(G'),损耗模量(G''),损耗正切值tanδ=G''/G'。
1.3 数据处理
实验数据平行测试3次,采用DPS 9.05统计软件进行数据统计,新复极差法进行显著性分析,数据间的显著性差异用小写字母表示,P<0.05。图片采用orign8.5进行绘制。
2. 结果与分析
2.1 纳微化笋膳食纤维对乳蛋白的吸附效果
不同浓度纳微化笋膳食纤维对乳蛋白的吸附效果如图1所示。M组的乳蛋白可以被罗丹明B标记从而呈现明亮的红色荧光。纳微化笋膳食纤维溶液经罗丹明B孵化离心后沉淀未观察到大量红色荧光,表明纤维素本身不能被罗丹明B荧光标记(见NBDF-L与NBDF-H)。乳体系与罗丹明B共混孵化后,膳食纤维沉淀呈现红色荧光,且M/NBDF-H观察到更多红色荧光聚集体。研究结果表明纳微化笋膳食纤维能够吸附或粘结乳蛋白,纤维增多会引起乳蛋白聚集。本研究观察结果与Khakalo等[15−16]报道的一致,他们发现酪蛋白与纤维素纳米纤维丝共混加热过程会发生界面能驱动下彼此吸附。因此,推测纳微化笋膳食纤维粘附的主要蛋白质为酪蛋白。
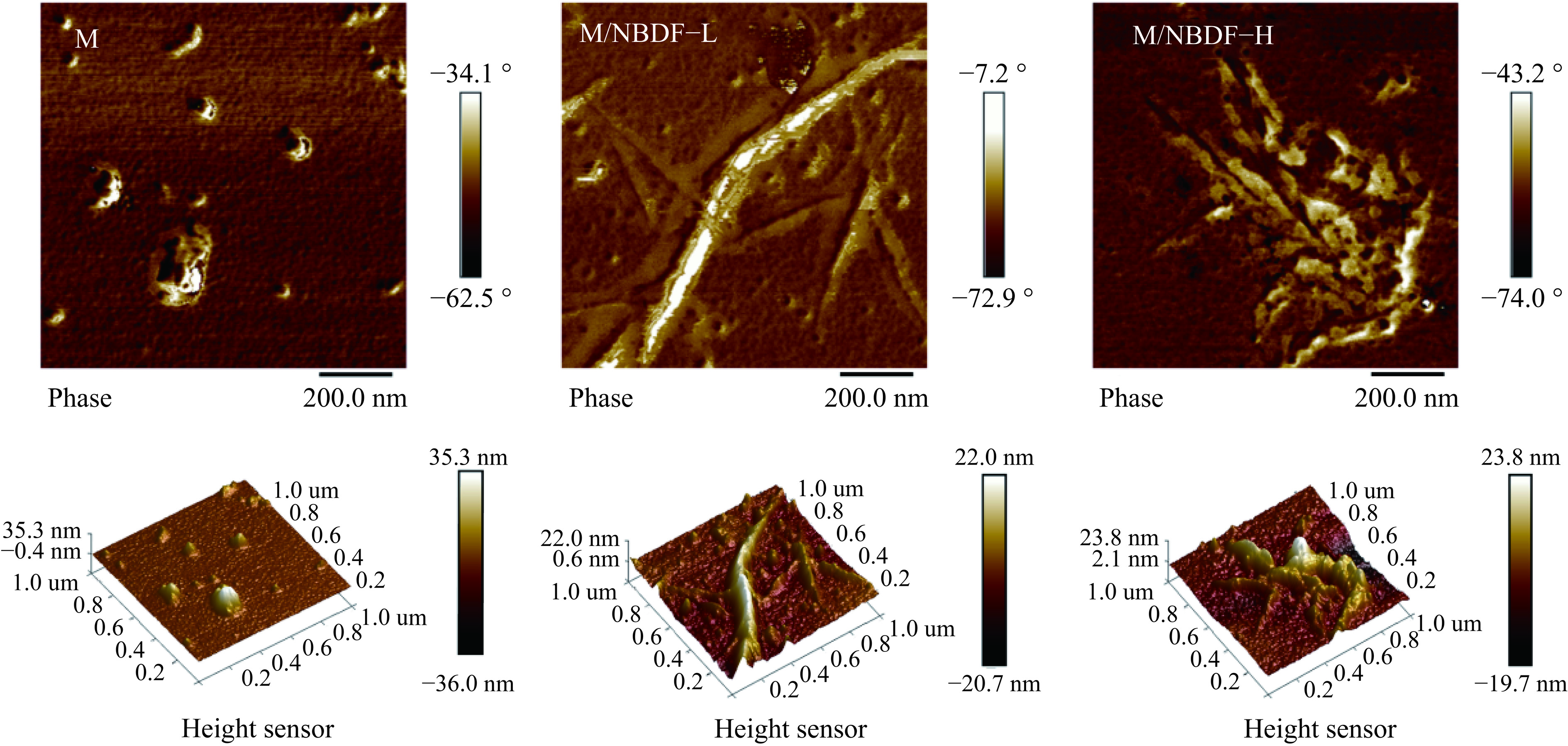
采用原子力显微镜进一步从分子层面评价了纳微化笋膳食纤维与乳蛋白的粘附作用。不同浓度纳微化笋膳食纤维与乳蛋白粘附的原子力显微镜图,见图2所示。乳蛋白呈现直径约40~150 nm的球状颗粒结构(Rq=4.88 nm),这归咎于酪蛋白经过氮气吹扫快速失水而引起分子链团聚形成球状胶束[17]。纳微化笋膳食纤维会影响乳蛋白分子的微观形态。M/NBDF-L体系可观察到明显的丝状纤维,蛋白分子颗粒均匀分散在纤维周边,只有少量乳蛋白粘附在纤维表面。M/NBDF-L体系的表面形貌平整,粗糙度Rq=2.75 nm。另一方面,M/NBDF-H体系可观察到膳食纤维与蛋白颗粒大量团聚,体系的整体形貌变得粗糙(Rq=5.02 nm)。此研究结果证明了纤维浓度升高容易导致乳蛋白大量富集在纤维丝表面。已有报道表明,高浓度的纳米微纤丝在热力学不稳定状态下易通过分子疏水作用发生分子团聚[18]。因此,推测纤维素与乳体系在热加工过程中发生了更多的相互作用。
2.2 纳微化笋膳食纤维与乳蛋白吸附的官能团结构变化
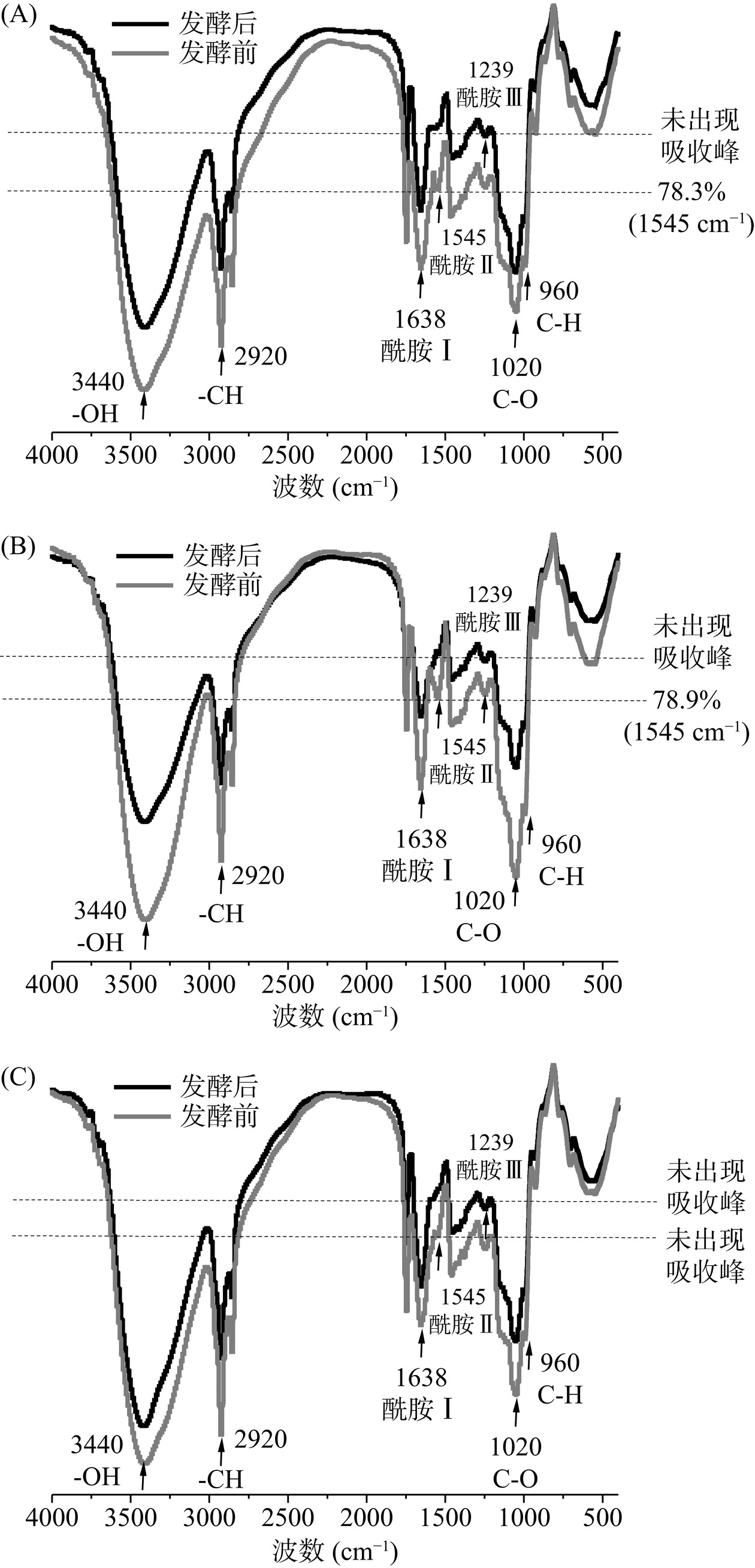
不同浓度纳微化笋膳食纤维与乳体系共混发酵前后的红外光谱变化,见图3。冻干酸奶粉末在波数为3440 cm−1处表示为-OH振动吸收峰,而在2920 cm−1处表示-CH振动吸收峰;1200~1700 cm−1为乳体系酪蛋白的特征吸收带,其中1638 cm−1为酰基I(C=O)振动吸收峰[19],1545 cm−1为酰基II(N-H)振动吸收峰[20],1449、1387和1239 cm−1为酰基III的振动吸收峰[21]。研究发现,发酵前M组酸奶与M/NBDF-L组酸奶的红外光谱在1545 cm−1出显示出明显的吸收峰(透过率为78.3%与78.9%),经发酵后酰基II(N-H)吸收峰消失。这可能归咎于乳体系发酵后体系pH值下降引起的酪蛋白磷酸盐电离,游离的酪蛋白氨基在水合作用下形成分子间氢键[22],形成凝胶网络。然而,M/NBDF-H组酸奶发酵前在1545 cm−1没有观察的到明显的酰基II(N-H)吸收峰,发酵后也未观察到明显的酰基II(N-H)吸收峰。这说明酸奶在发酵前酪蛋白氨基可能与纳微化纤维羟基形成氢键而被屏蔽。这些结果说明纳微化笋膳食纤维能与酪蛋白分子发生羟基-氨基互作,影响酪蛋白水合。
2.3 纳微化笋膳食纤维对凝固型酸奶发酵酸度及涂布性的影响
乳体系的发酵酸度会随着乳酸菌生长呈现上升趋势。当乳体系pH值下降至酪蛋白等电点时,酪蛋白变性水合形成胶束引起酸奶凝固成型。不同浓度纳微化笋膳食纤维对酸奶发酵酸度的影响见图4。酸奶的发酵酸度随发酵时间呈现上升趋势,各纤维组的发酵酸度均高于M组。当纳微化膳食纤维添加量为0.75%w/w时,酸奶发酵6 h后体系酸度达到91.66 oT,这与M组相比酸度增加了7.41%。此结果说明了添加纳微化膳食纤维可以提高酸奶的发酵酸度,这可能与笋膳食纤维在纳微化加工过程中降解形成了部分可溶性纤维,促进了乳酸菌的β-半乳糖苷酶及乳酸脱氢酶活力,使得乳酸菌代谢乳糖产生乳酸增多[23]。刘萍[24]也发现大豆可溶性膳食纤维可加速酸奶的发酵进程并提高其发酵酸度。酸奶发酵过程的质构涂布性分析显示,酸奶的质构涂布性随着发酵时间的增加呈现下降趋势。M组经发酵5 h后质构涂布性趋于稳定,涂布性数值为5.28 mm。然而,低浓度纳微化膳食纤维可以改善酸奶的涂布性,M/NBDF-L酸奶的涂布性数值为8.15 mm,与M组相比提高了54.35%;然而,M/NBDF-H酸奶发酵6 h后涂布性趋于稳定,且涂布性数值低于M组。这些结果说明高浓度纳微化膳食纤维会破坏酸奶的凝胶网络,造成体系稀化,涂布性能下降。黄子珍等[25]研究表明不溶性膳食纤维与乳蛋白间的相容性较差,会显著影响发酵体系pH值下降导致的酪蛋白分子凝聚。酸奶发酵过程酸度与涂布性数据变化说明了高浓度纳微化膳食纤维并不是通过改变发酵体系酸度来干预凝胶网络形成。
2.4 纳微化笋膳食纤维对凝固型酸奶微观结构的影响
不同浓度纳微化笋膳食纤维对酸奶凝胶微观形态的影响,见图5。牛乳经发酵形成的凝胶网络是由许多明晰的蛋白球形颗粒连接形成,凝胶网络形态粗糙,排列松散且孔隙大小不均。Ouyang等[26]研究报道表明松散的乳蛋白凝胶网络会显著影响酸奶的流变学性质,增加乳清析出。不同浓度纳微化笋膳食纤维对酸奶凝胶形态的干预差异较大。M/NBDF-L酸奶的可塑性较好并呈现乳酪状的凝胶形态,微观结构致密平整并伴有微小气孔;M/NBDF-H酸奶的凝胶形态松散,乳蛋白颗粒被拉伸扭曲并与纤维共混成团,表现出粗糙、大孔隙的凝胶微观形态。这也与AFM电镜观察的结构较为一致。电镜观察结果表明低浓度纳微化膳食纤维可以有效改善酸奶的凝胶网络,而高浓度纤维则不利于酸奶凝胶网络形成。已有报道显示,果胶[27]、氧化魔芋葡甘聚糖[28]、银耳多糖[29]、瓜尔豆胶[30]等可溶性多糖均能够稳定酸奶的凝胶网络结构,而较高的添加量(>1%w/v)会造成凝胶网络收缩或结构性塌陷。高浓度多糖引起酸奶凝胶网络劣化,主要原因可能是多糖分子链形成的空间位干预了酪蛋白凝胶网络聚集[31]。
2.5 纳微化笋膳食纤维对凝固型酸奶凝胶水分分布的影响
酸奶的低温后熟阶段是酪蛋白凝胶网络稳定的关键步骤,对酸奶的质构形成具有重要作用[32]。不同浓度纳微化笋膳食纤维对酸奶后熟前后凝胶水分分布的影响见图6所示。所有酸奶样品在低场氢谱核磁扫描过程中均显示出两个明显的水分弛豫峰,分别表示结合水(T21:0~1 ms)以及束缚-自由水混合组分(T22-23:10~1000 ms)。这说明酸奶中的束缚水与自由水界限区分不明显。无论是否添加膳食纤维,酸奶的自由水弛豫峰面积比例均高于90%,说明酸奶经发酵结束后体系仍以自由水为主。M组酸奶经低温后熟24 h后水分弛豫时间向低频方向移动,同时束缚水占比由5.75%增加至18.45%,表明酸奶在低温后熟过程中酪蛋白凝胶网络逐渐稳定,部分自由水转移为束缚水。M/NBDF-L组酸奶经低温后熟24 h后束缚水比例增加了33.59%,与M组酸奶相比显示出更高的束缚水比例。然而,M/NBDF-H组酸奶经低温后熟后束缚水比例仅为8.91%,低于M组酸奶。这说明低浓度与高浓度纳微化膳食纤维对酸奶凝胶网络水分分布的影响并不一致,影响效果存在浓度-效应多重性,适量添加可以协助增强后熟阶段的酪蛋白凝胶,而高浓度添加会干预凝胶网络结构的形成。
表 1 不同浓度高纤酸奶后熟前后水分比例的变化Table 1. Changes in the water content of high-fibre yogurts with different concentrations before and after ripening纤维组 后熟前 后熟后 结合水
比例(%)束缚水
比例(%)自由水
比例(%)结合水
比例(%)束缚水
比例(%)自由水
比例(%)M 3.70±0.30a 5.75±0.12c 90.55±1.05a 3.81±0.23a 18.45±0.14b 77.74±1.87b M/NBDF-L 3.24±0.13b 10.73±1.03a 86.03±0.76c 2.97±0.22b 44.32±0.52a 52.71±1.12c M/NBDF-H 4.14±0.16a 7.08±0.34b 88.78±0.65b 4.21±0.26a 8.91±0.41c 86.88±0.47a 注:同一列数据不同小写字母表示差异显著(P<0.05)。 2.6 纳微化笋膳食纤维对凝固型酸奶流变学特性的影响
不同浓度纳微化笋膳食纤维对凝固型酸奶凝胶强度的影响,见图7。所有酸奶的储存模量(G’)值大于损耗模量(G'')值并表现出明显的频率依赖性,这说明酸奶形成了粘弹性的凝胶网络结构。M组显示出较高的储存模量并在频率振动下出现损耗正切值(tanδ)升高的现象,这说明M组酸奶形成的凝胶网络不稳定。相比M组酸奶,M/NBDF-L酸奶的储存模量降低了53.35%,模量tanδ值在频率振动下变化幅度减小;然而,M/NBDF-H酸奶与M组酸奶相比储存模量降低了88.14%,且出现了频率振动下凝胶网络由出弹性凝胶向粘性液体转变的现象。这些研究结果表明,低浓度纳微化膳食纤维能够增强酸奶凝胶网络的剪切稳定性,这可能是因为纤维丝分布在凝胶中形成更多穿插的胶体连接区。高浓度的纳微化膳食纤维会造成凝胶质构劣化,主要表现为凝胶强度和网络稳定性显著下降。Du等[33]也发现相同的研究结果,桑果渣多糖对酸奶凝胶网络形成呈现出强烈的浓度-效应关系,大量添加导致酸奶凝胶网络结构崩解,这取决于桑果渣多糖具有强烈的水溶胀性可在酪蛋白凝胶过程中竞争结合水分,导致酪蛋白分子在疏水基团作用下发生聚集。Xu等[31]发现过量添加大豆多糖也会造成酸奶凝胶网络的质构崩解,质构崩解的机制可被阐述为大豆多糖产生的静电作用引起了酪蛋白的絮凝作用。
3. 结论
采用超声-压热结合酶法改性制备纳微化笋膳食纤维,研究了不同浓度纳微化笋膳食纤维对酸奶凝胶网络形成的影响。研究发现,微化笋膳食纤维对酸奶凝胶网络的形成表现出浓度-效应多重性,即低浓度(0.75%w/w)纤维添加有利用优化酸奶的凝胶网络,而添加浓度过高(1.50%w/w)则会破坏酪蛋白凝胶网络的形成。浓度-效应多重性主要归咎为纳笋膳食纤维与酪蛋白分子间的粘附及分子间相互作用。当纳微化笋膳食纤维添加量较低(0.75%w/w)时,纳微化笋膳食纤维的乳蛋白粘附及互作效果并不明显,但可将乳体系部分自由水转移为束缚水(提高了33.59%),从而与乳蛋白形成“奶酪状”凝胶网络来强化酸奶的凝胶网络结构。纳微化笋膳食纤维添加浓度升高(1.50%w/w)会在微观层面上通过氢键与蛋白氨基互作发生大量粘附作用。这些粘附不仅会抑制后熟过程酸奶凝胶自由水向束缚水迁移,还会影响酪蛋白分子排列的规整度,造成酸奶凝胶网络在剪切振荡过程中具有较高的损耗正切值,显示出较差的稳定性。虽然,纳微化笋膳食纤维可以改善酸奶的凝胶网络,但高浓度的凝胶弱化效果限制其在酸奶加工的使用量,未来有必要通过改性等方式增强纤维素的带电性,或通过添加外源添加物等方式,降低纳微化膳食纤维与乳蛋白间的粘附,从而为高浓度纤维酸奶的研制提供技术支持。
-
表 1 不同浓度高纤酸奶后熟前后水分比例的变化
Table 1 Changes in the water content of high-fibre yogurts with different concentrations before and after ripening
纤维组 后熟前 后熟后 结合水
比例(%)束缚水
比例(%)自由水
比例(%)结合水
比例(%)束缚水
比例(%)自由水
比例(%)M 3.70±0.30a 5.75±0.12c 90.55±1.05a 3.81±0.23a 18.45±0.14b 77.74±1.87b M/NBDF-L 3.24±0.13b 10.73±1.03a 86.03±0.76c 2.97±0.22b 44.32±0.52a 52.71±1.12c M/NBDF-H 4.14±0.16a 7.08±0.34b 88.78±0.65b 4.21±0.26a 8.91±0.41c 86.88±0.47a 注:同一列数据不同小写字母表示差异显著(P<0.05)。 -
[1] 曹亚文. 米糠的微细化、性质及其在糙米发糕中的应用[D]. 无锡:江南大学, 2022. [CAO Y W. Micronization and properties of rice bran and its application in brown rice cakes[D]. Wuxi:Jiangnan University, 2022.] CAO Y W. Micronization and properties of rice bran and its application in brown rice cakes[D]. Wuxi: Jiangnan University, 2022.
[2] 田硕, 王晋伟, 孔祥云, 等. 挤压处理的麦麸对酸奶品质的影响[J]. 食品研究与开发,2024,45(9):127−133. [TIAN S, WANG J W, KONG X Y, et al. Effect of extruded wheat bran on the quality of yogurt[J]. Food Research and Development,2024,45(9):127−133.] TIAN S, WANG J W, KONG X Y, et al. Effect of extruded wheat bran on the quality of yogurt[J]. Food Research and Development, 2024, 45(9): 127−133.
[3] 卜智斌, 曾劲, 禹淞文, 等. 超声辅助复合酶法提取马蹄渣不溶性膳食纤维工艺优化及品质对比[J]. 现代食品科技,2023,39(7):177−183. [BU Z B, ZENG J, YU S W, et al. Process optimization for ultrasound-assisted composite enzymatic extraction of insoluble dietary fiber from water chestnut dregs and quality comparison[J]. Modern Food Science and Technology,2023,39(7):177−183.] BU Z B, ZENG J, YU S W, et al. Process optimization for ultrasound-assisted composite enzymatic extraction of insoluble dietary fiber from water chestnut dregs and quality comparison[J]. Modern Food Science and Technology, 2023, 39(7): 177−183.
[4] LIU T, LEI H Y, ZHEN X Y, et al. Advancements in modifying insoluble dietary fiber:Exploring the microstructure, physicochemical properties, biological activity, and applications in food industry-a review[J]. Food Chemistry,2024,458:140154. doi: 10.1016/j.foodchem.2024.140154
[5] REZVANI Z, HOSSEIN GOLI S A. Fabrication, physicochemical properties and structural characteristics of nanoparticles from carrot pomace and its insoluble dietary fiber[J]. Food Hydrocolloids,2023,145:109131. doi: 10.1016/j.foodhyd.2023.109131
[6] 郭晓菲. 纳微化膳食纤维制备及其在凝固型酸奶中应用[D]. 福州:福建农林大学, 2023. [GUO X F. Preparation of nanosized dietary fiber and its application in set yogurt[D]. Fuzhou:Fujian Agriculture and Forestry University, 2023.] GUO X F. Preparation of nanosized dietary fiber and its application in set yogurt[D]. Fuzhou: Fujian Agriculture and Forestry University, 2023.
[7] 王坤, 王小茹, 魏振林. 芦苇纳米纤维素对乳酸菌生长及酸奶品质的影响[J]. 农业科学研究,2021,42(1):47−50,59. [WANG K, WANG X R, WEI Z L. Effect of reed nanocellulose on growth of lactic acid bacteria and quality of yogurt[J]. Journal of Agricultural Sciences,2021,42(1):47−50,59.] WANG K, WANG X R, WEI Z L. Effect of reed nanocellulose on growth of lactic acid bacteria and quality of yogurt[J]. Journal of Agricultural Sciences, 2021, 42(1): 47−50,59.
[8] TANG L, HU M, BAI S R, et al. Extraction of insoluble soybean fiber by alternating ultrasonic/alkali and its improved superior physicochemical and functional properties[J]. International Journal of Biological Macromolecules,2024,263:130505. doi: 10.1016/j.ijbiomac.2024.130505
[9] TIAN Y, SHENG Y N, WU T, et al. Effect of modified okara insoluble dietary fibre on the quality of yoghurt[J]. Food Chemistry:X,2024,21:101064.
[10] MEENA L, NEOG R, YASHINI M, et al. Pineapple pomace powder (freeze-dried):Effect on the texture and rheological properties of set-type yogurt[J]. Food Chemistry Advances,2022,1:100101. doi: 10.1016/j.focha.2022.100101
[11] WANG J Y, HE S M, TAO S H, et al. Structural, physicochemical, prebiotic properties of guava pulp insoluble dietary fiber and its quality enhancement ability on cow/goat yogurt:Impacts of ultrasound-assisted enzyme treatment[J]. Food Bioscience,2024,58:103797. doi: 10.1016/j.fbio.2024.103797
[12] 陈秉彦, 郭晓菲, 林晓姿, 等. 纳微化笋膳食纤维改善酸奶货架期乳清析出的作用[J]. 食品科学, 2024, 45(16):10−18. [CHEN B Y, GUO X F, LIN X Z, et al. The role of nanosized bamboo dietary fiber in reducing whey separation in yogurt during shelf life[J]. Food Science, 2024.] CHEN B Y, GUO X F, LIN X Z, et al. The role of nanosized bamboo dietary fiber in reducing whey separation in yogurt during shelf life[J]. Food Science, 2024.
[13] SILVA SOUZA D S, TARTARE V A, SILVA BEGA B, et al. The pH role in casein-carboxymethyl cellulose nano/microparticles formation[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2024,682:132953.
[14] ZHANG K Y, TANG H W, FARID M S, et al. Effect of Lactobacillus helveticus exopolysaccharides molecular weight on yogurt gel properties and its internal mechanism[J]. International Journal of Biological Macromolecules,2024,262:130006. doi: 10.1016/j.ijbiomac.2024.130006
[15] KHAKALO A, FILPPONEN I, ROJAS O, et al. Protein-mediated interfacial adhesion in composites of cellulose nanofibrils and polylactide:Enhanced toughness towards material development[J]. Composites Science and Technology,2018,160:145−151. doi: 10.1016/j.compscitech.2018.03.013
[16] KHAKALO A, FILPPONEN I, ROJAS O, et al. Protein Adsorption Tailors the Surface Energies and Compatibility between Polylactide and Cellulose Nanofibrils[J]. Biomacromolecules,2017,18(4):1426−1433. doi: 10.1021/acs.biomac.7b00173
[17] REN J B, LIAO M J, MA L J, et al. Effect of spray freeze drying on the structural modification and rehydration characteristics of micellar casein powders[J]. Innovative Food Science & Emerging Technologies,2022,80:103093.
[18] CAMPANO C, EXPOSITO P L, AGUILERA L G, et al. In-depth characterization of the aggregation state of cellulose nanocrystals through analysis of transmission electron microscopy images[J]. Carbohydrate Polymers,2021,254:117271. doi: 10.1016/j.carbpol.2020.117271
[19] WANG C Y, WANG E, BAI Y, et al. Encapsulated fucoxanthin improves the structure and functional properties of fermented yogurt during cold storage[J]. Food Chemistry,2023,419:136076. doi: 10.1016/j.foodchem.2023.136076
[20] QIN X T, YANG C R, SI J Y, et al. Fortified yogurt with high-quality dietary fiber prepared from the by-products of grapefruit by superfine grinding combined with fermentation treatment[J]. LWT - Food Science and Technology,2023,188:115396. doi: 10.1016/j.lwt.2023.115396
[21] ZALESKA H, TOMASIK P, LII C Y, Formation of carboxymethyl cellulose-casein complexes by electrosynthesis[J]. Food Hydrocolloids. 2002, 16(03):215−224.
[22] LEE W J, LUCEY J A. Formation and physical properties of yogurt[J]. Journal of Animal Science,2010,23(9):1127−1136.
[23] 林莹, 王旭清, 李坚斌. 水溶性膳食纤维对乳酸菌增殖及重金属离子吸附研究[J]. 食品工业科技,2011,32(4):133−136. [LIN Y, WANG XC Q, LI J B. Study on the proliferation of lactic acid bacteria and adsorption of heavy metal ions by water-soluble dietary fiber[J]. Science and Technology of Food Industry,2011,32(4):133−136.] LIN Y, WANG XC Q, LI J B. Study on the proliferation of lactic acid bacteria and adsorption of heavy metal ions by water-soluble dietary fiber[J]. Science and Technology of Food Industry, 2011, 32(4): 133−136.
[24] 刘萍. 大豆膳食纤维酸乳的研制[D]. 济南:山东师范大学, 2010. [LIU P. Development of soybean dietary fiber yogurt[D]. Ji’nan:Shandong Normal University, 2010.] LIU P. Development of soybean dietary fiber yogurt[D]. Ji’nan: Shandong Normal University, 2010.
[25] 黄子珍, 陈超锋, 曾庆坤, 等. 百香果膳食纤维对凝固型益生菌酸水牛乳品质特性的影响[J]. 食品科技,2019,44(7):314−319. [HUANG Z Z, CHEN C F, ZENG Q K, et al. Effect of passion fruit fiber on quality characteristics of buffalo milk probiotic yoghurt[J]. Food Science and Technology,2019,44(7):314−319.] HUANG Z Z, CHEN C F, ZENG Q K, et al. Effect of passion fruit fiber on quality characteristics of buffalo milk probiotic yoghurt[J]. Food Science and Technology, 2019, 44(7): 314−319.
[26] OUYANG K F, XIE H X, WU K W, et al. Improving fermented milk products using pH-responsive whey protein fibrils:A case study on stirred yogurt[J]. Food Bioscience,2024,60:104507. doi: 10.1016/j.fbio.2024.104507
[27] MADA T, DURAISAMY R, ABERA A, et al. Effect of mixed banana and papaya peel pectin on chemical compositions and storage stability of Ethiopian traditional yoghurt (ergo)[J]. International Dairy Journal,2022,131:105396. doi: 10.1016/j.idairyj.2022.105396
[28] LUO Y, LI Y, QIN X L, et al. Effects of oxidized konjac glucomannan on physicochemical and sensory properties of set-style yoghurt[J]. International Dairy Journal,2024,154:105909. doi: 10.1016/j.idairyj.2024.105909
[29] LIN Y, XU Q L, LI X M, et al. Tremella fuciformis polysaccharides as a fat substitute on the rheological, texture and sensory attributes of low-fat yogurt[J]. Current Research in Food Science,2022,5:1061−1070. doi: 10.1016/j.crfs.2022.06.007
[30] MUDGIL D, BARAK S, KHATKAR B S. Development of functional yoghurt via soluble fiber fortification utilizing enzymatically hydrolyzed guar gum[J]. Food Bioscience,2016,14:28−33. doi: 10.1016/j.fbio.2016.02.003
[31] XU K, GUO M M, DU J H, et al. Okra polysaccharide:Effect on the texture and microstructure of set yoghurt as a new natural stabilizer[J]. International Journal of Biological Macromolecules,2019,133:117−126. doi: 10.1016/j.ijbiomac.2019.04.035
[32] GYAWALI R, IBRAHIM S A. Effects of hydrocolloids and processing conditions on acid whey production with reference to Greek yogurt[J]. Trends in Food Science & Technology,2016,56:61−76.
[33] DU H X, WANG X P, YANG H G, et al. Effects of mulberry pomace polysaccharide addition before fermentation on quality characteristics of yogurt[J]. Food Control,2023,153:109900. doi: 10.1016/j.foodcont.2023.109900






 下载:
下载:




 下载:
下载:



