Study of Chrysanthemum indicum Flavonoid Extract on the Oxidative Stress Resistance of Caenorhabditis elegans
-
摘要: 为了探究野菊花黄酮提取物体内抗氧化效果及对氧化应激抗性的影响,本研究以秀丽隐杆线虫(简称线虫)为模型,考察了野菊花黄酮提取物对线虫体内抗氧化酶活和氧化应激条件下寿命的影响,并通过多种转基因线虫株系对其增强线虫氧化应激抗性机制进行了初步探究。结果显示,与对照组相比,经过50、200、300 μg/mL野菊花黄酮提取物处理的线虫在氧化应激条件下其平均寿命分别显著延长了14.00%、27.15%、18.65%(P<0.01),且线虫体内SOD酶活和还原型谷胱甘肽GSH水平均显著提高。此外,200 μg/mL野菊花黄酮提取物处理后LD1线虫体内SKN-1入核比例由17.16%上升至51.46%,且EU1突变体线虫寿命实验结果表明野菊花黄酮提取物增强线虫氧化应激抗性的作用依赖于skn-1。野菊花黄酮提取物增强线虫氧化应激抗性的机制可能是其激活了转录因子SKN-1,并提高了抗氧化相关蛋白SOD-3、GCS-1、GST-4的表达。本研究为野菊花黄酮类化合物在缓解氧化应激损伤中的应用提供了科学依据。Abstract: To investigate the in vivo antioxidant activity of flavonoid extract from Chrysanthemum indicum and its effects on oxidative stress resistance, this study evaluated the effects of Chrysanthemum indicum flavonoid extract on the antioxidant enzyme activities and the mean lifespan of Caenorhabditis elegans (C. elegans) under oxidative stress. Moreover, the mechanisms of enhancing oxidative stress resistance in nematodes were explored by utilizing a variety of transgenic strains. The results showed that pretreatment with Chrysanthemum indicum flavonoid extract significantly prolonged the mean lifespan of worms under oxidative stress by 14.00%, 27.15%, and 18.65% (P<0.01) at concentrations of 50, 200, and 300 μg/mL, respectively. In addition, Chrysanthemum indicum flavonoid extract significantly increased the SOD activity and GSH level of C. elegans. Furthermore, the nuclear proportion of SKN-1 was increased from 17.16% to 51.46% in LD1 strains when treated with 200 μg/mL Chrysanthemum indicum flavonoid extract. Additionally, the results of lifespan assay of EU1 strains indicated that the lifespan extension effect of Chrysanthemum indicum flavonoid extract under oxidative stress was relied on skn-1. The mechanism of enhancing oxidative stress resistance of Chrysanthemum indicum flavonoid extract might occur by activating the transcription factor SKN-1, which in turn increased the expression of antioxidant-related proteins SOD-3, GCS-1 and GST-4. This study provides a scientific basis for the application of Chrysanthemum indicum flavonoids in alleviating oxidative stress damage.
-
野菊花为菊科植物野菊(Chrysanthemum indicum L.)的干燥头状花序,具有清热解毒、泻火平肝等功效。野菊花分布广泛,在我国多个地区均有生长。研究表明,野菊花具有降血压、抗氧化、抗炎、增强机体免疫、抑菌等多种药理学作用[1]。野菊花中主要生物活性物质包括黄酮类、有机酸类、挥发油类、萜类等[2],其中黄酮类物质是野菊花的主要成分和药效成分,也是用来评价野菊花质量的重要指标之一[3]。陈佳敏[4]对我国31个地区野菊花中的黄酮进行分析发现,其中的总黄酮含量分布在30.17~94.28 mg·g−1之间,且这些地区中的黄酮类化合物均对黄嘌呤氧化酶和脂肪氧化酶具有较好的抑制活性。此外,研究表明野菊花黄酮类化合物具有体外抗氧化活性、降血压、缓解小鼠结肠炎并调节肠道菌群等多种生物活性[5−7]。
秀丽线虫在20世纪60年代首次作为发育生物学研究的模式生物被广泛应用于衰老、神经退行性疾病、糖脂代谢等方面的研究[8]。与传统的动物模型相比,这种真核多器官生物具有尺寸小(成虫体长约为1 mm)、寿命短(野生型线虫约21天)、传代快(约3天)、繁殖能力强、通体透明、基因组序列注释详细、正反向遗传操作简单、与人类基因组有38%的同源性等诸多优势[9−10]。此外,秀丽线虫模型凭借其独特的优势也广泛应用于体内抗氧化及氧化应激损伤研究中。最近的研究报道,水黄皮黄酮提取物展现出卓越的抗应激化能力,可以增强线虫的抗氧化防御系统,稳定细胞膜结构[11]。柑橘皮黄酮提取物也展现出显著的抗氧化特性,能够有效清除秀丽线虫体内过多的自由基,调节抗氧化酶系统的活性[12]。然而,目前关于野菊花黄酮类物质体内抗氧化作用及缓解氧化应激损伤的效果尚未报道。
因此,本研究利用秀丽线虫模型测定了野菊花黄酮提取物对线虫体内抗氧化酶活和氧化应激条件下寿命的影响,并对其增强氧化应激抗性的作用机制进行了初探探究。
1. 材料与方法
1.1 材料与仪器
野菊花 安徽省六安市丹贝尔生物科技有限公司,由荆楚理工学院生物工程学院植物科学教研室范淑芳副教授鉴定为野菊花(Chrysanthemum indicum L.)的干燥花;秀丽线虫株系包括:野生型秀丽线虫株系(N2)、EU1[skn-1(zu67)Ⅳ]、CF1553[(pAD76)sod-3p::GFP]、CL2166[(pAF15)gst-4p::GFP::NLS]、LD1[ldls7(skn-1b/c::GFP+rol-6(su1006))]、LD1171[ldIs3 (gcs-1p::GFP+rol-6(su1006))] 明尼苏达大学秀丽隐杆线虫遗传学中心Caenorhabditis Genetics Center(CGC);无水乙醇、无水氯化钙、七水合硫酸镁、磷酸二氢钾、磷酸氢二钾、氢氧化钠、氯化钠、一水合柠檬酸钾、一水合柠檬酸、十二水合磷酸氢二钠、胆固醇、次氯酸钠、EDTA、七水合硫酸亚铁、四水合氯化锰、七水合硫酸锌、五水合硫酸铜 均为分析纯,国药集团;二甲基亚砜(DMSO)、5-氟-2-脱氧尿苷(FudR) 纯度≥98%,美国Sigma公司;DPPH(1,1-二苯基-2-苦基肼) 纯度≥97%、ABTS(2,2’-联氨-双(3-乙基苯并噻唑啉-6-磺酸),纯度≥98%)、芦丁(纯度≥95%) 上海阿拉丁生化科技股份有限公司;SOD试剂盒、GSH试剂盒、BCA试剂盒 南京建成生物工程研究所。
SW-CJ-3F超净工作台 上海沪静医疗器械有限公司;MY-10手持研磨器 上海净信实业发展有限公司;XFH-50CA全自动高压灭菌锅 浙江新丰医疗器械有限公司;冷冻离心机 德国艾本德Eppendorf公司;YB710FL荧光显微镜 安徽越视精密仪器有限公司;Multiskan Skyhigh全波长酶标仪 美国Thermo公司。
1.2 实验方法
1.2.1 野菊花黄酮化合物的提取
参照豆佳媛等[13]的方法制备野菊花黄酮类提取物。野菊花经烘干、粉碎,过60目筛得到野菊花粗粉。称取一定量野菊花粗粉,按料液比1:50加入40%乙醇溶液进行超声辅助提取,提取功率为480 W,提取温度为35 ℃,提取时间为2 h,提取2次,过滤得到滤液。合并滤液,于55 ℃旋转蒸发浓缩至无乙醇,再进行冷冻干燥,得到野菊花黄酮提取物冻干粉,用DMSO配制成50 mg/mL储备液置于−80 ℃保存备用。
1.2.2 野菊花提取物中黄酮含量的测定
利用亚硝酸钠-硝酸铝法测定总黄酮含量[14]。取250 μL不同浓度的芦丁标准品溶液或样品溶液,加入75 μL 0.5% NaNO2溶液混匀后,避光静置5 min,再加入150 μL 10% Al(NO3)3·6H2O溶液,混匀后,室温避光静置反应5 min,最后加入500 μL 1mol/L NaOH溶液混匀后,在λ=510 nm处测定反应液吸光值,得到芦丁标准曲线:y=10.321x–0.0031,R2=0.9991。准确称取野菊花提取物冻干粉50.0 mg,加入无水乙醇10.0 mL溶解配成浓度为5.0 mg/mL提取物溶液,按上述方法在同样条件下测定其吸光度,根据芦丁标准品标准曲线计算样品中的黄酮含量,结果以mg Rutin/g样品表示。
1.2.3 体外抗氧化活性评价
1.2.3.1 DPPH自由基清除率测定
将野菊花黄酮提取物分别配制成0.1、0.2、0.4、0.6、0.8、1.0 mg/mL储备液。分别取2 mL野菊花黄酮提取物溶液,分别加入2 mL 0.1 mg/mL DPPH-无水乙醇溶液混匀,避光反应30 min,在517 nm下测定吸光度A1[15]。对照组用无水乙醇代替DPPH,测定其吸光度为A2。空白组用无水乙醇代替样品溶液,测定其吸光度A0。以等体积抗坏血酸溶液(0.1、0.2、0.4、0.6、0.8、1.0 mg/mL)作为阳性对照。按照式(1)计算DPPH自由基清除率。
DPPH自由基清除率(%)=A0−(A1−A2)A0×100 (1) 1.2.3.2 ABTS+自由基清除率测定
分别取0.1、0.2、0.4、0.6、0.8、1.0 mg/mL野菊花黄酮提取物溶液50 μL,分别加入150 μL ABTS工作液,充分混匀在室温下静置6 min,于734 nm下测定吸光度A样。以ABTS工作液和无水乙醇的混合液作为空白组,测定吸光度A空。以等体积抗坏血酸溶液(0.1、0.2、0.4、0.6、0.8、1.0 mg/mL)作为阳性对照[16]。按照式(2)计算ABTS+自由基清除率。
ABTS自由基清除率(%)=A空−A样A空×100 (2) 1.2.4 线虫的同步化及培养
1.2.4.1 线虫的同步化
将处于产卵期的线虫用M9缓冲液从NGM板上洗入1.5 mL离心管中,去上清,再用M9洗三次除去线虫身上粘附的菌。再在离心管中加入1 mL线虫裂解液,迅速剧烈振荡15 min至虫体完全裂解,常温下10000 r/min离心1 min,弃去上清,并用M9缓冲液重悬离心4次,最后一次离心,去上清,加入1 mL M9缓冲液混匀,待其孵化成幼虫备用[17]。
1.2.4.2 线虫培养
参照Solis等[18]的方法采用液体培养法。用24孔板培养,每孔加入300 µL S-complete培养基,其中设置仅含有DMSO的空白对照组和含有50、200、300 μg/mL野菊花黄酮提取物的加药组。将同步化至L4期的线虫用挑针挑取至S-complete培养基中,每孔挑取约300条线虫,挑取线虫的时间设为第0 d,密封后放入20 ℃培养。
1.2.5 线虫氧化应激寿命实验
按照1.2.4.2所述方法分别培养线虫株系N2、EU1,待线虫培养至成虫第7 d收集不同处理组的线虫用M9洗三次除去黏附的菌,再将线虫转移至每孔含有100 μL终浓度为1 mmol/L H2O2的M9缓冲液的96孔板中,室温避光静置。每隔2 h记录线虫存活率,直至所有线虫全部死亡[19]。最后用GraphPad软件绘制生存曲线并用log-rank (Mantel−Cox)分析方法分析数据。
1.2.6 线虫体内抗氧化酶活测定
按照1.2.4.2所述方法培养线虫N2、EU1,待线虫培养至成虫第3 d,收集不同处理组的线虫用M9缓冲液洗3次去除粘附的杂菌,在冰上充分研磨,再在4 ℃下10000 r/min离心5 min得到上清液,按照SOD试剂盒、GSH试剂盒、BCA试剂盒说明书操作,测定不同处理组线虫体内SOD酶活、还原型谷胱甘肽GSH含量[20]。
1.2.7 野菊花黄酮提取物对SKN-1蛋白核定位的影响
按照1.2.4.1方法对转基因线虫株系LD1进行同步化处理,将处于L4期的线虫分别转移至含有200 μg/mL野菊花黄酮提取物和0.4% DMSO的S-complete培养基(不含FudR)中培养48 h。收集不同处理组的线虫,用M9洗3次除去虫体粘附的杂质,用NaN3溶液麻醉线虫并用荧光显微镜采集图片[21]。SKN-1::GFP表达的核易位模式分为三类:“细胞质”、“核间质”、“细胞核”。当SKN-1::GFP发生核易位,就会观察到较亮的绿色荧光点。“细胞质”是指线虫整个身体没有明显的绿色荧光点,“核间质”是指线虫身体有部分绿色荧光点,“细胞核”是指线虫整个身体布满绿色荧光点[21]。统计并分析不同处理组线虫每种表达模式所占比例。
1.2.8 线虫绿色荧光蛋白可视化定量分析
利用带有GFP报告基因的线虫株系CF1553、CL2166、LD1171分别测定SOD-3、GST-4、GCS-1蛋白的表达。按照1.2.4.1方法分别对转基因线虫株系CF1553、CL2166、LD1171进行同步化处理,将处于L1期的幼虫在200 μg/mL野菊花黄酮提取物和0.4% DMSO的S-complete培养基(不含FudR)中分别培养72 h至成虫早期,收集不同处理组的线虫,用M9洗3次除去虫体粘附的杂质,用NaN3溶液麻醉线虫并用荧光显微镜采集图片[22−23]。最后利用Image J软件分析不同处理组线虫的荧光强度。
1.3 数据处理
所有实验重复三次,结果以均值±标准偏差表示。实验数据用SPSS进行统计分析,采用ANOVA进行显著性分析,并用GraphPad Prism9.0作图。
2. 结果与分析
2.1 野菊花提取物中黄酮含量测定结果
对野菊花中黄酮含量进行测定,得到提取物粉末中黄酮含量为41.21±0.61 mg/g,与豆佳媛等[13]报道的黄酮含量接近。
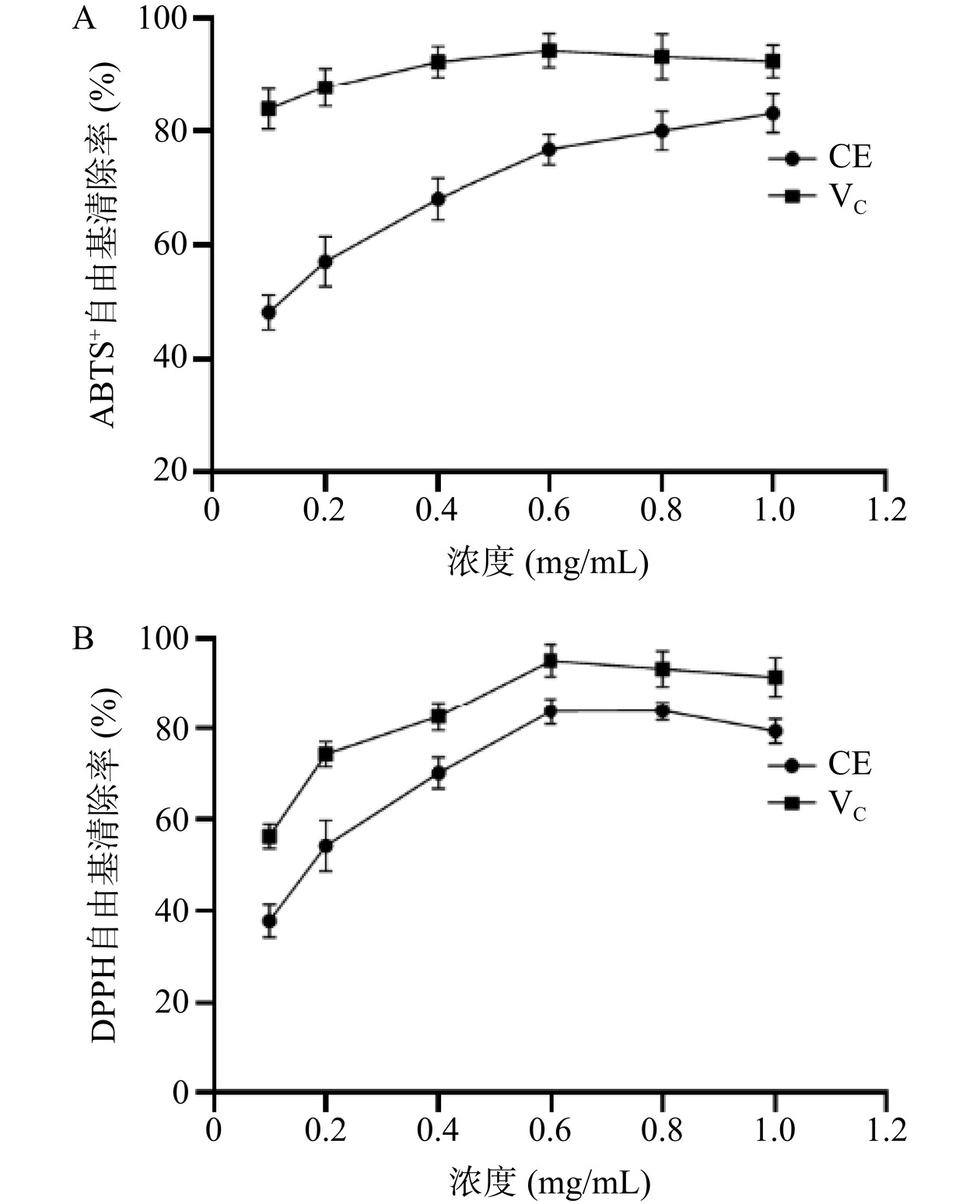
2.2 野菊花黄酮提取物体外抗氧化活性评价
基于化学分析法测定野菊花黄酮提取物(Chrysanthemum indicum flavonoid extract,CE)体外对ABTS+和DPPH自由基的清除率,结果如图1所示。结果显示,随着黄酮提取物浓度的增加,其对ABTS+和DPPH自由基的清除率也随之增加,并且在1.0 mg/mL浓度下其清除率与VC非常接近,其中VC对ABTS+和DPPH自由基清除率IC50分别为0.0035、0.0790 mg/mL,野菊花提取物对ABTS+和DPPH自由基清除率IC50分别为0.1214、0.1632 mg/mL,表明野菊花黄酮提取物对上述两种自由基具有较强的清除能力,这与王天顺[24]的报道一致,提示野菊花黄酮提取物具有较强的直接抗氧化能力。
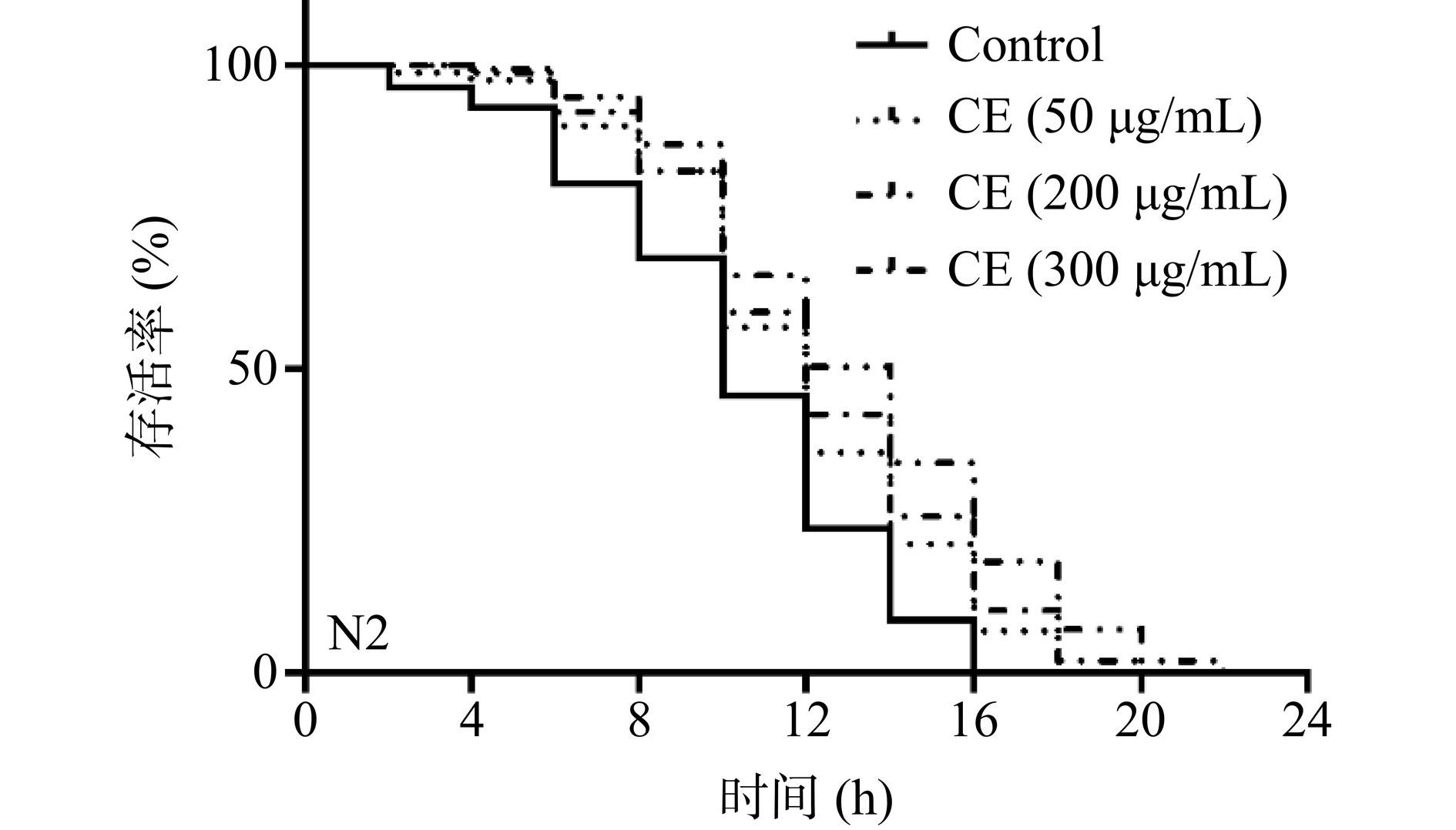
2.3 野菊花黄酮提取物对野生型秀丽线虫氧化应激条件下寿命的影响
野菊花黄酮提取物在体外具有较强的自由基清除能力,但其是否能够提高秀丽线虫抵抗外界不良刺激的能力还不明确。基于此,本研究测定了野菊花黄酮提取物对野生型秀丽线虫在氧化应激条件下的寿命,如图2和表1所示。结果显示,在H2O2诱导的氧化应激条件下,野菊花黄酮提取物能够显著延长野生型线虫的寿命,与对照组相比,经过50、200、300 μg/mL野菊花黄酮提取物处理的线虫其平均寿命分别显著延长了14.00%(P<0.01)、27.15%(P<0.0001)、18.65%(P<0.0001),表明野菊花黄酮提取物增强了线虫氧化应激抗性,其中野菊花黄酮提取物在200 μg/mL浓度下延寿效果最佳。研究表明,过量自由基造成的氧化应激损伤的累积是衰老的根本原因[25]。常见的氧化损伤剂会刺激机体产生过量的自由基,其会加剧细胞的氧化应激损伤,促进机体衰老[9]。由于野菊花黄酮提取物对自由基的清除能力较强,因此其可以通过在体内清除自由基,从而缓解外界氧化应激造成的机体损伤。TAO等[23]也报道了具有体外抗氧化活性的绿豆皮黄酮提取物可以显著延长野生型秀丽线虫在氧化应激下的寿命,与对照组相比,200 μg/mL绿豆皮黄酮提取物处理的线虫其平均寿命显著延长了20.0%。
表 1 野菊花黄酮提取物对野生型秀丽线虫氧化应激条件下寿命的影响Table 1. Effects of CE on the lifespan of N2 worms under oxidative stress组别 平均寿命(h) 百分比(%) 线虫数目 P值 Control 10.35±0.28a − 160 − CE(50 μg/mL) 11.80±0.28b 14.00 160 0.0047 CE(200 μg/mL) 13.16±0.32c 27.15 153 <0.0001 CE(300 μg/mL) 12.28±0.27b 18.65 152 <0.0001 注:同列不同字母表示组间存在显著差异,P<0.05,相同字母表示组间无显著差异,P>0.05;表2同。 2.4 野菊花黄酮提取物对野生型秀丽线虫体内抗氧化活性的影响
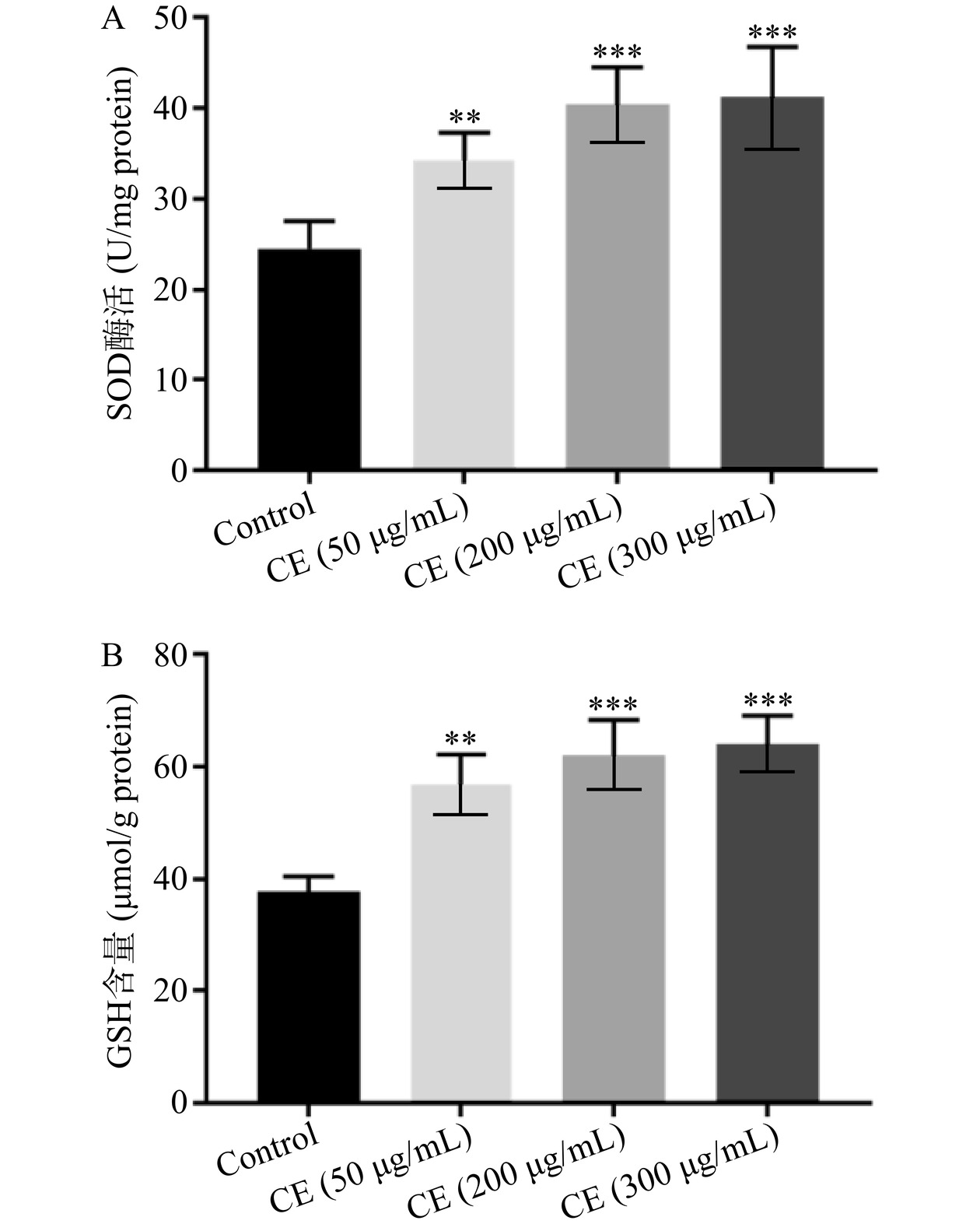
目前关于菊花中黄酮类物质抗氧化性活性研究主要集中在体外实验,关于其是否具有较好的体内抗氧化活性并未明确。本研究测定了野菊花黄酮提取物对野生型秀丽线虫体内超氧化物歧化酶SOD酶活和还原型谷胱甘肽GSH水平的影响,结果如图3所示。结果表明,野菊花黄酮提取物能够显著提高线虫体内的SOD酶活和GSH水平。与对照组相比,50、200、300 μg/mL野菊花黄酮提取物处理的线虫其体内SOD酶活分别提高了39.52%(P<0.01)、64.70%(P<0.001)、68.01%(P<0.001),其体内GSH含量分别提高了49.95%(P<0.01)、63.56%(P<0.001)、68.89%(P<0.001)。随着线虫的衰老,其体内的活性氧水平不断增加,而过量的自由基积累又会加速衰老进程。研究表明SOD酶和GSH都参与自由基的清除,而自由基的清除对于机体抵抗氧化应激造成的损伤、延缓衰老至关重要[9,19]。XU等[20]报道了具有抗衰老作用的生姜提取物可以显著提高线虫体内的SOD酶活和GSH水平。吴梦思等[15]也报道了具有增强线虫氧化应激抗性的卷丹百合提取物处理的线虫其体内SOD酶活和GSH含量分别提高了1.38倍和1.48倍。因此推测野菊花黄酮提取物增强秀丽线虫氧化应激抗性与其能够显著提高线虫体内SOD酶活和GSH含量有关。由于200 μg/mL野菊花黄酮提取物增强线虫氧化应激抗性效果最佳,因此后续实验选择200 μg/mL这一浓度。
![]() 图 3 野菊花黄酮提取物对N2线虫体内SOD酶活和还原型谷胱甘肽水平的影响注:与对照组比较,**表示P<0.01,***表示P<0.001,图4同。Figure 3. Effects of CE on the SOD enzyme activities and GSH contents of N2 worms
图 3 野菊花黄酮提取物对N2线虫体内SOD酶活和还原型谷胱甘肽水平的影响注:与对照组比较,**表示P<0.01,***表示P<0.001,图4同。Figure 3. Effects of CE on the SOD enzyme activities and GSH contents of N2 worms2.5 野菊花黄酮提取物对SKN-1蛋白核定位的影响
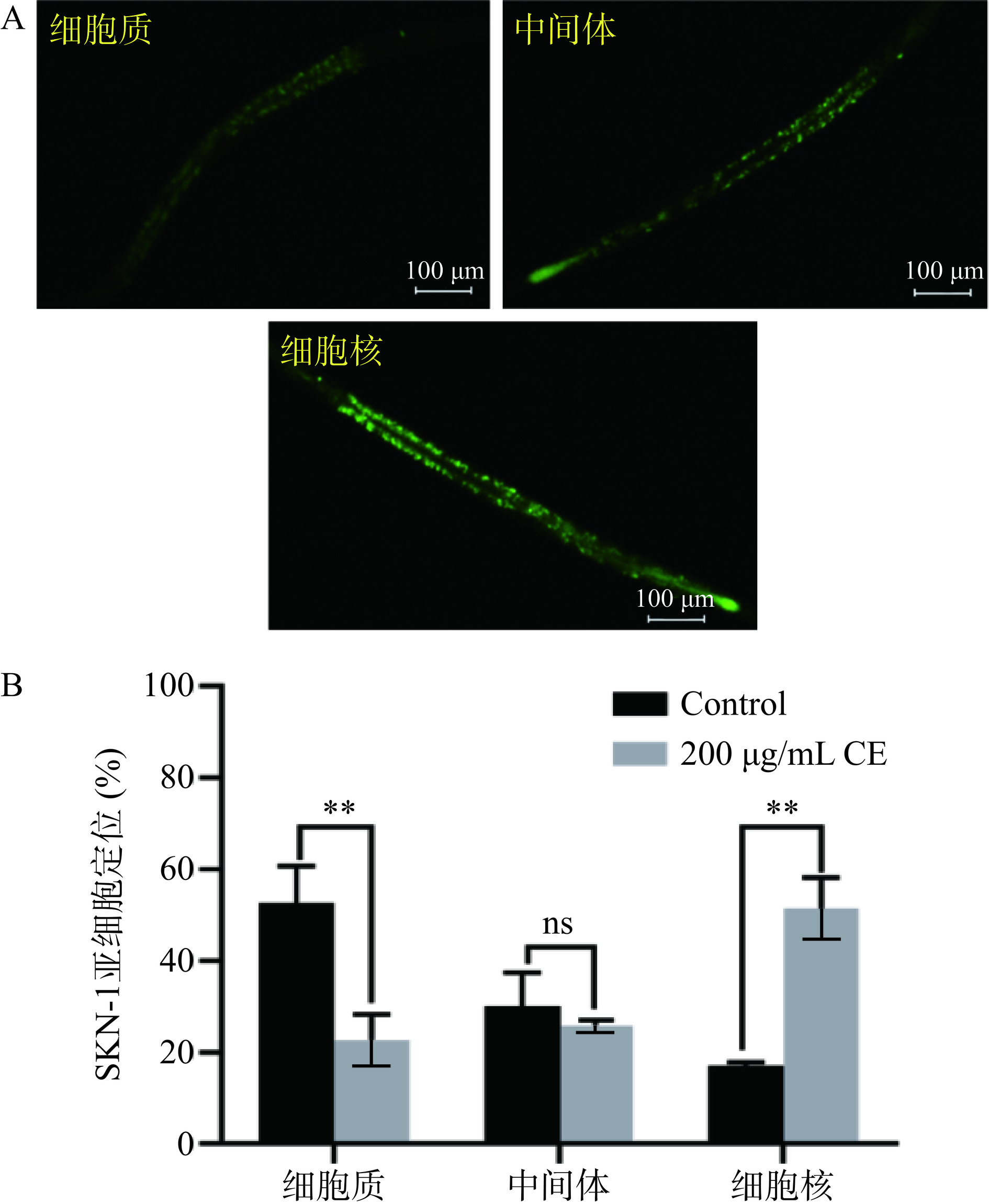
SKN-1是哺乳动物Nrf2的同源蛋白,当受到外界环境刺激时会进入细胞核通过激活Ⅱ相解毒基因和氧化应激响应来调控线虫的寿命,同时它也在多种长寿调控通路中发挥作用[9,26]。LD1是带有GFP标签蛋白的转基因线虫株系,可以用来观察转录因子SKN-1的细胞核定位情况。如图4所示,200 μg/mL野菊花黄酮提取物处理后线虫SKN-1入核比例由17.16%上升至51.46%(P<0.01),在细胞质中的比例由52.70%下降至22.71%(P<0.01),表明野菊花黄酮提取物促进了线虫SKN-1的核定位。有研究表明活性成分丹皮酚可以通过促进SKN-1入核,从而激活线虫体内的抗氧化信号通路,起到增强线虫氧化应激抗性、延缓衰老的效果[26]。基于前文结果中野菊花黄酮提取物可以提高线虫体内抗氧化酶活和GSH含量,因此推测由于野菊花黄酮提取物促进了SKN-1的入核,激活抗氧化信号通路从而增加线虫体内抗氧化能力,有助于提高线虫氧化应激抗性。
![]() 图 4 野菊花黄酮提取物对秀丽线虫SKN-1蛋白核定位的影响注:A分别为SKN-1::GFP在LD1线虫株系中细胞质、中间体和细胞核分布的典型荧光图像;B为200 μg/mL CE对SKN-1核定位的影响;ns表示无显著性差异,图6同。Figure 4. Effects of CE on the nuclear localization of SKN-1 in LD1 worms
图 4 野菊花黄酮提取物对秀丽线虫SKN-1蛋白核定位的影响注:A分别为SKN-1::GFP在LD1线虫株系中细胞质、中间体和细胞核分布的典型荧光图像;B为200 μg/mL CE对SKN-1核定位的影响;ns表示无显著性差异,图6同。Figure 4. Effects of CE on the nuclear localization of SKN-1 in LD1 worms2.6 野菊花黄酮提取物对突变体线虫EU1在氧化应激条件下寿命的影响
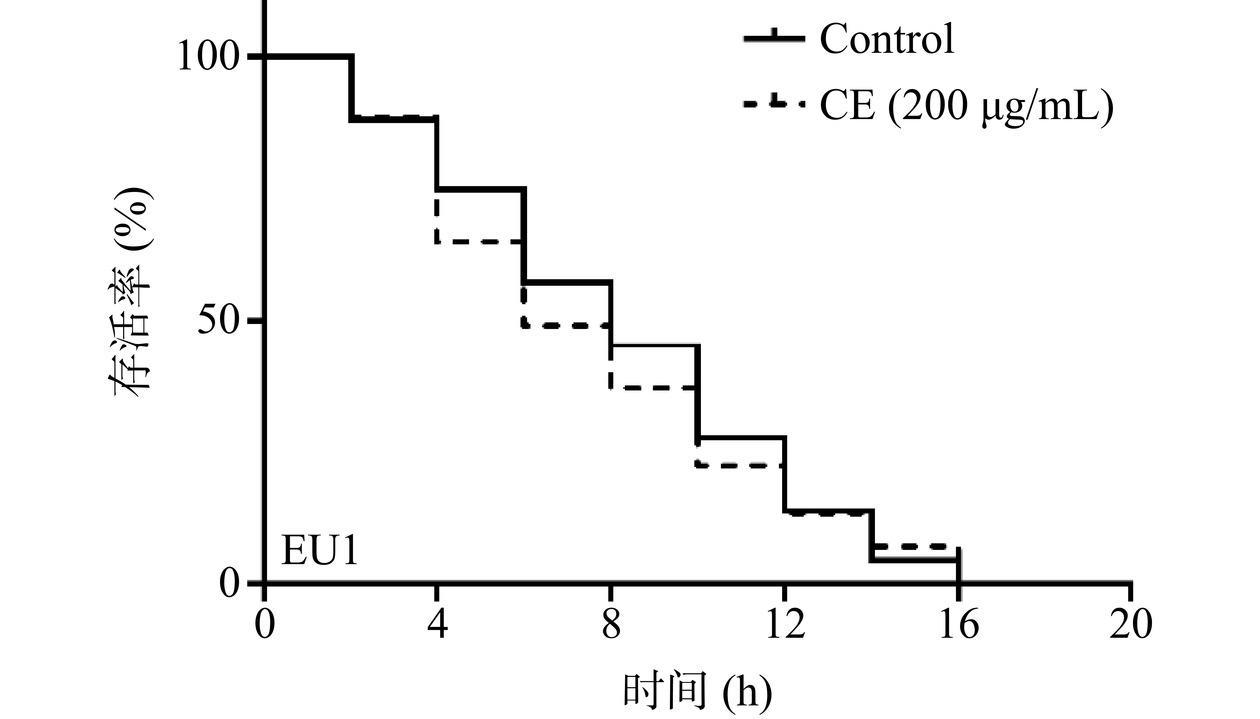
前文研究结果已经表明野菊花黄酮提取物可以延长野生型线虫在氧化应激条件下的寿命,且促进了SKN-1进入细胞核,然而其增强氧化应激抗性是否依赖skn-1仍未明确,基于此,本文测定了skn-1缺失突变体EU1在氧化应激条件下的寿命。如图5和表2所示,对照组线虫平均寿命为8.23 h,加药组线虫平均寿命为7.64 h,与对照组相比,野菊花黄酮提取物并没有显著延长skn-1缺失突变体EU1在氧化应激条件下的寿命(P>0.05),表明野菊花黄酮提取物增强线虫氧化应激抗性的作用依赖于skn-1。
表 2 野菊花黄酮提取物对EU1线虫氧化应激条件下寿命的影响Table 2. Effect of CE on the lifespan of EU1 strains under oxidative stress组别 平均寿命
(hours)百分比(%) 线虫数目 P值 Control 8.23±0.32a − 159 − CE(200 μg/mL) 7.64±0.33a -7.17% 158 0.4127 2.7 野菊花黄酮提取物对突变体线虫EU1体内抗氧化活性的影响
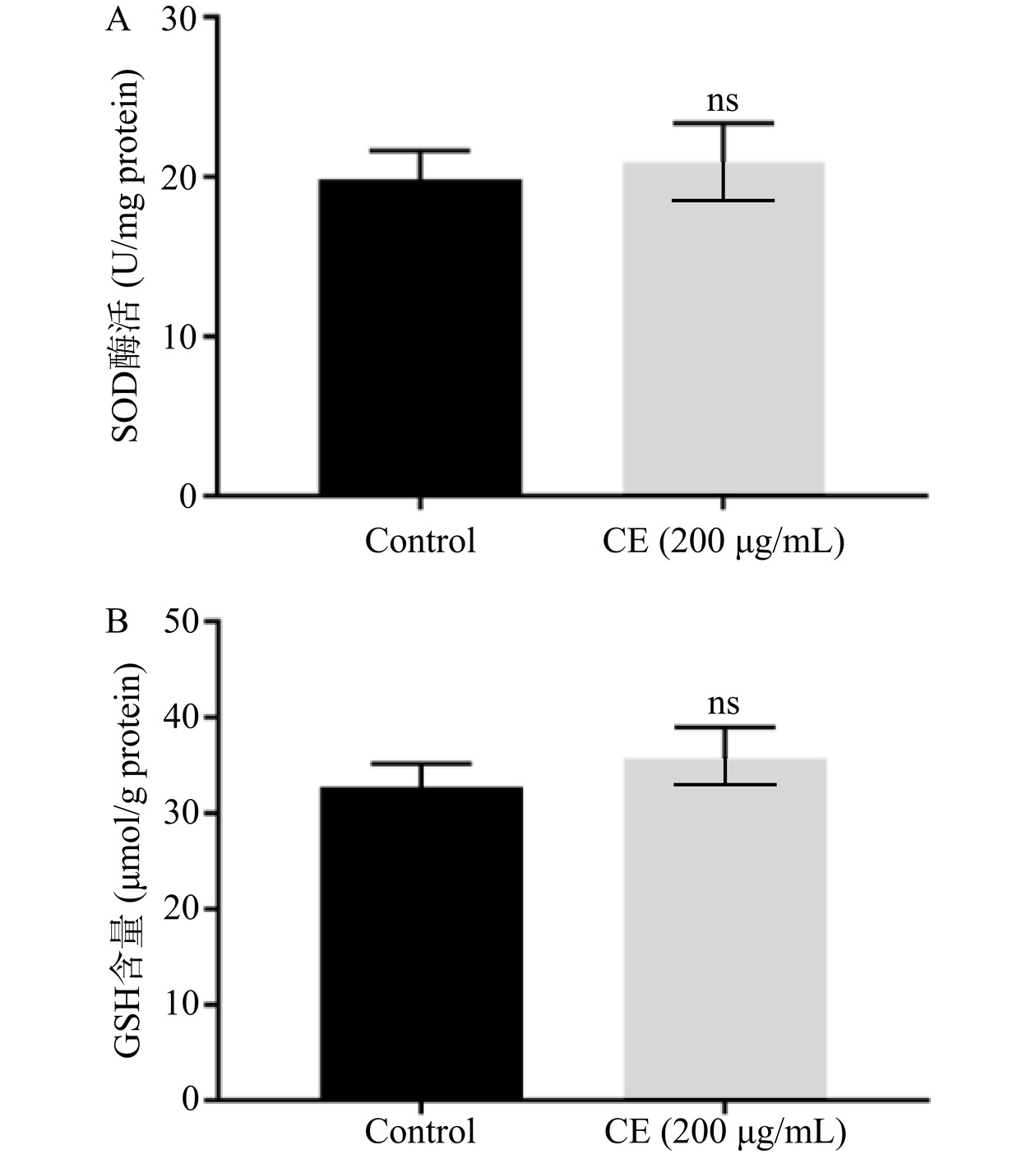
前面研究结果已经表明野菊花黄酮提取物可以显著提高野生型线虫体内SOD酶活和GSH水平,且其增强线虫氧化应激抗性的作用依赖于skn-1,基于此,本文测定了野菊花黄酮提取物对skn-1缺失突变体EU1线虫体内抗氧化活性的影响,结果如图6所示。与对照组相比,野菊花黄酮提取物并没有显著提高EU1线虫体内SOD酶活和GSH含量,表明野菊花黄酮提取物提高线虫体内抗氧化活性的作用依赖于skn-1。
2.8 野菊花黄酮提取物对SOD-3::GFP蛋白表达的影响
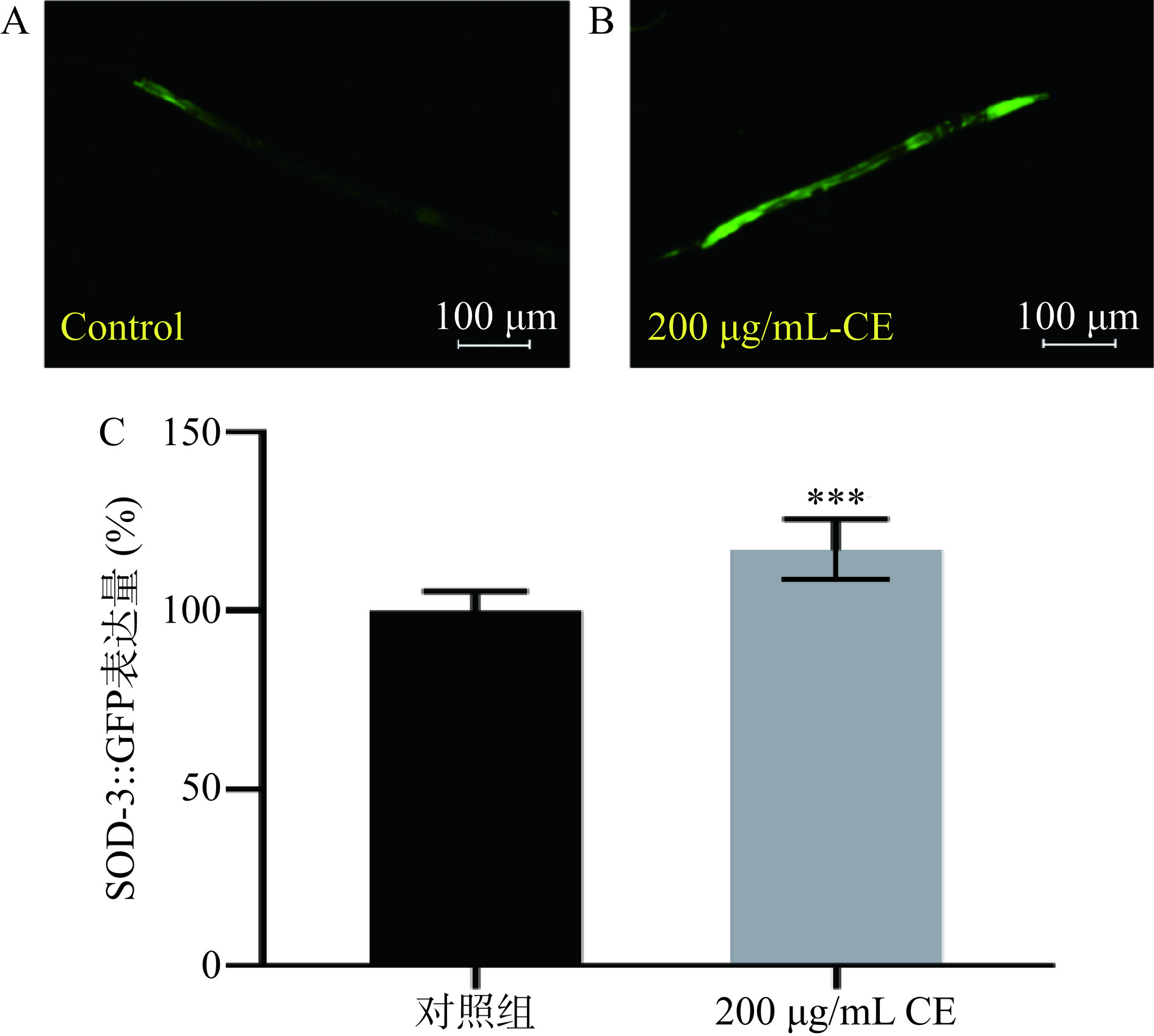
采用绿色荧光蛋白标记的SOD-3线虫株系CF1553可以用来可视化检测线虫体内SOD-3蛋白表达,其强荧光点主要分布在头部和尾部[27]。由于野菊花黄酮提取物可以显著提高线虫体内SOD酶活,而sod-3是线虫体内调节超氧化物歧化酶活性的基因[28],因此本文研究了野菊花黄酮提取物对SOD-3蛋白表达的影响。如图7所示,与对照组相比,野菊花黄酮提取物处理的CF1553线虫株系其头部和尾部绿色荧光显著增强。经过Image J软件处理,与对照组相比,野菊花黄酮提取物处理组线虫中SOD-3::GFP蛋白表达显著提高了16.94%(P<0.001)。以上结果表明,野菊花黄酮提取物通过促进SOD-3::GFP蛋白的表达从而提高线虫体内的SOD酶活,最终增强了线虫体内抗氧化活性。
2.9 野菊花黄酮提取物对GCS-1::GFP蛋白表达的影响
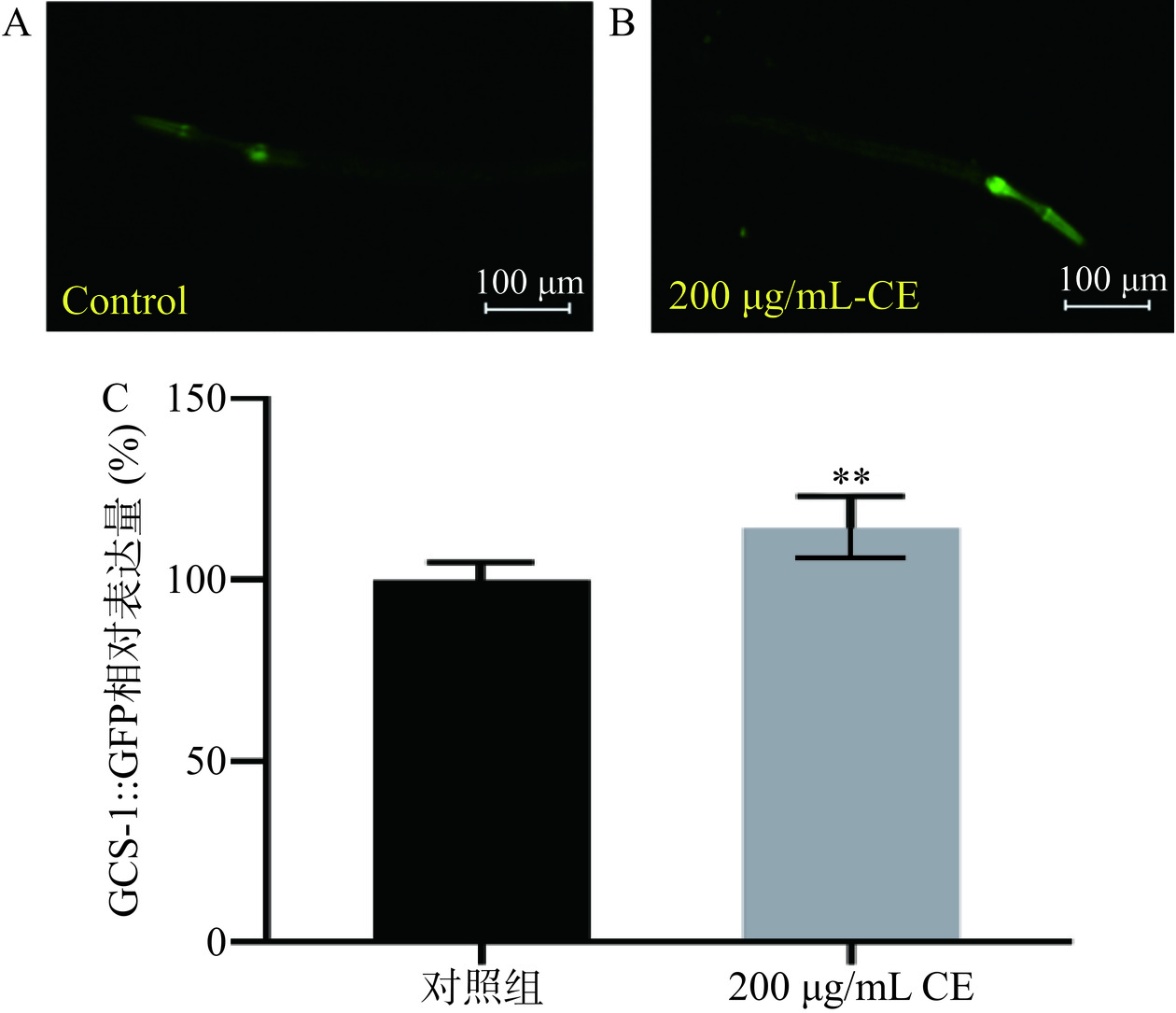
采用绿色荧光蛋白标记的GCS-1线虫株系LD1171可以用来可视化检测线虫体内GCS-1蛋白表达,其强荧光点主要分布在头部[29]。在线虫体内,gcs-1是转录因子SKN-1下游的靶基因,用来编码γ-谷氨酰半胱氨酸合成酶,与谷胱甘肽的生物合成和线虫氧化应激抗性有关[30]。由于野菊花黄酮提取物促进了SKN-1的入核,因此本文测定了其对SKN-1下游靶蛋白GCS-1表达的影响。如图8所示,与对照组相比,野菊花黄酮提取物处理的LD1171线虫株系其头部绿色荧光显著变亮。经过软件分析,与对照组相比,野菊花黄酮提取物处理线虫中GCS-1::GFP蛋白表达显著提高了14.16%(P<0.01)。以上结果表明野菊花黄酮提取物通过促进SKN-1入核,激活了其下游的gcs-1,从而有助于提高谷胱甘肽的含量和增强线虫氧化应激抗性。
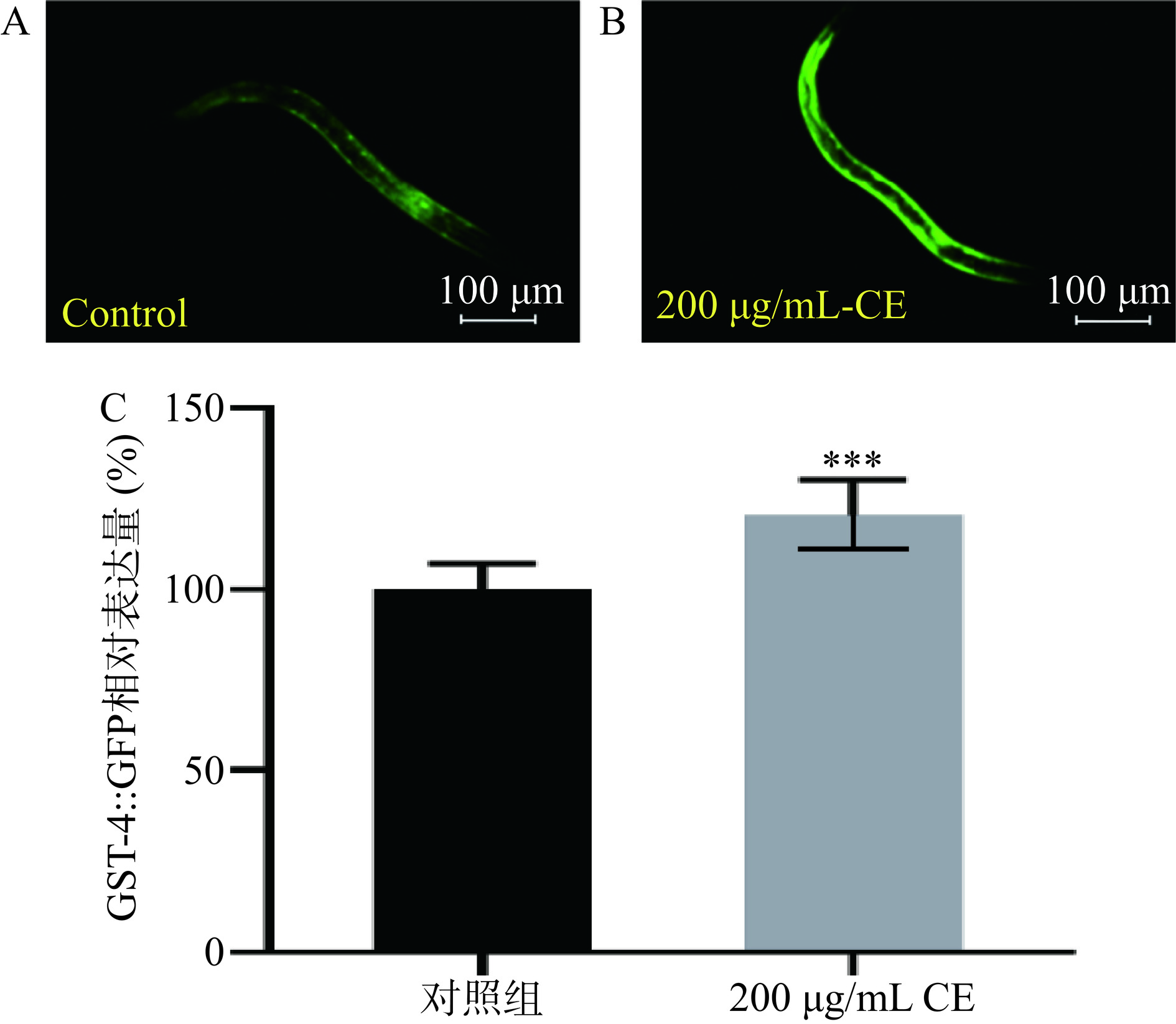
2.10 野菊花黄酮提取物对GST-4::GFP蛋白表达的影响
采用绿色荧光蛋白标记的GST-4线虫株系CL2166可以用来可视化检测线虫体内GST-4蛋白表达,其强荧光点主要集中在线虫周围的背部神经索。在秀丽线虫中,gst-4是转录因子SKN-1下游的靶基因之一,编码谷胱甘肽S-转移酶,其是一种Ⅱ相解毒酶,与谷胱甘肽的生物合成和线虫抗氧化应激响应有关[31]。如图9所示,与对照组相比,野菊花黄酮提取物处理的CL2166线虫株系表皮绿色荧光显著变亮。经过软件分析,与对照组相比,野菊花黄酮提取物处理线虫中GST-4::GFP蛋白表达显著提高了20.44%(P<0.001)。上述结果表明野菊花黄酮提取物通过促进转录因子SKN-1入核,提高了GST-4蛋白的表达,有助于提高谷胱甘肽的含量和增强线虫氧化应激抗性。
3. 结论
本研究首次利用秀丽线虫这一模式生物研究了野菊花黄酮提取物对线虫氧化应激抗性的影响,并对其作用机制进行了探究。通过寿命实验发现野菊花黄酮提取物可以显著延长野生型线虫在氧化应激条件下的平均寿命。进一步研究发现,野菊花黄酮提取物提高了线虫体内SOD酶活和还原型谷胱甘肽含量,表明其具有良好的体内抗氧化活性。此外,通过分析转录因子SKN-1核定位我们进一步证实,野菊花黄酮提取物促进了SKN-1的入核,并提高了与氧化应激抗性有关的蛋白SOD-3、GCS-1、GST-4的表达。本研究通过研究野菊花黄酮提取物对线虫氧化应激抗性的影响并解析其作用机制,明确野菊花黄酮提取物可能的作用靶点,为野菊花在体内抗氧化活性研究方面提供了新思路,并拓展了其在改善健康、缓解氧化应激损伤方面的应用。
-
图 3 野菊花黄酮提取物对N2线虫体内SOD酶活和还原型谷胱甘肽水平的影响
注:与对照组比较,**表示P<0.01,***表示P<0.001,图4同。
Figure 3. Effects of CE on the SOD enzyme activities and GSH contents of N2 worms
图 4 野菊花黄酮提取物对秀丽线虫SKN-1蛋白核定位的影响
注:A分别为SKN-1::GFP在LD1线虫株系中细胞质、中间体和细胞核分布的典型荧光图像;B为200 μg/mL CE对SKN-1核定位的影响;ns表示无显著性差异,图6同。
Figure 4. Effects of CE on the nuclear localization of SKN-1 in LD1 worms
表 1 野菊花黄酮提取物对野生型秀丽线虫氧化应激条件下寿命的影响
Table 1 Effects of CE on the lifespan of N2 worms under oxidative stress
组别 平均寿命(h) 百分比(%) 线虫数目 P值 Control 10.35±0.28a − 160 − CE(50 μg/mL) 11.80±0.28b 14.00 160 0.0047 CE(200 μg/mL) 13.16±0.32c 27.15 153 <0.0001 CE(300 μg/mL) 12.28±0.27b 18.65 152 <0.0001 注:同列不同字母表示组间存在显著差异,P<0.05,相同字母表示组间无显著差异,P>0.05;表2同。 表 2 野菊花黄酮提取物对EU1线虫氧化应激条件下寿命的影响
Table 2 Effect of CE on the lifespan of EU1 strains under oxidative stress
组别 平均寿命
(hours)百分比(%) 线虫数目 P值 Control 8.23±0.32a − 159 − CE(200 μg/mL) 7.64±0.33a -7.17% 158 0.4127 -
[1] 汤亚芳, 余婉婷, 余港, 等. 野菊花药用活性成分及调控措施研究进展[J]. 中华中医药学刊,2023,41(10):255−258. [TANG Y F, YU W T, YU G, et al. Research progress on pharmacological active constituents and regulation in Yejuhua ( Chrysanthemum indicium L. )[J]. Chinese Archives of Traditional Chinese Medicine,2023,41(10):255−258.] TANG Y F, YU W T, YU G, et al. Research progress on pharmacological active constituents and regulation in Yejuhua ( Chrysanthemum indicium L. )[J]. Chinese Archives of Traditional Chinese Medicine, 2023, 41(10): 255−258.
[2] 曹双, 刘瑞, 张秋月, 等. 野菊花化学成分和药理作用研究进展[J]. 广东化工,2023,50(3):203−204. [CAO S, LIU R, ZHANG Q Y, et al. Research progress on chemical constituents and pharmacological action of wild Chrysanthemum[J]. Guangdong Chemical Industry,2023,50(3):203−204.] doi: 10.3969/j.issn.1007-1865.2023.03.064 CAO S, LIU R, ZHANG Q Y, et al. Research progress on chemical constituents and pharmacological action of wild Chrysanthemum[J]. Guangdong Chemical Industry, 2023, 50(3): 203−204. doi: 10.3969/j.issn.1007-1865.2023.03.064
[3] 孙平, 董萍萍, 董丹华, 等. 超声波辅助低共熔溶剂提取野菊花总黄酮的工艺研究[J]. 食品工业科技,2020,41(20):147−152. [SUN P, DONG P P, DONG D H, et al. Ultrasound-assisted deep eutectic solvent extraction of total flavonoids from Chrysanthemum indicum[J]. Science and Technology of Food Industry,2020,41(20):147−152.] SUN P, DONG P P, DONG D H, et al. Ultrasound-assisted deep eutectic solvent extraction of total flavonoids from Chrysanthemum indicum[J]. Science and Technology of Food Industry, 2020, 41(20): 147−152.
[4] 陈佳敏. 不同产地野菊花主要活性成分及其体外活性研究[D]. 南京:南京农业大学, 2020. [CHEN J M. Studies on the active components and their biological activities of Chrysanthemum indicum L. from different areas[D]. Nanjing:Nanjing Agricultural University, 2020.] CHEN J M. Studies on the active components and their biological activities of Chrysanthemum indicum L. from different areas[D]. Nanjing: Nanjing Agricultural University, 2020.
[5] WANG Y, Li Y, GUO W, et al. Comparison of the chemical components, efficacy and mechanisms of action of Chrysanthemum morifolium flower and its wild relative Chrysanthemum indicum flower against liver-fire hyperactivity syndrome of hypertension via integrative analyses[J]. International Journal of Molecular Sciences,2022,23(22):13767.
[6] JIN C, LIU J, JIN R, et al. Linarin ameliorates dextran sulfate sodium-induced colitis in C57BL/6J mice via the improvement of intestinal barrier, suppression of inflammatory responses and modulation of gut microbiota[J]. Food & Function,2022,13(20):10574−1058.
[7] THU H N, THU H N, NGUYEN V P. Optimization of β-Cyclodextrin-assisted extraction of apigenin and luteolin from Chrysanthemum indicum L. using response surface methodology combined with different optimization algorithms and evaluation of its antioxidant capacity[J]. Chemistry & Biodiversity,2023,20(8):e202300873.
[8] SHEN P Y, YUE Y R, PARK Y. Caenorhabditis elegans:A convenient in vivo model for assessing the impact of food bioactive compounds on obesity, aging, and Alzheimer's disease[J]. Annual Review of Food Science and Technology,2018,9(9):1−22.
[9] YE Y L, GU Q Y, SUN X L. Potential of Caenorhabditis elegans as an antiaging evaluation model for dietary phytochemicals:A review[J]. Comprehensive Reviews in Food Science and Food Safety,2020,19(6):3084−3105.
[10] TISSENBAUM H A. Genetics, life span, health span, and the aging process in Caenorhabditis elegans[J]. Journals of Gerontology Series a-Biological Sciences and Medical Sciences,2012,67(5):503−510.
[11] WU S, MIAO J, ZHU S, et al. Pongamol prevents neurotoxicity via the activation of MAPKs/Nrf2 signaling pathway in H2O2-Induced neuronal PC12 cells and prolongs the lifespan of Caenorhabditis elegans[J]. Molecular Neurobiology,2024,61:8219−8233. doi: 10.1007/s12035-024-04110-x
[12] DONG Q, CUI Z, WU X, et al. Natural flavonoid hesperetin blocks amyloid β-protein fibrillogenesis, depolymerizes preformed fibrils and alleviates cytotoxicity caused by amyloids[J]. Food & Function,2024,15(8):4233−4245.
[13] 豆佳媛, 田巍, 唐琴, 等. 超声波辅助法提取野菊花中总黄酮的研究[J]. 皮革与化工,2022,39(2):19−26. [DOU J Y, TIAN W, TANG Q, et al. Study on Ultrasonic-assisted extraction of total flavonoids from Chrysanthemum indicum[J]. Leather and Chemicals,2022,39(2):19−26.] doi: 10.3969/j.issn.1674-0939.2022.02.004 DOU J Y, TIAN W, TANG Q, et al. Study on Ultrasonic-assisted extraction of total flavonoids from Chrysanthemum indicum[J]. Leather and Chemicals, 2022, 39(2): 19−26. doi: 10.3969/j.issn.1674-0939.2022.02.004
[14] 缪园欣, 廖明星, 孙爱红, 等. 超声-乙醇法提取铁皮石斛花总黄酮及其体外抗氧化性的研究[J]. 中国酿造,2019,38(4):155−159. [MIAO Y X, LIAO M X, SUN A H, et al. Extraction of total flavonoids from Dendrobium officinale flowers by ultrasonic-ethanol synergistic and its antioxidant activity[J]. China Brewing,2019,38(4):155−159.] doi: 10.11882/j.issn.0254-5071.2019.04.030 MIAO Y X, LIAO M X, SUN A H, et al. Extraction of total flavonoids from Dendrobium officinale flowers by ultrasonic-ethanol synergistic and its antioxidant activity[J]. China Brewing, 2019, 38(4): 155−159. doi: 10.11882/j.issn.0254-5071.2019.04.030
[15] 吴梦思, 金建宇, 尚书游, 等. 卷丹百合黄酮提取物抗氧化活性研究[J]. 食品与发酵工业,2024,50(15):163−169. [[WU M S, JIN J Y, SHANG S Y, et al. Study on antioxidant activity of Lilium lancifolium Thunb flavonoid extract[J]. Food and Fermentation Industries,2024,50(15):163−169.] [WU M S, JIN J Y, SHANG S Y, et al. Study on antioxidant activity of Lilium lancifolium Thunb flavonoid extract[J]. Food and Fermentation Industries, 2024, 50(15): 163−169.
[16] YANG T, LIU X, XUE L, et al. Quality assessment of red yeast rice by fingerprint and fingerprint-effect relationship combined with antioxidant activity[J]. Food Chemistry,2024,438(16):137744.
[17] LI R, TAO M F, WU T, et al. A promising strategy for investigating the anti-aging effect of natural compounds:A case study of caffeoylquinic acids[J]. Food & Function,2021,12(18):8583−8593.
[18] SOLIS G M, PETRASCHECK M. Measuring Caenorhabditis elegans life span in 96 well microtiter plates[J]. Jove-Journal of Visualized Experiments,2011,49(10):e2496.
[19] LI R, TAO M F, XU T T, et al. Artemisia selengensis Turcz. leaf extract promotes longevity and stress resistance in Caenorhabditis elegans[J]. Journal of the Science of Food and Agriculture,2022,102(11):4532−4541.
[20] XU T T, TAO M F, LI R, et al. Longevity-promoting properties of ginger extract in Caenorhabditis elegans via the insulin/IGF-1 signaling pathway[J]. Food & Function,2022,13(19):9893−9903.
[21] PENG Y, SUN Q, GAO R, et al. AAK-2 and SKN-1 are involved in chicoric-acid-induced lifespan extension in Caenorhabditis elegans[J]. Journal of Agricultural and Food Chemistry,2019,67(33):9178−9186.
[22] TAO M F, LI R, XU T T, et al. Vitexin and isovitexin delayed ageing and enhanced stress-resistance through the activation of the SKN-1/Nrf2 signaling pathway[J]. International Journal of Food Sciences and Nutrition,2023,74(6):685−694.
[23] TAO M F, LI R, XU T T, et al. Flavonoids from the mung bean coat promote longevity and fitness in Caenorhabditis elegans[J]. Food & Function,2021,12(17):8196−8207.
[24] 王天顺. 杭白菊、野菊花和神农香菊抗氧化损伤作用及有效成分研究[D]. 武汉:湖北中医药大学, 2023. [WANG T S. Antioxidative damage effect and active ingredients of Chrysanthmum Morifolium Ramat. , Chrysanthemum indicum L. and Chrysanthemum indicum var. aromaticum[D]. Wuhan:Hubei University of Chinese Medicine, 2023.] WANG T S. Antioxidative damage effect and active ingredients of Chrysanthmum Morifolium Ramat. , Chrysanthemum indicum L. and Chrysanthemum indicum var. aromaticum[D]. Wuhan: Hubei University of Chinese Medicine, 2023.
[25] LIOCHEV S I. Reactive oxygen species and the free radical theory of aging[J]. Free Radical Biology and Medicine,2013,60:1−4.
[26] LI R, YI Q P, WANG J S, et al. Paeonol promotes longevity and fitness in Caenorhabditis elegans through activating the DAF-16/FOXO and SKN-1/Nrf2 transcription factors[J]. Biomedicine & Pharmacotherapy,2024,173:1−15.
[27] WOLLENHAUPT S G, SOARES A T, SALGUEIRO W G, et al. Seleno- and Telluro-xylofuranosides attenuate Mn-induced toxicity in C. elegans via the DAF-16/FOXO pathway[J]. Food and Chemical Toxicology,2014,64:192−199.
[28] WAN Q L, FU X, MENG X, et al. Hypotaurine promotes longevity and stress tolerance via the stress response factors DAF-16/FOXO and SKN-1/NRF2 in Caenorhabditis elegans[J]. Food & Function,2020,11(1):347−357.
[29] NGUYEN V T, PARK A R, DURAISAMY K, et al. Elucidation of the nematicidal mode of action of grammicin on Caenorhabditis elegans[J]. Pesticide Biochemistry and Physiology,2022,188:105244.
[30] TULLET J M, HERTWECK M, AN J H, et al. Direct inhibition of the longevity-promoting factor SKN-1 by insulin-like signaling in C. elegans[J]. Cell,2008,132(6):1025−1038.
[31] WAN Q L, FU X, DAI W, et al. Uric acid induces stress resistance and extends the life span through activating the stress response factor DAF-16/FOXO and SKN-1/NRF2[J]. Aging-Us,2020,12(3):2840−2856.





 下载:
下载:
 下载:
下载:



