Identification of Endogenous Antagonistic Bacteria in Grape Leaves and Its Inhibitory Effect on Postharvest Aspergillus niger in Thompson Seedless Grapes
-
摘要: 从葡萄叶片中筛选具有较好抑菌活性的内生菌株并对其生防潜力进行评估,为开发葡萄曲霉腐烂病生物防治新策略提供理论依据。采用平板对峙法从无核白葡萄叶片筛选出对黑曲霉具有较强抑菌作用的拮抗菌株,通过形态学、生理生化指标和分子生物学方法将拮抗细菌鉴定至种。从拮抗菌发酵上清液中提取脂肽粗提物,利用超高效液相-离子淌度-飞行时间质谱(UPLC-Vion-IMS-QTof)检测其脂肽类型,活体条件下验证拮抗菌发酵液对葡萄果实采后曲霉腐烂病的防治效果。结果表明:本研究从无核白葡萄叶片中分离获得对黑曲霉具有抑菌效果的拮抗内生细菌25株,其中,菌株TLF4-3对黑曲霉具有较好抑菌活性,抑菌圈直径为27.27±0.05 mm,抑菌效价达18.27±0.53 cm/mL。经鉴定,拮抗内生细菌TLF4-3为贝莱斯芽孢杆菌(Bacillus velezensis)。使用UPLC-Vion-IMS-QTof技术明确该菌株抑菌活性物质主要为杆菌霉素D2(C15 Bacillomycin)和伊枯草菌素C(C14 Iturin)。TLF4-3发酵液浸泡处理后,3 d时处理组的防治效果最佳,葡萄果实病斑直径降低了2.3 mm,抑菌率达68.26%±0.91%。上述研究结果可为贝莱斯芽孢杆菌在葡萄采后曲霉腐烂病的防治提供理论依据和实践指导。Abstract: This work aimed to screen endophytic strains with strong antibacterial activity from grape leaves and assess their biocontrol potential, providing a theoretical basis for the development of new biological control strategies against grape Aspergillus rot disease. Using the plate confrontation approach, antagonistic strains displaying notable inhibitory effects on Aspergillus niger were separated from the leaves of ‘Thompson Seedless Grapes’. Morphological, physiologically, biochemical, and molecular biological studies revealed these antagonistic strains at the species level. Lipopeptide extracts were obtained from the supernatant of antagonistic fermentations, and their composition was analyzed via UPLC-Vion-IMS-QTof mass spectrometry. In vivo experiments further confirmed the efficacy of the antagonistic fermentation broth in reducing postharvest Aspergillus rot on 'Thompson Seedless Grapes'. From the leaves of ‘Thompson Seedless’ grapes, 25 endophytic bacterial strains with inhibitory effects on A. niger were isolated. Among these, strain TLF4-3 demonstrated the strongest antagonistic activity, exhibiting a inhibition zone diameter of 27.27±0.05 mm and an inhibitory titer of 18.27±0.53 cm3/mL. strain TLF4-3 showed the strongest inhibitory effect among these ones. UPLC-Vion-IMS-QTof analysis identified the primary antimicrobial compounds produced by this strain as Bacillomycin D2 (C15 Bacillomycin) and Iturin C (C14 Iturin). Treatments with TLF4-3 fermentation broth at 3 days postharvest achieved the best control effect, reducing lesion diameter by 2.3 mm and achieving an antibacterial rate of 68.26%±0.91%. These results offer a theoretical framework and pragmatic direction for the control and avoidance of Aspergillus rot in postharvest grapes.
-
Keywords:
- antagonizing endogenous bacteria /
- lipopeptides /
- A. niger /
- B. velezensis /
- biological control
-
新疆葡萄种植面积和产量居全国首位,2022年葡萄种植面积和产量分别占全国的17.17%和20.58%[1]。鲜食葡萄果肉多汁,甜味中性,质地松脆,糖分含量较高,为各类霉菌在采后提供了较好的生存条件,主要的病害有灰霉病、青腐病、曲霉腐烂病等[2],我国每年由此导致的葡萄经济损失达其总产值的30%~40%[3−4],严重阻碍葡萄产业的提升增效,降低了葡萄果实的经济价值和食用价值。
近年来,国内外葡萄保鲜技术的研究主要集中在物理防治和化学防治上[5]。物理防治包括冷库保鲜、气调保鲜、辐照保鲜等,其中冷库保鲜最为常见,但其香味物质含量随贮存时间的增加而逐渐减少,导致葡萄风味品质变差[6];气调保鲜和辐照保鲜的实施成本昂贵且会对人体存在潜在危险,使其较难成为葡萄保鲜技术的主流[7]。化学防治中包括臭氧保鲜和化学物质保鲜,化学物质保鲜主要是二氧化硫保鲜技术,使用200 μL/L的二氧化硫熏蒸处理木纳格葡萄2 h,能有效抑制果实的发病率并且延长灰霉病的发病时间,对照组比处理组提前一天达到100%,但二氧化硫残留也会对环境和人体健康产生较大的负面影响[8]。因此,鲜食葡萄采后保鲜急需更环保、成本低、绿色安全的新型保鲜技术[9]。
拮抗菌是防治葡萄采后病害的一种绿色、环保、高效的方法,用生物防治技术取代传统的保鲜技术也是目前葡萄采后病害防治的研究热点[10−11]。已有学者利用拮抗菌防治葡萄中的病害,例如淀粉芽孢杆菌(Bacillus amyloliquefaciens)NCPSJ7的发酵液可以将红地球葡萄采后灰霉病的自然发病率降低26.7%[12]。刘海波等[13]在苹果果实表面中分离纯化的罗伦隐球酵母对‘京秀’葡萄采后灰霉病的抑制率高达90%。使用1×108 cells/mL浓度的拮抗酵母菌YT-2处理红提葡萄,与对照相比,其对黑曲霉的抑制率高达100%[14];从昆虫病原线虫共生菌中分离筛选出的伯氏致病杆菌445能有效控制葡萄曲霉腐烂病的发病率,防治效果达61.3%[15]。虽然有研究表明拮抗菌可以有效防治葡萄贮藏过程中产生的曲霉腐烂病,但目前鲜有利用葡萄叶片内生菌防治葡萄曲霉腐烂病的内容和报道。
本研究通过从葡萄叶片中筛选并鉴定出对黑曲霉具有优良拮抗作用的内生菌,利用酸沉醇提获得拮抗菌的脂肽粗提液,采用超高效液相-离子淌度-飞行时间质谱(UPLC-Vion-IMS-QTof)检测其脂肽类型,并测试活体条件下拮抗内生菌对葡萄果实采后曲霉腐烂病的抑制效果,以期为葡萄采后贮藏保鲜提供一种有效的生防技术。
1. 材料与方法
1.1 材料与仪器
黑曲霉(Aspergillus niger) 由新疆农业科学院微生物应用研究所提供,内生细菌均为实验室于2023年7月从新疆吐鲁番市吐鲁番克尔村采摘的无核白葡萄叶片上分离筛选所得。供试水果 采用从新疆乌鲁木齐市新北园春干果市场购买的商业成熟度良好且质地均匀、大小一致的‘无核白’葡萄。将鲜食葡萄用0.2%次氯酸钠浸泡2 min,随后用自来水冲净,并确保其在室温条件下自然晾干,以备后用。
营养琼脂(nutrient agar,NA)培养基、马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、营养肉汤(nutrient broth,NB)培养基、琼脂粉 青岛海博生物技术有限公司;乙腈(色谱级)、甲酸、乙酸 Thermo Fisher Scientific公司;电镜固定液 武汉赛维尔生物科技有限公司(Servicebio);无水乙醇 国药集团化学试剂有限公司;乙酸异戊酯 国药集团化学试剂有限公司;磷酸盐缓冲液(PBS) 武汉赛维尔生物科技有限公司(Servicebio);锇酸 特德佩拉公司(Ted Pella Inc)。
SW-CJ-1F型超净工作台 浙江孚夏仪器有限公司;Eclipse Ci-L型光学显微镜 日本尼康株式会社;ZX-400型自动菌落技术仪 杭州泽析生物科技有限公司;Avanti JXN-26型高速冷冻离心机 美国贝克曼库尔特有限公司;R300型全自动旋转蒸发仪 瑞士步琦有限公司;Bluepard型恒温培养箱 上海一恒科学仪器有限公司;FiveEasy Plus型pH计 上海梅特勒-托利多仪器有限公司;Acquity UPLC型超高效液相-离子淌度-飞行时间质谱(UPLC-Vion-IMS-QTof) 美国马萨诸塞州米尔福德沃茨公司;K850型临界点干燥仪 阔融信息科技有限公司(Quorum);MC1000型离子溅射仪、SU8100型扫描电子显微镜 株式会社日立制作所(HITACHI)。
1.2 实验方法
1.2.1 葡萄叶片内生菌的分离纯化
使用剪刀将从吐鲁番采摘的无核白葡萄茎和叶(叶龄两个月)裁剪成大小均等的形状,75%无水乙醇擦拭葡萄叶片,晾干后,加5 mL无菌水,榨汁机取汁后,用四层纱布滤出,取1 mL过滤后的上清液置于1.5 mL离心管内。采用梯度稀释法,稀释至10−3、10−4、10−5和10−6,涂布棒均匀涂布于NA和PDA(含Cl)培养基中,30 ℃培养箱培养7 d。根据形态的不同挑取单菌落,在NA培养基上划线纯化。
1.2.2 葡萄叶片内生菌初筛
参考LI等[16]的方法,并有所改动。将斜面中黑曲霉接种至PDA上,30 ℃培养箱培养7 d。刮取黑曲霉至30 mL无菌水中,采用血球计数板将孢子悬浮液浓度调整至1×106 spores/mL。
采用平板对峙法,将45 μL的黑曲霉孢子悬浮液用移液枪吸取并滴至PDA中央,在距离中央2 cm的地方按十字法接种细菌,30 ℃培养箱进行6~7 d的连续培养,每组处理设3个平行,计算抑菌率,用抑菌率反映防治效果。
抑菌率(%)=对照组病斑直径−实验组病斑直径对照组病斑直径−伤痕直径×100 1.2.3 葡萄叶片内生菌复筛
参考Rana等[17]的方法,并有所改动。依据初步筛选的结果,选择对黑曲霉具有明显拮抗作用的内生细菌,挑取少量内生细菌将其接种至100 mL NB培养基内,在140 r/min、30 ℃下振荡24 h,得到种子液,用移液枪吸取1 mL种子液于新的100 mL NB培养基中,得到发酵液。使用移液枪吸取100 μL的黑曲霉孢子悬液(浓度为1×106 spores/mL)注入到PDA平板培养基中,涂布棒均匀涂抹。用9 mm的灭菌打孔器在PDA培养基中打孔,每孔注入的内生细菌发酵液,体积为100 μL,30 ℃培养箱中培养7 d,每组处理设3个平行,采用“十字测量法”测量抑菌圈直径,并按照下式计算抑菌效价。
抑菌效价(cm/mL)=抑菌圈直径-打孔器直径发酵液体积×100 1.2.4 菌株鉴定
1.2.4.1 形态学观察和生理生化测定
比照《常见细菌系统鉴定手册》[18],将分离得到的内生细菌进行形态学观察、生理生化测定,检验内容包括API20E、氧化酶等生理生化指标[19]。
API20E检测方法:将培养好的细菌接种到API20E试剂盒中的培养基中,根据API20E试剂盒中的说明书,添加一定量的试剂并观察反应的结果,根据API20E试剂盒提供的指南以及反应结果判定细菌的物种。
氧化酶检测方法:在培养好的细菌平板菌落上滴加试剂1~2滴,阳性者Kovacs氏试剂呈粉红色~深紫色,Ewing氏改进试剂呈蓝色。
扫描电镜方法:新鲜组织确定取材部位,尽量减小牵拉、挫伤与挤压等机械损伤,1~3 min内取样,组织块面积不超过3 mm2,用PBS轻轻漂洗将样本表面的血污,毛发等去掉,保护好需要扫描的面并做好标记(如在对面进行剪角处理)。迅速投入电镜固定液室温固定2 h,再转移至4 ℃保存。固定好的样品经0.1 mol/L磷酸缓冲液PB(pH7.4)漂洗3次,每次15 min。0.1 mol/L磷酸缓冲液PB(pH7.4)配制1%锇酸室温避光固定1~2 h。0.1 mol/L磷酸缓冲液PB(pH7.4)漂洗3次,每次15 min。组织依次加入30%-50%-70%-80%-90%-95%-100%-100%酒精,每次15 min,乙酸异戊酯15 min。将样品放入临界点干燥仪内进行干燥,将样本紧贴于导电碳膜双面胶上放入离子溅射仪样品台上进行喷金30 s左右,扫描电子显微镜下观察采图。
1.2.4.2 分子生物学分析
采用细菌基因组提取试剂盒提取菌株DNA,以总DNA为模板,用通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-TACCTTGTTACGACTT-3')进行聚合酶链式反应(PCR)。扩增30 μL体系:模板DNA 2 μL、引物各1 μL、2×PCR Buffer Mix 15 μL、ddH2O 11 μL。扩增程序:94 ℃ 4 min,94 ℃ 30 s,65 ℃ 40 s,72 ℃ 90 s,30个循环;72 ℃ 10 min[20−21]。扩增产物经1%琼脂糖电泳合格后,交由生工生物工程(上海)股份有限公司完成测序。测序后序列提交GenBank数据库,经NCBI和EzBioCloud数据库对比分析,选取序相近菌株的16S rDNA序列下载,用MEGA 7.0软件,选用NJ法进行构建系统发育进化树,Bootstrap值1000。
1.2.5 小鼠急性经口毒性实验
委托青岛科创质量检测有限公司对贝莱斯芽孢杆菌TLF4-3原样进行急性经口毒性试验[22]。贝莱斯芽孢杆菌TLF4-3使用20只月龄3~4周的SPF KM小鼠,动物伦理审查编号为IACUC-2023-1009,雌雄各半,雌性动物未交配过、未妊娠,体重18~22 g。以10000 mg/kg·bw的剂量灌胃进行试验,动物需预先适应5 d未出现异常情况在进行试验,试验前需禁食,KM小鼠禁食4 h,自由饮水。给予受试样品后小鼠继续禁食1 h。一次性给予受试样品,灌胃体积为20 mL/kg·bw。给药后观察小鼠3 h,然后每天观察一次,持续14 d。从试验开始后每一周称取小鼠体重并记录。对接近死亡的小鼠和在试验结束时处死的小鼠进行大体病理学观察。
1.2.6 TLF4-3代谢物质对黑曲霉的抑菌效果
将菌株TLF4-3在100 mL的NB培养基,30 ℃、140 r/min条件下震荡培养24 h作为种子液。使用200 mL的NB培养基发酵,发酵条件为种子液接种量2%、发酵温度30 ℃、转速140 r/min、培养14 d后得到菌株TLF4-3的发酵液。将发酵液在4 ℃高速冷冻离心机中,9102 g/min,10 min,获得发酵上清液。用6 mol/L HCl溶液调整上清pH为2.5,4 ℃保存过夜。为获得沉淀,收集上清液,4 ℃离心9102 g/min,30 min,通过逐渐增加甲醇浓度从沉淀中提取脂肽粗提物[23−24]。采用平板对峙法检测脂肽粗提物对黑曲霉的抑菌效果。使用移液枪吸取30 μL脂肽提取物和黑曲霉孢子悬浮液的混合液,接种至PDA中心处,以只接种黑曲霉孢子悬浮液和无菌水的混合物作对照,30 ℃培养箱培养5~7 d,每组处理设置3个平行,计算抑菌率,方法同1.2.2。
使用PREP HS C18(5 µm,10×250 mm)柱,通过半制备型高效液相色谱法纯化脂肽粗提物。移动的流动相为甲醇:水(80:20,v/v),流速3 mL/min,总运行时间20 min。按出峰时间依次收集物质,通过旋转蒸发器在40 ℃下干燥后用甲醇复溶,通过平板对峙法验证其对黑曲霉的抑菌效果并计算抑制率,每组处理设3个平行,方法同1.2.2。
参考Jia等[25]的方法,并有所改动。在超高效液相-离子淌度-飞行时间质谱上鉴定脂肽类型。使用UPLC HSS T3(1.7 µm,2.1×100 mm)色谱柱进行分离。流动相包括作为洗脱剂A的乙腈和作为洗脱剂B的超纯水。将流速设置为0.3 mL/min,进样体积为10 µL。使用Major Mix IMS/TOF校准试剂盒(waters),进行离子迁移率和质量校准。使用ADI 1.8.2软件进行其他数据采集和处理设置,这些设置是根据制造商的指导原则设置的。
1.2.7 TLF4-3处理对黑曲霉的防效测定
参考赖呈纯等[26]的方法,并有所改动。挑取少量TLF4-3菌体将其接种至100 mL NB培养基内,在140 r/min、30 ℃下振荡24 h,得到种子液,用移液枪吸取1 mL种子液于新的100 mL NB培养基中,得到发酵液,用无菌水将其稀释五倍得到稀释五倍的发酵液。选择外表无破损,大小、颜色及成熟程度相符的葡萄。将整串葡萄浸泡在稀释5倍的发酵液中;0.2%次氯酸钠浸泡为对照组,放于室温下风干2 h后备用。待葡萄果实于室温下自然晾干后,将留有4 mm的果梗的葡萄果粒剪下,使用灭过菌的钢钉在葡萄果实中心处刺破一个3 mm×3 mm×5 mm的伤痕,使用移液枪吸取3 μL的黑曲霉孢子悬浮液(1×106 spores/mL),分别加入到处理组和对照组果实的伤口后进行密封,于室温25 ℃下恒温恒湿培养10 d,每组处理设3个平行,每天观察并记录,按照公式计算抑菌率,用于反映防治效果。
抑菌率(%)=对照组病斑直径−实验组病斑直径对照组病斑直径−伤痕直径×100 1.3 数据处理
使用IBM SPSS Statistics 20的Duncan’s多重比较检验法分析数据和差异显著性检验,P<0.05)表示差异显著,利用Microsoft Excel绘制表格,MEGA 7.0软件构建系统发育树。
2. 结果与分析
2.1 离体条件下不同葡萄叶片内生细菌对黑曲霉的抑菌效果
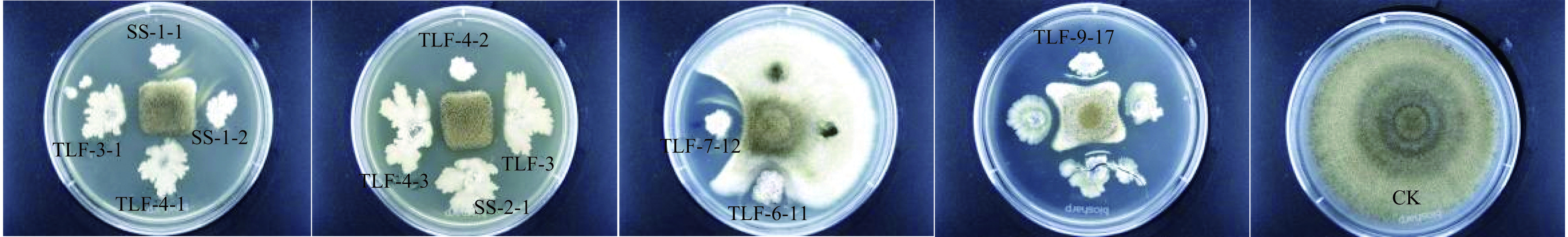
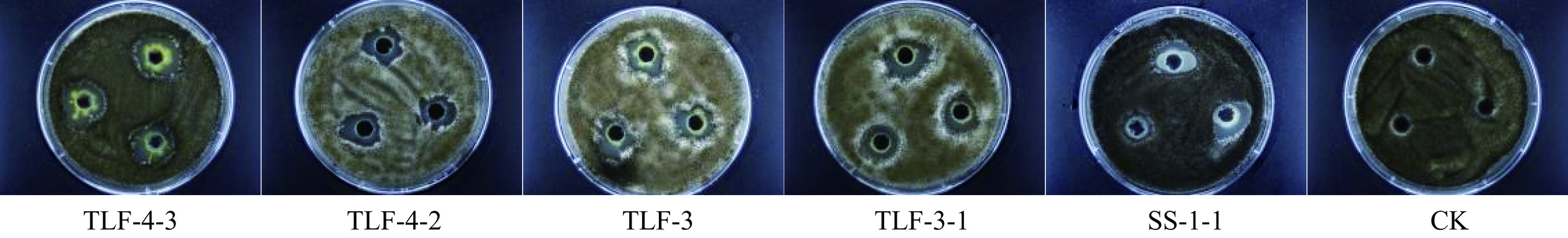
从葡萄叶片中共获得内生细菌25株,初步筛选出11株对黑曲霉抑菌率超过65%以上的内生细菌(图1),由计算可知抑菌率区间为65%~77%,其中TLF4-3的抑菌率最高为(76.04±0.99)%,而TLF6-11的抑菌率仅为(65.47±0.90)%(表1),因此选择抑菌效果较好的5株菌进行复筛,分别为TLF4-3、TLF3、SS1-1、TLF4-2、TLF3-1。复筛后TLF4-3对黑曲霉的抑菌效果最佳(图2),抑菌效价为(18.27±0.53)cm/mL(表2),显著(P<0.05)高于其它4株菌。
表 1 不同内生细菌菌株对黑曲霉A. niger的抑菌率Table 1. Inhibition rate of different endophytic bacterial strains against A. niger菌株编号 抑菌率 SS1-1 74.72±1.41ab SS1-2 69.85±0.51d TLF4-1 72.81±1.20bc TLF3-1 74.96±0.19a TLF4-2 74.67±0.51ab TLF3 74.82±1.08ab SS2-1 68.58±0.49e TLF4-3 76.04±0.99a TLF7-12 69.97±0.42d TLF6-11 65.47±0.90f TLF9-17 72.56±0.10c 注:同列不同小写字母表示差异显著(P<0.05)。 表 2 不同内生细菌菌株对黑曲霉A. niger的抑菌效价Table 2. Inhibition of different endophytic bacteria strains to A. niger菌株编号 抑菌效价 TLF4-3 18.27±0.53a TLF4-2 13.83±0.61b TLF3 12.31±0.38c TLF3-1 11.61±0.63cd SS1-1 10.85±0.54d 注:同列不同小写字母表示差异显著(P<0.05)。 2.2 菌株TLF4-3的鉴定
2.2.1 形态学鉴定
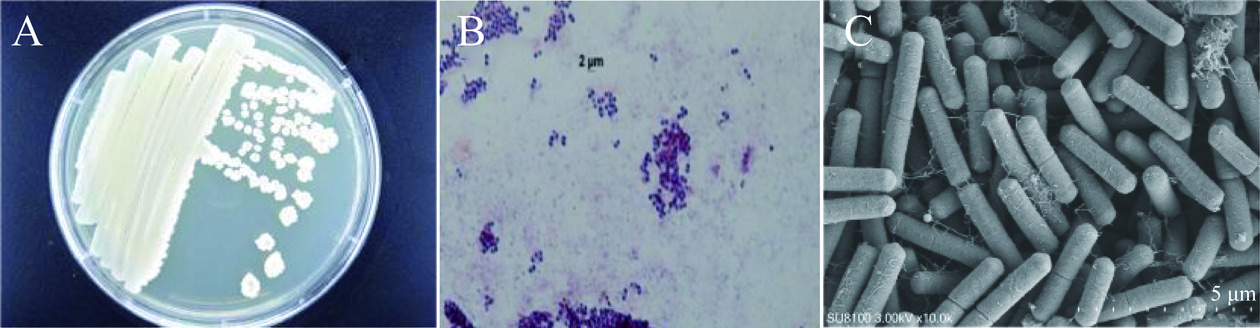
研究表明,菌株TLF4-3在NA培养基划线上培养24 h后,形成3~4 mm菌落,呈现不规则圆形或椭圆形,表面光滑呈乳白色,中间凸起,2~3 d后表面逐渐干燥、起皱(图左),其革兰氏染色结果呈现阳性(图中),光学显微镜下观察菌株TLF4-3杆状或短杆状,单个或多个细菌排列,呈短链状(图右)。
2.2.2 生理生化结果
菌株TLF4-3革兰氏染色结果为紫色,因此TLF4-3为革兰氏阳性菌,氧化酶、V-P、CIT、GEL反应均呈现阳性,可以利用蔗糖、葡萄糖、果糖、麦芽糖,并能水解淀粉,同时在5% NaCl的条件下可以正常生长(表3)。以上各项生理生化指标均与芽孢杆菌属特征相符,且与已报道的贝莱斯芽孢杆菌生理生化特征基本保持一致。
表 3 菌株TLF4-3的生理生化鉴定结果Table 3. Physiological and biochemical identification results of strain TLF4-3处理 结果 革兰氏染色Gram staining + 氧化酶反应Oxidase reaction + V-P反应V-P reaction + CIT反应CIT reaction + GEL反应GEL reaction + 蔗糖利用Sucrose utilization + 葡萄糖利用Glucose utilization + 果糖利用Fructose utilization + 麦芽糖利用Maltose utilization + 淀粉水解Starch hydrolysis + ONPG反应ONPG reaction − ADH反应ADH reaction − LDC反应LDC reaction − ODC反应ODC reaction − H2S反应H2S reaction − URE反应URE reaction − TDA反应TDA reaction − 5% NaCl + 注:+:反应阳性;−:反应阴性。 2.2.3 分子生物学
以菌株TLF4-3基因组DNA为模板,通过16S rRNA基因引物序列扩增后得到1段长度为1486 bp的序列,并将其上传至NCBI,得到GenBank登录号为AY603658,基于16S rRNA基因序列通过MEGA 7.0软件构建系统发育树,结果显示这1段序列与贝莱斯芽孢杆菌(Bacillus velezensis)AY603658聚为一支(图4);NCBI数据库比对分别与B. velezensis相似性达93%,综合形态学观察、生理生化和分子生物学结果可以确定菌株TLF4-3为贝莱斯芽孢杆菌(Bacillus velezensis)。
2.3 小鼠急性经口毒性实验
本实验条件下,受试物“贝莱斯芽孢杆菌TLF4-3”原样对KM小鼠的急性经口毒性LD50≥10000 mg/kg·bw,根据动物间体表面积折算等效剂量比值进行换算,计算得小鼠剂量换算成大鼠剂量为7000 mg/kg·bw;换算后“贝莱斯芽孢杆菌TLF4-3”原样对大鼠的急性经口毒性LD50>7000 mg/kg·bw。参照GB 15193.3-2014《食品安全国家标准急性经口毒性试验》中急性毒性(LD50)剂量分级,该样品急性经口毒性试验属实际无毒。
2.4 TLF4-3代谢产物中脂肽类物质的分离鉴定
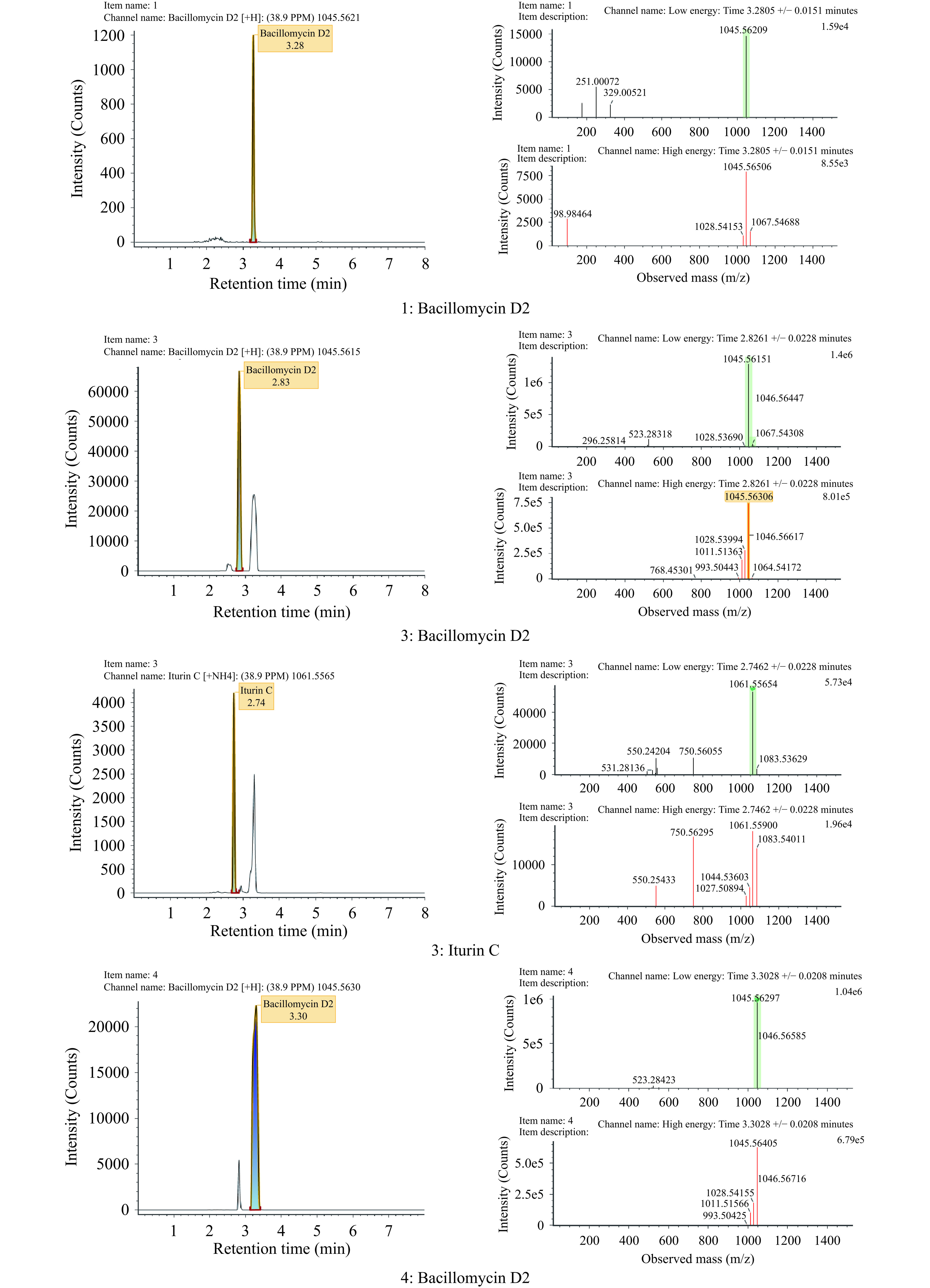
使用半制备液相色谱分离纯化TLF4-3脂肽粗提物得到4个组分,平板对峙结果显示组分1、组分2、组分3、组分4对黑曲霉的抑菌效果分别为(91.33±0.30)%、(14.57±1.57)%、(79.07±2.09)%和100%,其中组分2抑菌效果较弱,因此选择组分1、组分3和组分4分别做高分辨质谱(图7、表4),结果显示菌株TLF4-3的脂肽粗提物在1000~1100 Da分子质量区间主要有2个质谱峰,质核比(m/z)分别为1045.6、1061.6,峰的分布规律符合脂肽化合物的质谱峰规律[27]。根据文献报道可知,1045.6对应C15 Bacillomycin D的M+H+(分子量1045.4),1061.6对应C14Iturin C的M+NH4+(分子量1043.6)。根据表4数据推算可以得出:菌株TLF4-3产生了两种脂肽家族:杆菌霉素和伊枯草菌素,并且起主要抑菌作用的可能是这两种物质:C15 Bacillomycin D2、C14 Iturin C(图8、表5)。
表 4 脂肽粗提物分离纯化的组分对黑曲霉的抑制率Table 4. Inhibition rate of the purified components of the liptide crude extract to A. niger样品名称 抑制率(%) 组分1 91.33±0.30b 组分2 14.57±1.57d 组分3 79.07±2.09c 组分4 100.00±0.00a 注:同列不同小写字母表示差异显著(P<0.05)。 表 5 UPLC-QTOF/MS对TLF4-3脂肽产物的鉴定Table 5. Identification of lipopeptides produced by Bacillus velezensis TLF4-3样品名称 物质名称 分子质量(Da) 质核比 保留时间(min) 数据库响应值 响应值 加合物 组分1 Bacillomycin D2 1044.54916 1045.5621 3.28 7562 5222 +H 组分3 Bacillomycin D2 1044.54916 1045.5615 2.83 854373 458875 +H,+Na Iturin C 1043.52876 1061.5565 2.75 28666 18951 +NH4 组分4 Bacillomycin D2 1044.54916 1045.563 3.3 590879 341671 +H 2.5 TLF4-3对曲霉腐烂病的防治效果
先用TLF4-3发酵液浸泡处理无核白葡萄后再接种黑曲霉,可明显控制葡萄果实病斑直径的扩展,室温25 ℃下储存至第3 d时(表6,图9),与CK组相比,处理组病斑直径降低了2.3 mm(P<0.05),对葡萄采后病原菌黑曲霉的防治效果达到(68.26±0.91)%,Bacillus velezensis 4-3发酵液可有效抑制葡萄曲霉腐烂病的发病率,并能显著延缓葡萄腐烂的发展进程。
表 6 0~7 d内TLF4-3对黑曲霉的防治效果Table 6. Control effect of TLF4-3 on Aspergillus niger within 0~7 days时间(d) 处理组病斑直径(mm) CK组病斑直径(mm) 抑菌率(%) 3 4.2±0.08b 6.5±0.01a 68.26±0.91a 7 6.8±0.13b 11.1±0.07a 53.80±2.02b 注:同列不同小写字母表示差异显著(P<0.05)。 3. 讨论
植物内生菌是从健康组织中分离出来的菌株,不仅不会使植物感病,还可以产生多种抗菌活性物质,从而在与病原菌相互竞争的过程中获得一定的生长空间。前人研究发现,在橄榄树根系中分离得到的贝式芽孢杆菌Bvel1对葡萄灰霉病具有显著的抑制作用,发病率比对照降低了64.77%[2]。然而,目前防治葡萄采后病害的拮抗细菌主要来源于葡萄果实及葡萄园土壤等[28],很少来源于葡萄叶片。LI等[16]从葡萄果实表面筛选出一株枯草芽孢杆菌K1,其对灰葡萄孢菌菌丝的抑制率为78.42%。本研究从无核白健康葡萄叶片中分离纯化获得25株内生细菌,通过平板对峙法筛选出1株具有较好抑制效果的拮抗细菌TLF4-3,其抑菌圈直径达27.27 mm,抑菌效价为(18.27±0.53)cm/mL。前人筛选了伯氏致病杆菌445(Xenorhabdus bovienii)对黑曲霉的抑菌效价为10.59 cm/mL[15],抑菌效果低于本研究筛选的拮抗菌TLF4-3,因此将TLF4-3作为后续实验的目标菌株。
通过形态学、生理生化结果以及分子生物学,菌株TLF4-3被鉴定为为贝莱斯芽胞杆菌(B. velezensis)。贝莱斯芽胞杆菌应用于水果采后病害防治已有相关报道。喷施贝莱斯芽孢杆菌SM2发酵液可有效降低番茄灰霉病的发病率和病情指数,盆栽、田间防效分别达到71.73%、65.22%[29]。活体实验中,先接种菌株GSBZ09的发酵液,24 h再接种C. vitis,其处理组酿酒葡萄的发病率和病害指数下降了56.94%和26.03%[30]。但拮抗菌株应用到水果中,需要考虑食用后是否对人体无害,因此小鼠急性经口毒性试验就成为了考察菌株安全性的必备项[21]。照GB 15193.3-2014《食品安全国家标准急性经口毒性试验》,将贝莱斯芽孢杆菌TLF4-3发酵液喂服小鼠,结果表明该菌株属实际无毒,说明了其在葡萄采后保鲜中是可行的。
近年来,超高效液相-离子淌度-飞行时间质谱仪(UPLC-Vion-IMS-QTof)被用于脂肽类型的鉴定中,它方便快速,进样量少,高灵敏度和精确度,通过离子峰信号可以迅速定性判断杆菌霉素、伊枯草菌素和表面活性素等化合物[31]。Ravi等[32]利用UPLC-Vion-IMS-QTof技术在内生芽孢杆菌Fcl1中鉴定出其主要抑菌成分是表面活性素。本研究中对贝莱斯芽胞杆菌TLF4-3的脂肽粗提物进行UPLC-Vion-IMS-QTof测定,结果显示TLF4-3脂肽粗提物中含有杆菌霉素和伊枯草菌素两大家族,主要为杆菌霉素D和伊枯草菌素C。平板对峙实验也验证了其对黑曲霉具有较好的抑菌作用,杆菌霉素D是由芽孢杆菌等次级代谢产生的天然抗菌脂肽类物质,对柑橘绿霉的孢子萌发和菌丝生长具有直接的抑制作用[33]。Zirui等[34]研究发现贝莱斯芽胞杆菌WRB-ZX-001和贝莱斯芽孢杆菌WRB-ZX-002的主要抑菌物质均为C14和C15伊枯草菌素A。本研究后续将进一步探索其对黑曲霉的抑制机理,为该抑菌物质作为拮抗制剂防治葡萄采后病害提供理论基础。
目前关于拮抗酵母菌防治葡萄采后曲霉腐烂病的研究居多,而拮抗细菌较少。从苹果表面筛到的罗伦隐球酵母能有效抑制葡萄采后灰霉病的自然发病率,抑制率高达90%[13]。究其原因,酵母不会产生毒素,因此基于考虑食用者的安全性上,拮抗酵母是首选。但本研究中拮抗细菌TLF4-3经小鼠急性经口毒性试验被证明无毒。在进行葡萄果实防治试验中,先用稀释5倍后的TLF4-3发酵液浸泡无核白葡萄再接种黑曲霉,3 d后,处理组果实的病斑直径比对照组降低了2.3 mm,防效为68.26%。高宇洁等[15]使用伯氏致病杆菌445发酵液处理红地球葡萄果实,贮藏至第4 d时,处理组果实的病斑直径与对照组相比降低了21.02%,防治效果略低于本研究,为61.3%,且TLF4-3发酵液经过稀释5倍仍能达到较好的防治效果,可以降低生产成本,由此看来,贝莱斯芽孢杆菌TLF4-3在葡萄采后曲霉腐烂病的防治中具有较好的生防潜力。
4. 结论
本研究从葡萄叶片中分离筛选出1株对黑曲霉具有较好抑菌作用的拮抗内生细菌,经鉴定其为贝莱斯芽孢杆菌(Bacillus velezensis)。经UPLC IMS QTOF MS技术检测分析该菌株脂肽主要为杆菌霉素D2(C15 Bacillomycin)和伊枯草菌C (C14 Iturin)。与对照组相比,3 d后处理组的葡萄果实病斑直径降低了2.3 mm,防治效果达68.26%。离体活体条件下,贝莱斯芽孢杆菌TLF4-3均对葡萄黑曲霉产生了较好的抑菌效果,其主要抑菌物质是脂肽,并且具有安全性,可以应用于葡萄采后贮藏病害防治。
-
表 1 不同内生细菌菌株对黑曲霉A. niger的抑菌率
Table 1 Inhibition rate of different endophytic bacterial strains against A. niger
菌株编号 抑菌率 SS1-1 74.72±1.41ab SS1-2 69.85±0.51d TLF4-1 72.81±1.20bc TLF3-1 74.96±0.19a TLF4-2 74.67±0.51ab TLF3 74.82±1.08ab SS2-1 68.58±0.49e TLF4-3 76.04±0.99a TLF7-12 69.97±0.42d TLF6-11 65.47±0.90f TLF9-17 72.56±0.10c 注:同列不同小写字母表示差异显著(P<0.05)。 表 2 不同内生细菌菌株对黑曲霉A. niger的抑菌效价
Table 2 Inhibition of different endophytic bacteria strains to A. niger
菌株编号 抑菌效价 TLF4-3 18.27±0.53a TLF4-2 13.83±0.61b TLF3 12.31±0.38c TLF3-1 11.61±0.63cd SS1-1 10.85±0.54d 注:同列不同小写字母表示差异显著(P<0.05)。 表 3 菌株TLF4-3的生理生化鉴定结果
Table 3 Physiological and biochemical identification results of strain TLF4-3
处理 结果 革兰氏染色Gram staining + 氧化酶反应Oxidase reaction + V-P反应V-P reaction + CIT反应CIT reaction + GEL反应GEL reaction + 蔗糖利用Sucrose utilization + 葡萄糖利用Glucose utilization + 果糖利用Fructose utilization + 麦芽糖利用Maltose utilization + 淀粉水解Starch hydrolysis + ONPG反应ONPG reaction − ADH反应ADH reaction − LDC反应LDC reaction − ODC反应ODC reaction − H2S反应H2S reaction − URE反应URE reaction − TDA反应TDA reaction − 5% NaCl + 注:+:反应阳性;−:反应阴性。 表 4 脂肽粗提物分离纯化的组分对黑曲霉的抑制率
Table 4 Inhibition rate of the purified components of the liptide crude extract to A. niger
样品名称 抑制率(%) 组分1 91.33±0.30b 组分2 14.57±1.57d 组分3 79.07±2.09c 组分4 100.00±0.00a 注:同列不同小写字母表示差异显著(P<0.05)。 表 5 UPLC-QTOF/MS对TLF4-3脂肽产物的鉴定
Table 5 Identification of lipopeptides produced by Bacillus velezensis TLF4-3
样品名称 物质名称 分子质量(Da) 质核比 保留时间(min) 数据库响应值 响应值 加合物 组分1 Bacillomycin D2 1044.54916 1045.5621 3.28 7562 5222 +H 组分3 Bacillomycin D2 1044.54916 1045.5615 2.83 854373 458875 +H,+Na Iturin C 1043.52876 1061.5565 2.75 28666 18951 +NH4 组分4 Bacillomycin D2 1044.54916 1045.563 3.3 590879 341671 +H 表 6 0~7 d内TLF4-3对黑曲霉的防治效果
Table 6 Control effect of TLF4-3 on Aspergillus niger within 0~7 days
时间(d) 处理组病斑直径(mm) CK组病斑直径(mm) 抑菌率(%) 3 4.2±0.08b 6.5±0.01a 68.26±0.91a 7 6.8±0.13b 11.1±0.07a 53.80±2.02b 注:同列不同小写字母表示差异显著(P<0.05)。 -
[1] 刘凤之. 我国葡萄产业现状与高质量发展方向[J]. 农业知识,2023,75(10):10−14. [LIU F Z. Current situation and high quality development direction of grape industry in China[J]. Agricultural Knowledge,2023,75(10):10−14.] LIU F Z. Current situation and high quality development direction of grape industry in China[J]. Agricultural Knowledge, 2023, 75(10): 10−14.
[2] 张苗苗, 张雨晨, 杨怡中, 等. 拮抗菌防治葡萄采后病害研究进展[J]. 食品工业科技,2024,45(9):410−418. [ZHANG M M, ZHANG Y C, YAANG Y Z, et al. Research progress on antagonistic antimicrobial prevention and control of grape postharvest diseases[J]. Food Industry Science and Technology,2024,45(9):410−418.] ZHANG M M, ZHANG Y C, YAANG Y Z, et al. Research progress on antagonistic antimicrobial prevention and control of grape postharvest diseases[J]. Food Industry Science and Technology, 2024, 45(9): 410−418.
[3] 李小红, 李运景, 马晓青, 等. 我国葡萄产业发展现状与展望[J]. 中国南方果树,2021,50(5):161−166. [LI X H, LI Y J, MA X Q, et al. Current situation and prospect of grape industry development in China[J]. Fruit Trees of Southern China,2021,50(5):161−166.] LI X H, LI Y J, MA X Q, et al. Current situation and prospect of grape industry development in China[J]. Fruit Trees of Southern China, 2021, 50(5): 161−166.
[4] ASSAF L, PEDROZO L P, NALLY M C, et al. Use of yeasts from different environments for the control of Penicillium expansum on table grapes at storage temperature[J]. International Journal of Food Microbiology,2020,37(320):108520.
[5] 孟创鸽, 曹红霞, 韩峪, 等. 葡萄贮藏保鲜技术研究进展[J]. 黑龙江农业科学,2022,45(5):102−106. [MENG C G, CAO H X, HAN Y, et al. Research progress of grape storage and fresh-keeping technology[J]. Agricultural Sciences in Heilongjiang,2022,45(5):102−106.] MENG C G, CAO H X, HAN Y, et al. Research progress of grape storage and fresh-keeping technology[J]. Agricultural Sciences in Heilongjiang, 2022, 45(5): 102−106.
[6] 张鹏, 邵丹, 李江阔, 等. 葡萄冷藏时间对贮后货架期芳香物质的影响[J]. 食品科学,2016,37(2):218−224. [ZHANG P, SHAO D, LI J K, et al. Effect of cold storage time on aromatic substances of grape after storage[J]. Food Science,2016,37(2):218−224.] ZHANG P, SHAO D, LI J K, et al. Effect of cold storage time on aromatic substances of grape after storage[J]. Food Science, 2016, 37(2): 218−224.
[7] 邵千朔, 黄桂丽, 梁慧敏, 等. 鲜食葡萄保鲜技术研究进展[J]. 江苏农业科学,2024,52(4):17−22. [SHAO Q S, HUANG G L, LIANG H M, et al. Research progress on preservation technology of table grape[J]. Jiangsu Agricultural Sciences,2024,52(4):17−22.] SHAO Q S, HUANG G L, LIANG H M, et al. Research progress on preservation technology of table grape[J]. Jiangsu Agricultural Sciences, 2024, 52(4): 17−22.
[8] 王曼, 魏佳, 伊丽达娜·迪力夏提, 等. 二氧化硫调控亚硫酸盐代谢对葡萄采后灰霉病的抑制作用[J]. 中国食品学报,2022,22(11):299−308. [WANG M, WEI J, DI LI XIA TI Y L D N, et al. The inhibitory effect of sulfur dioxide on postharvest gray mold of grape by regulating sulfite metabolism[J]. Chinese Journal of Food Science,2022,22(11):299−308.] WANG M, WEI J, DI LI XIA TI Y L D N, et al. The inhibitory effect of sulfur dioxide on postharvest gray mold of grape by regulating sulfite metabolism[J]. Chinese Journal of Food Science, 2022, 22(11): 299−308.
[9] 王凤超. 二氧化硫处理对鲜食葡萄贮藏病害及生理的影响[D]. 乌鲁木齐:新疆农业大学, 2013. [WANG F C. Effects of sulfur dioxide treatment on storage diseases and physiology of table grapes[D]. Urumqi:University of Xinjiang Agricultural, 2013.] WANG F C. Effects of sulfur dioxide treatment on storage diseases and physiology of table grapes[D]. Urumqi: University of Xinjiang Agricultural, 2013.
[10] 李梓童, 彭丽, 熊思国, 等. 1-MCP和SO2处理对阳光玫瑰葡萄贮藏品质及风味的影响[J]. 包装工程,2023,44(11):64−77. [LI Z T, PENG L, XIONG S G, et al. Effects of 1-MCP and SO2 treatments on storage quality and flavor of Sunny Rose grape[J]. Packaging Engineering,2023,44(11):64−77.] LI Z T, PENG L, XIONG S G, et al. Effects of 1-MCP and SO2 treatments on storage quality and flavor of Sunny Rose grape[J]. Packaging Engineering, 2023, 44(11): 64−77.
[11] 秦丹, 石雪晖, 林亲录, 等. 葡萄采后病害生物防治研究进展[J]. 食品与机械,2007,122(6):142−144. [QIN D, SHI X H, LIN Q L, et al. Research progress on biological control of postharvest diseases of grape[J]. Food and Machinery,2007,122(6):142−144.] QIN D, SHI X H, LIN Q L, et al. Research progress on biological control of postharvest diseases of grape[J]. Food and Machinery, 2007, 122(6): 142−144.
[12] JIANG C, SHI J, LIU Y, et al. Inhibition of Aspergillus carbonarius and fungal contamination in table grapes using Bacillus subtilis[J]. Food Control,2014,35(1):41−48. doi: 10.1016/j.foodcont.2013.06.054
[13] 刘海波, 田世平, 秦国政, 等. 罗伦隐球酵母对葡萄采后病害的拮抗效果[J]. 中国农业科学,2002,43(7):831−835. [LIU H B, TIAN S P, QIN G Z, et al. Antagonistic effect of Cryptococcus lorenensis on postharvest diseases of grape[J]. Agricultural Science in China,2002,43(7):831−835.] doi: 10.3321/j.issn:0578-1752.2002.07.017 LIU H B, TIAN S P, QIN G Z, et al. Antagonistic effect of Cryptococcus lorenensis on postharvest diseases of grape[J]. Agricultural Science in China, 2002, 43(7): 831−835. doi: 10.3321/j.issn:0578-1752.2002.07.017
[14] 李丽梅, 刘霞, 李喜宏, 等. 常温下黑曲霉对刺伤红提葡萄的致病规律研究及拮抗菌筛选[J]. 食品研究与开发,2020,41(15):35−39. [LI L M, LIU X, LI X H et al. Study on pathogenic rule of Aspergillus niger on punctured red grapes at room temperature and screening of antagonistic bacteria[J]. Food Research and Development,2020,41(15):35−39.] doi: 10.12161/j.issn.1005-6521.2020.15.007 LI L M, LIU X, LI X H et al. Study on pathogenic rule of Aspergillus niger on punctured red grapes at room temperature and screening of antagonistic bacteria[J]. Food Research and Development, 2020, 41(15): 35−39. doi: 10.12161/j.issn.1005-6521.2020.15.007
[15] 高宇洁, 詹发强, 陈澄, 等. 黑曲霉拮抗菌Xenorhabdus bovienii 445筛选、鉴定及发酵优化[J]. 新疆农业科学,2022,59(5):1203−1215. [GAO Y J, ZHAN F Q, CHEN C, et al. Screening, identification and fermentation optimization of antagonistic Aspergillus niger bacterium Xenorhabdus bovienii 445[J]. Xinjiang Agricultural Sciences,2022,59(5):1203−1215.] GAO Y J, ZHAN F Q, CHEN C, et al. Screening, identification and fermentation optimization of antagonistic Aspergillus niger bacterium Xenorhabdus bovienii 445[J]. Xinjiang Agricultural Sciences, 2022, 59(5): 1203−1215.
[16] LI P, FENG B, YAO Z, et al. Antifungal activity of endophytic bacillus K1 against Botrytis cinerea[J]. Front Microbiol,2022,22(13):935675.
[17] HAIDAR R, ROUDET J, BONNARD O, et al. Screening and modes of action of antagonistic bacteria to control the fungal pathogen Phaeomoniella chlamydospora involved in grapevine trunk diseases[J]. Microbiol Res,2016,10(192):172−184.
[18] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001:166−171. [DONG X Z, CAI M Y. Common bacteri-al system identification manual[M]. Beijing:Science Press, 2001:166−171.] DONG X Z, CAI M Y. Common bacteri-al system identification manual[M]. Beijing: Science Press, 2001: 166−171.
[19] MULET M, GOMILA M, RAMÍREZ A, et al. Pseudomonas nosocomialis sp. nov. isolated from clinical specimens[J]. International Journal of Systematic and Evolutionary Microbiology,2019,69(11):3392−3398. doi: 10.1099/ijsem.0.003628
[20] 潘超, 高庆超, 梁颖, 等. 葡萄酒酿造乳酸菌的分离鉴定及糖苷酶活分析[J]. 中国食品学报,2023,23(4):345−353. [PAN C, GAO Q C, LIANG Y, et al. Isolation and identification of lactic acid bacteria from wine production and analysis of glycosidase activity[J]. Chinese Journal of Food Science,2023,23(4):345−353.] PAN C, GAO Q C, LIANG Y, et al. Isolation and identification of lactic acid bacteria from wine production and analysis of glycosidase activity[J]. Chinese Journal of Food Science, 2023, 23(4): 345−353.
[21] 张丽娟, 黄伟, 王宁, 等. 耐辐射芽胞杆菌JK23的鉴定及其生防活性研究[J]. 中国生物防治学报,2021,37(5):997−1006. [ZHANG L J, HUANG W, WANG N, et al. Identification and biocontrol activity of radiation-tolerant Bacillus JK23[J]. Chinese Journal of Biological Control,2021,37(5):997−1006.] ZHANG L J, HUANG W, WANG N, et al. Identification and biocontrol activity of radiation-tolerant Bacillus JK23[J]. Chinese Journal of Biological Control, 2021, 37(5): 997−1006.
[22] 全国信息与文献标准化技术委员会第6分委员会. GB 15193.3-2014 食品安全国家标准 急性经口毒性试验[S]. 北京:中国标准出版社, 2014:1−6. [The sixth sub-committee of the National Technical Committee for Standardization of Information and Documentation. GB 15193.3-2014 National standard acute oral toxicity test for food safety[S]. Beijing:Standards Press of China, 2014:1−6.] The sixth sub-committee of the National Technical Committee for Standardization of Information and Documentation. GB 15193.3-2014 National standard acute oral toxicity test for food safety[S]. Beijing: Standards Press of China, 2014: 1−6.
[23] 王宁, 黄伟, 鲁致远, 等. 苹果树腐烂病生防链霉菌A144的鉴定及其代谢产物的抑菌活性[J]. 西北农业学报,2023,32(3):440−449. [WANG N, HUANG W, LU Z Y, et al. Identification of Streptomyces A144 in apple tree rot and antibacterial activity of its metabolites[J]. Northwest Agricultural Journal,2023,32(3):440−449.] WANG N, HUANG W, LU Z Y, et al. Identification of Streptomyces A144 in apple tree rot and antibacterial activity of its metabolites[J]. Northwest Agricultural Journal, 2023, 32(3): 440−449.
[24] WU S, LIU G, ZHOU S, et al. Characterization of Antifungal lipopeptide Biosurfactants produced by marine Bacterium Bacillus sp. CS30[J]. Mar Drugs,2019,17(4):199. doi: 10.3390/md17040199
[25] JIA Q, FAN Y, DUAN S, et al. Effects of Bacillus amyloliquefaciens XJ-BV2007 on growth of Alternaria alternata and production of Tenuazonic Acid[J]. Toxins,2023,15(1):53. doi: 10.3390/toxins15010053
[26] 赖呈纯, 赖恭梯, 陈冰星, 等. 拮抗酵母菌的筛选鉴定、生物学特性及其对葡萄灰霉病菌的抑菌活性研究[J]. 中国生物防治学报,2023,39(2):1−14. [LAI C C, LAI G T, CHEN B X, et al. Screening, identification, biological characteristics and antibacterial activity of antagonistic yeast against Botrytis botrytis[J]. Chinese Journal of Biological Control,2023,39(2):1−14.] LAI C C, LAI G T, CHEN B X, et al. Screening, identification, biological characteristics and antibacterial activity of antagonistic yeast against Botrytis botrytis[J]. Chinese Journal of Biological Control, 2023, 39(2): 1−14.
[27] 刘佳欣. 海洋枯草芽孢杆菌产抗菌脂肽类化合物的分离纯化及鉴定分析[D]. 大连:大连工业大学, 2018. [LIU J X. Isolation, purification and identification of antibacterial liptide compounds produced by Bacillus subtilis marinum[D]. Dalian:Dalian Polytechnic University, 2018.] LIU J X. Isolation, purification and identification of antibacterial liptide compounds produced by Bacillus subtilis marinum[D]. Dalian: Dalian Polytechnic University, 2018.
[28] 魏玉洁, 邹弯, 马文瑞, 等. 应用高通量测序技术研究新疆产区葡萄果实、叶片及果园土壤微生物多样性[J]. 食品科学,2018,39(6):162−170. [WEI Y J, ZHOU W, MA W R et al. High-throughput sequencing technology was used to study the microbial diversity of grape fruits, leaves and orchards in Xinjiang[J]. Food Science,2018,39(6):162−170.] doi: 10.7506/spkx1002-6630-201806026 WEI Y J, ZHOU W, MA W R et al. High-throughput sequencing technology was used to study the microbial diversity of grape fruits, leaves and orchards in Xinjiang[J]. Food Science, 2018, 39(6): 162−170. doi: 10.7506/spkx1002-6630-201806026
[29] 张琦, 刘应敏, 杨东燕, 等. 贝莱斯芽孢杆菌SM2对番茄灰霉病的生防效果[J]. 中国瓜菜,2024,37(2):66−73. [ZHANG Q, LIU Y M, YANG D Y, et al. Biocontrol effect of Bacillus velezensis SM2 on gray mold of tomato[J]. Chinese Melon,2024,37(2):66−73.] ZHANG Q, LIU Y M, YANG D Y, et al. Biocontrol effect of Bacillus velezensis SM2 on gray mold of tomato[J]. Chinese Melon, 2024, 37(2): 66−73.
[30] YIN X, LI T, JIANG X, et al. Suppression of grape white rot caused by Coniella vitis using the potential biocontrol agent Bacillus velezensis GSBZ09[J]. Pathogens,2022,11(2):248. doi: 10.3390/pathogens11020248
[31] GIKAS E, BAZOTI F N, KATSIMARDOU, M, et al. Determination of colistin A and colistin B inhuman plasma by UPLC–ESI high resolution tandem MS:Application to a pharmacokinetic study[J]. Pharm Biomed Anal,2013,83(5):228−236.
[32] RAVI A, NANDAYIPURATH V V T, RAJAN S, et al. Effect of zinc oxidenanoparticle supplementation on the enhanced production of surfactin and iturin lipopeptides of endophytic Bacillus sp. Fcl1 and its ameliorated antifungal activity[J]. Pest Manag Sci,2020,77(20):1035−1041.
[33] 孙静, 刘玉娟, 罗晓娇, 等. 杆菌霉素D和壳聚糖复合抑菌作用及其对砂糖橘保鲜效果[J/OL]. 食品工业科技:1−14[2024-04-30]. [SUN J, LIU Y J, LUO X J, et al. Bacteriostatic effect of bacitomycin D and chitosan on preservation of sugar orange[J/OL]. Food Industry Science and Technology:1−14[2024-04-30].] SUN J, LIU Y J, LUO X J, et al. Bacteriostatic effect of bacitomycin D and chitosan on preservation of sugar orange[J/OL]. Food Industry Science and Technology: 1−14[2024-04-30].
[34] XIONG Z R, COBO M, WHITTAL R M, et al. Purification and characterization of antifungal lipopeptide produced by Bacillus velezensis isolated from raw honey[J]. PLoS One,2022,17(4):e0266470. doi: 10.1371/journal.pone.0266470





 下载:
下载:





 下载:
下载:



