Stability and Lipid- lowering Effect of the Complex of Agrocybe Cylindracea Polysaccharides and Pomegranate Peel Polyphenols
-
摘要: 目的:探究茶树菇多糖(Agrocybe cylindracea polysaccharide,ACP)与石榴皮多酚(Pomegranate peel polyphenols,PPP)提取物的复合物的稳定性,并研究其结构以及二者是否具有协同降脂作用。方法:在前期试验的基础上,获得了茶树菇多糖和石榴皮多酚的提取物,进行定量分析,通过非共价作用制备复合物,对复合物ACP-PPP进行结构表征、稳定性试验,并检测其单一组分及其复合物对饱和脂肪、不饱和脂肪、胆固醇、胰脂肪酶的吸附能力,通过Chou-Talalay联合指数(CI),分析二者是否具有协同降脂作用。结果:光谱分析表明ACP-PPP复合物之间主要是氢键相互作用,在复合物形成过程中并未形成新的双键。该复合物的热稳定性更好且溶解度更高。在不同光照、温度、pH、贮藏条件、消化体系的条件下,复合物发生不同程度解离,避光、低温、弱酸性的条件下有利于维持复合物的稳定。ACP与PPP复合后饱和脂肪吸附量13±0.14 g/g、不饱和脂肪吸附量8.73±0.53 g/g、胆固醇吸附量74.8±1.23 mg/g、质量浓度为1.2 mg/mL时,胰脂肪酶抑制率57.21±1.32%,联合作用指数CI均小于1,具有良好协同降血脂作用。结论:茶树菇多糖与石榴皮多酚复合后具有良好的稳定性和协同降脂效果。Abstract: Objective: To examine the structure and potential synergistic lipid-lowering effects of the complex of pomegranate peel polyphenols(PPP) and Agrocybe cylindracea polysaccharide(ACP) extracts, as well as the stability of the mixture. Methods: Based on the previous experiments, extracts of Agrocybe cylindracea polysaccharides and pomegranate peel polyphenols were obtained, subjected to quantitative analysis, and non-covalent interaction was used to generate the complexes. The adsorption capacities of the single components and their complexes on saturated fats, unsaturated fats, cholesterol, and pancreatic lipase were assessed using the Chou-Talalay Combined Index (CI) in order to determine whether the two have synergistic lipid-lowering effects. The complexes ACP-PPP were also subjected to structural characterization and stability tests. Results: The primary contacts between the ACP-PPP complexes were revealed by spectroscopic investigations to be hydrogen bonding interactions; no additional double bonds were created during the complex building process. The complex has greater solubility and thermal stability. It was advantageous to preserve the stability of the complex under the conditions of light avoidance, low temperature, and mild acidity. The complex dissociated to varying degrees under varied parameters of light, temperature, pH, storage settings, and digesting system. When ACP was combined with PPP, the amount of saturated fat that was adsorbed was 13±0.14 g/g, the amount of cholesterol that was adsorbed was 74.8±1.23 mg/g, and at a mass concentration of 1.2 mg/mL, the inhibition rate of pancreatic lipase was 57.21±1.32%. Following the complexation of ACP and PPP, the CI value of each assessment index was less than 1, including a good synergistic lipid-lowering ability. Conclusion: Agrocybe cylindracea polysaccharide and pomegranate peel polyphenols have good stability and synergistic hypolipidemic effect after compounding.
-
由于生活方式和饮食习惯的改变,肥胖、糖尿病、脂肪肝、高脂血症等糖脂代谢性疾病的患病率在全球呈现快速上升趋势,这类疾病的预防和治疗已成为21世纪的主要公共卫生问题[1]。人体内脂质积累过多会导致脂质代谢紊乱,进而导致肥胖、非酒精性脂肪性肝炎和其他代谢性疾病[2]。临床上治疗的药物主要有他汀类化学药品,治疗初期效果显著,但一部分患者对这一类药物并不耐受,而且还会产生副作用[3−4]。因此开发天然低价的降脂食品已成为食品领域的热门话题。
茶树菇(Agrocybe cylidracea)是一种珍贵的食药兼用真菌,原产于闽西北。营养丰富、味道鲜美,受到了广大消费者的一致好评[5]。茶树菇多糖(ACP)是其主要活性成分之一,具有抗氧化、降血脂、抗肿瘤、抗炎等多种功能特性[6−8]。徐峻等[9]采用茶树菇多糖评价小鼠高脂模型,结果表明茶树菇多糖在高脂模型组中降脂效果更为突出。
石榴(Punica granatum L.),千屈菜科石榴属植物,原产于巴尔干半岛至伊朗及其邻近地区。酸甜可口,具有丰富的氨基酸、维生素、纤维素、矿物质等营养物质[10]。在石榴的加工过程中,大部分的石榴皮被当作饲料、肥料简单处理,或直接丢弃,造成了极大的浪费。而天然多酚是石榴皮中功能成分之一。酚类化合物可在一定程度上抑制脂质的消化,并在肠道内吸附胆酸盐和减少脂肪的吸收,使机体保持健康[11]。ZHAO等[12]采用体外HL7702脂肪变性肝细胞模型评估石榴皮多酚及其他一些植物多酚的生物活性,表明石榴皮多酚具有较强的降脂作用。
多糖降脂机制主要是通过吸附胆固醇和甘油三酯,防止其在消化过程中被吸收[13]。多酚类物质调节脂质代谢的机制主要是通过改善肠道微生物群,抑制胰脂肪酶活性、促进膳食脂肪的氧化、减少机体对外源性脂类的吸收、增加排泄量及能量输出,抑制脂肪生成相关基因的表达、促进脂肪分解及能量代谢相关基因的表达,并通过提高高密度脂蛋白(HDL)水平和自身抗氧化作用减少脂类沉积[14]。在食品加工过程中,多糖与多酚的相互作用往往不可避免,它们之间可以通过非共价和共价作用发生结合,在多糖与多酚的非共价作用中主要涉及氢键作用、疏水作用、范德华力等,诱导它们之间形成非共价复合物[15]。而通过共价作用形成的复合物主要依靠自由基反应、缩合反应等[16]。当多糖与多酚复合后,由于结构和物理性质的改变,其功能也会发生相应的变化。复合物虽然提高了多酚的溶解性和稳定性但却降低了多糖溶液的粘度[17],因此多糖与多酚复合物的功能特性和生物活性需要综合考虑。目前,协同作用相关研究主要以抗氧化[18]、降血糖[19]为主,对于协同降脂方面的研究鲜有报道。因此本试验基于多糖与多酚非共价相互作用,考察茶树菇多糖和石榴皮多酚单一组分及其复合物的理化性质、功能效果,为降血脂功能食品的开发利用提供一定的理论依据。
1. 材料与方法
1.1 材料与仪器
茶树菇多糖(多糖含量61.2%)、石榴皮多酚(多酚含量61.5%) 实验室自制;猪油、大豆油市售 购于哈尔滨市;浓硫酸、浓盐酸 国药集团化学试剂有限公司;无水乙醇、氢氧化钠、冰乙酸、胆固醇、PBS磷酸盐缓冲液、甘胺胆酸钠、胰脂肪酶(20000 U/g)、胃蛋白酶(30000 U/g)、透析袋(截留分子质量1000 Da)人工唾液、人工胃液、人工小肠液 上海源叶生物科技有限公司;以上试剂均为分析纯。
ELx800 NB型酶标仪 美国BioTek公司;722可见分光光度计 上海佑科仪器仪表有限公司;HHS-22-8电热恒温水浴锅 上海博讯实业有限公司;TDL-5台式离心机 上海科兴仪器有限公司;DHG-9240电热恒温鼓风干燥箱 上海一恒科技有限公司;YP200lN电子天平 上海精天电子仪器厂
1.2 实验方法
1.2.1 茶树菇多糖提取工艺
参照胡晓倩等[20]的研究方法,采用水提醇沉法提取多糖。取新鲜茶树菇,去除杂质,洗净烘干研磨成粉末。取10 g茶树菇粉末置于1 L烧瓶中,加入500 mL蒸馏水,70 ℃下浸提3 h,过滤得滤液。旋转蒸发至原体积1/5,Sevage法脱除蛋白,重复多次至无明显白色沉淀,加入3倍体积无水乙醇静置一晚。沉淀溶于水,透析72 h冻干备用。
1.2.2 石榴皮多酚提取工艺
参照左栖枫等[21]研究方法稍作修改,新鲜石榴手工剥皮,将皮切成小块后放入50 ℃烘箱烘干,研磨成粉末。称取5 g石榴皮粉末于圆底烧瓶中,加入150 mL蒸馏水,在70 ℃恒温水浴锅中提取1 h,重复两次,将两次提取液混合后旋蒸得到粗提液。粗提液装入预先处理好的AB-8大孔树脂分离纯化,纯化后的石榴皮多酚冷冻干燥备用。
1.2.3 ACP-PPP复合物的制备
参照LI等[22]的研究方法制备茶树菇多糖-石榴皮多酚(ACP-PPP)复合物,稍作修改。根据预实验研究结果,以结合量为评价指标,探究质量比、pH、温度对复合物制备的影响,结果表明复合物在质量比为1:1 、25 ℃、中性的条件下结合率最高,ACP的PPP结合量达165 mg/g。因此将ACP水溶液和PPP水溶液按一定比例混合,常温搅拌30 min,搅拌结束后取10 mL混合液转移至预先处理好的透析袋(1000 Da),直至透析平衡,最后将透析袋内的溶液冷冻干燥,获得ACP-PPP复合物。
1.2.4 ACP-PPP复合物的结构表征
1.2.4.1 傅里叶变换红外光谱分析
参考陈燕云等[23]的方法:分别称取5 mg ACP、PPP和ACP-PPP样品与KBr混合均匀压片后,在4000~500 cm−1波长范围内进行扫描分析,扫描次数64次,分辨率4 cm−1。
1.2.4.2 紫外-可见光谱分析
参考羡荣华等[24]的方法:配制质量浓度为1 mg/mL的ACP、PPP和ACP-PPP样品溶液,稀释20倍,以蒸馏水建立基线,在波长为200~600 nm进行紫外光谱扫描。
1.2.4.3 热重分析
参照邢慧珍等[25]的方法:分别称取5 mg ACP、ACP-PPP样品,放入托盘中,托盘边缘不能有余留,通过热重分析仪在氮气环境中测定样品的热特性,温度范围30~600 ℃,升温速度10 ℃/min。
1.2.4.4 X-射线衍射分析
参照马婷等[26]的方法:采用X射线衍射仪在电压40 kV,电流40 mA, 2θ=5°~90°范围内测定ACP和ACP-PPP样品的X射线衍射强度。
1.2.5 ACP-PPP复合物稳定性试验
1.2.5.1 热稳定性
参照刘秋兰等[27]的研究方法,稍作修改,在1000 Da的透析袋中,分别放入10 mL的复合物水溶液(4 mg/mL),浸没在190 mL的蒸馏水中,并在0、25、37、100 ℃水浴透析4 h,以进行热稳定性评价,于波长765 nm处,酶标仪测定透析外液中多酚的吸光度,得到其浓度后按200 mL总体积计算多酚的保留率,保留率按公式(1)计算。
D(\text{%}) = (1−m1m2)×100 (1) 式中:D为多酚的保留率,%;m1为透析外液中游离多酚的质量,mg ; m2为复合物中多酚的质量,mg。
1.2.5.2 消化稳定性
参照刘秋兰等[27]的研究方法,分别取10 mL唾液、胃、肠道模拟消化液与三份10 mg ACP-PPP复合物于离心管中,150 r/min摇床37 ℃恒温孵育2 h后,将混合液装入透析袋中,透析4 h。于波长765 nm处,酶标仪测定透析外液中游离多酚的吸光度,计算多酚的保留率,保留率按公式(1)计算。
1.2.5.3 光稳定性
参照苏宁等[28]研究方法稍作修改,将ACP-PPP复合物(1 mg/mL)分别置于室内避光、室内自然光、直射太阳光的条件下,每隔5 d测定多酚含量,连续测定25 d,计算多酚保留率,保留率按公式(2)计算。
D(\text{%}) = m1m2×100 (2) 式中:D为多酚的保留率,%;m1为贮存一段时间后样品中多酚的质量,mg ; m2贮存前样品中多酚的质量,mg。
1.2.5.4 pH稳定性
参照何袅袅等[29]研究方法稍作修改,用1 mol/L HCl和0.5 mol/L NaOH配成pH值为2、3、4、5、6、7、8、9、10的溶液,加入适量样品溶液,避光静置24 h,测定多酚含量,计算多酚保留率,保留率按公式(2)计算。
1.2.5.5 贮藏稳定性
参照穆谈航等[30]研究方法,将ACP-PPP复合物(1 mg/mL)分别置于室温避光条件下和4 ℃冰箱内贮藏,每隔5 d测定多酚含量,连续测定25 d,计算多酚保留率,保留率按公式(2)计算。
1.2.6 体外降脂活性测定
1.2.6.1 油脂吸附试验
参照雷丹等[31]的研究方法,准确称取1 g ACP、PPP、ACP-PPP 样品置于烧杯中,分别加入20 mL饱和脂肪/不饱和脂肪混合均匀,加入10 mL pH 2盐酸溶液,于37 ℃恒温振荡摇床振荡1 h,离心去上层油脂,滤纸吸干残渣游离脂肪,称重,计算样品对油脂的吸附量。
Q(g/g) = m1−m2m3 (3) 式中:Q为油脂的吸附量,g/g;m1为所用油的质量,g;m2为游离油的质量,g;m3为样品的质量,g。
1.2.6.2 胆固醇吸附试验
参照LI等[32]的研究方法稍作修改,准确称取0.1 g ACP、PPP、ACP-PPP样品分别加入20 mL 0.2 mg/mL胆固醇溶液混合,恒温静置150 min,取0.2 mL上清液加入0.4 mL邻苯二甲醛溶液(1 mg/mL)、0.6 mL冰乙酸、8 mL混合酸(V浓硫酸:V冰乙酸=1:1),37 ℃水浴15 min,最终于550 nm波长检测样本吸光度。以吸光度为纵坐标y绘制标准曲线,y=1.2x+0.0395,R2=0.9921,求出胆固醇的浓度,胆固醇吸附能力根据公式(4)计算。
吸附量(mg/g)=V×(C0−C1)1000m (4) 式中:V为胆固醇溶液的体积,mL;m为样品质量,g;C1为吸附后胆固醇含量,mg;C0为对照组胆固醇含量,mg。
1.2.6.4 胰脂肪酶抑制试验
参照王威振等[33]研究方法稍作修改,取若干锥形瓶,加入5 mL pH为7.5的0.025 mol/L的PBS,将其与1 mL大豆油乳化液于40 ℃预热5 min,剧烈振荡后,取4 mL乳化液加入1 mL 0.02 g/mL胰脂肪酶,用蒸馏水代替样品溶液做空白对照,抑制管分别加入不同浓度ACP、PPP、ACP-PPP溶液(0.2、0.4、0.6、0.8、1.0、1.2 mg/mL)保温5 min,取出后立即加入15 mL 95%乙醇,终止酶反应。加入3滴酚酞指示剂,用0.025 mol/L NaOH滴定溶液至粉红色为止,记录氢氧化钠消耗量。胰脂肪酶活性抑制率按公式(5)计算。
X(\text{%}) = (V0− VV0)×100 (5) 式中:X为胰脂肪酶酶活抑制率,%;V0为空白对照组所消耗NaOH的体积,mL;V为加入样品实验组所消耗NaOH的体积,mL。
1.2.7 联合指数(CI)
为了确定ACP与PPP联合降脂作用是协同还是拮抗,参照Talady和Chou的中效原理联合作用指数CI,当CI<1时,表明二者具有协同作用,反之当CI>1时,表明二者具有协同作用,如果CI=1,表明二者具有加合作用[34,35]。利用CI来量化两种物质的相互作用,按公式(6)计算。
CI = D1Dx1+D2Dx2 (6) 式中:D1、D2为联合使用时产生清除率X两物质各自所需剂量;Dx1、Dx2为两物质单独使用产生清除率X时所需的剂量。
1.3 数据处理
实验结果均为三次平行实验,以平均值±标准差(X±SD)表示,采用Excel 2021、Origin 2021进行实验数据的处理分析以及绘图。采用IBM SPSS Statistics 25进行差异性分析,P<0.05表示差异显著。
2. 结果与分析
2.1 复合物的结构特征
2.1.1 傅里叶变换红外光谱分析结果
通过红外光谱可以获得多糖与多酚相互作用的结构信息。图1 为ACP、PPP与ACP-PPP复合物在4000~500 cm−1频率范围内的红外光谱吸收情况。ACP在3280 cm−1和2890 cm−1处出现特征峰代表O-H伸缩振动和C-H伸缩振动。1640 cm−1处附近的吸收峰代表C=O发生对称、非对称伸缩振动,1360 cm−1处附近的吸收峰为糖醛酸中羰基的特征吸收峰,1150 cm−1处对应吡喃糖环的吸收峰,999 cm−1处的吸收峰表明ACP具有α类型的糖苷键[36]。PPP具有酚羟基(3277 cm−1)、亚甲基(2870 cm−1)、羰基(1710 cm−1)、苯环(1510 cm−1)特征吸收峰[37]。复合物形成后O-H和C-H发生移动,分别移至3300 cm−1和2910 cm−1,表明ACP与PPP发生了强烈的氢键反应,在1700~500 cm−1范围内,复合物ACP-PPP保留了多糖和多酚某些特征吸收峰,但峰强度和位置发生了一定的变化,表明二者之间具有相互作用[38]。复合物ACP-PPP未出现新的特征峰,说明复合物ACP-PPP复合物之间主要是氢键相互作用。
2.1.2 紫外光谱分析结果
ACP、PPP与复合物ACP-PPP的紫外光谱如图2所示,ACP在260~280 nm波长范围内没有吸收峰,表明ACP几乎不含蛋白质与核酸。多酚结构中含有一个或多个苯环和不同数量双键、羰基,吸收峰主要存在200~380 nm范围内。PPP的特征峰出现在203 nm(π-π*苯环的跃迁)、275 nm(π-π*酚基的跃迁)。该特征峰也出现在复合物ACP-PPP的光谱中,但特征峰相对较弱,表明复合物形成的过程中没有形成新的双键。这与LI等[22]研究发现多糖与多酚通过非共价键结合,复合物的特征峰在紫外光谱中消失或减弱的研究结果一致。
2.1.3 热重分析结果
ACP与ACP-PPP在30~600 ℃时的热重分析结果如图3所示。多糖的质量损失大致分为三个阶段,第一阶段:在30~250 ℃范围内,ACP的质量损失约为12%,这是由于ACP结构中氢键水分的解吸,会发生少量重量的损失。第二阶段:在250~350 ℃范围内,ACP质量剧烈降低至22%,质量损失约为67%,这是由于高温使得多糖降解而使得质量大幅度损失。第三阶段:在350~600 ℃范围内,多糖失重率逐渐趋于缓慢,质量损失约为11%。复合物ACP-PPP的质量损失也分为三个阶段,第一阶段:在30~250 ℃范围内仍然为水分子的损失阶段,质量损失约为11%。第二阶段:在250~300 ℃范围内,质量继续降低至61%,但失重率明显低于ACP的第二阶段。第三阶段:在300~600 ℃范围内,质量损失约为23.7%。通过比较ACP与ACP-PPP的TG曲线,可以得出随着温度的不断升高,ACP-PPP在250~350 ℃期间由于热分解引起的质量损失明显低于ACP,由此表明ACP与PPP复合后的热稳定性更强。
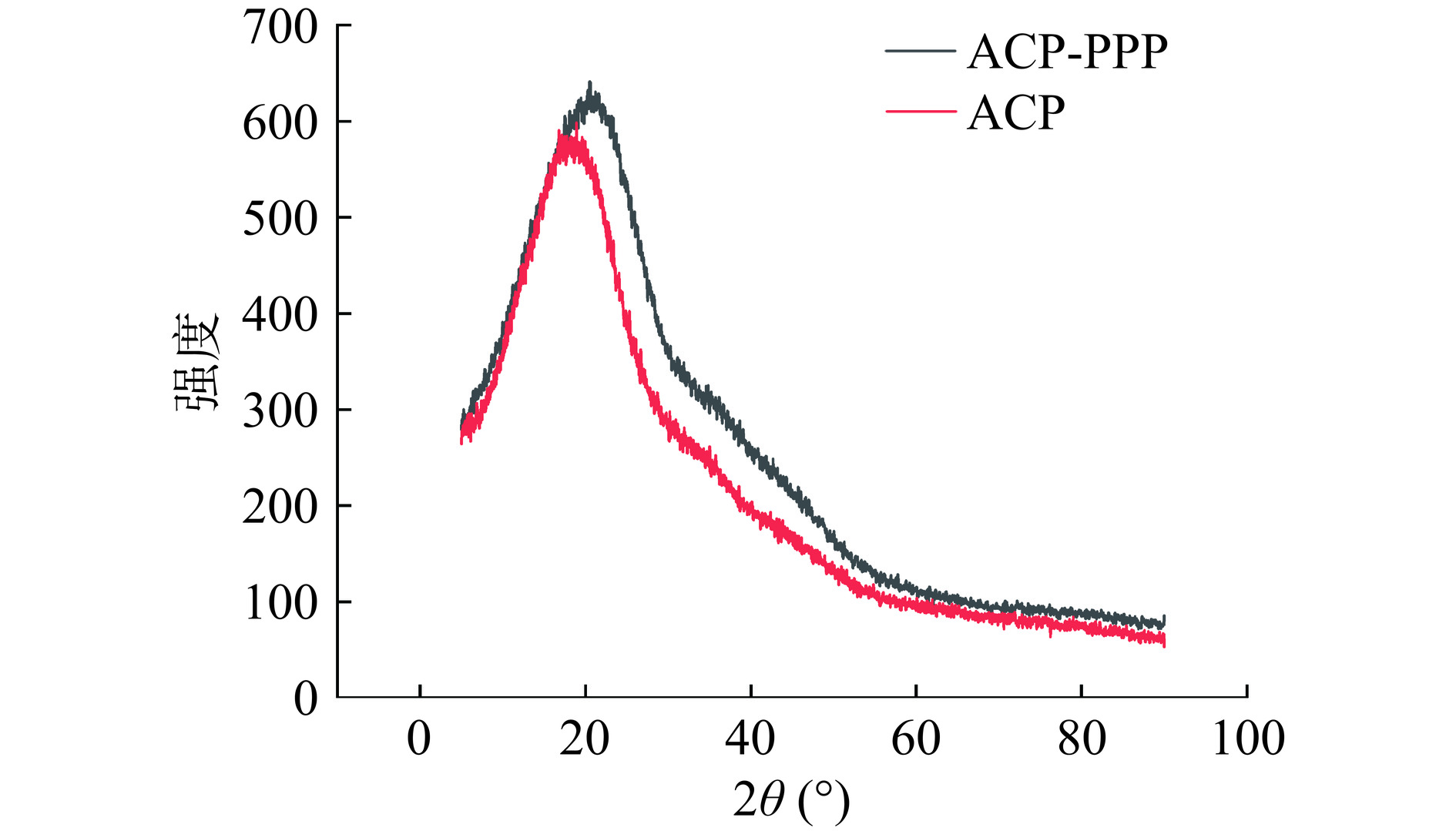
2.1.4 X-射线衍射分析结果
XRD通常用于复合物形成后表征分子晶体结构的一种方法[39]。ACP与ACP-PPP的X-衍射图谱如图4所示,在2θ=17.89°左右ACP有一个“面包形”晶体反射,衍射峰宽而弥散,说明ACP主要以非定形的结晶态存在,而多糖与多酚复合后在2θ=20°左右,衍射峰更加宽而弥散,表明复合物的结晶度小于单一多糖,主要以无定形、高度均匀的状态存在。这一构造可以增加其水溶性和在食品体系中的溶解度,最终提高其生物利用率。
2.2 稳定性分析结果
2.2.1 热稳定性分析结果
在食品加工及运输过程中,多糖和多酚复合物的稳定性是重点需要考虑的问题,因此本研究测定ACP-PPP复合物分别在0、25、37、100 ℃下PPP的解离率。结果如图5所示,在0 ℃时复配物最稳定,多酚保留率为98.27%,随着温度的不断升高,保留率显著下降(P<0.05),在温度为100 ℃时,保留率下降至45.01%,这是由于在高温的条件下,氢键的稳定性会受到影响,导致氢键变弱,复合物大幅度发生解离。
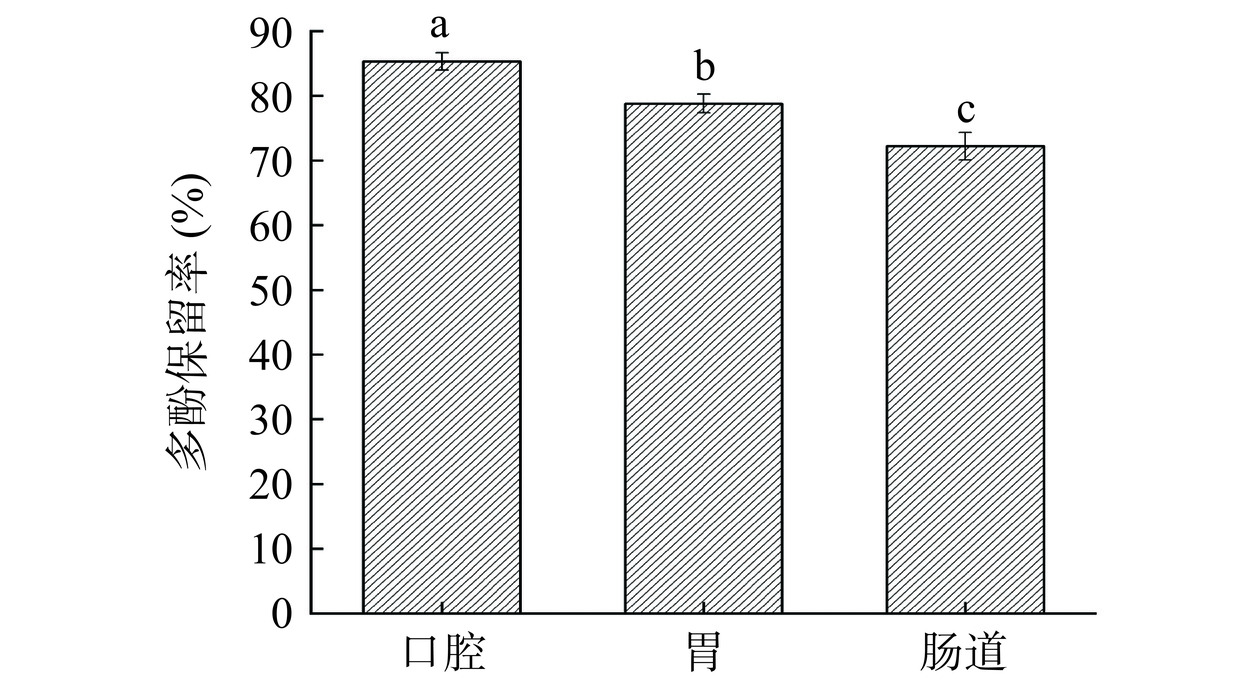
2.2.2 消化稳定性分析结果
在模拟哺乳动物胃肠道的条件下,单宁在肠道(pH 7.4)发生分解,仅保留10%的起始物质。为考察复配物ACP-PPP在消化体系中的稳定性,采用模拟体外消化系统,将复配物置于口腔、胃、肠道消化液中,结果如图6所示出现了不同程度的解离,在口腔、胃、肠道的保留率分别为85.3%、78.8%、72.2%,口腔中多酚保留率显著高于胃和肠道(P<0.05)。在肠道中的稳定性最差解离率最高,这可能是由于肠道中胰酶的影响,导致复配物不稳定,也表明ACP与PPP结合有助于PPP在消化道上的缓慢释放[27]。这与邹晓琴等[40]模拟体外消化系统,将复合物置于口腔、胃、肠道三种电解质溶液中,复合物在肠道中的的稳定性最差,分别是口腔和胃中解离率的1.25倍和1.78倍的研究结果一致。
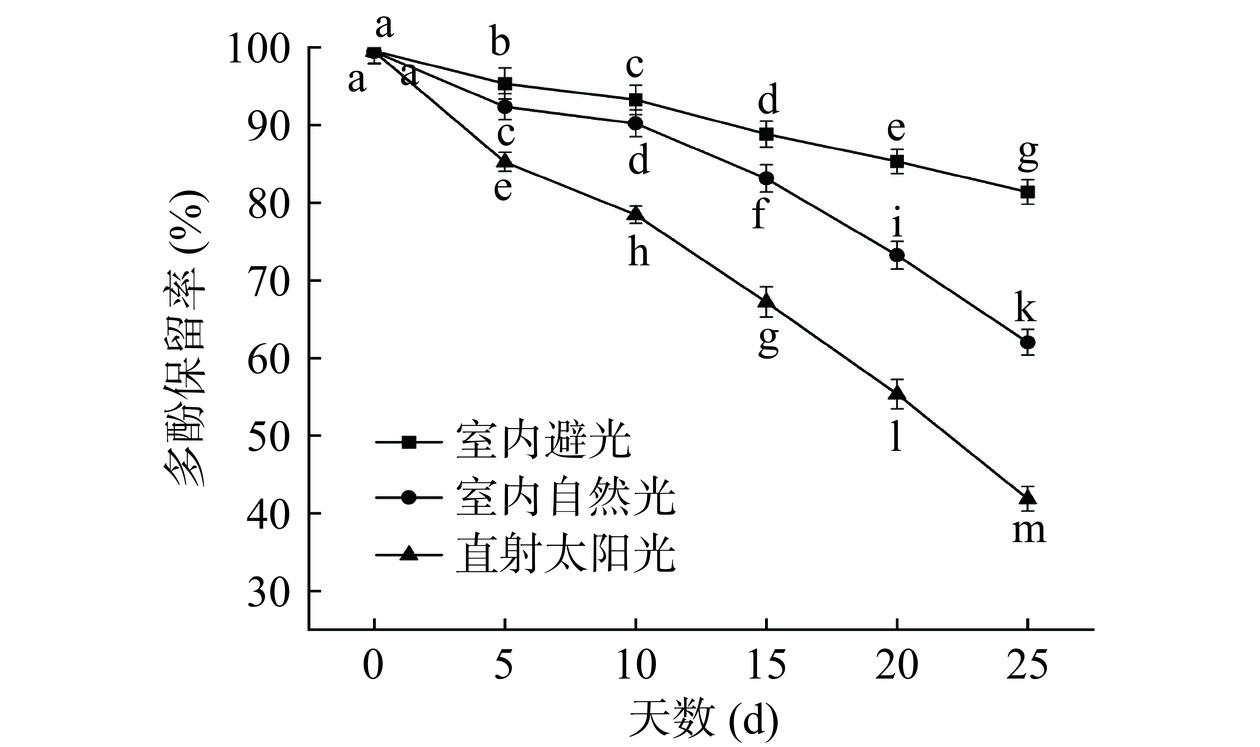
2.2.3 光稳定性分析结果
多酚类物质容易氧化对光极不稳定。如图7所示,测定ACP-PPP复合物在不同光照条件下的多酚保留率。可以看出经不同光照处理后的ACP-PPP复合物中PPP的含量呈现出不同程度的下降趋势,说明复合物中的PPP大量降解。室内避光、室内自然光、直射太阳光连续25 d后,多酚保留率分别下降至81.39%、62.01%、41.85%,这可能是由于在光照的条件下,复合物中的多酚发生降解和异构化,改变了复合物的结构[41]。因此复合物ACP-PPP应当避光保存。
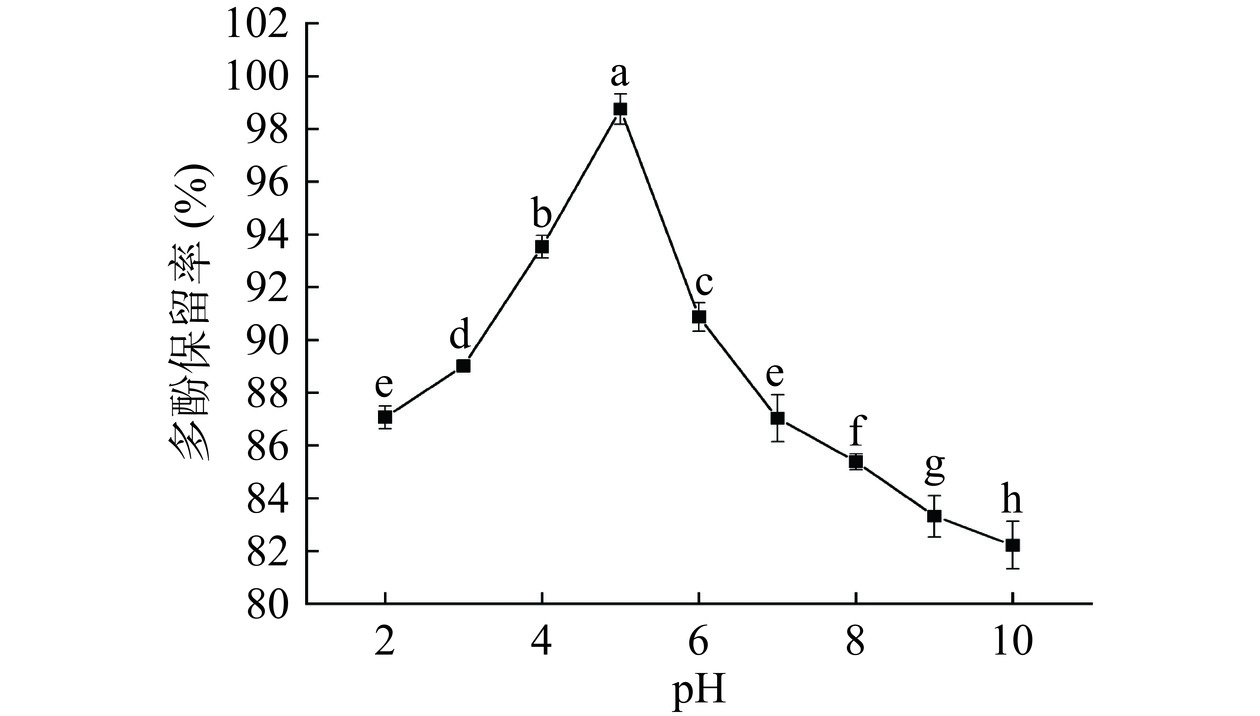
2.2.4 pH稳定性分析结果
如图8所示,不同pH值对ACP-PPP复合物的稳定性均有一定影响。随着pH的升高,多酚保留率呈先上升后下降趋势,在酸性条件下的稳定性优于碱性环境。在pH 5时,多酚保留率达到最大值,为98.75%,当pH为6~10,多酚保留率显著下降(P<0.05)。出现这种现象可能是由于ACP-PPP复合物含有大量酚羟基,呈弱酸性,在酸性环境条件下比较稳定,有利于氢键的形成。在碱性条件下容易被破坏,因此多酚保留率大幅度下降。这与干建松[42]研究发现在酸性条件下,荸荠皮多酚较稳定,而在碱性环境中多酚浓度迅速下降研究结果一致。同时这也对研究多糖与多酚的稳定结合也具有重要指导意义。
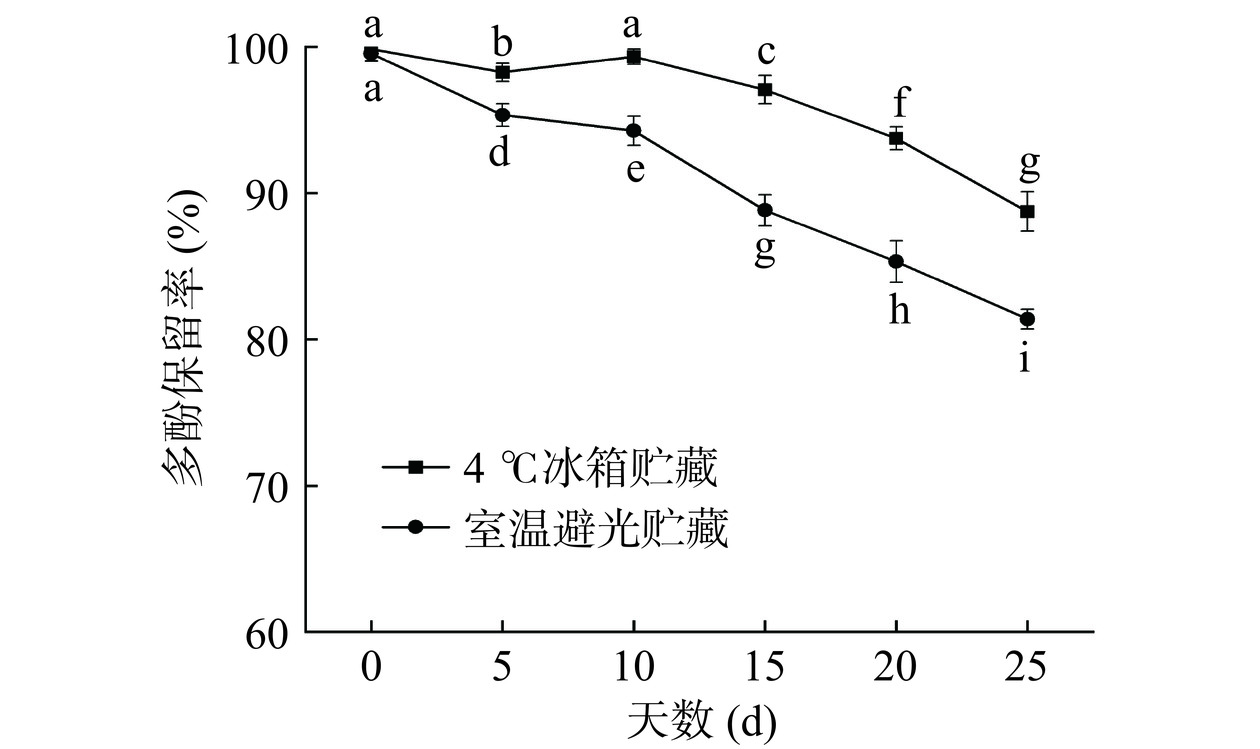
2.2.5 贮藏稳定性分析结果
评估复合物的稳定性时,贮藏稳定性是一个关键指标。如图9所示,ACP-PPP在不同贮藏条件下,PPP含量发生不同的变化。可以观察到在两种贮藏条件下PPP含量在10 d内没有显著的变化,表明复合物在贮藏10 d内比较稳定。10 d后复合物受温度的影响发生氧化,开始不同程度的分解,多酚保留率降低。贮藏25 d 后,4 ℃冰箱贮藏条件下的多酚保留率降低至89%左右,室温避光贮藏下的多酚保留率降低至81%左右。这是由于低温分子间运动较慢,更有利于氢键的形成[43],这与上述光稳定性试验结果一致。表明了复合物更适合在低温、避光条件下贮藏。
2.3 体外降脂活性研究结果
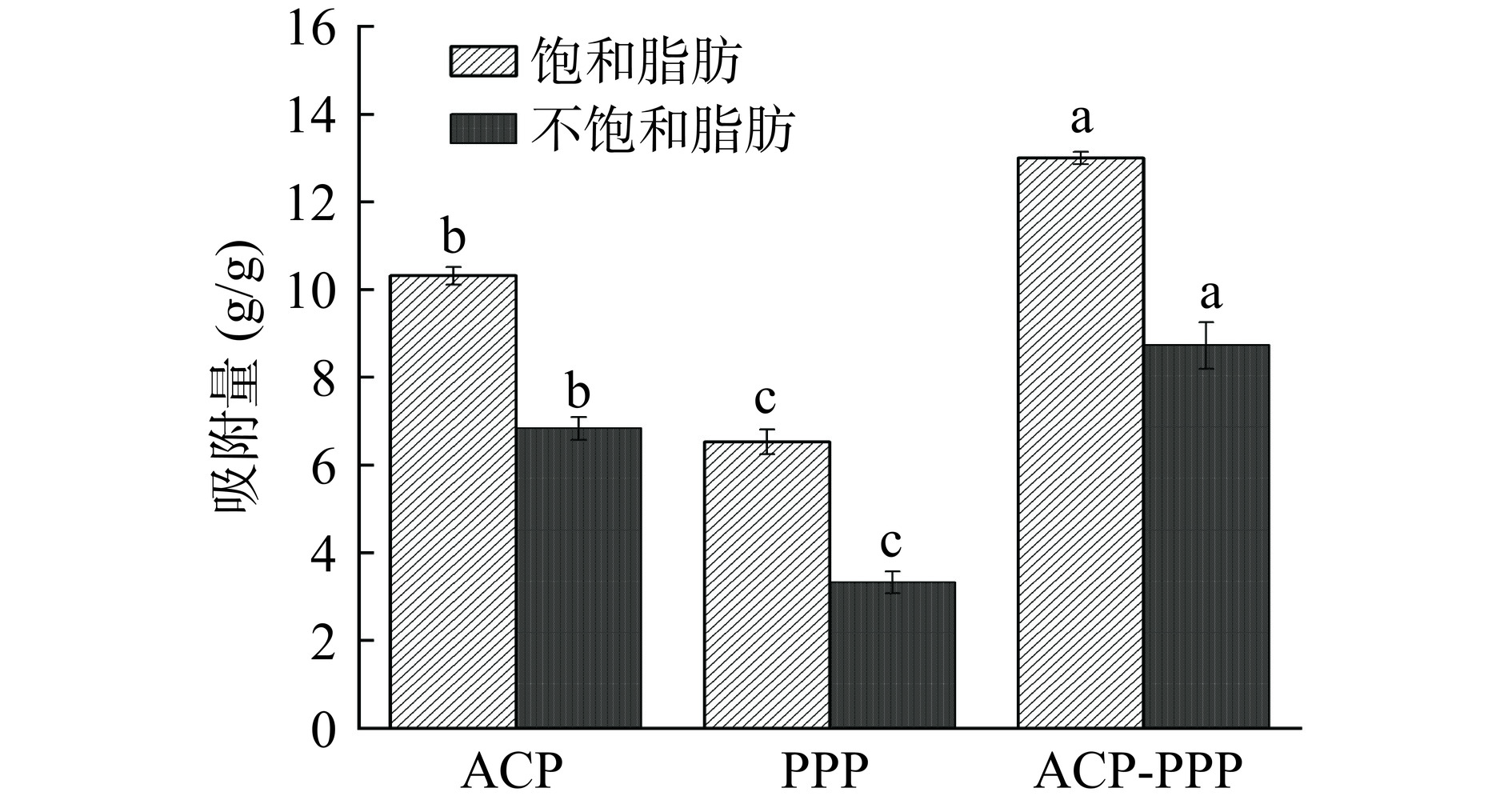
2.3.1 对油脂的吸附能力分析
食用菌多糖在胃肠中的粘性增加,吸收脂肪后会有饱足感,减少摄取的总能量,因此可以起到降脂的作用[44]。ACP、PPP、ACP-PPP对油脂的吸附能力如图10所示,多糖对油脂的吸附作用显著高于多酚(P<0.05),复合物对油脂的吸附作用显著高于单一组分(P<0.05)。单一组分及复合物对饱和脂肪的吸附作用要显著高于不饱和脂肪(P<0.05),这可能是由于二者结构具有一定差异,不饱和脂肪分子结构中双键电子云的空间位阻效果,导致对油脂的吸附量不同[45]。这与钟希琼等[46]研究发现麦麸纤维、米糠纤维、甘薯纤维对饱和油脂的吸附作用比不饱和油脂的吸附作用好的研究结果一致。
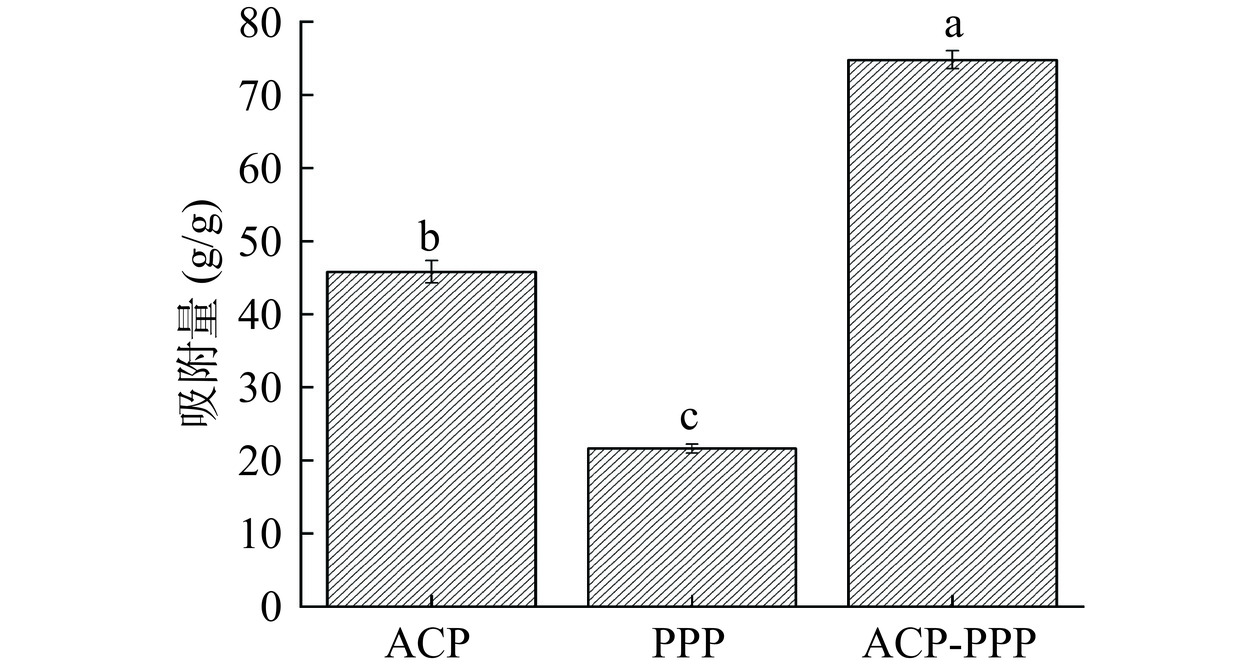
2.3.2 对胆固醇吸附能力分析
胆固醇浓度或组分发生异常,会导致慢性代谢紊乱疾病。有大量研究表明,食用菌多糖通过抑制总胆固醇合成途径,促进胆汁酸合成,调控脂代谢相关因子表达,减轻氧化应激反应和调节肠道功能等途径改善高脂血症的作用机制[47]。ACP、PPP、ACP-PPP对胆固醇的吸附能力如图11所示, ACP-PPP复合物对胆固醇的吸附量显著高于单一组分(P<0.05),相对于ACP和PPP吸附量分别提高了29%、53.2%。由此结果可知,ACP与PPP形成复合物,对胆固醇具有一定的吸附作用,从而减少胆固醇在体内的吸收,达到降脂的效果。
2.3.3 对胰脂肪酶抑制能力分析
胰脂肪酶主要由胰腺腺泡细胞和胃细胞分泌,是膳食脂肪水解中重要的酶。它可以将甘油三酯和胆固醇水解成甘油单脂和脂肪酸,被小肠上皮细胞吸收。因此可以通过抑制胰脂肪酶活性,减少人体对于脂肪的水解和吸收,从而达到降脂目的[48]。如图12所示,ACP、PPP、ACP-PPP对胰脂肪酶的抑制能力均呈上升后趋于平稳,在浓度为1.2 mg/mL时,对胰脂肪酶抑制率达到最大值,分别为43.88%±1.89%、57.14%±1.66%、57.21%±1.32%,ACP-PPP对胰脂肪酶的抑制率接近于PPP,但ACP-PPP的抑制率显著大于ACP (P<0.05),由此可见复合物的形成有利于提高多糖对于胰脂肪酶的抑制能力,具有潜在的降脂活性。
2.4 联合指数分析(CI)
根据Chou和Talady的中效原理计算油脂吸附量、胆固醇吸附量、胰脂肪酶抑制率的联合作用指数CI, CI饱和脂肪=0.67±0.09、CI不饱和脂肪=0.78±0.13、CI胆固醇=0.44±0.08、CI胰脂肪酶=0.64±0.06,CI值均小于1,表明ACP与PPP复合后具有协同降脂作用。
3. 结论
本研究采用非共价结合方式制备复合物ACP-PPP,并对复合物的稳定性、结构特征和体外协同降脂活性能力进行了研究。光谱分析结果表明,ACP与PPP形成复合物的分子间作用力主要是氢键,过程中并未形成其他的化学键。热重分析及X-射线光谱显示,ACP-PPP要比其单一组分具有更好的热稳定性和溶解性。稳定性试验结果表明复合物ACP-PPP在弱酸性、低温、避光的条件下更稳定,多酚不易分解。模拟体外消化结果表明ACP与PPP结合有助于PPP在消化道上的缓慢释放,极大地提高了多酚的生物利用率。通过中效原理计算油脂吸附量、胆固醇吸附量、胰脂肪酶抑制率的联合作用指数CI均小于1,结果表明ACP与PPP复配后具有良好的协同降血脂作用。通过制备复合物大大地提高了ACP和PPP的生理功能及其生物利用度,也为后续开发天然、安全、高效的降脂食品和相关药物提供理论依据。
-
-
[1] GILES L A. Hyperlipidemia prevention and management utilizing lifestyle changes[J]. Journal of Midwifery & Women's Health,2024,69(3):361−369.
[2] MURAKAMI, HIRAZAWA C, MIZUTANI T, et al. Edible red seaweed hypnea asiatica ameliorates high-fat diet induced metabolic diseases in mice[J]. Journal of Medicinal Food,2023,26(11):799−808. doi: 10.1089/jmf.2023.K.0010
[3] ABDUL T, BUKHARI S M A, HERRERA E C, et al. Lipid lowering therapy:an era beyond statins[J]. Current Problems in Cardiology,2022,47(12):101342. doi: 10.1016/j.cpcardiol.2022.101342
[4] PINAL I, CASAL M, MAMMEN A L. Statins:pros and cons[J]. Medicina Clínica (English Edition),2018,150(10):398−402.
[5] WANG H, NG T B, LIU Q. Isolation of a new heterodimeric lectin with mitogenic activity from fruiting bodies of the mushroom agrocybe cylindracea[J]. Life Sciences,2002,70(8):877−885. doi: 10.1016/S0024-3205(01)01463-1
[6] LIU J J, CHEN S K, WANG X, et al. Changes of the physicochemical properties and structural characteristics of alkali-extracted polysaccharides from agrocybe cylindracea across the growth process[J]. Journal of Agricultural and Food Chemistry,2024,72(22):12810−12821. doi: 10.1021/acs.jafc.4c02218
[7] LIU M, JING H J, ZHANG J J, et al. Optimization of mycelia selenium polysaccharide extraction from agrocybe cylindracea sl-02 and assessment of their antioxidant and anti-ageing activities[J]. Plos One,2016,11(8):e0160799. doi: 10.1371/journal.pone.0160799
[8] 高雅倩, 马诗经, 林丽, 等. 茶树菇多糖提取工艺优化及抗氧化活性研究[J]. 现代食品,2022,28(1):200−204. [GAO Y Q, MA S J, LIN L, et al. Optimisation of the extraction process and antioxidant activity of polysaccharides from tea tree mushroom[J]. Modern Food,2022,28(1):200−204.] GAO Y Q, MA S J, LIN L, et al. Optimisation of the extraction process and antioxidant activity of polysaccharides from tea tree mushroom[J]. Modern Food, 2022, 28(1): 200−204.
[9] 徐峻, 方绍海, 辛英姬, 等. 应用茶树菇(As-1)多糖评价小鼠高脂模型的建立[J]. 安徽农业科学,2010,38(29):16248−16249. [XU J, FANG S H, XIN Y J, et al. Application of tea tree mushroom (as-1) polysaccharide to evaluate the establishment of a mouse hyperlipidemic model[J]. Journal of Anhui Agricultural Sciences,2010,38(29):16248−16249.] XU J, FANG S H, XIN Y J, et al. Application of tea tree mushroom (as-1) polysaccharide to evaluate the establishment of a mouse hyperlipidemic model[J]. Journal of Anhui Agricultural Sciences, 2010, 38(29): 16248−16249.
[10] SINGH J, KAUR H P, VERMA A, et al. Pomegranate peel phytochemistry, pharmacological properties, methods of extraction, and its application:a comprehensive review[J]. ACS omega,2023,8(39):35452−35469. doi: 10.1021/acsomega.3c02586
[11] 闫晓越, 王子琦, 王桂林, 等. 石榴皮多酚提取研究进展[J]. 山东化工,2022,51(24):79−80,83. [YAN X Y, WANG Z Q, WANG G L, et al. Progress of pomegranate peel polyphenol extraction[J]. Shandong Chemical Industry,2022,51(24):79−80,83.] YAN X Y, WANG Z Q, WANG G L, et al. Progress of pomegranate peel polyphenol extraction[J]. Shandong Chemical Industry, 2022, 51(24): 79−80,83.
[12] ZHAO W, LI J, HE X Y, et al. In vitro steatosis hepatic cell model to compare the lipid-lowering effects of pomegranate peel polyphenols with several other plant polyphenols as well as its related cholesterol efflux mechanisms[J]. Toxicology Reports,2014,1:945−954. doi: 10.1016/j.toxrep.2014.10.013
[13] 殷伟伟, 张松. 食药用真菌降血脂作用的研究及应用[J]. 菌物研究,2006,4(4):5. [YIN W W, ZHANG S. Study and application of hypolipidemic effect of edible and medicinal fungi[J]. Journal of Fungal Research,2006,4(4):5.] YIN W W, ZHANG S. Study and application of hypolipidemic effect of edible and medicinal fungi[J]. Journal of Fungal Research, 2006, 4(4): 5.
[14] 王素敏, 徐欢欢, 黄业伟, 等. 茶多酚的降脂作用及其机制研究进展[J]. 食品研究与开发,2016,37(10):219−224. [WANG S M, XU H H, HUANG W Y, et al. Progress in the study of lipid-lowering effect of tea polyphenols and its mechanism[J]. Food Research and Development,2016,37(10):219−224.] WANG S M, XU H H, HUANG W Y, et al. Progress in the study of lipid-lowering effect of tea polyphenols and its mechanism[J]. Food Research and Development, 2016, 37(10): 219−224.
[15] ZHU J F, ZHANG D X, TANG H Y, et al. Structure relationship of non–covalent interactions between phenolic acids and arabinan–rich pectic polysaccharides from rapeseed meal[J]. International Journal of Biological Macromolecules,2018,120:2597−2603. doi: 10.1016/j.ijbiomac.2018.09.036
[16] KE C X , LI L. Modification mechanism of soybean protein isolate-soluble soy polysaccharide complex by egcg through covalent and non-covalent interaction:structural, interfacial, and functional properties[J]. Food Chemistry, 2024, 448:139033.
[17] 崔灵敏, 谢笔钧, 孙智达. 果胶与莲原花青素复合物理化性质及体外抑菌活性研究[J]. 食品工业科技,2020,41(16):60−66,80. [CUI L M, XIE B J, SUN Z D. Physicochemical properties and in vitro antibacterial activity of pectin complexed with lotus vulgaris anthocyanin[J]. Science and Technology of Food Industry,2020,41(16):60−66,80.] CUI L M, XIE B J, SUN Z D. Physicochemical properties and in vitro antibacterial activity of pectin complexed with lotus vulgaris anthocyanin[J]. Science and Technology of Food Industry, 2020, 41(16): 60−66,80.
[18] LI Z D, XIAO W H, XIE J H, et al. Isolation, characterization and antioxidant activity of yam polysaccharides[J]. Foods,2022,11(6):800. doi: 10.3390/foods11060800
[19] ZHAO X, FU Z, YAO M H, et al. Mulberry leaf polysaccharide ameliorates insulin resistance and a dipose deposition associated gut microbiota and lipid metabolites in high fat diet induced obese mice[J]. Food Science & Nutrition,2022,10(2):617−630.
[20] 胡晓倩, 唐洪华, 程安阳. 茶树菇多糖提取及其抗氧化性能的研究[J]. 湖北农业科学,2011,50(21):4465−4468. [HU X Q, TANG H H, CHENG A Y. Extraction of polysaccharides from tea tree mushroom and its antioxidant properties[J]. Hubei Agricultural Sciences,2011,50(21):4465−4468.] doi: 10.3969/j.issn.0439-8114.2011.21.047 HU X Q, TANG H H, CHENG A Y. Extraction of polysaccharides from tea tree mushroom and its antioxidant properties[J]. Hubei Agricultural Sciences, 2011, 50(21): 4465−4468. doi: 10.3969/j.issn.0439-8114.2011.21.047
[21] 左栖枫, 张新明, 邓舒畅, 等. S-8大孔树脂纯化会理石榴皮中多酚的工艺研究[J]. 轻工科技,2021,37(02):15−18. [ZUO Q F, ZHANG X M, DENG S C, et al. Process study on the purification of polyphenols from pomegranate peel in huili with s-8 macroporous resin[J]. Light Industrial Science and Technology,2021,37(02):15−18.] ZUO Q F, ZHANG X M, DENG S C, et al. Process study on the purification of polyphenols from pomegranate peel in huili with s-8 macroporous resin[J]. Light Industrial Science and Technology, 2021, 37(02): 15−18.
[22] LI S, LI J S, ZHU Z Z, et al. Soluble dietary fiber and polyphenol complex in lotus root:preparation, interaction and identification[J]. Food Chemistry,2020,314:126219. doi: 10.1016/j.foodchem.2020.126219
[23] 陈燕云, 平华, 高媛, 等. 黍稷麸皮多糖分离纯化、结构表征及抑菌活性分析[J]. 食品工业科技,2024,45(10):1−7. [CHEN Y Y, P H, G Y, et al. Isolation and purification of polysaccharides from millet bran, structural characterisation and analysis of antibacterial activities[J]. Science and Technology of Food Industry,2024,45(10):1−7.] CHEN Y Y, P H, G Y, et al. Isolation and purification of polysaccharides from millet bran, structural characterisation and analysis of antibacterial activities[J]. Science and Technology of Food Industry, 2024, 45(10): 1−7.
[24] 羡荣华, 蒲铎文, 樊梓鸾, 等. 老山芹多糖的分离纯化、结构表征及体外降糖活性研究[J]. 食品与发酵工业,2023,49(18):113−118,124. [XIAN R H, PU D W, FAN Z L, et al. Isolation and purification, structural characterisation and in vitro hypoglycemic activity of polysaccharides from cynodon grandiflorus[J]. Food and Fermentation Industries,2023,49(18):113−118,124.] XIAN R H, PU D W, FAN Z L, et al. Isolation and purification, structural characterisation and in vitro hypoglycemic activity of polysaccharides from cynodon grandiflorus[J]. Food and Fermentation Industries, 2023, 49(18): 113−118,124.
[25] 邢慧珍, 张玉梅, 刘会平, 等. 淡竹叶多糖的制备、热稳定性及其抗氧化活性[J]. 食品研究与开发,2023,44(19):86−96. [XING H Z, ZHANG Y M, LIU H P, et al. Preparation, thermal stability and antioxidant activity of polysaccharides from tempranillo leaves[J]. Food Research and Development,2023,44(19):86−96.] XING H Z, ZHANG Y M, LIU H P, et al. Preparation, thermal stability and antioxidant activity of polysaccharides from tempranillo leaves[J]. Food Research and Development, 2023, 44(19): 86−96.
[26] 马婷, 曲航, 杨海龙. 提取方法对羊栖菜多糖理化性质及体外生物活性的影响[J]. 食品安全质量检测学报,2023,14(15):259−268. [MA T, QU H, YANG H L. Influence of extraction methods on the physicochemical properties and in vitro bioactivity of polysaccharides from lamb's quarters[J]. Journal of Food Safety & Quality,2023,14(15):259−268.] MA T, QU H, YANG H L. Influence of extraction methods on the physicochemical properties and in vitro bioactivity of polysaccharides from lamb's quarters[J]. Journal of Food Safety & Quality, 2023, 14(15): 259−268.
[27] 刘秋兰, 邹晓琴, 易阳, 等. 莲藕多糖和阿魏酸的非共价相互作用及其复合物特性[J]. 中国食品学报,2023,23(7):26−36. [LIU Q L, ZOU X Q, YI Y, et al. Non-covalent interactions between lotus root polysaccharides and ferulic acid and their complex properties[J]. Journal of Chinese Institute of Food Science and Technology,2023,23(7):26−36.] LIU Q L, ZOU X Q, YI Y, et al. Non-covalent interactions between lotus root polysaccharides and ferulic acid and their complex properties[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(7): 26−36.
[28] 苏宁, 刘志明, 王海英. 桑叶多酚提取工艺优化及复配物比较研究[J]. 食品科技,2024,49(5):178−186. [SU N, LIU Z M, WANG H Y. Optimisation of mulberry leaf polyphenol extraction process and comparative study of compounds[J]. Food Science and Technology,2024,49(5):178−186.] SU N, LIU Z M, WANG H Y. Optimisation of mulberry leaf polyphenol extraction process and comparative study of compounds[J]. Food Science and Technology, 2024, 49(5): 178−186.
[29] 何袅袅, 蔡树芸, 阎光宇, 等. 铜藻多酚的提取工艺及其稳定性和抑制酪氨酸酶活性[J]. 食品研究与开发,2024,45(9):104−110. [HE N N, CAI S Y, YAN G Y, et al. Extraction process of polyphenols from copper algae and their stability and tyrosinase inhibitory activity[J]. Food Research and Development,2024,45(9):104−110.] doi: 10.12161/j.issn.1005-6521.2024.09.015 HE N N, CAI S Y, YAN G Y, et al. Extraction process of polyphenols from copper algae and their stability and tyrosinase inhibitory activity[J]. Food Research and Development, 2024, 45(9): 104−110. doi: 10.12161/j.issn.1005-6521.2024.09.015
[30] 穆谈航, 叶嘉, 杨明建, 等. 石榴皮多酚提取工艺优化及其贮藏稳定性研究[J]. 食品工业科技,2021,42(11):142−146. [MU T H, YE J, YANG M J, et al. Optimisation of pomegranate peel polyphenol extraction process and its storage stability studies[J]. Science and Technology of Food Industry,2021,42(11):142−146.] MU T H, YE J, YANG M J, et al. Optimisation of pomegranate peel polyphenol extraction process and its storage stability studies[J]. Science and Technology of Food Industry, 2021, 42(11): 142−146.
[31] 雷丹, 李军胜, 李书艺, 等. 莲藕可溶性膳食纤维与多酚复合物的稳定性及脂肪吸附活性研究[J]. 中国食品学报,2022,22(2):31−39. [LEI D, LI S J, LI S Y, et al. Studies on the stability and fat adsorption activity of soluble dietary fibre and polyphenol complexes from lotus roots[J]. Journal of Chinese Institute of Food Science and Technology,2022,22(2):31−39.] LEI D, LI S J, LI S Y, et al. Studies on the stability and fat adsorption activity of soluble dietary fibre and polyphenol complexes from lotus roots[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(2): 31−39.
[32] LI X G, ZHANG F Y, JIANG C X, et al. Structural analysis, in vitro antioxidant and lipid-lowering activities of purified tremella fuciformis polysaccharide fractions[J]. Process Biochemistry,2023,133:99−108. doi: 10.1016/j.procbio.2023.06.005
[33] 王威振, 杨盼盼, 遆永瑞, 等. 龙牙百合多糖的超声辅助提取及其抗氧化、降血脂活性分析[J]. 食品工业科技,2023,44(18):251−257. [WANG W Z, YANG P P, TI Y R, et al. Ultrasound-assisted extraction of polysaccharides from longya lilies and analysis of their antioxidant and hypolipidemic activities[J]. Science and Technology of Food Industry,2023,44(18):251−257.] WANG W Z, YANG P P, TI Y R, et al. Ultrasound-assisted extraction of polysaccharides from longya lilies and analysis of their antioxidant and hypolipidemic activities[J]. Science and Technology of Food Industry, 2023, 44(18): 251−257.
[34] 曹艳妮, 徐坤, 邱思, 等. 刺梨、苹果和脐橙复配物的抗氧化能力[J]. 食品研究与开发,2023,44(7):60−66. [CAO Y N, XU K, QIU S, et al. Antioxidant capacity of prickly pear, apple and navel orange complexes[J]. Food Research and Development,2023,44(7):60−66.] doi: 10.12161/j.issn.1005-6521.2023.07.009 CAO Y N, XU K, QIU S, et al. Antioxidant capacity of prickly pear, apple and navel orange complexes[J]. Food Research and Development, 2023, 44(7): 60−66. doi: 10.12161/j.issn.1005-6521.2023.07.009
[35] WANG J Y, LIU W, CHEN Z Q, et al. Physicochemical characterization of the oolong tea polysaccharides with high molecular weight and their synergistic effects in combination with polyphenols on hepatocellular carcinoma[J]. Biomedicine & Pharmacotherapy,2017,90:160−170.
[36] Košťálová Z, Hromádková Z. Structural characterisation of polysaccharides from roasted hazelnut skins[J]. Food Chemistry,2019,286:179−184. doi: 10.1016/j.foodchem.2019.01.203
[37] FAN H R, YAO X, CHEN Z J, et al. Interaction of high amylose corn starch with polyphenols:Modulating the stability of polyphenols with different structure against thermal processing[J]. Food Chemistry,2024,437:137708. doi: 10.1016/j.foodchem.2023.137708
[38] BUCHWEITZ M, CARLE R, KAMMERER D R. Bathochromic and stabilising effects of sugar beet pectin and an isolated pectin fraction on anthocyanins exhibiting pyrogallol and catechol moieties[J]. Food Chemistry,2012,135(4):3010−3019. doi: 10.1016/j.foodchem.2012.06.101
[39] ZHANG X J, KONG X R, HAO Y, et al. Chemical structure and inhibition on α-glucosidase of polysaccharide with alkaline-extracted from glycyrrhiza inflata residue[J]. International Journal of Biological Macromolecules,2020,147:1125−1135. doi: 10.1016/j.ijbiomac.2019.10.081
[40] 邹晓琴, 刘秋兰, 黄菲, 等. 莲藕多糖-绿原酸复合体制备及特性评价[J]. 现代食品科技,2023,39(7):184−193. [ZOU X Q, LIU Q L, HUANG F, et al. Preparation and characterisation of lotus root polysaccharide-chlorogenic acid complexes[J]. Modern Food Science and Technology,2023,39(7):184−193.] ZOU X Q, LIU Q L, HUANG F, et al. Preparation and characterisation of lotus root polysaccharide-chlorogenic acid complexes[J]. Modern Food Science and Technology, 2023, 39(7): 184−193.
[41] 张阳洋, 范金波, 麻奥, 等. 分子模拟结合荧光光谱法探究BSA-多酚复合物形成机理及对多酚的保护作用[J]. 中国食品学报,2021,21(8):298−308. [ZHANG Y Y, FAN J B, MA A, et al. Molecular modelling combined with fluorescence spectroscopy to investigate the formation mechanism of bsa-polyphenol complexes and their protective effects on polyphenols[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(8):298−308.] ZHANG Y Y, FAN J B, MA A, et al. Molecular modelling combined with fluorescence spectroscopy to investigate the formation mechanism of bsa-polyphenol complexes and their protective effects on polyphenols[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(8): 298−308.
[42] 干建松. 荸荠皮多酚的纯化与抗氧化性、稳定性研究[J]. 食品研究与开发,2022,43(17):27−33. [GAN J S. Purification and antioxidant properties and stability of polyphenols from water chestnut skin[J]. Food Research and Development,2022,43(17):27−33.] doi: 10.12161/j.issn.1005-6521.2022.17.004 GAN J S. Purification and antioxidant properties and stability of polyphenols from water chestnut skin[J]. Food Research and Development, 2022, 43(17): 27−33. doi: 10.12161/j.issn.1005-6521.2022.17.004
[43] SALAZAR G L, VILLALBA R, BERNAL M J, et al. Effect of storage conditions on the stability of polyphenols of apple and strawberry purees produced at industrial scale by different processing techniques[J]. Journal of Agricultural and Food Chemistry,2023,71(5):2541−2553. doi: 10.1021/acs.jafc.2c07828
[44] 魏奇, 翁馨, 吴艳钦, 等. 食用菌多糖降脂活性及其作用机制的研究进展[J]. 食品科技,2021,46(9):190−194. [WEI Q, WENG X, WU Y Q, et al. Research progress on lipid-lowering activity of edible mushroom polysaccharides and their mechanism of action[J]. Food Science and Technology,2021,46(9):190−194.] WEI Q, WENG X, WU Y Q, et al. Research progress on lipid-lowering activity of edible mushroom polysaccharides and their mechanism of action[J]. Food Science and Technology, 2021, 46(9): 190−194.
[45] 施慧, 张玉, 陈磊, 等. 龙眼壳/核膳食纤维对油脂、胆固醇和胆酸钠的吸附作用[J]. 食品工业,2015,36(3):103−107. [SHI H, ZHANG Y, CHEN L, et al. Adsorption of lipids, cholesterol and sodium bile acids by longan shell/kernel dietary fibre[J]. The Food Industry,2015,36(3):103−107.] SHI H, ZHANG Y, CHEN L, et al. Adsorption of lipids, cholesterol and sodium bile acids by longan shell/kernel dietary fibre[J]. The Food Industry, 2015, 36(3): 103−107.
[46] 钟希琼, 胡文娥, 林丽超. 膳食纤维对油脂、胆固醇、胆酸钠和亚硝酸根离子吸附作用的研究[J]. 食品工业科技,2010,31(5):134−136. [ZHONG X Q, HU W E, LIN L C. Studies on the adsorption of lipids, cholesterol, sodium cholate and nitrite ions by dietary fibre[J]. Science and Technology of Food Industry,2010,31(5):134−136.] ZHONG X Q, HU W E, LIN L C. Studies on the adsorption of lipids, cholesterol, sodium cholate and nitrite ions by dietary fibre[J]. Science and Technology of Food Industry, 2010, 31(5): 134−136.
[47] YIN D F, ZHONG Y D, LIU H, et al. Lipid metabolism regulation by dietary polysaccharides with different structural properties[J]. International Journal of Biological Macromolecules, 2024:132253.
[48] SUN H R, FAN R Q, FANG R, et al. Dynamics changes in metabolites and pancreatic lipase inhibitory ability of instant dark tea during liquid-state fermentation by aspergillus niger[J]. Food Chemistry,2024,448:139136. doi: 10.1016/j.foodchem.2024.139136






 下载:
下载:




 下载:
下载:



