Research Progress on the Composition of Bacteriophages and the Effect on Quality Formation in Fermented Foods
-
摘要: 发酵食品是通过控制微生物发酵过程转化其中成分所形成的产品,因其美味、益生的特性而成为人们日常饮食结构的重要组成部分。发酵食品的微生物组成复杂,局限于细菌和真菌的研究往往不足以完全揭示其品质形成机制,近年来研究目光逐渐关注噬菌体以探寻更为全面的品质调控路径。目前已从多种发酵食品中发现噬菌体存在,并证明pH、植物成分(有机酸、维生素)、温度及盐度等环境因素均可能导致其生命周期发生变化,进而触发温和噬菌体转变为烈性噬菌体,这可进一步使得噬菌体通过裂解核心微生物或致病微生物以及从基因水平上调控核心微生物产酸代谢等方式对最终品质形成产生重要作用。本文综述了发酵食品中噬菌体的组成,包括长尾噬菌体科、肌尾噬菌体科和短尾噬菌体科,并概述噬菌体通过裂解宿主或调节其代谢途径影响宿主代谢从而间接影响发酵过程,最终导致产品品质(感官、营养、安全)提升或劣变的机制,以期为提高发酵食品品质可控性做出科学指导。Abstract: Fermented foods, of which components are transformed through controlled microbial fermentation process, are an important part of the daily diet of people due to their delicious and probiotic properties. However, the microbial composition of fermented foods is complex, and studies limited to bacteria and fungi are often insufficient to fully reveal the quality formation mechanisms of fermented foods. Therefore, in recent years, research attention has been gradually turned to phages to explore a more comprehensive pathway for quality control. Phages have been detected across various fermented foods and have been shown that certain environmental factors such as pH, phytochemicals (organic acids and vitamins), temperature and salinity in fermented foods may lead to changes in their life cycle, which may trigger the transformation of temperate phages into virulent phages. This could further enable phages to play an important role in the formation of the final quality by lysing core microorganisms or pathogenic microorganisms as well as genetically regulating acid-production metabolism of core microorganisms at the gene level. This review summarized the composition of phages in fermented foods, including Siphoviridae, Myoviridae and Podoviridae. Additionally, it provided an overview of the mechanisms by which phages affect host metabolism by lysing the host or modulating their metabolic pathways, thus indirectly affecting the fermentation process and ultimately leading to an enhancement or deterioration of the product quality (sensory, nutritional, safety), aiming to provide scientific guidance for improving the controllability of the quality of fermented foods.
-
Keywords:
- fermented foods /
- phage composition /
- sense /
- nutrition /
- safety
-
发酵食品是通过控制微生物和酶的作用转化食品成分而生产的食品或饮料,可使原料发生有益的生化变化[1]。因其特殊的口感和风味[2−3]、丰富的营养成分[4−6]以及减少毒素和抗营养物质的重要作用[7−8],在世界美食中占有一席之地。由于发酵食品的感官品质、营养品质、安全品质的形成与微生物代谢活动密切相关[9−13],因此当前研究主要通过改善微生物的组成和代谢来调控发酵食品的进程或最终效果,且在发酵食品微生物的研究也主要集中在细菌和真菌等优势微生物上[14−16],对其组成及代谢方面的研究还不足以全面阐述发酵食品品质变化的深入机制。因此近年开始将噬菌体纳入微生态研究的重要组成部分,已在酒类[17]、醋[18]、酸奶[19−20]、奶酪[21]以及发酵蔬菜[22−23]等发酵食品中检测到噬菌体,发现其可影响发酵食品感官品质[24]、营养品质[25]以及安全品质[26]等,并证明其对于发酵食品品质形成的重要性,为发酵食品产业提供了更全面的品质控制靶点。
本文在概述噬菌体的基础上,从发酵乳制品、发酵蔬菜、酒精性饮料、醋以及其他发酵食品几类常见发酵食品出发,综述了发酵食品中噬菌体的组成,并且着重探讨噬菌体在发酵食品中对感官品质、营养品质以及安全品质形成的影响,深入分析其与微生物代谢、发酵过程的交互作用。通过这一研究,旨在为发酵食品的工业化标准化生产提供坚实的理论基础,为优化发酵工艺、提高产品质量和稳定性提供科学指导,从而推动发酵食品产业的可持续发展。
1. 噬菌体概述
噬菌体通常指一类可以侵染细菌的病毒[27]。随着测序技术快速发展,越来越多对发酵食品的发酵环境产生重要影响的噬菌体被发现,逐渐成为各领域研究的聚焦点。噬菌体与其他病毒结构相似,由蛋白质外壳与包裹在其中的遗传物质组成[28],其中大部分还有用于将遗传物质注入宿主体内的“尾巴”[29−31]。迄今为止发现的噬菌体有96%为有尾噬菌体目(Caudovirales),包括肌尾噬菌体科(Myoviridae)(61.7%)、短尾噬菌体科(Podoviridae)(24.5%)和长尾噬菌体科(Siphoviridae)(13.9%)[32]。而噬菌体还可根据针对宿主的破坏过程和程度分为烈性噬菌体(virulent phage)和温和噬菌体(temperate phage)[33−34],二者都可通过破坏或影响宿主生命活动进而影响发酵食品品质。目前已从多种发酵食品中发现了以乳杆菌(Lactobacillus)、芽孢杆菌(Bacillus)及醋杆菌(Acetobacter)等细菌为宿主的噬菌体[35−44],表明其在发酵食品微生物结构中具有不容忽视的作用。
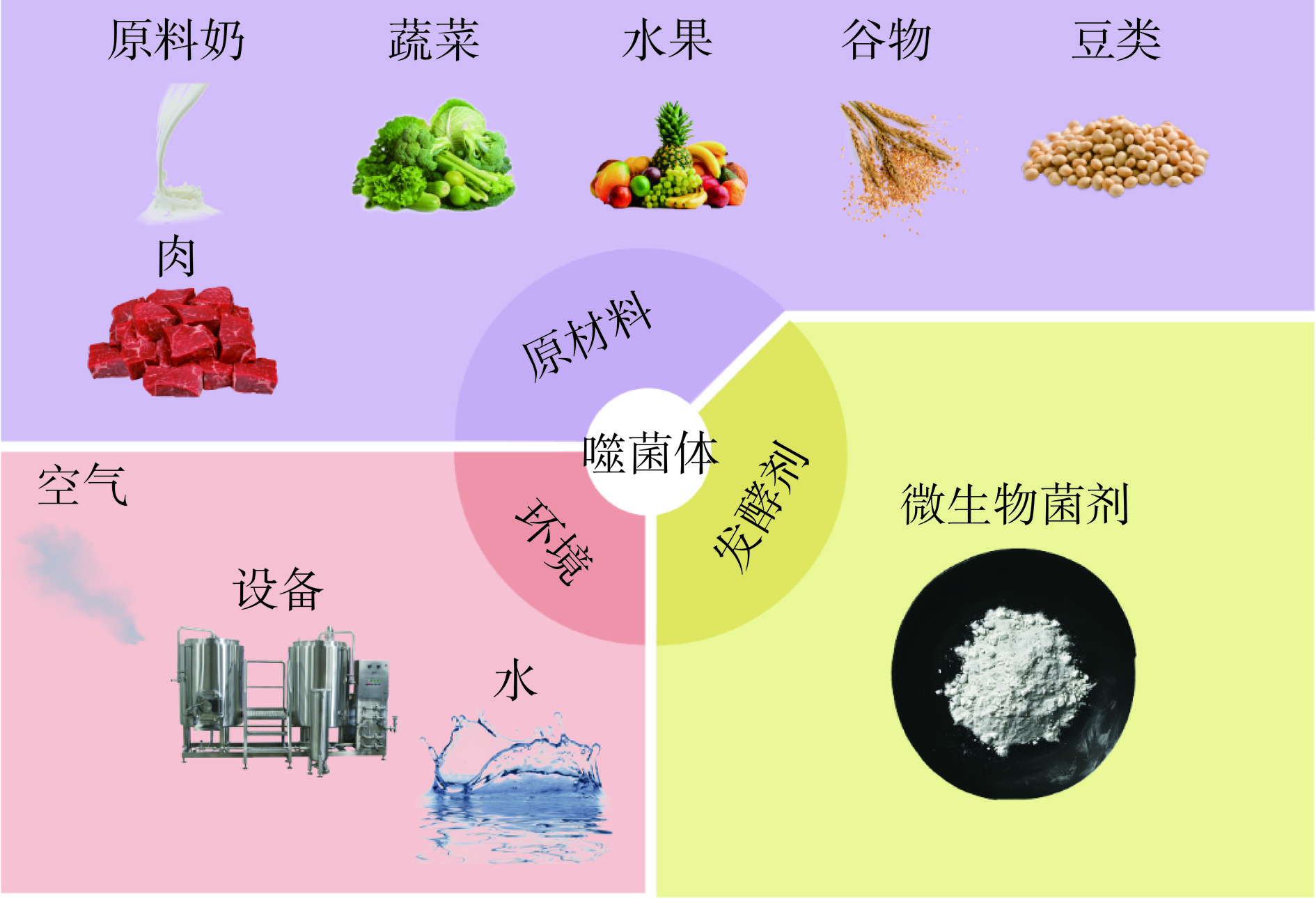
乳杆菌噬菌体、乳球菌噬菌体及醋杆菌噬菌体等发酵食品常见噬菌体存在于食品发酵过程的每一个环节中,有细菌就会存在噬菌体(图1)。其可能通过工业生产的环境被引入发酵体系中,例如工厂内的空气[45−46]、设备[47]、生产用水[48]等,以及发酵食品所采用的原料,例如最常见的牛奶发酵中的原料奶[49−50]。除此之外,用作发酵剂且带有温和噬菌体基因的某些菌株也可能成为噬菌体的来源,这样的噬菌体溶原性多出现于乳酸球菌和乳杆菌中[51]。
近年各领域对噬菌体的研究呈现快速增长趋势,噬菌体逐渐成为人们对微生态平衡调节研究机制重点。由于其分类复杂性和宿主多样性,噬菌体对发酵食品的菌群结构及最终发酵品质都具有不可忽视的重要作用。揭示噬菌体与发酵食品微生物相互关系及对发酵体系的间接影响,可更好地理解其对发酵过程和最终产品特性的调控作用。
2. 发酵食品中噬菌体的组成
发酵食品体系中存在丰富的细菌,这为噬菌体提供了多样的宿主环境,如表1所示,已有多种噬菌体被发现。
表 1 发酵食品中噬菌体组成Table 1. Phage composition in fermented foods发酵食品类型 食品名称 宿主细菌 噬菌体所属目/科 噬菌体类型 参考文献 发酵乳制品 酸奶 乳杆菌(Lactobacillus) 有尾噬菌体目(Caudovirales) 温和 [52] 乳杆菌(Lactobacillus) 长尾噬菌体科(Siphoviridae) 烈性 [53] 乳杆菌(Lactobacillus) 肌尾噬菌体科(Myoviridae) 烈性 [19] 链球菌(Streptococcus) 有尾噬菌体目(Caudovirales) 烈性 [54] 奶酪 乳球菌(Lactococcus) 有尾噬菌体目(Caudovirales) 烈性 [55] 乳球菌(Lactococcus) 有尾噬菌体目(Caudovirales) 烈性 [56] 乳球菌(Lactococcus) 长尾噬菌体科(Siphoviridae) 烈性 [57] 明串珠菌(Leuconostoc) 长尾噬菌体科(Siphoviridae) 烈性 [58] 链球菌(Streptococcus) 长尾噬菌体科(Siphoviridae) 烈性 [59] 发酵乳请 乳球菌(Lactococcus) 有尾噬菌体目(Caudovirales) 烈性 [60] 发酵蔬菜 韩国泡菜 魏斯氏菌(Weissella) 肌尾噬菌体科(Myoviridae) 烈性 [61] 魏斯氏菌(Weissella) 短尾噬菌体科(Podoviridae) 烈性 [22] 明串珠菌(Leuconostoc) 长尾噬菌体科(Siphoviridae) 温和 [62] 酸菜 明串珠菌(Leuconostoc) 长尾噬菌体科(Siphoviridae) 烈性 [63] 明串珠菌(Leuconostoc) 长尾噬菌体科(Siphoviridae) 烈性 [64] 酒精性饮料 白酒 芽孢杆菌(Bacillus) 有尾噬菌体目(Caudovirales) 温和 [65] 芽孢杆菌(Bacillus) 有尾噬菌体目(Caudovirales) 温和 [66] 苹果酒 柠檬酸杆菌(Citrobacter) 有尾噬菌体目(Caudovirales) 温和 [17] 葡萄酒 乳杆菌(Lactobacillus) 长尾噬菌体科(Siphoviridae) 烈性 [67] 醋 食醋 醋酸菌(Acetobacter) 肌尾噬菌体科(Myoviridae) 温和 [68] 醋酸菌(Acetobacter) 有尾噬菌体目(Caudovirales) 温和 [69] 醋酸单胞菌(Acetomonas) 肌尾噬菌体科(Myoviridae) 温和 [18] 其他发酵食品 可可豆 乳杆菌(Lactobacillus) 长尾噬菌体科(Siphoviridae) 烈性 [70] 乳杆菌(Lactobacillus) 肌尾噬菌体科(Myoviridae) 烈性 [71] 发酵肉 乳杆菌(Lactobacillus) 肌尾噬菌体科(Myoviridae) 烈性 [72] 酱油 魏斯氏菌(Weissella) 长尾噬菌体科(Siphoviridae) 温和 [73] 豆类发酵食品 芽孢杆菌(Bacillus) 长尾噬菌体科(Siphoviridae) 烈性 [74] 芽孢杆菌(Bacillus) 肌尾噬菌体科(Myoviridae) 烈性 [75] 2.1 发酵乳制品
发酵乳制品如酸奶、奶酪、酸奶油等可通过乳杆菌、链球菌、明串珠菌等产乳酸细菌形成独特风味,产酸细菌将原料中的碳源转化为乳酸从而达到提升口感及增加风味的目的。而噬菌体可通过调节产乳酸细菌的代谢对发酵体系和过程产生影响。目前已从酸奶、奶酪样品中检测出噬菌体,发现它们可显著调控产乳酸细菌的代谢及产乳酸效果。
目前已有学者从酸奶中分离出以乳杆菌为宿主的噬菌体[19,52−53],在宏基因组序列中噬菌体序列平均占总序列5.8%,短尾噬菌体科为最主要的噬菌体科。而在奶酪以及发酵乳清中发现以乳球菌(Lactococcus)为宿主的烈性噬菌体[55−57,60],主要是短尾噬菌体科(48.9%)和肌尾噬菌体科(39.3%)[56]。此外,在出现酸化问题的酸奶中鉴定出嗜热链球菌(Streptococcus thermophilus)噬菌体,并确定了其形态、限制性模式和宿主范围[54],也已从奶酪中发现分别以明串珠菌(Leuconostoc)[58]和嗜热链球菌[59]为宿主的长尾噬菌体科噬菌体,在工业生产奶酪环境中检测到的噬菌体浓度范围从7.5×10²到3.0×105 PFU/mL[59]。
现有研究发现在发酵乳制品中存在丰富的噬菌体,尤其是长尾噬菌体科、肌尾噬菌体科和短尾噬菌体科,并揭示了它们对产乳酸细菌的复杂调控[74−75]。然而,尚需深入研究不同噬菌体科的具体功能和在不同食品类型下的作用,以及噬菌体与宿主微生物之间的具体分子机制,今后研究需着重阐明这些噬菌体科的具体功能和特定作用,以及它们与宿主微生物之间的分子互动机制。
2.2 发酵蔬菜
酸菜、泡菜、腌菜等发酵蔬菜形成的独特风味离不开产酸细菌的重要作用[78],产酸细菌能够将原料中的碳源转化为乳酸,达到了提升口感和增添风味的双重功效,在发酵蔬菜样品中检测到的噬菌体也可通过调节产酸细菌的代谢来对发酵体系和过程产生影响[79−80]。目前已从韩国泡菜(Kimchi)、酸菜样品中检测出噬菌体,发现它们可显著改变产酸细菌的组成、代谢以及产品风味等。
韩国泡菜(Kimchi)中主要鉴定出的噬菌体以魏斯氏菌(Weissella)[22,61]和明串珠菌[62]为宿主,在泡菜发酵液中的噬菌体数量占细菌计数的28%~30%[22,62],主要属于肌尾噬菌体科和短尾噬菌体科,并证明噬菌体可能造成细菌宿主的死亡从而降低发酵品质[61],或促进细菌宿主的存活演替[22],从而对发酵产物的形成产生影响。在酸菜中也存在明串珠菌噬菌体[63−64],分离的噬菌体平均数量为102.1 PFU/mL,发酵前3 d则超过103 PFU/mL,分别为长尾噬菌体科和肌尾噬菌体科,且其可能有助于酸菜发酵的微生物动态变化,并影响蔬菜发酵中的乳酸代谢。
发酵蔬菜中同样存在丰富的噬菌体,已证实它们在调控发酵过程中核心微生物的重要性,然而不同地区和工艺导致的原料差异使得噬菌体的组成和功能存在显著变化,这些差异性尚未被充分研究,因此未来仍需深入研究不同类型发酵蔬菜中噬菌体的具体组成及功能,理解噬菌体如何影响发酵过程及其最终效果,以期提高发酵蔬菜的营养价值和风味特性。
2.3 酒精性饮料
酒精性饮料中除酵母菌外,其他细菌类微生物如乳杆菌和芽孢杆菌也是关键,细菌可通过将原料中的碳源转化为具有特殊风味的代谢物,例如乳杆菌产生的酸类物质能与醇类物质反应,生成具有特殊香气和风味的酯类物质,影响酒精性饮料的口感和后味。噬菌体能对酒精性饮料中微生物的代谢活动产生影响,例如某些地衣芽孢杆菌含有能编码孢子结构相关基因的前噬菌体,使其在酱香型白酒发酵环境中生存率大大提高,成为酱香型白酒产生关键风味物质的关键。现已从果酒及白酒样品中检测到可能对乳杆菌和芽孢杆菌细菌代谢产生调节作用的相关噬菌体。
结合宏病毒组测序技术在白酒中发现,噬菌体主要以有尾噬菌体目为主[65−66],其中长尾噬菌体科在发酵过程中占比为30.4%~47.3%,肌尾噬菌体科占比为34.7%~48.0%[65],且酱香型白酒的风味也会受由温和噬菌体因条件变化产生的烈性噬菌体的影响。在果酒例如苹果酒[17]和葡萄酒[67]中,由于其特定环境条件如低pH、高浓度乙醇和多酚等,可能导致游离烈性噬菌体含量低,而某些温和噬菌体在发酵过程中的丰度增加,RPKM值从13.6上升至35.6,表明在样本中具有较高丰度[17]。
白酒(清香型白酒、酱香型白酒、浓香型白酒等)、果酒(葡萄酒、苹果酒)以及米酒、奶酒等多种酒精性饮料的发酵过程涉及多种细菌例如乳杆菌、芽孢杆菌,噬菌体主要以有尾噬菌体目为主,其中肌尾噬菌体科含量相对较高,这些噬菌体通过调控细菌宿主的组成和代谢从而影响最终产品口感。虽然现有研究初步揭示了酒精性饮料发酵过程中噬菌体对微生物群落的调控作用及其对产品口感的影响,但对噬菌体动态演变及其与微生物群落相互作用的整体生态学的理解尚不深入,未来需要进一步探索噬菌体在发酵过程中的详细作用机制,为优化发酵工艺和提高酒精性饮料品质提供科学依据。
2.4 醋
醋想要获得特殊的酸香风味,乙酸不可或缺。产乙酸细菌例如醋酸菌可利用原料谷物或水果中的糖类发酵产生醋酸。噬菌体在其中也可通过影响细菌组成和代谢进而对发酵产酸过程进行调控。现已从食醋样品中检测到对细菌产醋酸活动起到调节作用的噬菌体。
食醋中主要由以醋杆菌[68−69]为宿主的噬菌体组成,大多数活性原噬菌体以长尾噬菌体科和肌尾噬菌体科为主,噬菌体GC含量范围为32.73%~63.62%,与宿主菌株的GC含量大致相符,表明可能对醋杆菌的代谢及演替产生影响。此外白醋固态酿造的醋醅中共鉴定出40个病毒科,其中肌尾噬菌体科在醋醅中比例最大,发酵后期醋酸单胞菌(Acetomonas)丰度达到最大值78.4%,已表明醋酸单胞菌噬菌体能对醋酸单孢菌代谢产生影响[18]。
除了常见的醋由醋杆菌参与产生乙酸外,其他发酵食品中的细菌群落也参与了乙酸产生的过程,乙酸均为最终产品的风味和口感做出了巨大贡献。但目前主要仅集中在识别发酵食品中不同噬菌体及其存在,对于噬菌体如何定量影响细菌群落结构和产品风味的深入理解尚显不足,后续研究应致力于定量分析噬菌体对细菌群落的影响,以及这些影响如何转化为风味和口感的变化,将有助于开发新的策略来优化发酵过程,提升产品品质。
2.5 其他发酵食品
其他发酵食品如发酵肉制品和豆类发酵食品在发酵食品中也占有重要地位,在豆类发酵食品中,细菌可利用原料中的碳源产生营养物质如多糖,而噬菌体在其中多起破坏作用,使得发酵进程或最终品质受到干扰。纳豆以及其他发酵大豆种已发现裂解宿主微生物的噬菌体,即烈性噬菌体。
可可豆中主要是以乳杆菌[70−71]和乳球菌[70]为宿主的噬菌体,且大多数属于长尾噬菌体科,其中乳杆菌噬菌体丰度最高(79.7%)[70]。运用鸟枪法宏基因组测序技术,已在发酵肉中检测出属于肌尾噬菌体科的植物乳杆菌(Lactobacillus plantarum)噬菌体[72],而生酱油中丰度最高的噬菌体分别为长尾噬菌体科(58.50%)和肌尾噬菌体科(33.01%)[73],都表明不同噬菌体组成对细菌群落及产品风味形成具有重要作用。纳豆作为主要的豆类发酵食品之一,主要以芽孢杆菌作为核心微生物,包含以芽孢杆菌为宿主的噬菌体[74−75],大多属于长尾噬菌体科和肌尾噬菌体科的烈性噬菌体,破坏纳豆中的细菌宿主从而对品质形成起到重要影响。
其他发酵类型食品中的细菌宿主发挥着至关重要的作用,而噬菌体也会对其以及产品最终品质造成影响。但目前研究的细菌宿主与噬菌体互作的主体和对象仍较少,尚未深入及系统总结发酵食品中噬菌体与宿主细菌的规律,未来还需拓展研究主体及内容,并深入了解机制。
3. 噬菌体对发酵食品品质形成的影响及相关机制
尽管近年来发酵食品行业中对噬菌体的研究兴趣日益增长,但现有研究多聚焦于细菌和真菌的组成及其相互作用[81],相比之下,噬菌体对微生物群落的影响及其在品质形成中的具体作用尚待深入探讨。在发酵食品体系中,噬菌体通过调节微生物的代谢和活性,对发酵过程和最终产品特性产生重要调控作用[82−83]。且噬菌体在特定环境条件下可能从温和状态激活为烈性状态[84]或引起基因水平转移[85](Horizontal Gene Transfer,HGT),这些触发机制及其对微生物群落和产品特性也可能造成潜在影响。因此,接下来将深入探讨噬菌体在各类发酵食品品质形成中的作用,并剖析其在发酵体系中的作用机制(表2),揭示其在整个发酵过程中所扮演的重要角色。
表 2 噬菌体对发酵食品的品质调控机制Table 2. Quality control mechanisms of bacteriophages on fermented foods发酵食品类型 食品名称 影响品质类型 噬菌体 调控机制 参考文献 发酵乳制品 奶酪 感官品质 乳酸乳球菌噬菌体ΦUS3 乳酸链球菌素激活温和噬菌体表达溶菌酶和溶解蛋白导致宿主裂解释放细胞内酶,促进风味形成 [24] 营养品质 乳酸乳球菌噬菌体 烈性噬菌体侵染宿主导致牛奶酸化缓慢或不足,营养物质转化率低、营养损失 [56] 安全品质 粪肠球菌噬菌体156 烈性噬菌体侵染宿主,减少生物胺积累,改善品质和安全性 [103] 安全品质 大肠杆菌噬菌体 烈性噬菌体裂解大肠杆菌减少奶酪孔洞,提高安全性 [104] 酸奶 安全品质 大肠杆菌噬菌体 烈性噬菌体侵染大肠杆菌,短时间内高效降低产品致病性 [105] 酒精性饮料 干白葡萄酒 感官品质 葡萄糖酸杆菌噬菌体GC1 烈性噬菌体裂解宿主,控制乙酸产生,保证风味稳定 [92] 白酒 感官品质 地衣芽孢杆菌噬菌体 烈性噬菌体抑制宿主菌生长,优化酱香白酒整体风味 [66] 发酵蔬菜 韩国泡菜 感官品质 魏斯氏菌属噬菌体
明串珠菌属噬菌体烈性噬菌体裂解酸耐受性较低乳酸菌,促进耐酸菌生长,
帮助风味形成[22] 酸菜 安全品质 Leuconostoc fallax噬菌体 烈性噬菌体侵染宿主,乳酸积累慢,影响微生物演替,抑制腐败菌和病原菌效果差 [64] 醋 米醋 营养品质 醋酸杆菌噬菌体 温和噬菌体辅助代谢基因辅助碳水化合物分解,利于营养合成 [97] 食醋 营养品质 醋酸杆菌噬菌体 温和噬菌体助辅助碳水化合物代谢基因有助增加醋产量、合成有机酸类营养物质 [18] 其他发酵食品 酱油 营养品质 Shewanella fodinae噬菌体 温和噬菌体辅助代谢基因辅助氨基酸生物合成,促进营养形成 [71] 纳豆 营养品质 枯草芽孢杆菌噬菌体 烈性噬菌体裂解宿主,聚谷氨酸含量降低,营养品质下降 [43] 清麴酱 安全品质 蜡样芽孢杆菌噬菌体BCP1-1和BCP8-2 烈性噬菌体裂解蜡样芽孢杆菌群,提高产品安全性 [26] 3.1 对感官品质的影响及相关机制
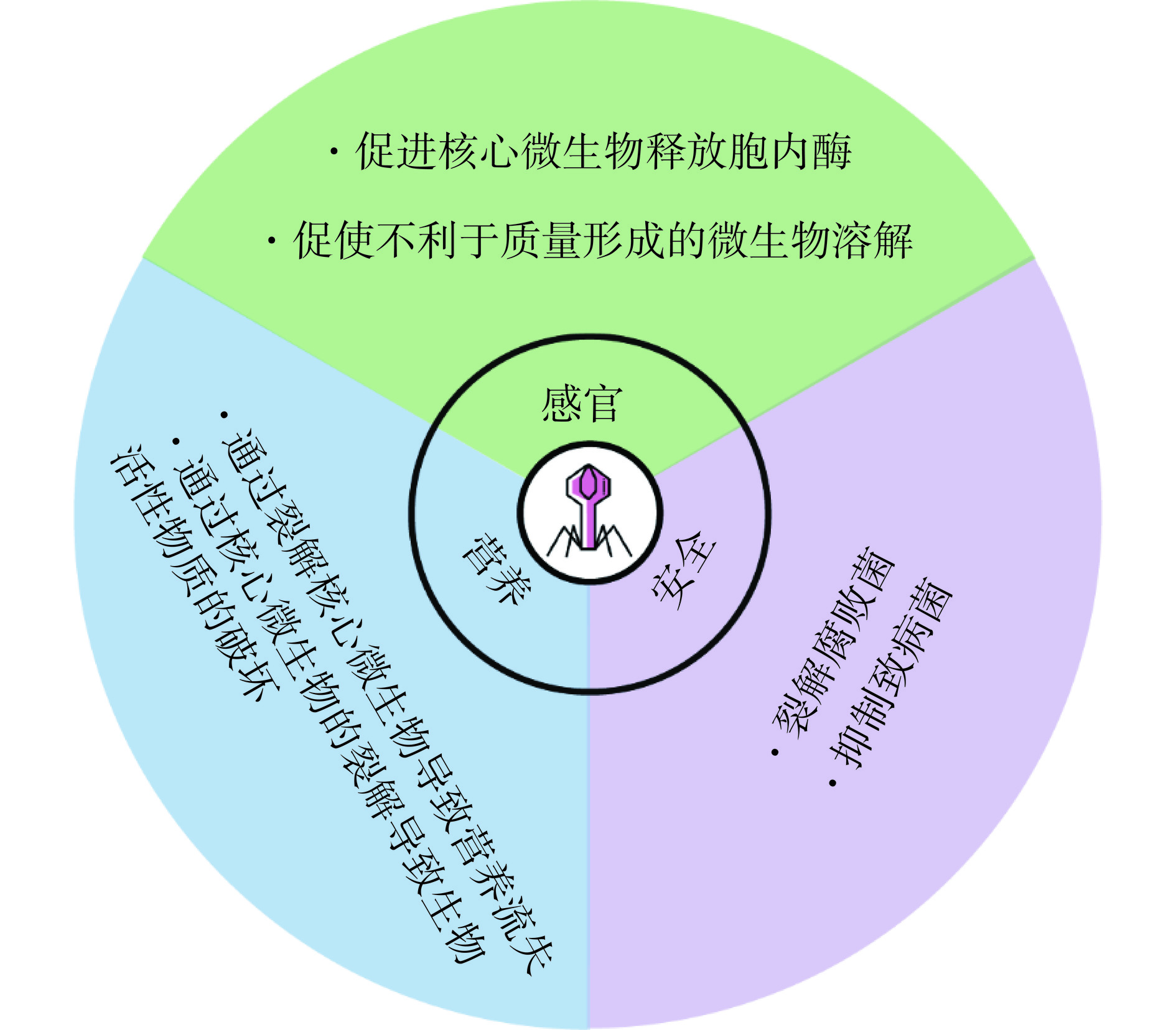
在食品发酵过程中,噬菌体不仅作为微生物群落的一部分,更扮演着调控感官品质形成的关键角色。噬菌体根据其生命周期的不同分为温和噬菌体和烈性噬菌体两种类型,它们对发酵过程和最终产品品质的影响各有特点。
温和噬菌体可通过整合基因至宿主基因组,在宿主细胞内保持潜伏状态,从而通过调节宿主的代谢途径来影响发酵过程。例如整合在乳酸乳球菌(Lactococcus lactis)基因组中的温和噬菌体可以通过乳酸乳球菌素诱导表达系统被激活,促使宿主细胞释放细胞内酶,增加L-乳酸脱氢酶活性,从而促进奶酪中风味物质的形成,加速奶酪的成熟过程[24]。Visweswaran的研究也进一步表明,即使在缺乏自溶素的乳酸乳球菌亚种中,噬菌体编码的同源内溶素也能诱导细胞裂解,加速奶酪成熟过程中香气和风味的形成[86]。
除此之外,在发酵过程中某些条件下温和噬菌体可被激活发生烈性化转变,例如受到pH[87]、植物成分(有机酸[88]以及维生素[89])的影响,在特定条件下可能诱导细菌宿主产生SOS反应,诱导温和噬菌体提前进入裂解周期,转化为烈性噬菌体[90]。这种转化可能导致发酵过程中靶点微生物裂解,释放细胞内酶、调整底物降解和反应过程等,从而影响最终产物的气味和风味特性。例如在乳品发酵剂中,基因工程的研究正向着通过构建易裂解的菌株来加速奶酪的成熟[91]。
烈性噬菌体则在感染宿主细胞后迅速繁殖,并最终导致宿主细胞的裂解。这种裂解作用可促使对品质产生不利影响的微生物裂解,从而防止发酵食品品质劣化。例如,在干白葡萄酒的发酵中,葡萄糖杆菌(Gluconobacter cerinus)能够将乙醇转化为乙酸,影响酒的风味,而特定的葡萄糖酸杆菌噬菌体GC1能够将其裂解并达到1的感染效率(EOP),极大控制酸味的形成从而保证酒的品质[92]。除了裂解对品质产生不利的微生物外,烈性噬菌体的裂解作用还能帮助发酵食品体系中微生物群落演替,例如在韩国泡菜中,随着发酵的进行,体系中大量魏斯氏菌属噬菌体和明串珠菌属噬菌体会导致魏斯氏菌属和明串珠菌属种群这两种酸耐受性较低的乳酸菌的死亡,从而为其他更耐酸的乳酸菌如乳酸菌属提供了生态位和生长机会,这种演替能有效促进韩国泡菜的风味形成以及提升其稳定性[22]。在白酒中也发现,噬菌体多样性可显著影响细菌和真菌的演替,起始噬菌体可以抑制对数生长期地衣芽孢杆菌的生长,可调整酱香白酒整体风味,维持发酵稳定性[66]。
总体而言,当前研究揭示了噬菌体在食品发酵过程中的复杂作用,它们不仅参与微生物群落的构成,而且通过环境因素的调控例如pH、植物成分(有机酸及维生素)的变化等,影响噬菌体的生命周期和裂解行为,进而通过噬菌体裂解宿主的调控机制影响发酵中产生的挥发性化合物和酸度,为发酵食品赋予独特的气味和风味特性。未来研究可利用噬菌体的这一特性来优化发酵过程,例如通过基因工程构建易裂解的菌株来加速奶酪的成熟,或利用噬菌体裂解机制控制不利微生物的生长,防止品质劣化以提升发酵品质。
3.2 对营养品质的影响及相关机制
发酵食品中的噬菌体虽未直接参与食品发酵的过程,但可通过影响发酵体系中微生物的代谢来影响最终发酵结果以及有效组分产生。关于噬菌体对发酵食品营养品质形成的影响,现更多注重于防止噬菌体侵染关键微生物导致发酵的失败以及随后引起的营养成分丢失、营养下降、营养物质生物利用度降低等。
首先,温和噬菌体在基因水平上对宿主菌群的调控可影响营养品质,例如其携带的辅助代谢基因(auxiliary metabolic gene,AMG)可通过参与宿主代谢活动[93−94]和增强噬菌体繁殖能力[95]的方式进行调控,从而影响特定营养成分的合成。已在生酱油的不同样品中检测到含有与碳水化合物及氨基酸转运代谢有关AMGs的温和噬菌体,表明其有利于半胱氨酸和蛋氨酸以及天冬氨酸的生物合成,促进酱油中营养成分的形成[71]。同样在传统发酵米醋中也有温和噬菌体存在,并发现其中含有较高丰度的糖苷水解酶(GHs)和糖基转移酶(GTs)的AMGs,表明其对米醋中营养物质的形成具有重要作用[96]。从固态酿造镇江香醋醋醅中的噬菌体鉴定出43个辅助碳水化合物代谢基因,其中醇氧化酶(alcohol oxidases)、乙酰酯酶(acetylesterase)、纤维素酶(cellulase)等可以增加醋的产量,帮助有机酸类营养物质的合成[18]。除此之外,奶酪中某些噬菌体介导的基因转移也可能导致发酵失败,间接影响有效营养成分的形成[25]。
其次,关注较多的是烈性噬菌体的裂解机制对发酵过程中关键微生物造成的影响。在乳制品酸奶中,有研究表明,用于提高产品产量而达到提升产品质地和营养的物质如乳清蛋白可在加热过程中保护噬菌体[97],使得其中的烈性噬菌体在高温环境中存活[50],或高温可能直接影响细菌内的组蛋白样核结构蛋白(Host Nucleoid Structuring protein,H-NS)的磷酸化状态,调控溶源噬菌体使其发生烈性化转变[98],最终导致宿主细胞裂解,造成乳制品质地的腐败和营养流失。同样在奶酪发酵过程中,乳酸乳球菌也会受到乳酸乳球菌噬菌体的侵染,这将导致牛奶酸化缓慢或不足,乳糖、酪蛋白、乳清蛋白等营养物质转化率低、营养损失,甚至最终导致发酵失败[56]。这种现象并非仅限于乳制品,它同样出现在其他发酵食品中。亚洲常见的发酵食品如纳豆,其中优势微生物枯草芽孢杆菌(Bacillus subtilis)在发酵过程中产生各种具有营养功能的生物活性物质。将枯草芽孢杆菌作为宿主的噬菌体可通过裂解枯草芽孢杆菌使其细胞壁破裂,导致聚谷氨酸(γ-Polyglutamic acid,γ-PGA)的含量下降约16%,最终引起纳豆发酵失败,影响其营养品质[43]。
综上所述,噬菌体在发酵食品中虽不直接参与发酵过程,却通过影响微生物代谢和裂解机制对发酵结果和营养品质产生重要影响。例如乳制品中的噬菌体能在高温下存活并发生烈性化转变,导致宿主细胞裂解和关键生物活性物质减少,引起产品质地腐败和营养流失最终影响产品营养品质。此外在基因水平上,噬菌体的辅助代谢基因以及噬菌体介导的基因转移对宿主菌群的调控,也对发酵食品的营养品质形成具有重要作用。目前在噬菌体对发酵食品营养品质形成积极影响方面的研究还较少,未来研究方向可聚焦于如何利用噬菌体的特性来优化发酵过程,通过促进微生物代谢活性、提高有效代谢产物产量的方式提高发酵食品中的营养含量和稳定性。
3.3 对安全品质的影响及相关机制
在发酵食品中,丰富的细菌群体为噬菌体侵染提供了充足的资源,一些噬菌体不仅会导致发酵失败,更为严重的可能是直接影响发酵食品的安全品质,甚至引发人类疾病,但发酵过程中的噬菌体动力学对于确保细菌的良好演替也至关重要[99]。这些过程可以作为调控食品安全品质的关键靶点,有助于对抗致病和有害细菌以及减少发酵食品中的有毒代谢产物的产生。
温和噬菌体对于发酵食品安全品质的影响研究相对烈性噬菌体研究较少,但同样地,发酵过程中的某些条件可能激活温和噬菌体,在包括清麴酱之内的大多盐渍发酵食品中,在高盐这类理化胁迫下噬菌体的生理状态、群落动态以及与宿主相互作用的生态效应也会受到影响[100]。与pH、温度、抗生素以及金属离子形成的胁迫环境可能导致噬菌体生命周期发生变化[90,101]一致,高盐同样可能成为噬菌体的触发机制之一。
而烈性噬菌体的裂解左右在改善发酵食品安全品质方面具有重要作用,例如奶酪中生物胺累积导致的安全问题,通过使用噬菌体侵染造成生物胺积累的关键微生物粪肠球菌(Enterococcus faecalis)可使酪胺浓度降低95%以上、腐胺浓度降低77.85%,有效减少其积累,改善品质和安全性[102]。奶酪孔洞过早产生以及孔洞过大导致的奶酪变质也会严重影响发酵食品安全,在奶酪生产中添加特定噬菌体混合物,能在成熟期初期减少腐生大肠杆菌(Escherichia coli)约0.4~0.7 log的数量,奶酪孔数量降低三分之一,气孔面积减少一倍,保证最终产品的可食用性和安全性[103]。除此之外,噬菌体呈现出在发酵食品保鲜领域发挥生物防治剂作用的潜力,其能够被利用来抑制食品腐败和防止变质的特性。例如牛奶发酵过程中的致病性大肠杆菌数量可通过噬菌体裂解得到控制,能够迅速(<1 h)降低致病菌数量且不影响发酵剂效能[104]。将高静水压力、裱霉素非热工艺等处理方法与噬菌体结合也是减少致病菌的有效手段,处理后李斯特菌(Listeria monocytogenes)数量立即减少至无法检测水平,且噬菌体颗粒在冷藏储存7 d内保持稳定[105]。韩国发酵食品清麴酱中的噬菌体也能够裂解引起腹泻和呕吐的蜡样芽孢杆菌(Bacillus cereus)群,提高发酵食品的安全性[26]。但在某些低盐发酵酸菜中,由于烈性噬菌体侵染乳酸菌宿主,导致发酵过程中乳酸产生减少、pH下降缓慢,可能无法有效抑制腐败菌和病原菌,对发酵食品安全品质构成威胁[64]。
总之,噬菌体的侵染可以作为调控食品安全品质的关键靶点,通过裂解致病和有害细菌,减少有毒代谢产物的产生,改善产品品质和安全性。此外高盐也可能导致噬菌体生命周期发生变化,成为触发机制之一,在部分盐渍发酵食品生产过程中这种转变也可能帮助裂解致病菌,帮助其作为生物防治剂发挥作用。未来研究可从噬菌体在不同环境胁迫下的生理状态和群落动态切入,利用噬菌体的裂解机制来提升发酵食品的品质和安全性。
4. 结论与展望
发酵食品中的噬菌体由于其复杂性和宿主多样性而对最终产品品质形成起重要调控作用,现已成为微生态平衡调节研究热点。现有研究表明在不同发酵类型食品中均富含长尾噬菌体科和肌尾噬菌体科噬菌体,且发酵食品中复杂而多样的环境因素如pH、植物成分(有机酸、维生素)、温度及高盐等均可能导致噬菌体生命周期的变化,成为触发温和噬菌体转变为烈性噬菌体的重要机制,进一步加速发酵菌群裂解促进感官品质形成,也可通过裂解核心微生物或基因水平抑制核心微生物代谢从而破坏营养品质,还可通过裂解致病菌调控安全品质,最终影响发酵过程和最终产品的品质。
然而,不同噬菌体处于不同发酵食品环境中的不同具体功能尚未研究透彻。未来研究应尤其注意在不同类型食品中的实际作用以及微生物互作的详细分子机制,有助于进一步理解发酵食品生产过程中的微生物生态系统。此外,目前研究目光多集中于以乳酸菌作为宿主的噬菌体,针对其他类型细菌的研究并未十分全面,且对噬菌体在整个发酵过程中的整体动态变化了解仍相对有限,因此还需更多关注发酵食品中以其他类型细菌为宿主的噬菌体对品质形成的变化,并进一步探究噬菌体的整体动态变化对细菌宿主的影响。同时,目前关于噬菌体对发酵食品营养品质形成积极影响方面的研究还存在一定空白,此后可通过深入探索噬菌体在微生物群落代谢中对加速营养物质生成或减少抗营养物质的具体作用,为生产更为营养丰富的发酵食品做出进一步优化。
-
表 1 发酵食品中噬菌体组成
Table 1 Phage composition in fermented foods
发酵食品类型 食品名称 宿主细菌 噬菌体所属目/科 噬菌体类型 参考文献 发酵乳制品 酸奶 乳杆菌(Lactobacillus) 有尾噬菌体目(Caudovirales) 温和 [52] 乳杆菌(Lactobacillus) 长尾噬菌体科(Siphoviridae) 烈性 [53] 乳杆菌(Lactobacillus) 肌尾噬菌体科(Myoviridae) 烈性 [19] 链球菌(Streptococcus) 有尾噬菌体目(Caudovirales) 烈性 [54] 奶酪 乳球菌(Lactococcus) 有尾噬菌体目(Caudovirales) 烈性 [55] 乳球菌(Lactococcus) 有尾噬菌体目(Caudovirales) 烈性 [56] 乳球菌(Lactococcus) 长尾噬菌体科(Siphoviridae) 烈性 [57] 明串珠菌(Leuconostoc) 长尾噬菌体科(Siphoviridae) 烈性 [58] 链球菌(Streptococcus) 长尾噬菌体科(Siphoviridae) 烈性 [59] 发酵乳请 乳球菌(Lactococcus) 有尾噬菌体目(Caudovirales) 烈性 [60] 发酵蔬菜 韩国泡菜 魏斯氏菌(Weissella) 肌尾噬菌体科(Myoviridae) 烈性 [61] 魏斯氏菌(Weissella) 短尾噬菌体科(Podoviridae) 烈性 [22] 明串珠菌(Leuconostoc) 长尾噬菌体科(Siphoviridae) 温和 [62] 酸菜 明串珠菌(Leuconostoc) 长尾噬菌体科(Siphoviridae) 烈性 [63] 明串珠菌(Leuconostoc) 长尾噬菌体科(Siphoviridae) 烈性 [64] 酒精性饮料 白酒 芽孢杆菌(Bacillus) 有尾噬菌体目(Caudovirales) 温和 [65] 芽孢杆菌(Bacillus) 有尾噬菌体目(Caudovirales) 温和 [66] 苹果酒 柠檬酸杆菌(Citrobacter) 有尾噬菌体目(Caudovirales) 温和 [17] 葡萄酒 乳杆菌(Lactobacillus) 长尾噬菌体科(Siphoviridae) 烈性 [67] 醋 食醋 醋酸菌(Acetobacter) 肌尾噬菌体科(Myoviridae) 温和 [68] 醋酸菌(Acetobacter) 有尾噬菌体目(Caudovirales) 温和 [69] 醋酸单胞菌(Acetomonas) 肌尾噬菌体科(Myoviridae) 温和 [18] 其他发酵食品 可可豆 乳杆菌(Lactobacillus) 长尾噬菌体科(Siphoviridae) 烈性 [70] 乳杆菌(Lactobacillus) 肌尾噬菌体科(Myoviridae) 烈性 [71] 发酵肉 乳杆菌(Lactobacillus) 肌尾噬菌体科(Myoviridae) 烈性 [72] 酱油 魏斯氏菌(Weissella) 长尾噬菌体科(Siphoviridae) 温和 [73] 豆类发酵食品 芽孢杆菌(Bacillus) 长尾噬菌体科(Siphoviridae) 烈性 [74] 芽孢杆菌(Bacillus) 肌尾噬菌体科(Myoviridae) 烈性 [75] 表 2 噬菌体对发酵食品的品质调控机制
Table 2 Quality control mechanisms of bacteriophages on fermented foods
发酵食品类型 食品名称 影响品质类型 噬菌体 调控机制 参考文献 发酵乳制品 奶酪 感官品质 乳酸乳球菌噬菌体ΦUS3 乳酸链球菌素激活温和噬菌体表达溶菌酶和溶解蛋白导致宿主裂解释放细胞内酶,促进风味形成 [24] 营养品质 乳酸乳球菌噬菌体 烈性噬菌体侵染宿主导致牛奶酸化缓慢或不足,营养物质转化率低、营养损失 [56] 安全品质 粪肠球菌噬菌体156 烈性噬菌体侵染宿主,减少生物胺积累,改善品质和安全性 [103] 安全品质 大肠杆菌噬菌体 烈性噬菌体裂解大肠杆菌减少奶酪孔洞,提高安全性 [104] 酸奶 安全品质 大肠杆菌噬菌体 烈性噬菌体侵染大肠杆菌,短时间内高效降低产品致病性 [105] 酒精性饮料 干白葡萄酒 感官品质 葡萄糖酸杆菌噬菌体GC1 烈性噬菌体裂解宿主,控制乙酸产生,保证风味稳定 [92] 白酒 感官品质 地衣芽孢杆菌噬菌体 烈性噬菌体抑制宿主菌生长,优化酱香白酒整体风味 [66] 发酵蔬菜 韩国泡菜 感官品质 魏斯氏菌属噬菌体
明串珠菌属噬菌体烈性噬菌体裂解酸耐受性较低乳酸菌,促进耐酸菌生长,
帮助风味形成[22] 酸菜 安全品质 Leuconostoc fallax噬菌体 烈性噬菌体侵染宿主,乳酸积累慢,影响微生物演替,抑制腐败菌和病原菌效果差 [64] 醋 米醋 营养品质 醋酸杆菌噬菌体 温和噬菌体辅助代谢基因辅助碳水化合物分解,利于营养合成 [97] 食醋 营养品质 醋酸杆菌噬菌体 温和噬菌体助辅助碳水化合物代谢基因有助增加醋产量、合成有机酸类营养物质 [18] 其他发酵食品 酱油 营养品质 Shewanella fodinae噬菌体 温和噬菌体辅助代谢基因辅助氨基酸生物合成,促进营养形成 [71] 纳豆 营养品质 枯草芽孢杆菌噬菌体 烈性噬菌体裂解宿主,聚谷氨酸含量降低,营养品质下降 [43] 清麴酱 安全品质 蜡样芽孢杆菌噬菌体BCP1-1和BCP8-2 烈性噬菌体裂解蜡样芽孢杆菌群,提高产品安全性 [26] -
[1] MUKHERJEE A, GOMEZ-SALA B, O'CONNOR E M, et al. Global regulatory frameworks for fermented foods:A review[J]. Frontiers in Nutrition,2022,9:902642. doi: 10.3389/fnut.2022.902642
[2] HUANG Q, DONG K, WANG Q, et al. Changes in volatile flavor of yak meat during oxidation based on multi-omics[J]. Food Chemistry,2022,371:131103. doi: 10.1016/j.foodchem.2021.131103
[3] ZHAO N, HUANG Y L, LAI H M, et al. Illumination and reconstruction of keystone microbiota for reproduction of key flavor-active volatile compounds during paocai (a traditional fermented vegetable) fermentation[J]. Food Bioscience,2023,56:103148. doi: 10.1016/j.fbio.2023.103148
[4] CHILESHE J, TALSMA E F, SCHOUSTRA S E, et al. Potential contribution of cereal and milk based fermented foods to dietary nutrient intake of 1-5 years old children in Central province in Zambia[J]. PLoS One,2020,15(5):e0232824. doi: 10.1371/journal.pone.0232824
[5] LIU L B, CHEN X Q, HAO L L, et al. Traditional fermented soybean products:processing, flavor formation, nutritional and biological activities[J]. Critical Reviews in Food Science and Nutrition,2022,62(7):1971−1989. doi: 10.1080/10408398.2020.1848792
[6] ROMULO A, SURYA R. Tempe:A traditional fermented food of Indonesia and its health benefits[J]. International Journal of Gastronomy and Food Science,2021,26:100413. doi: 10.1016/j.ijgfs.2021.100413
[7] ABU-SALEMFERIAL, RASHA M, AHMED G, et al. Levels of some Antinutritional factors in tempeh produced from some legumes and jojobas seeds[J]. Proceedings of the National Academy of Sciences of the United States of America,2014,111(1):5−6.
[8] LAATIKAINEN R, KOSKENPATO J, HONGISTO S M, et al. Randomised clinical trial:low-fodmap rye bread vs. regular rye bread to relieve the symptoms of irritable bowel syndrome[J]. Alimentary Pharmacology & Therapeutics,2016,44(5):460−470.
[9] CUVAS-LIMON R B, NOBRE C, CRUZ M, et al. Spontaneously fermented traditional beverages as a source of bioactive compounds:an overview[J]. Critical Reviews in Food Science and Nutrition,2021,61(18):2984−3006. doi: 10.1080/10408398.2020.1791050
[10] FAN J, QU G, WANG D, et al. Synergistic fermentation with functional microorganisms improves safety and quality of traditional chinese fermented foods[J]. Foods,2023,12(15):2892. doi: 10.3390/foods12152892
[11] HOTESSA N, ROBE J. Ethiopian indigenous traditional fermented beverage:The role of the microorganisms toward nutritional and safety value of fermented beverage[J]. International Journal of Microbiology,2020,2020:8891259.
[12] SHARMA R, GARG P, KUMAR P, et al. Microbial fermentation and its role in quality improvement of fermented foods[J]. Fermentation-Basel,2020,6(4):106. doi: 10.3390/fermentation6040106
[13] WANG J X, HAO S Y, REN Q. Uncultured microorganisms and their functions in the fermentation systems of traditional chinese fermented foods[J]. Foods,2023,12(14):2691. doi: 10.3390/foods12142691
[14] ASHAOLU T J. Safety and quality of bacterially fermented functional foods and beverages:a mini review[J]. Food Quality and Safety,2020,4(3):123−127. doi: 10.1093/fqsafe/fyaa003
[15] HWANG J, KIM Y, SEO Y, et al. Effect of starter cultures on quality of fermented sausages[J]. Food Science of Animal Resources,2023,43(1):1−9. doi: 10.5851/kosfa.2022.e75
[16] GE L H, LAI H M, HUANG Y L, et al. Comparative evaluation of package types in alleviating textural softening and package-swelling of Paocai during storage:Insight into microbial invasion, cell wall pectinolysis and alteration in sugar and organic acid profiles[J]. Food Chemistry,2021,365:130489. doi: 10.1016/j.foodchem.2021.130489
[17] LEDORMAND P, DESMASURES N, MIDOUX C, et al. Investigation of the phageome and prophages in french cider, a fermented beverage[J]. Microorganisms,2022,10(6):1203. doi: 10.3390/microorganisms10061203
[18] YU Z, MA Y, GUAN Y F, et al. Metagenomics of virus diversities in solid-state brewing process of traditional chinese vinegar[J]. Foods,2022,11(20):3296. doi: 10.3390/foods11203296
[19] YOU L J, YANG C C, JIN H, et al. Metagenomic features of traditional fermented milk products[J]. Lwt-Food Science and Technology,2022,155:112945. doi: 10.1016/j.lwt.2021.112945
[20] MA C J, PAN N Q, CHEN Z J, et al. Geographical diversity of Streptococcus thermophilus phages in Chinese yoghurt plants[J]. International Dairy Journal,2014,35(1):32−37. doi: 10.1016/j.idairyj.2013.10.007
[21] GAUTIER M, ROUAULT A, HERVé C, et al. Bacteriophages of dairy propionibacteria[J]. Lait,1999,79(1):93−104. doi: 10.1051/lait:199917
[22] PARK W J, KONG S J, PARK J H. Kimchi bacteriophages of lactic acid bacteria:population, characteristics, and their role in watery kimchi[J]. Food Science and Biotechnology,2021,30(7):949−957. doi: 10.1007/s10068-021-00930-y
[23] LEE S, PARK J H. Characteristics on host specificity, infection, and temperature stability of Weissella phages from watery kimchi[J]. Food Science and Biotechnology,2021,30(6):843−851. doi: 10.1007/s10068-021-00920-0
[24] DERUYTER P, KUIPERS O P, MEIJER W C, et al. Food-grade controlled lysis of Lactococcus lactis for accelerated cheese ripening[J]. Nature Biotechnology,1997,15(10):976−979. doi: 10.1038/nbt1097-976
[25] WALSH A M, MACORI G, KILCAWLEY K N, et al. Meta-analysis of cheese microbiomes highlights contributions to multiple aspects of quality[J]. Nature Food,2020,1(8):500−510. doi: 10.1038/s43016-020-0129-3
[26] BANDARA N, JO J, RYU S, et al. Bacteriophages BCP1-1 and BCP8-2 require divalent cations for efficient control of Bacillus cereus in fermented foods[J]. Food Microbiology,2012,31(1):9−16. doi: 10.1016/j.fm.2012.02.003
[27] ROHWER F, SEGALL A M. In retrospect A century of phage lessons[J]. Nature,2015,528(7580):46−48. doi: 10.1038/528046a
[28] 尹红梅, 侯忠余, 王金丽, 等. 普通变形杆菌噬菌体裂解酶Lys66的表达纯化及活性分析[J]. 食品工业科技,2024,45(4):109−115. [YIN H M, HOU Z Y, WANG J L, et al. Expression, purification and activity analysis of proteus vulgaris phage Lys66[J]. Food Industry Science and Technology,2024,45(4):109−115.] YIN H M, HOU Z Y, WANG J L, et al. Expression, purification and activity analysis of proteus vulgaris phage Lys66[J]. Food Industry Science and Technology, 2024, 45(4): 109−115.
[29] ACKERMANN H W. 2 5500 Phages examined in the electron microscope[J]. Archives of Virology,2007,152(2):227−243. doi: 10.1007/s00705-006-0849-1
[30] LEPRINCE A, MAHILLON J. Phage adsorption to gram-positive bacteria[J]. Viruses-Basel,2023,15(1):196. doi: 10.3390/v15010196
[31] MOUROSI J T, AWE A, GUO W, et al. Understanding bacteriophage tail fiber interaction with host surface receptor:The key "blueprint" for reprogramming phage host range[J]. International Journal of Molecular Sciences,2022,23(20):12146. doi: 10.3390/ijms232012146
[32] SHARP R. 3 Bacteriophages:biology and history[J]. Journal of Chemical Technology and Biotechnology,2001,76(7):667−672. doi: 10.1002/jctb.434
[33] 胡申才, 楚乐乐, 周敏. 假单胞菌噬菌体PrH-181对大黄鱼块防腐效果的研究[J]. 食品工业科技,2021,42(6):288−291,324. [HU S C, CHU L L, ZHOU M. Antiseptic effect of Pseudomonas bacteriophages PrH-181 on large yellow croaker meat[J]. Food Industry Science and Technology,2021,42(6):288−291,324.] HU S C, CHU L L, ZHOU M. Antiseptic effect of Pseudomonas bacteriophages PrH-181 on large yellow croaker meat[J]. Food Industry Science and Technology, 2021, 42(6): 288−291,324.
[34] LOS J M, LOS M, WEGRZYN G. Bacteriophages carrying Shiga toxin genes:genomic variations, detection and potential treatment of pathogenic bacteria[J]. Future Microbiology,2011,6(8):909−924. doi: 10.2217/fmb.11.70
[35] JUNG J Y, LEE S H, KIM J M, et al. Metagenomic analysis of kimchi, a traditional korean fermented food[J]. Applied and Environmental Microbiology,2011,77(7):2264−2274. doi: 10.1128/AEM.02157-10
[36] MAHONY J, MOSCARELLI A, KELLEHER P, et al. Phage biodiversity in artisanal cheese wheys reflects the complexity of the fermentation process[J]. Viruses-Basel,2017,9(3):45. doi: 10.3390/v9030045
[37] MURPHY J, ROYER B, MAHONY J, et al. Biodiversity of lactococcal bacteriophages isolated from 3 Gouda-type cheese-producing plants[J]. Journal of Dairy Science,2013,96(8):4945−4957. doi: 10.3168/jds.2013-6748
[38] KOT W, NEVE H, HELLER K J, et al. Bacteriophages of Leuconostoc, Oenococcus, and Weissella[J]. Frontiers in Microbiology,2014,5:186.
[39] MUDGAL P, BREIDT F, LUBKIN S R, et al. Quantifying the significance of phage attack on starter cultures:a mechanistic model for population dynamics of phage and their hosts isolated from fermenting sauerkraut[J]. Applied and Environmental Microbiology,2006,72(6):3908−3915. doi: 10.1128/AEM.02429-05
[40] ZINNO P, JANZEN T, BENNEDSEN M, et al. Characterization of Streptococcus thermophilus lytic bacteriophages from mozzarella cheese plants[J]. International Journal of Food Microbiology,2010,138(1-2):137−144. doi: 10.1016/j.ijfoodmicro.2009.12.008
[41] BRUSSOW H, FREMONT M, BRUTTIN A, et al. Detection and classification of Streptococcus thermophilus bacteriophages isolated from industrial milk fermentation[J]. Applied and Environmental Microbiology,1994,60(12):4537−4543. doi: 10.1128/aem.60.12.4537-4543.1994
[42] WHITEHEAD H R, HUNTER G J E. Bacteriophage in cheese manufacture:contamination from farm equipment[J]. Journal of Dairy Research,1947,15(1−2):112. doi: 10.1017/S0022029900004994
[43] NAGAI T. Overview of studies on Bacillus subtilis (natto) bacteriophages and the prospects[J]. Jarq-Japan Agricultural Research Quarterly,2012,46(4):305−310. doi: 10.6090/jarq.46.305
[44] KLEPPEN H P, HOLO H, JEON S R, et al. Novel Podoviridae family bacteriophage infecting Weissella cibaria isolated from Kimchi[J]. Applied and Environmental Microbiology,2012,78(20):7299−7308. doi: 10.1128/AEM.00031-12
[45] 艾连中. 发酵乳制品质量安全问题及控制技术[J]. 食品科学技术学报,2016,34(1):16−20. [AI L Z. Quality and safety issues and control technique of fermented milk[J]. Journal of Food Science and Technology,2016,34(1):16−20.] doi: 10.3969/j.issn.2095-6002.2016.01.003 AI L Z. Quality and safety issues and control technique of fermented milk[J]. Journal of Food Science and Technology, 2016, 34(1): 16−20. doi: 10.3969/j.issn.2095-6002.2016.01.003
[46] VERREAULT D, GENDRON L, ROUSSEAU G M, et al. Detection of airborne Lactococcal bacteriophages in cheese manufacturing plants[J]. Applied and Environmental Microbiology,2011,77(2):491−497. doi: 10.1128/AEM.01391-10
[47] GARNEAU J E, MOINEAU S. Bacteriophages of lactic acid bacteria and their impact on milk fermentations[J]. Microbial Cell Factories,2011,10:S20. doi: 10.1186/1475-2859-10-S1-S20
[48] LU Z, PEREZ-DÍAZ I M, HAYES J S, et al. Bacteriophage ecology in a commercial cucumber fermentation[J]. Applied and Environmental Microbiology,2012,78(24):8571−8578. doi: 10.1128/AEM.01914-12
[49] KLEPPEN H P, BANG T, NES I F, et al. Bacteriophages in milk fermentations:Diversity fluctuations of normal and failed fermentations[J]. International Dairy Journal,2011,21(9):592−600. doi: 10.1016/j.idairyj.2011.02.010
[50] MADERA C, MONJARDÍN C, SUÁREZ J E. Milk contamination and resistance to processing conditions determine the fate of Lactococcus lactis bacteriophages in dairies[J]. Applied and Environmental Microbiology,2004,70(12):7365−7371. doi: 10.1128/AEM.70.12.7365-7371.2004
[51] FERNÁNDEZ L, ESCOBEDO S, GUTIÉRREZ D, et al. Bacteriophages in the dairy environment:From enemies to allies[J]. Antibiotics-Basel,2017,6(4):27. doi: 10.3390/antibiotics6040027
[52] ZHANG X, KONG J, QU Y. Isolation and characterization of a Lactobacillus fermentum temperate bacteriophage from Chinese yogurt[J]. Journal of Applied Microbiology,2006,101(4):857−863. doi: 10.1111/j.1365-2672.2006.03007.x
[53] WANG S H, KONG J, GAO C, et al. Isolation and characterization of a novel virulent phage (phiLdb) of Lactobacillus delbrueckii[J]. International Journal of Food Microbiology,2010,137(1):22−27. doi: 10.1016/j.ijfoodmicro.2009.10.024
[54] QUIBERONI A, AUAD L, BINETTI A G, et al. Comparative analysis of Streptococcus thermophilus bacteriophages isolated from a yogurt industrial plant[J]. Food Microbiology,2003,20(4):461−469. doi: 10.1016/S0740-0020(02)00143-0
[55] DUGAT-BONY E, LOSSOUARN J, DE PAEPE M, et al. Viral metagenomic analysis of the cheese surface:A comparative study of rapid procedures for extracting viral particles[J]. Food Microbiology,2020,85:103278. doi: 10.1016/j.fm.2019.103278
[56] FRANTZEN C A, HOLO H. Unprecedented diversity of Lactococcal group 936 bacteriophages revealed by amplicon sequencing of the portal protein gene[J]. Viruses-Basel,2019,11(5):443. doi: 10.3390/v11050443
[57] QUEIROZ L L, LACORTE G A, ISIDORIO W R, et al. High level of interaction between phages and bacteria in an artisanal raw milk cheese microbial community[J]. Msystems,2023,8(1):e00564−e00522.
[58] KLEPPEN H P, NES I F, HOLO H. Characterization of a Leuconostoc bacteriophage infecting flavor producers of cheese starter cultures[J]. Applied and Environmental Microbiology,2012,78(18):6769−6772. doi: 10.1128/AEM.00562-12
[59] QUIBERONI A, TREMBLAY D, ACKERMANN H W, et al. Diversity of Streptococcus thermophilus phages in a large-production cheese factory in Argentina[J]. Journal of Dairy Science,2006,89(10):3791−3799. doi: 10.3168/jds.S0022-0302(06)72420-1
[60] MASUD T, LATIF A, HAMEED A. Characterization of four new Lactococcus lactis bacteriophages isolated from dahi whey[J]. International Journal of Dairy Technology,2009,62(1):107−111. doi: 10.1111/j.1471-0307.2008.00452.x
[61] KONG S J, PARK J H. Acid tolerance and morphological characteristics of five Weissella cibaria bacteriophages isolated from kimchi[J]. Food Science and Biotechnology,2020,29(6):873−878. doi: 10.1007/s10068-019-00723-4
[62] KIM S H, PARK J H. Characterization of prophages in Leuconostoc derived from Kimchi and genomic analysis of the induced prophage in Leuconostoc lactis[J]. Journal of Microbiology and Biotechnology,2022,32(3):333−340. doi: 10.4014/jmb.2110.10046
[63] 傅文博. 酱香型白酒发酵过程细菌病毒多样性及其功能的研究[D]. 无锡:江南大学, 2022. [FU W B. Study on diversity and function of bacterial viruses in the sauce-flavor Baijiu fermentation[D]. Wuxi:Jiangnan University, 2022.] FU W B. Study on diversity and function of bacterial viruses in the sauce-flavor Baijiu fermentation[D]. Wuxi: Jiangnan University, 2022.
[64] DU H, CHEN B W, FU W B, et al. Composition and function of viruses in sauce-flavor Baijiu fermentation[J]. International Journal of Food Microbiology,2023,387:110055. doi: 10.1016/j.ijfoodmicro.2022.110055
[65] KYRKOU I, CARSTENS A B, ELLEGAARD-JENSEN L, et al. Isolation and characterisation of novel phages infecting Lactobacillus plantarum and proposal of a new genus, "Silenusvirus"[J]. Scientific Reports, 2020, 10(1):8763.
[66] OMATA K, HIBI N, NAKANO S, et al. Distribution and genome structures of temperate phages in acetic acid bacteria[J]. Scientific Reports,2021,11(1):21567. doi: 10.1038/s41598-021-00998-w
[67] QIAN C G, MA J W, LIANG J L, et al. Comprehensive deciphering prophages in genus Acetobacter on the ecology, genomic features, toxin-antitoxin system, and linkage with CRISPR-Cas system[J]. Frontiers in Microbiology,2022,13:951030. doi: 10.3389/fmicb.2022.951030
[68] AGYIRIFO D S, WAMALWA M, OTWE E P, et al. Metagenomics analysis of cocoa bean fermentation microbiome identifying species diversity and putative functional capabilities[J]. Heliyon,2019,5(7):e02170. doi: 10.1016/j.heliyon.2019.e02170
[69] ILLEGHEMS K, DE V L, PAPALEXANDRATOU Z, et al. Phylogenetic analysis of a spontaneous cocoa bean fermentation metagenome reveals new insights into its bacterial and fungal community diversity[J]. PLoS One,2012,7(5):e38040. doi: 10.1371/journal.pone.0038040
[70] CHIBANI-CHENNOUFI S, DILLMANN M L, MARVIN-GUY L, et al. Lactobacillus plantarum bacteriophage LP65:A new member of the SPO1-like genus of the family Myoviridae[J]. Journal of Bacteriology,2004,186(21):7069−7083. doi: 10.1128/JB.186.21.7069-7083.2004
[71] TAN G L, QI S H, WANG Y, et al. Uncovering differences in the composition and function of phage communities and phage-bacterium interactions in raw soy sauce[J]. Frontiers in Microbiology,2023,14:1328158. doi: 10.3389/fmicb.2023.1328158
[72] UMENE K, OOHASHI S, YAMANAKA F, et al. Molecular characterization of the genome of Bacillus subtilis (natto) bacteriophage PM1, a phage associated with disruption of food production[J]. World Journal of Microbiology & Biotechnology,2009,25(10):1877−1881.
[73] GEWTAISONG J, CHUKEATIROTE E, AHN J. Characterization of Bacillus subtilis bacteriophage BasuTN3 isolated from Thua Nao, a thai fermented soybean food product[J]. Food Science and Biotechnology,2023,32(2):203−208. doi: 10.1007/s10068-022-01188-8
[74] CHMIELEWSKA-JEZNAC M, BARDOESKI J K, SZCZEPANKOWSKA A K. Lactococcus Ceduovirus phages isolated from industrial dairy plants-from physiological to genomic analyses[J]. Viruses-Basel,2020,12(3):280. doi: 10.3390/v12030280
[75] CHEN X, GUO J, LIU Y, et al. Characterization and adsorption of a Lactobacillus plantarum virulent phage[J]. Journal of Dairy Science,2019,102(5):3879−3886. doi: 10.3168/jds.2018-16019
[76] ZHAO N, HUANG Y L, LAI H M, et al. The role of abiotic and biotic factors of aged brine in directing microbial assembly and volatile profiles of Paocai during fermentation[J]. Food Bioscience,2024,57:103592. doi: 10.1016/j.fbio.2024.103592
[77] KONG S J, PARK J H. Effect of bacteriophages on viability and growth of co-cultivated Weissella and Leuconostoc in Kimchi fermentation[J]. Journal of Microbiology and Biotechnology,2019,29(4):558−561. doi: 10.4014/jmb.1902.02023
[78] LU Z J, PÉREZ-DÍAZ I M, HAYES J S, et al. Bacteriophages infecting gram-negative bacteria in a commercial cucumber fermentation[J]. Frontiers in Microbiology,2020,11:1306. doi: 10.3389/fmicb.2020.01306
[79] BARRANGOU R, YOON S S, BREIDT F, et al. Characterization of six Leuconostoc fallax bacteriophages isolated from an industrial sauerkraut fermentation[J]. Applied and Environmental Microbiology,2002,68(11):5452−5458. doi: 10.1128/AEM.68.11.5452-5458.2002
[80] YOON S S, BARRANGOU-POUEYS R, BREIDT F, et al. Isolation and characterization of bacteriophages from fermenting sauerkraut[J]. Applied and Environmental Microbiology,2002,68(2):973−976. doi: 10.1128/AEM.68.2.973-976.2002
[81] HUANG Y L, GE L H, LAI H M, et al. Seasonal alteration of environmental condition-driven shift in microbiota composition, physicochemical attributes and organic compound profiles in aged Paocai brine during intermittent back-slopping fermentation[J]. Food Bioscience,2022,50:102111. doi: 10.1016/j.fbio.2022.102111
[82] LU Z, ALTERMANN E, BREIDT F, et al. Sequence analysis of Leuconostoc mesenteroides bacteriophage Φ1-A4 isolated from an industrial vegetable fermentation[J]. Applied and Environmental Microbiology,2010,76(6):1955−1966. doi: 10.1128/AEM.02126-09
[83] MAHONY J, VAN SINDEREN D. Current taxonomy of phages infecting lactic acid bacteria[J]. Frontiers in Microbiology,2014,5:7.
[84] DEGROUX S, EFFANTIN G, LINARES R, et al. Deciphering bacteriophage T5 host recognition mechanism and infection trigger[J]. Journal of Virology,2023,97(3):e01584.
[85] BRITO I L. Examining horizontal gene transfer in microbial communities[J]. Nature Reviews Microbiology,2021,19(7):442−453. doi: 10.1038/s41579-021-00534-7
[86] VISWESWARAN G R R, KUREK D, SZELIGA M, et al. Expression of prophage-encoded endolysins contributes to autolysis of Lactococcus lactis[J]. Applied Microbiology and Biotechnology,2017,101(3):1099−1110. doi: 10.1007/s00253-016-7822-z
[87] FERNÁNDEZ L, GUTIÉRREZ D, GARCÍA P, et al. Environmental pH is a key modulator of Staphylococcus aureus biofilm development under predation by the virulent phage phiIPLA-RODI[J]. Isme Journal,2021,15(1):245−259. doi: 10.1038/s41396-020-00778-w
[88] OH J H, ALEXANDER L M, PAN M, et al. Dietary fructose and microbiota-derived short-chain fatty acids promote bacteriophage production in the gut symbiont Lactobacillus reuteri[J]. Cell Host & Microbe,2019,25(2):273−284.
[89] HENROT C, PETIT M A. Signals triggering prophage induction in the gut microbiota[J]. Molecular Microbiology,2022,118(5):494−502. doi: 10.1111/mmi.14983
[90] AL-ANANY A M, FATIMA R, NAIR G, et al. Temperate phage-antibiotic synergy across antibiotic classes reveals new mechanism for preventing lysogeny[J]. Mbio, 2024:e00504.
[91] SMID E, KLEEREBEZEM M. Production of aroma compounds in lactic fermentations[J]. Annual Review of Food Science and Technology,2014,5(1):313−326. doi: 10.1146/annurev-food-030713-092339
[92] PHILIPPE C, KRUPOVIC M, JAOMANJAKA F, et al. Bacteriophage GC1, a novel tectivirus infecting Gluconobacter Cerinus, an acetic acid bacterium associated with wine-making[J]. Viruses-Basel,2018,10(1):39. doi: 10.3390/v10010039
[93] WEN Q N, LV R R, ZHANG C, et al. Transcriptome analysis of the response of Lactiplantibacillus plantarum IMAU10120 to infection by phage P2[J]. International Journal of Dairy Technology,2024,77(2):435−449. doi: 10.1111/1471-0307.13055
[94] KARAYNIR A, SALIH H, BOZDOGAN B, et al. Isolation and characterization of Brochothrix phage ADU4[J]. Virus Research,2022,321:198902. doi: 10.1016/j.virusres.2022.198902
[95] ZHANG H D, ZHANG H X, DU H, et al. The insights into the phage communities of fermented foods in the age of viral metagenomics[J]. Critical Reviews in Food Science and Nutrition, 2023:2299323.
[96] MA J W, QIAN C G, HU Q J, et al. The bacteriome-coupled phage communities continuously contract and shift to orchestrate the traditional rice vinegar fermentation[J]. Food Research International,2024,184:114244. doi: 10.1016/j.foodres.2024.114244
[97] IPSEN R. Microparticulated whey proteins for improving dairy product texture[J]. International Dairy Journal,2017,67:73−79. doi: 10.1016/j.idairyj.2016.08.009
[98] LIU X, LIN S, LIU T, et al. Xenogeneic silencing relies on temperature-dependent phosphorylation of the host H-NS protein in Shewanella[J]. Nucleic Acids Research,2021,49(6):3427−3440. doi: 10.1093/nar/gkab137
[99] MASKE B L, PEREIRA G V D, VALE A D, et al. Viruses in fermented foods:are they good or bad? Two sides of the same coin[J]. Food Microbiology,2021,98:103794. doi: 10.1016/j.fm.2021.103794
[100] HUANG D, XIA R, CHEN C, et al. Adaptive strategies and ecological roles of phages in habitats under physicochemical stress[J]. Trends in microbiology,2024,2:002.
[101] SILPE J E, DUDDY O P, BASSLER B L. Induction mechanisms and strategies underlying interprophage competition during polylysogeny[J]. Plos Pathogens,2023,19(5):e1011363. doi: 10.1371/journal.ppat.1011363
[102] DEL RIO B, SÁNCHEZ-LLANA E, REDRUELLO B, et al. Enterococcus faecalis bacteriophage 156 is an effective biotechnological tool for reducing the presence of tyramine and putrescine in an experimental cheese model[J]. Frontiers in Microbiology,2019,10:566. doi: 10.3389/fmicb.2019.00566
[103] TABLA R, GÓMEZ A, REBOLLO J E, et al. Effectiveness of a bacteriophage cocktail in reducing cheese early blowing caused by Escherichia coli[J]. Lwt-Food Science and Technology,2022,153:112430. doi: 10.1016/j.lwt.2021.112430
[104] TOMAT D, MERCANTI D, BALAGUé C, et al. Phage biocontrol of enteropathogenic and Shiga toxin-producing Escherichia coli during milk fermentation[J]. Letters in Applied Microbiology,2013,57(1):3−10. doi: 10.1111/lam.12074
[105] KOMORA N, MACIEL C, PINTO C A, et al. Non-thermal approach to Listeria monocytogenes inactivation in milk:The combined effect of high pressure, pediocin PA-1 and bacteriophage P100[J]. Food Microbiology,2020,86:103315. doi: 10.1016/j.fm.2019.103315





 下载:
下载:
 下载:
下载:
