Screening of Starch Flocculation Bacteria in Sweet Potato Sour Pulp, Optimization of Flocculation Conditions and Analysis of Flocculation Components
-
摘要: 为获得具有良好红薯淀粉絮凝功能的乳酸菌,促进酸浆法红薯淀粉加工,本文对自然发酵红薯酸浆中具有红薯淀粉絮凝功能的乳酸菌进行了分离和筛选,并通过单因素实验和Box-Behnken响应面试验优化了高效絮凝菌株的絮凝条件,探究了其具有絮凝作用的细胞成分。结果表明,利用MRS培养基从自然发酵红薯酸浆中分离出植物乳杆菌(Lactiplantibacillus plantarum)HS1、棒状腐败乳杆菌(Loigolactobacillus coryniformis)HS2、沙克乳酸杆菌(Latilactobacillus sakei)HS3、肠膜明串珠菌(Leuconostoc mesenteroides)HS4和弯曲乳杆菌(Latilactobacillus curvatus)HS5等五种乳酸菌,其中植物乳杆菌(Lactiplantibacillus plantarum)HS1具有最高的淀粉絮凝能力。单因素实验和Box-Behnken响应面试验确定菌株HS1絮凝淀粉的最优条件为:发酵温度34 ℃、发酵时间44 h和发酵液添加量10%,在此条件下其对红薯淀粉的实际絮凝率为64.1%±1.87%。通过絮凝活性分布及加热、添加金属离子和酶处理对絮凝活性的影响分析,表明菌株HS1具有絮凝作用的细胞成分主要存在于发酵上清液中,且该成分的絮凝活性对温度、蛋白酶和金属离子比较敏感,因此推测其为某种胞外蛋白质。Abstract: In order to obtain lactic acid bacteria with good flocculation function of sweet potato starch and promote the processing of sweet potato starch by sour pulp method, lactic acid bacteria with flocculation function of sweet potato starch in natural fermented sweet potato sour pulp were isolated and screened in this paper. The flocculation conditions of high-efficiency flocculation strains were optimized by single factor test and Box-Behnken response surface test, and the cell components with flocculation effect were explored. The results showed that, five lactic acid bacteria, Lactiplantibacillus plantarum HS1, Loigolactobacillus coryniformis HS2, Latilactobacillus sakei HS3, Leuconostoc mesenteroides HS4 and Latilactobacillus curvatus HS5, were isolated from naturally fermented sweet potato sour pulp using MRS medium. Among them, L. plantarum HS1 had the highest starch flocculation ability. The optimal conditions for the flocculation of starch by strain HS1 were determined by single factor test and Box-Behnken response surface test as follows: fermentation temperature 34 ℃, fermentation time 44 h and fermentation broth addition amount 10%. Under these conditions, the actual flocculation rate of sweet potato starch was 64.1%±1.87%. By analyzing the distribution of flocculating activity and the effect of heating, adding metal ions and enzyme treatment on flocculating activity, it was shown that the cell component with flocculating effect of strain HS1 mainly existed in the fermentation supernatant, and the flocculating activity of the component was sensitive to temperature, protease and metal ions, so it was speculated that it was an extracellular protein.
-
我国是世界上红薯栽培面积最大且红薯年产量位居世界首位的国家,2023年我国红薯种植面积约213万公顷,红薯产量约4635万吨[1]。红薯块根中淀粉含量高(干基含量可高达 85%)[2],是天然淀粉的重要来源,且我国有50%左右红薯为淀粉型,其收获之后都用来加工成了淀粉[3−4]。在我国生产红薯淀粉的工艺主要有两种,即机械旋流法和酸浆沉淀法[5]。机械旋流分离法是先将鲜薯与水按一定比例混合磨浆后,通过电力驱动旋转,依靠高速离心使浆渣分离,静置沉淀,再过滤得到红薯淀粉;酸浆法是通过向粉碎过滤后的红薯浆中加入自然发酵的酸浆(红薯磨浆后自然放置,依靠自然微生物-主要是乳酸菌发酵后的酸性浆液),使淀粉迅速沉淀的传统生产方法[6]。在红薯淀粉生产时加入酸浆,淀粉颗粒会迅速集聚变大,形成团块,加速其与蛋白质的分离,提高淀粉纯度;并且酸浆对红薯淀粉具有显著的防褐变和抗老化作用,利用酸浆法生产的淀粉制成的粉条等制品品质更佳[7−8]。因此,虽然传统酸浆法制淀粉不如现代工业化生产效率高,但在实际生产中依然有着广泛的应用。
作为酸浆法生产红薯淀粉的重要原料——红薯酸浆,受到了科研人员的广泛关注。目前在红薯酸浆中微生物多样性分析、酸浆中微生物分离、絮凝能力测定及其沉淀淀粉机理等方面的研究都取得了一定的进展。如郑艳等[9]利用PCR-DGGE技术分析了红薯酸浆的细菌多样性,发现主要以厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)的明串珠菌属(Lactococcus)、不动杆菌属(Acinetobacter)、Reyranella属等细菌为主。吴企禾[10]采用高通量测序分析发现红薯酸浆主要以厚壁菌门的乳杆菌属(Lactobaillus,55.3%)和明串珠菌属(Leuconostoc,23.8%)为主,并筛选出1株具有淀粉絮凝功能的肠膜明串珠菌(Leuconostoc mesenteroides)。张莉力[11]从自然发酵红薯酸浆中筛选到一株具有高絮凝能力的副干酪乳杆菌L1。李新华等[12]采用Zeta电位测定、粒度分析及离子键检测,发现副干酪乳杆菌对红薯淀粉的絮凝过程是基于“架桥”机理,淀粉颗粒与菌体间靠离子键结合,絮凝作用使悬浊液中淀粉平均粒径减小,密度增大,导致淀粉颗粒凝聚沉降。然而,目前的利用酸浆法生产淀粉还都停留在沿袭传统工艺作坊式水平上,红薯酸浆的发酵过程受人为因素和自然条件影响大,导致其淀粉絮凝效果不稳定;并且由于缺少对其制作工艺的规范化和优势菌群的深入了解,使其工业化推广受到阻碍[13]。因此,获得具有良好淀粉絮凝能力的微生物菌株,并将其开发为微生物絮凝剂,对提高酸浆质量,减少酸浆的使用量,保证酸浆絮凝效果具有重要意义。红薯酸浆作为自然发酵的产物,其具有丰富的微生物多样性,但现有研究对其中具有淀粉絮凝功能的微生物的挖掘还远远不够。
红薯酸浆按照加工过程可分为头合浆、二合浆和三合浆三种[14],其中二合浆和三合浆是酸浆法中主要使用的酸浆,其具有促进淀粉颗粒沉降,提高淀粉纯度的功能[15]。为了进一步挖掘红薯酸浆中具有淀粉絮凝功能的微生物资源,本研究对自然发酵红薯酸浆二合浆中具有淀粉絮凝能力的乳酸菌进行了分离和筛选,并通过单因素实验和响应面试验对其絮凝淀粉的条件进行优化,通过絮凝活性分布及影响絮凝活性的因素分析探究其絮凝淀粉的活性成分,以期为利用乳酸菌开发红薯淀粉絮凝剂,并将其应用于红薯淀粉生产奠定基础。
1. 材料与方法
1.1 材料与仪器
红薯酸浆二合浆、商薯19 洛阳亚圣岭农业开发有限公司提供;胃蛋白酶(酶活1:3000)、胰蛋白酶(酶活1:250) 美国公司Amresco;溶菌酶(酶活20000 U/mg) 山东鲁森生物科技有限公司;纤维素酶(酶活20000 U/g) 河南万邦实业有限公司;中性蛋白酶(酶活4000 U/g) 河南万邦实业有限公司;细菌基因组提取试剂盒 爱思进生物技术(杭州)有限公司;Premix Taq™(TaKaRa Taq™ Version 2.0) 宝生物工程(大连)有限公司;16S rDNA扩增引物27F和1492R 生工生物工程(上海)股份有限公司合成。MRS培养基 蛋白胨10 g、牛肉膏10 g、酵母粉5 g、葡萄糖20 g、吐温80 1 mL、磷酸氢二钾2 g、醋酸钠5 g、柠檬酸铵2 g、七水硫酸镁0.2 g、四水硫酸锰0.2 g、蒸馏水1000 mL、(琼脂粉18~20 g),115 ℃灭菌30 min。
SW-CJ-1D型双人超净工作台 上海苏净实业有限公司;722N型可见光分光光度计 上海悦丰仪器仪表有限公司;L18-P161型破壁机 美的电器有限公司;H1850R型冷冻离心机 湖南湘仪实验室仪器开发有限公司;TC1000-G 型PCR仪 大龙兴创实验仪器(北京)股份公司;Eclipse E100光学显微镜 尼康仪器(上海)有限公司。
1.2 实验方法
1.2.1 红薯酸浆中乳酸菌的分离
以无菌操作吸取红薯酸浆二合浆样品10 mL,加入装有90 mL无菌水的三角瓶中,混匀,制成10−1样品悬液,然后吸取1 mL的10−1样品悬液加入到装有9 mL无菌水的试管中,得到10−2样品悬液,重复操作依次得到10−3、10−4、10−5的样品悬液,分别吸取 10−3、10−4、10−5样品悬液200 μL涂布于添加质量分数为2%CaCO3的MRS固体培养基上,将平板倒置于37 ℃恒温培养箱48 h后,挑选平板上带有透明圈且菌落形态不同的单菌落,利用MRS平板进一步划线纯化。
1.2.2 乳酸菌的鉴定
首先对划线纯化后的各个乳酸菌进行菌落形态观察,然后挑取少量菌体经结晶紫简单染色后,在光学显微镜下观察菌体形态;并参照《乳酸细菌分类鉴定及实验方法》[16]和《常见细菌系统鉴定手册》[17]对各个乳酸菌进行生理生化特征测定和16S rDNA序列分析。乳酸菌基因组DNA的提取参照细菌基因组抽提试剂盒说明书进行,其16S rDNA的PCR扩增引物为细菌16S rDNA通用引物27F和1492R[18]。PCR扩增产物经1%琼脂糖凝胶电泳检测后送生工生物工程(上海)股份有限公司测序,测序结果在美国国立生物技术信息中心(national center for biotechnology information,NCBI)的Genbank数据库中利用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行比对,选取同源性较高菌属的模式菌株16S rDNA序列,采用MEGA-X软件中的邻接(neighbor joining,NJ)法构建系统发育树,进行系统发育分析[19]。
1.2.3 淀粉絮凝菌株的筛选
参考李新华等[12]的试验方法,稍加改变。
1.2.3.1 乳酸菌发酵液的制备
首先将各乳酸菌单菌落分别接种到MRS液体培养基中,在30 ℃活化培养12 h,然后按3%接种量将活化后的菌液接种到新的MRS液体培养基中发酵培养24 h,调节发酵液OD600=2.0,备用。
1.2.3.2 红薯浆的制备
将新鲜无病害的商薯19与水按1:3.5比例在破壁机中磨浆10 min,用100目筛子过滤得红薯浆。
1.2.3.3 红薯淀粉的絮凝
在200 mL量杯中加入100 mL红薯浆和10 mL各乳酸菌发酵液,并调节混合液pH至5.5,然后静置沉降3 min,在液面下10 mL处取样,用分光光度计在540 nm处测定其吸光度,以未接菌的空白培养基代替发酵液作对照试验,并按照式(1)计算淀粉絮凝率:
絮凝率(%)=(A−B)/A×100% (1) 式中,A为对照吸光度,B为样品吸光度。
1.2.4 菌株絮凝条件优化
1.2.4.1 单因素实验
考察菌株发酵温度(20、25、30、35、40 ℃)、发酵时间(24、36、48、60、72 h)、发酵液添加量(4%、6%、8%、10%、12%、14%)和混合液pH(4.5、5.0、5.5、6.0、6.5、7.0)对淀粉的絮凝率的影响[20−21]。在进行单因素实验中,除选择的因素外,其余因素均按发酵温度30 ℃,发酵时间48 h,发酵液添加量10%和混合液pH5.5的条件进行试验。
1.2.4.2 响应面试验设计
根据单因素实验的结果,采用中心组合试验Box-Behnken设计方案,选取对菌种絮凝影响较大的三个因素:发酵液添加量、发酵温度和发酵时间,使用Design Expert 13软件,进行响应面设计[22]。每个因素设3个水平(−1、0、1),并以絮凝率作为响应值,对絮凝条件进行设计优化。响应面的试验因素与水平设计见表1。
表 1 响应面试验因素与水平设计Table 1. Factors and horizontal design of response surface test水平 因素 A发酵液添加量(%) B发酵温度(℃) C发酵时间(h) −1 8 30 36 0 10 35 48 1 12 40 60 1.2.5 絮凝成分分析
1.2.5.1 絮凝活性分布
乳酸菌在MRS培养基中发酵培养48 h后,将其发酵液用8000 r/min离心5 min,取上清液备用,离心后的菌体加入等体积无菌水制成菌悬液,同时用无菌蒸馏水洗涤菌体2次后,加入等体积水制成洗涤菌悬液。分别将10 mL发酵液原液、上清液、菌悬液和洗涤菌悬液加入到100 mL红薯浆中,然后测定其对红薯淀粉的絮凝率,确定菌体絮凝活性分布情况[23]。
1.2.5.2 絮凝活性的热稳定性分析
将10 mL发酵液分别在30~90 ℃恒温水浴中处理30 min后,加入到100 mL红薯浆中,测定其对红薯淀粉的絮凝率。
1.2.5.3 金属离子对絮凝活性的影响
将10 mL发酵液分别与1 mL浓度为1%的NaCl、CaCl2、MgCl2、CuSO4、KCl溶液一起加入到100 mL红薯浆中,然后测定各组红薯浆的淀粉絮凝率。
1.2.5.4 酶处理对絮凝活性的影响
取乳酸菌培养48 h后的发酵液,在4 ℃条件下8000 r/min离心5 min,取其上清液,按1.0 g/L分别加入溶菌酶、胃蛋白酶、胰蛋白酶、纤维素酶、中性蛋白酶,酶解pH分别为7.8、2.5、8.0、4.8、7.0,酶解温度分别为55、37、37、50、55 ℃,在140 r/min摇床上酶解2 h[23]。以未经过酶处理的上清液作为对照,按照1.2.3所述方法测定各处理淀粉的絮凝率。
1.3 数据处理
利用MEGA-X进行5株乳酸菌及各模式菌株同源性分析和系统发育树构建,利用Excel2007和DPS数据处理系统进行所有单因素试验数据的统计处理、差异显著性分析和绘图,使用Design Expert 13进行响应面试验设计及其数据分析。
2. 结果与分析
2.1 红薯酸浆中乳酸菌的分离与鉴定
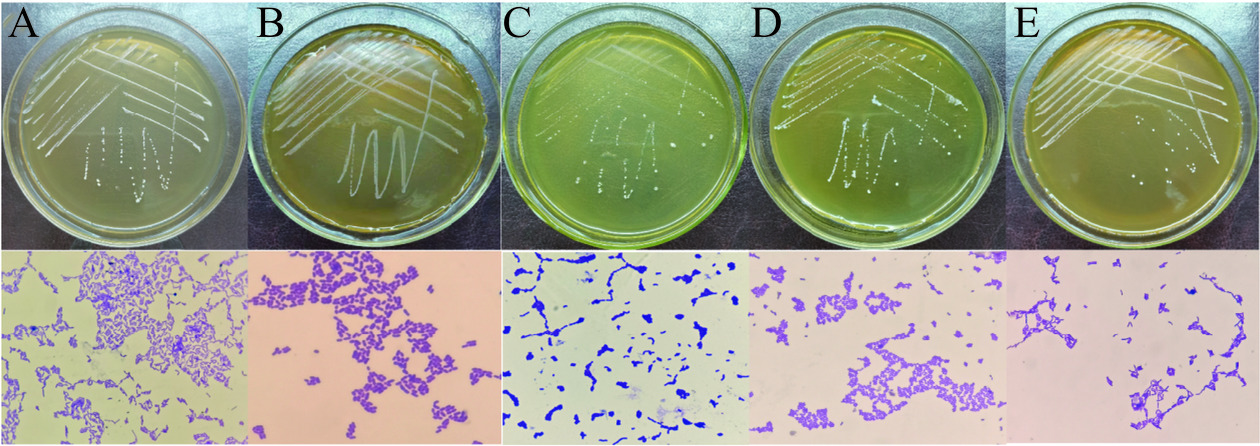
利用MRS培养基从红薯酸浆二合浆样品中分离出大量乳酸菌,从中选择了生长较好、菌落形态明显不同的5种菌株,分别命名为菌株HS1-HS5。5个菌株的菌落形态和菌体形态如图1和表2所示。它们的菌落均为白色或灰白色小菌落,圆形、半透明或不透明、隆起或扁平、粘稠,用接种环容易挑起;其菌体为长杆状、弯杆状或短棒状,呈单个、成对或成链排列,无鞭毛、无芽孢。
表 2 5株乳酸菌形态特征和生理生化试验结果Table 2. Morphological characteristics and physiological and biochemical test results of five lactic acid bacteria项目 HS1 HS2 HS3 HS4 HS5 菌落形态 白色,圆形,小菌落,隆起,不透明,湿润,边缘整齐 灰白色,圆形,小菌落,扁平,半透明,干燥,边缘整齐 白色,圆形,小菌落,凹陷,不透明,湿润,边缘不整齐 白色,圆形,小菌落,半隆起,不透明,湿润,边缘整齐 白色,圆形,小菌落,扁平,不透明,湿润,边缘不整齐 菌体形态 长杆状,单生、成对或链状 短棒状,单个、成对或链状 弯杆状,单个、成对或链状 短棒状,单个、成对或
链状弯杆状,单个、成对或链状 革兰氏染色 + + + + + 过氧化氢酶 − − − − − 甲基红试验 + − − − − V-P试验 − − − − − 明胶液化 − − − − − 淀粉水解 − − − − − 硝酸盐还原 − − − − − 葡萄糖 + + + + + 乳糖 + + + + + 棉籽糖 + + + + + 甘露寡糖 − + − − − 蔗糖 + − + + + 木糖 + − − − + 甘露醇 + − + + − 注:“+”阳性;“-”:阴性 5株乳酸菌的生理生化试验结果如表2所示,其革兰氏染色结果均为阳性,过氧化氢酶试验、明胶液化试验及硝酸盐还原试验等结果均为阴性,5个菌株能够分解利用多种糖和甘露醇进行发酵。
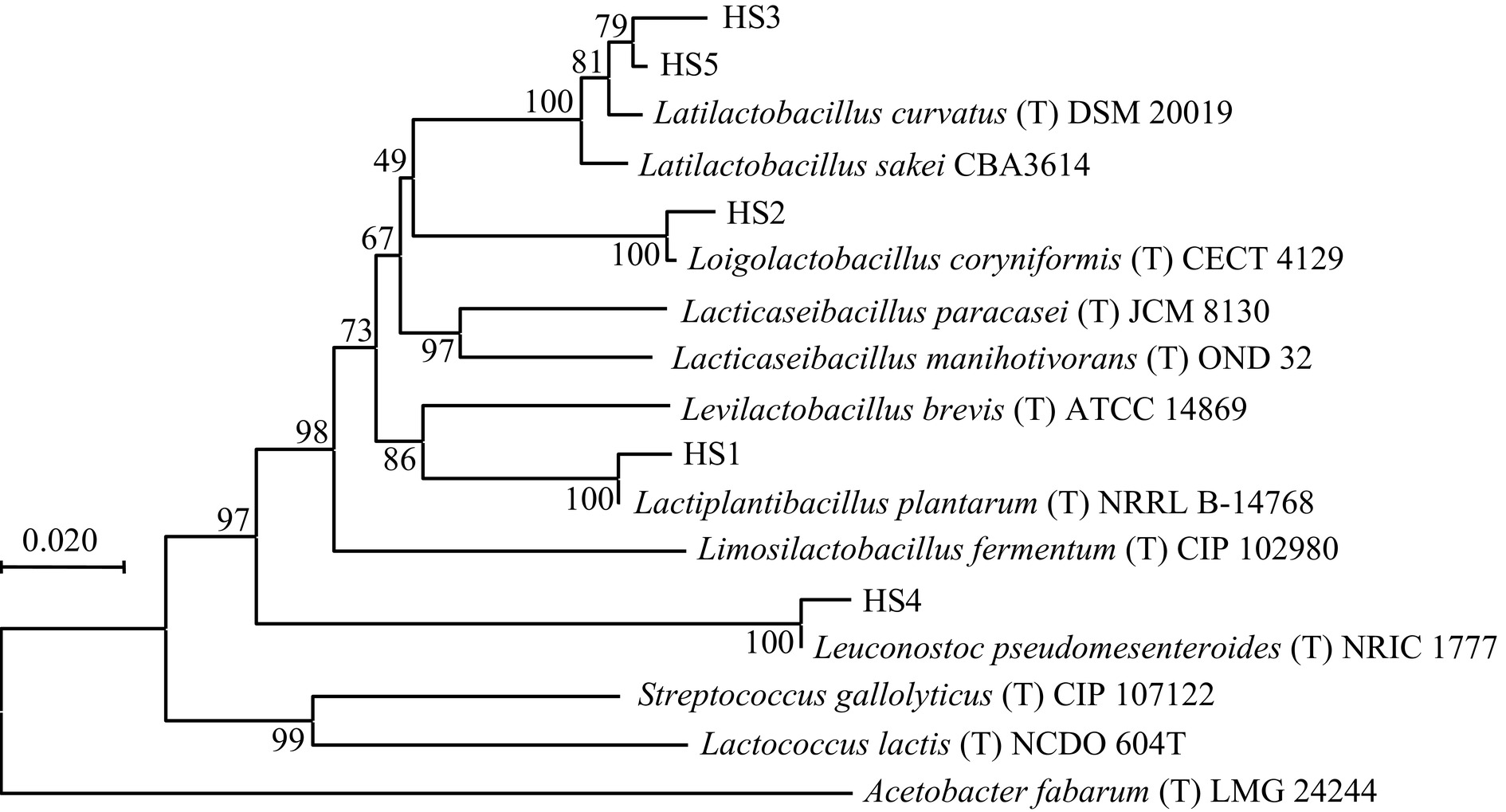
将5株乳酸菌的16S rRNA基因PCR扩增产物测序结果提交NCBI,登录号分别为PP544676、PP544677、PP544678、PP544679、PP544680,利用BLAST程序对其同源性进行分析比对后,采用MAGE-X构建各菌株16S rRNA基因序列系统进化树如图2所示。通过观察发现菌株HS1、HS2和HS4分别与Lactiplantibacillus plantarum NRRL B-14768、Loigolactobacillus coryniformis CECT 4129和Leuconostoc mesenteroides strain NRIC 1777位于相同的进化分支;菌株HS3和HS5则与Latilactobacillus sakei CBA3614和Latilactobacillus curvatus DSM 20019位于相同的进化分支。根据形态学特征、生理生化试验结果,结合16S rRNA基因序列分析,确定菌株HS1为植物乳植杆菌(Lactiplantibacillus plantarum),HS2为棒状腐败乳杆菌(Loigolactobacillus coryniformis),HS3为沙克广布乳酸杆菌(Latilactobacillus sakei),HS4为肠膜明串珠菌(Leuconostoc mesenteroides),HS5为弯曲广布乳酸杆菌(Latilactobacillus curvatus)。这与吴企禾[10]采用高通量测序分析发现红薯酸浆主要以厚壁菌门的乳杆菌属(Lactobaillus,55.3%)和明串珠菌属(Leuconostoc,23.8%)为主的结果相一致。
2.2 淀粉絮凝菌株的筛选
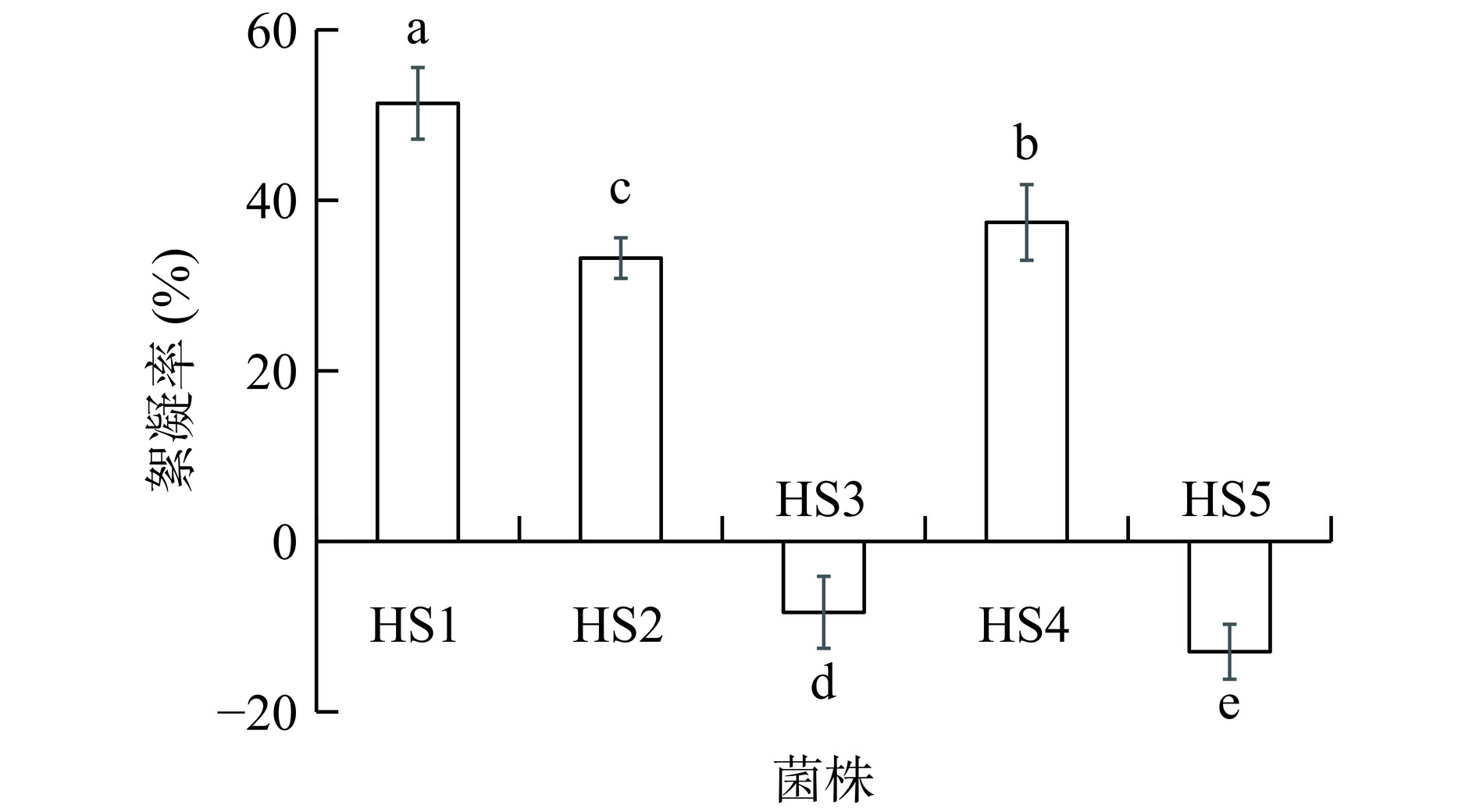
将5株乳酸菌利用MRS培养基进行培养后,测定其发酵液对红薯浆中淀粉的絮凝率,结果如图3所示,植物乳植杆菌HS1的淀粉絮凝率最高,可达51.37%,棒状腐败乳杆菌HS2和肠膜明串珠菌HS4的淀粉絮凝率也较高,其对淀粉絮凝率分别为33.22%和37.41%,而沙克广布乳酸杆菌HS3和弯曲广布乳酸杆菌HS5则对淀粉没有絮凝能力。因此,认为植物乳植杆菌HS1对淀粉絮凝能力最强,后续对其絮凝淀粉的条件和絮凝淀粉的活性成分进行优化与分析。目前已报道的红薯酸浆中具有淀粉絮凝功能的乳酸菌主要有肠膜明串珠菌[10]、副干酪乳杆菌[11]、乳酸链球菌[24]、乳酸乳球菌[25]和柠檬明串株菌[26]等,这是首次发现植物乳植杆菌和棒状腐败乳杆菌具有淀粉絮凝功能。
2.3 植物乳杆菌HS1絮凝淀粉条件优化
2.3.1 发酵时间、发酵温度、发酵液添加量及混合液pH对淀粉絮凝率的影响
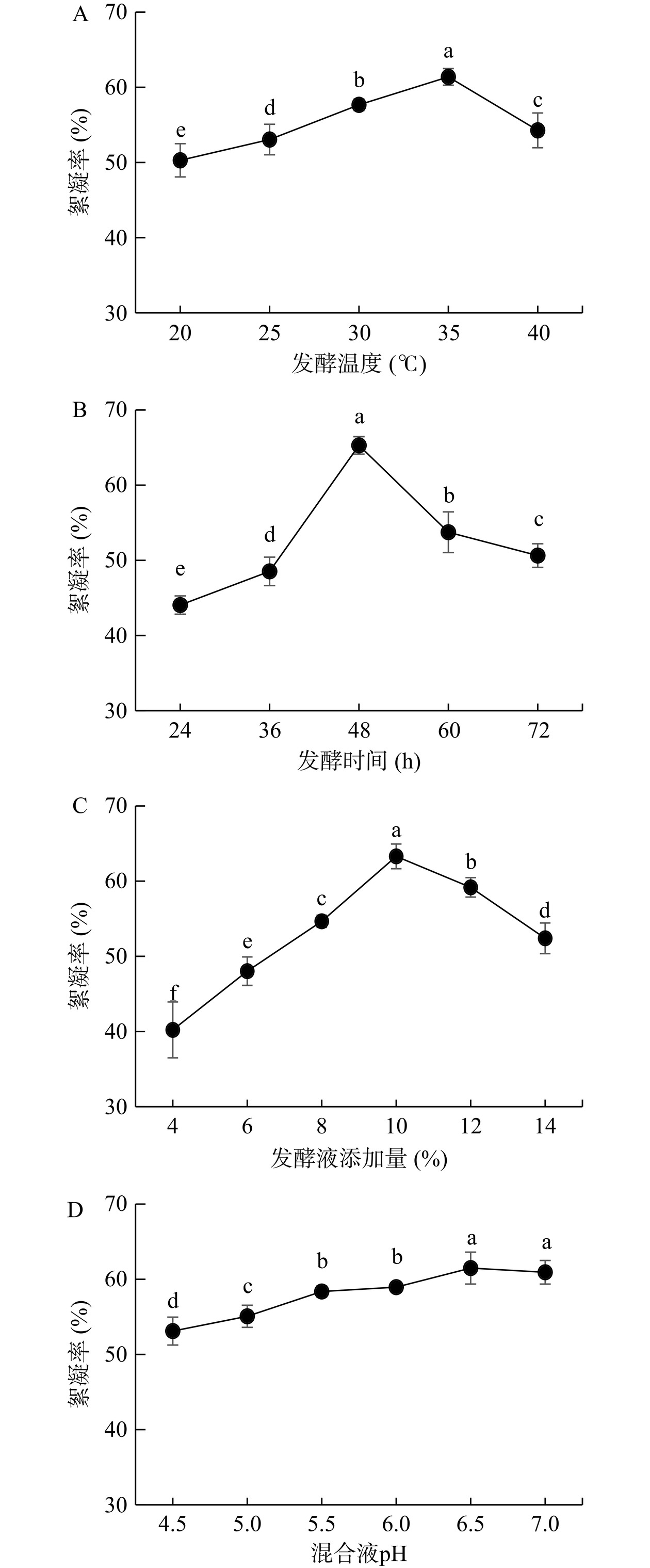
发酵时间、发酵温度、发酵液添加量及混合液pH对LP絮凝淀粉絮凝率的影响如图4所示。由图4A可知,当发酵温度从20 ℃上升到35 ℃的时候,HS1的絮凝能力逐渐升高,在35 ℃时,絮凝率达到最高;当温度继续上升到40 ℃时,絮凝率显著降低(P < 0.05)。一般植物乳植杆菌的最适生长温度为30~35 ℃左右[27],在此温度下其生长量可以达到最大,因此其对淀粉的絮凝活性也达到了最大。由图4B可知,将菌株HS1发酵培养48 h所得的发酵液具有最大的淀粉絮凝率,发酵时间短于或长于48 h的发酵液的淀粉絮凝率都显著下降(P<0.05)。已报道的副干酪乳杆菌L1对甘薯淀粉[20]和发酵乳杆菌FLL5429对豌豆淀粉[21]发挥最大絮凝能力的发酵时间也为48 h,与本研究结果一致。由图4C可知,发酵液的添加量对红薯浆淀粉絮凝率有着显著的影响(P<0.05),当发酵液添加量为4%时,红薯浆淀粉絮凝率最低;随着发酵液添加量的增加,淀粉絮凝率也逐渐上升,在添加量为10%时达到最大。随后继续加大添加量,淀粉絮凝率反倒逐渐下降。由图4D可知,混合液的pH对红薯浆的淀粉絮凝率也有一定的影响,随着混合液pH逐渐增加,淀粉絮凝率也逐渐上升;在pH为6.5时,淀粉絮凝率达到最大,但与其他三个因素相比,混合液pH对淀粉絮凝率的影响不如其他三个因素显著(P<0.05)。传统酸浆法生产红薯淀粉时,当兑浆后淀粉乳的pH为5.6~6.2时,淀粉絮凝效果最好[28];本研究发现混合液pH为6.5时,红薯淀粉絮凝率最高,与传统工艺中对兑浆后淀粉乳pH要求基本一致。兑浆后淀粉乳pH直接受到酸浆添加量的影响,所以为了达到理想的淀粉絮凝效果,必须控制合理的酸浆添加量,正如本研究发现当发酵液添加量为10%时,淀粉絮凝率达到最大,但继续加大酸浆添加量,淀粉絮凝率反倒逐渐下降。
2.3.2 响应面优化试验设计
2.3.2.1 模型构建与显著性检验
根据单因素实验的结果,对表3数据进行多元回归拟合分析,得到以淀粉絮凝率为响应值的回归方程:
表 3 响应面试验设计与结果Table 3. Design and results of response surface test实验编号 A发酵液添加量(%) B发酵温度(℃) C发酵时间(h) 絮凝率(%) 1 −1 0 −1 55.4±5.99 2 0 0 0 65.1±3.35 3 0 0 0 63.9±3.44 4 0 0 0 62.7±2.94 5 −1 −1 0 56.3±4.16 6 0 1 −1 48.7±5.79 7 0 0 0 58.7±0.83 8 1 −1 0 46.7±1.37 9 0 −1 −1 58.3±4.31 10 0 −1 1 47.5±5.56 11 0 0 0 63.5±4.72 12 −1 0 1 43.1±3.40 13 −1 1 0 47.2±5.52 14 1 0 1 44.2±1.97 15 0 1 1 50.8±3.14 16 1 1 0 43.3±1.77 17 1 0 −1 40.5±5.69 Y=62.78−3.41A−2.35B−2.16C+1.42AB+4AC+3.22BC−9.96A2−4.44B2−7.01C2
式中,Y表示絮凝率的预测值(%),A、B、C分别代表发酵液添加量(%),发酵温度(℃)和发酵时间(h)。
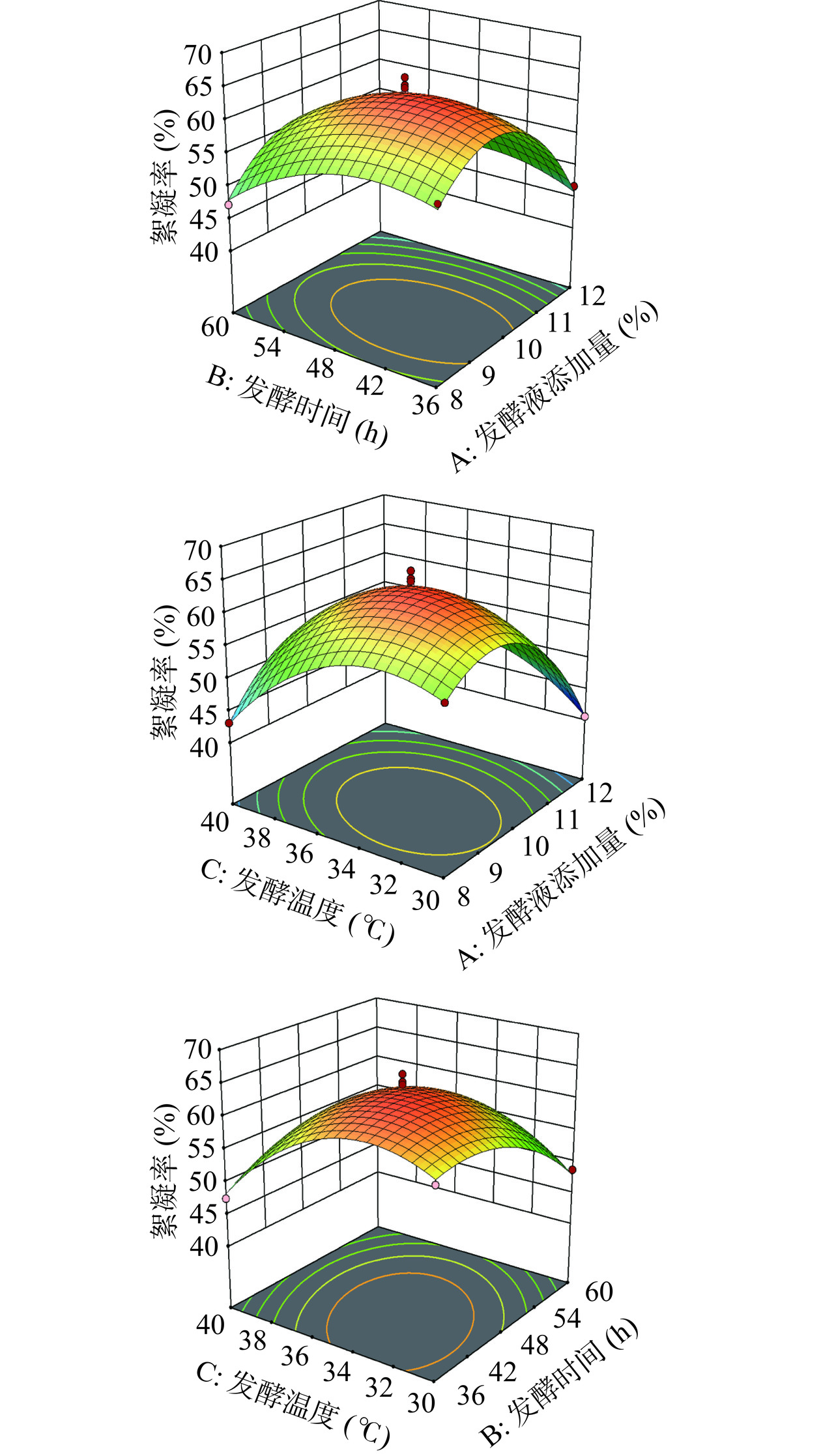
响应面方差分析的F值大小可以代表各因素对絮凝率的影响程度,P值可以看出各因素的交互作用[29]。本研究的响应面二次模型方差分析如表4所示,模型中F值为29.05,回归模型极显著(P<0.01),失拟项不显著(P=0.8448,P>0.05),说明回归方程拟合度高,误差小;决定系数R2=97.39%,即预测仅有2.61%的数据不能用该模型解释。调整系数为R2adj=94.04%,该模型可以对94.04 %的响应值变化做出解释;该模型的失拟项值大于0.05,故说明此模型没有失拟现象。模型校正决定系数,表示该模型的拟合度在接受范围内,结果可信。对各实验指标进行显著性分析,其结果可以用P值来表示。B、C、BC均具有显著性(P<0.05),其中A、AC、A2、B2、C2为极显著(P<0.01)。结合方差分析结果为:FA=22.78,FB=10.08,FC=9.15,得到FA>FB>FC,由于F值越大,影响越大,即对絮凝率影响的顺序为:发酵液添加量>发酵温度>发酵时间。
表 4 响应面二次模型方差分析Table 4. Analysis of variance for response surface quadratic model方差来源 平方和 自由度 均方 F值 P值 显著性 模型 1069.33 9 118.81 29.05 < 0.0001 ** A 93.16 1 93.16 22.78 0.0020 ** B 44.18 1 44.18 10.80 0.0134 * C 37.41 1 37.41 9.15 0.0193 * AB 8.12 1 8.12 1.99 0.2016 AC 64.00 1 64.00 15.65 0.0055 ** BC 41.60 1 41.60 10.17 0.0153 * A2 418.11 1 418.11 102.24 < 0.0001 ** B2 83.00 1 83.00 20.30 0.0028 ** C2 207.20 1 207.20 50.67 0.0002 ** 残差 28.63 7 4.09 失拟误差 4.82 3 1.61 0.2698 0.8448 纯误差 23.81 4 5.95 总和 1097.96 16 R2=97.39% R2adj=94.04% 注:“*”表示显著(P<0.05);“**”差异极显著(P<0.01)。 使用Design Expert 13软件对回归方程中的交互项AB、AC、BC绘制响应面图,如图5所示。各因素之间有不同程度的交互作用,各因素交互作用形成的响应面图均为曲面,且开口方向朝下,这表明随着各个因素的增长,对菌株HS1絮凝淀粉的能力影响变大,当其增大到最大值后,随着各因素继续增大,对菌株HS1絮凝淀粉的影响将逐渐减小[30−31]。
2.3.2.2 响应面优化试验设计验证
根据回归模型及 Design-Expert 13 软件求解方程得到菌株HS1对红薯淀粉最佳絮凝条件为:发酵液添加量9.89%、发酵时间43.62 h、发酵温度33.73 ℃,根据上述条件经模型优化预测得到其淀粉絮凝率最大值为63.7%。结合实际,将优化条件调整为:发酵液添加量10%、发酵时间 44 h、发酵温度 34 ℃,试验测得此条件下植物乳杆菌HS1发酵液对红薯淀粉的絮凝率为(64.1±1.87)%,与理论值的相对误相差较小。说明本模型可信度高,理论值与实际情况拟合度良好。据报道,王天琪等[25]筛选的乳酸乳球菌对绿豆淀粉的絮凝率为60.16%;张明等[20]对副干酪乳杆菌L1絮凝红薯淀粉的条件优化后,发现其在培养48 h、混合液pH为5.5及添加Na+条件下可以获得最高淀粉絮凝率达70%以上。与已报道的其他菌株相比,菌株HS1的淀粉絮凝能力属于中等水平,后期还可以通过改变发酵培养基成分对其絮凝条件进行进一步优化。
2.4 植物乳植杆菌HS1絮凝成分分析
目前已发现的酸浆中乳酸菌絮凝淀粉的活性成分主要有两种,一种是乳酸菌菌体本身起絮凝作用,如最早研究发现乳酸链球菌具有絮凝淀粉的作用[24],之后又发现副干酪乳杆菌副干酪亚种这种菌本身具有絮凝效果[12,32];另一种是微生物的胞外产物具有絮凝作用,例如研究发现发酵乳杆菌菌体本身没有絮凝特性,其胞外产物具有絮凝效果[21]。
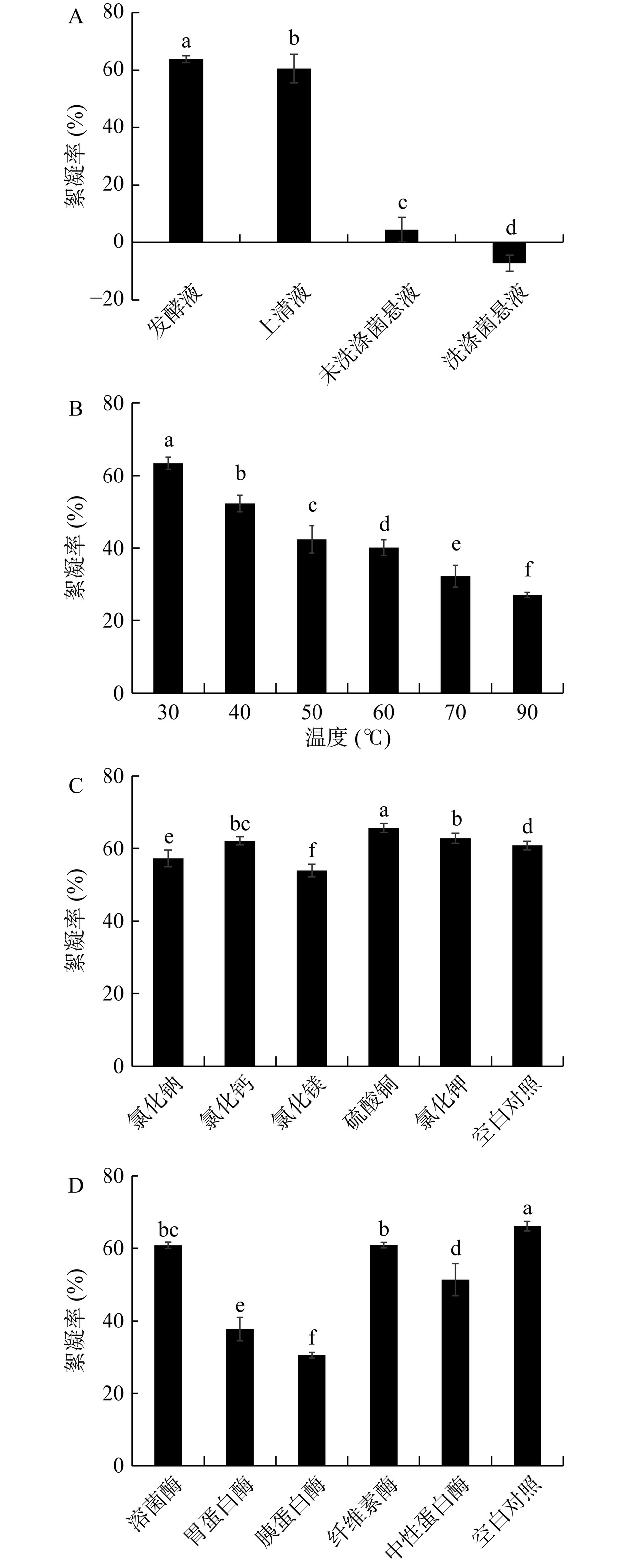
为探究菌株HS1絮凝淀粉的活性成分,对菌株HS1絮凝活性的分布及加热、金属离子和酶类对其絮凝活性的影响进行了测定,结果如图6所示。由图6A可知,植物乳植杆菌HS1发酵液和上清液都对红薯浆淀粉有很好的絮凝活性,而未洗涤菌悬液对红薯浆淀粉絮凝活性很低,洗涤后的菌悬液则对红薯浆淀粉没有絮凝活性,表明菌株HS1的絮凝活性物质是分泌到胞外的代谢产物,而不是菌体细胞本身。冯琳琳等[21]研究发现发酵乳杆菌 FLL5429具有淀粉絮凝活性的物质也是存在于其发酵上清液中,即细菌发酵后的胞外产物,而菌体自身并不具备凝活性。由图6B可知,将菌株HS1的发酵液在不同温度下处理后,其淀粉絮凝活性随着处理温度的升高而逐渐下降。由图6C可知,与未额外添加金属离子的对照相比,添加Ca2+、Cu2+和K+,对菌株HS1发酵液的淀粉絮凝活性有一定促进作用,其中Cu2+的促进作用最强;添加Na+和Mg2+,对发酵液的淀粉絮凝活性有一定的抑制作用。由图6D可知,与不经酶处理的对照组相比,经过不同酶处理后的发酵上清液的淀粉絮凝活性均有所下降,其中经溶菌酶和纤维素酶处理后,发酵上清液淀粉絮凝活性下降幅度较小;而经各种蛋白酶处理后,发酵上清液淀粉絮凝活性下降较明显,特别是经胃蛋白酶和胰蛋白酶处理后的发酵上清液淀粉絮凝率下降幅度较大。通过分析上述因素对菌株HS1发酵液絮凝活性的影响,发现发酵液中具有絮凝活性的成分对温度和蛋白酶比较敏感,所以认为该絮凝活性成分可能为蛋白类的物质。这与刘娇等[23]研究发现哈尔滨施莱弗乳杆菌LJ5和刘黎莹[33]研究发现醋酸杆菌LLY11絮凝豌豆淀粉的活性物质都为蛋白类物质相一致。
3. 结论
本研究从自然发酵的红薯酸浆二合浆中分离筛选到了具有红薯淀粉絮凝功能的植物乳植杆菌(Lactiplantibacillus plantarum)HS1、棒状腐败乳杆菌(Loigolactobacillus coryniformis)HS2和肠膜明串珠菌(Leuconostoc mesenteroides)HS4,其中植物乳植杆菌HS1的淀粉絮凝能力最强。菌株HS1在发酵温度34 ℃、发酵时间44 h、发酵液添加量10%时,对红薯淀粉的实际絮凝率可达64.1%±1.87%。通过对植物乳植杆菌HS1絮凝活性分布及其影响因素的分析表明,菌株HS1具有絮凝作用的成分主要存在于发酵上清液中,且该成分的絮凝活性易受到对温度、蛋白酶和金属离子的影响,因此推测该成分不是HS1的菌体本身,而是其分泌到细胞外的某种蛋白。本研究不仅为纯种微生物发酵红薯酸浆提供了新的菌种资源,也为实现酸浆法标准化生产红薯淀粉和丰富微生物絮凝淀粉的机理奠定了基础。
-
表 1 响应面试验因素与水平设计
Table 1 Factors and horizontal design of response surface test
水平 因素 A发酵液添加量(%) B发酵温度(℃) C发酵时间(h) −1 8 30 36 0 10 35 48 1 12 40 60 表 2 5株乳酸菌形态特征和生理生化试验结果
Table 2 Morphological characteristics and physiological and biochemical test results of five lactic acid bacteria
项目 HS1 HS2 HS3 HS4 HS5 菌落形态 白色,圆形,小菌落,隆起,不透明,湿润,边缘整齐 灰白色,圆形,小菌落,扁平,半透明,干燥,边缘整齐 白色,圆形,小菌落,凹陷,不透明,湿润,边缘不整齐 白色,圆形,小菌落,半隆起,不透明,湿润,边缘整齐 白色,圆形,小菌落,扁平,不透明,湿润,边缘不整齐 菌体形态 长杆状,单生、成对或链状 短棒状,单个、成对或链状 弯杆状,单个、成对或链状 短棒状,单个、成对或
链状弯杆状,单个、成对或链状 革兰氏染色 + + + + + 过氧化氢酶 − − − − − 甲基红试验 + − − − − V-P试验 − − − − − 明胶液化 − − − − − 淀粉水解 − − − − − 硝酸盐还原 − − − − − 葡萄糖 + + + + + 乳糖 + + + + + 棉籽糖 + + + + + 甘露寡糖 − + − − − 蔗糖 + − + + + 木糖 + − − − + 甘露醇 + − + + − 注:“+”阳性;“-”:阴性 表 3 响应面试验设计与结果
Table 3 Design and results of response surface test
实验编号 A发酵液添加量(%) B发酵温度(℃) C发酵时间(h) 絮凝率(%) 1 −1 0 −1 55.4±5.99 2 0 0 0 65.1±3.35 3 0 0 0 63.9±3.44 4 0 0 0 62.7±2.94 5 −1 −1 0 56.3±4.16 6 0 1 −1 48.7±5.79 7 0 0 0 58.7±0.83 8 1 −1 0 46.7±1.37 9 0 −1 −1 58.3±4.31 10 0 −1 1 47.5±5.56 11 0 0 0 63.5±4.72 12 −1 0 1 43.1±3.40 13 −1 1 0 47.2±5.52 14 1 0 1 44.2±1.97 15 0 1 1 50.8±3.14 16 1 1 0 43.3±1.77 17 1 0 −1 40.5±5.69 表 4 响应面二次模型方差分析
Table 4 Analysis of variance for response surface quadratic model
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 1069.33 9 118.81 29.05 < 0.0001 ** A 93.16 1 93.16 22.78 0.0020 ** B 44.18 1 44.18 10.80 0.0134 * C 37.41 1 37.41 9.15 0.0193 * AB 8.12 1 8.12 1.99 0.2016 AC 64.00 1 64.00 15.65 0.0055 ** BC 41.60 1 41.60 10.17 0.0153 * A2 418.11 1 418.11 102.24 < 0.0001 ** B2 83.00 1 83.00 20.30 0.0028 ** C2 207.20 1 207.20 50.67 0.0002 ** 残差 28.63 7 4.09 失拟误差 4.82 3 1.61 0.2698 0.8448 纯误差 23.81 4 5.95 总和 1097.96 16 R2=97.39% R2adj=94.04% 注:“*”表示显著(P<0.05);“**”差异极显著(P<0.01)。 -
[1] 智研咨询. 智研咨询—中国红薯行业市场运行态势及未来发展趋势研究报告(2024版)[EB/OL]. (2024-08-01) [2024-09-10]. https://caifuhao.eastmoney.com/news/20240801113636166488400. [ZHIYAN CONSULTING. Zhiyan consulting-research report on the market operation situation and future development trend of China's sweet potato industry (2024 Edition)[EB/OL]. (2024-08-01) [2024-09-10]. https://caifuhao.eastmoney.com/news/20240801113636166488400.] ZHIYAN CONSULTING. Zhiyan consulting-research report on the market operation situation and future development trend of China's sweet potato industry (2024 Edition)[EB/OL]. (2024-08-01) [2024-09-10]. https://caifuhao.eastmoney.com/news/20240801113636166488400.
[2] 赵凌霄, 赵冬兰, 戴习彬, 等. 甘薯抗性淀粉研究进展[J]. 中国粮油学报,2024,39(3):201−208. [ZHAO L X, ZHAO D L, DAI X B, et al. Research progress on resistant starch from sweet potato[J]. Journal of the Chinese Cereals and Oils Association,2024,39(3):201−208.] ZHAO L X, ZHAO D L, DAI X B, et al. Research progress on resistant starch from sweet potato[J]. Journal of the Chinese Cereals and Oils Association, 2024, 39(3): 201−208.
[3] LIAO L Y, LIU H H, GAN Z P, et al. Structural properties of sweet potato starch and its vermicelli quality as affected by heat-moisture treatment[J]. International Journal of Food Properties,2019,22(1):1122−1133. doi: 10.1080/10942912.2019.1626418
[4] 陆晗, 陆建珍. “双循环”新发展格局下我国甘薯产业链优化路径探析[J]. 江苏农业科学,2022,50(15):256−264. [LU H, LU J Z. Analysis on the optimization path of sweet potato industry chain in China under the new development pattern of “Double Cycle”[J]. Jiangsu Agricultural Sciences,2022,50(15):256−264.] LU H, LU J Z. Analysis on the optimization path of sweet potato industry chain in China under the new development pattern of “Double Cycle”[J]. Jiangsu Agricultural Sciences, 2022, 50(15): 256−264.
[5] 张静. 甘薯淀粉生产工艺研究[D]. 重庆:西南大学, 2018. [ZHANG J. Study on cleaner production technology of sweet potato starch[D]. Chongqing:Southwest University, 2018.] ZHANG J. Study on cleaner production technology of sweet potato starch[D]. Chongqing: Southwest University, 2018.
[6] DENG F M, MU T H, ZHANG M, et al. Composition, structure, and physicochemical properties of sweet potato starches isolated by sour liquid processing and centrifugation[J]. Starch,2013,65(1−2):162−171. doi: 10.1002/star.201200106
[7] 邓福明, 木泰华, 张苗. 旋流与酸浆法甘薯淀粉性能及粉条品质比较[J]. 食品工业科技,2012,33(17):98−102. [DENG F M, MU T H, ZHANG M. Comparative study of the physico-chemical properties of sweet potato starches prepared by centrifugal cyclone separator and sour liquid processing and their quality of noodle products[J]. Science and Technology of Food Industry,2012,33(17):98−102.] DENG F M, MU T H, ZHANG M. Comparative study of the physico-chemical properties of sweet potato starches prepared by centrifugal cyclone separator and sour liquid processing and their quality of noodle products[J]. Science and Technology of Food Industry, 2012, 33(17): 98−102.
[8] 孟亚萍, 焦婷婷. 鲜湿薯类粉条品质改良关键技术研究进展[J]. 粮食加工,2024,49(1):29−31. [MENG Y P, JIAO T T. Research progress and prospect on the key technology affecting quality of fresh and wet potato noodles[J]. Grain Processing,2024,49(1):29−31.] MENG Y P, JIAO T T. Research progress and prospect on the key technology affecting quality of fresh and wet potato noodles[J]. Grain Processing, 2024, 49(1): 29−31.
[9] 郑艳, 姚婷. PCR-DGGE分析甘薯酸浆自然发酵过程中细菌多样性[J]. 食品科学,2016,37(7):99−103. [ZHENG Y, YAO T. Analysis of bacterial diversity during natural fermenation of sweet potato sour liquid by PCR-DGGE[J]. Food Science,2016,37(7):99−103.] doi: 10.7506/spkx1002-6630-201607019 ZHENG Y, YAO T. Analysis of bacterial diversity during natural fermenation of sweet potato sour liquid by PCR-DGGE[J]. Food Science, 2016, 37(7): 99−103. doi: 10.7506/spkx1002-6630-201607019
[10] 吴企禾. 自然发酵甘薯酸浆细菌动态规律解析及乳酸菌絮凝性研究[D]. 沈阳:沈阳农业大学, 2017. [WU Q H. Anlysis of bacteria dynamic laws and flocculation of lactic acid bacteria in natural fermentated sweet potato sour liquid[D]. Shenyang:Shenyang Agricultural University, 2017.] WU Q H. Anlysis of bacteria dynamic laws and flocculation of lactic acid bacteria in natural fermentated sweet potato sour liquid[D]. Shenyang: Shenyang Agricultural University, 2017.
[11] 张莉力, 许云贺, 李新华. 对甘薯淀粉具有絮凝活性的乳酸菌的分离鉴定及其特性研究[J]. 食品科学,2010,31(7):228−231. [ZHANG L L, XU Y H, LI X H. Isolation, identification and characterization of lactic acid bacteria with activity to flocculate sweet potato starch[J]. Food Science,2010,31(7):228−231.] ZHANG L L, XU Y H, LI X H. Isolation, identification and characterization of lactic acid bacteria with activity to flocculate sweet potato starch[J]. Food Science, 2010, 31(7): 228−231.
[12] 李新华, 赵晓阳, 张荔力. 副干酪乳杆菌对甘薯浆液中淀粉絮凝机理研究[J]. 食品科学,2010,31(19):273−276. [Li X H, ZHAO X Y, ZHANG L L. Flocculation mechanism of sweet potato starch by addition of Lactobacillus paracasei-fermented sweet potato slurry[J]. Food Science,2010,31(19):273−276.] Li X H, ZHAO X Y, ZHANG L L. Flocculation mechanism of sweet potato starch by addition of Lactobacillus paracasei-fermented sweet potato slurry[J]. Food Science, 2010, 31(19): 273−276.
[13] 李文浩, 沈群. 酸浆法沉降淀粉机理研究现状[J]. 食品工业科技,2010,31(5):382−383,386. [LI W H, SHEN Q. Study status of mechanism of starch isolation with the acidic steeping liquor[J]. Science and Technology of Food Industry,2010,31(5):382−383,386.] LI W H, SHEN Q. Study status of mechanism of starch isolation with the acidic steeping liquor[J]. Science and Technology of Food Industry, 2010, 31(5): 382−383,386.
[14] 季子非, 王筱瑜, 田原. 一株自然发酵甘薯酸浆的促淀粉絮凝酵母菌的分离鉴定及其共凝集特性[J]. 食品工业科技,2019,40(11):147−160. [JI Z F, WANG X Y, TIAN Y, et al. Isolation of a yeast that promotes flocculation of starch by lactic acid bacteria and preliminary research on its flocculation-promoting mechanism[J]. Science and Technology of Food Industry,2019,40(11):147−160.] JI Z F, WANG X Y, TIAN Y, et al. Isolation of a yeast that promotes flocculation of starch by lactic acid bacteria and preliminary research on its flocculation-promoting mechanism[J]. Science and Technology of Food Industry, 2019, 40(11): 147−160.
[15] 刘文鼎, 曾凡逵. 酸浆法生产粉丝的工艺特点及其设备改进[J]. 农业工程技术,2016,36(23):61−64,76. [LIU W D, ZENG F K. The process characteristics and equipment improvement of vermicelli production by acid pulp method[J]. Agricultural Engineering Technology,2016,36(23):61−64,76.] LIU W D, ZENG F K. The process characteristics and equipment improvement of vermicelli production by acid pulp method[J]. Agricultural Engineering Technology, 2016, 36(23): 61−64,76.
[16] 凌代文, 东秀珍. 乳酸细菌分类鉴定及实验方法[M]. 北京:中国轻工业出版社, 1999. [LING D W, DONG X Z. Classification, identification and experimental methods of lactic acid bacteria[M]. Beijing:China Light Industry Press, 1999.] LING D W, DONG X Z. Classification, identification and experimental methods of lactic acid bacteria[M]. Beijing: China Light Industry Press, 1999.
[17] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001. [DONG X Z, CAI M Y. Manual for identification of common bacterial systems[M]. Beijing:Science Press, 2001.] DONG X Z, CAI M Y. Manual for identification of common bacterial systems[M]. Beijing: Science Press, 2001.
[18] NIE Y Y, LI W H, AL-MAQTARI Q A. Isolation, identification, and fermentation characteristics of endogenous lactic acid bacteria derived from edible mushrooms[J]. Food Science and Technology,2023,43:e129122. doi: 10.1590/fst.129122
[19] AZIZ T, SARWAR A, NAVEED M, et al. Bio-Molecular analysis of selected food derived Lactiplantibacillus strains for CLA production reveals possibly a complex mechanism[J]. Food Research International,2022,154:111031,. doi: 10.1016/j.foodres.2022.111031
[20] 张明, 顾英, 张莉力. 不同条件下副干酪乳杆菌L1絮凝甘薯淀粉的研究及酸浆的自然发酵[J]. 饲料研究,2015(18):63−69. [ZHANG M, GU Y, ZHANG L L. Flocculation of sweet potato starch by Lactobacillus paracasei L1 under different conditions Research and natural fermentation of acid pulp[J]. Feed Research,2015(18):63−69.] ZHANG M, GU Y, ZHANG L L. Flocculation of sweet potato starch by Lactobacillus paracasei L1 under different conditions Research and natural fermentation of acid pulp[J]. Feed Research, 2015(18): 63−69.
[21] 冯琳琳, 许云贺, 郭浩男, 等. 豌豆酸浆中微生物群落分析及淀粉絮凝菌分离鉴定[J]. 食品科技,2021,46(7):36−42. [FENG L L, XU Y H, GUO H N, et al. Analysis of microbial communities in pea sour pulp and isolation and identification of strain with starch flocculation characteristics[J]. Food Science and Technology,2021,46(7):36−42.] FENG L L, XU Y H, GUO H N, et al. Analysis of microbial communities in pea sour pulp and isolation and identification of strain with starch flocculation characteristics[J]. Food Science and Technology, 2021, 46(7): 36−42.
[22] GONG M H, SHAN C J, LI S J, et al. Optimization of exocytopolysaccharide production from fermented blueberry juice by complex lactic acid bacteria based on response surface method and artificial neural network[J]. Science and Technology of Food Industry,2023,44(17):242−250.
[23] 刘娇, 李源, 王佳瑶, 等. 豌豆酸浆中淀粉絮凝菌的筛选及其絮凝性质分析[J]. 食品工业,2023,44(7):130−136. [LIU J, LI Y, WANG J Y, et al. Screening and flocculating property analysis of starch flocculating bacteria in pea sour pulp[J]. The Food Industry,2023,44(7):130−136.] LIU J, LI Y, WANG J Y, et al. Screening and flocculating property analysis of starch flocculating bacteria in pea sour pulp[J]. The Food Industry, 2023, 44(7): 130−136.
[24] 曹宗巽, 卢光莹, 宋云, 等. 乳酸链球菌凝集淀粉粒机理的进一步研究[J]. 微生物学报,1980,20(3):271−275. [CAO Z X, LU G Y, SONG Y, et al. Further study on the mechanism of the agglutinating action of Streptococcus lactisin starch production[J]. Acta Microbiologica Sinica,1980,20(3):271−275.] CAO Z X, LU G Y, SONG Y, et al. Further study on the mechanism of the agglutinating action of Streptococcus lactisin starch production[J]. Acta Microbiologica Sinica, 1980, 20(3): 271−275.
[25] 王天琪, 王成, 郭浩男, 等. 绿豆酸浆微生物菌群分析比较及对淀粉有絮凝作用的乳酸菌筛选鉴定[J]. 食品科技,2021,46(6):14−19. [WANG T Q, WANG C, GUO H N, et al. Analysis and comparison of the flora in mung bean sour pulp and the screening of lactic acid bacteria with flocculation effect on starch[J]. Food Science and Technology,2021,46(6):14−19.] WANG T Q, WANG C, GUO H N, et al. Analysis and comparison of the flora in mung bean sour pulp and the screening of lactic acid bacteria with flocculation effect on starch[J]. Food Science and Technology, 2021, 46(6): 14−19.
[26] WANG X, ZHAO L, WANG Y T, et al. A new Leuconostoc citreum strain discovered in the traditional sweet potato sour liquid fermentation as a novel bioflocculant for highly efficient starch production[J]. Food Research International,2021,144:110327. doi: 10.1016/j.foodres.2021.110327
[27] 杨文鹏, 孟宇, 黄应权, 等. 植物乳杆菌在畜禽生产中的应用研究进展[J]. 饲料研究,2023,46(3):135−139. [YANG W P, MENG Y, HUANG Y Q, et al. Research progress on application of Lactobacillus plantarum in livestock and poultry production[J]. Feed Research,2023,46(3):135−139.] YANG W P, MENG Y, HUANG Y Q, et al. Research progress on application of Lactobacillus plantarum in livestock and poultry production[J]. Feed Research, 2023, 46(3): 135−139.
[28] 黄广礼. 红薯淀粉酸浆工艺加工技术[J]. 河北农业科技,2002(11):44. [HUANG G L. PROCESSING TECHNOLOGY OF SWEET POTATO STARCH ACID SLURRY[J]. HEBEI AGRICULTURAL SCIENCE AND TECHNOLOGY,2002(11):44.] HUANG G L. PROCESSING TECHNOLOGY OF SWEET POTATO STARCH ACID SLURRY[J]. HEBEI AGRICULTURAL SCIENCE AND TECHNOLOGY, 2002(11): 44.
[29] KURANE R. Microbial flocculation of waste liquids and oil emulsion by a bioflocculant 49 from Alcaligenes latus[J]. Agricultural and Biological Chemistry,1991,55(4):1127−1129.
[30] TORCHIO F, GIACOSA S, VILANOVA M, et al. Use of response surface methodology for the assessment of changes in the volatile composition of Moscato bianco (Vitis vinifera L.) grape berries during ripening[J]. Food Chemistry,2016,212:576−584. doi: 10.1016/j.foodchem.2016.05.191
[31] 黄婷婷, 白羽嘉, 冯作山, 等. 响应面结合主成分分析优化面片配方[J]. 食品工业科技,2021,42(21):197−204. [HUANG T T, BAI Y J, FENG Z S, et al. Optimization of instant dough slice formula by response surface principal component analysis[J]. Science and Technology of Food Industry,2021,42(21):197−204.] HUANG T T, BAI Y J, FENG Z S, et al. Optimization of instant dough slice formula by response surface principal component analysis[J]. Science and Technology of Food Industry, 2021, 42(21): 197−204.
[32] ZHANG L, YU Y, LI X, et al. Starch flocculation by the sweet potato sour liquid is mediated by the adhesion of lactic acid bacteria to starch[J]. Frontiers in microbiology,2017,8:1412. doi: 10.3389/fmicb.2017.01412
[33] 刘黎莹. 绿豆酸浆中高絮凝淀粉微生物的筛选及其特性研究[D]. 锦州:锦州医科大学, 2018. [LIU L Y. The screening of high flocculating starch microbiology from mung bean sour liquid and its characteristics[D]. Jinzhou:Jinzhou Medical University, 2018.] LIU L Y. The screening of high flocculating starch microbiology from mung bean sour liquid and its characteristics[D]. Jinzhou: Jinzhou Medical University, 2018.





 下载:
下载:
 下载:
下载:



