Microwave-assisted Deep Eutectic Solvent Extraction of Xinjiang Wild Prunus cerasifera Ehrh. Polysaccharides and Analysis of Its Antioxidant and Antibacterial Activities
-
摘要: 为探究新疆野生樱桃李多糖的最佳提取工艺、抗氧化及抑菌活性。以新疆霍城县大西沟的樱桃李为原材料,采用微波辅助低共熔溶剂法提取多糖,通过单因素实验和响应面法优化确定最佳提取工艺,再对其进行脱脂、脱色、除蛋白等得到粗多糖(PCE),最后通过体外抗氧化和抑菌实验进行功效评价。结果表明:当苹果酸与氯化胆碱的摩尔比例为4:1、微波功率400 W、微波温度60 ℃、微波时间70 min、液料比30:1 mL/g、DES浓度50%时,PCE得率最高值为26.38%±0.73%;PCE对清除DPPH自由基、ABTS+自由基和羟基自由基的IC50分别为1.163、0.506、2.958 mg/mL,PCE在质量浓度为4 mg/mL时总还原能力值为0.667。质量浓度为200 mg/mL的PCE对白色念珠菌、大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌均有较好的抑制作用,平均抑菌圈直径分别为23.45±1.88、16.12±0.47、17.68±1.32、17.20±1.18、12.00±0.72 mm,具有较好的体外抗氧化和抑菌能力。研究结果可为以樱桃李多糖为功能性产品的开发利用提供理论参考。Abstract: In this study, we determined the optimal process for extracting polysaccharides from wild Prunus cerasifera Ehrh. sourced from Xinjiang, and analyzed their antioxidant and antibacterial activities. Using Prunus cerasifera Ehrh. obtained from Daxigou, Huocheng County, Xinjiang, was used as raw materials, polysaccharides were extracted through a microwave-assisted deep eutectic solvent method. The optimal extraction parameters were established via single-factor experiments and response surface methodology optimization, including degreasing, decolorization, and protein removal. Crude polysaccharide extract (PCE) was obtained, whose efficacy was subsequently evaluated through in vitro antioxidant and antibacterial assays. The results revealed that the highest yield of PCE (26.38%±0.73%) was obtained under the following conditions: A malic acid to choline chloride molar ratio of 4:1. Microwave power, temperature, and duration of 400 W, 60 ℃, and 70 min, a liquid-to-material ratio of 30:1 (mL/g), and a deep eutectic solvent concentration of 50%. The IC50 values for PCE in scavenging DPPH, ABTS+, and hydroxyl free radicals were 1.163, 0.506, and 2.958 mg/mL, respectively. At a mass concentration of 4 mg/mL, PCE exhibited a total reducing capacity of 0.667. Furthermore, the PCE had significant inhibitory effects against Candida albicans, Escherichia coli, Staphylococcus aureus, Bacillus subtilis, and Pseudomonas aeruginosa at a mass concentration of 200 mg/mL, with average inhibition zone diameters of 23.45±1.88, 16.12±0.47, 17.68±1.32, 17.20±1.18, and 12.00±0.72 mm, respectively. These findings indicate the promising in vitro antioxidant and antibacterial properties of cherry plum polysaccharides and provide a theoretical foundation for their development and utilization as functional products.
-
Keywords:
- Prunus cerasifera Ehrh. /
- polysaccharide /
- extraction process /
- antioxidation /
- antibacterial
-
新疆野生樱桃李(Prunus cerasifera Ehrh.)俗称“野酸梅”,属蔷薇科,李属,集中分布于新疆霍城县的大西沟和小西沟,具有极高的种源保护价值[1]。以其形态独特,口感鲜美,营养价值丰富和珍稀性而闻名。多糖为野生樱桃李中含有的一种重要的活性成分,有着多种重要的生物活性,主要起到免疫调节[2]、抗肿瘤[3]、抗氧化[4]、降血糖[5]、保护肝脏[6]等药理作用。目前对野生樱桃李的研究主要集中在黄酮和多酚的成分上,在活性分析方面主要集中在抗氧化和降血糖等方面,对其多糖的抑菌活性还尚未被研究[7−9]。
提取多糖的方法包括利用不同溶剂特性的水提法、酸提法和碱提法,以及利用物理效应增强提取效率的超声波辅助提取法和微波辅助提取法等[10]。其中微波辅助提取法能够有效地破坏细胞壁结构,提高多糖分子的溶出效率[11]。低共熔溶剂(deep eutectic solvent,DES)是一种通过特定比例的氢键受体(Hydrogen bonded acceptor,HBA)和氢键供体(Hydrogen bond donor,HBD)混合,并经过加热处理后形成的低熔点、粘稠且透明的液体,具有生产成本低、合成方法简单、无毒无害、易降解等优点是一种新兴的绿色溶剂,被广泛应用于天然产物的提取中[12−14]。目前对于樱桃李多糖的提取工艺仅有传统的超声辅助提取法[15],对于微波辅助低共熔溶剂提取法在野生樱桃李多糖提取中的应用还尚未被报道[16−17]。
本研究通过微波辅助低共熔溶剂法优化提取工艺对樱桃李的多糖进行提取,并对其抗氧化活性和抑菌活性进行分析,为樱桃李在食品药品开发领域提供理论依据。
1. 材料与方法
1.1 材料与仪器
樱桃李 采于新疆霍城县大西沟;金黄色葡萄球菌、大肠埃希氏菌、白色念珠菌、枯草芽孢杆菌、铜绿假单胞菌菌种 购于广东环凯微生物科技有限公司;葡萄糖、无水乙醇、苯酚、氯化胆碱、苹果酸、草酸、乳酸、甘油、乙二醇(分析纯) 天津市科密欧化学试剂有限公司;三氯乙酸、硫酸亚铁(FeSO4)、1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二胺盐(ABTS)、铁氰化钾 均为分析纯,福州飞净生物科技有限公司;浓硫酸(分析纯) 国药集团化学试剂有限公司;LB培养基、PDA培养基 海博生物科技有限公司;抗坏血酸(VC) 福晨化学试剂有限公司。
MB-580酶标仪 上海闪谱生物科技有限公司;RE-2000A旋转蒸发仪 上海亚荣生化仪器公司;TGL-16 C高速台式离心机 上海安亭科学仪器有限公司;UV-2550紫外分光光度计 上海赫尔普国际贸易有限公司;WIGGENS加热磁力搅拌机 德州市高通实验仪器有限公司;XH-300A祥鹄电脑微波超声波组合合成/萃取仪 北京祥鹄科技发展有限公司;ICS-1600高效液相色谱仪 美国DNEX公司;高压灭菌锅 樱美迪生物科技有限公司。
1.2 实验方法
1.2.1 低共熔溶剂的制备
参考陈炯朝等[18]的方法并稍作修改,分别称取适量的HBA(氯化胆碱)与一定量的HBD(草酸、苹果酸、乳酸、甘油、乙二醇)混合配制成DES,在相同的摩尔比例条件下考察其对樱桃李多糖得率的影响,从中选取多糖得率最大的DES。设置HBD与HBA摩尔比1:1、2:1、3:1、4:1、5:1,找到最合适的摩尔比。按照一定的摩尔比例配制DES置于锥形瓶中,加热至90 ℃后在加热磁力搅拌机上不断搅拌成稳定的透明液体,作为浓度100%的DES溶液,再加入蒸馏水将DES稀释成不同浓度,放于4 ℃冰箱冷藏备用。
1.2.2 樱桃李的预处理
将野生樱桃李自然风干晾晒成干,用粉碎机将其粉碎过40目筛,将樱桃李粉末用石油醚于索氏萃取器中脱脂20 h,后经95%乙醇脱色24 h,并在通风橱中干燥过夜,得到脱脂、脱色素后的樱桃李粉末装瓶备用[15]。
1.2.3 樱桃李粗多糖的提取、纯化工艺
称取5 g樱桃李粉末,按照不同液料比分别加入不同浓度的DES溶液,于微波功率400 W下,设定一定的温度与时间,提取后通过高速台式离心机4000 r/min离心5 min,收取上清液重复三次,将三次的浸提液放入旋转蒸发仪中蒸发浓缩,在浓缩液中加入7%、2 mol/L三氯乙酸除蛋白,通过高速冷冻离心机4000 r/min离心5 min,去除沉淀取上清液,用三倍体积的无水乙醇进行醇沉,于4 ℃保存过夜,将醇沉的沉淀溶解后放入透析袋中透析48 h(透析袋截留分子量3000 Da),放入冷冻干燥机中冷冻干燥得到樱桃李粗纯化的多糖,命名为PCE[19]。
1.2.4 樱桃李粗多糖的提取工艺单因素实验
以PCE的得率为指标,分别选取微波时间、液料比、微波温度、DES浓度四个因素进行单因素实验。设定固定因素水平为:微波功率400 W;微波温度60 ℃;微波时间60 min;料液比40:1 mL/g;DES浓度50%。依次考察微波温度(40、50、60、70、80 ℃)、微波时间(40、50、60、70、80 min)、液料比(20:1、30:1、40:1、50:1、60:1 mL/g)、DES浓度(30%、40%、50%、60%、70%)对多糖得率的影响。
1.2.5 樱桃李粗多糖的提取工艺响应面优化试验
根据单因素试验的结果,以温度(A)、时间(B)、液料比(C)、DES浓度(D)四个因素做响应因素,以多糖得率为响应值,利用响应面中的Box-Behnken法设计四因素三水平,响应面实验因素与水平见表1。
表 1 响应面试验因素与水平Table 1. Factors and levels of response surface methodology水平 因素 A温度(℃) B时间(min) C液料比(mL/g) D DES浓度(%) −1 50 60 20 40 0 60 70 30 50 1 70 80 40 60 1.2.6 樱桃李多糖得率的测定
参考赵丛丛等[20]的方法稍加修改绘制葡萄糖标准曲线。取10 mg葡萄糖标准品放入100 mL容量瓶中定容,配制0.1 mg/mL葡萄糖标准溶液,分别取葡萄糖标准溶液0、0.2、0.4、0.6、0.8、1.0 mL于试管中加蒸馏水至1 mL,再加入1 mL 6%苯酚溶液和5.0 mL浓硫酸,振荡混匀,放于水浴锅中沸水水浴25 min后冷却至室温,用酶标仪于490 nm处测吸光度。以葡萄糖浓度(mg/mL,x)为横坐标,吸光度(y)为纵坐标绘制标准曲线,y=0.6676x+0.0802(R2=0.9997)。多糖得率按照公式(1)进行计算:
Y(%)=C×V×nm×100 (1) 式中:C:根据吸光值计算得到的樱桃李多糖的质量浓度,%;V:樱桃李多糖提取液的总体积,mL;m:称取的樱桃李粉末质量,mg;n:稀释倍数。
1.2.7 樱桃李多糖的抗氧化活性测定
1.2.7.1 DPPH自由基清除力测定
将不同浓度的PCE溶液(0.125、0.25、0.5、1.0、2.0 mg/mL)和0.2 mmol/L DPPH-无水乙醇溶液按照等体积比充分混匀,在室温下避光反应30 min,反应结束后转移至96孔板上,于517 nm波长处测定吸光度[21]。VC作为阳性对照。计算公式为:
DPPH自由基清除率(%)=(1−A1−A2A0)×100 (2) 式中:A0:空白对照的吸光度;A1:样品组的吸光度;A2:无DPPH的样品液的吸光度。
1.2.7.2 ABTS+自由基清除力测定
取1 mL不同浓度(0.125、0.25、0.5、1.0、2.0 mg/mL)PCE溶液与1 mL蒸馏水和2 mL ABTS供试液混合,充分混匀后室温避光10 min于734 nm处测定吸光度[22]。VC作为阳性对照。计算公式为:
ABTS+自由基清除率(%)=(1−A1−A2A0)×100 (3) 式中:A0:空白对照的吸光度;A1:样品组的吸光度;A2:无ABTS的样品液的吸光度。
1.2.7.3 羟基自由基清除力测定
取1 mL不同浓度(0.25、0.5、1.0、2.0、4.0 mg/mL)PCE溶液,加入1.0 mL的FeSO4(6 mmol/L),1 mL的水杨酸-乙醇溶液(mmol/L),加入1 mL的H2O2启动反应,在37 ℃条件下保温40 min,以超纯水为参比,在510 nm波长处测定吸光度[23]。VC作为阳性对照。计算公式为:
羟基自由基清除率(%)=(1−A1−A2A0)×100 (4) 式中:A0:空白对照的吸光度;A1:样品组的吸光度;A2:无H2O2样品液的吸光度。
1.2.7.4 总还原能力的测定
取1 mL不同浓度(0.25、0.5、1.0、2.0、4.0 mg/mL)PCE溶液,依次加入1 mL的磷酸盐缓冲液(0.2 mol/L、pH6.6),再加入1 mL铁氰化钾充分混合后,置于50 ℃烘箱中加热20 min后加入1 mL三氯乙酸溶液(10%),混合均匀,离心10 min(3000 r/min),取上清液,依次加入1 mL蒸馏水、0.2 mL三氯化铁溶液(1%),室温静置20 min后,采用酶标仪测定其在700 nm处的吸光度[24]。VC作为阳性对照。
1.2.8 樱桃李多糖的抑菌能力测定
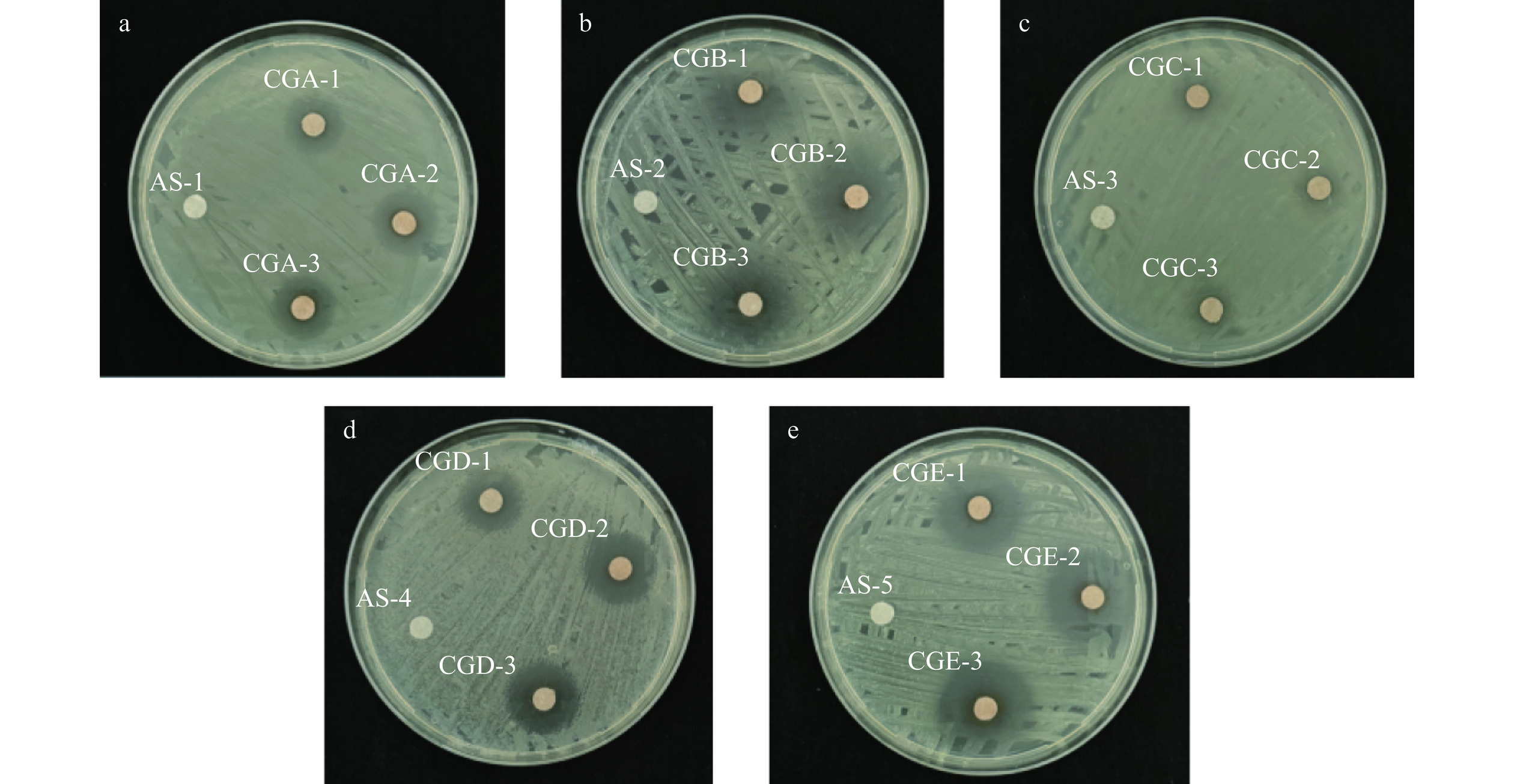
使用KB法测定PCE的抑菌能力,将大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌接入LB液体培养基中于37 ℃震荡培养24 h,将白色念珠菌接入PDA培养基中28 ℃培养48 h[25]。将少量菌液加入无菌水中进行稀释,用血球计数板计数,配制成含菌量为107 cfu/mL的菌液。称取200 mg的PCE,配制成200 mg/mL的多糖溶液,将无菌滤纸片浸泡于配制好的多糖溶液中晾干备用,用无菌棉签蘸取菌液均匀涂在平板上,再将晾干的滤纸片等间距放置于平板上,重复三次分别记为(CG-1、CG-2、CG-3),用无菌水作对照组分别记为(AS-1、AS-2、AS-3、AS-4、AS-5),放置于4 ℃冰箱中扩散2 h后于37 ℃培养12 h[26];其中大肠杆菌的对照组和3个试验组分别记为AS-1、CGA-1、CGA-2、CGA-3,金黄色葡萄球菌的对照组和3个试验组分别记为AS-2、CGB-1、CGB-2、CGB-3,铜绿假单胞菌的对照组和3个试验组分别记为AS-3、CGC-1、CGC-2、CGC-3,枯草芽孢杆菌的对照组和3个试验组分别记为AS-4、CGD-1、CGD-2、CGD-3,白色念珠菌的对照组和3个试验组分别记为AS-5、CGE-1、CGE-2、CGE-3。
1.3 数据处理
以上所有实验均重复三次,所得数据采用均数±标准差表示;运用Origin2022软件绘图;运用Design-Expert(10.0)软件进行响应面的实验设计;通过T检验,确认差异的显著性,P<0.01表示差异极显著,P<0.05表示差异显著;运用IBM SPSS Statistics 26软件对数据进行单因素方差分析;运用Graphpad prism 9软件计算半数抑制浓度IC50值。
2. 结果与分析
2.1 单因素实验结果
2.1.1 DES体系的选择
不同DES体系和不同摩尔比对多糖得率的影响如图1所示。由图1A可看出,其中以苹果酸作为HBD的多糖得率最高,这是由于其富含的羟基基团能更有效地形成氢键,促进溶剂与多糖分子的相互作用从而提高了多糖得率。由图1B可看出,随着HBD与HBA的摩尔比增加多糖得率有所增加并于4:1处达到了最高值(P<0.05),这是由于羧基释放较多的游离H+,加速了细胞壁的破坏,使多糖更易被提取出来,当HBD与HBA的摩尔比达到5:1时由于过量的HBD导致多糖发生降解,使得多糖得率有所下降[18]。故本文采用苹果酸为HBD,苹果酸与氯化胆碱的摩尔比为4:1进行后续实验。
2.1.2 微波温度的选择
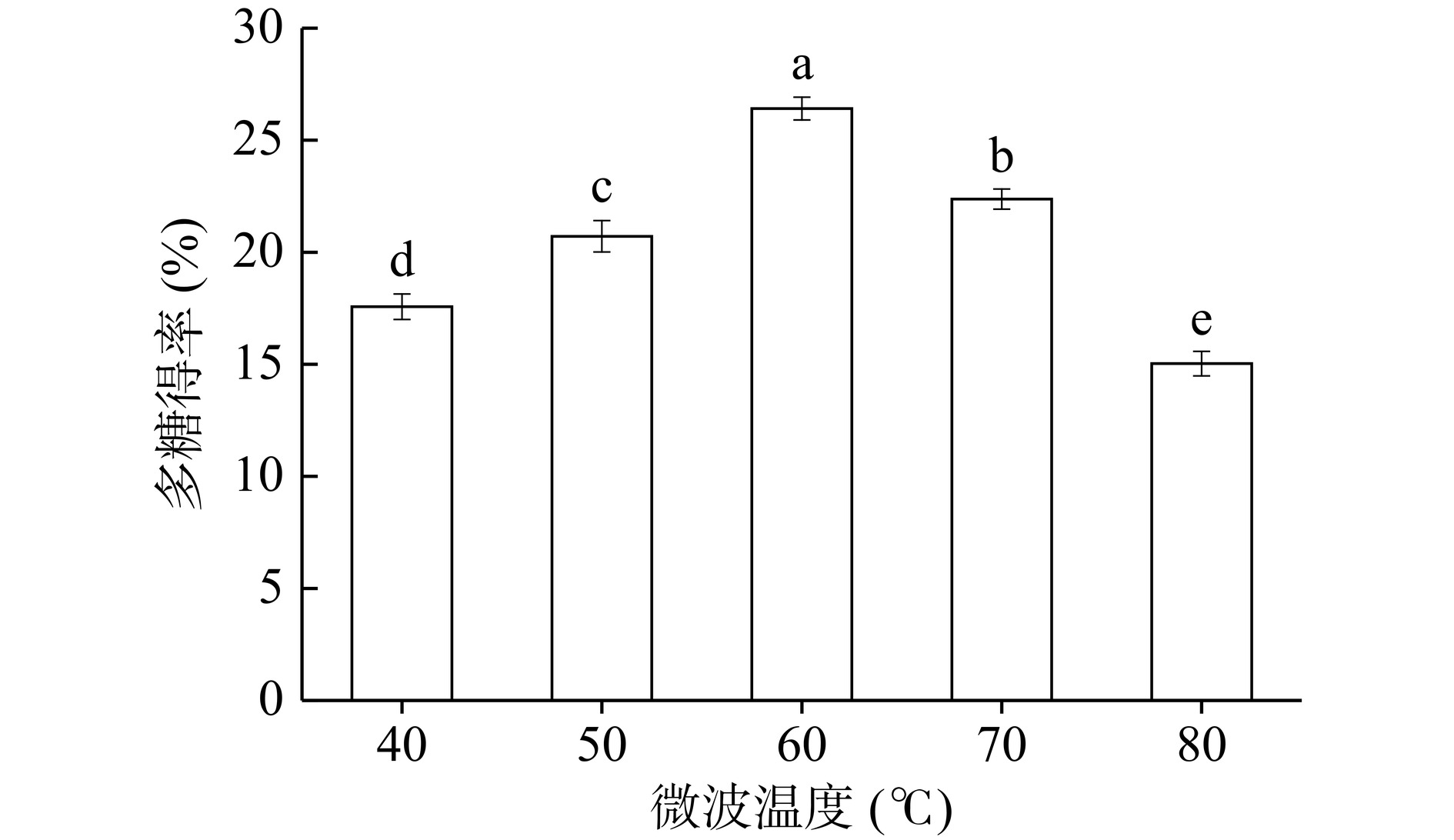
不同微波温度对多糖得率如图2所示,当微波温度逐渐升高时多糖得率显著增加(P<0.05),这说明温度升高加快了分子间的热运动,使多糖可以充分的提取到溶液中,当温度升高至60 ℃的时候,得率达到最高值,随后逐渐下降,这可能是由于温度过高导致糖苷键断裂,从而破坏多糖的完整结构,从而降低了多糖的得率[27]。因此选择微波温度为50、60、70℃作为PCE提取条件。
2.1.3 微波时间的选择
不同提取时间对多糖得率影响如图3所示,随着时间的增加多糖得率显著增加(P<0.05),于70 min达到了最高值,这可能是由于微波时间过短,多糖分子没有完全从原料中释放出来,从而导致提取率较低。时间大于70 min后,多糖得率呈显著下降趋势(P<0.05),这可能是由于微波时间过长会导致低共熔溶剂粘度发生改变从而影响多糖的得率[28]。因此选择微波时间为60、70、80 min作为PCE最佳提取条件。
2.1.4 液料比的选择
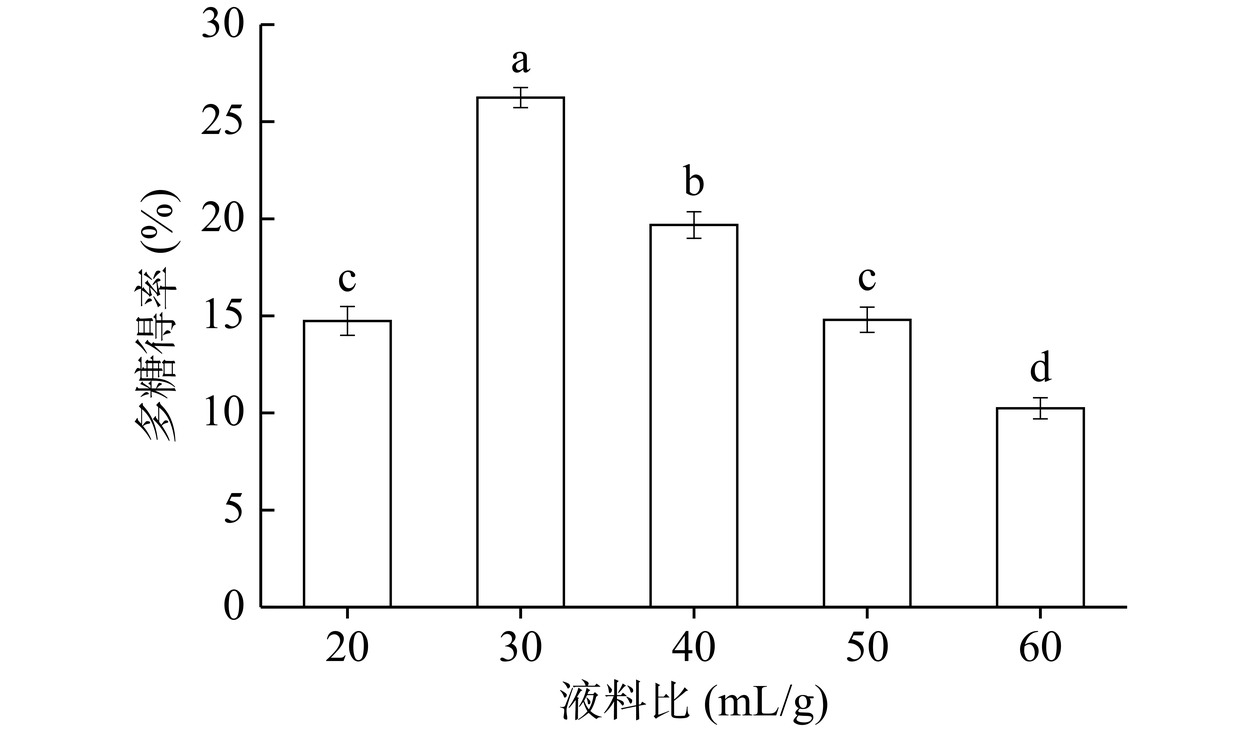
不同液料比对多糖得率影响如图4所示,多糖得率随着料液比的增加呈现先上升后下降的趋势(P<0.05),并且在30:1 mL/g时达到最高值,这可能是由于当液料比过低时,溶剂的用量相对较少,不足以充分浸润和渗透原料,导致多糖无法有效地从原料中释放出来。限制了多糖与溶剂的接触面积和接触时间,进而降低了多糖得率,液料比过高多糖尽可能游离到溶液中,但过多的溶剂量会导致多糖在溶液中的浓度降低,从而降低了多糖得率[29]。因此选择液料比为20:1、30:1、40:1 mL/g作为PCE最佳提取条件。
2.1.5 DES浓度的选择
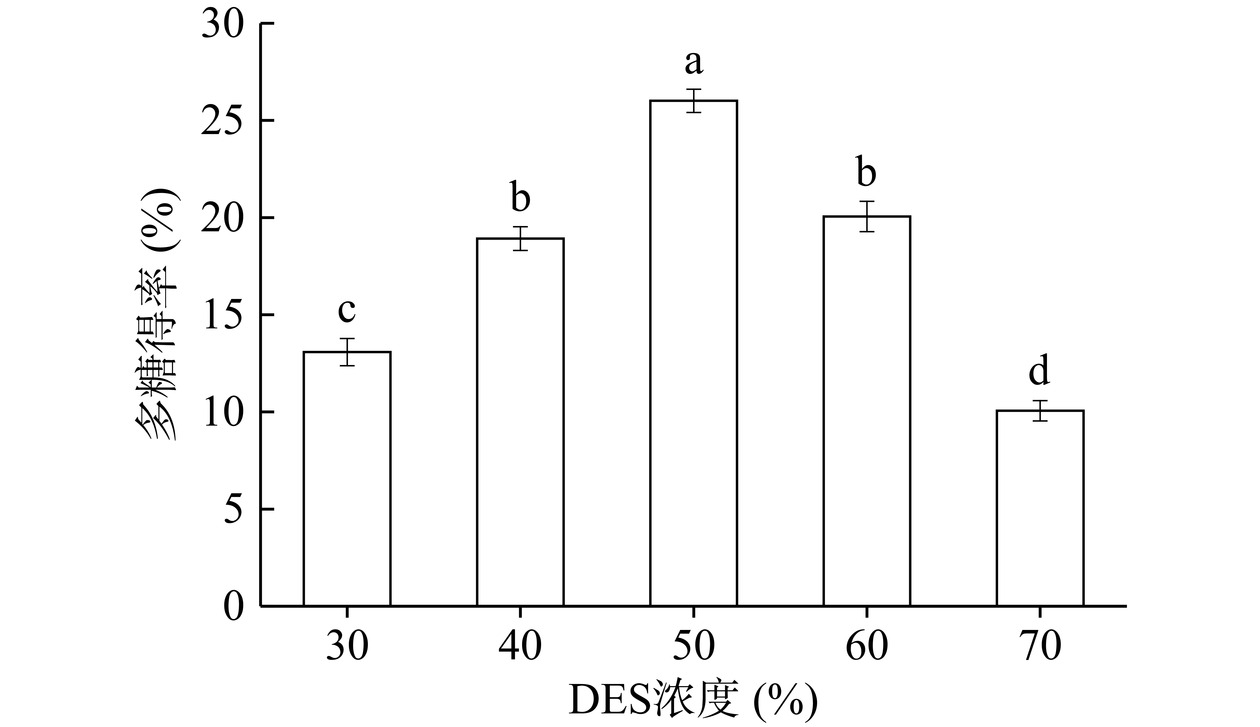
不同DES浓度对多糖得率影响如图5所示,随着DES浓度的增加多糖得率显著增加直到50%达到最高值随后开始下降(P<0.05),这可能是由于低浓度的DES无法提供足够的溶解能力来有效破坏多糖与原料基质间的相互作用力,导致多糖不能充分从原料中释放出来从而降低多糖得率,而高浓度的DES溶液通常具有较高的黏度,这会影响溶剂在原料中的渗透和扩散能力。多糖分子需要穿过溶剂层才能被提取出来,而高黏度的溶剂会阻碍这一过程,降低多糖得率[30]。因此选择DES浓度为40%、50%、60%作为PCE提取条件。
2.2 响应面法优化工艺
2.2.1 响应面法优化试验设计
在单因素实验的基础上,以多糖得率为指标,采用Design-Expert(10.0)软件Box-Benhnken法进行试验设计,确定微波辅助低共熔溶剂法提取多糖的工艺参数,结果见表2。对表2试验数据进行二次多项回归拟合,获得多糖得率对微波温度(A)、微波时间(B)、液料比(C)、DES浓度(D)的多元回归方程为:
表 2 响应面试验设计及结果Table 2. Response surface experimental design and results试验号 A温度 B时间 C液料比 D DES浓度 多糖得率(%) 1 1 0 0 −1 22.79 2 −1 −1 0 0 22.33 3 0 −1 1 0 23.37 4 0 −1 −1 0 22.17 5 0 0 0 0 26.36 6 0 0 0 0 25.79 7 0 −1 0 −1 20.24 8 0 0 −1 1 23.25 9 0 1 0 −1 23.67 10 −1 0 1 0 23.69 11 0 0 1 1 23.75 12 0 0 −1 −1 22.09 13 1 0 1 0 24.25 14 0 0 1 −1 23.18 15 −1 1 0 0 23.62 16 0 1 −1 0 23.64 17 −1 0 −1 0 22.51 18 0 0 0 0 26.62 19 1 0 −1 0 23.37 20 −1 0 0 1 23.75 21 1 −1 0 0 23.12 22 0 0 0 0 26.40 23 −1 0 0 −1 20.09 24 0 1 0 1 23.08 25 1 0 0 1 23.96 26 0 −1 0 1 23.01 27 0 0 0 0 26.08 28 0 1 1 0 23.86 29 1 1 0 0 24.40 Y=26.25+0.4917A+0.6692B+0.4225C+0.7283D−0.0025AB−0.075AC−0.6225AD−0.245BC−0.84BD−0.1475CD−1.44A2−1.61B2−1.28C2−2.07D2。
2.2.2 回归模型的方差分析
该模型的方差分析结果见表3,模型的F=23.40(P<0.0001)为极显著模型,失拟项的P=0.2111>0.05,差异不显著,说明无明显失拟因素存在,该模型可以很好的代表试验的真实情况。其中R2=0.9676,Radj2=0.9351,说明该模型拟合程度良好,可以用于预测PCE的多糖得率。试验中的微波温度(A)、微波时间(B)、液料比(C)、DES浓度(D)皆为极显著(P<0.01),由F值可知,4个因素对多糖得率影响顺序为:DES浓度>微波时间>微波温度>液料比。方差分析可知,A2、B2、C2、D2均为极显著(P<0.01),AB、AC、BC、CD之间的交互作用不显著(P>0.05),BD交互作用极显著(P<0.01),AD交互作用显著(P<0.05)。
表 3 响应面试验设计及结果Table 3. Analysis of variance for the regression model方差来源 平方和 自由度 均方 F值 P值 显著性 模型 66.64 14 4.76 23.40 <0.0001 ** A 2.90 1 2.90 14.26 0.0020 ** B 5.37 1 5.37 26.42 0.0002 ** C 2.14 1 2.14 10.53 0.0059 ** D 6.37 1 6.37 31.29 <0.0001 ** AB 0.0000 1 0.0000 0.0001 0.9913 # AC 0.0225 1 0.0225 0.1106 0.7444 # AD 1.55 1 1.55 7.62 0.0153 * BC 0.2401 1 0.2401 1.18 0.2956 # BD 2.82 1 2.82 13.88 0.0023 ** CD 0.0870 1 0.0870 0.4278 0.5237 # A2 13.44 1 13.44 66.09 <0.0001 ** B2 16.83 1 16.83 82.75 <0.0001 ** C2 10.68 1 10.68 52.52 <0.0001 ** D2 27.72 1 27.72 136.26 <0.0001 ** 残差误差 2.85 14 0.2034 失拟项 2.44 10 0.2436 2.36 0.2111 # 纯误差 0.4120 4 0.1030 总和 69.49 28 R2=0.9590 RAdj2=0. 0.9180 注:“*”表示差异显著(0.01<P<0.05);“**”表示差异极显著(P<0.01);“#”表示差异不显著(P>0.05)。 2.2.3 各因素交互作用的响应面分析
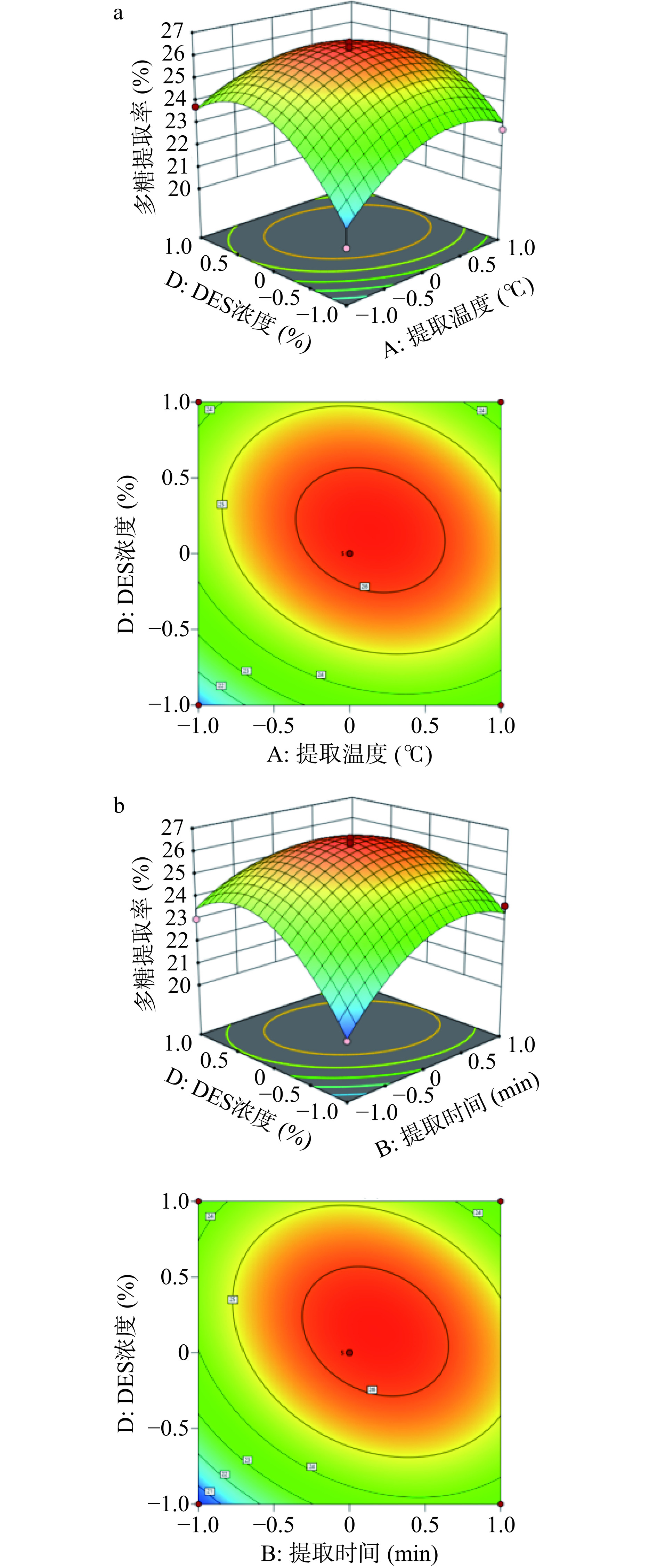
各因素间的响应面曲面图和等高线图如图6所示,3D图的曲线越陡峭表示相应因素对多糖得率影响越大,等高线图越趋近于椭圆形表示相应因素对多糖得率影响越大[19]。由图6a可知AD的3D图的曲线陡峭同时等高线图的形状趋近于椭圆形说明交互作用显著(P<0.05);由图6b可知BD的3D极陡峭同时等高线图呈椭圆形说明交互作用极显著(P<0.01),这与回归模型方差分析结果相吻合。
2.2.4 最佳工艺条件的验证实验结果
由Design-Expert(10.0)软件优化后的最佳工艺条件为微波功率400 W,微波温度60.142 ℃、微波时间70.16 min、液料比30.13:1 mL/g、DES浓度50.12%,多糖得率理论最高值为26.41%。为验证模型的准确性,将参数调整为:微波温度60 ℃、微波时间70 min、液料比30:1 mL/g、DES浓度50%,按照优化后的提取工艺条件下进行三次验证实验后测得多糖得率的平均值是26.38%±0.73%,与理论值相近,说明该模型具有一定的参考价值。对比沈静等运用超声法提取樱桃李多糖,微波辅助低共熔溶剂的多糖得率为超声提取法(7.20%)的3.6倍[15]。
2.3 PCE的生物活性分析
2.3.1 PCE的抗氧化活性分析
多糖类化合物因具备显著的抗氧化特性,成为当今科学研究的热点。它们的抗氧化作用主要通过清除自由基来表现,有助于延缓衰老和维护健康。测定DPPH自由基清除率、ABTS+自由基清除率、羟基自由基清除率和总还原能力是最常用的测定多糖抗氧化能力的方法,清除率越高说明其抗氧化能力越强[31]。如图7a、图7c可知,PCE对DPPH自由基和羟基自由基的清除率与浓度均呈显著正相关,IC50分别为1.163 mg/mL和2.958 mg/mL,VC的IC50分别为0.241 mg/mL和0.221 mg/mL,说明PCE对DPPH自由基和羟基自由基均具有一定的抗氧化能力但低于VC。图7b显示,PCE对ABTS+自由基的清除率接近VC的清除率,并且其IC50为0.506 mg/mL,VC的IC50为0.283 mg/mL,说明PCE对ABTS+自由基较好的抗氧化能力与VC相接近。如图7d所示,VC和PCE的还原能力随着多糖浓度增加而增加最终达到0.667,说明PCE具有良好的还原能力。这可能是由于多糖可以通过提供电子或供氢来中和自由基,从而防止自由基引发的连锁氧化反应,多糖中的一些官能团可以与金属离子形成螯合物,减少金属离子催化的氧化反应导致[24]。综上所述,PCE有较强的抗氧化活性,这有助于保护机体减少自由基引起的氧化损伤。
2.3.2 PCE的抑菌活性分析
植物多糖能够直接破坏或抑制细菌生长,不同种类的多糖针对多种细菌和真菌表现出特定的抑制效果[32−33],有研究表明,从青柳叶中提取的木质多糖对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌具有抗菌活性[34]。PCE对不同菌种的抑菌效果如图8所示,其中滴加无菌水的对照组均没有明显抑菌圈(AS-1、AS-2、AS-3、AS-4、AS-5),而实验组均有明显抑菌圈,由表4可知,PCE对大肠杆菌的抑菌圈直径为16.12±0.47 mm,对金黄色葡萄球菌的抑菌圈直径为17.68±1.32 mm,对铜绿假单胞菌的抑菌圈直径为12.00±0.72 mm,对枯草芽孢杆菌的抑菌圈直径为17.20±1.18 mm,对白色念珠菌的抑菌圈直径为23.45±1.88 mm,依据抑菌结果评价标准[35],可知PCE对白色念珠菌的抑制效果最好,达到了极敏感,而对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌的抑制效果均为高敏感,对铜绿假单胞菌相比其他菌较弱但也达到了中敏感。综上所述,PCE具有较强的抑菌能力,可为后续其在天然耐菌药物开发方面提供基础数据。
表 4 不同处理方式的PCE抑菌圈大小比较Table 4. Zones of inhibition (mm) for different concentrations of PCE treatment (mm)菌种 对照组AS 实验组 大肠杆菌 0.00 16.12±0.47 金黄色葡萄球菌 0.00 17.68±1.32 铜绿假单胞菌 0.00 12.00±0.72 枯草芽孢杆菌 0.00 17.20±1.18 白色念珠菌 0.00 23.45±1.88 3. 结论
本研究使用微波辅助低共熔溶剂法对野生樱桃李多糖进行提取,通过单因素与响应面试验找到最佳提取工艺条件,得到微波功率400 W、微波温度60 ℃、微波时间70 min、液料比30:1 mL/g、DES浓度50%,此工艺条件多糖得率最高值为26.384%。后经过脱脂、脱色素、除蛋白、透析等步骤最终得到粗纯化多糖PCE。PCE清除DPPH自由基、ABTS+自由基和羟基自由基的IC50分别为1.163、0.506、2.958 mg/mL,PCE在质量浓度为4 mg/mL时总还原能力值为0.667,说明PCE具有较好的抗氧化能力。同时PCE对白色念珠菌、大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌有较好的抑制作用,这表明PCE具有较好的体外抗氧化和抑菌能力。本研究试验数据为以后利用樱桃李多糖生产食品与药品方面提供理论依据。
-
表 1 响应面试验因素与水平
Table 1 Factors and levels of response surface methodology
水平 因素 A温度(℃) B时间(min) C液料比(mL/g) D DES浓度(%) −1 50 60 20 40 0 60 70 30 50 1 70 80 40 60 表 2 响应面试验设计及结果
Table 2 Response surface experimental design and results
试验号 A温度 B时间 C液料比 D DES浓度 多糖得率(%) 1 1 0 0 −1 22.79 2 −1 −1 0 0 22.33 3 0 −1 1 0 23.37 4 0 −1 −1 0 22.17 5 0 0 0 0 26.36 6 0 0 0 0 25.79 7 0 −1 0 −1 20.24 8 0 0 −1 1 23.25 9 0 1 0 −1 23.67 10 −1 0 1 0 23.69 11 0 0 1 1 23.75 12 0 0 −1 −1 22.09 13 1 0 1 0 24.25 14 0 0 1 −1 23.18 15 −1 1 0 0 23.62 16 0 1 −1 0 23.64 17 −1 0 −1 0 22.51 18 0 0 0 0 26.62 19 1 0 −1 0 23.37 20 −1 0 0 1 23.75 21 1 −1 0 0 23.12 22 0 0 0 0 26.40 23 −1 0 0 −1 20.09 24 0 1 0 1 23.08 25 1 0 0 1 23.96 26 0 −1 0 1 23.01 27 0 0 0 0 26.08 28 0 1 1 0 23.86 29 1 1 0 0 24.40 表 3 响应面试验设计及结果
Table 3 Analysis of variance for the regression model
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 66.64 14 4.76 23.40 <0.0001 ** A 2.90 1 2.90 14.26 0.0020 ** B 5.37 1 5.37 26.42 0.0002 ** C 2.14 1 2.14 10.53 0.0059 ** D 6.37 1 6.37 31.29 <0.0001 ** AB 0.0000 1 0.0000 0.0001 0.9913 # AC 0.0225 1 0.0225 0.1106 0.7444 # AD 1.55 1 1.55 7.62 0.0153 * BC 0.2401 1 0.2401 1.18 0.2956 # BD 2.82 1 2.82 13.88 0.0023 ** CD 0.0870 1 0.0870 0.4278 0.5237 # A2 13.44 1 13.44 66.09 <0.0001 ** B2 16.83 1 16.83 82.75 <0.0001 ** C2 10.68 1 10.68 52.52 <0.0001 ** D2 27.72 1 27.72 136.26 <0.0001 ** 残差误差 2.85 14 0.2034 失拟项 2.44 10 0.2436 2.36 0.2111 # 纯误差 0.4120 4 0.1030 总和 69.49 28 R2=0.9590 RAdj2=0. 0.9180 注:“*”表示差异显著(0.01<P<0.05);“**”表示差异极显著(P<0.01);“#”表示差异不显著(P>0.05)。 表 4 不同处理方式的PCE抑菌圈大小比较
Table 4 Zones of inhibition (mm) for different concentrations of PCE treatment (mm)
菌种 对照组AS 实验组 大肠杆菌 0.00 16.12±0.47 金黄色葡萄球菌 0.00 17.68±1.32 铜绿假单胞菌 0.00 12.00±0.72 枯草芽孢杆菌 0.00 17.20±1.18 白色念珠菌 0.00 23.45±1.88 -
[1] 刘影, 张相锋, 赵玉, 等. 新疆濒危野生樱桃李的种群结构与动态[J]. 生态学杂志,2013,32(7):1762−1769. [LIU Y, ZHANG X F, ZHAO Y, et al. Population structure and its dynamics of wild Prunus divaricata in Xinjiang, northwest China[J]. Chin J Ecol,2013,32(7):1762−1769.] LIU Y, ZHANG X F, ZHAO Y, et al. Population structure and its dynamics of wild Prunus divaricata in Xinjiang, northwest China[J]. Chin J Ecol, 2013, 32(7): 1762−1769.
[2] ZHAO Z H, JU X Y, WANG K W, et al. Structure characterization, antioxidant and immunomodulatory activities of polysaccharide from Pteridium aquilinum (L.) Kuhn[J]. Foods,2022,11(13):1834. doi: 10.3390/foods11131834
[3] GONG P, WANG M, GUO Y, et al. Structure characterization, in vitro antioxidant and anti-tumor activity of sulfated polysaccharide from Siraitia grosvenorii[J]. Foods,2023,12(11):2133. doi: 10.3390/foods12112133
[4] CHEN B. Optimization of extraction of Tremella fuciformis polysaccharides and its antioxidant and antitumour activities in vitro[J]. Carbohydrate Polymers,2010,81(2):420−424. doi: 10.1016/j.carbpol.2010.02.039
[5] 李成华, 秦汝兰, 关颖丽, 等. 超声-微波辅助提取酸浆宿萼多糖及其体外降糖活性[J]. 食品研究与开发,2023,44(14):93−98. [LI C H, QIN R L, GUAN Y L, et al. Ultrasonic-microwave assisted extraction of polysaccharide from calyx of Physali alkekengi L. and its hypoglycemic activity[J]. Food Research and Development,2023,44(14):93−98.] LI C H, QIN R L, GUAN Y L, et al. Ultrasonic-microwave assisted extraction of polysaccharide from calyx of Physali alkekengi L. and its hypoglycemic activity[J]. Food Research and Development, 2023, 44(14): 93−98.
[6] LI C, FENG Y, LI J, et al. Extraction, purification, structural characterization, and hepatoprotective effect of the polysaccharide from purple sweet potato[J]. Journal of the Science of Food and Agriculture,2023,103(4):2196−2206. doi: 10.1002/jsfa.12239
[7] 张静茹, 孙海龙, 陆致成, 等. 野生樱桃李(Prunus cerasifera)果实多酚多样性分析[J]. 果树学报,2017,34(5):567−575. [ZHANG J R, SUN H L, LU Z C, et al. Diversity analysis of phenolic in wild myrobalan plums (Prunus cerasifera)[J]. Journal of Fruit Science,2017,34(5):567−575.] ZHANG J R, SUN H L, LU Z C, et al. Diversity analysis of phenolic in wild myrobalan plums (Prunus cerasifera)[J]. Journal of Fruit Science, 2017, 34(5): 567−575.
[8] 刘伟, 李紫薇, 王航, 等. 新疆野生樱桃李(Prunus cerasifera)叶黄酮类成分研究[J]. 现代食品科技,2018,34(9):263−267,290. [LIU W, LI Z W, WANG H, et al. Study on the flavonoids in the leaves of Prunus cerasifera grown in Xinjiang[J]. Modern food science and technology,2018,34(9):263−267,290.] LIU W, LI Z W, WANG H, et al. Study on the flavonoids in the leaves of Prunus cerasifera grown in Xinjiang[J]. Modern food science and technology, 2018, 34(9): 263−267,290.
[9] 罗世博, 刘伟, 谢星, 等. 紫色野生樱桃李提取物抗氧化和降血糖活性研究及化学成分鉴定[J/OL]. 食品与发酵工业:1−12[2024-08-07]. https://doi.org/10.13995/j.cnki.11-1802/ts.039997. [LUO S B, LIU W, XIE X, et al. Antioxidant and hypoglycemic activities of purple Prunus cerasifera Ehrh extracts and identification of chemical constituents[J/OL]. Food and Fermentation Industries: 1−12[2024-08-07]. https://doi.org/10.13995/j.cnki.11-1802/ts.039997.] LUO S B, LIU W, XIE X, et al. Antioxidant and hypoglycemic activities of purple Prunus cerasifera Ehrh extracts and identification of chemical constituents[J/OL]. Food and Fermentation Industries: 1−12[2024-08-07]. https://doi.org/10.13995/j.cnki.11-1802/ts.039997.
[10] 武晓艳, 叶钰怡, 任文凯, 等. 植物多糖研究进展:功能活性及潜在机制[J]. 中国科学:生命科学,2023,53(6):808−824. [WU X Y, YE Y Y, REN W K, et al. Research progress of plant polysaccharides:Functional activities and potential mechanisms[J]. Scientia Sinica Vitae,2023,53(6):808−824.] WU X Y, YE Y Y, REN W K, et al. Research progress of plant polysaccharides: Functional activities and potential mechanisms[J]. Scientia Sinica Vitae, 2023, 53(6): 808−824.
[11] 张喜峰, 南艳, 李雪茹, 等. 两种方法提取琉璃苣叶多糖的理化性质及生理活性[J]. 精细化工,2022,39(11):2297−2304. [ZHANG X F, NAN Y, LI X R, et al. Physicochemical properties and physiological activities of polysaccharides extracted from borage leaves by two methods[J]. Fine Chemicls,2022,39(11):2297−2304.] ZHANG X F, NAN Y, LI X R, et al. Physicochemical properties and physiological activities of polysaccharides extracted from borage leaves by two methods[J]. Fine Chemicls, 2022, 39(11): 2297−2304.
[12] OZTURK B, PARKINSON C, GONZALEZ-MIQUEL M. Extraction of polyphenolic antioxidants from orange peel waste using deep eutectic solvents[J]. Separation and Purification Technology,2018,206:1−13. doi: 10.1016/j.seppur.2018.05.052
[13] CAO J, WANG H M, ZHANG W, et al. Tailor-made deep eutectic solvents for simultaneous extraction of five aromatic acids from Ginkgo biloba leaves[J]. Molecules,2018,23(12):3214. doi: 10.3390/molecules23123214
[14] LU W D, LIU S J. Choline chloride-based deep eutectic solvents (Ch-DESs) as promising green solvents for phenolic compounds extraction from bioresources:State-of-the-art, prospects, and challenges[J]. Biomass Conversion and Biorefinery,2022,12(7):2949−2962. doi: 10.1007/s13399-020-00753-7
[15] 沈静, 李洋, 李亚杰, 等. 新疆野生樱桃李中多糖提取物提取工艺及其抗氧化活性研究[J]. 中国现代应用药学,2019,36(24):3040−3045. [SHEN J, LI Y, LI Y J, et al. Study on extraction technology and antioxidant activity of polysaccharide extract from wild Prunus Cerasifera[J]. Chin J Mod Appl Pharm,2019,36(24):3040−3045.] SHEN J, LI Y, LI Y J, et al. Study on extraction technology and antioxidant activity of polysaccharide extract from wild Prunus Cerasifera[J]. Chin J Mod Appl Pharm, 2019, 36(24): 3040−3045.
[16] 罗光宏, 王海蓉, 崔晶, 等. 微波辅助低共熔溶剂提取、部分纯化螺旋藻多糖及其体外生物学活性研究[J]. 食品与发酵工业,2022,48(11):107−113. [LUO G H, WANG H R, CUI J, et al. Microwave-assisted deep eutectic solvents extraction, partial purification and in vitro biological activity of polysaccharides from Spirulina platensis[J]. Food and Fermentation Industries,2022,48(11):107−113.] LUO G H, WANG H R, CUI J, et al. Microwave-assisted deep eutectic solvents extraction, partial purification and in vitro biological activity of polysaccharides from Spirulina platensis[J]. Food and Fermentation Industries, 2022, 48(11): 107−113.
[17] 赵盈盈. 亚麻籽饼粕多糖微波辅助低共熔溶剂提取工艺优化及其生物活性研究[J]. 中国食品添加剂,2023,34(10):130−136. [ZHAO Y Y. Optimization of extraction process of flaxseed meal polysaccharide by microwave-assisted deep eutectic solvent and its bioactivity[J]. China Food Additives,2023,34(10):130−136.] ZHAO Y Y. Optimization of extraction process of flaxseed meal polysaccharide by microwave-assisted deep eutectic solvent and its bioactivity[J]. China Food Additives, 2023, 34(10): 130−136.
[18] 陈炯朝, 马雪, 张研, 等. 响应面法优化超声辅助低共熔溶剂提取洋蓟花苞多糖工艺[J]. 中国食品添加剂,2024,35(4):57−64. [CHEN J Z, MA X, ZHANG Y, et al. Optimisation of ultrasound-assisted low eutectic solvent extraction of polysaccharides from artichoke buds by response surface methodology[J]. China Food Additives,2024,35(4):57−64.] CHEN J Z, MA X, ZHANG Y, et al. Optimisation of ultrasound-assisted low eutectic solvent extraction of polysaccharides from artichoke buds by response surface methodology[J]. China Food Additives, 2024, 35(4): 57−64.
[19] 李文文, 蔺永刚, 边鹏, 等. 新疆藁本多糖的提取、理化性质与生物活性[J]. 精细化工, 2024, 41(9):1966−1977, 2081. [LI W W, LIN Y G, BIAN P, et al. Extraction, physicochemical property and bioactivity of polysaccharides from Conioselinum vaginatium[J/OL]. Fine Chemicals, 2024, 41(9):1966−1977, 2081.] LI W W, LIN Y G, BIAN P, et al. Extraction, physicochemical property and bioactivity of polysaccharides from Conioselinum vaginatium[J/OL]. Fine Chemicals, 2024, 41(9): 1966−1977, 2081.
[20] 赵丛丛, 彭春艳. 罗平小黄姜多糖提取工艺的优化及抗氧化活性测定[J]. 中国调味品,2017,42(11):133−136. [ZHAO C C, PENG C Y. Optimization of extraction process and determination of antioxidant activity of polysaccharides from Luoping yellow ginger[J]. China Condiment,2017,42(11):133−136.] ZHAO C C, PENG C Y. Optimization of extraction process and determination of antioxidant activity of polysaccharides from Luoping yellow ginger[J]. China Condiment, 2017, 42(11): 133−136.
[21] HUANG X, ZHANG Y, XIE N, et al. Molecular characterization and bioactivities of a novel polysaccharide from Phyllostachys pracecox bamboo shoot residues[J]. Foods,2023,12(9):1758. doi: 10.3390/foods12091758
[22] ZHU Z, CHEN J, CHEN Y, et al. Extraction, structural characterization and antioxidant activity of turmeric polysaccharides[J]. LWT,2022,154:112805. doi: 10.1016/j.lwt.2021.112805
[23] WEI L, HUANG L, DU L, et al. Structural characterization and in vitro antioxidant, hypoglycemic and hypolipemic activities of a natural polysaccharide from Liupao tea[J]. Foods,2023,12(11):2226. doi: 10.3390/foods12112226
[24] LIAN Jiqin, WANG Wenjie, WEN Pingwei, et al. Two water-soluble polysaccharides from mung bean skin:Physicochemical characterization, antioxidant and antibacterial activities[J]. Food Hydrocolloids,2020,100:105412−105412. doi: 10.1016/j.foodhyd.2019.105412
[25] ZHANG Kunfeng, HUANG Yuzhe, WU Qianzhen, et al. Antibacterial effect and mechanism against Escherichia coli of polysaccharides from Armillariella tabescens mycelia[J]. International Journal of Biological Macromolecules,2022,207:750−759. doi: 10.1016/j.ijbiomac.2022.03.086
[26] 史瑞武, 张素芳, 牛丽娜, 等. 忍冬叶多糖提取工艺优化及抗菌活性分析[J]. 中国农业科技导报,2023,25(11):218−226. [SHI R W, ZHANG S F, NIU L N, et al. Optimization on extraction of polysaccharide from honeysuckle (Lonicera japonica) leaves and its antibacterial activity[J]. Journal of Agricultural Science and Technology,2023,25(11):218−226.] SHI R W, ZHANG S F, NIU L N, et al. Optimization on extraction of polysaccharide from honeysuckle (Lonicera japonica) leaves and its antibacterial activity[J]. Journal of Agricultural Science and Technology, 2023, 25(11): 218−226.
[27] CVJETKO B M, VIDOVIĆ S, RADOJČIĆ R I, et al. New perspective in extraction of plant biologically active compounds by green solvents[J]. Food and Bioproducts Processing,2018,109:52−73. doi: 10.1016/j.fbp.2018.03.001
[28] SHANG X C, CHU D P, ZHANG J X, et al. Microwave-assisted extraction, partial purification and biological activity in vitro of polysaccharides from bladder-wrack (Fucus vesiculosus) by using deep eutectic solvents[J]. Separation and Purification Technology,2021,259:118169. doi: 10.1016/j.seppur.2020.118169
[29] 杨嘉丹, 刘婷婷, 张闪闪, 等. 微波辅助提取银耳多糖工艺优化及其流变、凝胶特性[J]. 食品科学,2019,40(14):289−295. [YANG J D, LIU T T, ZHANG S S, et al. Optimization of microwave-assisted extraction and rheological and gelling properties of polysaccharide from Tremella fuciformis[J]. Food Science,2019,40(14):289−295.] YANG J D, LIU T T, ZHANG S S, et al. Optimization of microwave-assisted extraction and rheological and gelling properties of polysaccharide from Tremella fuciformis[J]. Food Science, 2019, 40(14): 289−295.
[30] 罗光宏, 王海蓉, 崔晶, 等. 微波辅助低共熔溶剂提取、部分纯化螺旋藻多糖及其体外生物学活性研究[J]. 食品与发酵工业,2022,48(11):107−113. [LUO G H, WANG H R, CUI J, et al. Microwave-assisted deep eutectic solvents extraction, partial purification and in vitro biological activity of polysaccharides from Spirulina platensis[J]. Food and Fermentation Industries,2022,48(11):107−113.] LUO G H, WANG H R, CUI J, et al. Microwave-assisted deep eutectic solvents extraction, partial purification and in vitro biological activity of polysaccharides from Spirulina platensis[J]. Food and Fermentation Industries, 2022, 48(11): 107−113.
[31] 常相娜, 陈雪峰, 龚频, 等. 融水香菇多糖结构表征及体外抗氧化、降糖活性[J]. 中国食品添加剂,2022,33(4):1−9. [CHANG X N, CHEN X F, GONG B, et al. Structural characterization, in vitro anti-oxidative effect and hypoglycemic activity of lentinan from Rongshui county[J]. China Food Additives,2022,33(4):1−9.] CHANG X N, CHEN X F, GONG B, et al. Structural characterization, in vitro anti-oxidative effect and hypoglycemic activity of lentinan from Rongshui county[J]. China Food Additives, 2022, 33(4): 1−9.
[32] ZHOU Yin, CHEN Xinxin, CHEN Tingting, et al. A review of the antibacterial activity and mechanisms of plant polysaccharides[J]. Trends in Food Science and Technology,2022,123:264−280. doi: 10.1016/j.jpgs.2022.03.020
[33] ZHANG Li, MA Li, PAN Yaping, et al. Effect of molecular weight on the antibacterial activity of polysaccharides produced by Chaetomium globosum CGMCC 6882[J]. International Journal of Biological Macromolecules,2021,188:863−869. doi: 10.1016/j.ijbiomac.2021.08.059
[34] XIE J H, SHEN M Y, XIE M Y, et al. Ultrasonic-assisted extraction, antimicrobial and antioxidant activities of Cyclocarya paliurus (Batal.) Iljinskaja polysaccharides[J]. Carbohydrate Polymers,2012,89:177−184. doi: 10.1016/j.carbpol.2012.02.068
[35] 韩红艳, 冀爱青, 李洪燕. 5种中药材体外抑菌活性研究[J]. 中兽医医药杂志,2020,39(2):63−66. [HAN H Y, JI A Q, LI H Y. Study on quality standard of Yinluganmao oral solution[J]. J Trad Chin Vet Med,2020,39(2):63−66.] HAN H Y, JI A Q, LI H Y. Study on quality standard of Yinluganmao oral solution[J]. J Trad Chin Vet Med, 2020, 39(2): 63−66.





 下载:
下载:



 下载:
下载:



