Research Progress of Mechanoenzyme Catalysis and its Application in Food Field
-
摘要: 机械酶催化是一种新兴的生物催化技术,该技术通过机械化学手段强化无溶剂体系酶催化反应,可以显著提高反应效率、减少溶剂使用和增强酶的稳定性,符合绿色化学和可持续发展的理念。本文从机械酶催化反应的反应体系、反应方式、影响因素、酶在机械作用下维持稳定的原理和机械酶催化反应在食品添加剂合成、功能性成分提取和食品加工副产物降解中的应用等几个方面展开综述,从绿色化学角度展示了机械酶催化应用于食品领域的优势,并对机械酶催化反应面临的挑战和未来的发展方向进行了讨论。Abstract: Mechanoenzyme catalysis is a promising biocatalysis technology for producing value-added products in a sustainable and environment friendly manner. This approach can significantly improve the reaction efficiency, reduce the use of solvents and enhance the stability of enzymes in solvent-free system by mechanochemical means, in line with the concept of green chemistry and sustainable development. In this paper, the reaction system, reaction mode, influencing factors, the principle of enzyme stability under mechanical action and the application of mechanoenzyme catalysis in the synthesis of food additives, extraction of functional components and degradation of by-products of food processing are reviewed, and the advantages of mechanoenzyme catalysis in the field of food are demonstrated from the perspective of green chemistry. Finally, the challenges and future development directions of mechanoenzyme catalysis are discussed.
-
有机化学合成在食品、医药、农药、生物技术等领域具有广泛的应用,对食品添加剂的发现、开发和制备功能材料的设计和合成等起着至关重要的作用。传统有机化学合成常需苛刻条件,易产生有害副产品,存在化学残留风险,能源消耗大,且可能对环境及人体健康造成负面影响[1],严重违背现代社会对于环保的高度重视和绿色可持续发展的理念,因此发展一种绿色化学合成方法是学术界和工业界化学研究与发展的重要目标。近年来,机械化学技术与酶催化反应的结合开辟了机械酶催化这一新兴的生物催化技术。19世纪末,化学家Wilhelm Ostwald首次提出机械化学这一概念[2]。机械化学主要是利用机械研磨或挤压等物理手段引发的化学反应,在无溶剂条件下进行,这不仅避免了溶解度限制,还显著减少了溶剂使用,降低了环境和健康风险[3]。机械酶催化反应进一步地将生物催化整合到机械化学合成中,可以实现无溶剂酶催化过程,这不仅减少了溶剂使用,防止了废物产生,而且提高了过程的可持续性[4]。机械酶催化反应的特点是加快反应速率、降低合成难度、催化特殊分子材料的合成,同时减少后处理工序,有效提高了产量并降低了成本,减少能源消耗,展现了其在绿色化学合成中的显著优势[5]。机械酶催化反应技术以其绿色化学的特性,在化学合成和食品工业领域取得了重要进展。不仅在糖苷键、酯键和聚酯的裂解,以及酯键、肽键、酰胺键的形成上显示出高效的催化能力,还在手性化合物的立体选择性和对映选择性拆分方面实现了精准控制。同时,该技术也被成功应用于合成食品添加剂、提取功能性成分,以及降解食品加工副产物。为化学合成与食品工业的可持续发展提供了有效的解决方案[6]。本文围绕机械酶催化技术在食品领域的应用展开综述,重点探讨了其反应体系、反应方式、影响因素以及酶在机械作用下保持稳定性的原理,并详细介绍了其在食品添加剂合成、功能性成分提取和食品加工副产物降解中的应用。文章从绿色化学的角度,阐述了机械酶催化技术在食品领域的优势,并对当前面临的挑战及未来发展方向进行了深入讨论。
1. 机械酶催化反应
机械酶催化反应在食品工业中具有独特优势,包括能够处理难溶性底物、环境友好、提高酶解效率和产率、简化工艺流程、模拟自然条件、底物多样性、无需预处理、高产物浓度、减少溶剂浪费,以及安全的反应体系。这些特性使其在提高生产效率、降低成本、减少环境影响和开发新食品加工方法方面具有显著优势。
1.1 反应体系
机械化学技术已被应用于酶转化,促进了机械酶学这一新兴研究领域的产生。机械酶催化反应尤其适用于难溶性底物,因为它可以在不添加或微量添加剂条件下促进非均相体系进行酶催化反应。机械酶催化反应的环境与传统的酶催化稀溶液环境相比,更接近酶在自然环境中的湿润状态。机械酶催化的反应体系有无溶剂体系、低共熔体系[7]和助溶剂添加体系[8]。
在无溶剂体系中,酶能够完全扩散至整个试剂中,直接作用于反应底物[9]。无溶剂体系具有以下优点:反应底物浓度高;反应速度快;反应体积小;减少产物分离步骤;降低了溶剂回收成本[10−11]。因此,在无溶剂体系中进行的机械酶催化合成反应是一种具有很大潜力的绿色化学技术。
低共熔体系是由氢键的受体和氢键的供体组成的,通过氢键之间的相互作用,形成超分子结构,在室温下形成共融混合物。低共熔溶剂对酶有一定的稳定作用,同时还有着很高的溶解能力[12]。低共熔溶剂存在黏度较高的缺点,导致反应的扩散受到严重限制,反应速度变慢,但是在机械作用下可以克服这一问题。
目前,应用最广泛的是助溶剂添加体系,也称为液体辅助研磨(liquid-assisted grinding,LAG)技术,即通过添加少量甚至微量的离子液体(ILs)或深共晶溶剂(DES),来提高反应物的混合均匀度、机械反应性和反应速度,从而增强反应性能,并且该反应的增强作用与反应物的溶解度无关[13−14]。Friščić等[15]通过参数η(液体添加剂与反应物质量之比)来描述LAG反应,其中η=0 μL/mg表示纯磨,η在2~12 μL/mg范围内表示浆液状态,η>12 μL/mg则进入溶液反应状态,当η在0~2 μL/mg范围内,反应物的溶解度不影响反应结果,可视为无溶剂体系。LAG技术已被应用在有机和无机合成[4]、共晶筛选[16]、金属有机材料的构建以及超分子复合物的制备[17]中,并且近年来其在机械酶法合成中的应用报道也在不断增加[18],这些应用为食品行业带来了多方面的好处,包括改善食品成分的特性、创新食品包装材料的开发,以及食品添加剂的生产等。此外,许多酶具有底物多样性,传统溶剂环境中溶解度低的底物往往会限制酶反应的进行,而无溶剂环境可以避开溶解度问题,从而探索更多新的反应性。Ostadjoo等[19]利用LAG技术,以木聚糖水解酶为催化剂,对木质纤维素进行水解反应。实验中,球磨频率设定为30 Hz,酶载量为0.08%(蛋白质载荷w/w),球磨时间为10 min,颗粒尺寸细化到1 mm以下。对球磨后的样品进行反应老化处理,并定期取样分析。实验结果显示,生物质底物的水解产率超过60%,而在水溶液中进行相同反应的产率仅为5%,这一结果证明了液体辅助研磨相比水溶液反应具有更高的水解效率和产率。
在机械酶催化反应体系中最常见的现象是反应老化。反应老化(reaction aging,RAging),是一种在无溶剂条件下(η<1 μL/mg),结合机械化学和酶催化的化学转化方法。在特定温度下,通过反复进行研磨和静态孵育的循环,RAging实现了高效且产率更高的酶促反应[20]。Hammerer等[21]利用冻干的纤维素酶和极少量的水进行物理混合,通过重复的研磨和老化(静态培养)过程,对固体纤维素进行有效的机械酶解,其生成的葡萄糖浓度明显高于传统的溶液反应方法。这一过程最大的优势是不需要对生物质进行预处理或使用刺激性化学试剂。由于RAging中的含水量远低于传统溶液过程,并且在化学计量学上与底物相当,因此它为酶活性的发挥提供了更适宜的环境。Therien等[22]的研究表明,与溶液反应相比,RAging使得几丁质酶的效率提高了数倍,在无需大量溶剂、侵蚀剂或几丁质预处理的情况下,至少可以实现40%的裂解率。此外,这种机械酶催化反应过程产生的乙酰氨基葡萄糖产物浓度是在溶液中进行的几丁质酶反应的2~8倍,同时几乎不产生溶剂浪费。这些特点使得LAG和RAging成为机械酶催化反应过程的首选反应体系。
1.2 反应方式
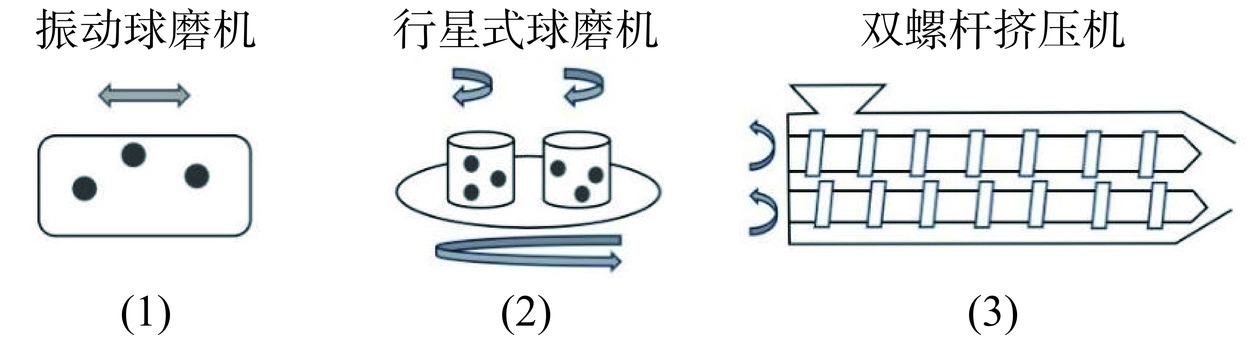
机械酶催化的反应方式有研磨、球磨和挤压,下文根据反应设备对其反应方式进行论述。机械酶催化反应常见的应用设备有振动式球磨机、行星式球磨机和双螺杆挤压机[5]。其运动轨迹如图1所示。在振动式球磨机中,磨罐以特定频率旋转混合,从而在三维空间内产生脉动效果,这种球磨机适用于毫克至克级规模的反应,其磨罐容量最大可达50 ml[5]。行星式球磨机则由一个旋转的磨盘和若干个反向旋转的小瓶组成,其处理能力可达500 ml,相比振动式球磨机,行星式球磨机能够达到更高的温度[23]。挤压机不同于球磨机的分批处理方式,双螺杆挤压机支持连续流动型的机械酶催化反应,解决了流动化学中产品浓度低、溶液需稀释以防止沉淀、堵塞和管道堵塞等问题[24]。
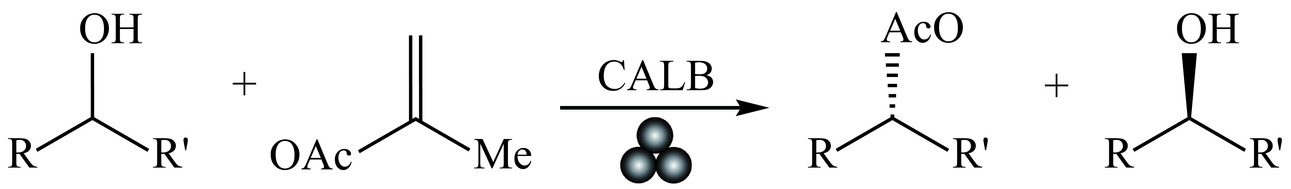
酶的本质是蛋白质,氨基酸是构建蛋白质的基本单元,因此氨基酸在球磨机研磨过程中表现出的稳定性为机械酶催化反应的发展奠定了重要基础[26]。最初由Rodríguez等[27]发现,氨基酸能抵抗机械化学应力,他们首次报道了在机械力介导的立体选择性醛醇反应中使用(S)-脯氨酸作为有机催化剂,这一过程不仅证实了氨基酸的高稳定性,还展示了机械化学在不对称过程中可以实现的显著立体选择性。随后,Hernández等[28]描述了在无溶剂条件下,利用球磨机合成α,β和β,β-二肽的重要进展。由于无溶剂环境,反应混合物高度浓缩,从而显著提高了二肽的催化活性。与传统的有机溶剂反应相比,球磨机研磨不仅缩短了反应时间,还提高了对映体诱导率。这种立体选择性的增强与催化剂与底物之间的非共价相互作用的增强密切相关[29]。二肽的成功合成为机械酶催化反应的发展提供了有力的实证。此外,他们团队还利用行星式球磨机,以南极假丝酵母脂肪酶B(CALB)作为催化剂,醋酸异丙酯作为酰基供体,在无溶剂条件下催化外消旋1-苯乙醇(rac-1 a),见图2,实现了高转化率和优异的对映选择性(醋酸酯的对映选择性可高达 99% ee)。这一研究不仅展示了克级规模的反应过程,还成功揭示了酶在机械条件下的稳定性[30]。
机械酶催化反应在双螺杆挤压机中主要用于大分子的降解,较少用于缩合反应[31]。2015年,Spinella等[31]报报道了第一例机械酶催化反应的上游反应,他们利用CALB在反应挤压过程中催化ω-十五内酯与聚(ω-十五内酯)的开环聚合,在90~130 °C的反应温度下,通过甲苯反应实现了超过99%的收率,且所得聚合物的聚合度高于传统溶液反应。2019年Vaidya等[32]通过机械酶催化挤压合成了共聚物,他们采用双螺杆挤压机,在60 °C、300 r/min和3 g/min的进料速度下,对壳聚糖进行酯化反应。该反应由CALB和南极假丝酵母脂肪酶A(NovoCor AD L)共同催化。实验结果显示,使用NovoCor AD L的嫁接率达到96.3%,而使用CALB的嫁接率仅为5.9%。CALB主要催化壳聚糖C6位置的伯-OH基团进行酯化反应,而NovoCor AD L则针对C3位置的仲-OH基团。这一结果表明,酶的选择性不仅在机械酶催化反应中不受挤压过程的影响,而且可以通过挤压使酶与底物充分接触,在剪切作用下增加了底物之间的碰撞频率,从而促进了酶的催化效率。
1.3 酶在机械作用下维持稳定性和活性的原理
酶在机械作用下能够保持其稳定性和活性,这主要得益于多个关键因素的协同作用。酶的天然三维空间结构为其活性位点提供了必要的保护,使其能够承受一定程度的机械力而不被破坏[33]。此外,通过物理或化学方法将酶固定化在载体上,可以减少酶分子在反应体系中的运动,增强其对机械力的抵抗能力[34]。同时,机械作用能够改善底物的分散性,细化固体颗粒,降低界面阻力,从而增加底物分子与酶活性位点的接触机会,提高催化效率,并且机械力的能量传递能够激活酶,增加其活性,从而促进酶催化的反应[35]。在无溶剂或几乎无溶剂的条件下进行的机械酶催化反应,能够更好地模拟酶的自然环境,减少水分子或其他溶剂分子对酶活性位点的干扰。使用特定的助溶剂可以进一步稳定酶的结构,增强其在机械化学过程中的稳定性[36]。
1.4 影响因素
机械酶催化反应效率受多种因素影响,包括机械作用、研磨罐和研磨球的材质、酶以及添加剂的使用。酶量增加可提高反应速度,但过量可能抑制活性。不同来源的酶催化效率不同。机械力可改变酶结构,影响活性。研磨介质的材质和尺寸,以及添加剂的类型和量,都会对反应产率和机理产生影响。这些因素对机械酶催化反应的具体影响如表1所示。
表 1 机械酶催化反应的影响因素Table 1. Reaction influencing factors of mechanoenzyme-catalyzed影响因素 反应参数 对反应的影响 参考文献 化学动力学参数 反应物比例 反应物的比例直接影响反应的化学平衡和产物的形成。 [37] 温度 温度会影响反应的活化能、酶活性和反应平衡。 [38] 酶的添加量 机械酶催化的反应速度与酶的添加量呈正比,酶添加量越多,酶与底物的结合能力越强。但酶的添加量超过一定值时,酶的催化活性受到抑制,机械酶催化反应产率降低。 [37] 酶的种类 酶的种类不同其Km值和Vmax值也会有所不同,这意味着它们对反应速率的影响也不同。 [39] 物理动力学参数 球磨罐和研磨球的材质 由于不同的磨球材质在密度、硬度和弹性模量各异,所以传递给反应物的能量不同。 [36] 研磨球的数量、尺寸 适量的球体可以确保反应物充分混合和研磨,但过多的球会导致过度磨损;相同的球料比下,小尺寸磨球的个数会更多,发生有效碰撞的频率更高。 [40] 球磨频率 较高的转速增加球体与反应物之间的碰撞频率和能量,加快反应速率。过高的转速会导致局部过热,这可能会改变反应机理,产生副反应。 [41] 挤压螺杆转速 螺杆转速会影响物料在挤出机内的混合程度和停留时间,不同的螺杆转速会产生不同的剪切应力,可能会影响酶的结构和活性。 [24] 老化周期 通过控制老化周期,可以在反应和暂停之间找到平衡,以控制反应温度和压力,避免过热使酶失活。 [42] 添加剂 研磨助剂 提高反应物混合均匀度、反应速度。 [14] 目前应用在机械酶催化反应中的酶有脂肪酶、蛋白酶、纤维素酶、葡萄糖水解酶、几丁质酶、角质酶和聚对苯二甲酸乙二醇酯水解酶(PET水解酶)等。同一种类的酶,由不同微生物生产时,其催化反应的速率也会有所不同,Ulla等[39]比较了不同脂肪酶对木质素模型化合物的酰化作用,其中CALB的活性明显高于南极假丝酵母脂肪酶A(CALA)和天野脂肪酶(PS-IM)。
机械力作用下酶的催化活性变化,可能是由于机械力导致酶的空间结构发生改变,使得催化中心暴露出来。通过调整机械作用力的频率、反应时间和反应温度,可以有效地控制机械酶催化反应的效率。Carter等[42]在研究机械酶介导的转氨酶反应时,通过改变研磨频率、研磨时间、老化周期和循环次数等参数,确定了一组最佳参数:在25 Hz的振荡频率下,配合30 min的老化周期和2个循环次数的操作条件下,能够实现苄胺1b的收率达到几乎定量的96%,与酶促反应相比展现出了高产率和优异的对映选择性。
在球磨过程中不同材质的研磨罐、研磨介质及研磨球的大小都会对机械酶催化反应产生影响。根据Hertzian接触碰撞理论[43],由于这些材料的硬度和密度各异,它们在研磨过程中传递给反应物的能量也存在差异,硬度和密度较高的材料通常具有较高的弹性模量,因此在接触区域会产生更大的应力。Gamboa-Velázquez等[40]在研究普萘洛尔对映体前体rac-2的对映选择性解离过程中发现,使用不锈钢和聚四氟乙烯(特氟龙)材料的研磨罐和研磨球时,对映选择性(ee)分别为ee(S)-1=98%和ee(R)-2=76%。然而,当采用玛瑙材料的研磨罐和研磨球时,对映选择性显著提高,达到ee(S)-1>99%和ee(R)-2=99%。此外,实验还发现,在玛瑙材料中,使用两个玛瑙球相比于单个球,能够实现对外消旋卤醇更高的动力学分辨率。
在机械酶催化反应中,固体研磨助剂可以提高反应产率和重复性。Li等[44]在2015年的研究报告中指出,通过添加不同的盐类(氧化铝、溴化钠、溴化钾、氯化钠和二氧化硅),可以增加机械酶催化合成1,4-二氢吡啶衍生物的产率。在不使用研磨助剂的情况下,产率为42.1%,而添加氯化钠后产率可达68.8%。
2. 机械酶催化反应在食品领域的应用
机械酶催化反应在食品领域的最大优势是因为它完美地体现了绿色化学的核心理念,通过其环保、高效的特性,为食品工业的可持续发展提供了强有力的支持。机械酶法可以高效地合成食品添加剂,如表面活性剂、增稠剂、抗氧化剂[45]、抗菌剂[46],提高食品质量和营养价值等。此外,机械酶法可以帮助降解食品加工副产物,高效提取其中的功能性成分,为食品工业提供新的原料来源,实现了资源的循环再利用[47]。
2.1 合成食品添加剂
2.1.1 糖酯合成
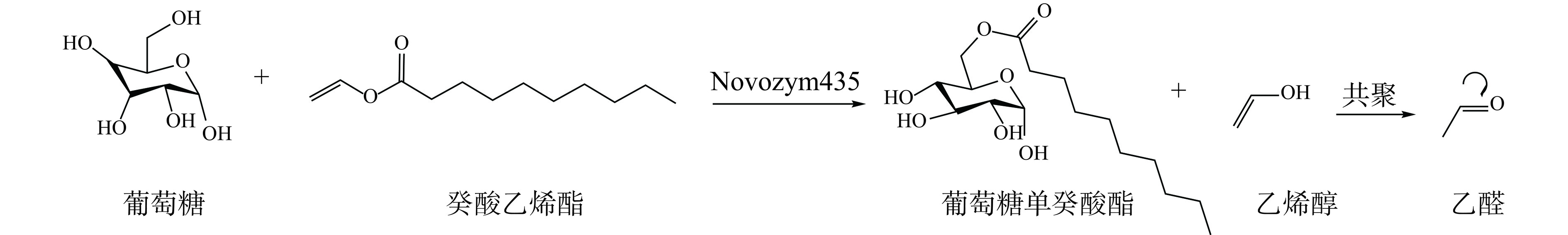
表面活性剂广泛应用于化妆品、药品、食品等行业。尤其是糖酯类生物表面活性剂,它是以单糖、二糖或低聚糖作为亲水性头部的化合物,具有可持续性、无臭、无毒、无味等优点[48]。尽管糖酯的生产主要通过化学合成完成,且具有成本效益和相当高的产量,但这种方法需要极端条件,如高温和酸性催化,并涉及多步骤复杂加工,产生大量副产物。相比之下,酶促糖酯合成在较温和的条件下进行,能有效减少副产物的生成。Delavault等[49]在深共熔溶剂中通过脂肪酶催化合成山梨糖醇-6-O-月桂酸酯,该反应条件温和,提高了反应的特异性和选择性,可减少副产物的形成,但是酶促反应很难同时溶解极性糖和非极性脂肪酸[50−51]。因此,Hollenbach等[52]利用机械酶法合成葡萄糖单癸酸酯的模型反应(如图3)提高糖酯生物催化合成性能的潜力,使用装有玻璃珠的珠磨机,通过脂肪酶Novozym 435催化糖与乙烯基化脂肪酸的酯交换反应,与传统加热方法相比实现了高达6倍的空间产率,证明了机械酶法在糖酯合成和生物催化中具有显著优势。
2.1.2 淀粉脂质复合物
淀粉-脂质复合物可作为稳定剂、增稠剂、糖衣制剂、化妆品成分、赋形剂、食用薄膜应用于食品、化妆品和药品等领域[53]。Liu等[54]采用机械酶催化反应合成了阿魏酸淀粉酯,最佳工艺条件为8.2%阿魏酸添加量、66 ℃挤出温度和3.2%脂肪酶添加量。阿魏酸淀粉酯的合成有效地解决了阿魏酸到达结肠功能影响的能力有限的挑战。机械酶催化反应具有效率高、不依赖有机溶剂方面的优势,双螺杆挤出利用高温高压条件下的机械剪切力、高频振动和摩擦力来引起材料的物理和化学变化[55]。以淀粉为例,其分子具有从有序状态转变为无序状态的能力,从而在机械作用下破坏淀粉晶体结构并改变淀粉颗粒的表面特性,这种转变暴露了淀粉分子上的反应位点,为后续的反应提供了丰富的活性中心。在脂肪酶的催化作用下,阿魏酸能够更有效地渗透到由淀粉结构分解而形成的空腔中。这种相互作用极大地促进了阿魏酸与淀粉分子之间的接触,从而实现了两者之间更高效的结合。这一研究成果标志着机械酶催化反应在促进阿魏酸淀粉酯快速和环保合成方面的巨大前景,为酯类研究开辟了新的视角[54]。
2.2 提取食品功能性成分
在食品供应链的各个环节中,从农业种植、储存和加工到最终消费,都会产生食物垃圾,食物垃圾富含碳水化合物、蛋白质和纤维等多种功能性成分[56]。利用机械酶法提取食品功能性成分,提高了资源的利用效率,贯彻了循环经济的可持续发展理念,体现了绿色化学的环保原则。
2.2.1 提取糖类成分
糖类化合物在食品中提供能量,增加甜味,改善口感,保持湿润,促进色泽,延长保质期,改善质构,并作为稳定剂和发酵剂。通过机械酶催化反应提取糖类成分可以避免大量使用有机溶剂,减少了环境污染和生产成本。Al Amin等[57]利用机械酶催化反应将香蕉皮水解为葡萄糖和果糖,将所得单糖转化为5-羟甲基糠醛。与化学水解相比,在机械酶反应老化条件下对香蕉皮的酶解产率显著提高,其中葡萄糖产率提高了11.88%,果糖产率提高了34.38%,机械酶水解后得到的葡萄糖或果糖脱水生成5-羟甲基糠醛的产率为71.9%,这是迄今为止从纤维素食物垃圾中获得的最高5-羟甲基糠醛的产率。与在相同的反应条件下未经机械酶处理的香蕉皮直接转化为5-羟甲基糠醛的产率相比提高了三倍。这项研究表明,机械酶催化反应是一种高效、可持续地从纤维素食物垃圾中生产5-羟甲基糠醛的替代方法,目前使用现有化学水解法和酶解法很难实现这么高的产率。Therien等[22]研究了利用机械酶催化反应将将甲壳素材料高效转化为N-乙酰氨基葡萄糖。该方法采用了在固体基质中进行球磨和老化的循环过程,通过机械作用破坏几丁质的晶体结构,几丁质酶作用于几丁质的糖苷键,断裂这些键,释放出N-乙酰氨基葡萄糖单体,这种方法实现了从虾和蟹壳等生物质资源中直接、高效生产N-乙酰氨基葡萄糖,简化了操作步骤,提高了生产效率。
2.2.2 提取生物活性成分物
氨基酸和多肽作为蛋白质的基本单元,它们是生命必需的营养源,而且具有特定功能的生物活性肽,具有抗氧化、降血压等健康益处[58]。在食品工业中,氨基酸和多肽作为添加剂,能够显著改善食品的风味、质地和稳定性[59]。通过机械酶催化能够提高浓缩奶油汤的生物价值,增加产品中游离氨基酸和短肽的含量,从而提高样品的营养和生物学价值[60]。Su等[47]利用机械酶催化反应从虾壳中高效提取出虾青素、小肽和氨基酸等多种功能性成分。这一过程首先破坏虾壳中的二硫键,暴露角蛋白纤维,然后通过蛋白酶水解成小肽和氨基酸,最终通过离心分离得到含有小肽和氨基酸的水溶液层。
酚酸和黄酮类是一类具有抗氧化性和抗菌性的天然有机化合物,在食品工业中用于延长保质期、提升风味、预防疾病、增强营养吸收等[61]。这些应用需平衡酚酸的稳定性、成本效益和环境影响。Zhang等[45]采用机械酶催化反应从菊花样品中提取酚酸和黄酮类化合物。他们将菊花样品与纤维素酶和果胶酶的混合酶加入到磷酸二氢钠二水合物-柠檬酸缓冲液中,在行星式球磨机中研磨,这一过程显著地增加了样品表面的粗糙度和断裂程度,同时伴随着羟基(-OH)基团浓度的上升,证实了机械酶催化反应能够有效破坏植物细胞壁,促进酚类和黄酮类化合物的释放。该方法避免了使用大量有害有机化学溶剂,提取和分析时间更短,且与经典的酶辅助提取方法相比,由于机械研磨与酶解作用的协同效应,整个提取过程仅需30 min即可高效完成。这一发现为传统的提取技术提供了一种环保且高效的替代方案,为从复杂的植物基质中提取活性成分开辟了新的途径。
2.3 食品加工副产物的降解
食品加工过程中植物原料产生的不可食用部分(玉米秸秆、稻壳和甘蔗渣等),它们主要由木质纤维素生物质组成,可通过加工用于食品生产[6]。木质纤维素生物质由纤维素、半纤维素和木质素组成,因其复杂的微观结构以及组分间的不均匀分布使得木质纤维素生物质具有天然的抗降解屏障[62]。机械酶催化反应是降解木质纤维素的有效方法,能显著提高转化效率并减少环境污染,避免化学预处理和大量用水。面对木质纤维素复杂的微观结构和天然抗降解性,机械作用与生物催化的结合,有效克服了降解过程中的障碍,实现了生物质的高效转化。表2中显示了使用机械酶催化反应降解生物质的机械方式、机械条件、球磨材质以及酶的种类。
表 2 机械酶法降解食品加工副产物Table 2. Mechaoenzymatic decomposition of food processing by-products序号 生物质 机械方式 反应参数 研磨罐、研磨球材质及数量 酶 参考文献 1 纤维素 研磨 30 Hz
30~90 min聚甲基丙烯酸甲酯球磨罐、2个直径7 mm不锈钢球 黑曲霉纤维素酶 [21] 2 纤维素 研磨 30 Hz
24 h特氟龙球磨罐,每个罐子装840 g直径15 mm的不锈钢球 黑曲霉纤维素酶 [63] 3 半纤维素 研磨 30 Hz
30 min聚四氟乙烯球磨罐、2个直径7 mm不锈钢球 木聚糖酶T [19] 4 木质素 研磨 400 r/min
180 min特氟龙球磨罐,直径5 mm氧化锆珠 漆酶 [64] 5 木质纤维素 研磨 30 Hz
5~60 min特氟龙球磨罐、2个直径7 mm不锈钢球 纤维素酶
木聚糖酶[65] 6 木质纤维素 挤压 50 ℃
85~250 r/min\ 纤维素酶和半纤维素酶 [66] Hammerer等[21]提出的机械酶法催化纤维素糖化技术,通过在无溶剂条件下实现了12 h内高达50%的葡萄糖产率。而Zhang等[63]通过湿法研磨和酶解反应的协同作用,经过20 d的RAging循环(30 Hz研磨5 min后55 ℃老化24 h),产生了20%的葡萄糖。这说明使用机械酶法催化纤维素糖化更适合在无溶剂条件下进行。XU等[64]则通过机械酶催化反应实现了木质素的有效解聚,转化为活性酚类单体,提高了木质素作为可再生资源的利用价值。Hammerer等[65]进一步研究了机械酶催化反应老化,对不同农业来源的木质纤维素生物质样品进行高效率的克级糖化,实现了在低蛋白酶负载下高浓度单糖的生产。机械酶催化的成功原因之一在于其能够更加贴近模拟酶在自然环境中的工作状态。在这一反应过程中,液固比通常非常低,仅为1~2 μL/mg,这不仅极大降低了溶剂的使用量,而且在某些情况下还能实现无溶剂操作,从而减少了对环境的负担,并提高了操作的经济效益。
3. 总结与展望
机械酶催化反应具有绿色环保和可持续性的特点,并且与传统的化学反应和生物催化反应相比,机械酶催化反应显著提高了反应速率和产率。而且在保持酶的高选择性方面表现出色。机械酶催化反应的应用前景广阔,它已经在食品垃圾的降解、食品功能性成分的提取以及合成食品添加剂等多个领域取得了成功,克服了有机溶剂的污染,实现了在无溶剂条件下的固体反应,为食品资源的高效利用和可持续发展提供了新的途径。
机械酶催化研究目前处于早期阶段,尽管一些研究展示了它的优势,但机械条件下酶催化反应的动力学和热力学研究有限,缺乏对反应机理和过程建模的详细探索。机械酶催化的本质是通过酶催化与机械力之间的相互作用来提高酶的催化效率,瓶颈在于如何在加快酶促反应效率的同时减少能量消耗和酶变性失活。为了提高酶的机械稳定性,可以采用金属有机框架或无机杂化材料对酶进行固定化。此外,机械酶催化还存在反应后底物产物和酶的分离问题难以解决,酶无法重复使用,可以考虑磁性载体固定化技术来加以解决。目前机械酶催化反应中应用的酶多为水解酶,扩大酶的种类和底物范围将对食品行业未来的发展有很大帮助。为了实现对酶活性的精确调控,未来需要进一步研究反应过程的模拟和智能控制。温度控制也是机械酶催化技术面临的一个挑战,因为机械力作用会产生热量,影响酶的活性和反应的选择性,但要想在研磨过程中实现精确的温度控制,对设备和技术要求很高,因此在机械酶催化反应中,温度控制的研究相对较少。为了深入探究机械酶催化反应,原位分析技术的开发是必要的,目前只能在固定时间点取样进行离线分析,这可能导致温度变化不可控或样品收集时的潜在蒸发问题。
随着对机械酶催化机制的深入探究和应用技术的不断创新,这一技术将引领我们走向一个更加绿色、高效、可持续的食品生产新时代。
-
表 1 机械酶催化反应的影响因素
Table 1 Reaction influencing factors of mechanoenzyme-catalyzed
影响因素 反应参数 对反应的影响 参考文献 化学动力学参数 反应物比例 反应物的比例直接影响反应的化学平衡和产物的形成。 [37] 温度 温度会影响反应的活化能、酶活性和反应平衡。 [38] 酶的添加量 机械酶催化的反应速度与酶的添加量呈正比,酶添加量越多,酶与底物的结合能力越强。但酶的添加量超过一定值时,酶的催化活性受到抑制,机械酶催化反应产率降低。 [37] 酶的种类 酶的种类不同其Km值和Vmax值也会有所不同,这意味着它们对反应速率的影响也不同。 [39] 物理动力学参数 球磨罐和研磨球的材质 由于不同的磨球材质在密度、硬度和弹性模量各异,所以传递给反应物的能量不同。 [36] 研磨球的数量、尺寸 适量的球体可以确保反应物充分混合和研磨,但过多的球会导致过度磨损;相同的球料比下,小尺寸磨球的个数会更多,发生有效碰撞的频率更高。 [40] 球磨频率 较高的转速增加球体与反应物之间的碰撞频率和能量,加快反应速率。过高的转速会导致局部过热,这可能会改变反应机理,产生副反应。 [41] 挤压螺杆转速 螺杆转速会影响物料在挤出机内的混合程度和停留时间,不同的螺杆转速会产生不同的剪切应力,可能会影响酶的结构和活性。 [24] 老化周期 通过控制老化周期,可以在反应和暂停之间找到平衡,以控制反应温度和压力,避免过热使酶失活。 [42] 添加剂 研磨助剂 提高反应物混合均匀度、反应速度。 [14] 表 2 机械酶法降解食品加工副产物
Table 2 Mechaoenzymatic decomposition of food processing by-products
序号 生物质 机械方式 反应参数 研磨罐、研磨球材质及数量 酶 参考文献 1 纤维素 研磨 30 Hz
30~90 min聚甲基丙烯酸甲酯球磨罐、2个直径7 mm不锈钢球 黑曲霉纤维素酶 [21] 2 纤维素 研磨 30 Hz
24 h特氟龙球磨罐,每个罐子装840 g直径15 mm的不锈钢球 黑曲霉纤维素酶 [63] 3 半纤维素 研磨 30 Hz
30 min聚四氟乙烯球磨罐、2个直径7 mm不锈钢球 木聚糖酶T [19] 4 木质素 研磨 400 r/min
180 min特氟龙球磨罐,直径5 mm氧化锆珠 漆酶 [64] 5 木质纤维素 研磨 30 Hz
5~60 min特氟龙球磨罐、2个直径7 mm不锈钢球 纤维素酶
木聚糖酶[65] 6 木质纤维素 挤压 50 ℃
85~250 r/min\ 纤维素酶和半纤维素酶 [66] -
[1] ALQAHTANI A S. Indisputable roles of different ionic liquids, deep eutectic solvents and nanomaterials in green chemistry for sustainable organic synthesis[J]. Journal of Molecular Liquids,2024,399:69−82.
[2] FEDRICO C, LIDIA L D, FRANCESCO D, et al. Mechanochemistry:New tools to navigate the uncharted territory of "impossible" reactions.[J]. ChemSusChem,2022,15(17):e202200362. doi: 10.1002/cssc.202200362
[3] JUARISTI E, AVILA-ORTIZ C G. Salient achievements in synthetic organic chemistry enabled by mechanochemical activation[J]. Synthesis,2023,55(16):2439−2459. doi: 10.1055/a-2085-3410
[4] FRIŠČIĆ T, MOTTILLO C, TITI H M. Mechanochemistry for synthesis[J]. Angewandte Chemie,2019,132(3):1030−1041.
[5] HOLLENBACH R, OCHSENREITHER K. Mechanoenzymatic reactions-challenges and perspectives[J]. ChemCatChem,2023,15(21):656−666.
[6] KOVER A, KRALJIĆ D, MARINARO R, et al. Processes for the valorization of food and agricultural wastes to value-added products:Recent practices and perspectives[J]. Systems Microbiology and Biomanufacturing,2021,2(1):50−66.
[7] HOLLENBACH R, OCHSENREITHER K, SYLDATK C. Enzymatic synthesis of glucose monodecanoate in a hydrophobic deep eutectic solvent[J]. International Journal of Molecular Sciences,2020,21(12):4342−4354. doi: 10.3390/ijms21124342
[8] PÉREZ-VENEGAS M, JUARISTI E. Mechanoenzymatic resolution of racemic chiral amines, a green technique for the synthesis of pharmaceutical building blocks[J]. Tetrahedron,2018,74(44):6453−6458. doi: 10.1016/j.tet.2018.09.029
[9] PYSER J B, CHAKRABARTY S, ROMERO E O, et al. State-of-the-art biocatalysis[J]. ACS Central Science,2021,7(7):1105−1116. doi: 10.1021/acscentsci.1c00273
[10] BEZBRADICA D, MIJIN D, SILER-MARINKOVIC S, et al. The Candida rugosa lipase catalyzed synthesis of amyl isobutyrate in organic solvent and solvent-free system:A kinetic study[J]. Journal of Molecular Catalysis B:Enzymatic,2006,38(1):11−16. doi: 10.1016/j.molcatb.2005.10.004
[11] AGUIEIRAS E C G, CAVALCANTI-OLIVEIRA E D, DE CASTRO A M, et al. Biodiesel production from Acrocomia aculeata acid oil by (enzyme/enzyme) hydroesterification process:Use of vegetable lipase and fermented solid as low-cost biocatalysts[J]. Fuel,2014,135:315−321. doi: 10.1016/j.fuel.2014.06.069
[12] CHEN Z, JACOBY W A, WAN C. Ternary deep eutectic solvents for effective biomass deconstruction at high solids and low enzyme loadings[J]. Bioresource Technology,2019,279:281−286. doi: 10.1016/j.biortech.2019.01.126
[13] FRIŠČIĆ T, TRASK A V, JONES W, et al. Screening for inclusion compounds and systematic construction of three‐component solids by liquid‐assisted grinding[J]. Angewandte Chemie,2006,118(45):7708−7712. doi: 10.1002/ange.200603235
[14] PÉREZ‐VENEGAS M, JUARISTI E. Mechanoenzymology:State of the art and challenges towards highly sustainable biocatalysis[J]. ChemSusChem,2021,14(13):2682−2688. doi: 10.1002/cssc.202100624
[15] FRIŠČIĆ T, CHILDS S L, RIZVI S A A, et al. The role of solvent in mechanochemical and sonochemical cocrystal formation:A solubility-based approach for predicting cocrystallisation outcome[J]. CrystEngComm,2009,11(3):418−426. doi: 10.1039/B815174A
[16] DARIO B, LUCIA M, FABRIZIA G. Mechanochemical preparation of co-crystals[J]. Chemical Society Reviews,2013,42(18):7638−7648. doi: 10.1039/c3cs60014a
[17] RIGHTMIRE N R, HANUSA T P. Advances in organometallic synthesis with mechanochemical methods[J]. Dalton Transactions,2016,45(6):2352−2362. doi: 10.1039/C5DT03866A
[18] KAABEL S, FRIŠČIĆ T, AUCLAIR K. Mechanoenzymatic transformations in the absence of bulk water:A more natural way of using enzymes[J]. ChemBioChem,2019,21(6):742−758.
[19] OSTADJOO S, HAMMERER F, DIETRICH K, et al. Efficient enzymatic hydrolysis of biomass hemicellulose in the absence of bulk water[J]. Molecules,2019,24(23):4206−4217. doi: 10.3390/molecules24234206
[20] CLIFFE M J, MOTTILLO C, STEIN R S, et al. Accelerated aging:A low energy, solvent-free alternative to solvothermal and mechanochemical synthesis of metal-organic materials[J]. Chemical Science,2012,3(8):2495−2500. doi: 10.1039/C2SC20344H
[21] HAMMERER F, LOOTS L, DO J L, et al. Solvent‐free enzyme activity:Quick, high‐yielding mechanoenzymatic hydrolysis of cellulose into glucose[J]. Angewandte Chemie International Edition,2018,57(10):2621−2624. doi: 10.1002/anie.201711643
[22] THERIEN J P D, HAMMERER F, FRIŠČIĆ T, et al. Mechanoenzymatic breakdown of chitinous material to N‐acetylglucosamine:The benefits of a solventless environment[J]. ChemSusChem,2019,12(15):3481−3490. doi: 10.1002/cssc.201901310
[23] TAKACS L, MCHENRY J S. Temperature of the milling balls in shaker and planetary mills[J]. Journal of Materials Science,2006,41(16):5246−5249. doi: 10.1007/s10853-006-0312-4
[24] BOLT R R A, LEITCH J A, JONES A C, et al. Continuous flow mechanochemistry:Reactive extrusion as an enabling technology in organic synthesis[J]. Chemical Society Reviews,2022,51(11):4243−4260. doi: 10.1039/D1CS00657F
[25] ANDERSEN J, MACK J. Mechanochemistry and organic synthesis:From mystical to practical[J]. Green Chemistry,2018,20(7):1435−1443. doi: 10.1039/C7GC03797J
[26] BOLM C, HERNáNDEZ J G. From synthesis of amino acids and peptides to enzymatic catalysis:A bottom‐up approach in mechanochemistry[J]. ChemSusChem,2018,11(9):1410−1420. doi: 10.1002/cssc.201800113
[27] RODRÍGUEZ B, BRUCKMANN A, BOLM C. A highly efficient asymmetric organocatalytic aldol reaction in a ball mill[J]. Chemistry-A European Journal,2007,13(17):4710−4722. doi: 10.1002/chem.200700188
[28] HERNÁNDEZ J G, JUARISTI E. Asymmetric aldol reaction organocatalyzed by (S)-proline-containing dipeptides:Improved stereoinduction under solvent-free conditions[J]. The Journal of Organic Chemistry,2011,76(5):1464−1467. doi: 10.1021/jo1022469
[29] DECLERCK V, NUN P, MARTINEZ J, et al. Solvent‐free synthesis of peptides[J]. Angewandte Chemie International Edition,2009,48(49):9318−9321. doi: 10.1002/anie.200903510
[30] HERNÁNDEZ J G, FRINGS M, BOLM C. Mechanochemical enzymatic kinetic resolution of secondary alcohols under ball‐milling conditions[J]. ChemCatChem,2016,8(10):1769−1772. doi: 10.1002/cctc.201600455
[31] SPINELLA S, GANESH M, LO RE G, et al. Enzymatic reactive extrusion:Moving towards continuous enzyme-catalysed polyester polymerisation and processing[J]. Green Chemistry,2015,17(8):4146−4150. doi: 10.1039/C5GC00992H
[32] VAIDYA A A, HUSSAIN I, GAUGLER M, et al. Synthesis of graft copolymers of chitosan-poly(caprolactone) by lipase catalysed reactive extrusion[J]. Carbohydrate Polymers,2019,217:98−109. doi: 10.1016/j.carbpol.2019.03.081
[33] HE C Z, LI H B. Staphylokinase displays surprisingly low mechanical stability[J]. Langmuir:the ACS Journal of Surfaces and Colloids,2017,33(4):1077−1083. doi: 10.1021/acs.langmuir.6b04425
[34] WAHBA M I. Sodium bicarbonate-gelled chitosan beads as mechanically stable carriers for the covalent immobilization of enzymes[J]. Biotechnology Progress,2017,34(2):347−361.
[35] PÉREZ-VENEGAS M, TELLEZ-CRUZ M M, SOLORZA-FERIA O, et al. Thermal and mechanical stability of immobilized candida antarctica lipase B:An approximation to mechanochemical energetics in enzyme catalysis[J]. ChemCatChem,2019,12(3):803−811.
[36] HAMMERER F, OSTADJOO S, FRIŠČIĆ T, et al. Towards controlling the reactivity of enzymes in mechanochemistry:Inert surfaces protect β-glucosidase activity during ball milling[J]. ChemSusChem,2019,13(1):106−110.
[37] RODRIGUES R S, SANT'ANA A S, ROBERTO L F, et al. Solvent-free esterifications mediated by immobilized lipases:A review from thermodynamic and kinetic perspectives[J]. Catalysis Science & Technology,2021,11(17):5696−5711.
[38] ERIKA Z, NICOLAS J, LUDOVIC C, et al. Enzymatic synthesis of amphiphilic carbohydrate esters:Influence of physicochemical and biochemical parameters[J]. Biotechnology Reports,2021,30:631−641.
[39] ULLA W, SAUMYA D, LAURE K, et al. Selective enzymatic esterification of lignin model compounds in the ball mill[J]. Beilstein Journal of Organic Chemistry,2017,13:1788−1795. doi: 10.3762/bjoc.13.173
[40] GAMBOA-VELáZQUEZ G, JUARISTI E. Mechanoenzymology in the kinetic resolution of β-blockers:Propranolol as a case study[J]. ACS Organic & Inorganic Au,2022,2(4):343−350.
[41] PÉREZ-VENEGAS M, JUARISTI E. Mechanochemical and mechanoenzymatic synthesis of pharmacologically active compounds:A green perspective[J]. ACS Sustainable Chemistry & Engineering,2020,8(24):8881−8893.
[42] CARTER E M, AMBROSE-DEMPSTER E, WARD J M, et al. Mechanoenzymatic reactions with whole cell transaminases:Shaken, not stirred[J]. Green Chemistry,2022,24(9):3662−3666. doi: 10.1039/D2GC01006B
[43] BUTYAGIN Y P, STRELETSKII N A. The kinetics and energy balance of mechanochemical transformations[J]. Physics of the Solid State,2005,47(5):856−862. doi: 10.1134/1.1924845
[44] LI Z, JIANG Z, SU W. Fast, solvent-free, highly enantioselective three-component coupling of aldehydes, alkynes, and amines catalyzed by the copper(II)pybox complex under high-vibration ball-milling[J]. Green Chemistry,2015,17(4):2330−2334. doi: 10.1039/C5GC00079C
[45] ZHANG R, WANG Y, SONG X, et al. Eco-friendly mechanobiological assisted extraction of phenolic acids and flavonoids from chrysanthemum[J]. Journal of Pharmaceutical and Biomedical Analysis,2020,186:113327. doi: 10.1016/j.jpba.2020.113327
[46] BYCHKOV A L, KOROLEV K G, LOMOVSKY O I. Obtaining mannanoligosaccharide preparations by means of the mechanoenzymatic hydrolysis of yeast biomass[J]. Applied Biochemistry and Biotechnology,2010,162(7):2008−2014. doi: 10.1007/s12010-010-8976-2
[47] SU W, XU W, POLYAKOV N E, et al. Zero-waste utilization and conversion of shrimp shell by mechanochemical method[J]. Journal of Cleaner Production,2023,425:28−38.
[48] GRüNINGER J, DELAVAULT A, OCHSENREITHER K. Enzymatic glycolipid surfactant synthesis from renewables[J]. Process Biochemistry,2019,87:45−54. doi: 10.1016/j.procbio.2019.09.023
[49] DELAVAULT A, OPOCHENSKA O, LANEQUE L, et al. Lipase-catalyzed production of sorbitol laurate in a “2-in-1” deep eutectic system:factors affecting the synthesis and scalability[J]. Molecules,2021,26(9):2759−2777. doi: 10.3390/molecules26092759
[50] HOLLENBACH R, BINDEREIF B, VAN DER SCHAAF U S, et al. Optimization of glycolipid synthesis in hydrophilic deep eutectic solvents[J]. Frontiers in Bioengineering and Biotechnology, 2020, 382-392.
[51] BUREK B O, DAWOOD A W H, HOLLMANN F, et al. Process intensification as game changer in enzyme catalysis[J]. Frontiers in Catalysis,2022,2:706−723.
[52] HOLLENBACH R, DELAVAULT A, GEBHARDT L, et al. Lipase-mediated mechanoenzymatic synthesis of sugar esters in dissolved unconventional and neat reaction systems[J]. ACS Sustainable Chemistry & Engineering,2022,10(31):10192−10202.
[53] 张俊杰, 王鹏, 岳程程, 等. 淀粉-脂质复合物研究进展[J]. 中国粮油学报,2023,38(8):250−259. [ZHANG Junjie, WANG Peng, YUE Chengcheng, et al. Starch-lipid complexes:A comprehensive review[J]. Journal of the Chinese Cereals and Oils Association,2023,38(8):250−259.] doi: 10.3969/j.issn.1003-0174.2023.08.034 ZHANG Junjie, WANG Peng, YUE Chengcheng, et al. Starch-lipid complexes: A comprehensive review[J]. Journal of the Chinese Cereals and Oils Association, 2023, 38(8): 250−259. doi: 10.3969/j.issn.1003-0174.2023.08.034
[54] LIU J, GAO T, XIN J, et al. Unveiling optimal synthesis and structural insights of starch ferulate via the mechanoenzymatic method[J]. Foods,2023,12(20):3715−3730. doi: 10.3390/foods12203715
[55] ARDILA-FIERRO K J, CRAWFORD D E, KöRNER A, et al. Papain-catalysed mechanochemical synthesis of oligopeptides by milling and twin-screw extrusion:Application in the Juliá-Colonna enantioselective epoxidation[J]. Green Chemistry,2018,20(6):1262−1269. doi: 10.1039/C7GC03205F
[56] KUMAR H, BHARDWAJ K, SHARMA R, et al. Fruit and vegetable peels:Utilization of high value horticultural waste in novel industrial applications[J]. Molecules,2020,25(12):2812−2833. doi: 10.3390/molecules25122812
[57] AL AMIN LEAMON A K M, VENEGAS M P, ORSAT V, et al. Semisynthetic transformation of banana peel to enhance the conversion of sugars to 5-hydroxymethylfurfural[J]. Bioresource Technology,2022,362:127782. doi: 10.1016/j.biortech.2022.127782
[58] 刘俊红, 王建成, 刘瑞芳, 等. 微波-超声波辅助酶解提取香菇中的呈味氨基酸[J]. 河南城建学院学报,2023,32(2):106−112. [LIU Junhong, WANG Jiancheng, LIU Ruifang, et al. Extraction of flavor amino acids from lentinula edodes by enzymatic hydrolysis assisted by ultrasound and microwave J]. Journal of Henan University of Urban Construction,2023,32(2):106−112.
[59] 杨美玉, 杨平平, 申秀娟, 等. 以氨基酸为基础的不同食品组方对小鼠抗疲劳能力的影响[J]. 食品科技,2019,44(12):94−98. [YANG Meiyu, YANG Pingping, SHEN Xiujuan, et al. Effects of different food groups based on amino acids on anti-fatigue ability of mice[J]. Food Science and Technology,2019,44(12):94−98.] YANG Meiyu, YANG Pingping, SHEN Xiujuan, et al. Effects of different food groups based on amino acids on anti-fatigue ability of mice[J]. Food Science and Technology, 2019, 44(12): 94−98.
[60] BYCHKOVA E, POGOROVA V, GOSMAN D, et al. The mechanoenzymatic method for enhancing the biological value of condensed cream soups[J]. IOP Conference Series:Materials Science and Engineering,2021,1019(1):012041. doi: 10.1088/1757-899X/1019/1/012041
[61] 马燕, 魏媛, 王冕, 等. 谷物酚酸合成途径及代谢调控研究进展[J]. 食品科学,2019,40(15):269−276. [MA Yan, WEI Yuan, WANG Mian, et al. A review of process in understand biosynthesis pathway and metabolic regulation of phenolic acids in cereals[J]. Food Science,2019,40(15):269−276.] doi: 10.7506/spkx1002-6630-20180918-198 MA Yan, WEI Yuan, WANG Mian, et al. A review of process in understand biosynthesis pathway and metabolic regulation of phenolic acids in cereals[J]. Food Science, 2019, 40(15): 269−276. doi: 10.7506/spkx1002-6630-20180918-198
[62] 薛智敏, 闫何恋. 氯化胆碱类低共熔溶剂用于木质纤维素预处理的研究进展[J]. 林业工程学报,2024,9(1):32−44. [XUE Zhimin, YAN Helian. Advances on lignocellulose pretreatment by choline chloride-based deep eutectic solvents[J]. Journal of Forestry Engineering,2024,9(1):32−44.] XUE Zhimin, YAN Helian. Advances on lignocellulose pretreatment by choline chloride-based deep eutectic solvents[J]. Journal of Forestry Engineering, 2024, 9(1): 32−44.
[63] ZHANG Q, LU Z, SU C, et al. High yielding, one-step mechano-enzymatic hydrolysis of cellulose to cellulose nanocrystals without bulk solvent[J]. Bioresource Technology,2021,331:125015. doi: 10.1016/j.biortech.2021.125015
[64] XU W, ZHOU C, HU K, et al. Novel mechanoenzymatic strategy for lignin depolymerization[J]. Industrial & Engineering Chemistry Research,2023,62(46):19448−19458.
[65] HAMMERER F, OSTADJOO S, DIETRICH K, et al. Rapid mechanoenzymatic saccharification of lignocellulosic biomass without bulk water or chemical pre-treatment[J]. Green Chemistry,2020,22(12):3877−3884. doi: 10.1039/D0GC00903B
[66] VANDENBOSSCHE V, BRAULT J, VILAREM G, et al. A new lignocellulosic biomass deconstruction process combining thermo-mechano chemical action and bio-catalytic enzymatic hydrolysis in a twin-screw extruder[J]. Industrial Crops and Products,2014,55:258−266. doi: 10.1016/j.indcrop.2014.02.022





 下载:
下载:
 下载:
下载:



