Effect of Fermented Wheat Gluten on the Physicochemical Properties of Soy Protein Isolate Films
-
摘要: 为改良大豆分离蛋白(soy protein isolate,SPI)膜的性质,利用发酵时间为0、2、4、8和24 h的谷朊粉(wheat gluten,WG)与SPI制备复合膜。通过测定膜的微观结构、傅里叶红外光谱、机械性能、水蒸气透过率和热稳定性等指标,探究不同发酵时间的WG对WG-SPI膜理化性质的影响。WG-SPI膜下表面的球形颗粒随WG发酵时间的延长逐渐消失,且含有发酵4 h WG的复合膜具有致密的网络结构。WG-SPI膜在傅里叶变换红外光谱中的酰胺A带吸收峰强度随着WG发酵时间的延长呈先增加后降低的趋势。随着WG发酵时间的增加,WG的高分子量聚合物(high-molecular-weight aggregate,HMWA)条带逐渐减弱,而在干燥形成的WG-SPI膜中HMWA条带呈先增强后减弱的趋势。当WG发酵时间从0 h延长至24 h时,WG-SPI膜的a*值从−3.24逐渐升高至-2.84,b*值从15.02降低至12.19。添加发酵4 h WG制备的WG-SPI膜的抗拉伸强度、上表面接触角和玻璃化转变温度分别达到4.99 MPa、99.67°和59.73 ℃的最高值,水蒸气透过率、透明度值和溶解度分别达到1.34×10−10 g·m−1·s−1·Pa−1、2.11和6.42%的最低值。研究结果表明,利用发酵处理4 h的WG能改善WG-SPI膜的抗拉伸强度、水蒸气阻隔能力和热稳定性,这将为利用WG改良SPI膜的理化性质提供新思路。Abstract: To improve the properties of soy protein isolate (SPI) films, composite films of wheat gluten (WG) and SPI were prepared with fermentation times of 0, 2, 4, 8 and 24 h. The effects of fermentation time on the physicochemical properties of the WG-SPI films were investigated through microstructural analysis of the material, Fourier transformed infrared spectroscopy, and measurements of mechanical properties, water vapor permeability and thermal stability. Spherical particles observed on the lower surface of the WG-SPI films gradually disappeared with increasing WG fermentation time. The WG-SPI films exhibited a dense network structure when WG was fermented for 4 h. The peak intensity of amide A in the WG-SPI films initially increased and then decreased as the WG fermentation time increased. With extended WG fermentation time, the intensity of the high-molecular-weight aggregate (HMWA) band in WG decreased, whereas that of the HMWA bands in WG-SPI films formed by drying first increased and then decreased. Over the fermentation period from 0 to 24 h for WG, the a* value of the WG-SPI films gradually increased from −3.24 to −2.84, while the b* value decreased from 15.02 to 12.19. The tensile strength, contact angle of the upper surface, and glass transition temperature of the WG-SPI films reached their maximum values—4.99 MPa, 99.67° and 59.73 ℃, respectively—when WG was fermented for 4 h. In contrast, the water vapor permeability, transparency value and solubility decreased to minimum values: 1.34×10−10 g·m−1·s−1·Pa−1, 2.11 and 6.42%, respectively. These results suggest that the addition of 4 h fermented WG significantly improves the physiochemical properties of SPI films, particularly in terms of tensile strength, water vapor permeability and thermal stability. This study provides a novel approach for enhancing the physicochemical properties of SPI films.
-
Keywords:
- soy protein isolate /
- wheat gluten /
- fermentation /
- composite films /
- physicochemical properties
-
近年来,天然生物基可食膜的开发逐渐成为食品包装行业的研究热点[1]。大豆分离蛋白(soy protein isolate,SPI)是利用大豆提取油脂过程中产生的副产物进行制备的,具有良好的成膜性[2]。然而,SPI中含有大量亲水性氨基酸导致SPI膜的水蒸气透过率(water vapor permeability,WVP)较高,从而限制了它在食品包装中的应用[3]。谷朊粉(wheat gluten,WG)主要由麦谷蛋白与醇溶蛋白组成,富含疏水性氨基酸[4]。然而,WG水溶性较差,不易与其他材料复合成膜[5]。前期研究发现,添加枧水处理的WG可以与SPI共混成膜并能改良膜的WVP和表面疏水性,这可能与枧水处理促进WG的蛋白质结构展开有关[6]。
有研究报道,不仅采用化学方法可以提高WG的水溶性,还可以通过超声、高压处理、酶解、微生物发酵等方法进行改良。超声处理会破坏WG多肽链中的氢键和分子间共价键,提高蛋白质的水溶性[7];400 MPa静水高压处理可以破坏蛋白质二硫键而提高WG的水溶性[8]。微生物发酵是利用发酵产生的酸与微生物分泌的酶使蛋白质结构伸展甚至降解进而改变其理化性质[9]。Tian等[10]利用乳酸菌发酵可以使高粱蛋白、大豆蛋白和蛋清蛋白等蛋白质的结构展开进而提高其在水中的溶解性。Kalantarmahdavi等[11]研究发现利用乳酸杆菌发酵的小麦粉制备可食膜后会使松散的网络结构变得光滑致密,进而提高膜的抗拉伸强度(tensile strength,TS)和水蒸气阻隔能力。以上研究表明,利用微生物发酵应该可以促进WG蛋白结构展开进而改变其成膜能力,然而有关发酵WG对WG-SPI膜理化性质的影响研究尚未见报道。
为了探究发酵WG对SPI膜理化性质的影响,本研究选择发酵时间为2、4、8和24 h的WG和SPI制备复合膜,测定WG-SPI复合膜的机械性能、水蒸气透过率(water vapor permeability,WVP)、热稳定性等性质,并利用扫描电子显微镜(scanning electron microscopy,SEM)和傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)对膜进行结构表征。本研究旨在利用发酵WG改良WG-SPI膜的理化性质,以解决SPI膜水蒸气阻隔能力差的问题,研究结果为利用疏水性蛋白改良SPI膜的性质提供理论参考。
1. 材料与方法
1.1 材料与仪器
大豆分离蛋白(蛋白含量91%) 临沂山松生物制品有限公司;谷朊粉(蛋白含量77.5%)封丘县华丰粉业有限公司;活性干酵母 安琪酵母股份有限公司;Na2CO3、K2CO3(分析纯) 西陇科学股份有限公司;十二烷基硫酸钠、丙烯酰胺(分析纯) 美国Bio-Rad公司;β-巯基乙醇(分析纯) 上海麦克林生化科技有限公司。
WFB-A617破壁机 美国西屋电器公司;UM113搅拌脱泡机 日本Unix公司;G-7C厚度计 日本Ozaki MFG公司;PhenomProX G6扫描电子显微镜 美国赛默飞世尔科技公司;Nicolet iS50傅里叶变换红外光谱仪 美国Thermo Nicolet公司;TA-XT Plus质构仪 英国Stable Micro System公司;SDC-200光学接触角测量仪 东莞晟鼎精密仪器有限公司;YS3010色差仪 深圳三恩时科技有限公司;UV-8000A紫外-可见分光光度计 上海元析仪器有限公司;Q2000差示扫描量热仪 美国TA公司。
1.2 实验方法
1.2.1 发酵WG的制备
称取3 g活性干酵母和10 g白砂糖,分散在200 mL蒸馏水中后,放在30 ℃水浴下活化20 min。将活化的200 mL酵母菌液与200 g WG混合均匀,在30 ℃和相对湿度(relative humidity,RH)75%的环境下进行发酵,分别在第2、4、8和24 h取样供以下实验使用。
1.2.2 WG-SPI膜的制备
将0.9 g Na2CO3和0.1 g K2CO3溶解于100 mL蒸馏水配制成枧水。取12 g发酵WG与6 g SPI溶解在150 mL蒸馏水中,加入2.4 g甘油,使用枧水将pH调至9后,采用破壁机处理10 min,再放在75 ℃下搅拌30 min,制备WG-SPI蛋白成膜液。将蛋白成膜液脱除气泡后浇筑在硅树脂板上,在25 ℃和RH 50%下干燥24 h。将干燥的WG-SPI膜从硅树脂板上剥离下来,放在25 ℃和RH 50%下平衡48 h后分析理化性质。
1.2.3 微观结构
膜样品上表面和下表面的微观结构通过SEM观察。膜样品置于干燥硅胶中充分脱水,在膜表面喷金后,在10 kV的加速电压下,以20000×的放大倍数进行拍摄。
1.2.4 傅里叶变换红外光谱
使用FTIR光谱仪设置波数范围为4000~800 cm−1。膜样品放在干燥硅胶中充分脱水后,在4 cm−1的分辨率下扫描32次得到光谱图。
1.2.5 机械性能
将膜样品裁成20 mm×45 mm的矩形,并使用厚度计测量膜样品的厚度。使用质构仪测定膜的机械性能,其中夹具初始间距设置为30 mm,测试速率设置为60 mm/min。根据公式(1)和(2)分别计算TS和断裂伸长率(elongation at break,EAB)。
TS(MPa)=FmA (1) 式中:Fm为拉断样品所需的最大拉力(N);A为截面面积(mm2)。
EAB(\%)=L30×100 (2) 式中:L值为膜断裂时增加的长度(mm);30为膜的初始长度(mm)。
1.2.6 WVP
测定前,使用厚度计测量膜样品的厚度。利用膜密封装有干燥硅胶的塑料瓶口后,将塑料瓶置于30 ℃和RH 100%的密闭环境中,测定塑料瓶的重量随储存时间的变化。根据公式(3)计算膜样品的WVP。
WVP(g⋅m−1×s−1⋅Pa−1)=w × xA × t ×Δp (3) 式中:w为塑料瓶增加的重量(g);x为膜的厚度(m);A为膜覆盖塑料瓶口的面积(m2);t为储存时间(s);Δp为膜两侧的水蒸气压差(4244.9 Pa)。
1.2.7 接触角
使用光学接触角测量仪测定膜的表面接触角。将膜样品平铺在载物台上,取蒸馏水(2 μL)滴加在膜表面,2 s后立即拍照并使用SDC-200配套软件计算表面接触角。
1.2.8 色泽
以标准板(L0*=91.86,a0*=−0.88,b0*=1.42)作为对照,使用色差仪测定膜的色泽参数L*值(亮度)、a*值(红度)和b*值(黄度)。
1.2.9 透明度值
实验前,使用厚度计随机测量膜样品上的5个点以计算平均厚度。使用紫外-可见分光光度计测定膜的透明度值。以空气作为背景,将膜样品固定在样品支架上,在波长600 nm处进行测定。并根据公式(4)计算得到复合膜的透明度值。
透明度值=-log T600x (4) 式中:T600为600 nm处的透光率(%);x为膜的厚度(mm)。
1.2.10 溶解度
实验前,测定膜样品的水分含量。将膜样品称重后浸没在30 ℃蒸馏水中,振荡24 h后过滤收集不溶解的部分并在105 ℃干燥24 h。根据公式(5)计算复合膜的溶解度。
溶解度(%)=m0−m0×MC−m1m0−m0×MC×100 (5) 式中:m0为膜的初始质量(g);m1为膜不溶解部分干燥后的质量(g);MC为膜的水分含量(%)。
1.2.11 差示扫描量热分析
精确称取充分干燥2 mg左右的膜样品密封在液体铝坩埚中,以5 ℃/min的升温速率从20 ℃升温至80 ℃。实验后,使用配套软件处理得到膜的玻璃化转变温度(glass transition temperature,Tg)。
1.2.12 十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)
使用SDS-PAGE对发酵WG、WG-SPI膜中的蛋白组成进行分析。将样品溶解在含有20 mmol/L Tris-HCL、2% SDS、8 mol/L尿素的缓冲液(pH8.8)中,添加或不添加β-巯基乙醇得到电泳样品。使用浓度为4%的浓缩胶和浓度为10%的分离胶进行电泳。电泳时,浓缩胶部分采用8 mA恒定电流进行,分离胶部分采用12 mA恒定电流进行。电泳结束后,使用考马斯亮蓝R-250染色,并在甲醇和乙酸的混合溶液中脱色。
1.3 数据处理
所有实验至少重复3次,以平均值±标准偏差的形式显示结果。使用Origin软件作图。使用SPSS statistics 26.0软件对数据进行单因素方差分析和Duncan’s检验分析显著性差异(P<0.05)。
2. 结果与分析
2.1 微观结构
图1显示了发酵WG对WG-SPI膜微观形貌的影响。利用未发酵的WG制备的WG-SPI膜上表面光滑致密而下表面显示出含有球形颗粒的粗糙结构。随WG发酵时间的增加,WG-SPI膜下表面的球形颗粒逐渐消失,且下表面的粗糙度呈现先减小后增大的趋势。这是由于WG经过发酵处理后发生解聚,结果导致球形麦谷蛋白颗粒消失[12]。另一方面,WG经过适当发酵后蛋白质结构展开[13],可能促进复合膜中的蛋白分子间相互作用,结果导致膜的表面粗糙度降低。WG经长时间发酵后会呈现出碎片状的结构[12],这可能导致WG-SPI膜的表面粗糙度增加。
2.2 傅里叶变换红外光谱
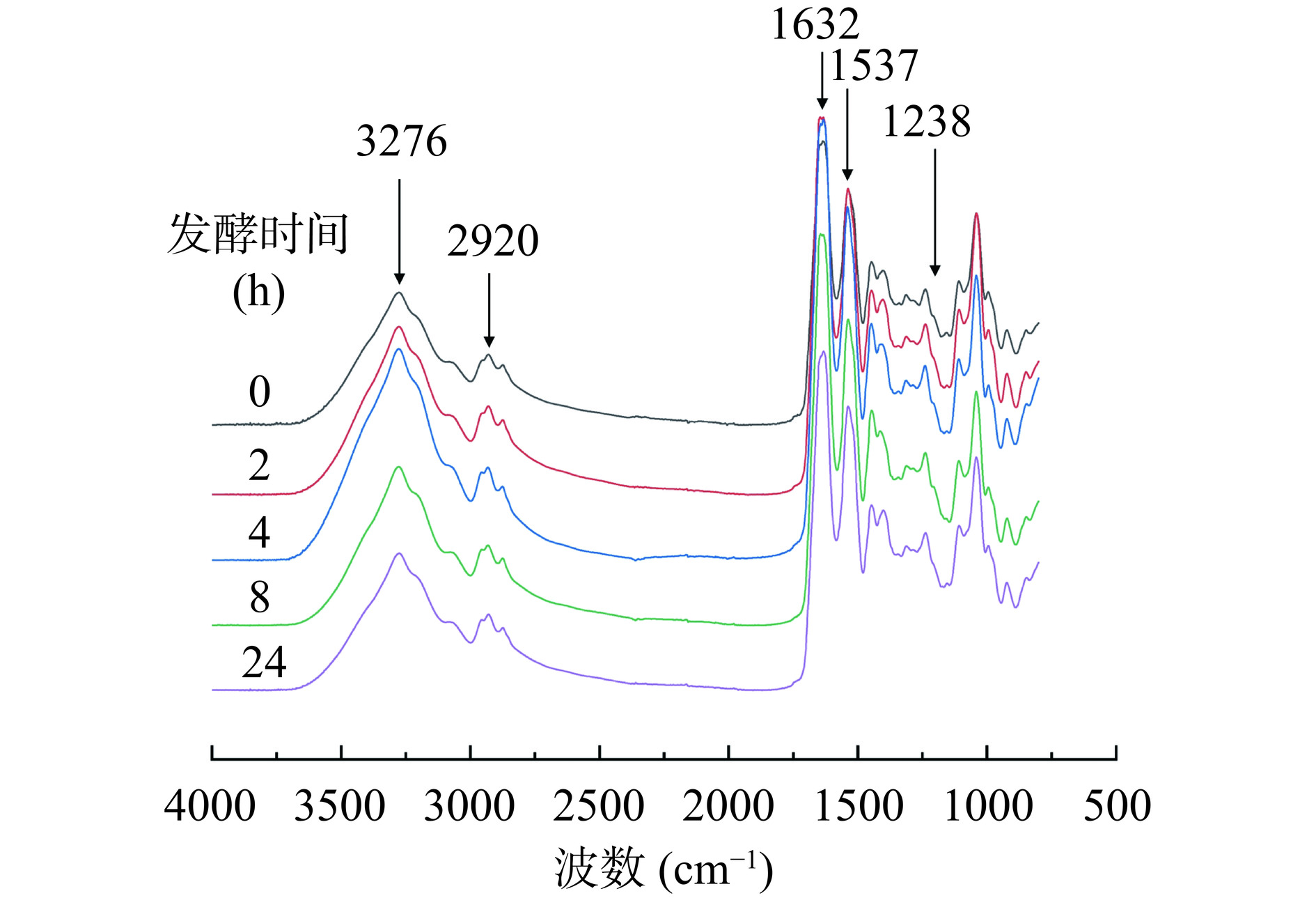
含有不同发酵时间WG的WG-SPI膜的傅里叶变换红外光谱如图2所示。研究报道,波数3274 cm−1的酰胺A带特征峰与-NH和-OH基团有关,特征峰的强度与氢键相互作用呈正相关;波数1633、1532、1235 cm−1的特征峰代表的酰胺Ⅰ带、酰胺Ⅱ带和酰胺Ⅲ带分别与C=O拉伸、N-H弯曲和C-N拉伸有关,特征峰的强度与共价键呈正相关[14−15]。
当WG的发酵时间从0 h增加至4 h时,WG-SPI膜的酰胺A带、酰胺Ⅰ带和酰胺ⅠⅠ带的特征峰强度均逐渐增强。当WG的发酵时间继续增加,WG-SPI膜的酰胺A带、酰胺Ⅰ带和酰胺ⅠⅠ带的特征峰强度却逐渐减弱。这可能是由于WG经过适当发酵处理后蛋白质结构展开,促进了膜基质中WG与SPI间的氢键和共价键相互作用。研究报道,油菜籽蛋白经碱性蛋白酶处理后蛋白结构展开,蛋白-壳聚糖间的相互作用增强,结果导致酰胺A带吸收峰强度增加[16]。Zhao等[12]研究了枯草芽孢杆菌发酵对WG结构的影响,结果发现WG经过120 h发酵后发生降解,分子间氢键遭到破坏,结果导致酰胺A带的特征峰强度明显降低。
2.3 机械性能
不同发酵时间的WG对WG-SPI膜机械性能的影响如表1所示。利用未发酵的WG制备的WG-SPI膜的TS和EAB分别为4.03 MPa和73.75%。当WG发酵时间为4 h时,WG-SPI膜的TS和EAB分别增加至4.99 MPa和89.54%。继续增加WG发酵时间,WG-SPI膜的TS显著减小(P<0.05)而EAB无显著变化(P>0.05)。Zhang等[16]研究发现添加碱性蛋白酶适当水解的油菜籽分离蛋白能改善蛋白-壳聚糖复合膜基质间的相容性,增强膜中分子间相互作用,进而提高复合膜的TS和EAB。在本研究中,WG经4 h发酵后与SPI可以形成致密的网络结构(图1),结果导致WG-SPI膜的TS最强。然而,WG发酵时间超过4 h时,WG-SPI膜的TS出现降低趋势,这可能是发酵过度导致WG与SPI相互作用下降。Kalantarmahdavi等[11]研究发现小麦粉经48 h过度发酵后,利用其制备的可食膜结构松散,TS发生下降。也有研究表明,可食膜的TS和EAB通常与膜的网络结构和分子间相互作用力相关,增强分子间相互作用力有利于形成致密的网络结构,进而提高膜的TS和EAB[17]。
表 1 发酵WG对WG-SPI膜机械性能的影响Table 1. Effect of fermented WG on mechanical properties of WG-SPI films发酵时间(h) TS(MPa) EAB(%) 0 4.03±0.28c 73.75±12.02b 2 4.44±0.24b 94.97±14.91a 4 4.99±0.14a 89.54±5.02ab 8 4.60±0.35ab 92.02±20.05a 24 4.32±0.31bc 92.99±12.44a 注:同一列中不同小写字母代表显著性差异(P<0.05)。 2.4 WVP
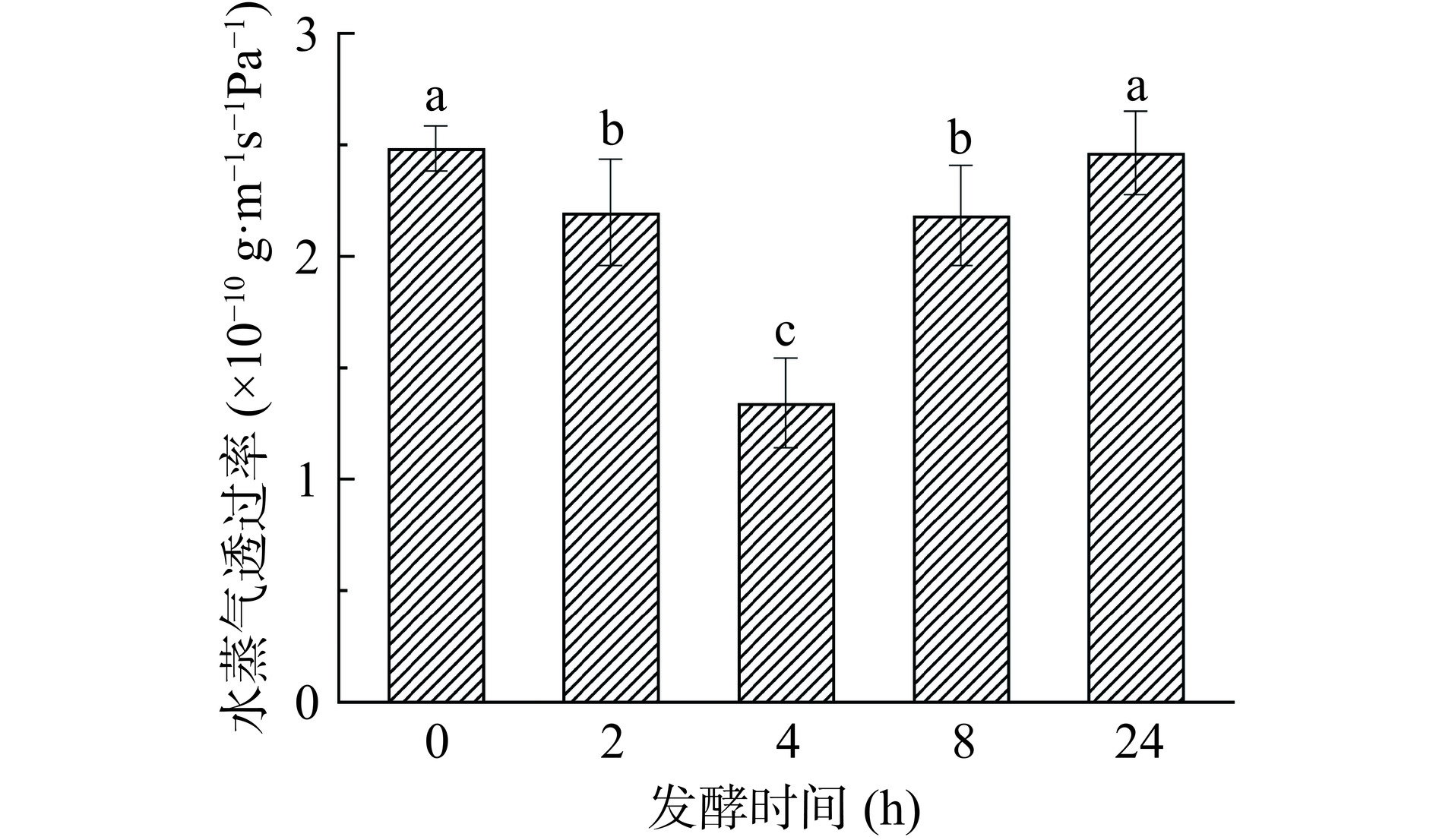
不同发酵时间的WG对WG-SPI膜WVP的影响如图3所示。伴随WG发酵时间的延长,WG-SPI膜的WVP呈先降低后增加的趋势(P<0.05)。当WG发酵时间为4 h时,WG-SPI膜的WVP最小(1.34×10−10 g·m−1·s−1·Pa−1),这可能与利用发酵4 h WG制备的WG-SPI膜具有最光滑致密的网络结构有关(图1)。Nilsuwan等[18]研究鸡肉分离蛋白-鱼明胶复合膜时,也发现复合膜具有致密的网络结构会阻碍水蒸气的透过,结果导致复合膜的WVP降低。另一方面,Zhang等[19]研究发现,WG经过碱性蛋白酶酶解后内部的疏水基团暴露会导致WG的疏水性增强,然而经过2 h酶解后,WG被切割成短肽并且其疏水性降低。Choi等[20]研究发现蛋白质的疏水基团暴露越多,玉米淀粉-豌豆分离蛋白复合膜的WVP越低。研究结果表明,WG经4 h发酵处理后蛋白质结构展开并形成致密的网络结构(图1),但发酵24 h后不仅致密的网络被破坏而且疏水性也有可能被削弱,导致膜的WVP出现增大的趋势。
2.5 接触角
WG发酵时间对WG-SPI膜接触角的影响如表2所示。研究报道,接触角越大说明膜的表面疏水性越强[21]。WG发酵时间相同的条件下,WG-SPI膜上表面的接触角均大于下表面。当WG发酵时间从0 h延长至4 h时,WG-SPI膜的上表面和下表面的接触角分别从88.93°和79.91°增加至99.67°和87.30°,这可能与膜的表面粗糙度降低(图1)有关。研究报道,光滑的表面会减缓水滴在膜表面扩散,导致魔芋葡甘聚糖-玉米醇溶蛋白复合膜的接触角提高[22]。然而,WG发酵时间超过4 h后膜的表面结构变粗糙(图1),水滴容易在粗糙的表面发生扩散,导致膜的接触角减小(P<0.05)。
表 2 发酵WG对WG-SPI膜接触角的影响Table 2. Effect of fermented WG on contact angle of WG-SPI films发酵时间(h) 接触角(°) 上表面 下表面 0 88.93±2.86dA 79.91±2.07cB 2 94.23±2.43bA 83.84±3.75bB 4 99.67±2.70aA 87.30±1.67aB 8 95.35±1.66bA 83.94±2.28bB 24 91.84±2.33cA 82.47±3.06bcB 注:同一列中不同小写字母代表显著性差异(P<0.05);同一行中不同大写字母代表显著性差异(P<0.05)。 2.6 色泽
WG发酵时间对WG-SPI膜色泽的影响如表3所示。利用未发酵的WG制备的WG-SPI膜的L*值、a*值和b*值分别为90.00、−3.24和15.02。当WG发酵时间延长至2 h时,WG-SPI膜的L*值和a*值分别增加至91.01和−3.19,而b*值降低至13.42。伴随WG的发酵时间进一步延长,WG-SPI膜的L*值无明显变化,a*值逐渐增大而b*值逐渐减小。研究报道,伴随发酵时间的增加,小麦蛋白中游离出的赖氨酸和还原糖发生的美拉德反应增强,结果导致WG的a*值增大[23]。也有研究发现,发酵过程中产生的酸会破坏WG中的叶黄素[24],可能导致WG-SPI膜b*值随发酵时间的延长而减小。
表 3 发酵WG对WG-SPI膜色泽和透明度值的影响Table 3. Effect of fermented WG on color and transparency value of WG-SPI films发酵时间(h) 颜色参数 透明度值 L* a* b* 0 90.00±0.18b -3.24±0.10c 15.02±0.56a 2.80±0.35a 2 91.01±0.08a -3.19±0.04bc 13.42±0.21b 2.45±0.19b 4 90.93±0.25a -3.01±0.11b 13.08±0.59bc 2.11±0.11c 8 90.59±0.15a -2.91±0.09ab 12.96±0.40bc 2.21±0.14bc 24 90.81±0.44a -2.84±0.06a 12.19±0.63c 2.31±0.12bc 注:同一列中不同小写字母代表显著性差异(P<0.05)。 2.7 透明度值
不同发酵时间的WG对WG-SPI膜透明度值的影响如表3所示,当WG发酵时间从0 h延长至4 h时,WG-SPI膜的透明度值从2.80显著降低至2.11(P<0.05),伴随WG发酵时间进一步延长,WG-SPI膜的透明度值却出现增大。这是由于WG发酵时间为4 h的WG-SPI膜表面粗糙度最低(图1),导致光透过膜时发生的光散射最少。Dong等[25]研究WG-蛋清蛋白复合膜时,也发现粗糙的表面会增加光的散射,结果导致膜的透明度值增大。研究表明,WG经4 h发酵处理后与SPI分子间的相互作用增强,形成光滑平整的网络结构,导致膜的透明度值最低。
2.8 溶解度
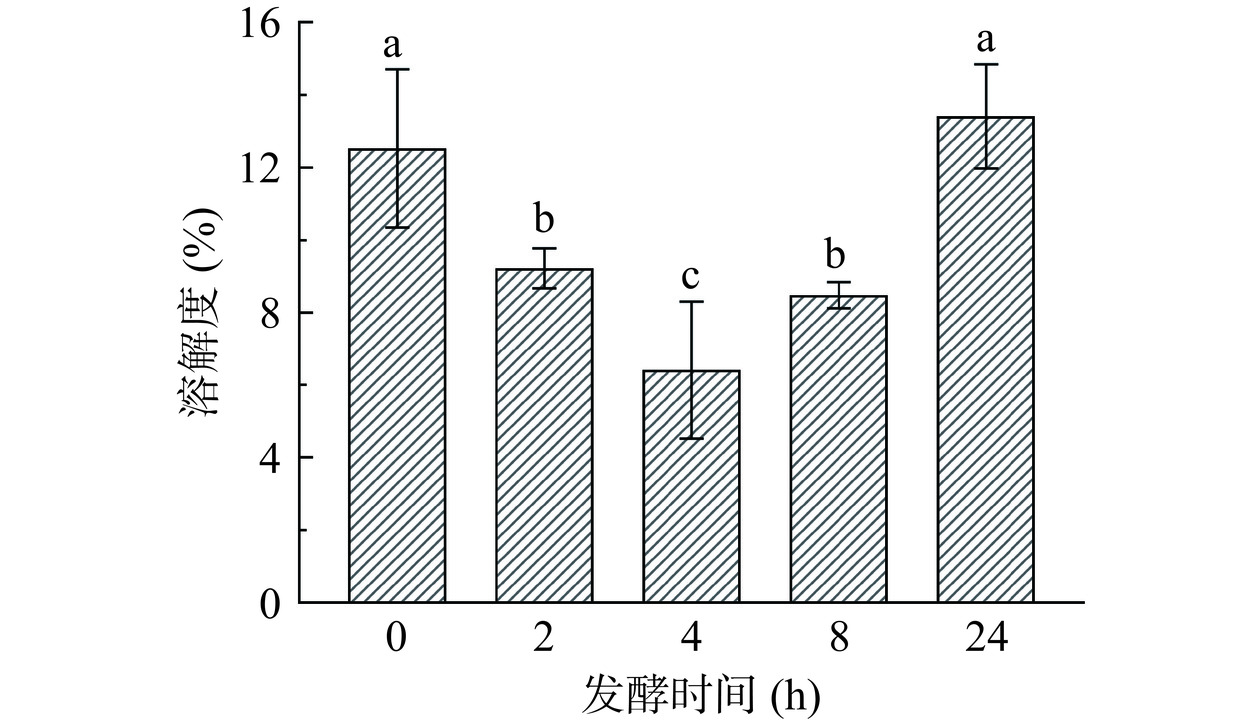
不同发酵时间的WG对WG-SPI膜溶解度的影响如图4所示。WG发酵时间从0 h延长至4 h时,WG-SPI膜的溶解度从12.53%降低至6.42%。WG的发酵时间继续增加,WG-SPI膜的溶解度却显著增大(P<0.05)。这可能与WG经过4 h的发酵处理后增强了膜中WG与SPI的蛋白分子间氢键相互作用有关(图2)。Fu等[26]研究玉米醇溶蛋白-SPI复合膜时,也发现膜中的蛋白分子间氢键相互作用增强能减少蛋白与水分子之间反应,结果导致膜的溶解度降低。Kalantarmahdavi等[11]研究发酵小麦粉制备可食膜的理化性质时,发现小麦粉经乳酸杆菌发酵48 h后制备的可食膜的网络结构松散,结果导致膜的溶解度上升。结果表明,当WG过度发酵其蛋白结构可能遭到破坏,蛋白质分子间的氢键相互作用减弱,结果使膜的溶解度上升。
2.9 差示扫描量热分析
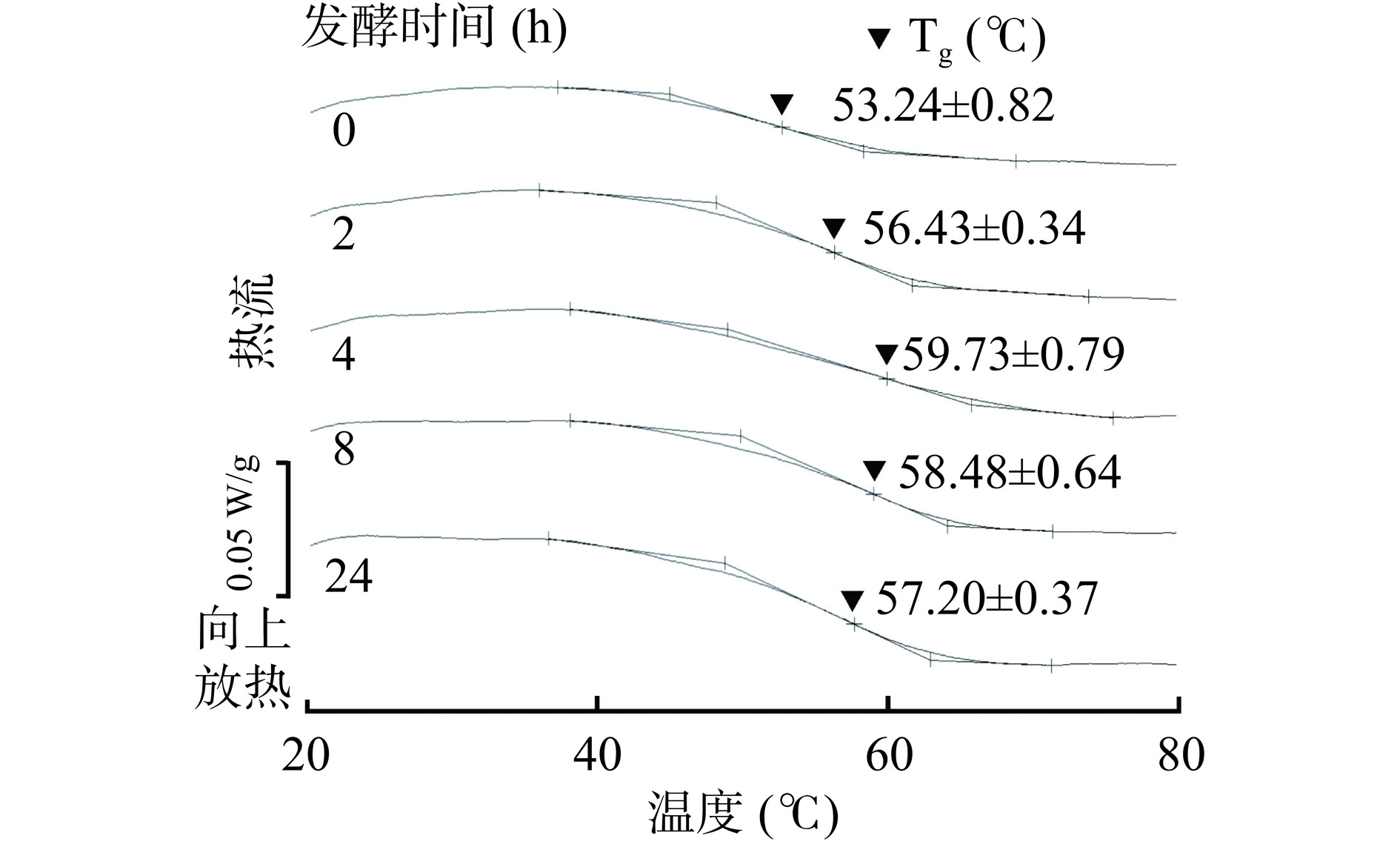
Tg反映了膜的热稳定性,其Tg越高表明膜的热稳定性越强[27]。WG发酵时间对WG-SPI膜的Tg的影响如图5所示。利用未发酵的WG制备的WG-SPI膜Tg为53.24 ℃,而利用发酵4 h WG制备的WG-SPI膜Tg增加至59.73 ℃。当WG发酵时间继续增加,WG-SPI膜的Tg却出现减小趋势。研究报道,复合膜组分间的相互作用越强,破坏膜基质中的分子链所需的温度就越高,膜的Tg就越大[28]。在本研究中,WG发酵时间从0 h增加至4 h后复合膜中WG与SPI的蛋白分子间相互作用增强(图2),且WG-SPI膜的TS增加(表1),这与膜的Tg变化趋势一致。另一方面,当WG发酵时间超过4 h后WG-SPI膜组分的蛋白分子间相互作用减弱(图2),可能导致膜的Tg下降。Xiao等[29]研究纤维素纳米晶-SPI复合膜的理化性质时也发现膜基质中的分子间相互作用减弱会降低膜的热稳定性。研究结果发现添加发酵4 h的WG可以提高WG与SPI间的相互作用,进而提高膜的TS和热稳定性。
2.10 电泳分析
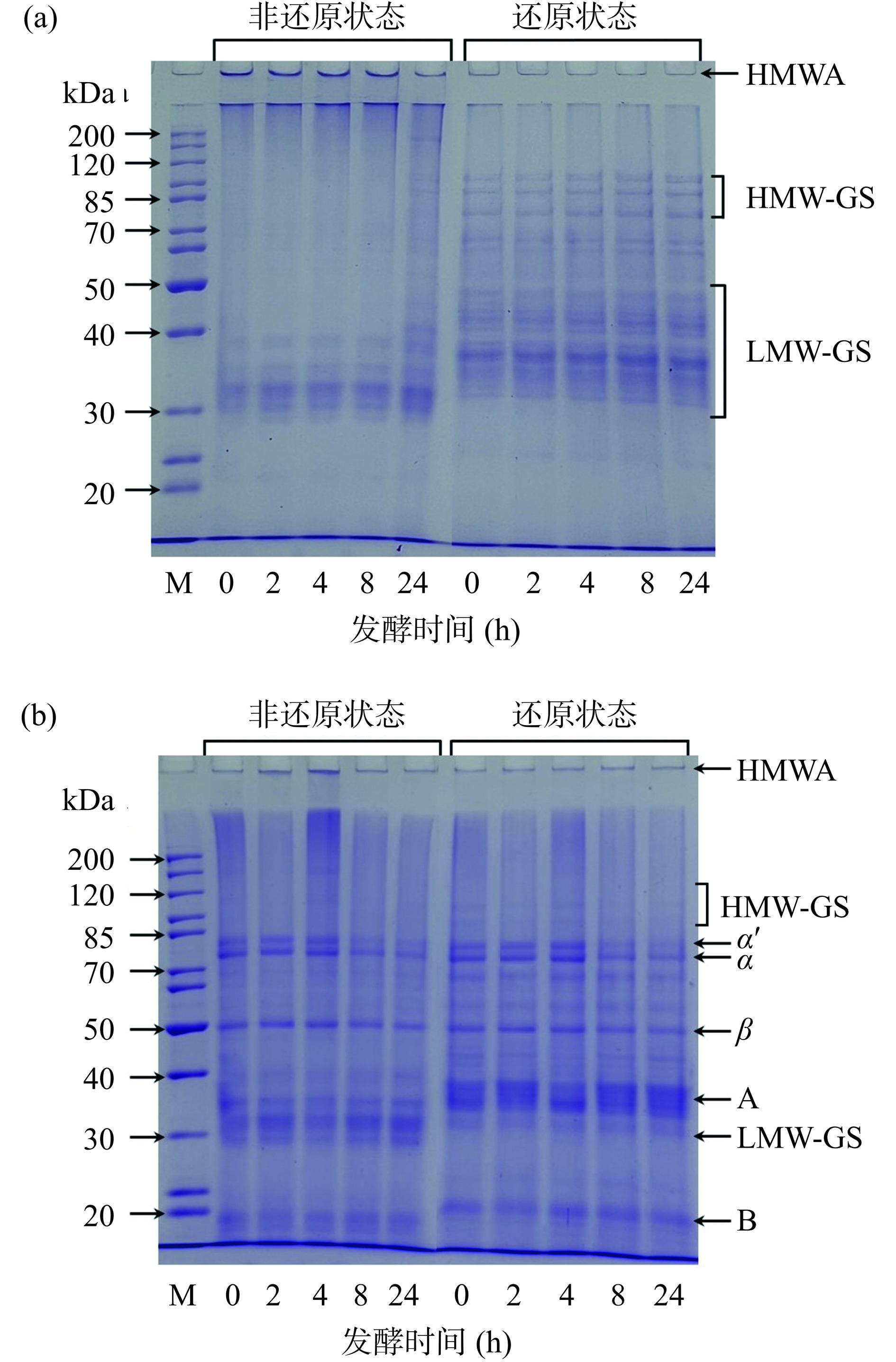
图6显示了不同发酵时间对WG,不同发酵时间的WG对WG-SPI膜蛋白质组成的影响。研究报道,SPI主要由α'、α、β、A和B亚基组成[30],WG主要由高分子量谷蛋白亚基(HMW-GS)和低分子量谷蛋白亚基(LMW-GS)组成[31]。发酵时间对WG蛋白组成的影响如图6(a)所示。在非还原条件下,WG主要含有无法进入浓缩胶的高分子量聚合物(HMWA)和LMW-GS亚基。当WG发酵时间增加至24 h时,WG的HMWA条带浓度减弱,LMW-GS亚基的条带浓度增强。Deng等[32]研究酸面团发酵对WG的影响时,也发现经过24 h的发酵后WG发生部分水解,结果导致LMW-GS条带的浓度增强。在还原条件的SDS-PAGE中,WG的HMWA条带消失且HMW-GS和LMW-GS亚基条带的浓度增强。图6(a)的结果表明,WG经过长时间发酵可能发生水解,导致二硫键占比下降。
不同发酵时间的WG对WG-SPI膜蛋白组成的影响如图6(b)所示。在非还原条件下,伴随WG发酵时间的增加,WG-SPI膜的HMWA条带浓度均呈现先增加后降低的趋势。HMWA条带浓度的增加可能是WG经适当发酵后复合膜基质中的蛋白分子间相互作用增强导致(图2)。Chambi等[33]研究明胶-酪蛋白复合膜时也发现,膜中的蛋白发生交联会导致HMWA条带的形成。然而,WG经过24 h发酵后发生降解,分子间二硫键遭到破坏,结果可能导致膜的HMWA条带的浓度降低。在还原条件的SDS-PAGE中,复合膜的HMWA条带消失而A和B亚基的条带浓度增加。这些结果进一步表明,WG适当发酵可能会促进WG-SPI膜基质中蛋白质分子间的交联,导致膜的机械性能(表1)、水蒸气阻隔能力(图3)和热稳定性(图5)提高。
3. 结论
本研究揭示了不同发酵时间的WG对WG-SPI膜理化性质的影响规律。当WG发酵时间为4 h时,干燥获得的WG-SPI膜的表面粗糙度最低,其表面疏水性最好。WG经过适当发酵后有利于与SPI发生相互作用,形成致密的网络结构,进而提高膜的机械性能、水蒸气阻隔能力和热稳定性。然而,发酵时间超过4 h的WG容易发生降解,破坏了WG-SPI膜致密的网络结构,导致膜的透明度值和溶解度出现增大。研究结果表明,发酵时间为4 h的WG可以显著改良WG-SPI膜的理化性质。
-
表 1 发酵WG对WG-SPI膜机械性能的影响
Table 1 Effect of fermented WG on mechanical properties of WG-SPI films
发酵时间(h) TS(MPa) EAB(%) 0 4.03±0.28c 73.75±12.02b 2 4.44±0.24b 94.97±14.91a 4 4.99±0.14a 89.54±5.02ab 8 4.60±0.35ab 92.02±20.05a 24 4.32±0.31bc 92.99±12.44a 注:同一列中不同小写字母代表显著性差异(P<0.05)。 表 2 发酵WG对WG-SPI膜接触角的影响
Table 2 Effect of fermented WG on contact angle of WG-SPI films
发酵时间(h) 接触角(°) 上表面 下表面 0 88.93±2.86dA 79.91±2.07cB 2 94.23±2.43bA 83.84±3.75bB 4 99.67±2.70aA 87.30±1.67aB 8 95.35±1.66bA 83.94±2.28bB 24 91.84±2.33cA 82.47±3.06bcB 注:同一列中不同小写字母代表显著性差异(P<0.05);同一行中不同大写字母代表显著性差异(P<0.05)。 表 3 发酵WG对WG-SPI膜色泽和透明度值的影响
Table 3 Effect of fermented WG on color and transparency value of WG-SPI films
发酵时间(h) 颜色参数 透明度值 L* a* b* 0 90.00±0.18b -3.24±0.10c 15.02±0.56a 2.80±0.35a 2 91.01±0.08a -3.19±0.04bc 13.42±0.21b 2.45±0.19b 4 90.93±0.25a -3.01±0.11b 13.08±0.59bc 2.11±0.11c 8 90.59±0.15a -2.91±0.09ab 12.96±0.40bc 2.21±0.14bc 24 90.81±0.44a -2.84±0.06a 12.19±0.63c 2.31±0.12bc 注:同一列中不同小写字母代表显著性差异(P<0.05)。 -
[1] 邓霜琪, 廖晶晶, 吴海柱, 等. 杨梅单宁-酪蛋白复合膜的制备及性能评价[J]. 食品工业科技,2023,44(17):35−41. [DENG S Q, LIAO J J, WU H Z, et al. Preparation and properties evaluation of casein-based film incorporated with Chinese bayberry tannin[J]. Science and Technology of Food Industry,2023,44(17):35−41.] DENG S Q, LIAO J J, WU H Z, et al. Preparation and properties evaluation of casein-based film incorporated with Chinese bayberry tannin[J]. Science and Technology of Food Industry, 2023, 44(17): 35−41.
[2] KOSHY R R, MARY S K, THOMAS S, et al. Environment friendly green composites based on soy protein isolate–A review[J]. Food Hydrocolloids,2015,50:174−192. doi: 10.1016/j.foodhyd.2015.04.023
[3] RANI P, YU X, LIU H, et al. Material, antibacterial and anticancer properties of natural polyphenols incorporated soy protein isolate:A review[J]. European Polymer Journal,2021,152:110494. doi: 10.1016/j.eurpolymj.2021.110494
[4] IWAKI S, HAYAKAWA K, FU B X, et al. Changes in hydrophobic interactions among gluten proteins during dough formation[J]. Processes,2021,9(7):1244. doi: 10.3390/pr9071244
[5] JOYE I J, MCCLEMENTS D J. Emulsifying and emulsion-stabilizing properties of gluten hydrolysates[J]. Journal of Agricultural and Food Chemistry,2014,62(12):2623−2630. doi: 10.1021/jf5001343
[6] 江睿钊, 石林凡, 任中阳, 等. 谷朊粉对大豆分离蛋白膜理化性质的影响[J]. 中国粮油学报,2024,39(5):79−85. [JIANG R Z, SHI L F, REN Z Y, et al. Effect of wheat gluten on the physicochemical properties of soy protein isolate films[J]. Journal of the Chinese Cereals and Oils Association,2024,39(5):79−85.] JIANG R Z, SHI L F, REN Z Y, et al. Effect of wheat gluten on the physicochemical properties of soy protein isolate films[J]. Journal of the Chinese Cereals and Oils Association, 2024, 39(5): 79−85.
[7] ZHANG H, CHEN G, LIU M, et al. Effects of multi-frequency ultrasound on physicochemical properties, structural characteristics of gluten protein and the quality of noodle[J]. Ultrasonics Sonochemistry,2020,67:105135. doi: 10.1016/j.ultsonch.2020.105135
[8] YAO Y, JIA Y, LU X, et al. Release and conformational changes in allergenic proteins from wheat gluten induced by high hydrostatic pressure[J]. Food Chemistry,2022,368:130805. doi: 10.1016/j.foodchem.2021.130805
[9] JIANG Y, JIA J, XIONG D, et al. Effects of short-term fermentation with lactic acid bacteria on egg white:Characterization, rheological and foaming activities[J]. Food Hydrocolloids,2020,101:105507. doi: 10.1016/j.foodhyd.2019.105507
[10] TIAN L, HU S, JIA J, et al. Effects of short-term fermentation with lactic acid bacteria on the characterization, rheological and emulsifying properties of egg yolk[J]. Food Chemistry,2021,341:128163. doi: 10.1016/j.foodchem.2020.128163
[11] KALANTARMAHDAVI M, KHANZADI S, SALARI A. Edible films incorporating with Lactobacillus plantarum based on sourdough, wheat flour, and gelatin:Films characterization and cell viability during storage and simulated gastrointestinal condition[J]. Starch-Stä rke,2021,73(9-10):2000268.
[12] ZHAO P, HOU Y C, WANG Z, et al. Effect of fermentation on structural properties and antioxidant activity of wheat gluten by Bacillus subtilis[J]. Frontiers in Nutrition,2023,10:1116982. doi: 10.3389/fnut.2023.1116982
[13] NUTTER J, SAIZ A I, IURLINA M O. Microstructural and conformational changes of gluten proteins in wheat-rye sourdough[J]. Journal of Cereal Science,2019,87:91−97. doi: 10.1016/j.jcs.2019.03.006
[14] HU Y, SHI L, REN Z, et al. Characterization of emulsion films prepared from soy protein isolate at different preheating temperatures[J]. Journal of Food Engineering,2021,309:110697. doi: 10.1016/j.jfoodeng.2021.110697
[15] ERTAN K, SAHIN S, SUMNU G. Effects of alkaline pH and gallic acid enrichment on the physicochemical properties of sesame protein and common vetch starch-based composite films[J]. International Journal of Biological Macromolecules,2024,257:128743. doi: 10.1016/j.ijbiomac.2023.128743
[16] ZHANG C, WANG Z, LI Y, et al. The preparation and physiochemical characterization of rapeseed protein hydrolysate-chitosan composite films[J]. Food Chemistry,2019,272:694−701. doi: 10.1016/j.foodchem.2018.08.097
[17] ZAREIE Z, YAZDI F T, MORTAZAVI S A. Development and characterization of antioxidant and antimicrobial edible films based on chitosan and gamma-aminobutyric acid-rich fermented soy protein[J]. Carbohydrate Polymers,2020,244:116491. doi: 10.1016/j.carbpol.2020.116491
[18] NILSUWAN K, ARNOLD M, BENJAKUL S, et al. Properties of chicken protein isolate/fish gelatin blend film incorporated with phenolic compounds and its application as pouch for packing chicken skin oil[J]. Food Packaging and Shelf Life,2021,30:100761. doi: 10.1016/j.fpsl.2021.100761
[19] ZHANG Y, WANG W, LIU Y, et al. Cryoprotective effect of wheat gluten enzymatic hydrolysate on fermentation properties of frozen dough[J]. Journal of Cereal Science,2022,104:103423. doi: 10.1016/j.jcs.2022.103423
[20] CHOI I, CHOI M H, HAN J. Exploring the effect of corn starch/pea protein blending on the physicochemical and structural properties of biopolymer films and their aging resistance[J]. International Journal of Biological Macromolecules,2024,269:132092. doi: 10.1016/j.ijbiomac.2024.132092
[21] 鄢煦, 陶宇轩, 叶子健, 等. 魔芋葡甘聚糖/乙基纤维素/玉米醇溶蛋白复合膜的制备与性能表征[J]. 食品工业科技,2023,44(2):285−292. [YAN X, TAO Y X, YE Z J, et al. Preparation and characterization of konjac glucomannan/ethyl cellulose/zein composite film[J]. Science and Technology of Food Industry,2023,44(2):285−292.] YAN X, TAO Y X, YE Z J, et al. Preparation and characterization of konjac glucomannan/ethyl cellulose/zein composite film[J]. Science and Technology of Food Industry, 2023, 44(2): 285−292.
[22] LI C, WU K, SU Y, et al. Effect of drying temperature on structural and thermomechanical properties of konjac glucomannan-zein blend films[J]. International Journal of Biological Macromolecules,2019,138:135−143. doi: 10.1016/j.ijbiomac.2019.07.007
[23] TOMIĆ J, DAPČEVIĆ-HADNAĐEV T, ŠKROBOT D, et al. Spontaneously fermented ancient wheat sourdoughs in breadmaking:Impact of flour quality on sourdough and bread physico-chemical properties[J]. LWT,2023,175:114482. doi: 10.1016/j.lwt.2023.114482
[24] YANG H, LI J G, WU N F, et al. Effect of hsian-tsao gum (HG) content upon rheological properties of film-forming solutions (FFS) and physical properties of soy protein/hsian-tsao gum films[J]. Food Hydrocolloids,2015,50:211−218. doi: 10.1016/j.foodhyd.2015.03.028
[25] DONG M, TIAN L, LI J, et al. Improving physicochemical properties of edible wheat gluten protein films with proteins, polysaccharides and organic acid[J]. LWT,2022,154:112868. doi: 10.1016/j.lwt.2021.112868
[26] FU M, CAO M, DUAN J, et al. Research on the properties of zein, soy protein isolate, and wheat gluten protein-based films containing cellulose nanocrystals[J]. Foods,2022,11(19):3010. doi: 10.3390/foods11193010
[27] WANG S, CHEN H, TONG Y, et al. Composite films with properties improved by increasing the compatibility of sodium caseinate and zein in a heated 60% ethanol solvent[J]. Food Hydrocolloids,2023,134:108017. doi: 10.1016/j.foodhyd.2022.108017
[28] XIANG F, XIA Y, WANG Y, et al. Preparation of konjac glucomannan based films reinforced with nanoparticles and its effect on cherry tomatoes preservation[J]. Food Packaging and Shelf Life,2021,29:100701. doi: 10.1016/j.fpsl.2021.100701
[29] XIAO Y, LIU Y, KANG S, et al. Insight into the formation mechanism of soy protein isolate films improved by cellulose nanocrystals[J]. Food Chemistry,2021,359:129971. doi: 10.1016/j.foodchem.2021.129971
[30] HU Y, XU W, REN Z, et al. Effect of drying rate on the physicochemical properties of soy protein isolate-soy oil emulsion films[J]. Food Packaging and Shelf Life,2023,36:101038. doi: 10.1016/j.fpsl.2023.101038
[31] SUN J, CHEN M, HOU X, et al. Effect of phosphate salts on the gluten network structure and quality of wheat noodles[J]. Food Chemistry,2021,358:129895. doi: 10.1016/j.foodchem.2021.129895
[32] DENG L, WANG Z, YANG S, et al. Improvement of functional properties of wheat gluten using acid protease from Aspergillus usamii[J]. PLoS One,2016,11(7):e0160101. doi: 10.1371/journal.pone.0160101
[33] CHAMBI H, GROSSO C. Edible films produced with gelatin and casein cross-linked with transglutaminase[J]. Food Research International,2006,39(4):458−466. doi: 10.1016/j.foodres.2005.09.009






 下载:
下载:
 下载:
下载:



