Protective Effect of Resveratrol on Exercise-induced Kidney Injury in Rats by Regulating Keap1-Nrf2 Signaling Pathway
-
摘要: 目的:探究白藜芦醇对大鼠运动性肾损伤的保护机制。方法:32只7周龄SPF级雄性SD大鼠随机分为安静组(CONT组,8只)、白藜芦醇组(RESV组,8只)、运动性肾损伤模型组(EIKIM组,8只)和白藜芦醇干预的运动性肾损伤模型组(REIKIM组,8只)。EIKIM和REIKIM组大鼠进行跑台训练建立运动性肾损伤模型。4周训练期间,RESV、REIKIM组大鼠在每次训练前1 h根据体重给予剂量和体积分别为150 mg/kg·bw和5 mL/kg的白藜芦醇溶液灌胃,其余大鼠给予等体积溶剂灌胃。末次训练24 h后采集各组大鼠血液和肾样本。通过HE染色评估大鼠肾组织形态。测定大鼠血液中肌酐(creatinine,Cr)和尿素氮(urea nitrogen,UN)水平及肾组织中Kelch样环氧氯丙烷相关蛋白-1(kelch-like ECH-associated protein-1,Keap1)、核因子E2相关因子2(nuclear factor-E2-related factor 2,Nrf2)、NAD(P)H醌脱氢酶1(NAD(P)H: quinone oxidoreductase 1,NQO1)、血红素氧合酶1(heme oxygenase-1,HO-1)mRNA和蛋白质表达水平,磷酸化(phosphorylated nuclear factor erythroid 2-related factor 2,p-Nrf2)蛋白质表达水平,超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和谷胱甘肽S移换酶(glutathione S-transferase,GSH-ST)活性,丙二醛(malondialdehyde,MDA)和活性氧簇(reactive oxygen species,ROS)含量,细胞凋亡及B淋巴细胞瘤因子-2(B cell lymphoma-2 protein,Bcl-2)、Bcl-2相关X蛋白(bcl-2-associated X protein,Bax)、含半胱氨酸的天冬氨酸蛋白水解酶-9(cysteinyl aspartate specific proteinase-9,Caspase-9)、含半胱氨酸的天冬氨酸蛋白水解酶-3(cysteinyl aspartate specific proteinase-3,Caspase-3)蛋白质表达水平。结果:经4周大强度跑台训练,与CONT组大鼠比较,EIKIM组大鼠肾组织病理改变明显;血液中Cr和UN水平,肾组织中Keap1 mRNA和蛋白质表达水平,MDA和ROS含量,细胞凋亡及Bax、Caspase-9和Caspase-3蛋白质表达水平,以及Bax/Bcl-2比值均显著升高(P<0.01);肾组织中Nrf2、NQO1、HO-1 mRNA和蛋白质表达水平,SOD、CAT和GSH-ST活性,p-Nrf2和Bcl-2蛋白质表达水平及p-Nrf2/Nrf2比值均显著下降(P<0.01)。经4周白藜芦醇干预,与EIKIM组大鼠比较,REIKIM组大鼠肾组织病理改变有效改善;血液中Cr和UN水平,肾组织中Keap1 mRNA和蛋白质表达水平,MDA和ROS含量,细胞凋亡及Bax、Caspase-9、Caspase-3蛋白质表达水平,以及Bax/Bcl-2比值均显著下降(P<0.05或P<0.01);肾组织中Nrf2、NQO1、HO-1 mRNA和蛋白质表达水平,SOD、CAT和GSH-ST活性,p-Nrf2和Bcl-2蛋白质表达水平及p-Nrf2/Nrf2比值均显著升高(P<0.05或P<0.01)。结论:白藜芦醇可有效激活大强度运动大鼠肾组织中Keap1-Nrf2信号通路,抑制氧化应激和细胞凋亡,保护肾结构和功能完整性。
-
关键词:
- 白藜芦醇 /
- 运动性肾损伤 /
- 大鼠 /
- Keap1-Nrf2信号通路 /
- 细胞凋亡
Abstract: Objective: To investigate the protective mechanism of resveratrol on exercise-induced kidney injury in rats. Methods: Thirty-two 7-week-old SPF-grade male SD rats were randomly assigned to four groups: control group (CONT, n=8), resveratrol group (RESV, n=8), exercise-induced kidney injury model group (EIKIM, n=8), and resveratrol-treated exercise-induced kidney injury group (REIKIM, n=8). Rats in groups EIKIM and REIKIM underwent high-intensity treadmill training to establish a model of exercise-induced kidney injury. During the four-week training, rats in groups RESV and REIKIM were administered resveratrol solution intragastrically at a dosage of 150 mg/kg·bw and a volume of 5 mL/kg, 1 h prior to each training session, and the remaining rats received an equal volume of solvent. Blood and kidney samples were obtained 24 h post the final training session. Kidney morphology was assessed using HE staining. Levels of serum creatinine (Cr) and urea nitrogen (UN), renal kelch-like ECH-associated protein-1 (Keap1), nuclear factor-E2-related factor 2 (Nrf2), NAD(P)H: quinone oxidoreductase 1 (NQO1), heme oxygenase-1 (HO-1) mRNA and protein expression levels, phosphorylated nuclear factor erythroid 2-related factor 2 (p-Nrf2) protein expression level, activities of superoxide dismutase (SOD), catalase (CAT) and glutathione S-transferase (GSH-ST) activity, levels of malondialdehyde (MDA), reactive oxygen species (ROS), apoptosis, B cell lymphoma-2 protein (Bcl-2), bcl-2-associated X protein (Bax), cysteinyl aspartate specific proteinase-9 (Caspase-9), and cysteinyl aspartate specific proteinase-3 (Caspase-3) protein expression were detected. Results: After 4 weeks of high-intensity treadmill training, significant renal pathological changes of rats were observed in group EIKIM compared to group CONT, with increased levels of serum Cr and UN, renal Keap1 mRNA and protein expression, MDA, ROS, apoptosis, Bax, Caspase-9, Caspase-3 protein expression and Bax/Bcl-2 ratio (P<0.01), and decreased levels of renal Nrf2, NQO1, HO-1 mRNA and protein expression, SOD CAT and GSH-ST activity, p-Nrf2, Bcl-2 protein expression and p-Nrf2/Nrf2 ratio (P<0.01). In contrast, after 4 weeks of resveratrol treatment, rats in group REIKIM exhibited significant improvements in renal pathology compared to group EIKIM, with decreased levels of serum Cr and UN, renal Keap1 mRNA and protein expression, MDA, ROS, apoptosis, Bax, Caspase-9, Caspase-3 protein expression and Bax/Bcl-2 ratio (P<0.05 or P<0.01), and increased levels of renal Nrf2, NQO1, HO-1 mRNA and protein expression, SOD, CAT and GSH-ST activity, p-Nrf2, Bcl-2 protein expression and p-Nrf2/Nrf2 ratio (P<0.05 or P<0.01). Conclusions: Resveratrol can activate the Keap1-Nrf2 signaling pathway of rats subjected to high-intensity exercise effectively, suppress oxidative stress and apoptosis, thereby protecting the integrity of renal structure and function. -
肾作为调节内环境稳态的重要器官,承担着多项维持生命活动所必需的功能。其对运动应激具有一定敏感性,适当运动有助于维持肾健康并预防肾病,而过度运动则可能导致肾损伤的发生[1]。相关研究证实,长时间、持续的大强度运动将导致肾组织氧化应激增强并促进细胞凋亡过程,这可能诱发和加速运动性肾损伤的发展[2−3]。Kelch样环氧氯丙烷相关蛋白-1(kelch-like ECH-associated protein-1,Keap1)-核因子E2相关因子2(nuclear factor-E2-related factor 2,Nrf2)信号通路是维持细胞内部氧化与还原状态平衡的核心调节系统。在正常状态下,Keap1与Nrf2结合会促使Nrf2降解,从而保持较低的活动水平。相反,在氧化应激条件下,Nrf2从Keap1中释放增加并适度激活抗氧化反应元件(antioxidant response element,ARE),进而促进抗氧化酶等基因表达,维持氧化还原平衡以抵御氧化损伤[4]。Nrf2对B淋巴细胞瘤因子-2(B cell lymphoma-2 protein,Bcl-2)基因表达及其激活的精准调控,有效阻止了细胞凋亡的发生与发展[5]。白藜芦醇作为一种天然的Nrf2激动剂,可以阻断Keap1对Nrf2的负调节作用,上调Nrf2表达,促进Nrf2核易位,激活Nrf2信号通路,发挥抗氧化活性[6−7]。张琳等[8]的早期研究发现,白藜芦醇能够通过调节大强度运动引发的自由基过度积累,提升肾抵御氧化应激的能力,有效降低脂质过氧化程度,确保肾细胞膜的稳定性和功能酶活性的维持,从而缓解大强度运动引起的肾氧化损伤。本团队近期研究也发现,运动性肝损伤的有效改善,得益于白藜芦醇激活了大强度运动后大鼠肝组织内Nrf2信号传导途径,进而成功抑制氧化应激下细胞凋亡的异常升高[9]。尽管Keap1-Nrf2信号通路可能在白藜芦醇对运动性肾损伤的保护作用中发挥关键作用,但目前针对这一机制的科学研究相对有限。因此,本研究构建运动性肾损伤大鼠模型,旨在全面探究持续4周白藜芦醇给予对大鼠的影响,为运动性肾损伤预防与控制开辟新的视角,同时也为开发相关运动营养品奠定科学基础。
1. 材料与方法
1.1 材料与仪器
大鼠 体重280~300 g,斯贝福(北京)生物技术有限公司提供(SCXK(京)2019-0010);白藜芦醇 纯度≥99% 华中海威(北京)基因科技;羟甲基纤维素钠 国药集团化学试剂有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽S移换酶(glutathione S-transferase,GSH-ST)、丙二醛(malondialdehyde,MDA)、活性氧簇(reactive oxygen species,ROS)试剂盒 北京华英生物技术研究所;Keap1、Nrf2、磷酸化Nrf2(phosphorylated nuclear factor erythroid 2-related factor 2,p-Nrf2)、NAD(P)H醌脱氢酶1(NAD(P)H: quinone oxidoreductase 1,NQO1)一抗 英国艾博抗公司;细胞凋亡检测试剂盒、血红素氧合酶1(heme oxygenase-1,HO-1)一抗 武汉赛维尔生物科技有限公司;Bcl-2、Bcl-2相关X蛋白(bcl-2-associated X protein,Bax)、含半胱氨酸的天冬氨酸蛋白水解酶-9(cysteinyl aspartate specific proteinase-9,Caspase-9)、含半胱氨酸的天冬氨酸蛋白水解酶-3(cysteinyl aspartate specific proteinase-3,Caspase-3)一抗 美国圣克鲁斯生物技术公司。
RM 2016病理切片机 德国徕卡显微系统公司;Pannoramic MIDI病理切片扫描仪 匈牙利3DHISTECH公司;DR-200BS酶标分析仪 无锡华卫德朗仪器有限公司;AU480生化分析仪 美国贝克曼库尔特有限公司。
1.2 实验方法
1.2.1 动物分组
32只7周龄SPF级雄性SD大鼠在完成7 d适应性喂养和训练后,依据数字随机法分为安静组(CONT组,8只)、白藜芦醇组(RESV组,8只)、运动性肾损伤模型组(EIKIM组,8只)和白藜芦醇干预的运动性肾损伤模型组(REIKIM组,8只)。实验严格遵循北京体育大学(SYXK(京)2021-0053)指导原则(批准号:2019095H)开展。实验动物在室温20~24 ℃,相对湿度55%~75%,光照周期为12 h明暗交替的适宜环境下被给予标准固体饲料饲养。
1.2.2 训练和营养干预方案
在为期4周的训练周期中,EIKIM和REIKIM组跑台训练以建立运动性肾损伤模型[10]。根据文献[11−12]及预实验结果,RESV、REIKIM组灌胃150 mg/kg·bw和5 mL/kg白藜芦醇溶液(每次训练前1 h);CONT、EIKIM组灌胃等体积溶剂。
1.2.3 样本采集
在完成最终1次训练后的24 h,开展所有大鼠血液及肾样本采集工作。2%戊巴比妥钠麻醉处理大鼠后,腹主动脉采血。血液室温条件下静置至凝固,4 ℃条件下离心,以提取血清,待测血液相关生化指标。接下来,对大鼠进行开腹手术,取出双肾后立即以生理盐水冲洗清洁。之后,选取部分肾组织在4%多聚甲醛中浸泡固定及后期制作石蜡切片待评估肾组织形态、凋亡水平及采用免疫组化法检测肾组织中相关蛋白质表达水平。其余组织经机械研磨处理,并通过超声波破碎法进一步破碎细胞,以充分释放细胞内成分。随后,将破碎后的样本4 ℃条件下离心,分离出上清液并冷冻保存待测肾组织氧化应激相关指标。
1.2.4 指标测试
1.2.4.1 肾组织形态结构评估
首先对石蜡切片进行脱蜡处理。随后,以苏木素和伊红染色以突出细胞和组织结构。染色完成后,切片经脱水、封片后置于显微镜下进行观察以评估肾组织形态结构。
1.2.4.2 肾组织Keap1、Nrf2、NQO1、HO-1 mRNA表达检测
20 mg肾组织匀浆后以12000 r/min离心10 min取上清。加入氯仿替代物以沉淀RNA,再洗涤后溶解并测定RNA浓度。通过反转录生成cDNA。在PCR反应板中配制反应体系(具体引物序列见表1),通过荧光定时PCR系统进行扩增,反应条件设定为:95 ℃ 30 s,95 ℃ 15 s和60 ℃ 30 s,40个循环;最后从65 ℃逐步升至95 ℃,每升高0.5 ℃采集荧光信号1次。β-actin为内参,ΔΔCT法计算表达倍数。
表 1 本实验中使用的引物序列Table 1. Primer sequence list used in this experiment表达 上游引物序列 下游引物序列 Keap1 5'-TACCTCGCCTCCAGTCC-3' 5'-GTGCTTTGGGGCTGTCT-3' Nrf2 5'-ATGGCAGGGGACACTTT-3' 5'-CACGGAGAACGAGGACA-3' NQO1 5'-GCGTCAGCTCTCGTCAA-3' 5'-GCCCGGTCTTCAGCTAC-3' HO-1 5'-CGTGGAACCCCAGTAAGA-3' 5'-GGTGTTGGAGGCAAAGG-3' β-actin 5'-CCTCACTGTCCACCTTCCA-3' 5'-GGGTGTAAAACGCAGCTCA-3' 1.2.4.3 肾组织细胞凋亡水平检测
首先将完成去蜡、组织重建及膜层去除的石蜡切片放置在保持适度湿度的密闭容器中。再将TdT酶与dUTP以2:29体积比混合后加入密闭容器中,在37 ℃温育箱中孵育2 h。孵育完成后,在室温下向体系中添加3%的过氧化氢,并保持孵育状态15 min。洗涤切片后,将其置于37 ℃的温育箱中,并加入Converter-POD试剂,孵育30 min。显色过程完成后,利用苏木素对细胞核进行再次染色。之后,执行冲洗、返蓝、脱水和透明化步骤,以完成封片过程。在完成所有染色和处理步骤后,采用全视野数字扫描技术对组织切片进行全面分析。随后,基于组织化学评分系统(H-score)对组织化学特征进行定量评估[13]。
1.2.4.4 肾组织中Keap1、Nrf2、p-Nrf2、NQO1、HO-1、Bcl-2、Bax、Caspase-9、Caspase-3蛋白质表达水平检测
在3%的过氧化氢溶液中浸入完成去蜡、组织重建的石蜡切片,在室温下于避光环境中孵育25 min。孵育结束后,使用缓冲液对切片进行多次彻底清洗。血清封闭30 min后,加入不同稀释比(稀释比分别为1:500、1:200、1:250、1:250、1:200、1:200、1:200、1:200、1:200)的一抗在4 ℃条件下过夜孵育。次日,以缓冲液洗涤后,室温条件下孵育二抗50 min。DAB显色后再以苏木素对比染色以增强细胞核对比度。随后,脱水、封片。在完成所有染色和处理步骤后,采用全视野数字扫描技术对组织切片进行全面分析。随后,基于组织化学评分系统(H-score),对组织化学特征进行定量评估。
1.2.4.5 其他指标检测
采用酶法测定血液中肌酐(creatinine,Cr)、尿素氮(urea nitrogen,UN)水平,比色法测定肾组织中SOD、CAT、GSH-ST活性及MDA含量,化学荧光法测定肾组织中ROS含量。
1.3 数据处理
多组间比较采用SPSS 23.0软件对数据单因素方差分析。若方差齐性检验通过,使用LSD法;若不通过,则使用Tamhane’s T2法。统计学显著性以P<0.05为标准。
2. 结果与分析
2.1 各组大鼠肾组织形态结构
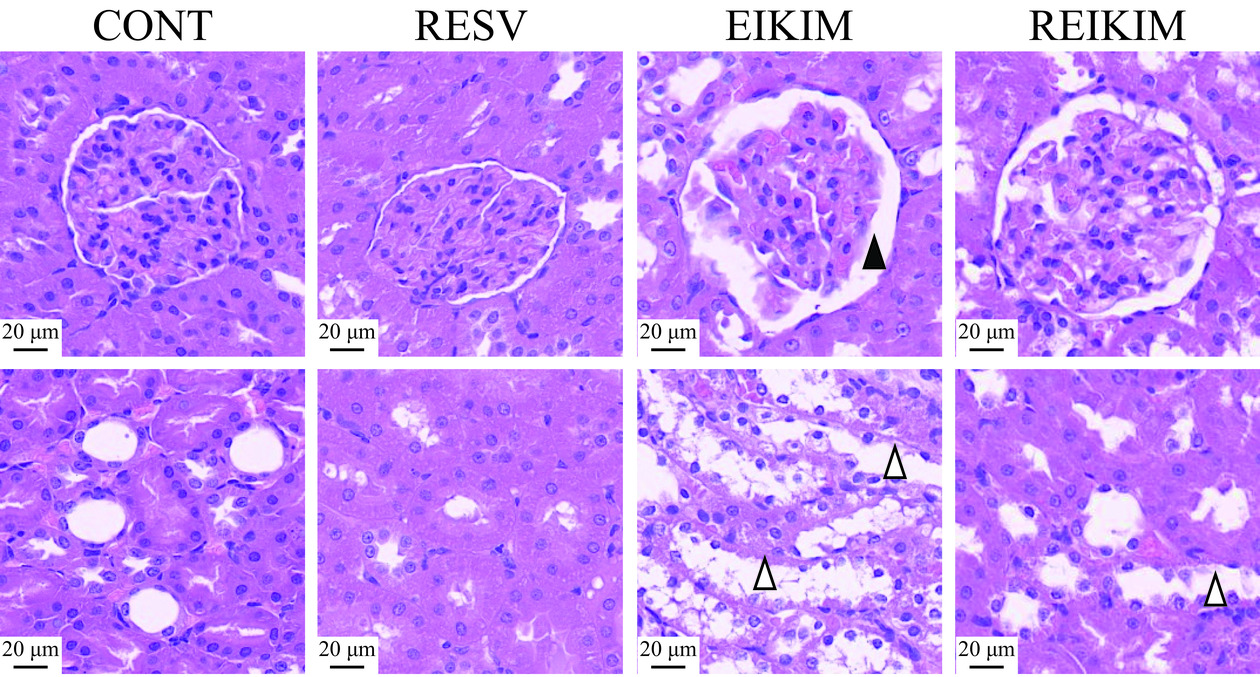
病理诊断被视为肾损伤的权威标准[14]。各组大鼠肾组织形态结构评估如下(图1):CONT、RESV两组肾小球、肾小囊腔及肾小管均呈现典型的健康结构特征,未见任何显著的异常变化。EIKIM组肾小球数量显著减少,分布稀疏,且呈现出萎缩状态,边缘轮廓不规则,反映出明显的组织退化迹象。进一步观察发现,肾小囊和肾小管的管腔有明显的扩张现象,提示可能存在功能障碍或潜在的病理变化。相较于EIKIM组,REIKIM组大鼠的肾小球数量显示出一定程度的恢复,分布更为密集,且形态趋向于正常,表明白藜芦醇干预可能促进了肾小球的再生或修复过程。然而,尽管有上述积极变化,部分肾小囊和肾小管的管腔仍表现出明显扩张,提示某些区域可能存在局部功能障碍或尚未完全逆转的病理状态。实验结果表明(图1),4周150 mg/kg·bw白藜芦醇干预对大鼠肾组织形态结构未产生显著影响。4周大强度跑台训练可诱发大鼠肾组织形态结构受损。4周训练前1 h进行150 mg/kg·bw白藜芦醇干预有效缓解大强度运动大鼠肾小球损伤,促进其结构和功能的恢复,同时通过稳定肾小管上皮细胞结构,维持肾过滤和重吸收功能,确保肾正常生理活动不受影响。
2.2 各组大鼠血液中肾损伤标志物水平
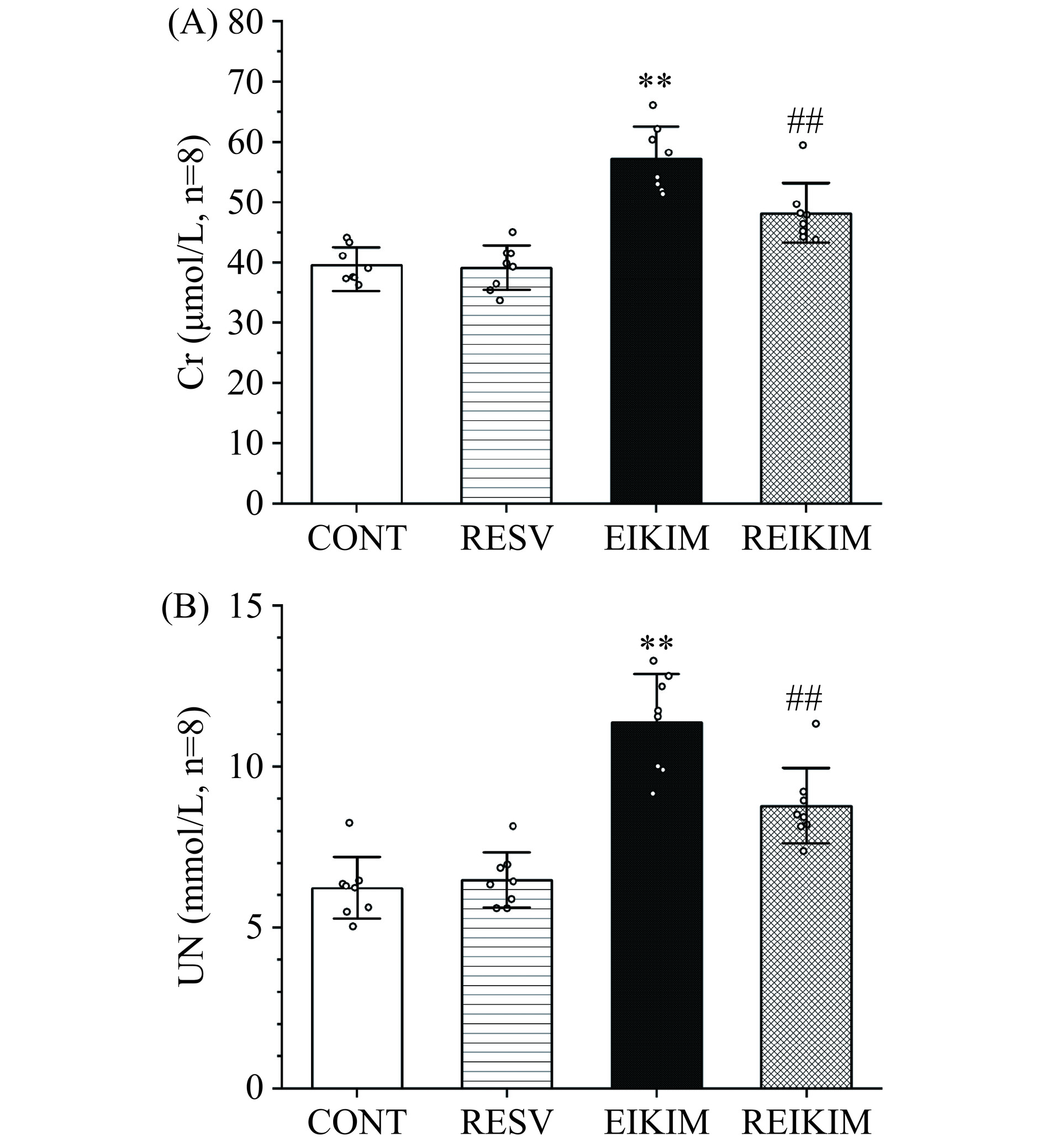
相关研究表明,缺血再灌注所致氧化应激增强是肾损伤的重要成因[15−16]。长时间高强度运动时,机体为了确保运动器官获得足够的血液供应,会激活交感神经系统,促使血管收缩,这通常会导致肾组织血液供应减少。而在运动后的恢复期,血液重新流向前期缺血的肾组织,氧分子在此期间极易与细胞膜发生脂质过氧化反应,进而导致运动性肾损伤。临床实践中,血液中Cr和UN水平常被用作评估肾功能的指标。当肾损伤发展到一定程度时,尤其是肾小球滤过功能受损时,二者清除效率降低,会导致其在血液中的水平异常升高[17−18]。实验结果表明(图2),4周150 mg/kg·bw白藜芦醇干预对大鼠肾功能未产生显著影响;4周高强度跑台训练可诱发大鼠肾功能受损;4周训练前1 h进行150 mg/kg·bw白藜芦醇干预可以有效维护高强度运动大鼠肾小球毛细血管完整性,改善肾小球滤过功能,确保肾健康状态。
2.3 各组大鼠肾组织中Keap1-Nrf2信号通路相关基因和蛋白质表达水平
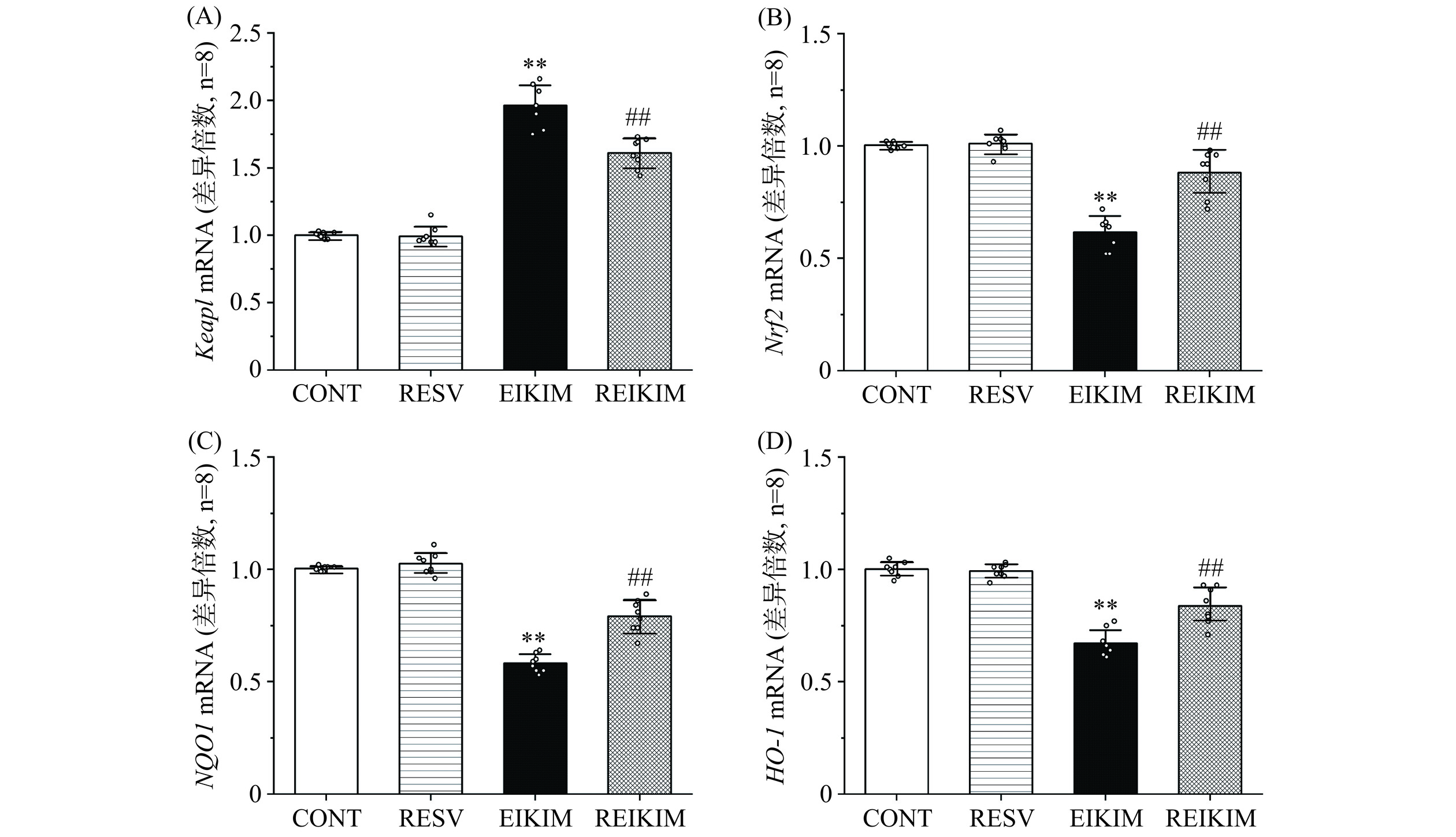
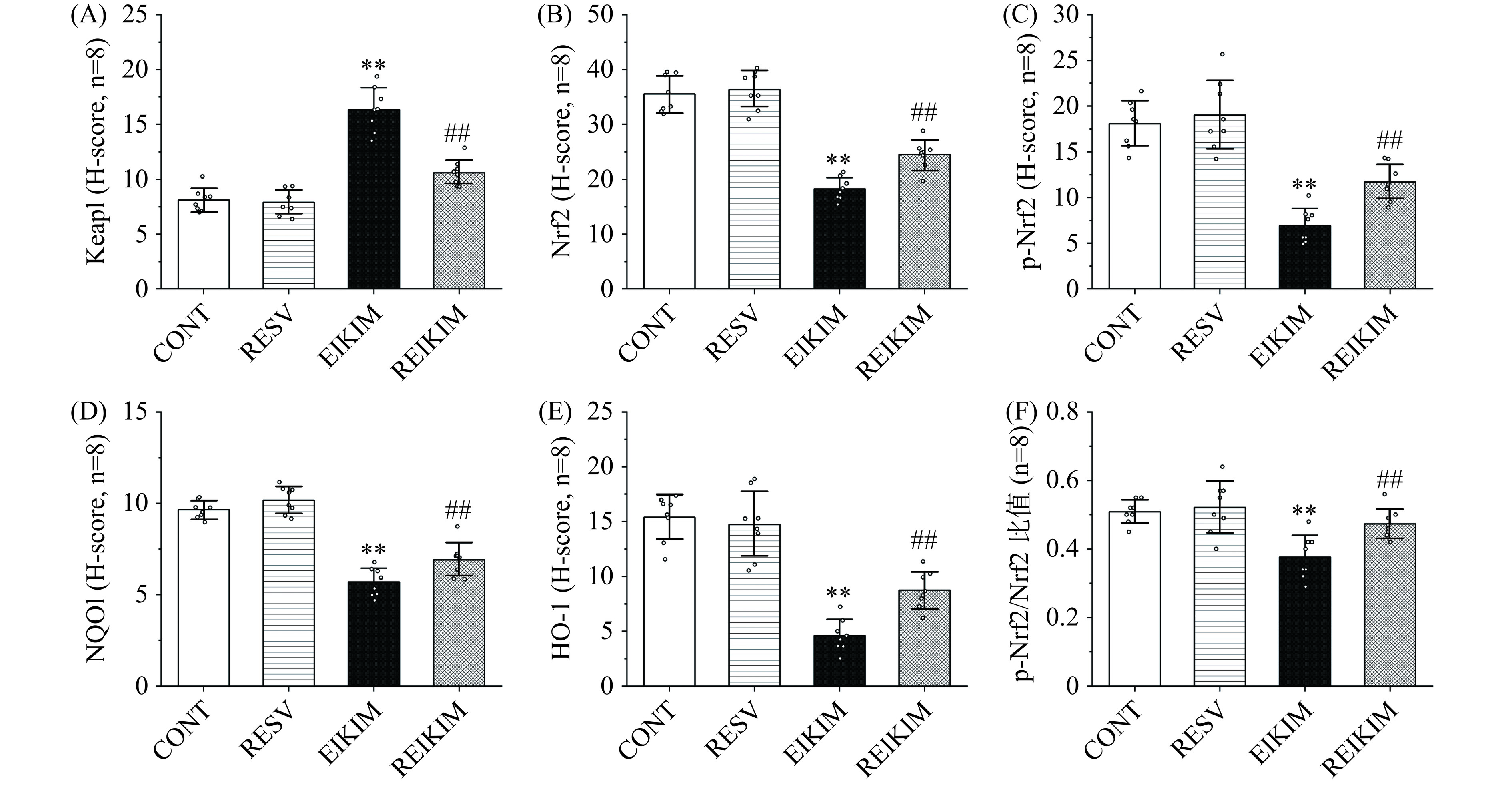
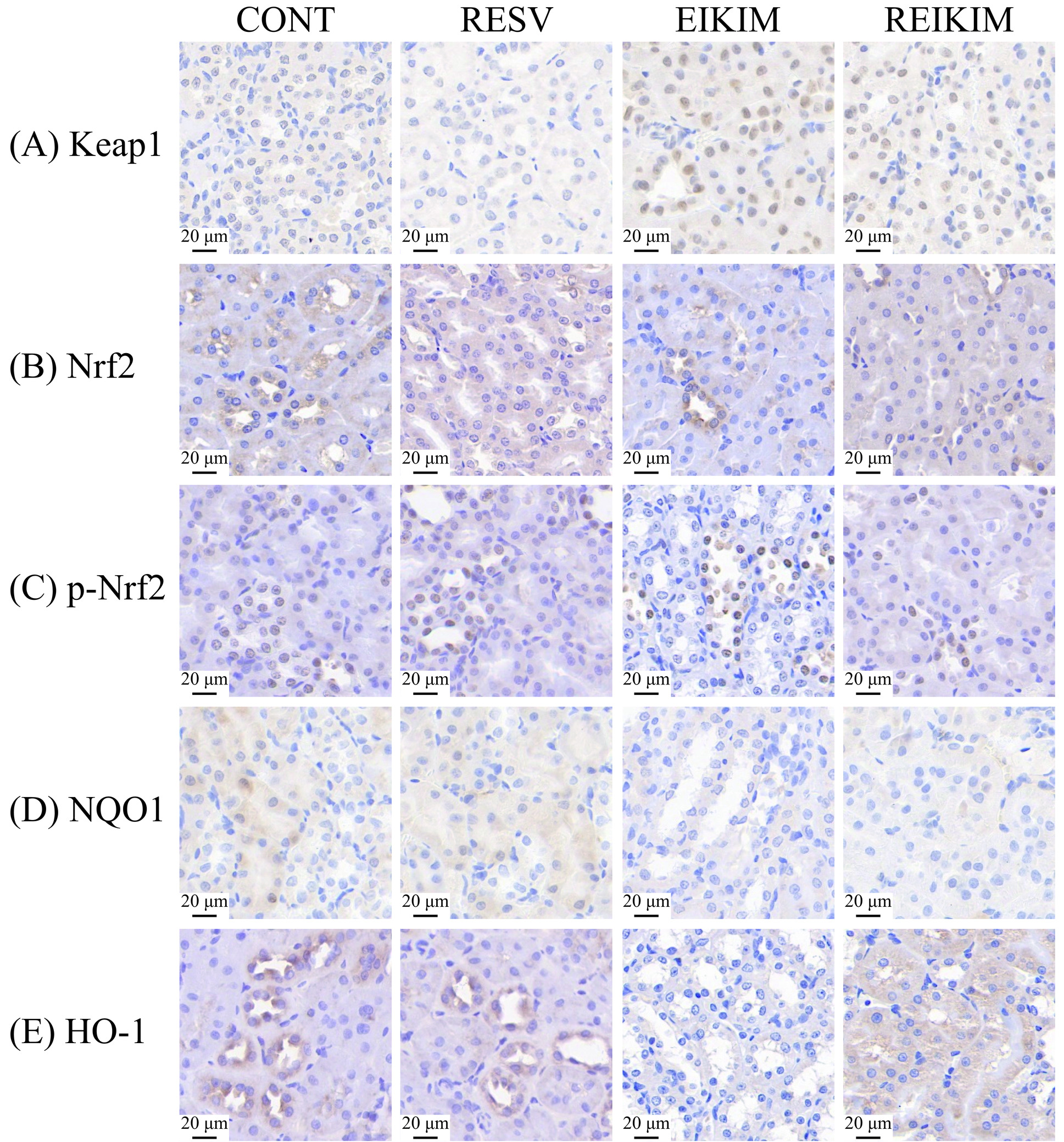
Keap1-Nrf2信号通路是调节氧化应激反应的关键机制,对于激活机体的抗氧化防御具有至关重要的作用[4]。综合多项研究的荟萃分析显示,Nrf2是白藜芦醇发挥其肾保护功效的关键分子靶点[19]。Wang等[20]研究发现,白藜芦醇可提升脓毒症模型大鼠肾细胞核中Nrf2的水平,同时诱导Nrf2下游靶基因NQO1和HO-1蛋白质表达水平增加。该研究团队进一步通过体外实验,使用人肾小管上皮细胞系HK-2细胞,证实了白藜芦醇以剂量依赖的方式上调NQO1和HO-1的表达。更重要的是,他们发现当Nrf2基因被敲除时,白藜芦醇原本具有的体外保护作用完全消失,这进一步证明了Nrf2在白藜芦醇介导的肾保护机制中的核心地位。实验结果表明(图3、图4、图5):4周150 mg/kg·bw白藜芦醇干预对大鼠肾组织中Keap1-Nrf2信号通路相关基因和蛋白质表达水平未产生显著影响。4周高强度跑台训练通过激活大鼠肾组织中Keap1,进而抑制Nrf2及其下游抗氧化基因的表达。4周训练前1 h进行150 mg/kg·bw白藜芦醇干预有效逆转了高强度运动大鼠肾组织中Keap1对Nrf2的抑制作用,恢复Nrf2的活性,促进抗氧化基因的表达,重启并增强Nrf2驱动的抗氧化防御机制,增强肾自我保护能力,有效减轻潜在肾损伤。
2.4 各组大鼠肾组织中氧化应激相关指标水平
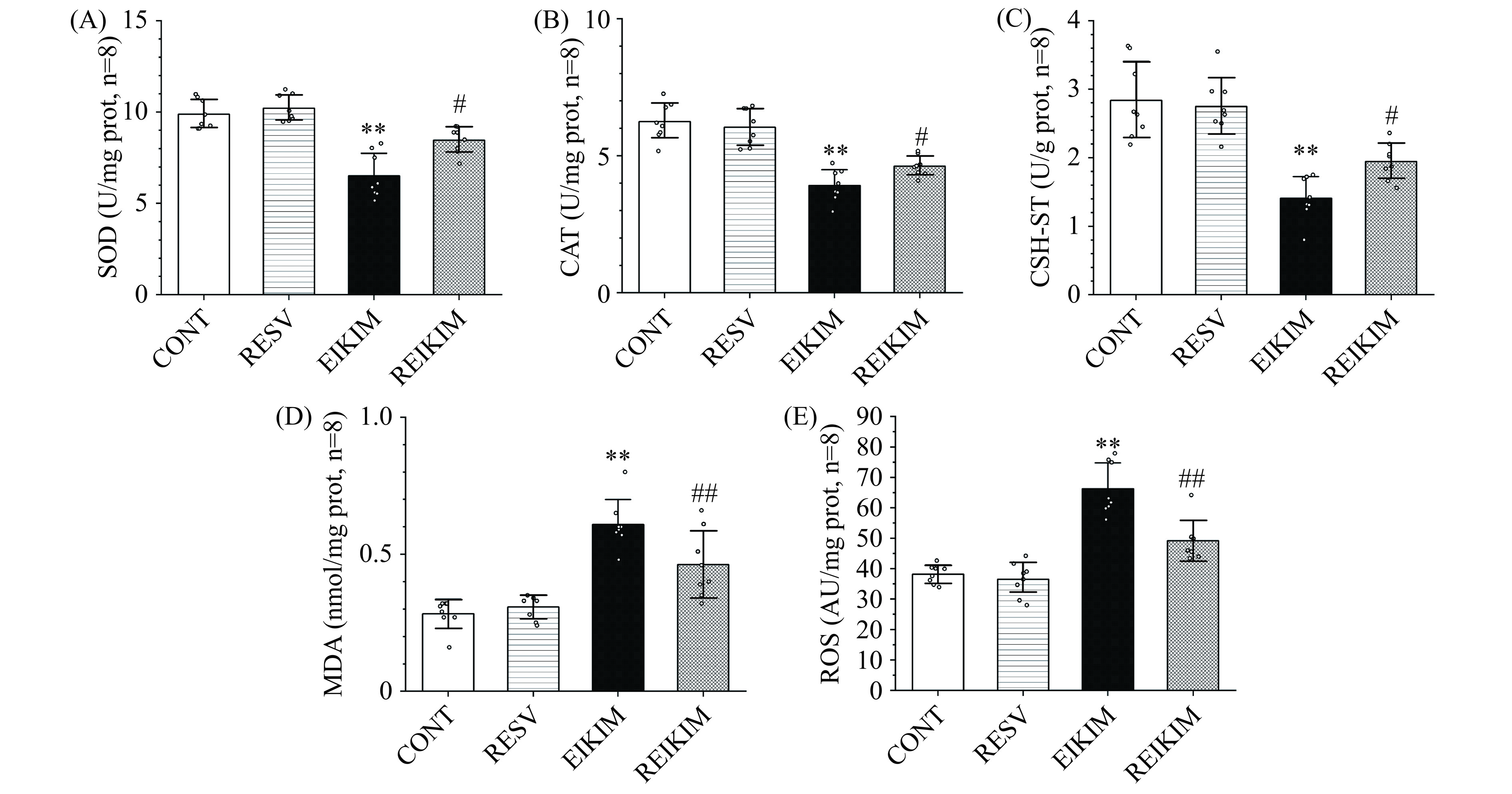
Nrf2作为转录因子的核心成员,与其下游多种抗氧化酶协同作用,共同防御氧化应激对细胞造成的潜在损害[4,21]。ROS是细胞正常氧代谢的自然副产品,在缺氧生理适应、细胞增殖和生长、血管反应性调节和信号转导中发挥积极作用。然而,当ROS生成过多或清除机制受阻,氧化还原稳态遭到破坏,会诱发机体产生损伤[22]。此外,ROS在细胞凋亡的生理和病理性诱导过程中亦发挥着重要作用[23−24]。Nrf2-Keap1信号轴构成了细胞应对ROS的核心机制。生理平衡状态下,Nrf2在细胞质中与Keap1紧密结合,保持在一个较低且稳定的水平。然而,当细胞遭遇ROS攻击,Nrf2将迅速从Keap1中解离,迁移至细胞核与ARE结合,启动NQO1等抗氧化基因表达,维持细胞的氧化还原平衡。实验结果表明(图6):4周150 mg/kg·bw白藜芦醇干预对大鼠肾组织中氧化应激相关指标水平未产生显著影响。4周高强度跑台训练使得大鼠肾组织中多种抗氧化酶活性下降,氧化应激加剧。4周训练前1 h进行150 mg/kg·bw白藜芦醇干预能够有效激活Nrf2信号通路,针对大强度运动大鼠肾组织中ROS异常增多和过度积累产生应答,通过促进一系列抗氧化酶的表达,从而有效防御氧化应激,维护肾健康和功能。
![]() 图 6 各组大鼠肾组织中SOD(A)、CAT(B)、GSH-ST(C)、MDA(D)和ROS(E)水平注:与CONT组相比,**代表结果显著性差异为P<0.01;与EIKIM组相比,#和##分别代表显著性差异为P<0.05和P<0.01,图7同。Figure 6. Levels of renal SOD (A), CAT (B), GSH-ST (C), MDA (D) and ROS (E) of rats in each group
图 6 各组大鼠肾组织中SOD(A)、CAT(B)、GSH-ST(C)、MDA(D)和ROS(E)水平注:与CONT组相比,**代表结果显著性差异为P<0.01;与EIKIM组相比,#和##分别代表显著性差异为P<0.05和P<0.01,图7同。Figure 6. Levels of renal SOD (A), CAT (B), GSH-ST (C), MDA (D) and ROS (E) of rats in each group2.5 各组大鼠肾组织中细胞凋亡及相关蛋白质表达水平
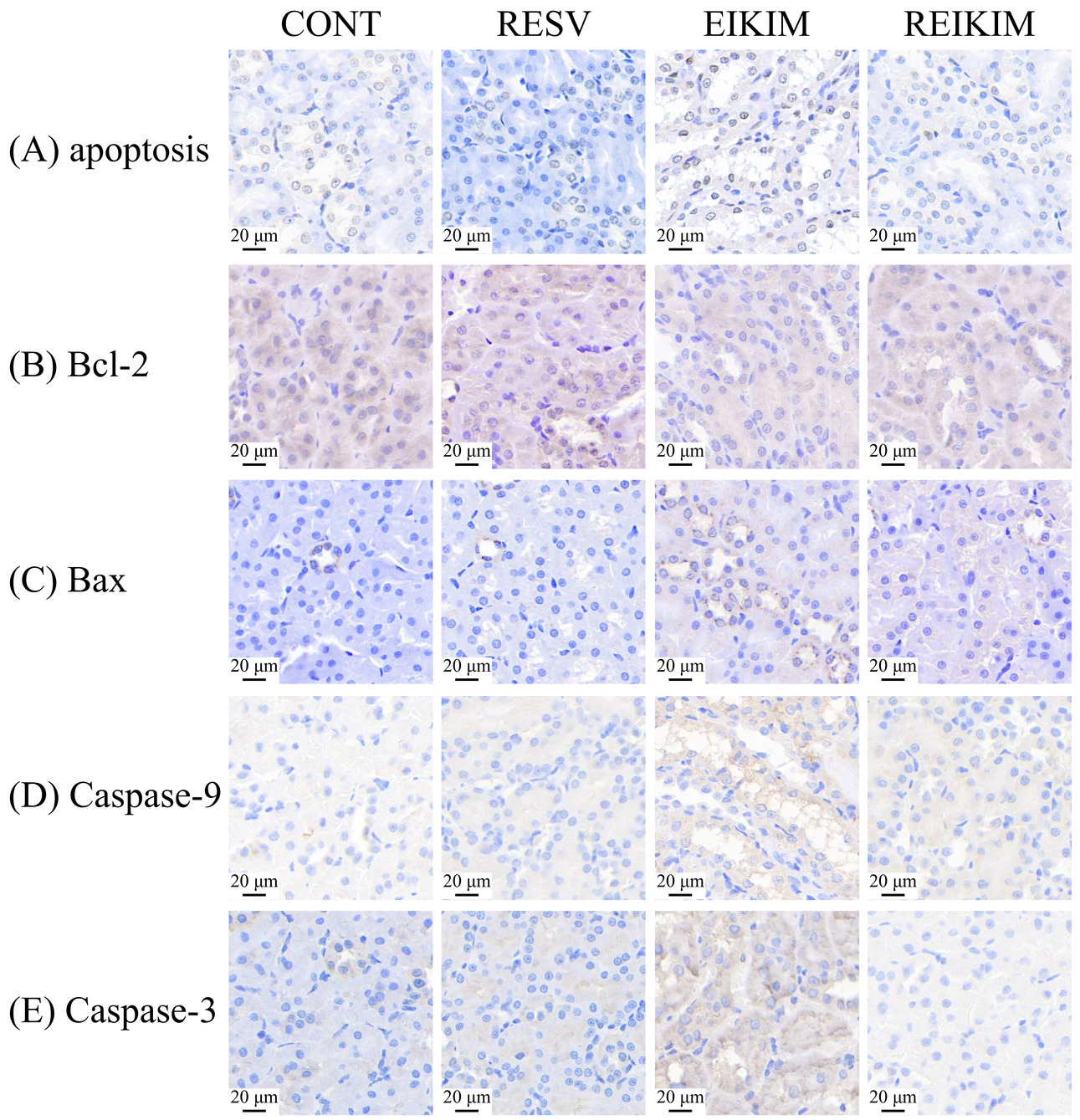
细胞凋亡是一种程序性细胞自我毁灭过程,对于维持体内平衡至关重要。在此过程中,Bcl-2家族蛋白扮演了中心角色。Bax作为关键的凋亡调节基因,当其表达水平上升时能够推动细胞凋亡的进行[25]。与之相对,Bcl-2通过与Bax结合形成复合体,能够有效抑制Bax的促凋亡效应[26]。因此,二者比值可以间接衡量细胞凋亡水平。在Bcl-2与Bax蛋白质表达失衡状态下,细胞色素c会从线粒体逃逸至细胞质,与凋亡蛋白酶激活因子1结合形成凋亡激活复合体。该复合体能够激活Caspase-9,继而触发Caspase-3的激活,通过切割特定的效应分子,启动一系列导致细胞凋亡的信号通路[27]。这一机制不仅在急性肾损伤中发挥着核心作用,而且在慢性肾病的进展中也是重要的驱动力[28]。Niture等[5]研究发现,在HEK-293细胞中,Nrf2与Bcl-2基因上的ARE结合,通过激活Bcl-2基因的转录和蛋白合成,增强其蛋白质表达,抑制Bax和细胞色素c的释放,阻断Caspase-3的激活,延缓细胞凋亡进程。这揭示了Nrf2在提高细胞抗凋亡能力方面的作用,使其成为对抗氧化应激引起的细胞损伤的有效防护机制。Kim等[29]的研究进一步证实,白藜芦醇可显著降低衰老小鼠血液中Cr水平,并上调肾组织中Nrf2、NQO1、HO-1、SOD1、SOD2、Bcl-2蛋白质表达和Bcl-2/Bax比值。Li等[30]在大鼠肾缺血再灌注模型和过氧化氢诱导的NRK-52E细胞氧化应激模型中均发现,白藜芦醇通过上调Nrf2表达,下调凋亡相关蛋白Caspase-9和Caspase-3表达,有效减少了氧化应激和细胞凋亡。实验结果表明(图7,图8):4周150 mg/kg·bw白藜芦醇干预对大鼠肾组织中细胞凋亡及相关蛋白质表达水平未产生显著影响。4周高强度跑台训练通过促进大鼠肾组织中促凋亡因子Bax的表达,激活Caspase-9和Caspase-3,从而加速细胞凋亡进程。同时,还通过阻碍抗凋亡因子Bcl-2表达,降低了其抑制Bax促凋亡效应的能力,最终导致细胞凋亡水平的显著上升。4周训练前1 h进行150 mg/kg·bw白藜芦醇干预通过调节高强度运动大鼠肾组织内促/抗凋亡因子的平衡及影响细胞凋亡途径中关键蛋白酶的活性,有效地抑制了细胞凋亡的发展,展现了其在减轻运动引起的肾氧化应激和细胞损伤方面的潜力。
3. 结论
本研究深入挖掘了白藜芦醇在运动性肾损伤保护中的作用机制,特别聚焦于Keap1-Nrf2信号轴的调控作用。与过往研究局限于白藜芦醇通过维持酶活性、增强抗氧化能力减轻肾过氧化损伤等宏观层面的观察不同,本研究通过详尽的分子机制解析,揭示了氧化还原稳态失衡可能是影响白藜芦醇介导Nrf2核易位、发挥抗氧化抗凋亡保护作用的重要诱因及白藜芦醇调控Keap1-Nrf2信号通路,抑制高强度运动大鼠肾氧化应激和细胞凋亡,保护结构与功能完整性的作用机制。这一发现将为设计和开发针对运动员和运动爱好者的营养补充品提供坚实的科学依据,有望在未来为运动营养领域带来创新性的解决方案,为运动人群提供更加个性化和有效的营养支持,助力他们在训练和竞赛中保持最佳的生理状态和运动表现。
-
图 6 各组大鼠肾组织中SOD(A)、CAT(B)、GSH-ST(C)、MDA(D)和ROS(E)水平
注:与CONT组相比,**代表结果显著性差异为P<0.01;与EIKIM组相比,#和##分别代表显著性差异为P<0.05和P<0.01,图7同。
Figure 6. Levels of renal SOD (A), CAT (B), GSH-ST (C), MDA (D) and ROS (E) of rats in each group
表 1 本实验中使用的引物序列
Table 1 Primer sequence list used in this experiment
表达 上游引物序列 下游引物序列 Keap1 5'-TACCTCGCCTCCAGTCC-3' 5'-GTGCTTTGGGGCTGTCT-3' Nrf2 5'-ATGGCAGGGGACACTTT-3' 5'-CACGGAGAACGAGGACA-3' NQO1 5'-GCGTCAGCTCTCGTCAA-3' 5'-GCCCGGTCTTCAGCTAC-3' HO-1 5'-CGTGGAACCCCAGTAAGA-3' 5'-GGTGTTGGAGGCAAAGG-3' β-actin 5'-CCTCACTGTCCACCTTCCA-3' 5'-GGGTGTAAAACGCAGCTCA-3' -
[1] KUO C P, TSAI M T, LEE K H, et al. Dose-response effects of physical activity on all-cause mortality and major cardiorenal outcomes in chronic kidney disease[J]. European Journal of Preventive Cardiology,2022,29(3):452−461. doi: 10.1093/eurjpc/zwaa162
[2] 陈丽娜, 周刚, 吴乐, 等. 力竭运动对大鼠肾脏的影响[J]. 中国康复理论与实践,2016,22(7):789−792. [CHEN L N, ZHOU G, WU L, et al. Effect of exhaustive exercise on kidney in rats[J]. Chinese Journal of Rehabilitation Theory and Practice,2016,22(7):789−792.] doi: 10.3969/j.issn.1006-9771.2016.07.010 CHEN L N, ZHOU G, WU L, et al. Effect of exhaustive exercise on kidney in rats[J]. Chinese Journal of Rehabilitation Theory and Practice, 2016, 22(7): 789−792. doi: 10.3969/j.issn.1006-9771.2016.07.010
[3] 胡戈, 曹卉, 周海涛, 等. 姜黄素对过度训练大鼠肾脏细胞凋亡的调控作用及其机制[J]. 中国应用生理学杂志,2018,34(6):513−518,583−584. [HU G, CAO H, ZHOU H T, et al. Regulatory effect of curcumin on renal apoptosis and its mechanism in overtraining rats[J]. Chinese Journal of Applied Physiology,2018,34(6):513−518,583−584.] HU G, CAO H, ZHOU H T, et al. Regulatory effect of curcumin on renal apoptosis and its mechanism in overtraining rats[J]. Chinese Journal of Applied Physiology, 2018, 34(6): 513−518,583−584.
[4] BAIRD L, YAMAMOTO M. The molecular mechanisms regulating the Keap1-Nrf2 Pathway[J]. Molecular and Cellular Biology,2020,40(13):e00099−20.
[5] NITURE S K, JAISWAL A K. Nrf2 protein up-regulates antiapoptotic protein Bcl-2 and prevents cellular apoptosis[J]. The Journal of Biological Chemistry,2012,287(13):9873−9886. doi: 10.1074/jbc.M111.312694
[6] FARKHONDEH T, FOLGADO S L, POURBAGHER-SHAHRI AM, et al. The therapeutic effect of resveratrol:Focusing on the Nrf2 signaling pathway[J]. Biomedicine & Pharmacotherapy,2020,127:110234.
[7] 王引, 张兰威. 益生菌联合白藜芦醇对小鼠慢性酒精性肝损伤的改善作用及机制研究[J]. 食品工业科技,2022,43(5):374−380. [WANG Y, ZHANG L W. Ameliorative effect and mechanism of probiotics combined with resveratrol on chronic alcoholic liver injury in mice[J]. Science and Technology of Food Industry,2022,43(5):374−380.] WANG Y, ZHANG L W. Ameliorative effect and mechanism of probiotics combined with resveratrol on chronic alcoholic liver injury in mice[J]. Science and Technology of Food Industry, 2022, 43(5): 374−380.
[8] 张琳, 熊正英, 郝选明, 等. 白藜芦醇对大强度运动大鼠肾脏功能的保护作用[J]. 天津体育学院学报,2011,26(3):208−210. [ZHANG L, XIONG Z Y, HAO X M. Protective effects of resveratrol on kidney in intensive exercise rats[J]. Journal of Tianjin University of Sport,2011,26(3):208−210.] doi: 10.3969/j.issn.1005-0000.2011.03.006 ZHANG L, XIONG Z Y, HAO X M. Protective effects of resveratrol on kidney in intensive exercise rats[J]. Journal of Tianjin University of Sport, 2011, 26(3): 208−210. doi: 10.3969/j.issn.1005-0000.2011.03.006
[9] 胡戈, 马欣雨, 秦菲, 等. 白藜芦醇对大鼠运动性肝损伤的保护作用[J]. 中国实验动物学报,2023,31(6):763−769. [HU G, MA X Y, QIN F, et al. Protective effect of resveratrol on exercise-induced liver injury in rats[J]. Acta Laboratorium Animalis Scientia Sinica,2023,31(6):763−769.] doi: 10.3969/j.issn.1005-4847.2023.06.008 HU G, MA X Y, QIN F, et al. Protective effect of resveratrol on exercise-induced liver injury in rats[J]. Acta Laboratorium Animalis Scientia Sinica, 2023, 31(6): 763−769. doi: 10.3969/j.issn.1005-4847.2023.06.008
[10] 李方, 曹建民, 王传军, 等. 白藜芦醇通过调节SIRT1/NF-κB通路减轻力竭训练致大鼠肾的炎症反应[J]. 中国生物化学与分子生物学报,2019,35(7):773−779. [LI F, CAO J M, WANG C J, et al. Resveratrol reduces renal inflammatory response induced by exhaustive exercise in rats by regulating SIRT1/NF-κB pathway[J]. Chinese Journal of Biochemistry and Molecular Biology,2019,35(7):773−779.] LI F, CAO J M, WANG C J, et al. Resveratrol reduces renal inflammatory response induced by exhaustive exercise in rats by regulating SIRT1/NF-κB pathway[J]. Chinese Journal of Biochemistry and Molecular Biology, 2019, 35(7): 773−779.
[11] 赵昆, 黎璞. 白藜芦醇对力竭训练动物能量代谢和抗氧化功能的影响[J]. 基因组学与应用生物学,2020,39(2):902−908. [ZHAO K, LI P. Effects of resveratrol on energy metabolism and antioxidant function in exhausted training animals[J]. Genomics and Applied Biology,2020,39(2):902−908.] ZHAO K, LI P. Effects of resveratrol on energy metabolism and antioxidant function in exhausted training animals[J]. Genomics and Applied Biology, 2020, 39(2): 902−908.
[12] DOLINSKY V W, JONES K E, SIDHU R S, et al. Improvements in skeletal muscle strength and cardiac function induced by resveratrol during exercise training contribute to enhanced exercise performance in rats[J]. The Journal of Physiology,2012,590(11):2783−2799. doi: 10.1113/jphysiol.2012.230490
[13] MARSLAND M, DOWDELL A, JIANG C C, et al. Expression of NGF/proNGF and their receptors TrkA, p75NTR and sortilin in melanoma[J]. International Journal of Molecular Sciences,2022,23(8):4260. doi: 10.3390/ijms23084260
[14] 李郭锦, 张路, 穆长征, 等. 大鼠肾缺血再灌注损伤程序性坏死的形态学观察[J]. 解放军医学杂志,2013,38(10):792−795. [LI G J, ZHANG L, MU C Z, et al. Morphological observation of necroptosis after renal ischemia-reperfusion injury in rats[J]. Medical Journal of Chinese People's Liberation Army,2013,38(10):792−795.] doi: 10.11855/j.issn.0577-7402.2013.10.02 LI G J, ZHANG L, MU C Z, et al. Morphological observation of necroptosis after renal ischemia-reperfusion injury in rats[J]. Medical Journal of Chinese People's Liberation Army, 2013, 38(10): 792−795. doi: 10.11855/j.issn.0577-7402.2013.10.02
[15] WANG Z S, ZHOU H H, HAN Q, et al. Effects of grape seed proanthocyanidin B2 pretreatment on oxidative stress and renal tubular epithelial cell apoptosis after renal ischemia reperfusion in mice[J]. Acta Cirurgica Brasileira,2020,35(8):e202000802. doi: 10.1590/s0102-865020200080000002
[16] LI M, NING J, HUANG H, et al. Allicin protects against renal ischemia-reperfusion injury by attenuating oxidative stress and apoptosis[J]. International Urology Nephrology,2022,54(7):1761−1768. doi: 10.1007/s11255-021-03014-2
[17] 牛衍龙, 曹建民, 周海涛, 等. 6周大强度训练对大鼠肾功能的影响及其机制[J]. 中国应用生理学杂志,2018,34(1):65−68,73. [NIU Y L, CAO J M, ZHOU H T, et al. Effects and mechanisms of 6-week intensive training on renal function in rats[J]. Chinese Journal of Applied Physiology,2018,34(1):65−68,73.] doi: 10.12047/j.cjap.5641.2018.017 NIU Y L, CAO J M, ZHOU H T, et al. Effects and mechanisms of 6-week intensive training on renal function in rats[J]. Chinese Journal of Applied Physiology, 2018, 34(1): 65−68,73. doi: 10.12047/j.cjap.5641.2018.017
[18] 刘佩佳, 彭洪泉, 郭兴华, 等. 验证四种基于肌酐的肾小球滤过率估算方程的性能[J]. 中山大学学报(医学科学版),2022,43(4):621−630. [LIU P J, PENG H Q, GUO X H, et al. Comparative performance of four creatinine-based gfr estimating equations[J]. Journal of Sun Yat-Sen University (Medical Sciences),2022,43(4):621−630.] LIU P J, PENG H Q, GUO X H, et al. Comparative performance of four creatinine-based gfr estimating equations[J]. Journal of Sun Yat-Sen University (Medical Sciences), 2022, 43(4): 621−630.
[19] RASHID H, JALI A, AKHTER M S, et al. Molecular mechanisms of oxidative stress in acute kidney injury:targeting the loci by resveratrol[J]. International Journal of Molecular Sciences,2023,25(1):3. doi: 10.3390/ijms25010003
[20] WANG Y, FENG F L, LIU M N, et al. Resveratrol ameliorates sepsis-induced acute kidney injury in a pediatric rat model via Nrf2 signaling pathway[J]. Experimental and Therapeutic Medicine,2018,16(4):3233−3240.
[21] NGO V, DUENNWALD ML. Nrf2 and oxidative stress:A general overview of mechanisms and implications in human disease[J]. Antioxidants (Basel),2022,11(12):2345. doi: 10.3390/antiox11122345
[22] PIZZINO G, IRRERA N, CUCINOTTA M, et al. Oxidative stress:harms and benefits for human health[J]. Oxidative Medicine and Cellular Longevity,2017,2017:8416763. doi: 10.1155/2017/8416763
[23] SIMON H U, HAJ-YEHIA A, LEVI-SCHAFFER F. Role of reactive oxygen species (ROS) in apoptosis induction[J]. Apoptosis,2000,5(5):415−418. doi: 10.1023/A:1009616228304
[24] VILLALPANDO-RODRIGUEZ GE, GIBSON SB. Reactive oxygen species (ROS) Regulates different types of cell death by acting as a rheostat[J]. Oxidative Medicine and Cellular Longevity,2021,2021:9912436. doi: 10.1155/2021/9912436
[25] van OPDENBOSCH N, LAMKANFI M. Caspases in cell death, inflammation, and disease[J]. Immunity,2019,50(6):1352−1364. doi: 10.1016/j.immuni.2019.05.020
[26] MUSHTAQ A U, ÅDÉN J, ALI K, et al. Domain-specific insight into the recognition of BH3-death motifs by the pro-survival Bcl-2 protein[J]. Biophysical Journal,2022,121(23):4517−4525. doi: 10.1016/j.bpj.2022.10.041
[27] YI J, YANG X, ZHENG L, et al. Photoactivation of hypericin decreases the viability of RINm5F insulinoma cells through reduction in JNK/ERK phosphorylation and elevation of caspase-9/caspase-3 cleavage and Bax-to-Bcl-2 ratio[J]. Bioscience Reports,2015,35(3):e00195. doi: 10.1042/BSR20150028
[28] PRIANTE G, GIANESELLO L, CEOL M, et al. Cell death in the kidney[J]. International Journal of Molecular Sciences,2019,20(14):3598. doi: 10.3390/ijms20143598
[29] KIM E N, LIM J H, KIM MY, et al. Resveratrol, an Nrf2 activator, ameliorates aging-related progressive renal injury[J]. Aging (Albany, NY),2018,10(1):83−99. doi: 10.18632/aging.101361
[30] LI J W, LI L, WANG S, et al. Resveratrol alleviates inflammatory responses and oxidative stress in rat kidney ischemia-reperfusion injury and H2O2-induced NRK-52E cells via the Nrf2/TLR4/NF-κB Pathway[J]. Cell and Physiology Biochemistry and Biophysical Journal,2018,45(4):1677−1689. doi: 10.1159/000487735





 下载:
下载:

 下载:
下载:



