Lowering Blood Lipids and Regulating Intestinal Flora Effects of Blueberry Enzyme in Hyperlipidemic Mice
-
摘要: 以蓝莓果汁为对照,研究蓝莓酵素对高脂血症小鼠血脂代谢异常的调节作用及肠道微生物菌群的影响。将高脂血症小鼠分为正常组、模型组、辛伐他汀组、蓝莓酵素高剂量组、蓝莓酵素中剂量组、蓝莓酵素低剂量组和蓝莓果汁组,使用药物干预4周,定期测量小鼠体重。实验结束后测定小鼠体重、血清血脂水平、脏器变化及蓝莓酵素对小鼠肝脏功能的影响,并观察肝脏、肾脏及结肠组织病理学切片。之后以高脂血症小鼠粪便为研究对象,通过16S rRNA高通量测序分析蓝莓酵素对高脂血症小鼠粪便中肠道菌群组成、相对丰度和多样性的影响。结果表明,蓝莓酵素可以抑制小鼠的体重增加(P<0.05);降低高脂血症小鼠血清中总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)的含量(P<0.01),增加血清中高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)的含量(P<0.01);减轻小鼠心脏、肝脏和肾脏组织器官重量(P<0.01),降低谷丙转氨酶(alanine transaminase, ALT)和谷草转氨酶(aspartate aminotransferase, AST)活性保护肝脏组织器官(P<0.01)。蓝莓果汁组对小鼠体重作用效果不明显,对TC、TG、LDL-C、HDL-C含量与高脂饮食组之间无明显差异。结果显示,蓝莓酵素能明显改善肝脏、肾脏及结肠组织病变,使组织损伤正常化,改善高脂血症状,影响了肠道微生物区系的碳水化合物代谢、氨基酸代谢和能量代谢能力,调节了肠道微生物的丰度和多样性,改变了高脂血症小鼠肠道微生物群的结构组成。
-
关键词:
- 蓝莓酵素 /
- 高脂血症 /
- 降血脂 /
- 肠道菌群 /
- 16S rRNA高通量测序
Abstract: The impact of blueberry enzyme on dysregulated lipid metabolism and intestinal microbiota in hyperlipidemic mice was investigated, using blueberry juice as a control, they were divided into normal group, model group, simvastatin group, high-dose blueberry jiaosu group, medium-dose blueberry jiaosu group, low-dose blueberry jiaosu group, and blueberry juice group. After 4 weeks of drug intervention, the mice's weight, serum lipid levels, organ changes and the liver function of each group mice were measured, and the pathological sections of liver, kidney and colon were also monitored. Then, the effect of blueberry jiaosu on the composition, relative abundance and diversity of intestinal flora in the feces of hyperlipidemic mice was analyzed by 16S rRNA high-throughput sequencing. The results indicated that blueberry jiaosu can inhibit the weight gain in mice (P<0.05); the serum levels of total cholesterol (TC), triglyceride (TG), low-density lipoprotein cholesterol (LDL-C) content in the serum of hyperlipidemic mice (P<0.01), increase the level of high-density lipoprotein cholesterol (HDL-C) in serum (P<0.01), and reduce the organ weight of heart, liver and kidney (P<0.01), alanine transaminase (ALT) and aspartate aminotransferase (AST) activities protected liver tissues and organs (P<0.01). Blueberry jiaosu can significantly improve the liver, kidney and colon tissue lesions, normalize tissue damage, improve hyperlipidemia symptoms, affects the carbohydrate metabolism, amino acid metabolism and energy metabolism capacity of the intestinal microflora, regulate the abundance and diversity of intestinal microbes, and change the structural composition of intestinal microbiota in hyperlipidemia mice. -
高脂血症是体内脂类代谢紊乱导致血脂水平增高的一种疾病,也是糖尿病、高血压、冠心病等多种慢性病的重要致病因素,与肠道微生态系统有密切联系,能引起肠道菌群的紊乱,影响肠道菌群的丰度和多样性[1]。但目前的治疗手段还很局限,药物副作用大、价格昂贵,而酵素制品作为价格实惠、副作用小的创新食品,有很大的发展前景在改善高脂血症作用方面。
研究发现,利用益生菌发酵的果蔬制品能调节体内血脂水平,达到降低罹患心脑血管疾病的效果[2]。研究结果表明,各菌株均有脱除胆固醇的能力,其降低胆固醇主要机制为菌体对胆固醇的同化作用。益生菌及其制剂在增强胃肠道功能、改善代谢及提升机体免疫功能等方面,已被广泛认可和应用[3]。
近年来,水果酵素以独特的功能特性、不良反应小受到了研究人员和消费者的高度关注,其含有抗氧化和抗炎特性的多酚化合物与促进健康、预防疾病之间存在密切联系[4−5]。蓝莓鲜果能够有效调节血清中脂质水平,改善肠道菌群紊乱,从而在体内产生抗氧化和抗炎作用,改善机体损伤[6]。大量研究表明,肠道菌群及其代谢产物与高脂血症的发展密不可分[7−8]。富含多酚、活性酶、有机酸等生物活性成分的蓝莓鲜果对肠道微生物有重要影响,并可能缓解高脂血症和相关的代谢综合征[9−10]。蓝莓酵素[11]富含多种生物活性物质,在改善肠道菌群失调、缓解高脂血症及代谢综合征方面具有潜在作用。因此,本章通过建立高脂血症小鼠模型,探讨蓝莓酵素对高脂血症诱导的血脂异常、脏器组织病变和肠道菌群的干预效果。
1. 材料与方法
1.1 材料与仪器
SPF级雄性昆明小鼠84只,体质量(18~22)g,6-8周龄。小鼠饲养于学院动物房,置于室温(19±2)℃,24 h昼夜循环光照条件下生活,自由饮水、取食。动物于实验前适应实验室环境1周。小鼠 湖南斯莱克景达动物有限公司,许可编号为SCXK(湘)2019-0004。食用基础饲料和高脂血症模型高脂饲料购于江苏省协同生物医药生物工程有限公司;新鲜蓝莓 产自试验基地;葡萄酒果酒专用酵母 安琪酵母股份有限公司;白砂糖 西安沣东新城永胜食品厂;植物乳杆菌(Lactobacillus plantarum)21809、干酪乳杆菌(Lactobacillus casei)6104 中国工业微生物菌种保藏管理中心;果胶酶(30 000 U/g)、纤维素酶(100000 U/g)、半纤维素酶(50000 U/g) 山东隆科特酶制剂有限公司;MRS肉汤培养基 北京奥博星生物技术有限公司;无水乙醇 国药集团化学试剂有限公司;氯化钠 广州赛国生物科技有限公司;PBS磷酸盐缓冲液 上海源叶生物科技有限公司;TC检测试剂盒、TG检测试剂盒、HDL-C检测试剂盒、LDL-C检测试剂盒、AST检测试剂盒、ALT检测试剂盒 南京建成生物工程研究所;4 %多聚甲醛 广州赛国生物科技有限公司。
TGL-16M高速冷冻离心机 湖南湘仪有限公司;NR-EW63WXA-H-20 ℃低温冰箱 中国海尔公司;MDF-C8V1-80 ℃超低温冰箱 Panasonic/日本松下;CP114电子天平 奥豪斯仪器(常州)有限公司;DSX-18L高压蒸汽灭菌锅 上海博讯医疗生物仪器有限公司;Milh-Q Integral超纯水系统 默克化工技术(上海)有限公司;T6紫外可见分光光度计 北京普析通用仪器有限公司;Eppendorf微量移液器 德国Eppendorf公司;RM2015光学显微镜 德国Leica公司;SpectraMax M3全波长多功能酶标仪 美国Molecular Devices公司。
1.2 实验方法
1.2.1 蓝莓酵素、蓝莓果汁的制作
酵母菌活化:将葡萄酒果酒专用酵母用10倍蒸馏水搅拌均匀至溶解,放置在30~35 ℃恒温水浴锅中活化30 min,当出现大量泡沫即表明活化完毕,取出备用。
植物乳杆菌(干酪乳杆菌)活化:将斜面保藏的植物乳杆菌(干酪乳杆菌)在MRS肉汤培养基中活化,两次继代培养后,36 ℃条件下静置培养48 h,备用。
将冷冻的蓝莓(−20 ℃)在4 ℃解冻后清洗晾干,用榨汁机破碎得到蓝莓果浆,在55 ℃条件下加入0.8%的果胶酶、纤维素酶、半纤维素酶(2:1:1)酶解3 h[12]。酶解结束后向蓝莓果浆中加入一定量的白砂糖,调整初始可溶性固形物含量为12°Bx。采用巴氏杀菌法杀菌(85 ℃、15 min)。将活化完成的酵母菌、植物乳杆菌及干酪乳杆菌接种发酵(采用血球计数板在显微镜下计数保证菌种的活菌数达到109 CFU/mL,体积比为0.1%、2%、0.47%),在31 ℃发酵40 h,4 ℃条件下静置2 h、使用纱布对其过滤,获得蓝莓酵素成品。蓝莓果汁,使用榨汁机鲜榨。用蓝莓汁做对照,可以更好的凸显蓝莓酵素中活性成分在高脂血症小鼠模型中所发挥的降血脂及肠道菌群调节作用。
1.2.2 高脂血症小鼠模型的建立与给药
将84只五周龄SPF级雄性昆明小鼠(18~22 g)使用普通饲料适应性饲养1周后,随机分为2组,正常对照组(饲喂普通饲料)、高脂实验组(喂养高脂饲料),喂养4周后,两组随机各取10只小鼠,眼球取血,测定血脂水平。通过分析实验组小鼠是否患有高脂血症,判断造模是否成功。
造模成功的小鼠随机分成6组,分别为高脂模型组、辛伐他汀组、蓝莓酵素高剂量组、蓝莓酵素中剂量组、蓝莓酵素低剂量组、蓝莓果汁组,各组小鼠同室分笼,仍饲喂高脂饲料,并每天灌胃给药。小鼠分组及灌胃给药情况如表1所示,连续给药4周,灌胃剂量根据小鼠体重调整。所有小鼠均可自由饮水、进食。
表 1 各组小鼠分组与给药情况Table 1. Grouping and administration of mice in each group分组(n=8) 灌胃量 饲料 正常对照组(NC) 0.9%生理盐水 普通饲料 高脂模型组(HFD) 0.9%生理盐水 高脂饲料 辛伐他汀组(SIM) 辛伐他汀3 mg/kg 高脂饲料 蓝莓酵素高剂量组(BJS-H) 蓝莓酵素溶液5 mL/kg 高脂饲料 蓝莓酵素中剂量组(BJS-M) 蓝莓酵素溶液10 mL/kg 高脂饲料 蓝莓酵素低剂量组(BJS-L) 蓝莓酵素溶液20 mL/kg 高脂饲料 蓝莓果汁组(BBJ) 蓝莓果汁10 mL/kg 高脂饲料 注:NC:正常对照组;HFD:高脂模型组;SIM:辛伐他汀组;BJS-H:蓝莓酵素高剂量组;BJS-M:蓝莓酵素中剂量组;BJS-L:蓝莓酵素低剂量组;BBJ:蓝莓果汁组。下同。 1.2.3 小鼠体质量的测定
小鼠造模成功后的灌胃期间,每周定期称量并记录小鼠的体质量。
1.2.4 血清中血脂指标检测
末次给药后禁食不禁水12 h后眼球取血,血样于室温静置2 h,4 ℃、4000 r/min离心10 min后,取上层血清于−20 ℃冰箱中贮存备用。测定血清中TC、TG、LDL-C和HDL-C含量。
1.2.5 脏器指数的计算
断颈处死小鼠,解剖,迅速取小鼠的心脏、肝脏、肾脏、脾脏于预冷的0.9 %生理盐水中清洗并用滤纸吸干水分,称量后计算各组脏器指数。计算见式(1):
脏器指数(%)=脏器重量体重×100 (1) 1.2.6 血清中肝功能指标检测
测定血清中谷丙转氨酶(alanine transaminase, ALT)和谷草转氨酶(aspartate aminotransferase, AST)含量。
1.2.7 肝脏、肾脏、结肠组织的病理学观察
解剖取各组小鼠的肝脏、肾脏、结肠组织,用4%多聚甲醛溶液固定,石蜡包埋切片后HE染色,用显微镜观察组织病理学形态。
1.2.8 16S rRNA高通量测序分析小鼠肠道微生物菌群
对检测合格的序列通过文库制备与库检后进行Illumina MiSeq 2×300 bp paired-end上机测序。Miseq测序完成后,得到原始的下机数据,去除Reads的Barcode和接头序列,利用Overlap将双端数据进行拼接,去除含有N,采用CD-HIT将序列相似性大于97%的clean tags定为一个OTU (operational taxonomy unit),过滤后获得最终的OTU丰度及代表序列,基于OTU分析结果,通过Alpha多样性、Beta多样性及物种组成分析研究不同组别的物种多样性,并进行功能基因预测分析。
1.3 数据处理
所有数据重复三次,均使用平均值±标准差表示,采用SPSS 24.0软件进行统计分析和处理,Origin 2021和GraphPad Prism 8.0进行绘图。其中,P<0.01表示差异极显著,P<0.05表示差异显著。
2. 结果与分析
2.1 高脂血症小鼠模型的建立
高脂血症是指TC、TG和LDL-C水平升高,以及HDL-C水平降低,它也是动脉粥样硬化的潜在威胁。高脂饲料喂食4周后,实验组与正常组相比,其血清中TC(P<0.01)、TG(P<0.01)、LDL-C(P<0.05)含量都显著升高,HDL-C水平极显著降低(P<0.01),说明高脂血症造模成功。
表 2 造模期小鼠血脂指标测定Table 2. Determination of lipid indexes in mice during modeling stage组别 TC TG HDL-C LDL-C 正常组 3.39±0.39 0.96±0.09 2.91±0.38 1.01±0.07 实验组 5.53±0.31** 1.90±0.17** 2.14±0.43** 2.28±0.35* 注:*表示与正常组相比,P<0.05(*)表示差异显著,P<0.01(**)表示差异极显著。 2.2 蓝莓酵素对高脂血症小鼠体重的影响
体重变化可直观反映不同药物灌胃小鼠后的状态与代谢水平。各组小鼠体重变化趋势如表3所示。与NC组相比,HFD组体重极显著增加(P<0.01)。蓝莓酵素干预前三周,与HFD组相比,蓝莓酵素组和果汁组的体重差异无统计学意义(P>0.05),但体重也在降低。干预第四周,SIM组和BJS-H组比HFD组的体重显著降低(P<0.05)。结果表明,BJS-H组于第三周开始呈现下降趋势,对高血脂症小鼠的体重有降低作用,其他剂量作用效果不明显。
表 3 蓝莓酵素对高脂血症小鼠体重的影响Table 3. Effect of blueberry jiaosu on weight of hyperlipidemia mice分组 小鼠体重值(g) 造模给药前 灌胃第1周 灌胃第2周 灌胃第3周 灌胃第4周 正常对照组 41.20±0.29 43.03±0.62 43.72±0.34 45.12±0.46 45.73±0.69 高脂模型组 45.82±0.64## 46.56±0.39## 48.45±0.52## 49.11±1.09## 51.06±0.96## 辛伐他汀组 44.16±0.61 45.95±0.84 47.46±0.44 48.68±0.51 49.09±0.47* 高剂量组 45.02±0.22 46.16±0.35 47.82±0.46 48.90±0.62 49.12±0.76* 中剂量组 45.78±0.26 46.22±0.91 47.74±0.94 48.53±0.66 49.64±0.44 低剂量组 44.26±0.38 46.49±0.49 47.81±0.90 48.86±0.79 50.13±0.66 果汁组 45.31±0.46 46.94±0.87 47.52±0.41 48.57±0.77 49.88±0.33 注:#表示与正常对照组相比,P<0.05(#)表示差异显著,P<0.01(##)表示差异极显著;*表示与高脂模型组相比,P<0.05(*)表示差异显著,P<0.01(**)表示差异极显著,表4、图1~图2同。 2.3 蓝莓酵素对高脂血症小鼠血脂水平的影响
TC、TG、HDL-C和LDL-C水平是判断HFD诱发的高脂血症、心脑血管疾病风险的重要参数[13]。从表4可知,与NC组相比,血清中TC、TG和LDL-C的含量(P<0.01)在高脂饮食的HFD组极显著增加,血清中HDL-C含量(P<0.01)极显著降低。灌胃4周后,与HFD组相比,BJS-H组通过降低血清TC(P<0.01)、TG(P<0.01)、LDL-C(P<0.01)含量和增加HDL-C(P<0.01)含量从而明显调节血清中血脂水平。与此同时,不同剂量蓝莓酵素处理后,血脂水平出现剂量依赖性。通过BBJ组做对照与HFD组比较,高剂量组在HDL-C含量中显著增加(P<0.05),而BBJ的TC、TG、LDL-C、HDL-C含量与HFD组之间均无明显差异(P>0.05)。结果表明BJS-H组在降低高脂血症患者体内的血脂水平比BBJ作用效果明显。
表 4 蓝莓酵素对高脂血症小鼠血脂水平的影响Table 4. Effect of blueberry jiaosu on blood lipid level in hyperlipidemia mice分组 总胆固醇TC
(mmol/L)甘油三酯TG
(mmol/L)低密度脂蛋白
胆固醇LDL-C
(mmol/L)高密度脂蛋白
胆固醇HDL-C
(mmol/L)正常对照组 4.44±0.02 1.49±0.09 0.44±0.06 2.64±0.10 高脂模型组 7.29±0.30## 2.71±0.23## 1.42±0.02## 1.80±0.02## 辛伐他汀组 5.28±0.13** 1.74±0.01** 0.67±0.08** 2.37±0.13** 高剂量组 5.68±0.32** 2.21±0.10** 0.79±0.07** 2.23±0.04** 中剂量组 6.62±0.18 2.30±0.06 1.17±0.03 2.02±0.04* 低剂量组 7.21±0.34 2.57±0.20 1.37±0.07 1.87±0.05 果汁组 7.02±0.19 2.36±0.11 1.26±0.08 1.97±0.06 2.4 蓝莓酵素对高脂血症小鼠脏器指数的影响
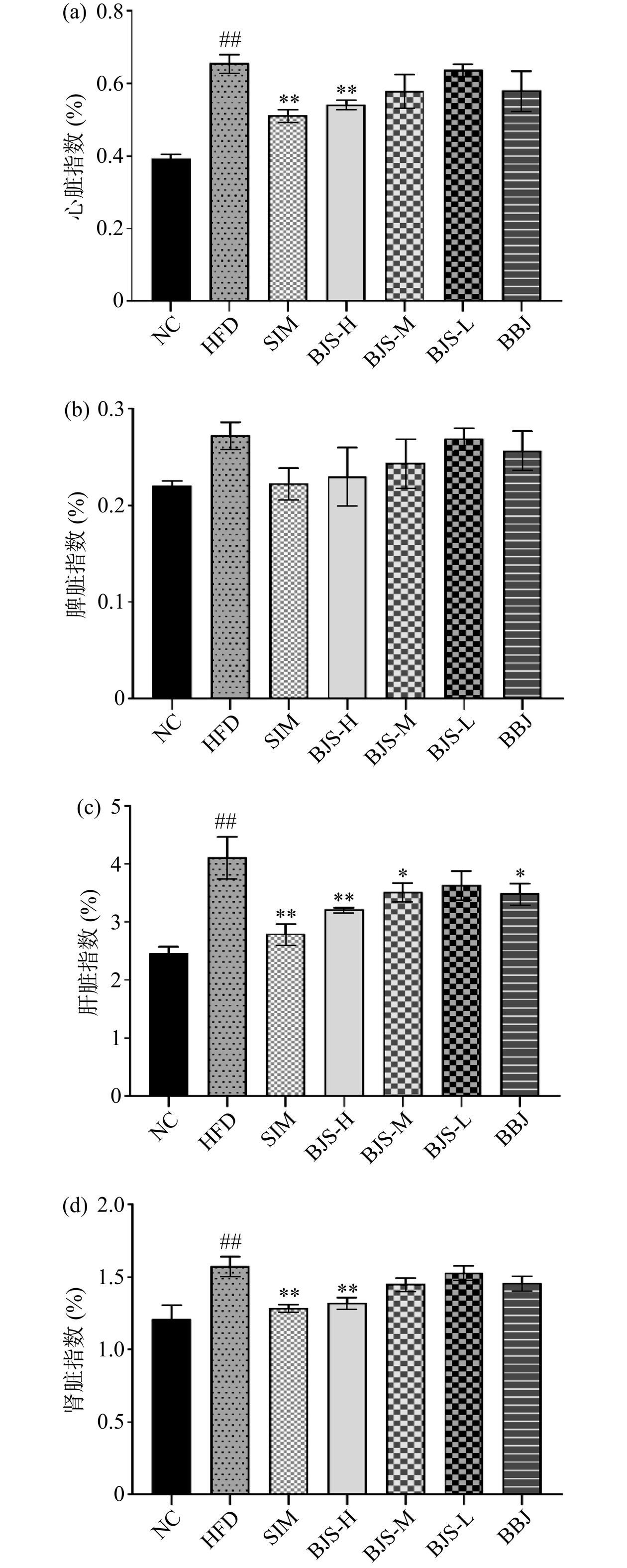
了解脏器指数能够判别内部组织器官是否受损,当人或动物身体出现异常状况时,组织器官的颜色、质量等都会发生改变[14]。由图1可知,与NC组相比,HFD组小鼠心脏、肝脏、肾脏指数极显著升高(P<0.01),表明高脂血症小鼠心脏、肝脏和肾脏组织器官均受到一定程度的损伤。通过灌胃4周后,与HFD组比较,BJS-H组的心脏、肝脏、肾脏指数较模型组极显著降低(P<0.01);BJS-M组和BBJ组的肝脏指数显著降低(P<0.05);其余剂量组之间的脾脏指数均无显著性差异(P>0.05)。本研究中,HFD组的体重增加,灌胃BJS-H比灌胃BBJ和BJS-L更能降低这些指标,表明BJS-H干预更有助于预防高脂血症。CHAI等人观察由益生菌发酵的蓝莓汁可缓解高脂饮食喂养小鼠的肥胖和高脂血症现象[15]。PARK发现植物乳杆菌EM发酵的卷心菜-苹果汁可能对脂质代谢功能障碍和肥胖相关异常有益[16]。蓝莓酵素发挥作用的原因可能是发酵后富含酚酸、活的乳酸菌和其他生物活性成分(如SOD酶、类黄酮、有机酸),这些成分被证明可以预防高脂血症和代谢疾病,调节肠道微生物群,并抑制炎症[17]。
2.5 蓝莓酵素对高脂血症小鼠肝脏功能的影响
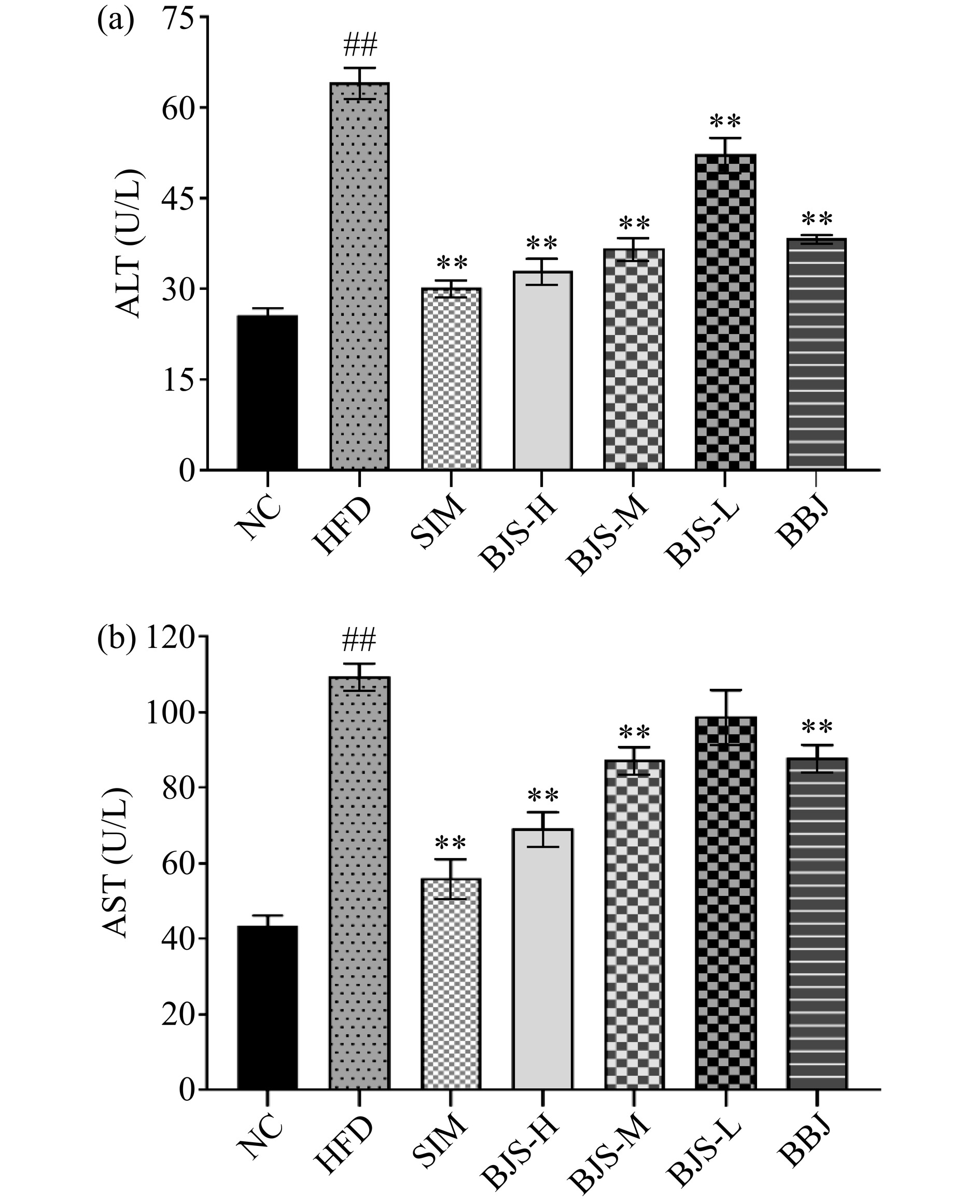
谷草转氨酶、谷丙转氨酶是评估肝损伤程度的重要指标[18]。由图2可知,HFD组小鼠血清中ALT和AST活性极显著高于NC组(P<0.01),说明高脂饮食可能导致小鼠肝功能受损。与HFD组比较,SIM、BJS-H、BJS-M、BJS-L及BBJ组的ALT和AST活性极显著下降(P<0.01)。但由图可知,通过比较BBJ组与其他剂量组可知,BBJ组作用效果不如BJS-H、BJS-M酵素组作用明显。表明蓝莓酵素对高血脂症保护肝脏损伤的作用优于BBJ组。
2.6 蓝莓酵素对高脂血症小鼠肝、肾、结肠组织病理切片的影响
2.6.1 蓝莓酵素对高脂血症小鼠肝脏病理切片的影响
高脂饮食可引起肝脏炎症、损伤和脂肪变性[19]。不同组别肝脏组织病理学的差异如图3所示。NC组肝组织结构完整、清晰,细胞核圆形,核仁明显,具有标准的小叶结构和有序的肝细胞分布排列。HFD组细胞结构明显肿胀,排列不规则,细胞轮廓模糊,部分细胞核挤出至细胞膜内,观察发现肝细胞球囊变性、脂滴蓄积、出现大量脂肪空泡。与HFD组相比,BJS组和BBJ组肝细胞脂滴略有减少,少量肝细胞呈空泡状结构,脂肪变性未完全改善。其中,SIM组和BJS-H组脂滴的减少更为明显,肝组织结构与NC组更相似,明显得到改善。结果表明,适量的蓝莓酵素可改善高脂饮食诱导的小鼠肝细胞病变,使肝损伤正常化。
2.6.2 蓝莓酵素对高脂血症小鼠肾脏病理切片的影响
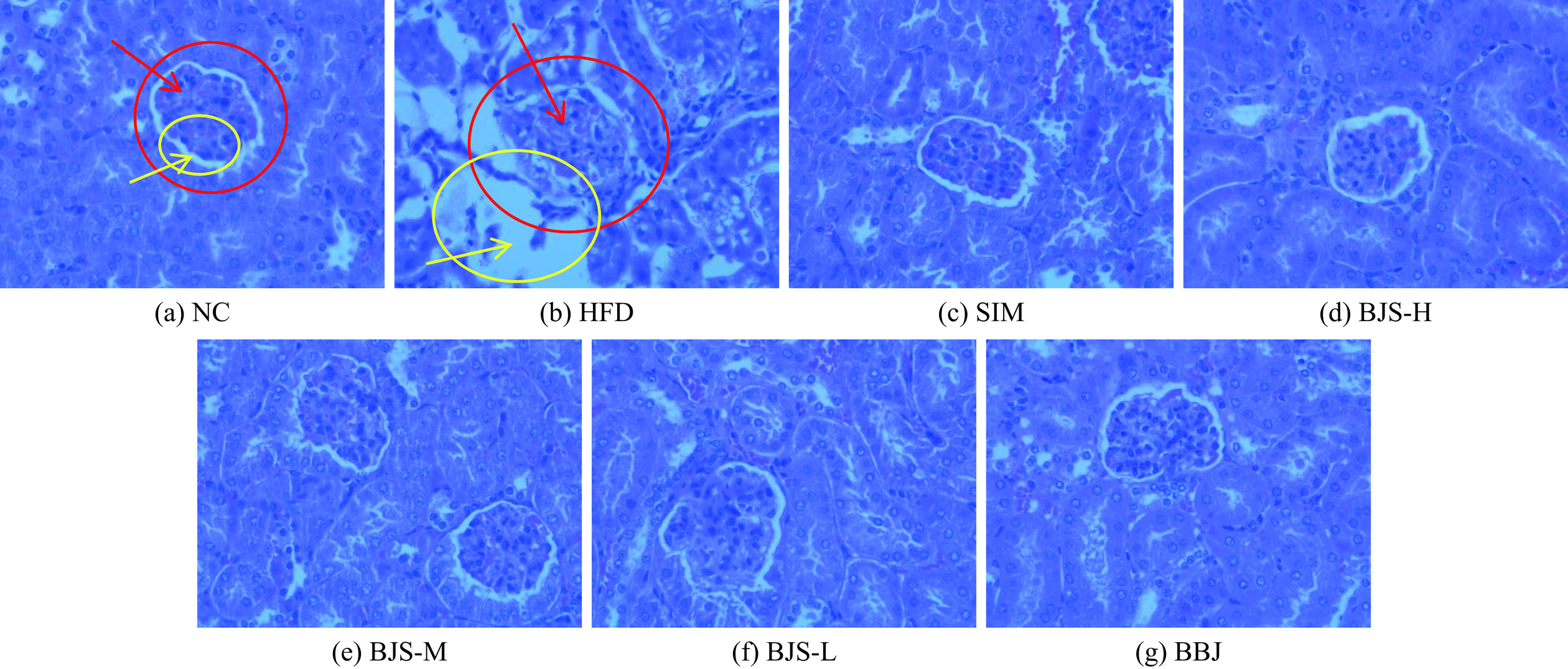
图4显示各组小鼠肾脏组织细胞HE染色病理切片。可以观察到,NC组小鼠肾组织形状规则,结构清晰,细胞排列整齐,肾小球基底膜未见异常,肾小囊体积和囊腔间隙正常。而HFD组小鼠肾组织细胞明显变形,系膜基质增生,基底膜增厚,间质区有炎性细胞浸润,肾小球边界不清,内皮融合。表明长期的高脂饮食会严重损伤小鼠的肾脏组织。经蓝莓酵素灌胃一段时间后,各剂量组小鼠肾脏组织较模型组均有不同程度的改善,其中以BJS-H组效果最明显,BJS-L和BBJ组也存在轻微病变。结果表明,蓝莓酵素与蓝莓果汁对比,蓝莓酵素提高肾脏功能,缓解损伤作用明显。
2.6.3 蓝莓酵素对高脂血症小鼠结肠病理切片的影响
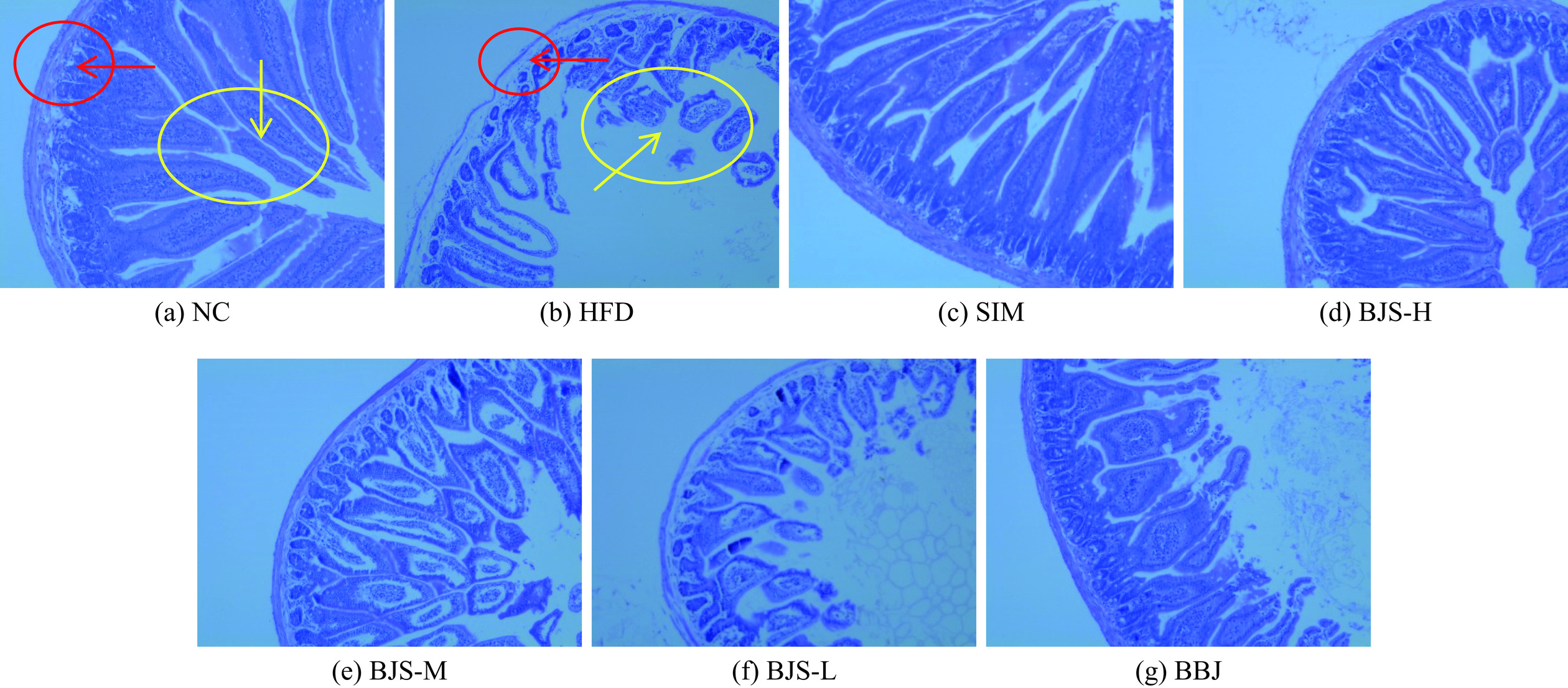
为确定蓝莓酵素对高脂血症的保护作用,通过HE染色对结肠进行组织病理学分析(图5)。NC组结肠绒毛排列整齐,隐窝结构和结肠黏膜结构相对完整。而HFD组结肠绒毛断裂、排列无序,隐窝结构受损,结肠上皮黏膜水肿,部分部位发生溃烂脱落。此外,杯状细胞数量明显减少,有明显的炎症浸润,结肠绒毛和隐窝排列不规则,损伤明显。相比于NC组,BJS和SIM组结肠上皮黏膜结构明显改善,结肠绒毛和隐窝排列有序,其中BJS-H组效果最好,BBJ组效果不及酵素组。结果表明,给予蓝莓酵素干预后可改善高脂血症小鼠结肠形态损伤。冯莉等[20]研究结果表明水果酵素对小鼠酒精性肝损伤有保护作用。同样,Han等[21]使用由乳酸菌发酵的浑浊苹果汁干预后可减轻HFD小鼠的体重并改善血脂异常和肝脏炎症。
2.7 蓝莓酵素对高脂血症肠道菌群的影响
2.7.1 肠道菌群多样性分析
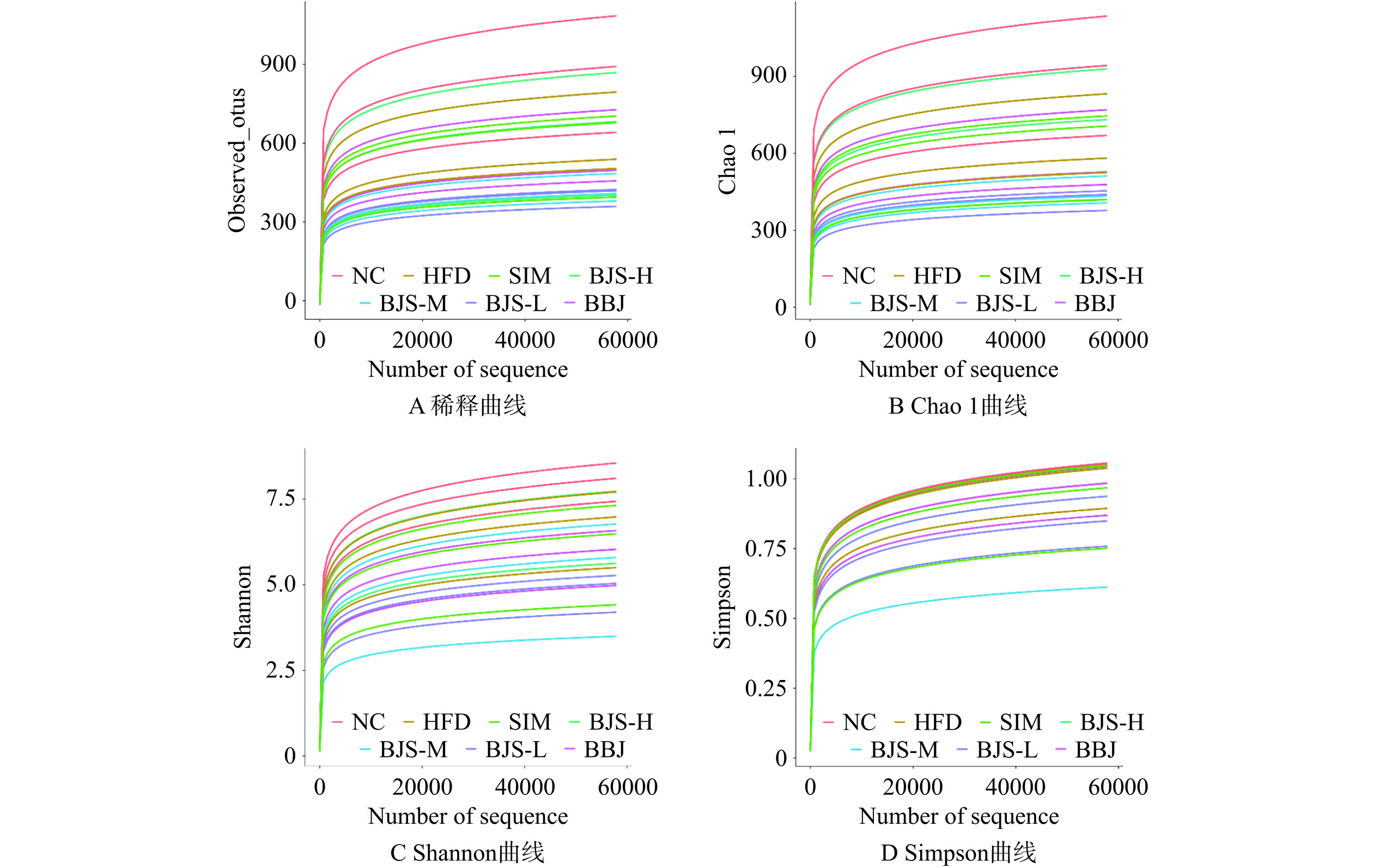
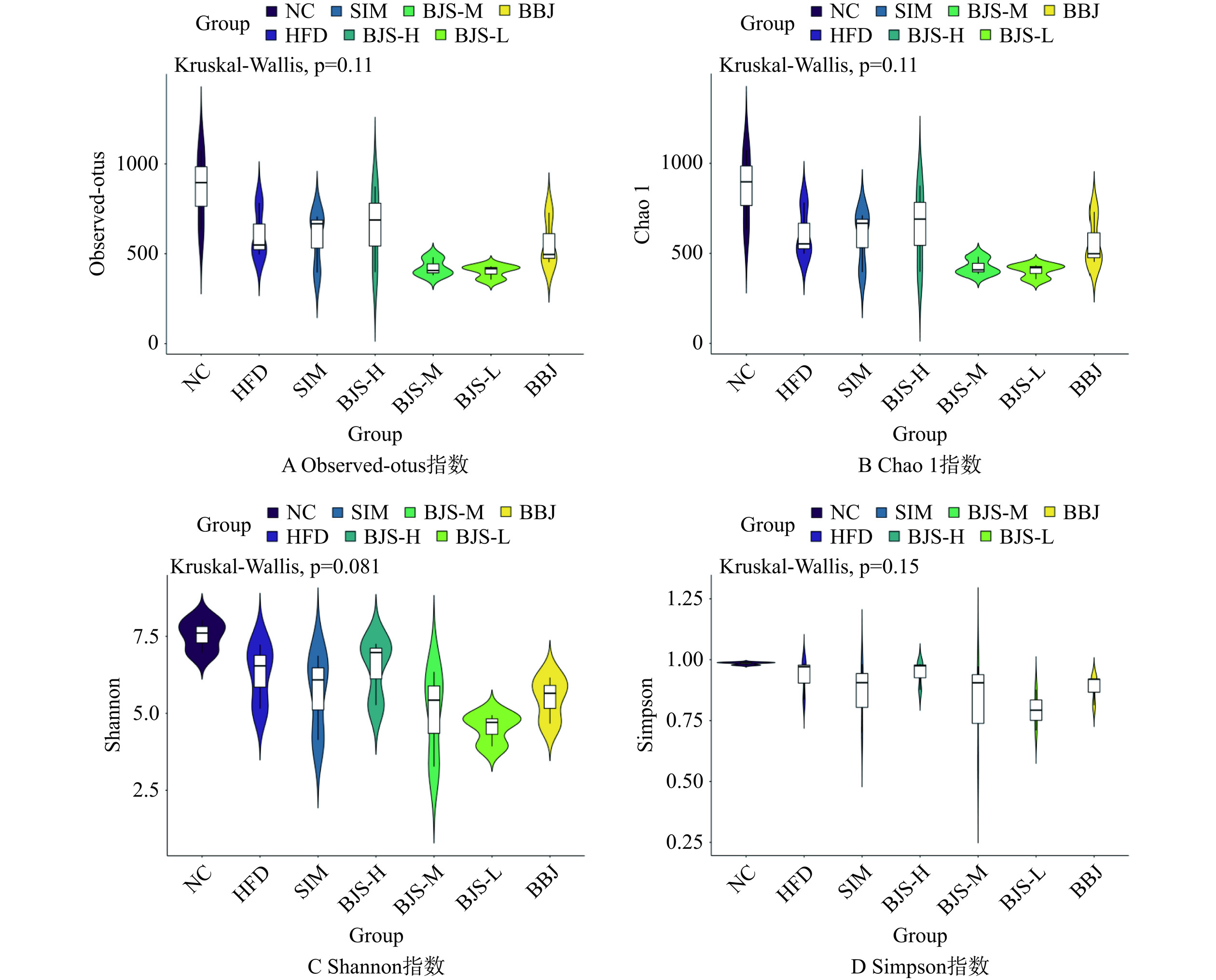
Alpha多样性中稀释曲线(图6A)用于评估测序深度是否反映了样品中的微生物多样性和丰富度[22]。从图可知,序列数超过10000时,样品的稀释曲线达到平台期,这时样品中大部分细菌被鉴定出来。Observed-otus、Chao 1、Shannon和Simpson指数通常用于测量样品的微生物多样性和丰富度,指数越大,样本的群落多样性和丰富性越大。图7中,与NC组相比,由HFD诱导的模型组小鼠Alpha多样性明显降低,表明高脂饮食改变了高脂血症小鼠肠道微生物群的多样性。BJS-M组、BJS-L组和BBJ组物种丰富度和多样性均未得到有效改善,甚至呈下降趋势。然而,高剂量的蓝莓酵素增加了HFD诱导的高脂血症小鼠肠道菌群的多样性和丰富度,甚至达到并超过了SIM组的效果。结果表明,长期高脂饮食会改变肠道微生物的多样性,蓝莓酵素干预后可以调节微生物菌群的丰度和多样性。
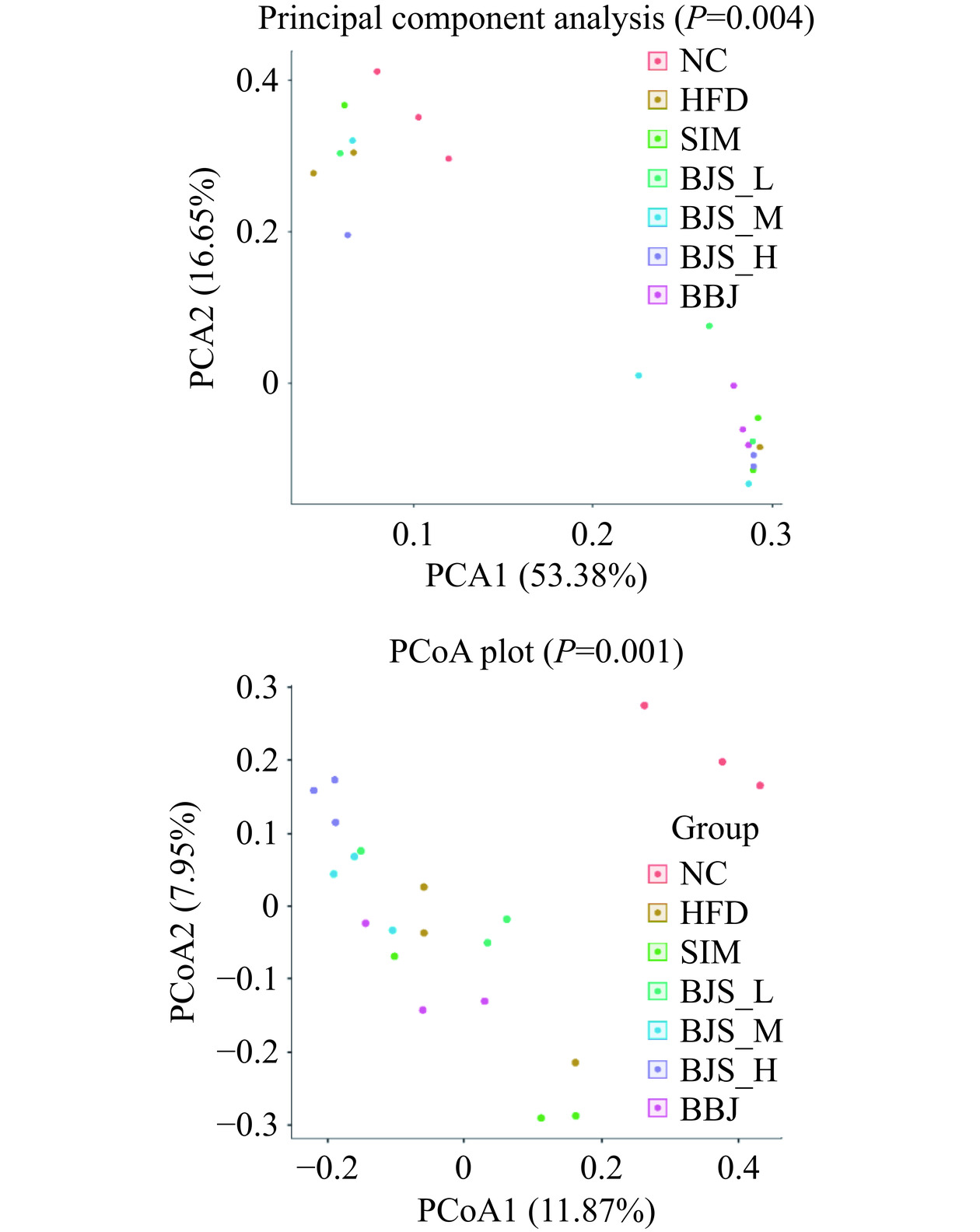
为了更好地比较七组小鼠之间微生物的结构变化,对样品中获得的OTU丰度进行Beta多样性的分析,包括PCA和PCoA分析。图8(PCA1)显示了NC组和HFD组小鼠的数据脱位并位于两个不 同的区域,说明高脂血症小鼠的微生物结构存在明显差异,各剂量组表现出与HFD组分离的趋势,结果表明蓝莓酵素干预减轻了HFD诱导的小鼠肠道微生物群干扰。PCoA用来分析不同组肠道菌群整体结构的变化。大量研究表明,厚壁菌和拟杆菌的失衡会导致高脂血症和相关炎症[23−24]。如图8(右)所示,ND组与HFD组明显分离,表明HFD显著影响肠道菌群组成。此外,BJS-H组与HFD组完全分离,这表明补充蓝莓酵素明显改变HFD组小鼠肠道微生物群的结构。BJS-M和BBJ组也出现与HFD组分离的趋势,并且随着蓝莓酵素剂量的增加,它们逐渐接近BJS-H组。结果表明,喂养蓝莓酵素可以降低个体间肠道菌群的异质性,可能有助于恢复HFD处理导致的肠道菌群结构。
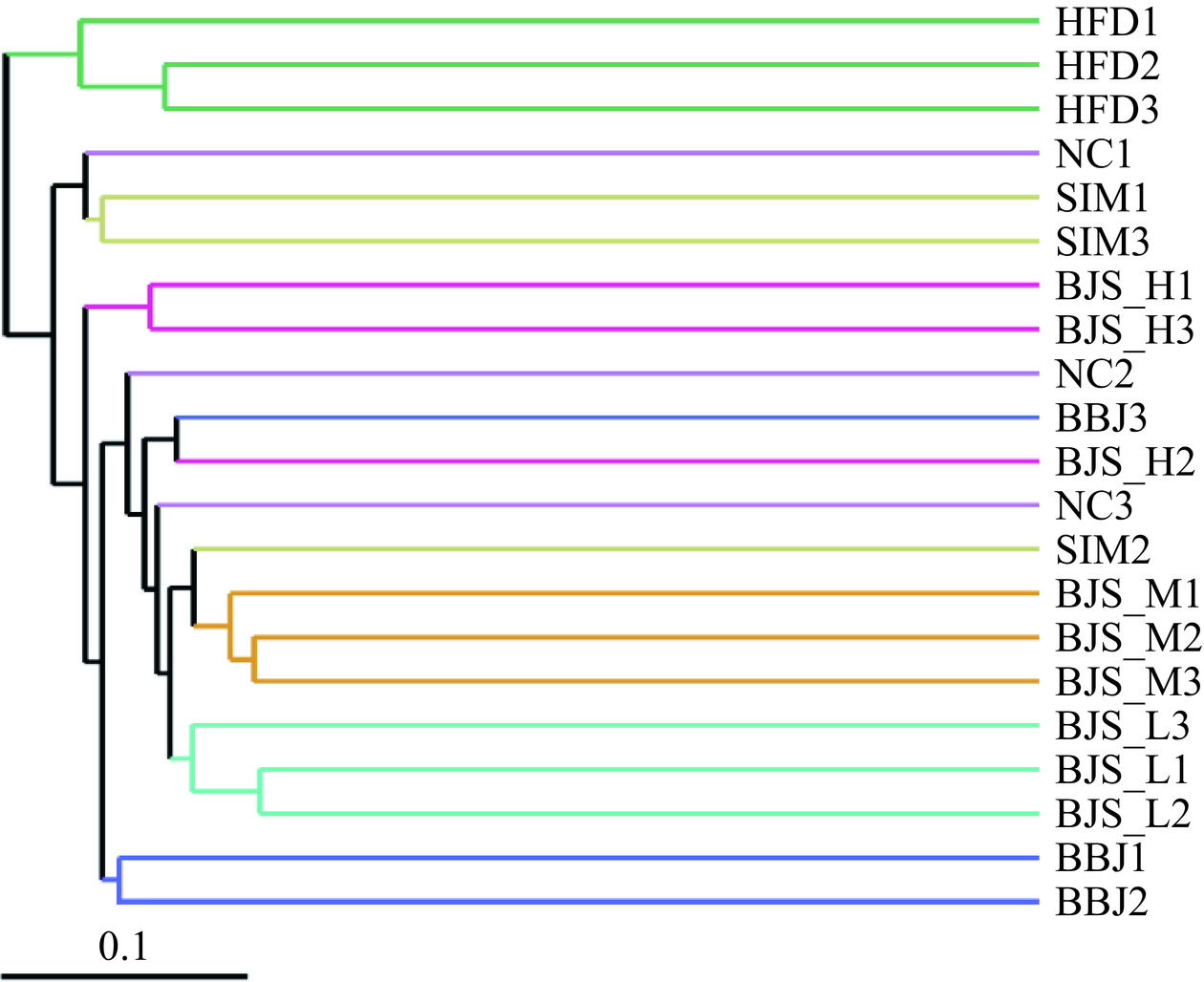
UPGMA聚类分析用于比较各组小鼠肠道菌群组成的个体相似性或差异性关系。结果如图9所示,HFD组明显与NC组物种组成差异显著,SIM组、BJS-H组和NC组的微生物菌群组成相似,说明蓝莓酵素能够调节高脂血症小鼠肠道紊乱。
2.7.2 物种组成分析
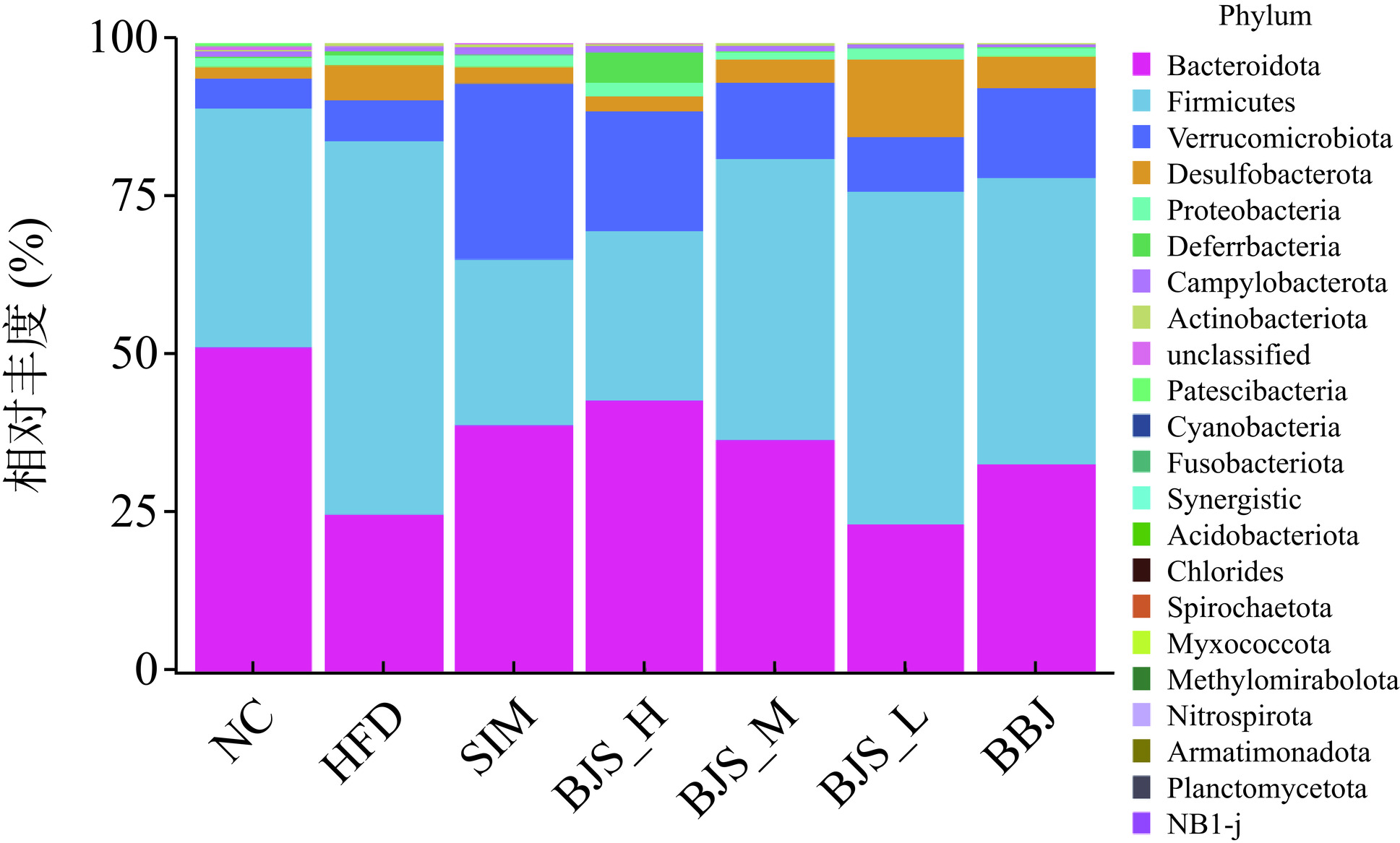
门水平上肠道微生物群的物种分布如图10所示,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、脱硫杆菌门(Desulfobacterota)和变形菌门(Proteobacteria)是所有组群共有的主要门种,相对比例超过90%。与NC组相比,HFD组厚壁菌门的相对丰度增加,成为微生物优势种群,而拟杆菌门和疣微菌门相对丰度降低。厚壁菌已被证实可以促进能量吸收和体重增加[25],图10也表明了高脂血症小鼠的厚壁菌升高。在SIM、BJS和BBJ组中,厚壁菌的相对丰度逐渐降低,而拟杆菌门和疣微菌门的相对丰度逐渐增加。此外,在高剂量蓝莓酵素干预后,厚壁菌和拟杆菌的变化趋势最大。结果表明,饲喂含有益生菌、多酚、类黄酮等活性化合物的蓝莓酵素可以调节HFD诱导的高脂血症小鼠的厚壁菌和拟杆菌的丰度来抑制高脂血症。研究表明,厚壁菌比拟杆菌具有更高的糖代谢效率,有利于能量吸收并促进体重增加[26],而拟杆菌与高脂血症呈负相关,有助于改善肠道健康[27]。蓝莓酵素干预后改变了厚壁菌和拟杆菌的相对丰度,表明蓝莓酵素在调节肠道菌群至正常水平方面具有改善作用。
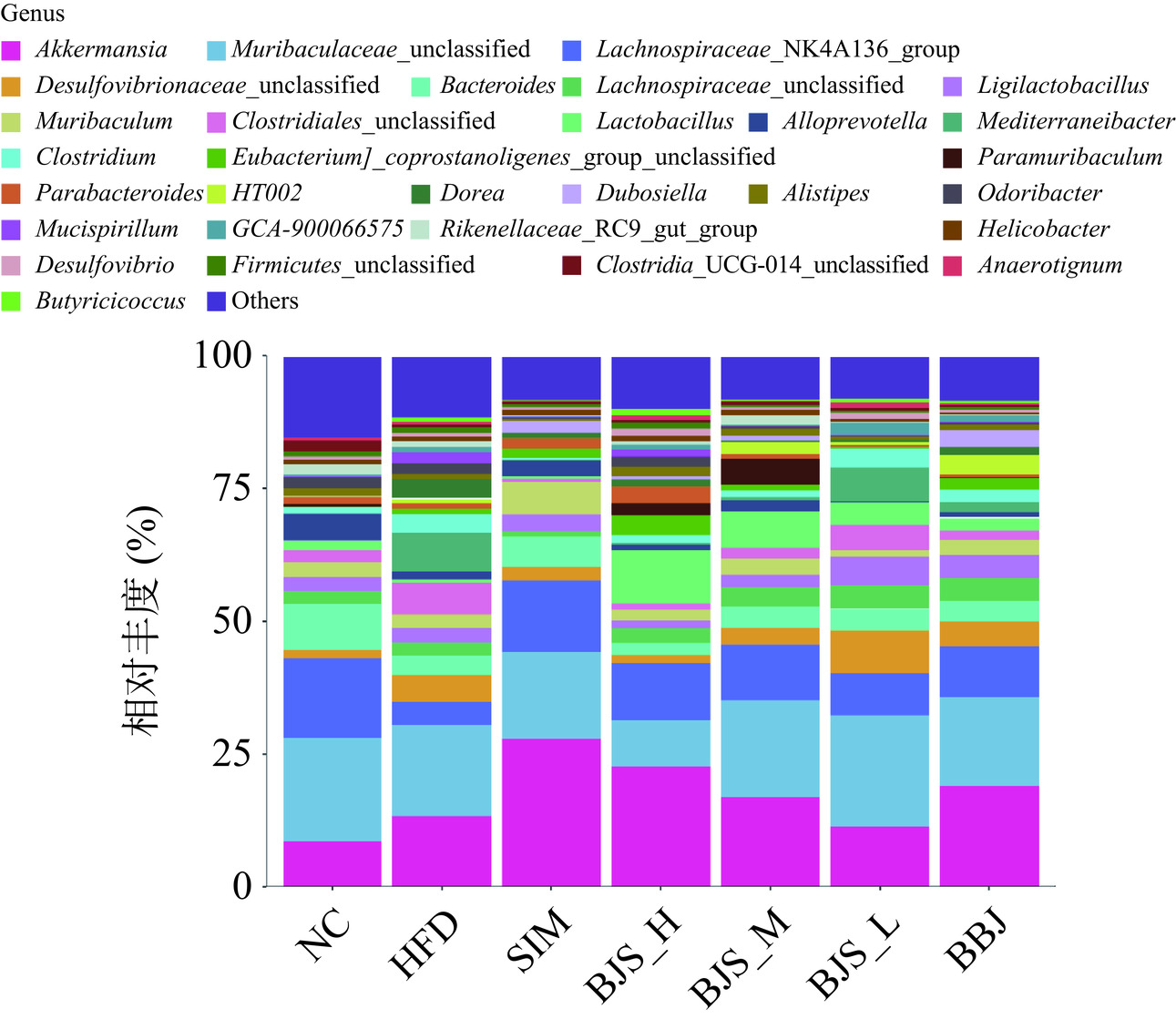
在属水平上,选择相对丰度最高的30个属评估蓝莓酵素改变小鼠肠道微生物组结构的结果如图11所示。艾克曼菌属(Akkermansia)[28]、绒毛杆菌属(Muribaculaceae_unclassified)、毛螺菌科NK4A136群(Lachnospiraceae_NK4A136_group)[29]、脱硫弧菌属(Desulfovibrionaceae_unclassified)和拟杆菌属(Bacteroides)是各组的共有优势菌属。与NC组相比,HFD诱导的小鼠中艾克曼菌属、脱硫弧菌属、梭状芽孢杆菌属(Clostridium)、Mediterraneibacter、Dorea、另枝菌属(Alistipes)、Odoribacter、粘螺旋菌(Mucispirillum)和厚壁菌属(Firmicutes_unclassified)的相对丰度更高。这一结果表明,HFD诱导在小鼠在属水平上能够引起肠道微生物生态失调。灌胃给药后,这些有害菌群的相对丰度降低。SIM组和BJS组明显增加了艾克曼菌属、毛螺菌科NK4A136群、拟杆菌属、乳酸杆菌属(Lactobacillus)[30]的相对丰度。此外,BJS干预后,Ligilactobacillus、Muribaculum、真杆菌属(Eubacterium_coprostanoligenes_group_ unclassified)和副杆菌属(Parabacteroides)的相对丰度也有所增加。同时,蓝莓酵素高剂量组对高脂血症小鼠肠道微生物菌群的门水平和属水平相对丰度的调控效果优于中、低剂量组,表明高剂量的蓝莓酵素对调节高脂血症引起的肠道菌群紊乱有改善作用。
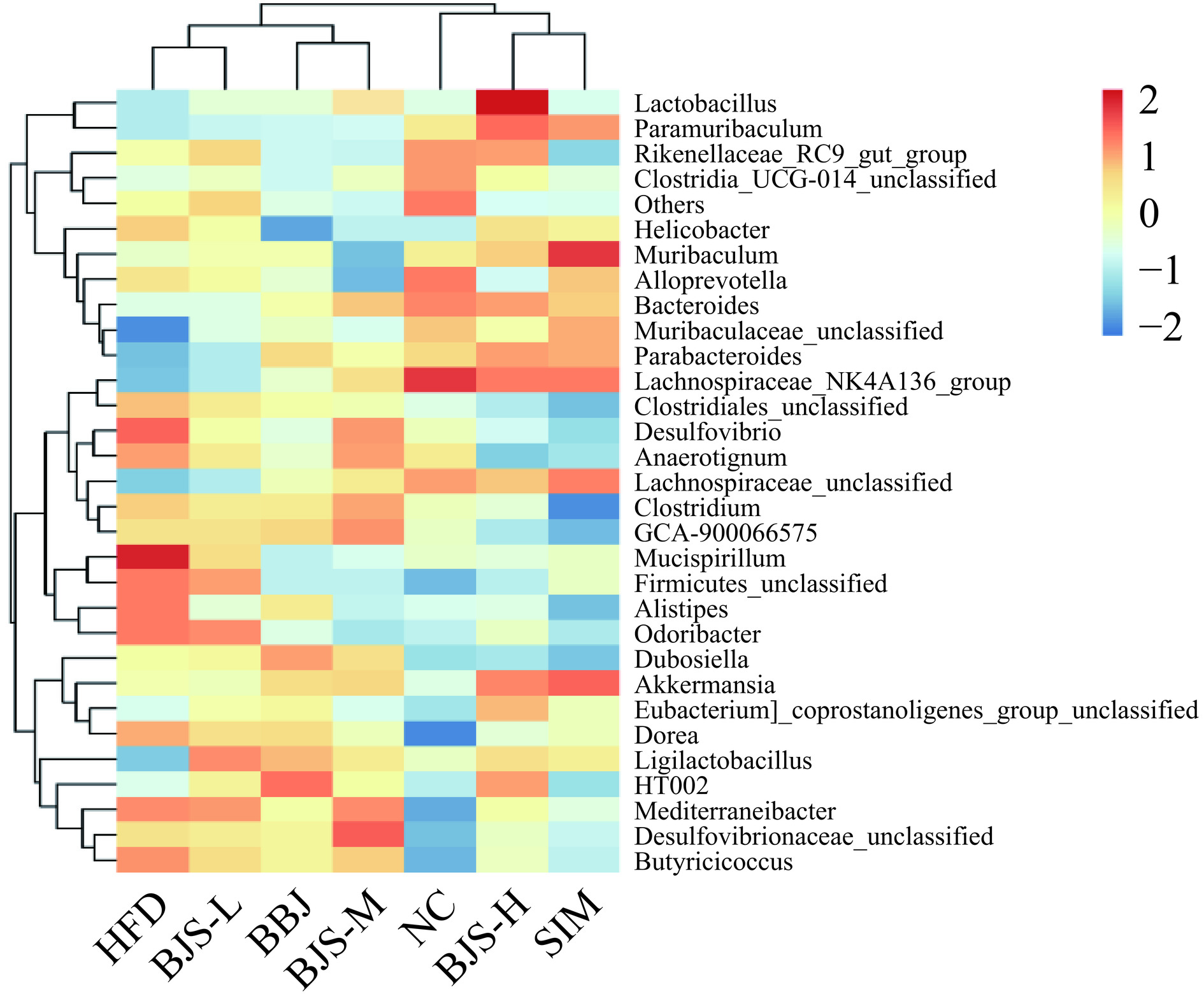
使用热图(图12)对属水平上的相对丰度进行分析。NC组与毛螺菌科NK4A136群(Lachnospiraceae_NK4A136_group)、拟杆菌属(Bacteroides)、拟普雷沃氏菌属(Alloprevotella)、Rikenellaceae_PC9_gut_group、梭状芽孢杆菌属UCG-014(Clostridium_UCG-014_ unclassified)呈正相关;而HFD组与粘螺旋菌(Mucispirillum)、厚壁菌属(Firmicutes_unclassified)、脱硫弧菌属(Desulfovibrio)、另枝菌属(Alistipes)、Odoribacter呈正相关。蓝莓酵素组与艾克曼菌属(Akkermansia)、绒毛杆菌属(Muribaculaceae)、毛螺菌科NK4A136群、乳酸杆菌属(Lactobacillus)相关性更强;与Firmicutes_unclassified、Alistipes、Dubosiella、Anaerotignum的丰度呈负相关。该实验结果与上述结果(图12)一致,进一步证明长期高脂饮食可以引发高脂血症,蓝莓酵素可以通过调节肠道微生物菌群的相对平衡缓解和改善高血脂症状。
2.7.3 潜能功能预测分析
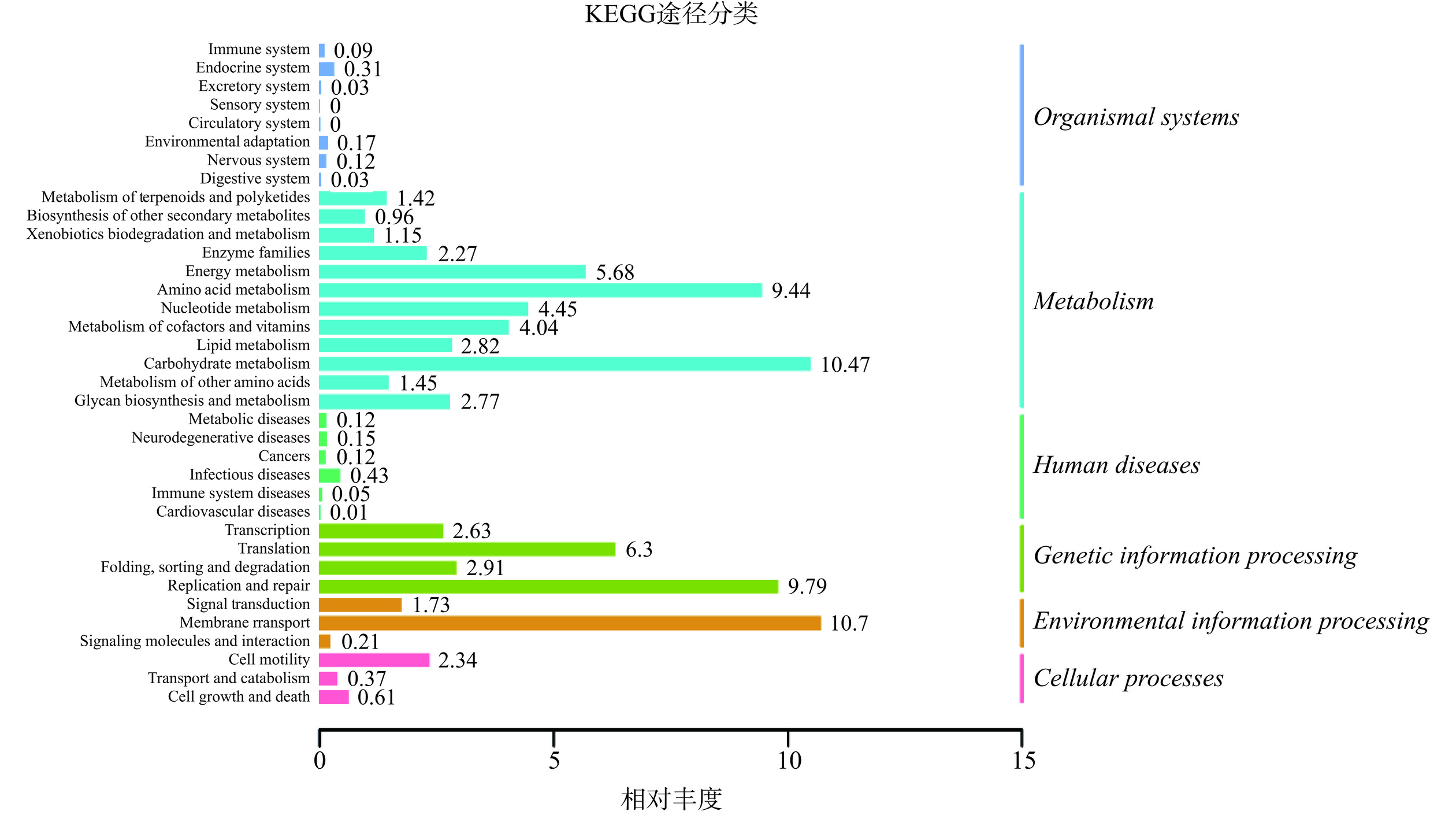
PICRUSt2可以对基因序列的潜在功能进行预测,图13显示了KEGG的二级通路的相对丰度。其中代谢通路(Metabolism)的相对丰度最大,由高到低依次为: Carbohydrate metabolism(碳水化合物代谢/10.47)、Amino Acid Metabolism(氨基酸代谢/9.44)、Energy metabolism(能量代谢/5.68)、Nucleotide metabolism(核苷酸代谢/4.45)、Metabolism of cofactors and vitamins(辅助因子和维生素代谢/4.04)、Lipid metabolism(脂类代谢/2.82)、Glycan biosynthesis and metabolism (聚糖的生物合成与代谢/2.77)等。在环境信息处理(Environmental Information Processing)中,Membrane transpor(膜运输/10.7)的相对丰度最大。在人类疾病(Human Diseases)模块中,该实验与Metabolic diseases(代谢疾病)、Neurodegenerative diseases(神经退行性疾病)、Cancers(癌症)、 Infectious diseases(传染病)、Immune system diseases(免疫系统疾病)和Cardiovascular diseases(心血管疾病)都有一定的关系。PICRUSt2功能预测表明,蓝莓酵素干预后,影响了肠道微生物区系的碳水化合物代谢、氨基酸代谢和能量代谢能力,提高了能量利用率,降低高脂血症和其他代谢综合征的发病率[31]。
3. 结论
本研究通过高脂饮食喂养小鼠构建高脂血症模型,测定蓝莓酵素对小鼠血脂水平、脏器指数、肝脏功能、结肠组织病理切片及肠道菌群的影响。实验结果显示,蓝莓酵素高剂量组显著减轻高脂血症小鼠体重(P<0.05),极显著降低高脂血症小鼠血清中TC、TG、LDL-C含量(P<0.01),极显著增加血清中HDL-C含量(P<0.01);高脂血症小鼠心脏、肝脏和肾脏组织器官重量极显著增加(P<0.01),高剂量蓝莓酵素干预后小鼠其组织器官重量极显著降低(P<0.01),对组织器官的肿大有一定的抑制作用,同时通过极显著降低ALT和AST活性(P<0.01)。实验结果表明蓝莓酵素可调节微生物菌群的丰度和多样性,明显改变高脂血症小鼠肠道微生物群的结构,有助于恢复高脂饮食导致的肠道菌群结构,对调节高脂血症患者体内的血脂水平,改善高脂血症及组织病变有明显效果。因此,蓝莓酵素可作为一种有前途的功能性材料开发应用于保健食品与药业。
-
表 1 各组小鼠分组与给药情况
Table 1 Grouping and administration of mice in each group
分组(n=8) 灌胃量 饲料 正常对照组(NC) 0.9%生理盐水 普通饲料 高脂模型组(HFD) 0.9%生理盐水 高脂饲料 辛伐他汀组(SIM) 辛伐他汀3 mg/kg 高脂饲料 蓝莓酵素高剂量组(BJS-H) 蓝莓酵素溶液5 mL/kg 高脂饲料 蓝莓酵素中剂量组(BJS-M) 蓝莓酵素溶液10 mL/kg 高脂饲料 蓝莓酵素低剂量组(BJS-L) 蓝莓酵素溶液20 mL/kg 高脂饲料 蓝莓果汁组(BBJ) 蓝莓果汁10 mL/kg 高脂饲料 注:NC:正常对照组;HFD:高脂模型组;SIM:辛伐他汀组;BJS-H:蓝莓酵素高剂量组;BJS-M:蓝莓酵素中剂量组;BJS-L:蓝莓酵素低剂量组;BBJ:蓝莓果汁组。下同。 表 2 造模期小鼠血脂指标测定
Table 2 Determination of lipid indexes in mice during modeling stage
组别 TC TG HDL-C LDL-C 正常组 3.39±0.39 0.96±0.09 2.91±0.38 1.01±0.07 实验组 5.53±0.31** 1.90±0.17** 2.14±0.43** 2.28±0.35* 注:*表示与正常组相比,P<0.05(*)表示差异显著,P<0.01(**)表示差异极显著。 表 3 蓝莓酵素对高脂血症小鼠体重的影响
Table 3 Effect of blueberry jiaosu on weight of hyperlipidemia mice
分组 小鼠体重值(g) 造模给药前 灌胃第1周 灌胃第2周 灌胃第3周 灌胃第4周 正常对照组 41.20±0.29 43.03±0.62 43.72±0.34 45.12±0.46 45.73±0.69 高脂模型组 45.82±0.64## 46.56±0.39## 48.45±0.52## 49.11±1.09## 51.06±0.96## 辛伐他汀组 44.16±0.61 45.95±0.84 47.46±0.44 48.68±0.51 49.09±0.47* 高剂量组 45.02±0.22 46.16±0.35 47.82±0.46 48.90±0.62 49.12±0.76* 中剂量组 45.78±0.26 46.22±0.91 47.74±0.94 48.53±0.66 49.64±0.44 低剂量组 44.26±0.38 46.49±0.49 47.81±0.90 48.86±0.79 50.13±0.66 果汁组 45.31±0.46 46.94±0.87 47.52±0.41 48.57±0.77 49.88±0.33 注:#表示与正常对照组相比,P<0.05(#)表示差异显著,P<0.01(##)表示差异极显著;*表示与高脂模型组相比,P<0.05(*)表示差异显著,P<0.01(**)表示差异极显著,表4、图1~图2同。 表 4 蓝莓酵素对高脂血症小鼠血脂水平的影响
Table 4 Effect of blueberry jiaosu on blood lipid level in hyperlipidemia mice
分组 总胆固醇TC
(mmol/L)甘油三酯TG
(mmol/L)低密度脂蛋白
胆固醇LDL-C
(mmol/L)高密度脂蛋白
胆固醇HDL-C
(mmol/L)正常对照组 4.44±0.02 1.49±0.09 0.44±0.06 2.64±0.10 高脂模型组 7.29±0.30## 2.71±0.23## 1.42±0.02## 1.80±0.02## 辛伐他汀组 5.28±0.13** 1.74±0.01** 0.67±0.08** 2.37±0.13** 高剂量组 5.68±0.32** 2.21±0.10** 0.79±0.07** 2.23±0.04** 中剂量组 6.62±0.18 2.30±0.06 1.17±0.03 2.02±0.04* 低剂量组 7.21±0.34 2.57±0.20 1.37±0.07 1.87±0.05 果汁组 7.02±0.19 2.36±0.11 1.26±0.08 1.97±0.06 -
[1] 朱超霞, 陆颖理. 肠道菌群与肥胖及相关代谢性疾病关系的研究进展[J]. 上海交通大学学报(医学版),2014,34(12):1829−1833. [ZHU C X, LU Y L. Research progress on the relationship between intestinal flora and obesity and related metabolic diseases[J]. Journal of Shanghai Jiaotong University (Medical Science Edition),2014,34(12):1829−1833.] ZHU C X, LU Y L. Research progress on the relationship between intestinal flora and obesity and related metabolic diseases[J]. Journal of Shanghai Jiaotong University (Medical Science Edition), 2014, 34(12): 1829−1833.
[2] 李航棋, 胡秋阳, 王文秀, 等. 浆果酵素食品发酵工艺及功能特性研究进展[J]. 食品安全质量检测学报,2022,13(12):3973−3980. [[LI H Q, HU Q Y, WANG W X, et al. Research progress of food fermentation technology and functional properties of berry enzymes[J]. Journal of Food Safety and Quality Inspection,2022,13(12):3973−3980.] [LI H Q, HU Q Y, WANG W X, et al. Research progress of food fermentation technology and functional properties of berry enzymes[J]. Journal of Food Safety and Quality Inspection, 2022, 13(12): 3973−3980.
[3] 刘晓芳, 钦佩, 黄晓东. 益生菌及其制剂的研究和应用[J]. 食品与药品,2019,21(6):514−517. [LIU X F, QIN P, HUANG X D. Research and application of probiotics and their preparations[J]. Food & Medicine,2019,21(6):514−517.] LIU X F, QIN P, HUANG X D. Research and application of probiotics and their preparations[J]. Food & Medicine, 2019, 21(6): 514−517.
[4] 欧雅文, 周倩, 刘琪, 等. 酚类物质与肠道微生物对高血脂症的作用机制[J]. 中国食品学报,2018,18(10):269−275. [OU Y W, ZHOU Q, LIU Q, et al. The mechanism of action of phenols and intestinal microorganisms on hyperlipidemia[J]. Chinese Journal of Food Science,2018,18(10):269−275.] OU Y W, ZHOU Q, LIU Q, et al. The mechanism of action of phenols and intestinal microorganisms on hyperlipidemia[J]. Chinese Journal of Food Science, 2018, 18(10): 269−275.
[5] 李涛, 李绮丽, 张群, 等. 基于肠道菌群的黄酮类化合物生理功能研究进展[J]. 中国食品学报,2022,22(2):357−368. [LI T, LI Q L, ZHANG Q, et al. Research progress on physiological functions of flavonoids based on intestinal flora[J]. Chinese Journal of Food Science,2022,22(2):357−368.] LI T, LI Q L, ZHANG Q, et al. Research progress on physiological functions of flavonoids based on intestinal flora[J]. Chinese Journal of Food Science, 2022, 22(2): 357−368.
[6] VALERO-CASES E, CERDA-BERNAD D, PASTOR J J, et al. Non-dairy fermented beverages as potential carriers to Ensure probiotics, prebiotics, and bioactive compounds arrival to the gut and their health Benefits[J]. Nutrients,2020,12(6):1666. doi: 10.3390/nu12061666
[7] 赵嘉, 梁法勇, 蒙宏, 等. 16S rDNA测序研究高脂饮食诱导的高脂血症大鼠肠道菌群变化[J]. 中国微生态学杂志,2022,34(3):257−261. [ZHAO J, LIANG F Y, MENG H, et al. 16S rDNA sequencing was used to study the changes of intestinal flora in hyperlipidemia rats induced by high fat diet[J]. Chinese Journal of MicroEcology,2022,34(3):257−261.] ZHAO J, LIANG F Y, MENG H, et al. 16S rDNA sequencing was used to study the changes of intestinal flora in hyperlipidemia rats induced by high fat diet[J]. Chinese Journal of MicroEcology, 2022, 34(3): 257−261.
[8] 吴茂兰, 翁家俊, 崔粲, 等. 基于肠道菌群的中药防治高脂血症及降低其相关危险因素的研究进展[J/OL]. 中成药, 2023, 45(18):2642−2650. [WU M L, WONG J J, CUI C, et al. Research progress on prevention and treatment of hyperlipidemia and reduction of related risk factors with traditional Chinese medicine based on intestinal flora[J]. Proprietary Chinese medicine, 2023, 45(18):2642−2650.] WU M L, WONG J J, CUI C, et al. Research progress on prevention and treatment of hyperlipidemia and reduction of related risk factors with traditional Chinese medicine based on intestinal flora[J]. Proprietary Chinese medicine, 2023, 45(18): 2642−2650.
[9] 金永学, 冯建国, 郑淘, 等. 蓝莓的功能成分、保健作用及其开发利用[J]. 食品与机械,2020,36(05):231−236. [JIN Y X, FENG J G, ZHENG T, et al. Functional components, health benefits and development and utilization of blueberry[J]. Food and machinery,2020,36(05):231−236.] JIN Y X, FENG J G, ZHENG T, et al. Functional components, health benefits and development and utilization of blueberry[J]. Food and machinery, 2020, 36(05): 231−236.
[10] 李颖畅, 孟宪军, 孙靖靖, 等. 蓝莓花色苷的降血脂和抗氧化作用[J]. 食品与发酵工业,2008,34(10):44−48. [LI Y C, MENG X J, SUO J J, et al. Effect of blueberry anthocyanins on lowering blood lipids and antioxidation[J]. Food and Fermentation Industry,2008,34(10):44−48.] LI Y C, MENG X J, SUO J J, et al. Effect of blueberry anthocyanins on lowering blood lipids and antioxidation[J]. Food and Fermentation Industry, 2008, 34(10): 44−48.
[11] 杨彬彦, 党娅, 黎坤怡. 蓝莓酵素复合菌种发酵工艺优化及品质分析[J]. 中国酿造,2023,42(12):165−169. [YANG B Y, DANG Y, LI K Y. Fermentation process optimization and quality analysis of blueberry enzyme compound strains[J]. Chinese brewing,2023,42(12):165−169.] YANG B Y, DANG Y, LI K Y. Fermentation process optimization and quality analysis of blueberry enzyme compound strains[J]. Chinese brewing, 2023, 42(12): 165−169.
[12] 白琳, 茹先古丽·买买提依明, 丁帅杰, 等. 蓝莓酵素中复合菌种添加比例的确定及发酵工艺优化[J]. 现代食品科技,2021,37(05):91−99,37. [BAI L, RU X G L, MAI M T Y M, DING S J, et al. Determination of the proportion of compound strains added to blueberry enzymes and optimization of fermentation process[J]. modern food technology,2021,37(05):91−99,37.] BAI L, RU X G L, MAI M T Y M, DING S J, et al. Determination of the proportion of compound strains added to blueberry enzymes and optimization of fermentation process[J]. modern food technology, 2021, 37(05): 91−99,37.
[13] 秦楠, 王辉敏, 杨金梅, 等. 复合沙棘原液对高脂血症大鼠的降脂作用[J]. 食品工业科技,2023,44(7):352−358. [QIN N, WANG H M, YANG J M, et al. Effect of complex sea-buckthorn stock liquid on lipid-lowering in hyperlipidemia rats[J]. Food Industry Technology,2023,44(7):352−358.] QIN N, WANG H M, YANG J M, et al. Effect of complex sea-buckthorn stock liquid on lipid-lowering in hyperlipidemia rats[J]. Food Industry Technology, 2023, 44(7): 352−358.
[14] 黄玉军, 姚瑶, 周帆, 等. 植物乳杆菌67干预频次及周期对高脂血症大鼠血脂的影响[J]. 食品科学,2020,41(11):179−183. [HUANG Y J, YAO Y, ZHOU F, et al. Effects of intervention frequency and cycle of Lactobacillus plantarum 67 on blood lipids in hyperlipidemia rats[J]. Food science,2020,41(11):179−183.] doi: 10.7506/spkx1002-6630-20190610-100 HUANG Y J, YAO Y, ZHOU F, et al. Effects of intervention frequency and cycle of Lactobacillus plantarum 67 on blood lipids in hyperlipidemia rats[J]. Food science, 2020, 41(11): 179−183. doi: 10.7506/spkx1002-6630-20190610-100
[15] CHAI Z, YAN Y, ZAN S, et al. Probiotic-fermented blueberry pomace alleviates obesity and hyperlipidemia in high-fat diet C57BL/6J mice[J]. Food Res Int,2022,157:111396. doi: 10.1016/j.foodres.2022.111396
[16] PARK S, SON H K, CHANG H C, et al. Effects of cabbage-apple Juice fermented by Lactobacillus plantarum EM on lipid profile improvement and obesity amelioration in rats[J]. Nutrients,2020,12(4):1135. doi: 10.3390/nu12041135
[17] LEONRD W, LIANG A, RANADHEERA C S, et al. Fruit juices as a carrier of probiotics to modulate gut phenolics and microbiota[J]. Food Funct,2022,13(19):10333−10346. doi: 10.1039/D2FO01851A
[18] 王青虎, 敖苏日古嘎, 包文林, 等. 柳蒿脂溶性部位对高脂血症大鼠脂质代谢及肝脏的影响[J]. 中草药,2022,53(11):3402−3409. [WANG Q H, AO S R G G, BAO W L, et al. Effects of the lipid-soluble parts of Artemisia sallow on lipid metabolism and liver in hyperlipidemia rats[J]. Chinese herbal medicine,2022,53(11):3402−3409.] WANG Q H, AO S R G G, BAO W L, et al. Effects of the lipid-soluble parts of Artemisia sallow on lipid metabolism and liver in hyperlipidemia rats[J]. Chinese herbal medicine, 2022, 53(11): 3402−3409.
[19] 石英, 拉巴普尺, 张丹瑛, 等. 双歧杆菌对高脂饮食诱导的C57BL/6小鼠非酒精性脂肪肝的影响[J]. 中国临床医学,2022,29(3):473−480. [SHI Y, LA B P C, ZHANG D Y, et al. Effect of Bifidobacterium on non-alcoholic fatty liver in high-fat diet-induced C57BL/6 mice[J]. Chinese Clinical medicine,2022,29(3):473−480.] SHI Y, LA B P C, ZHANG D Y, et al. Effect of Bifidobacterium on non-alcoholic fatty liver in high-fat diet-induced C57BL/6 mice[J]. Chinese Clinical medicine, 2022, 29(3): 473−480.
[20] 冯莉, 张鹤鑫, 何国库, 等. 水果酵素对小鼠酒精性肝损伤保护作用的研究[J]. 中国酿造,2017,36(9):112−115. [FENG L, ZHANG H X, HE G K, et al. Protective effect of fruit enzyme on alcohol-induced liver injury in mice[J]. Made in China,2017,36(9):112−115.] doi: 10.11882/j.issn.0254-5071.2017.09.024 FENG L, ZHANG H X, HE G K, et al. Protective effect of fruit enzyme on alcohol-induced liver injury in mice[J]. Made in China, 2017, 36(9): 112−115. doi: 10.11882/j.issn.0254-5071.2017.09.024
[21] HAN M, ZHANG M, WANG X, et al. Cloudy apple juice fermented by Lactobacillus prevents obesity via modulating gut microbiota and protecting intestinal tract health[J]. Nutrients,2021,13(3):971. doi: 10.3390/nu13030971
[22] LI G, LI S, LIU H, et al. Isinglass polysaccharides regulate intestinal-barrier function and alleviate obesity in high-fat diet mice through the HO-1/Nrf2 pathway and intestinal microbiome environment[J]. Nutrients,2022,14(19):3928. doi: 10.3390/nu14193928
[23] 何惠丽. 高脂饲料及运动干预对大鼠生理机能的影响[J]. 中国饲料,2023(4):17−20. [HE H L. Effects of high fat diet and exercise intervention on physiological function in rats[J]. Chinese Feed,2023(4):17−20.] HE H L. Effects of high fat diet and exercise intervention on physiological function in rats[J]. Chinese Feed, 2023(4): 17−20.
[24] 寇静, 史琳娜, 张怡敏, 等. 沙棘发酵茶对高脂饮食大鼠血脂和肠道菌群的影响[J/OL]. 食品与发酵工业:1−10[2023-03-25]. DOI:10.13995/j.cnki.11-1802/ts.032342. [KOU J, SHI L N, ZHANG Y J, et al. Effects of fermented sea buckthorn tea on blood lipids and intestinal flora in rats with high fat diet[J/OL]. Food and Fermentation Industry:1−10[2023-03-25]. DOI:10.13995/j.cnki.11-1802/ts.032342.] KOU J, SHI L N, ZHANG Y J, et al. Effects of fermented sea buckthorn tea on blood lipids and intestinal flora in rats with high fat diet[J/OL]. Food and Fermentation Industry: 1−10[2023-03-25]. DOI: 10.13995/j.cnki.11-1802/ts.032342.
[25] FU S, DANG Y, XU H, et al. Aloe Vera-fermented beverage ameliorates obesity and gut dysbiosis in high-fat-diet mice[J]. Foods,2022,11(22):3728. doi: 10.3390/foods11223728
[26] ZHONG H, WANG J, ABDULLAH, et al. Lactobacillus plantarum ZJUFB2 prevents high fat diet-induced insulin resistance in association with modulation of the gut microbiota[J]. Front Nutr,2021,8:754222. doi: 10.3389/fnut.2021.754222
[27] LI J, ZHANG J, ZHANG Y, et al. Effect and correlation of rosa roxburghii tratt fruit vinegar on obesity, dyslipidemia and intestinal microbiota disorder in high-fat diet mice[J]. Foods,2022,11(24):4108. doi: 10.3390/foods11244108
[28] 王伯韬. 青春双歧杆菌对高脂饮食引发肥胖症的缓解作用与机制研究[D]. 无锡:江南大学, 2021. [WANG B T. Study on the alleviating effect and mechanism of Bifidobacterium adolescences on obesity induced by high fat diet[D]. Wuxi:Jiangnan University, 2021.] WANG B T. Study on the alleviating effect and mechanism of Bifidobacterium adolescences on obesity induced by high fat diet[D]. Wuxi: Jiangnan University, 2021.
[29] 魏建敏, 杨华连, 陈莉, 等. 基于高通量测序分析果桑茶对2型糖尿病模型小鼠肠道菌群的影响[J]. 食品与发酵工业,2021,47(20):75−82. [WEI J M, YANG H L, CHENG L, et al. The effect of mulberry tea on intestinal flora of type 2 diabetic mice was analyzed based on high-throughput sequencing[J]. Food and Fermentation Industry,2021,47(20):75−82.] WEI J M, YANG H L, CHENG L, et al. The effect of mulberry tea on intestinal flora of type 2 diabetic mice was analyzed based on high-throughput sequencing[J]. Food and Fermentation Industry, 2021, 47(20): 75−82.
[30] 杜莹瑞, 李市场, 陈妍, 等. 乳酸菌发酵中药对高脂血症模型小鼠调脂作用的初步探究[J/OL]. 食品与发酵工业:1−11[2023-03-25]. DOI:10.13995/j.cnki.11-1802/ts.033646. [DU Y R, LI S C, CHEN Y, et al. Preliminary study on the effect of lactic acid bacteria fermentation of traditional Chinese medicine on lipid regulation in hyperlipidemia model mice[J/OL]. Food and Fermentation Industry:1−11[2023-03-25]. DOI:10.13995/j.cnki.11-1802/ts.033646.] DU Y R, LI S C, CHEN Y, et al. Preliminary study on the effect of lactic acid bacteria fermentation of traditional Chinese medicine on lipid regulation in hyperlipidemia model mice[J/OL]. Food and Fermentation Industry: 1−11[2023-03-25]. DOI: 10.13995/j.cnki.11-1802/ts.033646.
[31] 孙兆男, 张卫东, 杨云竣, 等. 益生菌干预对高脂高糖饮食诱导肥胖小鼠肠道菌群及脂代谢影响的研究[J]. 中国微生态学杂志,2017,29(2):142−145. [SUO Z N, ZHANG W D, YANG Y J, et al. Effect of probiotic intervention on intestinal flora and lipid metabolism of obese mice induced by high-fat and high-sugar diet[J]. Chinese Journal of MicroEcology,2017,29(2):142−145.] SUO Z N, ZHANG W D, YANG Y J, et al. Effect of probiotic intervention on intestinal flora and lipid metabolism of obese mice induced by high-fat and high-sugar diet[J]. Chinese Journal of MicroEcology, 2017, 29(2): 142−145.





 下载:
下载:

 下载:
下载:



