Research Progress on Resveratrol Production by Recombinant Engineering Bacteria Fermentation
-
摘要: 白藜芦醇作为非黄酮类多酚有机化合物,具有抗氧化、抗衰老、抗炎、抗癌等功能,在食品、医药、化妆品行业展现出广阔的应用前景。研究人员在微生物中成功设计并构建了高效的异源合成途径,通过结合工程菌株的大规模发酵实现了白藜芦醇的工业化生产。本文基于白藜芦醇生物合成研究中的前沿进展,在生物合成途径、重组工程菌底盘、合成方法优化策略三个方面进行了综述,重点介绍了酵母菌及大肠杆菌两种常用于生产白藜芦醇的重组工程菌并进行了比较,从白藜芦醇合成关键酶表达、前体物质及发酵工艺三个方面提出了关于白藜芦醇生物合成的优化策略。本文总结了现存问题和未来发展方向,以期为白藜芦醇的高效绿色生物制造提供理论支撑和思路借鉴,以满足日益增长的市场需求,推动白藜芦醇在食品产业的工业化应用,并促进未来食品工业领域的高质量、可持续发展。Abstract: Resveratrol, as a non-flavonoid polyphenol organic compound, has antioxidant, anti-aging, anti-inflammatory, anti-cancer and other functions, and has shown broad application prospects in the food, medicine, and cosmetics industries. Researchers have successfully designed and constructed an efficient heterologous synthesis pathway in microorganisms, and realized the industrial production of resveratrol by large-scale fermentation combined with engineered strains. In this paper, based on the frontier progress in the research of resveratrol biosynthesis, the biosynthetic pathway, the chassis of recombinant engineering bacteria, and the optimization strategy of synthesis methods are reviewed. Two recombinant engineering bacteria, yeast and Escherichia coli, commonly used in the production of resveratrol are introduced and compared. And the optimization strategy of resveratrol biosynthesis is proposed from three aspects: the expression of key enzymes, precursors and fermentation processes of resveratrol synthesis. This paper summarizes the existing problems and future development directions, in order to provide theoretical support and reference for the efficient and green biomanufacturing of resveratrol, so as to meet the growing market demand, promote the industrial application of resveratrol in the food industry, and promote the high-quality and sustainable development of the food industry in the future.
-
Keywords:
- resveratrol /
- recombinant engineered bacteria /
- biosynthesis /
- fermentation
-
白藜芦醇(Resveratrol,Res)又称芪三酚,是一类非黄酮类多酚有机化合物[1],作为植物体在逆境或遇到病原侵害时分泌的一种抗毒素广泛存在于100余种植物中[2],包括反式白藜芦醇、顺式白藜芦醇、反式白藜芦醇苷及顺式白藜芦醇苷四种形式[3]。白藜芦醇及其衍生物能显著抑制反式脂肪酸的合成[4−6],具有抗氧化、抗衰老、抗炎、抗癌等功能[7−8],在食品[9]、医药[10]、化妆品[11]领域展现出了极大的潜力与广阔的应用前景。白藜芦醇最早由日本科学家Takaoka[12]从毛叶黎芦根部提取所得,国内研究最早见于中国科学院王燕芳等[13]于爬山虎中成功进行提取并分离。迄今为止,研究人员已从葡萄、虎杖、花生等多种植物中成功提取出了白藜芦醇[14],常用的提取方法包括有机溶剂提取、酶法提取、超声提取、微波提取、超临界CO2萃取等[15]。然而,由于植物体中的白藜芦醇含量过低,远远满足不了工业化生产与应用的需求[16],且白藜芦醇的提取与纯化面临原料、技术、气候和地区等问题的限制,所以迫切需要采用更经济高效的方法合成白藜芦醇。
因顺式白藜芦醇的活性较低且白藜芦醇苷的合成路径较为复杂[17],当前研究多以反式白藜芦醇为目标合成产物。常见合成方法分为化学合成法和生物合成法,其中化学方法包括Witting法、Grignard法、Perkin法以及Heck法[18]。相对于化学合成反应复杂、耗能高、产量纯度低且易造成污染等问题,生物合成具有成本低、效率高、产品纯度高等优点[19],因而更适用于工业化生产。目前利用生物合成白藜芦醇的方法主要包括组织培养[20]、细胞培养[21]、毛状根诱导培养[22]、转基因植物培养[23]等植物合成方法,及微生物转化[24]和工程菌发酵[25]等微生物合成法。其中植物合成方法旨在利用植物细胞或组织在特定条件下进行培养或转化,具有易受微生物污染、细胞分化能力有限等的局限性,同时利用转基因技术进行基因表达还存在生态安全和伦理问题[26],因而在药物合成领域应用较为有限。
随着生物合成领域的发展,利用合成生物学技术对天然或人工生物元器件进行设计组合,获得重构或非天然的新生命系统的相关研究已经取得了极大进展。基于微生物合成法生产周期短、成本低、产物提纯简便和环境污染小等优势[27],研究人员已经在微生物中成功设计并构建了异源合成途径,通过结合工程菌株的大规模发酵,成功实现了白藜芦醇等植物源功能活性物质的高效合成,展现出了广泛的应用前景。近年来,研究者们通过在不同底盘中构建人工合成途径、利用基因编辑技术并优化代谢网络的方法,不断提高了白藜芦醇的合成效率和产量。本文基于白藜芦醇生物合成研究中的前沿进展,在生物合成途径、重组工程菌底盘、合成方法优化策略等三个方面进行了综述,并总结了现存问题和未来发展方向,以期为白藜芦醇的高效绿色生物制造提供理论支撑和思路借鉴。
1. 白藜芦醇生物合成途径
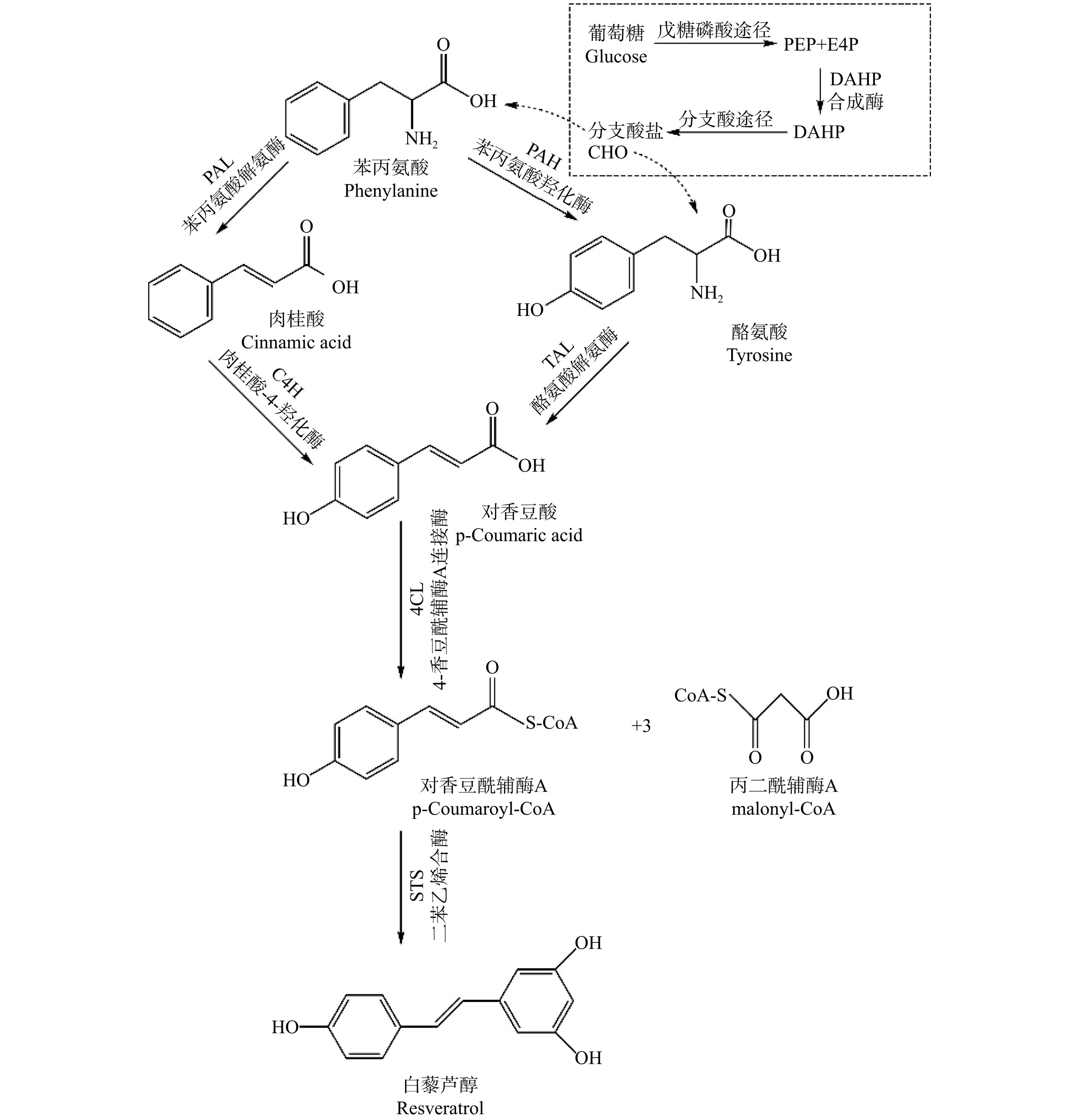
植物中白藜芦醇的生物合成主要通过苯丙烷途径的一个分支进行。如图1所示,白藜芦醇的合成通常始于苯丙氨酸,经苯丙氨酸解氨酶(Phenylalanine ammonia-lyase,PAL)和肉桂酸-4-羟化酶(Cinnamate-4-hydroxylase,C4H)催化生成对香豆酸,而后在4-香豆酰辅酶A连接酶(4-Coumarate: coenzyme A ligase,4CL)的作用下转化为对香豆酰辅酶A。另一种方法通常以酪氨酸为底物,通过酪氨酸解氨酶(Tyrosine ammonia-lyase,TAL)催化生成对香豆酸再进行转化。同时,酪氨酸也可由苯丙氨酸经苯丙氨酸羟化酶(Phenylalanine hydroxylase,PAH)催化生成。最后,二苯乙烯合酶(Stilbene synthase,STS)作为白藜芦醇合成关键酶,催化1分子对香豆酰辅酶A与3分子丙二酰辅酶A芪合生成白藜芦醇[28]。
随着关于白藜芦醇从头合成研究的日益增多,研究的重点转向如何调控碳通量,实现以低成本的葡萄糖、乙醇或甘油等作为碳源高效合成白藜芦醇。葡萄糖经戊糖磷酸途径生成赤藓糖-4-磷酸(Erythrose 4-phosphate,E4P)和磷酸烯醇式丙酮酸(Phosphoenolpyruvate,PEP),而后在DAHP合成酶的作用下生成3-脱氧-D-阿拉伯庚酮糖酸-7-磷酸(3-Deoxy-D-arabinoheptulosonate 7-phosphate,DAHP),经过分支酸途径形成分支酸盐(Chorismate,CHO)[25]。而CHO是苯丙氨酸和酪氨酸的主要前体,因此,提升E4P和PEP的供应和可用性是提高分支酸产量的主要方法,也是实现高效从头合成白藜芦醇的重要措施。
在白藜芦醇人工合成途径中,除了代谢途径的构建,工程菌底盘、前体物质及发酵工艺条件都扮演着至关重要的角色。工程菌底盘作为基因工程的载体,能够稳定地携带并表达外源基因,其具有复杂的代谢网络,通过基因工程手段可以调控这些代谢途径,以实现产物的合成[29]。工程菌底盘的选择直接决定了生物合成白藜芦醇的效率和产量,通过提供更优的代谢环境和表达效率,能显著提升白藜芦醇产量。前体物质则作为白藜芦醇生物合成过程中的直接原料,通过一系列酶促反应转化为白藜芦醇。由于C4H属于P450酶系,使得在大肠杆菌等原核生物中实现其异源表达变得尤为困难,因此,研究者更多地聚焦于以酪氨酸或对香豆酸作为前体物质,通过生物转化进而合成白藜芦醇[30]。发酵工艺条件例如温度、pH、溶氧量等直接影响工程菌的代谢活性,作为生物合成白藜芦醇过程中的关键环节,合理的工艺条件能够确保工程菌在最佳状态下生长和代谢,从而提高白藜芦醇的产量。通过优化这些条件可以显著提高白藜芦醇生物合成的效率及产量,为工业化生产提供有力支持。
2. 白藜芦醇生物合成重组工程菌底盘
重组工程菌底盘指的是经过遗传改造和优化,能够作为生物反应器或“细胞工厂”的微生物,作为合成生物学领域中的核心工具其重要性不言而喻。通过基因编辑和代谢工程等手段能在重组工程菌底盘中定向优化代谢途径,从而灵活地生产多种不同化合物[31],在生物合成白藜芦醇的过程中,不同的底盘菌株最终所获得的产量也不尽相同。
2.1 重组酵母菌
酿酒酵母作为极具大规模生产潜力的菌种,由于其安全性被广泛用于食品与制药行业[32]。作为真核生物,酿酒酵母能够成功表达来源于植物的C4H基因并展现出相应的功能[33],因此与其他宿主物种相比,酿酒酵母成为了白藜芦醇生产的优选宿主。但在目前的研究中,以重组酵母菌作为底盘菌株发酵所得白藜芦醇的产量仍处于较低水平,需要进一步优化改造。在以酿酒酵母为底盘菌株进行发酵时,Becker等[34]首次重建了微生物产白藜芦醇的生化途径,成功表达了杂交杨树4CL基因和葡萄STS基因,并引入对香豆酸为前体物质,获得了1.5 μg/L白藜芦醇滴度。孙萍等[35]选用了合成路径中的成本更低的酪氨酸作为前端底物,将粘红酵母TAL基因、拟南芥4CL基因和葡萄STS基因在酿酒酵母中进行表达,白藜芦醇滴度达到了6.20 mg/L。此前他们也曾将拟南芥4CL基因和葡萄STS基因共同转化至酿酒酵母工业菌株中,以对香豆酸为底物获得了0.78 mg/L白藜芦醇[36]。此外也有学者利用蔗糖发酵工业酵母进行了发酵尝试,Sydor等[37]将拟南芥4CL基因和葡萄STS基因引入巴西蔗糖发酵工业酵母菌株中,并在含有丰富营养物质的天然培养基中进行培养,白藜芦醇产量达到391 mg/L,实现了当时酵母菌合成白藜芦醇产量上的一个突破。近年来,Li等[38]通过酪氨酸为中间体在酿酒酵母中实现了从头合成白藜芦醇,以葡萄糖或乙醇为碳源分批补料发酵,白藜芦醇滴度分别为415.65 mg/L和531.41 mg/L,首次实现了从葡萄糖等简单碳源中从头合成白藜芦醇的突破,显著降低了其生产成本。
另一种酵母——解脂耶氏菌,由于其具备耐受低pH和高渗透压的工业特性,且拥有较为完善的基因编辑工具及底物选择的广谱性,因此被广泛应用于食品工业生产领域[39]。Palmer等[40]在解脂耶氏酵母上整合了烟草4CL基因和花生STS基因,并添加对香豆酸为底物,进行发酵过程优化后,获得了48.7 mg/L白藜芦醇滴度。He等[41]进一步对代谢途径进行了优化,将多个基因引入解脂耶氏酵母,通过结合酪氨酸和苯丙氨酸两种途径,在最佳发酵条件下,以甘油为唯一碳源,获得了0.43 g/L白藜芦醇,证明了解脂耶氏酵母通过莽草酸途径进行发酵生产的能力。Sáez-Sáez等[42]试图通过代谢工程提高解脂耶氏酵母的白藜芦醇滴度,通过葡萄糖分批加料得到了12.7 g/L的白藜芦醇。近年来,江南大学Liu等[43]在前期预筛选的基础上,表达了约氏黄杆菌TAL基因、欧芹4CL基因和葡萄STS基因的组合,并通过改造莽草酸途径,将糖酵解通量转向E4P,提高了对香豆酸的供给,在采用优化的分批补料策略后,白藜芦醇产量达到22.5 g/L,葡萄糖得率为65.5 mg/g,显著提升了葡萄糖从头合成白藜芦醇的产量。解脂耶氏酵母凭借其独特优势成为了生物合成白藜芦醇领域的重点研究底盘菌株之一,研究人员以其作为底盘菌株,显著提高了白藜芦醇的生产能力,实现了白藜芦醇的高效绿色生物合成,为工业化生产提供了重要依据。
2.2 重组大肠杆菌
大肠杆菌作为使用广泛的工程菌株具有遗传背景简单、基因操作容易、培养周期短、生长速度快等显著优势[44]。此外,酪氨酸和对香豆酸作为白藜芦醇的关键前体,对于提升产量至关重要,而在大肠杆菌中,这些前体物质可以通过代谢工程更有效地进行评估与利用,同时出于其对于对香豆酸的高耐受性,大肠杆菌成为了常用的生物合成宿主。Katsuyama等[45]在培养基中添加酪氨酸为前体物质,以大肠杆菌为载体成功表达了深红酵母PAL基因、紫草4CL基因和花生STS基因,最终白藜芦醇产量为37 mg/L。程皓[46]在大肠杆菌中成功表达拟南芥4CL基因和葡萄的STS基因后,以对香豆酸作为底物,白藜芦醇产量达到80.8 mg/L。此外,Lim等[47]将拟南芥4CL基因和葡萄STS基因引入大肠杆菌中进行表达,并添加对香豆酸前体,在经过表达路径的优化后,获得了2340 mg/L的白藜芦醇,体现了大肠杆菌高效生产白藜芦醇的巨大潜力。但事实上,作为原核生物,在大肠杆菌中表达TAL及PAL等真核酶活性仍较低且专一性差,限制了重组大肠杆菌中白藜芦醇的高产[30]。
近年来,利用重组大肠杆菌进行白藜芦醇的从头合成也获得了较为显著的成果。汪建峰等[48]在大肠杆菌中将烟草4CL基因和酿酒葡萄STS基因进行融合表达,并利用内源酪氨酸合成对香豆酸前体,经启动子工程改造、高拷贝融合表达等优化后,白藜芦醇产量最终达到了25.76 mg/L,其对于白藜芦醇从头合成工程菌构建取得的重要突破为实现白藜芦醇的工业化大规模生产奠定了坚实的基础。而后朱屹东[49]利用深红酵母TAL基因、欧芹4CL基因和葡萄STS基因在大肠杆菌中分别构建表达载体,以葡萄糖为底物发酵并进行优化后获得了71.6 mg/L白藜芦醇。刘向磊[50]通过基因定点整合的方式对相关基因进行过表达,所构建的重组菌株可合成4.61 mg/L的白藜芦醇,首次构建了真正意义上可利用葡萄糖从头合成白藜芦醇的重组大肠杆菌,通过质粒强化白藜芦醇合成的外源基因后使得白藜芦醇产量增加到13.70 mg/L。
2.3 其它底盘
不同种类的工程菌因其独特的生物学特性而表现出各异的优势与局限性,这些特性直接影响了它们在白藜芦醇发酵生产中的应用。除了酵母菌与大肠杆菌这两种在发酵工业中应用广泛的工程菌外,委内瑞拉链霉菌、谷氨酸棒状杆菌等工程菌也在白藜芦醇的发酵过程中发挥着不可忽视的作用。
另一种可用于白藜芦醇生物合成的菌株为委内瑞拉链霉菌。这种革兰氏阳性菌具有产生多种次级代谢产物的能力,经过改造后可以用于合成植物特有的黄酮和芪类化合物包括白藜芦醇。Park等[51]首次报道了在委内瑞拉链霉菌中异源表达苯丙烷类基因4CL和STS合成白藜芦醇,最终获得了0.4 mg/L的滴度,证明了委内瑞拉链霉菌用于生物合成白藜芦醇的可能性。
工程化的谷氨酸棒状杆菌也被用于发酵生产白藜芦醇,其具有生物安全、底物谱广泛、营养需求低、基因组编辑技术丰富等优点,适用于作为生物合成的底盘[52]。Kallscheuer等[53]将欧芹的4CL基因和花生STS基因引入到谷氨酸棒状杆菌中用于白藜芦醇的合成,以对香豆酸为前体,获得了158 mg/L的白藜芦醇。此后他们也尝试以4-羟基苯甲酸为底物,在谷氨酸棒状杆菌中经过四步转化后,生成了对香豆酰辅酶A,在STS的催化作用下成功生产了5 mg/L的白藜芦醇,这也是首次以芳香族氨基酸以外的4-羟基苯甲酸为底物合成苯丙素[54]。此外,Milke等[55]也构建了重组谷氨酸棒杆菌菌株,通过调控宿主菌株的中心碳代谢将白藜芦醇的产量提高到112 mg/L,证明了谷氨酸棒状杆菌在生产白藜芦醇方面的潜力。
2.4 不同底盘比较
由于用于发酵的底盘菌株、基因来源、表达强度及发酵工艺等的不同,众多研究人员利用重组工程菌发酵合成白藜芦醇所得的最终滴度也各不相同,具体结果如表1所示。Beekwilder等[56]克隆了烟草的4CL基因和葡萄的STS基因,分别在酿酒酵母及大肠杆菌中进行表达,以探究不同底盘菌株对白藜芦醇产量的影响,结果表明,以5 mmol/L对香豆酸为底物,并添加异丙基-β-D-硫代半乳糖苷(Isopropyl β-D-thiogalactoside,IPTG)后,获得的白藜芦醇的最终滴度分别为5.8 mg/L和16 mg/L。诸多研究表明,在克隆相同基因时,利用重组大肠杆菌发酵获得的白藜芦醇产量会比酿酒酵母高2倍左右,但造成该结果的原因尚不明确[29]。此外,各重组工程菌获得的白藜芦醇最高滴度也表现出巨大差异,酿酒酵母发酵获得的白藜芦醇最高滴度为812 mg/L[57],以大肠杆菌为底盘发酵最高获得了2340 mg/L[47]的滴度,而谷氨酸棒状杆菌发酵的最高产量为158 mg/L[53],相对而言,解脂耶氏酵母在白藜芦醇的生产中展现出显著优势,达到了22.5 g/L[43]的最高产量。
表 1 重组工程菌合成白藜芦醇Table 1. Resveratrol production by recombinant engineering bacteria fermentation宿主菌株 优势 引入基因及来源 添加底物 产量 参考文献 酿酒酵母 食品级安全;
遗传背景清晰;
蛋白翻译后修饰功能;
乙醇耐受性。4CL(杨树)
STS(葡萄)对香豆酸 1.5 μg/L [34] TAL(粘红酵母)
4CL(拟南芥)
STS(巨峰葡萄)酪氨酸 6.20 mg/L [35] 4CL(拟南芥)
STS(巨峰葡萄)对香豆酸 0.78 mg/L [36] 4CL(拟南芥)
STS(葡萄)对香豆酸 391 mg/L [37] TAL(橙色滑柱菌)
4CL(拟南芥)
STS(葡萄)葡萄糖 415.65 mg/L [38] 乙醇 531.41 mg/L 4CL(烟草)
STS(葡萄)对香豆酸 5.8 mg/L [56] PAL(拟南芥)
C4H(拟南芥)
4CL(拟南芥)
STS(葡萄)葡萄糖 812 mg/L [57] 葡萄糖+乙醇 755 mg/L PAL(拟南芥)
C4H、4CL(拟南芥)
STS(葡萄)木质纤维素 155.49 mg/L [58] PAL(圆红酵母)
C4H、4CL(拟南芥)
STS(花生)苯丙氨酸 0.94 mg/L [59] TAL(粘红酵母)
4CL(拟南芥)
STS(花生)酪氨酸 4.72 mg/L 解脂耶氏酵母 耐受低pH和高渗透压;
基因编辑工具完善;
底物选择的广谱性;
天然高产油脂及脂肪酸。4CL(烟草)
STS(花生)对香豆酸 48.7 mg/L [40] TAL(约氏黄杆菌)
4CL(拟南芥)
STS(葡萄)葡萄糖 12.7 g/L [42] TAL(约氏黄杆菌)
4CL(欧芹)
STS(葡萄)葡萄糖 22.5 g/L [43] 大肠杆菌 遗传背景简单;
基因操作容易;
培养周期短;
生长速度快。PAL(深红酵母)
4CL(紫草)
STS(花生)酪氨酸 37 mg/L [45] 4CL(拟南芥)
STS(葡萄)对香豆酸 80.8 mg/L [46] 4CL(拟南芥)
STS(葡萄)对香豆酸 2340 mg/L [47] TAL(类球红细菌)
4CL(烟草)
STS(葡萄)酪氨酸 25.76 mg/L [48] TAL(深红酵母)
4CL(欧芹)
STS(葡萄)葡萄糖 71.6 mg/L [49] TAL(黏红酵母)
4CL(荷兰芹)
STS(葡萄)葡萄糖 13.70 mg/L [50] 4CL(烟草)
STS(葡萄)对香豆酸 16 mg/L [56] 4CL(拟南芥)
STS(花生)对香豆酸 104.5 mg/L [60] 4CL(拟南芥)
STS(花生)对香豆酸 80.524 mg/L [61] TAL(西班牙糖丝菌)
4CL(拟南芥)
STS(花生)酪氨酸 114.2 mg/L [62] 4CL(欧芹)
STS(葡萄)对香豆酸 268.2 mg/L [63] TAL(粘红酵母)
4CL(欧芹)
STS(葡萄)葡萄糖 4.612 mg/L [64] TAL(黄孢原毛平革菌)
4CL(拟南芥)
STS(葡萄)葡萄糖 204.8 mg/L [65] TAL(皮状丝孢酵母菌)
4CL(欧芹)
STS(葡萄)葡萄糖 304.5 mg/L [66] TAL(粘红酵母)
4CL(天蓝色链霉菌)
STS(葡萄)甘油 22.58 mg/L [67] 4CL(拟南芥)
STS(葡萄)对香豆酸 202.92 mg/L [68] TAL(黄孢原毛平革菌)
4CL(拟南芥)
STS(葡萄)酪氨酸 238.71 mg/L 甘油 332.24 mg/L 谷氨酸棒状杆菌 生物安全;
底物谱广泛;
营养需求低;
基因组编辑技术丰富。4CL(欧芹)
STS(花生)对香豆酸 158 mg/L [53] TAL(约氏黄杆菌)
4CL(欧芹)
STS(花生)葡萄糖 59 mg/L [69] 总之,采用多样化的底盘菌株进行白藜芦醇的生物合成已成为重要趋势,每种底盘菌株通过各自的代谢途径和酶系统,能够高效地将底物转化为白藜芦醇,丰富了发酵生产的多样性和灵活性。鉴于合成生物学技术的日新月异,利用微生物作为生产白藜芦醇的生物工厂,其工业化生产的可行性正日益增强,有望在未来实现规模化、高效化的生产模式,从而满足市场对于白藜芦醇日益增长的需求。
3. 白藜芦醇生物合成优化策略
随着关于生物合成白藜芦醇研究的日益深入,研究人员提出了一系列优化策略,旨在通过促进白藜芦醇合成关键酶表达、前体物质优化及发酵工艺改进等手段,提升白藜芦醇产量与效率,从而满足日益增长的市场需求。
3.1 白藜芦醇合成关键酶表达优化
基于外源基因具有特定的密码子偏好性,按照偏好性进行密码子的重新设计,并优化启动子、终止子、核糖体结合位点等关键元件是重组工程菌中实现基因高效表达的重要策略。这一策略旨在提高基因转录和翻译的效率,从而增强工程菌的性能和应用价值。赵燕磊[70]结合解脂耶氏酵母对密码子的偏好性,将优化后的拟南芥4CL基因和葡萄STS基因进行全基因合成,使其在解脂耶氏酵母中实现了高效表达。此外,在以往的研究中,尽管类球红细菌的TAL基因已成功在酿酒酵母中进行翻译,但并未展现出相应功能,因此Wang等[71]针对酿酒酵母的密码子偏好性突变并重新合成了TAL基因序列,显著增加了酪氨酸解氨酶的翻译量,促进了对香豆酸和白藜芦醇的生物合成。
同时,在重组工程菌发酵中选择不同来源基因进行组合对于提高白藜芦醇的合成效率与产量也至关重要,这种组合不仅丰富了基因库,也为白藜芦醇的生物合成提供了多样化的可能。Lim等[47]选取了拟南芥4CL基因和马尾松STS基因进行组合后在大肠杆菌BL21Star中进行表达时并未有白藜芦醇产生,而在相同条件下选取欧芹4CL基因和花生STS基因进行组合则产生了33.0 mg/L白藜芦醇。随后他们将拟南芥4CL基因和花生STS基因转入大肠杆菌BW27784中进行表达,获得了404 mg/L的白藜芦醇,在相同条件下将基因来源替换为欧芹4CL基因和葡萄STS基因,获得了1380 mg/L的白藜芦醇。通过深入研究不同基因的功能与特性,可以更精准地调控生物合成过程,从而实现白藜芦醇的高效合成。
此外还需促进基因过表达,以避免基因表达水平低造成酶活下降进而导致白藜芦醇产量的降低。近年来,Cotner等[72]通过引入一种新的概率计算模型将STS确定为限制酶,在进行过表达STS基因,动态调控STS酶含量并添加足量前体物质后,将白藜芦醇的最终滴度从62.5 mg/L提高到172.8 mg/L,证明了过表达基因产生充足酶量对催化效率的正向影响,从而有助于提升白藜芦醇产率。与之相印证,Li 等[57]采用了高产苯丙氨酸的酵母底盘菌株,在其中过表达PAL、C4H,4CL和STS基因,实现了白藜芦醇从葡萄糖的高效合成。
构建融合表达蛋白并优化蛋白配比也是生物合成白藜芦醇过程中的关键步骤,通过将多个具有特定功能的蛋白域融合在一起,可以创建出具有更高催化效率、更强结构稳定性和更好底物特异性的融合蛋白。这样的融合蛋白支架不仅可以为生物合成白藜芦醇提供更优越的反应条件,还能够增强反应过程的可控性和重复性。例如张二浩[61]首次构建了拟南芥4CL基因和花生STS基因融合表达体系,在原核表达载体pET-30a/4CL::RS上诱导表达出目的融合蛋白的双功能酶,重组菌发酵得到的白藜芦醇产量达到了80.524 mg/L,证明了融合表达蛋白合成白藜芦醇的可行性。
通过优化蛋白配比,可以确保各个蛋白在反应体系中发挥最佳作用,从而提高白藜芦醇的产量。同时,也可以提高底物的利用率,通过提升添加底物的转化率,进一步降低白藜芦醇生产成本。Wang等[73]在酿酒酵母中成功构建了蛋白支架,通过调控4CL和STS两个蛋白的表达量之比来优化白藜芦醇的合成。结果表明,当蛋白支架中4CL和STS的拷贝数比例为2:4时,白藜芦醇最终滴度可以提高5倍,达到14.4 mg/L。
3.2 白藜芦醇合成前体物质优化
在重组工程菌发酵生产白藜芦醇的过程中,对香豆酸及丙二酰辅酶A等前体物质对白藜芦醇的合成至关重要,通过增加前体物质可供发酵利用的量,可以确保微生物在合成目标产物时有足够的原料供应,从而提高白藜芦醇的合成速率及产量。
3.2.1 丙二酰辅酶A
作为微生物合成脂肪酸的中间代谢物,一般情况下,丙二酰辅酶A在微生物细胞内含量极低,其作为白藜芦醇的重要前体物质,在STS芪合酶的作用下以3:1的比例提供碳原子形成苯环并与对香豆酰辅酶A结合后生成白藜芦醇。与此同时,丙二酰辅酶A主要被用作脂肪酸生物合成的必需中间体,以支持细胞生长[74],因此只有有限水平的丙二酰辅酶A用于白藜芦醇的生物合成,这是白藜芦醇生产的主要挑战。基于此,为扩大微生物胞内丙二酰辅酶A库,需增强丙二酰辅酶A的合成能力并减少其降解,同时,通过抑制其竞争性消耗途径,使其更多地用于白藜芦醇的生物合成。
对于提升丙二酰辅酶A含量的问题,Yang等[63]发现阻断丙二酰辅酶A的消耗和fab基因的缺失在微生物中具有致死性。因此,可以通过添加浅蓝菌素来抑制脂肪酸的合成,从而提高胞内丙二酰辅酶A含量,使碳通量更多地流向与对香豆酰辅酶A的芪合反应。Lim等[47]在发酵培养含有拟南芥4CL基因和葡萄STS基因的大肠杆菌时,通过添加浅蓝菌素抑制脂肪酸的合成途径,为丙二酰辅酶A含量提升提供了可行方案,白藜芦醇最终滴度可增长至2.3 g/L,相较未添加的对照组产量提高了约1倍。Kallscheuer等[53]在谷氨酸棒状杆菌中整合了欧芹4CL基因和花生STS基因,以对香豆酸作为底物获得的白藜芦醇滴度为12 mg/L,添加浅蓝菌素后提升至158 mg/L,证明了运用浅蓝菌素提升丙二酰辅酶A含量从而提升白藜芦醇产量的可行性。但实际应用中,由于浅蓝菌素价格昂贵,且浓度高时会抑制细胞生长,大规模应用受限。因此也有学者采用其它策略,如利用反义RNA抑制编码丙二酰辅酶A酰基载体蛋白转酰基酶的基因(fabD)及编码β-酮脂酰-ACP合成酶Ⅰ/Ⅱ/Ⅲ蛋白的基因(fabB/F/H),通过CRISPRi系统抑制fab基因,下调脂肪酸生物合成的表达,将碳通量导向丙二酰辅酶A等[75]。例如Wu等[66]通过下调fab操纵子的5个基因(fabD、fabH、fabB、fabF、fabI)的表达,提升了丙二酰辅酶A含量,使白藜芦醇产量最高提升了216.5%。
另外,还可以改变内源性丙二酰辅酶A途径流的化学计量学建模,通过增加丙二酰辅酶A库,提高白藜芦醇的产量,例如过表达乙酰辅酶A羧化酶基因(acetyl-CoA carboxylase,ACC)、乙酰辅酶A合成酶基因(acetyl-CoA synthetase,ACS),通过乙酰辅酶A羧化作用,增加羧化生成丙二酰辅酶A的量,扩大细胞质丙二酰辅酶A库[76]。Katsuyama等[45]在大肠杆菌中通过对谷氨酸棒状杆菌的ACC基因进行过表达,增加丙二酰辅酶A库,最终获得了171 mg/L的白藜芦醇滴度。同时,删除编码竞争途径的基因,如参与乙酰辅酶A降解为乙酸的磷酸转乙酰化酶基因(phosphotransacetylase,pta)和乙酸激酶基因(acetate kinase,ackA),以及参与乙醇生产的乙醇脱氢酶基因(alcohol dehydrogenase,adhE),也有助于增加细胞质丙二酰辅酶A库[77]。例如Zha等[78]在研究中通过敲除ackA、pta、adhE基因,过表达ACC、ACS、fabF基因,使大肠杆菌细胞内的丙二酰辅酶A含量提高了15倍。
此外,编码丙二酸辅酶A合成酶(malonyl‐CoA synthetase,matB)和丙二酸载体蛋白(malonate carrier protein,matC)的基因过表达也会增加丙二酰辅酶A库。Shrestha等[76]采用了一种模块化的工程方法,通过在大肠杆菌中过表达天蓝色链霉菌来源的丙二酸同化途径基因matB和matC,成功增加了丙二酰辅酶A库,合成了151 mg/L白藜芦醇及大量羟基化衍生物白皮杉醇。
3.2.2 苯丙氨酸及酪氨酸
苯基丙氨酸的生物合成始于从葡萄糖中通过莽草酸或芳香酸途径获得的苯丙氨酸或酪氨酸,作为白藜芦醇发酵生产所必需的前体物质,通过代谢工程引导碳通量增加其合成,对提升白藜芦醇的产量具有重要意义。
在苯丙氨酸及酪氨酸的合成过程中,DAHP合成酶作为关键酶,其三种亚型通过反馈抑制变构机制相互调节,有助于浓缩PEP和E4P生成DAHP,而后在6种酶的帮助下,DAHP被转化为CHO,CHO即苯丙氨酸和酪氨酸的主要前体。莽草酸途径的代谢工程主要调控的是进入分支酸的碳通量,其次是苯丙氨酸和酪氨酸[79]。在大多数细菌中,这些氨基酸是生物合成途径的最终产物,但在植物和一些细菌中,这些氨基酸是作为中间产物形成的,以合成次生代谢物[80]。因此增加莽草酸途径生物合成通量的常用策略是消除酶反馈抑制和调节转录[25]。为了提高微生物中芳香族氨基酸及衍生苯丙酸的产量,研究人员已经开发了重要的策略。例如,Juminaga等[81]报道了通过编码将E4P和PEP转化为酪氨酸的关键酶来生物合成白藜芦醇,显著提高了酪氨酸的产量,达到理论产量的80%。
由于常用的前体物质对香豆酸及酪氨酸价格较为昂贵,进行工业化生产成本较高,以低成本材料,如葡萄糖、乙醇或甘油等为前体高效合成白藜芦醇的研究日渐增多。通过将整个生物合成途径引入微生物细胞,成功实现了白藜芦醇的从头生物合成及生物转化。以葡萄糖生成白藜芦醇的主要瓶颈为苯丙氨酸的生成,在目前的研究中,通过引入高活性的氨裂解酶,如PAL或TAL能将芳香族氨基酸高效地转化为苯丙氨酸,例如Liu等[64]将TAL、4CL和STS基因导入大肠杆菌菌株,从葡萄糖中获得了4.612 mg/L的白藜芦醇;Wu等[66]也成功应用多种代谢工程手段在大肠杆菌中利用葡萄糖合成白藜芦醇,推动了重组工程菌发酵生产白藜芦醇低成本底物的应用。然而,TAL和PAL酶活性低仍然是将整个从头合成途径引入微生物需要解决的问题。
3.3 发酵工艺优化
在重组工程菌发酵生产白藜芦醇的过程中,进行发酵工艺优化的重要性不容忽视。通过优化发酵条件、保持代谢途径平衡、采用分批补料及两段式发酵工艺,可以提高白藜芦醇产量与产率、降低生产成本并提高产品质量和稳定性,为白藜芦醇的工业化生产提供有力支撑。
首先,通过调整发酵过程中的温度、pH、搅拌速度、通气量等参数,可以提供更有利于重组工程菌生长和代谢的环境,从而提高菌体的生长速度和代谢效率,最终增加白藜芦醇的产量与产率。Afonso等[82]克隆了拟南芥4CL基因和花生STS基因在大肠杆菌中进行过表达,探究了最适发酵培养的pH、温度、溶氧量、搅拌速度以及添加的底物浓度,进行优化后最终合成了160 mg/L白藜芦醇。培养基中的营养成分在一定条件下也影响着白藜芦醇的最终滴度。Sydor等[37]将原本用于工业酵母菌发酵生产白藜芦醇的SD培养基优化为YEPD培养基后,显著提升了白藜芦醇产量。林雅楠等[83]通过单因素实验优化了重组大肠杆菌发酵生产白藜芦醇的培养条件,将重组细菌在含有1.2 g/L对香豆酸和聚乙二醇的YM9培养基中进行重悬培养,在优化条件下培养24 h后白藜芦醇的产量达到598 mg/L。
其次,维持代谢途径的平衡有利于实现代谢通量的提升,确保生物合成过程中各步骤的协调与高效运行,从而实现最终目标产物的高效率合成。鉴于白藜芦醇固有的抗菌特性,它在细胞内的过度积累会对细胞整体代谢产生不利影响,因此及时将白藜芦醇排出胞外,不仅有助于缓解其对细胞活性的抑制作用,确保细胞的正常生长与代谢,同时,移除产物也有助于推动白藜芦醇的合成反应不断地向产物合成方向进行,进而实现产量的提升[68]。Wang等[71]在含有拟南芥4CL基因和葡萄STS基因的酿酒酵母中过表达低亲和性阿拉伯糖转运蛋白AraE,将白藜芦醇及时进行转运,以对香豆酸作为底物,使得白藜芦醇产量提升了1.4倍。
同时,分批补料也是提高白藜芦醇产量的重要培养策略。Katz等[84]通过质粒和基因整合等方式对多个基因进行过表达构建了菌株FS09322,以葡萄糖为碳源进行分批补料发酵,其白藜芦醇产量最高可接近5 g/L。而Li等[57]将拟南芥PAL、C4H、4CL基因和葡萄STS基因成功导入酿酒酵母中,并在可控生物反应器中添加葡萄糖为底物,在无机物培养基上进行分批补料发酵,在葡萄糖耗尽后分别添加葡萄糖或乙醇进行补料,结果表明,两者分别产生了812 mg/L和755 mg/L的白藜芦醇。
此外,两段式发酵工艺作为重组工程菌合成白藜芦醇的常用策略,其主要目标是前期快速获取高密度菌体,随后通过特定条件诱导目标产物的合成。在发酵培养过程中,当菌体生长达到一定密度时,添加前体对香豆酸和诱导剂异丙基-β-D-硫代半乳糖苷,以启动白藜芦醇的生物合成过程[45]。当处理植物源的外源基因时,前期通常需要采取较高温度来促进菌体的快速生长。随后,为了优化外源基因的表达,需要将温度适当降低,以实现外源基因的可溶性表达,并在此条件下进行转化,以提高产物的产量[85]。
3.4 共培养策略
在代谢工程领域,为合成高价值的天然代谢物,通常需要对大肠杆菌、酿酒酵母等微生物进行长代谢途径的功能重构。一方面,由于合成白藜芦醇所需真核酶结构的复杂性和细菌表达系统的局限性,实现其高效表达一直是个巨大的挑战[86]。另一方面,设计酵母菌来高效合成白藜芦醇面临协调代谢通路,从而精确调控其代谢流向特定产物的问题,需要更深入的代谢工程技术和精细的遗传操作[87]。同时,部分通路需要专门的环境或隔间来实现最佳功能,因此为了提供不同宿主发酵最佳环境,减轻单个宿主的代谢负担,研究人员采用细胞联合体策略,将人工微生物群落分工,将整个通路作为一个完整的模块划分并引入每个重组菌株[88],利用全生物合成实行共培养策略并进行模块化设计,优化反应过程,提高白藜芦醇产率。Yuan等[89]首次构建了从头合成白藜芦醇的大肠杆菌-酿酒酵母联合体体系,通过转录调节上游大肠杆菌模块,过表达TAL基因后将对香豆酸分泌到培养基中,同时将抗失活的ACC基因引入下游酿酒酵母模块,进一步提高对香豆酸向白藜芦醇的转化,两种菌株共同进行发酵,最终以葡萄糖为碳源得到了36 mg/L的白藜芦醇。近年来,Li等[65]利用共培养工程技术,将白藜芦醇生物合成途径分为上下游菌株,上游菌株从葡萄糖合成对香豆酸,下游菌株从对香豆酸生产白藜芦醇,并通过CRISPRi系统增加丙二酰辅酶A的供应,同时微调合成途径基因的表达强度,使白藜芦醇的产量提高了74%。
4. 结论与展望
现阶段,大量研究者选用了大肠杆菌、酿酒酵母、解脂耶氏酵母等多种底盘进行了白藜芦醇生物合成的研究,并从白藜芦醇合成关键酶的表达、前体物质与发酵工艺等多个层面对底盘、底物、催化酶及发酵过程进行了优化,采用对香豆酸、酪氨酸、葡萄糖、甘油等多种前体物质均成功实现了白藜芦醇的异源合成,为白藜芦醇的工业化生产提供了一种可持续、高效且低成本的方案,并与现有的化学合成和植物提取工艺形成有力竞争,极大程度推动了白藜芦醇在食品产业的工业化应用,促进了未来食品工业领域的高质量、可持续发展。
但是,利用重组工程菌进行白藜芦醇的工业化生产还面临着一系列问题:重组工程菌的细胞适应性和代谢稳定性经常受到异源化学物质的影响,这些化学物质在生物合成和长期积累过程中具有极大的细胞毒性。此外,由于缺乏关于代谢网络相互作用和调控的关键基础信息,潜在的生物合成途径尚不明确,需要更加深入剖析这些微生物的复杂代谢网络,并通过精细的基因操作和调控技术,实现对目标代谢途径的优化和改造。
未来,利用重组工程菌发酵生产白藜芦醇可以从以下几个方面展开研究:a.在底盘菌株的改造方面,适应性实验室进化和多功能全基因组CRISPR(MAGIC)系统已被证明能有效探究细胞胁迫的耐受机制并提高其耐受性,最大限度地提高产品的效价和产量,为提高微生物宿主的白藜芦醇生产能力提供了一种有前途的替代策略;b.在底盘菌株的选择方面,机器学习例如边缘感知的点集合并网络已经越来越多地用于蛋白质工程,其可以预测从序列到合成蛋白质过程中的蛋白质功能水平,通过建立概率计算模型,利用代谢物影响生物传感器,从而可量化反应的进行。在未来白藜芦醇的生产中,可用于选择高效合成菌株,从而进行预测并改善生物合成;c.在代谢途径优化方面,为了减轻限速步骤,定向进化等蛋白质工程,已被应用于改善酶的性质以提升酶的催化活性、适应性、稳定性,有待进一步研究以用于白藜芦醇的高效生产;d.此外,在基于微生物平台的白藜芦醇生物合成过程中,进行细胞网络代谢平衡调控,采用组合方法,引导中间代谢物和前体向大量合成白藜芦醇的方向发展,将有望提高工业生产白藜芦醇的生产效率和产量;e.基于绿色高效的生产要求,利用工程化措施提高前体与发酵底物葡萄糖间的碳通量,实现从头合成,尤其是建立光自养平台,利用CO2作为底物合成白藜芦醇具有良好的应用前景。
-
表 1 重组工程菌合成白藜芦醇
Table 1 Resveratrol production by recombinant engineering bacteria fermentation
宿主菌株 优势 引入基因及来源 添加底物 产量 参考文献 酿酒酵母 食品级安全;
遗传背景清晰;
蛋白翻译后修饰功能;
乙醇耐受性。4CL(杨树)
STS(葡萄)对香豆酸 1.5 μg/L [34] TAL(粘红酵母)
4CL(拟南芥)
STS(巨峰葡萄)酪氨酸 6.20 mg/L [35] 4CL(拟南芥)
STS(巨峰葡萄)对香豆酸 0.78 mg/L [36] 4CL(拟南芥)
STS(葡萄)对香豆酸 391 mg/L [37] TAL(橙色滑柱菌)
4CL(拟南芥)
STS(葡萄)葡萄糖 415.65 mg/L [38] 乙醇 531.41 mg/L 4CL(烟草)
STS(葡萄)对香豆酸 5.8 mg/L [56] PAL(拟南芥)
C4H(拟南芥)
4CL(拟南芥)
STS(葡萄)葡萄糖 812 mg/L [57] 葡萄糖+乙醇 755 mg/L PAL(拟南芥)
C4H、4CL(拟南芥)
STS(葡萄)木质纤维素 155.49 mg/L [58] PAL(圆红酵母)
C4H、4CL(拟南芥)
STS(花生)苯丙氨酸 0.94 mg/L [59] TAL(粘红酵母)
4CL(拟南芥)
STS(花生)酪氨酸 4.72 mg/L 解脂耶氏酵母 耐受低pH和高渗透压;
基因编辑工具完善;
底物选择的广谱性;
天然高产油脂及脂肪酸。4CL(烟草)
STS(花生)对香豆酸 48.7 mg/L [40] TAL(约氏黄杆菌)
4CL(拟南芥)
STS(葡萄)葡萄糖 12.7 g/L [42] TAL(约氏黄杆菌)
4CL(欧芹)
STS(葡萄)葡萄糖 22.5 g/L [43] 大肠杆菌 遗传背景简单;
基因操作容易;
培养周期短;
生长速度快。PAL(深红酵母)
4CL(紫草)
STS(花生)酪氨酸 37 mg/L [45] 4CL(拟南芥)
STS(葡萄)对香豆酸 80.8 mg/L [46] 4CL(拟南芥)
STS(葡萄)对香豆酸 2340 mg/L [47] TAL(类球红细菌)
4CL(烟草)
STS(葡萄)酪氨酸 25.76 mg/L [48] TAL(深红酵母)
4CL(欧芹)
STS(葡萄)葡萄糖 71.6 mg/L [49] TAL(黏红酵母)
4CL(荷兰芹)
STS(葡萄)葡萄糖 13.70 mg/L [50] 4CL(烟草)
STS(葡萄)对香豆酸 16 mg/L [56] 4CL(拟南芥)
STS(花生)对香豆酸 104.5 mg/L [60] 4CL(拟南芥)
STS(花生)对香豆酸 80.524 mg/L [61] TAL(西班牙糖丝菌)
4CL(拟南芥)
STS(花生)酪氨酸 114.2 mg/L [62] 4CL(欧芹)
STS(葡萄)对香豆酸 268.2 mg/L [63] TAL(粘红酵母)
4CL(欧芹)
STS(葡萄)葡萄糖 4.612 mg/L [64] TAL(黄孢原毛平革菌)
4CL(拟南芥)
STS(葡萄)葡萄糖 204.8 mg/L [65] TAL(皮状丝孢酵母菌)
4CL(欧芹)
STS(葡萄)葡萄糖 304.5 mg/L [66] TAL(粘红酵母)
4CL(天蓝色链霉菌)
STS(葡萄)甘油 22.58 mg/L [67] 4CL(拟南芥)
STS(葡萄)对香豆酸 202.92 mg/L [68] TAL(黄孢原毛平革菌)
4CL(拟南芥)
STS(葡萄)酪氨酸 238.71 mg/L 甘油 332.24 mg/L 谷氨酸棒状杆菌 生物安全;
底物谱广泛;
营养需求低;
基因组编辑技术丰富。4CL(欧芹)
STS(花生)对香豆酸 158 mg/L [53] TAL(约氏黄杆菌)
4CL(欧芹)
STS(花生)葡萄糖 59 mg/L [69] -
[1] LI T, QU Y, HU X, et al. Green synthesis and structure characterization of resveratrol conjugated linoleate[J]. Food Chemistry,2023,422:136151. doi: 10.1016/j.foodchem.2023.136151
[2] 田艳杰, 石爱民, 刘红芝, 等. 白藜芦醇的生物活性及其运载体系研究进展[J]. 食品科学,2023,44(1):371−379. [TIAN Y J, SHI A M, LIU H Z, et al. Progress in research on biological activities and delivery systems of resveratrol[J]. Food Science,2023,44(1):371−379.] doi: 10.7506/spkx1002-6630-20220308-104 TIAN Y J, SHI A M, LIU H Z, et al. Progress in research on biological activities and delivery systems of resveratrol[J]. Food Science, 2023, 44(1): 371−379. doi: 10.7506/spkx1002-6630-20220308-104
[3] 王新萍, 郭芹, 李甜, 等. 植物中白藜芦醇提取和检测方法研究进展[J]. 食品安全质量检测学报,2020,11(21):7957−7965. [WANG X P, GUO Q, LI T, et al. Research progress on extraction and detection methods of resveratrol in plants[J]. Journal of Food Safety and Quality,2020,11(21):7957−7965.] WANG X P, GUO Q, LI T, et al. Research progress on extraction and detection methods of resveratrol in plants[J]. Journal of Food Safety and Quality, 2020, 11(21): 7957−7965.
[4] GUO Q, LI T, QU Y, et al. New research development on trans fatty acids in food:Biological effects, analytical methods, formation mechanism, and mitigating measures[J]. Progress in Lipid Research,2023,89:101199. doi: 10.1016/j.plipres.2022.101199
[5] LI T, GUO Q, QU Y, et al. Inhibition mechanism of trans-resveratrol on thermally induced trans fatty acids in peanut oil[J]. Food Chemistry,2023,406:134863. doi: 10.1016/j.foodchem.2022.134863
[6] 李甜, 郭芹, 屈阳, 等. 白藜芦醇对花生油热致异构反式脂肪酸的抑制作用[J]. 食品科学,2023,44(18):34−39. [LI T, GUO Q, QU Y, et al. Inhibitory effect of resveratrol on thermally induced trans fatty acids in peanut oil[J]. Food Science,2023,44(18):34−39.] doi: 10.7506/spkx1002-6630-20220826-318 LI T, GUO Q, QU Y, et al. Inhibitory effect of resveratrol on thermally induced trans fatty acids in peanut oil[J]. Food Science, 2023, 44(18): 34−39. doi: 10.7506/spkx1002-6630-20220826-318
[7] LI T, GUO Q, QU Y, et al. Solubility and physicochemical properties of resveratrol in peanut oil[J]. Food Chemistry,2022,368:130687. doi: 10.1016/j.foodchem.2021.130687
[8] 田莹俏, 李甜, 张妤, 等. 天然抗氧化剂对玉米油热致异构体的影响[J]. 食品与发酵工业,2023,50(15):149−154. [TIAN Y Q, LI T, ZHANG Y, et al. Effect of natural antioxidants on thermally-induced trans isomers in corn oil[J]. Food and Fermentation Industries,2023,50(15):149−154.] TIAN Y Q, LI T, ZHANG Y, et al. Effect of natural antioxidants on thermally-induced trans isomers in corn oil[J]. Food and Fermentation Industries, 2023, 50(15): 149−154.
[9] LI Y, LIANG M, LI T, et al. Green process for the preparation of resveratrol-containing high oleic acid peanut oil[J]. Ultrasonics Sonochemistry,2023,100:106604. doi: 10.1016/j.ultsonch.2023.106604
[10] 李延姣, 张徽, 黎俊, 等. 白藜芦醇药理活性及作用机制研究进展[J]. 食品与药品,2021,23(3):284−288. [LI Y J, ZHANG H, LI J, et al. Research progress on pharmacological activity and action mechanism of resveratrol[J]. Food and Drug,2021,23(3):284−288.] doi: 10.3969/j.issn.1672-979X.2021.03.021 LI Y J, ZHANG H, LI J, et al. Research progress on pharmacological activity and action mechanism of resveratrol[J]. Food and Drug, 2021, 23(3): 284−288. doi: 10.3969/j.issn.1672-979X.2021.03.021
[11] 胡小宁. 白藜芦醇脂肪酸酯的合成及凝胶油产品开发[D]. 泰安:山东农业大学, 2022. [HU X N. Synthesis of resveratrol fatty acid esters and development of oleogel products[D]. Taian:Shandong Agricultural University, 2022.] HU X N. Synthesis of resveratrol fatty acid esters and development of oleogel products[D]. Taian: Shandong Agricultural University, 2022.
[12] TAKAOKA M. The synthesis of resveratrol and its derivatives[J]. Proceedings of the Imperial Academy,1940,16(8):405−407. doi: 10.2183/pjab1912.16.405
[13] 王燕芳, 张昌桂, 姚瑞茹, 等. 爬山虎化学成分的研究[J]. 药学学报,1982(6):466−468. [WANG Y F, ZHANG C G, YAO R R, et al. Studies on chemical constituents of Parthenocissus tricuspidate (Sieb. et Zucc. ) planch[J]. Acta Pharmaceutica Sinica,1982(6):466−468.] WANG Y F, ZHANG C G, YAO R R, et al. Studies on chemical constituents of Parthenocissus tricuspidate (Sieb. et Zucc. ) planch[J]. Acta Pharmaceutica Sinica, 1982(6): 466−468.
[14] 王新萍. 花生根中白藜芦醇的提取、纯化及对花生油品质影响的研究[D]. 乌鲁木齐:新疆农业大学, 2021. [WANG X P. Study on extraction, purification and application of resveratrol from peanut root[D]. Urumqi:Xinjiang Agricultural University, 2021.] WANG X P. Study on extraction, purification and application of resveratrol from peanut root[D]. Urumqi: Xinjiang Agricultural University, 2021.
[15] 王新萍, 李甜, 郭芹, 等. 响应面法优化花生根白藜芦醇酶提工艺及不同品种含量分析[J]. 新疆农业大学学报,2020,43(6):405−413. [WANG X P, LI T, GUO Q, et al. Response surface methodology to optimize the enzymatic extraction process of resveratrol from peanut roots and the content analysis of different varieties[J]. Journal of Xinjiang Agricultural University,2020,43(6):405−413.] doi: 10.3969/j.issn.1007-8614.2020.06.003 WANG X P, LI T, GUO Q, et al. Response surface methodology to optimize the enzymatic extraction process of resveratrol from peanut roots and the content analysis of different varieties[J]. Journal of Xinjiang Agricultural University, 2020, 43(6): 405−413. doi: 10.3969/j.issn.1007-8614.2020.06.003
[16] LI Y, WANG H, SHI H, et al. Quantification of resveratrol in peanut oils using stable isotope dilution ultra-high performance liquid chromatography-mass spectrometry[J]. Food Analytical Methods,2023,16(11-12):1673−1679. doi: 10.1007/s12161-023-02534-0
[17] 中国农业科学院农产品加工研究所. 一种同时检测花生中白藜芦醇的四种异构体的方法:中国, 201710543248.6[P]. 2017.12. 15. [Institute of Food Science and Technology CAAS. A method for simultaneous detection of four isomers of resveratrol in peanuts:China, 201710543248.6[P]. 2017.12. 15.] Institute of Food Science and Technology CAAS. A method for simultaneous detection of four isomers of resveratrol in peanuts: China, 201710543248.6[P]. 2017.12. 15.
[18] 张翠亚, 高艳蓉, 朱周静, 等. 白藜芦醇合成研究进展[J]. 化学工程师,2023,37(11):67−74. [ZHANG C Y, GAO Y R, ZHU Z J, et al. Research progress in resveratrol synthesis[J]. Chemical Engineer,2023,37(11):67−74.] ZHANG C Y, GAO Y R, ZHU Z J, et al. Research progress in resveratrol synthesis[J]. Chemical Engineer, 2023, 37(11): 67−74.
[19] 翟逸, 刘钦松, 任晓静. 白藜芦醇的微生物合成研究进展[J]. 现代食品,2017,10(20):9−11. [ZHAI Y, LIU Q S, REN X J. Research progress on microbial synthesis of resveratrol[J]. Modern Food,2017,10(20):9−11.] ZHAI Y, LIU Q S, REN X J. Research progress on microbial synthesis of resveratrol[J]. Modern Food, 2017, 10(20): 9−11.
[20] 胡晶晶. NaCl/MeJA及其联合Ca~(2+)调控花生发芽期间生理代谢及白藜芦醇富集研究[D]. 扬州:扬州大学, 2023. [HU J J. NaCl/MeJA and MeJA-Ca2+ regulate physiological metabolism and resveratrol enrichment during peanut germination[D]. Yangzhou:Yangzhou University, 2023.] HU J J. NaCl/MeJA and MeJA-Ca2+ regulate physiological metabolism and resveratrol enrichment during peanut germination[D]. Yangzhou: Yangzhou University, 2023.
[21] 王晓惠. 葡萄细胞悬浮培养工艺与白藜芦醇的促表达机制研究[D]. 上海:华东理工大学, 2021. [WANG X H. Study on cell suspension culture technology and promotion expression mechanism of resveratrol in grape[D]. Shanghai:East China University of Science and Technology, 2021.] WANG X H. Study on cell suspension culture technology and promotion expression mechanism of resveratrol in grape[D]. Shanghai: East China University of Science and Technology, 2021.
[22] 吴树宽. 桑树转基因毛状根生物合成白藜芦醇的研究[D]. 泰安:山东农业大学, 2021. [WU S K. Resveratrol biosynthesis in transgenic hairy roots of mulberry[D]. Tai'an:Shandong Agricultural University, 2021.] WU S K. Resveratrol biosynthesis in transgenic hairy roots of mulberry[D]. Tai'an: Shandong Agricultural University, 2021.
[23] 郭兆铖. 桑树MbMYB306调控白藜芦醇和类黄酮合成的机制研究[D]. 泰安:山东农业大学, 2023. [GUO Z C. Regulatory mechanism of resveratrol and flavonoids synthesis by MbMYB306 in mulberry[D]. Tai'an:Shandong Agricultural University, 2023.] GUO Z C. Regulatory mechanism of resveratrol and flavonoids synthesis by MbMYB306 in mulberry[D]. Tai'an: Shandong Agricultural University, 2023.
[24] HU X, LIU Y, LI D, et al. An innovative biotransformation to produce resveratrol by Bacillus safensis[J]. RSC Advances,2019,9(27):15448−15456. doi: 10.1039/C9RA01338E
[25] THAPA S B, PANDEY R P, PARK Y I, et al. Biotechnological advances in resveratrol production and its chemical diversity[J]. Molecules,2019,24(14):2571. doi: 10.3390/molecules24142571
[26] 蒋金金, 苏汉东, 洪登峰, 等. 植物生物技术研究进展[J]. 植物生理学报,2023,59(8):1436−1462. [JIANG J J, SU H D, HONG D F, et al. Advances and perspectives in plant biotechnology[J]. Plant Physiology Journal,2023,59(8):1436−1462.] JIANG J J, SU H D, HONG D F, et al. Advances and perspectives in plant biotechnology[J]. Plant Physiology Journal, 2023, 59(8): 1436−1462.
[27] 薛海洁, 王颖, 李春. 植物天然产物的微生物合成与转化[J]. 化工学报,2019,70(10):3825−3835. [XUE H J, WANG Y, LI C. Microbial synthesis and transformation of plant-derived natural products[J]. CIESC Journal,2019,70(10):3825−3835.] XUE H J, WANG Y, LI C. Microbial synthesis and transformation of plant-derived natural products[J]. CIESC Journal, 2019, 70(10): 3825−3835.
[28] THOMAS V. Phenylpropanoid biosynthesis[J]. Molecular Plant,2010,3(1):2−20. doi: 10.1093/mp/ssp106
[29] 李慧敏, 贾斌, 李霞, 等. 合成芳香族化合物的酵母底盘改造策略[J]. 中国生物工程杂志,2022,42(10):80−92. [LI H M, JIA B, LI X, et al. Advances in engineering yeast chassis for producing aromatic compounds[J]. China Biotechnology,2022,42(10):80−92.] LI H M, JIA B, LI X, et al. Advances in engineering yeast chassis for producing aromatic compounds[J]. China Biotechnology, 2022, 42(10): 80−92.
[30] 王长松, 赵莹, 赵广荣. 微生物合成白藜芦醇的研究进展[J]. 微生物学通报,2014,41(2):352−357. [WANG Z S, ZHAO Y, ZHAO G R. Advances on resveratrol production of engineered microorganisms[J]. Microbiology China,2014,41(2):352−357.] WANG Z S, ZHAO Y, ZHAO G R. Advances on resveratrol production of engineered microorganisms[J]. Microbiology China, 2014, 41(2): 352−357.
[31] 邓禹, 赵心清. 工业微生物:创新与突破专刊序言(2021)[J]. 生物工程学报,2021,37(3):801−805. [DENG Y, ZHAO X Q. Preface for special issue on industrial microorganisms:Innovation and breakthrough (2021)[J]. Chin J Biotech,2021,37(3):801−805.] DENG Y, ZHAO X Q. Preface for special issue on industrial microorganisms: Innovation and breakthrough (2021)[J]. Chin J Biotech, 2021, 37(3): 801−805.
[32] 杨立鑫, 周大伟, 崔心江, 等. 利用酵母生物合成虾青素的研究进展[J]. 食品与发酵工业,2024,50(22):368−379. [YANG L X, ZHOU D W, CUI X J, et al. Research progress on biosynthesis of astaxanthin by yeast[J]. Food and Fermentation Industries,2024,50(22):368−379.] YANG L X, ZHOU D W, CUI X J, et al. Research progress on biosynthesis of astaxanthin by yeast[J]. Food and Fermentation Industries, 2024, 50(22): 368−379.
[33] FLETCHER E, KRIVORUCHKO A, NIELSEN J. Industrial systems biology and its impact on synthetic biology of yeast cell factories[J]. Biotechnology and Bioengineering,2016,113(6):1164−1170. doi: 10.1002/bit.25870
[34] BECKER J, ARMSTRONG G, VANDERMERWE M, et al. Metabolic engineering of for the synthesis of the wine-related antioxidant resveratrol[J]. FEMS Yeast Research,2003,4(1):79−85. doi: 10.1016/S1567-1356(03)00157-0
[35] 孙萍, 郭丽琼, 黄佳俊, 等. 酿酒酵母工程菌生物合成白藜芦醇[J]. 中国食品学报,2016,16(3):68−74. [SUN P, GUO L Q, HUANG J J, et al. Biosynthesis of resveratrol in engineered Saccharomyces cerevisiae strain[J]. Journal of Chinese Institute of Food Science and Technology,2016,16(3):68−74.] SUN P, GUO L Q, HUANG J J, et al. Biosynthesis of resveratrol in engineered Saccharomyces cerevisiae strain[J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(3): 68−74.
[36] 孙萍, 郭丽琼, 梁景龙, 等. 白藜芦醇在酿酒酵母中的组合表达[J]. 食品与发酵工业,2013,39(8):7−12. [SUN P, GUO L Q, LIANG J L, et al. Combinatorial expression of resveratrol in engineered Saccharomyces cerevisiae[J]. Food and Fermentation Industries,2013,39(8):7−12.] SUN P, GUO L Q, LIANG J L, et al. Combinatorial expression of resveratrol in engineered Saccharomyces cerevisiae[J]. Food and Fermentation Industries, 2013, 39(8): 7−12.
[37] SYDOR T, SCHAFFER S, BOLES E. Considerable increase in resveratrol production by recombinant industrial yeast strains with use of rich medium[J]. Applied and Environmental Microbiology,2010,76(10):3361−3363. doi: 10.1128/AEM.02796-09
[38] LI M, KILDEGAARD K R, CHEN Y, et al. De novo production of resveratrol from glucose or ethanol by engineered Saccharomyces cerevisiae[J]. Metabolic Engineering,2015,32:1−11. doi: 10.1016/j.ymben.2015.08.007
[39] 黄良刚, 肖博文, 王文佳, 等. 代谢工程改造解脂耶氏酵母高效合成赤藓糖醇研究进展[J]. 生物工程学报,2024,40(3):665−686. [HUANG L G, XIAO B W, WANG W J, et al. Advances in efficient biosynthesis of erythritol by metabolic engineering of Yarrowia lipolytica[J]. Chinese Journal of Biotechnology,2024,40(3):665−686.] HUANG L G, XIAO B W, WANG W J, et al. Advances in efficient biosynthesis of erythritol by metabolic engineering of Yarrowia lipolytica[J]. Chinese Journal of Biotechnology, 2024, 40(3): 665−686.
[40] PALMER C M, MILLER K K, NGUYEN A, et al. Engineering 4-coumaroyl-coa derived polyketide production in Yarrowia lipolytica through a β-oxidation mediated strategy[J]. Metabolic Engineering,2020,57:174−181. doi: 10.1016/j.ymben.2019.11.006
[41] HE Q, SZCZEPANSKA P, YUZBASHEV T, et al. De novo production of resveratrol from glycerol by engineering different metabolic pathways in Yarrowia lipolytica[J]. Metabolic Engineering Communications,2020,11:e146.
[42] SÁEZ-SÁEZ J, WANG G, MARELLA E R, et al. Engineering the oleaginous yeast Yarrowia lipolytica for high-level resveratrol production[J]. Metabolic Engineering,2020,62:51−61. doi: 10.1016/j.ymben.2020.08.009
[43] LIU M, WANG C, REN X, et al. Remodeling metabolism for high-level resveratrol production in Yarrowia lipolytica[J]. Bioresource Technology,2022,365:128178. doi: 10.1016/j.biortech.2022.128178
[44] 苏鹏, 龚国利. 优化大肠杆菌表达外源蛋白的研究进展[J]. 生物技术通报,2017,33(2):16−23. [SU P, GONG G L. Research progress on optimizing the expression of exogenous proteins in Escherichia coli[J]. Biotechnology Bulletin,2017,33(2):16−23.] SU P, GONG G L. Research progress on optimizing the expression of exogenous proteins in Escherichia coli[J]. Biotechnology Bulletin, 2017, 33(2): 16−23.
[45] KATSUYAMA Y, FUNA N, MIYAHISA I, et al. Synthesis of unnatural flavonoids and stilbenes by exploiting the plant biosynthetic pathway in Escherichia coli[J]. Chemistry & biology,2007,14(6):613−621.
[46] 程皓. 生产白藜芦醇基因工程菌株的构建与表达研究[D]. 济南:山东大学, 2015. [CHENG H. Production of resveratrol in engineered Escherichia coli[D]. Jinan:Shandong University, 2015.] CHENG H. Production of resveratrol in engineered Escherichia coli[D]. Jinan: Shandong University, 2015.
[47] LIM C G, FOWLER Z L, HUELLER T, et al. High-yield resveratrol production in engineered Escherichia coli[J]. Applied and Environmental Microbiology,2011,77(10):3451−3460. doi: 10.1128/AEM.02186-10
[48] 汪建峰, 张嗣良, 王勇. 大肠杆菌中从头合成白藜芦醇途径的设计及优化[J]. 中国生物工程杂志,2014,34(2):71−77. [WANG J F, ZHANG S L, WANG Y. Pathway assembly and optimization in E. coli for de novo biosynthesis of resveratrol[J]. China Biotechnology,2014,34(2):71−77.] WANG J F, ZHANG S L, WANG Y. Pathway assembly and optimization in E. coli for de novo biosynthesis of resveratrol[J]. China Biotechnology, 2014, 34(2): 71−77.
[49] 朱屹东. 代谢工程改造大肠杆菌生产白藜芦醇[D]. 无锡:江南大学, 2016. [ZHU Y D. Metabolic engineering of Escherichia coli for resveratrol production[D]. Wuxi:Jiangnan University, 2016.] ZHU Y D. Metabolic engineering of Escherichia coli for resveratrol production[D]. Wuxi: Jiangnan University, 2016.
[50] 刘向磊. 合成生物学技术改造大肠杆菌生产莽草酸及白藜芦醇[D]. 上海:中国医药工业研究总院, 2016. [LIU X L. Production of shikimic acid and resveratrol in Escherichia coli based on synthetic biology[D]. Shanghai:China State Institute of Pharmaceutical Industry, 2016.] LIU X L. Production of shikimic acid and resveratrol in Escherichia coli based on synthetic biology[D]. Shanghai: China State Institute of Pharmaceutical Industry, 2016.
[51] PARK S R, YOON J A, PAIK J H, et al. Engineering of plant-specific phenylpropanoids biosynthesis in Streptomyces venezuelae[J]. Journal of Biotechnology,2009,141(3-4):181−188. doi: 10.1016/j.jbiotec.2009.03.013
[52] 薛宁, 王瑾, 李世新, 等. 多基因同步调控结合高通量筛选构建高产L-苯丙氨酸的谷氨酸棒杆菌工程菌株[J]. 生物技术通报,2023,39(9):268−280. [XUE N, WANG J, LI S X, et al. Construction of L-phenylalanine high-producing Corynebacterium glutamicum engineered strains via multi-gene simultaneous regulation combined with high-throughput screening[J]. Biotechnology Bulletin,2023,39(9):268−280.] XUE N, WANG J, LI S X, et al. Construction of L-phenylalanine high-producing Corynebacterium glutamicum engineered strains via multi-gene simultaneous regulation combined with high-throughput screening[J]. Biotechnology Bulletin, 2023, 39(9): 268−280.
[53] KALLSCHEUER N, VOGT M, STENZEL A, et al. Construction of a Corynebacterium glutamicum platform strain for the production of stilbenes and (2s)-flavanones[J]. Metabolic Engineering,2016,38:47−55. doi: 10.1016/j.ymben.2016.06.003
[54] KALLSCHEUER N, VOGT M, MARIENHAGEN J. A novel synthetic pathway enables microbial production of polyphenols independent from the endogenous aromatic amino acid metabolism[J]. ACS Synthetic Biology,2017,6(3):410−415. doi: 10.1021/acssynbio.6b00291
[55] MILKE L, FERREIRA P, KALLSCHEUER N, et al. Modulation of the central carbon metabolism of Corynebacterium glutamicum improves malonyl‐CoA availability and increases plant polyphenol synthesis[J]. Biotechnology and Bioengineering,2019,116(6):1380−1391. doi: 10.1002/bit.26939
[56] BEEKWILDER J, WOLSWINKEL R, JONKER H, et al. Production of resveratrol in recombinant microorganisms[J]. Applied and Environmental Microbiology,2006,72(8):5670−5672. doi: 10.1128/AEM.00609-06
[57] LI M, SCHNEIDER K, KRISTENSEN M, et al. Engineering yeast for high-level production of stilbenoid antioxidants[J]. Scientific Reports,2016,6:36827. doi: 10.1038/srep36827
[58] COSTA C E, MØLLER-HANSEN I, ROMANÍ A, et al. Resveratrol production from hydrothermally pretreated eucalyptus wood using recombinant industrial Saccharomyces cerevisiae strains[J]. ACS Synthetic Biology,2021,10(8):1895−1903. doi: 10.1021/acssynbio.1c00120
[59] 王鹤蓉. 利用酿酒酵母生物合成白藜芦醇途径的构建及优化[D]. 长春:吉林大学, 2020. [WANG H R. Construction and optimization of resveratrol pathway via Saccharomyces cerevisiae biosynthesis[D]. Changchun:Jilin University, 2020.] WANG H R. Construction and optimization of resveratrol pathway via Saccharomyces cerevisiae biosynthesis[D]. Changchun: Jilin University, 2020.
[60] WATTS K T, LEE P C, SCHMIDT-DANNERT C. Biosynthesis of plant-specific stilbene polyketides in metabolically engineered Escherichia coli[J]. BMC biotechnology,2006,6(1):22. doi: 10.1186/1472-6750-6-22
[61] 张二浩. 白藜芦醇合成代谢关键酶基因4CL和RS融合表达研究[D]. 北京:中国林业科学研究院, 2015. [ZHANG E H. Fusion Expression of the 4CL and RS genes of anabolic key enzymes of resveratrol[D]. Beijing:Chinese Academy of Forestry, 2015.] ZHANG E H. Fusion Expression of the 4CL and RS genes of anabolic key enzymes of resveratrol[D]. Beijing: Chinese Academy of Forestry, 2015.
[62] WANG S, ZHANG S, XIAO A, et al. Metabolic engineering of Escherichia coli for the biosynthesis of various phenylpropanoid derivatives[J]. Metabolic Engineering,2015,29:153−159. doi: 10.1016/j.ymben.2015.03.011
[63] YANG Y, LIN Y, LI L, et al. Regulating malonyl-CoA metabolism via synthetic antisense RNAs for enhanced biosynthesis of natural products[J]. Metabolic Engineering,2015,29:217−226. doi: 10.1016/j.ymben.2015.03.018
[64] LIU X, LIN J, HU H, et al. De novo biosynthesis of resveratrol by site-specific integration of heterologous genes in Escherichia coli[J]. FEMS Microbiology Letters,2016,363(8):fnw61.
[65] LI J, QIU Z, ZHAO G. Modular engineering of E. coli coculture for efficient production of resveratrol from glucose and arabinose mixture[J]. Synthetic and Systems Biotechnology,2022,7(2):718−729. doi: 10.1016/j.synbio.2022.03.001
[66] WU J, ZHOU P, ZHANG X, et al. Efficient de novo synthesis of resveratrol by metabolically engineered Escherichia coli[J]. Journal of Industrial Microbiology and Biotechnology,2017,44(7):1083−1095. doi: 10.1007/s10295-017-1937-9
[67] CAMACHO-ZARAGOZA J M, HERNANDEZ-CHAVEZ G, MORENO-AVITIA F, et al. Engineering of a microbial coculture of Escherichia coli strains for the biosynthesis of resveratrol[J]. Microbial Cell Factories,2016,15(1):163. doi: 10.1186/s12934-016-0562-z
[68] 赵莹. 代谢工程大肠杆菌合成白藜芦醇[D]. 天津:天津大学, 2019. [ZHAO Y. Metabolic engineering of Escherichia coli for resveratrol production[D]. Tianjin:Tianjin University, 2019.] ZHAO Y. Metabolic engineering of Escherichia coli for resveratrol production[D]. Tianjin: Tianjin University, 2019.
[69] BRAGA A, OLIVEIRA J, SILVA R, et al. Impact of the cultivation strategy on resveratrol production from glucose in engineered Corynebacterium glutamicum[J]. Journal of Biotechnology,2018,265:70−75. doi: 10.1016/j.jbiotec.2017.11.006
[70] 赵燕磊. 重组耶氏解脂酵母合成白藜芦醇的研究[D]. 淄博:山东理工大学, 2021. [ZHAO Y L. Study on recombinant Yarrowia lipolytica yeast to synthesize resveratrol[D]. Zibo:Shandong University of Technology, 2021.] ZHAO Y L. Study on recombinant Yarrowia lipolytica yeast to synthesize resveratrol[D]. Zibo: Shandong University of Technology, 2021.
[71] WANG Y, HALLS C, ZHANG J, et al. Stepwise increase of resveratrol biosynthesis in yeast Saccharomyces cerevisiae by metabolic engineering[J]. Metabolic Engineering,2011,13(5):455−463. doi: 10.1016/j.ymben.2011.04.005
[72] COTNER M, ZHAN J, ZHANG Z. A computational metabolic model for engineered production of resveratrol in Escherichia coli[J]. ACS Synthetic Biology,2021,10(8):1992−2001. doi: 10.1021/acssynbio.1c00163
[73] WANG Y, YU O. Synthetic scaffolds increased resveratrol biosynthesis in engineered yeast cells[J]. Journal of Biotechnology,2012,157(1):258−260. doi: 10.1016/j.jbiotec.2011.11.003
[74] 张倩. 基于β氧化强化酿酒酵母合成丙二酰辅酶A衍生物[D]. 无锡:江南大学, 2022. [ZHANG Q. Enhanced biosynthesis of malonyl-CoA derivatives in Saccharomyces cerevisiae based on β-oxidation[D]. Wuxi:Jiangnan University, 2022.] ZHANG Q. Enhanced biosynthesis of malonyl-CoA derivatives in Saccharomyces cerevisiae based on β-oxidation[D]. Wuxi: Jiangnan University, 2022.
[75] NANDAGOPAL K, HALDER M, DASH B, et al. Biotechnological approaches for production of anti-cancerous compounds resveratrol, podophyllotoxin and zerumbone[J]. Current Medicinal Chemistry,2018,25(36):4693−4717. doi: 10.2174/0929867324666170404145656
[76] SHRESTHA A, PANDEY R P, POKHREL A R, et al. Modular pathway engineering for resveratrol and piceatannol production in engineered Escherichia coli[J]. Applied Microbiology and Biotechnology,2018,102(22):9691−9706. doi: 10.1007/s00253-018-9323-8
[77] WANG J, GULERIA S, KOFFAS M A, et al. Microbial production of value-added nutraceuticals[J]. Current Opinion in Biotechnology,2016,37:97−104. doi: 10.1016/j.copbio.2015.11.003
[78] ZHA W, RUBIN-PITEL S B, SHAO Z, et al. Improving cellular malonyl-CoA level in Escherichia coli via metabolic engineering[J]. Metabolic Engineering,2009,11(3):192−198. doi: 10.1016/j.ymben.2009.01.005
[79] RODRIGUEZ A, KILDEGAARD K R, LI M, et al. Establishment of a yeast platform strain for production of p-coumaric acid through metabolic engineering of aromatic amino acid biosynthesis[J]. Metabolic Engineering,2015,31:181−188. doi: 10.1016/j.ymben.2015.08.003
[80] BRAGA A, FERREIRA P, OLIVEIRA J, et al. Heterologous production of resveratrol in bacterial hosts:Current status and perspectives[J]. World Journal of Microbiology and Biotechnology,2018,34(8):122. doi: 10.1007/s11274-018-2506-8
[81] JUMINAGA D, BAIDOO E E K, REDDING-JOHANSON A M, et al. Modular engineering of l-tyrosine production in Escherichia coli[J]. Applied and Environmental Microbiology,2012,78(1):89−98. doi: 10.1128/AEM.06017-11
[82] AFONSO M S, FERREIRA S, DOMINGUES F C, et al. Resveratrol production in bioreactor:Assessment of cell physiological states and plasmid segregational stability[J]. Biotechnology Reports,2015,5:7−13. doi: 10.1016/j.btre.2014.10.008
[83] 林雅楠, 王瑞明, 黄磊, 等. 重组大肠杆菌生物合成白藜芦醇条件的优化研究[J]. 药物生物技术,2013,20(5):427−430. [LIN Y N, WANG R M, HUANG L, et al. Optimization of biosynthetical conditions of resveratrol with recombinant Escherichia coli[J]. Pharmaceutical Biotechnology,2013,20(5):427−430.] LIN Y N, WANG R M, HUANG L, et al. Optimization of biosynthetical conditions of resveratrol with recombinant Escherichia coli[J]. Pharmaceutical Biotechnology, 2013, 20(5): 427−430.
[84] KATZ M, SMITS H P, FÖRSTER J, et al. Metabolically engineered cells for the production of resveratrol or an oligomeric or glycosidically-bound derivative thereof. US201514690542[P]. 2017.12. 05.
[85] CHOI O, WU C, KANG S Y, et al. Biosynthesis of plant-specific phenylpropanoids by construction of an artificial biosynthetic pathway in Escherichia coli[J]. Journal of Industrial Microbiology & Biotechnology,2011,38(10):1657−1665.
[86] 周强, 周大伟, 孙敬翔, 等. 微生物发酵法合成虾青素的研究进展[J]. 合成生物学,2024,5(1):126−143. [ZHOU Q, ZHOU D W, SUN J X, et al. Research progress in synthesis of astaxanthin by microbial fermentation[J]. Synthetic Biology Journal,2024,5(1):126−143.] doi: 10.12211/2096-8280.2023-065 ZHOU Q, ZHOU D W, SUN J X, et al. Research progress in synthesis of astaxanthin by microbial fermentation[J]. Synthetic Biology Journal, 2024, 5(1): 126−143. doi: 10.12211/2096-8280.2023-065
[87] 李秋阳, 孙文涛, 秦磊, 等. 天然产物生物合成与微生物制造的挑战[J]. 中国生物工程杂志,2024,44(1):72−87. [LI Q Y, SUN W T, QIN L, et al. Challenges in the biosynthesis of natural products and microbial manufacturing[J]. China Biotechnology,2024,44(1):72−87.] LI Q Y, SUN W T, QIN L, et al. Challenges in the biosynthesis of natural products and microbial manufacturing[J]. China Biotechnology, 2024, 44(1): 72−87.
[88] ZHOU K, QIAO K, EDGAR S, et al. Distributing a metabolic pathway among a microbial consortium enhances production of natural products[J]. Nature Biotechnology,2015,33(4):377−383. doi: 10.1038/nbt.3095
[89] YUAN S, YI X, JOHNSTON T G, et al. De novo resveratrol production through modular engineering of an Escherichia coli-Saccharomyces cerevisiae co-culture[J]. Microbial Cell Factories,2020,19(1):143. doi: 10.1186/s12934-020-01401-5





 下载:
下载:
 下载:
下载:



