A Preliminary Study on the Effects of Tartary Buckwheat-derived Nanoparticles on the Physiology of C57BL/6 Mice
-
摘要: 目的:探索饮食中添加苦荞来源的类外泌体囊泡(TBDNs)对小鼠主要生理指标的影响。方法:24只C57BL/6小鼠随机分为两组:正常对照组与添加TBDNs组,分析体重、血液生化指标、小鼠结肠、肝脏细胞组织学与免疫组织化学,肠道菌群变化。结果:相对正常饮食组,10 mg TBDNs 剂量组小鼠体重、甘油三酯、尿酸、丙氨酸氨基转移酶显著下降(P<0.01);天冬氨酸氨基转移酶 、胆固醇、高密度脂蛋白、低密度脂蛋白以及肌酐等生理指标及肝脏、结肠组织等未见显著改变(P>0.05);肠道中乳杆菌属Lactobacillus、苏黎世杆菌属Turicibacter和Lachnoclostridium均显著提高(P<0.05)。结论:TBDNs摄入对小鼠生理有一定影响,但其作用机制及对健康的意义仍需进一步探讨。研究结果为苦荞的营养评价提供了新的视角与资料。
-
关键词:
- 苦荞 /
- 苦荞来源类外泌体囊泡 /
- 肠道菌群 /
- 营养健康
Abstract: Objective: To investigate the effects of dietary supplementation with tartary buckwheat-derived nanoparticles (TBDNs) on key physiological parameters in mice. Methods: Twenty-four C57BL/6 mice were randomly assigned to two groups: a normal control group and a TBDNs group. Changes in body weight, blood biochemical markers, cell histology and immunohistochemistry of the colon and liver, as well as intestinal flora composition, were analyzed. Results: Compared to the normal diet group, the 10 mg TBDNs group exhibited significant reductions in body weight, triglyceride levels, uric acid levels, and alanine aminotransferase activity (P<0.01). Physiological indicators such as aspartate aminotransferase, cholesterol, high-density lipoprotein, low-density lipoprotein, and creatinine, as well as liver and colon tissues, showed no significant changes (P>0.05). The abundance of intestinal Lactobacillus, Turicibacter, and Lachnoclostridium species was all significant increased (P<0.05). Conclusion: Intake of TBDNs has discernible physiological effects on mice; however, further investigations are required to elucidate its underlying mechanisms and potential health benefits. These findings provide novel insights and data for nutritional evaluation of Tartary buckwheat. -
苦荞麦F. tataricum属蓼科(Polygonaceae)荞麦属(Fagopyrum)植物[1],是传统的食药兼用谷物,富含多种营养功能物质,如抗性淀粉、多酚、活性肽、多糖等[2]。已有研究表明,苦荞具有降糖、降脂、降压和改善微循环等作用,常推荐用于降低三高的饮食健康管理谷物[3]。然而,仅从传统营养活性成分角度解析苦荞营养作用机制尚存争议,例如,Stewart等[4]报道1.2%槲皮素喂养8周不能改善高脂饮食诱导的胰岛素抵抗,与传统认为黄酮类成分是苦荞发挥降脂活性的营养物质认识不一致。因此苦荞中可能尚存其它“营养暗物质”发挥生理作用。
植物细胞向外分泌的类外泌体样纳米颗粒(exosome-like nanoparticles,ELNs),是具有纳米样结构的囊泡,含脂类、蛋白、miRNA等。目前,已有大量研究证明ELNs具有多种生理功能,如葡萄[5−7]、生姜[8,10]、橙子[9]、蓝莓[11]等的外泌体样纳米颗粒。研究发现,来自葡萄、胡萝卜和生姜的外泌体样纳米颗粒可介导小鼠肠道组织重塑和预防炎症性肠病,减轻肠道屏障损伤引起的免疫反应[7]。蓝莓来源的外泌体样纳米颗粒(blueberry exosomes-like nanoparticles,BELNs),能改善高脂饮食(high-fat diet,HFD)喂养的小鼠非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD) 模型的胰岛素抵抗,并具有调节脂肪酸合成基因的表达以及 Nrf2 在肝脏的分布减轻肝脏的氧化应激反应等作用[11]。越来越多证据表明植物来源的类外泌体样纳米颗粒(PELNs)参与人体生理活动并发挥相关功能[12]。因此从PELNs层面揭示苦荞生物效应可为苦荞的质量评价提供新的观点。
课题组前期从苦荞中提取类外泌体,体外实验发现其能被肠道菌群吸收;生信分析与体外验证结果表明苦荞来源类外泌体囊泡(tartary buckwheat-derived nanoparticles,TBDNs)可以调节鼠李糖乳杆菌、大肠杆菌的生长,这可能与TBDNs中含有的脂质、蛋白以及miRNA等非编码RNA有关[13],从TBDNs角度阐明苦荞饮食合理性具有重要意义。《本草纲目》记载苦荞“发风动气、能发诸病”,说明长期食用苦荞可能对健康产生不利影响。因此本文重点考察在正常饮食条件下TBDNs对C57BL/6小鼠生理指标的影响,为进一步揭示TBDNs对健康的影响提供资料,也为后续苦荞营养功能评价奠定基础。
1. 材料与方法
1.1 材料与仪器
川荞1号种子 农业农村部杂粮加工重点实验室;饲料 北京华阜康生物科技股份有限公司;7~8周龄C57BL/6小鼠 成都药康生物科技有限公司,许可证号:SCXK(川)2020-034;丙氨酸氨基转移酶(alanine aminotransferase,ALT)测定试剂盒、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)测定试剂盒、肌酐(creatinine,CREA)测定试剂盒、尿酸(uric acid,UA)测定试剂盒、总胆固醇(total cholesterol,TC)测定试剂盒、总甘油三酯(total triglycerides,TG)测定试剂盒、高密度脂蛋白(high-density lipoprotein cholesterol,HDL-C)测定试剂盒、低密度脂蛋白(low-density lipoprotein cholesterol,LDL-C)测定试剂盒 mindray;HE染液套装 Leagene;Tunel试剂盒、枸橼酸抗原修复液(pH6.0)、TLR4、Myd88、CY3标记的山羊抗兔IgG 赛维尔生物科技有限公司;山羊血清 Biosharp;一抗TLR2、NF-KB P65 华安生物;抗荧光淬灭封片剂 SouthernBiotech。
D3024台式高速微量离心机、D3024R台式高速冷冻离心机、SLK-O3000-S数控摇床 美国赛洛捷克SCILOGEX;THZ-82A数显气浴恒温振荡器 常熟朗越仪器制造有限公司;KZ-III-F高速低温组织研磨仪 武汉赛维尔生物科技有限公司;BS360S全自动生化分析仪 迈瑞mindray;STP420 ES快速组织脱水机、Varistain™ Gemini ES全自动染色机 Thermo scientific/赛默飞世尔;S1010E脱色摇床 SCILOGEX;BC004组化笔 Biosharp;CX40荧光显微镜 SOPTOP;Pannoramic SCAN Ⅱ病理切片扫描仪 3DHISTECH Kft。
1.2 实验方法
1.2.1 苦荞预处理
选用未受虫害影响且充实饱满的川荞1号种子,经过清洗、去除灰尘和杂质后,使用50 ℃的烘箱烘干8 h,随后粉碎研磨并通过50目筛子过滤,以备后用。
1.2.2 TBDNs的提取流程
根据生姜外泌体提取方法进行优化[14],称取川荞1号种子粉末,加适量水混合后孵育过夜。次日,将苦荞水溶液,在4 ℃条件下,依次以1000×g,10 min、3000×g,20 min、10000×g,30 min进行离心操作,取上清液用1 μm过滤器进行过滤处理,加入PEG-6000使终浓度为10%并孵育过夜。次日,在4 ℃条件下,以10000×g,30 min进行离心,去除上清液后留下沉淀,用磷酸盐缓冲盐水(PBS)溶液重悬,最后放−80 ℃保存。通过扫描电镜、粒度分析等对外泌体进行表征。
1.2.3 动物分组
小鼠饲养于温度20~25 ℃,相对湿度45%~55%的动物房内,自由摄食和饮水,昼夜节律正常。所有动物实验规程均由成都大学实验动物伦理与福利委员会审核批准,动物实验涉及的所有程序均按照中国动物福利委员会的原则和指导方针执行。将24只小鼠随机分为2组,每组12只,分别为:正常饮食组(C)和正常饮食+10 mg TBDNs灌胃组(C_10),喂养8周后进行解剖实验。基础饲料为北京华阜康生物科技股份有限公司提供的维持饲料(编号:1025);TBDNs用PBS分散后进行灌胃,空白组灌胃PBS作为对照。
1.2.3.1 体重、进食量监测
每次灌胃前对每组小鼠的体重以及进食量进行监测称量(该监测以分组后第一天的体重、进食量作为起始点)。
1.2.3.2 小鼠血液生化指标检测
将小鼠禁食不禁水16 h,腹主动脉采血测定丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、肌酐(CREA)和尿酸(UA)八大血液生化指标。具体实验步骤按试剂盒说明书进行操作。
1.2.3.3 组织H&E及油红O染色分析
分别取小鼠结肠组织、肝脏组织进行H&E染色和油红O染色[15],进行组织病理学检查。分析小鼠肠上皮细胞炎性浸润以及肝脏中脂滴的累积情况。
1.2.3.4 小鼠结肠、肝脏组织免疫荧光
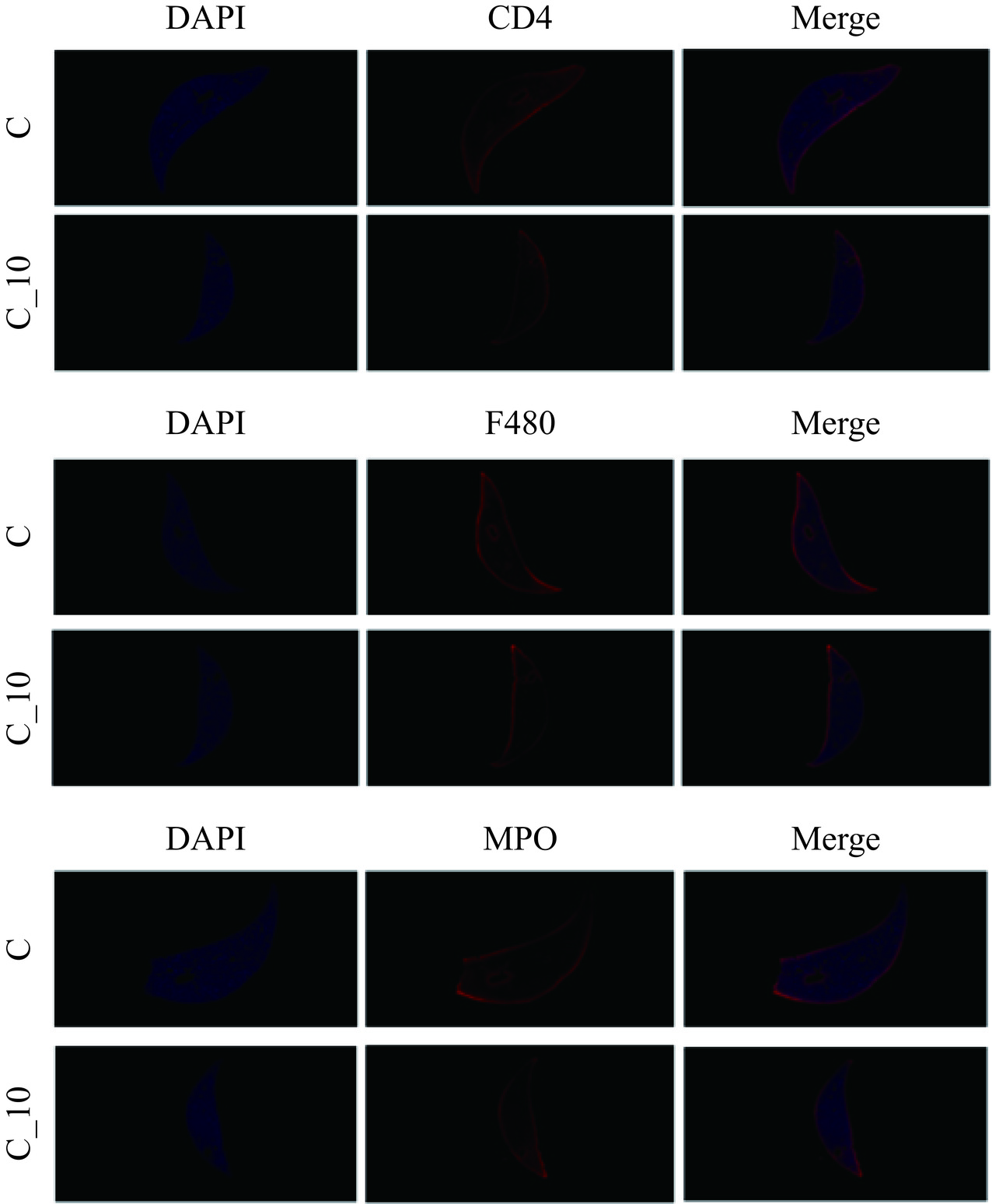
对小鼠的结肠、肝脏组织切片进行免疫荧光实验,以观察其结肠的屏障通透性和肝脏免疫细胞的表达、分布。首先进行石蜡切片前处理:a.石蜡切片脱蜡至水:依次将切片放入二甲苯Ⅰ15 min,二甲苯Ⅱ15 min,无水乙醇Ⅰ5 min,无水乙醇Ⅱ5 min,85%酒精5 min,75%酒精5 min,蒸馏水洗。b.抗原修复:向微波炉专用容器中加入合适的修复缓冲液(柠檬酸缓冲液)高火加热至沸腾,取出放入拨片,中火8 min至沸,停火8 min,转中低火7 min。自然冷却后将玻片置于PBS(pH7.4)中在脱色摇床上晃动洗涤3次,每次5 min。c.阻断内源性过氧化物酶;切片稍甩干后用组化笔在组织周围画圈(防止抗体流走),切片放入3%过氧化氢溶液,室温避光孵育15 min,将玻片置于PBS(pH7.4)中在脱色摇床上晃动洗涤3次,每次5 min。然后参考赵婉均[11]的实验方法,稍作修改:d.血清封闭:在圈内滴加5%山羊血清孵育30 min。e.加一抗:轻轻甩掉封闭液,在切片上滴加PBS按1:200比例配好的F480、CD4、MPO,切片平放于湿盒内4 ℃孵育过夜;f.加二抗:玻片置于PBS(pH7.4)中在脱色摇床上晃动洗涤3次,每次5 min。切片稍甩干后在圈内滴加CY3标记山羊抗兔IgG二抗覆盖组织,避光37 ℃孵育50 min。然后进行DAPI复染细胞核、封片,最后在显微镜下观察拍照。
1.2.3.5 16S rRNA 测序
参考Peng等[16]方法分析TBDNs灌胃组与正常组小鼠肠道的粪便微生物组成。对小鼠粪便微生物进行16S rRNA测序,设置的16S引物为:Primer5'-3':8F(5'-AGAGTTTGATCATGGCTCAG-3')和1492R(5'-CGGTTACCTTGTTACGACTT-3'),对提取的RNA进行 PCR 后再建库,建库后采用Nanopore GridION测序仪测序,测序试剂盒使用MinION Flow Cell(R9.4);此外,还进行了OTU聚类和注释分析。利用α多样性和β多样性作为基础,对粪便微生态的菌落组成进行了分析,并比较了TBDNs灌胃处理组对肠道微生物属水平的影响。
1.3 数据处理
小鼠的生理生化指标、肝脏与结肠病理检测和小鼠肠道菌群的物种丰度比较各项实验,通过GraphPad Prism 9.5.0软件对所有实验数据进行深入的统计学分析,使用平均值±标准差作为表示。两组之间的差异通过ANOVA方差统计进行对比。所有的研究结果都在三次或更多次独立的重复实验后得到。在小鼠肠道菌群的研究中,使用R语言对数据进行转化,并对Alpha多样性和Beta多样性进行分析;采用Origin 8.0制作箱式图。
2. 结果与分析
2.1 TBDNs 对HFD 小鼠体重、进食量的影响
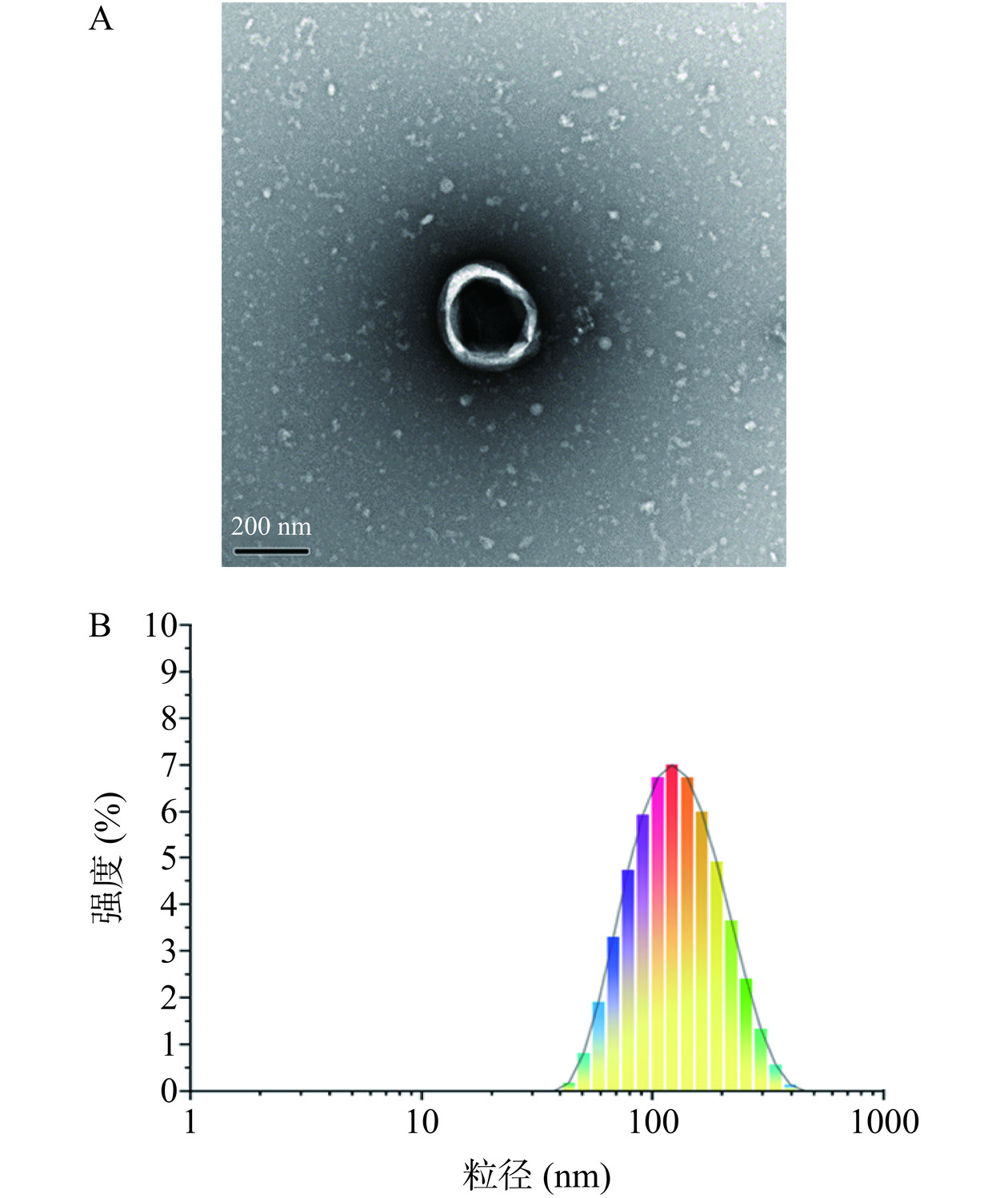
在本研究中,通过差速离心与PEG沉淀法结合从苦荞中分离出TBDNs样品,在透射电子显微镜下,能够观察到典型的茶托型囊泡结构,如图1A所示。提取的TBDNs经过粒径测试结果如图1B,其平均粒径为182.8 nm,粒径主峰在162.8 nm。本研究提取出的TBDNs与前期课题组采用超速离心法提取的TBDNs的表征相似[13]。因此,可以说明本文成功从苦荞中优化提取出了TBDNs。
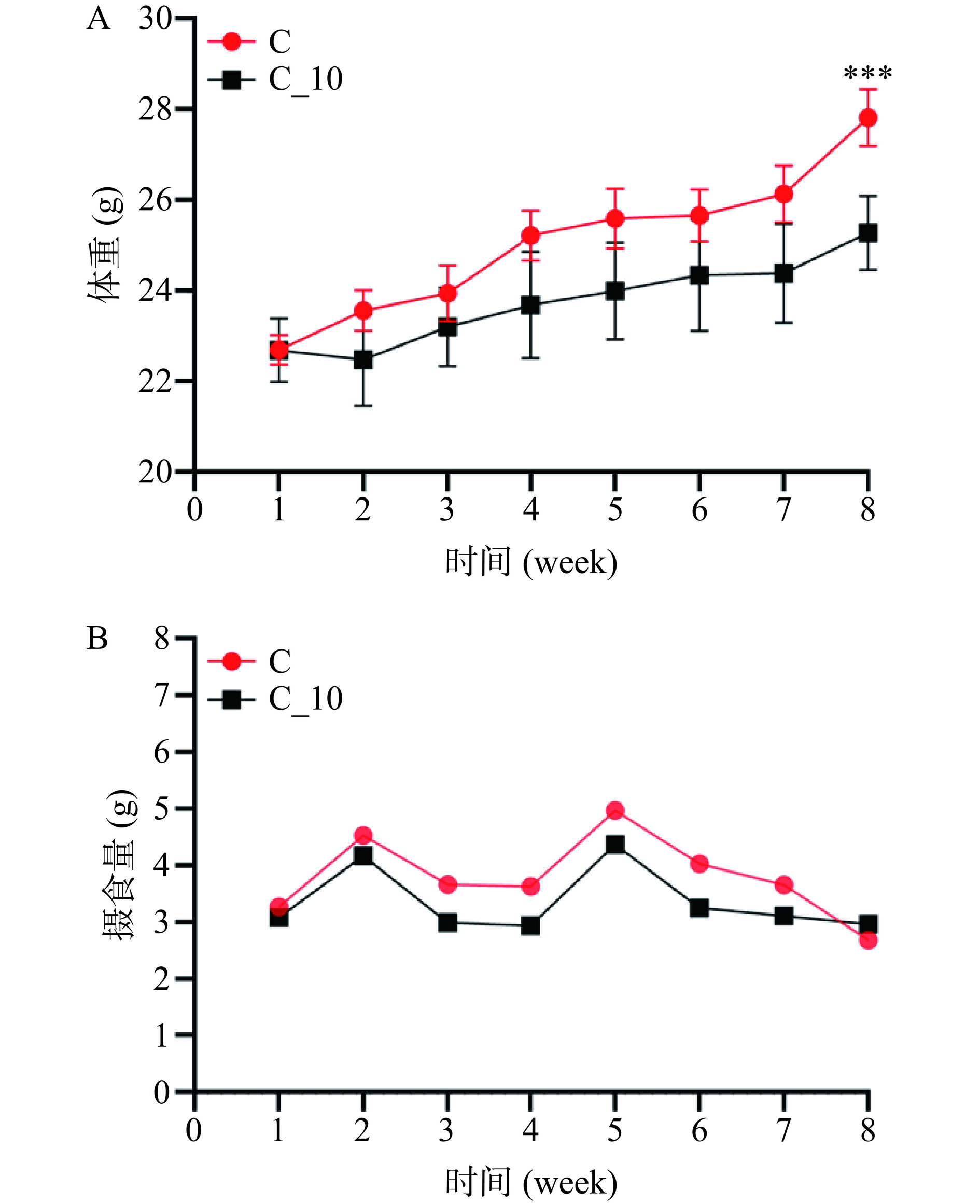
相关研究报道,PELNs能够被动物的胃肠道吸收从而影响其生理状态。因此,首先考察了苦荞类外泌体囊泡(TBDNs)对小鼠生理的影响。PEG提取得到的TBDNs沉淀分离后称重,每100 g苦荞约可提取10 mg的TBDNs。根据《中国居民膳食指南(2022)》推荐,每天摄入全谷物及杂豆类50~150 g(干重)[17]。因此,选用10 mg TBDNs进行灌胃。在本研究中,对C57BL/6小鼠进行10 mg TBDNs灌胃8 周后,TBDNs灌胃组(C_10)体重增长曲线低于正常饮食组(C)体重增长曲线(图2A);TBDNs灌胃组(C_10)小鼠体重为25 g左右,与正常饮食喂养组小鼠相比,体重显著降低(P<0.001)。进一步统计所有小鼠的摄食量发现(图2B),TBDNs灌胃组(C_10)的日均摄食量略低于正常组(C)小鼠。这些结果表明,TBDNs可能会通过影响食欲来影响正常饮食小鼠的体重。但TBDNs影响小鼠体重的原因和途径需进一步分析。
2.2 TBDNs对小鼠血液生化指标的影响
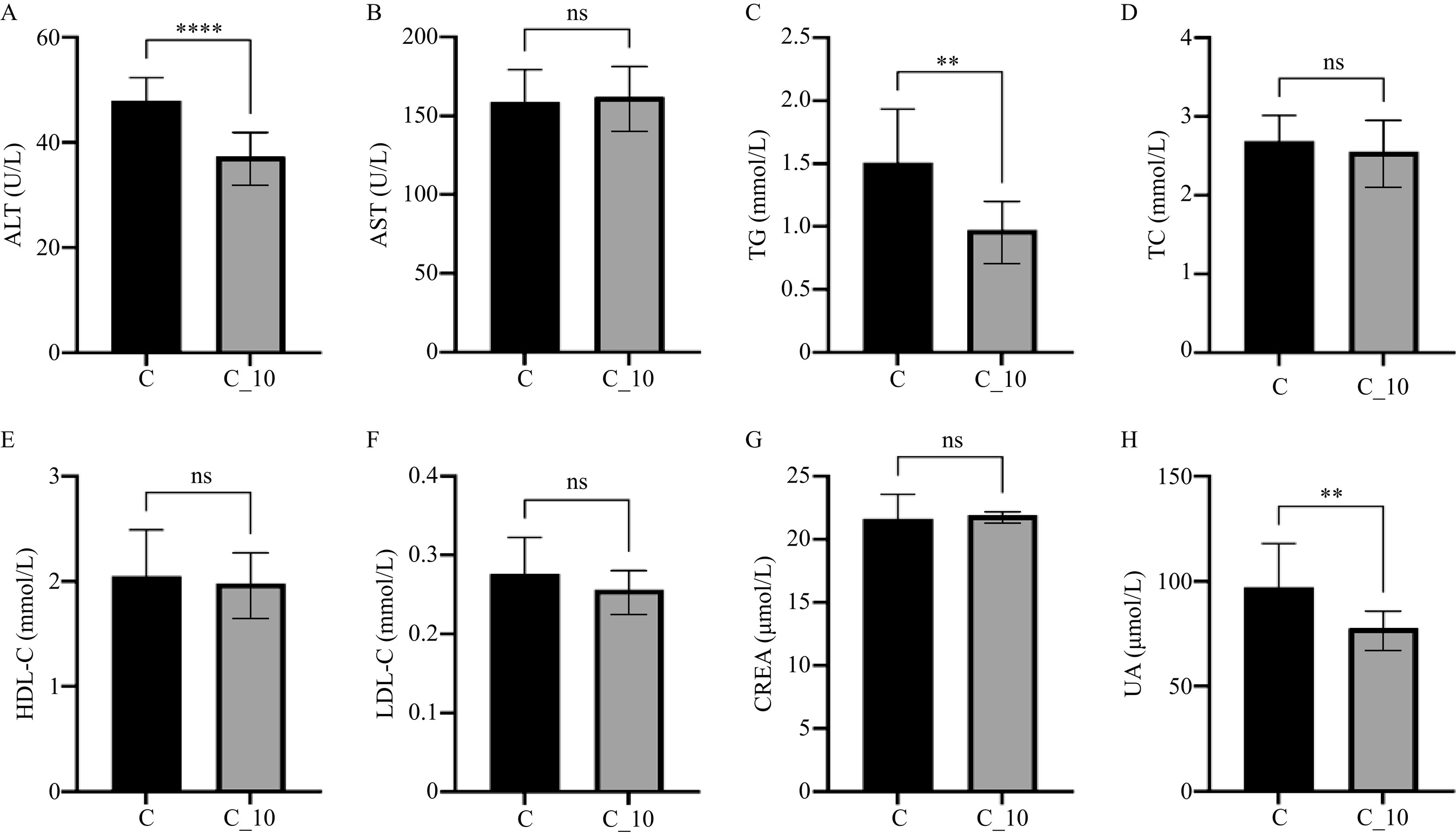
近年来,植物来源的类外泌体在改善各种疾病方面的潜力引起了广泛关注。本研究探讨了TBDNs对小鼠血液生化指标的影响,并将结果与其他植物来源类外泌体的研究进行了比较。在本实验中,C57BL/6小鼠经过8周的TBDNs灌胃处理后,对其血液生化指标进行了测定。结果显示,与正常对照组相比,TBDNs处理组的丙氨酸氨基转移酶(ALT)、甘油三酯(TG)和尿酸(UA)水平显著降低(P<0.01)(图3A、C、H)。这一发现与其他植物来源类外泌体的研究结果相似。例如,BERGER等[9]发现橙汁衍生的纳米囊泡(ONVs)能够降低甘油三酯的含量,同时还能降低胃肠道疾病中的炎症水平和血脂水平。赵婉均[11]的研究也表明,蓝莓类外泌体(BELNs)可以显著降低肥胖小鼠血清中的TG、TC、LDL-C、AST和ALT的水平。
虽然TBDNs降低了ALT、TG和UA的水平,但这些指标并未低于正常值。这种适度的调节作用可能暗示了TBDNs在维持生理平衡方面的潜在益处。然而,这些生理指标变化的健康意义还需要进一步分析。与BELNs不同,本文的研究发现TBDNs对天冬氨酸氨基转移酶(AST)、胆固醇(TC)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)以及肌酐(CREA)水平均没有显著影响(P>0.05)(图3B、D、E、F、G )。这种差异可能源于类外泌体的来源、提取方法以及实验动物模型的不同。基于本研究结果,认为在正常情况下摄入TBDNs对血液生化指标的影响相对较小。为了更全面地了解TBDNs的生理效应,未来的研究可以考虑增加TBDNs的浓度,或者在不同的生理和病理模型中进行观察。这不仅有助于深入了解TBDNs的作用机制,还可能为开发基于植物类外泌体的新型功能性食品或治疗策略提供重要依据。
2.3 TBDNs 对小鼠肝脏、结肠的影响
膳食对肠道微生物群、屏障功能和黏膜免疫具有重要影响,膳食摄入在炎症性肠病(IBD)发生发展中起着关键作用[18];同时肝脏是负责脂质代谢的主要器官,血脂异常与肝脏脂质积累高度相关[19]。研究报道,通过一个月的ONVs治疗逆转了饮食诱导的肠道改变,并调节参与免疫反应(肿瘤坏死因子[TNF]-α和白细胞介素[IL]-1β)、屏障通透性(CLDN1、OCLN、ZO1)和脂肪吸收和乳糜微粒释放的基因的mRNA水平,作为膳食补充剂保护了肠道和肝脏免受与高蔗糖饮食相关的脂肪过载的影响[9]。此外,来自生姜[8]、胡萝卜[7]和葡萄[5]的外泌体样纳米囊泡能够减轻肠道屏障损伤引起的免疫反应,对小鼠肠道组织重塑从而达到预防炎症性肠病的作用,蓝莓来源的外泌体样纳米囊泡还能改善肝功能障碍[7,11]。因此,植物来源的类外泌体可能通过多种途径影响肠道和肝脏生理。
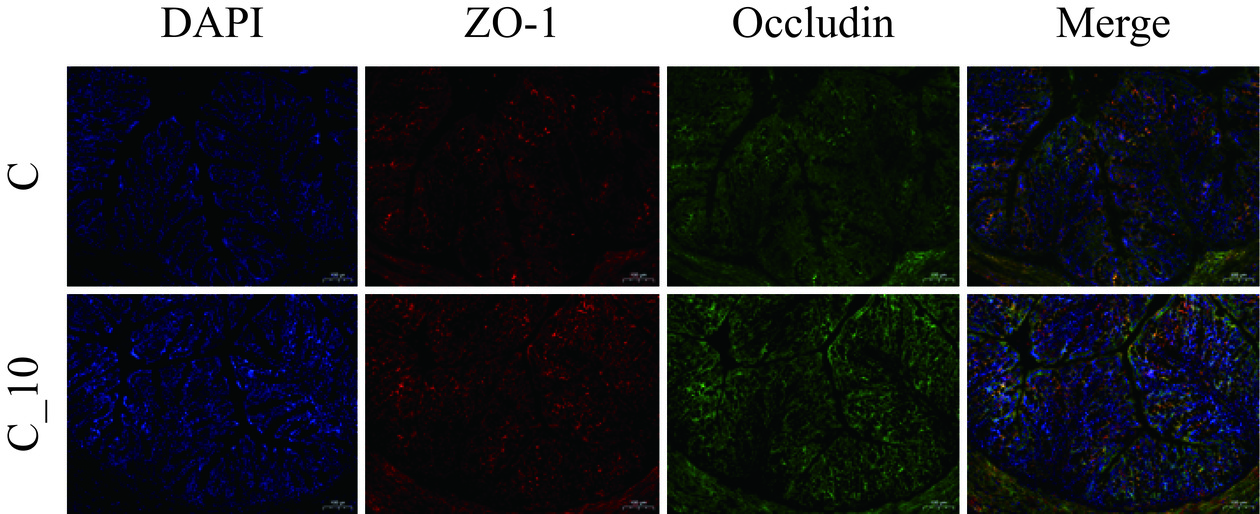
《本草纲目》记载苦荞“发风动气、能发诸病”,其机理尚无合理解析。由于对TBNDs的功能认识尚不足,本文首先考虑在正常条件下摄入TBDNs对小鼠传统生理指标、肝脏以及结肠组织等的影响。HE染色结果表明,两组肠道上皮细胞的炎性细胞浸润以及肝组织切片均无显著变化(图4A、B)。油红O染色(图4C)和脂滴面积定量分析(图4D)同样显示无显著性变化。进一步通过评估正常组和TBDNs组对小鼠结肠屏障功能的影响(图5),发现与正常组相比,TBDNs组的肠上皮Occludin和ZO-1的表达也未发生显著改变。对肝组织免疫组化检测,评估正常组和TBDNs组对小鼠抗原抗体的反应(图6)。与正常组相比,TBDNs组的CD4、F480、MPO的表达未发生显著变化。这些结果表明正常饮食下添加TBDNs对肝脏炎症、脂肪积累、肠道屏障功能等无不良影响。
2.4 肠道菌群分析
2.4.1 肠道微生物多样性分析
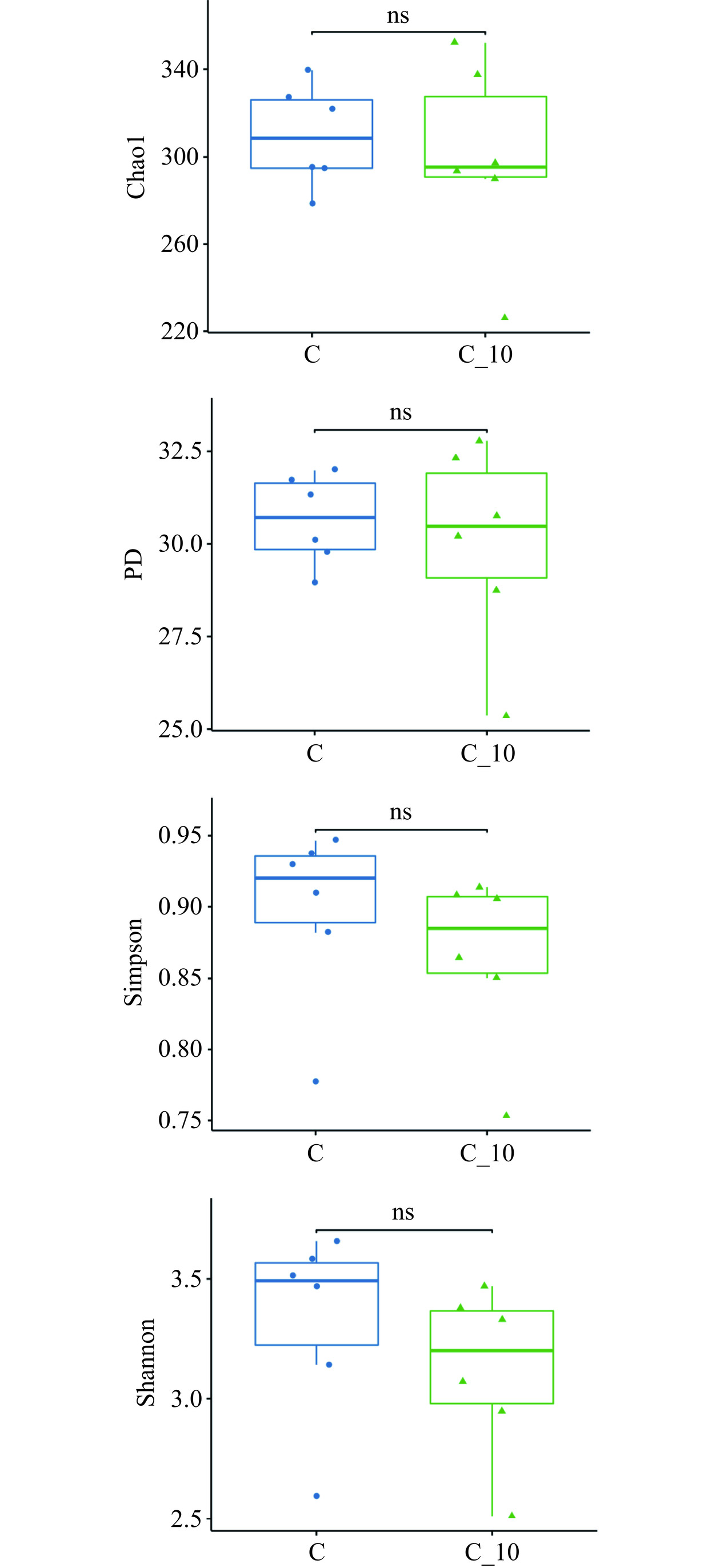
本研究扩增 16S rRNA 获得粪便微生态中的细菌群落结构。本实验中所测得的样本共获得428661条序列。通过比对过滤后,共得到325437条有效的序列用于后续的分析。对粪便微生态α多样性的分析,可以看出,正常组与TBDNs组对应的 Chao1指数、Shannon指数、Simpson指数以及PD指数均无显著性差异(图7),表明TBDNs的摄入不会对正常小鼠肠道微生态造成紊乱,仍能维持良好的肠道稳态。
2.4.2 物种组成分析
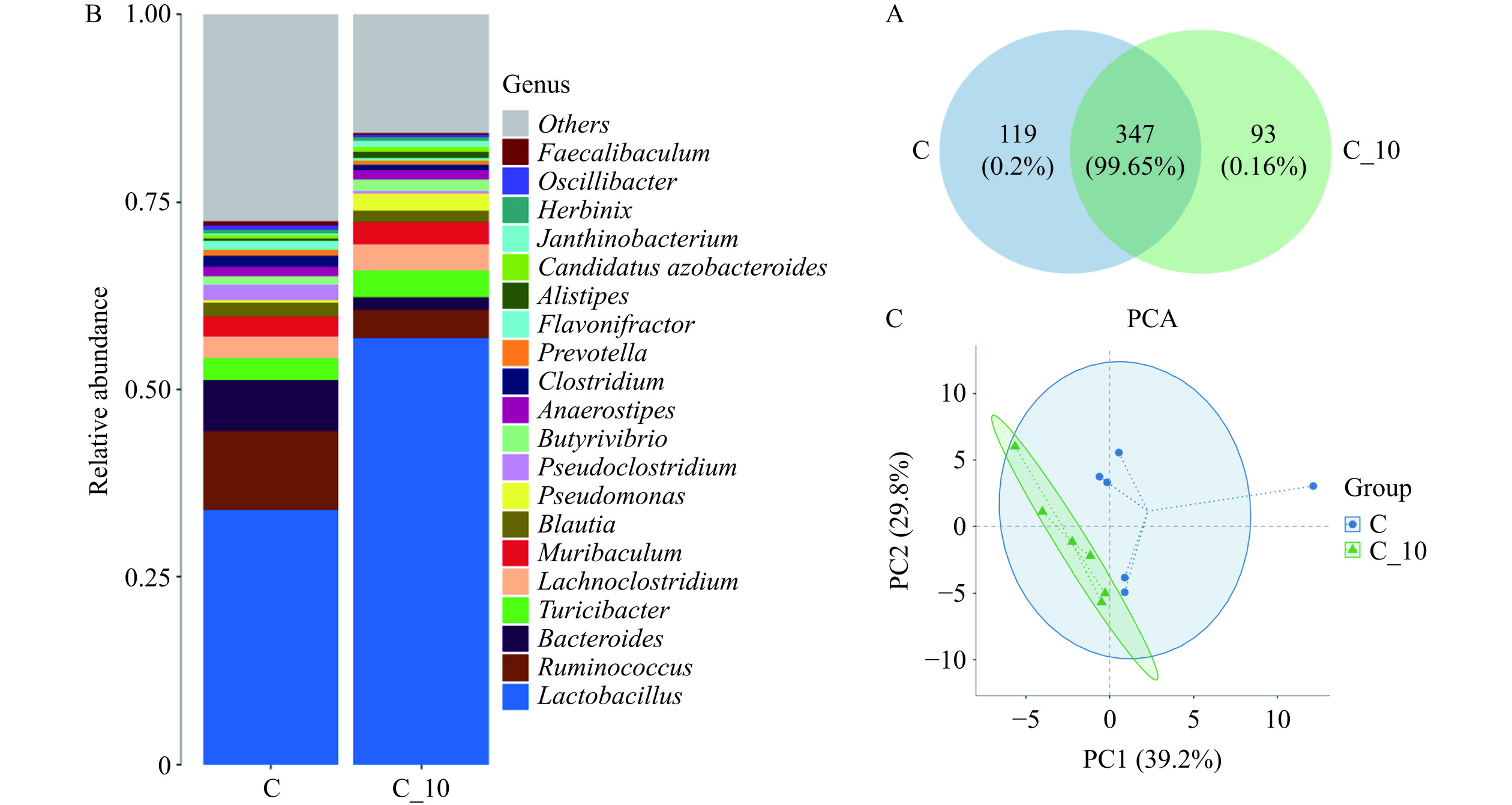
同时,从图8也可以看出,TBDNs组与正常组样本间共有的OUT数目占比高达99.65%(图8A),TBDNs处理组样本间特有的OUT数目共有93种。对不同处理间的β多样性分析结果如图8C,本实验基于主坐标 PCoA 分析表明,正常组的肠道微生物群落与TBDNs处理组虽然没有达到显著差异,但也可以看出其分布的不同,这可能受动物个体差异的影响较大。在属水平上可以看出,正常组与TBDNs组的肠道微生物群落组成比例有一定差异(图8B)。正常组的优势菌群有乳杆菌属Lactobacillus、瘤胃球菌属Ruminococcus、拟杆菌Bacteroides、苏黎世杆菌属Turicibacter和蓝绿藻菌属Lachnoclostridium。
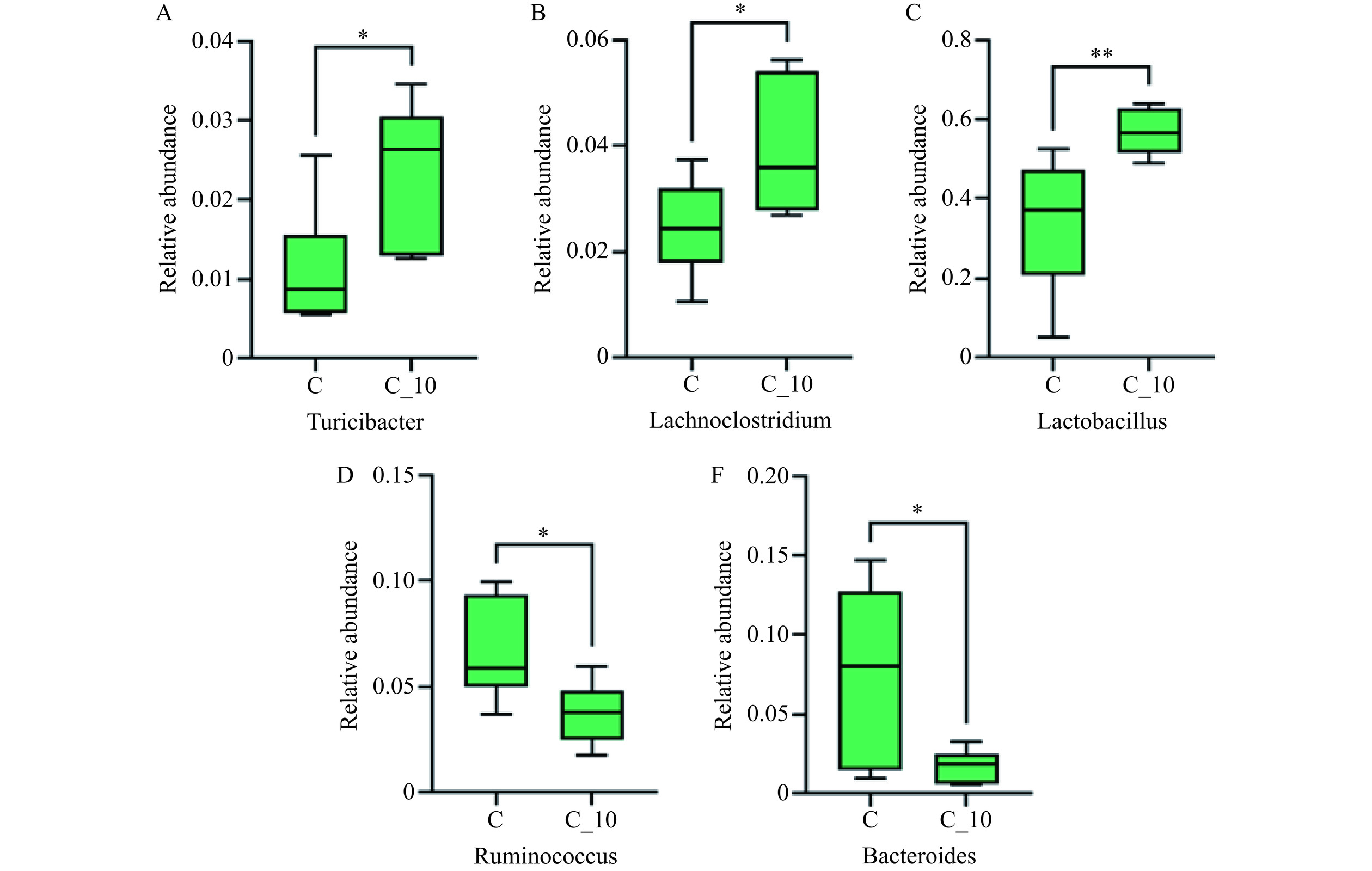
相比正常组,TBDNs组的乳杆菌属Lactobacillus、苏黎世杆菌属Turicibacter和蓝绿藻菌属Lachnoclostridium的相对丰度显著增加(P<0.05)(图9)。研究表明,Lactobacillus是一种益生菌,对人体健康有着重要的作用,具有抑制有害菌的生长,维护肠道菌群平衡,防止肠道感染和炎症的作用[20−21]。Lachnoclostridium与多种代谢性疾病的发生密切相关,包括肥胖、高血压、糖尿病等,其相对丰度与血糖水平呈负相关[22−25]。Lachnoclostridium是一种能够利用单糖和双糖产生乙酸的细菌,而乙酸可以通过抗炎和免疫抑制作用有效地稳定肠道内环境[22]。此外,乙酸还可以作为细菌的ATP产生的氧化产物,Lachnoclostridium的丰度与肠道内乙酸水平呈正相关,而且Lachnoclostridium还能够通过代谢L-谷氨酸来产生乙酸等短链脂肪酸,这些短链脂肪酸对于肾脏保护具有重要作用,如抗炎、抗动脉粥样硬化和抗氧化等[24]。因此,这些有益菌的增加具有潜在的健康效益。
本文的研究结果显示,TBDNs组中的瘤胃球菌属Ruminococcus的相对丰度显著降低(P<0.05)。研究发现,活跃期炎症性肠病(IBD)通常伴随着瘤胃球菌(Ruminococcus gnavus)的增加[26]。由于炎症促进黏膜氧化应激,这可能会形成土著微生物群落,有利于兼性厌氧菌的生长,如Ruminococcus gnavus[26],它被认为是IBD中改变的微生物群的重要菌群。此外,R. gnavus还与其他免疫相关疾病如儿童哮喘、婴儿湿疹、脊柱关节炎、系统性红斑狼疮、超重肥胖和一些代谢疾病(II型糖尿病、非酒精性脂肪肝等)有关,大部分研究认为,瘤胃球菌属与II型糖尿病呈正相关,但也有小部分研究结果不一致[27−35]。研究表明,在减肥手术和糖尿病缓解后,Ruminococcus bromii、Ruminococcus obeum丰度增加,而Ruminococcus torques丰度降低[36−38]。这些现象可能是由于瘤胃球菌偏好植物中的多糖,如果肠道中有过多的瘤胃球菌,细胞会吸收更多的糖,不可避免地导致体重增加[39]。因此,肠道中瘤胃球菌属的丰度会受到饮食的影响,但饮食的作用似乎很复杂,该复杂作用可能源于瘤胃球菌属的复杂构成。瘤胃球菌属包括有益菌和有害菌。例如,已知Ruminococcus bromii对健康具有有益效果。当长期食用水果和蔬菜时,瘤胃球菌属能够发酵复合糖类,产生乙酸酯、丙酸盐以及具有抗炎效益的丁酸盐[39]。而肉食会增加有害菌 Ruminococcus gnavus,部分瘤胃球菌属已被证明具有促炎性,除了肉食之外,高盐饮食、大豆、抗性淀粉也会增加瘤胃球菌的丰度[40−43]。
灌胃TBDNs也显著降低了拟杆菌属Bacteroides的丰度(P<0.05)。不同拟杆菌种类与不同炎症性肠病程度相关,炎症性肠病患者粪便微生物分析显示,拟杆菌门、厚壁菌门和疣微菌门的丰度下降,而变形菌门、放线菌门和梭杆菌门的丰度增加。在48名克罗恩病患者中,粪便样本中的拟杆菌细菌丰度不到健康个体的10%[44−46]。然而,大多数研究表明,拟杆菌因内毒素而表现出促炎特性,并影响细胞因子的产生,从而导致炎症性肠病[47]。总的来说,相对正常组,TBDNs的部分微生物发生了显著变化,但其对小鼠生理作用的影响是否存在因果关系仍需进一步验证、探明。
3. 结论
本文通过差速离心结合PEG沉淀法从苦荞中分离得到TBDNs。TBDNs呈典型的茶托型囊泡结构,平均粒径为182.8 nm,粒径主峰在162.8 nm。考察了正常饮食条件下添加TBDNs对小鼠生理生化及免疫的影响。结果表明,相对正常饮食组,TBDNs组小鼠体重、甘油三酯(TG)、尿酸(UA)、丙氨酸氨基转移酶(ALT)显著下降(P<0.01);天冬氨酸氨基转移酶(AST)、胆固醇(TC)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)以及肌酐(CREA)水平均未发生显著性变化(P>0.05);其它组织学指标、肠道屏障以及免疫组化(CD4、F480、MPO)指标未见显著改变(P>0.05)。肠道菌群分析发现,TBDNs的摄入还能提高肠道中一些有益菌如乳杆菌属Lactobacillus、苏黎世杆菌属Turicibacter和Lachnoclostridium的水平。综上所述,TBDNs的摄入对小鼠整体生理健康无显著影响,少量指标的变化是否与肠道微生态改变有关尚需验证,其生理意义亦需进一步阐明。未来可进一步加大摄入浓度,对TBDNs的吸收过程及引起的代谢变化进行深入研究。
-
-
[1] 彭镰心. 基于调节糖脂代谢效应的苦荞资源品质研究[D]. 成都:成都中医药大学, 2019. [PENG Lianxin. Study on the quality of tartary buckwheat resources based on the effect of regulating glucolipid metabolism[D]. Chengdu:Chengdu University of Traditional Chinese Medicine, 2019.] PENG Lianxin. Study on the quality of tartary buckwheat resources based on the effect of regulating glucolipid metabolism[D]. Chengdu: Chengdu University of Traditional Chinese Medicine, 2019.
[2] 刘钰. 苦荞来源的纳米颗粒对肠道微生物的影响及发酵饮料的研发[D]. 成都:成都大学, 2022. [LIU Yu. Effect of tartary buckwheat -derived nanoparticles (TBDNs) on gut microbiota and development of fermented beverages[D]. Chengdu:Chengdu University, 2022.] LIU Yu. Effect of tartary buckwheat -derived nanoparticles (TBDNs) on gut microbiota and development of fermented beverages[D]. Chengdu: Chengdu University, 2022.
[3] ZOU L, WU D, REN G, et al. Bioactive compounds, health benefits, and industrial applications of tartary buckwheat (Fagopyrum tataricum)[J]. Critical Reviews in Food Science and Nutrition,2023,63(5):657−673. doi: 10.1080/10408398.2021.1952161
[4] STEWART L K, WANG Z, RIBNICKY D, et al. Failure of dietary quercetin to alter the temporal progression of insulin resistance among tissues of C57BL/6J mice during the development of diet-induced obesity[J]. Diabetologia,2009,52(3):514−523. doi: 10.1007/s00125-008-1252-0
[5] JU S, MU J, DOKLAND T, et al. Grape exosome-like nanoparticles induce intestinal stem cells and protect mice from DSS-induced colitis[J]. Molecular Therapy,2013,21(7):1345−1357. doi: 10.1038/mt.2013.64
[6] PÉREZ-BERMÚDEZ P, BLESA J, SORIANO J M, et al. Extracellular vesicles in food:Experimental evidence of their secretion in grape fruits[J]. European Journal of Pharmaceutical Sciences,2017,98:40−50. doi: 10.1016/j.ejps.2016.09.022
[7] MU J, ZHUANG X, WANG Q, et al. Interspecies communication between plant and mouse gut host cells through edible plant derived exosome-like nanoparticles[J]. Molecular Nutrition & Food Research,2014,58(7):1561−1573.
[8] ZHANG M, VIENNOIS E, PRASAD M, et al. Edible ginger-derived nanoparticles:A novel therapeutic approach for the prevention and treatment of inflammatory bowel disease and colitis-associated cancer[J]. Biomaterials,2016,101:321−340. doi: 10.1016/j.biomaterials.2016.06.018
[9] BERGER E, COLOSETTI P, JALABERT A, et al. Use of nanovesicles from orange juice to reverse diet-induced gut modifications in diet-induced obese Mice[J]. Molecular Therapy Methods & Clinical Development,2020,18:880−892.
[10] MAN F, MENG C, LIU Y, et al. The study of ginger-derived extracellular vesicles as a natural nanoscale drug carrier and their intestinal absorption in rats[J]. AAPS PharmSciTech,2021,22(6):206. doi: 10.1208/s12249-021-02087-7
[11] 赵婉均. 蓝莓外泌体样纳米颗粒对肥胖小鼠肝细胞氧化应激的调节作用及机制研究[D]. 重庆:重庆理工大学, 2021. [ZHAO Wanjun. Blueberry-derived exosomes-like nanoparticles antagonize oxidative stress and its associated molecular mechanisms in the hepatocytes of HFD-fed mice[D]. Chongqing:Chongqing University of Technology, 2021.] ZHAO Wanjun. Blueberry-derived exosomes-like nanoparticles antagonize oxidative stress and its associated molecular mechanisms in the hepatocytes of HFD-fed mice[D]. Chongqing: Chongqing University of Technology, 2021.
[12] LIU Y, REN C, ZHAN R, et al. Exploring the potential of plant-derived exosome-like nanovesicle as functional food components for human health:A review[J]. Foods,2024,13(5):712. doi: 10.3390/foods13050712
[13] LIU Y, TAN M L, ZHU W J, et al. In vitro effects of tartary buckwheat-derived nanovesicles on gut microbiota[J]. Journal of Agricultural and Food Chemistry,2022,70(8):2616−2629. doi: 10.1021/acs.jafc.1c07658
[14] SURESH A P, KALARIKKAL S P, PULLAREDDY B, et al. Low pH-based method to increase the yield of plant-derived nanoparticles from fresh ginger rhizomes[J]. ACS Omega,2021,6(27):17635−17641. doi: 10.1021/acsomega.1c02162
[15] 李琰. 白藜芦醇通过调节肠道菌群和下调PPAR信号通路治疗酒精性脂肪肝的机制研究[D]. 辽宁:中国医科大学, 2022. [LI Yan. Study on the mechanism of resveratrol in the treatment of alcoholic fatty liver in mice by regulating gut microbiota and down regulating PPAR signaling pathway[D]. Liaoning:China Medical University, 2022.] LI Yan. Study on the mechanism of resveratrol in the treatment of alcoholic fatty liver in mice by regulating gut microbiota and down regulating PPAR signaling pathway[D]. Liaoning: China Medical University, 2022.
[16] PENG L, ZHANG Q, ZHANG Y, et al. Effect of tartary buckwheat, rutin, and quercetin on lipid metabolism in rats during high dietary fat intake[J]. Food Science & Nutrition,2020,8(1):199−213.
[17] 董志忠. 全谷物类产品的营养健康意义及产业发展机会[C]//粮食食品与营养健康产业发展科技论坛暨行业发展峰会, 2016. [DONG Zhizhong. The nutritional health significance and industrial development opportunities of whole grain products[C]//Conference on Grain Food and Nutritional Health Industry Development Technology Forum and Industry Development Summit, 2016.] DONG Zhizhong. The nutritional health significance and industrial development opportunities of whole grain products[C]//Conference on Grain Food and Nutritional Health Industry Development Technology Forum and Industry Development Summit, 2016.
[18] KONG C, YAN X, LIU Y, et al. Ketogenic diet alleviates colitis by reduction of colonic group 3 innate lymphoid cells through altering gut microbiome[J]. Signal Transduction and Targeted Therapy,2021,6(1):154. doi: 10.1038/s41392-021-00549-9
[19] XIE Z, XIE T, LIU J, et al. Glucokinase inactivation ameliorates lipid accumulation and exerts favorable effects on lipid metabolism in hepatocytes[J]. International Journal of Molecular Sciences,2023,24(5):4315. doi: 10.3390/ijms24054315
[20] LU F, LI Y, WANG X, et al. Early-life polyphenol intake promotes Akkermansia growth and increase of host goblet cells in association with the potential synergistic effect of Lactobacillus[J]. Food Research International (Ottawa, Ont),2021,149:110648. doi: 10.1016/j.foodres.2021.110648
[21] BORGONOVI T F, VIRGOLIN L B, JANZANTTI N S, et al. Fruit bioactive compounds:Effect on lactic acid bacteria and on intestinal microbiota[J]. Food Research International (Ottawa, Ont),2022,161:111809. doi: 10.1016/j.foodres.2022.111809
[22] MIAO J, CUI H T, WANG L, et al. Effects of evodiamine on carbon tetrachloride-induced liver fibrosis mice based on modulating gut microbiota[J]. Chinese Journal of Industrial Hygiene and Occupational Diseases,2021,39(6):401−406.
[23] PENG M, WANG L, SU H, et al. Ginsenoside Rg1 improved diabetes through regulating the intestinal microbiota in high-fat diet and streptozotocin-induced type 2 diabetes rats[J]. Journal of Food Biochemistry,2022,46(10):e14321.
[24] CAI Y Y, HUANG F Q, LAO X, et al. Integrated metagenomics identifies a crucial role for trimethylamine-producing Lachnoclostridium in promoting atherosclerosis[J]. NPJ Biofilms and Microbiomes,2022,8(1):11. doi: 10.1038/s41522-022-00273-4
[25] WANG G, ZHANG Y, ZHANG R, et al. The protective effects of walnut green husk polysaccharide on liver injury, vascular endothelial dysfunction and disorder of gut microbiota in high fructose-induced mice[J]. International Journal of Biological Macromolecules,2020,162:92−106. doi: 10.1016/j.ijbiomac.2020.06.055
[26] LLOYD-PRICE J, ARZE C, ANANTHAKRISHNAN A N, et al. Multi-omics of the gut microbial ecosystem in inflammatory bowel diseases[J]. Nature,2019,569(7758):655−662. doi: 10.1038/s41586-019-1237-9
[27] ZHENG H, LIANG H, WANG Y, et al. Altered gut microbiota composition associated with eczema in infants[J]. PloS One,2016,11(11):e0166026. doi: 10.1371/journal.pone.0166026
[28] AZZOUZ D, OMARBEKOVA A, HEGUY A, et al. Lupus nephritis is linked to disease-activity associated expansions and immunity to a gut commensal[J]. Annals of the Rheumatic Diseases,2019,78(7):947−956. doi: 10.1136/annrheumdis-2018-214856
[29] BREBAN M, TAP J, LEBOIME A, et al. Faecal microbiota study reveals specific dysbiosis in spondyloarthritis[J]. Annals of the Rheumatic Diseases,2017,76(9):1614−1622. doi: 10.1136/annrheumdis-2016-211064
[30] CHUA H H, CHOU H C, TUNG Y L, et al. Intestinal dysbiosis featuring abundance of Ruminococcus gnavus associates with allergic diseases in infants[J]. Gastroenterology,2018,154(1):154−167. doi: 10.1053/j.gastro.2017.09.006
[31] HUANG C, LI Y, FENG X, et al. Distinct gut microbiota composition and functional category in children with cerebral palsy and epilepsy[J]. Frontiers in Pediatrics,2019,7:394. doi: 10.3389/fped.2019.00394
[32] GRAHNEMO L, NETHANDER M, COWARD E, et al. Cross-sectional associations between the gut microbe Ruminococcus gnavus and features of the metabolic syndrome[J]. The lancet Diabetes & Endocrinology,2022,10(7):481−483.
[33] LUKIĆ I, GETSELTER D, ZIV O, et al. Antidepressants affect gut microbiota and Ruminococcus flavefaciens is able to abolish their effects on depressive-like behavior[J]. Translational Osychiatry,2019,9(1):133. doi: 10.1038/s41398-019-0466-x
[34] WANG L, CHRISTOPHERSEN C T, SORICH M J, et al. Increased abundance of Sutterella spp. and Ruminococcus torques in feces of children with autism spectrum disorder[J]. Molecular Autism,2013,4(1):42. doi: 10.1186/2040-2392-4-42
[35] HENKE M T, KENNY D J, CASSILLY C D, et al. Ruminococcus gnavus, a member of the human gut microbiome associated with Crohn's disease, produces an inflammatory polysaccharide[J]. Proceedings of the National Academy of Sciences of the United States of America,2019,116(26):12672−12677.
[36] MURUGESAN S, ULLOA-MARTÍNEZ M, MARTÍNEZ-ROJANO H, et al. Study of the diversity and short-chain fatty acids production by the bacterial community in overweight and obese Mexican children[J]. European Journal of Clinical Microbiology and Infectious Diseases,2015,34(7):1337−1346. doi: 10.1007/s10096-015-2355-4
[37] VERDAM F J, FUENTES S, DE JONGE C, et al. Human intestinal microbiota composition is associated with local and systemic inflammation in obesity[J]. Obesity (Silver Spring, Md),2013,21(12):E607−15.
[38] KASAI C, SUGIMOTO K, MORITANI I, et al. Comparison of the gut microbiota composition between obese and non-obese individuals in a Japanese population, as analyzed by terminal restriction fragment length polymorphism and next-generation sequencing[J]. BMC Gastroenterology,2015,15:100. doi: 10.1186/s12876-015-0330-2
[39] 刘巧红, 赵瑜, 胡义扬. 饮食对非酒精性脂肪性肝病肠道微生物菌型相关菌群的影响[J]. 临床肝胆病杂志,2021,37(4):4. [LIU Q H, ZHAO Y, HU Y Y. Effect of diet on enterotype-related gut microbiota in nonalcoholic fatty liver disease[J]. Journal of Clinical Hepatol,2021,37(4):4.] doi: 10.3969/j.issn.1001-5256.2021.04.046 LIU Q H, ZHAO Y, HU Y Y. Effect of diet on enterotype-related gut microbiota in nonalcoholic fatty liver disease[J]. Journal of Clinical Hepatol, 2021, 37(4): 4. doi: 10.3969/j.issn.1001-5256.2021.04.046
[40] KULATHUNGA J, SIMSEK S. A review:Cereals on modulating the microbiota/metabolome for metabolic health[J]. Current Nutrition Reports,2022,11(3):371−385. doi: 10.1007/s13668-022-00424-1
[41] MARCELINO G, HIANE P A, FREITAS K C, et al. Effects of olive oil and its minor components on cardiovascular diseases, inflammation, and gut microbiota[J]. Nutrients,2019,11(8):1826. doi: 10.3390/nu11081826
[42] TORAL M, ROBLES-VERA I, DE LA VISITACIÓN N, et al. Role of the immune system in vascular function and blood pressure control induced by faecal microbiota transplantation in rats[J]. Acta Physiologica (Oxford, England),2019,227(1):e13285. doi: 10.1111/apha.13285
[43] ZHANG L, OUYANG Y, LI H, et al. Metabolic phenotypes and the gut microbiota in response to dietary resistant starch type 2 in normal-weight subjects:A randomized crossover trial[J]. Scientific Reports,2019,9(1):4736. doi: 10.1038/s41598-018-38216-9
[44] STOJANOV S, BERLEC A, ŠTRUKELJ B. The influence of probiotics on the Firmicutes/Bacteroidetes ratio in the treatment of obesity and inflammatory bowel disease[J]. Microorganisms,2020,8(11):1715. doi: 10.3390/microorganisms8111715
[45] ZAFAR H, SAIER M H. Gut Bacteroides species in health and disease[J]. Gut Microbes,2021,13(1):1−20.
[46] YOSHIDA N, EMOTO T, YAMASHITA T, et al. Bacteroides vulgatus and Bacteroides dorei reduce gut microbial lipopolysaccharide production and inhibit atherosclerosis[J]. Circulation,2018,138(22):2486−2498. doi: 10.1161/CIRCULATIONAHA.118.033714
[47] CAO Y, WANG Z, YAN Y, et al. Enterotoxigenic Bacteroides fragilis promotes intestinal inflammation and malignancy by inhibiting exosomes-packaged miR-149-3p[J]. Gastroenterology,2021,161(5):1552−1566. doi: 10.1053/j.gastro.2021.08.003





 下载:
下载:

 下载:
下载:
