Food-grade High Internal Phase Pickering Emulsions: Food-grade Solid Particles, Stabilization Mechanisms and Application in Encapsulating Probiotics
-
摘要: 益生菌是一类具有增强免疫力、调节肠道菌群等多种有益生理作用的活性微生物。然而,益生菌对环境的高度敏感性使其在生产、储存和使用过程中很容易失活。高内相Pickering乳液(High internal phase Pickering emulsions,HIPPEs)液滴的微观结构能容纳油相中的益生菌,可以避免其与水接触失活从而提高存活率。本文首先阐述了稳定Pickering乳液的各类食品级固体颗粒及其稳定机制,主要包括固体颗粒在两相界面上的润湿性、空间位阻机理以及三维网络机理三个方面;然后进一步对HIPPEs在益生菌包埋中的应用进行综述,重点分析了不同类型HIPPEs之间对益生菌包埋、递送的特点及区别;最后对HIPPEs的发展前景及未来的研究方向进行了展望,以期为开发益生菌包埋技术提供理论基础和新思路。
-
关键词:
- 高内相Pickering乳液 /
- 食品级固体颗粒 /
- 益生菌 /
- 包埋技术 /
- 存活率
Abstract: Probiotics are live microorganisms that provide various health benefits, such as enhancing immune function and regulating gut microbiota. However, their high sensitivity to environmental conditions makes them prone to inactivation during production, storage, and use. The microstructure of high internal phase Pickering emulsions (HIPPEs) droplets can accommodate probiotics in the oil phase, protecting them from contact with water and thereby improving their survival rate. Here, the various types of food-grade solid particles used to stabilize Pickering emulsions and their mechanisms are firstly reviewed in this paper, including wetting properties at the interface, steric hindrance mechanisms, and three-dimensional network mechanisms. Furthermore, the application of HIPPEs in probiotic encapsulation is elaborated, focusing on the characteristics and differences of various types of HIPPEs in terms of probiotic encapsulation and delivery. Finally, the development prospects and future research directions of HIPPEs are discussed, aiming to provide a theoretical basis and new ideas for the development of probiotic encapsulation technologies. -
益生菌被世界卫生组织(WHO)定义为一种有活力的微生物,当给予足够的量时,特别是与肠道菌群平衡时,可以提供许多健康益处[1]。常见的益生菌包括双歧杆菌(Bifidobacterium)、乳杆菌(Lactobacillus)以及酵母(Yeasts)等。长期摄入益生菌可以调节肠道菌群,抑制有害细菌的繁殖,并加强人体的自然防御系统,降低胃肠道等疾病的发病率,从而达到促进健康的作用[2−3]。益生菌释放到人体肠道内的活菌数至少要达到106 CFU/g以上,才能发挥其益生效果[4]。然而,益生菌对温度、湿度、pH等环境因素极度敏感,在生产、加工、贮藏以及递送过程中容易失活,这些都极大地限制其发挥生物活性。因此对益生菌进行保护以提高它的稳定性及存活率非常重要,而包埋技术则是目前有效方法之一。
Pickering乳液是以固体颗粒代替传统乳化剂制成的新型乳状液[5],当油相体积分数高于74%时,在合适的制备条件下通过乳化剂的作用会形成高内相乳液(High internal phase emulsions,HIPEs),由固体颗粒稳定的HIPEs为高内相Pickering乳液(High internal phase Pickering emulsions,HIPPEs),其广泛应用于包埋活性物质[6]、替代饱和脂肪酸和氢化油[7]、制备多孔材料[8]等。与普通的乳液相比,半固体状态的HIPPEs流动性更低并且不易发生相变,具有更好的稳定性[9]。同时HIPPEs具有较高的油相体积分数,其O/W型的液滴结构可以将益生菌容纳在油相中,从而表现出提高益生菌存活率和限制其与水接触的优势[10]。
在过去的几年中,关于HIPPEs相关的研究很多,但利用HIPPEs包埋益生菌的研究却很少见到。因此本文综述了可用于稳定食品级HIPPEs的食品级固体颗粒,如蛋白质、多糖和复合颗粒等,通过固体颗粒的界面吸附、空间位阻、三维网络等原理解释了乳液的稳定机理及其在益生菌包埋中的应用,旨在展望未来的发展方向,为开发功能性更强的乳液及益生菌包埋技术提供理论基础和新思路。
1. 稳定HIPPEs的食品级固体颗粒
近年来,许多蛋白质、多糖以及复合物等食品级固体颗粒被用于稳定HIPPEs,它们作为一种新兴的固体颗粒,来源广泛,可生物降解,因此在食品中备受关注。但是一些固体颗粒由于其倾向于被水相浸湿而无法吸附在油-水界面上形成界面膜,因此通常需要对其进行改性以改善两亲性,使其在油-水界面上能更好地吸附,从而稳定HIPPEs[11]。
1.1 蛋白质
蛋白质作为一种天然聚合物,是食品中重要的营养成分。它们具有生物相容性、生物降解性、良好的两亲性等优点,常被用作乳化剂,根据不同的制备条件(不同的pH或油相体积等)可以制备出具有不同流变特性的HIPPEs。
1.1.1 动物蛋白
酪蛋白、乳清蛋白以及明胶等动物蛋白,都是制备固体颗粒的优质原料,固体颗粒随后可用于稳定HIPPEs。通过酸诱导[12]、热诱导[13]和离子处理[14]等方法可以改变蛋白的性质,使其更好地稳定HIPPEs。例如,未修饰的酪蛋白在0.2%~2%范围内只能稳定油相体积20%的乳液[15],而经过pH修饰后的酪蛋白能原位分散成纳米颗粒,从而可以制备出具有不同流变性能的凝胶型HIPPEs[16]。乳清分离蛋白(Whey protein isolate,WPI)稳定的HIPPEs已被证明具有一定的稳定性[17],当对WPI进行加热后,WPI中的球状蛋白会不可逆地变性并聚集形成微凝胶颗粒,可以用来制备HIPPEs[18]。与使用WPI或吐温20(Tween 20)制备的HIPEs相比,WPI微凝胶颗粒所制备的凝胶型HIPPEs稳定性和黏弹性明显增加,屈服应力、临界应力、复合模量和弹性模量也都有了显著提高[19]。明胶价格低、来源广,有良好的胶凝性,Tan等[20]通过两步脱溶法制备出了明胶纳米颗粒,并用明胶和明胶纳米颗粒一起作为乳化剂制备了具有可调节液滴大小分布和流变性能的HIPPEs,这类HIPPEs形成的多孔支架具有较好的生物相容性和细胞黏附特性,在生物医学工程中具有潜在的应用价值。
疏水蛋白由于其两亲性而具有高度的表面活性,可以通过自组装的方式在不同的亲疏水界面形成具有双亲性的蛋白膜,从而反转界面的性质,是一种良好的Pickering乳化剂[21]。例如酪蛋白作为牛奶中最主要的疏水蛋白,溶解性较差,但它的水解产物疏水多肽可对壳聚糖进行改性,改性后的产物可作为乳化剂,同时还赋予乳液一定的功能特性,如抗氧化性等[22]。它这种高度的表面活性能够改变其融合疏水蛋白的疏水性,因此在对蛋白改性及应用于多种分散系统方面具有潜在的能力,但是一些疏水蛋白的溶解性较差,且界面组装所需时间较长,这使得它们在食品应用方面受限。在未来,我们应该致力于寻找更有效的两亲性物质来改善这种蛋白的溶解度,加速界面组装,以促进疏水蛋白在食品工业的广泛应用。
1.1.2 植物蛋白
蛋白质微凝胶颗粒是蛋白质修饰的产物,这些颗粒具有独特的物理化学性质和结构特征。大豆分离蛋白(Soybean protein isolate,SPI)主要由11S和7S球蛋白组成,这些球蛋白大多处于聚集状态。Liu等[23]研究证明,通过对SPI进行热处理,可以使聚集状态的球蛋白转化为纳米结构的SPI微凝胶颗粒,然后将其作为乳化剂可用于稳定HIPPEs,这是第一个发现热诱导大豆蛋白聚集体具有作为Pickering乳液乳化剂的良好潜力的研究,为后面SPI的发展和应用奠定了基础。除了热处理,酸诱导的SPI微凝胶颗粒也具有稳定HIPPEs的能力[12]。β-伴大豆球蛋白(β-conglycinin,β-CG)是大豆蛋白的主要成分之一,通过调节颗粒的pH可以制备由低浓度(0.2wt%) β-CG颗粒稳定的HIPPEs,并且随着β-CG颗粒浓度的增加,HIPPEs的热稳定性和储存稳定性都得到了显著的提高[24]。
蛋白质微凝胶稳定的HIPPE在食品中也具有广泛应用的潜力,例如花生蛋白微凝胶颗粒可以制备油相比例高达87%和88%的食品级HIPPEs,当内相为食用油时,可获得替代部分氢化油(Partially hydrogenated oils,PHOs)的可食用材料[7],当内相为正己烷时,HIPPEs可作为模板制备多孔材料。这对于一些生物安全要求高的领域,如食品和组织工程,具有很大的意义。除此之外,研究报道反溶剂法制备的麦胶蛋白胶体颗粒(Gliadin colloidal particles,GCPs)能够作为稳定剂制备HIPPEs,将液态油转化为固体状乳液凝胶,可用于替代食品配方中的固体脂肪,而不引入反式脂肪和饱和脂肪,为未来的基础研究指明了新的方向[25]。
1.2 多糖
多糖广泛存在于自然界中,包括动物、植物和微生物等。一些天然多糖(如淀粉[26]、纤维素[27]、甲壳素[28]等)的乳化性能并不是很理想,通过纳米沉淀、酶水解、酸水解、化学修饰等方法修饰改性后可以稳定HIPPEs,如改性淀粉、壳聚糖和纳米纤维素等。其中,辛烯基丁二酸酐(Octenyl succinic anhydride,OSA)与淀粉的酯化反应是应用最广泛的改性方法,OSA是疏水性的,淀粉是亲水性的,经OSA改性后淀粉具有两亲性[29]。Wang等[30]利用纳米沉淀法制备的纳米淀粉晶体成功制备了包埋β-胡萝卜素的HIPPEs,随着淀粉浓度的增加,HIPPEs也更加稳定。天然纤维素是一种亲水性多糖,但是乳化能力欠缺。Chen等[31]通过结合OSA和纤维素纳米晶体(Cellulose nanocrystals,CNCs),增强了它们的疏水性和表面活性,然后在低浓度下制备出了稳定的食品级HIPPEs。CNCs由于其独特的纳米结构、两亲性以及生物相容性等特点,在绿色食品工业中具有很大的潜力。
除以上提到的两种多糖外,甲壳素纳米颗粒也具有稳定HIPPEs的能力[32]。甲壳素,又称几丁质,是一种线性多糖,具有很好的生物相容性,是各种海洋无脊椎动物外骨骼的主要结构成分[33]。为了扩大其应用范围,可以通过酸水解、酶水解等方法将甲壳素转化为壳聚糖、甲壳素纳米晶体(Chitin nanocrystals,ChNCs)、甲壳素纳米纤维(Chitin nanofibers,ChNFs)等[34]。ChNCs可以作为乳化剂稳定HIPPEs[32]。壳聚糖是由甲壳素通过脱乙酰化得到的一类多糖,含有大量的氨基和羟基,在中性条件下,不溶于水但易溶于稀酸水溶液。当pH低于其pKa(<6.5),氨基会发生质子化,表面活性较差无法稳定乳液。当pH接近6.5和碱性条件(pH>9)下,氨基基团去质子化,表面电荷降低,壳聚糖会自组装成胶体颗粒,吸附在油水界面稳定Pickering乳液[35]。与天然的壳聚糖相比,疏水改性后的壳聚糖微凝胶具有更高的疏水性,且在质量分数为0.05%时就可以稳定油相体积分数高达90%的HIPPEs[36]。
1.3 复合物
单一的蛋白质或者多糖颗粒往往本身乳化性能较差,不足以作为HIPPEs的稳定剂,有时单纯的利用化学方法进行改性并不符合绿色食品的要求。蛋白质和多糖之间能通过静电吸引、氢键或者疏水作用等物理作用力结合在一起,从而达到对乳液的稳定效果。复合颗粒包括蛋白质-多糖、蛋白质-蛋白质以及多糖-多糖等。
1.3.1 蛋白质-多糖
蛋白质和多糖作为来源丰富的天然材料,将它们复合在一起往往比单个组分更能稳定HIPPEs。例如,当玉米醇溶蛋白纳米颗粒(Zein)作为固体颗粒乳化剂时,由于其表面润湿性较差,往往是不稳定的,而阿拉伯胶(Arabic gum,GA)作为两亲性多糖,可以通过静电吸引和疏水相互作用与Zein结合成新的纳米颗粒,进而制备出性能优异的HIPPEs[37]。此外,GA还可以与麦胶蛋白纳米颗粒(Gliadin nanoparticles,GNP)结合,形成有效的乳化剂,用GNP/GA稳定的HIPPEs比单独用GNP稳定的HIPPEs具有更高的表观粘度、储能模量和成乳稳定性。这种复合颗粒稳定的HIPPEs因其良好的稳定性和传递生物活性物质的功能而受到广泛关注[38]。Zeng等[39]通过抗溶剂法在pH5.0条件下制备了麦胶蛋白-壳聚糖复合颗粒。在较低的颗粒浓度下,制备出了内相体积高达83%的HIPPEs。
1.3.2 蛋白质-蛋白质
蛋白质-蛋白质复合物通常是通过静电吸引结合在一起的,通过控制复合物的配比及pH等条件,可以制备出不同状态的HIPPEs。抗溶剂法制备的颗粒具有更好的蛋白质构象、表面活性和凝胶强度,其稳定的HIPPEs具有良好的液滴大小和热稳定性[40]。Liu等[41]通过反溶剂法合成了玉米蛋白-麦胶蛋白复合颗粒(Zein-gliadin complex particles,ZGCP),与单一的Zein或Gliadin相比,ZGCP倾向于在液滴周围形成致密的界面膜,且乳液液滴尺寸更小,从而使ZGCP稳定的乳液具有更高的黏弹性和更好的抗聚集稳定性。核桃蛋白(Walnut proteins,WPs)和大米蛋白(Rice proteins, RPs)本质上都是疏水性的,并且易于形成聚集体。Wang等[42]设计了双重蛋白质纳米结构(Dual ldual protein nanostructures,DPNs),其中WPs表现为纳米颗粒,RPs作为桥梁将纳米颗粒连接到3D网络中,DPNs制备的HIPPEs在95 ℃下加热30 min和储存2个月后保持稳定。此外,还开发了一种冻融稳定性优于商业蛋黄酱的植物性核桃酱,这种HIPPEs具有可调节的流变特性,以及对长期储存,加热和冻融的优异稳定性,可能是未来食品中植物性质地和感官材料的潜在替代品。
1.3.3 多糖-多糖
与蛋白质-蛋白质复合物类似,多糖-多糖复合物主要由带相反电荷的多糖之间的静电相互作用形成。壳聚糖作为天然阳离子多糖,常与阴离子多糖静电络合来稳定HIPPEs。支链淀粉是淀粉颗粒的主要成分,Pang等[43]以双醛支链淀粉和壳聚糖为原料,在超声波的辅助下,采用希夫碱反应制备了双醛支链淀粉/壳聚糖复合纳米粒子(Dialdehyde amylopectin/chitosan complex nanoparticles,DAPCNPs),所制得的DAPCNPs可用于稳定O/W型HIPPEs。带负电的阴离子OSA-淀粉可以与壳聚糖结合形成静电配合物,从而制备稳定凝胶状结构的HIPPEs,具有良好的离心和氧化稳定性[44]。这些结果为制备基于多糖的HIPPEs递送体系提供了有益的信息,有助于扩大其在食品工业中的应用。
2. 食品级固体颗粒稳定HIPPEs的稳定机制
2.1 食品级固体颗粒在两相界面上的润湿性
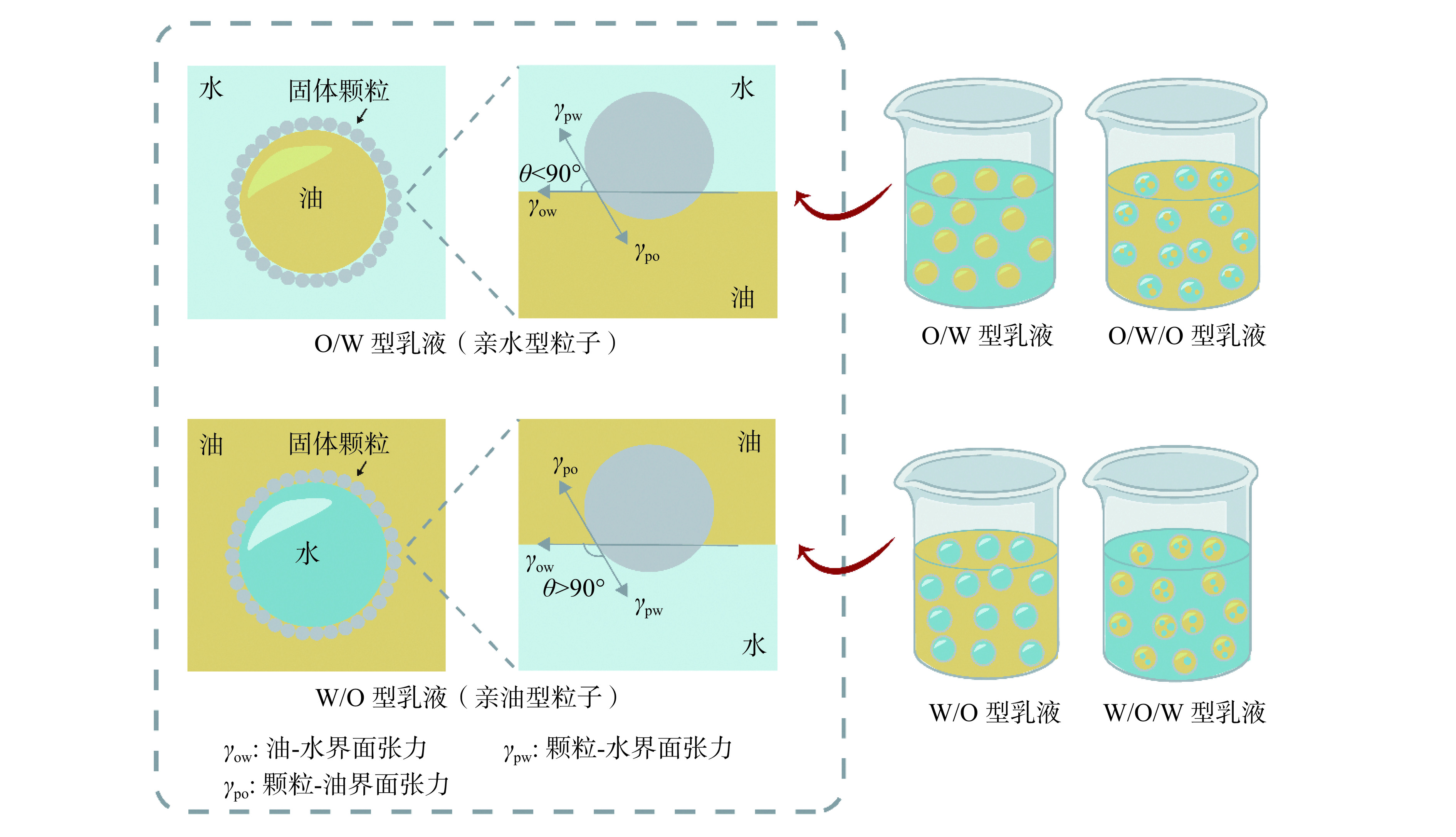
食品级固体颗粒在体系中同时受到油相和水相的润湿,它作为乳化剂的前提是能够被两相同时润湿且不完全溶于乳液任何一相[45]。颗粒与水相的接触角被称为三相接触角(θ),是反映颗粒润湿性的重要参数,也是判断乳液类型以及颗粒是否能够稳定乳液的重要条件。如果θ小于90°,表现为亲水性,则形成O/W型乳液,反之形成W/O型乳液。当θ=90°时,固体颗粒表现为两亲性,不仅能有效吸附在液滴表面,还能形成位阻抑制油滴的聚集,从而形成最稳定的Pickering乳液。当θ为0°或180°时,固体颗粒变得极度亲水或疏水,不能形成稳定的乳液[11]。除此之外还有多重乳液,如W/O/W型和O/W/O型等。前者为互不相溶的油相将两个水相隔开,后者为互不相溶的水相将两个油相隔开,如图1所示。
与单一Gliadin颗粒的θ相比,经OSA改性后的Gliadin(OGNPs)的θ和平均尺寸都明显增加,当OSA的浓度为6%时,θ达到87.6°,此时OGNPs具有良好的乳化性[46]。共聚焦激光扫描显微镜(Confocal laser scanning microscopy,CLSM)图像显示,OGNP能够吸附在油水界面上,并在油滴表面形成致密层,在14 d的储存期内表现出良好的稳定性。Li等[47]采用反溶剂沉淀法成功制备了麦醇溶蛋白-壳聚糖复合胶体颗粒,二者通过氢键和疏水相互作用结合在一起,θ从116.5°变为89.3°,CLSM图像显示二者质量比2:1时在油/水界面处吸附,有助于形成空间位阻抑制液滴聚集从而稳定乳液。因此,当固体颗粒的乳化性能不足以稳定乳液时,可以对固体颗粒进行复合或对表面进行改性来改善其两相润湿性,使θ接近90°,从而形成稳定的HIPPEs。
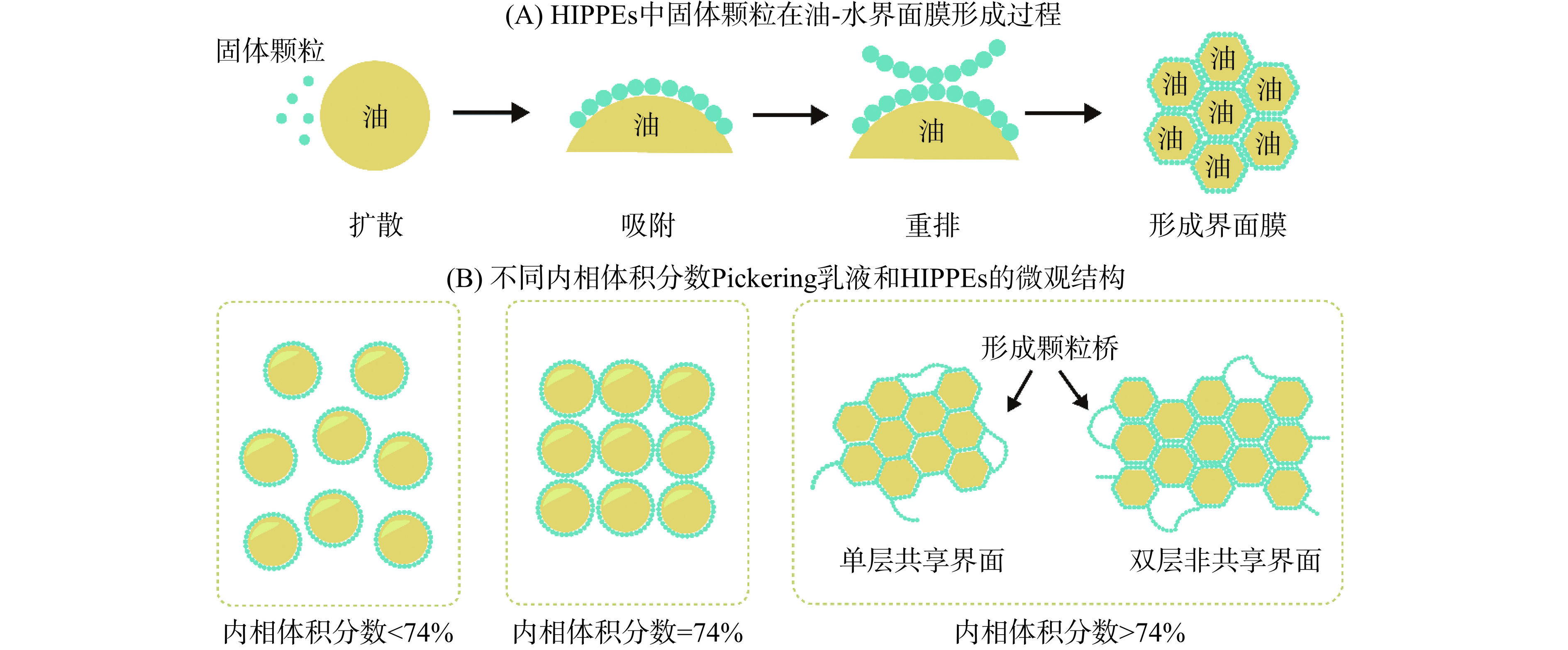
2.2 食品级固体颗粒的空间位阻机理
传统乳液的稳定往往是通过小分子表面活性剂吸附在油-水界面处并定向排列形成界面膜,从而降低油相和水相之间的界面张力来实现的。而固体颗粒并不会引起界面张力的大幅降低,而是倾向于吸附到油-水界面,然后定向排列形成一层或多层界面膜,进而改变颗粒间的空间位阻来抑制液滴聚集,最终实现乳液的稳定[48],如图2(A)所示。Sun等[49]通过实验发现SPI与羧甲基纤维素(Carboxymethyl cellulose sodium,CMC)结合后,SPI和CMC之间发生相互作用,形成了结构致密、界面润湿性良好的复合物,成功制备了性能良好的HIPPEs。此外,固体颗粒的乳化性往往还会受到很多因素的影响,如颗粒浓度、表面润湿性、表面电荷等。Liu等[50]通过加热和静电筛选复合处理制备了SPI纳米颗粒,并研究了蛋白浓度和乳化工艺变化对纳米颗粒的影响。结果显示,蛋白浓度的增加有利于颗粒在两相界面处的扩散和吸附,从而促进其形成液滴更小的乳液,提高成乳稳定性。这表明通过改变纳米颗粒的浓度、性质以及乳化工艺等可以制备出具有不同性能的乳液,在新型功能食品配方中具有良好的应用潜力。
2.3 食品级固体颗粒的三维网络机理
除了形成界面膜,固体颗粒间相互作用还会形成三维网络结构,进而增加连续相黏度,提高乳液稳定性。在固体颗粒稳定的HIPPEs中,当颗粒数量能够覆盖所有乳液液滴时,可以起到空间稳定的作用;当颗粒数量不足以覆盖所有液滴时,稀疏的颗粒会在相邻液滴之间形成颗粒桥,从而起到稳定乳液的作用[51]。当内相体积分数≤74%,液滴通常以球形存在,而当内相体积分数>74%时,超过了以刚性球体紧密排列堆积的最大几何限制,液滴会相互挤压在一起,从而呈现出多面体几何形状,如图2(B)所示。
Wang等[52]研究了魔芋葡甘露聚糖(Konjac glucomannan,KGM)对肌纤维蛋白(Myofibrillar protein,MP)结构和界面吸附的影响,以及KGM对HIPPEs共乳化的机理。结果显示:KGM能够促进MP结构的展开,提高MP的润湿性,使θ从73.69°(对照)增加到89.41°(0.5% KGM)。此外,KGM通过氢键连接MP,诱导其形成更密集的MP网络结构,形成了更强的空间位阻来抑制油滴聚集,提高了HIPPEs的储存稳定性和储能模量。该研究表明KGM可以通过改变界面吸附和网络结构来调节MP稳定化HIPPEs的物理性质。
一些天然蛋白需要修饰以提高其乳化性,研究显示,半乳糖(Gal)糖基化的牛血清白蛋白(Bovine serum albumin,BSA)具有更强的结构完整性和更高的再折叠能力,比天然BSA具有更好的乳化性能和稳定性,这种改善的潜在机制很大程度上与糖基化BSA中形成的核-壳纳米结构有关,该结构在蛋白核周围形成亲水性Gal壳[53]。基于此,Xu等[54]以BSA和海藻糖为材料,形成了由海藻糖层包裹BSA的核-壳纳米结构颗粒,这些颗粒在液滴之间形成颗粒桥以稳定HIPPEs。
3. HIPPEs在包埋益生菌中的应用
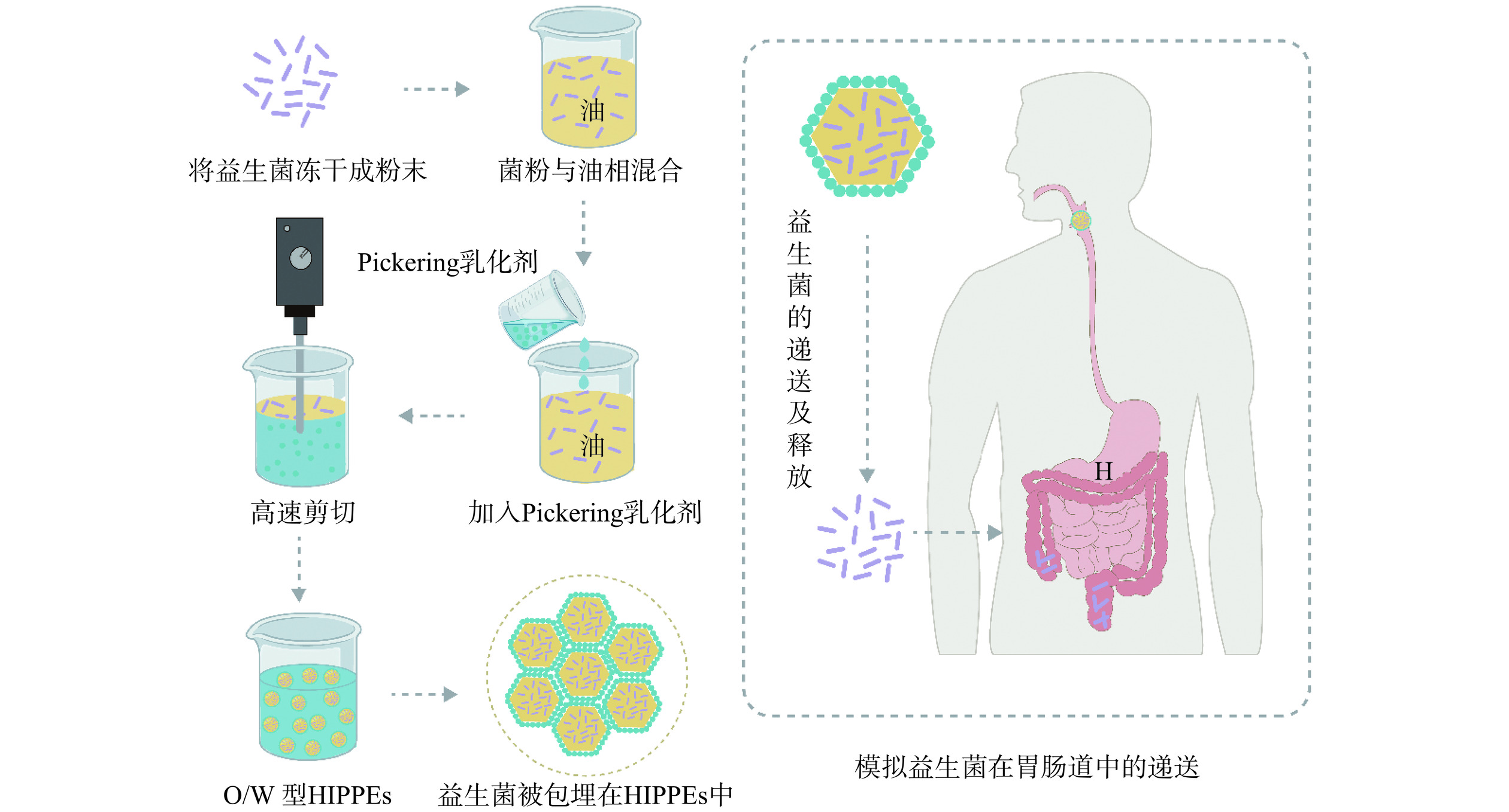
包埋是利用物理化学方法通过壁材将益生菌进行包裹,保护益生菌免受外界不利因素,提高菌体稳定性的有效方法[55]。影响益生菌活力的关键因素通常被认为是低相对湿度和温度[56]。而食品通常在水环境中,当添加干燥的益生菌时,水会以极快的速度渗透到干燥的菌粉中,从而导致益生菌的失活甚至死亡。基于上述要求,乳液似乎是提高益生菌存活率的理想载体。乳液的液滴结构可以容纳油相中的益生菌,有利于避免食品加工过程中的潮湿环境。其原理是将粉末状的菌粉与油相或水相混合均匀后,加入用作稳定剂的固体颗粒,经过高速剪切、高压均质等方式,固体颗粒吸附于油水界面表面形成膜,从而起到稳定乳液的作用[57]。以O/W型HIPPEs为例,制备流程图如图3所示。
W/O型和O/W型是两种常见的Pickering乳液类型。与小分子表面活性剂稳定的乳液相比,Pickering乳液表现出明显的优势。例如,将德氏乳杆菌(Lactobacillus dellbrueckii,L. dellbrueckii)包埋在Pickering W1/O/W2双乳液的内水相中,结果显示与Tween 80相比,以β-环糊精为乳化剂可以显著提高益生菌的存活率。尽管Tween 80稳定的双乳具有长期稳定性,但β-环糊精的高细胞存活率表明,固体颗粒稳定的Pickering乳液是益生菌包埋的更好选择[58]。除Pickering乳液包埋益生菌外,HIPPEs也是实用的益生菌输送系统。与传统表面活性剂稳定的HIPEs相比,HIPPEs所需的稳定剂更少,并且HIPPEs具有更高的油相体积、更强的抗凝聚稳定性、更高的储存稳定性等。
3.1 O/W型HIPPEs对益生菌的包埋及递送
O/W型是最常见的乳液类型,通过将益生菌分散在油相中构建低含水率的O/W型乳液中,可以达到较好的隔湿效果,防止益生菌因被水活化而失去活性[59]。选择合适的乳化剂和其他稳定剂来制备HIPPEs是很重要的,Su等[10]用WPI微凝胶稳定的HIPPEs去包埋植物乳杆菌(Lactobacillus plantarum,L. plantarum),成功地提高了巴氏灭菌处理后的存活率,且保护效果随油相体积分数和WPI微凝胶浓度的增加而增强。当pH为4.0时,WPI微凝胶聚集在油滴表面,保护效果最强。HIPPEs可调节孔隙结构,抵抗机械搅动,进一步增强益生菌在加工过程中的活性。类似的,乳清蛋白分离物-表儿茶素没食子酸酯(Whey protein isolate-epigallocatechin-3-gallate,WPI-EGCG)偶联物稳定的HIPPEs也被证明有利于提高L. plantarum在巴氏杀菌后的存活率和对胃肠道消化的抵抗力,与游离的L. plantarum相比,用HIPPEs包埋后的L. plantarum在储存和体外模拟胃肠道消化14 d后具有更高的存活率[60]。β-乳球蛋白与海藻酸丙二醇酯为乳化剂稳定的HIPPEs对鼠李糖乳杆菌(Lactobacillus rhamnosus GG,LGG)和姜黄素也有很好的保护作用,巴氏灭菌处理后保留了高达7.91 lg CFU/mL的LGG和93.0%的姜黄素,这为开发姜黄素和益生菌共包埋的递送系统提供了有用的信息[61]。
与以上研究不同的是,Gao等[62]通过WPI和果胶的协同交联构建双网络HIPPEs凝胶来包埋双歧杆菌V9(Bifidobacterium lactis V9, B. lactis V9),并通过调节HIPPEs凝胶结构和强度来探讨其对益生菌的稳定性和胃肠道活性的影响。结果显示,果胶的加入不仅能提高HIPPEs的机械强度,增强其持水性,减小孔径,还能提高益生菌的热稳定性,这与其具有较强的凝胶结构和有效填充油滴以延缓热传递有关。同时,体外消化试验结果表明,添加了果胶的HIPPEs能够通过形成双网络凝胶和紧密的油滴挤压,抑制益生菌与胃酸和胆盐的接触,从而增强益生菌的胃肠道活性。这项研究展示了HIPPEs在保护益生菌活性方面的潜力,可能有助于开发更有效的功能性食品。
很多研究已经证明了HIPPEs对益生菌有保护作用,但是对包埋后的HIPPEs的结构特征以及胃肠道消化后结构变化的原因却很少被介绍。基于此,Sun等[63]选择大豆种皮多糖(Soy hull polysaccharide,SHP)和SPI一起稳定HIPPEs,并包埋L. plantarum,探讨它们在结构特征和益生菌递送稳定性方面的相互作用。结果显示,当添加的SHP浓度为1.8%时,SHP和SPI稳定的HIPPEs表现出优异的稳定性和黏弹性,且显著增强了L. plantarum的活性,即使在高温(121 ℃)下也保持结构完整性。在模拟胃肠道消化实验中(在胃、小肠和结肠中分别培养游离益生菌和HIPPEs包埋的益生菌各2 h),结果显示游离益生菌在整个消化过程中活力急剧下降,尤其是在结肠中,几乎没有益生菌存活。而对于包埋后的益生菌,在胃消化阶段,由于胃中大量的H+,SHP/SPI的静电作用增强,从而提高了HIPPEs的稳定性;在肠道消化过程中,胃蛋白酶会导致SPI失活,使益生菌的活性降低。此外,胆盐和胰蛋白酶的存在也会进一步破坏HIPPEs的结构,导致益生菌的释放。尽管在肠道消化中益生菌的活性明显降低,但与游离益生菌相比,用1.8% SHP制备的HIPPEs中益生菌的活性在胃肠道消化后仍然很高。因此,SHP/SPI稳定的HIPPEs作为食品应用中的结肠靶向递送系统具有良好的潜力。
3.2 W/O型HIPPEs对益生菌的包埋及递送
到目前为止,我们只检索到一篇关于W/O型HIPEs包埋益生菌的研究。由于该乳液的乳化剂不属于固体颗粒的范畴,因此不属于HIPPEs。Zhang等[64]以聚甘油聚蓖麻油酸酯为油溶性表面活性剂,蜂蜡为油相制备了W/O型HIPEs,可用于有效地包埋和保护Bifidobacterium免受胃肠道条件的影响。益生菌位于W/O乳液的内部水区域内,外部被油相所包裹,因此可免受外部水相中的有害物质的影响,例如胃酸或胆汁酸等。
HIPPEs具有提高食品加工和储存过程中益生菌活力的潜力,尽管乳液在包埋益生菌方面已经取得了重大进展,但HIPPEs包埋益生菌的研究较少,并且大多集中在O/W型,其他类型的很少。在未来我们仍然需要进行更多的研究实践,以丰富我们在这一领域的知识,开发多样化的HIPPEs包埋益生菌体系,提高食品热加工过程中的益生菌活力。表1为不同类型的乳液在益生菌包埋中的应用。
表 1 不同类型的乳液在益生菌包埋中的应用Table 1. Application of different types of emulsions in probiotic encapsulation乳液类型 乳液状态 益生菌 乳化剂 制备方法 参考文献 O/W 液体 Lactobacillus casei K17 植物糖原纳米颗粒 高速剪切 [65] 液体 Lactococcus lactis IO-1 羟丙基甲基纤维素、壳聚糖 高速剪切 [66] O/W HIPPEs 半固体 L. plantarum WPI微凝胶 高速剪切 [10] 半固体 B. lactis V9 WPI、果胶 高速剪切 [62] 半固体 L. plantarum WPI-EGCG 高速剪切 [60] 半固体 L. plantarum SHP、SPI 高速剪切 [63] 半固体 LGG β-乳球蛋白、海藻酸丙二醇酯 高速剪切 [61] W/O HIPEs 半固体 Bifidobacterium 聚甘油聚蓖麻油酸酯 高速剪切 [64] W/W 液体 L. plantarum 羟丙基甲基纤维素、葡聚糖 喷雾干燥 [67] W/O/W 液体 L. dellbrueckii β-环糊精 两步均质法 [58] 液体 LGG BC纳米颗粒 两步均质法 [68] 4. HIPPEs未来的发展与展望
由蛋白质、多糖及复合物组成的食品级固体颗粒具有优良的生物相容性,但大多数天然颗粒通常需要通过改性或复合处理才可以稳定Pickering乳液。由于蛋白质与多糖种类十分丰富、制备方法和作用方式多种多样,因此形成的复合物也千差万别,目前关于食品级固体颗粒的研究越来越多,未来我们应该致力于研究其影响因素、稳定机制以及应用范围。关于复合物之间的作用机理已经有了不少研究,但还不算很透彻,例如,反应后复合物的结构变化与功能性改善之间的关系尚不明确,这些都需要进一步研究。
HIPPEs是包埋益生菌的良好载体,能有效提高益生菌对环境的耐受性和在肠道中的存活率。但是HIPPEs包埋益生菌的应用还不是很广泛,以及它们是否适合在实际产品中进行商业应用仍然是一个需要研究的问题。不同的益生菌对于Pickering乳液载体性质的需求不同,我们应该根据不同的需求构建有针对性且适用的载体递送系统。各种载体的递送能力在许多方面仍有待改进,包括更好的提高益生菌的生存能力和稳定性,益生菌与生物活性物质或益生元的共同递送系统以及多种益生菌菌株的靶向肠道释放。
未来,HIPPEs包埋益生菌的研究工作可在如下方面进一步探索:研究及调控包埋后的益生菌对食品感官特性的影响;深入阐述HIPPEs包埋益生菌后在食品中的稳定性和作用机制;探索界面结构(蛋白质浓度、表面电荷等)对包埋的益生菌在食品加工、储存和运输期间的存活率的影响;寻找更经济更方便的新型制备技术开发多样化和功能化的HIPPEs包埋益生菌及益生菌与活性物质共包埋的乳液体系。
-
表 1 不同类型的乳液在益生菌包埋中的应用
Table 1 Application of different types of emulsions in probiotic encapsulation
乳液类型 乳液状态 益生菌 乳化剂 制备方法 参考文献 O/W 液体 Lactobacillus casei K17 植物糖原纳米颗粒 高速剪切 [65] 液体 Lactococcus lactis IO-1 羟丙基甲基纤维素、壳聚糖 高速剪切 [66] O/W HIPPEs 半固体 L. plantarum WPI微凝胶 高速剪切 [10] 半固体 B. lactis V9 WPI、果胶 高速剪切 [62] 半固体 L. plantarum WPI-EGCG 高速剪切 [60] 半固体 L. plantarum SHP、SPI 高速剪切 [63] 半固体 LGG β-乳球蛋白、海藻酸丙二醇酯 高速剪切 [61] W/O HIPEs 半固体 Bifidobacterium 聚甘油聚蓖麻油酸酯 高速剪切 [64] W/W 液体 L. plantarum 羟丙基甲基纤维素、葡聚糖 喷雾干燥 [67] W/O/W 液体 L. dellbrueckii β-环糊精 两步均质法 [58] 液体 LGG BC纳米颗粒 两步均质法 [68] -
[1] DIANAWATI D, MISHRA V, SHAH N P. Survival of microencapsulated probiotic bacteria after processing and during storage:A review[J]. Critical Reviews in Food Science and Nutrition,2015,56(10):1685−1716.
[2] JIANG Z W, LI M T, MCCLEMENTS D J, et al. Recent advances in the design and fabrication of probiotic delivery systems to target intestinal inflammation[J]. Food Hydrocolloids,2022,125:107438. doi: 10.1016/j.foodhyd.2021.107438
[3] XIAO Y, LU C B, LIU Y Y, et al. Encapsulation of Lactobacillus rhamnosus in hyaluronic acid-based hydrogel for pathogen-targeted delivery to ameliorate enteritis[J]. ACS Appl Mater Interfaces,2020,12(33):36967−36977. doi: 10.1021/acsami.0c11959
[4] GAO Y X, WANG X, XUE C H, et al. Latest developments in food-grade delivery systems for probiotics:A systematic review[J]. Critical Reviews in Food Science and Nutrition,2021,63(20):4371−4388.
[5] GONZALEZ ORTIZ D, POCHAT-BOHATIER C, CAMBEDOUZOU J, et al. Current trends in Pickering emulsions:Particle morphology and applications[J]. Engineering,2020,6(4):468−482. doi: 10.1016/j.eng.2019.08.017
[6] LIU X, XIE F, ZHOU J J, et al. High internal phase Pickering emulsion stabilized by zein-tannic acid-sodium alginate complexes:β-Carotene loading and 3D printing[J]. Food Hydrocolloids,2023,142:108762. doi: 10.1016/j.foodhyd.2023.108762
[7] JIAO B, SHI A M, WANG Q, et al. High-internal-phase Pickering emulsions stabilized solely by peanut protein microgel particles with multiple potential applications[J]. Angewandte Chemie International Edition,2018,57(30):9274−9278. doi: 10.1002/anie.201801350
[8] ZHOU F Z, YU X H, ZENG T, et al. Fabrication and characterization of novel water-insoluble protein porous materials derived from Pickering high internal-phase emulsions stabilized by gliadin–chitosan-complex particles[J]. Journal of Agricultural and Food Chemistry,2019,67(12):3423−3431. doi: 10.1021/acs.jafc.9b00221
[9] 刘树萍, 彭秀文, 张佳美, 等. 大豆分离蛋白与茶多酚稳定的高内相Pickering乳液替代脂肪对肉丸品质的影响[J]. 食品工业科技,2024,45(6):59−66. [LIU S P, PENG X W, ZHANG J M, et al. Effect of soybean protein isolate and tea polyphenol stabilized high interior phase Pickering emulsion replacing fat on meatball quality[J]. Science and Technology of Food Industry,2024,45(6):59−66.] LIU S P, PENG X W, ZHANG J M, et al. Effect of soybean protein isolate and tea polyphenol stabilized high interior phase Pickering emulsion replacing fat on meatball quality[J]. Science and Technology of Food Industry, 2024, 45(6): 59−66.
[10] SU J L, WANG X Q, LI W, et al. Enhancing the viability of Lactobacillus plantarum as probiotics through encapsulation with high internal phase emulsions stabilized with whey protein isolate microgels[J]. Journal of Agricultural and Food Chemistry,2018,66(46):12335−12343. doi: 10.1021/acs.jafc.8b03807
[11] WU C, LIU Z, ZHI L Y, et al. Research progress of food-grade high internal phase Pickering emulsions and their application in 3D printing[J]. Nanomaterials,2022,12(17):2949. doi: 10.3390/nano12172949
[12] BI C H, CHI S Y, ZHOU T, et al. Characterization of a novel high internal phase Pickering emulsions stabilized by soy protein self-assembled gel particles[J]. Frontiers in Nutrition,2021,8:795396. doi: 10.3389/fnut.2021.795396
[13] WU J D, SHI M X, LI W, et al. Pickering emulsions stabilized by whey protein nanoparticles prepared by thermal cross-linking[J]. Colloids and Surfaces B:Biointerfaces,2015,127:96−104. doi: 10.1016/j.colsurfb.2015.01.029
[14] ZHANG X Y, ZHANG S, ZHONG M M, et al. Soy and whey protein isolate mixture/calcium chloride thermally induced emulsion gels:Rheological properties and digestive characteristics[J]. Food Chemistry,2022,380:132212. doi: 10.1016/j.foodchem.2022.132212
[15] FANG Y, DALGLEISH D G. Dimensions of the adsorbed layers in oil-in-water emulsions stabilized by caseins[J]. Journal of Colloid and Interface Science,1993,156(2):329−334. doi: 10.1006/jcis.1993.1120
[16] GUO Y, WU C, DU M, et al. In-situ dispersion of casein to form nanoparticles for Pickering high internal phase emulsions[J]. LWT,2021,139:110538. doi: 10.1016/j.lwt.2020.110538
[17] WIJAYA W, VAN DER MEEREN P, WIJAYA C H, et al. High internal phase emulsions stabilized solely by whey protein isolate-low methoxyl pectin complexes:Effect of pH and polymer concentration[J]. Food & Function,2017,8(2):584−594.
[18] LIU W, GAO H X, MCCLEMENTS D J, et al. Stability, rheology, and β-carotene bioaccessibility of high internal phase emulsion gels[J]. Food Hydrocolloids,2019,88:210−217. doi: 10.1016/j.foodhyd.2018.10.012
[19] ZAMANI S, MALCHIONE N, SELIG M J, et al. Formation of shelf stable Pickering high internal phase emulsions (HIPE) through the inclusion of whey protein microgels[J]. Food & Function,2018,9(2):982−990.
[20] TAN H, TU Z, JIA H Q, et al. Hierarchical porous protein scaffold templated from high internal phase emulsion costabilized by gelatin and gelatin nanoparticles[J]. Langmuir,2018,34(16):4820−4829. doi: 10.1021/acs.langmuir.7b04047
[21] 王斌. 二硫键在疏水蛋白自组装过程中的功能研究[D]. 天津:天津大学, 2019. [WANG B. Functional study of the disulfide bridges in the self-assembly of hydrophobin[D]. Tianjin:Tianjin University, 2019.] WANG B. Functional study of the disulfide bridges in the self-assembly of hydrophobin[D]. Tianjin: Tianjin University, 2019.
[22] 孟新宇. 壳聚糖的疏水改性及其乳化性能研究[D]. 无锡:江南大学, 2022. [MENG X Y. Hydrophobic modification of chitosan and the emulsifying properties[D]. Wuxi:Jiangnan University, 2022.] MENG X Y. Hydrophobic modification of chitosan and the emulsifying properties[D]. Wuxi: Jiangnan University, 2022.
[23] LIU F, TANG C H. Soy protein nanoparticle aggregates as Pickering stabilizers for oil-in-water emulsions[J]. Journal of Agricultural and Food Chemistry,2013,61(37):8888−8898. doi: 10.1021/jf401859y
[24] XU Y T, LIU T X, TANG C H. Novel pickering high internal phase emulsion gels stabilized solely by soy β-conglycinin[J]. Food Hydrocolloids,2019,88:21−30. doi: 10.1016/j.foodhyd.2018.09.031
[25] HU Y Q, YIN S W, ZHU J H, et al. Fabrication and characterization of novel Pickering emulsions and Pickering high internal emulsions stabilized by gliadin colloidal particles[J]. Food Hydrocolloids,2016,61:300−310. doi: 10.1016/j.foodhyd.2016.05.028
[26] YANG T, ZHENG J, ZHENG B S, et al. High internal phase emulsions stabilized by starch nanocrystals[J]. Food Hydrocolloids,2018,82:230−238. doi: 10.1016/j.foodhyd.2018.04.006
[27] QIAO M, YANG X C, ZHU Y, et al. Ultralight aerogels with hierarchical porous structures prepared from cellulose nanocrystal stabilized Pickering high internal phase emulsions[J]. Langmuir,2020,36(23):6421−6428. doi: 10.1021/acs.langmuir.0c00646
[28] ZHU Y, HUAN S Q, BAI L, et al. High internal phase oil-in-water Pickering emulsions stabilized by chitin nanofibrils:3D structuring and solid foam [J]. ACS Applied Materials & Interfaces,2020,12(9):11240−11251.
[29] 佟臻, 韦阳, 高彦祥. 基于食品级胶体颗粒稳定Pickering乳液的研究进展[J]. 食品工业科技,2019,40(4):317−324. [TONG Z, WEI Y, GAO Y X. Research progress of stabilized Pickering emulsion based on food grade colloidal particles[J]. Science and Technology of Food Industry,2019,40(4):317−324.] TONG Z, WEI Y, GAO Y X. Research progress of stabilized Pickering emulsion based on food grade colloidal particles[J]. Science and Technology of Food Industry, 2019, 40(4): 317−324.
[30] WANG C, PEI X P, TAN J L, et al. Thermoresponsive starch-based particle-stabilized Pickering high internal phase emulsions as nutraceutical containers for controlled release[J]. International Journal of Biological Macromolecules,2020,146:171−178. doi: 10.1016/j.ijbiomac.2019.12.269
[31] CHEN Q H, ZHENG J, XU Y T, et al. Surface modification improves fabrication of Pickering high internal phase emulsions stabilized by cellulose nanocrystals[J]. Food Hydrocolloids,2018,75:125−130. doi: 10.1016/j.foodhyd.2017.09.005
[32] PERRIN E, BIZOT H, CATHALA B, et al. Chitin nanocrystals for Pickering high internal phase emulsions[J]. Biomacromolecules,2014,15(10):3766−3771. doi: 10.1021/bm5010417
[33] MUXIKA A, ETXABIDE A, URANGA J, et al. Chitosan as a bioactive polymer:Processing, properties and applications[J]. International Journal of Biological Macromolecules,2017,105:1358−1368. doi: 10.1016/j.ijbiomac.2017.07.087
[34] SUN G G, ZHAO Q F, LIU S L, et al. Complex of raw chitin nanofibers and zein colloid particles as stabilizer for producing stable Pickering emulsions[J]. Food Hydrocolloids,2019,97:105178. doi: 10.1016/j.foodhyd.2019.105178
[35] SHARKAWY A, BARREIRO M F, RODRIGUES A E. Chitosan-based Pickering emulsions and their applications:A review[J]. Carbohydrate Polymers,2020,250:116885. doi: 10.1016/j.carbpol.2020.116885
[36] HUANG C, SUN F S, MA X X, et al. Hydrophobically modified chitosan microgels stabilize high internal phase emulsions with high compliance[J]. Carbohydrate Polymers,2022,288:119277. doi: 10.1016/j.carbpol.2022.119277
[37] SONG Y, ZHOU L Y, ZHANG D C, et al. Stability and release of peach polyphenols encapsulated by Pickering high internal phase emulsions in vitro and in vivo[J]. Food Hydrocolloids,2023,139:108593. doi: 10.1016/j.foodhyd.2023.108593
[38] MA L, ZOU L Q, MCCLEMENTS D J, et al. One-step preparation of high internal phase emulsions using natural edible Pickering stabilizers:Gliadin nanoparticles/gum Arabic[J]. Food Hydrocolloids,2020,100:105381. doi: 10.1016/j.foodhyd.2019.105381
[39] ZENG T, WU Z L, ZHU J Y, et al. Development of antioxidant Pickering high internal phase emulsions (HIPEs) stabilized by protein/polysaccharide hybrid particles as potential alternative for PHOs[J]. Food Chemistry,2017,231:122−130. doi: 10.1016/j.foodchem.2017.03.116
[40] SHEN R, LIN D H, LIU Z, et al. Fabrication of bacterial cellulose nanofibers/soy protein isolate colloidal particles for the stabilization of high internal phase Pickering emulsions by anti-solvent precipitation and their application in the delivery of curcumin[J]. Frontiers in Nutrition,2021,8:734620. doi: 10.3389/fnut.2021.734620
[41] LIU X, HUANG Y Q, CHEN X W, et al. Whole cereal protein-based Pickering emulsions prepared by zein-gliadin complex particles[J]. Journal of Cereal Science,2019,87:46−51. doi: 10.1016/j.jcs.2019.02.004
[42] WANG T, LI F S, ZHANG H, et al. Plant-based high internal phase emulsions stabilized by dual protein nanostructures with heat and freeze–thaw tolerance[J]. Food Chemistry,2022,373:131458. doi: 10.1016/j.foodchem.2021.131458
[43] PANG B, LIU H, REHFELDT F, et al. High internal phase Pickering emulsions stabilized by dialdehyde amylopectin/chitosan complex nanoparticles[J]. Carbohydrate Polymers,2021,258:117655. doi: 10.1016/j.carbpol.2021.117655
[44] YAN C, MCCLEMENTS D J, ZHU Y, et al. Fabrication of OSA starch/chitosan polysaccharide-based high internal phase emulsion via altering interfacial behaviors[J]. Journal of Agricultural and Food Chemistry,2019,67(39):10937−10946. doi: 10.1021/acs.jafc.9b04009
[45] XIAO J, LI Y Q, HUANG Q R. Recent advances on food-grade particles stabilized Pickering emulsions:Fabrication, characterization and research trends[J]. Trends in Food Science & Technology,2016,55:48−60.
[46] LI X M, ZHU J, PAN Y, et al. Fabrication and characterization of pickering emulsions stabilized by octenyl succinic anhydride -modified gliadin nanoparticle[J]. Food Hydrocolloids,2019,90:19−27. doi: 10.1016/j.foodhyd.2018.12.012
[47] LI F F, LI X H, HUANG K L, et al. Preparation and characterization of pickering emulsion stabilized by hordein-chitosan complex particles[J]. Journal of Food Engineering,2021,292:110275. doi: 10.1016/j.jfoodeng.2020.110275
[48] 吴昱春, 陈小草, 张琦, 等. Pickering乳液稳定机理及其在食品中的应用研究进展[J]. 食品科学, 2021, 42(7):275−282. [WU Y C, CHEN X C, ZHANG Q, et al. Stability mechanism of Pickering emulsion and its application in food industry:A review[J] Food Science, 2021, 42(7):275−282.] WU Y C, CHEN X C, ZHANG Q, et al. Stability mechanism of Pickering emulsion and its application in food industry: A review[J] Food Science, 2021, 42(7): 275−282.
[49] SUN F W, CHENG T F, REN S H, et al. Soy protein isolate/carboxymethyl cellulose sodium complexes system stabilized high internal phase Pickering emulsions:Stabilization mechanism based on noncovalent interaction[J]. International Journal of Biological Macromolecules,2024,256:128381. doi: 10.1016/j.ijbiomac.2023.128381
[50] LIU F, TANG C H. Emulsifying Properties of soy protein nanoparticles:Influence of the protein concentration and/or emulsification process[J]. Journal of Agricultural and Food Chemistry,2014,62(12):2644−2654. doi: 10.1021/jf405348k
[51] HOROZOV T S, BINKS B P. Particle-stabilized emulsions:A bilayer or a bridging monolayer?[J]. Angewandte Chemie,2006,118(5):787−790. doi: 10.1002/ange.200503131
[52] WANG S Y, LIU L G, BI S H, et al. Studies on stabilized mechanism of high internal phase Pickering emulsions from the collaboration of low dose konjac glucomannan and myofibrillar protein[J]. Food Hydrocolloids,2023,143:108862. doi: 10.1016/j.foodhyd.2023.108862
[53] XU Y T, TANG C H, BINKS B P. High internal phase emulsions stabilized solely by a globular protein glycated to form soft particles[J]. Food Hydrocolloids,2020,98:105254. doi: 10.1016/j.foodhyd.2019.105254
[54] XU Y T, TANG C H, BINKS B P. Ultraefficient stabilization of high internal phase emulsions by globular proteins in the presence of polyols:Importance of a core-shell nanostructure[J]. Food Hydrocolloids,2020,107:105968. doi: 10.1016/j.foodhyd.2020.105968
[55] IRAVANI S, KORBEKANDI H, MIRMOHAMMADI S V. Technology and potential applications of probiotic encapsulation in fermented milk products[J]. Journal of Food Science and Technology,2014,52(8):4679−4696.
[56] HIGL B, KURTMANN L, CARLSEN C U, et al. Impact of water activity, temperature, and physical state on the storage stability of Lactobacillus paracasei ssp. paracasei freeze-dried in a lactose matrix[J]. Biotechnology Progress,2007,23(4):794−800. doi: 10.1002/bp070089d
[57] 陈臣, 张晓丛, 袁海彬, 等. 益生菌包埋前沿技术及其研究进展[J]. 中国食品学报,2023,23(1):384−396. [CHEN C, ZHANG X C, YUAN H B, et al. Research progress on the advanced technology of embedding for probiotics[J]. Journal of Chinese Institute of Food Science and Technology,2023,23(1):384−396.] CHEN C, ZHANG X C, YUAN H B, et al. Research progress on the advanced technology of embedding for probiotics[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(1): 384−396.
[58] ESLAMI P, DAVARPANAH L, VAHABZADEH F. Encapsulating role of β-cyclodextrin in formation of pickering water-in-oil-in-water (W1/O/W2) double emulsions containing Lactobacillus dellbrueckii[J]. Food Hydrocolloids,2017,64:133−148. doi: 10.1016/j.foodhyd.2016.10.035
[59] GAO H X, MA L, CHENG C, et al. Review of recent advances in the preparation, properties, and applications of high internal phase emulsions[J]. Trends in Food Science & Technology,2021,112:36−49.
[60] QIN X S, GAO Q Y, LUO Z G. Enhancing the storage and gastrointestinal passage viability of probiotic powder (Lactobacillus Plantarum) through encapsulation with pickering high internal phase emulsions stabilized with WPI-EGCG covalent conjugate nanoparticles[J]. Food Hydrocolloids,2021,116:106658. doi: 10.1016/j.foodhyd.2021.106658
[61] SU J Q, CAI Y J, TAI K D, et al. High-internal-phase emulsions (HIPEs) for co-encapsulation of probiotics and curcumin:Enhanced survivability and controlled release[J]. Food & Function,2021,12(1):70−82.
[62] GAO H X, MA L, SUN W X, et al. Impact of encapsulation of probiotics in oil-in-water high internal phase emulsions on their thermostability and gastrointestinal survival[J]. Food Hydrocolloids,2022,126:107478. doi: 10.1016/j.foodhyd.2021.107478
[63] SUN C Y, WANG S N, HUANG X Y, et al. Enhancing probiotic viability:Impact of soy hull polysaccharide concentration on stabilized high-internal-phase emulsions encapsulated with Lactobacillus plantarum and their release during gastrointestinal digestive[J]. Food Hydrocolloids,2024,152:109959. doi: 10.1016/j.foodhyd.2024.109959
[64] ZHANG Y, XIE Y F, LIU H, et al. Probiotic encapsulation in water-in-oil high internal phase emulsions:Enhancement of viability under food and gastrointestinal conditions[J]. LWT,2022,163:113499. doi: 10.1016/j.lwt.2022.113499
[65] WANG J S, CHEN L M. Impact of a novel nano-protectant on the viability of probiotic bacterium Lactobacillus casei K17[J]. Foods,2021,10(3):529. doi: 10.3390/foods10030529
[66] RATTANABURI P, CHAROENRAT N, PONGTHARANGKUL T, et al. Hydroxypropyl methylcellulose enhances the stability of o/w Pickering emulsions stabilized with chitosan and the whole cells of Lactococcus lactis IO-1[J]. Food Research International,2019,116:559−565. doi: 10.1016/j.foodres.2018.08.074
[67] RUAN M J, XIE Y X, ZHOU C Y, et al. Biomacromolecule based water-in-water Pickering emulsion:A fascinating artificial cell-like compartment for the encapsulation of Lactobacillus plantarum[J]. Food Bioscience,2023,55:102916. doi: 10.1016/j.fbio.2023.102916
[68] WANG L, SONG M Y, ZHAO Z J, et al. Lactobacillus acidophilus loaded Pickering double emulsion with enhanced viability and colon-adhesion efficiency[J]. Lwt,2020,121:108928. doi: 10.1016/j.lwt.2019.108928





 下载:
下载:
 下载:
下载:



