Effects of High Pressure Steam Processing on Antioxidant and Anti-inflammatory Activities of Polygonatum Kingianum
-
摘要: 目的:本研究应用高压蒸汽加热方式研究不同温度对滇黄精活性成分的影响。方法:以未加工滇黄精、高压蒸汽热加工滇黄精(105、120、135 ℃)和传统九蒸九晒滇黄精(9-9)5个不同处理组滇黄精为原料,测定热加工后各组总糖、总皂苷、总酚及类黄酮含量变化,对不同处理组滇黄精的抗氧化及抗炎活性进行比较,并对不同处理组间滇黄精抗氧化活性相关化合物质量浓度进行检测。结果:随温度升高,总皂苷、总酚及类黄酮含量呈温度依赖性上升,与9-9组相比,135 ℃总皂苷含量提升62%,总酚含量提升3.5倍,类黄酮含量提升2.7倍,与对照组相比,135 ℃总糖含量降低42.2%;经热加工处理后,滇黄精抗氧化及抗炎活性均显著增强;高效液相色谱-三重四极杆质谱(high performance liquid chromatography -triple quadrupole mass spectrometer, HPLC-TQXS)仪检测结果显示,尼克酸、奎宁酸及丹参素的质量浓度随温度升高有所提升,135 ℃组比9-9组分别增加3.4倍、9.2%及1.2倍,135 ℃组异甘草素、异槲皮素、芦丁及柚皮素含量相比9-9组分别减少13%、70.90%、40.30%及24.4倍。结论:高压蒸汽热加工提升了滇黄精活性成分含量,增强了抗氧化及抗炎活性,可替代传统九蒸九晒方法,通过高温精准化加工,为后续标准化入药及工厂化生产滇黄精提供有效参考。Abstract: Objective: This study aimed to investigate the impact of high-pressure steam heating at different temperatures on the active components of Polygonatum kingianum. Methods: The levels of total sugars, total saponins, total phenols, and flavonoids in five different treatment groups of Polygonatum kingianum (raw Polygonatum kingianum, high-pressure steam-treated Polygonatum kingianum at 105, 120, and 135 ℃, as well as traditionally processed nine steaming nine drying Polygonatum kingianum, which also called 9-9) were determined post-heat processing. Furthermore, the antioxidant and anti-inflammatory activities of Polygonatum kingianum in various treatment groups were compared. Additionally, the mass concentration of antioxidant activity-related compounds in Polygonatum kingianum was measured across different treatment groups. Results: The content levels of total saponins, total phenols, and flavonoids exhibited a temperature-dependent increase with rising temperature. At 135 ℃, compared to group 9-9, there was a 62% increase in total saponin content along with a 3.5-fold increase in total phenol content and a 2.7-fold increase in flavonoid content. Compared with group 9-9, the total sugar content decreased by 42.2% at 135 ℃; Subsequent high-pressure steam hot processing significantly enhanced the antioxidant and anti-inflammatory activities of Polygonatum kingianum. The results of the High performance liquid chromatography-triple quadrupole mass spectrometer (HPLC-TQXS) indicated that the mass concentrations of niacin, quinic acid, and tanshinol in 135 ℃ group were increased by 3.4 fold, 9.2%, and 1.2 fold compared those in the 9-9 group. Meanwhile, the contents of isogliquiritin, isoquercitrin, rutin, and naringin in the 135℃ group were decreased by 13%, 70.90%, 40.30%, and 24.4 fold respectively compared to those in the 9-9 group. Conclusion: High-pressure steam hot processing can enhance Polygonatum kingianum active ingredient content as well as its antioxidant and anti-inflammatory activities. It has the potential to replace traditional nine-steaming-and-nine-drying methods through high-temperature precision processing for standardized pharmaceutical applications and industrial-scale production of Polygonatum kingianum.
-
黄精为单子叶百合科黄精属的多年生草本植物,包括滇黄精(Polygonatum kingianum Coll. et Hemsl)、黄精和多花黄精,主要分布在东亚地区,数千年来一直被用作食药同源产品广泛使用[1−2],具有免疫调节[3]、降血糖[4],抗炎、抗氧化[5]、抗肿瘤[6]及抗骨质疏松[7]等活性。生黄精通常具有咽喉刺激性,并伴有舌头麻木感,口感较差,不利于直接服用,因此黄精常通过炮制加工后入药,口感更佳[8]。
黄精传统炮制方法主要为“九蒸九晒”,又称为九制黄精。有研究表明黄精经炮制后其化学成分和药理作用均会发生较大变化[9],YAO等[10]在九蒸九晒黄精加工过程中发现,黄精的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl, DPPH)、2,2’-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐[2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)ammonium salt, ABTS]及铁离子还原/抗氧化能力法(ferric ion reducing antioxidant power, FRAP)清除活性,随加工周期的增加呈上升趋势,这表明九蒸九晒处理显著提高了黄精的抗氧化活性。然而九蒸九晒加工过程耗时费力,过程繁琐,遇到阴雨天气等会延长制作周期,可能存在变质风险,同时九蒸九晒方法多是依靠个人经验,且不同工厂生产品质差异不统一,造成黄精品质难一致,活性成分不稳定,导致黄精难以标准入药[11]。高压蒸汽灭菌工艺作为食品巴氏杀菌技术,操作方便,可在高温下抑制细菌真菌的产生,相对九蒸九晒传统方法,避免了环境中有害微生物及其他化合物的污染,延长了食品的保质期,同时杀死了食品病原体、清除了残留的重金属铅、镉等,提高了食药同源产品的安全性[12−13]。而高压蒸汽热加工作为一种非典型的炮制方法,通常用于肉制品的处理,可延长其保质期,其在天然产物活性成分中的应用甚少。
鉴于此,本研究采用高温蒸汽灭菌方式对滇黄精进行热加工炮制,与传统九蒸九晒炮制方法进行对比,分析总皂苷、总糖、总酚及类黄酮含量差异及其抗氧化、抗炎活性,并通过高效液相色谱-三重四极杆质谱仪(high performance liquid chromatography -triple quadrupole mass spectrometer, HPLC-TQXS)检测不同组间相关化合物质量浓度,为滇黄精标准化入药提供参考。
1. 材料与方法
1.1 材料与仪器
滇黄精 云南保山红花滇黄精(批次:CAAS-20220220滇黄精);无水乙醇 分析纯,国药集团化学试剂有限公司;过硫酸钾、铁氰化钾、三氯乙酸、氯化铁、磷酸盐缓冲液、青霉素-链霉素 上海麦克林生化科技股份有限公司;巨噬细胞RAW 264.7细胞 中国医学科学院国家实验细胞资源共享平台;胎牛血清(fetal bovine serum, FBS) 优级,美国Gibco公司;总糖、总皂苷、类黄酮及总酚含量测定试剂盒 苏州梦犀生物医药科技有限公司;CCK-8试剂盒 上海碧云天生物技术有限公司;一氧化氮(nitric oxide, NO)含量检测试剂盒、脂多糖(lipopolysaccharide, LPS)、地塞米松(dexamethasone, DEX) 北京索莱宝科技有限公司。
YQ205-20台式超纯水机 香港力康生物医疗科技控股集团;KQ-500DE数控超声波清洗器昆山市超声仪器有限公司;MGL-16MT台式超大容量冷冻离心机 上海美瑞克仪器有限公司;GR60DR立式自动压力蒸汽灭菌器 致微厦门仪器有限公司;UV-8000S紫外可见分光光度计 上海元析仪器有限公司;JJ1000型电子天平 精度0.001 g,常熟市双杰测试仪器厂;371水控湿度恒温二氧化碳细胞培养箱 美国Thermo Fisher公司;高效液相色谱-三重四极杆质谱联用Xevo TQ-XS 美国Waters公司。
1.2 实验方法
1.2.1 样品制备及提取
1.2.1.1 不同高温处理组滇黄精样品前处理
将新鲜滇黄精洗去泥土,除去须根切块,每份样品准确称取50 g,每组3个重复样品,设置3组,分别为105 ℃处理组,120 ℃处理组,135 ℃处理组;将滇黄精按上述设置温度,利用高压蒸汽灭菌锅分别加热2 h,得到9组高温处理滇黄精鲜样。
1.2.1.2 九蒸九制滇黄精样品前处理
参考ZHOU等[14]处理方法,将新鲜滇黄精洗去泥土,除去须根后于蒸锅中蒸制6 h,在室外通风晾晒1 d后,重复上述蒸制方法9次,直至内心出现黑色,重量不再增加,得到九蒸九晒滇黄精样品(9-9组滇黄精)。
1.2.1.3 样品制备
将空白未加热滇黄精块茎,105、120、135 ℃与9-9组滇黄精块茎同时进行低温冷冻干燥72 h,中药粉碎机将干燥块茎磨碎打粉,过40目筛,得到各处理组滇黄精粉末。
1.2.1.4 滇黄精化合物提取
不同处理组分别称取2 g,每组称取3份,每份滇黄精粉末中加入60 mL 80%乙醇,浸泡2 h,超声2 h,重复3次,富集上清液。旋转蒸发至微粘稠状后,低温冷冻干燥72 h,样品于干燥器内储存备用。
1.2.2 滇黄精提取物活性成分含量测定
1.2.2.1 类黄酮含量测定
将样本烘干至恒重,粉碎后过40目筛,称取0.05 g,加入1 mL 60%乙醇,60 ℃震荡提取2 h,于25 ℃,10000 r/min离心10 min,取上清待测。测定管加入80 μL上清液,试剂一20 μL,混匀,25 ℃静置6 min后,加入试剂二20 μL,混匀,25 ℃静置6 min,加入试剂三80 μL,混匀,25 ℃静置15 min,空白管用80 μL 60%乙醇代替上清液,其余操作同测定管,在510 nm处测定吸光值分别为A测定和A空白。类黄酮含量计算见式(1):
类黄酮含量(mg/g干重)=(ΔA+0.0101)÷2.4623÷(W÷V样总) (1) 式中:ΔA=A测定−A空白,V样总为加入提取液体积(mL),W为样品质量(g)。
1.2.2.2 总皂苷含量测定
将样本烘干至恒重,称取0.05 g,加入1 mL提取液,超声提取1 h,于25 ℃,10000 r/min离心10 min,取上清待测。测定管中加入500 μL上清液后于70 ℃挥发至干,加入试剂一200 μL,高氯酸800 μL,55 ℃水浴20 min,取反应液40 μL于96孔板后,加入乙酸200 μL,空白管不加入上清液,其余操作同测定管,分别充分混匀后,在550 nm测定吸光值分别为A测定和A空白。总皂苷含量计算见式(2):
总皂苷含量(mg/g干重)=(ΔA+0.0003)÷3.4538×(V样总÷V样)÷W (2) 式中:ΔA=A测定-A空白,V样总为加入提取液体积(mL),V样为加入样本体积(mL),W为样品质量(g)。
1.2.2.3 总酚含量测定
将样本烘干至恒重,粉碎后过40目筛,称取0.05 g,加入1 mL提取液,60 ℃震荡提取2 h,于25 ℃,10000 r/min离心10 min,取上清待测。测定管中加入10 μL上清液,试剂一50 μL,混匀,25 ℃静置2 min,加入试剂二50 μL,蒸馏水90 μL;对照管加入10 μL上清液,试剂二50 μL,蒸馏水140 μL,混匀静置10 min,在765 nm测定吸光值分别为A测定和A对照。总酚含量计算公式:
总酚含量(mg/g干重)=(ΔA−0.0012)÷2.808×V样÷(V样÷V样总×W) (3) 式中:ΔA=A测定−A对照,V样为加入样本体积(mL),V样总为加入提取液体积(mL),W为样品质量(g)。
1.2.2.4 总糖含量测定
将样本烘干粉碎,称取约0.02 g,加入2 mL提取液,充分匀浆,转移至离心管中,放置90 ℃烘箱(盖紧,防止水分散失),水解3 h,冷却后10000 r/min离心10 min,将上清液稀释10倍后测定。测定管中加入200 μL上清液,试剂一100 μL,浓硫酸500 μL,空白管中用200 μL蒸馏水代替上清液,其余操作同测定管。混匀后90 ℃水浴20 min,流水冷却,取200 μL加入96孔板中,于490 nm测定吸光值分别为A测定和A空白。总糖含量计算公式:
总糖含量(mg/g)=(ΔA−0.0099)÷8.4038×V提×稀释倍数÷W (4) 式中:ΔA=A测定−A空白,V提为加入提取液体积(mL),稀释倍数:10倍,W为样品质量(g)。
1.2.3 体外抗氧化活性检测
1.2.3.1 DPPH自由基清除试验
按照CHU等[15]报道的方法稍作修改,取不同处理组滇黄精样品各50 mL,分别加入100 μL蒸馏水和25 μL 无水乙醇DPPH溶液(0.4 mmol),漩涡振荡混匀后,于室温下避光静置30 min后,在515 nm处测定吸光值为A测定,用50 mL无水乙醇代替DPPH溶液,测定其吸光值为A对照,用50 mL蒸馏水代替样液,测得吸光值为A空白。DPPH自由基清除率按照式(5)计算:
DPPH自由基清除率(%)=[A空白−(A测定−A对照)]÷A空白×100 (5) 式中:A测定为样品吸光值,A对照为对照组吸光值,A空白为空白组的吸光值。
1.2.3.2 ABTS+自由基清除试验
参考CHEN等[16]方法,配置ABTS工作液,将ABTS溶液(7.4 mmol/L)与过硫酸钾溶液(2.6 mmol/L)等体积混合,室温避光放置12 h。用pH为7.4的磷酸盐缓冲液(0.2 mol/L)稀释ABTS工作液,直至ABTS工作液吸光度值为(0.70±0.02)。将2.0 mL的ABTS工作液与0.2 mL样品(0.5 mg/mL)混合均匀,于室温静置反应6 min后,在734 nm处测量吸光值为A测定,用0.2 mL蒸馏水代替ABTS工作液,测其吸光值为A对照,用0.2 mL蒸馏水代替样品溶液,测其吸光值为A空白,ABTS+自由基清除率计算公式如下:
ABTS+自由基清除率(%)=[A空白−(A测定−A对照)]÷A空白×100 (6) 式中:A测定为样品吸光值,A对照为对照组吸光值,A空白为空白组的吸光值。
1.2.3.3 FRAP铁离子还原能力检测试验
参考FEJÉR等[17]方法,取不同处理组滇黄精提取物样品溶液,分别加入1%铁氰化钾和pH为6.6的磷酸缓冲液(0.2 mol/L)各2.5 mL,混匀后在50 ℃恒温水浴锅中加热20 min,随后加入2.5 mL 10%三氯乙酸溶液,3000 r/min离心10 min后,取2.5 mL上清液,与2.5 mL蒸馏水和0.5 mL 0.1%氯化铁混合均匀,静置10 min后,在700 nm处测量吸光值为A1,以蒸馏水为空白组,重复上述实验步骤,测其吸光值为A0,计算公式见式(7)。
铁离子还原能力=A1−A0 (7) 式中:A1为样品组吸光值,A0为空白组吸光值。
1.2.4 体外抗炎活性测定
1.2.4.1 细胞培养
将RAW 264.7细胞在补充有10% FBS、青霉素(100 U/mL)和链霉素(10 mg/mL)的基础培养基(dulbecco's modified eagle medium, DMEM)中培养,并在含5% CO2的37 ℃恒温培养箱中生长。
1.2.4.2 细胞活力测定
参考沈圆圆等[18]方法,使用基于细胞计数CCK-8试剂盒评估RAW 264.7细胞活力,将RAW 264.7细胞悬液(1×105个/孔)接种到96孔板中,每个孔100 μL,培养过夜后,向细胞中加入不同浓度(20、40、80、160、320 μg/mL)的滇黄精提取液,DMEM基础培养基、LPS 1 μg/mL、DEX 10 μg/mL分别作为对照组、模型组和阳性对照组,孵育处理24 h,取出培养基用磷酸盐缓冲液洗涤一次后加入100 μL含有CCK-8的新鲜培养基,37 ℃培养箱孵育3 h,在450 nm处检测吸光度,细胞存活率按照式(8)计算。
细胞存活率(%)=(As−Ab)/(Ac−Ab)×100 (8) 式中:As为实验组(含有细胞培养基、CCK-8、待测样品);Ac为对照组(含有细胞培养基、CCK-8、无待测样品);Ab为空白组(不含细胞和待测样品培养基、CCK-8)。
1.2.4.3 NO含量测定
将RAW 264.7细胞接种到96孔板(6×105个/孔)中培养24 h,加入不同处理组的滇黄精提取液各320 μg/mL处理LPS(1 μg/mL)刺激的RAW 264.7巨噬细胞,培养细胞48 h后,分别收集上清液,根据试剂盒说明书步骤进行操作,测定NO含量。
1.2.5 UPLC-TQXS质谱检测抗氧化活性相关化合物
1.2.5.1 供试品溶液的制备
分别精密称取未处理滇黄精、105、120、135 ℃及9-9组滇黄精样品粉末0.1 g,分别用甲醇溶液定容至10 mL的容量瓶中,涡旋混匀后,过0.22 μm微孔滤膜,取续滤液,得到各处理组滇黄精供试品溶液。
1.2.5.2 对照品溶液的制备
精密称取尼克酸、奎宁酸、丹参素、异甘草素、芦丁、异槲皮素及柚皮素对照品适量分别用50%甲醇溶液定容至10 mL容量瓶中,混合摇匀,得到1 mg/mL对照品母液。
1.2.5.3 色谱和质谱条件
色谱条件:色谱柱ACQUITY UPLC HSS T3 C18(100 m×2.1 m, 1.8 µm);测定黄酮类化合物流动相:A为0.1%甲酸水,B为乙腈;梯度洗脱:0~1 min,99% A;1~10 min,99%~70%;10~12 min,70%~5% A;12~12.1 min,5%~99% A;12.1~15 min,99% A;流速为0.3 mL/min;进样量为4 μL;柱温35 ℃。
质谱条件:离子源采用电喷雾离子源(正负离子模式),多反应检测模式方式进行离子扫描;脱溶剂温度为500 ℃,脱溶剂气流速为900 L/Hr,离子源温度为150 ℃,锥孔器流量为150 L/h,雾化气和碰撞气分别为高纯氩气和高纯氮气。7个对照品化合物的质谱参数见表1。
表 1 7个滇黄精对照品化合物的质谱参数Table 1. Mass spectrum parameters of 7 reference compounds of Polygonatum kingianum成分 保留时间(min) 母离子(m/z) 子离子(m/z) 碎裂电压(V) 碰撞能量(eV) 尼克酸 1.73 124.13 78.06 20 12 80.11 20 12 奎尼酸 1.15 190.90 85.00 24 20 93.10 24 18 异甘草素 13.08 255.25 119.20 10 15 135.15 10 15 异槲皮素 10.70 462.90 271.00 58 38 300.20 58 27 丹参素 6.86 197.02 73.02 20 12 135.11 20 15 芦丁 10.49 609.10 270.90 60 58 300.00 60 36 柚皮素 12.87 270.90 119.10 8 26 151.00 8 18 1.2.5.4 线性关系考察
精密称取混合对照品母液,用甲醇将1 mg/mL的对照品母液按不同比例稀释后进样测定,以对照品浓度(X)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线,得到回归方程,相关系数及线性范围,见表2。
表 2 线性关系考察结果Table 2. Results of linear relationship investigation成分 回归方程 线性范围(mg/mL) r 尼克酸 Y=5413.43X+12833.2 0.004~0.128 0.9976 奎宁酸 Y=622.196X+1816.62 0.004~0.128 0.9977 异甘草素 Y=11706X+92590.2 0.004~0.128 0.9989 异槲皮素 Y=15881.8X−35891.1 0.004~0.128 0.9962 丹参素 Y=387.473X−516.539 0.004~0.128 0.9960 芦丁 Y=4034.92X+5746.59 0.004~0.128 0.9967 柚皮素 Y=18346.7X+50462 0.004~0.128 0.9964 1.3 数据处理
所有实验重复3次,结果表示为平均数±SD。采用SPSS 20.1统计软件进行数据处理,通过单因素方差分析进行各组样本平均数的比较,采用Origin 2022软件绘图,以P<0.05为差异显著,表示有统计学意义。
2. 结果与分析
2.1 不同高温处理组外观变化
按照1.2.1.1、1.2.1.2处理不同组滇黄精及1.2.1.4方法提取滇黄精后,不同处理组外观及提取液变化如图1所示,随着加热温度的上升,滇黄精样品颜色发生明显变化,由最初的浅黄色逐渐变成棕色,在135 ℃时呈黑色,与9-9组滇黄精颜色相近,分析原因可能是与美拉德反应有关,在加热过程中,黄精的还原糖与氨基化合物反应生成棕色甚至黑色的大分子物质,从而导致加工后的滇黄精颜色变深[19−20]。
2.2 不同处理组滇黄精提取物活性成分含量比较
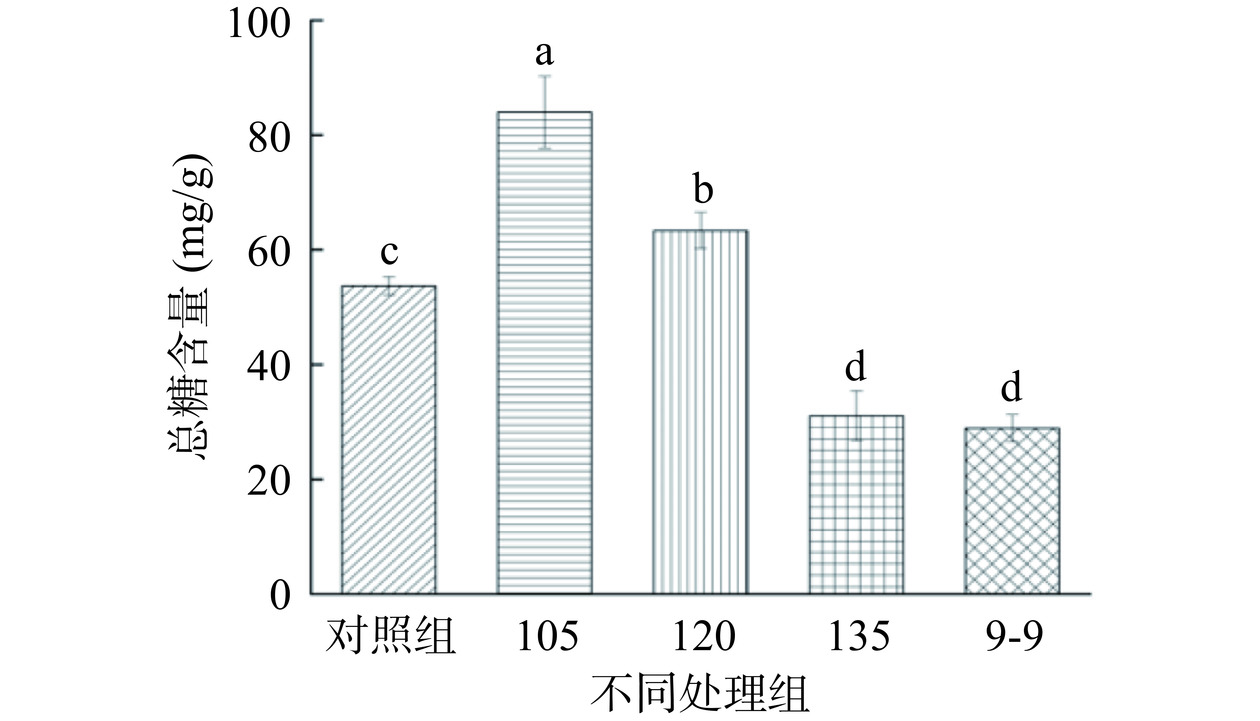
如图2所示,高温加工滇黄精后,各组滇黄精总糖含量与对照组相比,105 ℃组(83.96±6.25)mg/g含量最高,随温度升高,总糖含量显著下降(P<0.05),并具有温度依赖性下降,与105 ℃组相比,135 ℃组(31.05±4.35)mg/g降低了63.02%,总糖含量与9-9组(28.89±2.34)mg/g含量相当,这与YAO等[10]的研究结果一致,九蒸九晒黄精总糖含量随加工周期的增加而降低,这可能是由于高温状态下多糖和部分碳水化合物水解形成了低聚糖和单糖,单糖又与氨基酸发生了美拉德反应所致[21]。
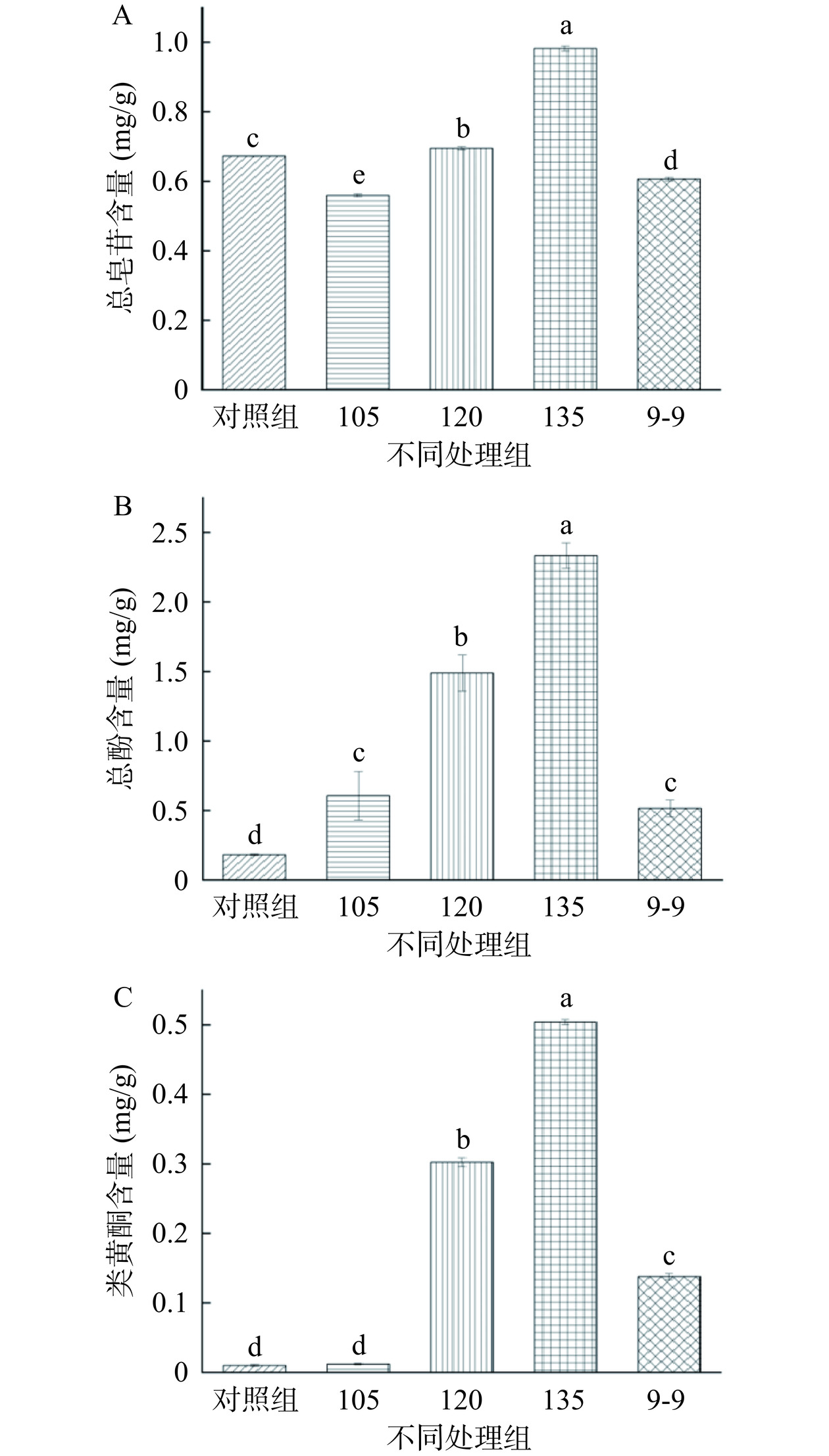
相反,总皂苷、总酚和类黄酮含量均随温度升高而呈上升趋势,这可能是加工过程中各含量的富集作用所致[22]。如图3A所示,随温度上升,总皂苷含量有所提升,135 ℃组相比105 ℃组,由(0.56±0.004)mg/g提升至(0.99±0.007)mg/g,总皂苷含量提升了75.58%。105 ℃组与9-9组(0.61±0.005)mg/g含量相当,120 ℃组(0.69±0.004)mg/g和135 ℃组与9-9组相比均有所提升,分别提升14.6%和62%。滇黄精经热加工后总皂苷含量有所提升,原因可能是高温伴随着甾体皂苷的转化,加热处理后薯蓣皂苷元被转化为苷元和次生糖苷[23−24]。
图3B显示了各温度处理组对滇黄精总酚含量的影响,结果表明,滇黄精经高温加热处理后,总酚含量均显著高于对照组(P<0.05),且呈温度依赖性上升趋势,这可能是由于在高温条件下,某些细胞元素和细胞壁成分发生降解,进一步促进了游离态多酚的快速释放[25],因此含量有所上升。135 ℃组(2.33±0.09)mg/g相比对照组总酚含量(0.18±0.01)mg/g,提升了11.9倍,与9-9组(0.51±0.06)mg/g相比,提升了3.5倍。
如图3C,高温加工滇黄精后,类黄酮含量随温度升高呈极显著上升(P<0.01),与对照组(0.009±0.001)mg/g相比,105 ℃组(0.01±0.001)mg/g提升了19.6%,120 ℃组(0.30±0.01)mg/g提升29.2倍,135 ℃组(0.50±0.003)mg/g提升49.4倍,120 ℃组和135 ℃组分别是9-9组的1.2倍和2.7倍,135 ℃组具有最高类黄酮含量。随温度升高,黄酮含量的增加可能归因于内源性氧化酶的降解失活,另一方面由于热处理引起的细胞破裂而释放出更多的黄酮类化合物,两者综合作用导致黄酮含量增加[26]。
2.3 体外抗氧化活性结果分析
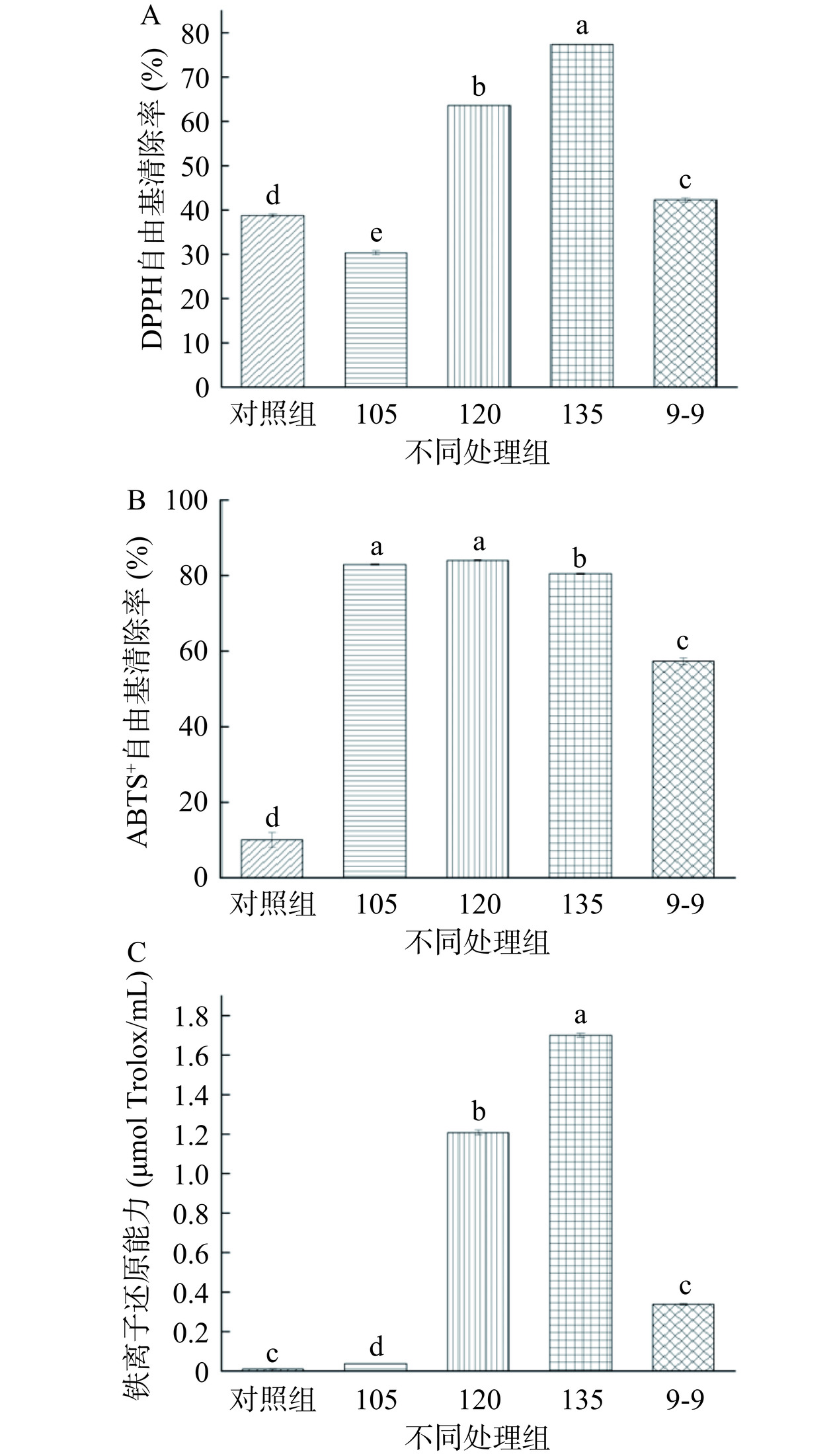
如图4A所示,不同高温处理组滇黄精对DPPH自由基清除能力随温度升高而增强,120 ℃和135 ℃组DPPH自由基清除率分别达到了63.58%和77.36%,是对照组的1.64和2.04倍,是9-9组的1.50倍和1.83倍,样品的自由基清除能力提高,一方面可能是由于热处理会释放并促进酚酸类化合物的增加[27],另一方面分子内部的功能基团在高温下被充分暴露出来,与DPPH自由基发生反应,从而增加了抗氧化能力[28]。
图4B显示,与对照组相比,经热处理的滇黄精抗氧化能力得到了极显著提升(P<0.01),105、120、135 ℃组对ABTS+自由基清除率均显著高于9-9组(P<0.05),在120 ℃升至135 ℃时,ABTS+自由基清除能力呈下降趋势,表明在适当的热处理温度下抗氧化能力有所提升,但温度过高会使部分游离酚和黄酮被破坏,从而抗氧化能力下降。
图4C表明,120 ℃和135 ℃铁离子还原能力与对照组相比显著上升(P<0.05),通过高压蒸汽热加工,细胞内结合酚得以释放,部分木质素和半纤维素降解为低分子的酚类化合物和水溶性糖,进一步增强了滇黄精的抗氧化能力[29]。经135 ℃处理的滇黄精是未处理滇黄精铁还原能力的157.07倍,120 ℃和135 ℃对铁离子还原能力分别达到1.21和1.70 μmol Trolox/mL,分别是9-9组的3.56和5.00倍。
综上,滇黄精经高温处理后,DPPH、ABTS+及FRAP抗氧化能力均有所升高,120 ℃和135 ℃组的抗氧化能力均优于9-9组。
2.4 体外抗炎活性结果分析
2.4.1 建立LPS诱导RAW 264.7细胞损伤模型
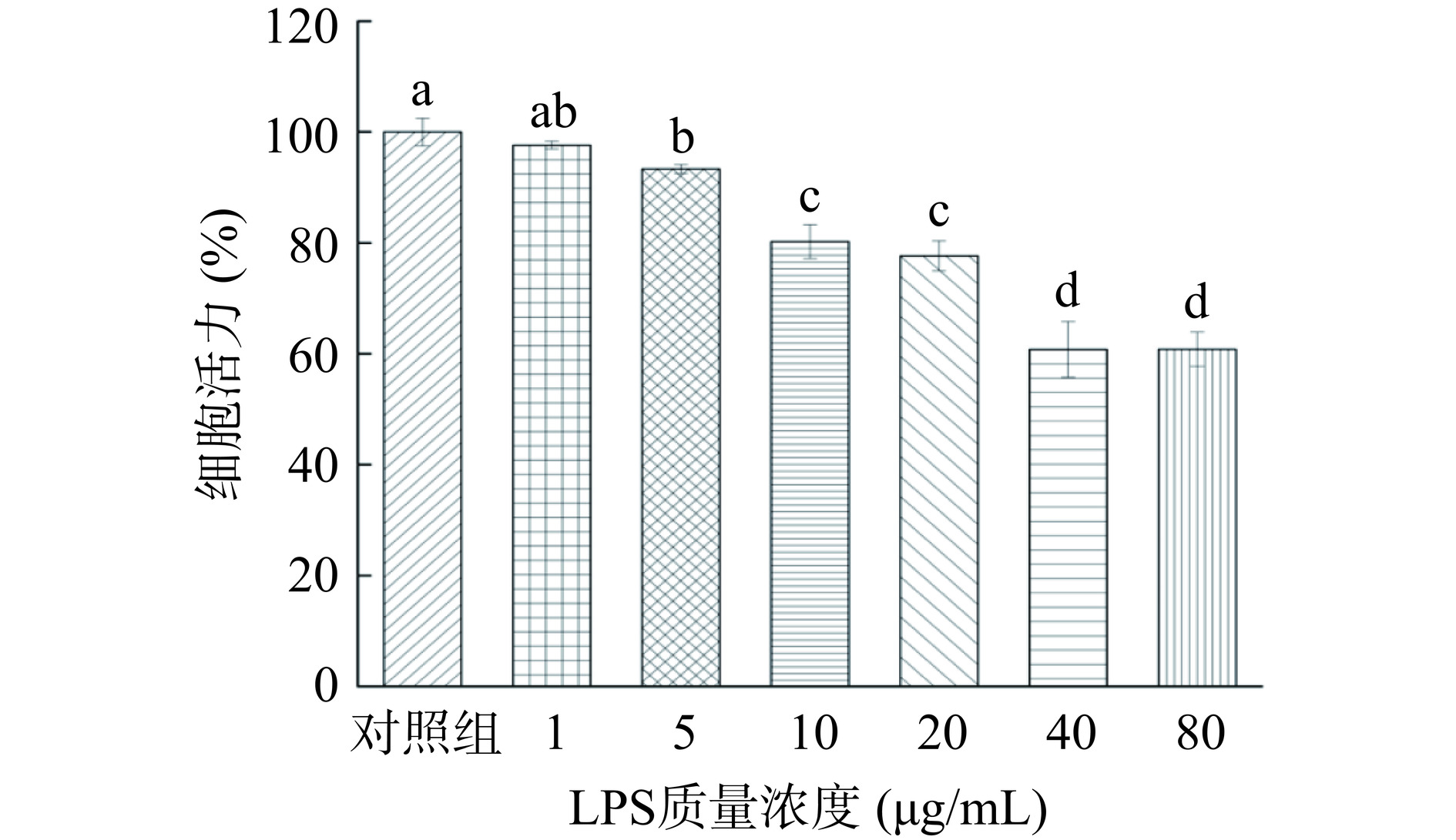
通常认为加入样品后,细胞活力大于90%,说明对细胞没有毒性,可进行后续实验[30]。如图5所示,LPS质量浓度在1~80 μg/mL范围内,细胞活力随LPS质量浓度的增加而逐渐降低,说明不同质量浓度LPS对细胞活力有良好的抑制作用。当LPS浓度达到40 μg/mL时,细胞仅有60%的存活率。在1~5 μg/mL质量浓度范围内,细胞存活率均在95%以上,最终选择具有较高细胞存活率的1 μg/mL(97.67%±0.73%)LPS处理RAW 264.7细胞24 h来构建细胞氧化损伤模型用于后续实验。
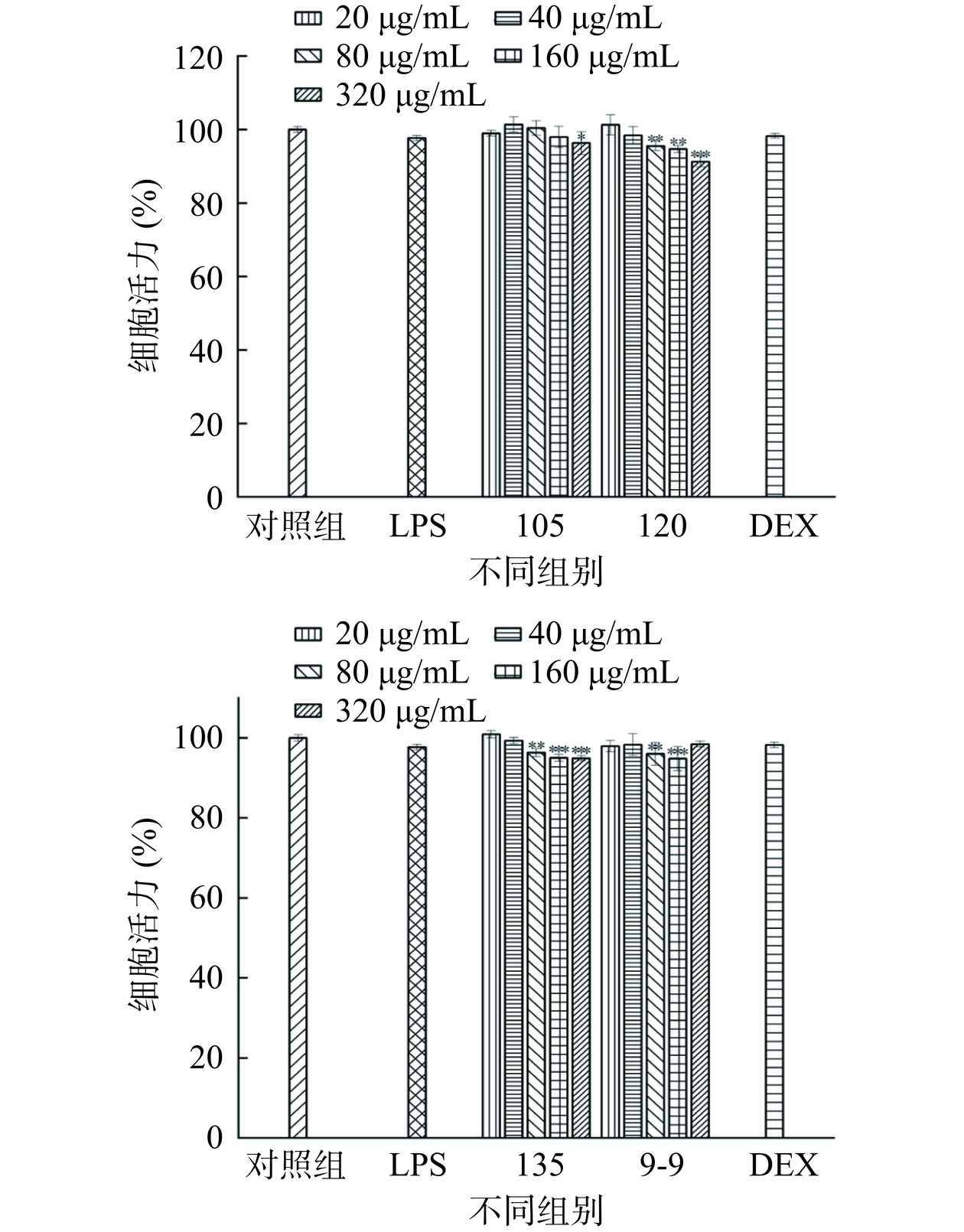
2.4.2 不同处理组对RAW 264.7细胞活力的影响
不同处理组的RAW 264.7细胞活力如图6所示,3组高温处理组和9-9组的滇黄精提取物质量浓度在0~320 μg/mL范围内,RAW细胞存活率均可达到90%以上,证明该质量浓度范围内的滇黄精提取物对RAW细胞无明显的毒性作用,因此,可用于后续实验。
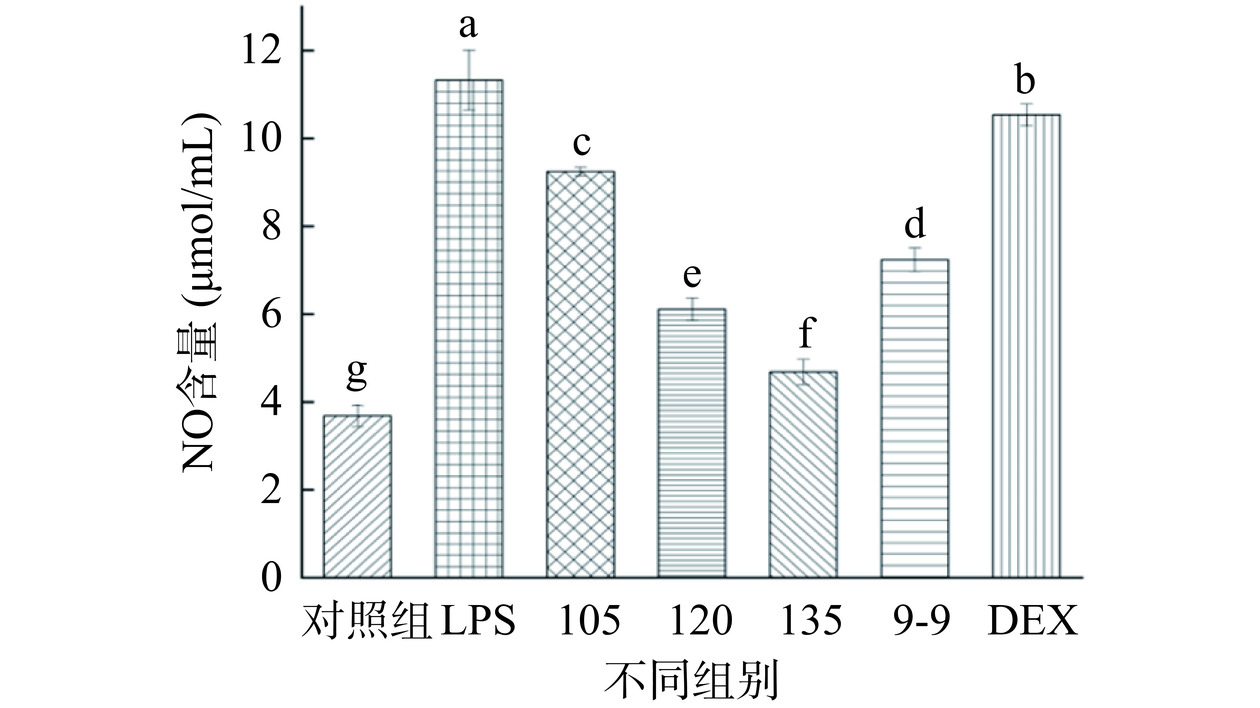
2.4.3 NO的释放
研究表明,LPS处理RAW 264.7细胞后,大量的NO被释放,从而导致炎症[31]。NO产生量的抑制代表药物对细胞抗炎活性强弱,NO产生量越低,则抗炎活性越强[32]。如图7结果显示,相对模型组,不同处理组都具有一定的抗炎活性。105 ℃处理组的抗炎活性相比对照组与9-9组有所降低,随处理温度升高,120 ℃处理组与135 ℃处理组相对对照组与9-9组,抗炎活性都显著增加(P<0.05),与9-9组相比,120 ℃处理组提升15.6%,135 ℃处理组提升35.3%。总体而言,滇黄精经高压蒸汽处理后,135 ℃处理组检测结果显示具有最好抑制NO释放能力(4.6±0.29)μmol/mL,抗炎活性优于9-9组滇黄精,抗炎活性可能与随温度升高甾体皂苷类化合物的增加有关[24]。
2.5 高效液相色谱-三重四极杆质谱滇黄精化合物质量浓度测定
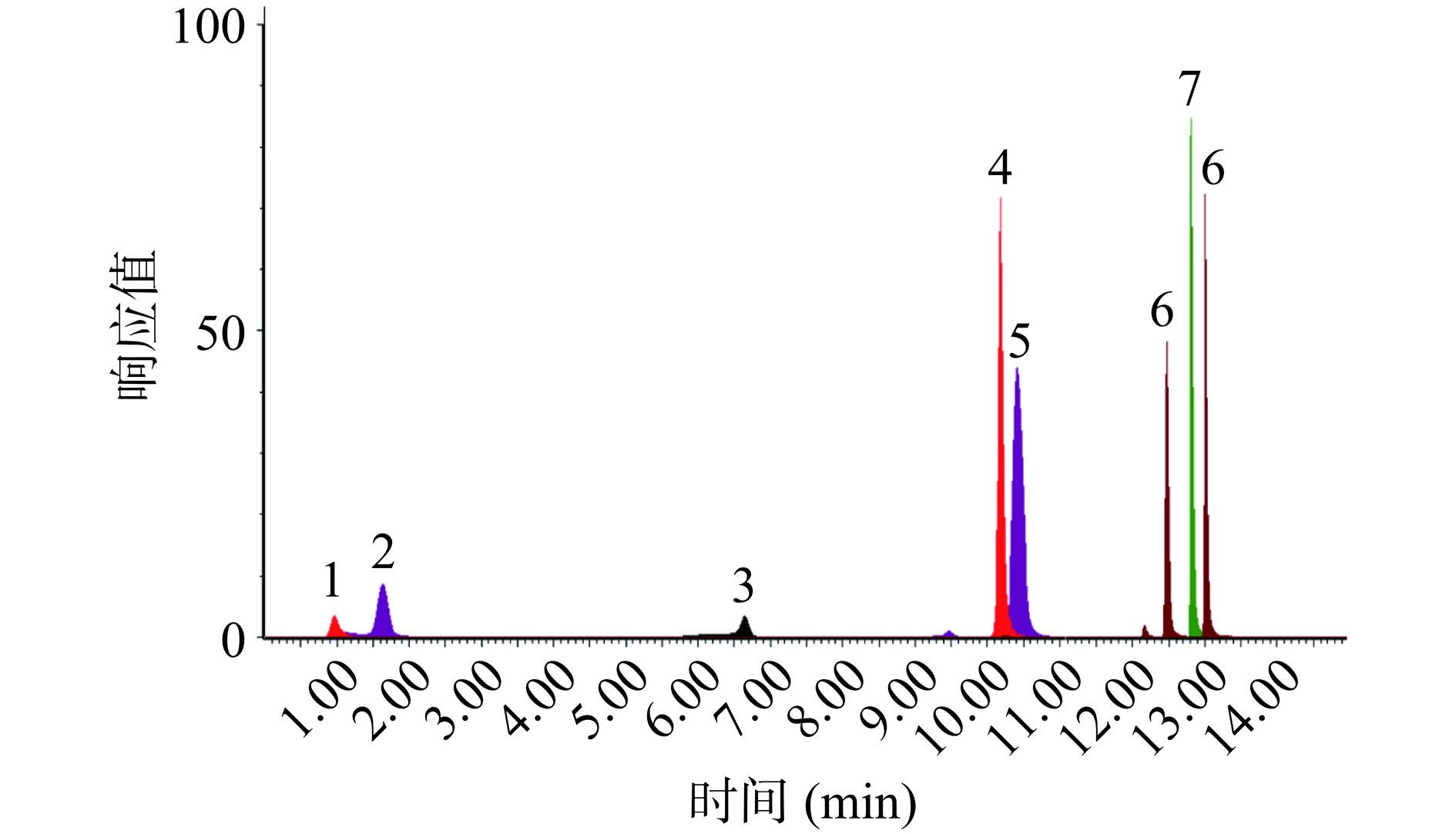
本研究选用ACQUITY UPLC HSS T3 C18色谱柱,以0.1%甲酸水溶液和乙腈溶液作为梯度洗脱流动相,7种目标物在15 min内达到基本分离,提取离子色谱图见图8。
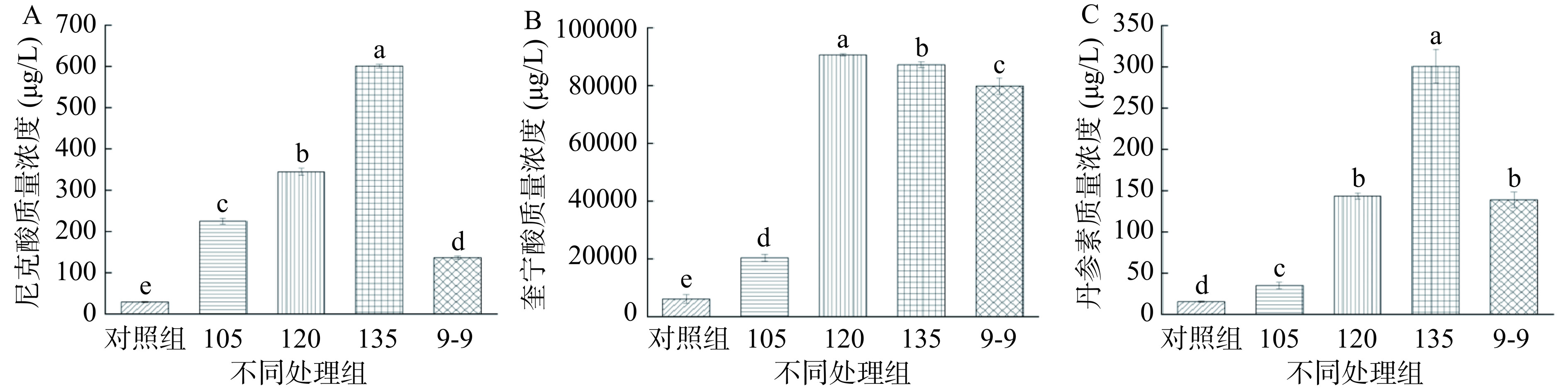
通过质谱检测结果比较了不同高温处理组滇黄精化合物质量浓度变化。如图9A所示,尼克酸质量浓度随加热温度升高而显著上升,且各高温处理组均高于9-9组,135 ℃组相比9-9组尼克酸质量浓度增加了3.4倍;奎宁酸作为高等植物特有的脂环有机酸,具有一定的抗氧化活性[33],图9B显示,奎宁酸在105~120 ℃时,浓度显著上升,在135 ℃组显著下降(P<0.05),含量下降可能是由于高温下脂环族有机酸受热分解所致[34]。135 ℃组比对照组与9-9组分别增加13.3倍,9.2%。图9C检测结果显示,随着加热温度的升高,丹参素质量浓度呈显著上升趋势(P<0.05),在135 ℃组达到最高(300.63±20.46)μg/L,其中120 ℃组与9-9组质量浓度相当,135 ℃组比对照组与9-9组分别增加18.6倍,1.2倍。
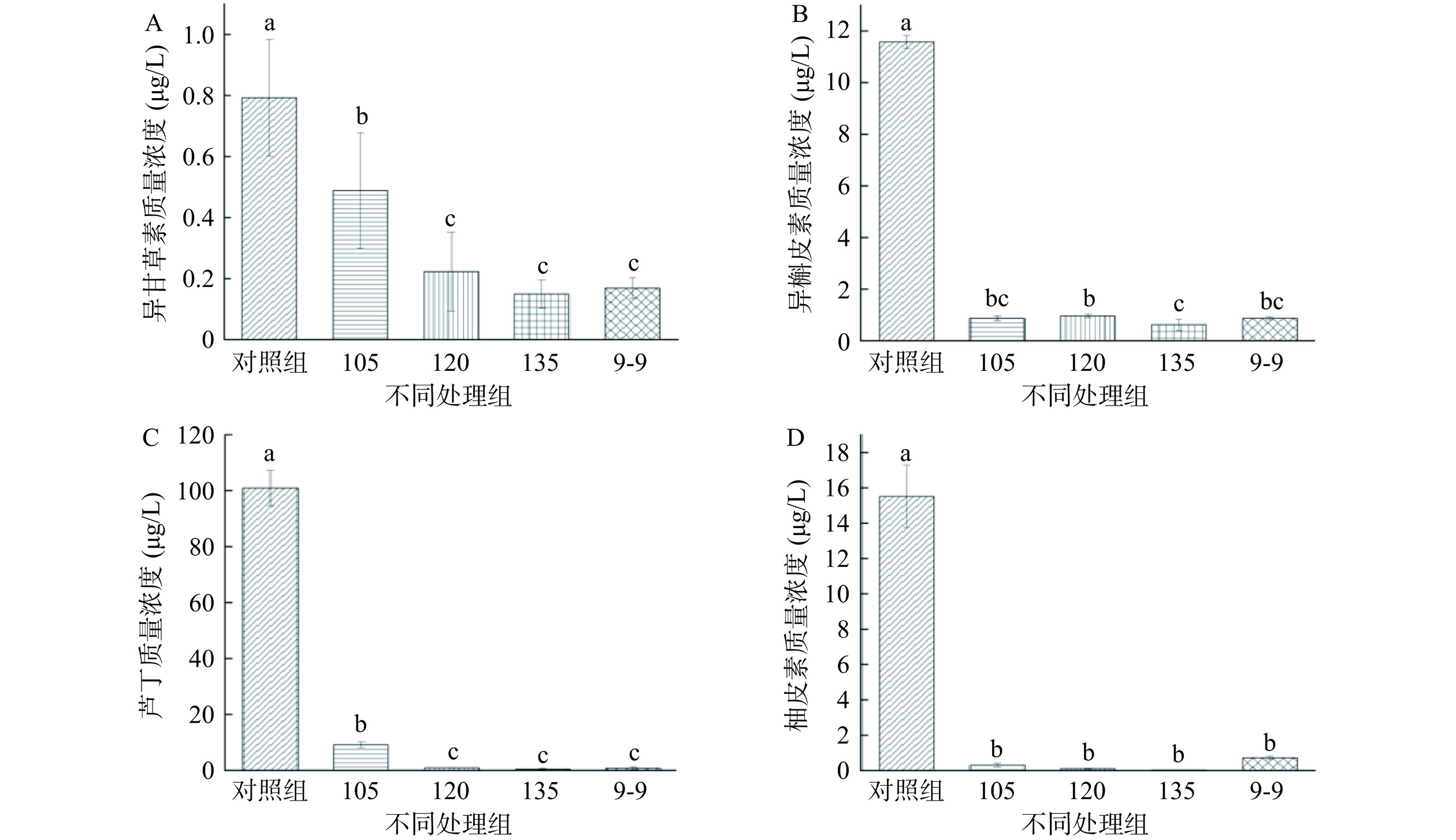
此外,还检测了异槲皮素、异甘草素、芦丁和柚皮素四种化合物质量浓度(图10A~D),结果显示4种化合物质量浓度相比未处理组,含量均显著降低(P<0.05),可能是由于这些抗氧化相关化合物随温度升高,降解速度加快,IOANNOU等[35]也曾发现芦丁在100 ℃下加热6 h,其含量降低22%。135 ℃处理组的异甘草素、异槲皮素、芦丁及柚皮素质量浓度相比9-9组分别减少13%、70.90%、40.30%及24.4倍。
3. 结论
高压蒸汽热加工滇黄精过程中,除总糖外,类黄酮、总皂苷及总酚含量在适宜的热处理温度下含量均有所提升,120 ℃和135 ℃组显现出优于9-9组的抗氧化及抗炎活性,经高压蒸汽处理后,尼克酸、奎宁酸及丹参素质量浓度有所提高。高压蒸汽热处理相比传统九蒸九晒方法,温度、时间等因素可控,操作方便,环境卫生,能够实现工业化标准生产加工黄精,提高药食同源产品的稳定性、一致性。目前,有关热处理加工后黄精的研究甚少,其热加工前后有效成分变化与药理活性之间的关系尚未系统阐述,后续可进一步研究其内在机制,明确物质变化规律。
-
表 1 7个滇黄精对照品化合物的质谱参数
Table 1 Mass spectrum parameters of 7 reference compounds of Polygonatum kingianum
成分 保留时间(min) 母离子(m/z) 子离子(m/z) 碎裂电压(V) 碰撞能量(eV) 尼克酸 1.73 124.13 78.06 20 12 80.11 20 12 奎尼酸 1.15 190.90 85.00 24 20 93.10 24 18 异甘草素 13.08 255.25 119.20 10 15 135.15 10 15 异槲皮素 10.70 462.90 271.00 58 38 300.20 58 27 丹参素 6.86 197.02 73.02 20 12 135.11 20 15 芦丁 10.49 609.10 270.90 60 58 300.00 60 36 柚皮素 12.87 270.90 119.10 8 26 151.00 8 18 表 2 线性关系考察结果
Table 2 Results of linear relationship investigation
成分 回归方程 线性范围(mg/mL) r 尼克酸 Y=5413.43X+12833.2 0.004~0.128 0.9976 奎宁酸 Y=622.196X+1816.62 0.004~0.128 0.9977 异甘草素 Y=11706X+92590.2 0.004~0.128 0.9989 异槲皮素 Y=15881.8X−35891.1 0.004~0.128 0.9962 丹参素 Y=387.473X−516.539 0.004~0.128 0.9960 芦丁 Y=4034.92X+5746.59 0.004~0.128 0.9967 柚皮素 Y=18346.7X+50462 0.004~0.128 0.9964 -
[1] CHENG Y, HUANG X Y, LI L X, et al. Effects of solid fermentation on Polygonatum cyrtonema polysaccharides:Isolation, characterization and bioactivities[J]. Molecules,2023,28(14):5498. doi: 10.3390/molecules28145498
[2] ZHAO L X, XU C Y, ZHOU W L, et al. Polygonati Rhizoma with the homology of medicine and food:A review of ethnopharmacology, botany, phytochemistry, pharmacology and applications[J]. J Ethnopharmacol,2023,309:116296. doi: 10.1016/j.jep.2023.116296
[3] WANG J, WANG F R, YUAN L X, et al. Blood-enriching effects and immune-regulation mechanism of steam-processed Polygonatum Sibiricum polysaccharide in blood deficiency syndrome mice[J]. Front Immunol,2022,13:813676. doi: 10.3389/fimmu.2022.813676
[4] CHAI Y Y, LUO J Y, BAO Y H, et al. Effects of Polygonatum sibiricum saponin on hyperglycemia, gut microbiota composition and metabolic profiles in type 2 diabetes mice[J]. Biomed Pharmacother,2021,143:112155. doi: 10.1016/j.biopha.2021.112155
[5] WANG Y T, NIU H M, MA Y, et al. Isolation, purification, fractionation, and hepatoprotective activity of Polygonatum polysaccharides[J]. Molecules,2024,29(5):1038. doi: 10.3390/molecules29051038
[6] HUANG Z Z, DU X, MA C D, et al. Identification of antitumor active constituents in Polygonatum sibiricum flower by UPLC-Q-TOF-MSE and network pharmacology[J]. ACS Omega,2020,5(46):29755−29764. doi: 10.1021/acsomega.0c03582
[7] ZHAO J L, LIN F Z, LIANG G H, et al. Exploration of the molecular mechanism of Polygonati Rhizoma in the treatment of osteoporosis based on network pharmacology and molecular docking[J]. Front Endocrinol,2022,12:815891. doi: 10.3389/fendo.2021.815891
[8] SUN Y, ZHOU L, SHAN X, et al. Untargeted components and in vivo metabolites analyses of Polygonatum under different processing times[J]. LWT,2023,173:114334. doi: 10.1016/j.lwt.2022.114334
[9] 张莹, 钟凌云. 炮制对黄精化学成分和药理作用影响研究[J]. 江西中医学院学报,2010,22(4):77−79. [ZAHNG Y, ZHONG L Y. Study on chemical constituents and pharmacological effects in pre-and post-processed of Polygonatum[J]. J Jiangxi Univ Tradit Chin Med,2010,22(4):77−79.] ZAHNG Y, ZHONG L Y. Study on chemical constituents and pharmacological effects in pre-and post-processed of Polygonatum[J]. J Jiangxi Univ Tradit Chin Med, 2010, 22(4): 77−79.
[10] YAO X J, DENG Z Y, LI H Y, et al. Effect of processing cycles on the composition of Polygonatum cyrtonema Hua during nine-steam-nine-bask processing[J]. Food Biosci,2022,50:102081. doi: 10.1016/j.fbio.2022.102081
[11] LIAO X Y, WANG S S, LI Y Q, et al. Effects of “nine steaming nine sun-drying” on proximate composition, protein structure and volatile compounds of black soybeans[J]. Food Res Int,2022,155:111070. doi: 10.1016/j.foodres.2022.111070
[12] ZHAO C Q, DAI J P, CHEN F F, et al. The effect of different sterilization methods on the shelf life and physicochemical indicators of fermented pork jerky[J]. Front Nutr,2023,10:1240749. doi: 10.3389/fnut.2023.1240749
[13] JIN J, LAO J, ZHOU R R, et al. Simultaneous identification and dynamic analysis of saccharides during steam processing of rhizomes of Polygonatum cyrtonema by HPLC-QTOF-MS/MS[J]. Molecules,2018,23(11):2855. doi: 10.3390/molecules23112855
[14] ZHOU L Q, LIU T Q, YAN T, et al. ‘Nine steaming nine sun-drying’ processing enhanced properties of Polygonatum kingianum against inflammation, oxidative stress and hyperglycemia[J]. J Sci Food Agric,2024,104(5):3123−3138. doi: 10.1002/jsfa.13203
[15] CHU C, DU Y M, YU X T, et al. Dynamics of antioxidant activities, metabolites, phenolic acids, flavonoids, and phenolic biosynthetic genes in germinating Chinese wild rice (Zizania latifolia)[J]. Food Chem,2020,318:126483. doi: 10.1016/j.foodchem.2020.126483
[16] CHEN W W, CHENG H, XIA W S. Construction of Polygonatum sibiricum polysaccharide functionalized selenium nanoparticles for the enhancement of stability and antioxidant activity[J]. Antioxidants,2022,11(2):240. doi: 10.3390/antiox11020240
[17] FEJÉR J, GRULOVA D, ELIASOVA A, et al. Seasonal variability of Juniperus communis L. Berry ethanol extracts:2. In vitro ferric reducing ability of plasma (FRAP) assay[J]. Molecules,2022,27(24):9027. doi: 10.3390/molecules27249027
[18] 沈圆圆, 于福田, 秦雅莉, 等. 纳豆菌液态发酵制备蚕蛹肽的工艺优化及其抗炎活性研究[J]. 食品工业科技,2022,43(3):162−171. [SEHN Y Y, YU F T, QIN Y L, et al. Optimization of liquid fermentation process for preparation of silkworm pupa peptide by Bacillus natto and its anti-inflammatory activity[J]. Science and Technology of Food Industry,2022,43(3):162−171.] SEHN Y Y, YU F T, QIN Y L, et al. Optimization of liquid fermentation process for preparation of silkworm pupa peptide by Bacillus natto and its anti-inflammatory activity[J]. Science and Technology of Food Industry, 2022, 43(3): 162−171.
[19] GANJE M, JAFARI S M, FARZANEH V, et al. Kinetics modelling of color deterioration during thermal processing of tomato paste with the use of response surface methodology[J]. Heat Mass Transfer,2018,54(12):3663−3671. doi: 10.1007/s00231-018-2394-3
[20] JIANG T, WU T, GAO P Y, et al. Research on processing-induced chemical variations in Polygonatum Cyrtonema rhizome by integrating metabolomics and glycomics[J]. Molecules,2022,27(18):5869. doi: 10.3390/molecules27185869
[21] HUANG J, ZHANG J P, BAI J Q, et al. Chemical profiles and metabolite study of raw and processed Polygoni Multiflori Radix in rats by UPLC-LTQ-Orbitrap MSn spectrometry[J]. Chin J Nat Medicines,2018,16(5):0375−0400. doi: 10.1016/S1875-5364(18)30070-0
[22] KANG M W, CHANG J P, DOH E S, et al. Antioxidant activities of water extracts from steamed Polygonati Rhizoma[J]. Korea J Herbology,2017,32(1):33−40. doi: 10.6116/kjh.2017.32.1.33.
[23] 王倩, 刘星, 许敏, 等. 黄精炮制过程中甾体皂苷的变化研究[J]. 云南中医中药杂志,2017,38(5):72−75. [WANG Q, LIU X, XU M, et al. Study on the change of steroidal saponins in the processing of Polygonatum[J]. Yunnan J Tradit Chin Med Mater Med,2017,38(5):72−75.] WANG Q, LIU X, XU M, et al. Study on the change of steroidal saponins in the processing of Polygonatum[J]. Yunnan J Tradit Chin Med Mater Med, 2017, 38(5): 72−75.
[24] GUAN Y H, LIANG Z W, LI R Y, et al. Chemical composition and antioxidant activity of Polygonatum kingianum processed by the traditional method of "Nine Cycles of Steaming and Sun-Drying"[J]. Food Chem X,2024,22:101292. doi: 10.1016/j.fochx.2024.101292
[25] 王俊楠, 卢琪, 薛淑静, 等. 九蒸九制对鸡头黄精理化性质及抗氧化性的影响[J]. 现代食品科技,2024,40(2):231−245. [WANG J N, LU Q, XUE S J, et al. Effects of nine steaming-nine drying on the physicochemical properties and antioxidant activity of Polygonatum sibiricum Red[J]. Modern Food Science and Technology,2024,40(2):231−245.] WANG J N, LU Q, XUE S J, et al. Effects of nine steaming-nine drying on the physicochemical properties and antioxidant activity of Polygonatum sibiricum Red[J]. Modern Food Science and Technology, 2024, 40(2): 231−245.
[26] AHMED M, EUN J B. Flavonoids in fruits and vegetables after thermal and nonthermal processing:A review[J]. Crit Rev Food Sci,2018,58(18):3159−3188. doi: 10.1080/10408398.2017.1353480
[27] KOWALCZEWSKI P Ł, PAUTER P, SMARZYńSKI K, et al. Thermal processing of pasta enriched with black locust flowers affect quality, phenolics, and antioxidant activity[J]. J Food Process Pres,2019,00:14106.
[28] 陈怡静, 李萍, 康雨薇, 等. 干热处理对杏鲍菇蛋白抗氧化活性的影响[J]. 食品安全质量检测学报,2022,13(13):4390−4396. [CEHN Y J, LI P, KANG Y W, et al. Effects of dry heat treatment on the antioxidation activities of Pleurotus eryngii protein[J]. J Food Saf Qual,2022,13(13):4390−4396.] CEHN Y J, LI P, KANG Y W, et al. Effects of dry heat treatment on the antioxidation activities of Pleurotus eryngii protein[J]. J Food Saf Qual, 2022, 13(13): 4390−4396.
[29] 夏智慧, 崔文玉, 丰程凤, 等. 蒸汽爆破对从植物中提取的多酚含量及抗氧化活性影响的研究进展[J]. 江苏农业学报,2021,37(5):1352−1360. [XIA Z H, CUI W Y, FENG C F, et al. Research progress on the effects of steam explosion on the content and antioxidant activity of polyphenols extracted from plants[J]. Jiangsu Agricultural Sciences,2021,37(5):1352−1360.] XIA Z H, CUI W Y, FENG C F, et al. Research progress on the effects of steam explosion on the content and antioxidant activity of polyphenols extracted from plants[J]. Jiangsu Agricultural Sciences, 2021, 37(5): 1352−1360.
[30] LIU F, LIU Y, FENG X, et al. Structure characterization and in vitro immunomodulatory activities of carboxymethyl pachymaran[J]. Int J Biol Macromol,2021,178:94−103. doi: 10.1016/j.ijbiomac.2021.02.046
[31] BOULAABA M, KALAI F Z, DAKHLAOUI S, et al. Antioxidant, antiproliferative and anti-inflammatory effects of Glaucium flavum fractions enriched in phenolic compounds[J]. Med Chem Res,2019,28:1995−2001. doi: 10.1007/s00044-019-02429-y
[32] YOUN U J, PARK E J, KONDRATYUK T P, et al. Anti-inflammatory triterpenes from the apical bud of Gardenia sootepensis[J]. Fitoterapia,2016,114:92−97. doi: 10.1016/j.fitote.2016.08.012
[33] GRITSUNOV A, PEEK J, CABALLERO J D, et al. Structural and biochemical approaches uncover multiple evolutionary trajectories of plant quinate dehydrogenases[J]. Plant J,2018,95:812−822. doi: 10.1111/tpj.13989
[34] ZABALZA A, ZULET-GONZALEZ A, BARCO-ANTONANZAS M, et al. Physiological approach to the use of the natural compound quinate in the control of sensitive and resistant Papaver rhoeas[J]. Plants,2020,9(9):1215. doi: 10.3390/plants9091215
[35] IOANNOU I, CHEKIR L, GHOUL M. Effect of heat treatment and light exposure on the antioxidant activity of flavonoids[J]. Processes,2020,8(9):1078. doi: 10.3390/pr8091078





 下载:
下载:

 下载:
下载:



