Identification of Major Bitter Compounds in Zanthoxylum bungeanum Under Different Thermal Processing Techniques
-
摘要: 花椒作为重要的香辛料,其苦味成分的存在对食品的整体风味具有显著影响。为了深入探究花椒苦味成分的形成机制及其影响因素,本研究以苦味强度为指标,利用感官评价对花椒在水煮和油炸时的工艺条件进行单因素优化。进一步地,通过有机溶剂萃取、固相萃取和制备型高效液相色谱技术,从花椒水和花椒油中分离并富集了苦味馏分。随后,利用滋味稀释分析评估了这些苦味馏分对食品感官特性的贡献。此外,采用高效液相色谱-质谱联用技术,对花椒水和花椒油中的苦味成分进行了成分鉴定。研究结果表明,在水煮过程中,花椒用量的增加和水煮时间的延长会增强苦味,而花椒的苦味在油炸过程中会随着温度升高、时间延长和用量增加而增强。推荐花椒水和花椒油的食用、加工条件如下:花椒水推荐在100 ℃下煮制5 min,花椒用量控制在2 g以下,以减少苦味。而花椒油建议在105~120 ℃的油炸温度下炸制10~30 min,花椒用量可适量添加,以保持较低苦味。花椒水中主要的苦味物质可能是槲皮素-3-鼠李糖龙胆二糖苷、槲皮素-3,7-二-O-β-D-吡喃葡萄糖苷、槲皮素-3-O-槐糖和荷叶碱,而花椒油中主要的苦味物质是羟基-α-山椒素和羟基-β-山椒素。本研究为花椒的加工利用、品质调控以及除苦抑苦等提供数据参考和理论依据。Abstract: Zanthoxylum bungeanum, as a vital spice, the presence of its bitter components has a notable impact on the overall flavor of the food. To deeply explore the formation mechanism of the bitter components in Z. bungeanum and correlated influencing factors, this study used bitterness intensity as an indicator and employed sensory evaluation to optimize the processing conditions of Z. bungeanum during boiling and frying through single-factor optimization. Furthermore, organic solvent extraction, solid-phase extraction, and preparative high-performance liquid chromatography were used to isolate and concentrate the bitter fractions from Z. bungeanum water and oil. Subsequently, taste dilution analysis was employed to evaluate the contribution of these bitter fractions to the sensory characteristics of food. Additionally, high-performance liquid chromatography-mass spectrometry was adopted to identify the bitter components in Z. bungeanum water and oil. The results indicated that during the boiling process, increasing the amount of Z. bungeanum and extending the boiling time intensified the bitterness, while the bitterness of Z. bungeanum during frying process increased with raised temperature, extended frying time, and increased amount of Z. bungeanum. The recommended conditions for consumption and processing of Z. bungeanum water and Z. bungeanum oil were as follows: Z. bungeanum water was recommended to be boiled at 100 ℃ for 5 min, and the dosage of Z. bungeanum could be controlled at less than 2 g to reduce the bitter flavor. Z. bungeanum oil was recommended to be fried at 105~120 ℃ for 10~30 min, and the amount of Z. bungeanum could be added moderately to keep the bitter flavor low. The main bitter substances in Z. bungeanum water might be quercetin-3-rhamnose gentiobioside, quercetin-3,7-di-O-β-D-glucopyranoside, quercetin-3-O-robinobioside, and nuciferine, while the primary bitter compounds in Z. bungeanum oil were hydroxy-α-sanshool and hydroxy-β-sanshool. This study provides data reference and theoretical basis for the processing, quality control, and bitterness reduction of Z. bungeanum.
-
花椒是芸香科(Rrutaceae)花椒属(Zanthoxylum L.)植物的成熟干燥果皮。花椒富含多种生物活性物质,我国古籍《神农本草经》记载花椒具有除寒、明目等食用药用价值[1],且现代科学研究也证明了其具有抗胃、宫颈、结肠和肝等肿瘤细胞增殖的作用[2]。在食品加工领域,特别是在火锅、卤味、肉制品等加工过程中,花椒作为 “八大调味料”之一,不仅可以增添香气,还可以有效去除肉类腥膻臭气和增加食欲等[3−6]。然而,花椒的苦味特性成为其在实际应用中的一大挑战[7],在一定程度上影响了整体口感,限制了其在某些食品中的应用范围。
花椒中的苦味物质来源广泛,多为天然产物及其衍生物[8],还有可能受食品加工工艺[9−11]和储藏[12−13]的影响。目前,对花椒中天然苦味物质来源研究较多。丁涌波等[14]采用感官评定结合气相色谱-质谱鉴定的方法初步鉴定花椒精油中的苦味嫌疑成分是酮类和醇类,且醇类和酮类之间具有协同作用。梅小飞[15]研究指出花椒属植物富含多种香豆素成分,其中包括简单香豆素、呋喃香豆素以及吡喃香豆素等,赋予花椒独特苦涩风味。此外,花椒中具有体外抗氧化活性的辛夷脂素,对花椒苦味也具有一定影响[16]。黄山[17]的研究发现苯丙氨酸、缬氨酸、精氨酸、山奈酚、表儿茶素、槲皮素、槲皮苷和异槲皮苷等为青花椒重点苦味代谢物。Yang等[18]采用非靶向代谢组学方法,对青花椒的代谢物进行全覆盖检测,首次全面界定了青花椒中的苦味物质。Huang等[19]确定了槲皮素-3-半乳糖苷是成熟青花椒苦味的主要来源。还有研究人员实验发现花椒的苦涩口感类似于黄连、苦参,测定红花椒中含有0.032 mg/g与黄连苦味成分一致的小檗碱,证实花椒的苦味物质可能源于生物碱和黄酮类化合物[20−21]。Ke等[22]利用感官引导分流技术研究发现7-甲氧基香豆素和8-异戊烯基山奈酚是花椒中的主要苦味来源物质,并且能激活苦味受体hTAS2R14。非天然苦味化合物主要来自食品的加工处理、制作和储藏等过程。不同的热加工工艺对花椒的苦味物质有一定影响,公敬欣等[23]模拟厨房水煮、油煎条件,发现热油处理时花椒麻味素的浸出量远高于水煮,且水煮或热油处理的时间增长,萃取出的花椒麻味素量均呈现先增后减的趋势。扈宁轩[24]首次在花椒残渣中发现山茶黄酮苷A、3’,5,7-三羟基-4’-甲氧基黄酮7芸香苷、Lethedioside A和山奈酚-3-芸香糖苷化合物。综上所述,虽然对花椒中的天然苦味物质研究较多,但对于热加工工艺下花椒苦味物质的研究较少,尤其是食品中常用的花椒加工处理方法,因此,有必要进一步研究热加工工艺对花椒苦味的影响,探讨不同热加工工艺对花椒苦味的影响规律和苦味来源。
因此,本研究针对花椒在水煮和油炸过程中的工艺条件进行了单因素优化,以苦味评分为指标,探究不同热加工工艺对花椒样品苦味影响的规律。采用优化的溶剂萃取法和Pre-HPLC技术,对不同热加工工艺下花椒样品中苦味物质分离和纯化,用滋味稀释分析(Taste Dilution Analysis,TDA)得到关键苦味馏分,使用高效液相色谱-质谱联用(HPLC-MS)进行定性分析,明确苦味物质,解析花椒在不同热加工工艺下苦味的来源。本研究合理控制花椒的加工条件,为后续花椒的加工利用提供基础数据参考和科学依据。解析不同热加工工艺下花椒苦味的来源,为花椒加工品质调控、除苦抑苦等提供理论依据。
1. 材料与方法
1.1 材料与仪器
汉源红花椒 购买于四川友嘉食品有限公司,干燥花椒经挑选除杂去梗后制样,用粉碎机粉碎成粉,过40目筛,再转移到密封袋中,储存在阴凉干燥处备用,现用现制;J.T. Baker甲醇(色谱纯)、槲皮素-3-O-槐糖(99%以上)、槲皮素-龙胆二糖苷(99%以上)、槲皮素-3,4-二-O-葡萄糖苷(99%以上) 北京迈瑞达科技有限公司;羟基-α-山椒素(99%以上)、羟基-β-山椒素(99%以上) 成都麦德生科技有限公司;液氮(99.9990%)、氮气(99.9992%) 北京氦普北分气体工业有限公司;硫酸奎宁(分析纯) 北京半夏科技发展公司;所有分离用有机溶剂均为国产分析纯。
JA2003型数字电子天平 上海舜宇恒平科学仪器有限公司;Taisite万能粉碎机 天津市泰斯特仪器有限公司;DF-101S集热式恒温加热磁力搅拌器 上海力辰邦西仪器科技有限公司;Himac CR22N/21N型高速冷冻离心机 日本Hitachi公司;EVELA N-1100型旋转蒸发仪 上海贤德实验仪器有限公司;Christ Alpha1-4 LSCplus冷冻干燥机 德国Christ公司;Clever-S系列芷昂超纯水机 芷昂仪器(上海)有限公司;1200分析型高效液相色谱仪、1200制备型高效液相色谱仪、三重四级杆质谱Agilent 6530、Zorbax Eclipse SB-C18色谱柱(4.6 mm×250 mm,5 μm)、Zorbax Eclipse SB-C18色谱柱(21.2 mm×250 mm,7 μm)、SPE固相萃取柱6 mL 美国Agilent公司。
1.2 实验方法
1.2.1 不同热加工工艺对花椒苦味的影响
1.2.1.1 温度
花椒水的烹饪一般在常压下煮沸操作,因此,本实验主要关注花椒油的制备,而未对花椒水的水煮温度进行探究。在制备花椒油时,参考烹饪过程中的日常用量,精确称量3.57 g粉碎花椒,加入到100 g已加热的大豆油中。随后,在105、110、115、120、125 ℃的温度下分别油炸30 min。冷却后,使用纱布过滤得到花椒油样品。所有样品均为现用现制,平行重复3次。
1.2.1.2 时间
花椒水的水煮时间:精确称量3.57 g粉碎花椒,加入到100 g沸腾的超纯水中。在100 ℃下分别水煮5、15、30、45、60 min。停止加热后,加入超纯水使样品恢复至原始重量。随后混匀,并使用纱布过滤得到花椒水样品。花椒油的油炸时间:精确称量3.57 g粉碎花椒,加入到100 g已加热至适宜温度的大豆油中。在110 ℃下分别油炸10、15、20、25、30 min。冷却后,使用纱布过滤得到花椒油样品。所有样品均为现用现制,平行重复3次。
1.2.1.3 用量
花椒水的花椒用量:分别精确称量0.5、1、2、3、4 g的粉碎花椒,并各自加入到100 g沸腾的超纯水中,然后在100 ℃下水煮60 min。停止加热后,加入超纯水使样品恢复至原始重量。混匀后,使用纱布过滤得到花椒水样品。花椒油的花椒用量:分别精确称量0.5、1、2、3、4 g的粉碎花椒,并各自加入到100 g已加热至适宜温度的大豆油中,然后在110 ℃油炸30 min。冷却后,使用纱布过滤得到花椒油样品。所有样品均为现用现制,平行重复3次。
1.2.1.4 感官评价
苦味参照溶液的配制:称量适量的奎宁,分别按照不同质量浓度(1、0.50、0.25、0.125、0.0625、0.03125、0.015625 mg/mL)制备样品溶液,并按照苦味强度的递减顺序,将各浓度溶液的苦味程度依次定义为7分到1分。以苦味程度为0分的超纯水作苦味样品的对照。
按照GB/T 16291.1-2012《感官分析 选拔、培训与管理评价员一般导则 第1部分:优选评价员》[25]的基本要求进行评价员筛选,本实验选择14名来自北京工商大学分子感官科学实验室受过训练的评价人员(8名女生,6名男生,平均年龄25岁)。使用苦味参照溶液进行为期两周的苦味感知培训,然后正式进行样品的感官评价。评价人员在评价前至少1 h未进食,参照苦味标准溶液的相应分值对样品打分,感官评价分数为评价小组成员的平均值。
1.2.2 花椒中苦味物质的鉴定
1.2.2.1 样品制备
花椒水:精确称量20 g粉碎花椒加到100 g沸腾的超纯水中,100 ℃煮60 min。停止加热后,补充超纯水使样品恢复至原来重量。充分混匀后,用纱布过滤以去除花椒残渣,得到花椒水样。接着,使用高速冷冻离心机在8000 r/min和4 ℃下离心30 min,取上清液作为实验所需具有苦味的花椒水,冷藏在−20 ℃备用。
花椒油:精确称量20 g粉碎花椒加到100 g已加热的大豆油中,120 ℃油炸30 min。待其冷却后,用纱布过滤以去除花椒残渣,得到花椒油样,冷藏在−20 ℃备用。
1.2.2.2 花椒水中苦味物质的提取
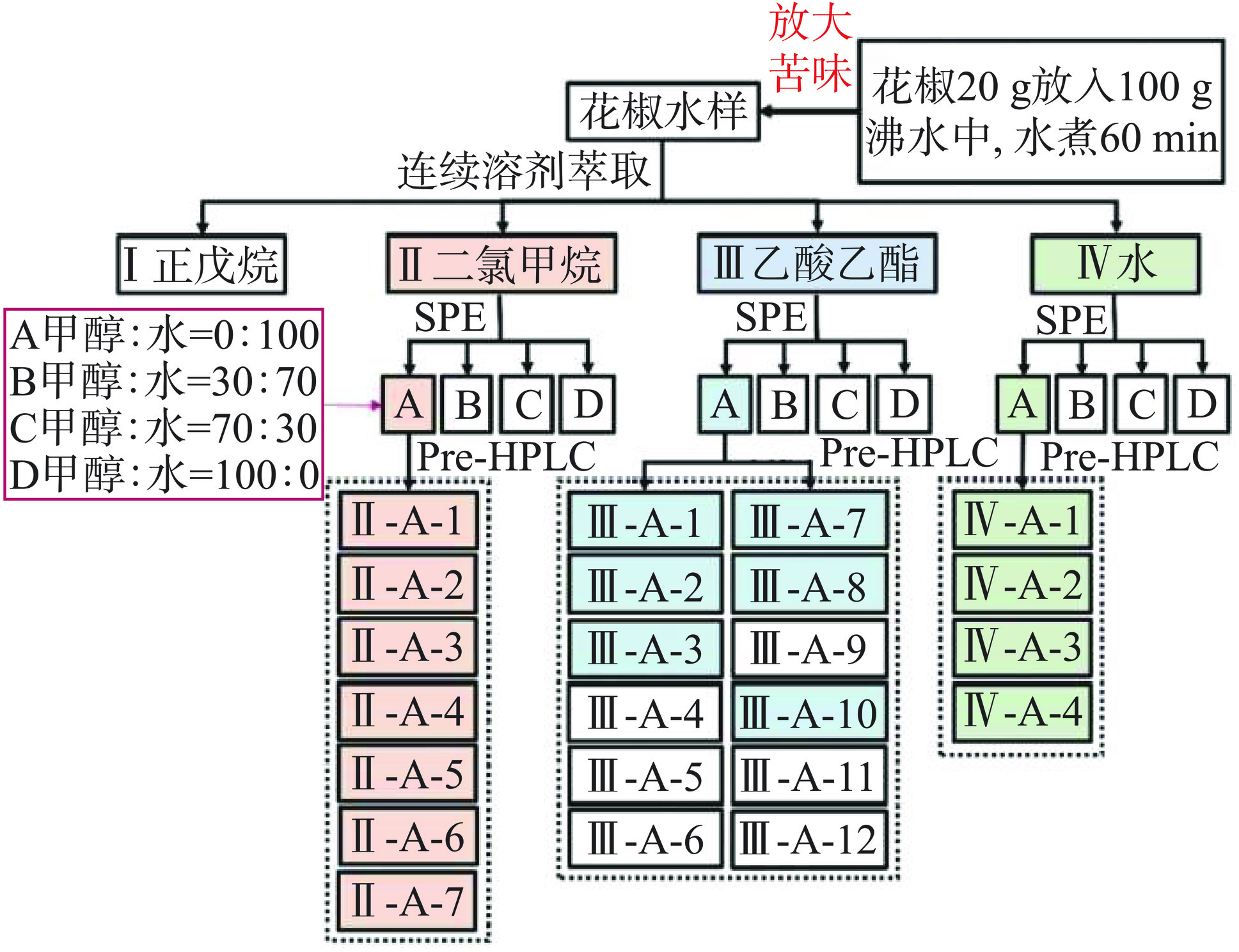
溶剂连续萃取:如图1所示,首先取30 mL花椒水置于分液漏斗中,并加入15 mL正戊烷溶液进行萃取,振荡后静置分层1 h,分离得到正戊烷溶液,此步骤重复4次;接着,向正戊烷萃取后的花椒水溶液中加入15 mL二氯甲烷溶液进行萃取,振荡后静置分层1 h,分离得到二氯甲烷溶液,此步骤也重复4次;最后,向经正戊烷、二氯甲烷溶液萃取后的花椒水溶液加入15 mL乙酸乙酯溶液萃取,振荡后静置分层1 h,分离得到乙酸乙酯溶液取出,此步骤同样重复4次。通过以上步骤,依次得到四个组分:I(正戊烷萃取液)、II(二氯甲烷萃取液)、III(乙酸乙酯萃取液)、IV(萃取后的花椒水)。
固相萃取(SPE):如图1所示,首先,将冷冻干燥好的II、III、IV三个苦味明显组分以花椒水原有比例溶于超纯水中。然后,使用1 mL甲醇分别润洗6 mL的SPE管3次,之后再用1 mL超纯水润洗1次。接下来,将1 mL复溶后的II组分加入到SPE管,缓缓压入填充物进行分离,再分别用1 mL甲醇/水(0:100)、1 mL甲醇/水(30:70)、1 mL甲醇/水(70:30)、1 mL甲醇/水(100:0)进行萃取,每种比例分别萃取3次,用离心管收集溶液,从而得II-A组分、II-B组分、II-C组分和II-D组分。III和IV两个组分复溶后,使用同样的SPE方法进行萃取,分别得到III-A、III-B、III-C、III-D四个组分和IV-A、IV-B、IV-C、IV-D四个组分。
1.2.2.3 花椒油中苦味物质的提取
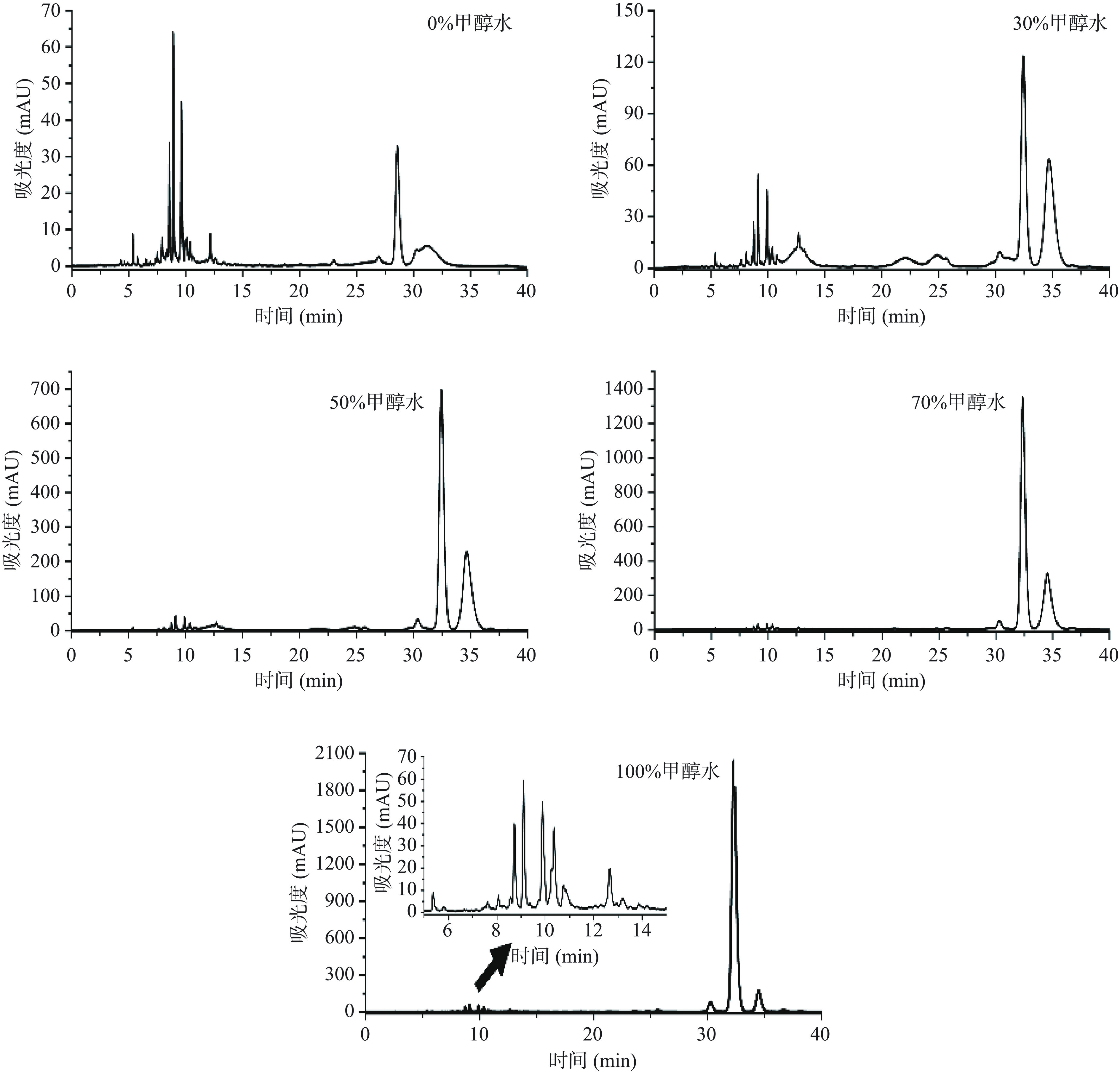
花椒油样品借鉴亚麻籽油中苦味物质的萃取方法进行萃取[26]。用不同比例的甲醇水溶液优化花椒油样品萃取效果。取30 mL花椒油,分三次加入30 mL甲醇/水(0:100)萃取,振荡混匀后静置1 h,将萃取液过膜后,作为用于液相操作的样品。接下来,分别用甲醇/水(30:70)、甲醇/水(50:50)、甲醇/水(70:30)、甲醇/水(100:0)对花椒油样品依次进行萃取。通过以上步骤,依次得到I、II、III、IV共四个组分。
1.2.2.4 冷冻干燥
用旋转蒸发仪把各组分或馏分的有机溶剂旋蒸出去,根据情况添加少量纯净水旋蒸得水溶液装入带盖离心管,放入−80 ℃冰箱冷冻8 h。取出后,装有水溶液的离心管用保鲜膜封口并针头扎孔,后放入冷冻干燥机。冷阱温度−80 ℃,主干燥时间24 h,终末干燥时间24 h。
1.2.2.5 制备型液相色谱(Pre-HPLC)
待测样品经0.22 μm滤膜过滤后放入样品盘。流动相:纯甲醇(A相)和超纯水(B相),色谱柱:Zorbax Eclipse SB-C18色谱柱(21.2 mm×250 mm,7 μm),进样量为2 mL;柱温为25 ℃,波长为280 nm。其它的仪器分析条件具体如下:
花椒水II-A:流速为18 mL/min,洗脱梯度:5%溶剂A,0~5 min;58%溶剂A,10~22 min;70%溶剂A,23~30 min;80%溶剂A,45 min;95%溶剂A,46 min;5%溶剂A,60 min。
花椒水III-A:流速为18 mL/min,洗脱梯度:5%溶剂A,0 min;20%溶剂A,10 min;50%溶剂A,30 min;55%溶剂A,40 min;70%溶剂A,60 min;5%溶剂A,65 min。
花椒水IV-A:流速为18 mL/min,洗脱梯度:5%溶剂A,0~5 min;40%溶剂A,25 min;60%溶剂A,45 min;95%溶剂A,50 min;5%溶剂A,55 min。
花椒油:流速为15 mL/min,洗脱梯度:5%溶剂A,0 min;55%溶剂A,3 min;63%溶剂A,5~10 min;64%溶剂A,30 min;80%溶剂A,35 min;5%溶剂A,40 min。
1.2.2.6 高效液相色谱(HPLC)
待测样品经0.22 μm的滤膜过滤后放入样品盘。流动相:纯甲醇(A相)和超纯水(B相),色谱柱:Zorbax Eclipse SB-C18色谱柱(4.6 mm×250 mm,5 μm),柱温为25 ℃,流速为1 mL/min,波长为280 nm。其它的仪器分析条件具体如下:
花椒水IV-A-2:进样量为10 μL,洗脱梯度:5%溶剂A,0 min;30%溶剂A,10 min;42%溶剂A,30 min;5%溶剂A,35 min。
花椒油:进样量为3 μL,洗脱梯度:5%溶剂A,0 min;55%溶剂A,3 min;63%溶剂A,5~10 min;64%溶剂A,35 min;80%溶剂A,40 min;5%溶剂A,45 min。
1.2.2.7 高效液相质谱(HPLC-MS)
HPLC条件:各样品所用色谱柱、流速、柱温、洗脱方法与其HPLC分析时相同。
三重四级杆质谱(QQQ)条件:载气流速为10 L/min;在正、负离子模式下,碎片化电压120 V,离子源温度350 ℃,毛细管电压4000 V,电子能量10 eV,扫描方式:全扫描,质量扫描范围为50~1000 m/z。
1.2.2.8 滋味稀释分析(TDA)
为了筛选出对花椒样品苦味贡献最大的化合物,采用TDA法进行分析。TDA法是把人的舌头作为生物感应器,检测食品中存在的呈味物质的阈值,并通过稀释倍数得到的味觉稀释因子(Taste Dilution factors,TD因子)来评价其贡献程度。TD因子越高的化合物,对整体滋味轮廓贡献越大[27]。
冷冻干燥后的苦味馏分用3%乙醇水按样品原有比例复溶,同时准备两个3%乙醇水的空白样品;待测样品和空白样品均用超纯水以2的倍数向下逐级稀释8倍,同一稀释倍数的待测样品和两个空白样品为一组;感官评价人员从稀释倍数从高到低品尝,在三个样品中选择出有苦味差异的样品。若感官评价人数半数以上判断正确,则此稀释倍数为该待测馏分的TD因子。所有苦味馏分的TD因子均按上述操作进行实验得到。
1.2.2.9 苦味物质的定性
首先,通过HPLC分析结果中各峰分别对应的紫外吸收光谱图,确定苦味物质的大致种类。然后,利用HPLC-MS检测该峰的碎片离子,分析并判断该物质。与已有研究文献中该物质的碎片离子构成对比进行初步定性。最后,通过分析该物质与其标准品的出峰时间,明确苦味物质。
1.3 数据处理
所有实验均重复3次。表格制作和数据分析通过Microsoft Office Excel 2019软件完成。采用SPSS 24.0进行显著性分析,P<0.05代表差异显著。质谱分析数据使用Agilent Mass Hunter qualitative analysis B.07.00软件。分析型、制备型液相色谱图以及HPLC-MS的色谱图由Origin 2021软件绘制而成。
2. 结果与分析
2.1 不同热加工工艺对花椒苦味的影响
2.1.1 温度
在固定花椒油的花椒用量3.57 g和油炸时间30 min的情况下,将不同油炸温度所得花椒油样品进行苦味感官评价。如表1所示,在油炸温度105~120 ℃内,花椒油的苦味程度随温度的升高而增强;在120~125 ℃时,花椒油样的苦味程度未发生变化。
表 1 不同油温下花椒油样苦味感官评价结果Table 1. Sensory evaluation results of Z. bungeanum oil bitterness under different oil temperatures2.1.2 时间
在花椒用量3.57 g和水煮温度100 ℃的情况下,不同水煮时间所得花椒水样品进行苦味感官评价。由表2所示,在水煮时间5~60 min内,花椒水的苦味程度随时间的延长而增强。水煮时间5 min时,花椒水的苦味程度已可被感官评价人员明显感知。在花椒用量3.57 g和油炸温度110 ℃的情况下,不同油炸时间所得花椒油苦味评价结果如表2所示,在油炸时间为10~30 min内,花椒油的苦味程度整体随着时间的延长略有增强但均不明显。
表 2 不同时间下花椒水样和花椒油样苦味感官评价结果Table 2. Sensory evaluation results of Z. bungeanum water and Z. bungeanum oil bitterness at different times样品 时间(min) 苦味得分(平均分) 苦味描述 花椒水 5 3.14a 苦 15 4.00b 苦 30 4.17b 苦 45 4.85c 苦 60 5.14c 苦 花椒油 10 0.14b 不苦 15 0a 不苦 20 0.14b 不苦 25 0.28c 不苦 30 0.42c 不苦 2.1.3 用量
在100 ℃水煮60 min下,不同花椒用量所得花椒水样品进行苦味感官评价。结果如表3所示,在花椒用量0.5~4 g内,花椒水的苦味程度随着用量的增加而增强。在花椒用量为2 g以上时,花椒水有明显苦味,且苦味程度的变化明显。在110 ℃油炸30 min下,不同花椒用量所得花椒油样品进行苦味感官评价。结果如表3所示,在花椒用量0.5~4 g内,花椒油的苦味程度随用量增加略有增强,但苦味均不明显。
表 3 不同花椒用量下花椒水样和花椒油样苦味感官评价结果Table 3. Sensory evaluation results of Z. bungeanum water and Z. bungeanum oil bitterness under different dosages of Z. bungeanum样品 用量(g) 苦味得分(平均分) 苦味描述 花椒水 0.5 0.83a 不苦 1 1.67b 微苦 2 3.17c 苦 3 4.17d 苦 4 5.33e 苦 花椒油 0.5 0.17a 不苦 1 0.17a 不苦 2 0.67b 不苦 3 0.67b 不苦 4 1.33c 微苦 综上所述,推荐花椒水和花椒油的食用、加工条件如下:花椒水推荐在100 ℃下煮制5 min,花椒用量控制在2 g以下,以减少苦味。而花椒油建议在105~120 ℃的油炸温度下炸制10~30 min,花椒用量可适量添加,以保持较低苦味。因此,适当控制油炸温度、时间和花椒用量,以及水煮时间和花椒用量,可以保持花椒油和花椒水的良好口感。
2.2 不同热加工工艺下花椒中苦味物质的研究
2.2.1 溶剂提取方法的优化
2.2.1.1 花椒水溶剂提取方法
按溶剂极性从低到高的顺序对花椒水进行连续溶剂萃取,其感官评价结果如表4所示,二氯甲烷和乙酸乙酯萃取的组分微苦,三种溶剂萃取后的花椒水溶液苦味更明显,其苦味得分可达到3.71分。正戊烷萃取效果不佳,其苦味得分仅0.86分,而二氯甲烷和乙酸乙酯可萃取出部分苦味物质。通过样品中出峰化合物的紫外光谱可知,二氯甲烷和乙酸乙酯可提取一些游离生物碱、黄酮类、香豆素等成分,萃取后的水溶液中可能会有氨基酸、糖类、无机盐等水溶性物质的存在。因此,花椒水中的苦味物质可能是由这些化学成分组成。
表 4 花椒水样连续溶剂萃取所得液体的苦味感官评价结果Table 4. Results of bitter taste sensory evaluation of the liquid obtained from continuous solvent extraction of Z. bungeanum water samples组分 苦味得分(平均分) 苦味描述 I(正戊烷萃取液) 0.86a 不苦 II(二氯甲烷萃取液) 2.86b 微苦 III(乙酸乙酯萃取液) 2.29b 微苦 IV(萃取后的花椒水) 3.71c 苦 2.2.1.2 花椒油甲醇水提法
采用不同比例甲醇水提取花椒油样品,所得的HPLC结果如图2所示,随着提取液中甲醇比例的加大,峰的个数没有明显变化,但6~14 min峰的分离效果变得更好,且最后出峰的几个物质的响应值也更高。因此,100%的甲醇萃取花椒油样品效果较好。
2.2.2 水煮条件下花椒苦味物质的分析
2.2.2.1 花椒水中苦味物质的分离提取
花椒水样品经连续溶剂萃取,旋蒸出萃取液中的有机溶剂后放入冷冻干燥机,冷冻干燥好的I(正戊烷萃取液)、II(二氯甲烷萃取液)、III(乙酸乙酯萃取液)、IV(萃取后的花椒水)四个组分的固体粉末以花椒水原有比例溶于超纯水中,由感官评价人员评价。结果显示,II组分和III组分微苦,IV组分的苦味较为明显(表4)。因此,如图1所示,为进一步分离纯化各组分中的苦味物质,对II、III、IV三个苦味明显的组分进行SPE处理。
三个组分依次采用甲醇/水(0:100)、甲醇/水(30:70)、甲醇/水(70:30)和甲醇/水(100:0)对SPE管中的样品进行分离,萃取液经冷冻干燥后以花椒水原有比例复溶,再进行感官评价。如表5、表6和表7所示,三个组分用甲醇/水(0:100)萃取的组分苦味程度均最强烈,其中乙酸乙酯萃取液中的A组分苦味评分最高,说明乙酸乙酯对于花椒水中的苦味物质有更好的溶解能力和选择性。因此,采用Pre-HPLC对II-A、III-A、IV-A三个组分进行分析,以筛选出各组分中的苦味物质。
表 5 花椒水样的二氯甲烷萃取液经SPE所得液体的苦味感官评价结果Table 5. Results of the bitter taste sensory evaluation of the liquid obtained by SPE from dichloromethane extract of Z. bungeanum water组分 苦味得分(平均分) 苦味描述 Ⅱ-A 5.57c 苦 Ⅱ-B 0.57a 不苦 Ⅱ-C 0.14a 不苦 Ⅱ-D 2.14b 微苦 表 6 花椒水样的乙酸乙酯萃取液经SPE所得液体的苦味感官评价结果Table 6. Results of the bitter taste sensory evaluation of the liquid obtained by SPE from ethyl acetate extract of Z. bungeanum water组分 苦味得分(平均分) 苦味描述 Ⅲ-A 6.43c 苦 Ⅲ-B 1.29b 微苦 Ⅲ-C 1.57b 微苦 Ⅲ-D 0.57a 不苦 表 7 连续溶剂萃取后的花椒水样经SPE所得液体的苦味感官评价结果Table 7. Results of bitter taste sensory evaluation of the liquid obtained by SPE of Z. bungeanum water after continuous solvent extraction组分 苦味得分(平均分) 苦味描述 Ⅳ-A 3.14c 苦 Ⅳ-B 0.28a 不苦 Ⅳ-C 1.71b 微苦 Ⅳ-D 1.57b 微苦 2.2.2.2 花椒水中重要苦味馏分的筛选
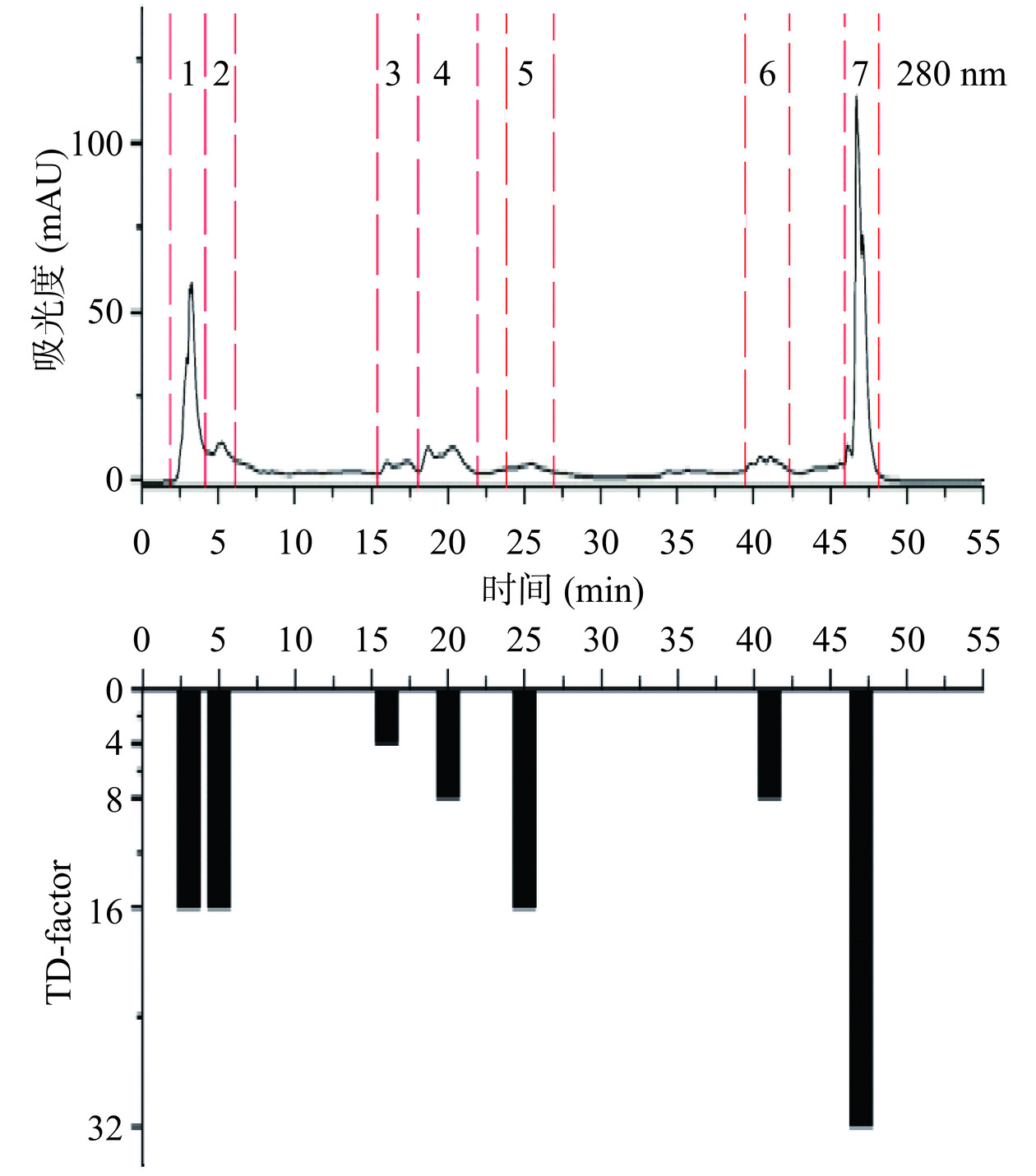
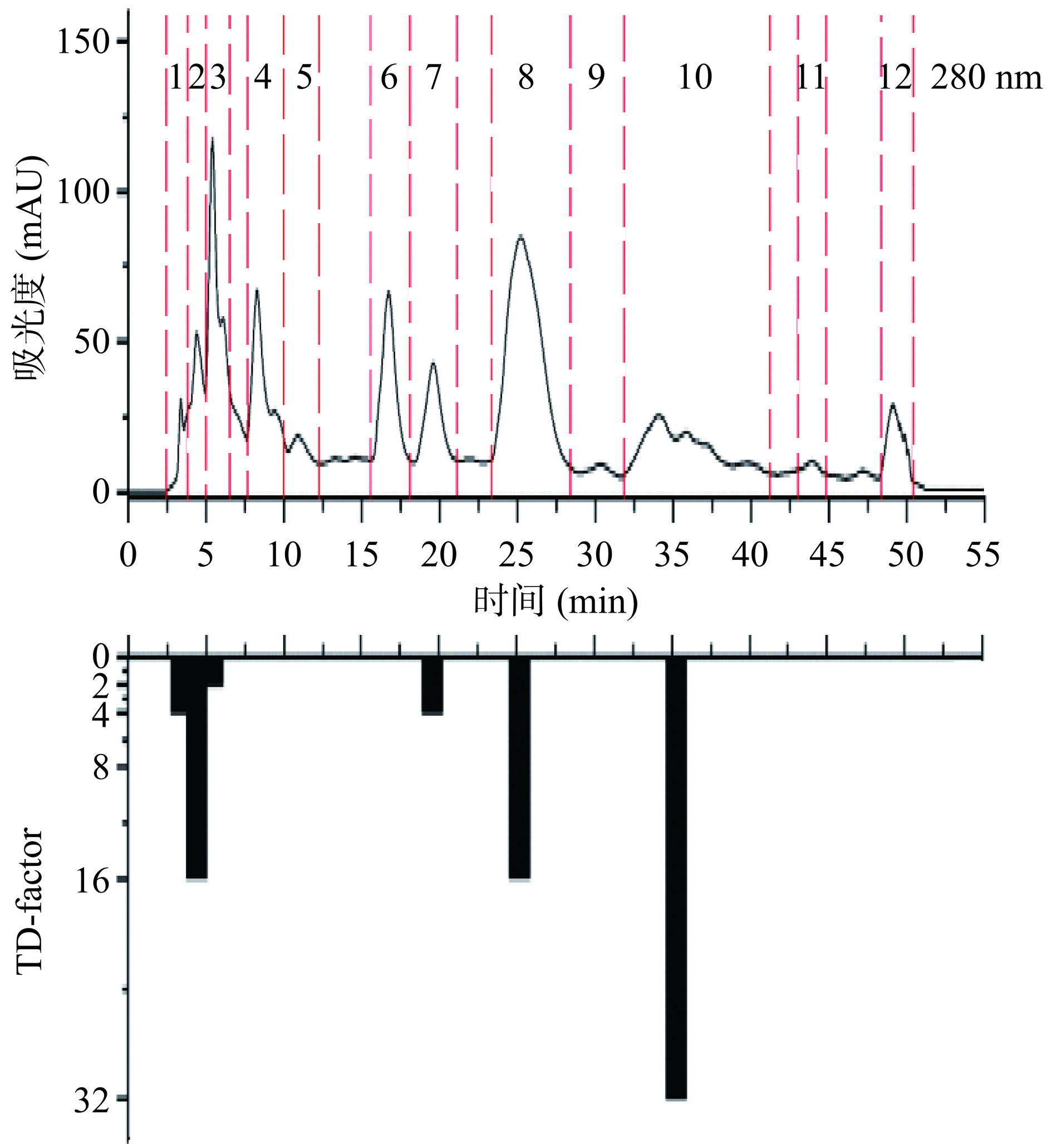
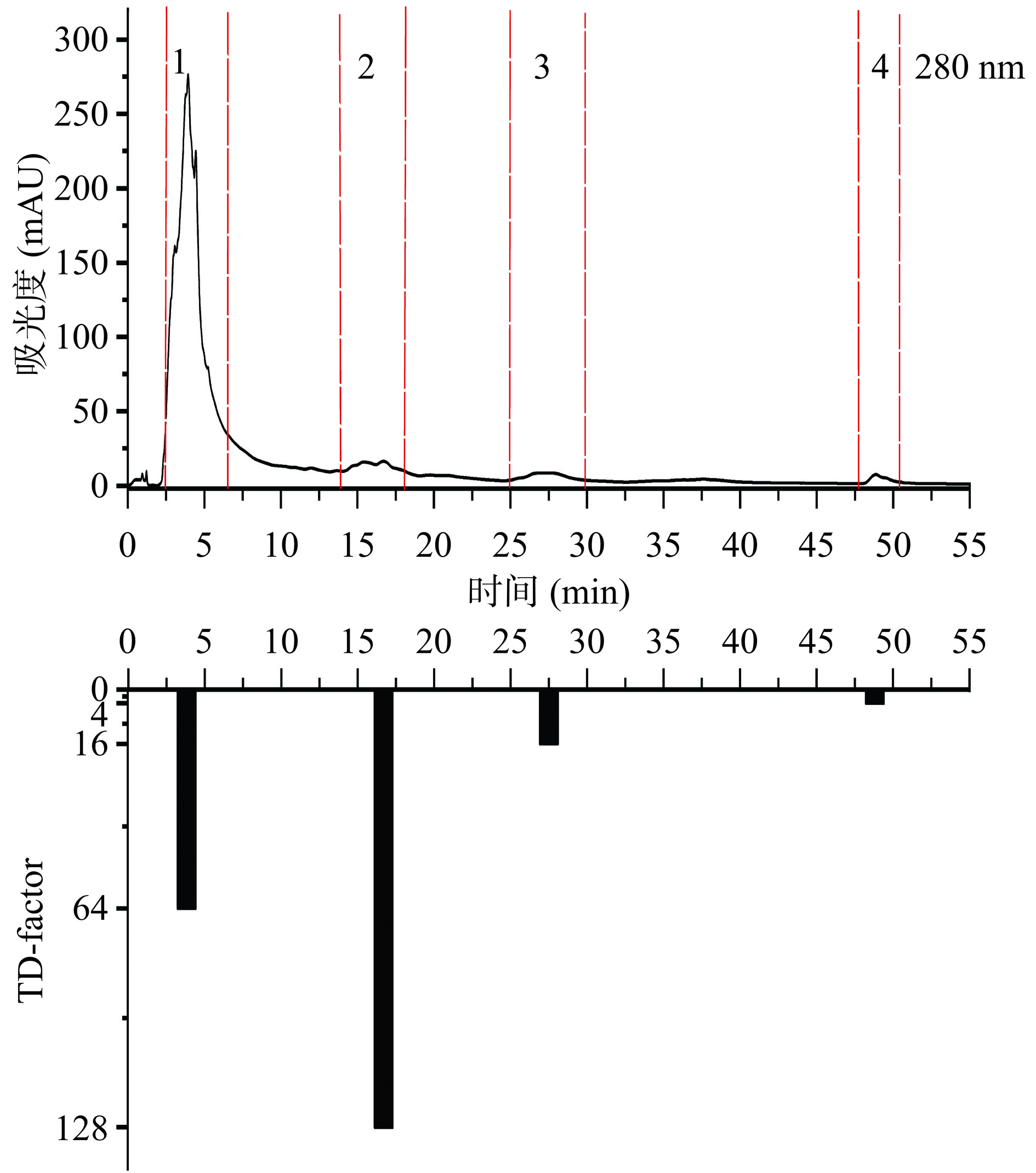
如图3所示,采用Pre-HPLC对II-A进行分析,共收集到7个馏分,多次富集后将这7个馏分冷冻干燥后进行感官评价,可知7个馏分具有不同程度的苦味。如图4所示,采用Pre-HPLC将III-A分离成12个馏分,多次富集并冷冻干燥后感官评价,其中第1、2、3、7、8、10个馏分有苦味。如图5所示,IV-A经Pre-HPLC分离后,共收集到4个馏分且感官评价发现有不同程度的苦味。
图3所示,II-A-7的TD因子最高,TD=32,对II-A的苦味贡献程度最大。图4所示,III-A-10的TD因子最高,TD=32,对III-A的苦味贡献程度最大。图5所示,IV-A-2的TD因子最高,TD=128,对IV-A的苦味贡献程度最大。综上,IV-A-2馏分是对花椒水样苦味贡献程度最大的馏分,其次是IV-A-1(TD=64)、II-A-7(TD=32)、III-A-10(TD=32)。无论采用何种溶剂进行萃取,花椒水样品中苦味物质均保留在水溶液中,即其水溶性极好且极性较强。
2.2.2.3 花椒水中苦味物质的鉴定
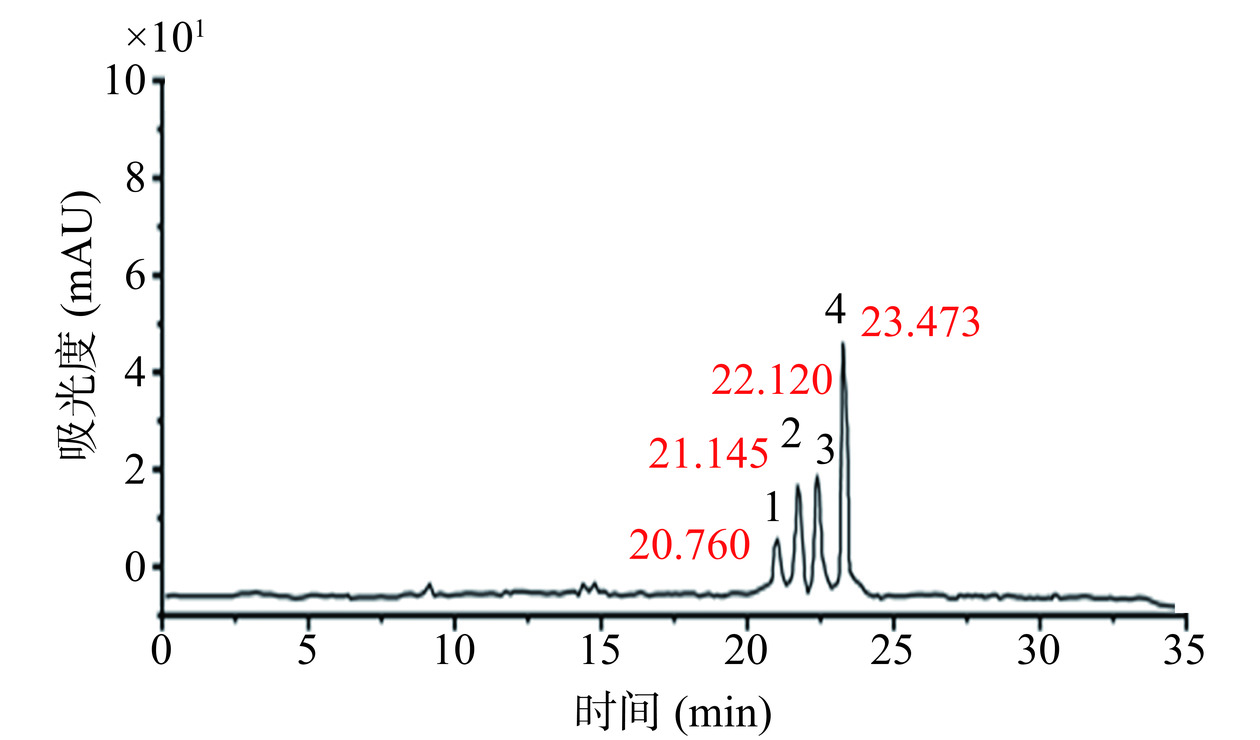
通过HPLC-MS对IV-A-2中的苦味物质进行分析,其结果如图6所示,HPLC图谱中含有四个主要色谱峰。根据HPLC-DAD紫外吸收光谱,可对IV-A-2的苦味物质进行初步定性。其中前三个峰可能是黄酮类物质,第四个峰可能是生物碱类或多酚类物质。
进一步利用HPLC-MS对花椒水IV-A-2中的四个主要的色谱峰进行质谱分析和结构解析,如表8所示。根据各个峰对应的碎片离子进行分析:
表 8 花椒水样IV-A-2中苦味物质的质谱解析Table 8. Mass spectral analysis of the bitter substances in Z. bungeanum water IV-A-2峰 保留时间(min) 波长(nm) 正离子模式 负离子模式 鉴定/推测结果 1 20.760 280,350 773(100),303 771(100),625 槲皮素-3-鼠李糖龙胆二糖苷 2 21.145 280,350 649(100),303,465 625(100) 槲皮素-3,7-二-O-β-D-吡喃葡萄糖苷 3 22.120 280,350 649(100),303 625(100) 槲皮素-3-O-槐糖 4 23.473 280 296(100),318 294(100) 荷叶碱 峰1,由DAD检测器的紫外吸收图谱得该成分为黄酮类;由正离子模式下出现分子离子峰m/z 773([M+H]+),负离子模式下出现分子离子峰m/z 771([M-H]−),可知该物质的分子量为m/z 772。正离子模式下,有碎片离子m/z 303([Y0+H]+),为槲皮素苷元离子;在负离子模式下,主要碎片有m/z 625([M-H]−-146 u),是分子离子峰失去一分子鼠李糖(146 u)产生的。因此,可推测该物质为槲皮素-3-鼠李糖龙胆二糖苷。
峰2,紫外最大吸收在280和350 nm,可知该物质为黄酮类,具典型的黄酮类物质裂解规律。正离子模式下,其分子离子峰为m/z 649([M+Na]+),主要碎片有m/z 303([Y0+H]+),为槲皮素苷元离子,是m/z 465([M+H]+-162 u)失去一分子葡萄糖(162 u)生成的。因此,该物质含两分子葡萄糖(162 u),推测可能为槲皮素-龙胆二糖苷、槲皮素-3,4-二-O-葡萄糖苷或槲皮素-3,7-二-O-β-D-吡喃葡萄糖苷等。经标准品验证,该物质不是前两者物质,但是第三个物质无法购买到标准品。因此,最终推测其为槲皮素-3,7-二-O-β-D-吡喃葡萄糖苷。
峰3,由紫外吸收图谱可知,该馏分为类黄酮化合物;由正离子模式下的碎片离子进行进一步的结构推定,其分子离子峰为m/z 649([M+Na]+),主要碎片有m/z 303([Y0+H]+),为槲皮素苷元离子。负离子模式下有分子离子峰m/z 625([M-H]−),其失去一分子槐糖(342 u)即可产生槲皮素苷元离子m/z 301([Y0+H]−)。通过比对该物质标准品的出峰时间,将该物质进一步定性为槲皮素-3-O-槐糖。
峰4,从紫外吸收图谱知,该物质可能是酚类物质。其正离子模式下出现分子离子峰m/z 296([M+H]+)和m/z 318([M+Na]+),且负离子模式下出现分子离子峰m/z 294([M-H]−)。根据此实验所得离子碎片以及紫外吸收与文献中荷叶碱的离子碎片的对比结果,推测其可能为荷叶碱[28−29]。但仅从质谱结果无法对该物质准确定性。
因此,花椒水样中主要的苦味物质可能是槲皮素-3-鼠李糖龙胆二糖苷、槲皮素-3,7-二-O-β-D-吡喃葡萄糖苷、槲皮素-3-O-槐糖和荷叶碱。
2.2.3 油炸条件下花椒苦味物质的分析
2.2.3.1 花椒油中苦味物质的分离提取及重要苦味馏分的筛选
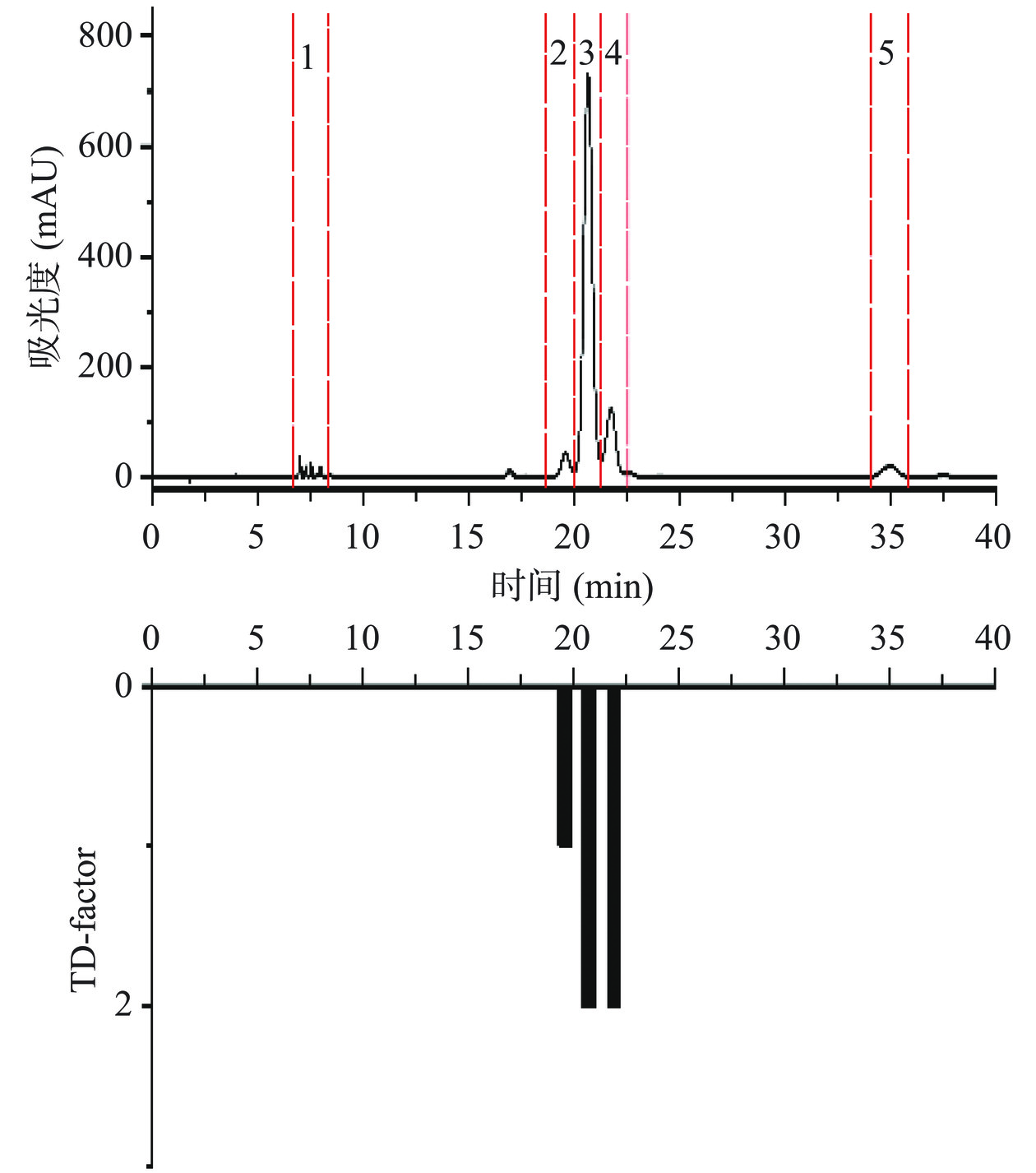
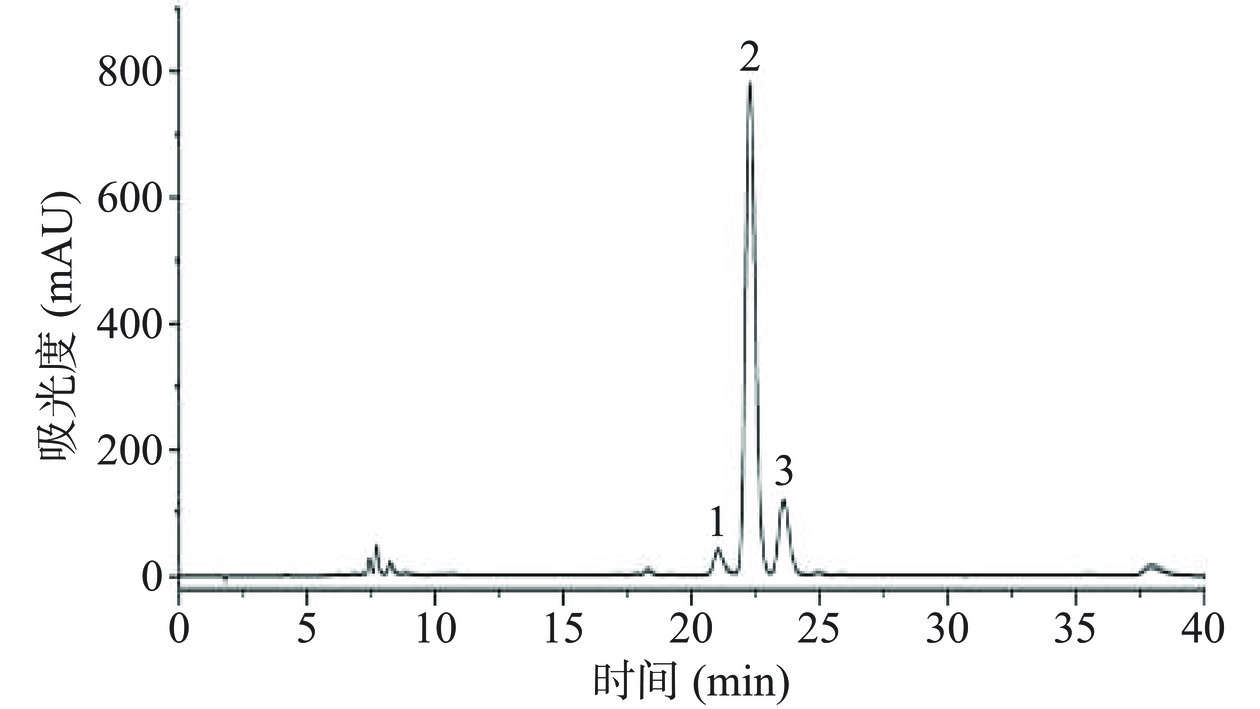
为探索对花椒油样苦味贡献程度最大的物质,花椒油样品采用100%的甲醇提取后经Pre-HPLC分离纯化,并通过TDA对苦味馏分进行分析。如图7所示,花椒油样品的甲醇萃取液共分离成5个馏分,所有馏分冷冻干燥后用含有3%乙醇的超纯水以花椒油原有比例进行复溶,经感官评价可知第2、3、4个馏分具有苦味。通过对苦味馏分进行TDA分析,第3和第4个馏分的TD值较高,TD值均为2,说明这两个馏分对花椒油的苦味贡献程度最大,且馏分3还可感受到明显的麻味。
2.2.3.2 花椒油中苦味物质的鉴定
通过HPLC-MS对花椒油中的苦味物质进行分析,如图8所示,HPLC图谱中有三个主要的色谱峰。根据HPLC-DAD的紫外吸收光谱,可对花椒油样品中苦味物质进行初步定性,这三个峰可能是生物碱类物质。利用HPLC-MS对收集到的红花椒油苦味馏分进行质谱分析,得到各自碎片离子(如表9所示)。根据各个碎片离子对红花椒油的苦味馏分进行结构解析。
表 9 花椒油样苦味物质的质谱解析Table 9. Mass spectrum analysis of bitter substances in Z. bungeanum oil samples峰 保留时间(min) 波长(nm) 负离子模式 正离子模式 鉴定/推测结果 1 20.480 270 262 286(100),264,143,186 羟基-ε-山椒素 2 21.667 270 262 286(100),264 羟基-α-山椒素 3 22.613 270 262 286(100),246,110 羟基-β-山椒素 峰1、2、3:通过质谱碎片m/z 286.1777 [M+Na]+,m/z 264 [M+H]+,m/z 246 [M+H−H2O]+,可以推测馏分1、2、3为羟基-山椒素的同分异构体。对比文献,参考羟基-山椒素在C18色谱柱上的洗脱顺序,可推断馏分1、2、3分别为羟基-ε-山椒素、羟基-α-山椒素、羟基-β-山椒素[30]。且经标准品进行进一步辨别后,可对馏分2和馏分3进行准确定性。
羟基-α-山椒素和羟基-β-山椒素是花椒油中主要的苦味物质,已有学者提出羟基-α-山椒素有刺痛感和麻味以及羟基-β-山椒素具麻味、涩味和苦味[31]。羟基-α-山椒素和羟基-β-山椒素的苦味TD值均为2,对花椒油苦味具有相同的贡献程度,与文献[31]中只有后者具苦味的结果矛盾。羟基-α-山椒素和羟基-β-山椒素是花椒中典型的麻味物质,推测其原因可能是麻味或刺痛感对苦味的感知造成影响。
3. 结论
本研究通过对温度、时间以及样品质量等条件的优化,通过感官评价获得花椒进行热加工的最优条件及不同热加工工艺对花椒样品苦味的影响规律。实验结果显示,水煮和油炸工艺中,花椒用量是影响苦味的关键因素。水煮时间延长和花椒用量增加均显著增强苦味;而在油炸工艺中,高温长时油炸对苦味影响有限,但增加花椒用量会明显增强苦味。且与油炸处理相比,花椒在水煮处理时更易产生苦味。花椒水与花椒油的最佳食用加工条件分别为:前者100 ℃ 煮 5 min,花椒少于 2 g;后者 105~120 ℃ 油炸 10~30 min,花椒适量。利用有机溶剂提取法、SPE、Pre-HPLC 对不同热加工工艺下花椒样品中苦味物质进行分离纯化,明确了花椒苦味的主要物质为槲皮素类化合物、荷叶碱及羟基-α/β-山椒素等。这些发现为花椒加工技术的改进和产品质量控制提供了重要的科学支撑,有助于实现花椒风味的优化,并促进相关产业的健康发展。
-
表 1 不同油温下花椒油样苦味感官评价结果
Table 1 Sensory evaluation results of Z. bungeanum oil bitterness under different oil temperatures
表 2 不同时间下花椒水样和花椒油样苦味感官评价结果
Table 2 Sensory evaluation results of Z. bungeanum water and Z. bungeanum oil bitterness at different times
样品 时间(min) 苦味得分(平均分) 苦味描述 花椒水 5 3.14a 苦 15 4.00b 苦 30 4.17b 苦 45 4.85c 苦 60 5.14c 苦 花椒油 10 0.14b 不苦 15 0a 不苦 20 0.14b 不苦 25 0.28c 不苦 30 0.42c 不苦 表 3 不同花椒用量下花椒水样和花椒油样苦味感官评价结果
Table 3 Sensory evaluation results of Z. bungeanum water and Z. bungeanum oil bitterness under different dosages of Z. bungeanum
样品 用量(g) 苦味得分(平均分) 苦味描述 花椒水 0.5 0.83a 不苦 1 1.67b 微苦 2 3.17c 苦 3 4.17d 苦 4 5.33e 苦 花椒油 0.5 0.17a 不苦 1 0.17a 不苦 2 0.67b 不苦 3 0.67b 不苦 4 1.33c 微苦 表 4 花椒水样连续溶剂萃取所得液体的苦味感官评价结果
Table 4 Results of bitter taste sensory evaluation of the liquid obtained from continuous solvent extraction of Z. bungeanum water samples
组分 苦味得分(平均分) 苦味描述 I(正戊烷萃取液) 0.86a 不苦 II(二氯甲烷萃取液) 2.86b 微苦 III(乙酸乙酯萃取液) 2.29b 微苦 IV(萃取后的花椒水) 3.71c 苦 表 5 花椒水样的二氯甲烷萃取液经SPE所得液体的苦味感官评价结果
Table 5 Results of the bitter taste sensory evaluation of the liquid obtained by SPE from dichloromethane extract of Z. bungeanum water
组分 苦味得分(平均分) 苦味描述 Ⅱ-A 5.57c 苦 Ⅱ-B 0.57a 不苦 Ⅱ-C 0.14a 不苦 Ⅱ-D 2.14b 微苦 表 6 花椒水样的乙酸乙酯萃取液经SPE所得液体的苦味感官评价结果
Table 6 Results of the bitter taste sensory evaluation of the liquid obtained by SPE from ethyl acetate extract of Z. bungeanum water
组分 苦味得分(平均分) 苦味描述 Ⅲ-A 6.43c 苦 Ⅲ-B 1.29b 微苦 Ⅲ-C 1.57b 微苦 Ⅲ-D 0.57a 不苦 表 7 连续溶剂萃取后的花椒水样经SPE所得液体的苦味感官评价结果
Table 7 Results of bitter taste sensory evaluation of the liquid obtained by SPE of Z. bungeanum water after continuous solvent extraction
组分 苦味得分(平均分) 苦味描述 Ⅳ-A 3.14c 苦 Ⅳ-B 0.28a 不苦 Ⅳ-C 1.71b 微苦 Ⅳ-D 1.57b 微苦 表 8 花椒水样IV-A-2中苦味物质的质谱解析
Table 8 Mass spectral analysis of the bitter substances in Z. bungeanum water IV-A-2
峰 保留时间(min) 波长(nm) 正离子模式 负离子模式 鉴定/推测结果 1 20.760 280,350 773(100),303 771(100),625 槲皮素-3-鼠李糖龙胆二糖苷 2 21.145 280,350 649(100),303,465 625(100) 槲皮素-3,7-二-O-β-D-吡喃葡萄糖苷 3 22.120 280,350 649(100),303 625(100) 槲皮素-3-O-槐糖 4 23.473 280 296(100),318 294(100) 荷叶碱 表 9 花椒油样苦味物质的质谱解析
Table 9 Mass spectrum analysis of bitter substances in Z. bungeanum oil samples
峰 保留时间(min) 波长(nm) 负离子模式 正离子模式 鉴定/推测结果 1 20.480 270 262 286(100),264,143,186 羟基-ε-山椒素 2 21.667 270 262 286(100),264 羟基-α-山椒素 3 22.613 270 262 286(100),246,110 羟基-β-山椒素 -
[1] 吴普. 神农本草经[M]. 长春:时代文艺出版社, 2008:199. [WU P. Shennong materia medica classic[M]. Changchun:Times Literature and Art Press, 2008:199.] WU P. Shennong materia medica classic[M]. Changchun: Times Literature and Art Press, 2008: 199.
[2] TIAN Y Q, ZHANG C M, GUO M Q. Comparative study on alkaloids and their anti-proliferative activities from three Zanthoxylum species[J]. BMC Complementary and Alternative Medicine,2017,17:460−469. doi: 10.1186/s12906-017-1966-y
[3] 张郁松. 风味麻辣香菇酱工艺的研制[J]. 中国调味品,2017,44(9):138−140. [ZHANG Y S. Development of technology of flavor spicy Lentinus edodes sauce[J]. Chinese Condiment,2017,44(9):138−140.] doi: 10.3969/j.issn.1000-9973.2017.09.034 ZHANG Y S. Development of technology of flavor spicy Lentinus edodes sauce[J]. Chinese Condiment, 2017, 44(9): 138−140. doi: 10.3969/j.issn.1000-9973.2017.09.034
[4] 欧阳灿, 江祖彬, 雷镇欧, 等. 麻辣鸭头腌制配方及工艺优化研究[J]. 农产品加工,2019,11:30−34. [OUYANG C, JIANG Z B, LEI Z O, et al. Research on marinating formula and process optimization of spicy duck head[J]. Farm Products Processing,2019,11:30−34.] OUYANG C, JIANG Z B, LEI Z O, et al. Research on marinating formula and process optimization of spicy duck head[J]. Farm Products Processing, 2019, 11: 30−34.
[5] 宁静, 许耀鹏, 马丽娅, 等. 牛油麻辣味火锅底料的制作[J]. 中国调味品,2019,44(6):150−153. [NING J, XU Y P, MA L Y, et al. Production of spicy beef hotpot seasoning[J]. Chinese Condiment,2019,44(6):150−153.] doi: 10.3969/j.issn.1000-9973.2019.06.034 NING J, XU Y P, MA L Y, et al. Production of spicy beef hotpot seasoning[J]. Chinese Condiment, 2019, 44(6): 150−153. doi: 10.3969/j.issn.1000-9973.2019.06.034
[6] 雷瑞萍. 一种新型花椒调味料的制取工艺研究[J]. 中国调味品,2017,42(9):93−95,108. [LEI R P. Research on preparation process of a new-type prickly ash seasoning[J]. China Condiment,2017,42(9):93−95,108.] doi: 10.3969/j.issn.1000-9973.2017.09.022 LEI R P. Research on preparation process of a new-type prickly ash seasoning[J]. China Condiment, 2017, 42(9): 93−95,108. doi: 10.3969/j.issn.1000-9973.2017.09.022
[7] LI Z, JEON J, KWON S Y, et al. Characterization and evaluation of changes in the aroma-active components in Szechuan pepper (Zanthoxylum bungeanum Maxim) under different cooking temperatures using gas chromatography-olfactometry[J]. Chemosensory Perception,2018,12:32−39.
[8] 袁海梅, 张崟, 邹亮, 等. 花椒属植物非苯丙素类成分研究进展[J]. 中草药,2021,52(22):7044−7056. [YUAN H M, ZHANG Y, ZOU L, et al. Research progress on non-phenylpropanoid constituents from plants of Zanthoxylum species[J]. Chinese Traditional and Herbal Drugs,2021,52(22):7044−7056.] doi: 10.7501/j.issn.0253-2670.2021.22.031 YUAN H M, ZHANG Y, ZOU L, et al. Research progress on non-phenylpropanoid constituents from plants of Zanthoxylum species[J]. Chinese Traditional and Herbal Drugs, 2021, 52(22): 7044−7056. doi: 10.7501/j.issn.0253-2670.2021.22.031
[9] 李潮俊, 何鑫柱, 陈凯, 等. 花椒挥发油的生物活性及提取方法研究进展[J]. 农产品加工,2022(17):102−106. [LI C J, HE X Z, CHEN K, et al. Research progress on the biological activity and extraction methods of volatile oil from Zanthoxylum bungeanum Maxim[J]. Farm Products Processing,2022(17):102−106.] LI C J, HE X Z, CHEN K, et al. Research progress on the biological activity and extraction methods of volatile oil from Zanthoxylum bungeanum Maxim[J]. Farm Products Processing, 2022(17): 102−106.
[10] 课净璇, 李永秀, 李杰, 等. 乳清分离蛋白掩蔽花椒苦味机制研究[J]. 食品工业科技,2023,44(19):10−16. [KE J X, LI Y X, LI J, et al. Study on the mechanism of whey protein isolate masking bitterness of Zanthoxylum bungeanum Maxim[J]. Science and Technology of Food Industry,2023,44(19):10−16.] KE J X, LI Y X, LI J, et al. Study on the mechanism of whey protein isolate masking bitterness of Zanthoxylum bungeanum Maxim[J]. Science and Technology of Food Industry, 2023, 44(19): 10−16.
[11] 李航, 孙婧譞, 秦泽宇, 等. 花椒调味油加工过程中品质变化分析[J]. 中国油脂,2023(7):29−33,61. [LI H, SUN J X, QIN Z Y, et al. Analysis of quality change of Zanthoxylum flavoring oil during processing[J]. Chinese Oils and Fats,2023(7):29−33,61.] LI H, SUN J X, QIN Z Y, et al. Analysis of quality change of Zanthoxylum flavoring oil during processing[J]. Chinese Oils and Fats, 2023(7): 29−33,61.
[12] 陆龙发, 任廷远, 黄涛. 花椒及花椒油(树脂)加工贮藏研究现状[J]. 农产品加工,2022(1):62−65. [LU L F, REN T Y, HUANG T. Research status of processing and storage of Zanthoxylum bungeanum and Zanthoxylum bungeanum oil (resin)[J]. Farm Products Processing,2022(1):62−65.] LU L F, REN T Y, HUANG T. Research status of processing and storage of Zanthoxylum bungeanum and Zanthoxylum bungeanum oil (resin)[J]. Farm Products Processing, 2022(1): 62−65.
[13] 景娜娜. 干燥和贮藏方式对花椒品质的影响[D]. 陕西:西北农林科技大学, 2021. [JING N N. Effects of drying and storage methods on the quality of Zanthoxylum bungeanum[D]. Shaanxi:Northwest A&F University, 2021.] JING N N. Effects of drying and storage methods on the quality of Zanthoxylum bungeanum[D]. Shaanxi: Northwest A&F University, 2021.
[14] 丁涌波, 罗东升, 陈光静, 等. 花椒精油的苦味成分鉴定[J]. 食品科学,2017,38(24):74−80. [DING Y B, LUO D S, CHEN G J, et al. Identification of bitter-tasting components in Zanthoxylum essential oils[J]. Food Science,2017,38(24):74−80.] doi: 10.7506/spkx1002-6630-201724012 DING Y B, LUO D S, CHEN G J, et al. Identification of bitter-tasting components in Zanthoxylum essential oils[J]. Food Science, 2017, 38(24): 74−80. doi: 10.7506/spkx1002-6630-201724012
[15] 梅小飞. 红花椒果皮苦味形成的关键苦味物质研究[D]. 重庆:西南大学, 2022. [MEI X F. Identification of key bitter compounds in the formation of bitter taste of red Huajiao (Zahthoxylum simulans Hance) peel[D]. Chongqing:Southwest University, 2022.] MEI X F. Identification of key bitter compounds in the formation of bitter taste of red Huajiao (Zahthoxylum simulans Hance) peel[D]. Chongqing: Southwest University, 2022.
[16] 蔡沁玥. 竹叶花椒果皮木脂素分离、鉴定、苦度分析及其体外抗氧化活性研究[D]. 雅安:四川农业大学, 2020. [CAI Q Y. Study on separation, identification, bitterness analysis and antioxidant activity of lignan from Zanthoxylum armatum DC[D]. Ya'an:Sichuan Agricultural University, 2020.] CAI Q Y. Study on separation, identification, bitterness analysis and antioxidant activity of lignan from Zanthoxylum armatum DC[D]. Ya'an: Sichuan Agricultural University, 2020.
[17] 黄山. 不同生长期青花椒果皮苦味形成的研究[D]. 重庆:西南大学, 2023. [HUANG S. Study on the formation of bitterness in the pericarp of green prickly ash (Zanthoxylum schinifolium Sieb. et Zucc) at different developmental stages[D]. Chongqing:Southwest University, 2023.] HUANG S. Study on the formation of bitterness in the pericarp of green prickly ash (Zanthoxylum schinifolium Sieb. et Zucc) at different developmental stages[D]. Chongqing: Southwest University, 2023.
[18] YANG Q, WANG Z, CHEN X, et al. Evaluation of bitter compounds in Zanthoxylum schinifolium Sieb. et Zucc. by instrumental and sensory analyses[J]. Food Chemistry,2022,390(3):133180.
[19] HUANG S, WANG L, WANG Z, et al. Multiomics strategy reveals the accumulation and biosynthesis of bitter components in Zanthoxylum schinifolium Sieb. et Zucc[J]. Food Research International, 2022, 162(Pt A):111964.
[20] 文秋萍. 花椒乙醇提取液中黄酮物质分离、鉴定及滋味研究[D]. 雅安:四川农业大学, 2020:10−47. [WEN Q P. Isolation and identification of flavonoids from Zanthoxylum armatum DC ethanol extract and taste research[D]. Ya'an:Sichuan Agricultural University, 2020:10−47.] WEN Q P. Isolation and identification of flavonoids from Zanthoxylum armatum DC ethanol extract and taste research[D]. Ya'an: Sichuan Agricultural University, 2020: 10−47.
[21] 周瑞, 项昌培, 张晶晶, 等. 黄连化学成分及小檗碱药理作用研究进展[J]. 中国中药杂志,2020,45(19):4561−4573. [ZHOU R, XIANG C P, ZHANG J J, et al. Research progress on chemical compositions of Coptidis Rhizoma and pharmacological effects of berberine[J]. China Journal of Chinese Materia Medica,2020,45(19):4561−4573.] ZHOU R, XIANG C P, ZHANG J J, et al. Research progress on chemical compositions of Coptidis Rhizoma and pharmacological effects of berberine[J]. China Journal of Chinese Materia Medica, 2020, 45(19): 4561−4573.
[22] KE J X, CHENG J, LUO Q, et al. Identification of two bitter components in Zanthoxylum bungeanum Maxim. and exploration of their bitter taste mechanism through receptor hTAS2R14[J]. Food Chemistry,2021,338:127816. doi: 10.1016/j.foodchem.2020.127816
[23] 公敬欣, 杨峥, 谢建春, 等. 花椒水煮及热油处理麻味素的含量变化研究[J]. 中国食品添加剂,2013,1:23−27. [GONG J X, YANG Z, XIE J C, et al. Content change of the tingling-taste components when the pericarps of Zanthoxylum bungeanum Maxim. processed in boiling water or hot oil[J]. China Food Additives,2013,1:23−27.] doi: 10.3969/j.issn.1006-2513.2013.01.003 GONG J X, YANG Z, XIE J C, et al. Content change of the tingling-taste components when the pericarps of Zanthoxylum bungeanum Maxim. processed in boiling water or hot oil[J]. China Food Additives, 2013, 1: 23−27. doi: 10.3969/j.issn.1006-2513.2013.01.003
[24] 扈宁轩. 花椒残渣中黄酮类活性成分的提取工艺及其抗氧化活性研究[D]. 呼和浩特:内蒙古农业大学, 2021. [HU N X. Study on extraction process of flavonoids active components in Zanthoxylum residue and its antioxidant activity[D]. Hohhot:Inner Mongolia Agricultural University, 2021.] HU N X. Study on extraction process of flavonoids active components in Zanthoxylum residue and its antioxidant activity[D]. Hohhot: Inner Mongolia Agricultural University, 2021.
[25] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 16291.1-2012, 感官分析 选拔、培训与管理评价员一般导则 第1部分:优选评价员[S]. 2012. [General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 16291.1-2012, Sensory analysis-General guidance for the selection, training and monitoring of assessors-Part 1:Selected assessors[S]. 2012.] General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 16291.1-2012, Sensory analysis-General guidance for the selection, training and monitoring of assessors-Part 1: Selected assessors[S]. 2012.
[26] BRÜHL L, MATTH U B, FEHLING E, et al. Identification of bitter off-taste compounds in the stored cold pressed linseed oil[J]. Journal of Agricultural and Food Chemistry,2007,55(19):7864−7868. doi: 10.1021/jf071136k
[27] FRANK O, OTTINGER H, HOFMANN T. Characterization of an intense bitter-tasting 1H, 4H-quinolizinium-7-olate by application of the taste dilution analysis, a novel bioassay for the screening and identification of taste-active compounds in foods[J]. Journal of Agricultural and Food Chemistry,2001,49(1):231−238. doi: 10.1021/jf0010073
[28] 陈昊, 刘畅, 李燕, 等. 用HPLC-TOF-MS法分析荷丹片的化学成分[J]. 药学服务与研究,2011,11(6):439−443. [CHEN H, LIU C, LI Y, et al. Analysis of the chemical constituents of Hedan tablet by HPLC-TOF-MS method[J]. Pharmaceutical Care and Research,2011,11(6):439−443.] doi: 10.5428/pcar20110612 CHEN H, LIU C, LI Y, et al. Analysis of the chemical constituents of Hedan tablet by HPLC-TOF-MS method[J]. Pharmaceutical Care and Research, 2011, 11(6): 439−443. doi: 10.5428/pcar20110612
[29] 李杨, 吴娇, 朱钊铭, 等. 荷叶碱的分离纯化与HPLC检测[J]. 大连民族大学学报,2020,22(1):21−25. [LI Y, WU J, ZHU Z M, et al. Isolation and purification of nuciferine and HPLC detection[J]. Journal of Dalian Minzu University,2020,22(1):21−25.] LI Y, WU J, ZHU Z M, et al. Isolation and purification of nuciferine and HPLC detection[J]. Journal of Dalian Minzu University, 2020, 22(1): 21−25.
[30] ZHAO Z F, ZHU R, ZHONG K, et al. Characterization and comparison of the pungent components in commercial Zanthoxylum bungeanum oil and Zanthoxylum schinifolium oil[J]. Journal of Food Science,2013,78(10):1516−1522.
[31] SUGAI E, MORIMITSU Y, IWASAKI Y, et al. Pungent qualities of sanshool-related compounds evaluated by a sensory test and activation of rat TRPV1[J]. Bioscience, Biotechnology and Biochemistry,2005,69(10):1951−1957. doi: 10.1271/bbb.69.1951
-
期刊类型引用(2)
1. 陈衍真,满文娟,程雷娜,王淑娴,魏鉴腾,曾祥俊. 响应面法优化肉苁蓉多糖提取液的脱色工艺及其抗氧化活性研究. 食品安全质量检测学报. 2025(05): 94-103 .  百度学术
百度学术
2. 魏鉴腾,申奥,张丹阳,陈衍真,周万聪,王淑娴. 高速剪切辅助提取蕨麻多糖工艺优化及抗氧化活性研究. 食品安全质量检测学报. 2024(23): 115-124 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:
 下载:
下载:



