Stability and Digestion Properties of Curcumin-Loaded Emulsion Gels Fabricated by Oat β-Glucan and Proanthocyanidins
-
摘要: 为改善姜黄素的稳定性和生物可及性,选用燕麦β-葡聚糖(β-glucan, BG)和原花青素(Proanthocyanidins, PA)自组装形成的复合物作为乳化和凝胶基质,含姜黄素的玉米胚芽油作为油相,构建了负载姜黄素的乳液凝胶。解析了BG与PA自组装复合物微观结构及形成机制,并探究了不同质量比BG/PA=1:0~1:1.0构建的负载姜黄素乳液的微观结构、流变学特性、稳定性及体外消化特性等性质。结果表明:BG与PA可通过氢键和疏水相互作用自组装形成复合物,且在BG/PA=1:0.5时可形成近似球形颗粒复合物。单独2%BG(BG/PA=1:0)无法制备得到负载姜黄素的乳液凝胶,而BG-PA复合物可构建形成负载姜黄素的乳液凝胶,其中BG/PA=1:0.1~1:0.5制备的负载姜黄素乳液凝胶具有较小的粒径(15 μm)和较好的离心稳定性(不稳定指数<0.3)。此外,BG-PA基负载姜黄素乳液凝胶可抑制高温(55 ℃)和紫外线辐照引起的姜黄素降解,且表现出良好的PA剂量依赖性。体外模拟胃肠消化结果展示了与单独2%BG制备的乳液相比,BG-PA基负载姜黄素乳液凝胶中姜黄素的生物可及性明显提升(P<0.05)。研究结果可为植物基多糖和多酚复合体系在负载生物活性因子的凝胶状食品和化妆品乳剂中的应用提供了技术参考。Abstract: In this paper, the curcumin-loaded O/W emulsion gels with an oil phase fraction of 80% were fabricated using oat β-glucan (BG) and proanthocyanidins (PA) complexes to improve the stability and bioaccessibility of curcumin. The microstructure and formation mechanism of BG and PA self-assembly complexes were analyzed. Additionally, the microstructure, rheological properties, stability, and in-vitro digestive properties of curcumin-loaded emulsion gels fabricated with different mass ratios of BG/PA (BG/PA=1:0~1:1.0) were explored. The results showed that BG-PA can self-assemble to form colloidal complexes through hydrogen bonding and hydrophobic interactions. Meanwhile, colloidal complexes that are approximately spherical in shape can be formed when the mass ratio of BG to PA is 1:0.5. The curcumin-loaded emulsion gels cannot be obtained with merely 2% BG (BG/PA=1:0), but the BG-PA complexes can form a stable emulsion gel. In particular, curcumin-loaded emulsion gels fabricated by BG-PA complexes with BG/PA=1:0.1~1:0.5 had small particle sizes (15 μm) and good centrifugal stability (instability index < 0.3). Additionally, when emulsions were exposed to high temperatures and UV light, BG-PA based emulsion gels effectively slowed down the degradation of curcumin in a dose-dependent manner. The results of simulated gastrointestinal digestion showed that the bioaccessibility of curcumin in the BG-PA based emulsion gels was higher compared with the emulsion fabricated by 2% BG alone (P<0.05). The research results can serve as a technical reference for the application of plant-based polysaccharide and polyphenol complex systems in gelled food and cosmetic emulsions loaded with bioactive ingredients.
-
Keywords:
- oat β-glucan /
- proanthocyanidins /
- emulsion gels /
- curcumin /
- in-vitro digestion
-
乳液凝胶(GEs),也称为凝胶状乳液或乳胶,是一种含有乳液液滴和凝胶基质的复杂胶体乳液,其特征是乳液液滴填充至凝胶状的连续相内,该过程可能与液滴和它们所含聚合物之间相互作用有关[1]。乳液凝胶因其具有良好的物理化学特性,如改善产品质构特性,提升储藏稳定性,提高产品持水能力,控制肠道药物的释放等,因此人们对在许多商业产品中使用乳液凝胶的兴趣越来越大[2−3]。此外,乳液凝胶能使液体油脂(如不饱和脂肪)形成性质更像固体脂肪的软固体材料,并用于运载脂溶性生物活性成分[4]。目前,乳液凝胶主要由天然食品级水胶体(如蛋白质、多糖及其配合物)制备而成,其中应用最广泛的蛋白质有牛奶蛋白(如乳清蛋白和酪蛋白)和豆类蛋白(如大豆、豌豆和鹰嘴豆蛋白)[1,5],常用的多糖有琼脂、果胶、κ-卡拉胶、菊糖、黄原胶和纤维素等[6−7]。
姜黄素是脂溶性的生物活性成分,它是从姜科、天南星科植物根茎中提取的一种天然多酚,因其具有良好的抗炎、抗癌和抗菌等多种生物活性被广泛研究[8]。然而,与其他亲脂性生物活性物质一样,它的化学结构不稳定、水溶性低、生物利用度较差限制了其在各领域的应用[9−10]。考虑到乳液凝胶具有良好的包埋稳定性以及控制释放等优势,因此通过乳液凝胶运载姜黄素可能是一种非常有效方法。在储存和递送过程中,乳液凝胶可阻碍油脂的运动和氧气扩散速率,从而提高封装生物活性成分的稳定性,并且还能调控生物活性成分的释放[11]。
天然的植物基多糖由于其具有良好的增稠性和凝胶性是用于构建乳液凝胶的重要的材料[6−7]。燕麦β-葡聚糖(BG)是一种天然的水溶性膳食纤维,由葡萄糖分子通过β-(1→4)和β-(1→3)键连接而成[12]。先前有研究表明,BG具有许多生物活性,如降低血清胆固醇水平和餐后血糖、减轻体重和缓解便秘等[13]。此外,BG具有良好的增稠和胶凝性能,这在许多食品和饮料均有所应用[14]。然而,BG是一种表面活性较低的亲水性多糖,因此其形成油水乳液的能力有限[15]。有研究表明:多糖和多酚复配可在一定程度上改善多糖的功能特性。如小麦淀粉和单宁酸复配其界面和乳化性能都得到改善,可用于构建稳定的乳液凝胶[16],变性淀粉与多酚复配也可形成稳定的乳液凝胶[17]。这些研究结果均表明多糖与多酚复配具有制备乳液凝胶的潜力。
原花青素(PA)是一种广泛存在于植物中的多酚,由儿茶素、表儿茶素及其没食子酸酯聚合而成,主要存在于葡萄、蓝莓、樱桃和深浆果果实的果皮和种子中[18−19]。它是一种水溶性膳食多酚,具有良好的抗氧化性及预防心血管疾病、高血压、高脂血症和糖尿病等功能活性[20]。PA常与蛋白等复配构建乳液凝胶,如Gong等[21]人发现大豆分离蛋白与PA复合物可以形成稳定高内向Pickering乳液凝胶,Zhou等[22]人利用鲭鱼蛋白与PA也制备得到了乳液凝胶。但PA与多糖BG复配是否可用于构建稳定乳液凝胶并用于生物活性物质的运载尚不清楚。
因此,本研究拟以燕麦β-葡聚糖(BG)和原花青素(PA)复合物作为水相,玉米胚芽油作为油相来构建负载姜黄素乳液凝胶。解析BG-PA复合物微观结构及形成机制,并探讨不同质量比BG/PA复合物对所形成的负载姜黄素乳液凝胶的微观结构、流变学特性、稳定性及体外消化特性的影响。本研究拓宽了构建乳液凝胶在天然多糖与膳食多酚复合材料选择上的范围,为开发性能优良的新型食品级乳液凝胶及设计新型疏水性生物活性物质运载体系提供了参考依据。
1. 材料与方法
1.1 材料与仪器
燕麦β-葡聚糖(BG,纯度80%,食品级) 张家口一康生物科技有限公司;原花青素(PA,纯度95%)、姜黄素(纯度=95%)和猪胆粉(分析纯) 上海源叶生物科技有限公司;玉米胚芽油(食品级) 益海嘉里粮油有限公司;氢氧化钠、磷酸氢二钠、磷酸二氢钠、盐酸 分析纯,西陇化工股份有限公司;叠氮化钠 分析纯,上海国药集团;尿素二氢钠、尿素、柠檬酸钾、氯化钙 分析纯,上海阿拉丁试剂有限公司;黏膜蛋白、胃蛋白酶(≥3200 U/mg protein)、胰酶 美国Sigma试剂公司。
十万分之一天平 德国赛多利斯公司;雷磁pH计 上海仪电科学仪器有限公司;低温高速离心机 德国Sigma公司;哈克MARS III流变仪 美国Thermo公司;DMI6000B光学显微镜 德国Leica公司;835 Titrando全自动电位滴定仪 瑞士万通公司;U-T6A紫外分光光度计 上海屹谱仪器制造有限公司;Color i5D色差仪 美国X-Rite公司;T-25高速分散机 德国IKA公司;LUMiSizer全功能稳定性分析仪 德国LUM公司。
1.2 实验方法
1.2.1 β-葡聚糖-原花青素复合物制备及微观结构
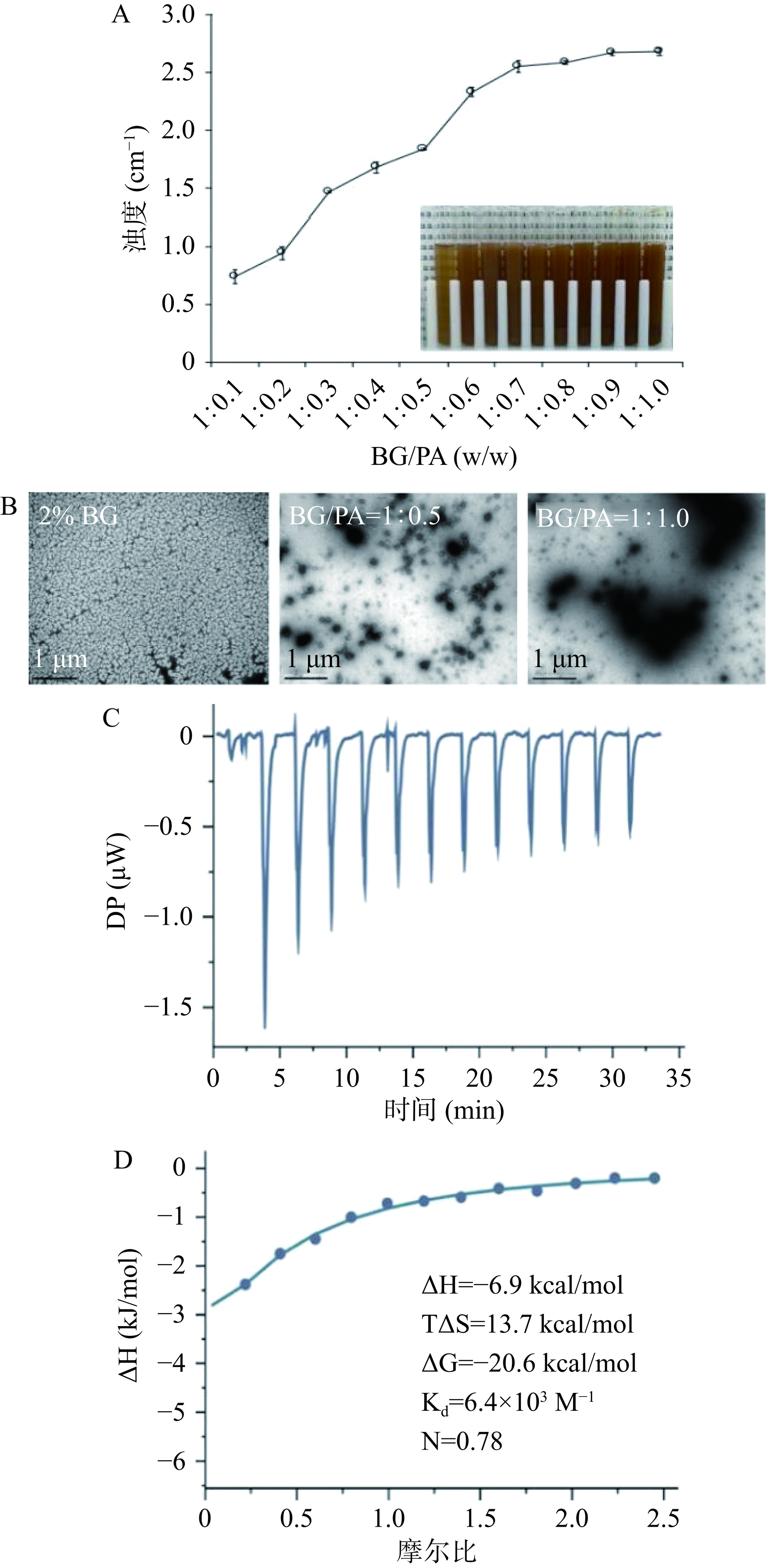
参考Li等[23]方法并稍作修改,将燕麦β-葡聚糖以4wt% 的浓度溶于5 mmol/L pH5的磷酸缓冲液中并在85 ℃水浴条件下搅拌溶解,分别加入不同浓度的原花青素溶液,使BG的最终浓度为2 wt%,BG与PA的质量比为1:0~1:1.0,得到不同比例的BG-PA复合物溶液。用UV-vis分光光度计记录不同比例的BG-PA复合物溶液在600 nm处吸光值作为其浊度值。BG及BG-PA复合物经1%乙酸双氧铀染色后由透射电镜(TEM)观察其微观结构。
1.2.2 β-葡聚糖-原花青素相互作用解析
利用等温滴定量热仪的BG和PA间的相互作用进行测定[23]。将PA溶液分13次滴入装有BG溶液的反应池中,每次滴定间隔时间为150 s。滴定池中溶液温度设置为25±0.1 ℃,搅拌速度为750 r/min,确保充分混合。利用仪器软件对热流曲线进行计算,采用“one set of sites”得到热力学参数:结合常数(K)、焓变(ΔH)、熵变(ΔS)、吉布斯自由能(ΔG)和结合位点数量(N)。
1.2.3 β-葡聚糖-原花青素基乳液的制备
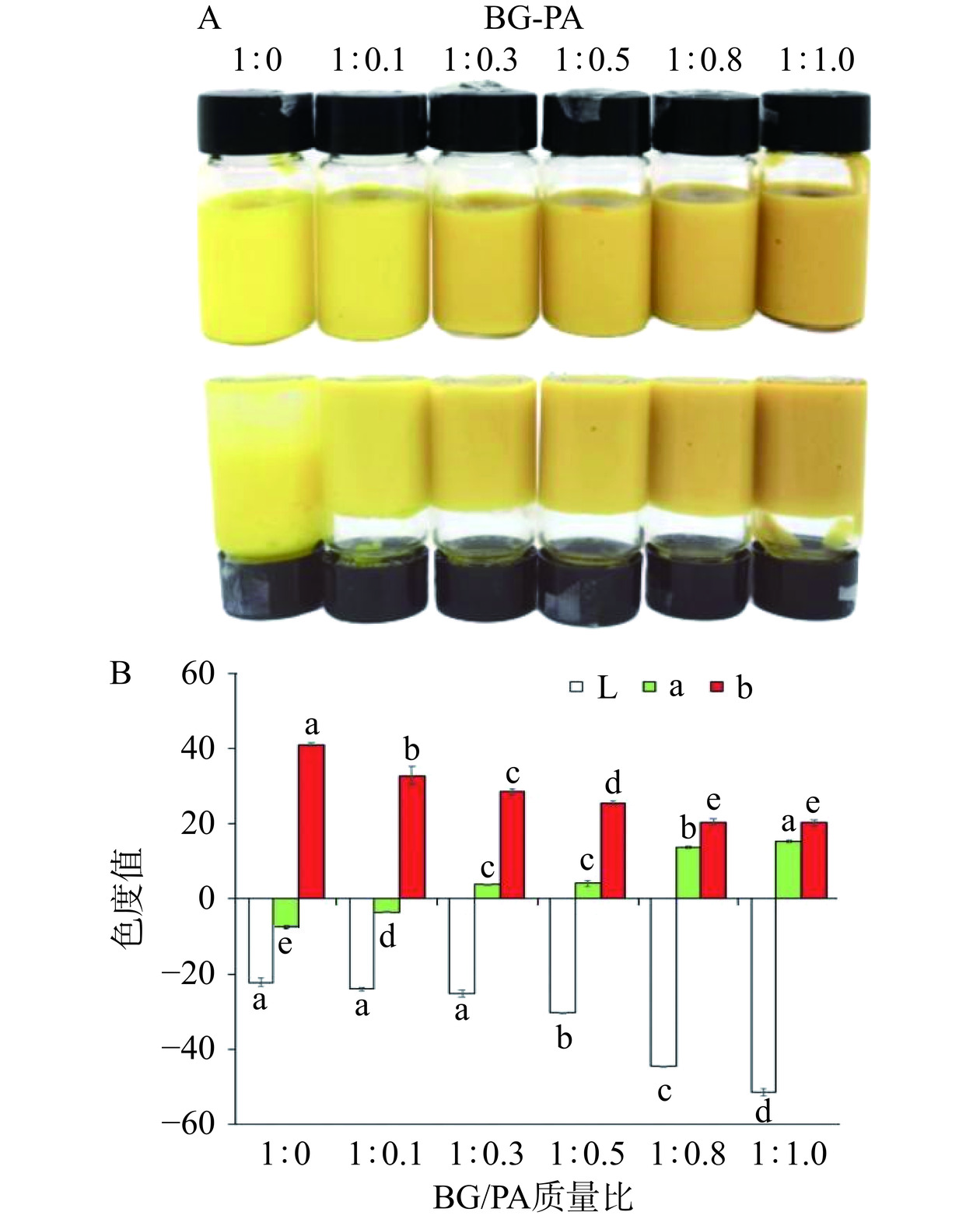
参考Li等[15]方法并稍作修改,将姜黄素以0.2wt%的浓度溶于玉米胚芽油中得到含姜黄素的油相;将燕麦β-葡聚糖以4wt%的浓度溶于5 mmol/L pH5的磷酸缓冲液中并在85 ℃水浴条件下搅拌溶解,分别加入不同浓度的原花青素溶液,使BG的最终浓度为2wt%,BG与PA的质量比为1:0,1:0.1,1:0.3,1:0.5,1:0.8和1:1.0,得到不同比例的BG-PA复合水相。然后将BG-PA复合水相按照油水比7:3加入含姜黄素的油相中,在12000 r/min下高速剪切2 min制备得到负载姜黄素的BG-PA复合乳液。
1.2.4 乳液的色度测度
室温条件下对色差仪进行校准,样品平铺后将校准后的色差仪检测口对准样品并保持稳定避免漏光,记录测量得到的L*,a*,b*值。
1.2.5 微观结构及粒径
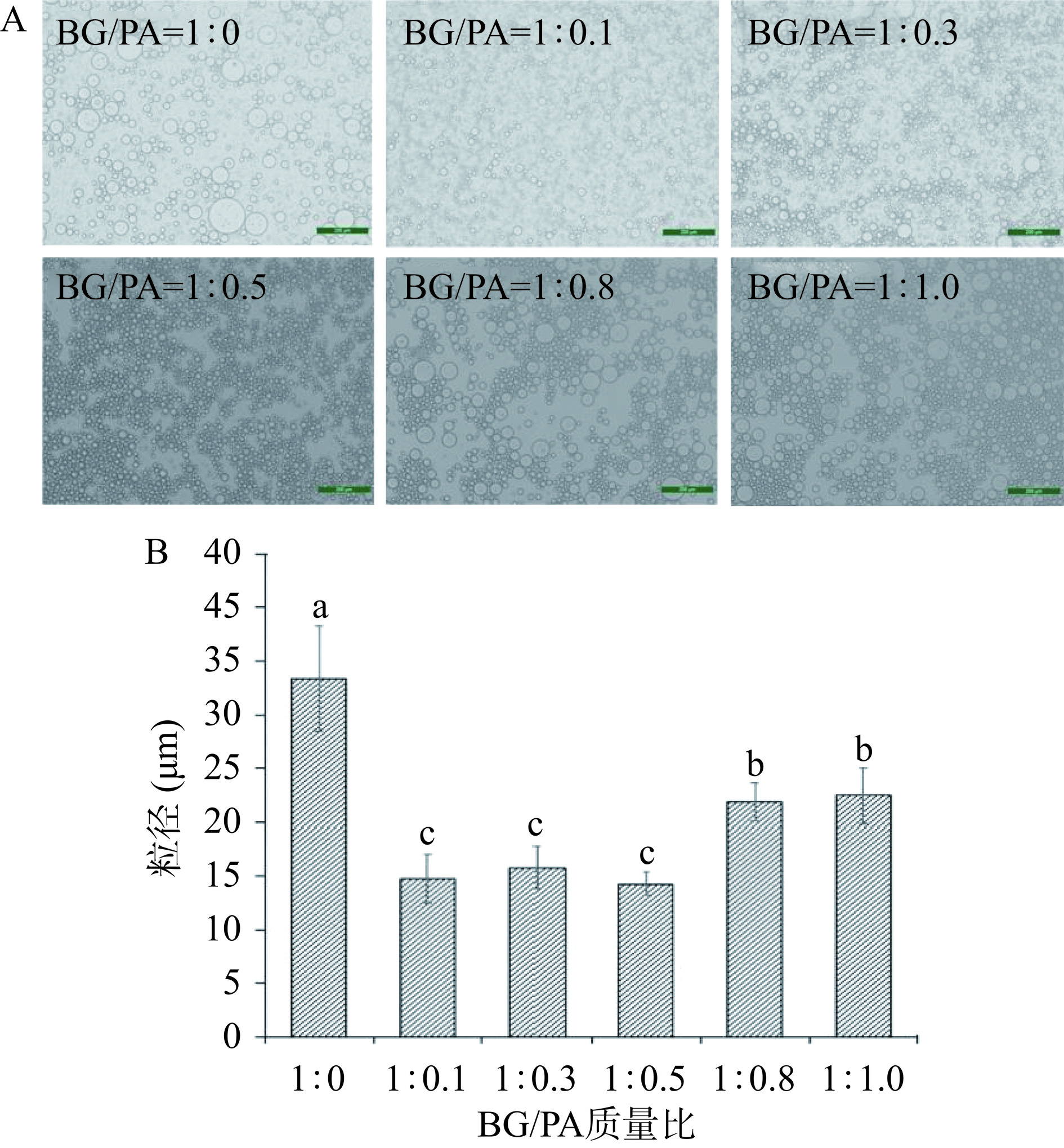
取新鲜的乳液用缓冲溶液稀释10倍后于光学显微镜观察乳液的微观结构。利用Image J软件对光学显微镜图像中至少200个液滴进行计数,测得样品的平均粒径和粒径分布[24]。
1.2.6 乳液离心稳定性
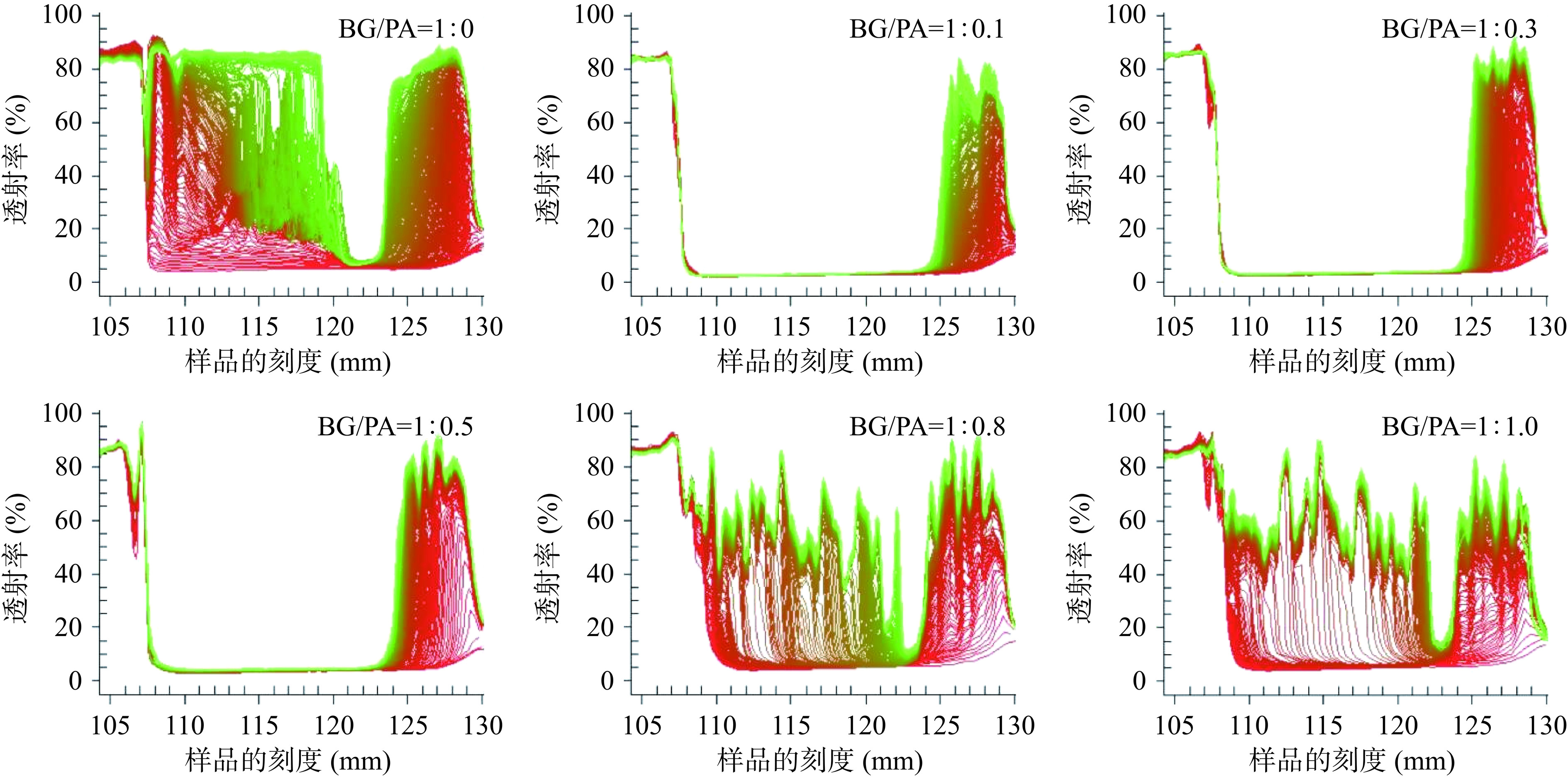
参照Liu等[25]的方法,采用全功能稳定性分析仪对乳液进行物理稳定性分析,将样品装入PC样品槽(2×8 mm)中,测试参数设置为离心速度2000 r/min,温度25 ℃,时间间隔:10 s,扫描次数:300。
1.2.7 流变学特性
参考Zhang等[26]的方法对乳液的流变学特性进行测定。使用MARSIII哈克流变仪对乳液的流变学特性进行评估,选用60 mm平行板,固定间隙为1 mm。对于动态粘弹性测量,在1 Hz频率下,通过动态振幅扫描测定乳液的线性粘弹性区域。在25 ℃,1%的应变力条件下进行频率扫描,获得0.01~15 Hz的储能模量(G')和损耗模量(G'');并在0.1~100 s−1剪切速率下测量乳液表观黏度,并采用幂律模型对数据拟合[27],计算见式(1):
η(Pa×s)=K(γ)n−1 (1) 式中:η表示黏度(Pa·s),γ表示剪切速率(s−1),K为稠度系数(Pa·Sn),n为流动指数。
1.2.8 姜黄素保留率的测定
参考文献[28]的方法,并稍作修改。对负载姜黄素的乳液在55 ℃和紫外线条件下的姜黄素保留率进行测定。负载姜黄素的乳液充分混匀后,从中取0.2 mL样品加入到二甲基亚砜溶液中,用紫外分光光度计于420 nm处测定其吸光度。根据姜黄素标准曲线(y=0.1383x-0.0053,R2=0.9996)计算姜黄素的含量。姜黄素的保留率(Rt)根据式(2)计算:
Rt=CtC0×100 (2) 式中:C0表示初始姜黄素的浓度(μg/mL),Ct表示储存t d/紫外处理t d后姜黄素的浓度(μg/mL)。
1.2.9 高温对乳液中姜黄素稳定性的影响
将负载姜黄素的乳液密封后在55 ℃恒温培养箱中避光储存7 d,定时取样测定乳液中姜黄素含量并记录样品的乳析指数和第7 d样品外观[29],并依据1.2.8中的方法计算姜黄素保留率,乳析指数(CI)计算见式(3):
CI(%)=HsHt×100 (3) 式中:Hs为乳清层高度(mm),Ht为乳液总高度(mm)。
1.2.10 紫外线对乳液中姜黄素稳定性的影响
将负载姜黄素的乳液密封后放入在带有6 W,220 V紫外线灯密封箱内照射7 d,分别在0、0.5、1、2、3、5、7 d取样测定乳液中姜黄素含量[28],并依据1.2.8中的方法计算姜黄素保留率。
1.2.11 胃肠道消化特性
根据Li等[29]和Tan等[30]的方法采用胃肠道(GIT)模型来评估样品的体外胃肠道消化行为,并进行了一些修改。将乳液用磷酸缓冲液稀释,使其脂肪含量适合模拟胃肠道(GIT)模型。
口腔阶段:将25 mL每种乳液与25 mL人工唾液工作液(ASWS)(含3.0 mg/mL粘蛋白)在37 ℃条件下混合。将pH调制6.8,并使用磁力搅拌器在37 ℃下搅拌2 min,得到口腔消化样品。
胃阶段:取30.0 mL口腔消化样品和30.0 mL模拟胃液(SGF)(含3.2 mg/mL胃蛋白酶)1:1(v/v)混合,然后立即将pH调节至2.5,并将混合物在37 ℃、160 r/min的摇床中连续搅拌2 h,得到胃消化样品。
小肠阶段:将40 mL胃消化的样品pH调至7.0,与等体积模拟肠液(SIF)混合后在37 ℃的水浴中连续消化2 h,消化过程中使用自动滴定装置通过滴加0.5 mol/L NaOH标准液以始终维持pH为7.0。最后根据消耗NaOH的体积计算脂肪酸(FFA)的释放率,计算见式(4):
FFA(%)=VNaOH×cNaOH×Mlipid2mlipid×100 (4) 式中:VNaOH为FFA释放所消耗NaOH溶液的体积(mL);cNaOH为NaOH标准液浓度(mol/L);Mlipid为玉米油的平均摩尔质量(872 g/mol);mlipid为消化开始时乳液含有的玉米油质量(g)。
1.2.12 姜黄素生物可及性
将小肠消化液在4 ℃下12000 r/min离心25 min。取上清液,测定姜黄素含量。在小肠消化液中可溶解的部分被认为是在胶束中能被吸收的部分[10]。姜黄素的生物可及性通过式(5)计算:
生物可及性(%)=CMicellesCDigesta×100 (5) 式中:CMicelles为小肠消化液中姜黄素溶解在胶束中的浓度(μg/mL),CDigesta为小肠消化液中总的姜黄素浓度(μg/mL)。
1.3 数据分析
所有实验设置平行组并重复测定3次,数据以平均值±标准偏差表示,所有的数据用Excel绘图,并用SPSS 25.0 进行显著性分析。
2. 结果与分析
2.1 BG-PA复合物的形成及微观结构
BG-PA混合后浊度的变化如图1A所示,在2% BG浓度下,BG-PA溶液的浊度随着PA添加量的增加而增大,说明BG与PA两者间发生了相互作用形成一定的聚集复合物导致了光散射致使浊度增大[23]。此外,通过TEM图(图1B)表征BG及BG-PA复合物的微观结构可以发现单独的BG呈现纤维状的网络结构,这与Zielke等[31]通过TEM观察到的BG结构一致。然而,将BG与PA混合后两者会发生聚集,BG/PA=1:0.5时形成了近似球形的颗粒状复合物,而BG/PA=1:1.0时形成了不规则的大颗粒复合物。基于上述现象,进一步利用等温滴定量热仪解析了BG-PA间相互作用,如图1C所示。PA滴入BG中出现一系列的放热峰,且随着PA滴加次数的增加而减小,这是由于BG分子上能够结合PA的位点逐渐趋于饱和。通过对热流曲线计算得到BG与PA间相互作用的焓变曲线及相关热力学参数,BG与PA反应的吉布斯自由能(ΔG=ΔH-TΔS)为负值,表明BG与PA间的反应是自发进行的;且焓变(ΔH)的值为负,熵变(ΔS)的值为正,表明BG与PA间相互作用是由焓变和熵变共同驱动的,其结合过程可能存在氢键和疏水相互作用[32−33]。综上所述,BG与PA间可通过氢键和疏水相互作用自组装形成复合物,且BG-PA复合物即可形成近似球形的小颗粒,也会因PA添加量过高而形成不规则大颗粒。
2.2 BG-PA基负载姜黄素乳液外观及色度
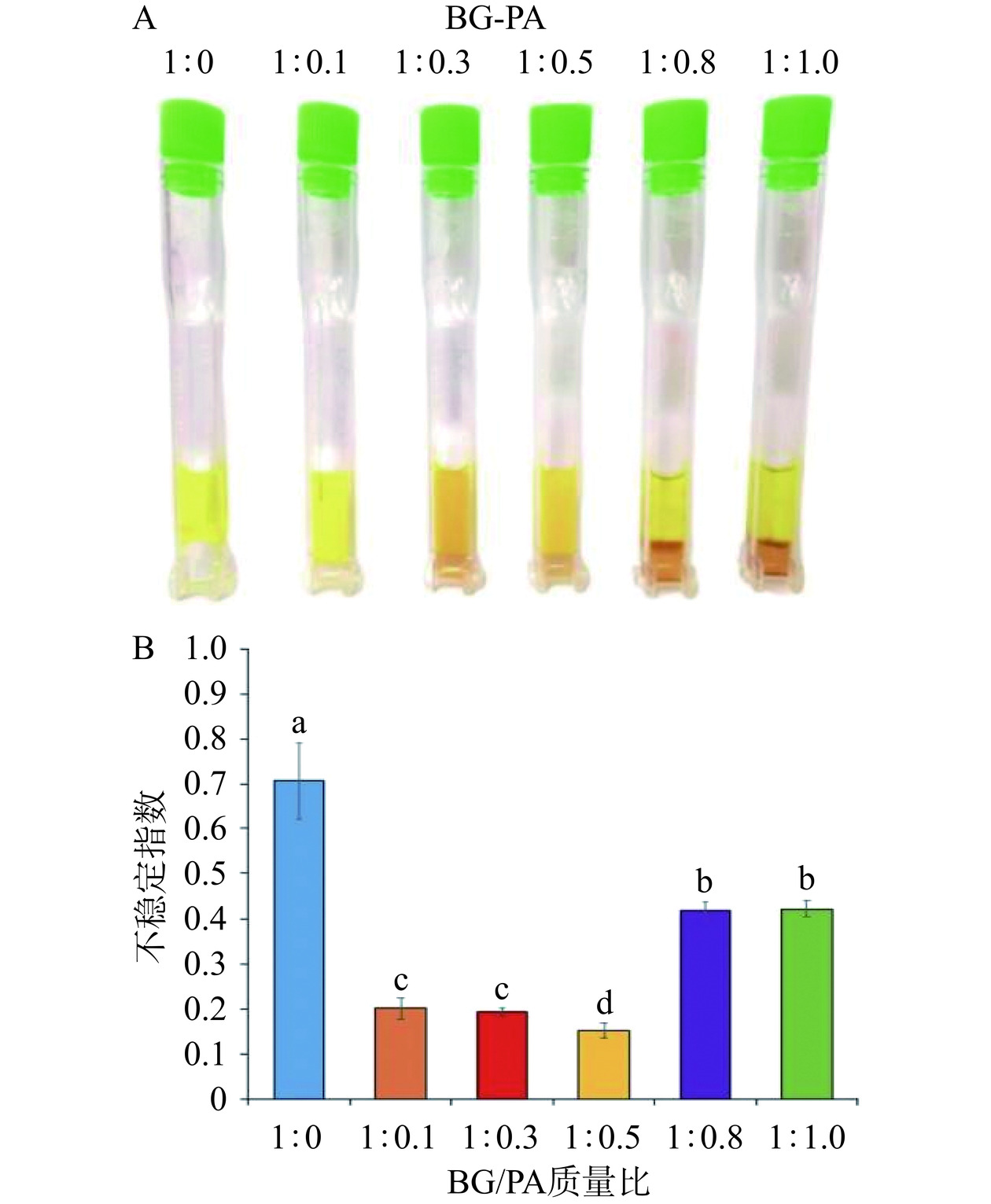
在油相体积分数为70%,水相为不同BG/PA质量比溶液制备的负载姜黄素乳液外观形貌如图2A所示,仅使用2%BG(BG/PA=1:0)所形成的乳液为流动状态,将其装入瓶中倒置时,乳液会因重力作用而向下流动。然而,BG/PA以不同质量比混合后所制备的姜黄素乳液均能形成质地均匀的凝胶状态,瓶中乳液倒置后均保留在瓶子顶部。PA可通过非共价相互作用在油水界面交联BG分子,从而在油滴界面形成一层刚性保护壳,抑制液滴间的聚结改变其流动性[15]。此外,连续水相中的多糖分子与单宁类化合物发生相互作用可增加乳液黏度,进而减缓乳液的流动[17]。对BG-PA基负载姜黄素乳液的色度进行测定发现随着水相中PA含量增加,L*和b*值逐渐降低,而a*值增加(图2B)。由此可见,PA含量的增加降低了负载姜黄素乳液凝胶的亮度和黄色度,增大了乳液的红色度。这主要是由于原花青素水溶液为深棕红色,且随着浓度的增大颜色加深[19],因此导致乳液亮度降低和红色度增加。
2.3 BG-PA基负载姜黄素乳液的微观结构及粒径
BG-PA基负载姜黄素乳液的微观结构及粒径大小如图3所示。光学显微镜下可以观察到仅使用2%BG制备的乳液液滴较大且不均匀,平均粒径为33.37±4.89 μm。相比之下,以BG-PA混合溶液构建的乳液粒径较小,其平均粒径均小于25 μm,特别是由BG/PA=1:0.1~1:0.5制备的乳液液滴更小且更加均匀。但是,BG/PA=1:0.8和1:1.0制备的乳液中含有较多的大液滴,这表明当PA浓度过高时,BG-PA两者在油水界面上的吸附性能和防止油滴间聚结的效果可能会降低[34]。除此之外,BG-PA基负载姜黄素乳液中的液滴间有明显的聚集交联现象,尤其是在BG/PA=1:0.5条件下制备的乳液这种液滴间的聚集最为明显。
2.4 BG-PA基负载姜黄素乳液的离心稳定性
全功能稳定性分析仪是通过分析软件记录离心过程中红外光穿过样品管内样品颗粒的透射率变化情况,并将其绘制成光谱图。光谱图中的横坐标为样品管的刻度,纵坐标为红外光的透射率,红外光从样品管的顶部扫描至底部,随着离心时间的延长样品稳定性在离心力的作用下发生改变,导致透射率的变化,并以此表征样品的稳定性[35]。不同BG/PA质量比制备的负载姜黄素乳液的离心稳定性如图4所示。所有样品经离心后透射率均有明显增加,表明所有样品稳定性均存在不同程度的破坏。仅使用2%BG(BG/PA=1:0)制备的乳液在离心过程中透射率随时间的延长而增大,样品管顶部和底部的透射率明显增大,表明样品遭到了彻底的破坏。同时,乳液外观图也展现出了2%BG制备的乳液有明显的破乳油析现象,顶部为油脂,中部为乳化层,底部为水(图5A)。BG/PA=1:0.8和1:1.0制备的乳液也出现与2%BG制备的乳液相似的油析现象,但由于PA的存在,中部乳化层和底部水相均为橙红色。然而,BG/PA=1:0.1~1:0.5所制备的乳液仅样品管底部透射率增大,顶部无明显变化,这表明乳液中液滴在离心过程中向样品管顶部移动,但未出现破乳现象,其外观图也只显示底部有少量水相(图5A),表明样品的稳定性相对较好。此外,通过稳定性分析软件自动依据透射率曲线的变化可以得到不稳定性指数,该数值越小表明体系越稳定[36]。如图5B所示,BG/PA=1:0.5制得的乳液不稳定指数最小,表明其稳定性最好;其次是BG/PA=1:0.1和1:0.3;再次是BG/PA=1:0.8和1:1.0;不稳定指数最高的是2%BG(BG/PA=1:0)制得的乳液,其稳定性最差。样品中BG/PA=1:0.1~1:0.5所制备的乳液具有相对较好的物理稳定性,这可能归因于相对较小的液滴尺寸和液滴间的交联聚集[37]。
2.5 BG-PA基负载姜黄素乳液的流变学特性
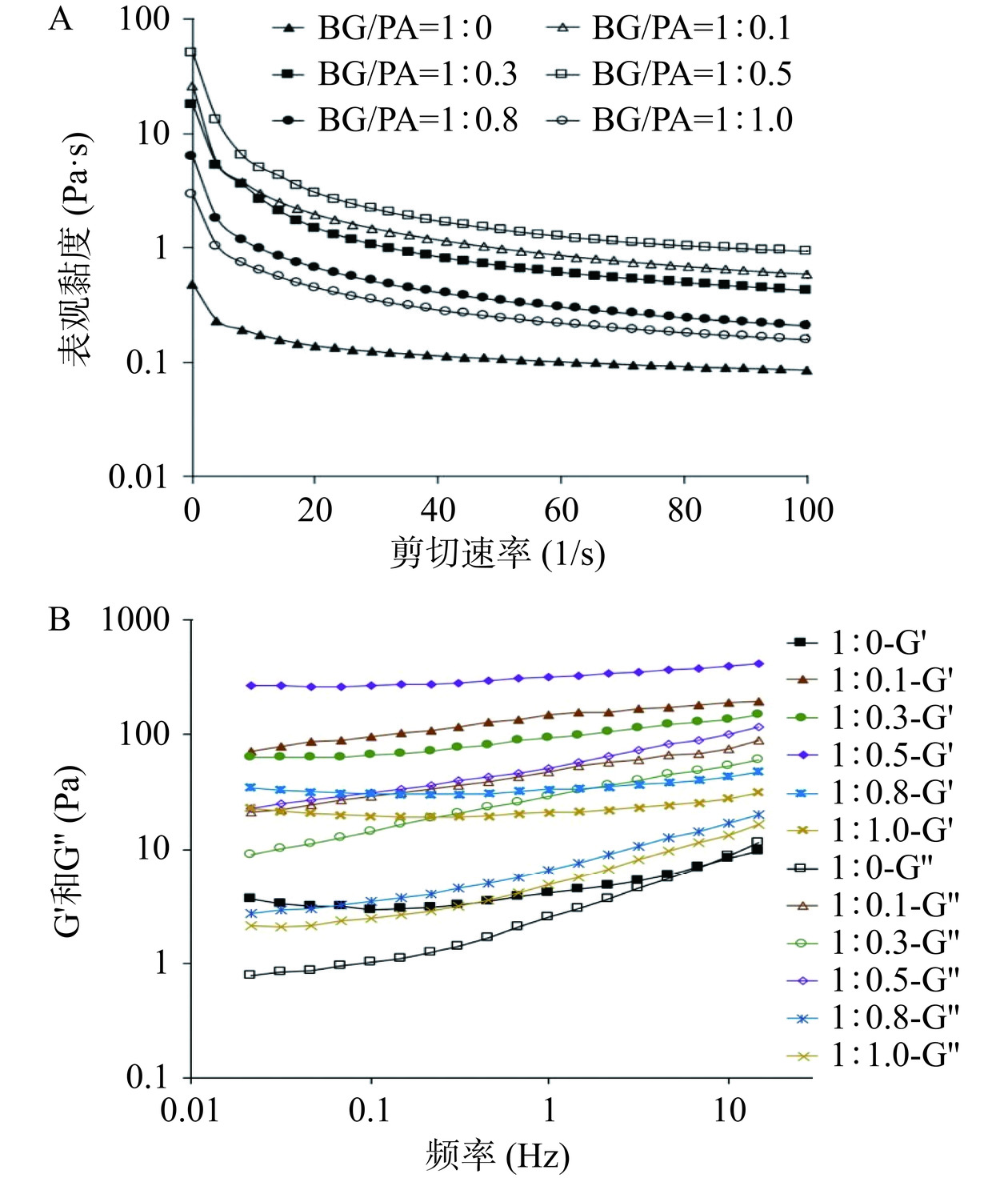
图6为BG-PA基负载姜黄素乳液凝胶的表观黏度和频率扫描对应的储能模量G'和损耗模量G''值。BG-PA基负载姜黄素乳液凝胶的表观黏度均随剪切速率从0.1 s−1增加至100 s−1而呈现下降趋势,存在剪切变稀的现象(图6A)。这是由于在快速的剪切速率下,乳液在剪切方向上的聚集结构被破坏,进而导致其黏度的下降[38]。此外,相同剪切速率下,2%BG制备的乳液表观黏度最低,其本身也表现出流动状态(图2A)。PA的添加可使乳液表观黏度增大,但过多的PA(如BG/PA=1:0.8和1:1.0)会导致乳液表观黏度的下降。进一步对表观黏度曲线进行幂律模型拟合,结果如表1所示。表1中R2均大于0.99,表明幂律模型对于表观黏度曲线拟合度好。n为流动指数,所有样品的n值均在0~1的范围内,表明所有乳液均为假塑性流体;并且n值随着乳液中PA的增加呈现先下降后上升的趋势。在BG-PA基负载姜黄素乳液体系,其中的PA作为多酚类化合物具有一定的交联能力[39],即多酚与多糖间或液滴间形成相互作用,增加了液滴间的纠缠或聚集形成一定的凝胶结构导致分子运动受限,流动指数下降,黏度增大[7,40]。在本研究中,乳液的表观黏度与乳液粒径大小的变化基本一致,BG/PA=1:0.8和1:1.0制得的乳液粒径明显大于BG/PA=1:1.0~1:0.5制得的乳液(图3B),其乳液相对应的表观黏度更低,且流动指数n更大。Li等[41]研究也发现儿茶素与米糠蛋白构建的O/W乳液体系其粒径的变化与乳液表观黏度密切相关,当儿茶素浓度>0.15%时乳液粒径增大,表观黏度下降。
表 1 不同BG/PA质量比构建的负载姜黄素乳液的幂律模型拟合参数Table 1. Power-law model fitting parameters of curcumin-loaded emulsion gels fabricated by BG-PA complexes with various BG/PA mass ratiosBG/PA质量比 K(Pa·Sn) n 回归系数(R2) 1:0 0.358 0.691 0.9985 1:0.1 18.398 0.252 0.9998 1:0.3 16.780 0.194 0.9936 1:0.5 40.415 0.159 0.9916 1:0.8 4.747 0.331 0.9959 1:1.0 2.620 0.395 0.9959 乳液的黏弹性可用于表征乳液凝胶结构的强度,其中储能模量G'表示乳液在受到外力作用下所存储的弹性能量,而损耗模量G''表示由于黏性耗散而造成的能力损失[41]。BG-PA基负载姜黄素乳液凝胶的黏弹性如图6B所示,仅含2%BG制备的乳液具有较低的G'和G'',且在高频率扫描下G'与G''间存在交叉点,这表明此乳液液滴在增大的频率作用下结构被完全破坏,不再具备凝胶的黏弹性,无法恢复形变。相比之下,BG-PA制备的乳液G'均大于G'',且远高于2%BG制备乳液的G'和G'',这表明它们具有更高的粘弹性。BG-PA制备乳液弹性模量的增加可以归因于以下两个因素:BG-PA制备的乳液在均质过程中形成的油滴较小,这导致油滴之间的排斥更强;多糖与多酚间的相互作用在油滴表面和水相中形成聚合物网络[17,42]。
2.6 BG-PA基乳液凝胶负载姜黄素的稳定性分析
2.6.1 热稳定性分析
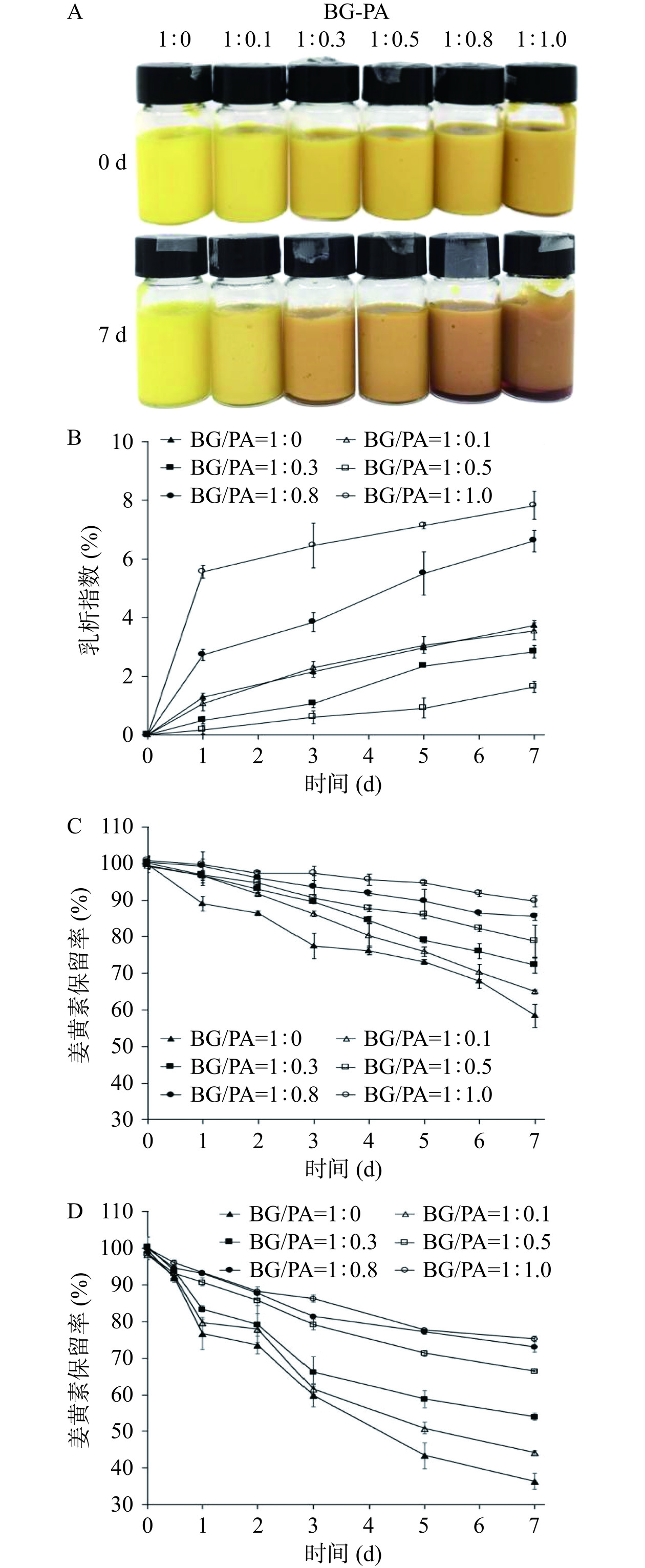
在食品加工生产、运输、销售的过程中,温度是影响食品品质的一项重要因素。而当食品受到高温照射时,食品内部的组分会发生变化进而会影响食品品质。因此,探讨了高温(55 ℃)对BG-PA基负载姜黄素乳液凝胶热稳定性的影响,结果如图7A~C所示。所有乳液在55 ℃条件下暴露7 d后颜色均有变化,特别是BG/PA=1:0.8和1:1.0制备的乳液外观(图7A),乳液颜色由明亮的橙色变为粽红色且瓶子底部有少量的红色乳清层。此外,所有乳液在55 ℃储存7d后乳析指数均<10%(图7B),展现出较好的热稳定性,其中BG/PA=1:0.5制备的乳液稳定性最佳。进一步对55 ℃储存7 d的乳液中姜黄素保留率分析发现:所有乳液姜黄素的保留率均呈现下降趋势,而2%BG制备的乳液中姜黄素的保留率最低。然而,BG-PA基乳液中姜黄素的保留率明显高于2%BG制备的乳液,并且姜黄素保留率与乳液中PA含量密切相关,即乳液中PA含量增加,姜黄素的降解速度减慢,保留率更高,表明PA的存在可有效抑制高温引起的姜黄素降解[43]。
2.6.2 紫外光照稳定性分析
姜黄素是一种光敏性化合物,其结构在可见光或紫外线下极易失去两个氢质子后被氧化降解[44]。因此,BG-PA基负载姜黄素乳液凝胶中姜黄素在紫外线辐射下的稳定性被探究,结果如图6B所示。所有乳液在紫外光线下暴露7 d后,姜黄素的保留率均有所下降,其中仅2%BG制备的乳液中姜黄素的保留率最低,仅为36.43%。相比之下,BG-PA基乳液中姜黄素保留率明显提升,BG/PA=1:0.8和1:1.0制备的乳液在紫外光线下暴露7 d后姜黄素保留率仍可到达70%以上。
综上所述,BG-PA基负载姜黄素乳液凝胶可抑制高温(55 ℃)和紫外线辐照引起的姜黄素降解,并且呈现PA剂量依赖性,即乳液中PA含量越高,姜黄素降解越慢,保留率越高。这是可能是由于PA的抗氧化活性,使得它可以作为氢供体代替姜黄素被氧化[44],进而保护姜黄素免受环境高温、紫外线因素的影响。
2.7 BG-PA基负载姜黄素乳液凝胶的体外消化特性
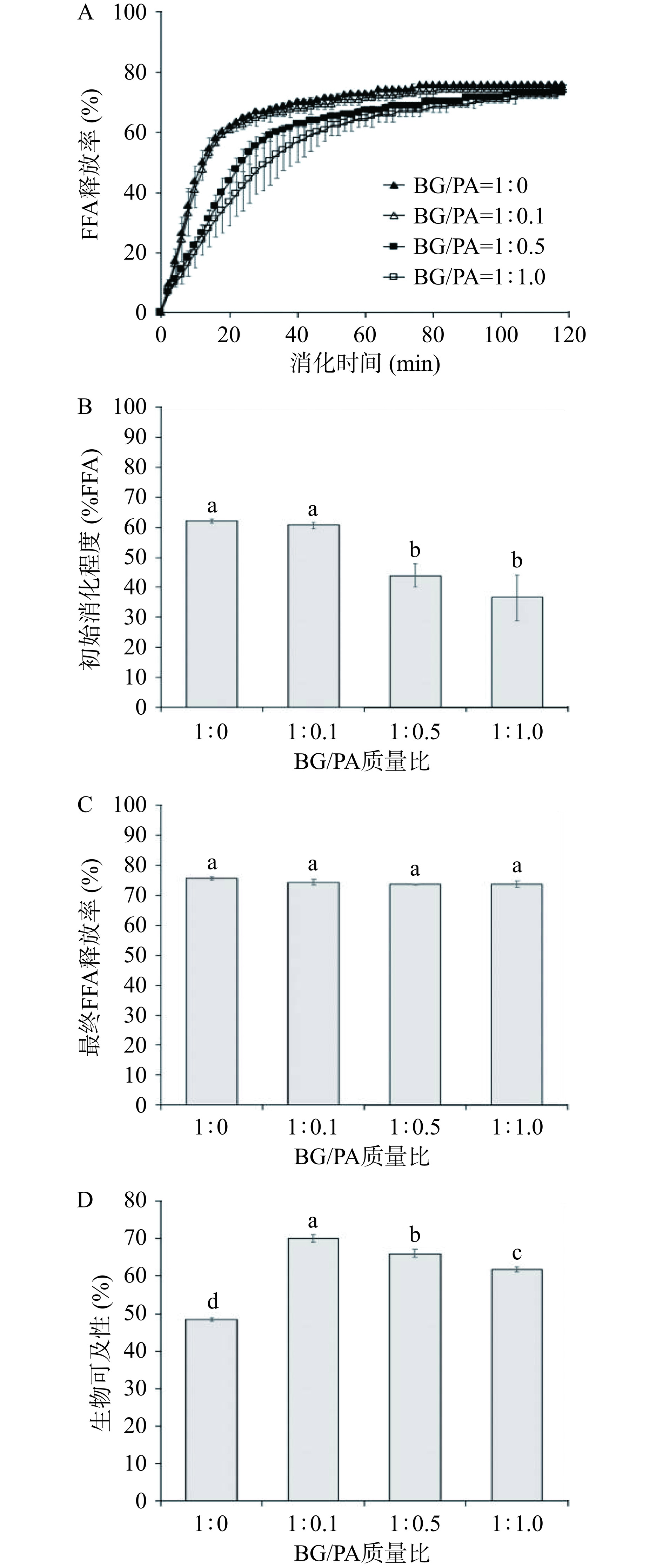
选取BG/PA=1:0、1:0.1、1:0.5、1:1.0(分别表示2%BG制备的乳液和BG-PA基中含低、中、高浓度的PA制备的乳液)制备的乳液进行体外消化模拟。如图8A所示,小肠消化阶段乳液中脂肪在胰脂肪酶的作用下迅速分解释放出游离脂肪酸,但随着消化时间的延长,脂肪分解速率减缓,最终游离脂肪酸的释放量趋于恒定。在小肠消化20 min内乳液中游离脂肪酸的释放率存在明显差异(图8B),BG/PA=1:0.5和1:1.0制备的乳液脂肪酸释放率显著低于BG/PA=1:0和1:0.1制备的乳液(P<0.05),表明高水平PA在一定程度上减缓了脂肪的分解速率。有研究表明:PA可以与胰脂肪酶发生相互作用,从而抑制脂肪酶活性,导致脂肪分解速率下降[45]。但是,2 h的小肠消化后所有样品的游离脂肪酸释放率相近,均在74%左右(图8C)。在此乳液体系中,高水平的PA仅能减缓初始脂肪消化的速度,对于脂肪的最终消化程度无显著影响。此外,进一步探究了BG-PA基负载姜黄素乳液凝胶小肠消化后的姜黄素生物可及性,结果如图8D所示。仅2%BG制备的负载姜黄素乳液中姜黄素的生物可及性最低,仅为48.42%±0.48%。但BG/PA制备的负载姜黄素乳液中姜黄素的生物可及性显著提升(P<0.05),其中BG/PA=1:0.1制备乳液姜黄素的生物可及性最高,为70.19%±0.97%。
3. 结论
本研究发现燕麦β-葡聚糖(BG)和原花青素(PA)可通过氢键和疏水相互作用自组装形成胶体复合物,且此BG-PA复合物作为基质成功地构建了负载姜黄素的乳液凝胶。BG/PA=1:0.1~1:0.5制备的负载姜黄素乳液凝胶具有较小的粒径(15 μm)和较好的离心稳定性(不稳定指数<0.3)。对乳液的微观结构和流变学特性分析发现BG-PA复合物可能通过减小液滴尺寸、提高表观黏度和凝胶强度来提升乳液的稳定性。此外,在高温(55 ℃)和紫外线(UV)环境下,BG-PA基负载姜黄素乳液凝胶可有效抑制姜黄素的降解,且表现出良好的PA剂量依赖性,这表明乳液中PA的存在可有效抑制高温和UV引起的姜黄素降解。在体外模拟消化中,BG-PA基负载姜黄素乳液凝胶中高水平的PA(BG/PA=1:0.5和1:1.0)能减缓初始脂肪的消化速度,但对于脂肪的最终消化程度无显著影响。同时,与单独2%BG制备的乳液相比,BG-PA基负载姜黄素乳液凝胶中姜黄素的生物可及性更高。BG和PA作为天然的植物基材料,通过简单均质即可形成凝胶状乳液,并用于递送生物活性成分,这为植物基多糖和多酚类化合物体系在凝胶状食品和化妆品乳剂中的应用提供了新的思路。但本研究仅探究了BG-PA复合物在构建负载姜黄素乳液凝胶方面的性能,后续还可在负载其他生物活性成分、优化乳液凝胶性能和3D打印食品方面开展相关研究。
-
表 1 不同BG/PA质量比构建的负载姜黄素乳液的幂律模型拟合参数
Table 1 Power-law model fitting parameters of curcumin-loaded emulsion gels fabricated by BG-PA complexes with various BG/PA mass ratios
BG/PA质量比 K(Pa·Sn) n 回归系数(R2) 1:0 0.358 0.691 0.9985 1:0.1 18.398 0.252 0.9998 1:0.3 16.780 0.194 0.9936 1:0.5 40.415 0.159 0.9916 1:0.8 4.747 0.331 0.9959 1:1.0 2.620 0.395 0.9959 -
[1] PAGLARINI C, VIDAL V, MARTINI S. , et al. Protein-based hydrogelled emulsions and their application as fat replacers in meat products:A review[J]. Critical Reviews in Food Science and Nutrition,2022,62(3):640−655. doi: 10.1080/10408398.2020.1825322
[2] DREHE J, BLACH C, TERJUNG N, et al. Influence of protein content on plant-based emulsified and crosslinked fat crystal networks to mimic animal fat tissue[J]. Food Hydrocolloids,2020,106:105864. doi: 10.1016/j.foodhyd.2020.105864
[3] SHI Z Y, CHEN Z J, MENG Z. Study on oil body emulsion gels stabilized by composited polysaccharides through microgel particles compaction and natural gelation[J]. Food Hydrocolloids,2023,135:108146. doi: 10.1016/j.foodhyd.2022.108146
[4] LI R L, GUO Y, DONG A J, et al. Protein-based emulsion gels as materials for delivery of bioactive substances:Formation, structures, applications and challenges[J]. Food Hydrocolloids,2023,144:108921. doi: 10.1016/j.foodhyd.2023.108921
[5] MANTOVANI R, CAVALLIETRI Â, CUNHA R. Gelation of oil-in-water emulsions stabilized by whey protein[J]. Journal of Food Engineering,2016,175:108−116. doi: 10.1016/j.jfoodeng.2015.12.011
[6] BEN-FADHEL Y, MAHERANI B, MANUS J, et al. Physicochemical and microbiological characterization of pectin-based gelled emulsions coating applied on pre-cut carrots[J]. Food Hydrocolloids,2020,101:105573. doi: 10.1016/j.foodhyd.2019.105573
[7] LONG M, REN Y Y, LI Z S, et al. Effects of different oil fractions and tannic acid concentrations on konjac glucomannan-stabilized emulsions[J]. International Journal of Biological Macromolecules,2024,265:130723. doi: 10.1016/j.ijbiomac.2024.130723
[8] CHEN Y, WANG J, RAO Z, et al. Study on the stability and oral bioavailability of curcumin loaded (-)-epigallocatechin-3-gallate/poly (N-vinylpyrrolidone) nanoparticles based on hydrogen bonding-driven self-assembly[J]. Food Chemistry,2022,378:5373−9.
[9] TANG Y, GAO C C, ZHANG Y, et al. A review of literature on pickering emulsion gels stabilized by polysaccharide-based particles[J]. Food Science, China,2022,43(3):341−351.
[10] DONG Y, WEI Z H, WANG Y M, et al. Oleogel-based Pickering emulsions stabilized by ovotransferrin-carboxymethyl chitosan nanoparticles for delivery of curcumin[J]. Lwt-Food Science and Technology,2022,157:113121. doi: 10.1016/j.lwt.2022.113121
[11] XU Y, SUN L P, ZHUANG Y L, et al. Protein-stabilized emulsion gels with improved emulsifying and gelling properties for the delivery of bioactive ingredients:A review[J]. Foods,2023,12(14):2703. doi: 10.3390/foods12142703
[12] NGUYEN T, FLANAGANl M, TAO K, et al. Effect of processing on the solubility and molecular size of oat β-glucan and consequences for starch digestibility of oat-fortified noodles[J]. Food Chemistry,2022,372:131291. doi: 10.1016/j.foodchem.2021.131291
[13] MATHEWS R, SHETE V, CHU Y. The effect of cereal Β-glucan on body weight and adiposity:A review of efficacy and mechanism of action[J]. Critical Reviews in Food Science and Nutrition,2023,63(19):3838−3850. doi: 10.1080/10408398.2021.1994523
[14] MATHEWS R, CHU Y. The effect of whole-grain oats, oat bran, and isolated beta-Glucan on indices of satiety and short-term energy intake[J]. Food Reviews International,2024,40(4):1196−1216. doi: 10.1080/87559129.2023.2214807
[15] LI R, PENG S, ZHANG R, et al. Formation and characterization of oil-in-water emulsions stabilized by polyphenol-polysaccharide complexes:Tannic acid and β-glucan[J]. Food Research International,2019,123:266−275. doi: 10.1016/j.foodres.2019.05.005
[16] WEI X, LI J, EID M, et al. Fabrication and characterization of emulsions stabilized by tannic acid-wheat starch complexes[J]. Food Hydrocolloids,2020,107:105728. doi: 10.1016/j.foodhyd.2020.105728
[17] LIU Y K, YAN C, CHEN J, et al. Enhancement of beta-carotene stability by encapsulation in high internal phase emulsions stabilized by modified starch and tannic acid[J]. Food Hydrocolloids,2020,109:106083. doi: 10.1016/j.foodhyd.2020.106083
[18] GARRIDO G, BUICA A, TOIT W. Relationship between anthocyanins, proanthocyanidins, and cell wall polysaccharides in grapes and red wines. A current state-of-art review[J]. Critical Reviews in Food Science and Nutrition,2022,62(28):7743−7759. doi: 10.1080/10408398.2021.1918056
[19] DAI T T, LI T, LI R Y, et al. Utilization of plant-based protein-polyphenol complexes to form and stabilize emulsions:Pea proteins and grape seed proanthocyanidins[J]. Food Chemistry,2020,329:127219. doi: 10.1016/j.foodchem.2020.127219
[20] QI Q Q, CHU M J, YU X T, et al. Anthocyanins and proanthocyanidins:Chemical structures, food fources, bioactivities, and product development[J]. Food Reviews International,2023,39(7):4581−4609. doi: 10.1080/87559129.2022.2029479
[21] GONG W, GUO X L, WANG S J, et al. Construction of high internal phase Pickering emulsions using cold plasma modified soy protein isolate-proanthocyanidin complex[J]. Food Research International,2023,167:112664. doi: 10.1016/j.foodres.2023.112664
[22] ZHOU C F, ZHANG L J, ZAKY A, et al. High internal phase Pickering emulsion by Spanish mackerel proteins-procyanidins:Application for stabilizing astaxanthin and surimi[J]. Food Hydrocolloids,2022,133:107999. doi: 10.1016/j.foodhyd.2022.107999
[23] LI R Y, ZENG Z C, FU G , et al. Formation and characterization of tannic acid/beta-glucan complexes:Influence of pH, ionic strength, and temperature[J]. Food Research International, 2019, 120:748-755.
[24] ZHU Y, HUAN S Q, BAI L, et al. High internal phase oil-in-water Pickering emulsions stabilized by chitin nanofibrils:3D structuring and solid foam[J]. ACS Applied Materials & Interfaces,2020,12(9):11240−11251.
[25] LIU Y, GUO X, LIU T, et al. Study on the structural characteristics and emulsifying properties of chickpea protein isolate-citrus pectin conjugates prepared by Maillard reaction[J]. International Journal of Biological Macromolecules,2024,264:130606. doi: 10.1016/j.ijbiomac.2024.130606
[26] ZHANG Y H, LU Y, ZHANG R N, et al. Novel high internal phase emulsions with gelled oil phase:Preparation, characterization and stability evaluation[J]. Food Hydrocolloids,2021,121:106995. doi: 10.1016/j.foodhyd.2021.106995
[27] 胡露丹, 杜杰, 彭林, 等. 明胶基乳液的流变学特性及其对煎炸食品的应用[J]. 食品科学,2022(16):114−121. [HU L D, DU J, PENG L, et al. Rheological properties of gelatin based emulsion and its application to fried food[J]. Food Science,2022(16):114−121.] doi: 10.7506/spkx1002-6630-20210616-191 HU L D, DU J, PENG L, et al. Rheological properties of gelatin based emulsion and its application to fried food[J]. Food Science, 2022(16): 114−121. doi: 10.7506/spkx1002-6630-20210616-191
[28] 魏晓晶, 陈红, 张迈, 等. 荷载姜黄素的Pickering乳液流变学特性和稳定性研究:姜黄素溶解在乙醇和油中的比较[J]. 食品与发酵工业,2024,50(13):98−107. [WEI X J, CHEN H, ZHANG M, et al. Rheological properties and stability of Pickering emulsions loaded with curcumin:Comparison of curcumin dissolved in ethanol and oil[J]. Food and Fermentation Industry,2024,50(13):98−107.] WEI X J, CHEN H, ZHANG M, et al. Rheological properties and stability of Pickering emulsions loaded with curcumin: Comparison of curcumin dissolved in ethanol and oil[J]. Food and Fermentation Industry, 2024, 50(13): 98−107.
[29] LI R Y, TAN Y B, DAI T T, et al. Bioaccessibility and stability of β-carotene encapsulated in plant-based emulsions:impact of emulsifier type and tannic acid[J]. Food & Function,2019,10(11):7239−7252.
[30] TAN Y B, LI R Y, ZHOU H L, et al. Impact of calcium levels on lipid digestion and nutraceutical bioaccessibility in nanoemulsion delivery systems studied using standardized INFOGEST digestion protocol[J]. Food & Function,2020,11(1):174−186.
[31] ZIELKE C, STRADNER A, NILSSON L. Characterization of cereal β-glucan extracts:Conformation and structural aspects[J]. Food Hydrocolloids,2018,79:218−227. doi: 10.1016/j.foodhyd.2017.12.036
[32] HUANG Z L, LIAO L K, MCCLEMENTS J, et al. Utilizing protein-polyphenol molecular interactions to prepare moringa seed residue protein/tannic acid Pickering stabilizers[J]. LWT,2022,154:112814. doi: 10.1016/j.lwt.2021.112814
[33] MATIC P, ULIC Š, JAKOBEK L. Adsorption of procyanidins B1 and B2 onto β-Glucan:adsorption isotherms and thermodynamics[J]. Adsorption,2024,30:1303−1313. doi: 10.1007/s10450-024-00503-5
[34] JIA Y Y, DANG M Z, KHALIFA I, et al. Persimmon tannin can enhance the emulsifying properties of persimmon pectin via promoting the network and forming a honeycomb-structure[J]. Food Hydrocolloids,2023,135:108157. doi: 10.1016/j.foodhyd.2022.108157
[35] HUANG X, TU R, SONG H, et al. Fabrication of gelatin-EGCG-pectin ternary complex stabilized W/O/W double emulsions by ultrasonic emulsification:Physicochemical stability, rheological properties and structure[J]. Journal of Food Engineering,2023,338:111259. doi: 10.1016/j.jfoodeng.2022.111259
[36] GAO Y, LI X Q, XIE Y F, et al. Encapsulation of bitter peptides in diphasic gel double emulsions:Bitterness masking, sustained release and digestion stability[J]. Food Research International,2022,162:112205. doi: 10.1016/j.foodres.2022.112205
[37] MCCLEMENTS J, JAFARI M. Improving emulsion formation, stability and performance using mixed emulsifiers:A review[J]. Advances in Colloid and Interface Science,2018,251:55−79. doi: 10.1016/j.cis.2017.12.001
[38] FAROOQ S, IJAZ A, ZHANG Y, et al. Fabrication, characterization and in vitro digestion of camellia oil body emulsion gels cross-linked by polyphenols[J]. Food Chemistry,2022,394:133469. doi: 10.1016/j.foodchem.2022.133469
[39] WU Z, LIU J, LIN J, et al. Novel digital light processing printing strategy using a collagen-based bioink with prospective cross-linker procyanidins[J]. Biomacromolecules,2022,23(1):240−252. doi: 10.1021/acs.biomac.1c01244
[40] WANG Y Y, LIU J, CHEN F, et al. Effects of molecular structure of polyphenols on their noncovalent interactions with opat β-glucan[J]. Journal of Agricultural and Food Chemistry,2013,61(19):4533−4538. doi: 10.1021/jf400471u
[41] LI D, ZHAO Y, WANG X, et al. Effects of (+)-catechin on a rice bran protein oil-in-water emulsion:Droplet size, zeta-potential, emulsifying properties, and rheological behavior[J]. Food Hydrocolloids,2020,98:105306. doi: 10.1016/j.foodhyd.2019.105306
[42] HUANG Y, LI A J, QIU C Y, et al. Self-assembled colloidal complexes of polyphenol–gelatin and their stabilizing effects on emulsions[J]. Food & Function,2017,8(9):3145−3154.
[43] LI W J, HUANG D J, SONG W X, et al. Pickering emulsions stabilized by zein-proanthocyanidins-pectin ternary composites (ZPAAPs):Construction and delivery studies[J]. Food Chemistry,2023,404:134642. doi: 10.1016/j.foodchem.2022.134642
[44] CAI X X, WENG Q X, LIN J M, et al. Radix pseudostellariae protein-curcumin nanocomplex:Improvement on the stability, cellular uptake and antioxidant activity of curcumin[J]. Food and Chemical Toxicology,2021,151:112110. doi: 10.1016/j.fct.2021.112110
[45] SOSNOWSKA D, PODSEDEK A, KUCHARSK Z. Proanthocyanidins as the main pancreatic lipase inhibitors in chokeberry fruits[J]. Food & Function,2022,13(10):5616−5625.





 下载:
下载:
 下载:
下载:



