Effects of Konjac Glucomannan and Whey Protein Complex on Stability and Slow Release Properties of Vitamin C W1/O/W2 Multiple Emulsion
-
摘要: 研究魔芋葡甘聚糖(Konjac glucomannan,KGM)与乳清蛋白(Whey protein,WP)复配对维生素C多重乳液稳定性和缓释性能的影响,为维生素C多重乳液的应用提供参考。以KGM和WP混合溶液制备负载维生素C的W1/O/W2型多重乳液,考察不同质量分数的KGM和WP对多重乳液离心乳析率、离心沉淀率、负载率、粒径、Zeta电位、流变特性、维生素C保留率和释放率的影响。结果表明,KGM质量分数为0.10%,WP质量分数为10.00%时,多重乳液的稳定性和缓释性能最好。此时,乳滴分布均匀,粒径为64.38 μm,Zeta电位为−46.50 mV;维生素C的负载率达到93.24%;且在4、25和50 ℃下贮藏20 d均未出现明显分层;经模拟消化后乳液中维生素C的释放率为85.64%。上述结果证实了KGM与WP复配具有稳定维生素C W1/O/W2型多重乳液的潜在能力。Abstract: To study the effects of konjac glucomannan and whey protein on the stability and slow release properties of vitamin C multiple emulsion, and to provide reference for the application of vitamin C multiple emulsion. W1/O/W2 multiple emulsion loaded with vitamin C was prepared by mixing konjac glucomannan and whey protein. The effects of various mass fractions of KGM and WP on the centrifugation stability index, centrifugal precipitation rate, loading rate, particle size, zeta potential, rheological properties, vitamin C retention rate and release rate of multiple emulsion were investigated. The results showed that the multiple emulsion exhibited good stability and slow release properties when the mass fraction of KGM was 0.10% and WP quality score was 10.00%. At this point, the droplet distributed equally, the particle size was 64.38 μm, and the Zeta potential was −46.50 mV. The loading rate of vitamin C was reached 93.24%. No obvious stratification occurred after 20 d when the multiple emulsion was stored at 4, 25 and 50 ℃. After simulated digestion, the release rate of vitamin C in the emulsion was 85.64%. The above results confirmed that KGM and WP combination has the potential ability to stabilize vitamin C W1/O/W2 multiple emulsion.
-
Keywords:
- konjac glucomannan /
- whey protein /
- vitamin C /
- W1/O/W2 multiple emulsion /
- stability /
- slow release properties
-
维生素C常被称为抗坏血酸,作为一种天然的活性成分,是人体生长发育所必需的营养物质[1]。由于维生素C抗氧化能力很强,常被用于护肤品行业,有淡斑、美白的功效,然而维生素C对温度、金属离子、氧气、光线敏感性强,易降解,这些因素都限制了维生素C在食品、化妆品和制药领域中的应用[2−3]。由于维生素C的不稳定,目前有关维生素C的研究大部分集中于抗氧化以及应用等方面[4],近年来研究人员使用纳米乳液[5]、以及脂质体[6]等载体来封装维生素C,但由于载体本身的不稳定性,其封装优势受到限制;而脂质体既容易聚集又容易泄露包载物,因此,如何巧妙地包裹维生素C,既能维持其稳定性状,又能简化制备步骤成为当前研究的热点。
W1/O/W2型多重乳液是内部包裹有水滴(W1)的水包油乳状液(O/W2),也是目前较为常见的一种乳液体系[7],由于多重乳液具有独特的“两膜三相”的多隔室结构,能够在不降低油滴尺寸或相分数的情况下将亲水性活性化合物包裹在多重乳液的内水相中,在胃肠道中缓慢释放并表现出更大的稳定性,提高了生物利用度。然而,热力学不稳定性和亲水化合物在油层中的扩散是导致多重乳液稳定性较差的主要问题,限制了其在食品、药品以及化妆品等领域的应用[8−10]。
近年来,多糖-蛋白质复合物也被用于生产稳定的多重乳液。多糖-蛋白质的相互作用为食品配方的应用提供了新界面结构,多糖和蛋白质分子之间的相互作用可以通过共价键或静电相互作用形成。作为天然乳化剂和稳定剂的蛋白质(例如,乳清蛋白)可以通过在油滴上形成粘弹性吸附层而产生热力学和动力学稳定的乳液,多糖则通过提高水相的粘度和形成多层膜来提高界面膜质量,从而提高乳液的稳定性。魔芋葡甘聚糖(Konjac glucomannan,KGM)是一种天然的可再生高分子储备性多糖,具有良好的流变性,粘度较高,溶于水后能迅速形成粘稠的溶胶,在脱水后经一定条件还能形成一种粘而有力的膜,这种膜在酸碱以及冷热环境中均能保持稳定。同时,它还是一种重要的水溶性膳食纤维,具有增强人体免疫力、调节肠道的微生物代谢、降糖以及降脂等功效[11−13]。乳清蛋白(Whey protein,WP)主要由α-乳清蛋白、β-乳球蛋白和免疫球蛋白组成,具有在最佳蛋白浓度和离子强度下形成热诱导凝胶的能力[14−15]。
本研究主要以棕榈油为内乳液的油相,Tween-80和Span-80为乳化剂,KGM和WP复合物为外水相制备维生素C多重乳液,衡量不同质量分数的KGM-WP复配物对载维生素C的W1/O/W2型多重乳液稳定性的影响,期望为W1/O/W2型多重乳液在食品等领域的应用提供借鉴和参照,并为探究维生素C稳定性和相容性奠定了基础。
1. 材料与方法
1.1 材料与仪器
魔芋葡甘露聚糖(KGM,纯度≥98%)、乳清蛋白(WP,纯度≥98%)、吐温80(Tween-80)、司盘80(Span-80)、抗坏血酸(维生素C)、棕榈油 上海源叶生物科技有限公司;氯化钠、盐酸、磷酸氢二钾、氢氧化钠 国药集团化学试剂有限公司;胰蛋白酶(酶活力80 U/mg)、脂肪酶(酶活力10000 U/g)、胃蛋白酶(酶活力30000 U/g) 诺维信生物医药有限公司;所有其他试剂均为分析纯;水为去离子水。
JJ-1A型电热恒温水浴锅 北京市永光明医疗仪器有限公司;YP10002型电子天平 上海光正医疗仪器有限公司;IKA T18数显型高速分散机 艾卡(广州)仪器设备有限公司;TDL-5-A型台式离心机 上海安亭科学仪器厂;TECAN M200pro型酶标仪 瑞士帝肯公司;Zetasizer Nano-ZS电位仪 英国Malvern仪器有限公司;OS20-Pro顶置式电子搅拌器 北京大龙兴创实验仪器股份公司
1.2 实验方法
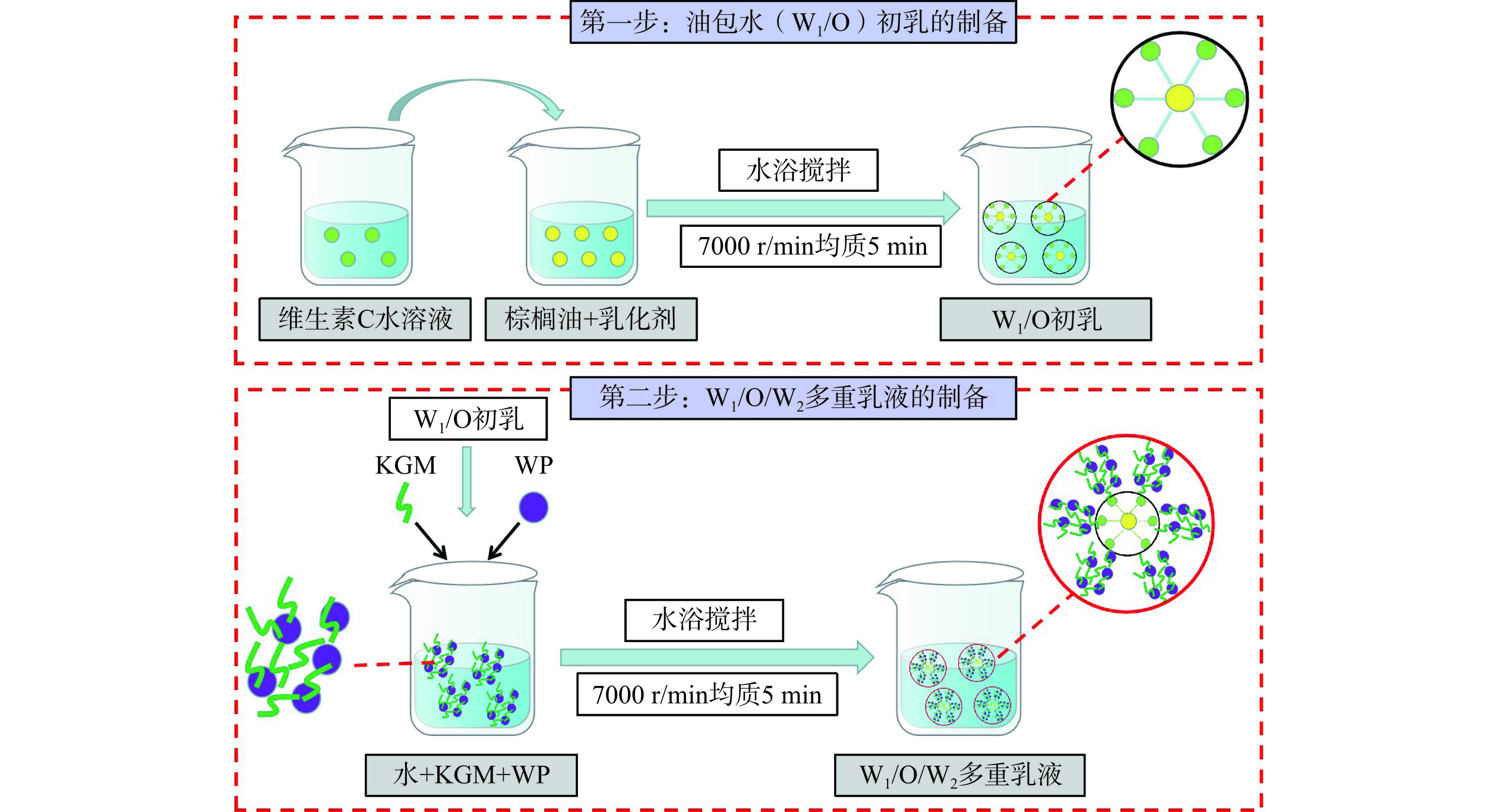
1.2.1 载维生素C的W1/O/W2型多重乳液的制备
根据符叶等[16]的方法,采用两步乳化法制备水包油包水乳液负载维生素C的W1/O/W2型多重乳液(见图1)。准确称取10 g棕榈油加入到250 mL的烧杯中,按9:1的比例称取Span-80和Tween-80加入到盛有棕榈油的烧杯中,将烧杯置于磁力搅拌水浴锅中搅拌20 min,取出后将浓度为1.0%的维生素C水溶液(添加量为10%)加入到烧杯中,作为内层水相(W1),采用电子搅拌器于恒温条件下按照3000 r/min的转速搅拌30 min,取出后冷却至室温,7000 r/min条件下均质5 min,得到含有维生素C的油包水(W1/O)初乳。
根据前期实验结果发现,油相与维生素C的质量比为2:1时,质量比为3:7的Span-80和Tween-80为外层颗粒乳化剂时,多重乳液综合性质最佳。因此,分别取不同质量分数(0.05%、0.10%、0.15%、0.20%)的KGM溶液与10% w/w的WP溶液与去离子水(W2)混匀,30 ℃水浴30 min。加入初乳,使初乳与W2的体积比为2:1(v/v),7000 r/min条件下均质5 min,得到负载维生素C的W1/O/W2型多重乳液。
1.2.2 多重乳液理化性质的测定
1.2.2.1 离心乳析率和离心沉淀率的测定
离心乳析率测定:取静置24 h后的10 mL W1/O/W2型多重乳液置于15 mL的离心管中,在3500 r/min的转速下离心10 min,取出离心管后读取上清液中析出的油的体积,每个样品重复测定3次,取3次测定数据的平均值进行计算,计算方法见公式(1)。
离心乳析率(%)=V1V2×100 (1) 式中:V1为析出油的体积,mL;V2为离心乳液的总体积,mL。
离心沉淀率测定:称取静置24 h后10 mL的W1/O/W2型多重乳液置于15 mL的离心管中,在3500 r/min的转速下离心10 min,取出离心管后倒出上清液,称取离心管底部的沉淀物质量,每个样品重复测定3次,取3次测定数据的平均值进行计算,计算方法见公式(2)。
离心沉淀率(%)=m1m2×100 (2) 式中:m1为沉淀物的质量,g;m2为离心乳液的总质量,g。
1.2.2.2 负载率的测定
准确称取10 g W1/O/W2型多重乳液置于30 kDa透析袋中,将透析袋浸于去离子水中,常温避光环境下透析24 h(可去除乳液中未被包裹的维生素C),向10 mL的容量瓶中加入被处理过的透析液0.2 mL,用去离子水定容至10 mL,在波长265 nm处测定其吸光度。利用维生素C标准曲线计算乳液中残余维生素C的质量,计算方法见公式(3)。
负载率(%)=m1−m2m1×100 (3) 式中:m1为维生素C原始添加量,g;m2为复乳中残余维生素C的质量,g。
1.2.2.3 微观结构的观察
采用扫描式电子显微镜(Scanning electron microscope,SEM)观察乳液的微观结构。取乳液均匀涂抹于导电胶上,加速电压为10 kV,测试前于样品表面喷金,观察倍数为5000×。
1.2.2.4 粒径及Zeta电位的测定
取W1/O/W2型多重乳液通过Zetasizer Nano-ZS仪器测量样品的ζ-电位,激光器为4 mV的He-Ne激光器,入射波长为633 nm,平衡时间为2 min,测量温度为25 ℃。采用DLS技术在激光动态粒度扫描仪上测定样品溶液的平均粒径(Dz),散射角度为90°,在温度为25 ℃的条件下完成测量,样品不经过滤直接置于样品池测试,平衡时间为2 min,每个样品测定3次取平均值。
1.2.3 流变特性研究
取适量W1/O/W2型多重乳液通过流变仪测量乳液的流变特性。主要参数如下,平板直径为25 mm,仪器扫描频率范围0.1~100 rad/s,应变力范围为0.001%~100%,测试温度25 ℃,记录乳液样品的储能模量(G')和损耗模量(G'')随扫描频率的变化情况。
1.2.4 贮藏稳定性研究
将新鲜制备的W1/O/W2型多重乳液分别置于低温(4 ℃)、室温(25 ℃)、高温(50 ℃)下避光贮藏20 d,观察乳液表观形态的变化情况。同时每隔5 d测定维生素C的保留率,探究不同贮藏温度、贮藏时间对乳液负载维生素C稳定性的影响。多重乳液中维生素C的保留率(RR)计算方法见公式(4)。
RR(%)=W2W1×100 (4) 式中:W1为新鲜制备的多重乳液中维生素C的负载量,g;W2为贮藏第5、10、15和20 d时乳液中维生素C的负载量,g。
1.2.5 缓释性能研究
根据Wang等[17]方法,采用人工胃液(Simulated gastric fluid,SGF)和人工肠液(Simulated intestinal fluid,SIF)研究多重乳液的缓释性能。其中SGF溶液的配制如下:称取2.0 g的氯化钠溶解于900 mL的蒸馏水中,用浓度为36%的盐酸调整pH至1.2,再加入3.2 g的胃蛋白酶,定容至1000 mL的容量瓶中。SIF溶液的配制如下:称取0.68 g的磷酸氢二钾溶解于800 mL的蒸馏水中,加入77 mL的氢氧化钠(0.2 mol/L),用氢氧化钠(1 mol/L)或盐酸(1 mol/L)调整pH至6.8,加入10.0 g的胰蛋白酶及少量脂肪酶混匀后定容至1000 mL。将配制好的消化液保存在4 ℃的冰箱中待用,避免酶失活。将多重乳液和胃液按照1:1(v/v)混合后,置于温度为37 ℃的水浴中消化,搅拌速度100 r/min,消化时间为1 h,模拟胃液消化的过程。待胃液消化完成后,用氢氧化钠(1 mol/L)调整pH至6.8使胃蛋白酶灭活,加入20 mL的SIF溶液,在相同的条件下继续消化3 h。在模拟胃肠消化实验的4 h中,每隔30 min取样0.20 mL测维生素C的含量,维生素C释放率(%)的计算方法见公式(5)。
释放率(%)=m1m2×100 (5) 式中:m1为每隔30 min取样0.20 mL测得维生素C的含量,g;m2为维生素C总含量,g。
1.3 数据处理
实验均进行3次取平均值,采用SPSS 25.0对实验数据统计分析,结果表示为“平均值±标准差”。采用单因素方差分析(ANOVA)和Duncan's法多重比较分析各组的差异显著性,其中P<0.05代表显著性差异,用Origin 2021软件作图。
2. 结果与分析
2.1 多重乳液离心乳析率、离心沉淀率和负载率的结果与分析
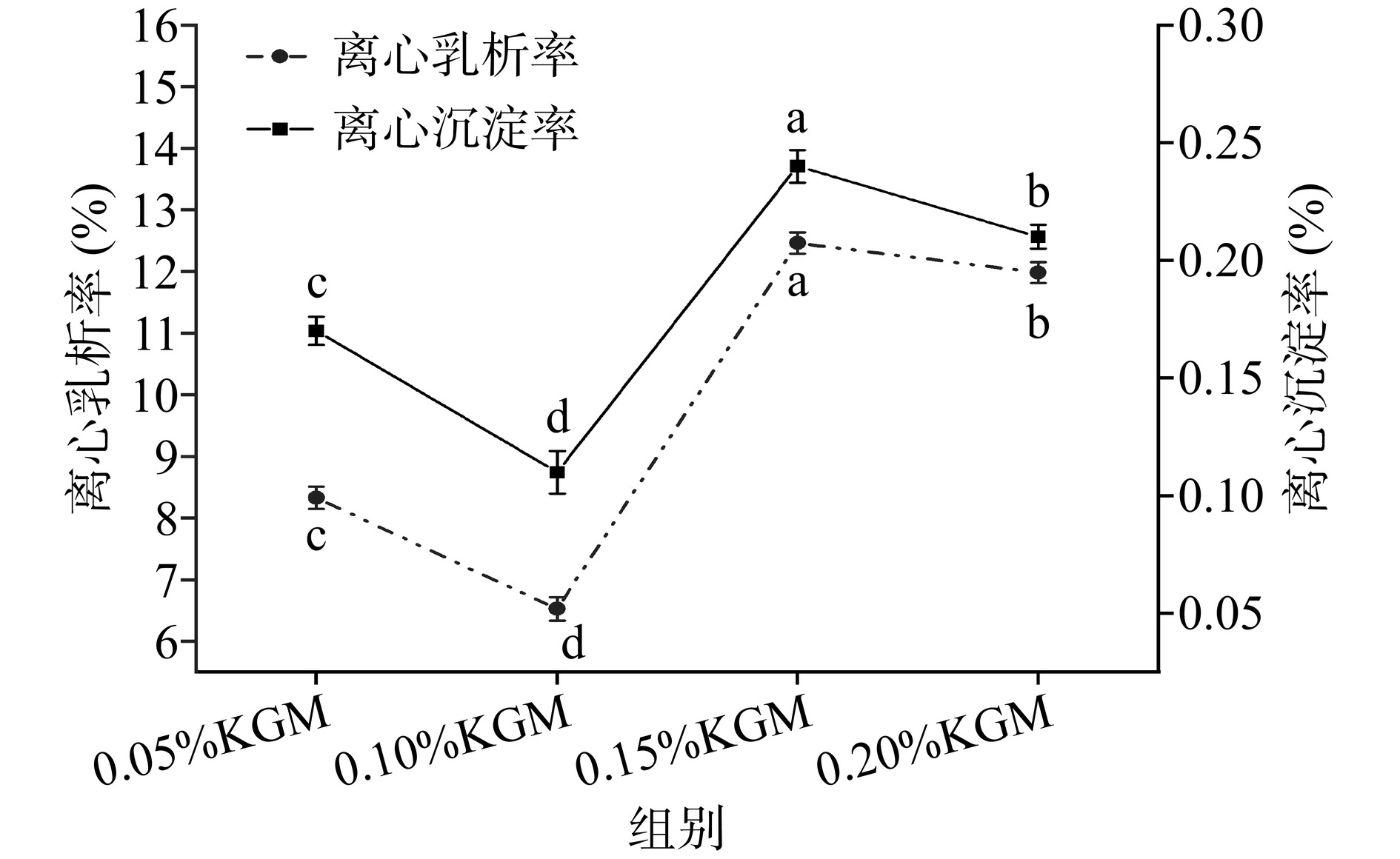
不同KGM质量分数对多重乳液离心乳析率和离心沉淀率的影响如图2所示。由图2可知,质量分数为0.10%的KGM的乳液离心乳析率和离心沉淀率显著低于其他KGM质量分数的多重乳液(P<0.05),添加了0.05%KGM的并不能有效抑制乳析的发生,这可能是因为在多重乳液刚完成制备后粘度相对较高,KGM-WP复合物虽然能够减缓脂肪球的上浮,但是随着时间的延长,脂肪球会逐步形成乳析层,且0.15%和0.20%质量分数的KGM会不断的促进乳析,迅速降低了乳液的稳定性[18]。同样的,随着KGM质量分数的增加,乳液的离心沉淀率也增加,这说明KGM-WP复配使多重乳液具有良好的悬浮性,其中质量分数为0.10%的KGM具有较好的离心沉淀抑制作用,这与Xu等[19]的研究结果是一致的。通过上述分析可知,0.15%和0.20%质量分数的KGM在降低离心沉淀率同时还增加乳状液的乳析率,因此在维生素C W1/O/W2型多重乳液制备中,推荐使用质量分数为0.10%的KGM。
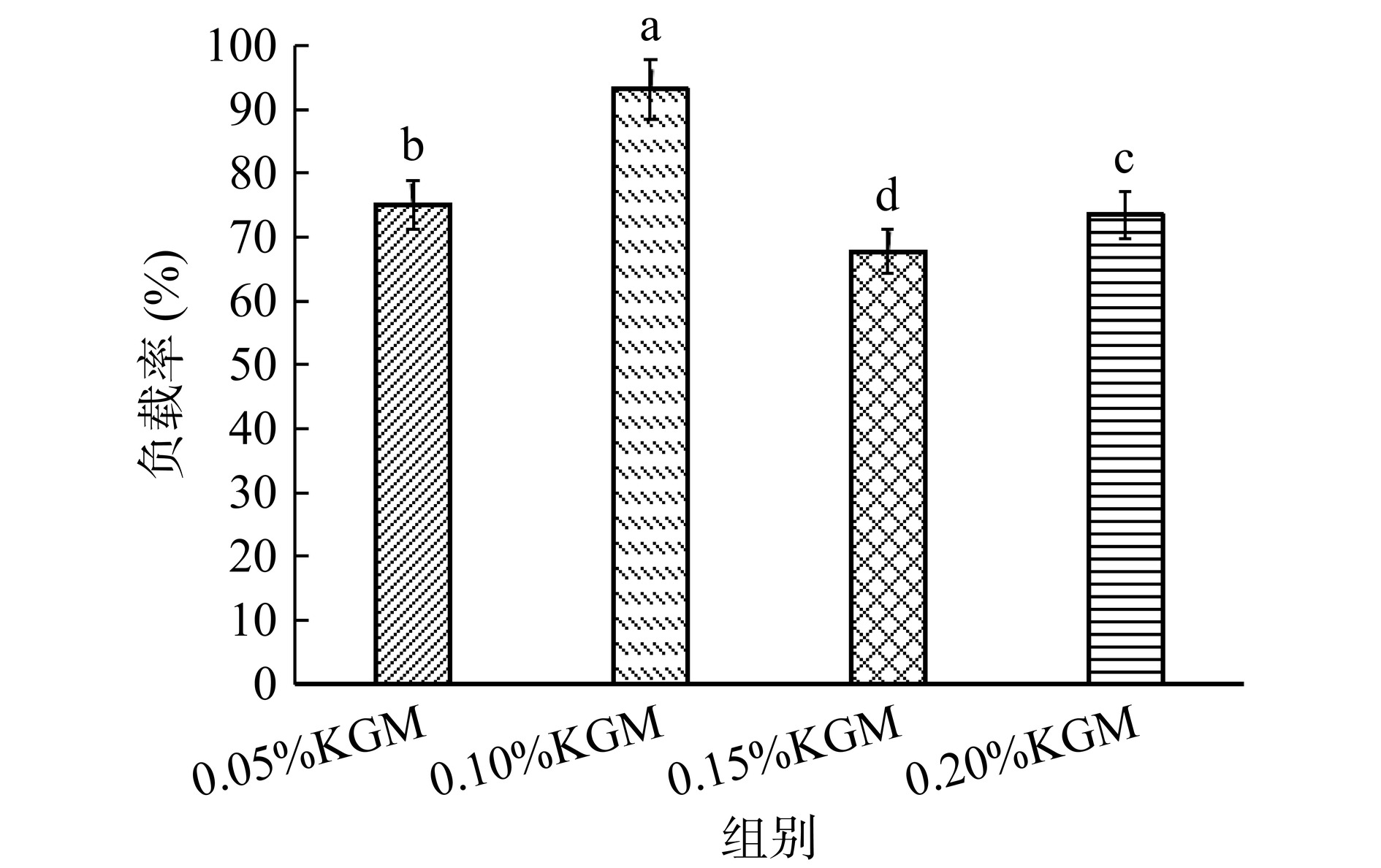
由图3中可知,KGM质量分数为0.10%的多重乳液中维生素C负载率最高,达到了93.24%,其原因可能是0.10%KGM的加入提高了连续相的粘度,使WP与KGM在油水界面上的吸附更加紧密,由于静电和空间相互作用形成的膜具有很强的抗破裂性,防止维生素C从内相释放[20]。此外,KGM添加量为0.15%的乳液的负载率最低,负载率仅为67.79%±2.38%,其与乳液液滴尺寸增大,包封效率降低有关[21−22]。
2.2 多重乳液微观结构观察
多重乳液的微观结构特征如图4所示。总体而言,不同KGM质量分数的乳液均呈现出液滴状态,说明KGM-WP复配物能降低液液界面的张力,使乳液呈现均匀分散的状态[22]。然而,当KGM质量分数为0.05%时,多重乳液液滴的体积相对较大且形状不规则,结构不明显,见图4(A)。随着KGM质量分数逐渐增大到0.10%,多重乳液液滴呈现均匀分布的状态,表明维生素C在KGM-MP复合物包被的多重乳液中分散性较好,见图4(B),由此可知,KGM能够在W1/O初乳的周围形成一层结构和性质均稳定的保护层,该保护层可提高多重乳液的稳定性,该结果与此前Wang等[23]对维生素C多重乳液的研究结果相似。然而,随着KGM质量分数的进一步增加至0.15%和0.20%,导致其与W1/O初乳的相容性降低,乳液液滴的结构被破坏,见图4(C)和图4(D)。
2.3 多重乳液粒径及Zeta电位的测定
多重乳液粒径大小是评价乳状液体系物理稳定性的重要参数。不同KGM质量分数下乳液的粒径大小见表1。由表1可知,KGM质量分数为0.05%时,乳液粒径87.30 μm,随着KGM质量分数的增加,乳液粒径呈先减小后增大的趋势,质量分数0.10%时,粒径达到最小,为64.38±1.24 μm,这是因为KGM是一种不吸附的线性中性多糖,增加了多重乳液体系的粘度和位阻效应,抑制了体系中油滴的聚集,导致油滴尺寸减小,提高了乳液的稳定性。当KGM质量分数大于0.10%时,KGM与WP之间复杂的凝聚作用在油滴周围形成更厚的层,因此不利于油相的分散,KGM-WP包裹的分散液滴尺寸增加,液滴尺寸分布不均匀[24]。此外,Chen等[25]学者也表明,多重乳液粒径的大小与乳析率呈正相关关系,由此可知,乳液粒径变大会导致乳析层的形成,乳析率就越高。
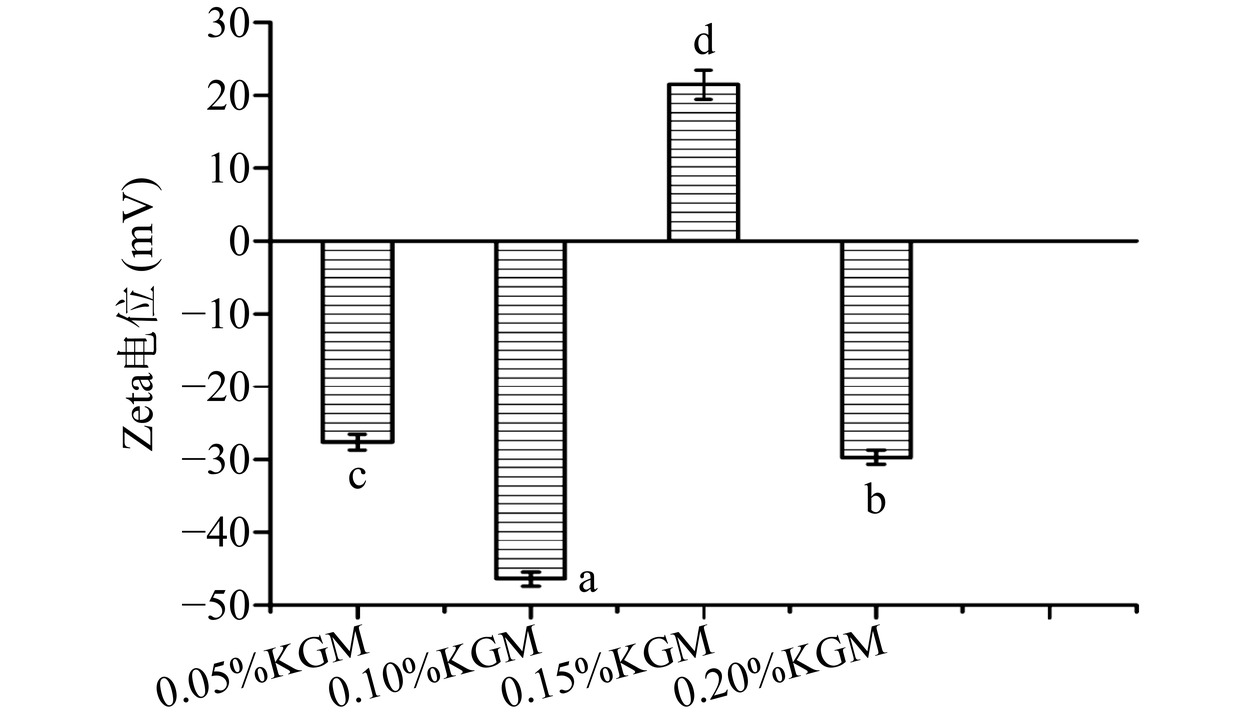
表 1 不同KGM质量分数对多重乳液粒径的影响Table 1. Effects of different KGM mass fractions on particle size of multiple emulsions组别 粒径(μm) 0.05%KGM 87.30±2.39a 0.10%KGM 64.38±1.24d 0.15%KGM 76.09±1.17c 0.20%KGM 78.15±2.29b 注:不同字母表示差异显著(P<0.05) Zeta电位的大小是度量多重乳液稳定性的重要指标[26],由图5可知,Zeta电位绝对值随着KGM质量分数的增加呈现出先增大后减小的趋势。当KGM质量分数为0.05%时,不能稳定初乳(W1/O)油水界面,乳液液滴易聚集,导致乳液粒径变大;当KGM的质量分数为0.10%时,电位绝对值最大,为-46.50±2.09 mV,这是因为随着KGM质量分数增大,KGM和WP之间形成的膜会降低液滴的碰撞效率,减少聚结。此外,随着表面电荷的积累,Zeta电位的绝对值变大,乳滴间相互排斥力增强,提升了乳液的稳定性[27],而KGM与WP聚集粒子之间的相互作用可能增加了其稳定性,这有待于进一步的研究。当KGM质量分数大于0.10%时,KGM自身就会发生聚集,与WP的碰撞加剧,造成液滴聚结,Zeta电位绝对值随之减小,这与Pei等[28]的研究结果是一致的,也就是说乳滴粒径越小,两相界面表面积越大,多重乳液就越稳定。
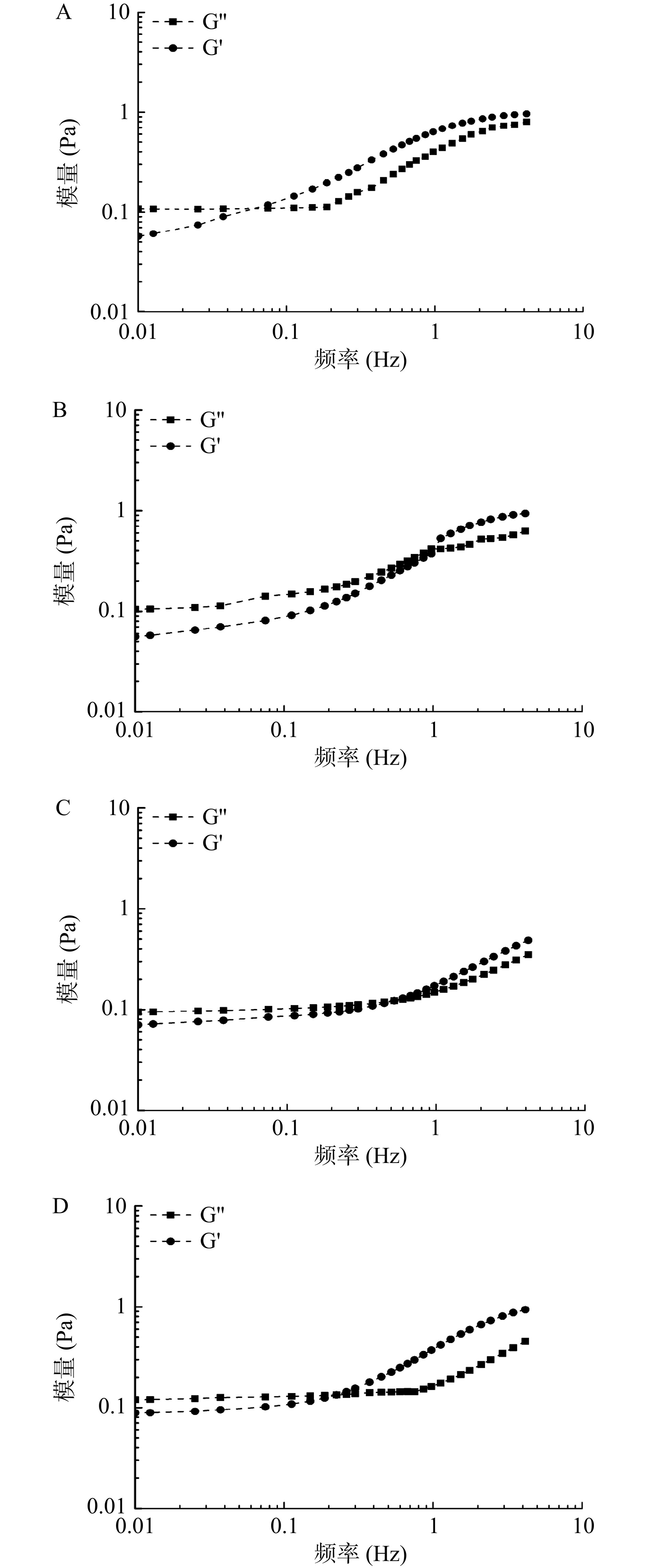
2.4 多重乳液流变性研究
流变特性可以为研究多重乳液的性质和性能提供有价值的信息,相关指标主要包括贮能模量(G')和损耗模量(G'')[29]。由图6可知,随着剪切速率的不断增大,多重乳剂的G''逐渐小于G',表明多重乳液的抗剪切能力增强,乳状液的稳定性提高。当KGM质量分数为0.50%时,乳状液的粘弹性在相同频率下处于相同水平,并随着频率的增加而逐渐增加,见图6(A),此时多重乳液属于液体状态。由图6(B)可知,当KGM的质量分数为0.10%时,多重乳液的粘弹性显著高于其他乳液,这可能是由于该质量分数的KGM更好的促进了整个多重乳液凝胶网络的形成。当KGM浓度大于0.10%时,乳液的质地发生了显著的变化,乳液的粘弹性随频率的增加变化不明显,见图6(C)和图6(D)。
2.5 多重乳液贮藏稳定性研究
2.5.1 不同贮藏温度下KGM质量分数对多重乳液表观形态的影响
不同KGM质量分数的乳液在0 d和4、25、50 ℃下贮藏20 d的表观形态对比见图7。由图7(A)和7(B)可知,贮藏0 d的乳液和4 ℃放置20 d的乳液,在KGM质量分数0.05%~0.20%时,均呈现均匀状态。由图7(C)和7(D)可知,在25 ℃和50 ℃的贮藏条件下,KGM质量分数为0.15%和0.20%的乳液均出现明显分层现象,这可能是因为KGM质量分数较高,导致初乳(W1/O)乳化液液滴与外水相(W2)相存在密度差,破坏了乳液凝胶的有序结构,导致维生素C从初乳中渗漏到外水相中。且KGM质量分数为0.05%的乳液在50 ℃的贮藏添加下出现明显分层,这可能是由于温度升高导致乳液中紧密堆积的液滴与乳滴逐渐分散所致[30],并伴有轻微的油脂酸败味。同样的,Al-Maqtari等[31]也发现多重乳液在高温下贮藏稳定性较低。由此可知,KGM质量分数为0.10%时,乳液最稳定,这是因为随着KGM质量分数的增加,液滴变得更小且更密集。KGM与WP的相互作用有利于油滴周围空间网络的形成,液滴间相互连接使得网络结构更加致密,从而降低了油滴聚集的可能性。
2.5.2 多重乳液在不同温度和时间下维生素C的保留率分析
KGM质量分数为0.10%时,乳液在4、25、50 ℃下贮藏20 d的维生素C保留率结果见图8。由图8可知,随着贮藏时间延长,维生素C的保留率逐渐降低,这是因为液滴的逐渐聚集导致乳液稳定性减低,维生素C被释放[32]。在不同温度下贮藏20 d,乳液均具有较高的维生素C保留率(>75.00%),尤其是在4 ℃条件下,20 d后仅有约7.0%的维生素C泄漏,相较于25、50 ℃下贮藏的乳液,维生素C保留率的降幅较小,可能是因为低温抑制了乳滴间的相互碰撞。随着温度升高,乳滴热运动加剧,三维网络结构分散直至乳液体系失稳,维生素C逐渐析出,而高温下游离的维生素C不稳定,易发生降解[33]。Dai等[34]以方格星虫盐溶蛋白为乳化剂制备W1/O/W2型乳液对维生素C进行负载,55 ℃贮藏7 d后乳液中已检测不出维生素C,该结果略低于本试验结果,体现出了共递送多重乳运载体系对功能因子负载稳定性较好的优势,可能是由于多重乳液中维生素C被负载于最内层水相,可很大程度地减少外界环境对其结构和稳定性的影响。此外,本结果表明,不同贮藏温度与贮藏时间对多重乳液中维生素C具有协同保护作用,随着温度的升高和时间的延长,乳液物理稳定性越差,负载稳定性越差,这与Liu等[35]学者的研究结果是一致的。当KGM质量分数为0.10%时,乳液在4、25、50 ℃下贮藏20 d,维生素C的负载稳定性最好。
2.6 多重乳液缓释性能研究
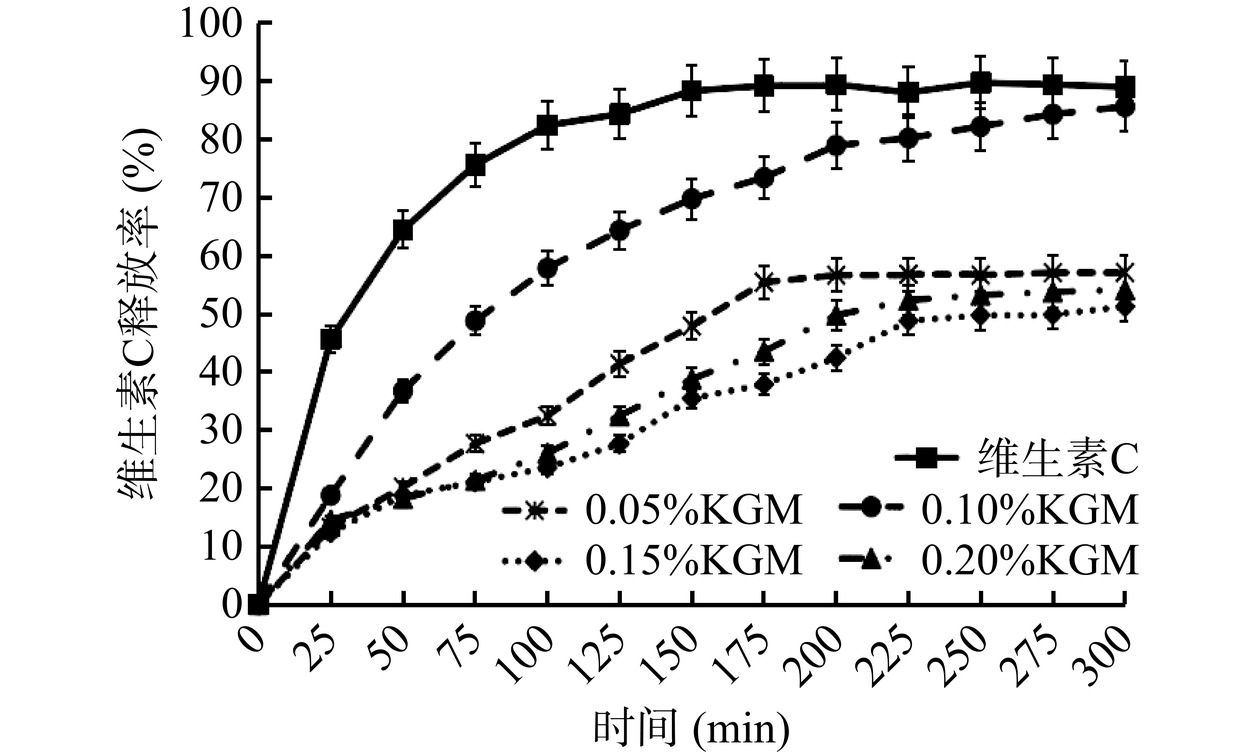
亲水活性化合物被包裹在多重乳液的内水相中,在胃肠道液中表现出更高的稳定性、缓释性以及生物利用度[36−37]。KGM质量分数为0.05%~0.20%时,乳液在体外模拟胃肠消化中维生素C的释放率变化趋势见图9。由图9可知,维生素C水溶液在胃肠道内释放速度较快,且释放到80%时就不再释放,这是因为维生素C从内水相透过油膜扩散到外水相,然后释放到缓冲溶液中,当内外渗透压达到平衡状态时将不再释放[38]。而KGM质量分数为0.10%的多重乳液在300 min内缓慢持续释放,最终释放率为85.64%,这是因为KGM-WP加入后形成的油水混合小乳滴具有特殊的致密网络结构,能有效抵抗胃酸侵蚀,Pan等[39]在研究中也发现KGM多重乳液受模拟胃液影响很小。KGM质量分数为0.05%、0.15%和0.20%的多重乳液在75 min内对维生素C的释放率在20%左右,随后释放率缓慢增大,这主要是由于胃肠中低pH和强离子强度的综合作用,降低了静电斥力,增加了静电屏蔽效果。此外,样品中的WP可以被胃蛋白酶水解,减少静电斥力和位阻,导致液滴絮凝,而KGM的存在降低了蛋白与胃蛋白酶之间结合位点的数量,导致WP的水解延迟。对比说明添加KGM的多重乳液对维生素C具有很好的缓释作用。此外,KGM自身有较强的亲水性,它与维生素C的羟基之间形成额外的分子间氢键[40−41],提高了内水相的黏度,从而阻止维生素C向外释放。
3. 结论
利用KGM与WP复配的方法成功制备了负载维生素C的W1/O/W2型多重乳液。研究发现,采用0.10%KGM-10.00%WP配合物是提高维生素C负载率和保留率的有效方法,乳液粒径为64.38±1.24 μm,Zeta电位为-46.50±2.09 mV,贮藏稳定性和缓释性能均得到有效改善,其中体外消化结果表明,多重乳液中维生素C的释放率达到了85.64%。研究表明,KGM与WP复配制备的W1/O/W2型多重乳液中乳滴的絮凝/聚集作用和粘度等剪切变化较小,可有效避免维生素C失活。因此,KGM-WP多重乳液是一种潜在的、具有良好缓释功能的微型载体系统,具有较高的应用价值。
-
表 1 不同KGM质量分数对多重乳液粒径的影响
Table 1 Effects of different KGM mass fractions on particle size of multiple emulsions
组别 粒径(μm) 0.05%KGM 87.30±2.39a 0.10%KGM 64.38±1.24d 0.15%KGM 76.09±1.17c 0.20%KGM 78.15±2.29b 注:不同字母表示差异显著(P<0.05) -
[1] CARITÁ A C, FONSECA-SANTOS B, SHULTZ J D, et al. Vitamin C:One compound, several uses. Advances for delivery, efficiency and stability[J]. Nanomedicine,2020,24:102117. doi: 10.1016/j.nano.2019.102117
[2] DOSEDĚL M, JIRKOVSKÝ E, MACÁKOVÁ K, et al. Vitamin C-sources, physiological role, kinetics, deficiency, use, toxicity, and determination[J]. Nutrients,2021,13(2):615. doi: 10.3390/nu13020615
[3] ARILLA E, MARTÍNEZ-MONZÓ J, CODOÑER-FRANCH P, et al. Stability of vitamin C, carotenoids, phenols, and antioxidant capacity of pasteurised orange juice with resistant maltodextrin storage[J]. Food Science and Technology International,2024,30(1):18−29. doi: 10.1177/10820132221124200
[4] KAŹMIERCZAK-BARAńSKA J, BOGUSZEWSKA K, ADAMUS-GRABICKA A, et al. Two faces of vitamin C-antioxidative and pro-oxidative agent[J]. Nutrients,2020,12(5):1501. doi: 10.3390/nu12051501
[5] FERNÁNDEZ-LUQUEÑO F, MEDINA-PÉREZ G, PÉREZ-SOTO E, et al. Bioactive compounds of opuntia spp. acid fruits:Micro and nano-emulsified extracts and applications in nutraceutical foods[J]. Molecules,2021,26(21):6429. doi: 10.3390/molecules26216429
[6] TAN Y, MCCLEMENTS D J. Plant-based colloidal delivery systems for bioactives[J]. Molecules,2021,26(22):6895. doi: 10.3390/molecules26226895
[7] 陈松, 张国芳, 张彤, 等. 基于三种多糖与酪蛋白复配制备W/O/W型乳液及其包封红景天苷效果的研究[J]. 食品工业科技,2022,43(19):137−145. [CHEN Song, ZHANG Guofang, ZHANG Tong, et al. Study on the preparation of W/O/W emulsion based on three polysaccharides mixed with casein and its encapsulation effect of salidroside[J]. Science and Technology of Food Industry,2022,43(19):137−145.] CHEN Song, ZHANG Guofang, ZHANG Tong, et al. Study on the preparation of W/O/W emulsion based on three polysaccharides mixed with casein and its encapsulation effect of salidroside[J]. Science and Technology of Food Industry, 2022, 43(19): 137−145.
[8] WANG X, WANG S J, NAN Y, et al. The effects of oil type and crystallization temperature on the physical properties of vitamin C-loaded oleogels prepared by an emulsion-templated approach[J]. Food & Function,2020,11(9):8028−8037.
[9] KLOJDOVÁ I, STATHOPOULOS C. W/O/W multiple emulsions:A novel trend in functional ice cream preparations?[J]. Food Chemistry X,2022,16:100451. doi: 10.1016/j.fochx.2022.100451
[10] ZHENG B Y, LI X Y, HAO J, et al. Meat systems produced with Monascus pigment water-in-oil-in-water multiple emulsion as pork fat replacers[J]. Food Chemistry,2023,402:134080. doi: 10.1016/j.foodchem.2022.134080
[11] YE S, ZONGO A W, SHAH B R, et al. Konjac glucomannan (KGM), deacetylated KGM (Da-KGM), and degraded KGM derivatives:A special focus on colloidal nutrition[J]. Journal of Agricultural and Food Chemistry,2021,69(44):12921−12932. doi: 10.1021/acs.jafc.1c03647
[12] WARESINDO W X, PRIYANTO A, SIHOMBING Y A, et al. Konjac glucomannan-based hydrogels with health-promoting effects for potential edible electronics applications:A mini-review[J]. International Journal of Biological Macromolecules,2023,248:125888. doi: 10.1016/j.ijbiomac.2023.125888
[13] ZHANG Y T, TONG C L, CHEN Y Y, et al. Advances in the construction and application of konjac glucomannan-based delivery systems[J]. International Journal of Biological Macromolecules, 2024, 262(Pt 1):129940.
[14] KONG F H, KANG S M, ZHANG J, et al. The non-covalent interactions between whey protein and various food functional ingredients[J]. Food Chemistry,2022,394:133455. doi: 10.1016/j.foodchem.2022.133455
[15] DU Q W, TANG J J, XU M J, et al. Whey protein and maltodextrin-stabilized oil-in-water emulsions:Effects of dextrose equivalent[J]. Food Chemistry,2021,339:128094. doi: 10.1016/j.foodchem.2020.128094
[16] 符叶, 周庄, 王大鸷. 温敏性W/O/W型多重乳液的制备及其对维生素C的控释性[J]. 大连工业大学学报,2022,41(4):269−274. [FU Ye, ZHOU Zhuang, WANG Dazhi. Preparing a novel type of W/O/W multiple emulsion with thermal-reversible properties for controlled release of vitamin C[J]. Journal of Dalian Polytechnic University,2022,41(4):269−274.] FU Ye, ZHOU Zhuang, WANG Dazhi. Preparing a novel type of W/O/W multiple emulsion with thermal-reversible properties for controlled release of vitamin C[J]. Journal of Dalian Polytechnic University, 2022, 41(4): 269−274.
[17] WANG Z T, TANG W X, SUN Z L, et al. An innovative pickering W/O/W nanoemulsion co-encapsulating hydrophilic lysozyme and hydrophobic perilla leaf oil for extending shelf life of fish products[J]. Food Chemistry,2024,439:138074. doi: 10.1016/j.foodchem.2023.138074
[18] LOU S R, NI X W, XIAO W L, et al. Physical stability, microstructure and antimicrobial properties of konjac glucomannan coatings enriched with Litsea cubeba essential oil nanoemulsion and its effect on citruses preservation[J]. International Journal of Biological Macromolecules, 2024, 256(Pt 1):128306.
[19] XU W, NING Y L, SUN Y Y, et al. Reversibility of freeze-thaw/re-emulsification on pickering emulsion stabilized with gliadin/sodium caseinate nanoparticles and konjac glucomannan[J]. International Journal of Biological Macromolecules,2023,233:123653. doi: 10.1016/j.ijbiomac.2023.123653
[20] LIU N, LIN P, ZHANG K, et al. Konjac glucomannan promoted fabrication of diacylglycerol oil-based oleogels through emulsion-templated approach:Comparison with triacylglycerol oleogels[J]. International Journal of Biological Macromolecules,2023,251:126420. doi: 10.1016/j.ijbiomac.2023.126420
[21] HAN Q, WANG H L, ZHOU T X, et al. Ultrastable emulsion stabilized by the Konjac Glucomannan-Xanthan gum complex[J]. ACS Omega,2023,8(34):31344−31352. doi: 10.1021/acsomega.3c03796
[22] ZHUANG H, LI X Q, WU S J, et al. Fabrication of grape seed proanthocyanidin-loaded W/O/W emulsion gels stabilized by polyglycerol polyricinoleate and whey protein isolate with konjac glucomannan:Structure, stability, and in vitro digestion[J]. Food Chemistry,2023,418:135975. doi: 10.1016/j.foodchem.2023.135975
[23] WANG R J, MA C L, YAN H T, et al. Preparation and characterization of GX-50 and vitamin C co-encapsulated microcapsules by a water-in-oil-in-water (W1/O/W2) double emulsion-complex coacervation method[J]. Langmuir,2023,39(39):13863−13875. doi: 10.1021/acs.langmuir.3c01360
[24] ZHOU X, ZONG X X, WANG S L, et al. Emulsified blend film based on konjac glucomannan/carrageenan/ camellia oil:Physical, structural, and water barrier properties[J]. Carbohydrate Polymers,2021,251:117100. doi: 10.1016/j.carbpol.2020.117100
[25] CHEN J F, GUO J, LIU S H, et al. Zein Particle-stabilized water-in-water emulsion as a vehicle for hydrophilic bioactive compound loading of riboflavin[J]. Journal of Agricultural and Food Chemistry,2019,67(35):9926−9933. doi: 10.1021/acs.jafc.9b02415
[26] SUN Y, TANG W T, PU C F, et al. Improved stability of liposome-stabilized emulsions as a co-encapsulation delivery system for vitamin B2, vitamin E and β-carotene[J]. Food Function,2022,13(5):2966−2984. doi: 10.1039/D1FO03617C
[27] 廖静如, 杜冰, 刘志伟, 等. 超声辅助优化制备壳寡糖-果胶稳定的Pickering乳液工艺及稳定性分析[J]. 食品工业科技, 2023, 44(13):9−20. [LIAO Jingru, DU Bing, LIU Zhiwei, et al. Study on ultrasound-assisted optimization of chitooligosaccharide-. [pectin stabilized pickering emulsion and its stability[J]. Science and Technology of Food Industry, 2023, 44(13):9−20.] pectin stabilized pickering emulsion and its stability[J]. Science and Technology of Food Industry, 2023, 44(13): 9−20.
[28] PEI Y Q, ZHANG Y Q, DING H, et al. Stability and rheological behavior of mayonnaise-like emulsion co-emulsified by konjac glucomannan and whey protein[J]. Foods,2023,12(15):2907. doi: 10.3390/foods12152907
[29] YAHYA M, SAKTI SCW, FAHMI M Z, et al. Bio-based Pickering emulsifier from mangosteen residues-derived sodium caseinate grafted spherical cellulose nanocrystals:stability, rheological properties and microstructure studies[J]. International Journal of Biological Macromolecules, 2024, 257(Pt 2):128696.
[30] XU W, NING Y L, WANG M Y, et al. Construction of astaxanthin loaded Pickering emulsions gel stabilized by xanthan gum/lysozyme nanoparticles with konjac glucomannan from structure, protection and gastrointestinal digestion perspective[J]. International Journal of Biological Macromolecules,2023,252:126421. doi: 10.1016/j.ijbiomac.2023.126421
[31] AL-MAQTARI QA, GHALEB ADS, MAHDI AA, et al. Stabilization of water-in-oil emulsion of pulicaria jaubertii extract by ultrasonication:fabrication, characterization, and storage stability[J]. Food Chemistry,2021,350:129249. doi: 10.1016/j.foodchem.2021.129249
[32] HUANG X, TU R, SONG H B, et al. Gelatin-EGCG-high methoxyl pectin ternary complex stabilized W1/O/W2 double emulsions loaded with vitamin C:Formation, structure, stability, in vitro gastrointestinal digestion[J]. International Journal of Biological Macromolecules,2022,216:891−905. doi: 10.1016/j.ijbiomac.2022.07.210
[33] JIANG H, HU X F, JIANG W J, et al. Water-in-oil pickering emulsions stabilized by hydrophobized protein microspheres[J]. Langmuir,2022,38(40):12273−12280. doi: 10.1021/acs.langmuir.2c01904
[34] DAI Y P, LU X L, LI R Y, et al. Fabrication and characterization of W/O/W emulgels by sipunculus nudus salt-soluble proteins:co-encapsulation of vitamin C and β-carotene[J]. Foods,2022,11(18):2720. doi: 10.3390/foods11182720
[35] LIU Z, SHEN R, YANG X B, et al. Characterization of a novel konjac glucomannan film incorporated with pickering emulsions:Effect of the emulsion particle sizes[J]. International Journal of Biological Macromolecules,2021,179:377−387. doi: 10.1016/j.ijbiomac.2021.02.188
[36] BASHIR O, AMIN T, HUSSAIN S Z, et al. Development, characterization and use of rosemary essential oil loaded water-chestnut starch based nanoemulsion coatings for enhancing post-harvest quality of apples var. Golden delicious[J]. Current Research in Food Science,2023,7:100570. doi: 10.1016/j.crfs.2023.100570
[37] MARTÍNEZ-NAVARRETE N, GARCÍA-MARTÍNEZ E, CAMACHO MDM. Characterization of the orange juice powder co-product for its valorization as a food ingredient[J]. Foods,2022,12(1):97. doi: 10.3390/foods12010097
[38] XU Z, ZHANG X Y, WU X X, et al. Co-delivery of vitamin C and β-carotene in W/O/W emulsions stabilized by modified aggregated insoluble soybean protein hydrolysate-xanthan gum complexes[J]. International Journal of Biological Macromolecules, 2024, 261(Pt 2):129855.
[39] PAN Z B, ZHONG W Q, XU J T, et al. Effects of oregano essential oil Pickering emulsion and ZnO nanoparticles on the properties and antibacterial activity of konjac glucomannan/carboxymethyl chitosan nanocomposite films[J]. RSC Advances,2024,14(10):6548−6556. doi: 10.1039/D3RA07845K
[40] LIMAMPAI T, IMPAPRASERT R, SUNTORNSUK W. Influence of some hydrocolloids and sterilization conditions on the physical properties of texture-modified foods developed for the swallow training of dysphagia patients[J]. Foods,2023,12(19):3676. doi: 10.3390/foods12193676
[41] DU Y Y, ZHANG S K, SHENG L J, et al. Food packaging films based on ionically crosslinked konjac glucomannan incorporating zein-pectin nanoparticle-stabilized corn germ oil-oregano oil pickering emulsion[J]. Food Chemistry,2023,429:136874. doi: 10.1016/j.foodchem.2023.136874





 下载:
下载:



 下载:
下载:



