In Vitro Fermentation Characteristics of Endopolysaccharides Extracted from Monascus purpureus
-
摘要: 为研究红曲霉不同菌丝体胞内多糖(endopolysaccharides,MPS)组分MPS-1、MPS-2、MPS-3和MPS-4的肠道酵解特性,采用体外猪结肠模型,测定不同酵解时间多糖分子量、猪结肠短链脂肪酸(Short-chain fatty acids,SCFAs)和肠道菌群的变化。结果表明,经肠道酵解后,各多糖处理组中乙酸、丙酸和丁酸产量较高。在酵解48 h时,MPS-2和MPS-3处理组酵解产生的总SCFAs含量显著(P<0.05)增加,分别从22.80、17.20 mmol/L增至63.08、71.61 mmol/L,各多糖处理组总SCFAs含量从高到低顺序为MPS-3>MPS-2>MPS-1>MPS-4。16S rDNA结果显示,MPS处理后,在门水平上,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)是主要的优势菌门,且降低了Firmicutes/Bacteroidetes的比例。在属水平上,随着酵解时间的延长,拟杆菌属(Bacteroides)、普雷沃菌属(Prevotella)和副拟杆菌属(Parabacteroides)等有益菌的丰度升高,有害菌属包括链球菌(Streptococcus)、梭菌属(Clostridium)等的丰度显著(P<0.05)下降,其中MPS-2和MPS-3处理组酵解过程中有益菌的相对丰度较大,有害菌的相对丰度较低。综上,红曲霉菌丝体多糖作为益生元在功能性食品及生物医药领域具有很大的应用潜力。Abstract: To investigate the intestinal fermentation characteristics of different endopolysaccharides (MPS) sub-fractions MPS-1, MPS-2, MPS-3, and MPS-4 from Monascus purpureus mycelium, an in vitro pig colon model was used to determine the changes in molecular weight of the polysaccharides, the contents of short-chain fatty acids (SCFAs), and gut microbiota at different fermentation times. The results showed that after intestinal fermentation, the acetic acid, propionic acid, and butyric acid production in each MPS treatment group was higher. At 48 h of fermentation, the total SCFAs content produced by the MPS-2 and MPS-3 treatment groups increased significantly (P<0.05), from 22.80 and 17.20 mmol/L to 63.08 and 71.61 mmol/L, respectively. The total SCFAs concentration of each polysaccharide treatment group was MPS-3>MPS-2>MPS-1>MPS-4 in descending order. The 16S rDNA results revealed that after MPS treatment, Firmicutes and Bacteroidetes were the main dominant bacteria at the phylum level, and the ratio of Firmicutes/Bacteroidetes was reduced. At the genus level, with the extension of fermentation time, the abundance of beneficial bacteria such as Bacteroides, Prevotella, and Parabacteroides increased, while the abundance of harmful genera, including Streptococcus and Clostridium, decreased significantly (P<0.05). Among them, the MPS-2 and MPS-3 treatment group had the higher abundance of beneficial bacteria and the lower abundance of harmful bacteria. In summary, MPS have great potential as prebiotics in the fields of functional foods and biomedical applications.
-
肠道被视为机体最大、最复杂的微生态系统,包含100多万亿微生物,其多样性和丰富度对人类健康具有重要作用[1]。非淀粉多糖是一种复杂的碳水化合物,只有在被大肠内的微生物降解后才能被人体消化道吸收,它通过调节肠道菌群组成和促进短链脂肪酸(Short-chain fatty acids,SCFAs)的产生影响宿主健康[2]。肠道菌群与人体免疫系统也有着密不可分的关系[3−4]。研究发现,许多共生菌的代谢产物如SCFAs(主要包括乙酸、丙酸、丁酸),有益于大肠癌小鼠的肠道免疫[5]。另外,SCFAs在结肠腔内可作为肠粘膜细胞的主要能量来源激活肠道内G蛋白偶联受体[6],还可以预防肿瘤的发生和减弱结肠炎炎症反应[7]。
紫色红曲霉(Monascus purpureus)是生产红曲米酒和天然红曲色素的主要真菌,一直被报道具有药用和食用特性。其次级代谢产物如红曲色素,Monacolin K、γ-氨基丁酸(GABA)和红曲多糖表现出各种生物活性,包括抗炎、抗氧化、抗肿瘤、抗真菌和降血脂[8−11],近年来引起了学术界越来越多的关注。在现代食品工业中,红曲霉液态发酵已广泛用于生产红曲色素,同时也产生了许多红曲霉菌丝体,其中富含多糖、蛋白质、脂肪和其他生物活性化合物[12],但一直没有得到有效利用。在前期研究中,采用弱碱提取结合DEAE-Cellulose柱层析法成功地将红曲霉液体发酵产生的菌丝体多糖(endopolysaccharides,MPS,9.43wt%)进行了分离,获得四个组分:MPS-1(18.0%)、MPS-2(27.1%)、MPS-3(12.6%)和MPS-4(14.7%)。结合单糖组成分析、甲基化分析和一维、二维核磁共振,对各组分的结构进行了系统表征。MPS-1和MPS-2的结构都是基于呋喃半乳糖基(Galf)的半乳甘露聚糖,具有不同的分子量和糖苷键。此外,基于RAW 264.7细胞模型,MPS-2可以显著促进IL-6、TNF-α、IL-10等细胞因子的分泌,并提高相关mRNA的表达水平,且Galf含量较高的MPS-2对RAW 264.7巨噬细胞具有更高的免疫调节作用[13]。另有研究表明,真菌多糖会影响其肠道发酵特性。例如,来自黑根霉的胞外多糖可以增加结肠直肠癌小鼠粪便中总SCFAs的产生并调节小鼠粪便中的肠道微生物群[5];还有人对鸡冠菇胞内多糖和胞外多糖进行了模拟消化和体外发酵试验,以探讨其在消化系统中的应用,结果表明,胞内多糖和胞外多糖可以调节肠道微生物群的组成,从而增加SCFAs的产生[14]。MPS作为一种结构新颖的半乳甘露聚糖,其不同多糖组分对肠道酵解特性的影响尚不清楚。
基于此,本研究以红曲霉菌丝体不同多糖组分为研究对象,采用体外猪结肠模型,深入研究红曲霉菌丝体多糖对猪结肠SCFAs的产生和结肠中肠道菌群的变化,监测多糖在酵解过程中分子量的变化,有助于揭示MPS不同组分的体外代谢行为,以期从红曲多糖对肠道菌群的影响方面进一步探究多糖的肠道免疫活性,进而提高红曲霉菌丝体的附加值,拓展红曲霉菌丝体及多糖在功能食品及医药领域的应用。
1. 材料与方法
1.1 材料与仪器
红曲霉菌丝体多糖组分(MPS-1、MPS-2、MPS-3和MPS-4) 本实验室自红曲霉菌丝体(由广东天益生物科技有限公司提供)分离纯化得到;猪结肠消化物 由天津市农博种猪厂提供;短链脂肪酸标准品、二乙基丁酸 分析纯,美国Sigma试剂公司;CaCl2、CoCl·6H2O、K2HPO4、MgSO4、NaCl、(NH4)2SO4 分析纯,天津市大茂化学试剂厂;FeSO4·7H2O、MnSO4·H2O、Na2CO3、ZnSO4·7H2O 分析纯,天津市化学试剂一厂;刃天青、D-Biotin、泛酸钙、维生素B12、叶酸、烟酰胺、对氨基苯甲酸、维生素B6、维生素B2、维生素B1、L-盐酸半胱氨酸 北京索莱宝科技有限公司;浓盐酸 分析纯,天津市化学试剂供销公司。
NPS RT2 Advanced磁力加热搅拌器、Digital Vortex Mixer涡旋混匀器 美国Thermo公司;Infinite 200 Pro型酶标仪 上海安景科技有限公司;TDZ5-WS台式离心机 长沙湘仪离心机仪器有限公司;SQP型十万分之一电子天平、PB-10型pH计 赛多利斯科学仪器(北京)有限公司;RID-20A型示差高效液相色谱仪、GC2010 Plus型热脱附气相色谱仪 日本岛津公司;YQX-II型厌氧培养箱 上海新苗医疗器械制造有限公司;LS-B50L型立式压力蒸汽灭菌锅 上海华线医用核子仪器有限公司;SB-25-12DTD超声波清洗机 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 红曲霉菌丝体多糖制备
参照本实验室之前的制备方法[13],采用0.2 mol/L的NaOH溶液提取菌丝体多糖:料液比1:20(w/v),提取温度49 ℃,浸提时间2 h。4000 r/min离心20 min,离心后的液体在室温下用蒸馏水透析(8000~14000 Da),以除去游离色素和其他小分子化合物,收集透析后的液体,浓缩醇沉,离心取沉淀,冻干。采用三氯乙酸(TCA)沉淀法脱蛋白得红曲霉菌丝体粗多糖MPS,配制5 mL MPS溶液(10 mg/mL)过DEAE-52纤维素柱(26 mm×30 cm),以纯水、0.2 mol/L和0.5 mol/L NaCl溶液为洗脱液,流速为0.5 mL/min,采用苯酚-硫酸法检测洗脱曲线,浓缩冻干得到四个多糖组分MPS-1、MPS-2、MPS-3和MPS-4,并分别收集,冻干备用。
1.2.2 培养基配制
参照Ding等[15]报道的方法进行厌氧培养基的配制,具体组成如表1所示,主要由两部分组成:a.按表1称取矿物质和刃天青于1 L烧杯中,加入995 mL蒸馏水,超声波清洗机进行溶解,用5 mol/L盐酸调节pH为6.8,再将溶液煮沸,移至1 L棕色瓶中,充入氮气,121 ℃灭菌20 min,灭菌后置于厌氧培养箱中;b.按表1称取维生素和L-盐酸半胱氨酸于10 mL离心管中,加入5 mL蒸馏水溶解,在超净工作台用0.22 μm无菌滤膜除菌后放至灭菌的10 mL离心管中,最后将两者在厌氧箱中进行混匀,即配制成厌氧培养基。
表 1 厌氧培养基的组成Table 1. Composition of anaerobic incubation medium (AIM)矿物质(mg) 维生素(mg) 其它(mg) CaCl2 50 D-Biotin 0.05 L-盐酸半胱氨酸 1000 CoCl·6H2O 2 泛酸钙 2 刃天青 1 FeSO4·7H2O 20 维生素B12 0.005 K2HPO4 900 叶酸 0.05 MgSO4 50 烟酰胺 2 MnSO4·H2O 20 对氨基苯甲酸 0.1 NaCl 900 维生素B6 2 Na2CO3 4000 维生素B2 2 (NH4)2SO4 900 维生素B1 2 ZnSO4·7H2O 20 1.2.3 红曲多糖的体外酵解
体外酵解体系主要由猪结肠消化物、多糖及厌氧培养基构成,其中猪结肠消化物的添加量为10%(w/v),多糖作为唯一的碳源,其添加量为1%(w/v),同时设置空白组。具体操作方法[15]为:称取0.02 g多糖于离心管中,加2 mL厌氧培养基,在磁力搅拌器上60 ℃过夜溶解,在10 mL离心管中称取0.2 g猪结肠消化物,在厌氧培养箱中将多糖溶液加入其中,并充分混匀。所有的操作过程均在厌氧环境(80% N2,10% CO2和10% H2)下进行。空白组中只添加猪结肠消化物和厌氧培养基。将离心管用封口膜封口,装入厌氧袋中,置于37 ℃,250 r/min的振荡摇床中进行酵解。
1.2.4 SCFAs标准曲线的制作
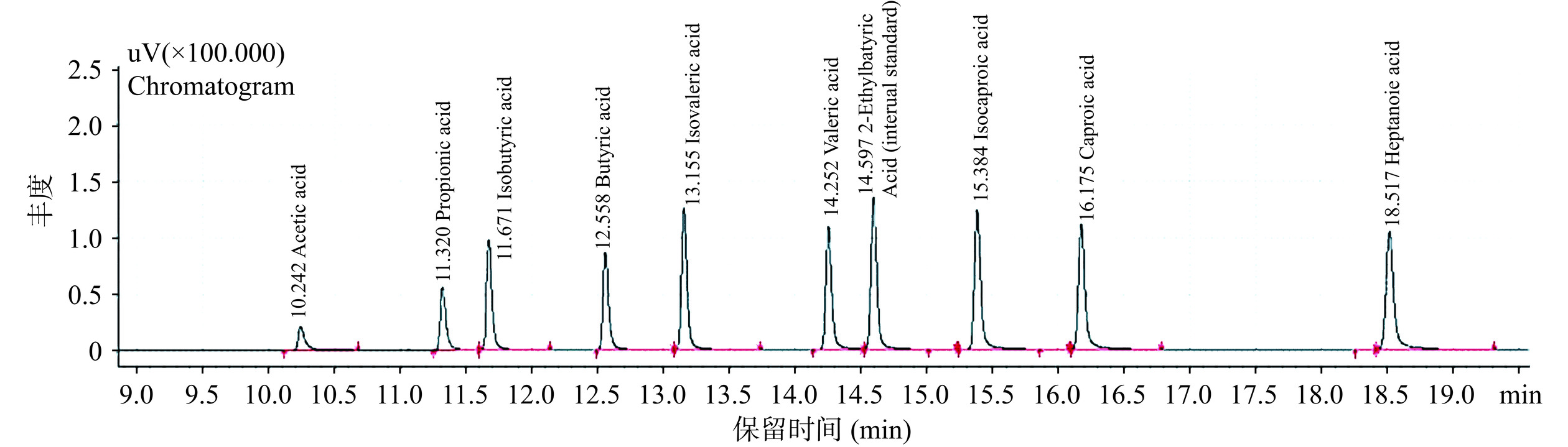
取混合酸标准品溶液各0、0.1、0.2、0.4、0.6、0.8、1.0 mL,用超纯水补至1.0 mL,配制成浓度分别为0、1、2、4、6、8、10 mmol/L的混合酸标准品溶液(包括乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸、异己酸、己酸和庚酸),过0.22 μm水系滤膜,以0.5 μL二乙基丁酸作为内标,混匀后进行气相色谱(Gas chromatography,GC)检测[16]。
色谱条件:色谱柱NukolTM Fused Silica Capillary Column(60 m×0.25 mm×0.25 μm);进样量1 μL;进样口温度200 ℃,检测器(Flame ionization detector,FID)250 ℃,H2流速:40 mL/min,空气流速:400 mL/min。以标品质量与内标质量的比为横坐标,标品峰面积与内标峰面积的比为纵坐标绘制标准曲线。
1.2.5 SCFAs含量的测定
分别在酵解时间为0、12、24和48 h时取样,11000 r/min 4 ℃离心10 min,取上清,0.22 µm水系膜过滤后,用于各SCFAs的测定,具体操作同标准曲线测定一致,最后计算出样品峰面积与内标峰面积的比,利用标准曲线计算得样品中各短链脂肪酸的浓度。
1.2.6 多糖分子量变化
制备各样品不同时间点的发酵液,用无菌滤膜进行无菌处理,用高效示差液相色谱仪对其酵解过程中多糖分子量降解情况进行监测。以不同分子量的葡聚糖(T-10、T-40、T-70、T-500、T-2000 kDa)作为标准品,根据HPLC保留时间和分子量对数绘制标准曲线,计算样品分子量变化情况。色谱条件为:色谱柱:Ultrahydrogel linear(WAT011545);进样量:20 μL;流速:0.60 mL/min;时间:25 min。
1.2.7 猪结肠中肠道菌群变化
不同发酵时间点离心后的沉淀保存至−20 ℃冰箱,用于肠道菌群的分析。
1.2.7.1 基因组DNA的提取
通过CTAB法提取样品的基因组DNA,然后通过琼脂糖凝胶电泳检测提取的DNA的纯度和浓度。将适量的样品放入离心管中,并用无菌水将样品稀释至1 ng/μL。
1.2.7.2 PCR 扩增
以稀释的基因组DNA为模板,根据测序区域的选择,使用带Barcode的特异性引物进行扩增,以New England Biolabs公司的Phusion®高保真度的PCR和GC Buffer预混液作为缓冲液,PCR反应时使用高效和高保真度的酶进行反应,以确保扩增的效率和准确性,反应体系如表2所示,反应程序为98 ℃预变性1 min;30个循环包括(98 ℃,10 s;50 ℃,30 s;72 ℃,30 s);72 ℃,5 min。
表 2 PCR反应体系Table 2. Reaction system of PCRPCR 反应体系 30 μL体系 Phusion Master Mix(2×) 15 μL Primer(2 μmol/L) 3 μL gDNA(1 ng/μL) 10 μL H2O 2 μL 1.2.7.3 PCR 产物的混样和纯化
根据PCR产物的浓度,等量混合PCR产物。充分混匀后,通过琼脂糖凝胶电泳以1×TAE浓度为2%的浓度纯化PCR产物,使用Thermo Scientific的GeneJET凝胶回收试剂盒进行胶回收。
1.2.7.4 文库构建和上机测序
文库构建使用Thermofisher公司的Ion Plus Fragment Library Kit 48 rxns试剂盒,之后进行Qubit定量和文库检测,合格后,使用IonS5TMXL进行上机测序。对有效数据进行OTUs(Operational taxonomic units)聚类和物种分类分析、多样性指数分析、物种注释的群落结构统计分析、PCoA和PCA统计分析等[17]。
1.3 数据处理
每组试验至少重复3次。采用SPSS 18.0软件进行统计分析,结果以均数±标准差表示,单因素方差分析显著性差异,其中P<0.05表示具有显著统计学意义。
2. 结果与分析
2.1 不同多糖组分对SCFAs产量的影响
2.1.1 SCFAs标准溶液色谱图分析
SCFAs标准溶液气相色谱图如图1所示,以十种短链脂肪酸混合标准品为标准品,采用热脱附气相色谱仪对其进行检测,通过内标物及峰面积计算得出每种脂肪酸的标准曲线,如表3所示,进行每种样品SCFAs产量的计算分析。
表 3 SCFAs的标准曲线Table 3. Standard curve equations of SCFAsSCFA 标准曲线 R2 乙酸 y=0.2636x−0.0076 0.995 丙酸 y=0.4596x−0.0257 0.9913 异丁酸 y=0.5084x−0.0243 0.9906 正丁酸 y=0.5902x−0.0313 0.9938 异戊酸 y=0.6454x−0.0366 0.9913 正戊酸 y=0.7295x−0.0461 0.9913 异己酸 y=0.7465x−0.0505 0.992 正己酸 y=0.766x−0.0516 0.9923 正庚酸 y=0.7086x−0.0545 0.9915 2.1.2 不同多糖组分对SCFAs含量的影响
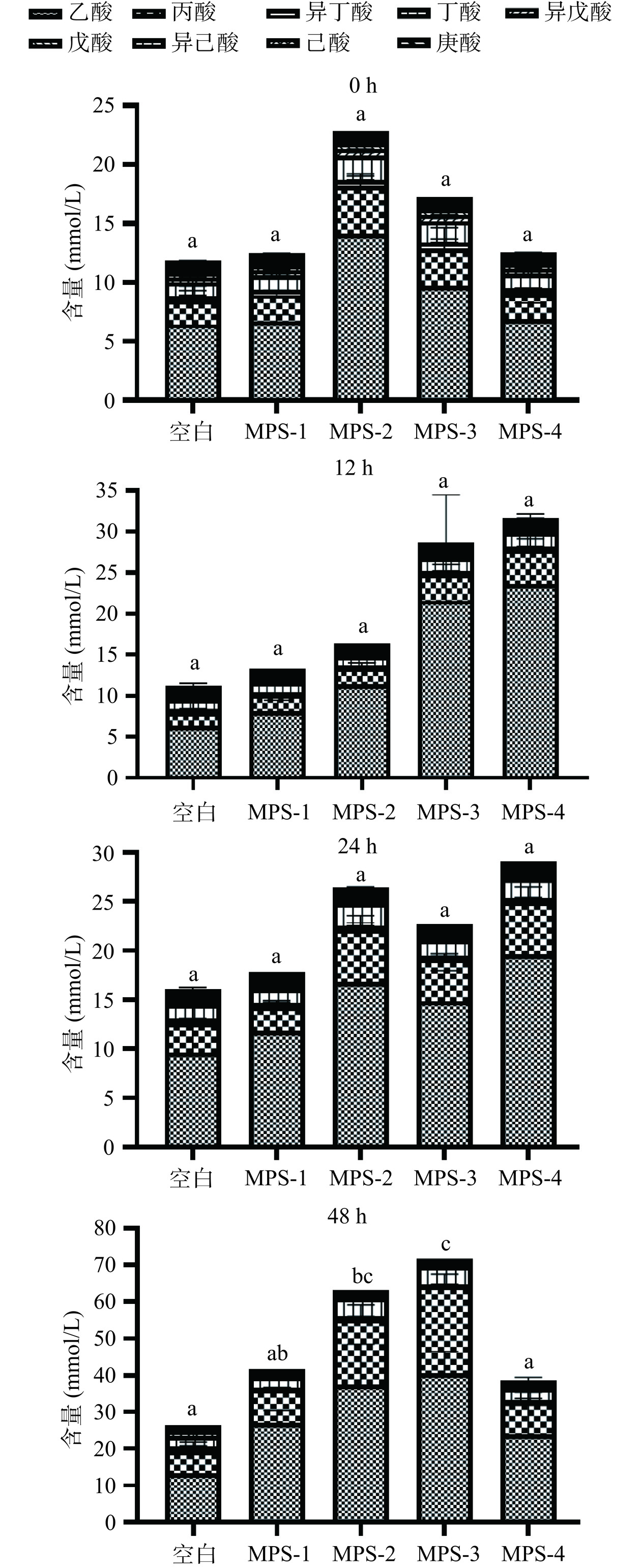
SCFAs是碳水化合物在结肠中由双歧杆菌、乳酸菌等有益菌群酵解产生的一类重要的代谢终产物,主要包括乙酸、丙酸、丁酸、戊酸等,主要通过糖酵解途径和磷酸戊糖途径产生,对维持人体肠道健康起着非常重要的作用[18]。红曲霉不同多糖组分处理组和空白组在酵解的不同阶段(0、12、24和48 h)上清液中总SCFAs的浓度如图2所示。结果显示,随着体外酵解时间的增加,酵解0~24 h时,多糖处理组总SCFAs含量整体上是增加的,但与空白组相比无显著性差异;而酵解48 h时,仅MPS-2和MPS-3处理组酵解产生的总SCFAs含量显著增加(P<0.05),MPS-2和MPS-3组分别从22.80、17.20 mmol/L增至63.08、71.61 mmol/L,说明MPS-2和MPS-3能够更好地被肠道内厌氧微生物发酵。一般来说,多糖在结肠内酵解的时间越长,所产生的总SCFAs含量越高,结果与前人研究报道相近[19]。本研究中,在酵解48 h时总SCFAs浓度达到最大,各多糖处理组总SCFAs浓度从高到低顺序为MPS-3>MPS-2>MPS-1>MPS-4。而有的多糖如荞麦蜂花粉多糖总SCFAs浓度在酵解24 h时达到最大,可能与多糖本身的结构有关[20]。
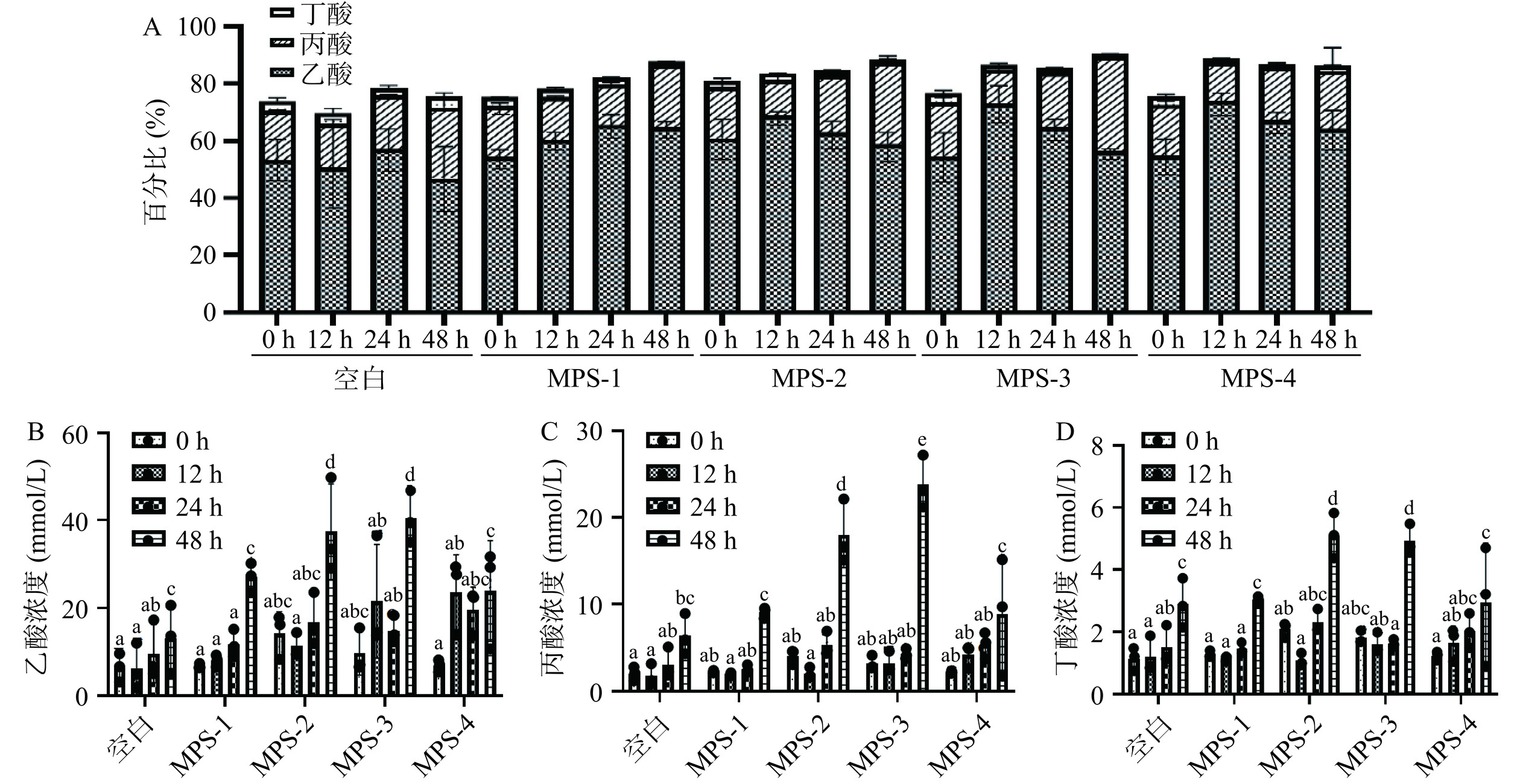
乙酸、丙酸和丁酸是多糖在肠道内降解后产生的主要SCFAs,能够占酵解SCFAs总产量的90%左右[15]。如图3A所示,本研究中,红曲霉不同多糖组分处理组和空白组在酵解的不同阶段(0、12、24和48 h)上清液中乙酸、丙酸和丁酸的含量占总SCFAs的69.80%~90.43%。不同组分的MPS能不同程度的刺激肠道产生SCFA,不同多糖组分经肠道菌群酵解后乙酸、丙酸和丁酸含量随酵解时间变化如图3B~图3D所示,与空白组相比,随着酵解时间的延长,酵解48 h后,MPS处理组的乙酸、丙酸、丁酸含量显著升高(P<0.05),各SCFAs的浓度由高到低依次为乙酸>丙酸>丁酸。酵解48 h后(图3B),不同多糖处理组乙酸的含量显著增加(P<0.05),其中,MPS-1、MPS-2、MPS-3、MPS-4分别从最初的6.75、14.15、9.70、6.93 mmol/L增至27.00、37.46、40.47、23.88 mmol/L。除乙酸外,丙酸和丁酸也是红曲多糖酵解产生的主要短链脂肪酸,由图3C可知,多糖处理组丙酸含量在酵解24 h时,与空白对照组相比,丙酸含量无显著性差异,而在酵解48 h时,各组中丙酸的含量2.22、4.06、3.21、2.19 mmol/L增至9.08、17.96、23.86、8.86 mmol/L,其中MPS-2和MPS-3处理组的丙酸浓度显著升高(P<0.05)。由图3D所示,丁酸的浓度随着多糖酵解时间的增加一直增加,酵解48 h其浓度达到最大,各组中丙酸的含量1.28、2.09、1.81、1.24 mmol/L增至3.04、5.10、4.92、2.94 mmol/L。相关研究表明,乙酸和丁酸的增加可能是由于多糖中半乳糖的发酵,且随发酵时间的延长而增大,48 h含量达到最高,与本研究结果一致[21]。值得注意的是,对于MPS-4来说,与空白组相比,其产生的丙酸和丁酸的含量随着酵解时间的延长并无显著性变化,推测与该多糖组分的结构有关。研究表明,多糖的分子结构较为复杂,其进入结肠后的酵解特性受其分支、分子量、单糖组成、糖苷键的连接方式等的影响。一般来说,与其他单糖相比,葡萄糖(Glc)是体外发酵过程中消耗最多的单糖,表明Glc可能是肠道微生物优先代谢的单糖[22]。前期研究结果显示[13],MPS-1和MPS-2分别由甘露糖(Man)、Glc和半乳糖(Gal)组成,摩尔比分别为1.5:1.6:1.0和10.6:1.0:13.8。MPS-3含有阿拉伯糖(Ara)、木糖(Xyl)、Man、Glc和Gal五种不同的单糖,摩尔比为6.2:4.7:21:1.0:24.7,MPS-4含有鼠李糖(Rha)、Ara、Xyl、Man和Gal,摩尔比为3.2:2.6:1:4.0:9.0。与MPS-1,MPS-2和MPS-3相比,MPS-4单糖组成中并不含Glc。因此,MPS-4的单糖组成可能影响了其被肠道菌群的利用。此外,研究选取的SCFA标准品包含十种脂肪酸,除乙酸、丙酸和丁酸的产量随时间变化较为显著外,由图2可知,其他种类的短链脂肪酸浓度变化并不是很明显。结果表明,红曲多糖在体外结肠消化内容物酵解体系中可被相关微生物所降解,从而产生丰富的SCFAs。结肠中的SCFAs还是粘膜细胞的重要营养物质,有助于促进结肠细胞的增殖,增加血液流动,维持结肠内环境的稳定。SCFAs的产生还能够降低肠道内的pH,而酸性环境能够抑制肠道致病菌的定植,并提高食物的吸收率[23]。
![]() 图 3 不同多糖组分酵解后乙酸、丙酸、丁酸含量百分比(A)以及乙酸含量(B),丙酸含量(C)和丁酸含量(D)注:标注有相同字母为差异不显著(P>0.05),标注有不同字母为差异显奢(P<0.05)。Figure 3. Percentage of acetic acid, propionic acid, and butyric acid content (A), and the contents of acetic acid (B), propionic acid (C) and butyric acid (D) after fermentation of different polysaccharide components
图 3 不同多糖组分酵解后乙酸、丙酸、丁酸含量百分比(A)以及乙酸含量(B),丙酸含量(C)和丁酸含量(D)注:标注有相同字母为差异不显著(P>0.05),标注有不同字母为差异显奢(P<0.05)。Figure 3. Percentage of acetic acid, propionic acid, and butyric acid content (A), and the contents of acetic acid (B), propionic acid (C) and butyric acid (D) after fermentation of different polysaccharide components2.2 不同多糖组分酵解过程中Mw的变化
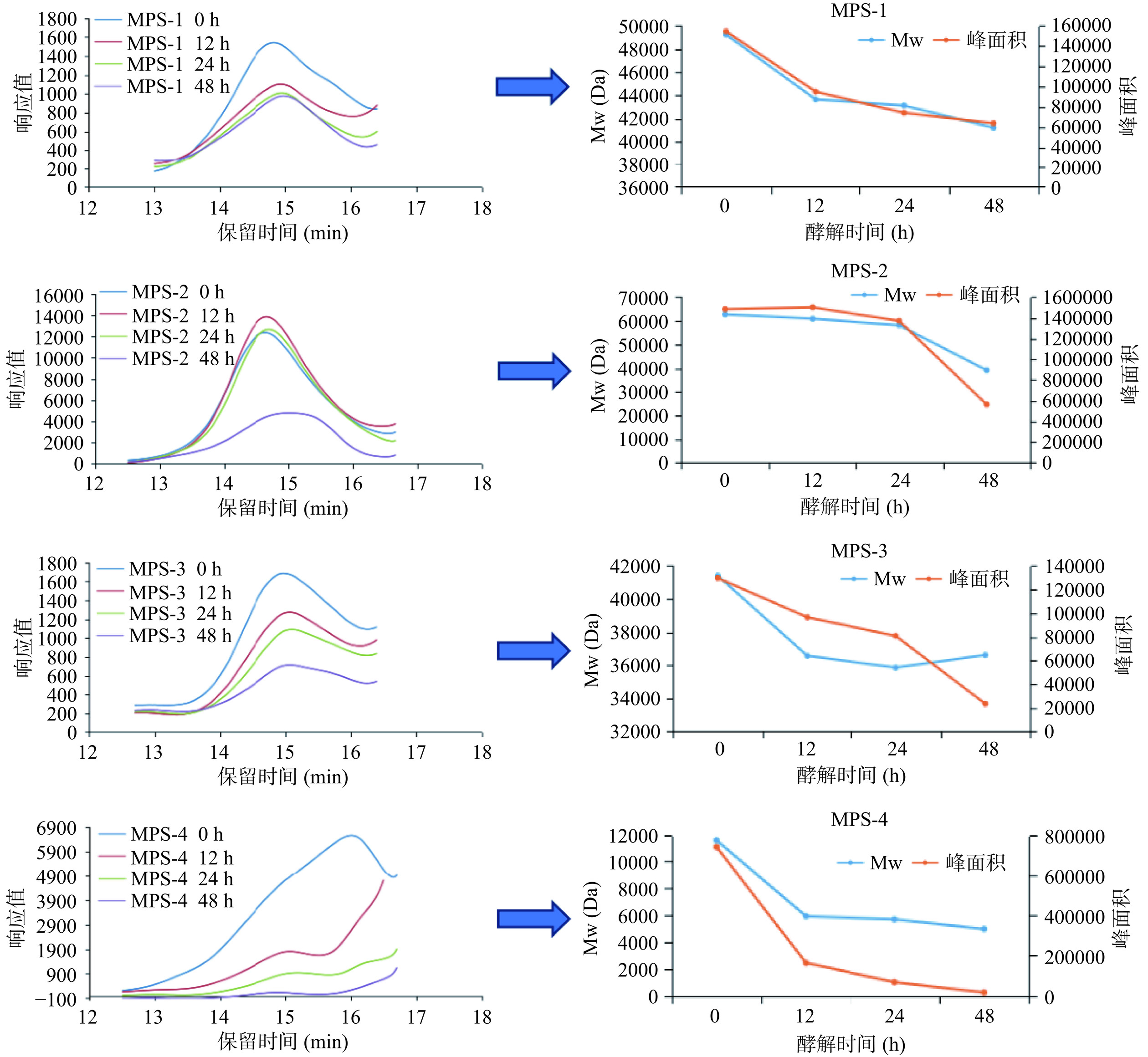
多糖的分子量能够反映在胃肠消化过程中多糖的降解情况[24],有研究表明,不同特性的多糖在胃肠消化过程中的降解情况不同,可能与多糖组分的理化性质、分子结构等有关,如太平洋鲍鱼硫酸多糖的Mw在消化过程中保持不变[25],但从桑椹果实中提取的多糖Mw随胃肠消化而降低,其单糖主要由鼠李糖、阿拉伯糖、葡萄糖、半乳糖、木糖等中性糖组成[26]。此外,分子量较大多糖在胃肠消化过程中不易被分解,而分子量较小的多糖组分易降解[27]。不同多糖组分酵解过程中Mw的变化如图4所示,结果发现,各多糖处理组Mw大小及峰面积随着发酵时间的延长而降低,其中,MPS-2分子量和峰面积降低幅度最大,说明MPS-2更容易被肠道微生物所降解,可能与糖苷键的断裂有关。研究显示,Rui等[14]通过体外模拟消化和发酵研究了冠突曲霉胞内多糖(IPS)和胞外多糖(EPS)是否能在消化系统中被分解及其对肠道菌群的调节作用,结果显示,在发酵过程中,HPLC色谱中IPS和EPS峰的响应值明显降低,表明IPS和EPS被肠道菌群水解成分子量更小的片段。由此可见,IPS和EPS均可被肠道菌群利用,这与本研究MPS的结果一致。
2.3 不同多糖组分对猪结肠肠道菌群组成的影响
采用16S区域扩增子测序分析技术,评估红曲霉不同菌丝体多糖组分在酵解过程中肠道菌群组成的变化。由SCFAs结果可知,酵解12 h和24 h SCFAs含量并无显著性差异,因此选取初始肠道菌群及酵解24和48 h的肠道菌群进行对比分析。
2.3.1 OTU分析
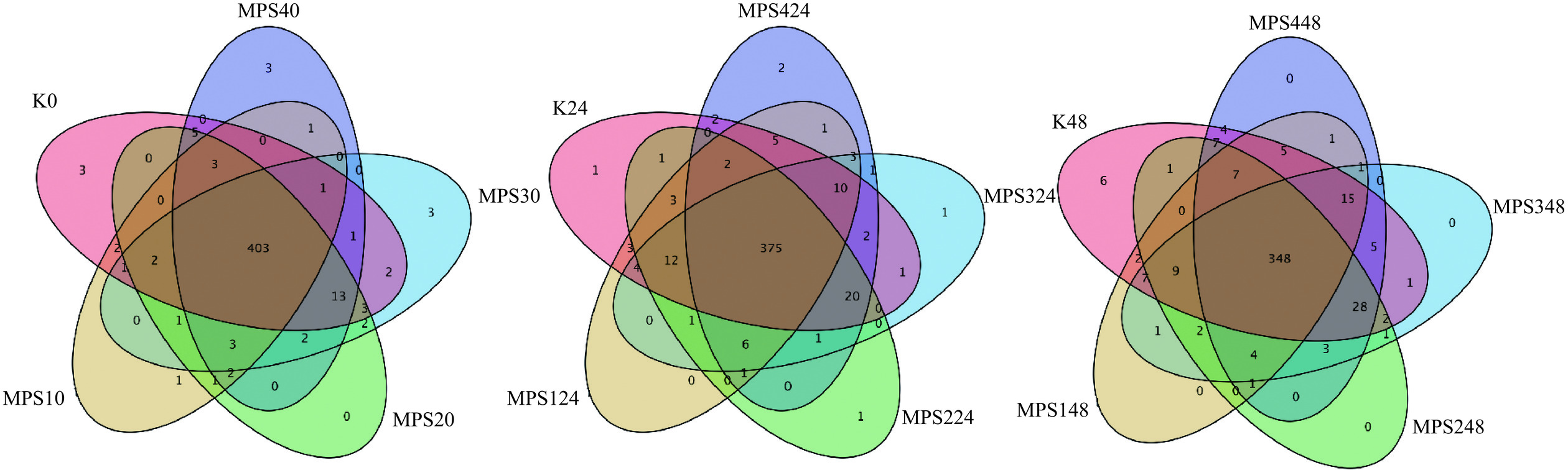
基于OTU的Venn图可以统计不同样本或者分组间特有的OTU和共有的OTU。不同多糖样品发酵0、24和发酵48 h的OTU重叠的Venn图如图5所示,初始肠道菌群共有的OTU数为403,发酵24 h后,其共有的OTU数目为375,而48 h后,共有的OTU数为348,说明经多糖酵解后,肠道微生物多样性稍有减少,而相对48 h来说,发酵24 h能更好的促进和维持肠道微生物的多样性。
![]() 图 5 不同多糖组分基于OTU的特征花瓣图注:K0:空白对照组酵解0 h,K24:空白对照组酵解24 h;K48:空白对照组酵解48 h;MPS10:MPS-1酵解0 h;MPS124:MPS-1酵解24 h;MPS148:MPS-1酵解48 h;MPS20:MPS-2酵解0 h;MPS224:MPS-2酵解24 h;MPS248:MPS-2酵解48 h;MPS30:MPS-3酵解0 h;MPS324:MPS-3酵解24 h;MPS348:MPS-3酵解48 h;MPS40:MPS-4酵解0 h;MPS424:MPS-4酵解24 h;MPS448:MPS-4酵解48 h。Figure 5. Characteristic petal plot based on OTU for different polysaccharide components
图 5 不同多糖组分基于OTU的特征花瓣图注:K0:空白对照组酵解0 h,K24:空白对照组酵解24 h;K48:空白对照组酵解48 h;MPS10:MPS-1酵解0 h;MPS124:MPS-1酵解24 h;MPS148:MPS-1酵解48 h;MPS20:MPS-2酵解0 h;MPS224:MPS-2酵解24 h;MPS248:MPS-2酵解48 h;MPS30:MPS-3酵解0 h;MPS324:MPS-3酵解24 h;MPS348:MPS-3酵解48 h;MPS40:MPS-4酵解0 h;MPS424:MPS-4酵解24 h;MPS448:MPS-4酵解48 h。Figure 5. Characteristic petal plot based on OTU for different polysaccharide components2.3.2 物种注释及分类学分析
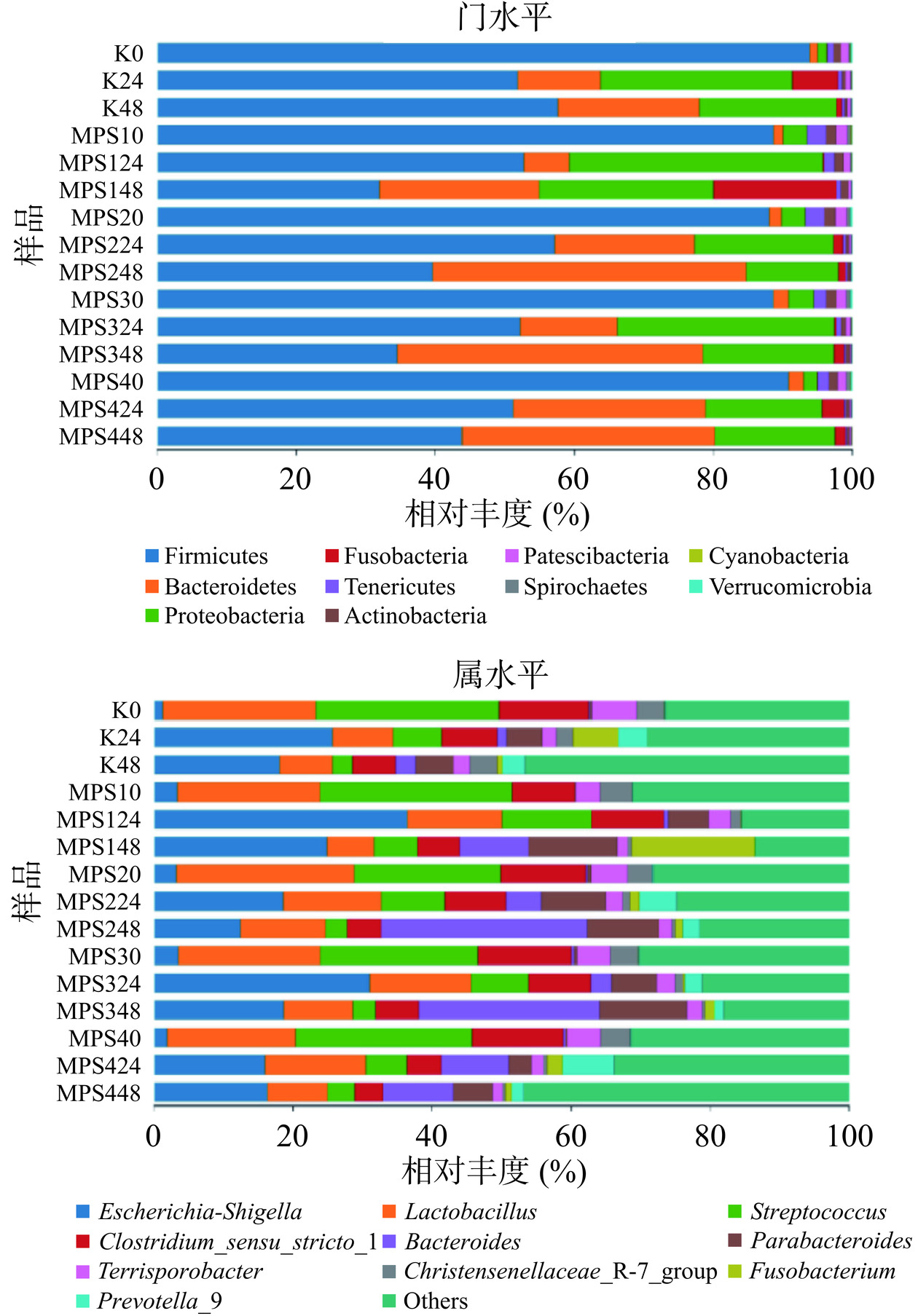
不同红曲多糖组分肠道酵解过程中物种相对丰度柱状图如图6所示,在门水平上(图6A),各组均主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形杆菌门(Proteobacteria)、梭杆菌门(Fusobacteria)、软壁菌门(Tenericutes)、放线菌门(Actinobacteria)、Patescibacteria、螺旋体门(Spirochaetes)、蓝藻门(Cyanobacteria)、疣微菌门(Verrucomicrobia)等组成,其中,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)是主要的优势菌门,在每个样本中厚壁菌门(Firmicutes)的相对丰度最大。随着酵解时间的延长(0~48 h),各组中厚壁菌门的丰度慢慢降低,拟杆菌门的丰度增加,变形菌门的丰度先升高后降低。有研究表明,许多多糖能够被拟杆菌门(Bacteroidetes)降解,从而增加拟杆菌门(Bacteroidetes)的相对丰度[28]。在酵解时间为48 h时,MPS-2和MPS-3处理组拟杆菌门(Bacteroidetes)相对丰度较大。另有研究显示,拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)的比例与肥胖有很大的相关性,在肥胖模型中,Firmicutes/Bacteroidetes值会有所升高[29],在本实验中,添加MPS的实验组Firmicutes/Bacteroidetes值在酵解48 h后下降,说明红曲多糖在一定程度上对肥胖的抑制有积极作用。这与冠突曲霉多糖对肠道菌群的影响结果相一致[30]。
由属水平柱状图(图6B)可以看出,与空白组相比,随着酵解时间的延长(0~48 h),埃希氏菌属(Escherichia-Shigella)的丰度先升高后降低,拟杆菌属(Bacteroides)、副拟杆菌属(Parabacteroides)等有益菌的丰度升高,而普雷沃菌属(Prevotella)在酵解24 h时丰度最高。有害菌属包括链球菌(Streptococcus)、梭菌属(Clostridium)、Terrisporobacter等的丰度显著下降。其中MPS-2处理组酵解过程中有益菌的相对丰度较大,有害菌的相对丰度最低。有研究表明,普雷沃菌属(Prevotella)更容易降解复杂的膳食多糖,可能是由于Prevotella在富含粘蛋白的环境中降解糖蛋白的粘蛋白能力[31]。另外,普雷沃菌属(Prevotella)和拟杆菌属(Bacteroides)均是婴儿健康肠道中的优势菌,能够参与营养和能量的提供以及维生素的合成和免疫的发育[32]。而副拟杆菌属(Parabacteroides)是人类肠道微生物群的核心成员,与宿主健康(如代谢综合征、炎症性肠病和肥胖)有密切关系,同时具有碳水化合物代谢和分泌SCFAs的生理特性[33]。
研究表明,在发酵过程中,肠道菌群会降解多糖从而影响其分子结构。例如,益生菌发酵会降低多糖的分子量,并改变多糖的单糖组成及比例[34],而这些变化均与原始多糖的分子结构相关。不同初始分子结构的多糖其对肠道酵解特性的影响差异较大,主要表现在短链脂肪酸的产生和肠道菌群变化[35]。呋喃半乳糖基的半乳甘露聚糖通常存在于真菌中,尤其是曲霉菌属、青霉属和青霉属等,而在植物和动物多糖中很少被报道。例如,Li等[36]从曲霉的发酵液中获得的WPA骨架由[→5)-β-D-Galf-(1→2,6)-α-D-Manp(1→)]组成,具有良好的抗肿瘤活性。此外,Li等[37]分别从麻曲霉、土曲霉和木霉KK19L1发酵液中分离的WPA、WPB、AP2A和TP1A四个组分,其免疫调节活性顺序为:WPA>WPB>AP2A>TP1A。其中,WPA富含5-Galf。此外,在课题组前期研究中,MPS-2中5-Galf的含量最高,同样显示出最强的免疫调节活性[13],说明Galf的含量和连接方式可能在霉菌多糖的生物活性中起重要作用[38−39]。
2.3.3 Alpha多样性分析
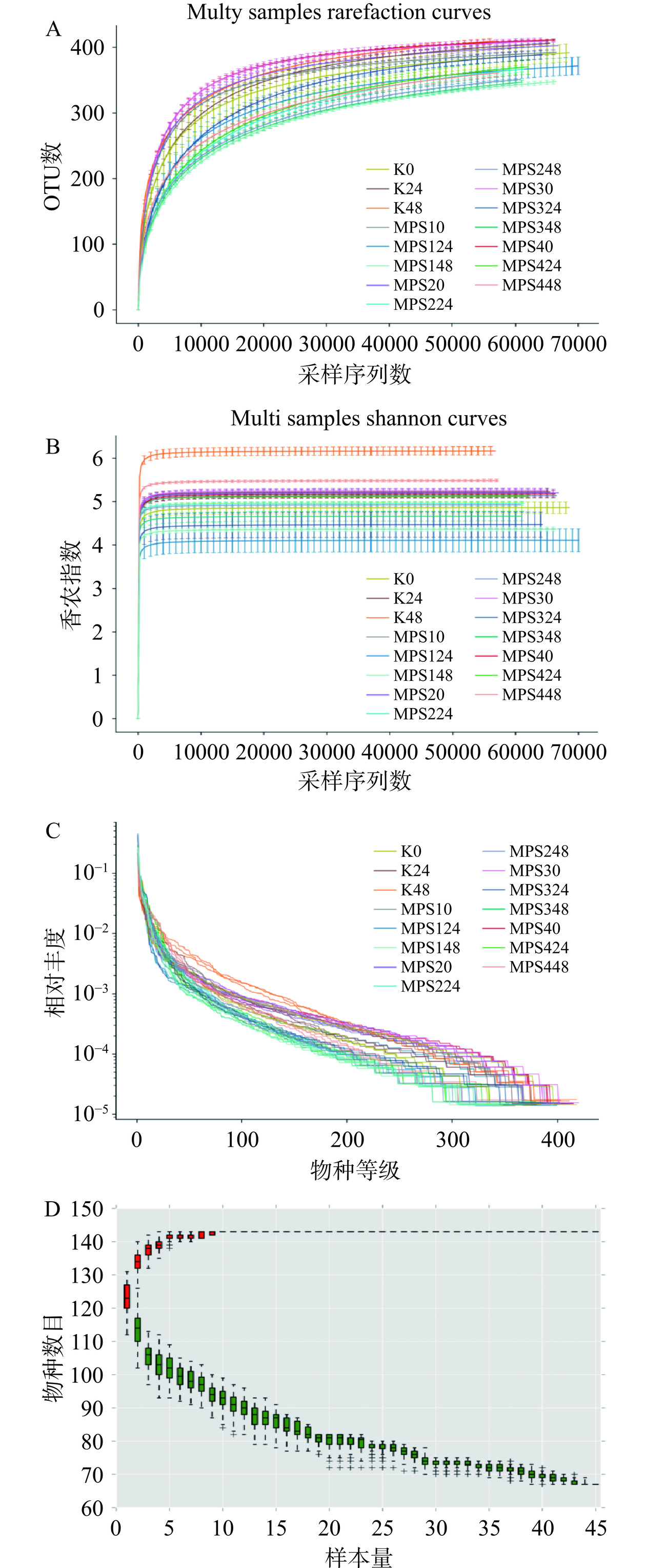
Alpha多样性能够反映单个样品中物种的丰度及物种多样性,包括稀释曲线(图7A)、香农指数曲线(图7B)、等级丰度曲线(图7C)、物种累积曲线(图7D)等指标,由图7A和图7B可以看出,各样本整体曲线趋向平坦,说明本次测序数据量合理,即使获得更多的数据量,也不会产生大量的OTUs数。由图7C可知,等级丰度曲线说明各样本所含物种的丰富度和均匀度都已达到一定的水平,说明可进行数据分析。
物种累积箱形图可以判断样本量是否充分,还可以对物种的丰富度进行预测。从图7D中可以看出,箱形图位置整体趋于平缓,说明在此环境中,即使样本数量增加,其相应的物种也不会显著增多。结果表明,此次测序抽样充分,可以进行数据分析。
2.3.4 Beta多样性分析
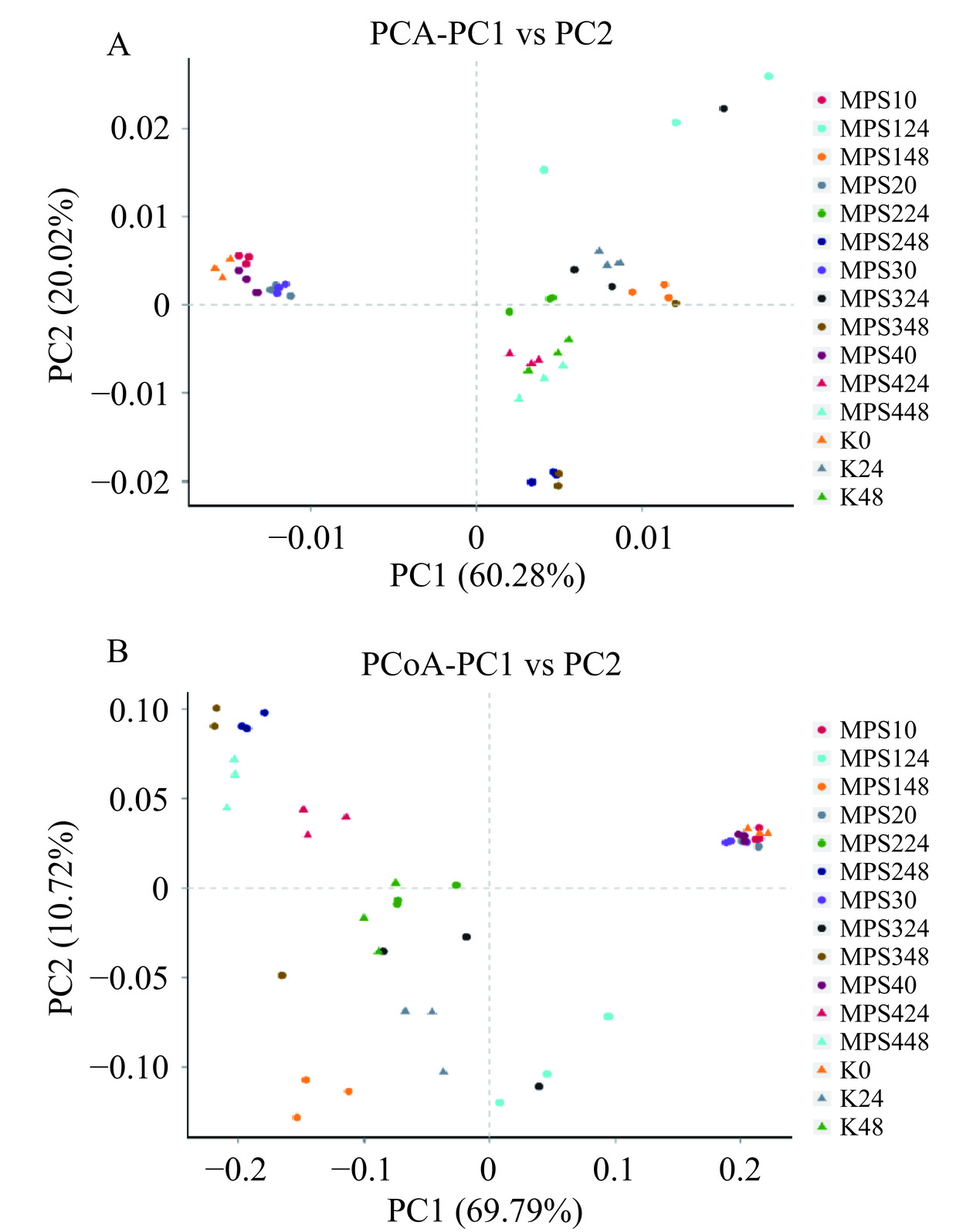
主成分分析(PCA)中,两个样品距离越近,则表示这两个样品的组成越相似。组间PCA分析结果如图8A所示,所有初始(0 h)样品具有明显的聚集,其他酵解时间样品距离较远,说明不同组初始肠道菌群相似,经多糖干预后,肠道菌群发生较大变化。其中,酵解48 h后,MPS-2和MPS-3处理组具有明显的聚集,MPS-4酵解24 h和48 h后与空白组48 h相近。多糖处理组基于Weighted Unifrac距离PCoA分析如图8B所示,与空白组相比,多糖处理组在酵解过程中肠道微生物的组成均有较大差异。该结果与PCA结果类似,不同样品在酵解0 h时肠道菌群相似,而随着酵解时间的延长,不同样品的肠道菌群结构发生了明显的变化。
3. 结论
本研究利用猪结肠内容物体外酵解模型,对紫色红曲霉4种菌丝体多糖组分的肠道酵解特性进行了研究。发现MPS的分子量随着酵解时间的延长而降低,能在一定程度上增加猪结肠内容中SCFAs的含量,说明多糖能够被肠道微生物所降解,从而调节肠道微生物的结构,促进部分有益菌属的生长,抑制有害菌属的生长,其中MPS-2和MPS-3产SCFAs的能力和调节猪结肠中肠道菌群的能力高于其他多糖组分,可能与Galf的含量有关。本研究可为红曲霉菌丝体多糖益生元产品的开发提供参考。
-
图 3 不同多糖组分酵解后乙酸、丙酸、丁酸含量百分比(A)以及乙酸含量(B),丙酸含量(C)和丁酸含量(D)
注:标注有相同字母为差异不显著(P>0.05),标注有不同字母为差异显奢(P<0.05)。
Figure 3. Percentage of acetic acid, propionic acid, and butyric acid content (A), and the contents of acetic acid (B), propionic acid (C) and butyric acid (D) after fermentation of different polysaccharide components
图 5 不同多糖组分基于OTU的特征花瓣图
注:K0:空白对照组酵解0 h,K24:空白对照组酵解24 h;K48:空白对照组酵解48 h;MPS10:MPS-1酵解0 h;MPS124:MPS-1酵解24 h;MPS148:MPS-1酵解48 h;MPS20:MPS-2酵解0 h;MPS224:MPS-2酵解24 h;MPS248:MPS-2酵解48 h;MPS30:MPS-3酵解0 h;MPS324:MPS-3酵解24 h;MPS348:MPS-3酵解48 h;MPS40:MPS-4酵解0 h;MPS424:MPS-4酵解24 h;MPS448:MPS-4酵解48 h。
Figure 5. Characteristic petal plot based on OTU for different polysaccharide components
表 1 厌氧培养基的组成
Table 1 Composition of anaerobic incubation medium (AIM)
矿物质(mg) 维生素(mg) 其它(mg) CaCl2 50 D-Biotin 0.05 L-盐酸半胱氨酸 1000 CoCl·6H2O 2 泛酸钙 2 刃天青 1 FeSO4·7H2O 20 维生素B12 0.005 K2HPO4 900 叶酸 0.05 MgSO4 50 烟酰胺 2 MnSO4·H2O 20 对氨基苯甲酸 0.1 NaCl 900 维生素B6 2 Na2CO3 4000 维生素B2 2 (NH4)2SO4 900 维生素B1 2 ZnSO4·7H2O 20 表 2 PCR反应体系
Table 2 Reaction system of PCR
PCR 反应体系 30 μL体系 Phusion Master Mix(2×) 15 μL Primer(2 μmol/L) 3 μL gDNA(1 ng/μL) 10 μL H2O 2 μL 表 3 SCFAs的标准曲线
Table 3 Standard curve equations of SCFAs
SCFA 标准曲线 R2 乙酸 y=0.2636x−0.0076 0.995 丙酸 y=0.4596x−0.0257 0.9913 异丁酸 y=0.5084x−0.0243 0.9906 正丁酸 y=0.5902x−0.0313 0.9938 异戊酸 y=0.6454x−0.0366 0.9913 正戊酸 y=0.7295x−0.0461 0.9913 异己酸 y=0.7465x−0.0505 0.992 正己酸 y=0.766x−0.0516 0.9923 正庚酸 y=0.7086x−0.0545 0.9915 -
[1] KANG J, YIN S, LIU J, et al. Fermentation models of dietary fibre in vitro and in vivo - A review[J]. Food Hydrocolloids, 2022, 107685.
[2] YE S, SHAH B, LI J, et al. A critical review on interplay between dietary fibers and gut microbiota[J]. Trends in Food Science & Technology,2022,124:237−249.
[3] MA Y, PENG X, YANG J, et al. Impacts of functional oligosaccharide on intestinal immune modulation in immunosuppressive mice[J]. Saudi Journal of Biological Sciences,2020,27(1):233−241. doi: 10.1016/j.sjbs.2019.08.019
[4] SONG Z, LIU F, CHEN Y, et al. CTGF-mediated ERK signaling pathway influences the inflammatory factors and intestinal flora in ulcerative colitis[J]. Biomedicine & Pharmacotherapy,2019,111:1429−1437.
[5] YU Z, SONG G, LIU J, et al. Beneficial effects of extracellular polysaccharide from Rhizopus nigricans on the intestinal immunity of colorectal cancer mice[J]. International Journal of Biological Macromolecules,2018,115:718−726. doi: 10.1016/j.ijbiomac.2018.04.128
[6] SONNENBURG J L, BACKHED F. Diet-microbiota interactions as moderators of human metabolism[J]. Nature,2016,535(7610):56−64. doi: 10.1038/nature18846
[7] TIAN Y, XU Q, SUN L, et al. Short-chain fatty acids administration is protective in colitis-associated colorectal cancer development[J]. The Journal of Nutritional Biochemistry,2018,57:103−109. doi: 10.1016/j.jnutbio.2018.03.007
[8] WU H, CHENG M, WU M, et al. Three new constituents from the fungus of Monascus purpureus and their anti-inflammatory activity[J]. Phytochemistry Letters,2019,31:242−248. doi: 10.1016/j.phytol.2018.12.017
[9] HANDA C, DE Lima F, GUELFI M, et al. Parameters of the fermentation of soybean flour by Monascus purpureus or Aspergillus oryzae on the production of bioactive compounds and antioxidant activity[J]. Food Chemistry,2019,271:274−283. doi: 10.1016/j.foodchem.2018.07.188
[10] CHENG M, WU M, CHEN I, et al. Chemical constituents from the fungus Monascus purpureus and their antifungal activity[J]. Phytochemistry Letters,2011,4(3):372−376. doi: 10.1016/j.phytol.2011.08.003
[11] LEE C, WEN J, HSU Y, et al. The blood lipid regulation of Monascus -produced monascin and ankaflavin via the suppression of low-density lipoprotein cholesterol assembly and stimulation of apolipoprotein A1 expression in the liver[J]. Journal of Microbiology, Immunology and Infection,2018,51(1):27−37. doi: 10.1016/j.jmii.2016.06.003
[12] YANG X. Production of functional Monascus mycelium by liquid-state fermentation[J]. Liquor-Making Science & Technology,2019,11:35−38.
[13] WANG N, WU Y, JIA G, et al. Structural characterization and immunomodulatory activity of mycelium polysaccharide from liquid fermentation of Monascus purpureus (Hong Qu)[J]. Carbohydrate Polymers,2021,262(2):117945.
[14] RUI Y, WAN P, CHEN G, et al. Simulated digestion and fermentation in vitro by human gut microbiota of intra- and extra-cellular polysaccharides from Aspergillus cristatus[J]. LWT-Food Science and Technology,2019,116:108508. doi: 10.1016/j.lwt.2019.108508
[15] DING H H, CUI S W, GOFF H D, et al. Short-chain fatty acid profiles from flaxseed dietary fibres after in vitro fermentation of pig colonic digesta:Structure-function relationship[J]. Bioactive Carbohydrates & Dietary Fibre,2015,6(2):62−68.
[16] 蒋汶. 红曲霉发酵产多糖及其性质的初步研究[D]. 芜湖:安徽工程大学, 2016. [JIANG Wen. Preliminary study on the fermentation of Monacus polysaccharide and its properties of Monacus polysaccharide[D]. Wuhu:Anhui Polytechic University, 2016.] JIANG Wen. Preliminary study on the fermentation of Monacus polysaccharide and its properties of Monacus polysaccharide[D]. Wuhu: Anhui Polytechic University, 2016.
[17] GUO X Y, ZHANG X M, YING X, et al. Fermentation properties and prebiotic potential of different pectins and their corresponding enzymatic hydrolysates[J]. Food Hydrocolloids,2023,143:108878. doi: 10.1016/j.foodhyd.2023.108878
[18] 陆松翠, 郑楠, 王加启, 等. 短链脂肪酸的生物学功能研究进展[J]. 动物营养学报,2024,36(6):3514−3524. [LU Songcui, ZHENG Nan, WANG Jiaqi, et al. Research Progress on biological Function of Short-Chain Fatty Acids[J]. Chinese Journal of Animal Nutrition,2024,36(6):3514−3524.] LU Songcui, ZHENG Nan, WANG Jiaqi, et al. Research Progress on biological Function of Short-Chain Fatty Acids[J]. Chinese Journal of Animal Nutrition, 2024, 36(6): 3514−3524.
[19] 耿雪冉, 王无霞, 刘荣柱, 等. 超声辅助低共熔溶剂提取的鳞杯伞多糖的体外消化与酵解特性[J]. 菌物学报,2024,43(4):84−97. [GENG Xueran, WANG Wuxia, LIU Rongzhu, et al. In vitro digestion and fermentation characteristics of Clitocybe squamulosa polysaccharides extracted by ultrasound-asisted deep eutectic solvents[J]. Mycosystema,2024,43(4):84−97.] GENG Xueran, WANG Wuxia, LIU Rongzhu, et al. In vitro digestion and fermentation characteristics of Clitocybe squamulosa polysaccharides extracted by ultrasound-asisted deep eutectic solvents[J]. Mycosystema, 2024, 43(4): 84−97.
[20] 李娟, 邓泽元, 范亚苇. 荞麦蜂花粉多糖对人体粪便菌群代谢的影响[J]. 中国食品学报,2021,21(5):133−139. [LI Juan, DENG Zeyuan, FAN Yawei. Effects of polysaccharide from Fago pyrum esculentum Moench bee pollen on metabolism of human fecal flora[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(5):133−139.] LI Juan, DENG Zeyuan, FAN Yawei. Effects of polysaccharide from Fagopyrum esculentum Moench bee pollen on metabolism of human fecal flora[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(5): 133−139.
[21] 樊莹润, 郑婷婷, 李泽林, 等. 黄皮疣柄牛肝菌多糖体外模拟消化和酵解特性研究[J/OL]. 食品科学技术学报, 1−12[2024-08-29]. http://kns.cnki.net/kcms/detail/10.1151.TS.20231106.1452.002.html. [FAN Yingrun, ZHENG Tingting, LI Zelin, et al. Study on in vitro simulated digestion and characteristics of polvsaccharides from fermentatlon Crocioodium (Letelier.) watlad ACCIUnA[J/OL]. Journal of Food Science and Technology, 1−12[2024-08-29]. http://kns.cnki.net/kcms/detail/10.1151.TS.20231106.1452.002.html.] FAN Yingrun, ZHENG Tingting, LI Zelin, et al. Study on in vitro simulated digestion and characteristics of polvsaccharides from fermentatlon Crocioodium (Letelier.) watlad ACCIUnA[J/OL]. Journal of Food Science and Technology, 1−12[2024-08-29]. http://kns.cnki.net/kcms/detail/10.1151.TS.20231106.1452.002.html.
[22] YE K, FU C, MA S, et al. Comprehensive assessment of Hypsizygus marmoreus polysaccharides through simulated digestion and gut microbiota fermentation in vitro[J]. Food Hydrocolloids,2023,144:108989. doi: 10.1016/j.foodhyd.2023.108989
[23] 李翠茹, 彭买姣, 谭周进. 肠道菌群相关短链脂肪酸的研究进展[J]. 世界华人消化杂志,2022,30(13):562−570. [LI C R, PENG M J , TAN Z J. Progress in research of intestinal microbiota related short chain fatty acids[J]. World Chinese Journal of Digestology,2022,30(13):562−570.] LI C R, PENG M J , TAN Z J. Progress in research of intestinal microbiota related short chain fatty acids[J]. World Chinese Journal of Digestology, 2022, 30(13): 562−570.
[24] HUANG F, HONG R, YI Y, et al. In vitro digestion and human gut microbiota fermentation of Longan pulp polysaccharides as affected by Lactobacillus fermentum fermentation[J]. International Journal of Biological Macromolecules,2020,147:363−368. doi: 10.1016/j.ijbiomac.2020.01.059
[25] AI C, MA N, SUN X, et al. Absorption and degradation of sulfated polysaccharide from pacific abalone in in vitro and in vivo models[J]. Journal of Functional Foods,2017,35:127−133. doi: 10.1016/j.jff.2017.05.022
[26] CHEN C, ZHANG B, FU X, et al. The digestibility of mulberry fruit polysaccharides and its impact on lipolysis under simulated saliva, gastric and intestinal conditions[J]. Food Hydrocolloids,2016,58:171−178. doi: 10.1016/j.foodhyd.2016.02.033
[27] ZHOU W, YAN Y, MI J, et al. Simulated digestion and fermentation in vitro by human gut microbiota of polysaccharides from bee collected pollen of Chinese wolfberry[J]. Journal of Agricultural and Food Chemistry,2018,66(4):898−907. doi: 10.1021/acs.jafc.7b05546
[28] CHENG J, HU J, GENG F, et al. Bacteroides utilization for dietary polysaccharides and their beneficial effects on gut health[J]. Food Science and Human Wellness,2022,11(5):1101−1110. doi: 10.1016/j.fshw.2022.04.002
[29] NISHTSUJI K, Xiao J, NAGATOMO R, et al. Analysis of the gut microbiome and plasma short-chain fatty acid profiles in a spontaneous mouse model of metabolic syndrome[J]. Scientific Reports,2017,7(1):15810−15876. doi: 10.1038/s41598-017-15671-4
[30] CHEN G, XIE M, DAI Z, et al. Kudingcha and Fuzhuan brick tea prevent obesity and modulate gut microbiota in high-fat diet fed mice[J]. Molecular Nutrition & Food Research,2018,62(6):e1700485.
[31] EDWARD A B P, JONG-PYO C, MARILEN P B, et al. Assessment of fecal bacterial diversity among healthy piglets during the weaning transition[J]. Journal of General & Applied Microbiology,2014,60(4):140−146.
[32] NUTAN T, CHANGOTRA H, GROVER N, et al. Elucidation of bacterial species during childhood diarrhea through 16S rRNA Illumina Miseq approach[J]. Meta Gene,2018,16:234−240. doi: 10.1016/j.mgene.2018.03.012
[33] CUI Y, ZHANG L, WANG X, et al. Roles of intestinal Parabacteroides in human health and diseases[J]. FEMS Microbiology Letters,2022,369:1−11.
[34] WANG X, HU K, CHEN Y, et al. Effect of Lactiplantibacillus plantarum fermentation on the physicochemical, antioxidant activity and immunomodulatory ability of polysaccharides from Lvjian okra[J]. International Journal of Biological Macromolecules,2024,257:128649. doi: 10.1016/j.ijbiomac.2023.128649
[35] 尹思嘉, 李春蓉, 郭庆彬. 6种多糖体外酵解特性的比较[J]. 食品研究与开发,2023,44(12):51−60. [YIN Sijia, LI Chunrong, GUO Qingbin. Comparative study on the in vitro fermentation characteristics of six polysaccharides[J]. Food Research and Development,2023,44(12):51−60.] YIN Sijia, LI Chunrong, GUO Qingbin. Comparative study on the in vitro fermentation characteristics of six polysaccharides[J]. Food Research and Development, 2023, 44(12): 51−60.
[36] LI H, LIU X, XU Y, et al. Structure and antitumor activity of the extracellular polysaccharides from aspergillus aculeatus via apoptosis and cell cycle arrest[J]. Glycoconjugate Journal,2016,33(6):1−10.
[37] LI H, XIE W, SUN H, et al. Effect of the structural characterization of the fungal polysaccharides on their immunomodulatory activity[J]. International Journal of Biological Macromolecules,2020,164:3603−3610. doi: 10.1016/j.ijbiomac.2020.08.189
[38] WANG T, DONG Z, ZHOU D, et al. Structure and immunostimulating activity of a galactofuranose-rich polysaccharide from the bamboo parasite medicinal fungus Shiraia bambusicola[J]. Journal of Ethnopharmacology,2020,257:112833.
[39] WANG N, SHAN Z, JIA X, et al. Galf-containing polysaccharides from medicinal molds:Sources, structures and bioactive properties[J]. Trends in Food Science & Technology,2023,131:244−263.





 下载:
下载:
 下载:
下载:



