Preparation and Physicochemical Properties of High-purity Isomaltooligosaccharides by Sequential Simulated Moving Bed Chromatography
-
摘要: 本文以低聚异麦芽糖(IMOs-50型)糖浆为原料,利用顺式模拟移动床色谱分离技术对其进行纯化,并对高纯度低聚异麦芽糖相关理化性质进行分析。通过单柱固定床试验选择适合低聚异麦芽糖分离的固定相,比较了不同类型的阳离子交换树脂对低聚异麦芽糖和单糖、二糖混合液的分离度,筛选出ZG106 K+型树脂为合适的分离介质;在制备色谱单柱评价试验结果基础上,结合物料平衡原理和顺序式模拟移动床基本原理,初步确立了顺序式模拟移动床色谱分离高纯度低聚异麦芽糖工艺的基本操作参数,并对分离条件进一步优化,得到最佳纯化技术参数为:进料量455 mL/h、进料折光60%、色谱柱温65 ℃、进水量为682 mL/h、进料流速为40.2 mL/min、进水流速为31.8 mL/min、总循环流量为409.5 mL/h,出口折光率为18.70%,纯度为92.80%,收率为83.20%。高纯度低聚异麦芽糖在相对湿度为43%和81%的环境中保存7 d后,吸湿率分别为61.63%和67.10%。在相对湿度为43%和0的环境下保存7 d,水分残存率分别为77.96%和15.56%;其化学结构在352.5 ℃下保持稳定;能进行美拉德反应,典型的非牛顿型“假塑性流体”。顺序式模拟移动床技术可高效纯化低聚异麦芽糖,为我国高纯度低聚异麦芽糖的大规模商业化生产以及广泛应用提供了相应的技术支撑。高纯度低聚异麦芽糖良好的理化特性为其在食品以及相关功能性糖领域的应用提供理论基础。
-
关键词:
- 低聚异麦芽糖 /
- 顺序式模拟移动床色谱 /
- 制备色谱 /
- 纯化 /
- 理化性质
Abstract: In this paper, isomaltooligosaccharides 50 syrup was used as raw material and purification of isomaltooligosaccharides by sequential simulated moving bed chromatography, and the related physical and chemical properties of high-purity isomaltooligosaccharide were analyzed. The stationary phase suitable for the separation of isomaltooligosaccharides was selected by single column fixed bed experiment. The separation degree of different types of cation exchange resin on isomaltooligosaccharides, monosaccharides and disaccharides mixture was compared, ZG106 K+ resin was selected as the suitable separation medium. Then, based on the single column evaluation test of preparative chromatography and the principle of material balance and the basic principle of sequential simulated moving bed. The initial operating parameters for the sequential simulated moving bed chromatographic separation high-purity isomaltooligosaccharides process were roughly determined. Further the separation conditions were optimized and the best technical parameters were as follows: feed refraction was 60% and column temperature was 65 ℃. At the same time quantity of flow in the entrance and eluent were 455 mL/h and 682 mL/h, respectively. The velocity of flow in the entrance and eluent were 40.2 mL/min and 31.8 mL/min, respectively. Besides, the circulating flow was kept within 409.5 mL/h. Finally, the outlet refraction of isomaltooligosaccharides was 18.70%. Products gained with purity was 92.80% and the yield was 83.20%. After 7 days of storage in environments with relative humidity of 43% and 81%, the moisture absorption rates of high-purity isomaltooligosaccharides were 61.63% and 67.10% respectively. Meanwhile, after 7 days of storage in environments with relative humidity of 43% and 0, the moisture retention rates of high-purity isomaltooligosaccharides were 77.96% and 15.56% respectively. Its chemical structure could still maintain high stability at 352.5 ℃. It was capable of performing the Maillard reaction. Syrup was a typical non-Newtonian "pseudoplastic fluid". Sequential simulated moving bed technology can efficiently purify isomaltooligosaccharides, which provides corresponding technical support for the large-scale commercial production and wide application of high-purity isomaltooligosaccharides. The good physical and chemical properties of high purity isomaltooligosaccharide provide a theoretical basis for its application in food and related functional sugar fields. -
低聚异麦芽糖(Isomaltooligosaccharides,IMOs)是一种非消化性,由葡萄糖基不规则连接成的短链低聚糖(Anomalously linked oligosaccharides,ALOs)[1−2],是公认的功能性食品成分,具有益生元潜力并对健康有益[3−4]。据报道,到2024年IMOs市场的年复合增长率(Compound Annual Growth Rate,CAGR)将增加6.59%,市场对IMOs的需求大幅增加。目前,主要采用复合酶法生产IMOs[5−7],而酶法制备的IMOs中通常含有葡萄糖、麦芽糖和其他非IMOs的低聚糖,降低了目标产物的纯度,影响了IMOs的功能性和理化特性,也制约其终端产品的开发和应用。因此纯化工艺对于功能性低聚糖的生产是至关重要的一个工序。
传统的纯化低聚糖的方法包括溶剂沉淀法、溶剂萃取法、活性炭吸附法和色谱法。近年来,随着膜分离技术的发展[8−10]主要采用纳滤和超滤法对低聚糖进行分离纯化[11−12],其中超滤技术是根据聚合度的不同从高分子量的化合物中分离出低聚糖[13−14];纳滤法则是通过对低聚糖混合物浓缩后除去不需要的成分,进而达到纯化的目的[1,15−16]。而这些技术所用设备价格昂贵,且纯化过程中容易发生膜污染,还需定期进行杀菌清洗和维护。导致这些方法都无法实现在大规模工业化生产中的应用。为此在考虑食品安全,环境保护,大规模生产低聚糖的经济可行性等因素,迫切需要新的色谱分离纯化技术的应用。
顺序式模拟移动床(Sequential simulated moving bed,简写SSMB)作为一种现代化精细的色谱分离技术[17]在制糖工业领域的应用逐渐得到认可。目前,我国已有利用SSMB技术纯化低聚木糖[18]、菊芋多聚果糖[19]、木糖母液[20]、葡萄糖母液[21]等的应用研究,在此背景下,本研究通过单柱固定床试验,筛选出适合于IMOs分离的树脂,再利用自主研制的SSMB设备对IMOs-50型的原料液进行分离纯化,在最佳工艺条件下制备出高纯度IMOs,并对其相关理化性质进行研究。为提高低聚糖行业的生产效率以及进一步扩大生产规模提供一定的参考,也为其在食品以及相关功能性糖领域的应用提供理论基础。
1. 材料与方法
1.1 材料与仪器
IMOs-50型糖浆 山东保龄宝生物股份有限公司;ZG106 Ca2+型树脂、ZG106 K+型树脂、ZG106 H+型树脂 浙江争光实业股份有限公司;乙腈 色谱纯,瑞典Oceanpak化学公司。
制备色谱单柱实验系统:SSMB-9L9Z型分离纯化设备 黑龙江八一农垦大学国家杂粮工程技术研究中心制造;1200 Series Ⅲ型HPLC色谱仪 美国Agilent公司;DR102数显糖度计折射仪 深圳雅戈科技有限公司;RID-10A示差折光检测器 日本Shimadzu公司;Gemini SEM 300扫描电镜 德国Zeiss公司;Thermo Scientific HAAKE MARS 60型旋转式流变仪 德国Haake公司;STA 449 F3型热重分析仪 德国Netzsch公司;X-射线衍射仪Ulilma IV 日本Rigaku公司;TENSORⅡ型傅立叶转换红外光谱仪 德国Bruker公司。
1.2 实验方法
1.2.1 树脂预处理与装填方法
先将ZG106 Ca2+树脂、ZG106 K+树脂、ZG106 H+树脂中的破损树脂去除,然后分别取 200 mL树脂用95%乙醇将其浸泡1 d,再用超纯水反复冲洗,直到冲洗至无乙醇气味。在试验过程中,采用专门的色谱柱装柱装置对三种特定的阳离子型树脂逐一进行填充操作,随后用超纯水连续不间断地冲洗,直到流出液体的电导率与去离子水基本一致。在此过程中,对单柱系统逐步提升温度至恒定的65 ℃。树脂填充完毕后,暂存待用。
1.2.2 树脂的选型及分离参数优化
采用强酸性聚苯乙烯大孔树脂对IMOs-50型进行分离,先分别对树脂用Ca2+、K+、H+三种阳离子进行改型,再根据普通树脂的一般承受程度进行参数设置,在柱温为65 ℃、料液浓度浓缩至60%、进样量10 mL、流速1.5 BV条件下测定三种树脂对IMOs-50型糖浆的分离效果。再选用分离效果较好的树脂作为分离用树脂,在此条件下对其他分离参数(进样浓度、分离温度、进样量、洗脱流速等)进行优化。
1.2.3 测定方法
1.2.3.1 糖浓度的测定方法
采用DR102数显糖度计折射仪测定。胶头滴管吸取0.2~0.3 mL样液,滴入滴液口,盖上遮光盖,读取折光率。
1.2.3.2 纯度测定方法
高效液相色谱法测定[22]。色谱条件:氨基键合柱:Agilent ZORBAX NH2分析柱(4.6 mm×300 mm,5 μm);流动相:乙腈:水=75:25;流速:1.0 mL/min;柱温:35 ℃;进样量:20 μL。钙型阳离子交换树脂柱:Sepax Carbomix Ca-NP5:8%(7.8 mm×300 mm,5 μm);流动相:哇哈哈水;柱温:82 ℃;流速:0.5 mL/min;进样量:20 μL;示差折光检测器(RID)。
1.2.3.3 收率的计算方法
收率按照下式进行计算:
收率(%)=ρ1×V1×C1ρ0×V0×C0×100 式中,C1表示分离后IMOs组分的总糖折光;C0表示原料液总糖的折光;ρ1表示分离后IMOs组分中IMOs的纯度,%;ρ0表示原料液中IMOs纯度,%;V1表示分离后IMOs组分溶液体积,mL;V0表示原料液的体积,mL。
1.2.3.4 分离度计算方法
杂糖与IMOs分离度按照下式进行计算:
Rs=2(t2−t1)W2+W1 式中,t2为杂糖的保留时刻,而t1代表的是IMOs的保留时刻。W1表示IMOs色谱峰的宽度,W2则指代杂糖色谱峰的宽度。
1.2.4 制备色谱评价试验
1.2.4.1 柱温对分离度的影响
将超纯水作为解吸剂,设置进料折光为60%,进料量10 mL,洗脱流速1.6 mL/min,然后分别在5个温度(35、45、55、65、75 ℃)水平下进行试验,使用多功能自动收集装置每 2 min收集1管样品。测定样品中IMOs的纯度,并绘制出折线图,以确定最优化的柱温条件。
1.2.4.2 进料浓度对分离度的影响
试验设计选择了5个不同的进料折光水平,分别为30%、40%、50%、60%以及70%,其余步骤同1.2.4.1。
1.2.4.3 进料量对分离度的影响
选择进料量分别为 6、8、10、12、14 mL 5个水平下进行试验,其余步骤同1.2.4.1。
1.2.4.4 洗脱流速对分离度的影响
调节洗脱流速分别在1.2、1.4、1.6、1.8、2.0 mL/min 5个水平下进行试验,其余步骤同1.2.4.1。
1.2.4.5 洗脱曲线的绘制
通过单因素实验,确定了最佳色谱分离参数为:进料量10 mL、进样流速1.6 mL/min、柱温65 ℃、进料折光率60%,并进行色谱分离实验,绘制洗脱曲线图。
1.2.5 SSMB纯化IMOs的工艺研究
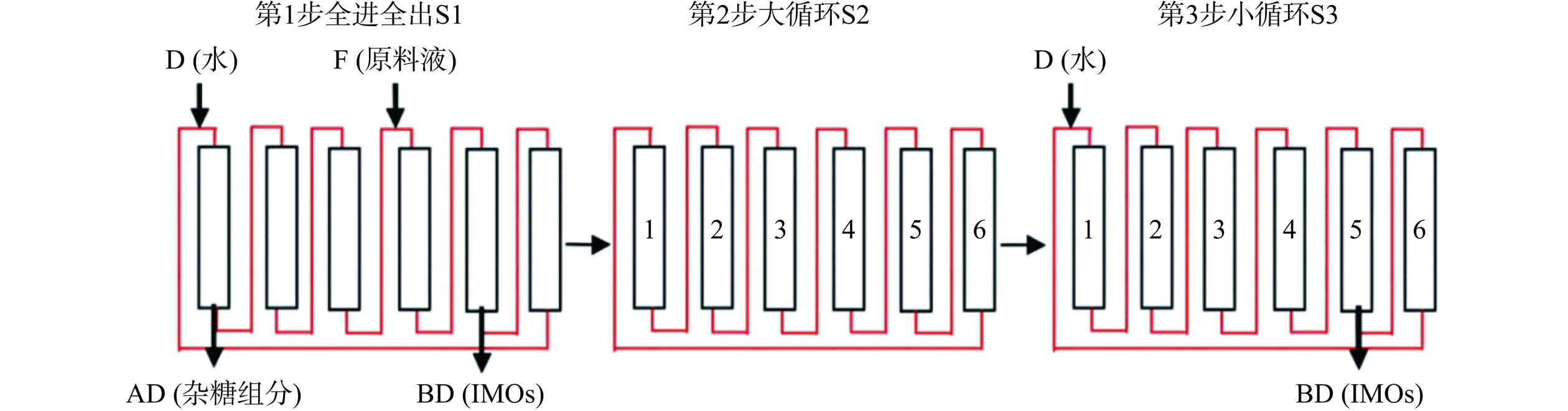
基于制备色谱评价试验,将进料液的折射率设为60%,柱温设为65 ℃作为SSMB基础操作参数。同时结合物料守恒定律的实质和SSMB核心理论进行IMOs-50型分离纯化工艺参数(进料流量、进水流量、进料流速、进水流速和循环流量)的设计试验。在各出料口将收集到的流出液进行折光度的测定以及IMOs纯度和收率的计算,并以IMOs纯度和收率为指标,优化进料流量、进水流量、进料流速、进水流速及循环流量5个主要技术参数以达到最佳的纯化效果。IMOs分离工艺流程见图1所示。
1.2.6 IMOs的理化性质分析及结构表征
1.2.6.1 IMOs吸湿性和保湿性测定
以甘油为对照,参照张心怡[23]的相关方法进行测定。
1.2.6.2 IMOs的表面形态观察
根据ASAD等[24]的方法并作适当修改,对纯化前后IMOs的表面结构通过扫描电子显微镜(SEM)进行观察。将冷冻干燥后的IMOs粉末铺在铝片上,置真空喷镀仪内喷金,在其表面溅射10 nm的金层。在加速电压为3 kV,工作距离7.3 mm,使用SE2探测器,放大倍数为50、500、1000的条件下观察样品表面形态特征。
1.2.6.3 IMOs的热力学性质分析
采用热重分析仪对IMOs进行热重分析。将3.500 mg干燥后IMOs粉末置于氧化铝坩埚中。试验在氮气流中进行,以10 mL/min的流速冲氮气置换,并以10 ℃/min的速率从25 ℃升温至600 ℃。记录升温过程中质量随温度变化的TGA曲线,并绘制微商热重分析(DTG)曲线。
1.2.6.4 IMOs贮藏稳定性测定
温度稳定性测定:将纯化后IMOs溶于超纯水中,配制成终浓度为5 g/L的溶液,分别在 4、40、50、60、70 ℃下储存7 d,每隔24 h测定其OD200 nm。
pH稳定性分析:将纯化后IMOs分别溶于pH3.0、5.0、7.0、9.0、11.0的PBS缓冲液中,配制成终浓度为5 g/L的溶液,在4 ℃下储存7 d,每隔24 h测定其OD200 nm。
1.2.6.5 IMOs糖浆褐变度测定
取含固形物70%的糖浆样本,将其稀释成10%的溶液,采用0.5 mol/L的磷酸钠缓冲液(pH7.0)进行调配。然后,加入0.3%固形物含量的谷氨酸钠。将混合溶液均匀地分配到多个试管内,并紧密封闭试管口。然后置于120 ℃中进行加热处理,时间范围从0~180 min。加热过程结束后,迅速将试管放入冷水中冷却。随后在特定波长420 nm处测量其吸光度。所有的测量均以蒸馏水作为无色空白对比样本。
1.2.6.6 傅里叶转换红外光谱分析
根据CASTROCAMPOS等[25]的方法并作适当修改,分别取适量纯化前IMOs和纯化后的IMOs粉末,并与KBr以1:100的比例精细研磨,确保混合物的均匀性。然后,借助真空压片机将混合物制成适合红外光谱分析的样品薄片。红外光谱分析在4000~400 cm−1的波数范围内进行,分辨率为4 cm−1,测定其官能团。
1.2.6.7 X-射线衍射光谱分析
根据GONZÁLEZ等[26]的方法并作适当修改。取10 mg纯化后冻干的IMOs粉末样品与100 mg KBr共同碾磨并压片,收集XRD的曲线,扫描速率为2°/min,采样步宽设为0.05°,测量范围2θ=5°~80°。采用MDI Jade 6.0软件查找峰值。
1.2.6.8 IMOs的流变性质分析
不同可溶性固形物含量的纯化后IMOs样品的流变性质由MARS 60型旋转式流变仪测定。参照徐炜[27]的相关方法和试验参数进行稳态剪切流变测定和动态黏弹性测定。
1.3 数据处理
所有试验均设置3组平行,数据用平均值±标准差表示,采用2021版Origin对树脂分离参数优化结果进行作图;N3000色谱工作站处理HPLC数据结果;2024版Excel软件制作洗脱曲线图。
2. 结果与分析
2.1 IMOs原料液组成分析
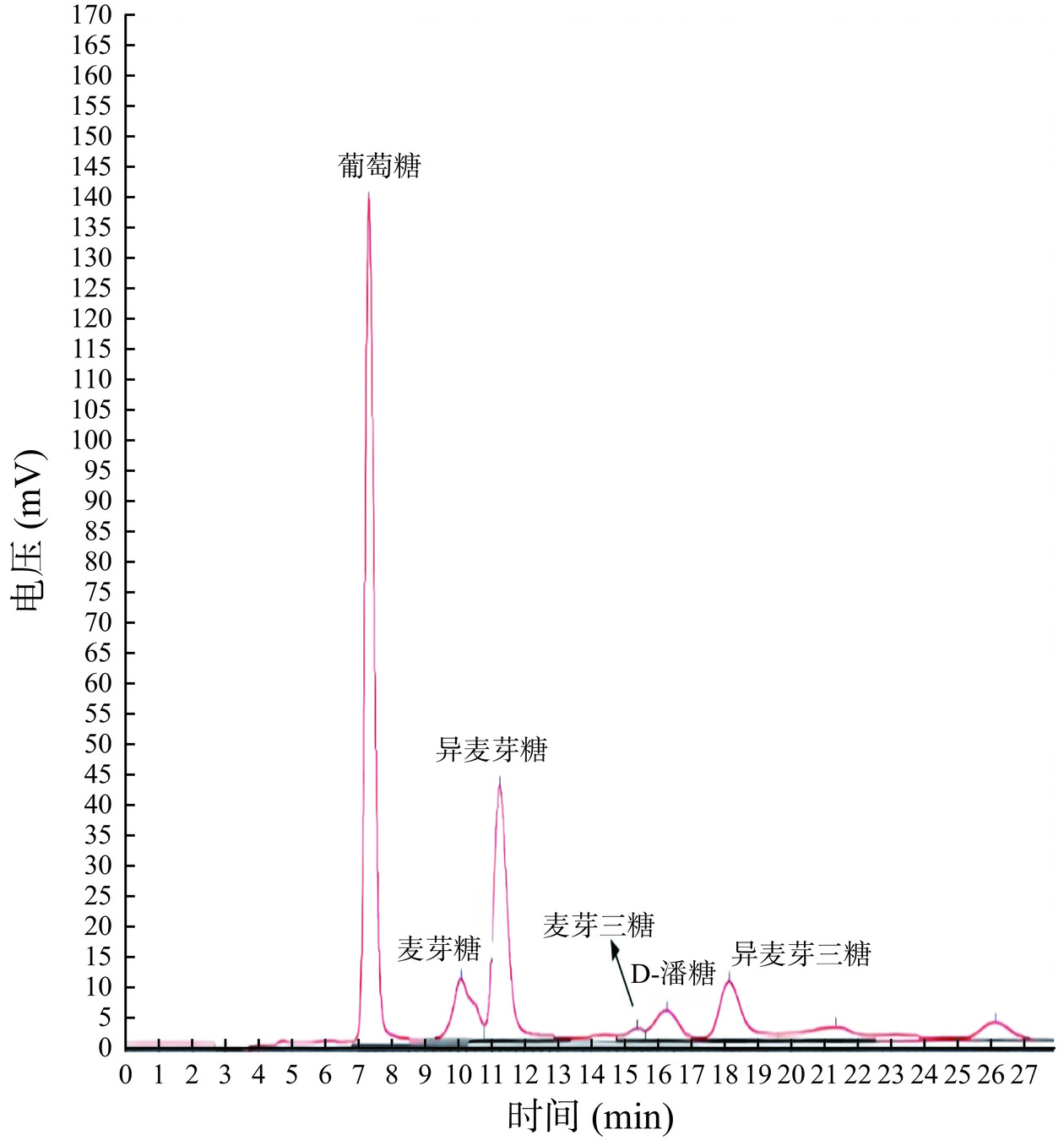
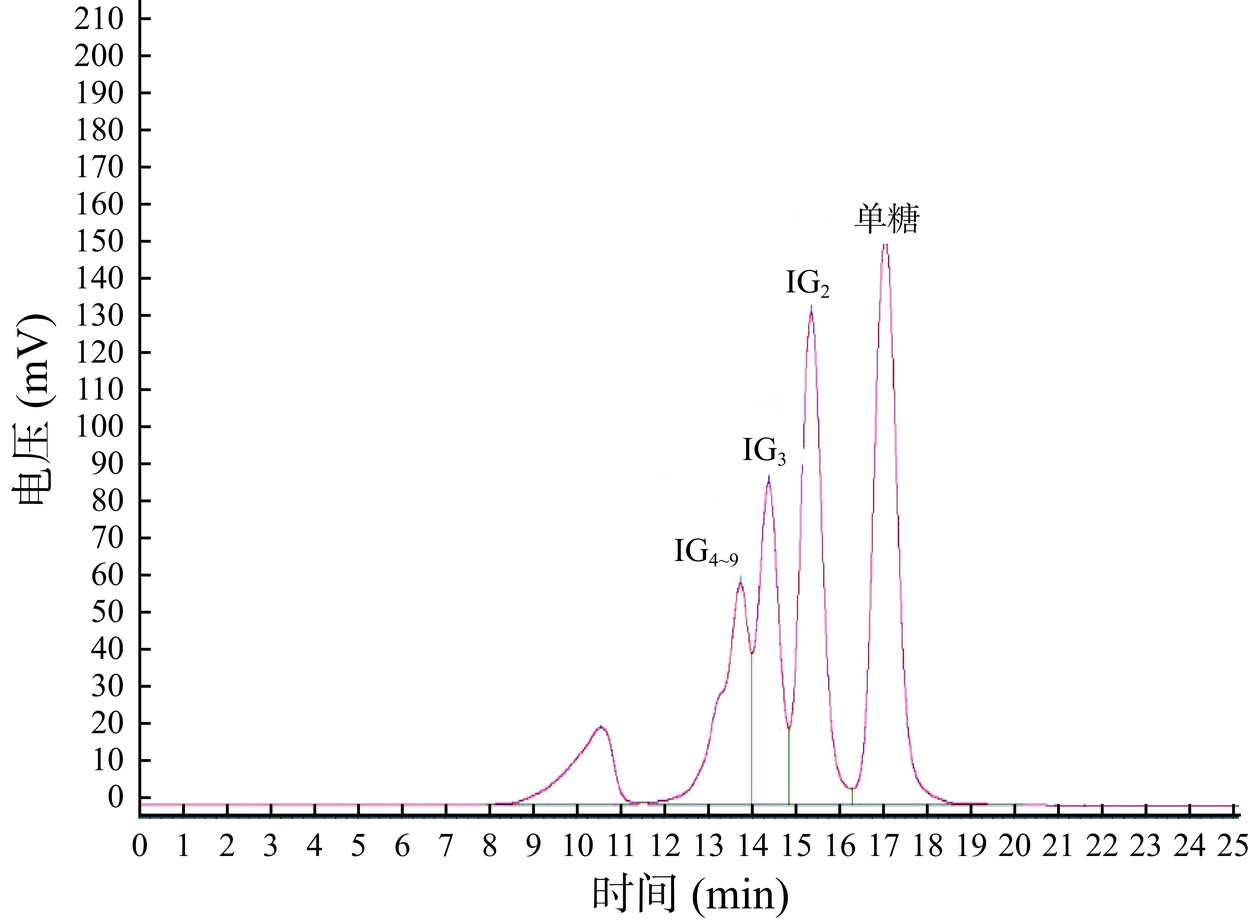
采用HPLC对原料液进行分析,结果见图2和图3。IMOs原料液氨基键合柱色谱图如图2所示。经与标准品逐一对比分析发现,各物质出峰顺序依次为葡萄糖(G)、麦芽糖(M2)、异麦芽糖(IG2)、麦芽三糖(M3)、潘糖(P)、异麦芽三糖(IG3),含量较高的组分为葡萄糖,其峰面积占比约为40.40%,异麦芽糖占比约为22.90%,之后依次为麦芽糖(4.20%)、异麦芽三糖(8.50%)、潘糖(6.50%)和麦芽三糖(1.10%)。低聚异麦芽糖样品经钙型阳离子交换色谱柱所得色谱图如图3所示,按照出峰顺序依次为IG4~9、IG3、IG2和单糖,其中含量较高的组分为单糖峰面积占比约38%,IG2占比约26%,之后分别为IG3和IG4~9。
2.2 不同阳离子树脂对IMOs原料液分离的影响
树脂上固定的阳离子形态对IMOs与单糖、双糖的分离具有决定性作用。表1的数据比较了不同阳离子树脂处理IMOs原料液的效果,结果显示,相比于Ca2+型和H+型树脂,K+型树脂的性能最佳,其葡萄糖和麦芽糖含量较低,同时经过单柱分离后的IMOs中的功能性三糖(IG2,P,IG3)总量达到38.96%。基于此,本研究选取K+型阳离子交换树脂作为SSMB色谱法分离IMOs的固定相。
表 1 不同阳离子树脂分离IMOs原料液组分含量Table 1. Raw material components of IMOs was separated by various cationic resins树脂类型 葡萄糖(G) 麦芽糖(M2) 异麦芽糖(IG2) 麦芽三糖(M3) 潘糖(P) 异麦芽三糖(IG3) 四糖及以上(IG4~IGn) Ca2+型树脂 6.21% 11.36% 13.95% 2.93% 10.26% 7.52% 47.77% K+型树脂 3.10% 8.96% 18.17% 3.25% 11.25% 9.54% 45.73% H+型树脂 8.05% 9.94% 11.21% 3.96% 7.75% 5.97% 53.12% 2.3 色谱评价试验结果分析
2.3.1 柱温对制备色谱分离度的影响
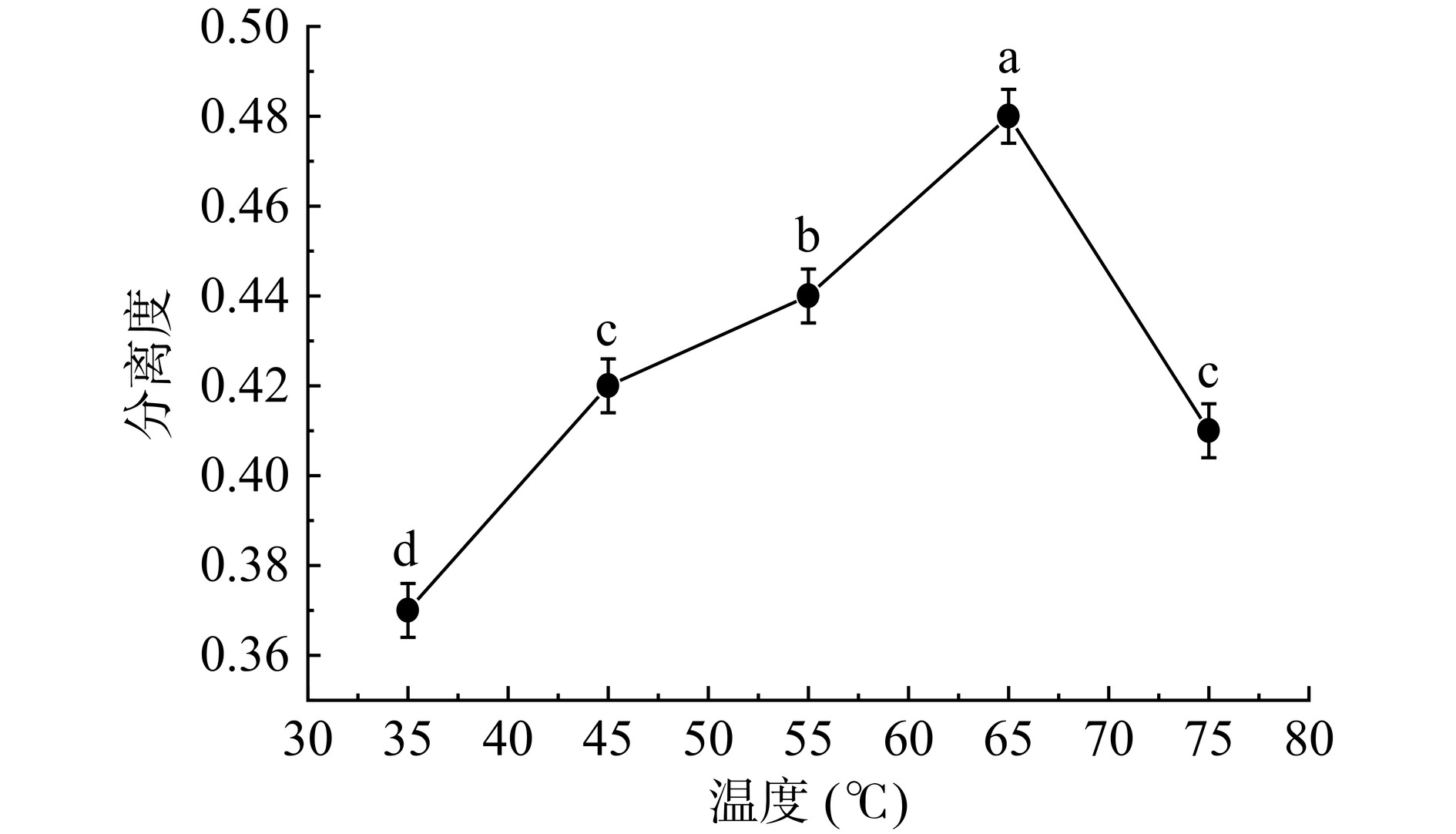
柱温对分离度的影响结果,如图4所示。试验柱温范围在35~65 ℃之间,随着柱温的升高,分离度呈现出上升趋势(P<0.05)。主要原因是在较高的温度下,根据热力学原理,糖溶液分子的运动活力增加,扩散速率也随之增加。而糖液的粘度和比重下降,使物料穿越树脂层的阻力减小,促进了物料分离。当温度达到65 ℃时,分离效果达到峰值。但是超过这个温度,分离度呈现出显著(P<0.05)的下降趋势。主要归因于过高的温度降低了吸附剂的选择性[28]。基于试验数据和实际操作考虑,最适宜的柱温条件为65 ℃。
2.3.2 进料浓度对制备色谱分离度的影响
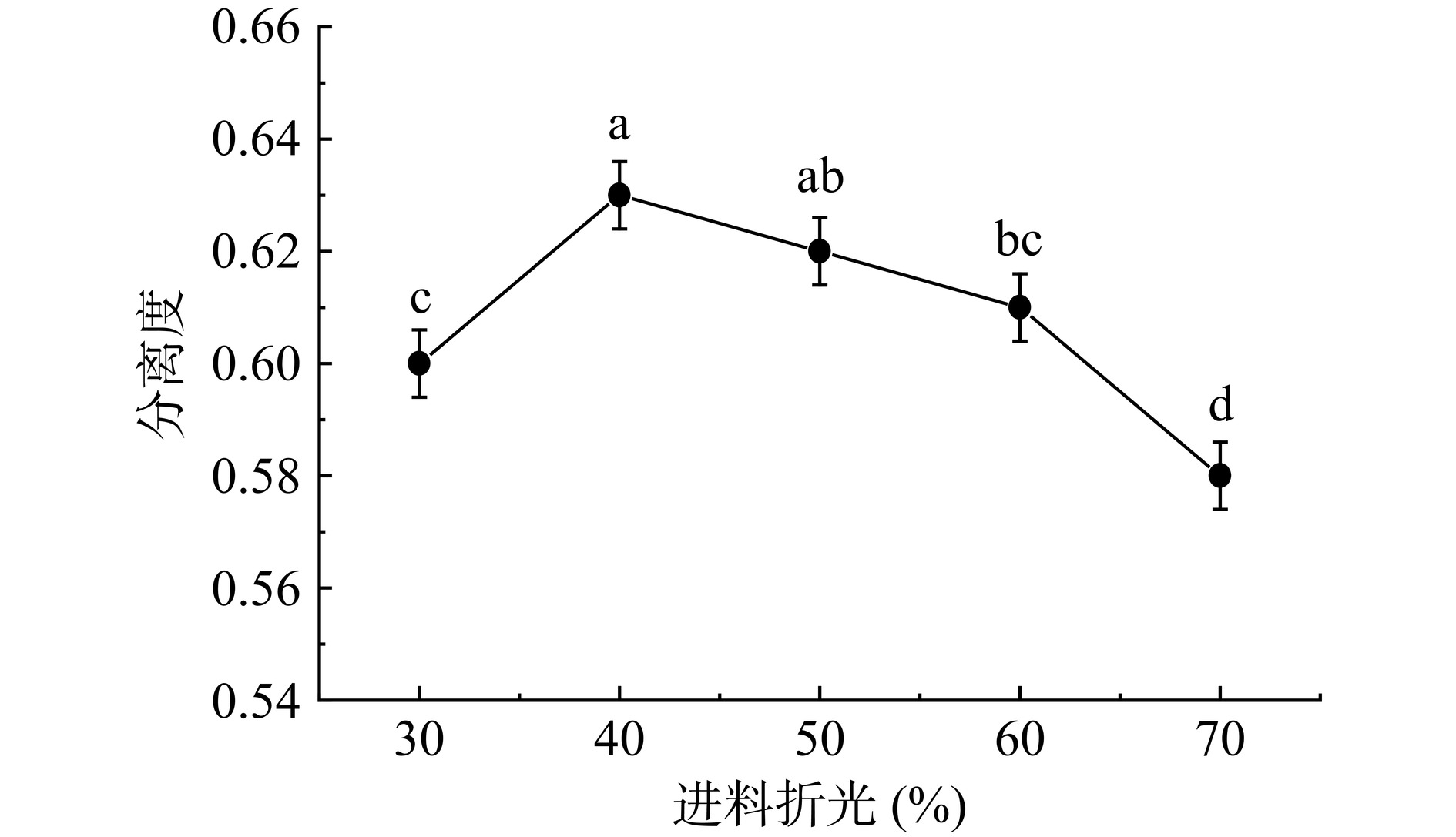
进料浓度对分离度的影响结果,如图5所示。糖的浓度主要是指干物质(固形物)含量,由折光表示。由图5可知,原料液的折光在40%~70%的动态范围内,对应的K+型树脂的分离度呈现出下降趋势。尤其折射率高于60%时,分离性能明显下降(P<0.05)。原因是随着浓度的增加,树脂中的水分减少,糖溶液的粘稠度增加,限制了糖分子穿透树脂层的速度,影响了分离效率。尽管在40%折射率时表现出较好的分离效果,但考虑到工业生产的实际需求,也为了提升生产效率,可以在保证可行性的前提下适当提高进料浓度。通常情况下,进料浓度增加会提高K+型树脂的选择性。而过高的糖液质量浓度,可能引入更多的竞争吸附杂质,削弱糖分子与树脂分子间的亲和力,影响K+型树脂对糖分子的有效吸附,从而降低IMOs的纯度。若糖液浓度超过树脂吸附的极限,糖液可能会提前流出,回收率会受到影响[29]。综上所述,最佳进料折光为60%。
2.3.3 进料量对制备色谱分离度的影响
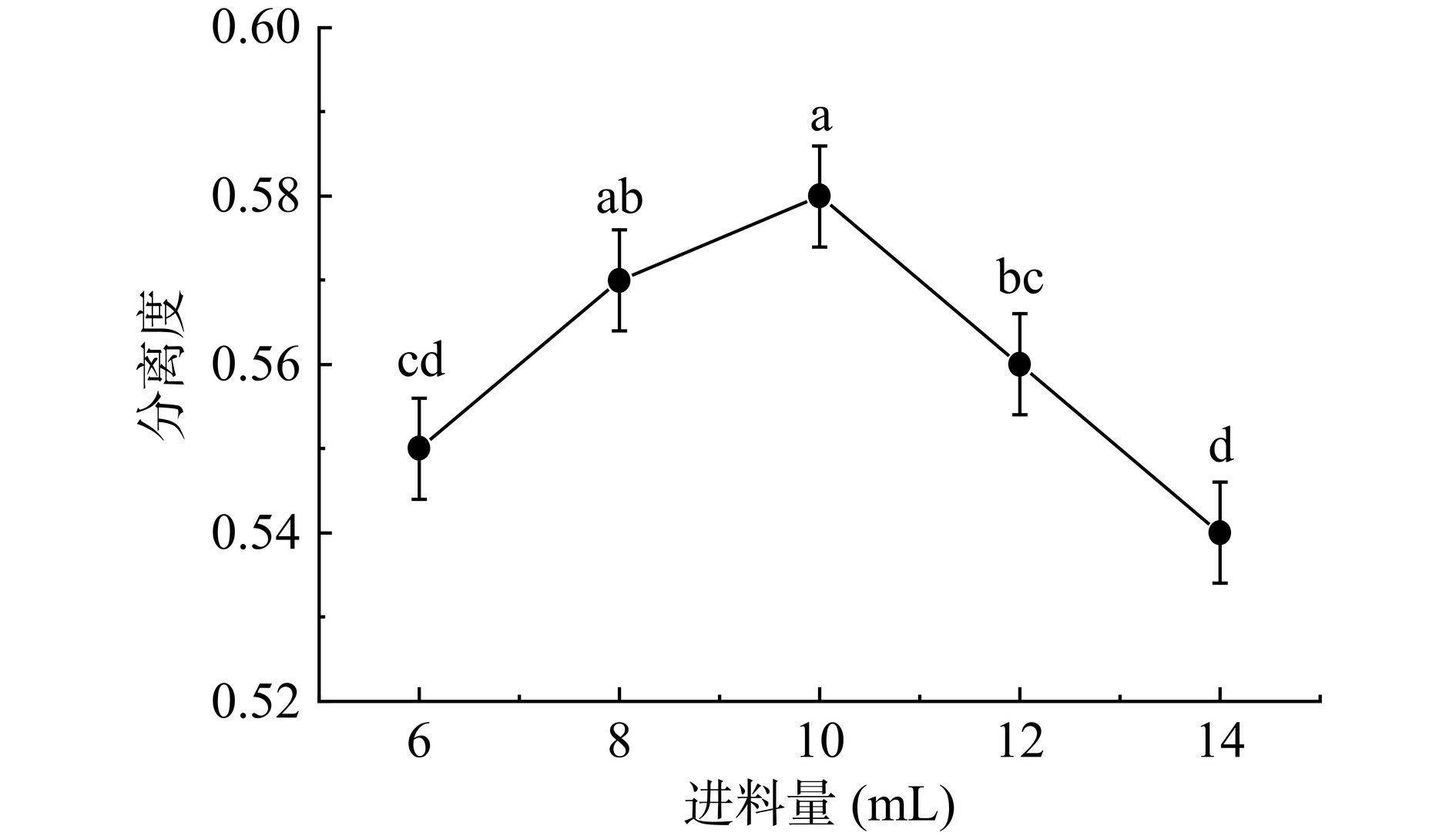
进料量对分离度的影响结果如图6所示。结果表明,当进料量增大时,糖液在K+型树脂中的分离程度也随之增大,当进料量为10 mL时,样品的分离程度最大,表明糖溶液中各成分的分离效率最高。而继续增大分离柱中的液体体积时分离度降低,原因是K+型树脂对糖液的吸收容量已接近饱和[30],过多的糖液小分子无法再被吸附而随着洗脱剂流出。这使得分离度和整体回收率均有降低的趋势。适量降低原料液用量对IMOs的分离更为有利,但具体的进料量仍要结合具体的工艺条件进行分析,在本次试验中,10 mL为最优进料量。
2.3.4 洗脱流速对制备色谱分离度的影响
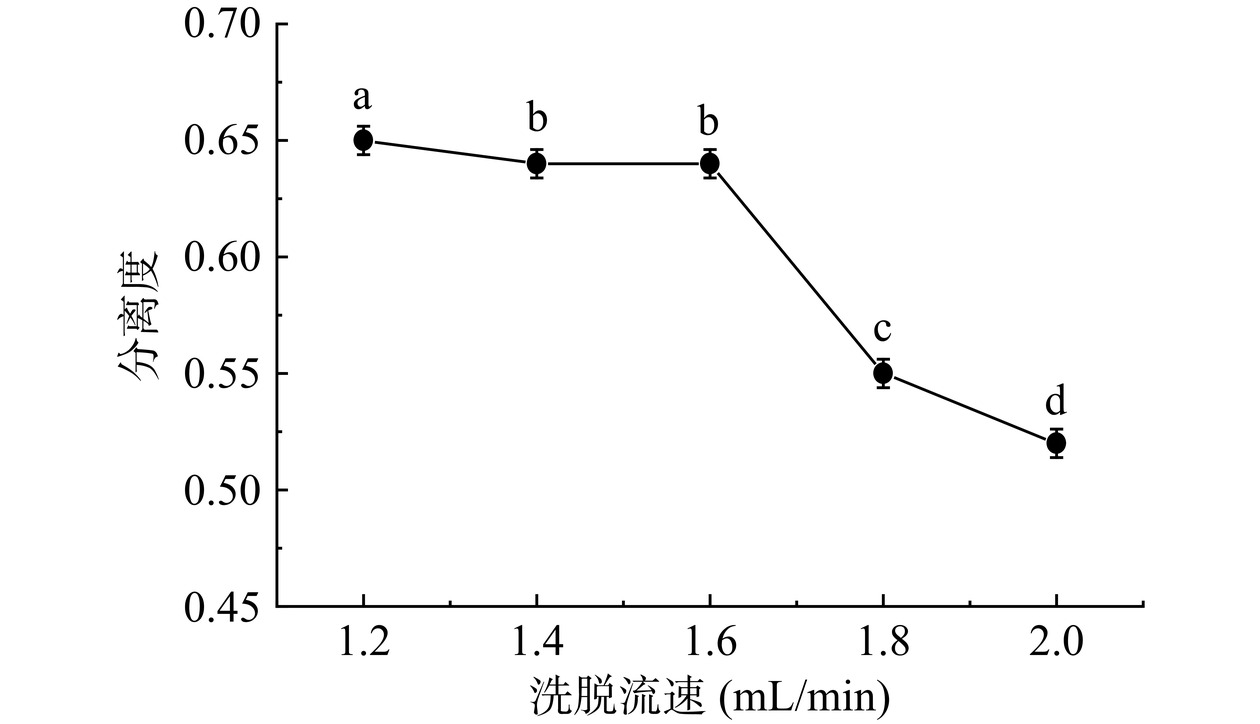
洗脱流速对分离度的影响结果如图7所示。当洗脱流速为1.2 mL/min时能实现最佳的分离效果,洗脱性能达到最优。尽管减缓流速有利于IMOs的分离,但过低的流速会导致洗脱时间变长,从而影响树脂的分离效率。在1.4~1.6 mL/min的流速范围内,流速变化对分离度的影响较小,且无差异(P>0.05)。适度提高流速利于除去原糖液中的葡萄糖和麦芽糖,提高IMOs的纯度。但流速超过1.6 mL/min,分离度急剧下降,过快的流速会减薄树脂周围的静态液膜,减小糖分子穿越树脂层的扩散阻力,同时也加大了通过柱体的压力损耗,影响糖液分离效果[31]。因此基于试验数据和具体条件,最佳洗脱流速设定在1.6 mL/min。
2.3.5 洗脱曲线的绘制
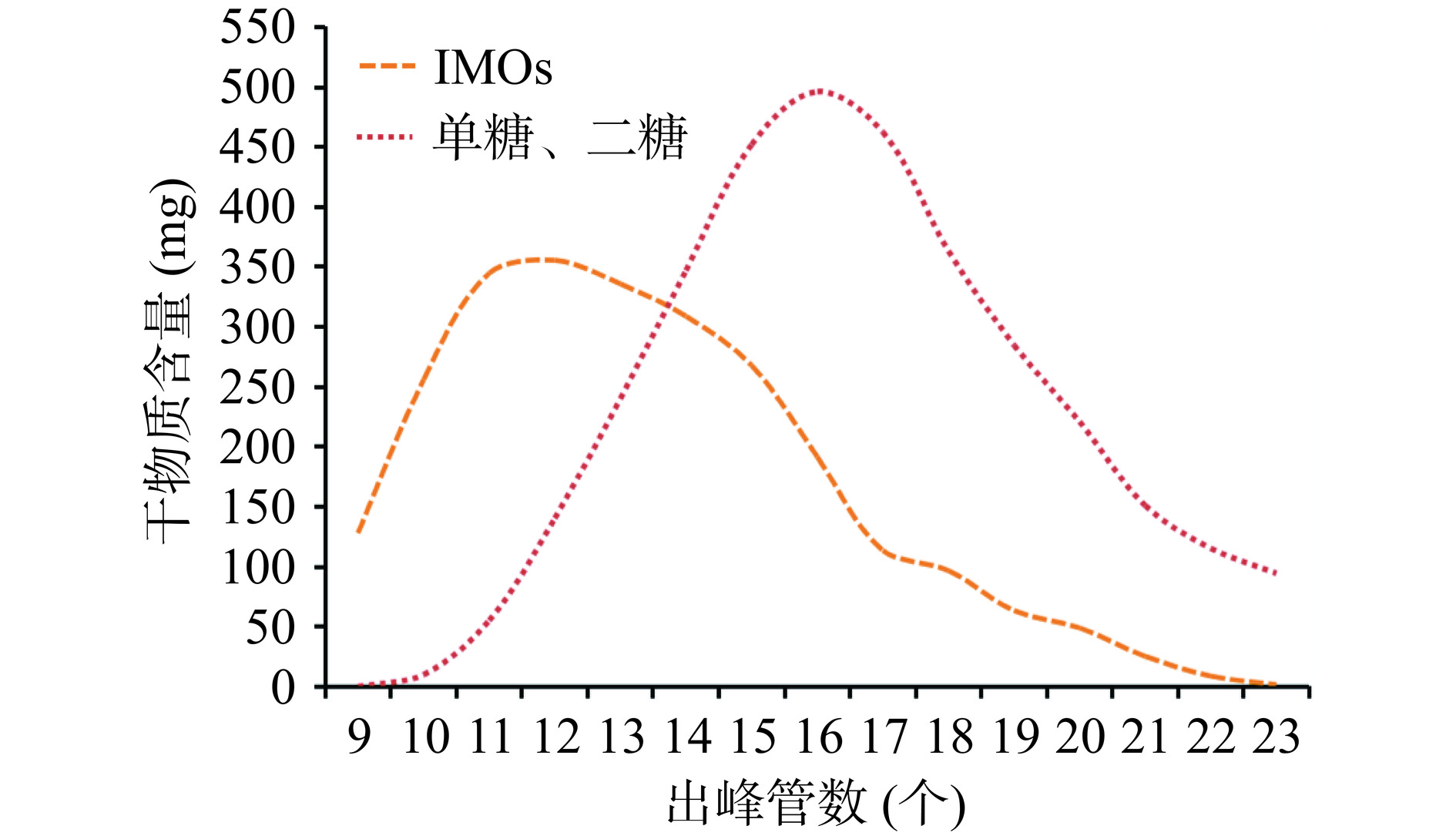
在基于单因素的实验参数设计条件下,进行了一系列试验来研究对IMOs原料液的分离度的影响。试验选取了特定参数:进料量为10 mL,进样流速为1.6 mL/min,柱温为65 ℃,进料折光率为60%。流出液样本每2 min收集一次,然后采用HPLC法测定样品中IMOs的纯度。根据分离度,绘制了IMOs的洗脱曲线。详细的试验数据见表2和图8。
表 2 K+型树脂分离IMOs的单柱试验Table 2. Single column evaluation of IMOs separation with potassium type resin管数 流出体积(mL) 柱温(℃) 柱压(MPa) 折光率(%) IMOs纯度(%) 杂糖纯度(%) IMOs干物质(mg) 杂糖干物质(mg) 9 28.80 65.00 0.20 5.00 100.00 0.00 128.00 0.00 10 32.00 65.00 0.20 8.78 97.14 2.86 256.00 9.93 11 35.20 65.00 0.20 11.28 91.75 8.25 344.88 55.12 12 38.40 65.00 0.20 12.25 88.01 11.99 355.58 140.42 13 41.60 65.00 0.20 13.50 71.06 28.94 335.87 240.13 14 44.80 65.00 0.20 14.75 62.01 37.99 308.91 347.09 15 48.00 65.00 0.20 16.25 48.97 51.03 267.84 452.16 16 51.20 65.00 0.20 17.38 38.11 61.89 191.61 496.39 17 54.40 65.00 0.20 18.75 43.53 56.47 113.47 462.53 18 57.60 65.00 0.20 20.25 29.98 70.02 96.72 363.28 19 60.80 65.00 0.20 20.25 25.65 74.35 63.30 284.70 20 64.00 65.00 0.20 18.75 18.51 81.49 48.96 221.04 21 67.20 65.00 0.20 15.75 18.35 81.65 25.13 150.87 22 70.40 65.00 0.20 11.75 13.27 86.73 8.76 115.24 23 73.60 65.00 0.20 7.50 12.08 87.92 1.47 94.53 由于所用的SSMB分离纯化设备属于中试级别,启动后需要连续24 h运行。不同的分离介质和样本之间会有较明显的分离参数差异,因此需要实时调整优化过程。选择适合的分离树脂是分离的关键步骤,需要在SSMB设备启动前完成树脂的筛选。单柱分离试验是评估分离介质对目标化合物适用性的有效方法[32]。表2和图8中的数据表明,IMOs与杂糖的保留时间存在差异,计算出分离度为0.89。尽管未实现完全分离,如果通过延长分离距离,增加运行时间和洗脱液剂的量,并通过后续的优化试验,则可提高分离效果。据此,可判断,K+型阳离子树脂在单糖、双糖与IMOs的分离过程中表现出较好的分离能力,适合作为SSMB系统中用于高纯度IMOs分离的树脂。
2.4 SSMB分离纯化IMOs工艺参数优化
根据表3的数据显示,在保持进料量恒定的前提下,第3和第4组的水使用量明显少于第5、6和第7组。第1和第2组的用水量虽然最低,但这两组处理的原料量相对较少。综合考虑进料量、料水比、目标产物出料口折光等多个关键指标后,并与其余6组相比第4试验组表现出最优的效果。因此,确定最佳的工艺参数为:进料量455 mL/h、进水量682 mL/h,此时,目标产物在出料口处的折光率为18.70%,纯度高达92.80%,并且回收率达到了83.20%。
表 3 SSMB分离操作条件和试验结果Table 3. Operation conditions and test results on SSMB序号 进料流量(mL·h−1) 进水流量(mL·h−1) 循环流量(mL·h−1) 进料流速(mL·min−1) 切换时间(s) 进水流速(mL·min−1) 折光率(%) IMOs纯度(%) IMOs收率(%) 1 273 546 364 29 1333 27.3 15.4 92.5 82.7 2 273 546 345.8 27.1 1279 26.4 17.3 90.1 85.4 3 455 682 364 37.4 1038 29.6 20.4 90.2 85.5 4 455 682 409.5 40.2 1246 31.8 18.7 92.8 83.2 5 455 910 382.2 34.9 1243 34.3 16.1 91.3 83.5 6 455 910 345.8 32.9 1078 32.4 18.7 89.7 86.8 7 455 910 409.5 36.5 1282 35.6 17.5 90.8 85.2 2.5 SSMB纯化IMOs高效液相色谱分析图谱
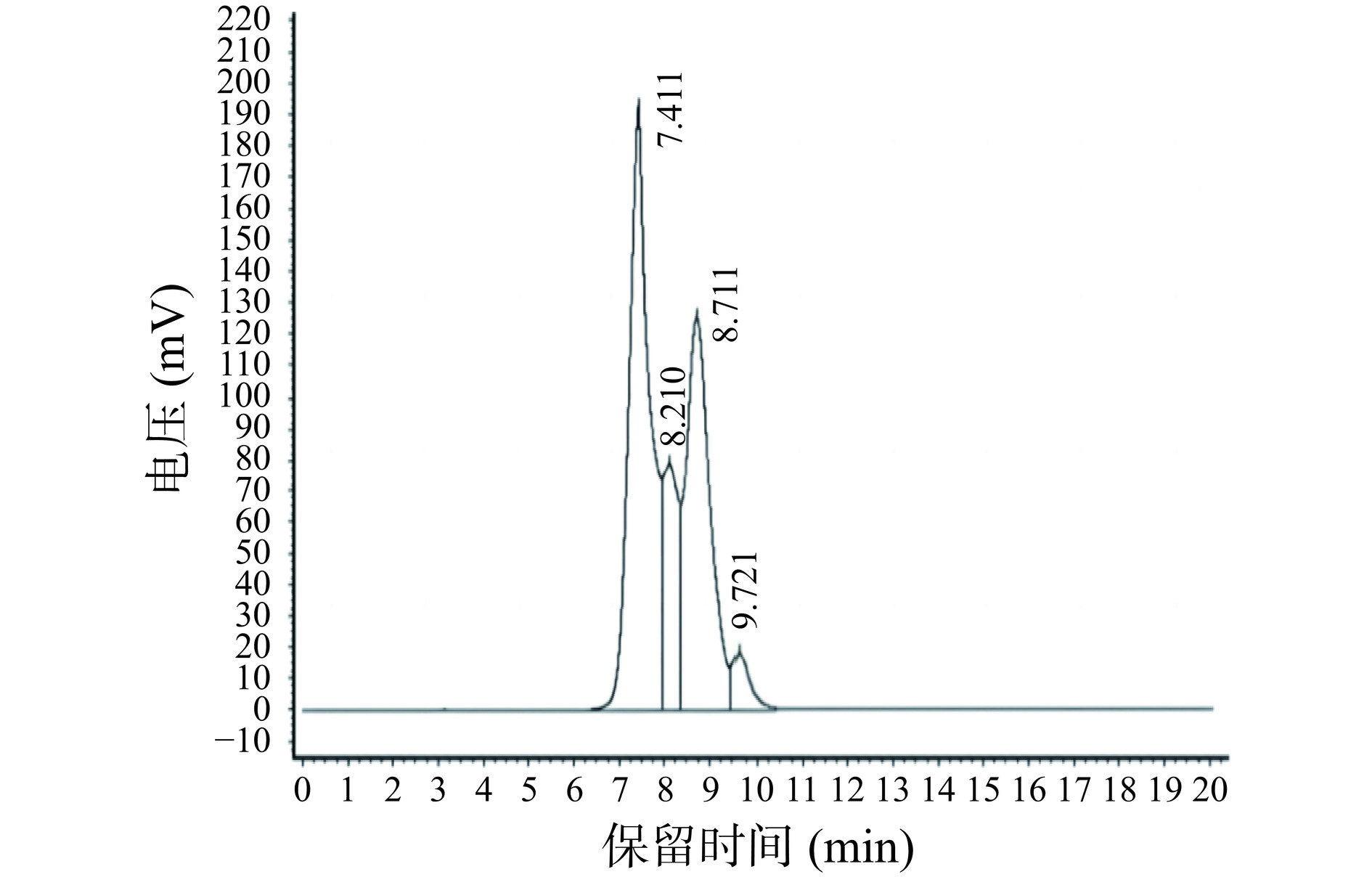
经SSMB纯化后IMOs组分的液相色谱图和组分表,见图9和表4。根据图9和数据表4可知IMOs的各组分的保留时间分别为7.411、8.210和8.711 min。之后出现的是单糖(如葡萄糖)和二糖的峰。峰面积直接反映了各组分的纯度,结果表明纯化后,IMOs纯度明显提高,单糖和二糖含量明显减少。
表 4 IMOs组分液相色谱分析Table 4. HPLC analysis of IMOs component出峰次序 保留时间(min) 含量(%) 组分名 1 7.411 41.719 IMOs 2 8.210 18.935 3 8.711 31.992 4 9.721 7.354 单糖、二糖 2.6 IMOs理化性质
2.6.1 吸湿性和保湿性测定
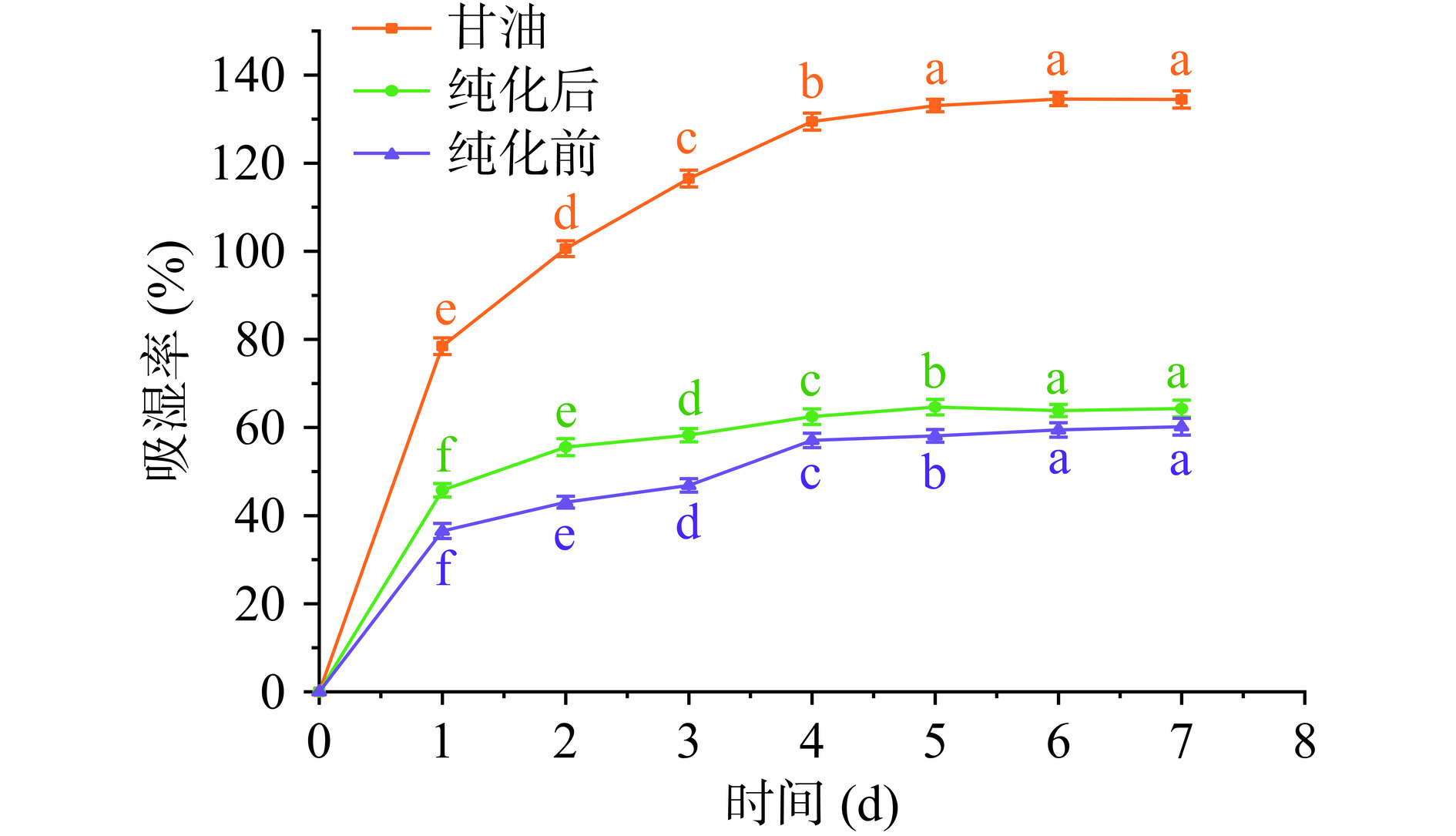
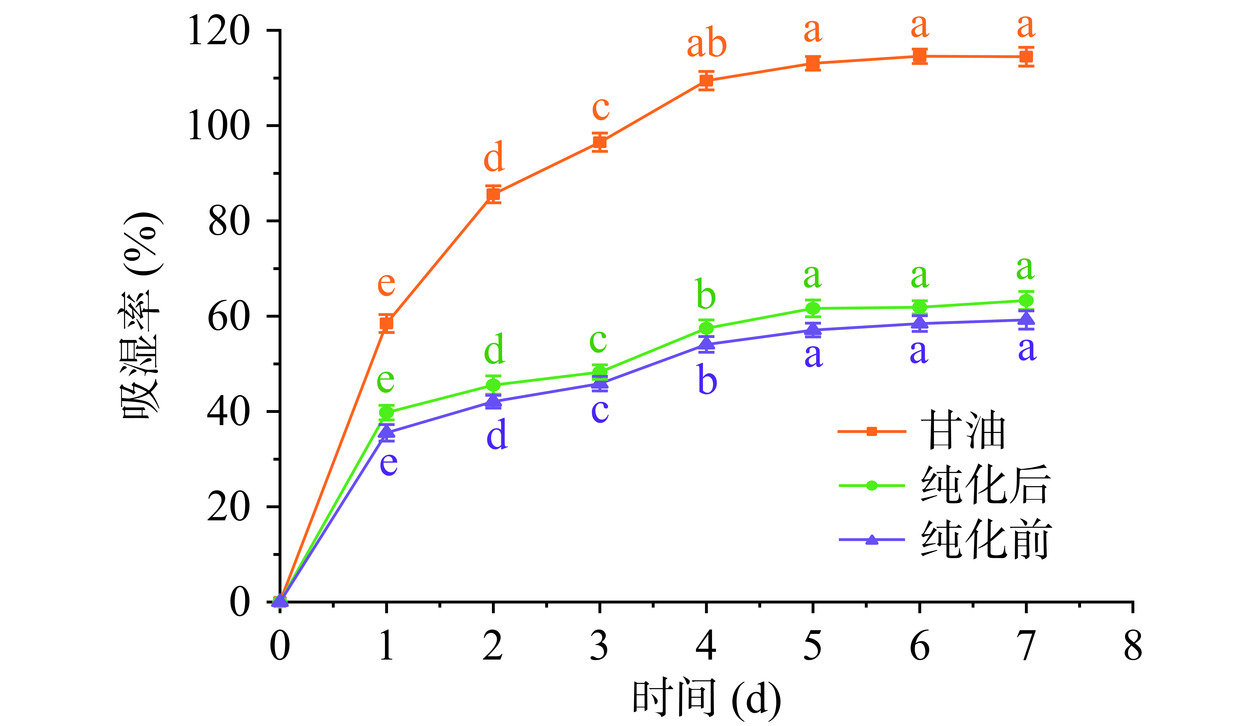
纯化前后的IMOs吸湿性和保湿性变化结果如图10~图13所示。如图10所示,两种糖浆的吸水量随时间的延长呈现出同步增长的趋势。初始48 h内吸湿率增加的幅度较快,超过48 h后甘油的吸湿率继续增加,但增加速率也逐渐变缓。相较于未纯化的IMOs,纯化后的IMOs糖浆吸水性更高。第5 d之后,纯化前后IMOs糖浆的吸湿率基本趋于稳定状态,含水量分别达到58.10%、61.63%。通常,糖类化合物的吸湿性顺序为G3>G4>G5=G7>G1>G2,其中麦芽三糖的吸湿性最大[33],因此麦芽三糖及麦芽四糖含量相对较高的纯化后IMOs糖浆的吸湿率则要略高于纯化前的IMOs糖浆的吸湿率。如图11所示,在相对湿度为81%时保存到第5 d后,纯化前后IMOs糖浆的吸水量基本达到平衡状态,含水量分别达到67.10%、61.63%。
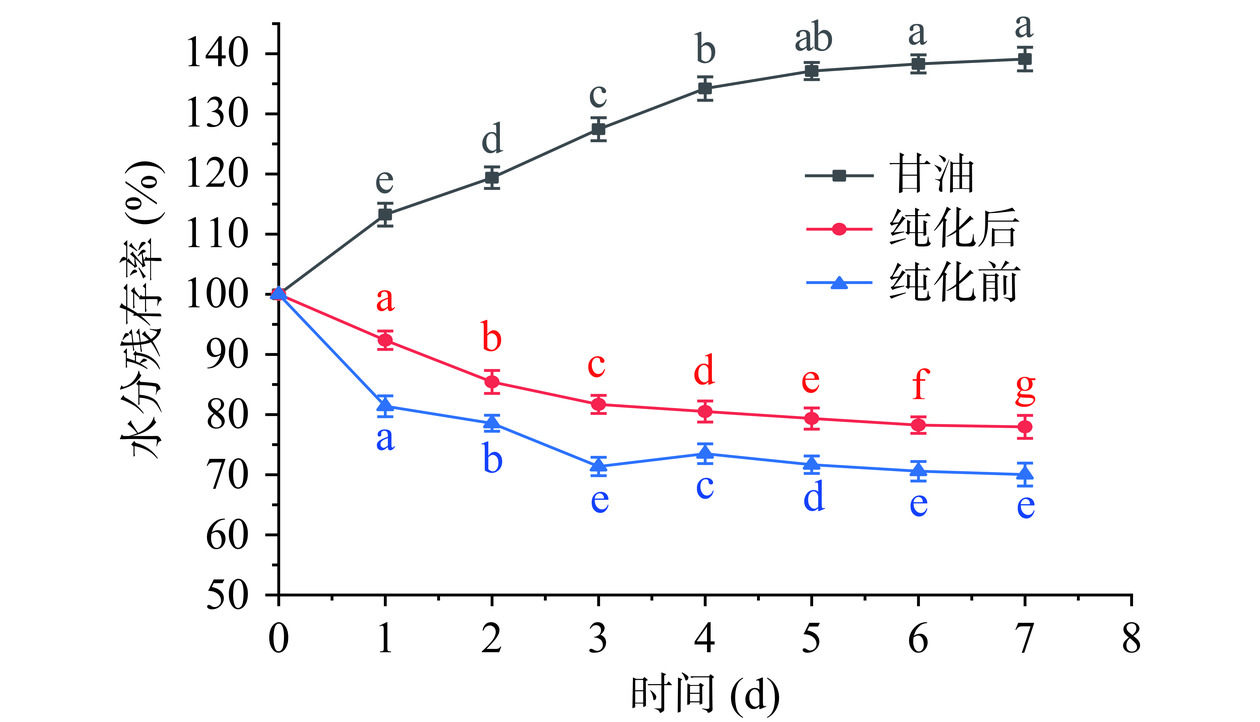
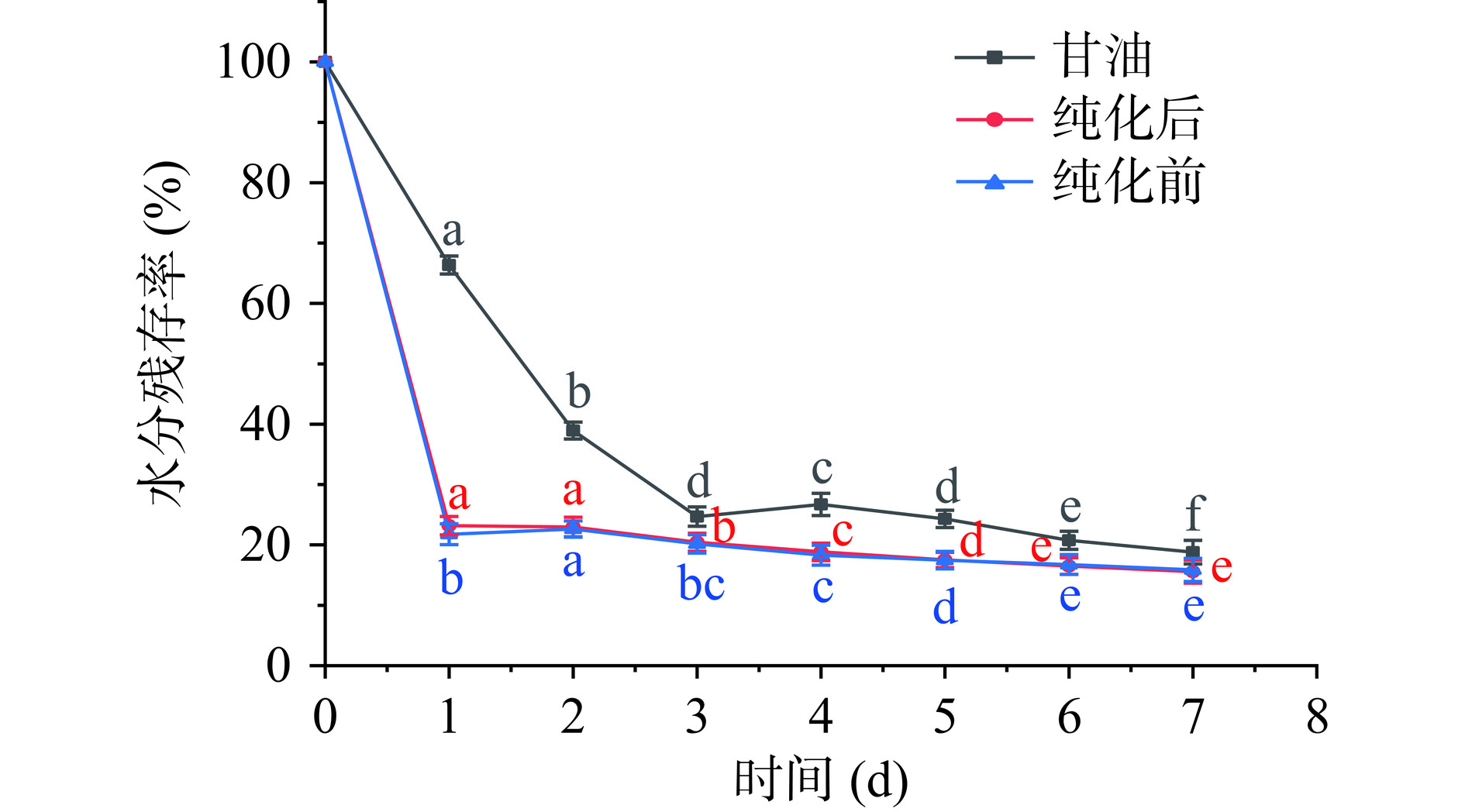
由图13可知,在相对湿度0的环境下甘油和纯化前后的IMOs保存24 h后均极显著的失去水分(P<0.01),而纯化前后的IMOs在保存第2 d后水分残存率保持不变,且两者之间的差异不显著(P>0.05)。到第7 d时,纯化前后的IMOs水分残存率分别为15.87%、15.56%,无显著性差异(P>0.05)。图12所示,在43%相对湿度下随着保存时间的延长,两种糖浆的水分含量均呈现出递减趋势。而纯化后的IMOs其水分流失速率缓慢。在第5 d后,纯化前IMOs糖浆的含水量基本保持稳定,在第7 d时的含水量为70.03%,而纯化后的IMOs糖浆此时含水量为77.96%。这一差异可能归因于麦芽低聚糖(G3-G7)的良好保湿性[34],纯化前后IMOs的成分组成含量的变化可能是影响吸湿性和保湿性的关键因素。
2.6.2 表面形态观察
纯化前后IMOs扫面电镜观察结果如图14所示。由图14可知,纯化前IMOs样品的颗粒状较多且表面粗糙有裂缝、质地坚硬。纯化后的IMOs表面褶皱较多,表面积较原制备的IMOs样品也有所增加。而纯化前后的IMOs的表面形态结构可能对其吸湿性和保湿性也有一定影响。
2.6.3 热稳定性分析
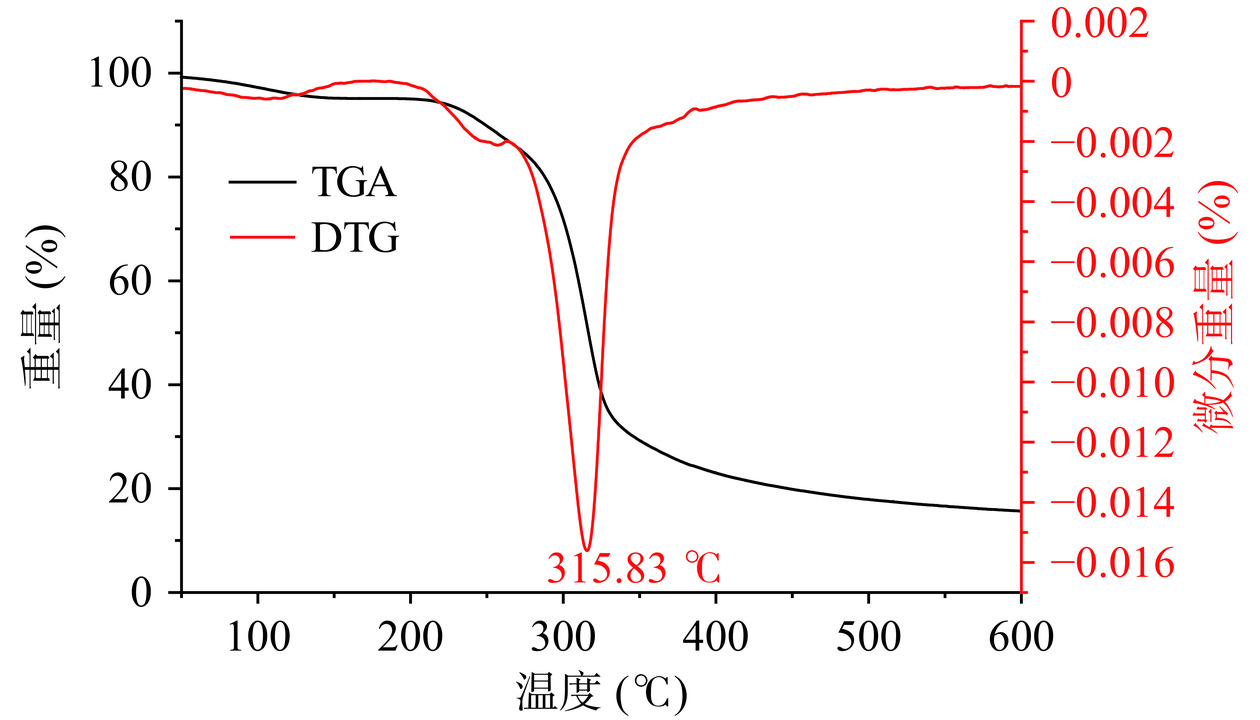
纯化后IMOs的TGA曲线如图15所示,图中也显示了相应的微分热重DTG曲线。TGA结果显示,在25~600 ℃范围内,IMOs的重量变化主要分为三个阶段,IMOs的最大重量损失发生在第二阶段。降解的第一阶段,即起始温度至200 ℃范围内,由于IMOs自身自由水和结合水的蒸发,其总的水分含量减少,导致其重量损失了初始重量的8.36%。当温度升高到352.5 ℃,IMOs的重量急剧减少,大约损耗了初始重量的71.11%。DTG曲线在质量损失的第二阶段呈现出一个峰,测得IMOs的分解温度为315.83 ℃。可以推断,此过程,发生了强烈的热降解反应,如糖分子内的C-O键、C-C键等关键化学键发生断裂,转化成了一氧化碳(CO),二氧化碳(CO2)和水等[35]。随着温度升高至500 ℃,IMOs的重量损失速度呈现出减小的趋势,大约有4.87%的初始重量在这一阶段损失。这一阶段的质量损失可能是由于有机物氧化造成的[35]。当温度高于500 ℃,大约保留有15.66%的IMOs样品重量。热力学性质的研究表明,IMOs的化学结构在352.5 ℃以下是较稳定的。
2.6.4 贮藏稳定性测定
2.6.4.1 pH稳定性
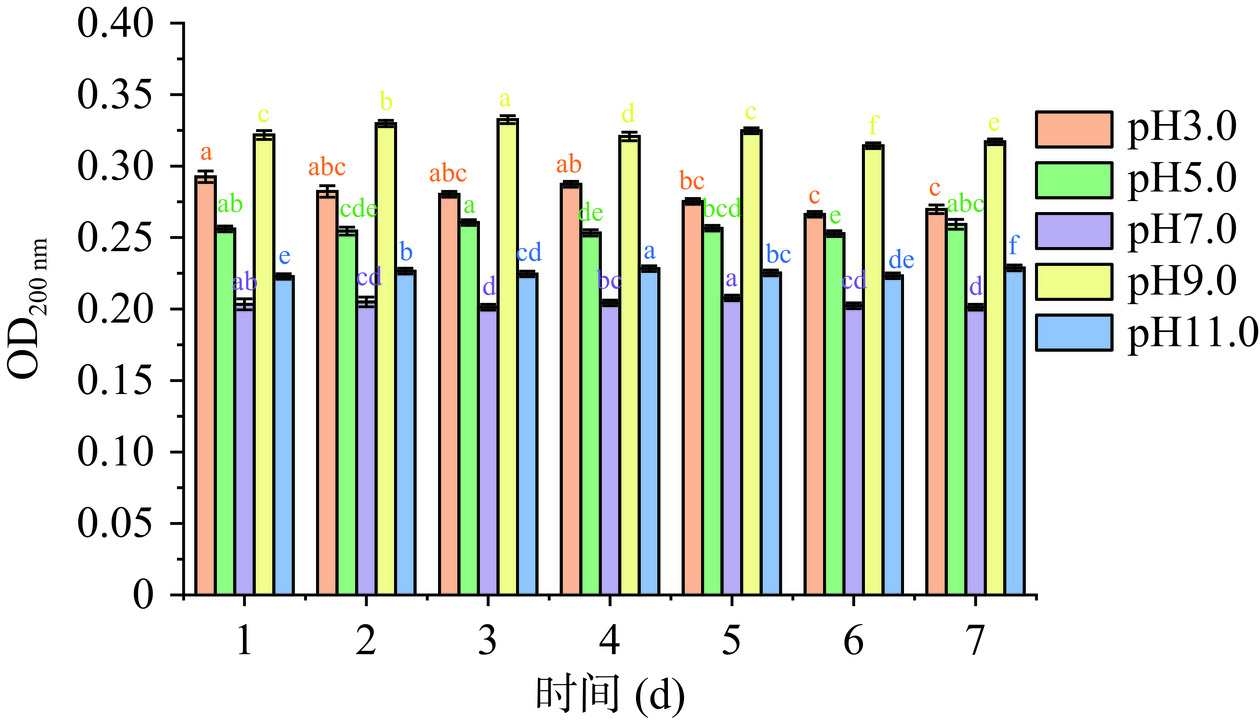
纯化后的IMOs在不同pH条件下的贮存稳定性测定结果如图16所示。由图16可以看出,纯化后的IMOs溶液在4 ℃贮存期间,IMOs溶液的吸光值变化幅度小,且在强酸和强碱性条件下稳定性均较好。而IMOs较高的pH稳定性可能归因于其有着比单糖和二糖较高的分子量和聚合度以及α-(1,6)糖苷键。
2.6.4.2 温度稳定性
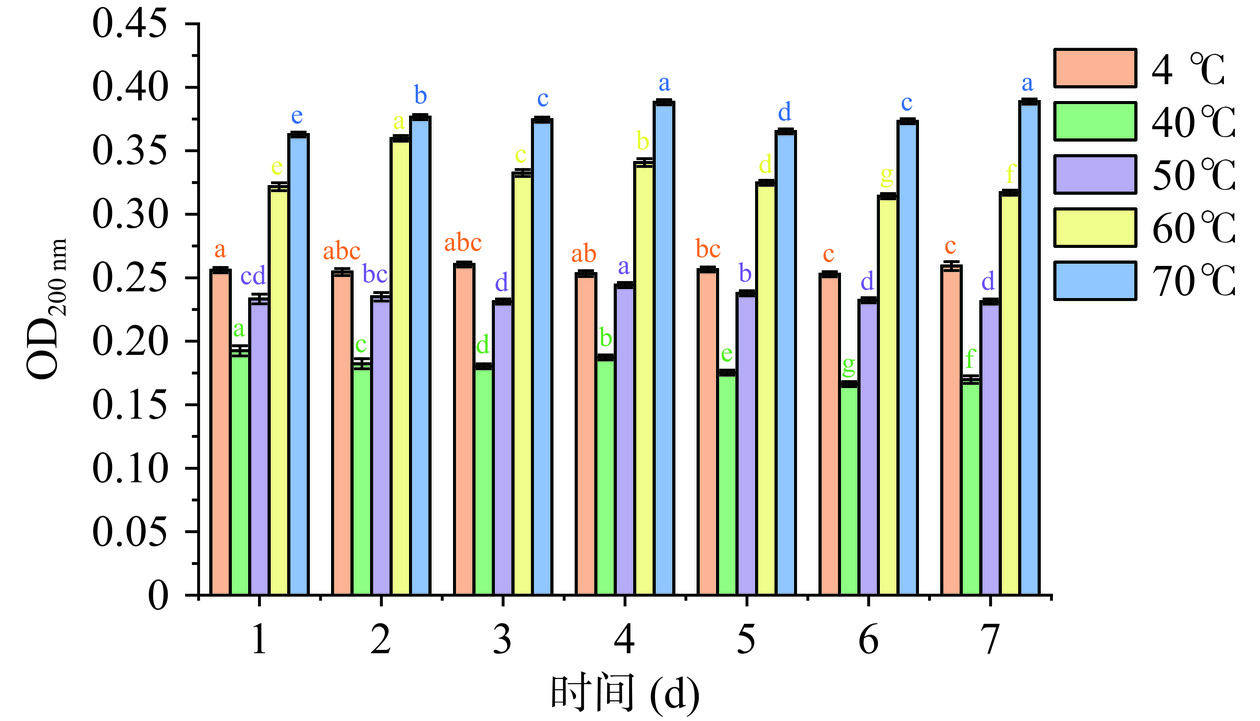
纯化后的IMOs在不同温度条件下的贮存稳定性测定结果如图17所示。由图可知,在4~70 ℃的温度范围内,纯化后的IMOs溶液在200 nm处的吸光度变化幅度不大。说明在此温度范围内,纯化后的IMOs的稳定性较好,可以长时间贮存。
2.6.5 褐变度测定
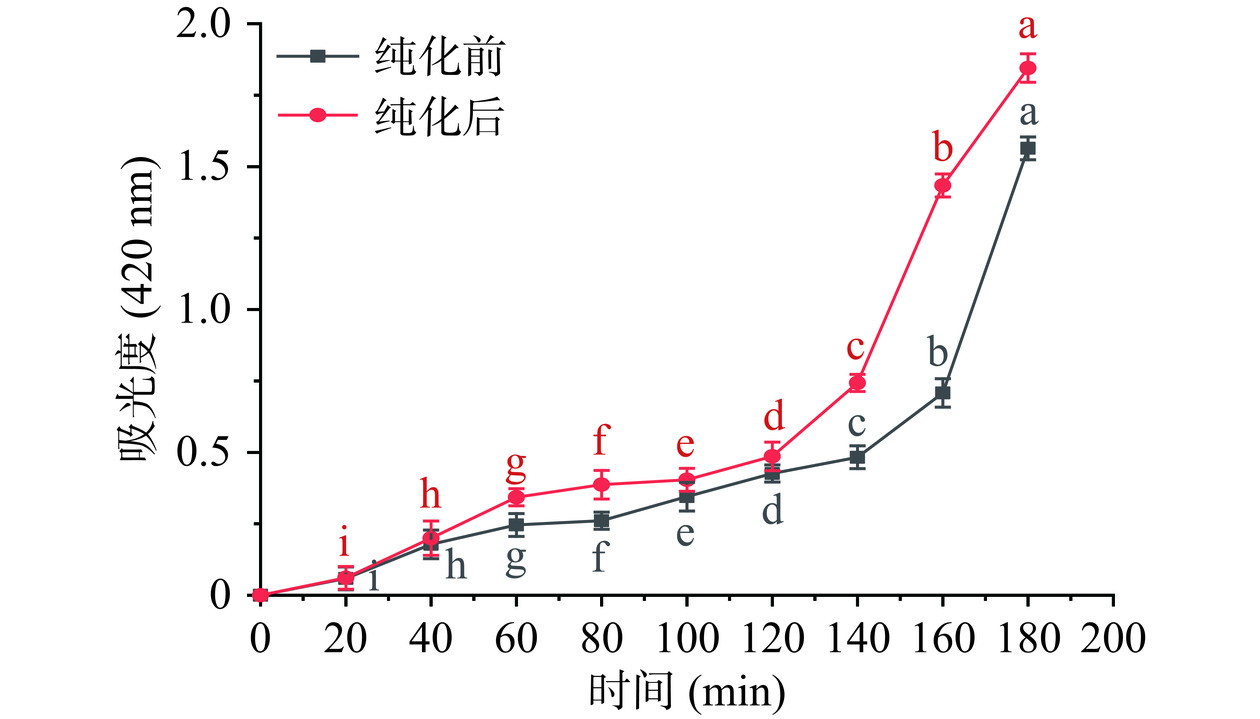
纯化前后IMOs的褐变反应的吸光值与加热时间关系的变化曲线以及褐变程度如图18和图19所示。由图18可知,在加热40 min内,纯化前后的IMOs糖浆的褐变反应吸光值显示出相似的趋势。而随加热时间的延长,纯化前IMOs的吸光值低于纯化后IMOs的吸光值,特别是在160 min时吸光值差异极显著(P<0.01)。主要是由于纯化前后IMOs糖浆中的葡萄糖和麦芽糖的含量不同,纯化后糖浆中的葡萄糖含量相对较少,而麦芽糖含量相对较高。由图19可知,随着反应时间的延长两种IMOs糖浆的褐变程度不断加深,反应液颜色也不断变深。
2.6.6 傅里叶转换红外光谱分析
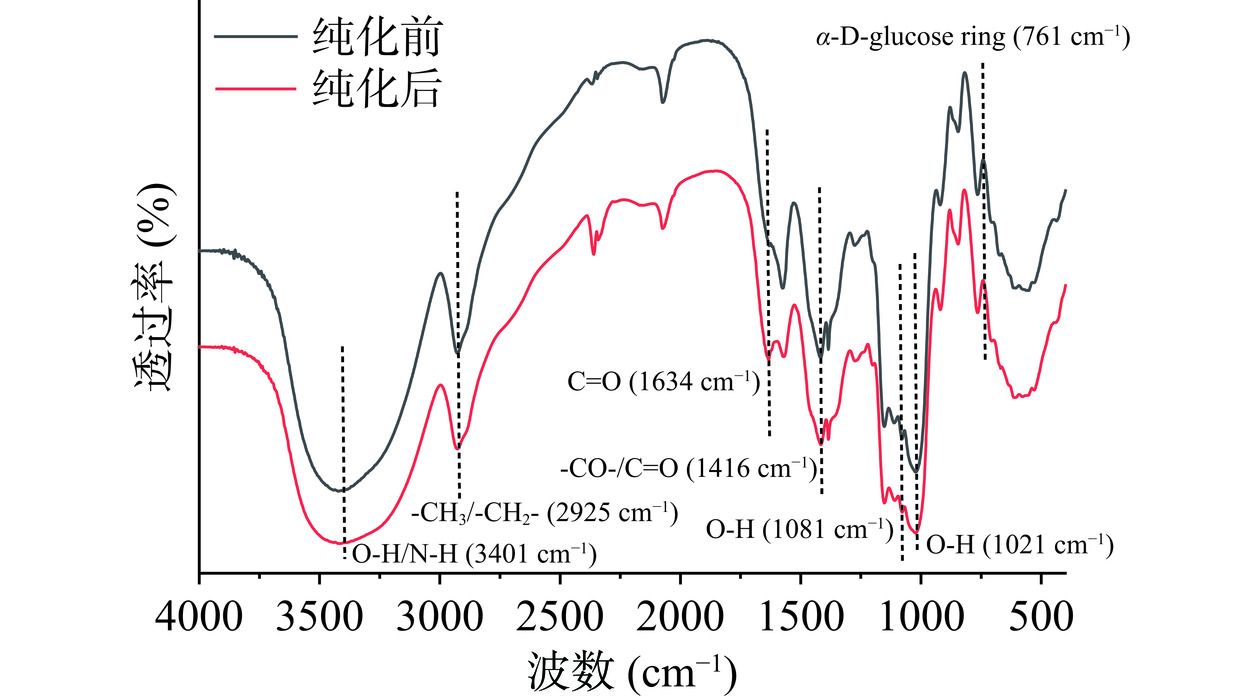
IMOs纯化前后的红外光谱图如图20所示。与目前已确定的市售的90型IMOs特征吸收峰进行比对[36],结果相似。如3401 cm−1处宽峰是由O-H伸缩振动或N-H伸缩振动引起的,2925 cm−1处的尖峰则是由烷烃的C-H伸缩振动导致,也是糖类的特征峰,表明低聚糖中含有-CH2-基团。1634 cm−1附近的吸收峰为一级氨基和二级氨基N-H的变角振动或-C=O的非对称伸缩振动峰,表明有蛋白质成分存在。-COOH的C-O伸缩振动引起的1416 cm−1处有吸收峰,-COO的C=O对称伸缩振动引起的1350 cm−1吸收峰和-COOH的O-H变角振动引起的1250 cm−1吸收峰表明IMOs中含有-COOH基团。1040 cm−1处的吸收峰为一级醇羟基的变角振动峰。1400~1160 cm−1处的吸收峰是C-H键的变角振动,它与C-H的伸缩振动构成了糖环的特征吸收,1160~1040 cm−1间的吸收峰证明了吡喃糖糖苷的存在。同样,在1000~800 cm−1出现的诸多尖峰,也是碳水化合物的典型红外吸收峰[37]。840 cm−1和760 cm−1左右为α型糖苷键和α-D-葡萄糖环的吸收峰。
2.6.7 结晶度分析
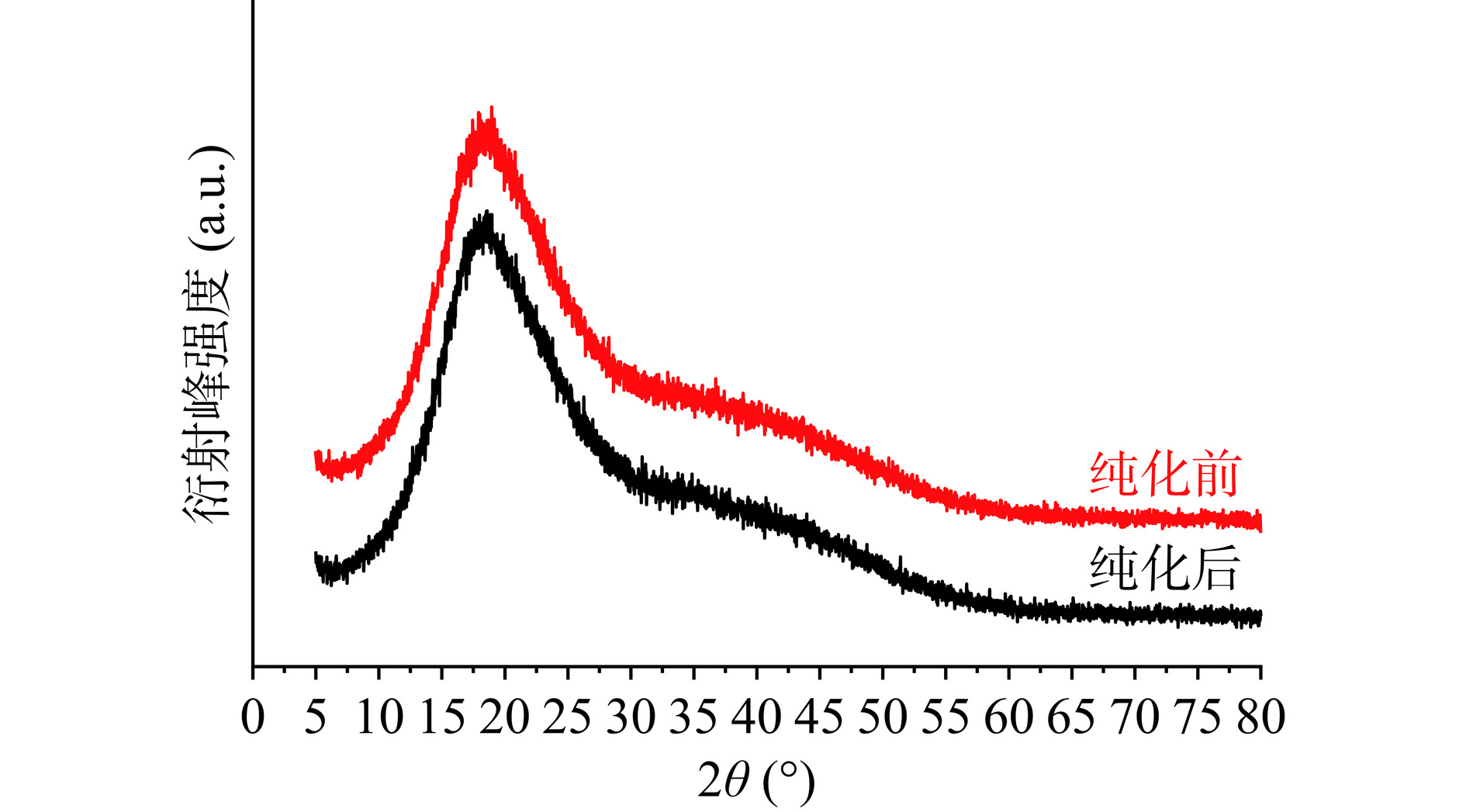
IMOs纯化前后的XRD谱图如图21所示。纯化前后的IMOs在15°~55°(2θ)内出峰的衍射角度分别为18.83°(2θ)和18.60°(2θ),是V型结晶峰[38]。这一现象表明,虽然在纯化前后,IMOs的衍射特性表现出相似性,然而纯化前的IMOs显示出稍高的结晶性。有研究者曾提出,支链的含量可能与相对分子间结晶度呈正相关。据此推断,试验中纯化前的IMOs样本表现出较高结晶度,可能是由于其内部含有一定的支链结构。而纯化后的IMOs几乎不含有支链或其他杂质,而这很有可能是导致两者出现结晶域差异的重要原因。
2.6.8 流变特性分析
2.6.8.1 不同浓度IMOs溶液的静态流变曲线
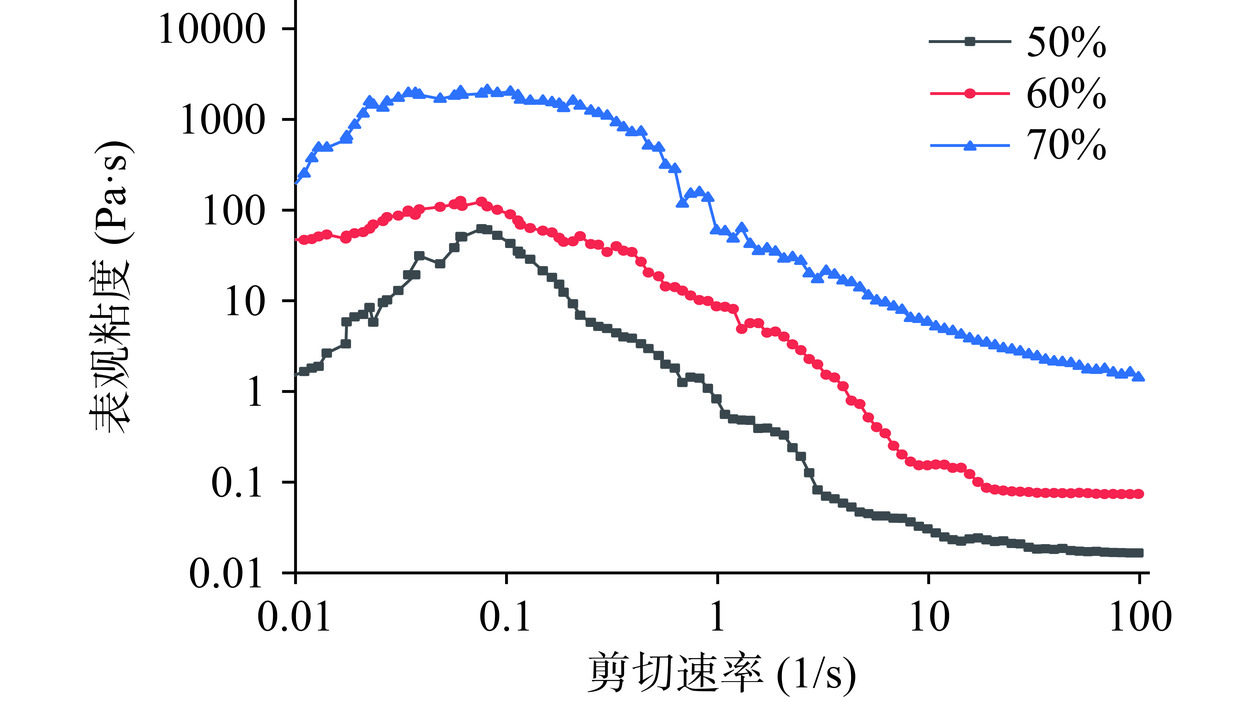
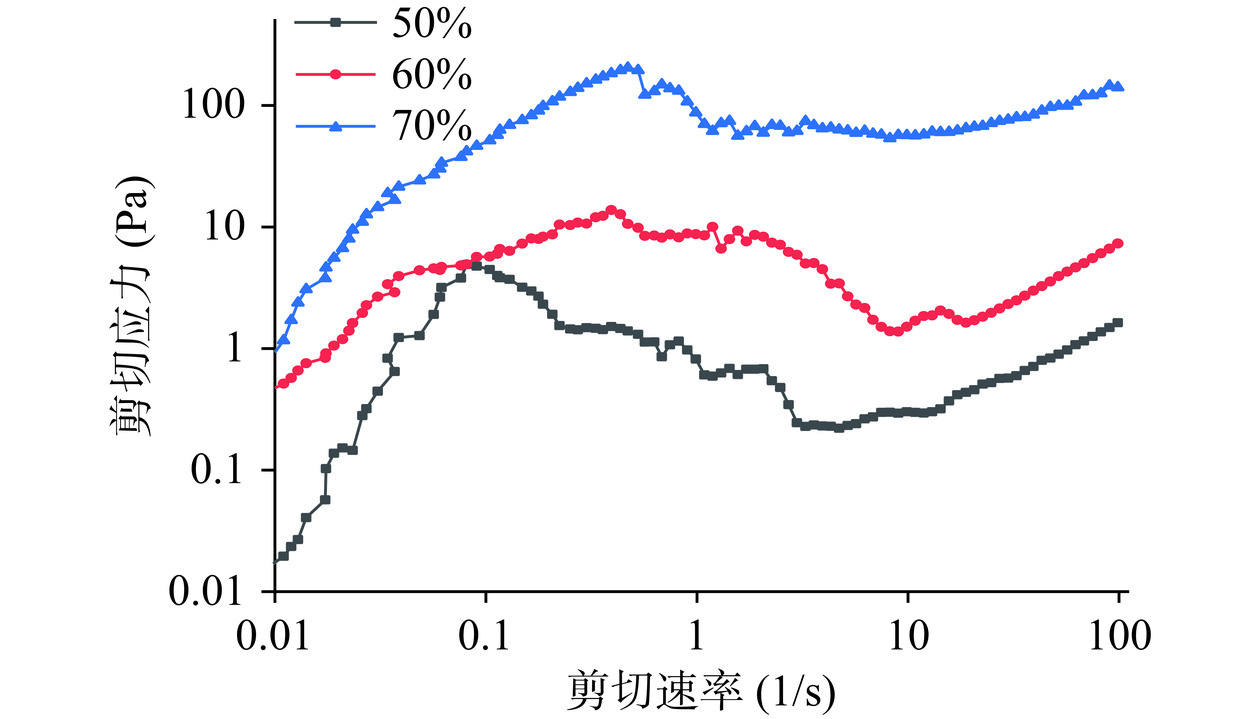
溶液浓度和剪切速率对IMOs表观粘度以及剪切应力的影响,如图22、图23所示。在设定的剪切速率范围内IMOs溶液的表观粘度随着剪切速率的增大先增大后减小之后趋于稳定,这就是剪切变稀现象,呈现出典型的非牛顿型“假塑性流体”[39]。随着IMOs溶液浓度的增加,其表观粘度增大。IMOs溶液中存在着大量分子间的相互缠绕和连接,在初始阶段低浓度状态下糖分子间的交互作用相对较弱IMOs溶液的粘度对剪切速率的变化不敏感。当剪切速率不断升高时,原本稳定的糖分子结构会受到扰动,其相互间的缠绕程度随之下降,这个过程直接导致了溶液的表观粘度随剪切速率的增加而呈现出下降的趋势。
2.6.8.2 IMOs的动态流变分析
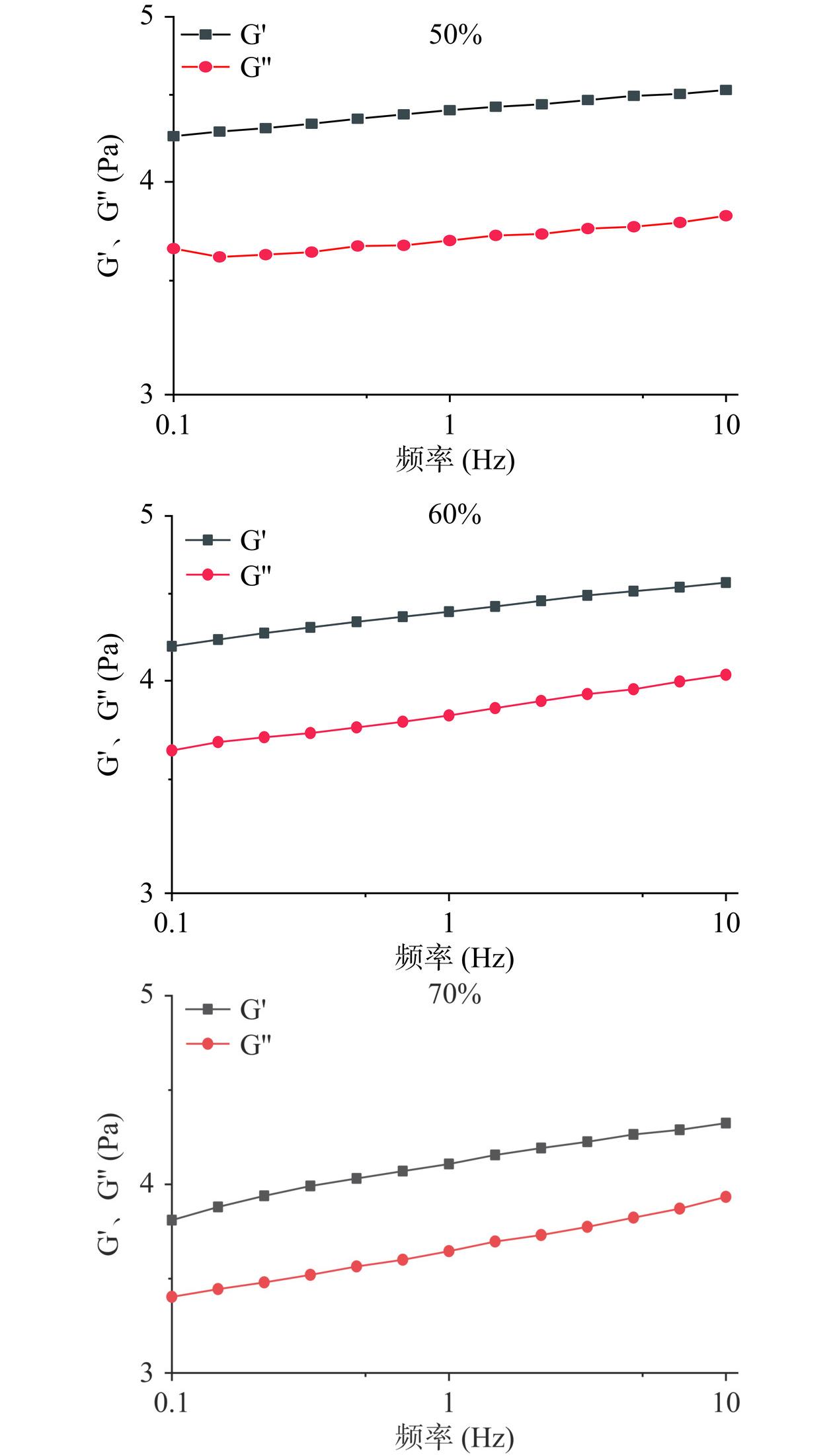
3种浓度的IMOs水溶液动态流变结果,如图24所示。体系的黏弹性的变化规律可以通过动态流变学反映,如图24中对于质量分数为50%和60%以及更高浓度70%的IMOs溶液而言,在小振幅频率扫描试验范围内,G'与G''均随着频率的增大而升高,此外G'始终且明显高于G'',这表明IMOs在质量分数50%以及更高浓度时会形成类似凝胶的结构,可能形成弱凝胶,并且其体系将以弹性为主。从G'在图中的曲线变化趋势来看,随着频率的不断增大G'的变化幅度较为平缓,说明此时的相对模量关系与对频率的依赖性较小。
3. 结论
本研究采用SSMB技术以ZG106 K+型阳离子树脂作固定相,高纯水作流动相纯化IMOs,并对高纯度IMOs相关理化特性进行测定。对SSMB纯化IMOs的主要技术参数进行优化,得到最佳纯化IMOs的技术参数为:进料折光60%、柱温65 ℃、进料量455 mL/h、进料流速40.2 mL/min、进水量682 mL/h、进水流速31.8 mL/min、总循环流量409.5 mL/h、出口折光率18.70%,纯度92.80%,收率为83.20%。表明SSMB技术在IMOs的纯化过程中展现出高效性,不仅实现了高效生产,而且低耗环保,为我国高纯度IMOs的大规模商业化生产以及广泛应用提供了相应的技术支撑。高纯度IMOs展现出良好的吸湿性、保湿性,热稳定性以及贮藏稳定性等理化特性也为其在食品以及相关功能性糖领域的应用提供理论基础。
-
表 1 不同阳离子树脂分离IMOs原料液组分含量
Table 1 Raw material components of IMOs was separated by various cationic resins
树脂类型 葡萄糖(G) 麦芽糖(M2) 异麦芽糖(IG2) 麦芽三糖(M3) 潘糖(P) 异麦芽三糖(IG3) 四糖及以上(IG4~IGn) Ca2+型树脂 6.21% 11.36% 13.95% 2.93% 10.26% 7.52% 47.77% K+型树脂 3.10% 8.96% 18.17% 3.25% 11.25% 9.54% 45.73% H+型树脂 8.05% 9.94% 11.21% 3.96% 7.75% 5.97% 53.12% 表 2 K+型树脂分离IMOs的单柱试验
Table 2 Single column evaluation of IMOs separation with potassium type resin
管数 流出体积(mL) 柱温(℃) 柱压(MPa) 折光率(%) IMOs纯度(%) 杂糖纯度(%) IMOs干物质(mg) 杂糖干物质(mg) 9 28.80 65.00 0.20 5.00 100.00 0.00 128.00 0.00 10 32.00 65.00 0.20 8.78 97.14 2.86 256.00 9.93 11 35.20 65.00 0.20 11.28 91.75 8.25 344.88 55.12 12 38.40 65.00 0.20 12.25 88.01 11.99 355.58 140.42 13 41.60 65.00 0.20 13.50 71.06 28.94 335.87 240.13 14 44.80 65.00 0.20 14.75 62.01 37.99 308.91 347.09 15 48.00 65.00 0.20 16.25 48.97 51.03 267.84 452.16 16 51.20 65.00 0.20 17.38 38.11 61.89 191.61 496.39 17 54.40 65.00 0.20 18.75 43.53 56.47 113.47 462.53 18 57.60 65.00 0.20 20.25 29.98 70.02 96.72 363.28 19 60.80 65.00 0.20 20.25 25.65 74.35 63.30 284.70 20 64.00 65.00 0.20 18.75 18.51 81.49 48.96 221.04 21 67.20 65.00 0.20 15.75 18.35 81.65 25.13 150.87 22 70.40 65.00 0.20 11.75 13.27 86.73 8.76 115.24 23 73.60 65.00 0.20 7.50 12.08 87.92 1.47 94.53 表 3 SSMB分离操作条件和试验结果
Table 3 Operation conditions and test results on SSMB
序号 进料流量(mL·h−1) 进水流量(mL·h−1) 循环流量(mL·h−1) 进料流速(mL·min−1) 切换时间(s) 进水流速(mL·min−1) 折光率(%) IMOs纯度(%) IMOs收率(%) 1 273 546 364 29 1333 27.3 15.4 92.5 82.7 2 273 546 345.8 27.1 1279 26.4 17.3 90.1 85.4 3 455 682 364 37.4 1038 29.6 20.4 90.2 85.5 4 455 682 409.5 40.2 1246 31.8 18.7 92.8 83.2 5 455 910 382.2 34.9 1243 34.3 16.1 91.3 83.5 6 455 910 345.8 32.9 1078 32.4 18.7 89.7 86.8 7 455 910 409.5 36.5 1282 35.6 17.5 90.8 85.2 表 4 IMOs组分液相色谱分析
Table 4 HPLC analysis of IMOs component
出峰次序 保留时间(min) 含量(%) 组分名 1 7.411 41.719 IMOs 2 8.210 18.935 3 8.711 31.992 4 9.721 7.354 单糖、二糖 -
[1] PALANIAPPAN A, EMMAMBUX M N. The challenges in production technology, health-associated functions, physico-chemical properties and food applications of isomaltooligosaccharides[J]. Critical Reviews in Food Science and Nutrition,2021,63(19):3821−3837.
[2] GOURINENI V, STEWART M L, ICOZ D, et al. Gastrointestinal tolerance and glycemic response of isomaltooligosaccharides in healthy adults[J]. Nutrients,2018,10(3):301. doi: 10.3390/nu10030301
[3] 阮圣慧, 姜彩霞, 刘晓兰, 等. 酶法制备低聚异麦芽糖的研究现状[J]. 食品工业科技,2023,44(17):463−469. [RUAN S H, JIANG C X, LIU X L, et al. Research status of isomaltooligosaccharides by enzymatic preparation[J]. Science and Technology of Food Industry,2023,44(17):463−469.] RUAN S H, JIANG C X, LIU X L, et al. Research status of isomaltooligosaccharides by enzymatic preparation[J]. Science and Technology of Food Industry, 2023, 44(17): 463−469.
[4] WANG S M, XIAO Y, TIAN F W, et al. Rational use of prebiotics for gut microbiota alterations:Specific bacterial phylotypes and related mechanisms[J]. Journal of Functional Foods,2020,66:103838. doi: 10.1016/j.jff.2020.103838
[5] KLAHAN P, OKUYAMA M, JINNAI K, et al. Engineered dextranase from Streptococcus mutans enhances the production of longer isomaltooligosaccharides[J]. Bioscience, Biotechnology, and Biochemistry,2018,82(9):1480−1487. doi: 10.1080/09168451.2018.1473026
[6] HU Y, WINTER V, GANZLE M. In vitro digestibility of commercial and experimental isomalto-oligosaccharides[J]. Food Research International,2020,134:109250. doi: 10.1016/j.foodres.2020.109250
[7] SORNDECH W, NAKORN K N, TONGA S, et al. Isomalto-oligosaccharides:Recent insights in production technology and their use for food and medical applications[J]. LWT-Food Science and Technology,2018,95:135−142. doi: 10.1016/j.lwt.2018.04.098
[8] RAJAGOPALAN G, KRISHNAN C. Functional oligosaccharides:production and action[J]. Next Generation Biomanufacturing Technologies,2019,8:155−180.
[9] SU Z, LUO J, SIGURDARDOTTIR S B, et al. An enzymatic membrane reactor for oligodextran production:Effects of enzyme immobilization strategies on dextranase activity[J]. Carbohydrate Polymers,2021,271:118430. doi: 10.1016/j.carbpol.2021.118430
[10] 洪兰, 蒋尚昆, 刘美玲, 等. 酶膜反应器与手性分离膜在功能性糖生产中的应用展望[J]. 膜科学与技术,2022,42(2):146−153. [HONG L, JIANG S K, LIU M L, et al. Application prospect of enzymatic membrane reactors and chiralseparation membranes in functional sugars production[J]. Membrane Science and Technology,2022,42(2):146−153.] HONG L, JIANG S K, LIU M L, et al. Application prospect of enzymatic membrane reactors and chiralseparation membranes in functional sugars production[J]. Membrane Science and Technology, 2022, 42(2): 146−153.
[11] 李佳明, 张宏建, 王靓, 等. 膜分离法提高麦芽四糖糖浆纯度的研究[J]. 食品与发酵工业,2024,50(9):182−187. [LI J M, ZHANG H J, WANG L, et al. Study on improving the purity of maltotetraose syrup by membrane separation[J]. Food and Fermentation Industries,2024,50(9):182−187.] LI J M, ZHANG H J, WANG L, et al. Study on improving the purity of maltotetraose syrup by membrane separation[J]. Food and Fermentation Industries, 2024, 50(9): 182−187.
[12] 宁利敏, 朱本伟, 姚忠, 等. 膜分离技术在寡糖制备与分离中的应用[J]. 中国生物工程杂志,2022,42(4):102−110. [NING L M, ZHU B W, YAO Z, et al. Recent research progresses of membrane separation technology usedfor oligosaccharides preparation and separation[J]. China Biotechnology,2022,42(4):102−110.] NING L M, ZHU B W, YAO Z, et al. Recent research progresses of membrane separation technology usedfor oligosaccharides preparation and separation[J]. China Biotechnology, 2022, 42(4): 102−110.
[13] LIU H P, WEI X Y, ZU S Y, et al. Separation and identification of neutral oligosaccharides with prebiotic activities from apple pectin[J]. Food Hydrocolloids,2021,121:107062. doi: 10.1016/j.foodhyd.2021.107062
[14] 钱金宏, 卢晓会, 应烨, 等. 一种高纯度魔芋甘露大糖及其制备方法、应用:中国, CN107760740A[P]. 2018-03-06. [QIAN J H, LU X H, YING Y, et al. High-purity konjac mannan polysaccharide as well as preparation method and application thereof:China, CN107760740A[P]. 2018-03-06.] QIAN J H, LU X H, YING Y, et al. High-purity konjac mannan polysaccharide as well as preparation method and application thereof: China, CN107760740A[P]. 2018-03-06.
[15] CAO W L, DENG T T, CAO W F, et al. From sucrose to fructo-oligosaccharides:Production and purification of fructo-oligosaccharides by an integrated enzymatic catalysis and membrane separation process[J]. Separation and Purification Technology,2022,288:12608.
[16] 陈献富, 季华, 范益群. 纳滤膜在功能性低聚糖分离纯化中的应用研究进展[J]. 化工进展,2019,38(1):394−403. [CHEN X F, JI H, FAN Y Q. Application of nano-filtration membranes in the separation and purification of functional oligosaccharides[J]. Chemical Industry and Engineering Progress,2019,38(1):394−403.] CHEN X F, JI H, FAN Y Q. Application of nano-filtration membranes in the separation and purification of functional oligosaccharides[J]. Chemical Industry and Engineering Progress, 2019, 38(1): 394−403.
[17] 李良玉, 曹龙奎, 王维浩. 模拟移动床色谱技术在功能糖生产中的应用[M]. 北京:中国纺织出版社, 2018. [LI L Y, CAO L K, WANG W H. Application of simulant moving bed chromatography in production of functional oligosaccharides[M]. Beijing:China Textile &Apparel Press, 2018.] LI L Y, CAO L K, WANG W H. Application of simulant moving bed chromatography in production of functional oligosaccharides[M]. Beijing: China Textile &Apparel Press, 2018.
[18] 李艳, 凌山, 刘聚明, 等. 顺序式模拟移动床分离低聚木糖多目标优化及其变量调控机制[J]. 现代化工,2023,43(1):240−245. [LI Y, LING S, LIU J M, et al. Multi-objective optimization of sequentially-simulated moving bed for separation of xylo-oligosaccharides and its variables regulation mechanism[J]. Modern Chemical Industry,2023,43(1):240−245.] LI Y, LING S, LIU J M, et al. Multi-objective optimization of sequentially-simulated moving bed for separation of xylo-oligosaccharides and its variables regulation mechanism[J]. Modern Chemical Industry, 2023, 43(1): 240−245.
[19] 李良玉. 顺序式模拟移动色谱高效纯化菊芋多聚果糖的技术研究[R]. 大庆:黑龙江八一农垦大学, 2016. [LI L Y. Study on efficient purification of Jerusalem artichoke polyfructose by sequential simulated moving bed chromatography[R]. Daqing:Heilongjiang Bayi Agricultural University, 2016.] LI L Y. Study on efficient purification of Jerusalem artichoke polyfructose by sequential simulated moving bed chromatography[R]. Daqing: Heilongjiang Bayi Agricultural University, 2016.
[20] 李洪飞, 孙大庆, 李良玉, 等. 基于顺序式模拟移动床色谱法的两种木糖母液分离工艺比较[J]. 食品与机械,2019,35(10):210−213. [LI H F, SUN D Q, LI L Y, et al. Comparing of two seperation processes for recovering xylose mother liquor with sequential simulated moving bed technology[J]. Food & Machinery,2019,35(10):210−213.] LI H F, SUN D Q, LI L Y, et al. Comparing of two seperation processes for recovering xylose mother liquor with sequential simulated moving bed technology[J]. Food & Machinery, 2019, 35(10): 210−213.
[21] 李良玉, 宋大巍, 孙蕊, 等. 模拟移动色谱法纯化葡萄糖母液的技术研究[J]. 核农学报,2015,29(10):1970−1978. [LI L Y, SONG D W, SUN R, et al. Research on simulated moving bed chromatography purification of dextrose mother liquid[J]. Journal of Nuclear Agricultural Sciences,2015,29(10):1970−1978.] LI L Y, SONG D W, SUN R, et al. Research on simulated moving bed chromatography purification of dextrose mother liquid[J]. Journal of Nuclear Agricultural Sciences, 2015, 29(10): 1970−1978.
[22] 中国国家标准化管理委员会. GB/T 20881-2017. 低聚异麦芽糖[S]. 北京:中国标准出版社, 2017. [Standardization Administration of the People’S Republic of China. GB/T 20881-2017. Isomaltooligosaccharides[S]. Beijing:Standards Press of China, 2017.] Standardization Administration of the People’S Republic of China. GB/T 20881-2017. Isomaltooligosaccharides[S]. Beijing: Standards Press of China, 2017.
[23] 张心怡. 银杏低聚异麦芽糖的制备、理化性质及其益生活性研究[D]. 南京:南京林业大学, 2021. [ZHANG X Y. The preparation, physicochemical properties and probiotic activity of ginkgo isomaltooligosaccharides[D]. Nanjing:Nanjing Forestry University, 2021.] ZHANG X Y. The preparation, physicochemical properties and probiotic activity of ginkgo isomaltooligosaccharides[D]. Nanjing: Nanjing Forestry University, 2021.
[24] ASAD N, SHINAWAR W A, SANA I, et al. Effect of peeling and unpeeling on yield, chemical structure, morphology and pasting properties of starch extracted from three diverse potato cultivars of Pakistan[J]. International Journal of Food Science and Technology,2020,55(6):14412.
[25] CASTROCAMPOS F G, CABRERARAMÍREZ A H, MORALESSÁNCHEZ E, et al. Impact of the popping process on the structural and thermal properties of sorghum grains (Sorghum bicolor L. Moench)[J]. Food Chemistry,2021,348:129092. doi: 10.1016/j.foodchem.2021.129092
[26] GONZÁLEZ M, VERNON-CARTER E J, ALVAREZ-RAMIREZ J, et al. Effects of dry heat treatment temperature on the structure of wheat flour and starch in vitro digestibility of bread[J]. International Journal of Biological Macromolecules,2021,166:1439−1447. doi: 10.1016/j.ijbiomac.2020.11.023
[27] 徐炜. β-(2, 6)果聚糖蔗糖酶的性质鉴定、分子改造及其合成 β-(2, 6)果聚糖的应用[D]. 无锡:江南大学, 2020. [XU W. Molecular identification and modification of levansucrase and its application for levan production[D]. Wuxi:Jiangnan University, 2020.] XU W. Molecular identification and modification of levansucrase and its application for levan production[D]. Wuxi: Jiangnan University, 2020.
[28] CHAI J H, PARK H, PARK C H, et al. Highly efficient recovery of xylobiose from xylooligosaccharides using a simulated moving bed method[J]. Journal of Chromatography A,2016,1465:143−154. doi: 10.1016/j.chroma.2016.08.063
[29] HOU Y Y, LIU L J, ZHANG X X, et al. Adsorption differences and mechanism of chitooligosaccharides with specific degree of polymerization on macroporous resins with different functional groups[J]. Journal of Industrial and Engineering Chemistry,2022,115:416−429. doi: 10.1016/j.jiec.2022.08.027
[30] 杨伟东. 阳离子交换树脂分离纯化葡甘露低聚糖工艺研究[J]. 食品与发酵科技,2019,55(4):14−17. [YANG W D. The study of separation and purification of manna-oligosaccharides with cationic exchange resin[J]. Food and Fermentation Science & Technology,2019,55(4):14−17.] YANG W D. The study of separation and purification of manna-oligosaccharides with cationic exchange resin[J]. Food and Fermentation Science & Technology, 2019, 55(4): 14−17.
[31] ZHANG Q B, ZHOU X, XU Y. Xylooligosaccharides production from xylanhydrolysis using recyclable strong acidic cationic exchange resin as solid acid catalyst[J]. Applied Biochemistry and Biotechnology,2022,194:3609−3620. doi: 10.1007/s12010-022-03924-6
[32] 曹敏, 雷光鸿, 王元春, 等. 模拟移动床制备高纯度低聚果糖的研究与应用[J]. 食品工业科技,2017,38(19):84−87. [CAO M, LEI G H, WANG Y C, et al. Research and application on preparation of high purity fructooligsacchrides by simulate moving bed chromatography[J]. Science and Technology of Food Industry,2017,38(19):84−87.] CAO M, LEI G H, WANG Y C, et al. Research and application on preparation of high purity fructooligsacchrides by simulate moving bed chromatography[J]. Science and Technology of Food Industry, 2017, 38(19): 84−87.
[33] 麦芽三糖的生产与应用[EB/OL]. 2012-08-14. [Production and application of maltotriose[EB/OL]. 2012-08-14.] Production and application of maltotriose[EB/OL]. 2012-08-14.
[34] 张力田, 高群玉. 淀粉糖(第三版)[M]. 北京:中国轻工业出版社, 2011. [ZHANG L T, GAO Q Y. Starch sugars (third edition)[M]. Beijing:China Light Industry Press, 2011.] ZHANG L T, GAO Q Y. Starch sugars (third edition)[M]. Beijing: China Light Industry Press, 2011.
[35] BAGCHI S, KUMAR K J. Studies on water soluble polysaccharides from Pithecellobium dulce (Roxb.) Benth. seeds[J]. Carbohydrate Polymers,2016,138:215−221. doi: 10.1016/j.carbpol.2015.11.018
[36] 毛凯, 李丹, 吴姣娇, 等. pH过程控制优化低聚异麦芽糖铁配合物的制备工艺[J]. 食品科学,2015,36(16):56−60. [MAO K, LI D, WU J J, et al. Optimization of preparation of isomaltooligosaccharide-Iron complex by pH control[J]. Food Science,2015,36(16):56−60.] MAO K, LI D, WU J J, et al. Optimization of preparation of isomaltooligosaccharide-Iron complex by pH control[J]. Food Science, 2015, 36(16): 56−60.
[37] MIAO M, MA Y J, HUANG C, et al. Physicochemical properties of a water soluble extracellular homopolysaccharide from Lactobacillus reuteri SK24.003[J]. Carbohydrate Polymers,2015,131:377−383. doi: 10.1016/j.carbpol.2015.05.066
[38] 赵姝婷, 王维浩, 全志刚, 等. 绿豆RS4·Se(Ⅳ)制备、结构表征及对酶活抑制动力学[J]. 食品科学,2022,43(20):53−62. [ZHAO S T, WANG W H, QUAN Z G, et al. Preparation and structural characterization of mung bean RS4·Se(IV) and kinetics of enzymatic inhibition by it[J]. Food Science,2022,43(20):53−62.] ZHAO S T, WANG W H, QUAN Z G, et al. Preparation and structural characterization of mung bean RS4·Se(IV) and kinetics of enzymatic inhibition by it[J]. Food Science, 2022, 43(20): 53−62.
[39] LIU D L, ZHOU F, FANG K. A theoretical study on transitional shear flow behavior of the compressible and isothermal thermoplastic polymer[J]. Chinese Journal of Polymer Science,2019,37(5):518−526. doi: 10.1007/s10118-019-2214-3





 下载:
下载:


 下载:
下载:



