Research Progress on the Bacteriostatic Mechanism, Biosynthesis and Application of Phenyllactic Acid
-
摘要: 苯乳酸(Phenyllactic Acid,PLA)是一种具有广谱抑菌特性的天然物质,其可由部分乳酸菌与非乳酸菌代谢产出,作为一种对食品安全具有积极意义的绿色产物,苯乳酸受到了广泛的关注。本文介绍了苯乳酸的结构与理化性质,阐述了苯乳酸的抑菌能力、作用机理、生物合成及其应用方面的最新进展,指出了苯乳酸生产过程中影响其产量与效率的因素,以期为苯乳酸工业生产与市场开拓提供思路。Abstract: Phenyllactic acid (PLA), produced by many lactic acid bacteria and non-lactic acid bacteria, is a natural substance with broad-spectrum antibacterial properties. As a green product with positive implications for food safety, it has received widespread attention. This work introduces the structure and physicochemical properties of PLA, elaborates on the latest progress in its antibacterial ability, bacteriostatic mechanism, biosynthesis and application. Factors that affect its yield and efficiency in the production process are also illustrated, which provide insights for industrial and market development.
-
Keywords:
- phenyllactic acid /
- physicochemical properties /
- antibacterial activity /
- biosynthesis /
- application
-
伴随时代的发展,人们对卫生健康与环保问题愈发关注[1]。传统化学合成抑菌剂在食品保鲜领域存在健康隐患、环境污染等问题。生物保鲜由于其环境友好性与可持续发展性,被科研人员广泛研究。苯乳酸是一种由一些乳酸菌及非乳酸菌等自然菌株天然合成的小分子抑菌化合物,可损伤微生物细胞壁、破坏细胞膜完整性、抑制生物膜形成、干扰线粒体能量代谢等,因此对多种微生物都具有抑制能力,具有广谱抑菌特性[2],食品工业中常见致病菌,如李斯特菌、沙门氏菌、黄曲霉等都能被其有效地抑制[3]。苯乳酸的广谱、高效、绿色等特性,契合社会对新型抑菌剂的要求,使之在食品保鲜领域具有广阔的应用前景[4]。
苯乳酸合成方法主要为化学合成法与生物合成法。由于化学法合成苯乳酸存在污染与副产物繁杂等问题,依靠菌株生物合成逐渐成为苯乳酸生产领域的主要研究方向[5]。生物合成苯乳酸通过野生菌株自然发酵产量不高,通过筛选优秀菌株,系统优化培养条件等方法能够有效提升苯乳酸的产量[6];提升脱氢酶、转氨酶活性,促进辅酶再生等诸多方法也使苯乳酸产量不断增长[7−8];基因工程定向改造的工程菌株更是提升了苯乳酸的产量与生产效率[9]。目前,还有使用新培养底物与新催化载体的生产方法,使苯乳酸生产成本更低、效率更高[2]。苯乳酸生物合成已成为研究热点。
本文综述了苯乳酸的理化性质、抑菌能力及抑菌机理,阐述了苯乳酸生物合成及应用方面的最新进展,以期对食品加工与保藏行业提供助力。
1. 苯乳酸的理化性质
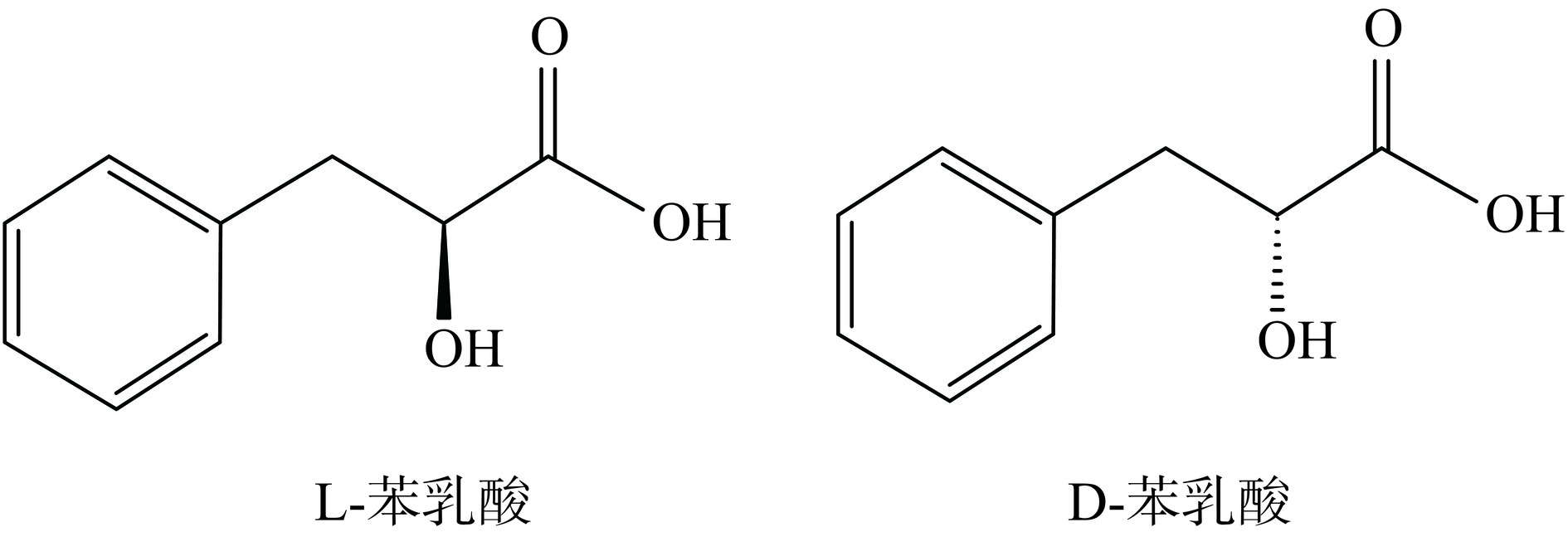
苯乳酸全名为2-羟基-3苯基丙酸,也称3-苯基乳酸或β-苯基乳酸,是一种酚酸,分子量为166.17[3]。苯乳酸拥有一个疏水基团-苯环和一个亲水基团-羧基,从而表现出两亲性,使其可以在液体溶剂中均匀分散,最大化表达自身特性。它的第二个碳原子为手性碳原子,这导致苯乳酸具有两种构型,分别为L-苯乳酸和D-苯乳酸(图1)[10−11]。苯乳酸纯对映体的熔点在122.1至125.7 ℃之间,熔化焓为30.5 kJ/mol;而外消旋晶体熔点在93.4至96.7 ℃之间,熔化焓为26.5 kJ/mol。尽管外消旋晶体有更高的密度与晶体堆积效率,但它们不如以更短、更强的氢键相互作用的同源晶体更稳定[12]。较高的熔化晗使苯乳酸的热稳定性优良,Cortes-zavaleta等[13]将苯乳酸置于121 ℃,处理20 min后,其抗菌活性仍然没有发生改变。此外,苯乳酸也具有较强的酸碱稳定性,并在宽pH范围内结构稳定[14]。
2. 苯乳酸的抑菌机理及其与其他抑菌物质的协同作用
2.1 抑菌能力
苯乳酸具有广谱抑菌性,对大部分细菌(如弧菌属、李斯特菌属、大肠杆菌属、葡萄球菌属、沙门氏菌属等)、真菌(镰刀霉属、曲霉属、青霉属、假丝酵母菌属等)均有一定抑制效果(表1)。
表 1 苯乳酸的抑菌能力、作用部位和抑菌机理Table 1. Antibacterial ability, action sites, and mechanism of PLA类别 受体菌株 作用部位 抑菌机制 最小抑菌
浓度(mg/mL)参考文献 真菌 白假丝酵母
(Candida albicans)DNA 下调ALS3和ERG11基因的表达水平,
从而抑制其生物膜的形成7.5 [15] 黄曲霉
(A. flavus)细胞膜、DNA 破坏细胞膜;改变细胞膜通透性;
干扰线粒体能量代谢6 [16] 米根霉
(Rhizopus oryzae)DNA 干扰线粒体能量代谢 8 [17] 细菌 单增李斯特菌
(L. monocytogenes)细胞膜、DNA 破坏细胞膜;与DNA结合干扰正常细胞功能 1.25 [18] 阴沟肠杆菌
(E. Cloacae)细胞壁、细胞膜 裂解细胞;破坏细胞膜 − [19] 金黄色葡萄球菌_45
(S. aureus_45)− − 3.5 [20] 大肠杆菌44752
(E. Coli 44752)细胞膜、DNA 改变细胞膜通透性;与DNA结合干扰正常细胞功能 2.5 [18] 副溶血性弧菌
(V. parahaemolyticus)细胞膜、DNA 增加细胞膜通透性,导致钾离子渗漏;与DNA结合,影响正常生理功能;降低细菌流动性并抑制生物膜的形成 3.2 [21] 铜绿假单胞菌
(P. aeruginosa PAO1)− − 0.2 [22] 福氏志贺菌_14
(S. flexneri_14)− 抑制生物膜形成 2.45 [23] 沙门氏菌
(Salmonella)细胞膜、DNA 破坏细胞膜;促进ATP消耗 − [24] 注:“−”为未提及。 L-苯乳酸和D-苯乳酸两种构型的抑菌能力体现出一定差异性,在过去的研究中,研究人员普遍认为D-苯乳酸的抗菌活性要优于L-苯乳酸[25−27]。如Dieuleveux等[28]实验证明,120 mmol/L的D-苯乳酸在琼脂扩散法下对李斯特菌的抑制直径(38±0.7 mm)大于L-苯乳酸(30±0.7 mm)。但Svanstrom等[29]研究指出,L-苯乳酸在较低浓度下就能抑制真菌的生长和孢子形成,而D-苯乳酸在低浓度下活性较低,使得L-苯乳酸的抑菌能力优于D-苯乳酸。目前,对于两种构型苯乳酸抑菌能力差异的原因还有待更进一步研究。
影响苯乳酸抑菌能力的环境因素主要为pH。虽然苯乳酸在宽范围pH内具有稳定性,但其抑菌能力随着pH的变化会发生改变。苯乳酸的最小抑菌浓度(MIC)与pH呈正相关,在较高的pH下,苯乳酸的抑菌能力较低。有研究人员以李斯特菌为指示菌测试pH对苯乳酸抑菌能力的影响,研究发现,当pH为4.5、5、5.5、6.0、6.5和7.0时,其MIC值逐渐增加,分别为1.6、2.8、5.7、11.3、22.6和45 mmol/L[30]。苯乳酸的抑菌活性与其他一些酸类防腐剂和有机酸相似,其抑菌能力与其解离程度相关,未解离的苯乳酸能够穿过微生物膜[30]。
2.2 抑菌机制
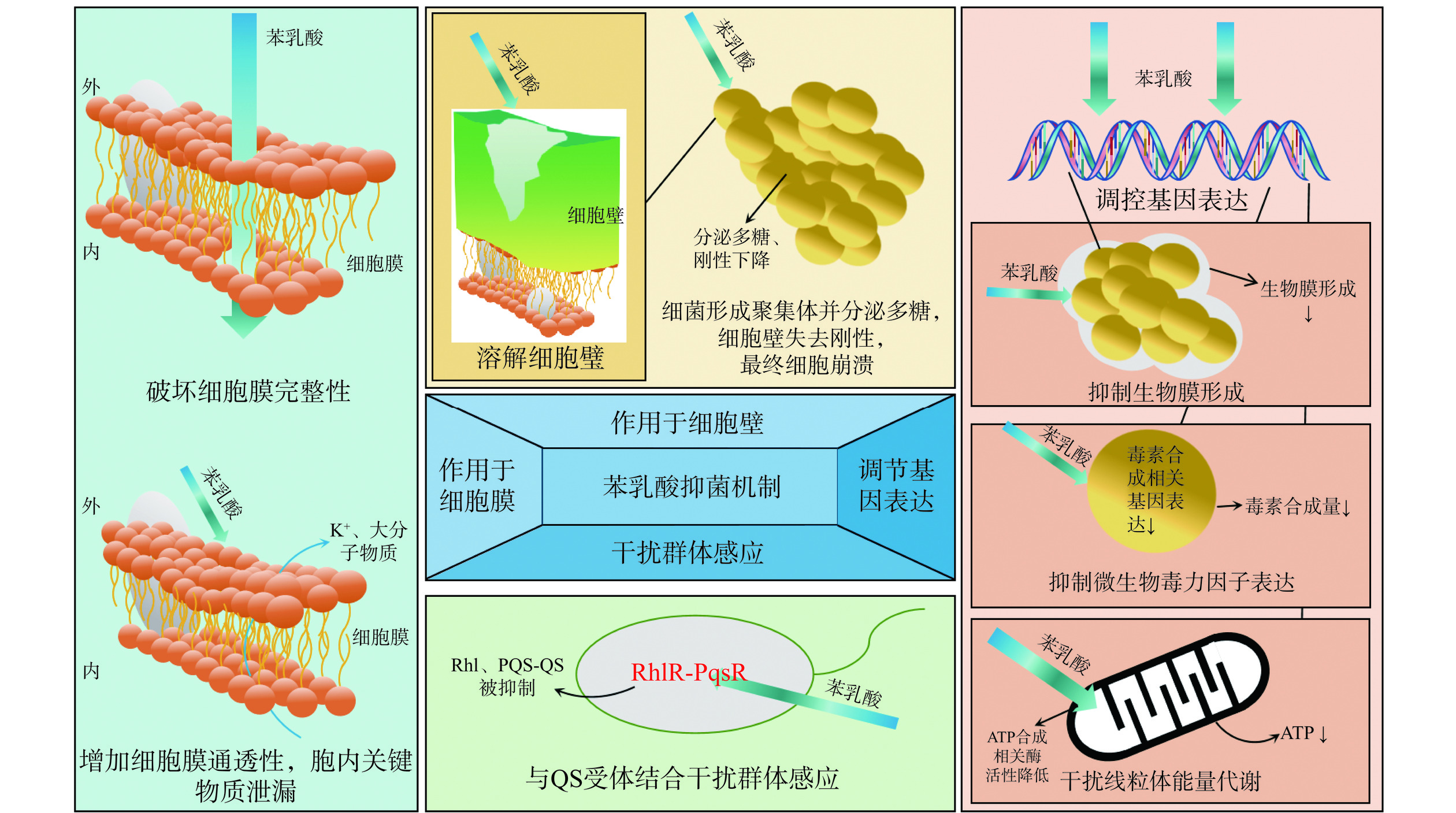
苯乳酸是一种具有两性亲和性的小分子化合物,可通过损伤微生物细胞壁、破坏细胞膜完整性、增加细胞膜的通透性、抑制生物膜形成、干扰微生物群体感应、抑制微生物毒力因子表达、干扰线粒体能量代谢等方式抑制微生物的生长增殖(图2)。
2.2.1 损伤微生物细胞壁
苯乳酸可以通过作用细胞壁对受体细胞带来损伤与破坏。其对阴沟肠杆菌细胞壁的作用是完全溶解大多数细胞的细胞壁,使细胞壁变形和不成比例[19]。Dieuleveux等[28]表明,苯乳酸作用于单核细胞增生李斯特菌细胞壁,致使细胞壁结构受损,导致细菌形成聚集体并分泌多糖,最终导致细菌细胞壁失去刚性,细菌膨胀甚至崩溃。Zhou等[24]指出,用L-PLA处理的沙门氏菌,其细胞壁受到严重损伤,壁上产生空隙与部分缺失。
2.2.2 改变细胞膜结构功能
2.2.2.1 破坏微生物细胞膜完整性
在破坏细胞壁的同时,由于苯乳酸具有两性亲和性,其还可与细胞膜脂质和蛋白质相互作用[31]。当苯乳酸与细胞膜相互作用,细胞膜完整性与形态发生改变,导致内容物外泄,从而杀死细胞,达成抑制效果。Jiang等[20]指出,在用苯乳酸处理后,金黄色葡萄球菌细胞膜的完整性受到破坏,导致细胞形态改变、细胞膜破裂和细胞内容物泄漏。在添加10 mg/mL苯乳酸的马铃薯葡萄糖水培养液中孵育30 min的黄曲霉孢子,有高达98.02%±0.01%的孢子细胞膜受损[32]。Ning等[18]通过PI荧光探针-膜完整性测定法研究了苯乳酸对单核细胞增生李斯特菌细胞膜的影响,荧光显微镜显示,MIC浓度苯乳酸处理后的李斯特菌细胞膜出现一些孔或局部破裂,形成聚集和粘连;当用2倍MIC浓度苯乳酸处理后,大多数细胞膜塌陷甚至破裂成细胞碎片,并形成大的细菌团块。
2.2.2.2 增加细胞膜的通透性
苯乳酸与细胞膜的作用还会改变细胞膜的电位,导致细胞膜的去极化,即细胞膜内外的电荷差异减小或消失。这可能会影响细胞内外的离子平衡和电荷分布,使其通透性发生改变,细胞膜对溶质和溶剂的选择性通透性降低,导致细胞内外物质的交换增加,细胞内离子与其他大分子物质可能发生泄漏[19]。如Fang等[21]指出,苯乳酸可以增加细菌的渗透性导致钾离子泄漏。有研究人员观察到MIC浓度与2倍MIC浓度的苯乳酸处理后的大肠杆菌细胞膜并未破裂,只是出现表面褶皱,粗糙和细胞体积缩小[18]。苯乳酸通过改变细胞膜通透性,致使胞内物质流失,使细胞内一些关键物质泄漏,细胞新陈代谢受到影响,从而导致细胞的死亡。
2.2.2.3 干扰群体感应
苯乳酸与细胞膜作用,除了可能破坏细胞膜结构,改变细胞膜通透性,还可能与细菌感应受体结合来干扰细菌的群体感应系统[31]。Shariff等[33]指出,铜绿假单胞菌的生物膜发育受其群体感应(QS)系统的调节,它有三个主要的QS系统:LasI/R、RhlI/R和PQS/MvfR。苯乳酸可以与铜绿假单胞菌QS受体RhlR和PqsR结合并抑制Rhl和PQS-QS,从而实现对生物膜发育的抑制。群体感应是细菌调控毒力因子表达的重要机制,干扰群体感应可能会降低细菌的毒力,使其变得更加温和或无害。群体感应还参与细菌生物膜的形成,干扰群体感应可能会抑制生物膜的形成,从而减少细菌的附着和生长[34]。
2.2.3 调节基因表达
2.2.3.1 抑制生物膜的形成
生物膜对宿主免疫系统和抗生素具有很强的抗性,是一些细菌真菌感染治疗无效和感染复发的主要原因。DNA相互作用分析表明,苯乳酸与基因组DNA之间存在插入作用,可能影响细菌的正常生理功能[21]。Maione等[15]通过实时荧光定量PCR分析得出,苯乳酸通过下调白色念珠球菌的ALS3和ERG11基因的表达水平,导致其生物膜形成受到抑制。Shakya等[31]研究表明,苯乳酸能通过下调A. actinomycetemcomitans的粘附基因PGA的表达水平,使菌体之间的粘附性降低,难以粘黏,从而抑制其生物膜的形成。
2.2.3.2 抑制微生物毒力因子表达
苯乳酸同样可以调控受体细胞毒素合成的基因,使毒素分泌产生滞后,甚至抑制毒素的产生。Zhao等[32]将黄曲霉用苯乳酸处理后,发现实验组黄曲霉素B1浓度(10.20±0.03 µg/L)显著低于对照组(181.20±1.08 µg/L),转录组分析显示,苯乳酸处理使黄曲霉孢子mRNA水平发生变化,共有980个基因差异表达,与黄曲霉毒素生物合成相关的基因表达被显著下调。Chatterjee等[22]同样指出,苯乳酸能够抑制铜绿假单胞菌产生的多种毒力因子,包括脓青蛋白、蛋白酶和鼠李糖脂等,从而降低铜绿假单胞菌的侵袭力和毒性。
2.2.3.3 干扰线粒体能量代谢
苯乳酸还可以通过干扰线粒体能量代谢抑制孢子萌发,导致孢子凋亡。Li等[16]观察到,苯乳酸能引起黄曲霉孢子线粒体ATP酶和脱氢酶活性降低,导致ATP合成显著降低,使黄曲霉孢子萌发受到了抑制。Fan等[17]首次表明能量代谢可以成为苯乳酸对抗米曲霉的靶标,串联质谱标签蛋白质组显示,苯乳酸显著下调糖酵解中己糖激酶、磷酸果糖激酶、α-酮戊二酸脱氢酶、腺苷酸激酶、细胞色素C氧化酶和NADH脱氢酶的表达,并上调线粒体ADP/ATP载体蛋白和IV亚基在糖酵解、三羧酸循环或氧化磷酸化代谢中的表达。根据这些发现,通过酶活性测定显示上述途径的HK和a-KGDH活性下调,并通过实时定量PCR进一步证实ADK1、AAC、CCIO IV和NADH脱氢酶的基因表达下调。中心碳代谢组学显示,在苯乳酸作用下,三羧酸循环代谢产物如柠檬酸、顺式乌头酸、异柠檬酸、α-酮戊二酸、琥珀酸、富马酸和苹果酸的浓度显著下降,氧化磷酸化产生的ATP也显著减少,导致能量产生不足,活性氧(ROS)代谢异常,ROS水平较对照值增加了141%,细胞色素C被释放,导致细胞逐渐凋亡。
2.3 与其他物质协同作用
在自然环境下,苯乳酸往往是和其他抑菌物质协同作用,共同抑制微生物生长[35−36]。在复杂的协同作用下,苯乳酸往往表现出更高的抑菌能力。虽然单一的苯乳酸和乳酸都能破坏蜡样芽孢杆菌膜的完整性和形态,但联合使用的苯乳酸与乳酸增强了损伤效果。Ning等[37]基于iTRAQ的蛋白质组学分析表明,苯乳酸下调kdpB并抑制K+转运,干扰核糖体功能基因表达;乳酸下调周质磷结合蛋白并抑制磷转运,扰乱核糖体、TCA循环以及嘌呤和嘧啶代谢的功能;苯乳酸和乳酸联合抑制K+和磷的转运,影响嘌呤和嘧啶的合成代谢。闫爱红[38]具体分析了苯乳酸与几种常见有机酸协同抑制Listeria monocytogenes 10403s与Escherich coli ATCC 44752的效果,提出苯乳酸分别与乳酸和乙酸发挥协同作用的机制是通过增强彼此对细胞膜通透性和完整性的破坏性;进而使苯乳酸、乳酸、乙酸能够更容易地进入到细胞内部,通过与DNA结合,影响DNA稳定性,从而发挥协同抑菌作用。Liu等[39]研究了Nisin和苯乳酸的联合抑菌能力,发现Nisin和苯乳酸的联合使用能够显示出更强的抗菌活性。随后他们构建了可以同时生产Nisin和苯乳酸的L. lactis菌株,其发酵液对S. xylosus和M. luteus具有明显的抑菌活性。目前,一些物质与苯乳酸协同作用增强抑菌效果已被证明,但由于对不同的受体菌株的抑菌机制存在不同,协同机制复杂,仍有很多协同抑菌机制未被解释,亟待后续研究来阐明。
3. 苯乳酸的生物合成
3.1 生物合成菌株
苯乳酸的生物合成途径在自然界中呈现出菌种多样性,该化合物不仅可由植物乳杆菌(L. plantarum)、瑞士乳杆菌(L. Helveticus)、戊糖片球菌(P. pentosaceus)等典型乳酸菌天然合成,部分非乳酸菌属如白地霉(Geotrichum candidum)等真菌也具备合成能力(表2),但不同野生菌株的苯乳酸产量差异很大。
表 2 自然界中产苯乳酸的野生菌株Table 2. Wild strains producing PLA in nature野生菌株 苯乳酸产量(mg/L) 筛选材料 参考文献 魏斯氏菌DY2(Weissella sp.DY2) 2450.0 鱼肠道 [6] 戊糖片球菌SK25(Pediococcus pentosaceus SK25) 47.2 泡菜 [40] 面包乳杆菌NWAFU 1078(L. crustorum NWAFU 1078) 7.5 自然发酵蔬菜 [41] 瑞士乳杆菌L15(L. Helveticus L15) 110.4 食醋 [42] 白地霉(Geotrichum candidum) 410.0 − [43] 唾液乳杆菌YW-7(L. salivary YW-7) 1470.0 猪粪便 [44] 植物乳杆菌LY-78(L. plantarum LY-78) 246.0 传统发酵食品 [45] 植物乳杆菌YM-5-2n(L. plantarum YM-5-2n) 130.0 发酵大豆,牛奶 [46] 注:“−”为未提及。 3.2 生物合成通路
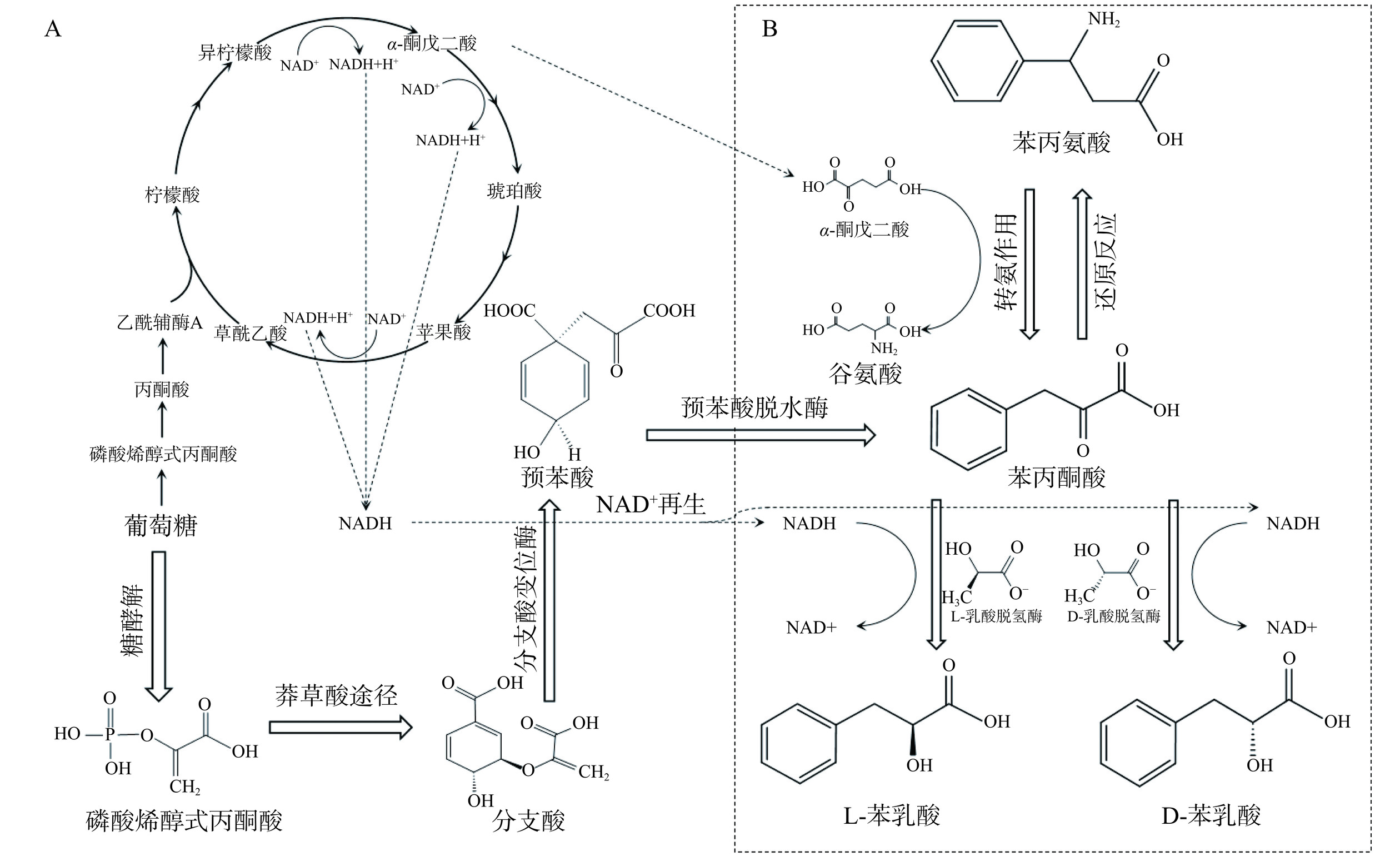
苯乳酸的生物合成起始于葡萄糖的代谢,葡萄糖首先通过糖酵解转化成磷酸烯醇式丙酮酸,再经莽草酸途径,生成分支酸,分支酸通过分支变位酶转变为预苯酸,再进一步生成苯丙酮酸,而后形成苯乳酸(图3)[11]。这一系列流程中,苯丙氨酸→苯丙酮酸→苯乳酸是目前公认的生物合成法主要核心通路,苯丙氨酸在转氨酶作用下通过转氨反应,生成苯丙酮酸,然后经过脱氢酶(通常是乳酸脱氢酶)催化,转化为苯乳酸。苯丙酮酸→苯乳酸途径中,除了脱氢酶不可或缺,辅酶NADH也至关重要,三羧酸循环能够促进NADH的再生,在整个通路中起着辅助的作用。另外,α-酮戊二酸作为氨基受体,加大供给量能够促进转氨作用,从而提升苯乳酸的产量[3,11]。然而,苯乳酸生物合成与众多酶的表达相关联,其代谢途径比较复杂,菌株的某种基因缺失可能导致相关通路被阻断,因此,不同菌株的苯乳酸生物合成通路可能存在差异[47]。
3.3 生物合成方法的优化
3.3.1 培养基及培养条件优化
野生乳酸菌菌株产苯乳酸能力参差不齐,且由于自然环境的营养物质、pH、温度、氧气含量以及细胞密度等原因,它们合成苯乳酸的潜力不能完全被挖掘出来。营养成分作为关系到微生物生物合成的直接因素,其种类及在培养基中的占比会大大影响菌株生长以及特定物质的产量,通过优化碳源、氮源以及无机盐等培养基组分,能够有效提升苯乳酸产量[45,48−49]。李士龙[45]以苯乳酸产量为指标,在对植物乳杆菌LY-78培养基碳源、氮源、无机盐以及其他组分分别优化后,通过响应面分析,获得了最优培养基配比,使发酵液抑菌效价的理论值达到了2238.428。Wu等[48]优化了植物乳杆菌YM-4-3y的培养基,在分别优化碳源、氮源与其他营养成分后,苯乳酸产量达到最高(400.74 mg/L)。特别地,通过向底物中直接添加苯乳酸合成所必需的前体物质苯丙氨酸与苯丙酮酸,能使苯乳酸的单位产量倍增[31],植物乳杆菌BLPC002在发酵培养基添加苯丙氨酸并优化培养基后,其苯乳酸产量由0.36 g/L提升至1.67 g/L,是优化前的4.6倍;玉米乳杆菌Y44在培养基添加5 mmol/L苯丙酮酸后,苯乳酸产量由0.8 mmol/L升至4.23 mmol/L,产量提升约4.3倍[50]。添加苯丙氨酸降解过程的中间产物α-酮戊二酸也会增加某些乳酸菌合成苯乳酸的能力[31],如在植物乳杆菌TMW1.468合成培养基中添加α-酮戊二酸后,PLA产量可提升6倍以上[51]。除了营养成分的影响外,培养条件也会对苯乳酸产量造成很大影响。研究人员发现,较高的温度有助于底物苯丙酮酸的溶解和转化,从而提高L-苯乳酸的得率和产量[52];低溶氧(低转速)培养条件下,糖酵解、磷酸戊糖途径与莽草酸途径的一些基因会上调,苯乳酸合成副产物减少,从而使苯乳酸产量更高[45,48−49]。同时,不同的初始pH、接种量与培养时间也会通过影响菌体浓度来影响苯乳酸产量[6,45,48]。吕孟敏等[6]优化了1株苯乳酸产量达到2.45 g/L的高产苯乳酸菌株的培养条件,在接种量3%、初始pH6.0、发酵温度34 ℃条件下静置培养50 h,苯乳酸产量达到2.99 g/L,较优化前提高1.22倍。田雪娇[53]优化了植物乳杆菌突变株NY-34的培养条件,在发酵时间75 h、发酵温度33 ℃、接种量9%、菌种种龄17 h、初始pH7、摇床转速150 r/min时,发酵液抑菌效价的平均值由300左右提升至1475。另外,廉价的非常规发酵基质也被证明可以用以生产苯乳酸。Huang等[2]首次报道利用海藻残渣和海藻超滤液作为发酵基质生产苯乳酸,在向基质中添加苯乳酸前体、纤维素酶后,苯乳酸产量高达4.58 g/L,比在MRS培养基中培养的乳酸菌菌株KP3高出2.5倍。
3.3.2 提高酶活性
乳酸菌产苯乳酸的能力除了和自然环境相关外,与自身催化酶的活性也有关系。脱氢酶作为苯乳酸生物合成通路的关键酶,提高脱氢酶的活性,是提升菌株苯乳酸产量的有效手段。Zhang等[52]将NADH依赖的L-乳酸脱氢酶编码变异基因(L-LcLDH1Q88A/I229A)在毕赤酵母GS115中表达,其比活性高达447.6 U/mg,比野生型L-LcLDH1高38.26倍。在LsGDHD255C双酶催化系统下,中间体Phe的积累显著减少,L-苯乳酸产率达到90.0%。设计筛选突变酶来改良菌株也能提升苯乳酸的产量。Zhou等[54]设计筛选了一种脱氢酶突变酶LrLDHT247I/D249A/F306W/A214Y (LrLDH-M1),它的酶活性比突变前提高了3.3倍,Kcat(催化常数)提高了约2.08倍。此外,此突变体在恶劣环境中,特别是在酸性条件下,表现出优异的抗性。除了脱氢酶之外,转氨酶也是菌株生物合成苯乳酸过程中的一种重要的限速酶。作为苯乳酸生物合成的直接前体,苯丙酮酸的浓度直接关系到苯乳酸的产量,而菌株氨基酸转氨酶对底物的活性与特异性决定了苯丙氨酸转化成苯丙酮酸这一过程的转化效率[3]。Hou等[55]在大肠杆菌中表达了奇异变形杆菌(Proteus mirabilis)的膜结合L-氨基酸脱氨酶(L-AAD)基因,并纯化L-AAD 52倍(通过使用洗涤剂正十二烷基-Β-D-麦芽糖苷(DDM)溶解已解离大肠杆菌膜中的L-AAD,然后用亲和微珠纯化溶解的L-AAD)。以重组大肠杆菌制作的纯化酶游离体系和以重组大肠杆菌为全细胞的催化体系内,苯丙氨酸到苯丙酮酸的最大产量分别为2.6±0.1 g/L和3.3±0.2 g/L,质量转化率分别为86.7%±5%和82.5%±4%,比酶活分别为1.02±0.02 μmol PPA/min/mg和0.013±0.003 μmol PPA/min/mg。综上,筛选突变酶、基因重组构建相关酶高表达菌株、纯化催化酶等方法都可提高酶活性从而实现苯乳酸高产量的目的。
3.3.3 辅酶再生
NADH作为电子供体参与细胞呼吸过程中的氧化还原反应,没有辅酶的参与,氧化还原酶通常不能发挥作用[56]。有研究人员选择用一些NAD+依赖性脱氢酶来实现辅酶再生:Qin等[57]利用灵活的肽链连接器构建D-乳酸脱氢酶和甘油脱氢酶的双功能融合蛋白,实现了更高效的辅酶通道传递和催化反应,促进了NADH的循环再生,提高了酶催化效率。Reeve等[56]使用酶修饰的颗粒系统,利用脱氢酶和NAD+还原酶从H2生成NADH,H2的电子通过一系列FeS簇链传递到颗粒中,最后由NAD+还原酶将NAD+还原为NADH,该系统可以实现100%的原子效率化学合成。他们还探讨了影响H2驱动的NADH生成速率的参数,并表明增加脱氢酶的相对负载可以提高NADH产生的初始速率。也有人提及将脱氢酶和辅酶捆绑在一起,在填充床反应器中实现NADH的使用、保留和循环[58]。因此,利用NAD+依赖性脱氢酶将NAD+还原为NADH有望应用于苯乳酸的生产,解决NADH浓度低导致的产能低的问题。
3.3.4 基因重组
大肠杆菌生长速度快,遗传背景清晰,易于培养,其常被用于进行基因重组研究[59]。目前有报道的基因重组生产苯乳酸的方法大致有三种:单酶表达的全细胞催化法、双酶表达的全细胞催化法以及三酶表达的全细胞催化法[3]。
通过将高活性脱氢酶基因重组到底盘细胞中,可以使苯乳酸的产量大大提升。Zhou等[60]使用工程化大肠杆菌异源表达一种新的乳酸脱氢酶,通过全细胞催化的方式,以苯丙酮酸为底物生产D-苯乳酸,产量达到18.21 g/L,转化率为90.49%。
但是乳酸脱氢酶的活性依赖于NADH的供应量,单酶表达的全细胞催化法由于NADH供应的不连续,在生产上具有生产速率的限制。双酶表达的全细胞催化法通过在重组菌株中共表达乳酸脱氢酶与其他再生系统脱氢酶(如葡萄糖脱氢酶、甲酸脱氢酶、甘油脱氢酶等),实现NADH的循环再生,有效降低了生产中的成本问题[3]。Lou等[27]筛选了鸟枪法测定的罗氏乳杆菌中的LrLDH(新型NADH依赖性d-乳酸脱氢酶),并将LrLDH基因与葡萄糖脱氢酶基因插入表达载体pCDFDuet-1,而后转化到大肠杆菌BL21(DE3)中,实现了辅酶再生,发酵液中的总酶活性达到峰值2359.0 U/L。在该工程菌株内,50 g/L苯丙酮酸钠能够完全转化为D-苯乳酸,日产量高达262.8 g/L。然而,葡萄糖脱氢酶再生系统会产生副产物葡萄糖酸[3]。相比之下,通过将甲酸盐不可逆的转化为无害副产物CO2从而为NADH的再生提供驱动力的甲酸脱氢酶也是一种好的选择[61]。Zhu等[61]设计并在大肠杆菌中成功表达了四种同时具有乳酸脱氢酶与甲酸脱氢酶活性的功能蛋白,以苯丙酮酸为底物,其中一种表达融合蛋白的全细胞生物合成苯乳酸产量达到了17.46 g/L,转化率达到了77.6%。另外,还有研究人员选择甘油脱氢酶作为再生系统脱氢酶。Qin等[57]采用了D-乳酸脱氢酶和甘油脱氢酶的双功能融合蛋白来实现辅酶NADH的有效再生。在不添加额外NADH条件下,使用苯丙酮酸和甘油共底物来增加细胞内NADH浓度,使D-苯乳酸的产量达到了5.83 g/(L·h)。
除了辅酶NADH,使用苯丙酮酸作为苯乳酸生产的底物,也会大大增加工业生产的成本。为解决这一问题,研究人员又设计了三酶表达的全细胞催化法,将促进苯丙氨酸转氨作用的L-氨基酸脱氨酶和实现NADH再生的甲酸脱氢酶联合乳酸脱氢酶在工程菌株中共表达,实现以苯丙氨酸为底物生产苯乳酸,同时大大降低生产成本。以该策略进行苯乳酸生物合成,能够在12 h内使30 g/L的苯丙氨酸到苯乳酸的转化率达到100%[62]。Hou等[9]使用同样的酶组合(L-氨基酸脱氨酶、甲酸脱氢酶、乳酸脱氢酶)进行全细胞级联催化,在使用葡萄糖、酵母抽提物以及甘油共底物增加NADH浓度和细胞稳定性后,苯乳酸产量达到了54.0 g/L。
2023年又有新的策略被提出:仅使用苯丙氨酸脱氢酶和l-羟基异己酸脱氢酶两种异源酶,级联催化产生L-苯乳酸,促进辅酶的再生。该策略极简了L-苯乳酸的生物合成过程,使成本降至最低。以苯丙氨酸为底物,该工艺的初始L-苯乳酸产量达到2.53±0.07 g/L。在精心优化诱导酶表达L-苯乳酸的生物合成参数后,L-苯乳酸的产量成功提高到4.68±0.04 g/L,转化率为64.54%±0.29%[63]。
3.3.5 新型培养载体与催化载体的应用
除了传统的液体发酵外,有研究人员提出以凝胶作为培养载体发酵生产苯乳酸。Lou等[64]使用半疏水性聚甲基丙烯酸2-羟基乙酯-甲基丙烯酸丁酯冷冻凝胶作为乳杆菌细胞培养以产生苯乳酸的载体,通过单独培养与共同培养L. casei和L. paracasei菌株发现,以冻胶为细胞载体单独培养L. casei和L. paracasei、以及共培养的最高细胞浓度分别比未加冻胶的提高18.2%、37.5%和22.0%。两株菌共培养的细胞负载冻胶的苯丙氨酸转化为苯乳酸的最大产率分别是单菌培养的5.4倍和4.2倍。更有人设计出可回收生物催化剂装置:将酶和磁性纳米颗粒(MNPs)封装到金属有机骨架(MAF-7)中。Sun等[65]发现LDH/MNPs@MAF-7具有良好的热稳定性和酸碱稳定性,且对有机溶剂具有良好的耐受性,在催化反应中表现出良好的重复使用性能,在重复利用8次后,残余活性仍保持在80%以上。证实该复合材料可以作为一种潜在的、可磁性回收的生物催化剂,用于D-苯乳酸的制备。
4. 苯乳酸在食品领域的应用与前景
随着人们生活水平的提升,大家对食品健康也更加重视。传统保鲜方法如化学法,因为其污染性,不能满足大众的需求,而物理法诸如低温冷冻,其成本较高,且不适合所有场合。生物保鲜法由于其天然无污染,成本低等特性,正在快速抢占市场[66]。苯乳酸作为一种广谱抑菌物质,由于其天然无毒、较强热稳定性、宽pH范围的酸碱稳定性等特性,在水果、奶制品、肉制品、水产品等领域具有广阔的应用前景。
4.1 在水果中的应用
水果作为食品行业重要的一种品类,在食品市场内举足轻重。通常的采摘环境(如较高的温度与湿度)为微生物提供了理想的生长条件,采摘过程中造成的损伤也增大了水果被微生物侵袭的风险,使含水量相对较高的水果极易腐烂,从而造成巨大的经济损失[67],且常温贮藏条件下,一些后熟性水果由于呼吸作用快速到达衰老阶段,也会导致果实品质降低[68]。
苯乳酸在水果贮藏保鲜方面具有巨大潜力。首先,苯乳酸可以通过抑制腐败菌延长水果保鲜期。以D-苯乳酸浸渍的巨峰葡萄,相对清水处理与单独涂膜处理的对照组,其表面细菌总数分别降低99%(P<0.05)和99.3%(P<0.05),霉菌总数分别降低75%(P<0.05)和94.17%(P<0.05),果实腐烂率分别降低20.65%(P<0.05)和23.68%(P<0.05)[69]。被苯乳酸处理过的香蕉疾病指数均显著降低,C. musae菌丝生长被有效抑制,炭疽病的严重程度得到改善[68]。其次,苯乳酸可以调节与呼吸、能量代谢以及抗病相关的基因表达和酶的活性,从而维持水果色度硬度等以保持水果的高品质。苯乳酸处理会降低香蕉的呼吸速率和乙烯的释放,增强香蕉抗病酶β-1,3-葡聚糖酶和几丁质酶的活性,并上调抗病相关基因的表达[68],维持香蕉的硬度与色度,减缓可溶性固形物的积累,推迟后熟衰老过程,延长香蕉的货架期[70]。Xu等[71]发现,苯乳酸浸渍增强了冬枣中L-半乳糖-1,4-内酯脱氢酶、L-半乳糖脱氢酶、抗坏血酸过氧化物酶、脱氢抗坏血酸还原酶、单脱氢抗坏血酸还原酶和谷胱甘肽还原酶的酶活性和基因表达,同时降低抗坏血酸氧化酶的活性。这些变化有效延缓了冬枣可溶性固形物和叶绿素含量的下降,减少了冬枣质量损失。“Zaosu”梨在苯乳酸处理后,梨中葡萄糖-6-磷酸脱氢酶、葡萄糖磷酸异构酶、己糖激酶、烟酰胺腺嘌呤二核苷酸激酶、细胞色素C氧化酶和琥珀酸脱氢酶的活性和基因表达被增强,梨中磷酸脱水激酶、氢离子ATP酶和钙离子ATP酶的表达上调,苹果酸脱氢酶活性、磷酸果糖激酶和苹果酸脱氢酶的表达被抑制。可溶性固形物和还原糖含量增加,梨子的质量损失减少,有效减缓梨子的衰老[72]。
4.2 在奶制品中的应用
奶与奶制品是人类饮食中一个重要的组成部分。作为一种高蛋白高营养的食品,长时间贮藏易受腐败微生物影响导致变质。苯乳酸作为许多乳酸菌的代谢产物,基于其广谱抑菌性,能有效延长奶制品的保质期,对维持乳饮料、牛奶、奶酪等奶制品品质有积极作用[73]。在103~104 CFU/mL蜡样芽孢杆菌孢子污染的乳饮料中,6 MIC(7.5 mg/mL)的苯乳酸可抑制孢子的生长,在储存10 d后,活细胞减少约90%,乳品粘度未发生变化,经6 MIC处理的乳汁饮料的感官特性较好且稳定[74]。在4 ℃下加入3 mg/mL苯乳酸的超高温灭菌全脂牛奶和巴氏灭菌牛奶,在14 d内,李斯特菌的生长都受到了抑制[75]。添加大于1/2 MIC的苯乳酸的脱脂牛奶与奶酪在4 ℃下贮藏能够在21 d内保持对金色葡萄球菌的抗菌活性[23]。苯乳酸还是参与奶酪风味形成的代谢产物[76]。氨基酸分解代谢是奶酪风味形成的主要过程,转氨作用是乳酸菌降解所有氨基酸的主要途径[77]。苯乳酸的合成途经了苯丙氨酸的转氨作用,是羧酸等风味物质形成的中间产物。Kieronczyk等[78]指出,干酪乳杆菌在干酪中,将苯乳酸前体物质苯丙氨酸与苯丙酮酸转化为苯乳酸,随后生成羧酸类强芳香型化合物,为奶酪带来浓郁风味。此外,苯乳酸还具有刺激免疫细胞、减轻肠道炎症等促进健康的作用[74,79],添加苯乳酸的乳制品可以为新型益生奶制品研发提供思路。
4.3 在肉制品中的应用
肉类是优质的蛋白质来源,但是肉制品的高水活度与高营养成分含量易于滋生腐败微生物[80]。苯乳酸凭借其广泛的抑菌能力,在肉制品保鲜行业潜力巨大。浓度≥3 mg/mL的苯乳酸能够显著降低五香牛肉样品在储存过程中的单核细胞增生李斯特菌数量[75]。1.5%的苯乳酸对牛肉表面的大肠杆菌O157:H7、鼠伤寒沙门氏菌DT104具有致死性[81]。由于苯乳酸具有高效抑制肉制品中腐败菌生长的特性,许多研究人员选择将苯乳酸与其他抑菌物质或保鲜方法联合使用。相同终浓度下,苯乳酸与Nisin联合使用效果要优于二者单独对冻猪肉的保鲜作用[39]。冷冻鸡胸肉在苯乳酸(0.4%)辅以大蒜精油(3%)与生姜精油(3%)制成的复合天然保鲜剂处理后,鸡胸肉菌落总数明显低于对照组,挥发性盐基氮(TVBN)上升速率明显低于对照组,肌肉蛋白质的降解速率有效降低,4 ℃下贮藏12 d感官评价仍在可接受范围内[82]。Pius等[83]指出,在70% N2/30% CO2的气调包装条件下,苯乳酸可以显著降低新鲜猪里脊肉的葡萄糖、TVBN值、硫代巴比妥酸值和细菌总量,并能在4 d内维持新鲜猪里脊肉的颜色、气味、质地、持水能力等品质特性,相对于单独使用气调包装,表现出优异的对腐败菌的抑制能力。
4.4 在水产品中的应用
水产品极易受到微生物和生化腐败的影响,为了确保产品的新鲜度和质量,在捕获或屠宰后必须立即进行保存,使用生物保鲜方法是一种可以满足消费者需求与获得高质量产品的可行策略[84]。苯乳酸作为生物保鲜制剂,在水产品保鲜领域也有很大潜力。8倍MIC浓度的苯乳酸能够彻底消除生鲜三文鱼片上的V. parahaemolyticus污染,低浓度的苯乳酸也可以作为抗菌剂抑制V. parahaemolyticus在生鲜三文鱼片上的生长[21]。经过2.5 mg/mL苯乳酸处理后的鮰鱼,贮藏期间蛋白质分解与脂肪氧化程度减弱,持水性与质构特性的降低明显减缓,感官品质劣化被抑制[85]。范晓然[86]考察了苯乳酸作为太湖白虾保鲜剂的可能性,使用20 mg/mL苯乳酸处理后,太湖白虾贮藏过程中的腐败菌得到有效抑制,货架期由4 d提升至8 d;他还将苯乳酸与Nisin、ε-聚赖氨酸组成复合保鲜剂,在气调包装下,该保鲜剂处理的太湖白虾货架期达到10 d,TVBN值在货架期内仅达到27.40 mg/100 g,仍然低于国家规定的安全限值(36.17 mg/100 g),且腐胺也得到很好的控制,有效维持了太湖白虾的品质。以上结果表明,苯乳酸处理后,水产品腐败菌能够被明显抑制,感官品质劣化减缓,有效地延长了水产品的货架期。
4.5 在其他食品中的应用
除了在水果、奶制品、肉制品、水产品保鲜中被广泛应用外,苯乳酸还可应用于鸡汤、面包、蘑菇等食品中。2.5 mg/mL的苯乳酸能够在24 h内对奶油鸡汤中食源性致病菌单增李斯特菌、沙门氏菌、大肠杆菌和金黄色葡萄球菌做到完全抑制[87]。Dopazo等[88]报道,使用产苯乳酸的乳酸菌发酵液作为防霉剂可以延长面包的货架寿命,并且对抗真菌污染的效果优于常用的防霉剂。Ren等[89]研究了苯乳酸对双孢蘑菇中PPO活性的抑制作用,将鲜切的双孢蘑菇碎片分别在0.03和0.05 mol/L的苯乳酸溶液中浸泡15 min,室温自然干燥后于4 ℃下贮藏12 d,苯乳酸处理的鲜切蘑菇切口较蒸馏水处理的对照组抗褐变效果明显。研究表明,苯乳酸是一种可逆的混合型多酚氧化酶(PPO)抑制剂,能够与PPO上的Cu原子螯合,并通过苯基与PPO氨基酸残基形成CH-π的相互作用来实现稳定的疏水结合,从而有效地抑制PPO活性,减少酶促褐变[90]。
4.6 在新型抗菌食品包装材料中的应用
近年来,新型的抗菌包装保鲜技术开始出现在公众视野[90]。由于苯乳酸性质稳定,抑菌谱宽泛,在发现苯乳酸在食品保鲜行业的优秀能力与巨大潜力后,研究人员开始尝试研制添加苯乳酸的抗菌包装材料。Liu等[91]制作了一种以明胶、壳聚糖(CS)、苯乳酸为材料的抗菌水凝胶(GCP)。苯乳酸能有效增强GCP水凝胶的吸水能力,苯乳酸中的羧基与CS中的羟基在酸性条件下反应形成酰胺基,从而增强了水凝胶的结构和稳定性。GCP水凝胶具有多孔的三维网络结构,可持续释放抗菌物质CS与苯乳酸,具有优异的抗菌活性和生物相容性。该水凝胶能有效灭活食源性病原体大肠杆菌与金黄色葡萄球菌,使冷冻鸡肉的保存时间延长至4 d。Zhang等[92]开发并评估了基于富含苯乳酸的CS-聚乙烯醇(PVA)混合物的抗菌活性膜。苯乳酸可以与CS-PVA基质相互作用,显著改善该膜的断裂伸长率、紫外线阻隔性能和热稳定性,并降低了拉伸强度,且对薄膜表面微观结构、厚度、色泽、水分含量、水溶性和水蒸气渗透性均无影响。该膜能够有效抑制食源性腐败菌生长,可用于食品包装应用。Sun等[93]以壳聚糖和纤维素为成膜材料,甘油为增塑剂,无机抗菌剂ZnO和天然化合物苯乳酸为主要抗菌成分制备了纤维素/CS/ZnO/苯乳酸(CZP)复合膜。苯乳酸的加入提高了该复合膜对金黄色葡萄球菌、大肠杆菌、黑曲霉和红青霉的抗菌活性,并降低了吸水性和溶胀性。综上所述,苯乳酸在可生物降解的抗菌食品包装应用中具有很大的潜力。
5. 苯乳酸的安全性评价
苯乳酸主要由公认安全(Generally recognized as safety,GRAS)乳酸菌,如瑞士乳杆菌、植物乳杆菌等代谢产生。尽管苯乳酸尚未作为杀菌剂被列入GB 2760-2014的目录中,但已有许多例子直接或间接证明了其绿色无毒的特性。苯乳酸曾被发现存在于新西兰的麦卢卡蜂蜜内,一些奶酪中也因为乳酸菌代谢而含有这种物质[94]。苯乳酸在添加到鸡饲料中后,提升了肉鸡免疫力,对肉鸡健康并没有带来负面影响[86]。Maione等[15]在探究苯乳酸治疗白色念珠菌引起的阴道念珠菌病可行性时,选用了免疫系统与哺乳动物先天免疫反应相似的G. mellonella幼虫来替代体内模型以评估苯乳酸的毒性,结果表明,低剂量的苯乳酸(2.5 mg/mL)并没有引起幼虫死亡或中毒迹象,证明了苯乳酸使用的安全性。然而,目前验证苯乳酸功能的实验载体并非人体,对于苯乳酸在人体上应用的安全性,还需要探索苯乳酸在人体内的代谢动力学和动物毒理学来全面评估。
6. 总结与展望
苯乳酸是一种主要由瑞士乳杆菌、植物乳杆菌等乳酸菌代谢产生的小分子抑菌化合物。可损伤微生物细胞壁、抑制生物膜形成、破坏细胞膜完整性、干扰线粒体能量代谢等,因此对众多微生物都具有抑制能力,具有广谱抑菌特性。通过优化培养条件、提升脱氢酶活性、促进辅酶再生、基因重组等方法可显著提升苯乳酸生物合成能力和效率。苯乳酸在水果、奶制品、肉制品、水产品等食品加工领域都具有广阔的应用前景。
当前,对苯乳酸抑菌能力的研究大部分还停留在抑菌效果上,由于苯乳酸对微生物的抑菌作用涉及细胞壁、细胞膜、线粒体等细胞结构变化和相关基因表达调节,因此,苯乳酸抑菌机制及其与其它抑菌物质的协同作用机制仍需要深入挖掘。另外,研究表明基因重组工程菌株的苯乳酸产量普遍更高。尽管现已有很多以大肠杆菌生物合成天然化合物的例子,但工程菌株在食品添加剂生产中的生物安全性仍有待验证,而且,由于特定基因工程菌的制备过程复杂及多次传代后可能出现的不稳定性,从自然界中筛选来源安全、无危害的优良野生菌株还有着很大的探索空间。因此,选育苯乳酸高产安全菌株、解析其合成通路并优化发酵技术是提升苯乳酸工业生产产量的主要方向。
未来,更全面系统地抑菌机制的阐明将为苯乳酸在食品乃至其他领域的应用提供更多思路。随着苯乳酸天然菌株的不断挖掘、生物合成与发酵技术的日益完善,将会形成一条安全、高产、绿色的苯乳酸产业链。
-
表 1 苯乳酸的抑菌能力、作用部位和抑菌机理
Table 1 Antibacterial ability, action sites, and mechanism of PLA
类别 受体菌株 作用部位 抑菌机制 最小抑菌
浓度(mg/mL)参考文献 真菌 白假丝酵母
(Candida albicans)DNA 下调ALS3和ERG11基因的表达水平,
从而抑制其生物膜的形成7.5 [15] 黄曲霉
(A. flavus)细胞膜、DNA 破坏细胞膜;改变细胞膜通透性;
干扰线粒体能量代谢6 [16] 米根霉
(Rhizopus oryzae)DNA 干扰线粒体能量代谢 8 [17] 细菌 单增李斯特菌
(L. monocytogenes)细胞膜、DNA 破坏细胞膜;与DNA结合干扰正常细胞功能 1.25 [18] 阴沟肠杆菌
(E. Cloacae)细胞壁、细胞膜 裂解细胞;破坏细胞膜 − [19] 金黄色葡萄球菌_45
(S. aureus_45)− − 3.5 [20] 大肠杆菌44752
(E. Coli 44752)细胞膜、DNA 改变细胞膜通透性;与DNA结合干扰正常细胞功能 2.5 [18] 副溶血性弧菌
(V. parahaemolyticus)细胞膜、DNA 增加细胞膜通透性,导致钾离子渗漏;与DNA结合,影响正常生理功能;降低细菌流动性并抑制生物膜的形成 3.2 [21] 铜绿假单胞菌
(P. aeruginosa PAO1)− − 0.2 [22] 福氏志贺菌_14
(S. flexneri_14)− 抑制生物膜形成 2.45 [23] 沙门氏菌
(Salmonella)细胞膜、DNA 破坏细胞膜;促进ATP消耗 − [24] 注:“−”为未提及。 表 2 自然界中产苯乳酸的野生菌株
Table 2 Wild strains producing PLA in nature
野生菌株 苯乳酸产量(mg/L) 筛选材料 参考文献 魏斯氏菌DY2(Weissella sp.DY2) 2450.0 鱼肠道 [6] 戊糖片球菌SK25(Pediococcus pentosaceus SK25) 47.2 泡菜 [40] 面包乳杆菌NWAFU 1078(L. crustorum NWAFU 1078) 7.5 自然发酵蔬菜 [41] 瑞士乳杆菌L15(L. Helveticus L15) 110.4 食醋 [42] 白地霉(Geotrichum candidum) 410.0 − [43] 唾液乳杆菌YW-7(L. salivary YW-7) 1470.0 猪粪便 [44] 植物乳杆菌LY-78(L. plantarum LY-78) 246.0 传统发酵食品 [45] 植物乳杆菌YM-5-2n(L. plantarum YM-5-2n) 130.0 发酵大豆,牛奶 [46] 注:“−”为未提及。 -
[1] WOODRUFF T J. Making it real—the environmental burden of disease. What does it take to make people pay attention to the environment and health?[J]. Journal of Clinical Endocrinology and Metabolism,2015,100(4):1241−1244. doi: 10.1210/jc.2015-1622
[2] HUANG C H, CHEN W C, GAO Y H, et al. Production of phenyllactic acid from porphyra residues by lactic acid bacterial fermentation[J]. Processes,2021,9(4):678−688. doi: 10.3390/pr9040678
[3] WU H, GUANG C, ZHANG W, et al. Recent development of phenyllactic acid:Physicochemical properties, biotechnological production strategies and applications[J]. Critical Reviews in Biotechnology,2023,43(2):293−308. doi: 10.1080/07388551.2021.2010645
[4] GUAN J, HAN C, GUAN Y, et al. Optimizational production of phenyllactic acid by a Lactobacillus buchneri strain via uniform design with overlay sampling methodology[J]. Chinese Journal of Chemical Engineering,2019,27(2):418−425. doi: 10.1016/j.cjche.2018.04.005
[5] 陆永祥, 李平, 白史且. 苯乳酸的研究进展[J]. 草学,2020(4):19−24. [LU Y X, LI P, BAI S Q. Research progress on phenyllactic acid[J]. Cao Xue,2020(4):19−24.] LU Y X, LI P, BAI S Q. Research progress on phenyllactic acid[J]. Cao Xue, 2020(4): 19−24.
[6] 吕孟敏, 白凤翎, 崔方超, 等. 鱼肠道中高产苯乳酸乳酸菌的筛选、鉴定及发酵条件优化[J]. 中国酿造,2023,42(9):125−130. [LÜ M M, BAI F L, CUI F C, et al. Screening, identification, and optimization of fermentation conditions for high-yield phenyllactic acid bacteria in fish intestines[J]. Chinese Brewing,2023,42(9):125−130.] LÜ M M, BAI F L, CUI F C, et al. Screening, identification, and optimization of fermentation conditions for high-yield phenyllactic acid bacteria in fish intestines[J]. Chinese Brewing, 2023, 42(9): 125−130.
[7] LUO X, WANG Y, ZHENG W, et al. Simultaneous improvement of the thermostability and activity of lactic dehydrogenase from Lactobacillus rossiae through rational design[J]. RSC Adv,2022,12(51):33251. doi: 10.1039/D2RA05599F
[8] LI T, QIN Z, WANG D, et al. Coenzyme self-sufficiency system-recent advances in microbial production of high-value chemical phenyllactic acid[J]. World J Microbiol Biotechnol,2022,39(1):36−46.
[9] HOU Y, GAO B, CUI J, et al. Combination of multi-enzyme expression fine-tuning and co-substrates addition improves phenyllactic acid production with an Escherichia coli whole-cell biocatalyst[J]. Bioresource Technology,2019,287:121423. doi: 10.1016/j.biortech.2019.121423
[10] 程一凡, 刘念丽, 侯颖. 苯乳酸的研究进展[J]. 发酵科技通讯,2023,52(4):212−217. [CHENG Y F, LIU N L, HOU Y. Research progress on phenyllactic acid[J]. Fermentation Technology Communication,2023,52(4):212−217.] CHENG Y F, LIU N L, HOU Y. Research progress on phenyllactic acid[J]. Fermentation Technology Communication, 2023, 52(4): 212−217.
[11] RAJANIKAR R V, NATARAJ B H, NAITHANI H, et al. Phenyllactic acid:A green compound for food biopreservation[J]. Food Control,2021,128:108184. doi: 10.1016/j.foodcont.2021.108184
[12] NAVARE P S, MACDONALD J C. Investigation of stability and structure in three homochiral and heterochiral crystalline forms of 3-phenyllactic acid[J]. Crystal Growth & Design,2011,11(6):2422−2428.
[13] CORTES-ZAVALETA O, LOPEZ-MALO A, HERNANDEZ-MENDOZA A, et al. Antifungal activity of lactobacilli and its relationship with 3-phenyllactic acid production[J]. Int J Food Microbiol,2014,173:30−35. doi: 10.1016/j.ijfoodmicro.2013.12.016
[14] DIEULEVEUX V, VAN DER PYL D, CHATAUD J, et al. Purification and characterization of anti-listeria compounds produced by Geotrichum candidum[J]. Appl Environ Microbiol,1998,64(2):800−803. doi: 10.1128/AEM.64.2.800-803.1998
[15] MAIONE A, IMPARATO M, BUONANNO A, et al. Anti-biofilm activity of phenyllactic acid against clinical isolates of fluconazole-resistant Candida albicans[J]. J Fungi (Basel),2023,9(3):335−351. doi: 10.3390/jof9030335
[16] LI M, YAO B, MENG X. Inhibitory effect and possible mechanism of phenyllactic acid on Aspergillus flavus spore germination[J]. J Basic Microbiol,2022,62(12):1457−1466. doi: 10.1002/jobm.202200274
[17] FAN W, LI B, DU N, et al. Energy metabolism as the target of 3-phenyllactic acid against Rhizopus oryzae[J]. Int J Food Microbiol,2022,369:109606. doi: 10.1016/j.ijfoodmicro.2022.109606
[18] NING Y, YAN A, YANG K, et al. Antibacterial activity of phenyllactic acid against Listeria monocytogenes and Escherichia coli by dual mechanisms[J]. Food Chemistry,2017,228:533−540. doi: 10.1016/j.foodchem.2017.01.112
[19] LIU F, WANG F, DU L, et al. Antibacterial and antibiofilm activity of phenyllactic acid against Enterobacter cloacae[J]. Food Control,2018,84:442−448. doi: 10.1016/j.foodcont.2017.09.004
[20] JIANG Y H, YING J P, XIN W G, et al. Antibacterial activity and action target of phenyllactic acid against Staphylococcus aureus and its application in skim milk and cheese[J]. Journal of Dairy Science,2022,105(12):9463−9475. doi: 10.3168/jds.2022-22262
[21] FANG M, WANG R, AGYEKUMWAA A K, et al. Antibacterial effect of phenyllactic acid against Vibrio parahaemolyticus and its application on raw salmon fillets[J]. LWT,2022,154:112586. doi: 10.1016/j.lwt.2021.112586
[22] CHATTERJEE M, D'MORRIS S, PAUL V, et al. Mechanistic understanding of phenyllactic acid mediated inhibition of quorum sensing and biofilm development in Pseudomonas aeruginosa[J]. Appl Microbiol Biotechnol,2017,101(22):8223−8236. doi: 10.1007/s00253-017-8546-4
[23] JIANG Y H, YANG L Y, XIN W G, et al. Combined antibacterial and antibiofilm activity of phenyllactic acid and bacteriocin XJS01 against Shigella flexneri[J]. Food Bioscience,2022,45:101512. doi: 10.1016/j.fbio.2021.101512
[24] ZHOU Q, GU R, LI P, et al. Anti-Salmonella mode of action of natural L-phenyl lactic acid purified from Lactobacillus plantarum ZJ316[J]. Appl Microbiol Biotechnol,2020,104(12):5283−5292. doi: 10.1007/s00253-020-10503-4
[25] 胡虹, 张秀江, 向凌云, 等. 高产D-苯乳酸菌株的选育及发酵工艺的试验研究[J]. 饲料研究,2021,44(22):73−77. [HU H, ZHANG X J, XIANG L Y, et al. Experimental study on the breeding and fermentation process of high-yield D-phenyllactic acid strains[J]. Feed Research,2021,44(22):73−77.] HU H, ZHANG X J, XIANG L Y, et al. Experimental study on the breeding and fermentation process of high-yield D-phenyllactic acid strains[J]. Feed Research, 2021, 44(22): 73−77.
[26] LUO X, ZHANG Y, YIN L, et al. Efficient synthesis of d-phenyllactic acid by a whole-cell biocatalyst co-expressing glucose dehydrogenase and a novel d-lactate dehydrogenase from Lactobacillus rossiae[J]. 3 Biotech,2020,10(1):1−9. doi: 10.3390/biotech10010001
[27] LUO X, ZHANG Y, YIN F, et al. Enzymological characterization of a novel d-lactate dehydrogenase from Lactobacillus rossiae and its application in d-phenyllactic acid synthesis[J]. 3 Biotech,2020,10(3):1−2.
[28] DIEULEVEUX V, LEMARINIER S, GUEGUEN M. Antimicrobial spectrum and target site of D-3-phenyllactic acid[J]. Int J Food Microbiol,1998,40(3):177−183. doi: 10.1016/S0168-1605(98)00031-2
[29] SVANSTROM A, BOVERI S, BOSTROM E, et al. The lactic acid bacteria metabolite phenyllactic acid inhibits both radial growth and sporulation of filamentous fungi[J]. BMC Res Notes,2013,6(1):1−9. doi: 10.1186/1756-0500-6-1
[30] SORRENTINO E, TREMONTE P, SUCCI M, et al. Detection of antilisterial activity of 3-phenyllactic acid using Listeria innocua as a model[J]. Front Microbiol,2018,9:1373−1381. doi: 10.3389/fmicb.2018.01373
[31] SHAKYA S, DANSHIITSOODOL N, NODA M, et al. 3-Phenyllactic acid generated in medicinal plant extracts fermented with plant-derived lactic acid bacteria inhibits the biofilm synthesis of Aggregatibacter actinomycetemcomitans[J]. Front Microbiol,2022,13:991144. doi: 10.3389/fmicb.2022.991144
[32] ZHAO C, PENTTINEN P, ZHANG L, et al. Mechanism of inhibiting the growth and aflatoxin B(1) biosynthesis of Aspergillus flavus by phenyllactic acid[J]. Toxins (Basel),2023,15(6):370−385. doi: 10.3390/toxins15060370
[33] SHARIFF M, CHATTERJEE M, MORRIS S D, et al. Enhanced inhibition of Pseudomonas aeruginosa virulence factor production and biofilm development by sublethal concentrations of eugenol and phenyllactic acid[J]. Lett Appl Microbiol,2022,75(5):1336−1345. doi: 10.1111/lam.13803
[34] REUTER K, STEINBACH A, HELMS V. Interfering with bacterial quorum sensing[J]. Perspect Medicin Chem,2016,8:1−15.
[35] 宁亚维, 付浴男, 何建卓, 等. 苯乳酸和醋酸联用对单核细胞增生李斯特菌的协同抑菌机理[J]. 食品科学,2020,41(23):70−76. [NING Y W, FU Y N, HE J Z, et al. Synergistic antibacterial mechanism of the combination of phenyllactic acid and acetic acid against Listeria monocytogenes[J]. Food Science,2020,41(23):70−76.] NING Y W, FU Y N, HE J Z, et al. Synergistic antibacterial mechanism of the combination of phenyllactic acid and acetic acid against Listeria monocytogenes[J]. Food Science, 2020, 41(23): 70−76.
[36] WANG R, HU X, AGYEKUMWAA A K, et al. Synergistic effect of kojic acid and tea polyphenols on bacterial inhibition and quality maintenance of refrigerated sea bass (Lateolabrax japonicus) fillets[J]. LWT,2021,137:110452. doi: 10.1016/j.lwt.2020.110452
[37] NING Y, FU Y, HOU L, et al. iTRAQ-based quantitative proteomic analysis of synergistic antibacterial mechanism of phenyllactic acid and lactic acid against Bacillus cereus[J]. Food Res Int,2021,139:109562. doi: 10.1016/j.foodres.2020.109562
[38] 闫爱红. 苯乳酸与常用食品防腐剂和有机酸的联合抑菌作用及机理研究[D]. 石家庄:河北科技大学, 2016. [YAN A H. Study on the combined antibacterial effect and mechanism of phenyllactic acid with commonly used food preservatives and organic acids[D]. Shijiazhuang:Hebei University of Science and Technology, 2016.] YAN A H. Study on the combined antibacterial effect and mechanism of phenyllactic acid with commonly used food preservatives and organic acids[D]. Shijiazhuang: Hebei University of Science and Technology, 2016.
[39] LIU J, HUANG R, SONG Q, et al. Combinational antibacterial activity of nisin and 3-phenyllactic acid and their co-production by engineered Lactococcus lactis[J]. Frontiers in Bioengineering and Biotechnology,2021,9:612105. doi: 10.3389/fbioe.2021.612105
[40] YU S, ZHOU C, ZHANG T, et al. 3-Phenyllactic acid production in milk by SK25 during laboratory fermentation process[J]. Journal of Dairy Science,2015,98(2):813−817. doi: 10.3168/jds.2014-8645
[41] XU J J, SUN J Z, SI K L, et al. 3-Phenyllactic acid production by Lactobacillus crustorum strains isolated from naturally fermented vegetables[J]. LWT,2021,149:111780. doi: 10.1016/j.lwt.2021.111780
[42] 赵天行. 产苯乳酸乳酸菌的生物学特性分析及其在食醋生产中的应用[D]. 武汉:华中农业大学, 2022. [ZHAO T X. Biological characteristics analysis of lactic acid bacteria producing phenyllactic acid and their application in vinegar production[D]. Wuhan:Huazhong Agricultural University, 2022.] ZHAO T X. Biological characteristics analysis of lactic acid bacteria producing phenyllactic acid and their application in vinegar production[D]. Wuhan: Huazhong Agricultural University, 2022.
[43] KAWTHARANI H, SNINI S P, HEANG S, et al. Phenyllactic acid produced by Geotrichum candidum reduces Fusarium sporotrichioides and F. langsethiae growth and T-2 toxin concentration[J]. Toxins (Basel),2020,12(4):209−224. doi: 10.3390/toxins12040209
[44] 魏娜. 猪源乳酸菌分离鉴定及初步应用[D]. 成都:四川农业大学, 2016. [WEI N. Isolation, identification and preliminary application of lactic acid bacteria from pigs[D]. Chengdu:Sichuan Agricultural University, 2016.] WEI N. Isolation, identification and preliminary application of lactic acid bacteria from pigs[D]. Chengdu: Sichuan Agricultural University, 2016.
[45] 李士龙. 传统发酵食品中高产苯乳酸菌株的筛选及发酵工艺条件优化[D]. 大庆:黑龙江八一农垦大学, 2012. [LI S L. Screening of high-yield strains of phenyllactic acid in traditional fermented foods and optimization of fermentation process conditions[D]. Daqing:Heilongjiang Bayi Agricultural University, 2012.] LI S L. Screening of high-yield strains of phenyllactic acid in traditional fermented foods and optimization of fermentation process conditions[D]. Daqing: Heilongjiang Bayi Agricultural University, 2012.
[46] 吴文妤. 植物乳杆菌YM-4-3苯乳酸合成代谢调控机制及相关基因的功能研究[D]. 昆明:昆明理工大学, 2021. [WU W Y. Research on the regulatory mechanism of phenyllactic acid synthesis metabolism and related genes in Lactobacillus plantarum YM-4-3[D]. Kunming:Kunming University of Science and Technology, 2021.] WU W Y. Research on the regulatory mechanism of phenyllactic acid synthesis metabolism and related genes in Lactobacillus plantarum YM-4-3[D]. Kunming: Kunming University of Science and Technology, 2021.
[47] 倪正, 关今韬, 沈绍传, 等. 苯乳酸的微生物合成及分离研究进展[J]. 化工进展,2016,35(11):3627−3633. [NI Z, GUAN J T, SHEN S C, et al. An overview of recent advances in microbial synthesis and separation of phenyllactic acid[J]. Chemical Industry and Engineering Progress,2016,35(11):3627−3633.] NI Z, GUAN J T, SHEN S C, et al. An overview of recent advances in microbial synthesis and separation of phenyllactic acid[J]. Chemical Industry and Engineering Progress, 2016, 35(11): 3627−3633.
[48] WU W, DENG G, LIU C, et al. Optimization and multiomic basis of phenyllactic acid overproduction by Lactobacillus plantarum[J]. J Agric Food Chem,2020,68(6):1741−1749. doi: 10.1021/acs.jafc.9b07136
[49] KAWAGUCHI H, MIYAGAWA H, NAKAMURA-TSURUTA S, et al. Enhanced phenyllactic acid production in Escherichia coli via oxygen limitation and shikimate pathway gene expression[J]. Biotechnology Journal,2019,14(6):10.
[50] YOO J A, LIM Y M, YOON M H. Production and antifungal effect of 3-phenyllactic acid (PLA) by lactic acid bacteria[J]. Journal of Applied Biological Chemistry,2016,59(3):173−178. doi: 10.3839/jabc.2016.032
[51] VERMEULEN N, GÁNZLE M G, VOGEL R F. Influence of peptide supply and cosubstrates on phenylalanine metabolism of Lactobacillus sanfranciscensis DSM20451T and Lactobacillus plantarum TMW1.468[J]. Journal of Agricultural and Food Chemistry,2006,54(11):3832−3829. doi: 10.1021/jf052733e
[52] ZHANG D, ZHANG T, LEI Y, et al. Enantioselective biosynthesis of L-phenyllactic acid from phenylpyruvic acid in vitro by L-lactate dehydrogenase coupling with glucose dehydrogenase[J]. Front Bioeng Biotechnol,2022,10:846489. doi: 10.3389/fbioe.2022.846489
[53] 田雪娇. 高产苯乳酸菌株的诱变选育及发酵条件优化[D]. 大庆:黑龙江八一农垦大学. 2013. [TIAN X J. Breeding of high-yield phenyllactic acid strains and optimization of fermentation conditions[D]. Daqing:Heilongjiang Bayi Agricultural University, 2013.] TIAN X J. Breeding of high-yield phenyllactic acid strains and optimization of fermentation conditions[D]. Daqing: Heilongjiang Bayi Agricultural University, 2013.
[54] ZHOU Y, SUN X, HU J, et al. Enhanced catalytic activity and stability of lactate dehydrogenase for cascade catalysis of D-PLA by rational design[J]. J Biotechnol,2024,382:1−7. doi: 10.1016/j.jbiotec.2024.01.004
[55] HOU Y, HOSSAIN G S, LI J, et al. Production of phenylpyruvic acid from L-phenylalanine using an L-amino acid deaminase from Proteus mirabilis:Comparison of enzymatic and whole-cell biotransformation approaches[J]. Appl Microbiol Biotechnol,2015,99(20):8391−402. doi: 10.1007/s00253-015-6757-0
[56] REEVE H A, LAUTERBACH L, LENZ O, et al. Enzyme-modified particles for selective biocatalytic hydrogenation by hydrogen-driven NADH recycling[J]. ChemCatChem,2015,7(21):3480−3487. doi: 10.1002/cctc.201500766
[57] QIN Z, WANG D, LUO R, et al. Using unnatural protein fusions to engineer a coenzyme self-sufficiency system for D-phenyllactic acid biosynthesis in Escherichia coli[J]. Front Bioeng Biotechnol,2021,9:795885. doi: 10.3389/fbioe.2021.795885
[58] ROCHA R A, NORTH A J, SPEIGHT R E, et al. Cofactor and process engineering for nicotinamide recycling and retention in intensified biocatalysis[J]. Catalysts,2022,12(11):1454−1466. doi: 10.3390/catal12111454
[59] 晏雄鹰, 王振, 娄吉芸, 等. 生物燃料高效生产微生物细胞工厂构建研究进展[J]. 合成生物学, 2023, 4(6):1082-121. [YAN X Y, WANG Z, LOU J Y, et al. Research progress on the construction of microbial cell factories for efficient production of biofuels[J]. Synthetic Biology, 2023, 4(6):1082.] YAN X Y, WANG Z, LOU J Y, et al. Research progress on the construction of microbial cell factories for efficient production of biofuels[J]. Synthetic Biology, 2023, 4(6): 1082.
[60] ZHOU X, ZHOU J, XIN F, et al. Heterologous expression of a novel d-lactate dehydrogenase from Lactobacillus sp. ZX1 and its application for d-phenyllactic acid production[J]. International Journal of Biological Macromolecules,2018,119:1171−1178. doi: 10.1016/j.ijbiomac.2018.08.036
[61] ZHU Y, JIANG Z, CHEN J, et al. Fusion of D-lactate dehydrogenase and formate dehydrogenase for increasing production of (R)-3-phenyllactic acid in recombinant Escherichia coli BL21 (DE3)[J]. Journal of Biobased Materials and Bioenergy,2017,11(4):372−378. doi: 10.1166/jbmb.2017.1680
[62] WANG X, HOU Y, LIU L, et al. A new approach for efficient synthesis of phenyllactic acid from L-phenylalanine:Pathway design and cofactor engineering[J]. Journal of Food Biochemistry,2018,42(5):e12584. doi: 10.1111/jfbc.12584
[63] XU H, CHENG Q, QIU Y, et al. A novel strategy for whole-cell biotransformation enabling simultaneous L-phenyllactic acid production and coenzyme regeneration[J]. Journal of Agricultural and Food Chemistry,2023,71(51):20772−20781. doi: 10.1021/acs.jafc.3c06387
[64] LOU X, JIANG Y, ZHAO F, et al. Preparation and characterization of semi-hydrophobic cryogels for culture of Lactobacillus strains and bioconversion towards phenyllactic acid bioproduction[J]. Biochemical Engineering Journal,2022,179:108312. doi: 10.1016/j.bej.2021.108312
[65] SUN X, HU J, WANG Y, et al. One-pot encapsulation of lactate dehydrogenase and Fe3O4 nanoparticles into a metal-organic framework:A novel magnetic recyclable biocatalyst for the synthesis of D-phenyllactic acid[J]. Front Bioeng Biotechnol,2022,10:1124450.
[66] CHEN H, YAN X, DU G, et al. Recent developments in antifungal lactic acid bacteria:Application, screening methods, separation, purification of antifungal compounds and antifungal mechanisms[J]. Critical Reviews in Food Science and Nutrition,2021,63(15):2544−2558.
[67] 林广智. 水果保鲜纸基材料的结构与性能研究[D]. 济南:齐鲁工业大学, 2023. [LIN G Z. Research on the structure and properties of fruit preservation paper based materials[D]. Jinan:Qilu University of Technology, 2023.] LIN G Z. Research on the structure and properties of fruit preservation paper based materials[D]. Jinan: Qilu University of Technology, 2023.
[68] GAO Y, LI Y, LI F, et al. Phenyllactic acid treatment for controlling anthracnose disease (Colletotrichum musae) and preserving banana fruit quality during storage[J]. Physiological and Molecular Plant Pathology,2024,129:102181. doi: 10.1016/j.pmpp.2023.102181
[69] WAN Y L , CHEN L S, XIE D, et al. The effect of D-phenyllactic acid combined with coating treatment on anti-microbial and preservation of grapes during storage[J]. Food and Machinery, 2018, 34(1):117-120.
[70] 高羽莎, 李奕星, 李芬芳, 等. 苯乳酸处理对香蕉果实后熟品质的影响[J]. 保鲜与加工,2024,24(2):8−14. [GAO Y S, LI Y X, LI F F, et al. The effect of phenyllactic acid treatment on the ripening quality of banana fruits[J]. Preservation and Processing,2024,24(2):8−14.] doi: 10.3969/j.issn.1009-6221.2024.02.002 GAO Y S, LI Y X, LI F F, et al. The effect of phenyllactic acid treatment on the ripening quality of banana fruits[J]. Preservation and Processing, 2024, 24(2): 8−14. doi: 10.3969/j.issn.1009-6221.2024.02.002
[71] XU H, LIU J, JIN Y, et al. Phenyllactic acid maintains the postharvest quality of winter jujube fruit via activating ascorbic acid metabolism[J]. Scientia Horticulturae,2023,322:112443. doi: 10.1016/j.scienta.2023.112443
[72] ZHANG S, LI C, WANG M, et al. Phenyllactic acid maintains the storage quality of ‘Zaosu’ pears by regulating respiration and energy metabolism[J]. Postharvest Biology and Technology,2024,207:112607. doi: 10.1016/j.postharvbio.2023.112607
[73] HUANG P, YU L, TIAN F, et al. Untargeted metabolomics revealed the key metabolites in milk fermented with starter cultures containing Lactobacillus plantarum CCFM8610[J]. LWT,2022,165:113768. doi: 10.1016/j.lwt.2022.113768
[74] ZHANG D, TONG D, WANG Z, et al. Inactivation mechanism of phenyllactic acid against Bacillus cereus spores and its application in milk beverage[J]. Food Chemistry,2024,453:139601. doi: 10.1016/j.foodchem.2024.139601
[75] JIANG X, JIANG C, YU T, et al. Phenyllactic acid application to control Listeria monocytogenes biofilms and its growth in milk and spiced beef[J]. Int J Food Microbiol,2022,381:109910. doi: 10.1016/j.ijfoodmicro.2022.109910
[76] VALERIO F. Production of phenyllactic acid by lactic acid bacteria:An approach to the selection of strains contributing to food quality and preservation[J]. FEMS Microbiology Letters,2004,233(2):289−295. doi: 10.1111/j.1574-6968.2004.tb09494.x
[77] YVON M, RIJNEN L. Cheese flavour formation by amino acid catabolism[J]. International Dairy Journal,2001,11(4−7):185−201. doi: 10.1016/S0958-6946(01)00049-8
[78] KIERONCZYK A, SKEIE S, LANGSRUD T, et al. Cooperation between Lactococcus lactis and nonstarter Lactobacilli in the formation of cheese aroma from amino acids[J]. Applied and Environmental Microbiology,2003,69(2):734−739. doi: 10.1128/AEM.69.2.734-739.2003
[79] ZHOU Q, GU R, XUE B, et al. Phenyl lactic acid alleviates Samonella Typhimurium-induced colitis via regulating microbiota composition, SCFA production and inflammatory responses[J]. Food & Function,2021,12(12):5591−5606.
[80] 路飞, 顾孟清, 朱轶群, 等. 天然保鲜剂的抗菌机理及在肉制品中的应用[J]. 沈阳师范大学学报(自然科学版),2023,41(5):419−426. [LU F, GU M Q, ZHU Y Q. et al. The antibacterial mechanism of natural preservatives and their application in meat products[J]. Journal of Shenyang Normal University (Natural Science Edition),2023,41(5):419−426.] LU F, GU M Q, ZHU Y Q. et al. The antibacterial mechanism of natural preservatives and their application in meat products[J]. Journal of Shenyang Normal University (Natural Science Edition), 2023, 41(5): 419−426.
[81] ZHENG R, ZHAO T, HUNG Y C, et al. Evaluation of bactericidal effects of phenyllactic acid on Escherichia coli O157:H7 and Salmonella Typhimurium on beef meat[J]. Journal of Food Protection,2019,82(12):2016−2022. doi: 10.4315/0362-028X.JFP-19-217
[82] 刘绍鹏, 曹秀娟, 贺峰. 苯乳酸复合保鲜剂在鸡肉保鲜中的应用[J]. 肉类工业,2019(6):46−50. [LIU S P, CAO X J, HE F. Application of phenyllactic acid compound preservative in chicken preservation[J]. Meat Industry,2019(6):46−50.] doi: 10.3969/j.issn.1008-5467.2019.06.010 LIU S P, CAO X J, HE F. Application of phenyllactic acid compound preservative in chicken preservation[J]. Meat Industry, 2019(6): 46−50. doi: 10.3969/j.issn.1008-5467.2019.06.010
[83] PIUS BASSEY A, PEI LIU P, CHEN J, et al. Antibacterial efficacy of phenyllactic acid against Pseudomonas lundensis and Brochothrix thermosphacta and its synergistic application on modified atmosphere/air-packaged fresh pork loins[J]. Food Chemistry,2024,430:137002. doi: 10.1016/j.foodchem.2023.137002
[84] CAMPOS C A, AUBOURG S P, SCHELEGUEDA L I. Use of biopreservation to improve the quality of fresh aquatic products [M]. Postharvest and Postmortem Processing of Raw Food Materials, Elsevier, 2022:343-378.
[85] 黄琪, 王世哲, 胡传峰, 等. 苯乳酸处理对鮰鱼低温贮藏品质的影响[J]. 肉类研究,2023,37(11):35−41. [HUANG Q, WANG S Z, HU C F, et al. The effect of phenyllactic acid treatment on the low-temperature storage quality of catfish[J]. Meat Research,2023,37(11):35−41.] HUANG Q, WANG S Z, HU C F, et al. The effect of phenyllactic acid treatment on the low-temperature storage quality of catfish[J]. Meat Research, 2023, 37(11): 35−41.
[86] 范晓然. 太湖白虾低温贮藏时的菌相分析及其保鲜剂的开发[D]. 南京:南京财经大学, 2018. [FAN X R. Microflora analysis and preservation of Taihu white prawn (Exopalaemon modestus) during low temperature storage[D]. Nanjing:Nanjing University of Finance Economics, 2018.] FAN X R. Microflora analysis and preservation of Taihu white prawn (Exopalaemon modestus) during low temperature storage[D]. Nanjing: Nanjing University of Finance Economics, 2018.
[87] MANU D K. Antimicrobial effectiveness of phenyllactic acid against foodborne pathogenicbacteria and Penicillium and Aspergillus molds[D]. ISU:University of Iowa, 2012.
[88] DOPAZO V, ILLUECA F, LUZ C, et al. Evaluation of shelf life and technological properties of bread elaborated with lactic acid bacteria fermented whey as a bio-preservation ingredient[J]. LWT,2023,174:114427. doi: 10.1016/j.lwt.2023.114427
[89] REN H, DU N, NIU X, et al. Inhibitory effects of L-3-phenyllacitc acid on the activity of mushnroom pholyphenol oxidase [J]. Food Science and Technology, 2021, 41(suppl 1):343-351.
[90] 孔保华, 刁新平. 冷却肉包装保鲜技术的研究进展[J]. 肉类研究,2008(2):54−59. [KONG B H, DIAO X P. The review of extending the shelf-life of chilled meat by packaging[J]. Meat Research,2008(2):54−59.] doi: 10.3969/j.issn.1001-8123.2008.02.015 KONG B H, DIAO X P. The review of extending the shelf-life of chilled meat by packaging[J]. Meat Research, 2008(2): 54−59. doi: 10.3969/j.issn.1001-8123.2008.02.015
[91] LIU Y, WANG R, WANG D, et al. Development of a food packaging antibacterial hydrogel based on gelatin, chitosan, and 3-phenyllactic acid for the shelf-life extension of chilled chicken[J]. Food Hydrocolloids, 2022, 127.
[92] ZHANG J, CHEN J, ZHANG C, et al. Characterization and antibacterial properties of chitosan–polyvinyl alcohol-3-phenyllactic acid as a biodegradable active food packaging[J]. Food Packaging and Shelf Life, 2022, 34.
[93] SUN X, YIN L, ZHU H, et al. Enhanced antimicrobial cellulose/chitosan/ZnO biodegradable composite membrane[J]. Membranes (Basel),2022,12(2):239−251. doi: 10.3390/membranes12020239
[94] 李兴峰, 江波, 潘蓓蕾. 新型生物防腐剂——苯乳酸在食品中的研究与应用[J]. 食品与发酵工业,2007(5):87−91. [LI X F, JIANG B, PAN B L. Research and application in food of phenyllactic acid as a novel biopreservative:A review[J]. Food and Fermentation Industries,2007(5):87−91.] doi: 10.3321/j.issn:0253-990X.2007.05.022 LI X F, JIANG B, PAN B L. Research and application in food of phenyllactic acid as a novel biopreservative: A review[J]. Food and Fermentation Industries, 2007(5): 87−91. doi: 10.3321/j.issn:0253-990X.2007.05.022





 下载:
下载:
 下载:
下载:



