Extraction of Saponins from Xanthoceras sorbifolium Bunge Leaves Using Deep Eutectic Solvents and Their Inhibitory Activity against Postharvest Pathogenic Fungi
-
摘要: 为研究低共熔溶剂(DES)提取文冠果叶皂苷的效果及其抑菌活性,采用了43种DES提取文冠果叶皂苷,选择得率最高的氯化胆碱:乳酸(1:1)为提取溶剂,通过单因素和Box-Behnken试验优化提取工艺,用超高效液相色谱-串联质谱(UPLC-MS/MS)对提取物进行成分鉴定;通过扫描电子显微镜(SEM)、傅立叶变换红外光谱(FT-IR)和X-射线衍射(XRD)分析探究了DES对文冠果叶皂苷的提取机制。此外,考察了文冠果叶皂苷对危害果蔬的6种典型真菌的抑菌效果。结果表明,在DES浓度47.00%、液固比42.00 mL/g、提取温度43.00 ℃的条件下,DES提取文冠果叶皂苷得率达到(10.22±0.28)%,较传统溶剂得率提高了38.8%,是一种应用潜力很大的文冠果叶皂苷提取方法;DES从文冠果叶中提取的皂苷类化合物主要包括羟基积雪草酸、皂苷元D、甘草次酸、齐墩果酸、人参皂苷Rg3、山楂酸、柴胡皂苷A和积雪草酸;DES通过溶解细胞壁中的部分木质素和半纤维素,导致细胞壁破损,因此皂苷类化合物更易溶出;文冠果叶皂苷能有效抑制6种典型果蔬采后病原真菌中的3种—黑曲霉、米根霉和黄曲霉孢子的萌发,其中对米根霉的孢子萌发抑制效果最好,抑制率达到(78.76±2.56)%,且文冠果叶皂苷通过抑制真菌的抗氧化酶活性而抑制其生长,表明文冠果叶皂苷在果蔬采后保鲜方面具有良好的应用前景。Abstract: To investigate the effect of deep eutectic solvents (DES) on the extraction of saponins from Xanthoceras sorbifolium Bunge leaves (XLs) and their antifungal properties, a total of 43 DES were utilized for the extraction. Among these, choline chloride:lactic acid (1:1) exhibited the highest yield was therefore chosen as the extraction solvent. Optimization of the extraction procedure was carried out through one-way and Box-Behnken experiments. The extracts were characterized using ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS). The mechanism of XLs saponins extraction by DES was investigated by scanning electron microscopy (SEM), Fourier-transform infrared spectroscopy (FT-IR), and X-ray diffraction (XRD). Furthermore, the inhibitory effects of XLs saponins on six typical fungi that posed a threat to fruits and vegetables were evaluated. Results showed that under the conditions of DES concentration of 47.00%, liquid-solid ratio of 42.00 mL/g, and extraction temperature of 43.00 ℃, the yield of XLs saponin using DES reached 10.22%±0.28%, representing a 38.8% increase compared to traditional solvents. It was an extraction method of XLs saponin with great potential for application. The saponins extracted by DES from XLs mainly included madecassic acid, saikogenin D, glycyrrhetinic acid, oleanolic acid, ginsenoside Rg3, maslinic acid, saikosaponin A and asiatic acid. DES was observed to disrupt cell integrity and cell wall structure by dissolving lignin and hemicellulose components, facilitating the release and solubilization of saponins. Additionally, XLs saponin demonstrated effective inhibition of spores of Aspergillus niger, Rhizopus oryzae and Aspergillus flavus of three out of the six typical post-harvest pathogenic fungi of fruits and vegetables. Among the pathogenic fungi studied, the spore germination of Rhizopus oryzae was inhibited with the best effect, the inhibition rate reached 78.76%±2.56%, and XLs saponin inhibited the growth of the fungus by suppressing the antioxidant enzyme activity. These results suggest promising applications for XLs saponins in the postharvest preservation of fruits and vegetables.
-
文冠果(Xanthoceras sorbifolium Bunge)属于无患子科,是我国特有的一种食用油料树种。随着国家木本粮油战略的推进,近几年文冠果种植业在我国北方得到了快速发展,但其加工业明显滞后。文冠果叶与果实的产量相当,一般作为废弃物处理,2023年卫健委将其纳入新食品原料,因而目前广受关注。研究发现,文冠果叶(Xanthoceras sorbifolium Bunge leaves,XLs)富含皂苷,且含量明显高于其他部位[1]。文冠果叶皂苷对大肠杆菌、金黄色葡萄球菌和肠炎沙门氏菌等细菌均有抑制能力[2],但是文冠果叶皂苷对真菌的抑菌效果研究还不充分。
文冠果叶皂苷的制备一般采用醇溶液,存在有机试剂需求量大,能耗高、提取时间长、成本高且污染环境等问题[3]。低共熔溶剂(Deep eutectic solvents,DES)是由几种天然成分的共晶混合物组成的流体系统[4],因具备诸多优点(易合成、价廉、环境友好等[5−6])而广受关注。近年来,DES已被广泛用于从植物中提取天然产物,包括多糖[7]、酚类[8]和黄酮类[9]等。DES提取文冠果叶皂苷还鲜有报道,但Yang等[10]定制并比较了21种DES对Dioscoreae Nipponicae Rhizoma中四种甾体皂苷的提取效率,发现4种甾体皂苷的提取效率受DES类型的影响,不同的DES导致不同的得率,Yu等[11]采用由氯化胆碱和甲基脲组成的DES从油茶籽粕中提取茶皂苷,得率达到94.36 mg/g,与传统的乙醇提取相比,得率提高了27%,证实了DES作为皂苷类化合物提取溶剂的可行性和有效性。
果蔬采后易受多种真菌的侵染,由此造成严重的经济损失,特别是发展中国家,其损失高达12%以上[12],相关问题亟待解决。合成化学物质常被用作保鲜抑菌剂来抑制果蔬表面腐败真菌的生长,但其导致的环境污染、食品安全和菌株耐药等问题不容忽视。如何安全且有效地控制果蔬采后易受多种真菌侵染的问题,一直是果蔬采后研究的重点。植物源保鲜抑菌剂有着安全、无毒、来源丰富的优点,受到越来越多研究人员的关注,因此探寻植物源保鲜抑菌剂代替化学保鲜抑菌剂是非常必要的。
本研究拟以传统溶剂提取文冠果叶皂苷为对照,采用Box-Behnken设计方案优化DES提取文冠果叶皂苷条件,用高效液相色谱-串联质谱(UPLC-MS/MS)分析提取物的组分,并通过SEM、FT-IR、XRD探究其提取机制,以期为DES代替传统有机溶剂提取文冠果叶皂苷提供理论和实践依据。同时,探讨文冠果叶皂苷对6种典型果蔬腐败真菌的抑制效果,以明确文冠果叶皂苷作为新型果蔬保鲜抑菌剂的应用潜力。
1. 材料与方法
1.1 材料与仪器
文冠果叶 于2023年3月采集自中国山东省潍坊市,常温晾干后,用高速粉碎机将叶片研磨并过筛得到40目细粉,储存于阴凉干燥处,以备进一步研究;香草醛、氯化胆碱(ChCl)、甜菜碱(Bet)、L-脯氨酸(Pro)、丙二酸(Mal)、尿素(Ur)、甲基脲(Met)、乳酸(La) 上海麦克林有限公司;齐墩果酸标准品(HPLC≥98%) 上海源叶生物科技有限公司;丙三醇(Gly)、葡萄糖(Glu) 国药集团化学试剂有限公司;过氧化氢酶(CAT)测定试剂盒、超氧化物歧化酶(SOD)测定试剂盒 南京建成生物工程研究所;供试的果蔬采后病原真菌:黑曲霉(Aspergillus niger)、米根霉(Rhizopus oryzae)、链格孢菌(Alternaria nees)、炭疽菌(Colletotrichum fructicola)、黄曲霉(Aspergillus flavus)、灰葡萄孢菌(Botrytis cinerea) 均由南京林业大学轻工与食品学院食品贮藏与保鲜实验室分离、鉴定并保存[13−15]。
SB-5200DTD超声波清洗机 宁波新芝生物科技股份有限公司;EASY-nLC 1000超高压液相、QExactive高分辨质谱、C18(75 μm×15 cm×3 μm)色谱柱 赛默飞世尔科技(中国)有限公司;SpectraMaxi3x酶标仪 上海美谷生物科技有限公司;Quanta200环境扫描电子显微镜 美国FEI公司;VERTEX80V傅立叶变换红外光谱仪 德国Bruker公司;XRD Ultima IV组合型多功能水平X-射线衍射仪 日本理学株式会社。
1.2 实验方法
1.2.1 DES的制备
DES的制备方法在Duan等[16]的方法上稍作修改。以ChCl、Bet和Pro为氢键接受体(HBA),以各种酰胺、羧酸、醇和糖(Mal、Ur、Met、Gly、La和Glu)为氢键供体(HBD)制备DES。在本研究中,将HBA:HBD以1:1、1:2、1:3三种摩尔比混合后,在80 ℃下进行磁力搅拌,直至形成清澈均匀的液体,即可得到DES。
1.2.2 文冠果叶皂苷的提取
DES提取:将0.1 g文冠果叶粉末与1 mL 70% DES溶液混合,在60 ℃下提取30 min。传统溶剂提取:将0.1 g文冠果叶粉末分别与1 mL 70%乙醇和1 mL水混合,在60 ℃下提取30 min。乙醇-超声提取:在陈先强[17]的方法上稍作修改,将0.1 g文冠果叶粉末与1 mL 70%乙醇混合,然后在60 ℃、140 W的超声波功率下提取30 min。提取后的样品在4000 r/min下离心10 min,收集上清液用于测定皂苷含量。
1.2.3 文冠果叶皂苷含量的测定
皂苷含量的测定采用改良的香草醛-浓硫酸比色法[18]。将不同浓度的齐墩果酸标准溶液(20 μL)与香草醛(8%,w/v,20 μL)和硫酸(77%,w/v,200 μL)在96孔板中混合。混合物在60 ℃水浴中反应10 min,然后在冰水浴中反应5 min。最后,在540 nm波长处测量吸光度。根据齐墩果酸溶液的质量浓度(X)和吸光度(Y)得到标准曲线方程为:Y=0.7186X+0.4086(R2=0.9919)。取文冠果叶皂苷提取液20 μL,以其代替齐墩果酸标准溶液,按照以上步骤测定其在540 nm处的吸光度,根据标准曲线方程得到提取液中皂苷的质量浓度,再按式(1)计算文冠果叶皂苷的得率。
皂苷得率(%)=Vρ1000M×100 (1) 式中,V表示提取溶剂的体积,mL;ρ表示提取液中皂苷的质量浓度,mg/mL;M表示文冠果叶粉末质量,g。
1.2.4 文冠果叶皂苷提取工艺的优化
根据上述步骤,筛选出提取效果最好的DES溶剂,用于提取条件优化。固定条件:DES浓度70%、液固比40 mL/g、提取温度60 ℃,提取时间30 min,考察DES浓度(10%、20%、30%、40%、50%、60%、70%、80%、90%、100%)、液固比(10、20、30、40、50 mL/g)、提取温度(30、40、50、60、70 ℃)以及提取时间(10、20、30、40、50、60 min)对皂苷得率的影响。根据单因素实验的结果,选择对皂苷得率影响较大的DES浓度(A,%)、液固比(B,mL/g)和温度(C,℃),采用Design-ExpertVer.12.0设计Box-Behnken试验,进行三因素三水平响应面设计,以皂苷得率(Y)作为响应值,最终得到DES提取皂苷的最佳条件(表1)。
表 1 Box-Behnken试验因素与水平Table 1. Factors and levels of Box-Behnken experiment变量 水平 −1 0 1 A:DES浓度(%) 30 40 50 B:液固比(mL/g) 30 40 50 C:温度(℃) 40 50 60 1.2.5 文冠果叶皂苷纯化与鉴定
参照Tang等[19]和Yang等[20]的方法,采用改良的大孔树脂柱层析法分离纯化DES提取的文冠果叶皂苷,取适量提取液用纯水稀释,用AB-8大孔树脂吸附,依次用纯水、0.1% NaOH和纯水洗脱。最后,用70%的乙醇洗脱分离出皂苷溶液,并在旋转蒸发仪中浓缩,最后收集浓缩液并用真空冷冻干燥器干燥后备用。采用超高压液相色谱结合高分辨率质谱仪分析经大孔吸附树脂纯化后文冠果叶皂苷里的主要化合物。液相色谱条件:柱温40 ℃;流量0.3 mL/min;进样量1 μL;正离子模式下,以0.1%甲酸(溶剂A)和0.1%甲酸乙腈(溶剂B)为流动相。负离子模式下,以2 mmol/L乙酸铵(溶剂A)和乙腈(溶剂B)为流动相。质谱条件:电喷雾离子源(ESI),温度320 ℃;离子喷雾电压(IS)4500 V(正离子模式)/–4000 V(负离子模式);碰撞诱导电力参数设置为高。最后,采用MSDIAL4.60结合Metlin、Mass Bank、MoNA的数据库,得到鉴定结果。
1.2.6 提取前后文冠果叶的特征分析
1.2.6.1 扫描电子显微镜(SEM)
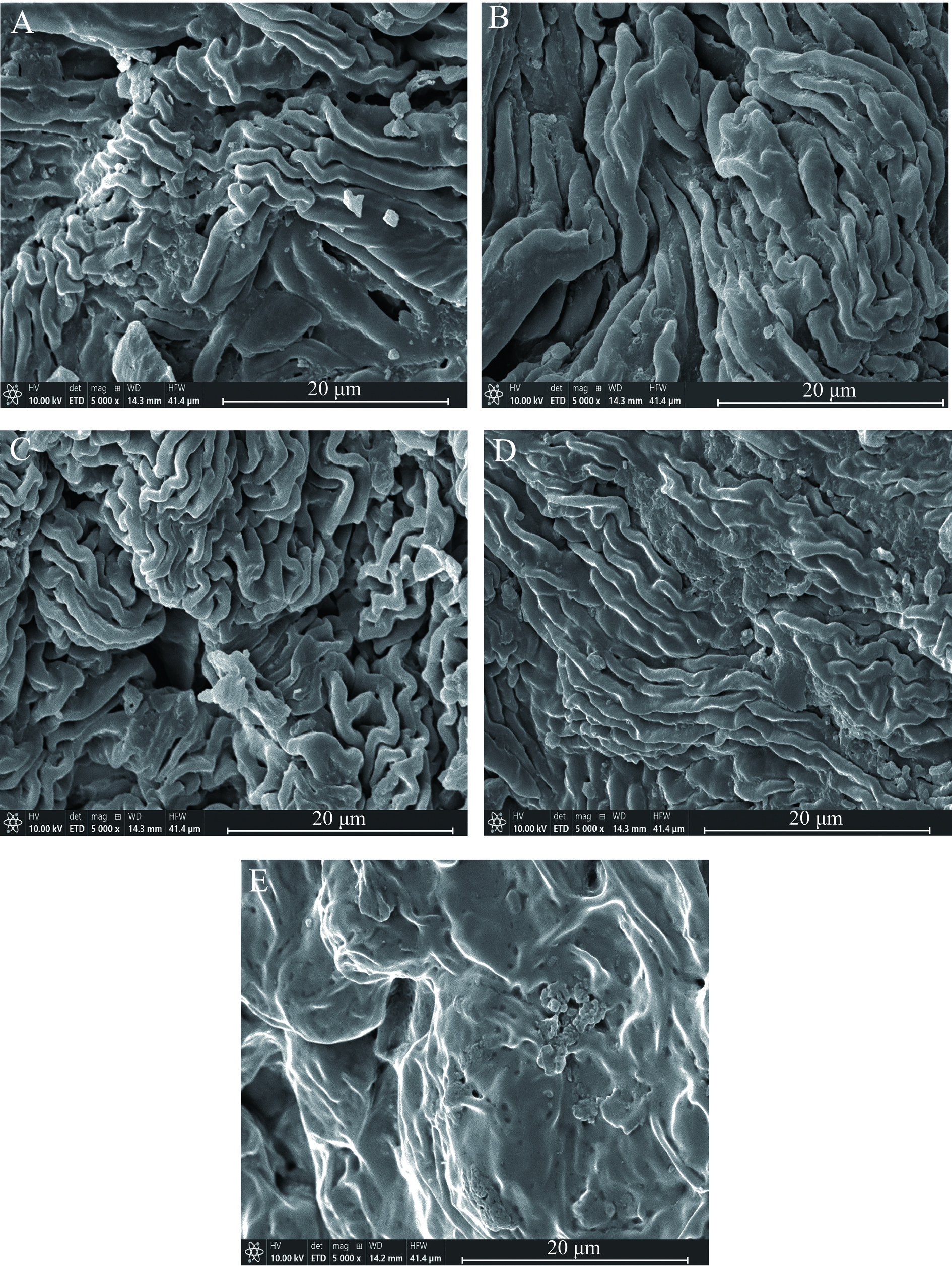
前处理方法同1.2.2,离心后收集文冠果叶残渣干燥后备用。使用环境扫描电子显微镜观察了文冠果叶在不同提取方法(水、乙醇、乙醇-超声、DES)处理前后的微观结构。样品干燥后,取少量不同提取方法(水、乙醇、乙醇-超声、DES)处理前后的文冠果叶粘在铜盘上,喷上一层薄薄的金。在10.0 kV的加速电压下对样品进行检测,并以5000倍的放大率进行成像。
1.2.6.2 傅立叶变换红外光谱(FT-IR)
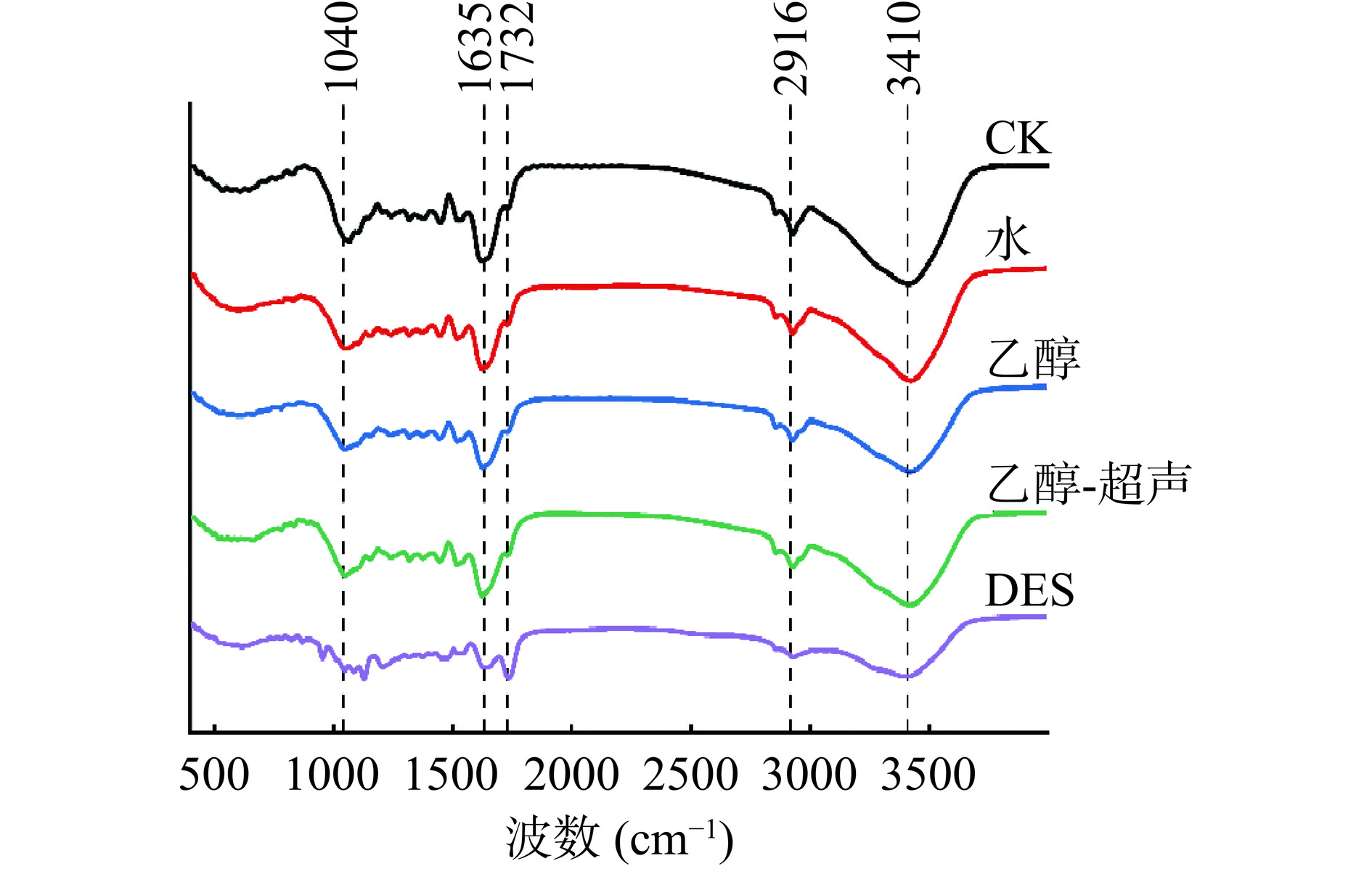
使用傅立叶变换红外光谱仪分析文冠果叶在不同提取方法(水、乙醇、乙醇-超声、DES)处理前后的官能团变化。取少量不同提取方法(水、乙醇、乙醇-超声、DES)处理前后的文冠果叶,加入KBr后用玛瑙研钵进行研磨并压制成透明圆片,以32次扫描/min的速度对每个样品进行一次分析,记录范围500~4000 cm−1,分辨率为2 cm−1。总结晶度指数(TCI)由1375 cm−1和2900 cm−1的吸收比决定。TCI与纤维素结晶度成正比[21]。横向有序度指数(LOI)由1427和897 cm−1的吸收比决定。LOI与纤维素中整体有序程度有关[22]。
TCI=A1375cm−1A2900cm−1 (2) LOI=A1427cm−1A897cm−1 (3) 1.2.6.3 X-射线衍射(XRD)
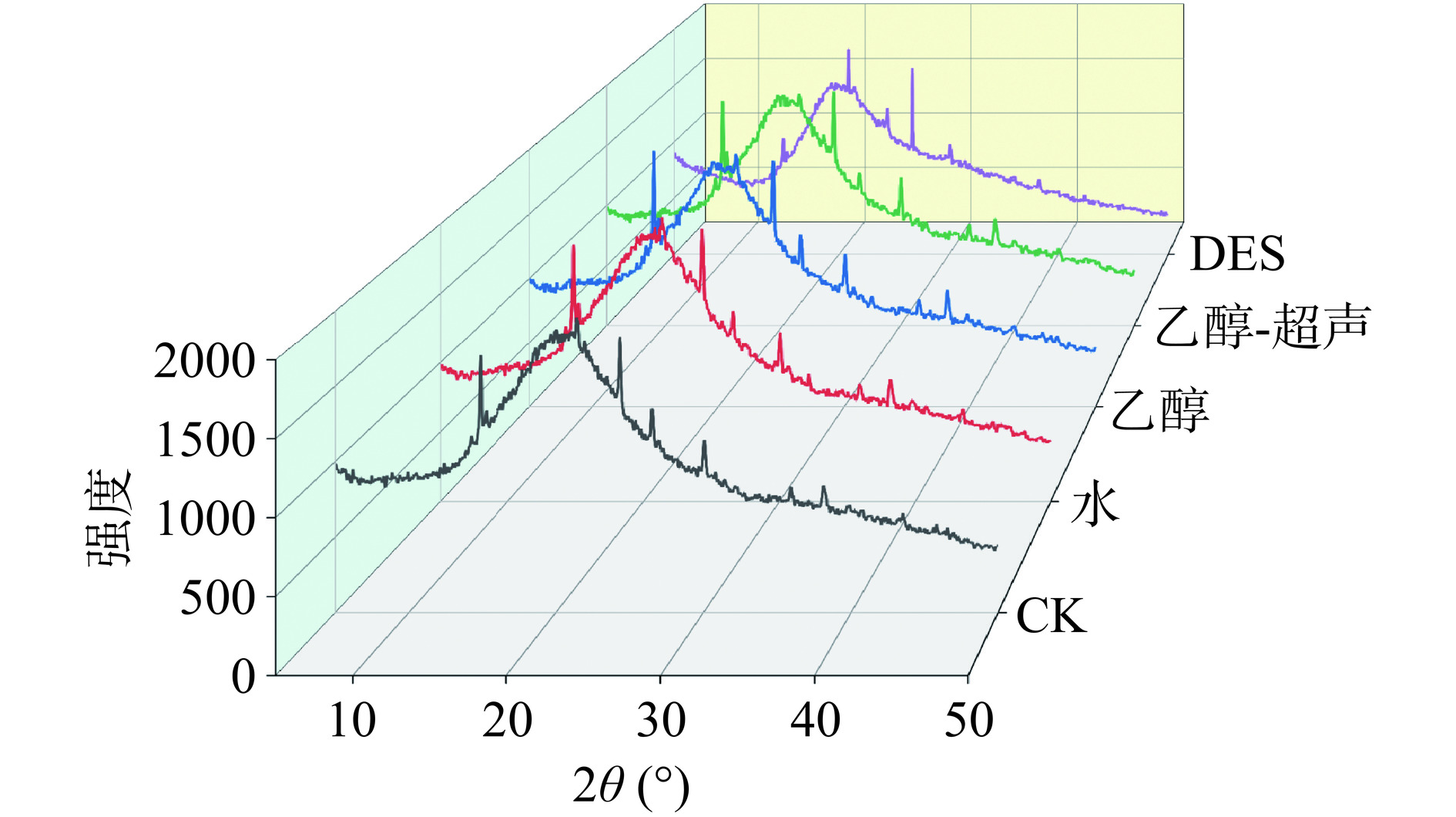
在组合型多功能水平X-射线衍射仪上对不同提取方法(水、乙醇、乙醇-超声、DES)处理前后的文冠果叶进行结晶度研究。分析在5°~50°范围内进行,使用Cu-Kα作为单色辐射。固体样品的结晶度指数(Crystallinity index,CrI)是根据Segal表达式计算得出的,如式(4)所示。
CrI(%)=I002−IamI002×100 (4) 式中,I002表示布拉格角(2θ)为22°时确定的纤维素结晶区的强度;Iam表示布拉格角(2θ)为18°时确定的纤维素无定形区的强度。
1.2.7 文冠果叶皂苷抑制果蔬采后真菌试验
1.2.7.1 采后病原真菌孢子萌发率的测定
采用孢子萌发悬滴法进行试验[23],步骤如下:从平板收集供试的果蔬采后病原真菌的孢子,制备成1×105~1×107个孢子/mL的悬浮液,并加入1%葡萄糖溶液。取上述制备好的孢子悬浮液,与等体积文冠果叶皂苷溶液混合均匀使文冠果叶皂苷终浓度为10 mg/mL,将混合液滴于凹玻片上,置于带浅层水的培养皿中,加盖置于适宜温度的培养箱中定时观察。以孢子芽管长于孢子半径为萌发,当对照组孢子70%以上萌发时,观察并记录处理组孢子萌发情况,按式(6)计算孢子萌发抑制率。用光学显微镜拍摄处理12 h后各组孢子萌发情况。
孢子萌发率(%)=孢子萌发数孢子总数×100 (5) 孢子萌发抑制率(%)=对照萌发率−处理萌发率对照萌发率×100 (6) 1.2.7.2 采后病原真菌抗氧化酶活性的测定
取1.2.7.1配制好的米根霉孢子悬浮液分别与等体积文冠果叶皂苷溶液混合使其终浓度为0.5、2.5、5、10 mg/mL,以纯水处理作对照,置于37 ℃培养12 h,经离心后,弃上清液,测定米根霉菌体中CAT、SOD活性。CAT测定采用钼酸铵法,SOD测定采用WST-1法。
CAT活性(U/g)=(OD对照−OD测试)×271×V样总V样×T×M (7) SOD活性(U/g)=(OD对照−OD测试)V样总1/2OD对照MV样 (8) 式中,V样表示样本体系下取样量,mL;V样总表示样本匀浆总体积,mL;T表示反应时间,60 s;M表示组织样本质量,g。
1.3 数据处理
所有实验均设三个重复,结果以平均值±标准差表示。使用SPSS 27.0进行单因素方差分析,并通过邓肯检验进行比较或最小显著差异检验,统计结果以P<0.05为有显著性差异。
2. 结果与分析
2.1 DES的制备
本实验选择了价廉、提取效果好的3种HBA和6种HBD,以不同的摩尔比,欲制备54种DES,最终成功制备了43种稳定、透明、粘稠的低共熔溶剂(表2)。在制备过程中发现,不同的HBA对DES的制备影响较大,如ChCl因其吸湿性更容易制备DES,制备出的DES流动性优于以Bet和Pro为HBA制备出的DES。ChCl和Bet能与Glu按不同摩尔比1:1、1:2、1:3的比例制备出DES,而Pro不能与Glu按摩尔比1:1、1:2、1:3的比例制备出DES,因此Pro形成DES的能力最弱。这与之前的研究一致,表明HBA的化学结构在DES的形成和稳定过程中起着重要作用[16]。此外,HBD的物质状态也会影响DES的形成和稳定。当HBD处于液态(Gly和La)时,很容易制备出无沉淀、透明且粘度低的DES。
表 2 不同DES的皂苷得率Table 2. Saponin yield of different DESsDES溶剂 HBA:HBD摩尔比 得率(%) Mal Ur Met Gly La Glu ChCl 1:1 6.24±0.09qr 6.19±0.33r 8.60±0.18bc − 9.26±0.07a 3.28±0.61w 1:2 5.75±0.14s 6.58±0.03pq 8.05±0.28efgh 8.61±0.02bc 8.15±0.19defg 3.23±0.65w 1:3 − 5.81±0.13s − 6.94±0.12nop 8.46±0.10bcd 5.25±0.42u Bet 1:1 8.30±0.18cdef 7.72±0.08hij 7.51±0.08ijkl 8.24±0.01cdefg 7.48±0.07ijkl 4.78±0.26v 1:2 5.64±0.02st 7.37±0.02ijklm 7.17±0.12lmn 8.81±0.01b 7.89±0.11gh 4.76±0.46v 1:3 − 6.69±0.14op − 7.41±0.01ijkl 7.69±0.13hijk 3.36±0.57w Pro 1:1 5.32±0.09tu 8.18±0.04defg 6.75±0.14op 6.18±0.02r 8.42±0.06cde − 1:2 − 7.01±0.07mno − 7.36±0.03jklm 7.31±0.31klmn − 1:3 − 8.59±0.06bc 7.76±0.06hi 7.40±0.02ijklm 7.96±0.18fgh − 注:“−”为该摩尔比例下未能成功制备DES;不同字母表示有显著性差异(P<0.05),图1~图4、图9、表6同。 2.2 DES筛选
将制备成功的43种DES溶剂用于提取皂苷,各DES处理的皂苷得率见表2。传统溶剂选取了极性大的水,常用作提取皂苷的有机溶剂乙醇以及目前文冠果叶皂苷得率最高的乙醇-超声提取法作对照,水、乙醇、乙醇-超声的得率分别为4.95%,5.67%、7.36%,由表2可知大部分DES得率高于水、乙醇得率,由此证明了DES作为提取溶剂的高效性。
在43种DES溶剂中,ChCl:La(1:1)和Bet:Gly(1:2)的皂苷得率最高,分别为9.26%和8.81%。此外,部分HBD为Glu的DES得率低于水得率,部分DES得率与乙醇-超声的得率差异不显著,说明DES的类型对皂苷的得率差异较大,这可能是由于不同类型的DES对有效成分的溶解能力不同所致;不同HBD制备的DES对皂苷的提取能力不同,这可能是由于不同HBD形成的DES能与皂苷形成不同强度的分子间氢键[24−26],从而导致不同的提取能力。
先前的研究表明,DES的粘度和表面张力可能会随着HBD百分比的增加而降低,以改善扩散传质[26],但Bet:Gly(1:2)的得率8.81%高于Bet:Gly(1:1)的得率8.24%和Bet:Gly(1:3)的得率7.41%,而Bet:Ur(1:1)的得率7.72%高于Bet:Ur(1:2)的得率7.37%和Bet:Ur(1:3)的得率6.69%。因此,从HBD的比例来判断DES的提取能力是不可取的,这与刘政均[27]的研究一致。一般来说,DES的理化性质,如溶解度、粘度、表面张力、极性等[28],及其内在的相互作用都会影响其提取生物活性化合物的能力[29]。皂苷的结构复杂,因此其提取和分离研究较为复杂,尚未被完全探究。最终,本研究选择得率最高的ChCl:La(1:1)进行后续的工艺优化实验。
2.3 单因素实验结果分析
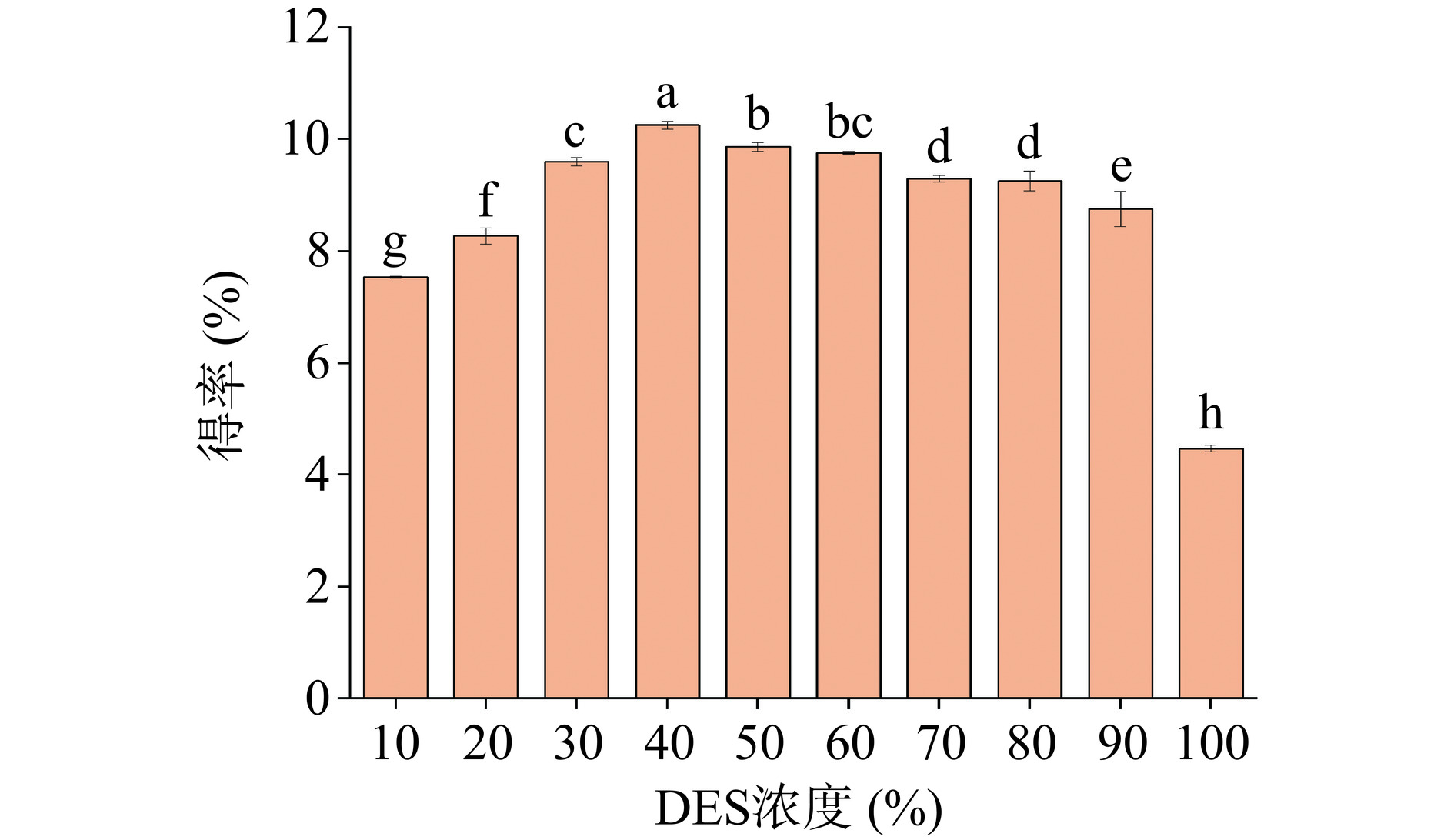
如图1所示,当DES的浓度为40%时,得率最高,这与Lei等[30]的研究结果相似。这是由于DES溶剂的高粘度问题阻碍了相间的有效传质,影响了得率,同时也会影响溶剂的极性和表面张力[31]。然而,过高的含水量会降低DES与皂苷之间的相互作用力,降低得率[32]。
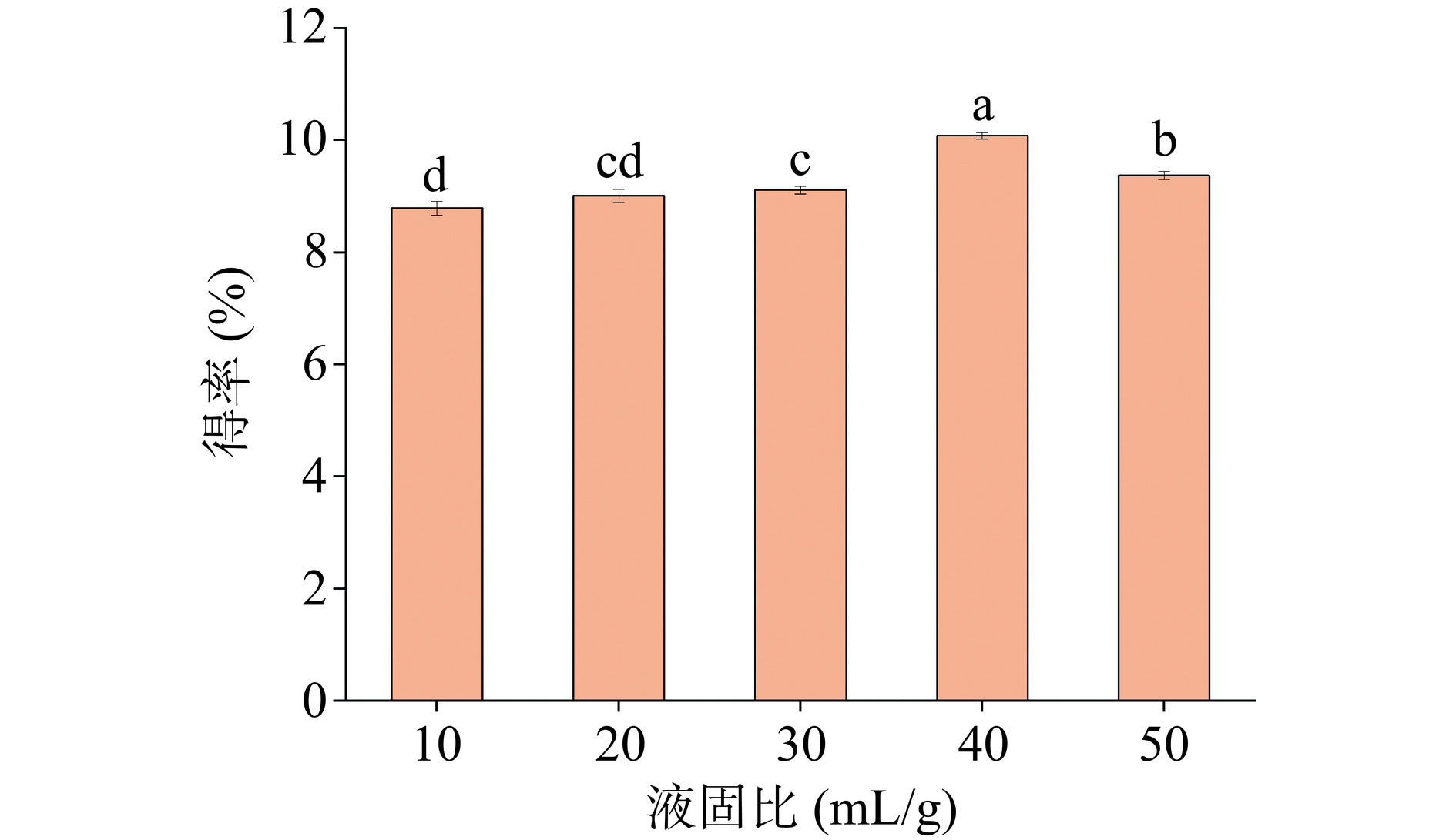
萃取剂的用量也会影响得率。如图2所示,当液固比为10~50 mL/g时,皂苷的得率呈先上升后下降的趋势。当液固比为40 mL/g时,皂苷的得率达到最大值10.08%。这一趋势与Shirsath等[33]的研究结果一致,这可能是由于液固比相对较小时,溶剂量少,不足以进入样品;液固比相对较大时,溶质浓度小,传质推动力大[34],提取速率相对较快。但随着液固比的进一步增大,提取剂的量不断增加,其他杂质的溶解也会增多[35],杂质与皂苷争夺DES溶剂,导致皂苷的得率下降。
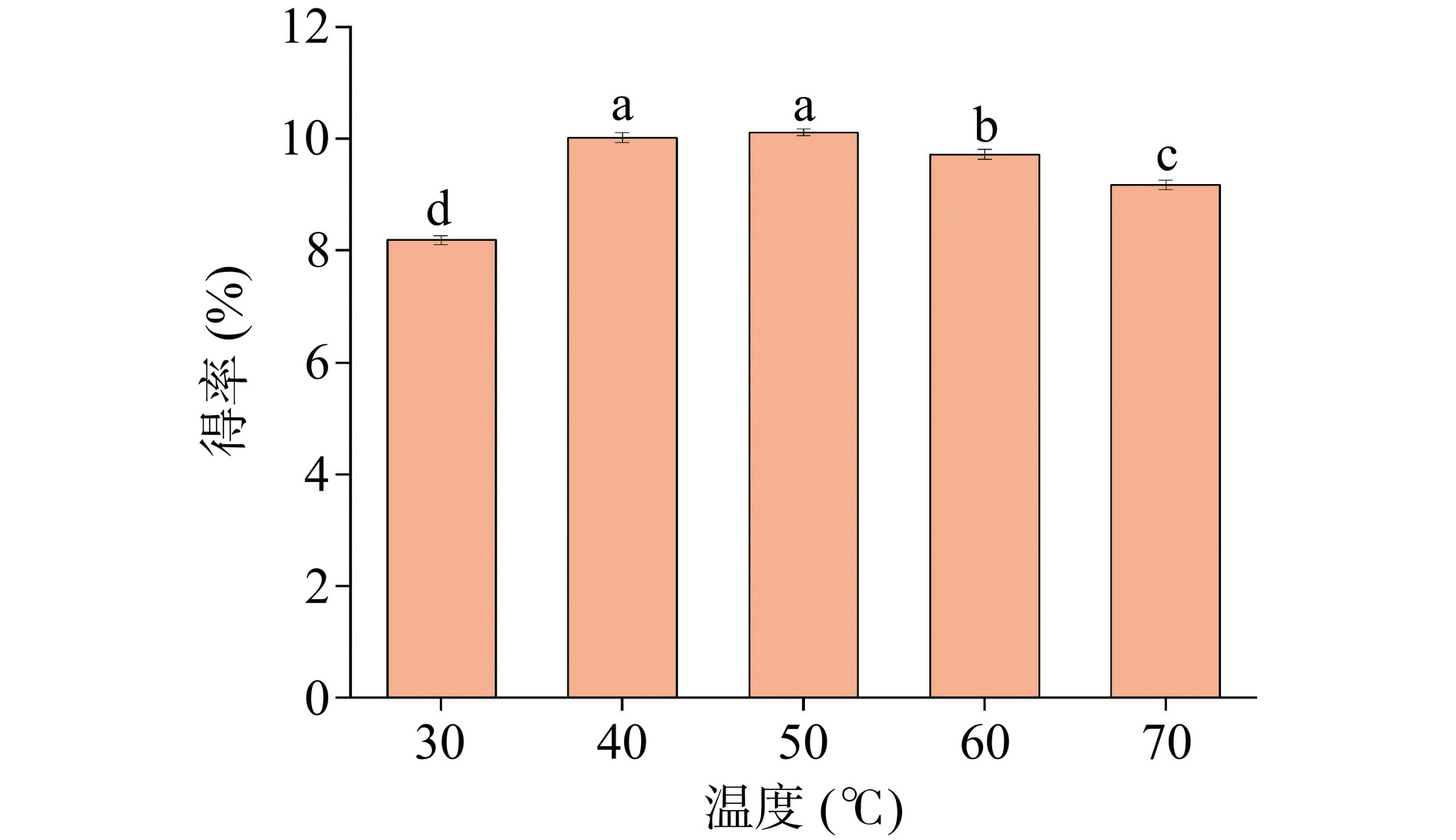
温度也是影响得率的一个重要因素。如图3所示,随着温度的升高,皂苷得率呈先升高后降低的趋势,得率在50 ℃时达到峰值。这是因为温度升高可以降低DES的粘度,促进溶质扩散[8]。但温度过高时,皂苷的糖苷键可能会被破坏分解,从而导致皂苷得率下降[33]。
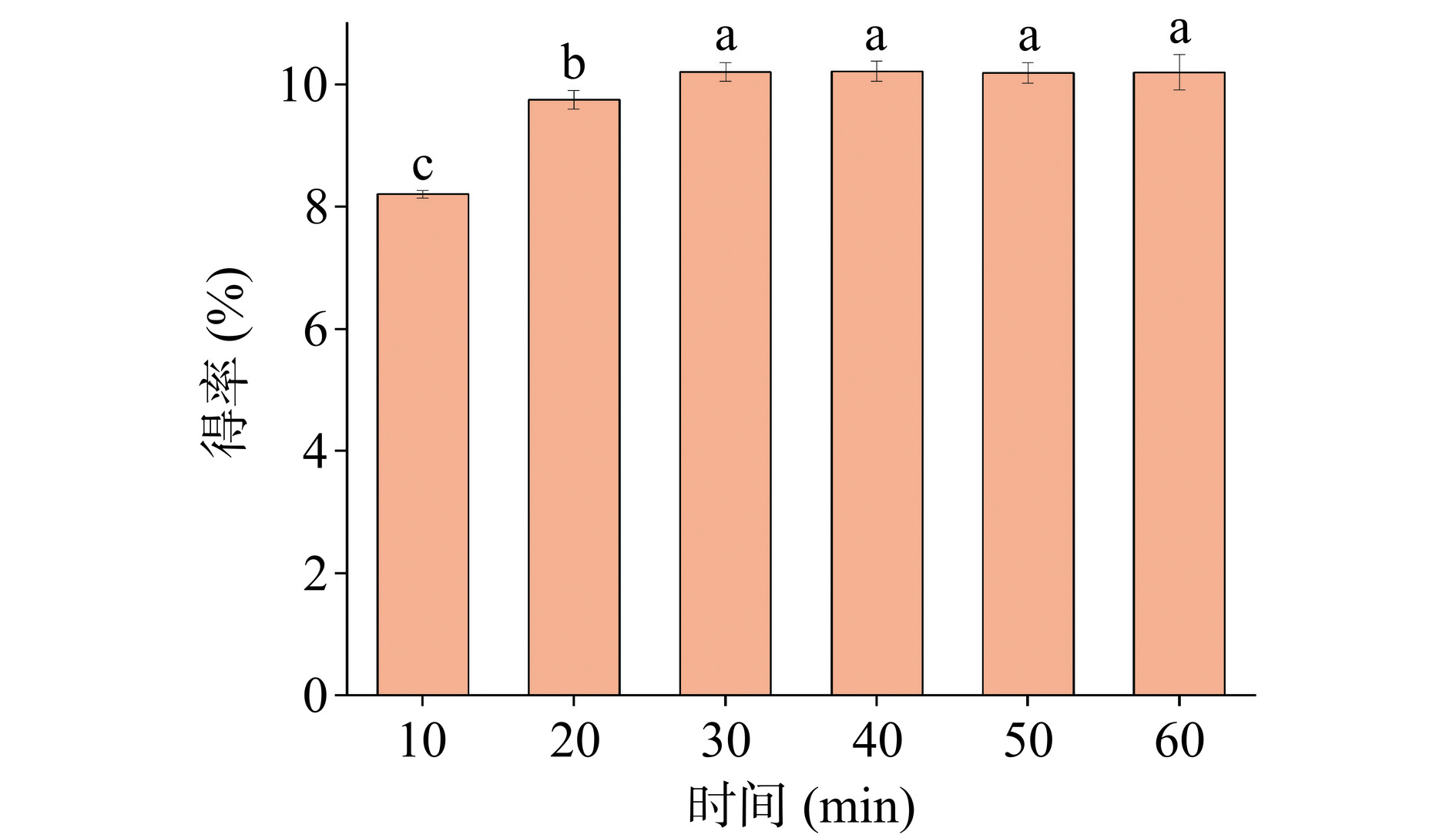
从图4可以看出,DES提取文冠果叶效率高,仅需30 min文冠果叶皂苷便可被快速提取出,在10~60 min内,随着提取时间的延长,文冠果叶皂苷的得率逐渐增大,但超过30 min后,得率趋于平稳,可能是由于文冠果叶皂苷在DES中的溶解趋于饱和。
2.4 BBD试验结果分析
根据单因素实验的结果,选择对皂苷得率影响较大的DES浓度(A,%)、液固比(B,mL/g)和温度(C,℃),采用Design-ExpertVer.12.0设计Box-Behnken试验,进行三因素三水平响应面设计,以皂苷得率(Y)作为响应值,优化DES提取皂苷的条件。由表3可知,BBD试验中,DES提取文冠果叶皂苷的得率为8.78%~10.34%。为分析各自变量对文冠果叶皂苷得率的影响,建立二阶多项式方程:Y=10.26+0.0875A+0.19B−0.3475C+0.0675AB−0.0775AC−0.1375BC−0.6231A2−0.5931B2−0.358C2。在此预测模型中,F值为63.74,P<0.0001,决定系数(R2)为0.9875,调整系数(R2Adj)为0.9714,表明该模型结果可靠,实验值和预测值之间具有显著相关性。
表 3 Box-Behnken 试验结果Table 3. Box-Behnken experimental results试验号 A:DES浓度(%) B:液固比(mL/g) C:温度(℃) Y:得率(%) 1 30 30 50 8.78 2 50 30 50 8.91 3 30 50 50 9.04 4 50 50 50 9.44 5 30 40 40 9.54 6 50 40 40 9.78 7 30 40 60 8.93 8 50 40 60 8.86 9 40 30 40 9.30 10 40 50 40 9.94 11 40 30 60 8.95 12 40 50 60 9.04 13 40 40 50 10.08 14 40 40 50 10.33 15 40 40 50 10.26 16 40 40 50 10.28 17 40 40 50 10.34 采用Design Expert 12.0软件进行提取工艺参数优化,以最大限度地提高文冠果叶皂苷得率,得到的文冠果叶皂苷最佳提取条件为DES浓度47.47%、液固比42.75 mL/g、温度43.81 ℃,此条件下的得率为10.14%。为了便于实际操作,调整提取工艺参数为DES浓度47.00%、液固比42.00 mL/g、提取温度43.00 ℃进行3次重复实验,得到文冠果叶皂苷的得率为10.22%±0.28%。实验结果表明,Design Expert 12.0软件成功地优化了DES提取文冠果叶皂苷的工艺条件,预测结果准确可靠。与常规方法(水得率4.95%,乙醇得率5.67%、乙醇-超声得率7.36%)相比,DES提取显著提高了文冠果叶皂苷的得率。
2.5 文冠果叶皂苷的纯化和组分分析
经1.2.5初步纯化且应用于抑制采后病原真菌研究的文冠果叶皂苷纯度为39.56%±1.51%,并采用UPLC-MS/MS鉴定其主要成分。表4列出了DES提取的文冠果叶中的皂苷类化合物及其保留时间(time)、分子式和质荷比(m/z)。
表 4 文冠果叶皂苷的主要化学成分Table 4. Main chemical components of XLs saponins序号 保留时间(min) 质荷比(m/z) 化学简式 化合物名称 1 20.26 503.34 C30H48O6 羟基积雪草酸 2 24.57 473.35 C30H48O4 皂苷元D 3 15.99 471.35 C30H46O4 甘草次酸 4 14.88 455.35 C30H46O3 齐墩果酸 5 21.37 785.49 C42H72O13 人参皂苷Rg3 6 14.88 473.36 C30H48O4 山楂酸 7 23.32 779.45 C42H68O13 柴胡皂苷A 8 26.34 487.34 C30H48O5 积雪草酸 结果表明,由DES从文冠果叶中提取的皂苷类化合物主要包括羟基积雪草酸、皂苷元D、甘草次酸、齐墩果酸、人参皂苷Rg3、山楂酸、柴胡皂苷A和积雪草酸,其主要成分为三萜皂苷,而三萜皂苷为酸性皂苷,极性较大,以乳酸为HBD的DES极性大,能够有选择性地萃取出极性大的三萜皂苷。
2.6 DES提取对文冠果叶结构的影响
2.6.1 文冠果叶的微观结构的变化
为了解释DES皂苷得率高的原因,使用SEM观察了经不同处理前后文冠果叶残渣的外部显微形态。如图5所示,经过不同处理后,叶粉表面粗糙,细胞表面明显受损。表面损伤程度依次为DES处理>乙醇-超声处理>乙醇处理>水处理>未处理。未处理的文冠果叶粉表面形态较为光滑,原生细胞结构保存完好,细胞壁未见损伤(图5A)。用水和乙醇处理过的叶粉表面有许多条纹状褶皱,没有裂缝(图5B和图5C)。图5D表明经乙醇-超声处理的叶粉表面变得粗糙,出现长裂纹,样品边缘出现湿润纹理。这可能是由于超声波的机械和空化效应[36],促进了溶剂与植物组织的充分接触,从而提高了得率。与乙醇处理和乙醇-超声处理相比,DES处理的损伤更严重、更明显,边缘渗透效果更明显,这是因为ChCl和La配制成的DES对植物细胞壁中的木质素具有良好的增溶作用[37],细胞壁完整性遭到破坏后,更有利于DES的向内渗透和生物活性物质向外溶出(图5E),从而提高了文冠果叶皂苷的得率。
2.6.2 文冠果叶的结构性多糖特征的变化
对经不同处理前后的文冠果叶残渣进行FT-IR分析,以评估文冠果叶中木质素、纤维素和半纤维素结构的变化,不同样品的峰值和强度变化不同。如图6所示,文冠果叶的主要峰为3410、2916、1732、1635和1040 cm−1。传统溶剂(水、乙醇、乙醇-超声)处理与未处理样品峰型、峰强几乎一致,说明传统溶剂难以改变文冠果叶中木质素、纤维素和半纤维素结构,而DES处理样品的峰型变得平滑。1040 cm−1处的峰对应于半纤维素中C-O键的强烈拉伸振动[38],3410 cm−1处的峰对应于半纤维素中O-H键的拉伸振动[39],未处理、水、乙醇、乙醇-超声处理样品在1040、3410 cm−1处的峰强度大致相当,而DES处理样品在1040、3410 cm−1处的峰强度降低,这可归因于水、乙醇、乙醇-超声处理难以改变半纤维素结构,DES处理后去除了部分半纤维素。2916 cm−1处的峰对应于木质素、纤维素中甲基、亚甲基C-H拉伸振动[40],1635 cm−1处的峰对应木质素芳香族结构中C=C键的拉伸振动[41],未处理、水、乙醇、乙醇-超声处理样品在2916、1635 cm−1处的峰强度大致相当,而DES处理样品在2916、1635 cm−1处的峰强度降低,这可归因于水、乙醇、乙醇-超声处理难以改变木质素结构,DES处理后去除了部分木质素。此外,DES处理后的样品在1732 cm−1处对应于羰基的C=O伸缩振动的特征峰[42]的强度明显提高,这可能归因于La与纤维素表面的羟基发生了酯化反应。上述结果表明,传统溶剂(水、乙醇、乙醇-超声)难以改变文冠果叶中结构性多糖,而DES处理能够去除部分半纤维素和木质素,使细胞壁结构破坏,文冠果叶皂苷更易向外溶出。
由表5中数据可知,不同处理后各组TCI和LOI数值与未处理TCI和LOI数值大致相当,因此不能准确地判断不同处理方法对文冠果叶的纤维素结晶程度和横向有序指数的影响,这可能是由于文冠果叶中纤维素含量较少导致的。因此,还需通过XRD分析进一步研究不同溶剂处理后样品的纤维素结晶度。
表 5 FT-IR和XRD分析纤维素结晶度的变化Table 5. FT-IR and XRD analysis of cellulose crystallinity changes样品 TCI LOI CrI(%) CK 1.00 0.91 5.44 水 0.97 0.92 5.32 乙醇 0.98 0.91 5.55 乙醇-超声 0.99 0.91 5.44 DES 0.97 0.92 6.22 2.6.3 文冠果叶细胞壁纤维素结晶度的变化
与半纤维素和木质素的无定形结构不同,纤维素的结构既有结晶区域又有非结晶区域,其分子间的氢键相互作用与范德华力形成了具有独特衍射现象的晶体结构[43]。可通过对X-射线衍射图的分析来评估纤维素的处理效果。图7显示,经过传统溶剂(水、乙醇、乙醇-超声)处理后纤维素的晶体结构与未处理的样品几乎一致,峰型基本未发生改变,而DES处理样品的结晶峰发生明显变化。
纤维素的相对结晶度可以用CrI来表示,相对结晶度的变化表示无定形的半纤维素和木质素的去除程度以及在非结晶区的纤维素的去除程度[44]。水、乙醇和乙醇-超声提取后残渣结晶度CrI为5.32%~5.44%,与未处理样品CrI 5.44%差异很小,而DES处理过的残渣,其CrI为6.22%,明显高于对照(表5)。CrI的增加并不意味着纤维素含量的增加,而是生物质中纤维素占比增加[45]。因此,DES处理样品结晶度提高可能由于去除了部分非晶体成分,如木质素和半纤维素[46]的结果,这进一步印证了FT-IR分析的结果。综上所述,DES能显著提高文冠果叶皂苷得率是通过提高细胞壁的通透性而实现,具体是通过破坏C-H、C=C、C-O和O-H等化学键使半纤维素和木质素降解,而对纤维素结构的影响较小。
2.7 文冠果叶皂苷对果蔬采后病原真菌的抑制作用
2.7.1 文冠果叶皂苷对真菌孢子萌发的影响
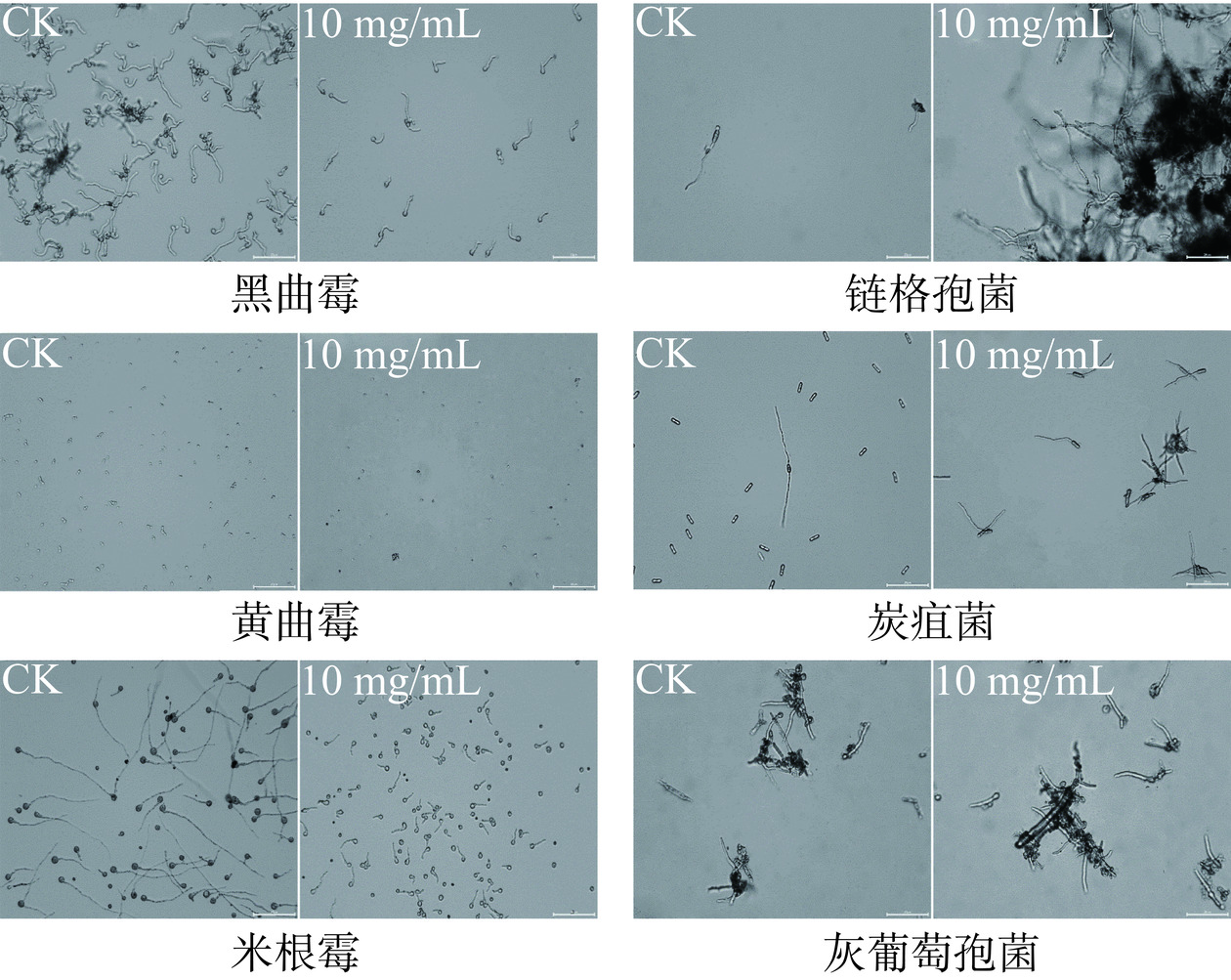
本文选取了6种典型的果蔬采后病原真菌进行文冠果叶皂苷抑菌实验,从表6可以看出,文冠果叶皂苷对黑曲霉、米根霉和黄曲霉的孢子萌发均有抑制作用,说明文冠果叶皂苷有较为广谱的抑菌作用。而对链格孢菌、炭疽菌和灰葡萄孢菌的孢子萌发无抑制作用。
表 6 文冠果叶皂苷对采后病原真菌的抑制作用Table 6. Inhibitory effect of XLs saponins on postharvest pathogenic fungi供试菌株 孢子萌发抑制率(%) 米根霉 78.76±2.56a 黑曲霉 59.77±3.12b 炭疽菌 0 黄曲霉 25.43±1.98c 链格孢菌 0 灰葡萄孢菌 0 图8直观地呈现了经文冠果叶皂苷处理培养12 h后对6种采后真菌孢子萌发的抑制作用,由图8可知,米根霉和黑曲霉孢子对照组基本全部萌发且菌丝较长,而10 mg/mL文冠果叶皂苷处理组孢子萌发长度较短;黄曲霉孢子对照组基本全部萌发,而10 mg/mL文冠果叶皂苷处理组未见萌发;炭疽菌孢子对照组为双侧萌发,而10 mg/mL文冠果叶皂苷处理组炭疽菌孢子为单侧萌发;链格孢菌和灰葡萄孢菌孢子对照组萌发菌丝较短,而10 mg/mL文冠果叶皂苷处理组萌发菌丝较长,表明文冠果叶皂苷促进了链格孢菌和灰葡萄孢菌的孢子萌发。综上所述,文冠果叶皂苷具有广谱抑菌效果,能够有效抑制米根霉、黑曲霉和黄曲霉的萌发,能够迫使炭疽菌由双侧萌发转变为单侧萌发。文冠果叶皂苷对米根霉孢子萌发抑制效果最强,抑制率达78.76%±2.56%,因此选取米根霉进行后续实验。
2.7.2 文冠果叶皂苷对真菌抗氧化酶(CAT、SOD)活性的影响
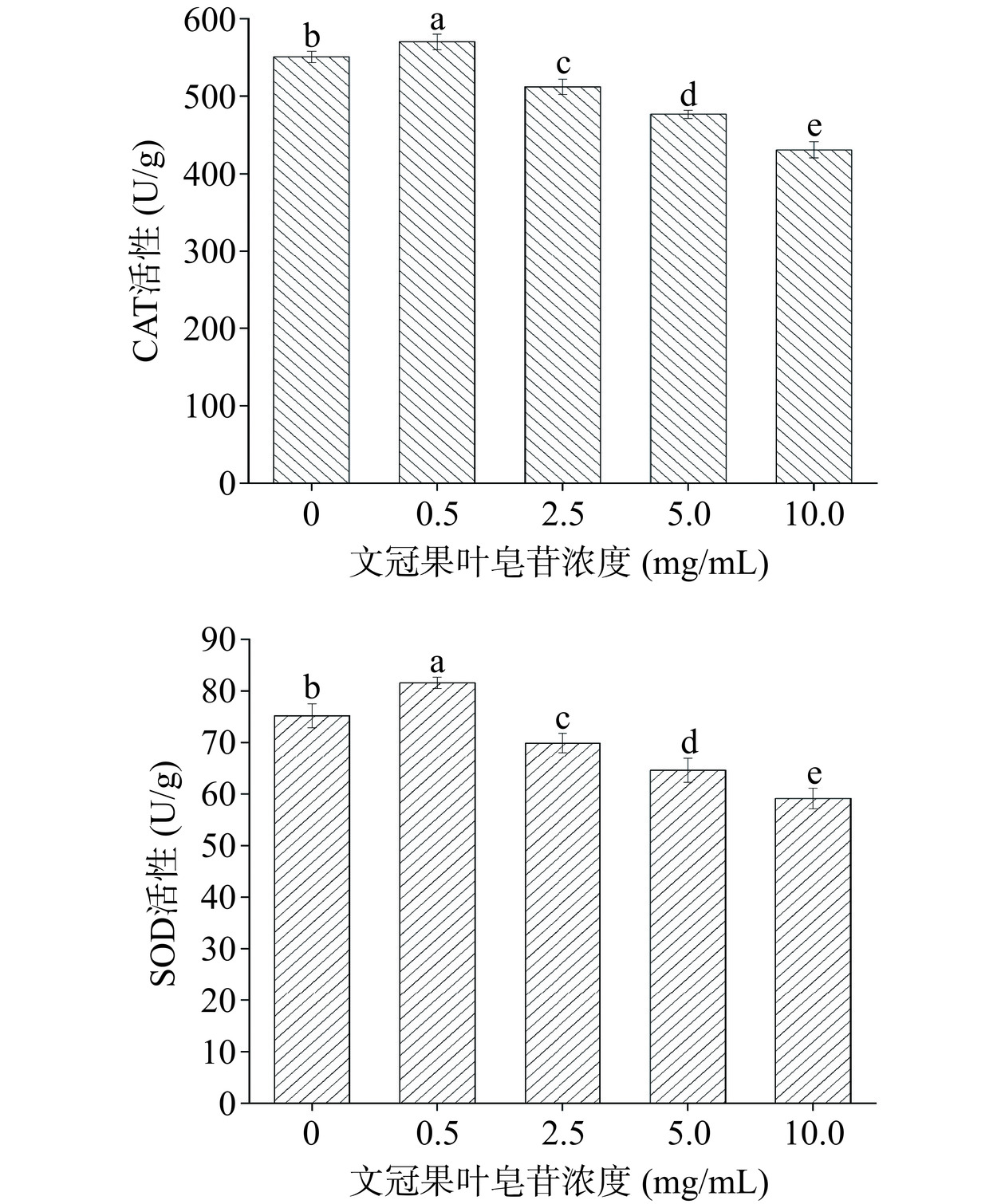
CAT催化过氧化氢分解为氧和水,清除生物体内的过氧化氢,使生物体免于遭受过氧化氢的毒害,是生物防御体系的关键酶。SOD是生物体内重要的抗氧化酶,是生物体内清除自由基的首要物质,SOD在生物体内的水平高低是生物体衰老与死亡的直观指标。由图9可知,经0.5、2.5、5和10 mg/mL文冠果叶皂苷处理后,米根霉内CAT活性分别为对照组的1.04倍、0.93倍、0.86倍和0.78倍,SOD活性分别为对照组的1.08倍、0.93倍、0.86倍和0.79倍。随着文冠果叶皂苷浓度的增加,CAT、SOD活性均出现先上升后下降的趋势,表明低浓度文冠果叶皂苷对菌体造成了迫害,促使菌体提升抗氧化酶活性,以抵御文冠果叶皂苷造成的迫害,而高浓度文冠果叶皂苷可以通过抑制SOD、CAT的活性,促进米根霉中ROS积累,这与Valenzuela等[47]的研究相似,这可能是由于文冠果叶皂苷具有影响真菌细胞代谢的能力,抑制CAT和SOD活性,从而达到抑菌效果。
3. 结论
本文建立了一种从文冠果叶粉末中绿色、快速、高效提取皂苷的方法并探究了文冠果叶皂苷用作新型果蔬采后保鲜抑菌剂的潜力。由氯化胆碱:乳酸(1:1)制备的DES提取效果最好,皂苷得率为10.22%±0.28%,这一结果显著高于传统溶剂得率(水4.95%,乙醇5.67%、乙醇-超声7.36%)。提取前后文冠果叶粉末的SEM、FT-IR和XRD结果表明:与传统溶剂(水、乙醇、乙醇-超声)相比,DES能显著提高文冠果叶皂苷得率,通过提高细胞壁的通透性实现,具体是通过破坏C-H、C=C、C-O和O-H等化学键降解半纤维素和木质素,而对纤维素结构的影响较小。用于采后果蔬病原真菌抑制研究的文冠果叶皂苷,经初步纯化后纯度为39.56%±1.51%,主要成分为三萜皂苷。考察该皂苷对6种典型的采后病原真菌的抑菌效果,发现其对黑曲霉、米根霉、黄曲霉和炭疽菌的孢子萌发均有明显的抑制作用,其中对米根霉生长抑制作用最为显著,能够抑制米根霉抗氧化酶的活性而抑制其萌发,下一步可以从能量代谢、细胞膜损伤等角度深入挖掘文冠果叶皂苷的抑菌机制。目前文冠果叶皂苷抑菌作用研究聚焦于细菌,以上结果填补了文冠果叶皂苷对真菌抑制作用研究的空白,表明文冠果叶皂苷用作新型果蔬采后保鲜抑菌剂具有很大的应用潜力。
-
表 1 Box-Behnken试验因素与水平
Table 1 Factors and levels of Box-Behnken experiment
变量 水平 −1 0 1 A:DES浓度(%) 30 40 50 B:液固比(mL/g) 30 40 50 C:温度(℃) 40 50 60 表 2 不同DES的皂苷得率
Table 2 Saponin yield of different DESs
DES溶剂 HBA:HBD摩尔比 得率(%) Mal Ur Met Gly La Glu ChCl 1:1 6.24±0.09qr 6.19±0.33r 8.60±0.18bc − 9.26±0.07a 3.28±0.61w 1:2 5.75±0.14s 6.58±0.03pq 8.05±0.28efgh 8.61±0.02bc 8.15±0.19defg 3.23±0.65w 1:3 − 5.81±0.13s − 6.94±0.12nop 8.46±0.10bcd 5.25±0.42u Bet 1:1 8.30±0.18cdef 7.72±0.08hij 7.51±0.08ijkl 8.24±0.01cdefg 7.48±0.07ijkl 4.78±0.26v 1:2 5.64±0.02st 7.37±0.02ijklm 7.17±0.12lmn 8.81±0.01b 7.89±0.11gh 4.76±0.46v 1:3 − 6.69±0.14op − 7.41±0.01ijkl 7.69±0.13hijk 3.36±0.57w Pro 1:1 5.32±0.09tu 8.18±0.04defg 6.75±0.14op 6.18±0.02r 8.42±0.06cde − 1:2 − 7.01±0.07mno − 7.36±0.03jklm 7.31±0.31klmn − 1:3 − 8.59±0.06bc 7.76±0.06hi 7.40±0.02ijklm 7.96±0.18fgh − 注:“−”为该摩尔比例下未能成功制备DES;不同字母表示有显著性差异(P<0.05),图1~图4、图9、表6同。 表 3 Box-Behnken 试验结果
Table 3 Box-Behnken experimental results
试验号 A:DES浓度(%) B:液固比(mL/g) C:温度(℃) Y:得率(%) 1 30 30 50 8.78 2 50 30 50 8.91 3 30 50 50 9.04 4 50 50 50 9.44 5 30 40 40 9.54 6 50 40 40 9.78 7 30 40 60 8.93 8 50 40 60 8.86 9 40 30 40 9.30 10 40 50 40 9.94 11 40 30 60 8.95 12 40 50 60 9.04 13 40 40 50 10.08 14 40 40 50 10.33 15 40 40 50 10.26 16 40 40 50 10.28 17 40 40 50 10.34 表 4 文冠果叶皂苷的主要化学成分
Table 4 Main chemical components of XLs saponins
序号 保留时间(min) 质荷比(m/z) 化学简式 化合物名称 1 20.26 503.34 C30H48O6 羟基积雪草酸 2 24.57 473.35 C30H48O4 皂苷元D 3 15.99 471.35 C30H46O4 甘草次酸 4 14.88 455.35 C30H46O3 齐墩果酸 5 21.37 785.49 C42H72O13 人参皂苷Rg3 6 14.88 473.36 C30H48O4 山楂酸 7 23.32 779.45 C42H68O13 柴胡皂苷A 8 26.34 487.34 C30H48O5 积雪草酸 表 5 FT-IR和XRD分析纤维素结晶度的变化
Table 5 FT-IR and XRD analysis of cellulose crystallinity changes
样品 TCI LOI CrI(%) CK 1.00 0.91 5.44 水 0.97 0.92 5.32 乙醇 0.98 0.91 5.55 乙醇-超声 0.99 0.91 5.44 DES 0.97 0.92 6.22 表 6 文冠果叶皂苷对采后病原真菌的抑制作用
Table 6 Inhibitory effect of XLs saponins on postharvest pathogenic fungi
供试菌株 孢子萌发抑制率(%) 米根霉 78.76±2.56a 黑曲霉 59.77±3.12b 炭疽菌 0 黄曲霉 25.43±1.98c 链格孢菌 0 灰葡萄孢菌 0 -
[1] 朱丹, 王红斗, 李霞冰, 等. 文冠果叶化学成分的初步研究[J]. 中国野生植物,1989(3):32−36. [ZHU D, WANG H D, LI X B, et al. Preliminary studies on the chemical composition of xanthoceras sorbifolium bunge leaves[J]. Chinese Wild Plants,1989(3):32−36.] ZHU D, WANG H D, LI X B, et al. Preliminary studies on the chemical composition of xanthoceras sorbifolium bunge leaves[J]. Chinese Wild Plants, 1989(3): 32−36.
[2] 邱悦. 文冠果叶总皂苷的提取纯化及其生理活性研究[D]. 长春:吉林农业大学, 2020. [QIU Y. Establishment of extraction, purification and physiological activity of total saponin from leaves of Xanthoceras sorbifolia Bunge[D]. Changchun:Jilin Agricultural University, 2020.] QIU Y. Establishment of extraction, purification and physiological activity of total saponin from leaves of Xanthoceras sorbifolia Bunge[D]. Changchun: Jilin Agricultural University, 2020.
[3] ZHAO Y, SU R, ZHANG W, et al. Antibacterial activity of tea saponin from Camellia oleifera shell by novel extraction method[J]. Industrial Crops and Products,2020,153:112604. doi: 10.1016/j.indcrop.2020.112604
[4] 曹君. 深共熔溶剂非水相生物催化的应用基础研究[D]. 南京:南京林业大学, 2021. [Cao J. Fundamental research in the application of deep eutectic solvent in non-aqueous biocatalysis[D]. Nanjing:Nanjing Forestry University, 2021.] Cao J. Fundamental research in the application of deep eutectic solvent in non-aqueous biocatalysis[D]. Nanjing: Nanjing Forestry University, 2021.
[5] DAI Y, VAN SPRONSEN J, WITKAMP G J, et al. Natural deep eutectic solvents as new potential media for green technology[J]. Analytica Chimica Acta,2013,766:61−68. doi: 10.1016/j.aca.2012.12.019
[6] SONG Z, LI X, CHAO H, et al. Computer-aided ionic liquid design for alkane/cycloalkane extractive distillation process[J]. Green Energy & Environment,2019,4(2):154−165.
[7] CAI C, WANG Y, YU W, et al. Temperature-responsive deep eutectic solvents as green and recyclable media for the efficient extraction of polysaccharides from Ganoderma lucidum[J]. Journal of Cleaner Production,2020,274:123047. doi: 10.1016/j.jclepro.2020.123047
[8] BUBALO M C, CURKO N, TOMASEVIC M, et al. Green extraction of grape skin phenolics by using deep eutectic solvents[J]. Food Chemistry,2016,200:159−166. doi: 10.1016/j.foodchem.2016.01.040
[9] SHANG X, TAN J N, DU Y, et al. Environmentally-friendly extraction of flavonoids from Cyclocarya paliurus (Batal.) iljinskaja leaves with deep eutectic solvents and evaluation of their antioxidant activities[J]. Molecules,2018,23(9):002110. doi: 10.3390/molecules23092110
[10] YANG G Y, SONG J N, CHANG Y Q, et al. Natural deep eutectic solvents for the extraction of bioactive steroidal saponins from dioscoreae Nipponicae rhizoma[J]. Molecules,2021,26(7):002079. doi: 10.3390/molecules26072079
[11] YU X J, ZHAO Z M, YAN X L, et al. Extraction optimization of tea saponins from camellia oleifera seed meal with deep eutectic solvents:Composition identification and properties evaluation[J]. Food Chemistry,2023,427:136681. doi: 10.1016/j.foodchem.2023.136681
[12] AL-REZA S M, RAHMAN A, AHMED Y, et al. Inhibition of plant pathogens in vitro and in vivo with essential oil and organic extracts of Cestrum nocturnum L[J]. Pesticide Biochemistry and Physiology,2010,96(2):86−92. doi: 10.1016/j.pestbp.2009.09.005
[13] 程金凤. DBD等离子体处理对枸杞鲜果采后主要致病菌的影响及其保鲜作用[D]. 南京:南京林业大学, 2023. [CHENG J F. The effects of DBD plasma treatment on the main postharvest pathogenic fungi of goji berries and its preservation properties[D]. Nanjing:Nanjing Forestry University, 2023.] CHENG J F. The effects of DBD plasma treatment on the main postharvest pathogenic fungi of goji berries and its preservation properties[D]. Nanjing: Nanjing Forestry University, 2023.
[14] LEI Z L, CHEN X Q, CAO F L, et al. Efficient saccharification of Lycium barbarum leaf biomass by using enzyme cocktails produced by a novel fungus Aspergillus costaricensis LS18[J]. Journal of Environmental Management,2022,321:115969. doi: 10.1016/j.jenvman.2022.115969
[15] 郑香容. 青钱柳炭疽病病原及抗性机制研究[D]. 南京:南京林业大学, 2022. [ZHENG X R. Study on the pathogeny of Cyclocarya paliurus anthracnose and its resistance mechanism[D]. Nanjing:Nanjing Forestry University, 2022.] ZHENG X R. Study on the pathogeny of Cyclocarya paliurus anthracnose and its resistance mechanism[D]. Nanjing: Nanjing Forestry University, 2022.
[16] DUAN L, DOU L L, GUO L, et al. Comprehensive evaluation of deep Eutectic solvents in extraction of bioactive natural products[J]. Acs Sustainable Chemistry & Engineering,2016,4(4):2405−2411.
[17] 陈先强. 超声波辅助提取文冠果叶皂苷及其起泡和乳化特性研究[D]. 南京:南京林业大学, 2023. [CHEN X Q. Ultrasonic-assisted extraction of saponins from Xanthoceras sorbifolium Bunge leaves and their foaming and emulsifying properties[D]. Nanjing:Nanjing Forestry University, 2023.] CHEN X Q. Ultrasonic-assisted extraction of saponins from Xanthoceras sorbifolium Bunge leaves and their foaming and emulsifying properties[D]. Nanjing: Nanjing Forestry University, 2023.
[18] LI T, ZHANG H, WU C E. Screening of antioxidant and antitumor activities of major ingredients from defatted Camellia oleifera seeds[J]. Food Science and Biotechnology,2014,23(3):873−880. doi: 10.1007/s10068-014-0117-1
[19] TANG Y Y, HE X M, SUN J, et al. Comprehensive evaluation on tailor-made deep eutectic solvents (DESs) in extracting tea saponins from seed pomace of Camellia oleifera Abel[J]. Food Chemistry,2021,342:128243. doi: 10.1016/j.foodchem.2020.128243
[20] YANG P, ZHOU M, ZHOU C, et al. Separation and purification of both tea seed polysaccharide and saponin from camellia cake extract using macroporous resin[J]. Journal of Separation Science,2015,38(4):656−662. doi: 10.1002/jssc.201401123
[21] GUNDUPALLI M P, CHEENKACHORN K, CHUETOR S, et al. Assessment of pure, mixed and diluted deep eutectic solvents on Napier grass (Cenchrus purpureus):Compositional and characterization studies of cellulose, hemicellulose and lignin[J]. Carbohydrate Polymers,2023,306:120599. doi: 10.1016/j.carbpol.2023.120599
[22] POLETTO M, ZATTERA A J, SANTANA R M C. Structural differences between wood species:Evidence from chemical composition, FTIR spectroscopy, and thermogravimetric analysis[J]. Journal of Applied Polymer Science,2012,126:E336−E343.
[23] QIN S, ZHOU M Q, WANG Z F, et al. Effect of pulsed electric field on spore germination rate and enzyme activity of Aspergillus niger[J]. Innovative Food Science & Emerging Technologies,2023,89:103473.
[24] MASTELLONE G, MARENGO A, SGORBINI B, et al. New phases for analytical scale extraction from plants:Current and future trends[J]. Trac-Trends in Analytical Chemistry,2021,141:116288. doi: 10.1016/j.trac.2021.116288
[25] FU X Z, BELWAL T, HE Y H, et al. UPLC-Triple-TOF/MS characterization of phenolic constituents and the influence of natural deep eutectic solvents on extraction of Carya cathayensis Sarg. peels:Composition, extraction mechanism and in vitro biological activities[J]. Food Chemistry,2022,370:131042. doi: 10.1016/j.foodchem.2021.131042
[26] NGUYEN T H, TRIEU T T U, NGUYEN V P. Green extraction of apigenin and luteolin from celery seed using deep eutectic solvent[J]. Journal of Pharmaceutical and Biomedical Analysis,2022,207:114406. doi: 10.1016/j.jpba.2021.114406
[27] 刘政均. 低共熔溶剂提取茶皂素的工艺优化及茶皂素在药物载体中的应用[D]. 咸阳:西北农林科技大学, 2021. [LIU Z J. Optimization of extraction process of tea saponin with deep eutectic solvent and application of tea saponin in drug carrier[D]. Xianyang:Northwest A&F University, 2021.] LIU Z J. Optimization of extraction process of tea saponin with deep eutectic solvent and application of tea saponin in drug carrier[D]. Xianyang: Northwest A&F University, 2021.
[28] CHEN Z Q, WU K W, ZHU W Z, et al. Chemical compositions and bioactivities of essential oil from perilla leaf (Perillae folium) obtained by ultrasonic-assisted hydro-distillation with natural deep eutectic solvents[J]. Food Chemistry,2022,375:131834. doi: 10.1016/j.foodchem.2021.131834
[29] LU C, CAO J, WANG N, et al. Significantly improving the solubility of non-steroidal anti-inflammatory drugs in deep eutectic solvents for potential non-aqueous liquid administration[J]. Medchemcomm,2016,7(5):955−959. doi: 10.1039/C5MD00551E
[30] LEI J, WANG Y M, LI W W, et al. Natural green deep eutectic solvents-based eco-friendly and efficient extraction of flavonoids from Selaginella moellendorffii:Process optimization, composition identification and biological activity[J]. Separation and Purification Technology,2022,283:120203. doi: 10.1016/j.seppur.2021.120203
[31] LIU J Z, LYU H C, FU Y J, et al. Simultaneous extraction of natural organic acid and flavonoid antioxidants from Hibiscus manihot L. flower by tailor-made deep eutectic solvent[J]. LWT-Food Science and Technology,2022,163:113533. doi: 10.1016/j.lwt.2022.113533
[32] LIU C, QIAO L, GAO Q, et al. Total biflavonoids extraction from Selaginella chaetoloma utilizing ultrasound-assisted deep eutectic solvent:Optimization of conditions, extraction mechanism, and biological activity in vitro[J]. Ultrasonics Sonochemistry,2023,98:106491. doi: 10.1016/j.ultsonch.2023.106491
[33] SHIRSATH S R, SABLE S S, GAIKWAD S G, et al. Intensification of extraction of curcumin from Curcuma amada using ultrasound assisted approach:Effect of different operating parameters[J]. Ultrasonics Sonochemistry,2017,38:437−445. doi: 10.1016/j.ultsonch.2017.03.040
[34] LEE L S, LEE N, KIM Y H, et al. Optimization of ultrasonic extraction of phenolic antioxidants from green tea using response surface methodology[J]. Molecules,2013,18(11):13530−13545. doi: 10.3390/molecules181113530
[35] DONG J N, WU G D, DONG Z Q, et al. Natural deep eutectic solvents as tailored and sustainable media for the extraction of five compounds from compound liquorice tablets and their comparison with conventional organic solvents[J]. Rsc Advances,2021,11(59):37649−37660. doi: 10.1039/D1RA06338C
[36] IVANOVIC M, ALBREHT A, KRAJNC P, et al. Sustainable ultrasound-assisted extraction of valuable phenolics from inflorescences of Helichrysum arenarium L. using natural deep eutectic solvents[J]. Industrial Crops and Products,2021,160:113102. doi: 10.1016/j.indcrop.2020.113102
[37] MALAEKE H, HOUSAINDOKHT M R, MONHEMI H, et al. Deep eutectic solvent as an efficient molecular liquid for lignin solubilization and wood delignification[J]. Journal of Molecular Liquids,2018,263:193−199. doi: 10.1016/j.molliq.2018.05.001
[38] HONG T, YIN J Y, NIE S P, et al. Applications of infrared spectroscopy in polysaccharide structural analysis:Progress, challenge and perspective[J]. Food Chemistry-X,2021,12:100168. doi: 10.1016/j.fochx.2021.100168
[39] KUMAR R, MAGO G, BALAN V, et al. Physical and chemical characterizations of corn stover and poplar solids resulting from leading pretreatment technologies[J]. Bioresource Technology,2009,100(17):3948−3962. doi: 10.1016/j.biortech.2009.01.075
[40] DASHTBAN M, KEPKA G, SEIBOTH B, et al. Xylitol production by genetically engineered Trichoderma reesei strains using barley straw as feedstock[J]. Applied Biochemistry and Biotechnology,2013,169(2):554−569. doi: 10.1007/s12010-012-0008-y
[41] KUBOVSKY I, KACIKOVA D, KACIK F. Structural changes of oak wood main components caused by thermal modification[J]. Polymers,2020,12(2):000485. doi: 10.3390/polym12020485
[42] 沈荣盛. 基于低共熔溶剂木质纤维素的高效分离及其功能化利用[D]. 杭州:浙江理工大学, 2023. [SHEN R S. Efficient separation and functional utilization of lignocellulose based on deep eutectic solvent[D]. Hangzhou:Zhejiang Sci-Tech University, 2023.] SHEN R S. Efficient separation and functional utilization of lignocellulose based on deep eutectic solvent[D]. Hangzhou: Zhejiang Sci-Tech University, 2023.
[43] YANG L, RU Y, XU S, et al. Features correlated to improved enzymatic digestibility of corn stover subjected to alkaline hydrogen peroxide pretreatment[J]. Bioresource Technology,2021,325:124688. doi: 10.1016/j.biortech.2021.124688
[44] ELMAS G M, YILGOR N. Chemical and thermal characterizations of Pinus sylvestris and Pinus pinaster[J]. Bioresources,2020,15(2):3604−3620. doi: 10.15376/biores.15.2.3604-3620
[45] PROCENTESE A, JOHNSON E, ORR V, et al. Deep eutectic solvent pretreatment and subsequent saccharification of corncob[J]. Bioresource Technology,2015,192:31−36. doi: 10.1016/j.biortech.2015.05.053
[46] XU G C, DING J C, HAN R Z, et al. Enhancing cellulose accessibility of corn stover by deep eutectic solvent pretreatment for butanol fermentation[J]. Bioresource Technology,2016,203:364−369. doi: 10.1016/j.biortech.2015.11.002
[47] VALENZUELA C D F, BUITIMEA C G V, PLASCENCIA J M, et al. Inhibition of the antioxidant activity of catalase and superoxide dismutase from Fusarium verticillioides exposed to a Jacquinia macrocarpa antifungal fraction[J]. Journal of Environmental Science and Health Part B-Pesticides Food Contaminants and Agricultural Wastes,2019,54(8):647−654.





 下载:
下载:
 下载:
下载:



