Research Progress on Rapid Detection of Pyrethroid Pesticide Residues
-
摘要: 拟除虫菊酯(pyrethroids,PYRs)农药因其稳定性和高效性被广泛应用,其残留问题日益突出,对人类生命安全构成威胁。传统的实验室检测一直面临着设备昂贵、操作复杂和耗时长的挑战,亟需开发高效、灵敏的PYRs快速检测技术,实现食品农产品中PYRs的现场检测。本文总结了PYRs的快速检测技术,包括酶联免疫法(ELISA)、侧流免疫法(LFIA)、荧光传感和电化学传感,评述了这些方法与新型纳米材料和技术结合的前景与优势,展望了高灵敏度、智能化、便携化的发展趋势,以期为PYRs快速检测的进一步发展提供最新的科学参考。Abstract: Pyrethroids (PYRs) are widely used pesticides due to their stability and high efficiency, while the problem of its residue is becoming more and more serious, posing a threat to human life safety. Traditional laboratory detection has been faced with the challenges such as expensive equipment, complex operation, and lengthy procedures. Therefore, it is urgent to develop efficient and sensitive rapid detection technology for PYRs to realize its on-site detection in food and agricultural products. In this review, the technologies for rapid detection of PYRs, including enzyme linked immunosorbent assay (ELISA), lateral flow immunoassay (LFIA), fluorescence sensing and electrochemical sensing, are summarized, the prospects and advantages of the combination of these methods with novel nanomaterials and technologies are reviewed, and the development trend of becoming high sensitive, intelligent and portable is forecasted, aiming to provide scientific references for the further development of rapid detection technology for PYRs.
-
食品安全与人类健康密切相关,一直受到国际社会的广泛关注。有关研究表明,通过大气、饮用水进入人体的农药仅占10%,通过食物进入人体的农药却高达90%,这些进入人体的农药会对人体产生巨大的伤害[1]。拟除虫菊酯(pyrethroids,PYRs)是一类由除虫菊酯衍生而来的合成有机杀虫剂,与其他杀虫剂(如有机磷和氨基甲酸酯化合物)相比,其具有药效高、毒性低的特点,已成为三大杀虫剂之一,在全球范围内广泛使用[2−3]。PYRs是脂溶性的,与皮肤、消化道和呼吸道接触都会导致其渗入体内,而且一旦进入生物体内就很难清除。I型PYRs,包括氯菊酯和联苯菊酯,会引起震颤型综合征,其特征为全身震颤、过敏、攻击行为和共济失调;以氯氰菊酯和溴氰菊酯为代表的II型PYRs与舞蹈症-唾液分泌综合征有关,患者会出现唾液分泌和肌肉功能障碍等问题[4−5]。可见,PYRs对人体伤害巨大,因此对其进行实时监测是十分必要的。
传统的PYRs检测方法包括气相色谱法、气相色谱-串联质谱法、液相色谱-串联质谱法等大型仪器方法,这些方法能够对PYRs进行定性和精确的定量检测[6−8]。然而,这些方法操作复杂、耗时长、成本高,限制了其应用范围。近年来,基于侧流免疫分析(lateral flow immunoassay,LFIA)、酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)、电化学和荧光传感的快速检测方法已被开发并应用于PYRs的检测。与传统的大型仪器检测方法相比,这些方法具有快速、便携、易于在线检测、检测成本低等优点,具有很大的应用潜力。
本文详细介绍了基于ELISA、LFIA、电化学传感器和光学传感器的PYRs快速检测方法。这些方法可以很容易与移动设备相结合,实现对实际样品中PYRs的快速检测。其中,量子点(quantum dots,QDs)、金属有机框架(metal-organic frameworks,MOFs)和纳米微球等新型纳米材料被广泛应用于PYRs的快速检测方法,显著提高了传感器的灵敏度和检测范围,为未来PYRs的快速检测方法提供了新的研究思路。
1. 基于ELISA的快速检测
ELISA是一种由吸附底物、免疫识别和酶标记组成的免疫测定方法[9]。在免疫测定检测技术中,ELISA是一种非常成熟的技术,已被广泛应用于食品安全和质量控制领域[10]。由于其具有高灵敏、高通量和低成本的优点,并且不需要使用昂贵的分析仪器,因此ELISA是检测PYRs常用的方法之一。针对单个PYR农药或PYRs亚类的高选择性免疫测定方法已经开发出来。基于单克隆抗体构建的ELISA试剂盒已用于检测单一PYR农药,包括联苯菊酯、氰戊菊酯、氟氯氰菊酯、溴氰菊酯、甲氰菊酯等[11−15]。此外,还开发了具有广泛选择性的ELISA试剂盒,用于检测PYRs亚型。Watanabe等[16]开发了一种检测I型PYRs农药的ELISA方法,优化后氯菊酯和氰戊菊酯IC50分别为30 μg/L和20 μg/L,对II型PYRs均无交叉反应,具有良好的特异性。Mak等[17]开发了一种针对II型PYRs的特异性ELISA,优化后的IC50值为6~205 μg/L,对I型PYRs均无交叉反应。这两种检测方法都可用于监测和区分I型和II型PYRs。ELISA成本低,样品处理量大,是一种良好的定量方法。该方法还可用作初步筛选,以减少后续仪器分析所需的样品数量。此外,ELISA也存在一定的不足,比如过程费时费力,结果易受pH、盐离子、温度等因素的干扰,检测的灵敏度、稳定性和准确性有待提高[18]。
荧光免疫吸附法(FLISA)是一种利用荧光作为信号对残留物进行定量的免疫测定方法,与ELISA相比,FLISA具有检测速度快,灵敏度高,假阳性更低,无需底物反应等优点[19]。QDs是一种具有优异的光谱特性的半导体荧光纳米材料,它具有良好的量子产率、宽激发光谱、窄发射峰光、化学稳定性和良好的生物相容性,非常适合作为FLISA的荧光标记物[20]。近来,Liu等[21]合成了谷胱甘肽包被的CdTe QDs,该方法将QDs与氰戊菊酯单克隆抗体偶联,建立了以QDs为信号定量检测氰戊菊酯的荧光免疫分析法。该方法基于QDs特定的发射波长能够降低实验的假阳性率,与ELISA相比,节省了1 h以上的时间,能准确、灵敏地筛选出实际样品中的氰戊菊酯,在农产品的检测中发挥着突出的作用。
2. 基于LFIA的快速检测
LFIA也称为免疫层析分析法(immunochromatographic assay,ICA)或试纸条法,是一种基于抗原-抗体特异性识别和相应信号读出的经典免疫分析策略[22]。与ELISA等传统免疫学技术相比,LFIA具有成本低、操作简便、适应现场检测等优点,便于大规模检测和家庭自检,是一种拥有良好应用前景的分析物鉴定工具[23]。基于这些优势,LFIA已广泛应用于病原体、农药和兽药残留以及代谢物的检测。
2.1 比色LFIA
金纳米粒子合成方法简单、稳定性好、具有良好的光学性能和生物相容性,能与抗体稳定结合,是目前在LFIA中应用最广泛的标记物之一[24]。基于胶体金的LFIA在现场快速检测中具有极大的优势。基于单克隆抗体制备的胶体金试纸可用于检测PYRs,包括甲氰菊酯、氯氰菊酯、联苯菊酯、苯醚氰菊酯、λ-氯氟氰菊酯等[25−29]。但是单克隆抗体试纸条只能对一种农药进行单一的检测,效率较低。因此,有必要开发基于广谱型的免疫试纸条,Kranthi等[30]制备了可以检测三种II型PYRs(氯氰菊酯、溴氰菊酯和氰戊菊酯)的多克隆抗体试纸条,检测限分别为800、1000和1400 µg/L。
金纳米颗粒作为一种纳米标记材料,可以与抗原/抗体偶联形成稳定的探针,对探针的生物学特性影响较小,是目前最常用的LFIA标记材料,但其灵敏度较低,无法满足一些超灵敏检测分析物的要求。为了获得更高的灵敏度和稳定性,必须找到更加合适的载体。近年来,一些新型荧光材料,如QDs、荧光微球和碳点等也被用作LFIA检测的载体,相较于金纳米颗粒具有更好的光学性能,有望实现更好的灵敏度[31−32]。
2.2 荧光LFIA
荧光LFIA在保留常规LFIA简单、快速、便携等优点的同时,有效地提高了定量分析的检测灵敏度,备受人们期待。荧光染料是一种能吸收特定波长的光能,然后发射出另一波长的光的物质。荧光主要来自于荧光团中结合的芳香基团或共轭双键[32]。由于其制备简单、成本低廉,因此在各种平台中备受青睐[33]。Costa等[34]利用罗丹明荧光染料作为荧光信号,开发了一种抗体门控指示剂释放材料,并将其固定在试纸上,通过横向测流法检测氯菊酯,利用智能手机进行读数。这种简单的检测方法可在5 min内检测出低至1 µg/L水平的氯菊酯。然而,荧光染料也存在团聚引起的荧光猝灭和光漂白等问题,使其在检测应用领域受到限制[35]。
碳点具有低毒性、高生物相容性和优异的光学性能等优点,已成为药物传递、生物传感和生物成像的潜在材料[36]。然而,碳点的荧光也可能被金属纳米颗粒、小分子物质甚至其自身猝灭。将碳点转化为聚合物碳点是提高光稳定性的可行策略。因此,Zhao等[37]合成了超稳定、超高亮度的聚合物碳点代替普通碳点作为标签,提高了氯氰菊酯和其代谢物3-PBA检测的灵敏度和稳定性,并可通过智能手机直接记录检测结果,是一种成本低、灵敏度高、操作简单的检测方法,适合在各种环境中实地应用。
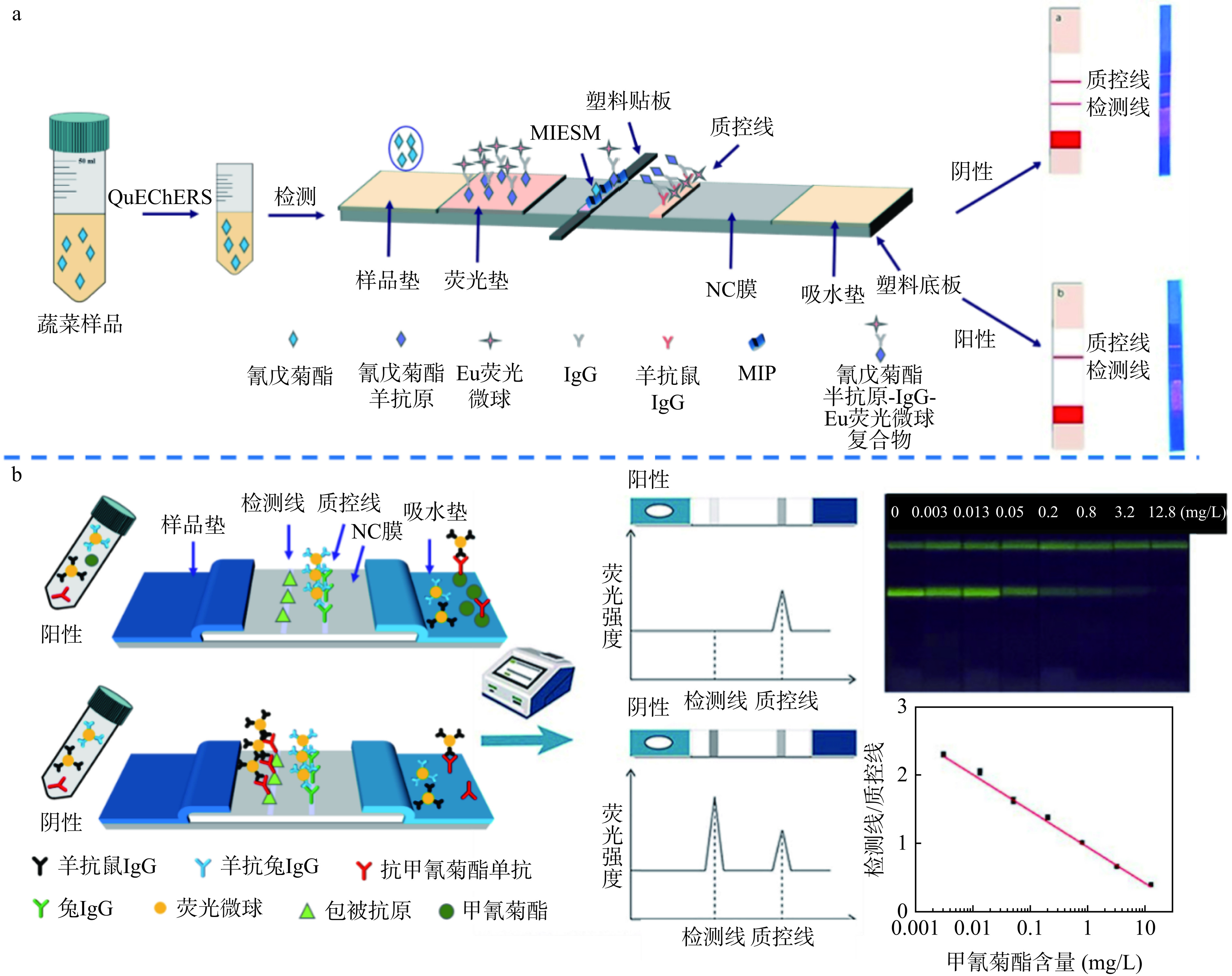
近年来,基于荧光微球的免疫层析技术得到了快速发展,其具有荧光寿命长、荧光强度高、稳定性好等特点,可提高检测信噪比,从而提高检测的准确性和灵敏度[38−40]。如图1a 所示,Zhang等[41]采用静电纺丝法制备了分子印迹聚合物纤维膜,利用Eu荧光微球合成了氰戊菊酯半抗原-小鼠IgG-Eu荧光微球探针,构建了基于竞争法的LFIA,测定了蔬菜中的氰戊菊酯。该方法在50~1000 µg/mL浓度范围内线性关系良好,检出限为51.29 µg/mL。近来,Xu等[42]也利用荧光微球制备荧光探针,首次建立了快速筛查果蔬中甲氰菊酯残留的荧光免疫层析检测方法,通过比较检测线和质控线上荧光强度的变化来测定样品中的甲氰菊酯含量。该方法实际样品的检出限为0.012 mg/kg,远低于食品样品中甲氰菊酯的最大残留限量,具有良好的应用前景(图1b)。
良好的光学性能,稳定性强的信号标签是提高荧光LFIA灵敏度和稳定性的关键。因此,Wang等[43]将荧光染料掺入到纳米材料MOFs中,形成了稳定的荧光复合材料NaFL/UiO-66@CMCS。该材料增强了荧光强度和灵敏度,还保护荧光染料免受周围环境的影响,从而延长了保质期和保持了长期稳定性。建立的LFIA实际样品的检出限为1.56 μg/kg,实际样品的检出限比胶体金高出16倍,为快速检测PYRs残留提供了一种灵敏、稳定、方便的方法。LFIA只需观察检测线上出现颜色或荧光的强弱,即可判别样品中是否含有农药,借助仪器还可对样品中的农药含量进行准确测定。在PYRs检测中,胶体金-LFIA方法简单、快速,是目前最常用的试纸条标记材料,但灵敏度较低,因此探索了新型荧光材料来提高检测性能。这些材料具有良好的光学性能和稳定性,能达到更好的灵敏度,并将与智能手机相结合,以提高其应用潜力。
2.3 双信号LFIA
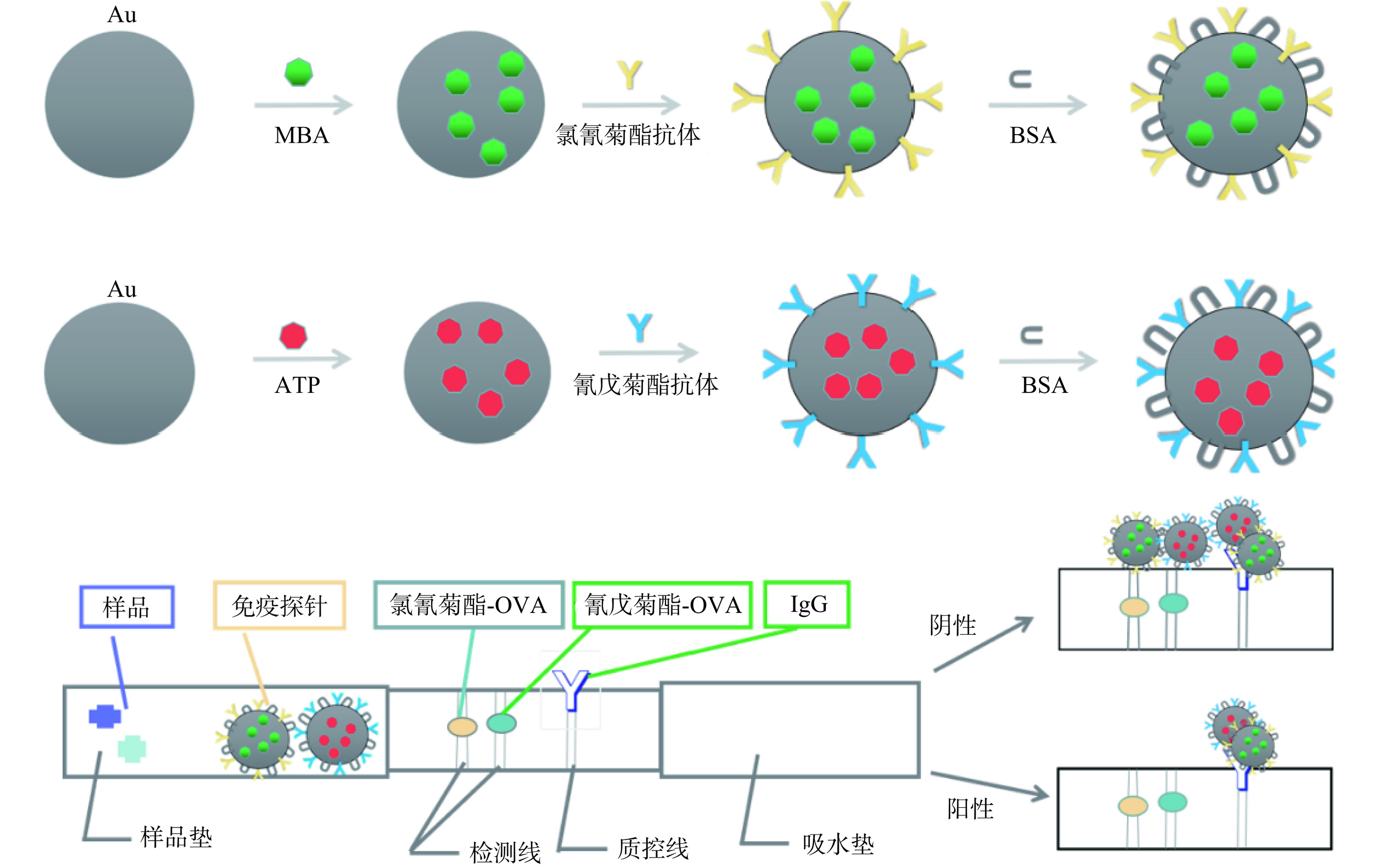
与基于单读取的分析技术相比,双读取方法可以通过双重验证提高准确性和特异性。为了获得更好的性能,人们开发了双读取策略LFIA,以放大信号,从而对分析物进行更准确的定性和定量分析。例如,Wang等[44]制备了鲁米诺还原金纳米颗粒作为新型的双读取探针,利用金纳米颗粒制备的试纸条以比色分析作为第一重信号确认污染样品,又以鲁米诺还原金纳米颗粒化学发光(CL)信号作为定量读取信号,有助于提高分析灵敏度,满足定性分析和定量检测的需要。在最佳条件下,氰戊菊酯的检出限为0.067 ng/mL。如图2所示,Li等[45]将表面增强拉曼光谱(surface-enhanced Raman spectroscopy,SERS)技术与LFIA相结合,建立了一种采用两条检测线测定氯氰菊酯和氰戊菊酯的双读取免疫层析方法。从两条检测线的金纳米颗粒颜色变化中观察到定性分析。采用SERS技术对所测农药进行定量分析,氯氰菊酯和氰戊菊酯的检出限分别为2.3×10−4和2.6×10−5 ng/mL。该方法灵敏度比ELISA和基于荧光的ICA方法高3~4倍,是一种简单、灵敏的双PYRs农药快速检测方法。
双信号的LFIA可以高灵敏度的快速检测PYRs农药。比色信号无需使用设备,肉眼即可读取,方便快捷。CL信号或SERS信号等第二重信号,可以借助设备对PYRs进行定量分析,得到更准确灵敏的结果。双信号输出保证了检测结果的准确性,减少了假阳性率。
LFIA具有快速、体积小、方便、价格低廉等优点,在食品安全检测中也得到了广泛的应用。典型的LFIA是基于金纳米颗粒AuNPs作为信号标记材料,但该方法检出限较高,不能满足高灵敏农药残留快速检测的需求。为了提高LFIA的检测性能,突破传统技术的缺陷,研究人员结合新型纳米材料不断改进LFIA的信号标记材料增强其检测信号,并开发了多重检测方法和检测信号的读取方式。这些新型的LFIA检测方法在一定程度上提高了农药检测的灵敏度和效率。表1列举了一些LFIA在PYRs农药残留检测中的应用。
表 1 LFIA在PYRs农药残留检测中的应用Table 1. Application of LFIA in PYRs pesticide residue detection目标 标签 检出限 线性范围 样品回收率 机制 文献 甲氰菊酯 金纳米颗粒 62 µg/L 15.6~250 µg/L 苹果、黄瓜(81.6%~103.8%) 比色 [25] 氯氰菊酯 金纳米颗粒 0.3 µg/mL / / 比色 [26] 联苯菊酯 金纳米颗粒 50 ng/mL / / 比色 [27] 苯醚氰菊酯 金纳米颗粒 1 µg/kg / / 比色 [28] λ-氯氟氰菊酯 金纳米颗粒 1.2 ng/g
0.7 ng/g
1.0 ng/g
4.0 ng/g2.3~122.0 ng/g
1.5~98.2 ng/g
2.1~145.5 ng/g
6.6~129.7 ng/g白菜(82.1%~96.7%)
欧芹(82.4%~96.1%)
菠菜(81.2%~94.8%)
绿茶(80.4%~90.7%)比色 [29] 氯氰菊酯
溴氰菊酯
氰戊菊酯金纳米颗粒 800 µg/L
1000 µg/L
1400 µg/L/ / 比色 [30] 氯菊酯 罗丹明 1 µg/L / / 荧光 [34] 氯氰菊酯
3-PBA聚合物碳点 0.35 ng/mL
0.04 ng/mL1~100 ng/mL
0.1~100 ng/mL/ 荧光 [37] 氰戊菊酯 Eu荧光微球 51.29 µg/mL 50~1000 µg/L 甘蓝、黄瓜、茄子(68.7%~109.2%) 荧光 [41] 甲氰菊酯 荧光微球 0.003 mg/L 0.003~12.8 mg/L 白菜、生菜、梨、苹果(85.0%~105.0%) 荧光 [42] 甲氰菊酯 NaFL/UiO-66@CMCS 1.56 µg/kg 0.98~62.5 μg/L 小麦、玉米(96.58%~118.56%) 荧光 [43] 氰戊菊酯 鲁米诺还原金纳米颗粒 0.067 ng/mL 0.2~200 ng/mL 党参、丹参(95%~116%) 比色、
化学发光[44] 氯氰菊酯
氰戊菊酯金纳米颗粒 2.3×10−4 ng/mL
2.6×10−5 ng/mL10−5~100 ng/mL 自来水、牛奶、河水(94.9%~112%) 比色、
SERS[45] 3. 基于电化学传感器的快速检测
电化学传感是依靠测定目标分析物和传感电极之间相互作用产生的电信号,如电流、电荷或电位变化反映检测结果[46]。与传统检测技术相比,电化学传感器具有响应速度快、成本低、灵敏度高和特异性强等优点。
分子印迹技术(MIPs)是一种选择性捕获目标分析物的有效方法,具有稳定性好、制备简单、成本低、不易受环境影响等独特优点,可作为产生特定传感信号的理想识别候选物[47]。将MIPs与电化学分析相结合,进一步拓宽了特异性检测和高灵敏度分析的检测领域,取得了良好的应用效果。白静等[48]制备了一种快速检测联苯菊酯的分子印迹电化学传感器,该传感器是在石墨烯修饰的玻璃电极表面制备了一层分子印迹电聚合膜。Li等[49]制备了一种结合了双单体MIP膜的Ag-N@ZnO/CHAC涂层玻碳电极。均匀分散的Ag-N@ZnO/CHAC复合材料提高了电极/电解质界面的电子传递速率,为MIP修饰提供了更大的表面积,双单体MIP具有更高的响应性和选择性。该传感器可快速准确地测定实际样品中的氯氰菊酯,在食品安全、药物残留检测和环境监测等方面具有很大的应用潜力。
电极材料是构建新型电化学传感器的关键,其电化学性能受颗粒大小、材料分散度、结晶度、比表面积大小和孔隙率的影响[50]。先进的纳米材料修饰电极可以通过增加比表面积来提供更多的反应位点并提高电子传递速率,从而显著提高电化学分析的灵敏度、特异性和强度。多孔或框架结构可以提供吸附位点、改善催化性能以及促进电信号的有序产生[47]。田利等[51]采用一步法制备了CdTe@ZIF-7复合材料,并通过电聚合方法将其修饰在玻碳电极表面,制备了一种高灵敏度的氯菊酯电化学发光传感器,CdTe@ZIF-7纳米复合材料显著增强了ECL信号,大大提高了灵敏度,检测限达到3.5×10−10 mol/L。Sun等[52]制备Au@Pt-rGo/CdTe/Zn-MOF NFs复合材料来修饰玻碳电极,Zn-MOF NFs具有较大的比表面积和孔洞可以作为CdTe和Au@Pt-rGo的载体,复合材料可以通过促进电子转移和减少电子传递路径来促进发光。该传感器可在4×10−11~4×10−6 mol/L范围内检测出甲氰菊酯,检出限为1.33×10−11 mol/L。
电化学传感器具有灵敏度高、系统组成简单、分析速度快、易于小型化等优点,是一种检测PYRs的有效分析方法。将快速发展的技术和新型的纳米材料用于修饰电极为高性能电化学传感器的发展提供了新的机遇。
4. 基于光学传感器的快速检测
4.1 比色传感器的快速检测
比色传感器由于其成本效益,高灵敏度和特异性以及清晰的可视性而被广泛用于检测多种分析物[53]。酶传感器在过去几十年里得到了广泛的开发,并被证明是对各种目标底物进行定性和定量分析的一种创新方法[54]。酶传感器具有灵敏度高、特异性强、便于携带、成本效益高、可微型化等独特优势,已成为农药检测的常用技术[55]。例如,何丽媛等[56]基于羧酸酯酶的酶抑制原理,建立了快速检测联苯菊酯和甲氰菊酯的比色法。Dowd等[57]同样利用酶抑制建立了一种依据pH变化检测溴氰菊酯的比色法,该方法具有精度高、准确度好、反应时间短等优点。然而,酶对温度和pH敏感并且保质期较短,可能会影响检测的结果。适配体是一种可以特异性地识别目标分析物的短寡核苷酸链,具有高特异性、低成本、良好的生物相容性等优点[58]。Yang等[59]利用分子对接技术研究了适配体与靶标的识别机制和作用位点。以适配体为识别分子,阳离子聚合物介导的胶体金(AuNPs)聚集为传感信号,建立了一种新的λ-氯氟氰菊酯比色检测方法。该研究为检测食品中的小分子物质提供了一种参考方法。
金、银和铜等金属纳米粒子作为有前途的信号换能器被广泛应用于制造比色传感器。Wang等[60]利用2-巯基-6-硝基苯并噻唑修饰的金纳米颗粒复合材料(Au NPs-MNBT),建立了一种基于比色的快速检测溴氰菊酯的方法,溴氰菊酯浓度会导致金纳米颗粒溶液颜色发生变化,可利用紫外可见分光光度计定量检测溴氰菊酯。Li等[61]基于表面胺修饰的银硅核壳纳米粒子(Ag@SiO2-NH2 NPs)合成了高灵敏、高效的比色探针,可快速定量检测低至1.0×10−6 mol/L的氯氟氰菊酯。
自2008年首次将微流控纸基装置用于生物传感以来,该装置在现场快速检测领域已显示出较大的应用潜力。Zhu等[62]成功制备了一种新型的可见纸传感器,并通过不同的比色反应同时检测氯氰菊酯、毒死蜱、丙烯磷三种农药。Pengpumkiat等[63]成功开发了一种基于微流控纸基的分析装置,用于检测液体样品中的Ⅱ型PYRs农药,该方法对氯氰菊酯、溴氰菊酯、氯氟氰菊酯和氰戊菊酯的检出限分别为2.50、1.06、3.20和5.73 µg/mL。Rasheed等[64]合成了一种基于甲硝唑的银纳米粒子(MTZ-AgNPs)作为新型比色传感器,首次实现了对氯菊酯的快速、灵敏和选择性检测。该传感器进一步与智能手机和微流控纸基分析装置集成,用于实时和现场检测氯菊酯,在有其他几种杀虫剂存在的情况下,该传感器对氯菊酯显示出卓越的选择性,并且在6周内高度稳定,可长期使用。微流控纸基分析装置制造简单,无需洁净室设施,大多数由廉价和现成的材料制成,并且不需要计算机控制的泵来操作,是理想的现场快速检测的方法。
比色法具有直观易读的优点,是一种有效的快速现场检测方法。新型的比色传感技术越来越适用于现场快速检测。在智能手机的辅助下,比色传感器的灵敏度可以达到传统实验室检测的水平。
4.2 荧光传感器的快速检测
荧光法具有灵敏度高、选择性强、观察方便、对生物体毒性小等的明显优势,通常通过分子内电荷转移、共振能量转移、激发态分子内质子转移、聚集诱导发射等机制引发荧光信号变化来实现检测[65]。许多新型荧光材料已被用于构建荧光传感器,包括荧光染料、QDs、上转换纳米粒子(upconverting nanoparticles,UCNPs)、MOFs等。
UCNPs是一种无机晶体纳米材料,能够将近红外(NIR)激发光转换为可见光和紫外发射光。低毒性、长寿命和低光漂白的特点使得UCNPs具有广泛的应用前景[66]。Liu等[67]利用UCNPs与AuNPs之间的发光共振能量转移(LRET)行为,构建了一种检测含氰农药的荧光方法,对甲氰菊酯检出范围为1.0~100 ng/mL,检出限为0.24 ng/mL。最近,Song等[68]合成了尺寸均匀、分散性好、发光效率高的三层核-壳-壳UCNPs,提高了发光效率和稳定性,并用其建立了甲氰菊酯的荧光免疫分析方法,结果快速准确。
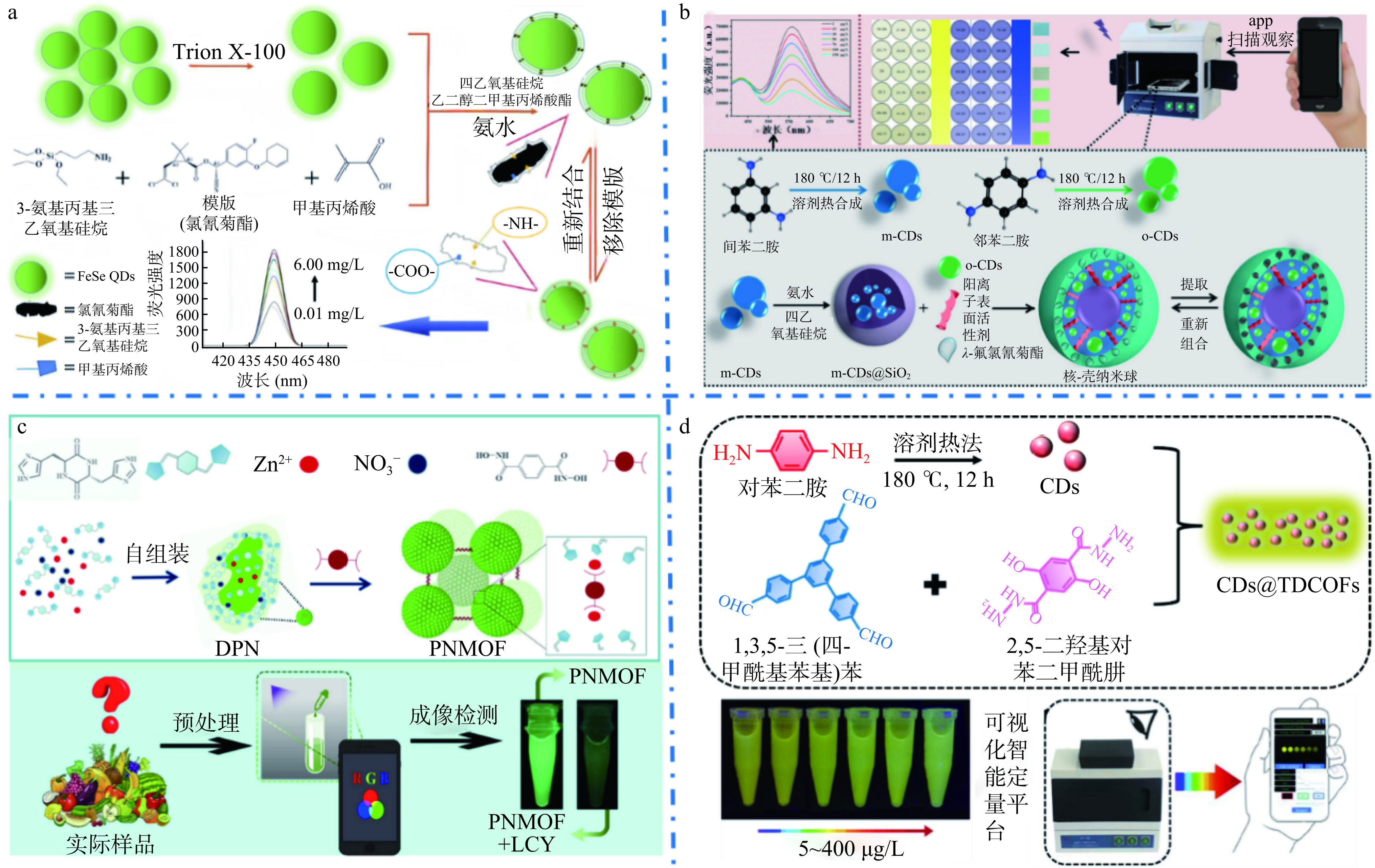
QDs是一种能在特定波长下产生荧光信号的纳米材料,通过调整QDs的大小和组成,可以获得不同波长荧光的QDs[69]。量子点的发射荧光峰值波长是稳定的,因此,QDs比传统荧光素更稳定[21]。Li等[70]制备了一种新型的FeSe QDs印迹二氧化硅层(MIP-FeSe-QDs),开发了一种选择性灵敏的氟氯氰菊酯(CYF)荧光纳米传感器(图3a)。对CYF的特异性识别是由于离子相互作用、分子结构选择和氢键相互作用阻止了电荷从FeSe-QDs转移到CYF上,从而使得荧光猝灭现象的产生。该方法具有良好的线性度、选择性和灵敏度,可用于鱼类样品中CYF的检测。
碳点的特征尺寸小于10 nm,是碳材料与传统QDs交叉领域的后起之秀。碳点具有独特的结构、物理化学和光化学特性,使其成为生物、设备、催化和其他应用的理想平台[71]。李满秀等[72]制备了一种碳量子点/银复合材料(CQDS/Ag),当溴氰菊酯与该复合材料反应时,会增强其荧光强度,从而建立了一种简单快速的荧光检测方法,可用于蔬菜样品中溴氰菊酯的定量检测。如图3b所示,Zhu等[73]制备了两种不同荧光的碳点,成功构建了基于蓝绿双发射荧光碳点的核壳纳米球,利用分子印迹技术建立了一种简单有效的双通道特异荧光测定λ-氯氟氰菊酯的方法。根据碳点的比例荧光信号,纳米微球实现了PYRs的现场定量检测,具有良好的选择性。结合智能手机设备后,通过监测荧光从绿色到蓝色的变化,实现对λ-氯氟氰菊酯的实时检测。该方法成本效益高、便携、可靠,可用于食品现场的农药监测。
MOFs和共价有机框架(covalent organic frameworks,COF)是可以设计和调整的新型功能性多孔材料,已被探索用于催化、化学传感、水收集、气体储存和分离等领域[74]。MOFs是一类由有机配体连接金属离子或金属簇节点的材料,由于其比表面积大、孔隙率高、化学和热稳定性好等特点,已被广泛应用于电化学传感和荧光传感等领域[75]。如图3c所示,Zhang等[76]设计了一种基于多肽的三维MOFs(PNMOF),是以具有荧光的二肽纳米点(DPN)作为节点,在Zn2+主导的配位环境中与二羟酸酯连接剂桥接,从而得到基于有机框架的发光材料,该材料具有明亮的绿色荧光。之后建立了基于PNMOF的级联扩增平台,利用荧光成像技术结合智能手机检测溶液和固态样品中的PYRs。Jiang等[77]利用COF制备了具有稳定性和发光活性的高效荧光传感器(CARs-CCFs),可利用荧光传感和手机扫描双重模式快速直观地检测λ-氯氟氰菊酯。为了满足不同的应用需求,利用不同的纳米材料对COF进行修饰是开发多功能荧光材料的有效策略之一。例如,Zhang等[78]先用热溶剂法合成了具有荧光特性的碳点,再利用碳点对COF进行包封制备了用于检测PYRs的荧光有机骨架,该传感器检出限低至0.69 μg/L(图3d)。与智能手机辅助设备集成后,可对PYRs进行可视化智能定量检测,检测限为4.875 μg/L。
总而言之,新型的荧光材料具有优异的光学性能、生物相容性和稳定性,可以满足分析需求,并推动荧光传感器的发展。荧光传感器的荧光信号反应快速而强烈,只需特定光源即可读取信号,使其在PYRs检测中具有很好的应用前景。表2列举了部分光学传感器在PYRs农药残留检测中的应用。
表 2 光学传感器在PYRs农药残留检测中的应用Table 2. Application of optical sensor in PYRs pesticide residue detection目标 材料 检出限 线性范围 样品回收率 识别元件 检测机制 文献 联苯菊酯
甲氰菊酯羧酸酯酶、固蓝B盐 0.1 μg/mL / / 酶 比色 [56] 溴氰菊酯 谷胱甘肽-转移酶、溴百里酚蓝 / 0~50 µg/mL / 酶 比色 [57] λ-氯氟氰菊酯 LCT-1适配体
LCT-1-39适配体
AuNPs0.0197 µg/mL
0.0186 µg/mL0.1~0.4 µg/mL
0.1~0.5 µg/mL黄瓜、梨(82.93%~95.5%) 适配体 比色 [59] 溴氰菊酯 AuNPs-MNBT 0.25 μmol/L 0.005~1 μmol/L 樱桃、小番茄(85.75%~100.7%) / 比色 [60] 氯氟氰菊酯 Ag@SiO2-NH2 NPs 1.0×10−6 mol/L 1.0×10−6~2.0×10−3 mol/L / / 比色 [61] 氯氰菊酯 茚三酮 4.053 mg/L 12.0~60.0 mg/L 果蔬(90.9%~108.4%) / 比色 [62] 氯氰菊酯
溴氰菊酯
氯氟氰菊酯
氰戊菊酯茚三酮 2.50 µg/mL
1.06 µg/mL
3.20 µg/mL
5.73 µg/mL2~40 µg/mL 水(83.73%~106%) / 比色 [63] 氯菊酯 MTZ-AgNPs 0.0104 µmol/L 0.1~50 µmol/L 番茄、苹果(97.4%~101.6%) / 比色 [64] 甲氰菊酯 UCNPs@SiO2-NH2、AuNPs 0.24 ng/mL 1.0~100 ng/mL / / 荧光 [67] 甲氰菊酯 NaGdF4@NaGdF4: Yb, Tm@NaGdF4:
Yb, Nd UCNPs0.114 µg/kg 0.02~62.5 µg/kg 番茄、黄瓜、白菜(86.5%~100.2%) 抗原抗体 荧光 [68] 氟氯氰菊酯 MIP-FeSe-QDs 1.3/1.0 µg/kg 0.01~0.20 mg/L 沉积物、
鱼类(88.0%~113.9%)MIP 荧光 [70] 溴氰菊酯 CQDS/Ag 0.44 µg/mL 4.8~16.8 µg/mL 油菜、黄瓜、油麦菜(95.8%~109.7%) / 荧光 [72] λ-氯氟氰菊酯 双CD核-壳纳米球 0.048 μg/L 1~150 μg/L 自来水、茶叶、黄瓜和苹果(87.93%~101.4%) / 荧光 [73] 高效氯氟氰
菊酯PNMOF 0.34 μg/L 5~300 μg/L 苹果、白菜、梨(88.26%~108.17%) 多肽 荧光 [76] λ-氯氟氰菊酯 CCFs 0.368 μg/L 0.8~175 μg/L 白菜、黄瓜、茶、红薯、苹果(88%~103%) / 荧光 [77] PYRs CDs@TDCOFs 0.69 μg/L 5~400 μg/L 白菜、花椰菜、苹果(105.48%~113.40%) / 荧光 [78] 5. 总结与展望
近年来,PYRs农药的快速检测技术取得了重大进展,最常见的快速检测方法ELISA在PYRs检测领域具有成本低、应用成熟度高等优点,但其灵敏度、稳定性和准确性都有待提高。LFIA、比色传感、荧光传感和电化学传感分析快速、信号强、易于操作,还能与智能手机结合,使检测更加便捷准确。然而,这些快速检测技术仍存在一些缺点,如制造成本高、技术不够成熟等。纳米材料和新型技术的发展将为传感器提供广泛的新材料选择,以克服目前快速检测技术面临的困难。因此,未来的研究方向可以将快速检测技术与新型纳米材料相结合,实现高灵敏度、快速、集成化和小型化的PYRs检测。因此,今后的研究可以从以下几个方面挖掘:a.各种具有优异的光学、物理和化学性质的纳米材料,利用其独特的荧光、吸附、催化性能构建新型传感器,并将其与快速检测方法结合,实现PYRs的高灵敏快速检测。b.目前的纳米材料仍存在荧光不稳定、电导率差、稳定性低等缺点。复合改性策略可以使材料在原有优势的基础上获得其他材料的导电性、发光性、磁性、催化性等优异性能,扩大纳米材料在食品PYRs检测中的应用范围。c.微流控装置在检测PYRs方面显示出一定的前景。将其与新型纳米材料联用,可兼具两者优势,有望实现PYRs的灵敏便捷、集成化和小型化检测。d.将新型传感器与便携式设备或智能手机等组合,有望实现智能化、便携化的PYRs检测,无需笨重的大型外部仪器。
-
表 1 LFIA在PYRs农药残留检测中的应用
Table 1 Application of LFIA in PYRs pesticide residue detection
目标 标签 检出限 线性范围 样品回收率 机制 文献 甲氰菊酯 金纳米颗粒 62 µg/L 15.6~250 µg/L 苹果、黄瓜(81.6%~103.8%) 比色 [25] 氯氰菊酯 金纳米颗粒 0.3 µg/mL / / 比色 [26] 联苯菊酯 金纳米颗粒 50 ng/mL / / 比色 [27] 苯醚氰菊酯 金纳米颗粒 1 µg/kg / / 比色 [28] λ-氯氟氰菊酯 金纳米颗粒 1.2 ng/g
0.7 ng/g
1.0 ng/g
4.0 ng/g2.3~122.0 ng/g
1.5~98.2 ng/g
2.1~145.5 ng/g
6.6~129.7 ng/g白菜(82.1%~96.7%)
欧芹(82.4%~96.1%)
菠菜(81.2%~94.8%)
绿茶(80.4%~90.7%)比色 [29] 氯氰菊酯
溴氰菊酯
氰戊菊酯金纳米颗粒 800 µg/L
1000 µg/L
1400 µg/L/ / 比色 [30] 氯菊酯 罗丹明 1 µg/L / / 荧光 [34] 氯氰菊酯
3-PBA聚合物碳点 0.35 ng/mL
0.04 ng/mL1~100 ng/mL
0.1~100 ng/mL/ 荧光 [37] 氰戊菊酯 Eu荧光微球 51.29 µg/mL 50~1000 µg/L 甘蓝、黄瓜、茄子(68.7%~109.2%) 荧光 [41] 甲氰菊酯 荧光微球 0.003 mg/L 0.003~12.8 mg/L 白菜、生菜、梨、苹果(85.0%~105.0%) 荧光 [42] 甲氰菊酯 NaFL/UiO-66@CMCS 1.56 µg/kg 0.98~62.5 μg/L 小麦、玉米(96.58%~118.56%) 荧光 [43] 氰戊菊酯 鲁米诺还原金纳米颗粒 0.067 ng/mL 0.2~200 ng/mL 党参、丹参(95%~116%) 比色、
化学发光[44] 氯氰菊酯
氰戊菊酯金纳米颗粒 2.3×10−4 ng/mL
2.6×10−5 ng/mL10−5~100 ng/mL 自来水、牛奶、河水(94.9%~112%) 比色、
SERS[45] 表 2 光学传感器在PYRs农药残留检测中的应用
Table 2 Application of optical sensor in PYRs pesticide residue detection
目标 材料 检出限 线性范围 样品回收率 识别元件 检测机制 文献 联苯菊酯
甲氰菊酯羧酸酯酶、固蓝B盐 0.1 μg/mL / / 酶 比色 [56] 溴氰菊酯 谷胱甘肽-转移酶、溴百里酚蓝 / 0~50 µg/mL / 酶 比色 [57] λ-氯氟氰菊酯 LCT-1适配体
LCT-1-39适配体
AuNPs0.0197 µg/mL
0.0186 µg/mL0.1~0.4 µg/mL
0.1~0.5 µg/mL黄瓜、梨(82.93%~95.5%) 适配体 比色 [59] 溴氰菊酯 AuNPs-MNBT 0.25 μmol/L 0.005~1 μmol/L 樱桃、小番茄(85.75%~100.7%) / 比色 [60] 氯氟氰菊酯 Ag@SiO2-NH2 NPs 1.0×10−6 mol/L 1.0×10−6~2.0×10−3 mol/L / / 比色 [61] 氯氰菊酯 茚三酮 4.053 mg/L 12.0~60.0 mg/L 果蔬(90.9%~108.4%) / 比色 [62] 氯氰菊酯
溴氰菊酯
氯氟氰菊酯
氰戊菊酯茚三酮 2.50 µg/mL
1.06 µg/mL
3.20 µg/mL
5.73 µg/mL2~40 µg/mL 水(83.73%~106%) / 比色 [63] 氯菊酯 MTZ-AgNPs 0.0104 µmol/L 0.1~50 µmol/L 番茄、苹果(97.4%~101.6%) / 比色 [64] 甲氰菊酯 UCNPs@SiO2-NH2、AuNPs 0.24 ng/mL 1.0~100 ng/mL / / 荧光 [67] 甲氰菊酯 NaGdF4@NaGdF4: Yb, Tm@NaGdF4:
Yb, Nd UCNPs0.114 µg/kg 0.02~62.5 µg/kg 番茄、黄瓜、白菜(86.5%~100.2%) 抗原抗体 荧光 [68] 氟氯氰菊酯 MIP-FeSe-QDs 1.3/1.0 µg/kg 0.01~0.20 mg/L 沉积物、
鱼类(88.0%~113.9%)MIP 荧光 [70] 溴氰菊酯 CQDS/Ag 0.44 µg/mL 4.8~16.8 µg/mL 油菜、黄瓜、油麦菜(95.8%~109.7%) / 荧光 [72] λ-氯氟氰菊酯 双CD核-壳纳米球 0.048 μg/L 1~150 μg/L 自来水、茶叶、黄瓜和苹果(87.93%~101.4%) / 荧光 [73] 高效氯氟氰
菊酯PNMOF 0.34 μg/L 5~300 μg/L 苹果、白菜、梨(88.26%~108.17%) 多肽 荧光 [76] λ-氯氟氰菊酯 CCFs 0.368 μg/L 0.8~175 μg/L 白菜、黄瓜、茶、红薯、苹果(88%~103%) / 荧光 [77] PYRs CDs@TDCOFs 0.69 μg/L 5~400 μg/L 白菜、花椰菜、苹果(105.48%~113.40%) / 荧光 [78] -
[1] 贺顺喜, 周师军. 应重视食品残留农药的监测[J]. 解放军健康,2002(2):17. [HE S X, ZHOU S J. Attention should be paid to the monitoring of pesticide residues in food[J]. PLA Health,2002(2):17.] HE S X, ZHOU S J. Attention should be paid to the monitoring of pesticide residues in food[J]. PLA Health, 2002(2): 17.
[2] TANG W, WANG D, WANG J, et al. Pyrethroid pesticide residues in the global environment:An overview[J]. Chemosphere,2018,191:990−1007. doi: 10.1016/j.chemosphere.2017.10.115
[3] STELLMAN S D, STELLMAN J M. Pyrethroid insecticides-time for a closer look[J]. JAMA Internal Medicine,2020,180(3):374−375. doi: 10.1001/jamainternmed.2019.6093
[4] PATHAK P N, PANDE S G, SUKHADEVE A A, et al. Ultrasonication assisted development of new greener method for extraction of cypermethrin and transfluthrin from various samples:A forensic approach[J]. Asian Journal of Chemistry,2018,30(4):817−820. doi: 10.14233/ajchem.2018.21058
[5] HOLYNSKA-IWAN I, SZEWCZYK-GOLEC K. Pyrethroids:How they affect human and animal health?[J]. Medicina,2020,56(11):582. doi: 10.3390/medicina56110582
[6] 罗苹. 农产食品中菊酯类农药残留量的气相色谱快速分析方法[J]. 化学研究与应用,1999(6):691−693. [LUO P. Rapid gas chromatographic method for the determination of pyrethroid pesticide residues in foods[J]. Chemical Research and Application,1999(6):691−693.] LUO P. Rapid gas chromatographic method for the determination of pyrethroid pesticide residues in foods[J]. Chemical Research and Application, 1999(6): 691−693.
[7] TIAN F, QIAO C, LUO J, et al. Method development and validation of ten pyrethroid insecticides in edible mushrooms by modified QuEChERS and gas chromatography-tandem mass spectrometry[J]. Scientific Reports,2020,10(1):7042. doi: 10.1038/s41598-020-64056-7
[8] JABOT C, FIEU M, GIROUD B, et al. Trace-level determination of pyrethroid, neonicotinoid and carboxamide pesticides in beeswax using dispersive solid-phase extraction followed by ultra-high-performance liquid chromatography-tandem mass spectrometry[J]. International Journal of Environmental Analytical Chemistry,2015,95(3):240−257. doi: 10.1080/03067319.2015.1016011
[9] WU L, LI G, XU X, et al. Application of nano-ELISA in food analysis:Recent advances and challenges[J]. Trends in Analytical Chemistry,2019,113:140−156. doi: 10.1016/j.trac.2019.02.002
[10] ZHAO Q, LU D, ZHANG G, et al. Recent improvements in enzyme-linked immunosorbent assays based on nanomaterials[J]. Talanta,2021,223(P1):121722.
[11] HUA X, LIU X, YIN W, et al. A sensitive monoclonal antibody-based enzyme-linked immunosorbent assay for the detection of bifenthrin in a chemical soil barrier[J]. Science of the Total Environment,2015,502:246−251. doi: 10.1016/j.scitotenv.2014.09.032
[12] SONG Y, LU Y, LIU B, et al. A sensitivity-improved enzyme-linked immunosorbent assay for fenvalerate:A new approach for hapten synthesis and application to tea samples[J]. Journal of the Science of Food and Agriculture, 2011:2210-6.
[13] CHEN X, XU L, MA W, et al. Development of an enzyme-linked immunosorbent assay for cyhalothrin[J]. Immunological Investigations,2013,42(6):493−503. doi: 10.3109/08820139.2013.797909
[14] FRUHMANN P, SANCHIS A, MAYERHUBER L, et al. Immunoassay and amperometric biosensor approaches for the detection of deltamethrin in seawater[J]. Analytical and Bioanalytical Chemistry,2018,410(23):5923−5930. doi: 10.1007/s00216-018-1209-1
[15] SHI H Y, ZHANG B H, YE Y H, et al. Development of an enzyme-linked immunosorbent assay for the pyrethroid fenpropathrin[J]. Food and Agricultural Immunology,2011,22(1):69−76. doi: 10.1080/09540105.2010.527926
[16] WATANABE T, SHAN G, STOUTAMIRE D W, et al. Development of a class-specific immunoassay for the type I pyrethroid insecticides[J]. Analytica Chimica Acta,2001,444:119−129. doi: 10.1016/S0003-2670(01)01163-1
[17] MAK S K, SHAN G, LEE H J, et al. Development of a class selective immunoassay for the type II pyrethroid insecticides[J]. Analytica Chimica Acta,2005,534(1):109−120. doi: 10.1016/j.aca.2004.11.021
[18] XIAO X, HU S, LAI X, et al. Developmental trend of immunoassays for monitoring hazards in food samples:A review[J]. Trends in Food Science & Technology,2021,111:68−88.
[19] QI X, XU H, LIU W, et al. Development of a rapid FLISA detection of Salmonella spp. based on CdTe/ZnS quantum dots[J]. Journal of Food Safety,2020,40(5):e12830. doi: 10.1111/jfs.12830
[20] LIAO Y, CUI X, CHEN G, et al. Simple and sensitive detection of triazophos pesticide by using quantum dots nanobeads based on immunoassay[J]. Food and Agricultural Immunology,2019,30(1):522−532. doi: 10.1080/09540105.2019.1597022
[21] LIU J, ZHANG Q, ZHANG W, et al. Development of a fluorescence-linked immunoassay based on quantum dots for fenvalerate[J]. Food and Agricultural Immunology,2013,25(1):82−93.
[22] LIU S, SHU R, NIE C, et al. Bioresource-derived tannic acid-supported immuno-network in lateral flow immunoassay for sensitive clenbuterol monitoring[J]. Food Chemistry,2022,382:132390. doi: 10.1016/j.foodchem.2022.132390
[23] WANG X, SUN T, SHEN W, et al. A lateral flow immunochromatographic assay based on nanobody-oriented coupling strategy for aflatoxin B1 detection[J]. Sensors and Actuators B:Chemical,2023,394:134419. doi: 10.1016/j.snb.2023.134419
[24] ZHU J, DOU L, MI J, et al. Production of highly sensitive monoclonal antibody and development of lateral flow assays for phallotoxin detection in urine[J]. Analytical and Bioanalytical Chemistry,2021,413(20):4979−4987. doi: 10.1007/s00216-021-03457-7
[25] CHEN X, LIU L, KUANG H, et al. A strip-based immunoassay for rapid determination of fenpropathrin[J]. Analytical Methods,2013,5(21):6234−6239. doi: 10.1039/c3ay41030g
[26] HUANG L, ZHANG F, LI F, et al. Development of IC-ELISA and colloidal gold lateral flow immunoassay for the determination of cypermethrin in agricultural samples[J]. Biosensors,2022,12(11):1058. doi: 10.3390/bios12111058
[27] YAO J, XU X, LIU L, et al. Gold nanoparticle-based immunoassay for the detection of bifenthrin in vegetables[J]. Food Additives & Contaminants:Part A, 2022, 39(3):531-541.
[28] 吴小胜, 贾芳芳, 崔海峰. 一种苯醚氰菊酯胶体金免疫快速检测试纸条的研制[J]. 湖北农业科学,2020,59(7):196−198. [WU X S, JIA F F, CUI H F. Study on gold immunochromatography assay for rapid detection of cypermethrin[J]. Hubei Agricultural Sciences,2020,59(7):196−198.] WU X S, JIA F F, CUI H F. Study on gold immunochromatography assay for rapid detection of cypermethrin[J]. Hubei Agricultural Sciences, 2020, 59(7): 196−198.
[29] LIN L, SONG S, WU X, et al. Ultrasensitive immunochromatographic strip for the detection of cyhalothrin in foods[J]. Analytical Methods,2021,13(27):3040−3049. doi: 10.1039/D1AY00609F
[30] KRANTHI K R, DAVIS M, MAYEE C D, et al. Development of a colloidal-gold based lateral-flow immunoassay kit for ‘quality-control’ assessment of pyrethroid and endosulfan formulations in a novel single strip format[J]. Crop Protection,2009,28(5):428−434. doi: 10.1016/j.cropro.2009.01.003
[31] DI NARDO F, ANFOSSI L, GIOVANNOLI C, et al. A fluorescent immunochromatographic strip test using quantum dots for fumonisins detection[J]. Talanta,2016,150:463−468. doi: 10.1016/j.talanta.2015.12.072
[32] GONG X, CAI J, ZHANG B, et al. A review of fluorescent signal-based lateral flow immunochromatographic strips[J]. Journal of Materials Chemistry B,2017,5(26):5079−5091. doi: 10.1039/C7TB01049D
[33] BANERJEE M, BHOSLE A A, CHATTERJEE A, et al. Mechanochemical synthesis of organic dyes and fluorophores[J]. The Journal of Organic Chemistry,2021,86(20):13911−13923. doi: 10.1021/acs.joc.1c01540
[34] COSTA E, CLIMENT E, AST S, et al. Development of a lateral flow test for rapid pyrethroid detection using antibody-gated indicator-releasing hybrid materials[J]. The Analyst,2020,145(10):3490−3494. doi: 10.1039/D0AN00319K
[35] ZHAO Y, SONG Q, LIN Y, et al. Improving the photostability of fluorescent dyes by polymer nano-insulating layer[J]. Journal of Applied Polymer Science,2021,139(6):51625.
[36] TUERHONG M, XU Y, YIN X B. Review on carbon dots and their applications[J]. Chinese Journal of Analytical Chemistry,2017,45(1):139−150. doi: 10.1016/S1872-2040(16)60990-8
[37] ZHAO Y, RUAN X, SONG Y, et al. Smartphone-based dual-channel immunochromatographic test strip with polymer quantum dot labels for simultaneous detection of cypermethrin and 3-phenoxybenzoic acid[J]. Analytical Chemistry,2021,93(40):13658−13666. doi: 10.1021/acs.analchem.1c03085
[38] 周芳, 窦彩云. 时间分辨荧光免疫层析快速检测牛奶中地塞米松[J]. 食品安全质量检测学报,2022,13(22):7331−7338. [ZHOU F, DOU C Y. Rapid detection of dexamethasone in milk by time-resolved fluorescence immunochromatography[J]. Journal of Food Safety and Quality,2022,13(22):7331−7338.] ZHOU F, DOU C Y. Rapid detection of dexamethasone in milk by time-resolved fluorescence immunochromatography[J]. Journal of Food Safety and Quality, 2022, 13(22): 7331−7338.
[39] PENG T, PEI X, ZHENG Y, et al. Performance of fluorescence microspheres-based immunochromatography in simultaneous monitoring of five quinoxalines[J]. Food and Agricultural Immunology,2017,28(6):1544−1554. doi: 10.1080/09540105.2017.1354357
[40] LIU Y, JI J, CUI F, et al. Development of a two-step immunochromatographic assay for microcystin-LR based on fluorescent microspheres[J]. Food Control,2019,95:34−40. doi: 10.1016/j.foodcont.2018.07.036
[41] ZHANG L, ZHENG Y, SHAO H, et al. Development of a time-resolved fluorescence microsphere Eu lateral flow test strip based on a molecularly imprinted electrospun nanofiber membrane for determination of fenvalerate in vegetables[J]. Frontiers in Nutrition,2022,9:957745. doi: 10.3389/fnut.2022.957745
[42] XU Z H, WANG J K, YE Q X, et al. Highly selective monoclonal antibody-based fluorescence immunochromatographic assay for the detection of fenpropathrin in vegetable and fruit samples[J]. Analytica Chimica Acta,2023,1246:340898. doi: 10.1016/j.aca.2023.340898
[43] WANG X, HUANG H, ZHONG S, et al. Carboxymethyl chitosan-modified UiO-66 for the rapid detection of fenpropathrin in grains[J]. International Journal of Biological Macromolecules,2024,265:131032. doi: 10.1016/j.ijbiomac.2024.131032
[44] WANG W, OUYANG H. Luminol-reduced Au nanoparticles-based dual-signal immunochromatographic test strip for pesticide residues[J]. Microchemical Journal,2019,149:104055. doi: 10.1016/j.microc.2019.104055
[45] LI X, YANG T, SONG Y, et al. Surface-enhanced Raman spectroscopy (SERS)-based immunochromatographic assay (ICA) for the simultaneous detection of two pyrethroid pesticides[J]. Sensors and Actuators B:Chemical,2019,283:230−238. doi: 10.1016/j.snb.2018.11.112
[46] NOORI J S, MORTENSEN J, GETO A. Recent development on the electrochemical detection of selected pesticides:A focused review[J]. Sensors,2020,20(8):2221. doi: 10.3390/s20082221
[47] SUN Y, WATERHOUSE G I N, QIAO X, et al. Determination of chloramphenicol in food using nanomaterial-based electrochemical and optical sensors-a review[J]. Food Chemistry,2023,410:135434. doi: 10.1016/j.foodchem.2023.135434
[48] 白静, 朱冰. 三维氮掺杂石墨烯分子印迹传感器在联苯菊酯检测中的应用[J]. 分析科学学报,2022,38(5):658−662. [BAI J, ZHU B. Three-dimensional nitrogen-doped graphene molecular imprinting sensor for bifenthrin detection[J]. Journal of Analytical Science,2022,38(5):658−662.] BAI J, ZHU B. Three-dimensional nitrogen-doped graphene molecular imprinting sensor for bifenthrin detection[J]. Journal of Analytical Science, 2022, 38(5): 658−662.
[49] LI Y, ZHANG L, DANG Y, et al. A robust electrochemical sensing of molecularly imprinted polymer prepared by using bifunctional monomer and its application in detection of cypermethrin[J]. Biosensors and Bioelectronics,2019,127:207−214. doi: 10.1016/j.bios.2018.12.002
[50] CIROCKA A, ZARZECZAŃSKA D, WCISŁO A. Good choice of electrode material as the key to creating electrochemical sensors-characteristics of carbon materials and transparent conductive oxides (TCO)[J]. Materials,2021,14(16):4743. doi: 10.3390/ma14164743
[51] 田利, 李慧玲, 张鑫, 等. 基于CdTe@ZIF-7复合材料的电化学发光传感器检测氯菊酯[J]. 分析试验室,2024,43(10):1479−1483. [TIAN L, LI H L, ZHANG X, et al. Determination of permethrin by electrochemiluminescence sensor based on CdTe@ZIF-7 composite material[J]. Chinese Journal of Analysis Laboratory,2024,43(10):1479−1483.] TIAN L, LI H L, ZHANG X, et al. Determination of permethrin by electrochemiluminescence sensor based on CdTe@ZIF-7 composite material[J]. Chinese Journal of Analysis Laboratory, 2024, 43(10): 1479−1483.
[52] SUN Z, LU J, ZHANG X, et al. Electrospun nanofibres containing Zn-MOF for electrochemiluminescent determination of fenpropathrin residues in fruit juices[J]. Food Chemistry,2023,405:134950. doi: 10.1016/j.foodchem.2022.134950
[53] WU Y, FENG J, HU G, et al. Colorimetric sensors for chemical and biological sensing applications[J]. Sensors,2023,23(5):2749. doi: 10.3390/s23052749
[54] NGUYEN H H, LEE S H, LEE U J, et al. Immobilized enzymes in biosensor applications[J]. Materials,2019,12(1):121. doi: 10.3390/ma12010121
[55] BUCUR B, MUNTEANU F D, MARTY J L, et al. Advances in enzyme-based biosensors for pesticide detection[J]. Biosensors,2018,8(2):27. doi: 10.3390/bios8020027
[56] 何丽媛, 倪树标, 武悦俊, 等. 基于分光光度法快速检测果蔬中的拟除虫菊酯类农药残留[J]. 现代食品,2021(24):175−180,184. [HE L Y, NI S B, WU Y J, et al. Based on the spectrophotometric method for the rapid determination of pyrethroid pesticide residues in fruits and vegetables[J]. Analysis and Testing,2021(24):175−180,184.] HE L Y, NI S B, WU Y J, et al. Based on the spectrophotometric method for the rapid determination of pyrethroid pesticide residues in fruits and vegetables[J]. Analysis and Testing, 2021(24): 175−180,184.
[57] DOWD A J, MOROU E, STEVEN A, et al. Development of a colourimetric pH assay for the quantification of pyrethroids based on glutathione-S-transferase[J]. International Journal of Environmental Analytical Chemistry,2010,90(12):922−933. doi: 10.1080/03067310903359526
[58] MO T, LIU X, LUO Y, et al. Aptamer-based biosensors and application in tumor theranostics[J]. Cancer Science,2021,113(1):7−16.
[59] YANG Y, TANG Y, WANG C, et al. Selection and identification of a DNA aptamer for ultrasensitive and selective detection of λ-cyhalothrin residue in food[J]. Analytica Chimica Acta, 2021, 1179.
[60] WANG Z, HUANG Y, WANG D, et al. A rapid colorimetric method for the detection of deltamethrin based on gold nanoparticles modified with 2-mercapto-6-nitrobenzothiazole[J]. Analytical Methods,2018,10(15):1774−1780. doi: 10.1039/C8AY00137E
[61] LI Y, CUI Z, LI D, et al. Colorimetric determination of pyrethroids based on core-shell Ag@SiO2 nanoparticles[J]. Sensors and Actuators B:Chemical,2011,155(2):878−883. doi: 10.1016/j.snb.2011.01.064
[62] ZHU J, YIN X, ZHANG W, et al. Simultaneous and sensitive detection of three pesticides using a functional poly(sulfobetaine methacrylate)-coated paper-based colorimetric sensor[J]. Biosensors,2023,13(3):309. doi: 10.3390/bios13030309
[63] PENGPUMKIAT S, NAMMOONNOY J, WONGSAKOONKAN W, et al. A microfluidic paper-based analytical device for type-II pyrethroid targets in an environmental water sample[J]. Sensors,2020,20(15):4107. doi: 10.3390/s20154107
[64] RASHEED S, UL HAQ M A, AHMAD N, et al. Smartphone-integrated colorimetric and microfluidic paper-based analytical devices for the trace-level detection of permethrin[J]. Food Chemistry,2023,429:136925. doi: 10.1016/j.foodchem.2023.136925
[65] YAN F, SUN X, ZU F, et al. Fluorescent probes for detecting cysteine[J]. Methods Appl Fluoresc,2018,6(4):042001. doi: 10.1088/2050-6120/aad580
[66] WILHELM S. Perspectives for upconverting nanoparticles[J]. ACS Nano,2017,11(11):10644−10653. doi: 10.1021/acsnano.7b07120
[67] LIU M, ZHANG L, JIANG S, et al. A facile luminescence resonance energy transfer method for detecting cyano-containing pesticides in herbal medicines[J]. Microchemical Journal,2020,152:104451. doi: 10.1016/j.microc.2019.104451
[68] SONG Y, JIN J, HU L, et al. Core-shell-shell upconversion nanomaterials applying for simultaneous immunofluorescent detection of fenpropathrin and procymidone[J]. Foods,2023,12(18):3445. doi: 10.3390/foods12183445
[69] HUA L, HAN H, ZHANG X. Size-dependent electrochemiluminescence behavior of water-soluble CdTe quantum dots and selective sensing of l-cysteine[J]. Talanta,2009,77(5):1654−1659. doi: 10.1016/j.talanta.2008.09.061
[70] LI X, JIAO H F, SHI X Z, et al. Development and application of a novel fluorescent nanosensor based on FeSe quantum dots embedded silica molecularly imprinted polymer for the rapid optosensing of cyfluthrin[J]. Biosensors and Bioelectronics,2018,99:268−273. doi: 10.1016/j.bios.2017.07.071
[71] LIU Y, HUANG H, CAO W, et al. Advances in carbon dots:From the perspective of traditional quantum dots[J]. Materials Chemistry Frontiers,2020,4(6):1586−1613. doi: 10.1039/D0QM00090F
[72] 李满秀, 任光明, 胡文欣, 等. 碳量子点/银复合材料的制备及其在溴氰菊酯检测中的应用[J]. 分析科学学报,2020,36(1):154−158. [LI X M, REN G M, HU W X, et al. Preparation of carbon quantum dots/Ag composites and its application for deltamethrin detection[J]. Journal of Analytical Science,2020,36(1):154−158.] LI X M, REN G M, HU W X, et al. Preparation of carbon quantum dots/Ag composites and its application for deltamethrin detection[J]. Journal of Analytical Science, 2020, 36(1): 154−158.
[73] ZHU X, HAN L, LIU H, et al. A smartphone-based ratiometric fluorescent sensing system for on-site detection of pyrethroids by using blue-green dual-emission carbon dots[J]. Food Chemistry,2022,379:132154. doi: 10.1016/j.foodchem.2022.132154
[74] HAN X, ZHANG W, CHEN Z, et al. The future of metal-organic frameworks and covalent organic frameworks:Rational synthesis and customized applications[J]. Mater Horiz,2023,10(12):5337−5342. doi: 10.1039/D3MH01396K
[75] 魏子奇, 张涵瑜, 杨昌颖. 金属有机框架传感器在农药检测中的应用研究进展[J]. 分析试验室,2023,42(9):1267−1278. [WEI Z Q, ZHANG H Y, YANG C Y. Review on the application of metal-organic framework sensor for pesticides detection[J]. Chinese Journal of Analysis Laboratory,2023,42(9):1267−1278.] WEI Z Q, ZHANG H Y, YANG C Y. Review on the application of metal-organic framework sensor for pesticides detection[J]. Chinese Journal of Analysis Laboratory, 2023, 42(9): 1267−1278.
[76] ZHANG Y, CHEN Y, ZHANG D, et al. Peptide nanodots-bridged metal-organic framework (PNMOF):Intelligently design a cascade amplification platform for smartphone-facilitated mobile fluorescence imaging detection of pyrethroids[J]. Chemical Engineering Journal,2023,468:143690. doi: 10.1016/j.cej.2023.143690
[77] JIANG W, ZHAO Y, ZHANG D, et al. Efficient and robust dual modes of fluorescence sensing and smartphone readout for the detection of pyrethroids using artificial receptors bound inside a covalent organic framework[J]. Biosensors & Bioelectronics,2021,194:113582.
[78] ZHANG Y, ZHU X, LI M, et al. Temperature-responsive covalent organic framework-encapsulated carbon dot-based sensing platform for pyrethroid detection via fluorescence response and smartphone readout[J]. Journal of Agricultural and Food Chemistry,2022,70(20):6059−6071. doi: 10.1021/acs.jafc.2c01568





 下载:
下载:
 下载:
下载:



