Effect of Freezing Methods on the Physical and Chemical Properties and Protein Oxidation of Porcine Liver
-
摘要: 为解决猪肝在冷冻贮藏过程中的品质劣变问题,本实验通过测定猪肝的冰晶微观结构、表面色度、挥发性盐基氮(TVB-N)值、硫代巴比妥酸(TBARs)值,以及猪肝蛋白质的羰基含量、巯基及二硫键含量、表面疏水性等指标,探究了−20 ℃常规空气冻结(Conventional air freezing,CAF)、−80 ℃冰箱深冷冻结(Refrigerator cryogenic freezing,RCF)液氮浸渍冻结(Liquid nitrogen immersion freezing,LNF)3种冻结方式对冻藏猪肝理化特性和蛋白质氧化的影响(猪肝冻结后于−20 ℃贮藏180 d)。结果显示,随着贮藏时间的延长,猪肝鲜度品质下降、蛋白质氧化程度增加。与CAF相比,RCF和LNF组猪肝通过最大冰晶生成带的时间分别减少了71.60%和99.81%,生成的冰晶更加细小均匀。LNF组冻藏180 d后TVB-N和TBARs值分别比CAF组降低了28.43%和41.79%。冻藏180 d后,LNF组蛋白质羰基含量、二硫键含量和表面疏水性分别比CAF组降低38.88%、6.77%和21.04%,巯基含量比CAF组高8.60%,表明使用LNF能够有效延缓猪肝蛋白质的氧化。通过改变冻结方式提高冻结速率,降低冰晶对猪肝细胞组织的破坏程度,能够有效抑制猪肝在冻藏过程中品质的下降。本实验可为猪肝的冷冻贮藏及运输提供技术支撑。Abstract: To address the quality deterioration of porcine liver during frozen storage, the impacts of different freezing methods on porcine liver were investigated, including −20 ℃ conventional air freezing (CAF), −80 ℃ refrigerator cryogenic freezing (RCF) and liquid nitrogen immersion freezing (LNF). The ice crystal microstructure, color, total volatile base nitrogen (TVB-N) value, thiobarbituric acid reactive substances (TBARs) value, carbonyl content, sulfhydryl and disulfide bond content and surface hydrophobicity of porcine liver were determined. The results showed that as the storage time was increased, the quality of porcine liver decreased and the degree of protein oxidation increased. Porcine liver from the RCF and LNF groups formed finer and more uniform ice crystals, which passed through the maximum ice crystal formation zone in less time than the CAF group (71.60% and 99.81%, respectively). In addition, the TVB-N and TBARs values in the LNF group decreased by 28.43% and 41.79% respectively after storage for 180 d compared to the CAF group. Furthermore, compared to the CAF group, the carbonyl content, disulfide bond content and surface hydrophobicity of proteins in the LNF group decreased by 38.88%, 6.77% and 21.04%, respectively, and the sulfhydryl content increased by 8.60%, indicating that the use of LNF could reduce the oxidation of porcine liver proteins significantly. The results suggested that by modifying the freezing method, the freezing rate was increased and the degree of damage caused by ice crystals to porcine liver cell tissues was reduced, effectively preventing the deterioration of porcine liver quality. The results of this investigation could provide technical support for the transportation and freezing of porcine liver.
-
Keywords:
- porcine liver /
- freezing method /
- frozen storage /
- quality /
- protein oxidation
-
猪肝中矿物质、维生素、必需氨基酸和蛋白质含量丰富,其中铁含量为瘦肉的18倍,VA含量是瘦肉的300多倍[1],是补血、护目食物,具有较高的营养价值和医学价值[2]。在我国,每年可得猪肝以数亿公斤计,但是在贮藏运输及加工中存在色泽劣变、食用品质下降等问题,严重影响了猪肝的食品价值[3−4]。因此,猪肝在冷冻及储存过程中的品质劣变问题亟需解决。冻藏保鲜是一种在肉及肉制品加工业中被广泛使用的保藏方式[5]。但由于温度波动、氧气存在等原因,长期冻藏会使冰晶体积增大,导致肉制品内部蛋白质及脂质氧化,而蛋白质氧化等氧化反应是决定肉制品最终品质的主要因素之一[6−7]。冰晶的大小、形态和分布状况与冻结速率密切相关,冻结速率较高时,产生的冰晶数量较多、细小、分布均匀,能在很大程度上减轻对肉制品品质的破坏[8]。在冻结速率较低时,产生的冰晶体积较大且分布不均,从而对组织细胞造成不可逆的破坏[9]。目前,大多数冷冻和调制食品都使用常规的低温空气冻结。冻结速度缓慢,冷冻过程中产生的大冰晶很容易破坏产品的结构[10]。因此,如何提高冻结速率,减少冷冻工艺对产品品质的影响,已成为至关重要的问题。
随着空气分离技术的发展,液氮冻结成本也在逐渐下降,使得液氮冻结技术在食品行业中成为新的研究热点[11]。通过液氮速冻提高冻结速率,在冻结过程中能够快速通过最大冰晶生成带形成较小冰晶,对肌肉组织的损伤较小,产品的质量和营养价值能够更好地维持[12]。已有文献研究表明,使用液氮喷雾冷冻鱼糜凝胶,具有较低液氮喷雾温度(−90 ℃)的凝胶在冷却到最大冰晶生成温度时耗时少[13]。通过液氮速冻、−35 ℃鼓风冷冻和−18 ℃冰箱直接冷冻三种方式冻结大虾,其中液氮速冻能有效改善冷冻大虾的质构特性[14]。除了更好地维持冷冻产品的品质之外,与使用螺旋冷冻机相比,使用液氮冷冻还可提高工艺产量[15−16]。然而,目前对液氮速冻的研究常见于水产品,关于液氮速冻对于猪肝品质的影响未见报道。
本研究通过−20 ℃常规空气冻结、−80 ℃深冷冻结和液氮浸渍冻结三种冻结方式处理猪肝,测定猪肝在冻藏各个阶段的色度、挥发性盐基氮(Total volatile base nitrogen,TVB-N)值、硫代巴比妥酸(Thiobarbituric acid reactive substances,TBARs)值、冰晶显微结构,同时提取猪肝中的蛋白质测定羰基、巯基及二硫键含量以及表面疏水性,以探究冻结方式对猪肝冻藏过程中理化特性和蛋白质氧化的影响,为猪肝的冷冻贮藏以及运输提供技术指导。
1. 材料与方法
1.1 材料与仪器
生猪肝 湖北正大有限公司;液氮 武汉星黎华科技有限公司;1-苯胺基-8-萘磺酸(1-Anilino-8-naphthalisene,ANS)、2,4-二硝基苯肼(2,4-Dinitrophenylhydrazine,DNPH)、5,5'-二硫代双(2-硝基苯甲酸)[5,5'-Dithiobis-(2-nitrobenzoic acid),DTNB] 上海源叶生物科技有限公司;尿素、乙二胺四乙酸(EDTA)、三氯乙酸、盐酸胍 国药集团化学试剂有限公司;甘氨酸 广州赛国生物科技有限公司;Tris 美国Angus化学公司;β-巯基乙醇 美国Genview化学公司;福林酚 北京索莱宝科技有限公司;苏木精伊红染色液 武汉塞维尔生物科技有限公司。
DW-25W518冷冻柜 青岛海尔特种电器有限公司;MDF-U54V超低温冰箱 松下健康医疗器械株式会社;SSN-61热电偶温度记录仪 深圳宇问加壹传感系统有限公司;CR-410手持型色差仪 日本柯尼卡美能达公司;K1160微量凯氏定氮仪 湖北恒康化玻仪器公司;XHF-DY高速分散器 宁波新芝生物科技股份有限公司;F-4600型荧光光谱仪 日本Hitachi公司;XSP-BM-4C光学显微镜 上海彼爱姆(BM)光学仪器制造公司;Cryotome E冷冻切片机 美国Thermo公司。
1.2 实验方法
1.2.1 猪肝样品处理
当天屠宰未经冷冻的猪肝在室温(25±1 ℃)下使用流动的蒸馏水冲洗10 min,切成约6 cm×5 cm×3 cm大小的块状样品,分为3组,使用聚乙烯袋包装。分别使用−20 ℃常规空气冻结(Conventional air freezing,CAF)、−80 ℃冰箱深冷冻结(Refrigerator cryogenic freezing,RCF)和液氮浸渍冻结(Liquid nitrogen immersion freezing,LNF)3种方式冻结猪肝,直至猪肝的中心温度达到−20 ℃。冻结完成后于−20 ℃冰柜贮藏180 d。测定其冻藏第30、60、90、120、150、180 d及第0 d未冻结样品的各项指标。解冻方式采用4 ℃冷藏12 h解冻。
1.2.2 中心温度测定
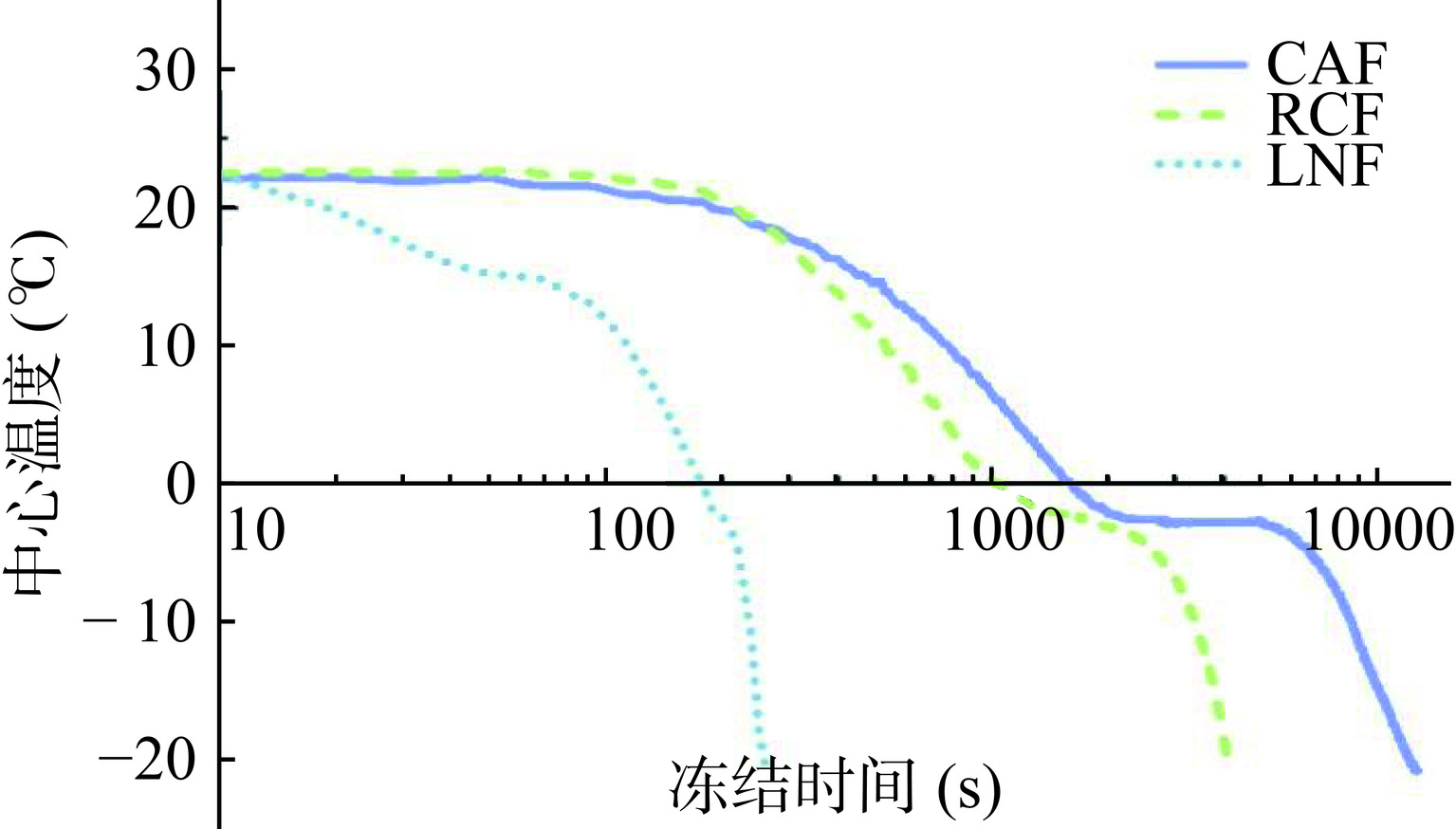
参照栾兰兰[17]的方法测定猪肝的中心温度。将温度计热电偶测温线插入猪肝块的中心,通过CAF、RCF和LNF三种方式分别进行冻结,记录冻结时间和中心温度。冻结实验结束,以时间为横坐标、中心温度为纵坐标,绘制猪肝冻结过程的中心温度变化图。
1.2.3 冰晶微观结构观察
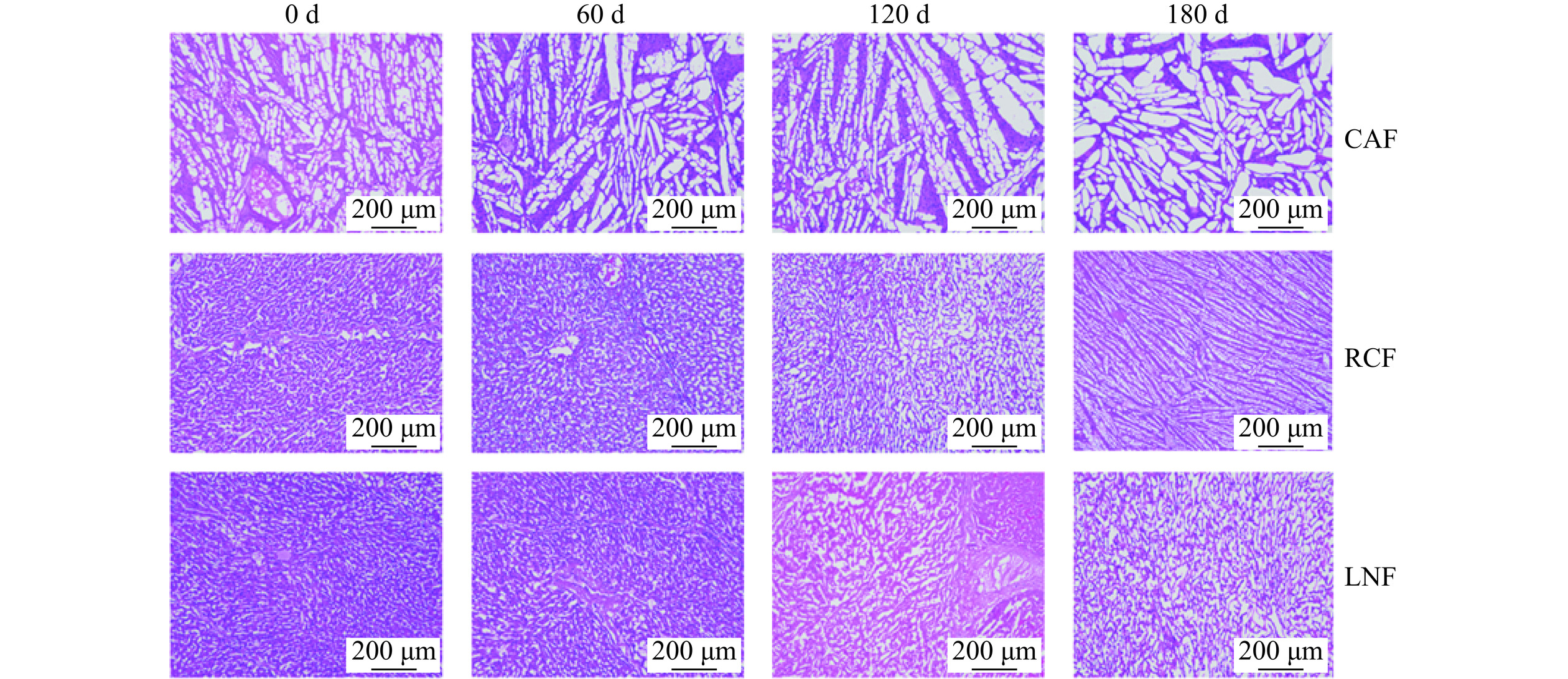
参照ALIZADEH等[18]的方法观察猪肝的冰晶微观结构并稍作修改。使用冷却至−20 ℃的刀片,将冻藏猪肝切成1 mm×1 mm×1 mm的正方体小块。将冻藏猪肝块置于30 mL由60%无水乙醇、30%三氯甲烷和10%冰醋酸组成的混合溶液中(混合溶液已降温至−20 ℃),−20 ℃冰柜贮藏18 h。取出贮藏后的猪肝并自然升温至25 ℃,无水乙醇脱水2 h,之后正丁醇溶液脱水2次,每次2 h,最后浸泡在正丁醇溶液中8 h。洗脱后的猪肝用甲苯冲洗3次,石蜡包埋后切10 μm厚的切片。石蜡切片依次使用脱蜡液(20 min)、无水乙醇(5 min)、75%酒精(5 min)脱蜡,自来水洗。切片入苏木素染液染色3 min,伊红染液染色15 s后脱水封片,显微镜放大100倍观察。
1.2.4 表面色度测定
猪肝色度的测定采用CIE-L*a*b*法。使用便携式色差仪直接测定解冻后的猪肝表面的亮度L*、红度a*、黄度b*,不同猪肝样品测量部位基本一致。色度计在使用前预热半小时并用白板进行校准。
1.2.5 TVB-N值测定
参照国标GB 5009.228-2016《食品安全国家标准 食品中挥发性盐基氮的测定》[19]测定猪肝的TVB-N值。取解冻后的猪肝,绞碎搅匀。按照半微量定氮法进行加样、蒸馏、滴定等过程。使用甲基红乙醇溶液与溴甲酚绿乙醇溶液按照体积为1:5混合制成指示剂,滴定终点颜色为紫红色。
1.2.6 TBARs值测定
参照国标GB 5009.181-2016《食品安全国家标准 食品中丙二醛的测定》[20]测定猪肝的TBARs值。取解冻后的猪肝绞碎,参照分光光度法进行混合、均质、加硫代巴比妥酸水溶液反应等过程。于532 nm处测定吸光度值。
1.2.7 肌原纤维蛋白的提取
猪肝肌原纤维蛋白的提取参照FAN等[21]的方法并稍作修改。取10.0 g猪肝,破碎后加入4倍体积的低盐磷酸盐缓冲液(0.05 mol/L NaCl,3.38 mmol/L NaH2PO4,15.5 mmol/L Na2HPO4,pH7.5)溶解,均质(9000 r/min,1 min),4 ℃静置15 min,离心(10000 r/min,10 min,4 ℃),重复3次取沉淀。沉淀用4倍体积高盐缓冲液溶解(0.45 mol/L NaCl,3.38 mmol/L NaH2PO4,15.5 mmol/L Na2HPO4,pH7.5),均质(9000 r/min,1 min),4 ℃静置22 h,离心(12000 r/min,10 min),取上清液用10倍体积冷凝水沉淀30 min,离心(10000 r/min,10 min),沉淀用溶解液(0.6 mol/L NaCl,0.02 mol/L Tris-HCl,pH7.5)溶解即得肌原纤维蛋白溶液。
1.2.8 羰基含量的测定
猪肝羰基含量的测定参照陈晓楠等[22]的方法并稍作修改。取2.0 mL用Tris-HCl缓冲溶液(6 mol KCl-20 mmol Tris-HCl,pH7)稀释至浓度为0.50 mg/mL的肌原纤维蛋白溶液,加入1.0 mL DNPH(10 mmol/L,溶于2 mol/L盐酸),对照组加入1.0 mL盐酸(2 mol/L),避光反应1 h,每隔10 min涡旋一次。加入1.0 mL 20% TCA溶液,5000 r/min离心10 min。将沉淀用1.0 mL乙醇-乙酸乙酯(1:1,v/v)充分洗涤3次,除去DNPH。加入4.0 mL盐酸胍溶液(6 mol/L),在37 ℃水浴中溶解沉淀20 min,10000 r/min离心5 min,取上清液,测定370 nm处的吸光值。按式(1)计算羰基含量。
X(nmol/mg)=A−A0b×ε×C (1) 式中:X为羰基含量,nmol/mg;A为实验组在370 nm处的吸光值;A0为对照组在370 nm处的吸光值;C为蛋白质浓度,mg/mL;b为比色皿光径,cm;ε为摩尔消光系数,22000 L/(mol·cm)。
1.2.9 巯基及二硫键含量的测定
猪肝巯基及二硫键含量的测定参考GAO等[23]的方法并稍作修改。称取2.0 g解冻后的猪肝绞碎,溶于20 mL的Tris-甘氨酸缓冲液1中(pH8.0,含0.086 mol/L Tris,0.09 mol/L甘氨酸,0.004 mol/L EDTA及8 mol/L尿素),均质(8000 r/min,1 min),离心(12000 r/min,4 ℃,10 min),取上清液用Lowry法测其蛋白浓度,并备用。
SHF(游离巯基)含量的测定:取4 mL上清液,加入200 μL Ellman试剂(DTNB溶于缓冲液1中,4.0 mg/mL DTNB),在室温下反应1 h,在412 nm下测其吸光度值。
SHT(总巯基)含量的测定:取2 mL上清液,加入8 mL Tris-甘氨酸缓冲液2(pH8.0,20 mmol/L Tris,0.09 mol/L Gly,15 mg/mL β-巯基乙醇,8 mol/L尿素和5 mol/L盐酸胍)中,置于40 ℃水浴1 h,10 mL 12% TCA沉淀蛋白1 h,离心(4 ℃,4000 r/min,10 min),收集沉淀并重复用12% TCA漂洗三次,最终沉淀用20 mL Tris-甘氨酸缓冲液1溶解,均质,离心,取得上清液。最后取4 mL上清液,加入200 μL Ellman试剂,在室温下反应1 h,置于412 nm下测其吸光度值。
SHF、SHT含量按式(2)计算,S-S含量按式(3)计算:
SH(μmol/g)=106×A412×n13600×C (2) S-S(μmol/g)=(SHT−SHF)2 (3) 式中:C为蛋白浓度,mg/mL;A412即为412 nm处的吸光值;n为稀释倍数;13600 L/(mol·cm)是摩尔消光系数。
1.2.10 表面疏水性的测定
肌原纤维蛋白表面疏水性的测定参照YONGSAWATDIGUL等[24]的方法并稍作修改。使用0.6 mol/L NaCl Tris-HCl缓冲液(pH7.5)将蛋白质溶液分别稀释至0、0.05、0.1、0.15、0.2 mg/mL,并将4 mL稀释后的蛋白溶液与20 μL ANS混合,同时制备4 mL不含ANS的各浓度蛋白溶液,4 ℃静置10 min后测量荧光强度。将激发和发射狭缝分别设置为5 nm、激发波长设置为390 nm、发射波长设置为470 nm。表面疏水性以荧光值-蛋白浓度曲线的斜率来表示。
1.3 数据处理
所有实验均重复三次,实验结果用Origin、SPSS等软件对数据进行分析处理,结果用平均值±标准差(SD)表示。方差分析采用(Analysis of variance,ANOVA)过程,显著性分析采用Duncan’s检验,其中P<0.05判定为差异显著。
2. 结果与分析
2.1 冻结过程中心温度变化
通过冻结曲线的测定可以观察猪肝通过最大冰晶生成带的过程,比较不同冻结方式的猪肝中心温度通过最大冰晶生成带的时间,能够反映冻结过程对猪肝细胞的破坏程度[25]。猪肝的冻结曲线如图1所示。猪肝的最大冰晶生成带温度范围为−1 ℃至−5 ℃,CAF、RCF和LNF通过最大冰晶生成带的时间分别为4930、1400和40 s。同时,中心温度的变化速率能够反映冻结速率,因此LNF和RCF组的冻结速率明显高于CAF组,其中LNF冻结速率最高。在冻结过程中,冻结速率与冰晶的成核和生长密切相关。BELLO等[26]研究表明,快速冻结产生的较小冰晶,可以均匀分布在组织中并对组织造成较低的损伤。因此,与CAF相比,LNF和RCF能够通过提高冻结速率来降低在冻结过程中对猪肝品质的损害。
2.2 猪肝冰晶微观结构的变化
冻藏各个时期猪肝细胞组织中冰晶的显微结构如图2所示。图中紫红色区域为猪肝细胞组织,而白色区域代表冰晶。3组样品猪肝中的冰晶随冻藏时间延长不断增大,在冻藏初期,CAF组冰晶面积最大,并且随着冻藏时间延长,冰晶逐渐生长为叶形,大量挤占猪肝细胞组织空间。而LNF组冰晶最为细小、分布均匀,且其冰晶形态在冻藏期间保持最好。在冷冻储存期间冰晶的演变也是至关重要的[27]。储存过程中冰晶生长的原因可能是温度波动,温度梯度导致表层的小冰晶轻微融化,随后水分扩散至内部的冰晶,使冰晶变大;或者在恒定温度下,水蒸气会从高压区域转移到低压区域,从而导致冷冻储存期间的重结晶[28]。冻藏过程中形成的大冰晶会引起细胞内外电解质浓度的增加,并穿透细胞膜,造成细胞质构的严重破坏[29]。而快速冷冻可以产生较小且均匀的冰晶,同时在贮藏过程中保持较为稳定的形态,以保持冷冻食品的品质。因此,使用液氮冻结提高冻结速率能够在一定程度上排除冰晶对冻藏猪肝品质的影响。YANG等[30]研究冻结方式对东方鲀鱼片冰晶微观结构的影响发现,冻结速率越高冰晶越细小均匀,本文实验结果与文献结论一致。
2.3 猪肝表面色度的变化
色泽是决定猪肝品质的主要因素之一,与鲜度密切相关[31]。冻藏过程中猪肝的表面色度参数如表1所示。随着冻藏时间的延长,CAF组样品的L*值呈现波动下降的趋势,而RCF和LNF组L*值在冻藏初期出现小幅度下降,但整体无明显变化规律。各组样品的红度a*、黄度b*值整体呈现上升趋势。在贮藏过程中,猪肝L*值的下降可能是由于失水和色素浓缩而逐渐失去光泽所导致[32]。a*值的升高可能是由于猪肝中存在大量血红蛋白,血红蛋白中的二价铁与氧气结合,使猪肝表面由淡紫红色转为深红色;而b*值的升高则可能与猪肝中的脂肪氧化有关,脂肪的氧化使其表面呈现出黄褐色。CAF组样品的a*值和b*值升高幅度最大,表明较低的冻结速率导致冰晶增长破坏猪肝细胞结构,从而加速猪肝中色素的浓缩以及猪肝的褐变。
表 1 冻结方式对猪肝表面色度的影响Table 1. Effect of freezing methods on the surface color of porcine liver冻藏时间(d) 冻结方式 测试指标 L* a* b* 0 CAF 33.41±0.87a 6.39±0.38a 2.79±0.30a RCF 33.41±0.87a 6.39±0.38a 2.79±0.30a LNF 33.41±0.87a 6.39±0.38a 2.79±0.30a 30 CAF 30.71±1.57a 7.44±0.33b 2.99±0.22c RCF 32.52±1.74b 5.38±0.34a 1.60±0.28a LNF 32.08±1.03b 7.49±0.69b 2.72±0.42b 60 CAF 33.45±0.88a 8.65±0.23c 3.45±0.54c RCF 37.13±1.21c 6.57±0.70a 1.50±0.16a LNF 34.55±0.80b 7.10±0.66b 1.93±0.27b 90 CAF 33.70±0.51b 9.99±0.95c 4.64±0.86c RCF 32.06±0.89a 6.13±0.59a 2.58±0.24a LNF 34.89±0.61c 7.37±0.35b 2.93±0.69b 120 CAF 32.76±0.98a 7.98±0.45a 4.94±0.25c RCF 35.43±0.53b 9.63±0.37b 4.44±0.49b LNF 35.64±0.64b 7.96±0.47a 3.05±0.58a 150 CAF 33.44±1.01c 9.98±0.76c 5.98±0.75b RCF 31.31±0.79a 7.99±0.43a 3.87±0.88a LNF 32.03±0.98b 8.02±0.21b 3.85±0.17a 180 CAF 31.58±1.23a 10.91±0.40b 6.14±0.55c RCF 33.41±1.03b 8.42±0.42a 4.32±0.68b LNF 34.12±1.01c 8.16±0.23a 3.99±0.16a 注:同列不同字母表示同一贮藏时间下组间有显著差异(P<0.05)。 2.4 猪肝TVB-N和TBARs值的变化
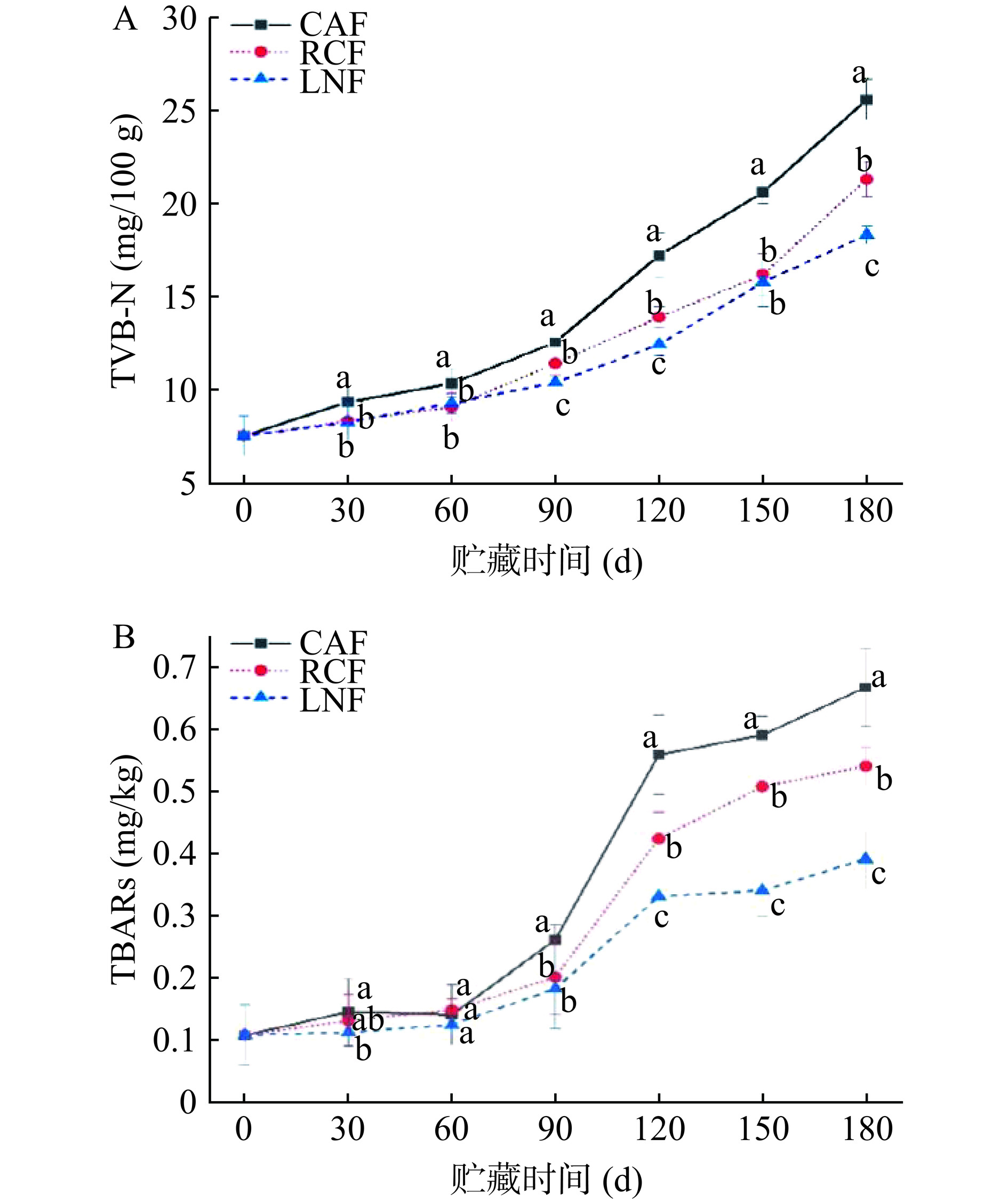
TVB-N值反映了肉制品中蛋白质被微生物和内源酶降解,分解产生氨及胺类等物质的含量,是评价肉制品腐败的常用指标[33],GB 2707-2016《食品安全国家标准 鲜(冻)畜、禽产品》规定冷冻猪肝的TVB-N值不能超过15 mg/100 g[34]。冻结方式对冻藏猪肝TVB-N值的影响如图3A所示。由图可以看出,各组猪肝的TVB-N值随着冻藏时间的延长呈增大趋势,其中CAF组在冻藏第120 d时超过国家标准限量值。冻藏至第180 d时,CAF、RCF和LNF组样品的TVB-N值分别升高至初始水平的3.41、2.84和2.44倍。冻藏期间,RCF和LNF组猪肝的TVB-N值始终显著小于CAF组(P<0.05),在冻藏150 d后超过国家标准限值。冻藏180 d后LNF组的TVB-N值最小,这说明随着冻结速率的提升,TVB-N值显著减小(P<0.05)。这可能是由于较低的冻结温度使更多不耐低温的微生物失活甚至死亡,同时较高的冻结速率形成的冰晶较小,减轻了对猪肝组织的破坏,减少了内源蛋白酶的流出以及蛋白质被分解形成的非蛋白氮[17]。结果表明使用LNF提高冻结速率,能够抑制猪肝在冻藏过程中的腐败。
虽然冻藏过程中生化反应大大减缓,但在冻藏条件下仍会发生氧化反应,导致猪肝品质劣变。TBARs值是评价脂质氧化的重要指标[35],如图3B所示,所有猪肝在第0 d的TBARs值约为0.11 mg/kg,在整个冻藏期间三组样品的TBARs值以不同的速率持续增加,这也解释了猪肝表面黄度值升高的原因。CAF、RCF和LNF组冻藏至第180 d时TBARs值分别升高至第0 d的6.09、4.91和3.90倍。此外,LNF组的TBARs值在冻藏第120~180 d时显著低于CAF和RCF组(P<0.05)。慢速冻结产生的大冰晶破坏猪肝细胞完整性,导致肌红蛋白的泄漏以及脂肪酶、蛋白酶和核酸酶的释放,最终加速脂质氧化并诱导丙二醛的增加[7]。因此,LNF能够抑制猪肝TBARs值的升高,延缓猪肝冻藏过程中的脂肪氧化,是由于细小冰晶对猪肝细胞微观结构的破坏较小。TUELL等[36]研究发现,快速冷冻可以延迟脂质氧化过程,本文实验结果与文献结论一致。
2.5 猪肝蛋白质羰基含量的变化
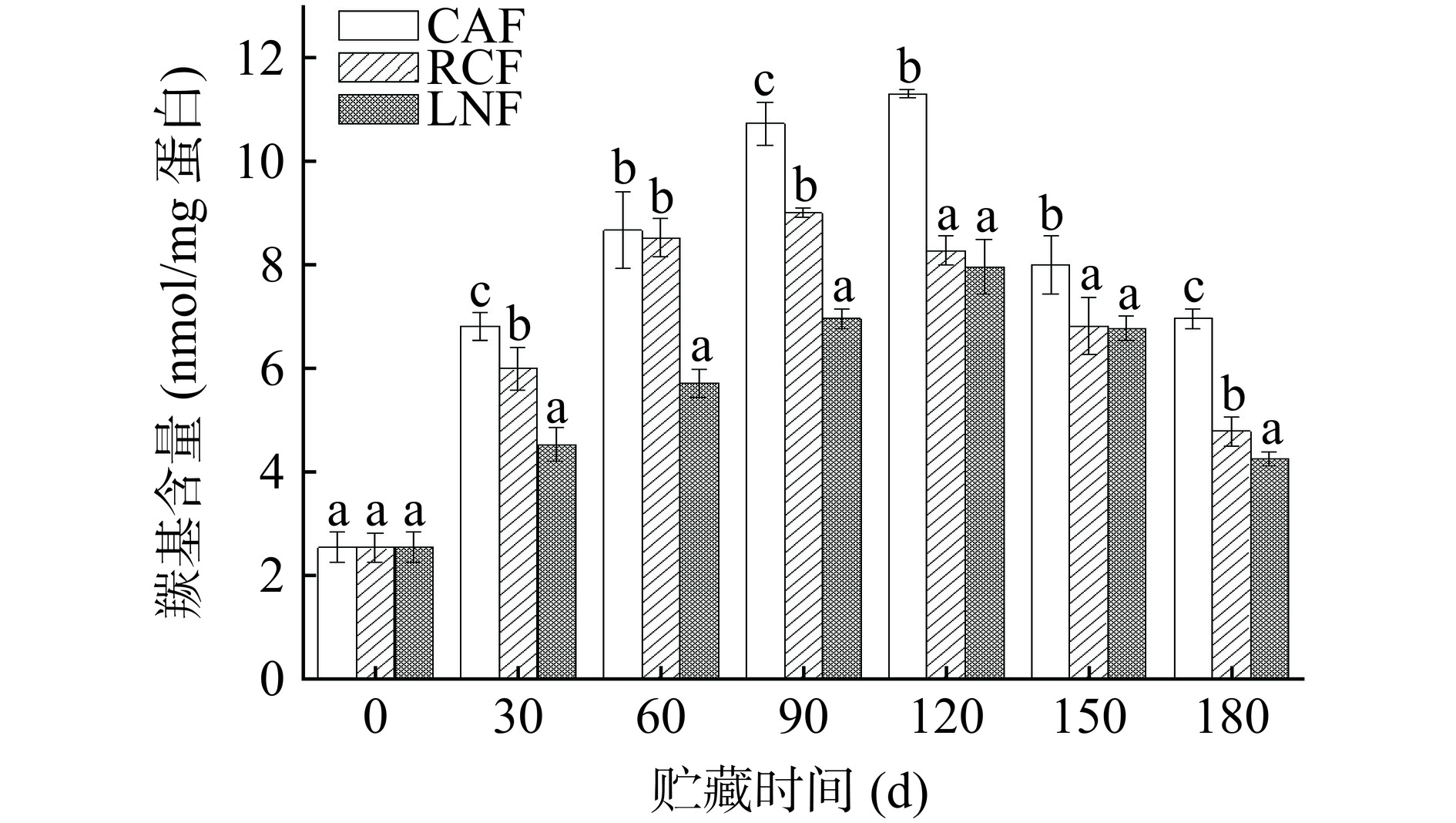
蛋白质氧化可导致主链断裂,形成交联,并将一些氨基酸残基转化为羰基衍生物[37]。羰基化合物的含量是判断肉类蛋白质氧化程度的重要指标之一,其含量变化通常可以用于表示蛋白质的氧化速率[38]。如图4所示,与冻藏初期相比,各组冻结处理的猪肝蛋白羰基含量在贮藏期间呈现升高趋势。羰基含量的初始值为2.55 nmol/mg蛋白,贮藏至180 d时,三组的羰基含量在4.26~6.97 nmol/mg蛋白之间,CAF、RCF和LNF组蛋白质羰基含量分别是初始水平的2.73、1.88和1.67倍,冻结速率越高,羰基含量的增加速度越慢。这些结果与脂质氧化的结果一致,脂质氧化产生过氧自由基,能够促进蛋白质氧化;同时,冷冻贮藏期间脂质氧化产生的丙二醛与蛋白质衍生物反应也会使蛋白质氧化程度升高[32]。ZHU等[39]研究冻结方法及时间对猪背最长肌蛋白的影响发现,快速冻结抑制羰基含量的上升。结果表明,冻结速率的提高能够有效抑制猪肝中的肌原纤维蛋白在贮藏过程中的氧化。
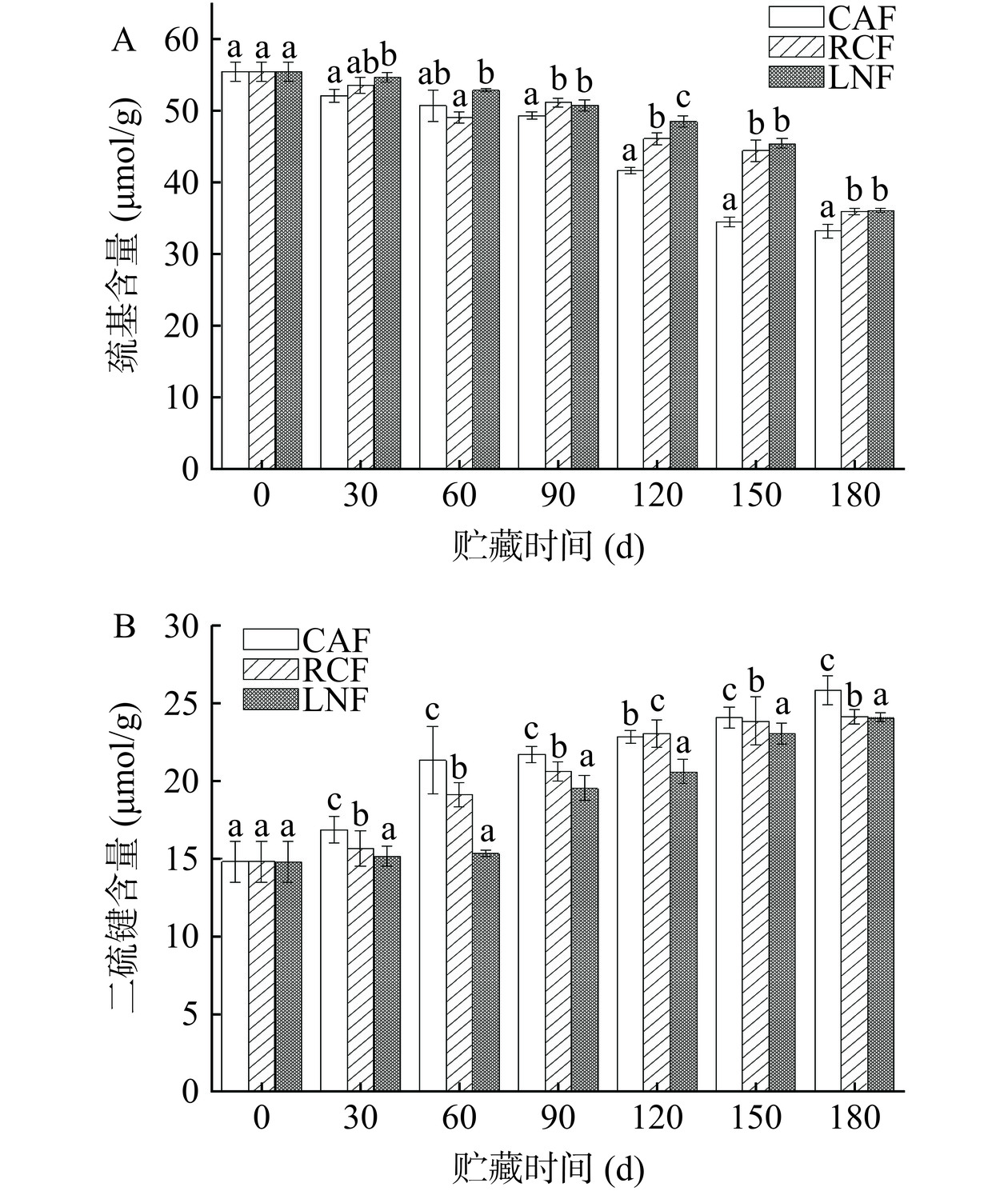
2.6 猪肝蛋白质巯基和二硫键含量的变化
肌原纤维蛋白的巯基易被氧化,在冻藏期间产生二硫键、磺酸和其他氧化产物[40−41]。蛋白质氧化可以通过巯基的损失来反映,随着巯基氧化的进行,二硫键作为氧化产物其含量会随着巯基的减少而逐渐增加[42]。图5显示了各组中总巯基和二硫键的变化。如图5A所示,随着贮藏时间的延长,各处理组中总巯基含量整体呈现下降趋势。这与HE等[43]对于冻藏石斑鱼的研究发现的趋势相似。CAF组巯基含量在贮藏第150 d降至34.48 μmol/g,显著低于RCF组和LNF组(P<0.05)。表明冻结速率的升高能够抑制蛋白质巯基的损失。
如图5B所示,各组中猪肝的二硫键含量随着贮藏时间的延长逐渐增加,这与总巯基含量的变化趋势基本相反。贮藏至180 d时,CAF、RCF和LNF组二硫键含量分别比初始水平升高了74.3%、62.8%和62.5%,CAF组二硫键含量显著高于RCF和LNF组(P<0.05)。这是由于较低的冻结速率形成的冰晶较大,对猪肝细胞微观结构的破坏较为严重,使巯基接触到更多的活性氧,从而促进了巯基向二硫键的转化。这与蛋白质羰基含量的结果类似,表明较高的冻结速率能够使猪肝组织维持较好的微观结构,从而延缓其蛋白质巯基的氧化,有利于猪肝保持较高的品质。
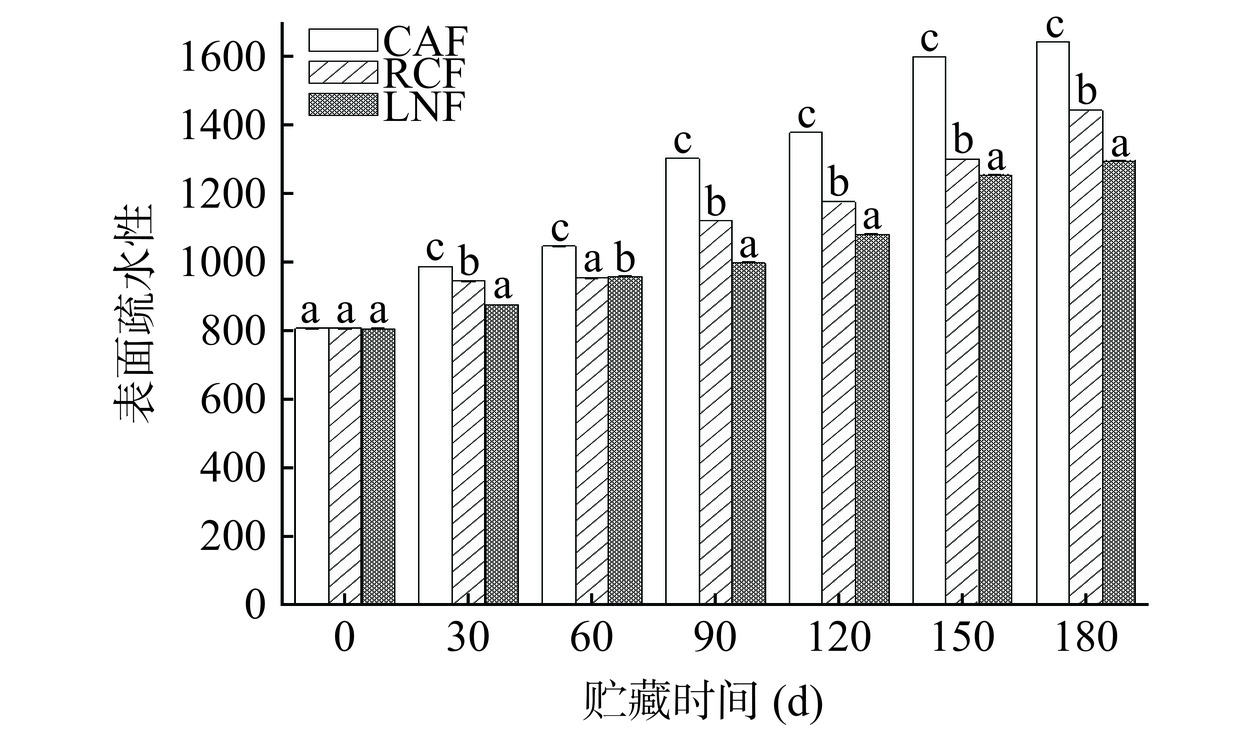
2.7 猪肝蛋白质表面疏水性的变化
表面疏水性的大小与疏水性基团的暴露程度有关。在蛋白质氧化过程中,表面和内部的氨基酸残基被氧化,造成蛋白质结构的改变,使原本包裹在蛋白质内部的疏水基团暴露出来,从而使表面疏水性升高[44]。冻结方式对猪肝肌原纤维蛋白表面疏水性的影响如图6所示,随着贮藏时间的延长,各组样品的表面疏水性均呈逐渐升高的趋势,冻藏至180 d时,CAF、RCF和LNF组表面疏水性分别比初始水平升高了78.7%、66.2%和60.7%。其中CAF组的表面疏水性在整个冻藏期间始终最大,而冻藏第90~180 d时LNF组最小。冻结速率的提高延缓了蛋白质表面疏水性的升高,这可能是非极性氨基酸分子进入疏水簇这一过程被抑制,减少了表面疏水基团的暴露[45]。结果表明,RCF和LNF显著延缓了猪肝中蛋白质的氧化和变性(P<0.05),更好地维持了蛋白质的构象。ZHANG等[46]研究冻融猪里脊肉中蛋白质表面疏水性的变化得到了类似结论。
3. 结论
使用深冷冻结和液氮冻结能够显著提高猪肝的冻结速率,减小冻结过程中生成冰晶的体积、使冰晶分布更加均匀。同时,深冷冻结和液氮冻结抑制了冻藏过程中猪肝TVB-N和TBARs值的上升,以及猪肝色泽的劣变。其中液氮冻结组冻藏后期TVB-N和TBARs值最低,有效延缓了猪肝冻藏过程中鲜度品质的下降。此外,液氮冻结通过提高冻结速率,显著抑制了蛋白质羰基含量、二硫键含量及表面疏水性的上升,能够有效抑制猪肝冻藏过程中理化特性的劣变及蛋白质的氧化。本文为优化猪肝冷冻工艺、提高冻藏品质提供了新的依据,后期研究可以通过优化液氮冻结工艺降低成本,探索更加适合规模化生产的冻结方式,以将其应用于猪肝冷冻加工。
-
表 1 冻结方式对猪肝表面色度的影响
Table 1 Effect of freezing methods on the surface color of porcine liver
冻藏时间(d) 冻结方式 测试指标 L* a* b* 0 CAF 33.41±0.87a 6.39±0.38a 2.79±0.30a RCF 33.41±0.87a 6.39±0.38a 2.79±0.30a LNF 33.41±0.87a 6.39±0.38a 2.79±0.30a 30 CAF 30.71±1.57a 7.44±0.33b 2.99±0.22c RCF 32.52±1.74b 5.38±0.34a 1.60±0.28a LNF 32.08±1.03b 7.49±0.69b 2.72±0.42b 60 CAF 33.45±0.88a 8.65±0.23c 3.45±0.54c RCF 37.13±1.21c 6.57±0.70a 1.50±0.16a LNF 34.55±0.80b 7.10±0.66b 1.93±0.27b 90 CAF 33.70±0.51b 9.99±0.95c 4.64±0.86c RCF 32.06±0.89a 6.13±0.59a 2.58±0.24a LNF 34.89±0.61c 7.37±0.35b 2.93±0.69b 120 CAF 32.76±0.98a 7.98±0.45a 4.94±0.25c RCF 35.43±0.53b 9.63±0.37b 4.44±0.49b LNF 35.64±0.64b 7.96±0.47a 3.05±0.58a 150 CAF 33.44±1.01c 9.98±0.76c 5.98±0.75b RCF 31.31±0.79a 7.99±0.43a 3.87±0.88a LNF 32.03±0.98b 8.02±0.21b 3.85±0.17a 180 CAF 31.58±1.23a 10.91±0.40b 6.14±0.55c RCF 33.41±1.03b 8.42±0.42a 4.32±0.68b LNF 34.12±1.01c 8.16±0.23a 3.99±0.16a 注:同列不同字母表示同一贮藏时间下组间有显著差异(P<0.05)。 -
[1] 王者悦. 中国药膳大辞典[M]. 大连:大连出版社, 2002. [WANG Z Y. Chinese medicated diet dictionary[M]. Dalian:Dalian Publishing House, 2002.] WANG Z Y. Chinese medicated diet dictionary[M]. Dalian: Dalian Publishing House, 2002.
[2] 潘冬梅, 汪丽娟, 张献领. 不同烹饪方法对猪肝品质的影响研究[J]. 兰州文理学院学报:自然科学版,2020,34(3):39−42. [PAN D M, WANG L J, ZHANG X L. Study on the effect of different cooking methods on the quality of pig liver[J]. Journal of Lanzhou University of Arts and Science (Natural Sciences),2020,34(3):39−42.] PAN D M, WANG L J, ZHANG X L. Study on the effect of different cooking methods on the quality of pig liver[J]. Journal of Lanzhou University of Arts and Science (Natural Sciences), 2020, 34(3): 39−42.
[3] 倪来学, 王伟, 石念荣. 一种猪肝香肠的加工工艺研究[J]. 肉类工业,2020(5):13−16. [NI L X, WANG W, SHI N R. Study on processing technology of a kind of sausage withpig liver[J]. Meat Industry,2020(5):13−16.] NI L X, WANG W, SHI N R. Study on processing technology of a kind of sausage withpig liver[J]. Meat Industry, 2020(5): 13−16.
[4] 戚彪, 曲超, 成晓瑜, 等. 微波杀菌对卤猪肝品质特性的影响[J]. 食品科学,2013,34(1):69−72. [WEI B, QU C, CHENG X Y, et al. Effect of microwave sterilization on quality properties of stewed pork liver[J]. Food Science,2013,34(1):69−72.] WEI B, QU C, CHENG X Y, et al. Effect of microwave sterilization on quality properties of stewed pork liver[J]. Food Science, 2013, 34(1): 69−72.
[5] CHENG S, WANG X, LI R, et al. Influence of multiple freeze-thaw cycles on quality characteristics of beef semimembranous muscle:With emphasis on water status and distribution by LF-NMR and MRI[J]. Meat Science,2019,147:44−52. doi: 10.1016/j.meatsci.2018.08.020
[6] HU R, ZHANG M, MUJUMDAR A S. Application of infrared and microwave heating prior to freezing of pork:Effect on frozen meat quality[J]. Meat Science,2022,189:108811. doi: 10.1016/j.meatsci.2022.108811
[7] LI F, ZHONG Q, KONG B, et al. Deterioration in quality of quick-frozen pork patties induced by changes in protein structure and lipid and protein oxidation during frozen storage[J]. Food Research International,2020,133:109142. doi: 10.1016/j.foodres.2020.109142
[8] 储渊明, 谢晶. 水产品冻藏品质变化及镀冰衣技术的研究进展[J]. 包装工程,2020,41(17):31−37. [ZHU Y M, XIE J. Research progress on quality change of frozen storage of aquatic products and application of glazing technology[J]. Packing Engineering,2020,41(17):31−37.] ZHU Y M, XIE J. Research progress on quality change of frozen storage of aquatic products and application of glazing technology[J]. Packing Engineering, 2020, 41(17): 31−37.
[9] LI D M, ZHU Z W, SUN D W. Effects of high-pressure freezing and deep-frozen storage on cell structure and quality of cordyceps sinensis[J]. LWT-Food Science and Technology,2023,175:114044. doi: 10.1016/j.lwt.2022.114044
[10] TEUTEBERG V, KLUTH I-K, PLOETZ M, et al. Effects of duration and temperature of frozen storage on the quality and food safety characteristics of pork after thawing and after storage under modified atmosphere[J]. Meat Science,2021,174:108419. doi: 10.1016/j.meatsci.2020.108419
[11] 鲁珺, 余海霞, 杨水兵, 等. 液氮速冻对银鲳鱼品质及微观结构的影响[J]. 现代食品科技,2015(4):210−216,94. [LU J, YU H X, YANG S B, et al. Effects of cryogenic freezing by liquid nitrogen on the quality and microstructure of silver pomfret (Pampus argenteus)[J]. Modern Food Science and Technology,2015(4):210−216,94.] LU J, YU H X, YANG S B, et al. Effects of cryogenic freezing by liquid nitrogen on the quality and microstructure of silver pomfret (Pampus argenteus)[J]. Modern Food Science and Technology, 2015(4): 210−216,94.
[12] 宋敏, 许艳顺, 夏文水, 等. 冻结方式对鮰鱼片品质的影响[J]. 食品科技,2017,42(8):154−159. [SONG M, XU Y S, XIA W S, et al. Effects of different freezing methods on the quality of channel catfish fillets[J]. Food Science and Technology,2017,42(8):154−159.] SONG M, XU Y S, XIA W S, et al. Effects of different freezing methods on the quality of channel catfish fillets[J]. Food Science and Technology, 2017, 42(8): 154−159.
[13] LUO X, LI J, YAN W, et al. Physicochemical changes of MTGase cross-linked surimi gels subjected to liquid nitrogen spray freezing[J]. International Journal of Biological Macromolecules,2020,160:642−651. doi: 10.1016/j.ijbiomac.2020.05.249
[14] YU L, JIANG Q, YU D, et al. Quality of giant freshwater prawn (Macrobrachium rosenbergii) during the storage at −18 ℃ as affected by different methods of freezing[J]. International Journal of Food Properties,2018,21(1):2100−2109. doi: 10.1080/10942912.2018.1484760
[15] GONCALVES A A, RIBEIRO J L D. Optimization of the freezing process of red shrimp (Pleoticus muelleri) previously treated with phosphates[J]. International Journal of refrigeration,2008,31(7):1134−1144. doi: 10.1016/j.ijrefrig.2008.03.005
[16] GONCALVESO A A, RIBEIRO J L D. Effects of phosphate treatment on quality of red shrimp (Pleoticus muelleri ) processed with cryomechanical freezing[J]. LWT-Food Science and Technology,2009,42(8):1435−1438. doi: 10.1016/j.lwt.2009.03.016
[17] 栾兰兰. 冷冻带鱼冰晶生长预测模型及分形维数品质评价体系的建立[D]. 杭州:浙江大学, 2018. [LUAN L L. Estabilshment of prediction model for ice crvstal growth and quality evaluation system based on fractal dimension of frozen hairtails (Trichiurus haumela)[D]. Hangzhou:Zhejiang University, 2018.] LUAN L L. Estabilshment of prediction model for ice crvstal growth and quality evaluation system based on fractal dimension of frozen hairtails (Trichiurus haumela)[D]. Hangzhou: Zhejiang University, 2018.
[18] ALIZADEH E, CHAPLEAU N, DE LAMBALLERIE M, et al. Effect of different freezing processes on the microstructure of atlantic salmon (Salmo salar) fillets[J]. Innovative Food Science and Emerging Technologies,2007,8(4):493−499. doi: 10.1016/j.ifset.2006.12.003
[19] 中华人民共和国国家卫生和计划生育委员会. GB 5009.228-2016 食品安全国家标准 食品中挥发性盐基氮的测定[S]. 北京:中国标准出版社, 2016. [National Health and Family Planning Commission of the People's Republic of China. GB 5009.228-2016 National food safety standard Determination of total volatile base nitrogen in foods[S]. Beijing:Standards Press of China, 2016.] National Health and Family Planning Commission of the People's Republic of China. GB 5009.228-2016 National food safety standard Determination of total volatile base nitrogen in foods[S]. Beijing: Standards Press of China, 2016.
[20] 中华人民共和国国家卫生和计划生育委员会. GB 5009.181-2016 食品安全国家标准 食品中丙二醛的测定[S]. 北京:中国标准出版社, 2016. [National Health and Family Planning Commission of the People's Republic of China. GB 5009.181-2016 National food safety standard Determination of malondialdehyde in foods[S]. Beijing:Standards Press of China, 2016.] National Health and Family Planning Commission of the People's Republic of China. GB 5009.181-2016 National food safety standard Determination of malondialdehyde in foods[S]. Beijing: Standards Press of China, 2016.
[21] FAN M, HU T, ZHAO S, et al. Gel characteristics and microstructure of fish myofibrillar protein/cassava starch composites[J]. Food Chemistry,2017,218:221−230. doi: 10.1016/j.foodchem.2016.09.068
[22] 陈晓楠, 赵金丽, 张宾, 等. 低温冻藏过程中鲐鱼肌肉蛋白质氧化特性研究[J]. 包装工程,2020,41(17):38−45. [CHEN X N, ZHAO J L, ZHANG B, et al. Oxidation of muscle protein in mackerel during cryopreservation[J]. Packing Engineering,2020,41(17):38−45.] CHEN X N, ZHAO J L, ZHANG B, et al. Oxidation of muscle protein in mackerel during cryopreservation[J]. Packing Engineering, 2020, 41(17): 38−45.
[23] GAO Z, SHEN P, LAN Y, et al. Effect of alkaline extraction pH on structure properties, solubility, and beany flavor of yellow pea protein isolate[J]. Food Research International,2020,131:109045. doi: 10.1016/j.foodres.2020.109045
[24] YONGSAWATDIGUL J, SINSUWAN S. Aggregation and conformational changes of tilapia actomyosin as affected by calcium ion during setting[J]. Food Hydrocolloids,2007,21(3):359−367. doi: 10.1016/j.foodhyd.2006.04.006
[25] ZHANG Y, MAGRO A, PUOLANNE E, et al. Myofibrillar protein characteristics of fast or slow frozen pork during subsequent storage at -3 ℃[J]. Meat Science,2021,176:108468. doi: 10.1016/j.meatsci.2021.108468
[26] BELLO R A, LUFT J H, PIGOTT G M. Ultrastructural study of skeletal fish muscle after freezing at different rates[J]. Journal of Food Science,1982,47(5):1389−1394. doi: 10.1111/j.1365-2621.1982.tb04945.x
[27] CHENG L, SUN D W, ZHU Z, et al. Emerging techniques for assisting and accelerating food freezing processes:A review of recent research progresses[J]. Critical Reviews in Food Science and Nutrition,2017,57(4):769−781. doi: 10.1080/10408398.2015.1004569
[28] KAALE L D, EIKEVILK T M, BARDAL T, et al. The effect of cooling rates on the ice crystal growth in air-packed salmon fillets during superchilling and superchilled storage[J]. International Journal of Refrigeration,2013,36(1):110−119. doi: 10.1016/j.ijrefrig.2012.09.006
[29] YANG F, JING D, YU D, et al. Differential roles of ice crystal, endogenous proteolytic activities and oxidation in softening of obscure pufferfish (Takifugu obscurus) fillets during frozen storage[J]. Food Chemistry,2019,278:452−459. doi: 10.1016/j.foodchem.2018.11.084
[30] YANG F, JING D, DIAO Y, et al. Effect of immersion freezing with edible solution on freezing efficiency and physical properties of obscure pufferfish (Takifugu obscurus) fillets[J]. LWT-Food Science and Technology,2020,118:108762. doi: 10.1016/j.lwt.2019.108762
[31] WACHIRASIRI K, WANLAPA S, UTTAPAP D, et al. Changing in processing yield and physical properties of frozen white shrimp (Penaeus vannamei) treated with lysine and sodium bicarbonate[J]. International Journal of Food Science and Technology,2017,52(3):763−771. doi: 10.1111/ijfs.13333
[32] ZHU L, BREWER M. Discoloration of fresh pork as related to muscle and display conditions[J]. Journal of Food Science,1998,63(5):763−767. doi: 10.1111/j.1365-2621.1998.tb17895.x
[33] GUO Z, GE X, YU Q L, et al. Quality predictive models for bovine liver during storage and changes in volatile flavors[J]. International Journal of Food Properties,2018,21(1):2452−2468. doi: 10.1080/10942912.2018.1522330
[34] 中华人民共和国国家卫生和计划生育委员会. GB 2707-2016 食品安全国家标准 鲜(冻)畜、禽产品[S]. 北京:中国标准出版社, 2016. [National Health and Family Planning Commission of the People's Republic of China. GB 2707-2016 National food safety standard Fresh (frozen) livestock and poultry products[S]. Beijing:Standards Press of China, 2016.] National Health and Family Planning Commission of the People's Republic of China. GB 2707-2016 National food safety standard Fresh (frozen) livestock and poultry products[S]. Beijing: Standards Press of China, 2016.
[35] WANG Z, HE Z, ZHANG D, et al. Effect of multiple freeze-thaw cycles on protein and lipid oxidation in rabbit meat[J]. International Journal of Food Science and Technology,2021,56(6):3004−3015.
[36] TUELL J R, SEO J K, KIM Y H B. Combined impacts of initial freezing rate of pork leg muscles (M. biceps femoris and M. semitendinosus) and subsequent freezing on quality characteristics of pork patties[J]. Meat Science,2020,170:108248. doi: 10.1016/j.meatsci.2020.108248
[37] YU D, REGENSTEIN J M, ZANG J, et al. Inhibitory effects of chitosan-based coatings on endogenous enzyme activities, proteolytic degradation and texture softening of grass carp (Ctenopharyngodon idellus) fillets stored at 4 ℃[J]. Food Chemistry,2018,262:1−6. doi: 10.1016/j.foodchem.2018.04.070
[38] PENG Z, ZHU M, ZHANG J, et al. Physicochemical and structural changes in myofibrillar proteins from porcine longissimus dorsi subjected to microwave combined with air convection thawing treatment[J]. Food Chemistry,2021,343:128412. doi: 10.1016/j.foodchem.2020.128412
[39] ZHU M, ZHANG J, JIAO L, et al. Effects of freezing methods and frozen storage on physicochemical, oxidative properties and protein denaturation of porcine longissimus dorsi[J]. LWT-Food Science and Technology,2022,153:112529. doi: 10.1016/j.lwt.2021.112529
[40] BISWAS S, CHIDA A S, RAHMAN I. Redox modifications of protein–thiols:Emerging roles in cell signaling[J]. Biochemical Pharmacology,2006,71(5):551−564. doi: 10.1016/j.bcp.2005.10.044
[41] ZHU M M, PENG Z Y, LU S, et al. Physicochemical properties and protein denaturation of pork longissimus dorsi muscle subjected to six microwave-based thawing methods[J]. Foods,2019,9(1):26. doi: 10.3390/foods9010026
[42] SOYER A, ÖZALP B, DALMIS Ü, et al. Effects of freezing temperature and duration of frozen storage on lipid and protein oxidation in chicken meat[J]. Food Chemistry,2010,120(4):1025−1030. doi: 10.1016/j.foodchem.2009.11.042
[43] HE Y, HUANG H, LI L, et al. The effects of modified atmosphere packaging and enzyme inhibitors on protein oxidation of tilapia muscle during iced storage[J]. LWT-Food Science and Technology,2018,87:186−193. doi: 10.1016/j.lwt.2017.08.046
[44] ZHANG L, GUI P, ZHANG Y, et al. Assessment of structural, textural, and gelation properties of myofibrillar protein of silver carp (Hypophthalmichthys molitrix) modified by stunning and oxidative stress[J]. LWT-Food Science and Technology,2019,102:142−149. doi: 10.1016/j.lwt.2018.12.030
[45] 范丽丽, 窦博鑫, 张晓琳, 等. 大豆7S球蛋白的MTGase条件对其表面疏水性与功能特性, 溶液性质的影响及相关性分析[J]. 食品工业科技,2020,41(5):52−57. [FAN L L, DOU B X, ZHANG X L, et al. Effect of MTGase conditions on surface hydrophobicity, functional properties and solution properties of soybean 7S globulin and correlation analysis of its indexes[J]. Science and Technology of Food Industry,2020,41(5):52−57.] FAN L L, DOU B X, ZHANG X L, et al. Effect of MTGase conditions on surface hydrophobicity, functional properties and solution properties of soybean 7S globulin and correlation analysis of its indexes[J]. Science and Technology of Food Industry, 2020, 41(5): 52−57.
[46] ZHANG Y, PUOLANNE E, ERTBJERG P. Mimicking myofibrillar protein denaturation in frozen-thawed meat:Effect of pH at high ionic strength[J]. Food Chemistry,2021,338:128017. doi: 10.1016/j.foodchem.2020.128017





 下载:
下载:
 下载:
下载:



