Optimization of Enzymatic Hydrolysis Process, Structural Characterization and Antioxidant Activity Analysis of Gastrodia elata Polysaccharide
-
摘要: 多糖因其具有多种生物活性而备受关注,但天然多糖往往分子量较高,导致其低溶解率和生物利用率。本研究利用α-淀粉酶降解天麻多糖,以还原糖生成量为指标优化酶解工艺。在最佳酶解条件下酶解天麻多糖,并对酶解前后天麻多糖的溶解度、单糖组成、相对分子量、官能团、微观结构进行考察。此外,体外检测了酶解前后天麻多糖对ABTS+和DPPH自由基的清除能力。结果表明,最佳酶解工艺为:酶添加量460 U/g、酶解时间100 min、酶解温度60 ℃、酶解pH5.4,在最佳工艺下,天麻多糖酶解后的还原糖生成量为0.441 mg/mL。酶解后天麻多糖的溶解率从81.28%提高至93.57%,单糖组成和官能团结构没有明显变化,两个多糖组分的分子量都显著降低(P<0.05),天麻多糖的网状结构被破坏,变为片状结构。此外,酶处理后天麻多糖抗氧化活性得到显著提升(P<0.05)。该研究为α-淀粉酶降解天麻多糖提供一定的科学依据。Abstract: Polysaccharides are attracted much attention because of their diverse biological activities. However, natural polysaccharides tend to have high molecular weights, resulting in their low solubility and bioavailability. In this study, α-amylase was used to degrade polysaccharides derived from Gastrodia elata, and the enzymatic hydrolysis process was optimized based on the yield of reducing sugars. G. elata polysaccharides were prepared under the optimal conditions for enzymatic hydrolysis. Their dissolution rate, monosaccharide composition, relative molecular weight, functional groups, and microstructure were analyzed before and after enzymatic hydrolysis. In addition, the ABTS+ and DPPH free radical scavenging abilities in vitro were tested before and after enzymolysis. Results revealed that the optimal enzymolysis process was as follows: enzyme dosage, 460 U/g, enzymolysis time, 100 min, enzymolysis temperature, 60 ℃, enzymolysis pH, 5.4. Under these conditions, the yield of reducing sugars after enzymolysis was 0.441 mg/mL. After enzymatic hydrolysis, the dissolution rate of G. elata polysaccharides increased from 81.28% to 93.57%. The monosaccharide composition and functional group structure indicated no obvious changes, except that the molecular weights of the two polysaccharide components were substantially reduced (P<0.05), and the mesh structure of G. elata polysaccharides was destroyed and changed into sheet structure. In addition, the antioxidant activity of G. elata polysaccharides was considerably enhanced after enzymatic treatment (P<0.05). This study provides a scientific basis for the enzymatic degradation of G. elata polysaccharides.
-
天麻是兰科植物天麻(Gastrodia elata Bl.,G. elata)的干燥块茎,是一种中国传统名贵中药[1],近年来被划为药食两用植物,具有极大的市场价值。现代药理学研究表明,天麻具有抗惊厥[2]、改善记忆[3]、预防衰老[4]、神经保护[5]等作用。这与天麻中的主要活性物质天麻素、对羟基苯甲醇、巴利森苷和天麻多糖等有关[6]。其中,天麻多糖因其具有抗氧化、抗衰老、降血脂、抗肿瘤等作用而备受关注[7]。而多糖的活性与其分子量大小和单糖组成等密切相关[8−9]。而高分子量的多糖的分子量大、聚合度高且溶解性较差,从而限制其吸收、利用与生物活性[10]。降解可以降低多糖分子量和聚合度从而改善其溶解性和生物活性[9]。
多糖降解的方法主要分为物理、化学和生物降解法。物理方法多为超声波、微波、水热和电离辐射降解法,通常操作较为简单,降解效率也较高,但往往对设备要求较高[10]。而化学降解法主要包括酸降解法、碱降解法和氧化降解法,这些方法具有试剂廉价、操作简单、无辐射污染、降解效率较高等优点,但也存在引入重金属离子、污染环境等缺点[9]。生物降解法一般分为微生物和酶法降解,微生物降解法是利用微生物产生能水解多糖糖苷键的酶从而实现多糖降解[11],而酶法降解是利用酶水解多糖的糖苷键从而达到降解的目的[12]。生物降解法有着对环境友好、降解高效、专一性强的优点,尤其是酶法降解对多糖的降解高效且特异性较强,但酶法降解还需要对酶解条件进行控制以确保其能高效降解[10]。Wu等[12]采用纤维素酶降解黑木耳多糖,并通过响应面试验优化了酶解工艺,在最佳酶解工艺下,降解后黑木耳多糖的抗氧化活性提高。Hu等[13]利用半纤维素酶降解桑叶多糖,酶解后得到的桑叶低聚糖的抗氧化活性和益生元活性更高。Liu等[14]利用内切鼠李糖苷酶降解猴头菌多糖,发现酶解增强了多糖对巨噬细胞的活化以及免疫调节功能。目前的研究发现,天麻多糖是一种主要由α-D-1,4-糖苷键为主链的葡聚糖,可能还含有α-1,3-糖苷键和α-1,4,6-糖苷键[7]。α-淀粉酶可以水解α-1,4-糖苷键,已有研究采用α-淀粉酶降解蛹虫草多糖,使其抗氧化活性提高、三螺旋结构改变[15]。而目前利用α-淀粉酶降解天麻多糖的研究鲜有报道。
因此本研究利用α-淀粉酶降解天麻多糖,采用响应面试验优化了酶降解工艺。此外,还对酶降解前后天麻多糖的溶解率、结构变化以及抗氧化活性变化进行检测,以期为天麻多糖的酶法修饰及其应用提供一定的理论基础。
1. 材料与方法
1.1 材料与仪器
天麻粉 市售;枯草杆菌α-淀粉酶(4000 U/g) 食品级、普通型透析袋(截留分子量1000 Da),上海源叶生物科技有限公司; DPPH试剂盒、ABTS试剂盒 北京盒子生工科技有限公司;二硝基水杨酸、酒石酸钾钠、亚硫酸钠 均为分析纯,上海易恩化学技术有限公司;三氟乙酸、氢氧化钠、盐酸、硝酸钠、叠氮化钠 均为分析纯,国药化学试剂有限公司;乙腈、氯仿 均为色谱级,美国ACS恩科化学公司;1-苯基-3-甲基-5-吡唑啉酮 上海阿拉丁生化科技股份有限公司;鼠李糖、阿拉伯糖、岩藻糖、半乳糖、半乳糖醛酸、葡萄糖醛酸、核糖 均为色谱级,上海安谱实验科技股份有限公司;木糖、甘露糖、葡萄糖 均为色谱级,坛墨质检科技股份有限公司;古罗糖醛酸、甘露糖醛酸 均为色谱级,青岛和海生物科技有限公司;其他分析试剂均为国产分析纯。
FA-1004电子天平 上海舜宇恒平科学仪器有限公司;HH-8显数恒温水浴锅 国华电器有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;V-5600紫外可见分光光度计 上海元析有限公司;TG220M台式高速冷冻离心机 湖南湘立科学仪器有限公司;GZX-GH01-3-BS电热恒温鼓风干燥箱 上海跃进医疗器械有限公司;1200高效液相色谱仪、1260 InfinityⅡMDS凝胶渗透色谱仪(配有示差检测器、双角度激光散射检测器) 美国Agilent公司;MTN-5800氮吹仪 天津奥特赛恩斯仪器有限公司;IB-3型离子镀金仪喷金镀膜 日本Eiko公司;JSM-840扫描电镜 捷欧路(北京)科贸有限公司;Nicolet™ iS50傅里叶红外光谱仪 美国Thermo Fisher公司;Synergy H1全波长荧光酶标仪 美国Biotek公司。
1.2 实验方法
1.2.1 天麻多糖的提取
天麻多糖的提取参照马风伟等[16]的方法,并略有改动。取烘干至恒重的天麻粉末,加入90%的乙醇回流脱脂。脱脂后待乙醇挥发完全,称取30 g天麻粉,按照料液比(1:30)加入去离子水,在75 ℃下提取4 h。随后浓缩至100 mL,加入Savage试剂(氯仿:正丁醇=4:1)脱蛋白,重复七次后,将剩余溶液转移至透析袋并放置于装有超纯水的烧杯中透析2 d。透析完成后加入无水乙醇至乙醇浓度为80%,并在4 ℃下静置。离心收集后用少量无水乙醇、丙酮洗涤,再加入蒸馏水溶解,冷冻干燥后得天麻多糖。
1.2.2 天麻多糖酶解工艺
参考吴迪等[17]的方法,并略有改动。称取冷冻干燥好的天麻多糖100 mg,加入适量超纯水溶解后,配制为1 mg/mL的天麻多糖溶液。加入α-淀粉酶并以柠檬酸—磷酸氢二钠缓冲液调节pH,配制成不同酶添加量和不同pH的溶液。反应时间结束后,立即沸水浴10 min,以彻底使α-淀粉酶失活。随后在5000×g下离心10 min,取上清液进行测定,以还原糖生成量为指标考察不同酶添加量、酶解时间、酶解温度和酶解pH对天麻多糖酶解效率的影响。
在最佳工艺条件下进行酶解试验,反应时间结束后,立即沸水浴10 min,以彻底使α-淀粉酶失活。在5000×g下离心10 min,取上清液在旋转蒸发仪中浓缩。浓缩后加入无水乙醇至终浓度为80%,于4 ℃过夜静置,离心后弃上清,收集沉淀冷冻干燥,得酶解后的天麻多糖。
1.2.3 单因素实验
1.2.3.1 酶添加量对还原糖生成量的影响
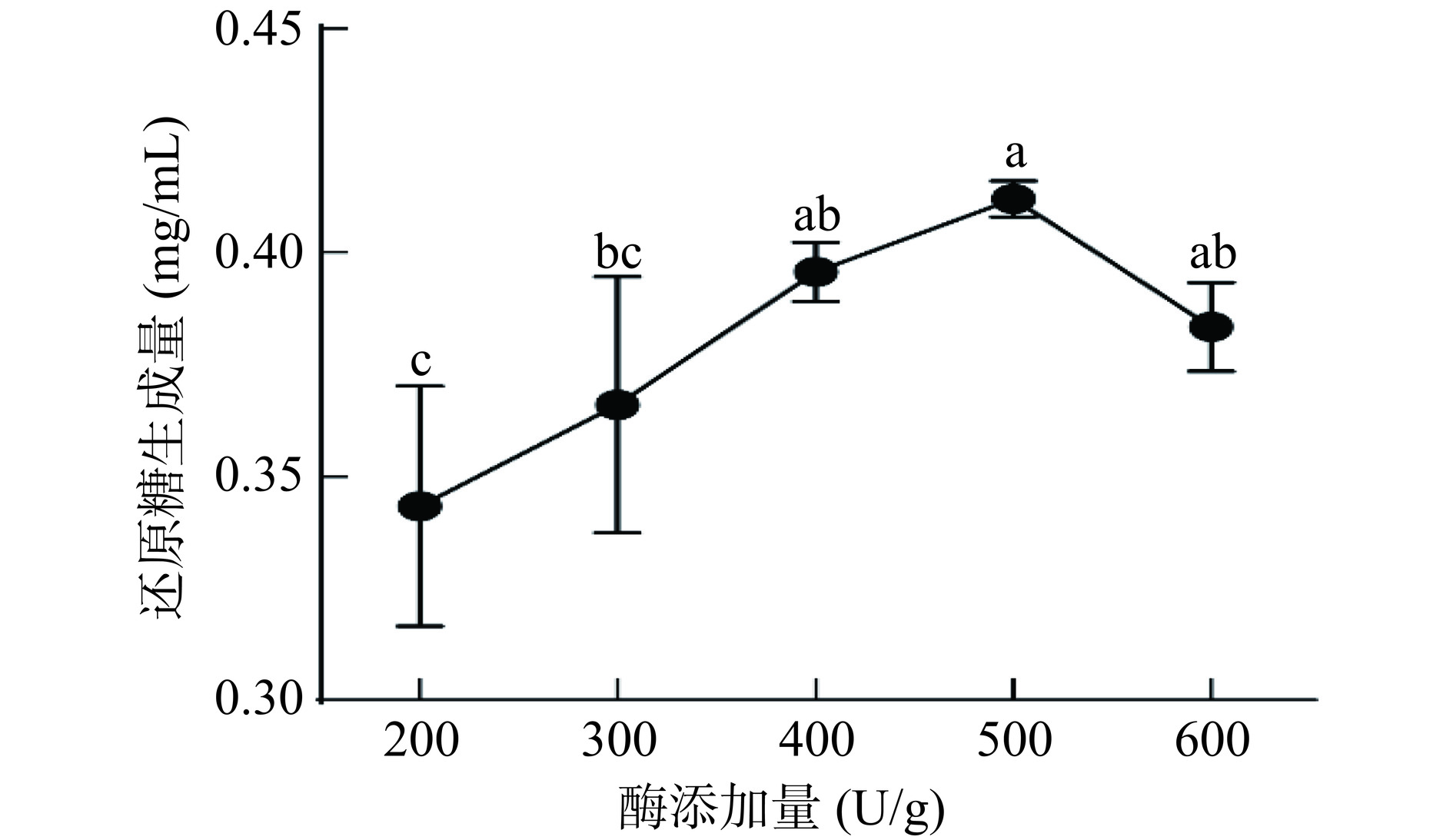
固定酶解时间为90 min,酶解温度为60 ℃,酶解pH为7,考察酶添加量(200、300、400、500和600 U/g)对还原糖生成量的影响。
1.2.3.2 酶解时间对还原糖生成量的影响
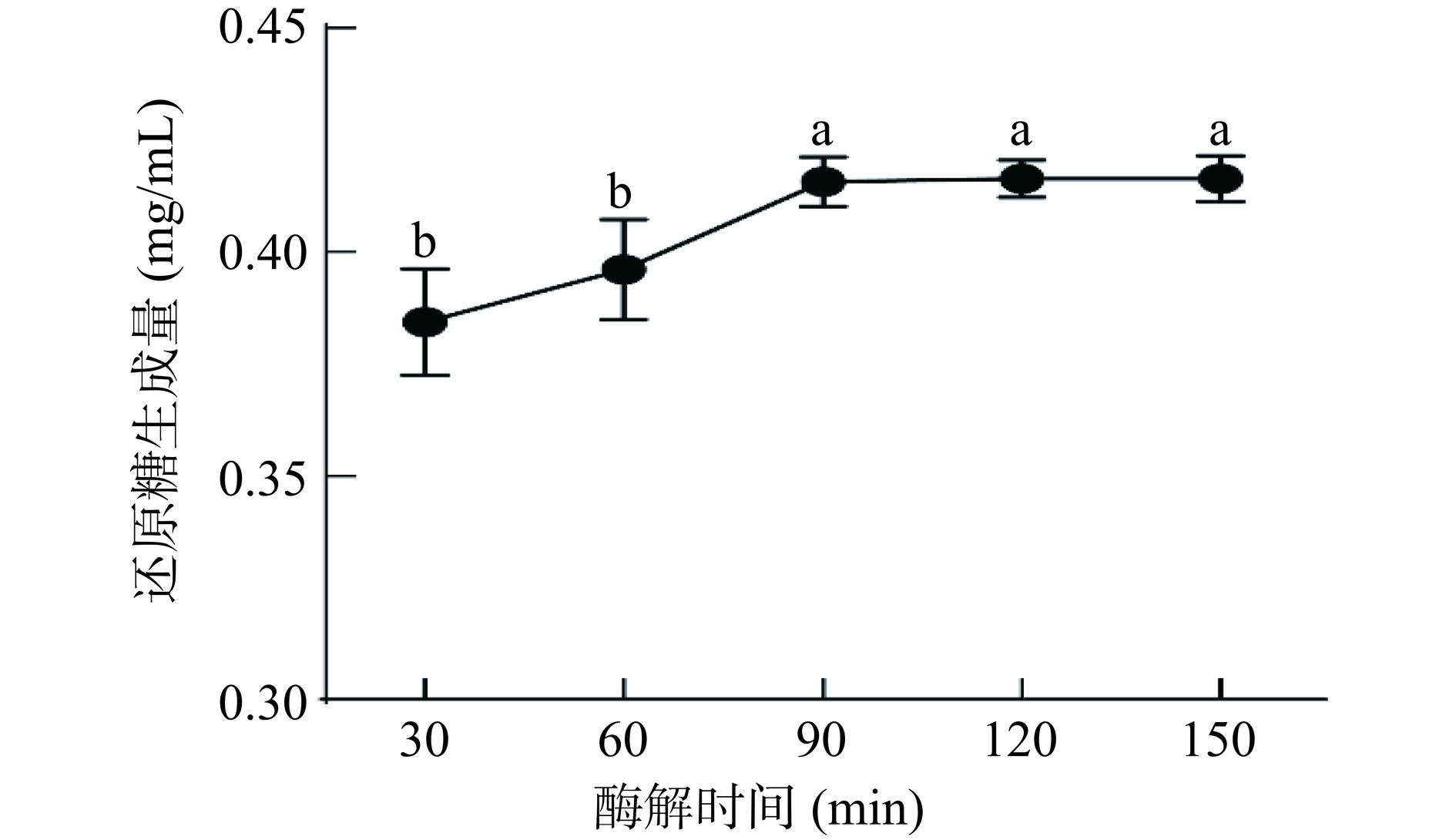
固定酶添加量为500 U/g,酶解温度为60 ℃,酶解pH为7,考察酶解时间(30、60、90、120和150 min)对还原糖生成量的影响。
1.2.3.3 酶解温度对还原糖生成量的影响
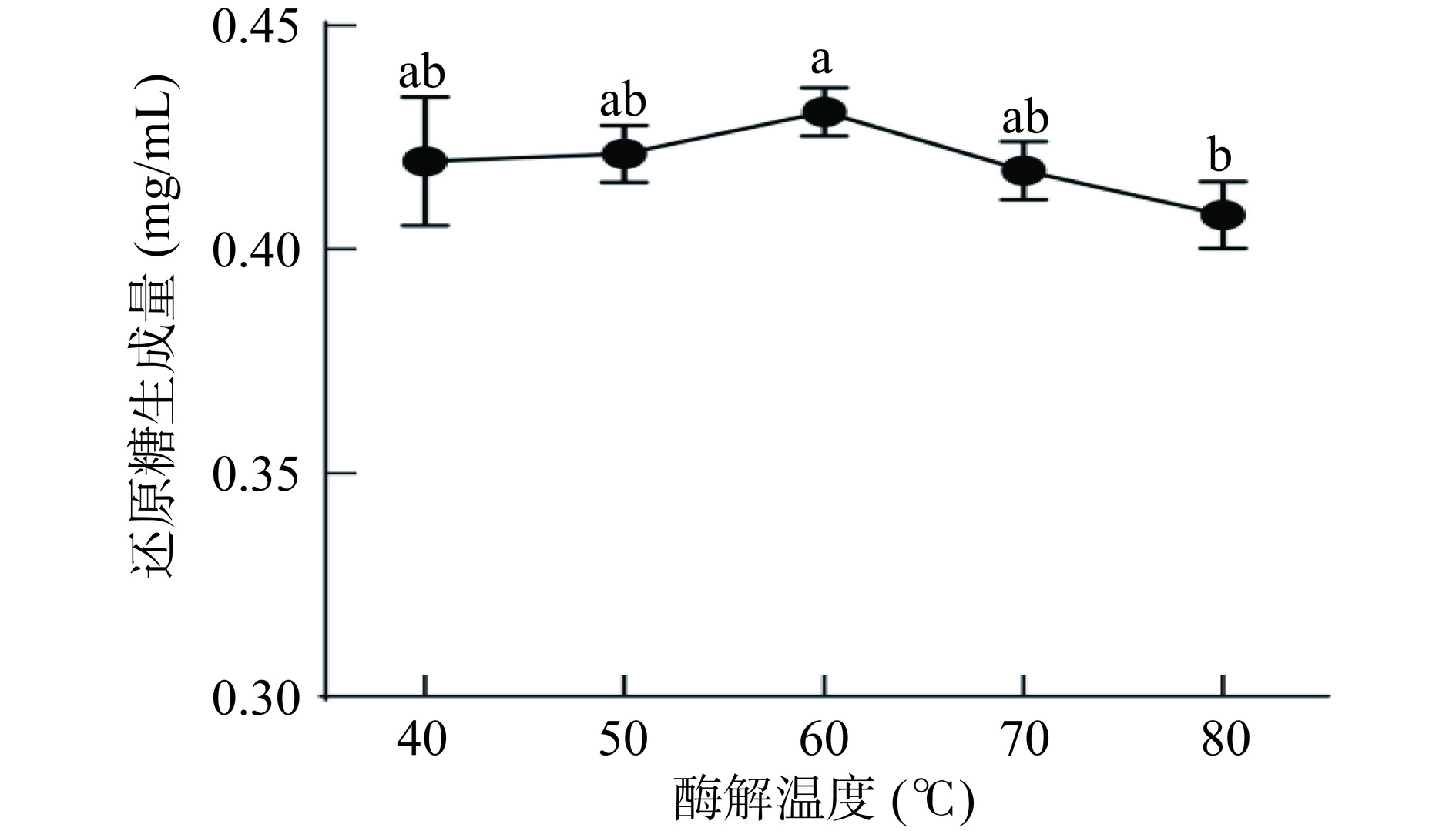
固定酶添加量为500 U/g,酶解时间为90 min,酶解pH为7,考察酶解温度(40、50、60、70和80 ℃)对还原糖生成量的影响。
1.2.3.4 酶解pH对还原糖生成量的影响
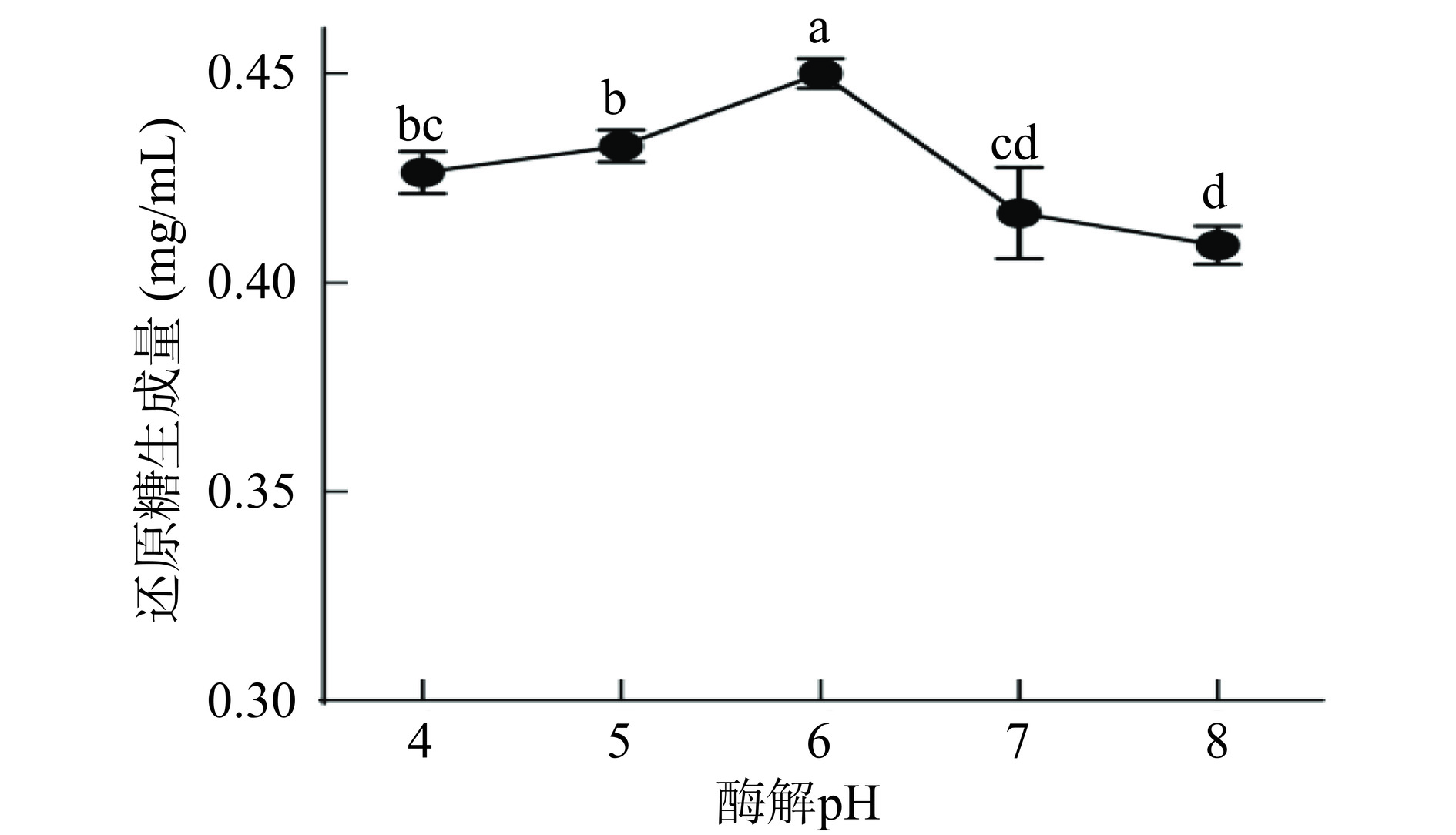
固定酶添加量为500 U/g,酶解时间为90 min,酶解温度为60 ℃,考察酶解pH(4、5、6、7和8)对还原糖生成量的影响。
1.2.4 响应面试验
在单因素实验的基础上,以还原糖生成量为指标,选择酶添加量(300、400和500 U/g)、酶解时间(60、90和120 min)和酶解pH(5、6和7)进行三因素三水平的响应面优化试验,试验设计见表1。
表 1 响应面优化试验因素与水平Table 1. Factors and levels of response surface optimized experiment
水平因素 A酶添加量( U/g) B酶解时间(min) C酶解pH −1 400 60 5 0 500 90 6 1 600 120 7 1.2.5 还原糖生成量的测定
1.2.5.1 标准曲线的制作
还原糖的计算参考牟佳红等[18]的方法。精密称取烘干至恒重的葡萄糖100 mg,加超纯水溶解并定容至100 mL,得1 mg/mL的葡萄糖溶液。制备浓度为0.1、0.2、0.3、0.4、0.5、0.6 mg/mL的葡萄糖溶液,备用。在具塞玻璃管中加入1 mL超纯水,再加入不同浓度的葡萄糖溶液l mL,最后加入1.5 mL的二硝基水杨酸试剂,摇匀,沸水浴5 min,流水冷却至室温后,用超纯水定容至25 mL。在波长540 nm下检测吸光度,平行测定三次。以葡萄糖浓度为横坐标(X),吸光度为纵坐标(Y),绘制标准曲线,得方程Y=16.05X−0.01689,R2=0.9974,表明在0.004~0.024 mg/mL范围内线性关系良好。
1.2.5.2 天麻多糖酶解后还原糖生成量的检测
在试管中加入1 mL超纯水,再加入酶反应结束后的上清液l mL,最后加入1.5 mL的二硝基水杨酸试剂,摇匀,沸水浴5 min,流水冷却至室温后,用超纯水定容至25 mL。在波长540 nm下检测吸光度,平行测定三次。根据1.2.5.1中的标准曲线计算天麻多糖酶解后得到还原糖的生成量。
还原糖生成量(mg/mL)=c×D 式中:c表示根据吸光度值计算出的溶液质量浓度,mg/mL;D表示溶液稀释倍数。
1.2.6 溶解率的测定
参考曹馨慧等[19]的方法,取酶解前后的天麻多糖各60 mg于EP管中,加入适量超纯水充分溶解后,在8000×g下离心10 min,移弃上清液。50 ℃干燥至恒重,称重后按下式计算天麻多糖溶解率。
溶解率(%)=m1−m2m1×100 式中:m1表示样品溶解前的质量,mg;m2表示样品烘干后的质量,mg。
1.2.7 多糖结构的测定
1.2.7.1 单糖组成测定
参考Yang等[20]的方法并略有改动。称取适量样品于水解管中,加入2 mol/L三氟乙酸1 mL,充氮,110 ℃烘箱中水解5 h,取出后冷却至室温,取0.5 mL于4 mL离心管中,调pH至中性。然后向4 mL离心管中加入0.2 mL浓度为0.3 mol/L的NaOH,0.4 mL PMP甲醇溶液,充氮,70 ℃水浴60 min,取出后冷却至室温。然后加入0.2 mL浓度为0.3 mol/L的HCl,加水定容到2 mL,加入1.5 mL氯仿,振荡摇匀后静置分层,弃去下层氯仿,如此反复萃取三次,水层过0.45 μm滤膜,上机测定。
数据采集仪器系统包括Agilent 1200,检测器:紫外检测器。色谱柱:C18(4.6 mm×250 mm×5 μm);流动相A:15%乙腈(乙腈经0.05 mol/L KH2PO4稀释,pH6.8),流动相B:40%乙腈(乙腈经0.05 mol/L KH2PO4稀释,pH6.8)。流速:1.0 mL/min;柱温:25 ℃;进样量:20 μL ;检测波长:254 nm。洗脱梯度:0 min A相/B相(100:0 V/V),10 min A相/B相(92:8 V/V),40 min A相/B相(63:37 V/V),45 min A相/B相(100:0 V/V),50 min A相/B相(100:0 V/V)。
1.2.7.2 分子量测定
参考胡卫珍等[21]的方法,采用凝胶渗透色谱(GCP)联合示差检测器和双角度激光散射检测器进行多糖分子量的检测。准确称取适量样品用流动相溶解,配制为浓度约1~3 mg/mL溶液,过0.22 μm微孔滤膜后上机测试。色谱柱:PL aquagel-OH Mixed-H,8 μm,7.5×300 mm(分子量范围500~107 Da);流速:1.0 mL/min,柱温:45 ℃;进样量:50 μL;流动相:0.1 mol/L硝酸钠(0.01%叠氮化钠),等度洗脱。通过样品的粘度、出峰时间等利用GPC软件拟合计算出样品的分子量Mw。
1.2.7.3 红外光谱扫描
称取酶解前后的天麻多糖各5 mg,加入5 mg的KBr研磨混合后,取出2 mg粉末压片,在400~4000 cm−1范围下进行红外扫描。
1.2.7.4 扫描电镜观察
取酶解前后的天麻多糖样品适量,利用IB-3 型离子镀金仪喷金镀膜后,电子枪加速电压20 kV,JSM-840扫描电镜在不同放大倍数下观察。
1.2.8 抗氧化能力测定
1.2.8.1 DPPH自由基的抗氧化测试
采用DPPH自由基清除能力检测试剂盒进行抗氧化能力测试。具体步骤按照试剂盒说明书进行。制备2、4、6、8、10 mg/mL的酶解前后天麻多糖和维生素C溶液备用。在96孔板中加入待测样品150 μL,再加入50 μL的DPPH工作液为测量组A1。在96孔板中加入试剂一150 μL,再加入待测样品50 μL为对照组As。在96孔板中加入提取液150 μL,再加入工作液50 μL为空白组A0。用维生素C作为阳性对照。充分混匀后,室温避光反应30 min。在515 nm处测定吸光值,待测样本DPPH自由基清除率按下式计算。
DPPH自由基清除率(%)=A0−A1+AsA0×100 式中:A0为提取液与DPPH工作液反应后的吸光度;A1为样品与DPPH工作液反应后的吸光度;As为试剂一与待测样品反应后的吸光度。
1.2.8.2 ABTS+自由基的抗氧化测试
采用ABTS+自由基清除能力检测试剂盒进行抗氧化能力测试。具体步骤按照试剂盒说明书进行。制备2、4、6、8、10 mg/mL的酶解前后天麻多糖和维生素C溶液备用。在离心管中依次加入试剂一50 μL、试剂二100 μL和试剂三100 μL,立即混匀。然后加入待测样本50 μL和试剂四50 μL,充分混匀后,37 ℃反应60 min,随后10000×g常温离心10 min,吸取200 μL上清液于96孔板中,在536 nm处测定吸光值,待测样本ABTS+自由基清除率按下式计算。维生素C作为阳性对照。
ABTS+自由基清除率(%)=A0−A1+AsA0×100 式中:A0为提取液与ABTS+工作液反应后的吸光度;A1为样品与ABTS+工作液反应后的吸光度;As为试剂一与待测样品反应后的吸光度。
1.3 数据处理
数据分析采用SPSS Statistics 26软件,结果以平均值±标准差表示,P<0.05为显著水平。响应面试验设计和图表制作采用Design Expert 10.0,其余图表制作均采用Graphpad prism 8。
2. 结果与分析
2.1 天麻多糖酶解单因素实验
2.1.1 酶添加量对还原糖生成量的影响
考察了不同酶添加量对还原糖生成量的影响,结果如图1所示。酶添加量从200~600 U/g,还原糖生成量不断提高,而当酶添加量为600 U/g时,还原糖含量反而降低,这可能是由于酶添加过多时,酶分子粘结吸附而使反应减缓[17],从而导致还原糖含量降低,因此本研究中最佳酶添加量为500 U/g。
2.1.2 酶解时间对还原糖生成量的影响
合适的酶解时间有利于多糖与酶的充分反应,酶解时间对天麻多糖降解效率的影响如图2所示。当酶解时间从30 min增加至90 min,还原糖生成量逐渐升高,而随着时间继续增加,还原糖生成量趋于稳定。随着反应时间的增加,溶液中底物浓度逐渐降低和酶活力降低,因此还原糖生成量逐渐趋于稳定[12]。考虑时间成本,最佳酶解时间选取90 min。
2.1.3 酶解温度对还原糖生成量的影响
酶解温度对还原糖生成量的影响如图3所示。还原糖生成量呈先升高后降低的趋势,在60 ℃时还原糖生成量最高,但不同温度(40、50、60、70和80 ℃)对还原糖生成量的影响并不显著(P>0.05),这可能是由于本试验采用的枯草杆菌α-淀粉酶具有较强的耐热性,即使在较高温度下也具有较强的活性。综合以上结果,确定最佳酶解温度为60 ℃。
2.1.4 酶解pH对还原糖生成量的影响
pH的大小往往会影响酶活力的高低,图4显示了酶解pH对还原糖生成量的影响。由图可知,当pH从4上升至6时,还原糖生成量也随之增加。但当pH进一步上升时,还原糖生成量开始降低。因为过低或过高的pH都会导致酶活力降低[22],所以在本研究中选择最佳酶解pH为6。
2.2 天麻多糖酶解响应面试验
2.2.1 响应面试验方差分析
在单因素实验的结果基础上,确定酶添加量(A)、酶解时间(B)以及酶解pH(C)3个因素进行响应面优化试验,以还原糖生成量为响应值,采用Box-Behnken模型进行三因素三水平的响应面试验设计,试验结果见表2。
表 2 响应面试验设计及结果Table 2. Experimental design and results of response surface试验号 A酶添加量(U/g) B酶解时间(min) C酶解pH 还原糖生成量(mg/mL) 1 500 90 6 0.444±0.001 2 500 60 7 0.430±0.001 3 400 90 7 0.427±0.003 4 500 90 6 0.455±0.001 5 600 90 7 0.417±0.001 6 400 120 6 0.437±0.001 7 500 90 6 0.452±0.002 8 500 120 7 0.420±0.001 9 400 90 5 0.435±0.003 10 600 90 5 0.418±0.002 11 600 120 6 0.411±0.003 12 400 60 6 0.425±0.001 13 600 60 6 0.426±0.001 14 500 90 6 0.454±0.004 15 500 120 5 0.419±0.001 16 500 60 5 0.434±0.003 17 500 90 6 0.441±0.001 通过Design-Expert10软件对表2的试验结果进行回归拟合分析,得到酶解天麻多糖还原糖生成量(Y)对酶添加量(A)、酶解时间(B)和酶解pH(C)的二元多项回归方程:Y=0.45−0.0065A−0.0035B−0.0015C−0.00675AB+0.00175AC+0.00125BC−0.013A2−0.011B2−0.012C2。
对响应面结果进行方差分析,结果见表3。由表3可知,建立的模型P值小于0.01时,为极显著水平,表明该模型显著性较高。而失拟项(P=0.6746>0.05)不显著,说明该模型具有统计学意义。一次项A和AB表现为显著水平(P<0.05),表明对天麻多糖降解效率有显著影响,A2、C2和B2各项的P值小于0.01,表明这些因素对天麻多糖降解效率有极显著影响。其他因素P值均大于0.05,所以这些因素对天麻多糖降解效率影响较小。由方差分析结果可知,各因素对天麻多糖降解效率影响大小顺序为A(酶添加量)>B(酶解时间)>C(酶解pH)。
表 3 回归方程的方差分析Table 3. Analysis of variance for the fitted regression equation方差来源 平方和 自由度 均方 F值 P值 显著性 模型 0.0027410 9 0.0003045 9.50 0.0036 ** A 0.0003380 1 0.000338 10.55 0.0141 * B 0.0000980 1 0.000098 3.06 0.1238 C 0.0000180 1 0.000018 0.56 0.4780 AB 0.0001823 1 0.0001823 5.69 0.0485 * AC 0.0000123 1 0.00001225 0.38 0.5560 BC 0.0000063 1 0.00000625 0.20 0.6721 A2 0.0007088 1 0.0007088 22.12 0.0022 ** B2 0.0005544 1 0.0005544 17.30 0.0042 ** C2 0.0006038 1 0.0006038 18.84 0.0034 ** 残差 0.0002243 7 0.00003204 失拟项 0.0000655 3 0.00002183 0.55 0.6746 不显著 纯误差 0.0001588 4 0.0000397 总差 0.0029650 16 注:P<0.05代表显著,以“*”表示;P<0.01代表极显著,以“**”表示。 2.2.2 响应曲面分析
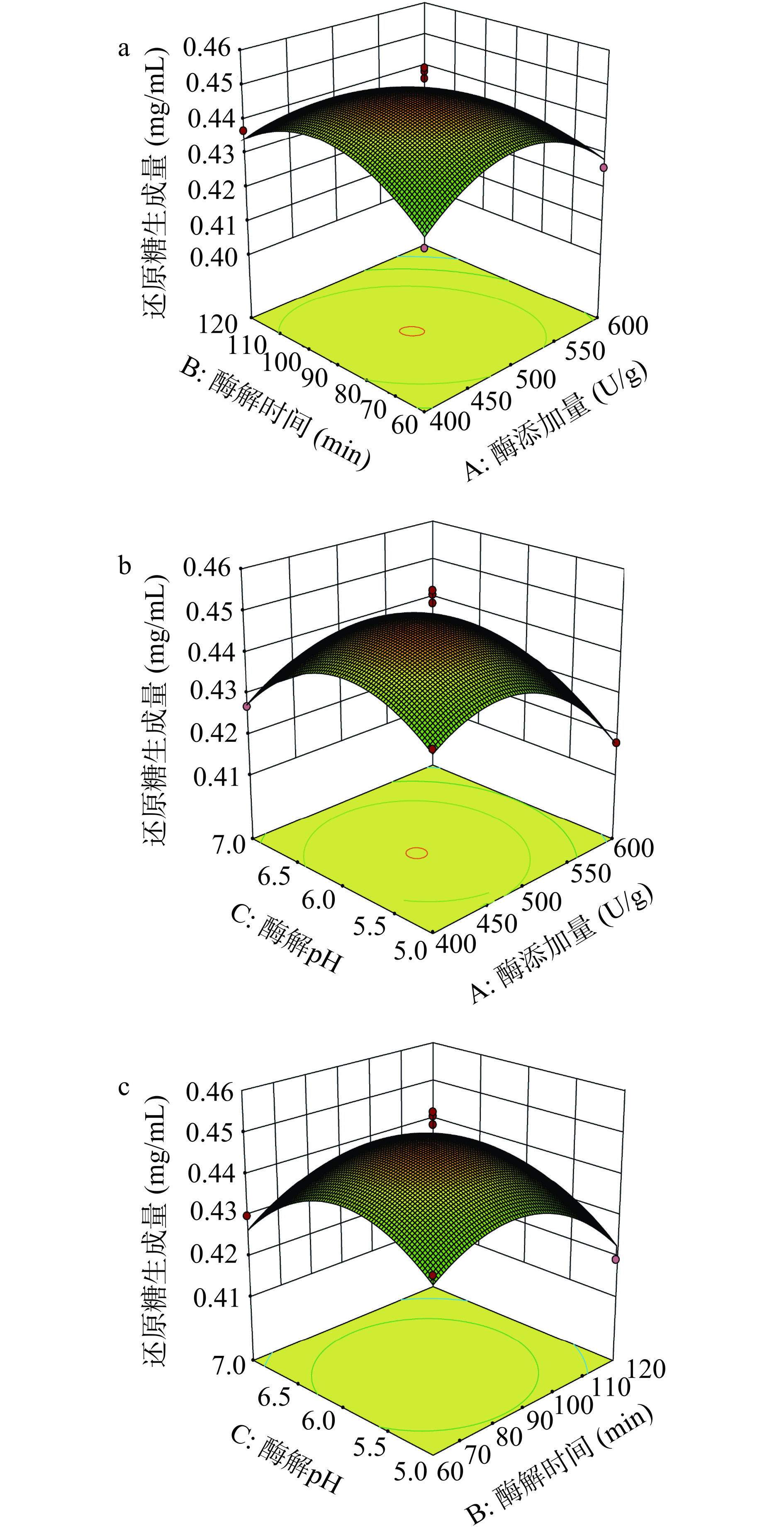
根据回归模型建立如图5所示的响应曲面图,响应曲面坡度的陡峭程度可以看出两两因素之间的交互情况[23]。在图5a中可以观察到,随着酶解时间和酶添加量的增加,天麻多糖酶解过程中还原糖生成量呈先增加后降低的趋势,且响应曲面较陡,因此两因素间交互作用较为显著(P<0.05)。在图5b和5c中同样可以观察到类似的现象,但两两因素之间交互作用并不显著(P>0.05),其中图5b中两因素的交互作用强于图5c中两因素的交互作用,这与方差分析的结果也一致。
2.2.3 最佳工艺的确定及模型验证
通过响应面优化试验后,得到天麻多糖酶解的最佳工艺为酶解时间100.493 min,酶添加量459.563 U/g,酶解pH为5.379。结合试验实际操作情况,得到最优工艺为酶解时间100 min,酶添加量460 U/g,酶解pH为5.4。在此条件下,进行模型验证试验三次,得到天麻多糖酶解后还原糖生成量为0.441±0.020 mg/mL,与理论值0.442 mg/mL较为接近,因此该模型可用于天麻多糖酶解效率的预测。
2.3 溶解率的测定
天麻多糖酶降解后溶解率的变化如表4所示。由图可知,天麻多糖在酶解后,溶解率发生了显著的变化(P<0.05)。酶解前天麻多糖溶解率为81.28%,而酶解后的天麻多糖溶解率为93.57%,这表明酶处理后天麻多糖的溶解率得到了提高。吴迪等[17]使用β-葡聚糖酶处理黑木耳多糖后,也观察到黑木耳多糖溶解率的提高。
表 4 酶解前后天麻多糖溶解率的变化Table 4. Changes of dissolution rate of G. elata polysaccharide before and after enzymatic hydrolysis样品 溶解率(%) 酶解前天麻多糖 81.82±0.02b 酶解后天麻多糖 93.57±0.05a 注:不同小写字母表示差异显著,P<0.05。 2.4 单糖组成分析
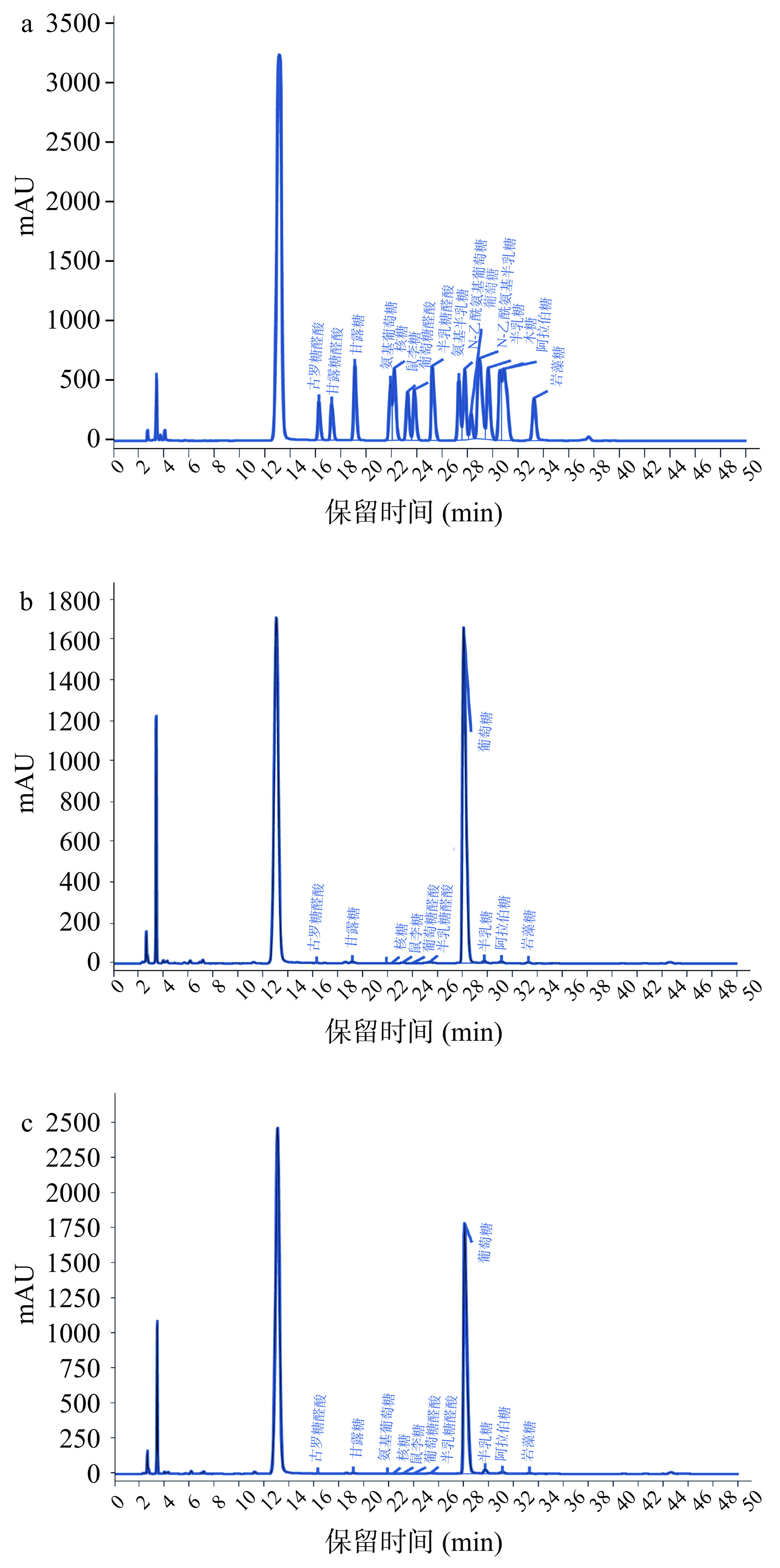
酶处理前后天麻多糖的单糖组成色谱检测图见图6,单糖组成与含量变化见表5。由表5可知,酶解前后天麻多糖的单糖组成以葡萄糖为主,分别为97.97%和97.26%,这表明天麻多糖是一种以葡萄糖为主的多糖,这在前人许多研究中得到了证实。Huo等[24]通过水提醇沉法提取天麻多糖,Sevage法脱蛋白,经过10 kDa膜透析后发现天麻多糖是一种葡聚糖。Huo等[25]同样采用水提醇沉法提取多糖,然后用Sevage法脱蛋白,再经过两步柱纯化后得到的天麻多糖仍然为一种葡聚糖。然而也有其他研究中提取得到的天麻多糖含有多种单糖[26],这可能是因为提取纯化方法的不同或天麻品种的差异。酶解处理后,葡萄糖含量略微降低,而半乳糖、阿拉伯糖和岩藻糖的含量显著增加(P<0.05)。这可能是由于酶处理后葡聚糖主链的断裂,而其他单糖暴露了出来[27]。
表 5 酶解前后天麻多糖的单糖组成及其含量的变化Table 5. Changes of monosaccharide composition and content of G. elata polysaccharide before and after enzymatic hydrolysis样品 葡萄糖
(%)古罗糖醛酸
(%)甘露糖
(%)氨基葡萄糖
(%)核糖
(%)鼠李糖
(%)葡萄糖醛酸
(%)半乳糖醛酸
(%)半乳糖
(%)阿拉伯糖
(%)岩藻糖
(%)GEP 97.97 0.05 0.37 0.02 0.02 0.12 0.01 0.36 0.43 0.31 0.34 E-GEP 97.26 0.04 0.30 0.02 0.01 0.13 0.01 0.29 1.07 0.43 0.44 注:GEP为酶解前天麻多糖;E-GEP为酶解后天麻多糖。 2.5 分子量的检测
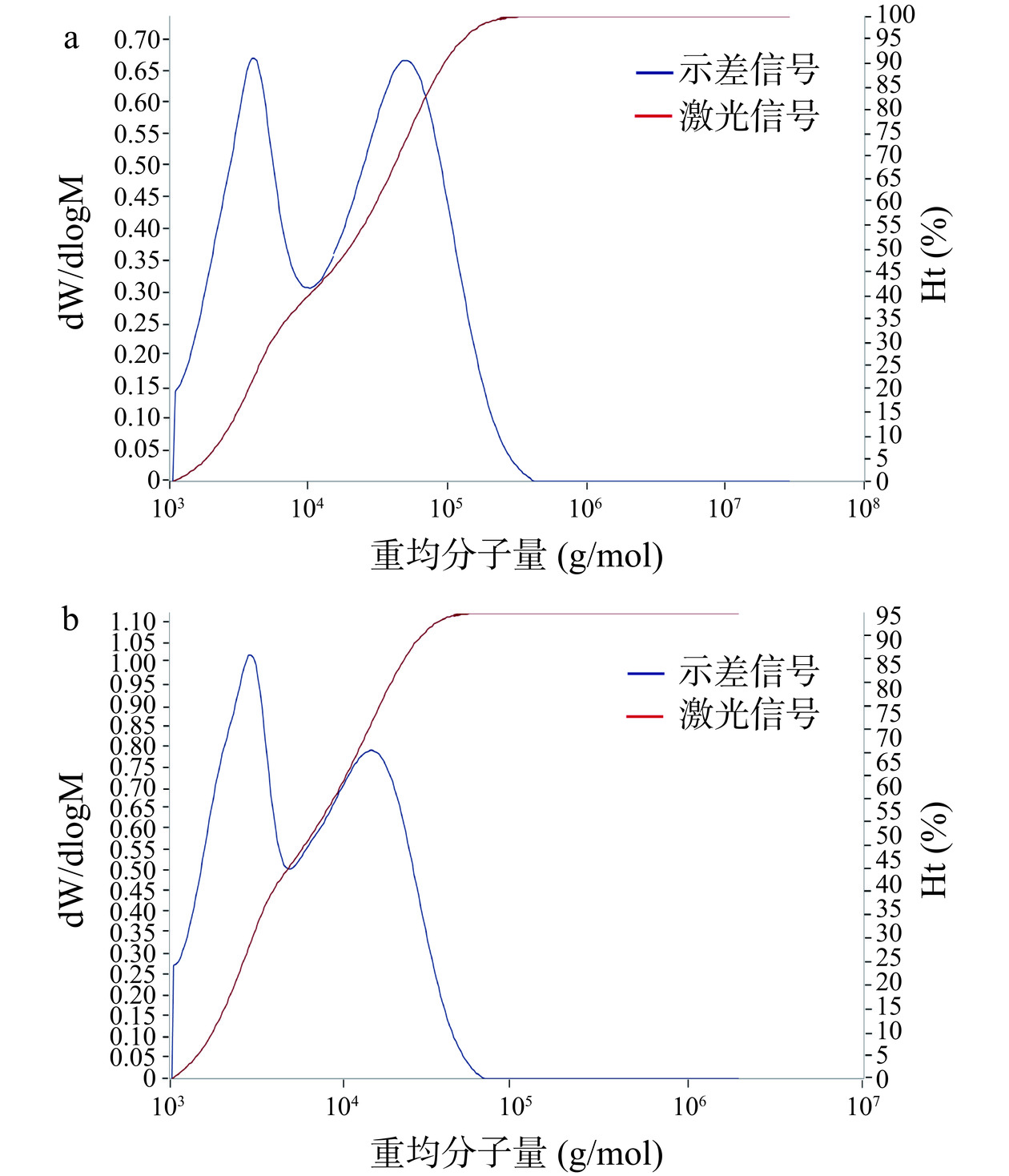
多糖是一种高分子聚合物,往往具有较大的分子量,酶解前后分子量的检测图见图7。由图7可知,本研究提取纯化得到的天麻多糖并不是均一多糖,有两个主要的峰出现。酶解前两个峰对应的天麻多糖平均分子量为3.064×103 Da和3.737×104 Da。而酶解后两个峰对应的天麻多糖分子量都显著降低(P<0.05),平均分子量分别为1.206×103 Da和9.652×103 Da,表明经过酶解处理后天麻多糖的分子量显著降低(P<0.05)。杜国丰等[28]采用微波辅助H2O2/VC降解浒苔多糖,发现经过微波辅助H2O2/VC处理后浒苔多糖的分子量显著降低。Wu等[12]利用纤维素酶降解黑木耳多糖后同样发现黑木耳多糖分子量显著降低。酶降解多糖主要是基于酶对多糖糖苷键的作用,经过酶解处理后往往会造成大量糖苷键的断裂,从而使多糖分子量显著降低[14]。
2.6 红外光谱分析
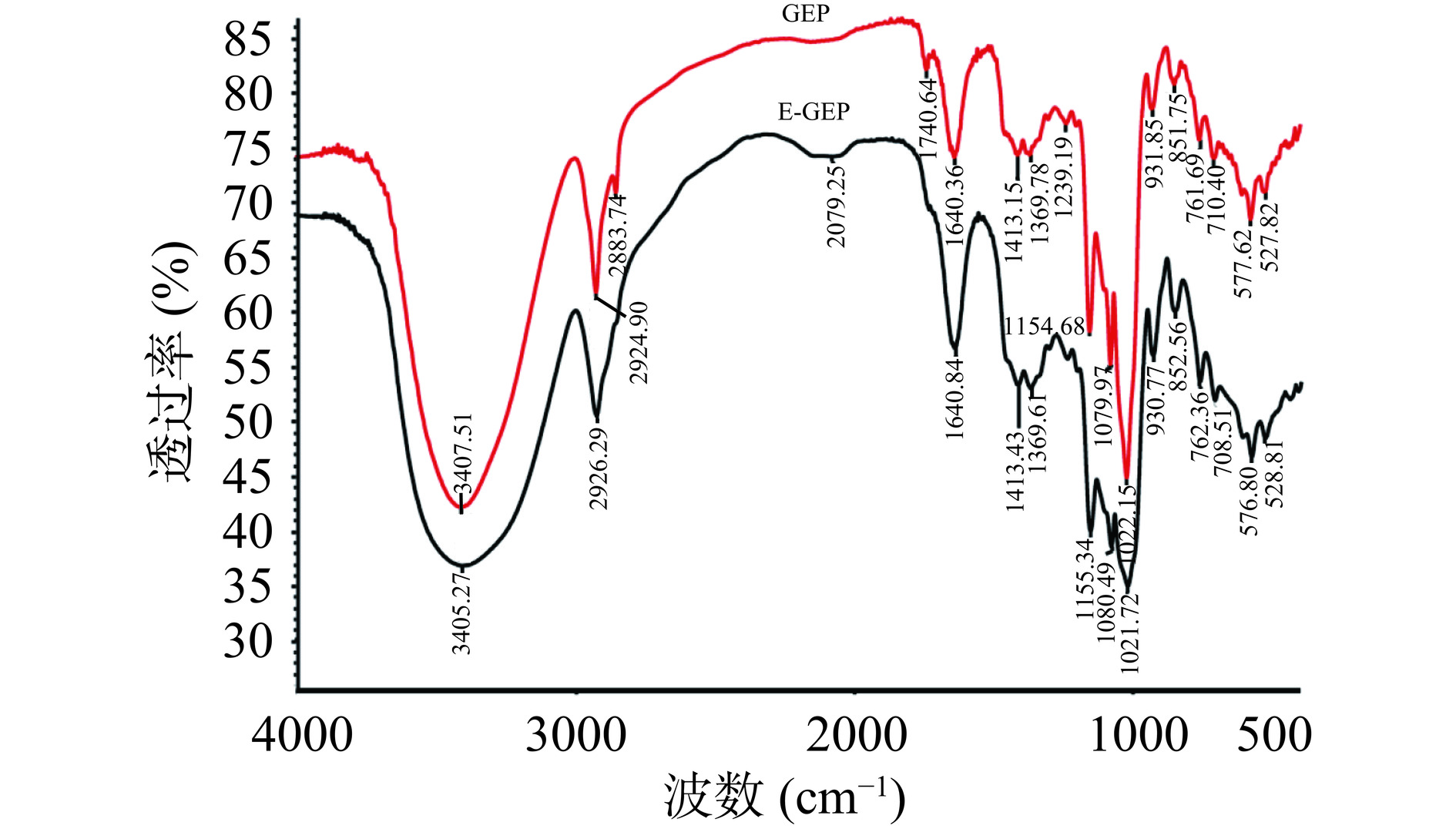
傅里叶红外光谱是多糖结构表征的主要检测方式之一,可通过观察特定波长的变化反映样品中所含有的基团,进而推测出样品中的官能团和结构。图8显示了酶解前后天麻多糖在400~4000 cm−1波长下的傅里叶红外光谱图。3400 cm−1的吸收峰是由于多糖中羟基伸缩振动引起的,而2926 cm−1左右的吸收峰则是由于甲基C-H的拉伸振动导致[25]。在1640 cm−1处的吸收峰可能是由于多糖中的结合水[29],而1412 cm−1处的吸收峰归因于C-H变形振动的原因[30]。在1154、1080和1021 cm−1处的吸收峰表明存在C-O-C和C-O-H键[29],表明多糖中有吡喃糖形式的糖基残基。在929.0 cm−1处的吸收是典型的D-吡喃糖形式葡萄糖[29],而在850 cm−1处的特征吸收带表明多糖中含有α-糖苷键[31],这与Huo等[25]对多糖结构解析的结果一致。总体来看,酶解前后天麻多糖的基本结构没有发生变化。
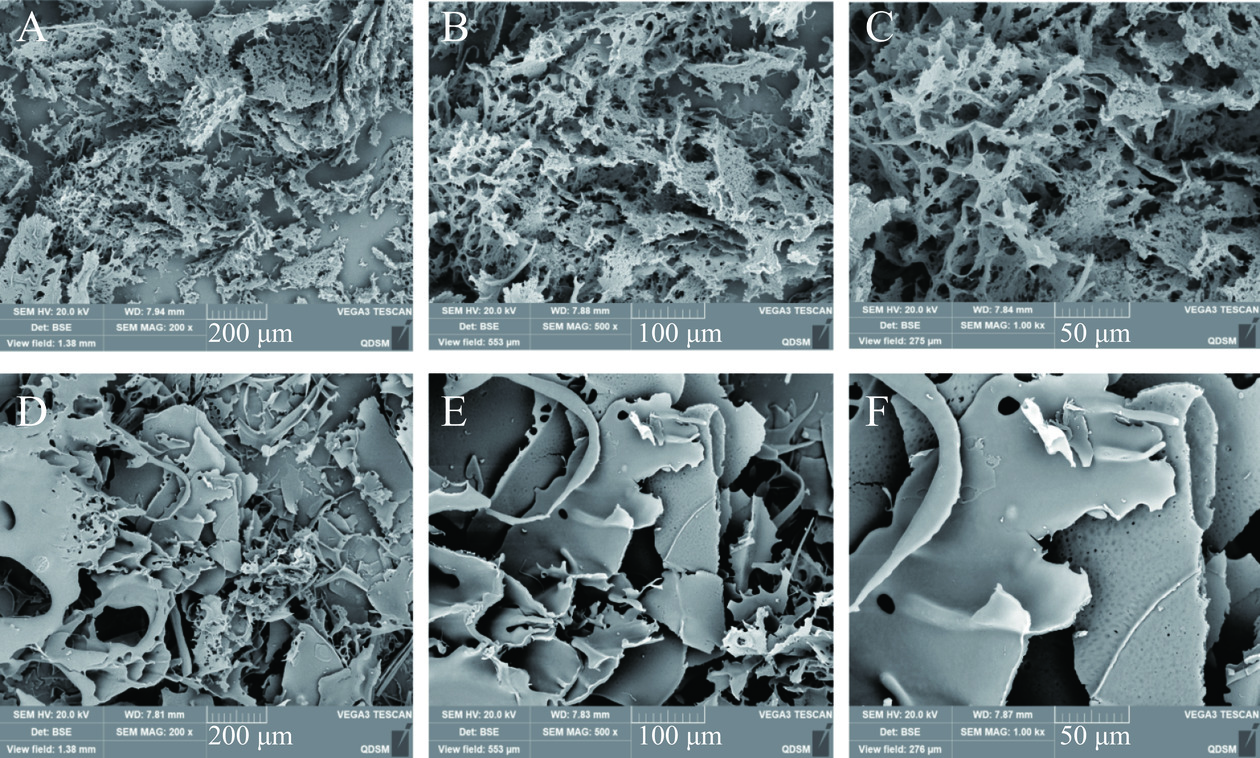
2.7 扫描电镜观察结果
天麻多糖酶解前后扫描电镜形貌图如图9所示。酶解前天麻多糖为网状结构,而酶解后天麻多糖的网状结构被破坏,形成片状结构,孔隙变得更大。结果表明,酶解可以改变天麻多糖的微观结构,这与Hu等[13]的研究结果一致。
2.8 抗氧化活性分析
自由基可引起脂质过氧化,破坏蛋白质和DNA的结构和功能,导致细胞膜破裂和细胞死亡,进而引发一系列疾病的产生[32]。植物提取物中往往存在许多天然抗氧化剂,能够清除自由基,例如:多酚、黄酮和多糖等[33]。因此可以通过测定它们对自由基的清除能力来评价生物活性物质的抗氧化能力。
2.8.1 酶解前后天麻多糖对DPPH自由基清除能力的变化
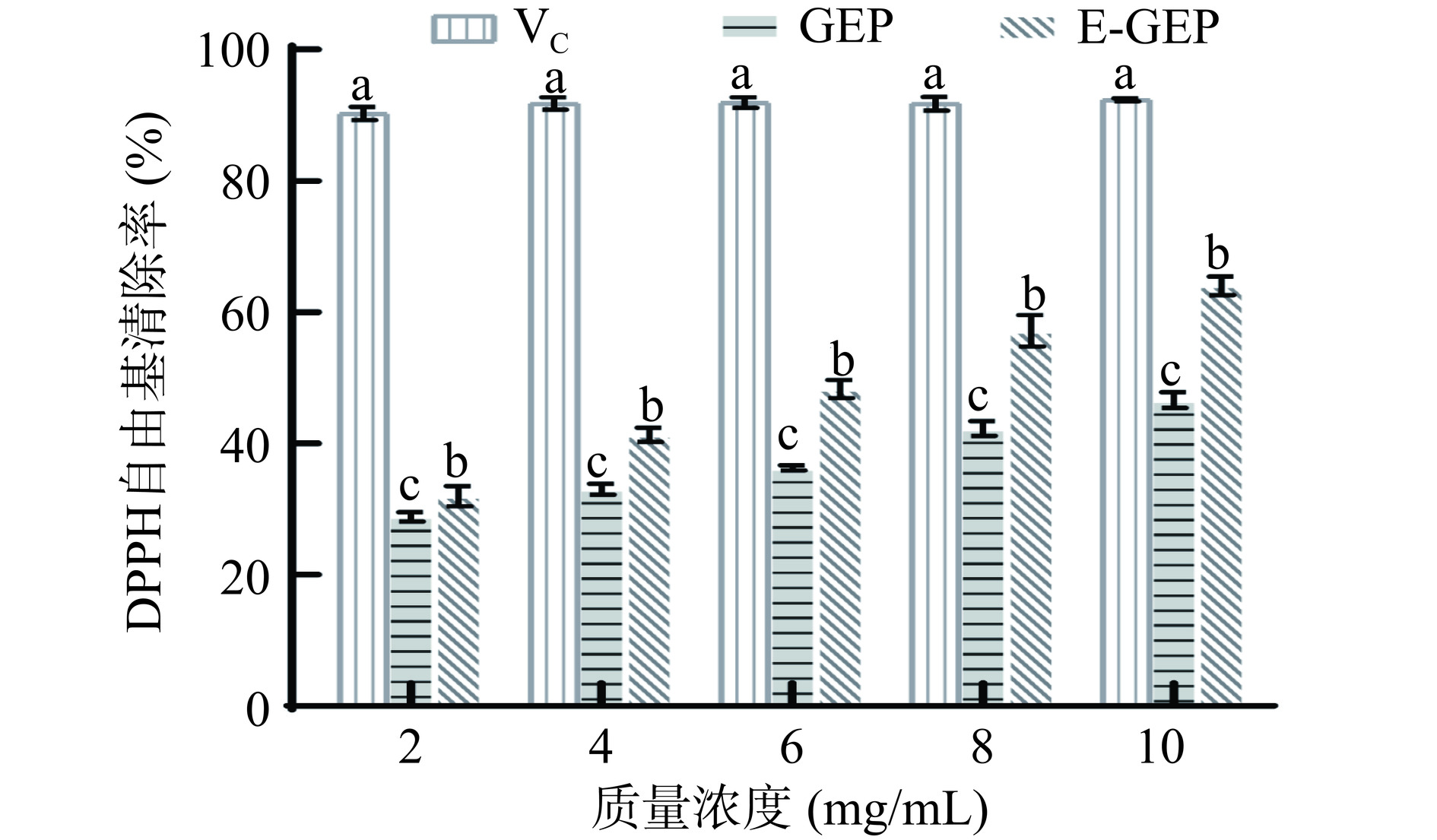
酶解前后天麻多糖对DPPH自由基清除能力的变化如图10所示。由图中可以看出,相比于酶解前的天麻多糖,酶解后天麻多糖的DPPH自由基清除率显著提高(P<0.05)。酶解前后的天麻多糖对DPPH自由基清除率具有浓度依赖性,清除率随着浓度的增加而增加,IC50值分别为17.30±2.51 mg/mL和5.61±0.21 mg/mL。常相娜等[27]测定了酶解前后苹果渣多糖对DPPH自由基的清除能力,发现酶解前多糖自由基清除率为34.49%,而酶解后为53.99%,提高了19.5%,这与本研究结果相似。
![]() 图 10 酶解前后天麻多糖对DPPH自由基清除率的影响注:VC为维生素C;不同小写字母表示相同质量浓度下不同处理组存在显著性差异(P<0.05),图11同。Figure 10. Effect of G. elata polysaccharide on DPPH free radical clearance before and after enzymatic hydrolysis
图 10 酶解前后天麻多糖对DPPH自由基清除率的影响注:VC为维生素C;不同小写字母表示相同质量浓度下不同处理组存在显著性差异(P<0.05),图11同。Figure 10. Effect of G. elata polysaccharide on DPPH free radical clearance before and after enzymatic hydrolysis2.8.2 酶解前后天麻多糖对ABTS+自由基清除能力的变化
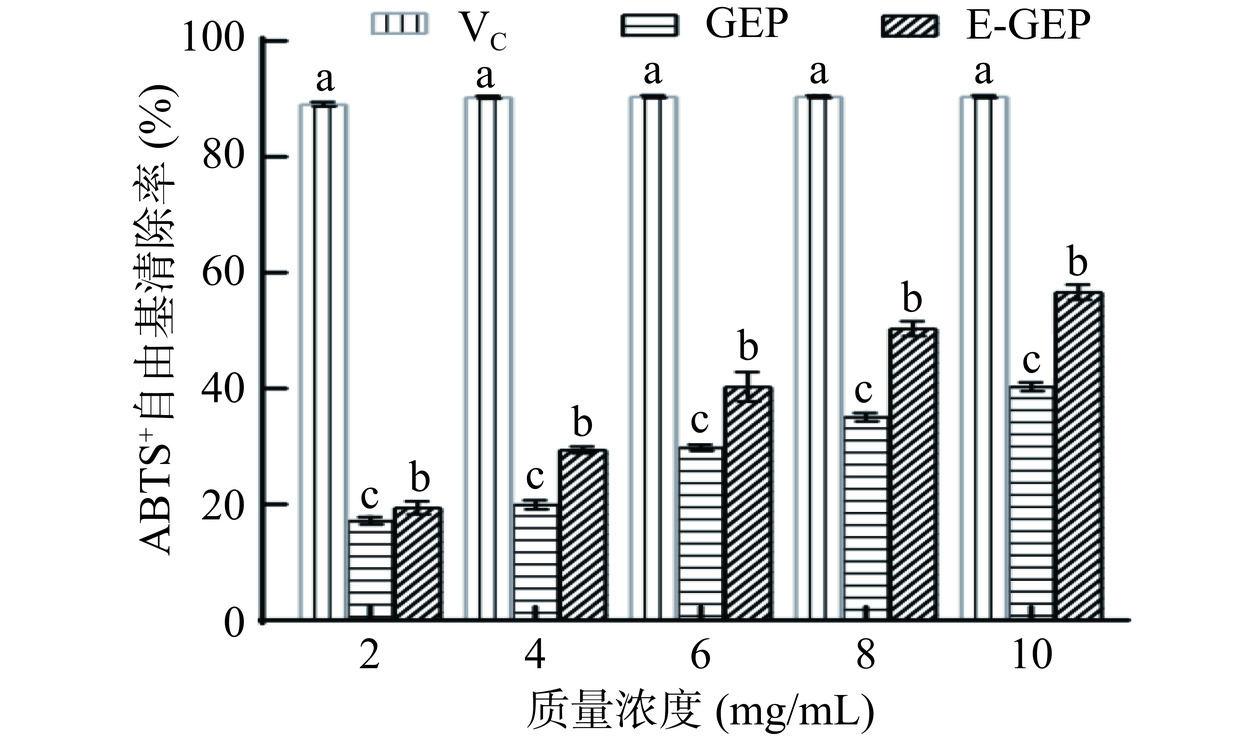
酶解前后天麻多糖对ABTS+自由基清除能力的变化如图11所示。由图可知,酶解前后天麻多糖对ABTS+自由基的清除率具有质量浓度依赖性,清除率随着质量浓度的增加而增大。此外,酶解前后天麻多糖对ABTS+自由基清除率的IC50值分别为22.46±0.89 mg/mL和8.27±0.36 mg/mL,酶解后的天麻多糖对ABTS+自由基的清除率显著高于酶解前的天麻多糖(P<0.05)。结果表明,酶解后天麻多糖的抗氧化能力得到显著提升(P<0.05)。Hu等[13]利用半纤维素酶降解桑叶多糖,酶解后得到的桑叶低聚糖对ABTS+自由基清除能力提升。酶解前天麻多糖分子量较高,结构也较为复杂,酶解后的天麻多糖具有更低的分子量,而低分子量的多糖往往具有更好的生物活性[14]。分子量较高的多糖水溶性较差,黏度高,限制了人体对它们的吸收、利用和生物活性[34]。而当多糖的分子量降低后,多糖的空间结构更加松散,分子内氢键变得较弱,形成更多的游离氨基和羟基,这有利于发挥其生物活性[35]。也有研究发现较低的分子量会让多糖的空间结构变得不稳定,造成生物活性的降低[34],因此有必要深入了解分子量大小与多糖活性的关系。此外,天麻多糖在酶解前后都有两个主要组分,且分子量大小差异较大,哪些组分在抗氧化活性中发挥了更显著的效果仍值得进一步探讨。同时本研究发现,酶解后天麻多糖的阿拉伯糖、半乳糖和岩藻糖含量增加,这可能是多糖抗氧化活性提高的另一个原因。在前人的研究中发现单糖组成及其比例的变化可能影响其生物活性,Lin等[35]发现半乳糖含量与金针菇多糖的抗氧化活性呈正相关(P<0.05),Yi等[36]发现经蒸汽爆破预处理后牛膝多糖中阿拉伯糖、半乳糖和糖醛酸的含量增加,提高了其对ABTS+、DPPH、羟基自由基和超氧阴离子的体外清除活性。
3. 结论
本研究利用α-淀粉酶降解天麻多糖,以还原糖生成量为指标优化酶解工艺。结果表明,最佳酶解工艺为:酶添加量460 U/g,酶解时间100 min,酶解温度60 ℃,酶解pH5.4,在最佳工艺下天麻多糖酶解后还原糖生成量为0.441 mg/mL。酶解后天麻多糖的溶解率从81.28%提高到93.57%,两个多糖组分的分子量都显著降低(P<0.05),天麻多糖的网状结构被破坏,变为片状结构,而单糖组成和官能团结构没有明显变化。此外,酶处理后天麻多糖抗氧化活性得以显著提升(P<0.05)。这些发现表明能够使用α-淀粉酶处理来对天麻多糖进行修饰,从而改善天麻多糖性质和生物活性,也为进一步解析天麻多糖的构效关系提供了一定的理论依据。
-
图 10 酶解前后天麻多糖对DPPH自由基清除率的影响
注:VC为维生素C;不同小写字母表示相同质量浓度下不同处理组存在显著性差异(P<0.05),图11同。
Figure 10. Effect of G. elata polysaccharide on DPPH free radical clearance before and after enzymatic hydrolysis
表 1 响应面优化试验因素与水平
Table 1 Factors and levels of response surface optimized experiment
水平因素 A酶添加量( U/g) B酶解时间(min) C酶解pH −1 400 60 5 0 500 90 6 1 600 120 7 表 2 响应面试验设计及结果
Table 2 Experimental design and results of response surface
试验号 A酶添加量(U/g) B酶解时间(min) C酶解pH 还原糖生成量(mg/mL) 1 500 90 6 0.444±0.001 2 500 60 7 0.430±0.001 3 400 90 7 0.427±0.003 4 500 90 6 0.455±0.001 5 600 90 7 0.417±0.001 6 400 120 6 0.437±0.001 7 500 90 6 0.452±0.002 8 500 120 7 0.420±0.001 9 400 90 5 0.435±0.003 10 600 90 5 0.418±0.002 11 600 120 6 0.411±0.003 12 400 60 6 0.425±0.001 13 600 60 6 0.426±0.001 14 500 90 6 0.454±0.004 15 500 120 5 0.419±0.001 16 500 60 5 0.434±0.003 17 500 90 6 0.441±0.001 表 3 回归方程的方差分析
Table 3 Analysis of variance for the fitted regression equation
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 0.0027410 9 0.0003045 9.50 0.0036 ** A 0.0003380 1 0.000338 10.55 0.0141 * B 0.0000980 1 0.000098 3.06 0.1238 C 0.0000180 1 0.000018 0.56 0.4780 AB 0.0001823 1 0.0001823 5.69 0.0485 * AC 0.0000123 1 0.00001225 0.38 0.5560 BC 0.0000063 1 0.00000625 0.20 0.6721 A2 0.0007088 1 0.0007088 22.12 0.0022 ** B2 0.0005544 1 0.0005544 17.30 0.0042 ** C2 0.0006038 1 0.0006038 18.84 0.0034 ** 残差 0.0002243 7 0.00003204 失拟项 0.0000655 3 0.00002183 0.55 0.6746 不显著 纯误差 0.0001588 4 0.0000397 总差 0.0029650 16 注:P<0.05代表显著,以“*”表示;P<0.01代表极显著,以“**”表示。 表 4 酶解前后天麻多糖溶解率的变化
Table 4 Changes of dissolution rate of G. elata polysaccharide before and after enzymatic hydrolysis
样品 溶解率(%) 酶解前天麻多糖 81.82±0.02b 酶解后天麻多糖 93.57±0.05a 注:不同小写字母表示差异显著,P<0.05。 表 5 酶解前后天麻多糖的单糖组成及其含量的变化
Table 5 Changes of monosaccharide composition and content of G. elata polysaccharide before and after enzymatic hydrolysis
样品 葡萄糖
(%)古罗糖醛酸
(%)甘露糖
(%)氨基葡萄糖
(%)核糖
(%)鼠李糖
(%)葡萄糖醛酸
(%)半乳糖醛酸
(%)半乳糖
(%)阿拉伯糖
(%)岩藻糖
(%)GEP 97.97 0.05 0.37 0.02 0.02 0.12 0.01 0.36 0.43 0.31 0.34 E-GEP 97.26 0.04 0.30 0.02 0.01 0.13 0.01 0.29 1.07 0.43 0.44 注:GEP为酶解前天麻多糖;E-GEP为酶解后天麻多糖。 -
[1] LEE D K, LIM D K, UM J A, et al. Evaluation of four different analytical tools to determine the regional origin of Gastrodia elata and Rehmannia glutinosa on the basis of metabolomics study[J]. Molecules,2014,19(5):6294−6308. doi: 10.3390/molecules19056294
[2] HSIEH C L, CHIANG S Y, CHENG K S, et al. Anticonvulsive and free radicalscavenging activities of Gastrodia elata Bl. in kainic acid-treated rats[J]. The American Journal of Chinese Medicine,2001,29(2):331−341. doi: 10.1142/S0192415X01000356
[3] WU C R, HSIEH M T, HUANG S C, et al. Effects of Gastrodia elata and its active constituents on scopolamine-induced amnesia in rats[J]. Planta Medica,1996,62(4):317−321. doi: 10.1055/s-2006-957892
[4] WANG Z W, LI Y, LIU D H, et al. Four new phenolic constituents from the rhizomes of Gastrodia elata Blume[J]. Natural Product Research,2019,33(8):1140−1146. doi: 10.1080/14786419.2018.1460836
[5] LIU Z K, NG C F, SHIU H T, et al. Neuroprotective effect of Da Chuanxiong Formula against cognitive and motor deficits in a rat controlled cortical impact model of traumatic brain injury[J]. Journal of Ethnopharmacology,2018,217:11−22. doi: 10.1016/j.jep.2018.02.004
[6] ZHAN H D, ZHOU H Y, SUI Y P, et al. The rhizome of Gastrodia elata Blume–An ethnopharmacological review[J]. Journal of Ethnopharmacology,2016,189:361−385. doi: 10.1016/j.jep.2016.06.057
[7] 吴国真, 贾传青, 王晓, 等. 天麻多糖的提取、纯化及药理活性研究进展[J]. 中华中医药学刊,2022,40(7):135−139. [WU Gouzhen, JIA Chuanqing, WANG Xiao, et al. Research progress on extraction, purification and pharmacological activities of Gastrodiae Rhizoma polysaccharides[J]. China Archives of Traditional Chinese Medicine,2022,40(7):135−139.] WU Gouzhen, JIA Chuanqing, WANG Xiao, et al. Research progress on extraction, purification and pharmacological activities of Gastrodiae Rhizoma polysaccharides[J]. China Archives of Traditional Chinese Medicine, 2022, 40(7): 135−139.
[8] LI Q, ZENG J, GONG P, et al. Effect of steaming process on the structural characteristics and antioxidant activities of polysaccharides from Polygonatum sibiricum rhizomes[J]. Glycoconjugate Journal,2021,38:561−572. doi: 10.1007/s10719-021-10013-z
[9] WANG Z C, ZHOU X Y, SHU Z H, et al. Regulation strategy, bioactivity, and physical property of plant and microbial polysaccharides based on molecular weight[J]. International Journal of Biological Macromolecules,2023,244:125360. doi: 10.1016/j.ijbiomac.2023.125360
[10] 冀晓龙, 郭建行, 田静源, 等. 植物多糖降解方法及降解产物特性研究进展[J]. 轻工学报,2023,38(3):55−62. [JI Xiaolong, GUO Jianxing, TIAN Jingyuan, et al. Research progress on degradation methods and product properties of plant polysaccharides[J]. Journal of Light Industry,2023,38(3):55−62.] JI Xiaolong, GUO Jianxing, TIAN Jingyuan, et al. Research progress on degradation methods and product properties of plant polysaccharides[J]. Journal of Light Industry, 2023, 38(3): 55−62.
[11] 王聪聪, 周剑丽, 顾秋亚, 等. 产岩藻多糖酶菌株的筛选及其酶解制备低分子质量岩藻多糖的研究[J]. 食品与发酵工业,2022,48(23):49−56. [WANG Congcong, ZHOU Jianli, GU Qiuya, et al. Screening of fucoidanase-producing strains and preparation of low molecular weight fucoidan by enzymatic hydrolysis[J]. Food and Fermentation Industries,2022,48(23):49−56.] WANG Congcong, ZHOU Jianli, GU Qiuya, et al. Screening of fucoidanase-producing strains and preparation of low molecular weight fucoidan by enzymatic hydrolysis[J]. Food and Fermentation Industries, 2022, 48(23): 49−56.
[12] WU Q, QIN D D, CAO H X, et al. Enzymatic hydrolysis of polysaccharide from Auricularia auricula and characterization of the degradation product[J]. International Journal of Biological Macromolecules,2020,162:127−135. doi: 10.1016/j.ijbiomac.2020.06.098
[13] HU T G, ZOU Y X, LI E N, et al. Effects of enzymatic hydrolysis on the structural, rheological, and functional properties of mulberry leaf polysaccharide[J]. Food Chemistry,2021,355:129608. doi: 10.1016/j.foodchem.2021.129608
[14] LIU X P, REN Z, YU R H, et al. Structural characterization of enzymatic modification of Hericium erinaceus polysaccharide and its immune-enhancement activity[J]. International Journal of Biological Macromolecules,2021,166:1396−1408. doi: 10.1016/j.ijbiomac.2020.11.019
[15] 贾俊强, 沈健, 陈炼, 等. 蛹虫草多糖的酶法修饰及其抗氧化活性[J]. 食品科学, 2013, 34(1):114−120. [JIA Junqiang, SHEN Jian, CHEN Lian, et al. Enzymatic modification and antioxidant activity of polysaccharides from cordyceps militaris fruit bodies[J]. Food Science, 2013, 34(1):114−120.] JIA Junqiang, SHEN Jian, CHEN Lian, et al. Enzymatic modification and antioxidant activity of polysaccharides from cordyceps militaris fruit bodies[J]. Food Science, 2013, 34(1): 114−120.
[16] 马风伟, 李莹, 潘成, 等. 不同采收期乌天麻中多糖的提取及含量测定[J]. 食品研究与开发,2018,39(22):47−51,90. [MA Fengwei, LI Ying, PAN Cheng, et al. Extraction and content determination of polysaccharides from Rhizoma gastrodiae of different harvest periods[J]. Food Research and Development,2018,39(22):47−51,90.] MA Fengwei, LI Ying, PAN Cheng, et al. Extraction and content determination of polysaccharides from Rhizoma gastrodiae of different harvest periods[J]. Food Research and Development, 2018, 39(22): 47−51,90.
[17] 吴迪, 王旭升, 于特, 等. β-葡聚糖酶降解黑木耳多糖工艺研究[J]. 食品研究与开发,2022,43(6):130−135. [WU Di, WANG Xusheng, YU Te, et al. Optimization of β-Glucanase degradation of Auricularia auricula polysaccharides[J]. Food Research and Development,2022,43(6):130−135.] WU Di, WANG Xusheng, YU Te, et al. Optimization of β-Glucanase degradation of Auricularia auricula polysaccharides[J]. Food Research and Development, 2022, 43(6): 130−135.
[18] 牟佳红, 梁安雯, 覃超琳, 等. 酶解与发酵联合处理对黑木耳还原糖含量及抗氧化性能的影响[J]. 食品工业科技,2022,43(7):139−147. [MU Jiahong, LIANG Anwen, QIN Chaolin, et al. Effect of enzymatic hydrolysis combined with fermentation treatment on reducing sugar content and antioxidant performance of Auricularia auricula[J]. Science and Technology of Food Industry,2022,43(7):139−147.] MU Jiahong, LIANG Anwen, QIN Chaolin, et al. Effect of enzymatic hydrolysis combined with fermentation treatment on reducing sugar content and antioxidant performance of Auricularia auricula[J]. Science and Technology of Food Industry, 2022, 43(7): 139−147.
[19] 曹慧馨, 吴迪, 王旭升, 等. 黑木耳多糖的降解及其产物抗氧化性[J]. 食品研究与开发,2022,43(10):15−21. [CAO Huixin, WU Di, WANG Xusheng, et al. Degradation of Auricularia auricula polysaccharide and antioxidant activity of its products[J]. Food Research and Development,2022,43(10):15−21.] CAO Huixin, WU Di, WANG Xusheng, et al. Degradation of Auricularia auricula polysaccharide and antioxidant activity of its products[J]. Food Research and Development, 2022, 43(10): 15−21.
[20] YANG T H, CHIU C Y, LU T J, et al. The anti-obesity effect of polysaccharide-rich red algae (Gelidium amansii) hot-water extracts in high-fat diet-induced obese hamsters[J]. Marine Drugs,2019,17(9):532. doi: 10.3390/md17090532
[21] 胡卫珍, 齐振宇, 陈晓芳, 等. 凝胶渗透色谱联用多角度激光光散射测定铁皮石斛多糖分子量及其分布[J]. 浙江农业科学,2020,61(6):1166−1167,1175. [HU Weizhen, QI Zhenyu, CHEN Xiaofang, et al. Gel permeation chromatography coupled multi-angle laser light scattering to determine Dendrobium officinale polysaccharide molecular weight and its distribution[J]. Journal of Zhejiang Agricultural Sciences,2020,61(6):1166−1167,1175.] HU Weizhen, QI Zhenyu, CHEN Xiaofang, et al. Gel permeation chromatography coupled multi-angle laser light scattering to determine Dendrobium officinale polysaccharide molecular weight and its distribution[J]. Journal of Zhejiang Agricultural Sciences, 2020, 61(6): 1166−1167,1175.
[22] 陈淑琼, 李晓月, 吴晨烁, 等. 酶解制备褐藻寡糖工艺优化及活性研究[J]. 食品研究与开发,2019,40(13):51−56. [CHEN Shuqiong, LI Xiaoyue, WU Chenshuo, et al. Optimization of process conditions and activity for enzymatic hydrolysis of sodium alginate[J]. Food Research and Development,2019,40(13):51−56.] CHEN Shuqiong, LI Xiaoyue, WU Chenshuo, et al. Optimization of process conditions and activity for enzymatic hydrolysis of sodium alginate[J]. Food Research and Development, 2019, 40(13): 51−56.
[23] ACOSTA O, VIQUEZ F, CUBERO E, et al. Optimisation of low calorie mixed fruit jelly by response surface methodology[J]. Food Quality and Preference,2008,19(1):79−85. doi: 10.1016/j.foodqual.2007.06.010
[24] HUO J Y, LEI M, LI F F, et al. Structural characterization of a polysaccharide from Gastrodia elata and its bioactivity on gut microbiota[J]. Molecules,2021,26(15):4443. doi: 10.3390/molecules26154443
[25] HUO J Y, LEI M, ZHOU Y, et al. Structural characterization of two novel polysaccharides from Gastrodia elata and their effects on Akkermansia muciniphila[J]. International Journal of Biological Macromolecules,2021,186:501−509. doi: 10.1016/j.ijbiomac.2021.06.157
[26] LEE O H, KIM K I, HAN C K, et al. Effects of acidic polysaccharides from Gastrodia rhizome on systolic blood pressure and serum lipid concentrations in spontaneously hypertensive rats fed a high-fat diet[J]. International Journal of Molecular Sciences,2012,13(1):698−709. doi: 10.3390/ijms13010698
[27] 常相娜, 陈雪峰, 苏瑶. 酶解苹果渣中多糖的结构分析及其体外抗氧化活性[J]. 陕西科技大学学报,2022,40(5):63−69. [CHANG Xiangna, CHEN Xuefeng, SU Yao. Structure annlysis and in vitro antioxidant activity of polysaccharides form enzymatic hydrolysis apple pomace[J]. Journal of Shaanxi University of Science and Technology,2022,40(5):63−69.] doi: 10.3969/j.issn.1000-5811.2022.05.007 CHANG Xiangna, CHEN Xuefeng, SU Yao. Structure annlysis and in vitro antioxidant activity of polysaccharides form enzymatic hydrolysis apple pomace[J]. Journal of Shaanxi University of Science and Technology, 2022, 40(5): 63−69. doi: 10.3969/j.issn.1000-5811.2022.05.007
[28] 杜国丰, 尹梦琪, 梁飞龙, 等. 微波辅助 H2O2/VC 降解制备低分子量浒苔多糖的研究[J]. 食品工业科技,2023,44(12):37−44. [DU Guofeng, YIN Mengqi, LIANG Feilong, et al. Preparation of low-molecular-weight Enteromorpha polysaccharides by microwave-assisted degradation with H2O2/VC[J]. Science and Technology of Food Industry,2023,44(12):37−44.] DU Guofeng, YIN Mengqi, LIANG Feilong, et al. Preparation of low-molecular-weight Enteromorpha polysaccharides by microwave-assisted degradation with H2O2/VC[J]. Science and Technology of Food Industry, 2023, 44(12): 37−44.
[29] CHEN J C, TIAN S, SHU X Y, et al. Extraction, characterization and immunological activity of polysaccharides from Rhizoma gastrodiae[J]. International Journal of Molecular Sciences,2016,17(7):1011. doi: 10.3390/ijms17071011
[30] ZHU Z Y, CHEN C J, SUN H Q, et al. Structural characterisation and ACE-inhibitory activities of polysaccharide from Gastrodia elata Blume[J]. Natural Product Research,2019,33(12):1721−1726. doi: 10.1080/14786419.2018.1434643
[31] MING J, LIU J, WU S R, et al. Structural characterization and hypolipidemic activity of a polysaccharide PGEB-3H from the fruiting bodies of Gastrodia elata Blume[J]. Procedia Engineering,2012,37:169−173. doi: 10.1016/j.proeng.2012.04.221
[32] ZHAO Z Z, FU C, ZHANG Y P, et al. Dimeric histidine as a novel free radical scavenger alleviates non-alcoholic liver injury[J]. Antioxidants,2021,10(10):1529. doi: 10.3390/antiox10101529
[33] 王欣, 徐宝成, 罗登林, 等. 植物源天然抗氧化物质基本特征及其在食用油中的应用研究进展[J]. 西北农林科技大学学报(自然科学版),2022,50(4):135−143,154. [WANG Xin, XU Baocheng, LUO Denglin, et al. Basic characteristics of plant-derived natural antioxidants and their application in edible oils:A review[J]. Journal of Northwest A& F University(Natural Science Edition),2022,50(4):135−143,154.] WANG Xin, XU Baocheng, LUO Denglin, et al. Basic characteristics of plant-derived natural antioxidants and their application in edible oils: A review[J]. Journal of Northwest A& F University(Natural Science Edition), 2022, 50(4): 135−143,154.
[34] 周雪艳, 常贺, 苟海芹, 等. 分子量影响多糖生物活性的研究进展[J]. 河南工业大学学报(自然科学版),2024,45(1):124−132. [ZHOU Xueyan, CHANG He, GOU Haiqin, et al. Advances in research of molecular weight affecting the bioactivity of polysaccharides[J]. Journal of Henan University of Technology(Natural Science Edition),2024,45(1):124−132.] ZHOU Xueyan, CHANG He, GOU Haiqin, et al. Advances in research of molecular weight affecting the bioactivity of polysaccharides[J]. Journal of Henan University of Technology(Natural Science Edition), 2024, 45(1): 124−132.
[35] LIN L, CUI F Y, ZHANG J J, et al. Antioxidative and renoprotective effects of residue polysaccharides from Flammulina velutipes[J]. Carbohydrate Polymers,2016,146:388−395. doi: 10.1016/j.carbpol.2016.03.071
[36] YI J P, LI X, WANG S, et al. Steam explosion pretreatment of Achyranthis bidentatae radix:Modified polysaccharide and its antioxidant activities[J]. Food Chemistry,2022,375:131746. doi: 10.1016/j.foodchem.2021.131746





 下载:
下载:
 下载:
下载:



