Structure, Immune and Anti-aging Activities of Capsular Polysaccharide Produced by Lactobacillus plantarum W1
-
摘要: 为了初步探究植物乳杆菌W1荚膜多糖(CPS)的结构及生物活性。本研究采用酶解法提取制备CPS,通过凝胶渗透色谱系统、傅里叶红外光谱和高效液相色谱法分析其绝对分子量、官能团和单糖组成,并利用RAW264.7细胞和秀丽隐杆线虫模型,评估CPS的免疫和抗衰老活性。结果表明,CPS是一种平均分子量为5.49×104 Da,由葡萄糖和半乳糖组成的杂多糖,其单糖摩尔比为3.12:1。CPS可以促进RAW264.7细胞的增殖和对中性红的吞噬作用,促进NO和细胞因子的分泌,从而发挥免疫调节作用;125 μg/mL剂量下,RAW264.7细胞的TNF-α、IL-6、IL-1β的分泌水平达到最大值,分别为对照组的1.26倍、1.11倍、1.96倍。同时,CPS可显著提升线虫的抗氧化体系(P<0.05),延长其寿命,并提高其应激耐受性。正常、氧化应激和热休克环境下线虫的平均寿命均在125 μg/mL处理剂量下达到最大值,寿命延长率分别为21.05%±0.21%、42.86%±0.27%和50.00%±0.27%。以上研究结果表明CPS具有良好的生物活性,具有开发为功能性辅料应用于食品中的潜力。Abstract: In order to preliminarily explore the structure, immune and anti-aging activity of capsular polysaccharide (CPS) produced by Lactobacillus plantarum W1. In this study, CPS was extracted and prepared by enzymatic hydrolysis. The absolute molecular weight, functional groups and monosaccharide composition of CPS were analyzed by gel permeation chromatography system, Fourier transform infrared spectroscopy and high performance liquid chromatography. The immune and anti-aging activities of CPS were investigated using RAW264.7 cells and Caenorhabditis elegans (C. elegans) models. The results showed that CPS was a heteropolysaccharide with an average molecular weight of 5.49×104 Da, consisting of glucose and galactose in a molar ratio of 3.12:1. Furthermore, CPS had been found to enhance the proliferation and phagocytosis of RAW264.7 cells, as well as promote the secretion of NO and cytokines, thereby exerting an immunomodulatory effect. At a concentration of 125 μg/mL, the secretion levels of TNF-α, IL-6 and IL-1β in RAW264.7 cells reached their maximum values, which were 1.26 times, 1.11 times and 1.96 times higher than those in the control group, respectively. Concurrently, CPS significantly enhanced the antioxidant system of C. elegans (P<0.05), prolonged their lifespan, and improved their stress tolerance. The average lifespan of nematodes under normal, oxidative stress and heat shock conditions reached its maximum at 125 μg/mL, with lifespan extension rates of 21.05%±0.21%, 42.86%±0.27% and 50.00%±0.27%, respectively. These findings indicate that CPS exhibits significant biological activity and has the potential to be utilized as functional excipients in food products.
-
Keywords:
- capsular polysaccharide /
- macrophage /
- immune activity /
- Caenorhabditis elegans
-
乳酸菌(lactic acid bacteria,LAB)是一类能发酵碳水化合物产生乳酸的革兰氏阳性菌的总称,是食品工业中常用的一类益生菌。乳酸菌胞外多糖(exopoly saccharides,EPS)是微生物在生长发育过程中分泌到周围环境中的一类高分子聚合物,往往通过多个单糖以糖苷键的形式连接而成[1]。按其与菌体的依附关系分为分泌到细胞壁外的粘液多糖(RPS)和与细胞壁紧密结合的荚膜多糖(CPS)[2]。乳酸菌胞外多糖具有高粘度和优良的流变学特性,因此常常作为乳化剂、增稠剂和稳定剂用于食品工业中改善食品的质地和口感[3]。CPS因其附着于细胞表面,在对细胞的保护和生理活性作用方面发挥着十分重要的作用。Wang等[4]研究发现L. plantarum JLAU103的EPS通过增强RAW264.7巨噬细胞的吞噬活性,促进细胞因子IL-6、TNF-α和NO的分泌来发挥免疫调节作用;与之作用类似的还有瑞士乳杆菌LZ-R-5和戊糖乳杆菌LZ-R-17的EPS[5−6]。目前,对乳酸菌源EPS调节免疫活性的研究主要集中在RPS上,而对CPS的研究相对较少。基于乳酸菌对人体潜在的益生作用和对微生物细胞的保护作用,有必要对乳酸菌源CPS进一步研究。
巨噬细胞在人体免疫系统中起着非常重要的作用。它们通过吞噬和降解凋亡细胞、微生物及肿瘤细胞,从而维持机体的平衡[7]。人体的免疫系统复杂而高效,当人体受到细菌、病毒等原微生物入侵时,巨噬细胞就会立刻将其吞噬掉,进而实现免疫调节。巨噬细胞表面存在多种多糖的受体,这些受体能够识别多糖类物质,如细菌表面的多糖、病毒表面的糖蛋白等,二者结合能够激活巨噬细胞释放细胞因子和趋化因子,引发炎症反应,并吞噬和降解病原微生物,发挥免疫调节作用[8−10]。有报道称,免疫功能失调会加速机体的衰老。Garcia-Vello等[11]对植物乳杆菌IMB19分泌的荚膜物质进行分离纯化得到纯荚膜多糖(CPS-100)和磷酸壁(CPS-400),对两种荚膜物质进行免疫分析发现CPS-100是主要的免疫刺激物,其能通过促进TNF-α、IL-6、IL-12和IL-10的分泌,来发挥免疫调节作用。Wang等[12]研究表明发酵乳杆菌GBJ的CPS可通过促进RAW264.7细胞的增殖和吞噬作用,增加NO和细胞因子的分泌,从而发挥免疫调节活性。以上研究发现乳酸菌荚膜多糖具有良好的免疫活性,值得进一步探究。
秀丽隐杆线虫(Caenorhabditis elegans)以细菌为食,具有寿命短、繁殖能力强、易于培养和操作[13−14]、与人类基因同源度高等优点[15−16],使其成为生物学研究领域的热门模式生物。对秀丽隐杆线虫寿命的研究有助于了解人类的寿命健康情况及衰老过程。线虫衰老的标志有许多,例如寿命缩短、脂褐素浓度升高、运动能力和应激能力下降以及神经系统退化等[17],这些指标可以用于研究衰老过程。有报道称,多糖的添加可以缓解衰老。例如,Hui等[18]研究发现百合根多糖能以剂量依赖的方式有效缓解秀丽隐杆线虫的衰老。此外,三七和白芨多糖能通过增强秀丽隐杆线虫的抗逆性从而延长其寿命[19−20]。然而,关于乳酸菌CPS影响线虫寿命的相关研究较少,因此利用线虫作为模式生物探索乳酸菌CPS的生物活性具有重要意义。
本实验对植物乳杆菌W1的CPS进行提取,通过测定RAW246.7细胞的中性红吞噬率、酸性磷酸酶活性指数、NO和细胞因子的分泌水平来评价CPS的免疫调节活性;以秀丽隐杆线虫为模型,通过测定体内抗氧化水平、寿命、热/氧应激以及生殖能力等指标来探究CPS的抗衰老活性,以期为乳酸菌CPS在抗衰老及免疫调节方面的研究提供参考,并为开发抗衰老、免疫活性的功能性食品提供理论依据。
1. 材料与方法
1.1 材料与仪器
植物乳杆菌W1(Lactiplantibacillus plantarum W1,Genbank 登录号:MK235131) 从贵州酸菜中自主分离,采用甘油管保藏法冻存于−20 ℃中;小鼠单核巨噬细胞RAW246.7 中国科学院上海细胞库;秀丽隐杆线虫N2野生型(Caenorhabditis elegans)、基因敲除型大肠杆菌(Escherichia coli OP50) 秀丽隐杆线虫遗传学中心;透析袋MD44(截留分子量为8000~14000 Da)、双抗(青/链霉素) 北京索莱宝公司;胎牛血清(FBS)、二甲基亚砜(DMSO) 美国Clark-Bioscience公司;脂多糖(LPS) 合肥博美生物公司;中性红溶液、酸性磷酸酶试剂盒 上海碧云天生物有限公司;肿瘤坏死因子-α(TNF-α)、白介素-β(IL-1β)、白介素-6(IL-6)试剂盒 上海朗顿生物技术有限公司;一氧化氮(NO)试剂盒、总抗氧化试剂盒(T-AOC)、超氧化物歧化酶试剂盒(T-SOD) 南京建成生物工程研究所;1-苯基-3-甲基-5-吡唑啉酮(PMP)、无水乙醇、噻唑兰(MTT)、甲醇、氯仿 均为国产分析纯;HP培养基:20 g葡萄糖、20 g大豆蛋白胨、5 g柠檬酸铵、5 g酵母粉、0.05 g硫酸锰、0.4 g硫酸镁、0.07 g硫酸亚铁、1 mL吐温-80加热溶解后定容至1 L蒸馏水中,121 ℃高压灭菌15 min备用。
Twnsor-27 型傅立叶变换红外光谱仪 德国布鲁克公司;VICTOR NIVOTM发光酶标仪 美国PerkinElmer公司;DM750光学显微镜 德国莱卡公司;Agilent 1260 II HPLC型液相色谱仪 美国安捷伦科技有限公司;U3000液相系统 美国赛默飞世尔科技公司;OPTILAB T-rex示差检测器、DAWN HELEOS-Ⅱ激光光散射检测器 美国怀雅特技术公司。
1.2 实验方法
1.2.1 L. plantarum W1 CPS的提取
CPS的提取参考Uemura等[21]报道的方法略加修改。将甘油管中保藏菌种活化两次后,按3%(v/v)的接种量重新接种于新鲜培养基中,在30 ℃下培养24 h产生CPS。将培养后的菌体于8000×g,4 ℃条件下离心10 min,收集菌体;加入发酵液1/4体积的生理盐水清洗菌体,再次离心收集菌体并加入发酵液1/3体积含20 mg/L溶菌酶的磷酸盐缓冲液(pH6.7,10 mmol/L),然后于37 ℃,140 r/min条件下恒温振荡48 h;离心取上清经减压浓缩后75%乙醇醇沉过夜,沉淀重溶于水后透析,冻干备用。CPS的产量参照公式计算:
CPS产量(mg/L)=CPS干重的质量(mg)发酵液体积(L) 1.2.2 常规组成成分分析
分别采用苯酚-硫酸法以葡萄糖为标品测定样品中性糖含量(回归方程:y=1.8493x+0.0196,R2=0.9996);考马斯亮蓝法以牛血清白蛋白为标品测定蛋白含量(回归方程:y=0.0057x+0.2289,R2=0.9978),硫酸钡比浊法以硫酸钾作为标品测定硫酸基含量(回归方程:y=1.0723x+0.0003,R2=0.9988);间羟基联苯比浊法以葡萄糖醛酸作为标品测定糖醛酸含量(回归方程:y=0.0145x−0.0032,R2=0.9991)[22]。
1.2.3 CPS分子量的测定
将CPS以1 mg/mL浓度溶解于0.1 mol/L NaNO3水溶液中。CPS的分子量采用配备DAWN HELEOS-II型激光光度计和OPTILAB T-rex示差检测器的U3000液相系统进行测定。样品的分离采用Ohpak SB-805 HQ(300×8 mm)和Ohpak SB-803 HQ(300×8 mm)凝胶排阻色谱柱串联。色谱条件:柱温45 ℃,进样量100 μL,流动相(0.02% NaN3,0.1 mol/L NaNO3),流速为0.6 mL/min,洗脱时间75 min。
[η]=K⋅Mαv 式中:[η]表示特性粘度;K和α表示Mark-Houwink方程常数;Mv是粘度平均分子量。
1.2.4 CPS的结构表征及理化性质分析
1.2.4.1 单糖组成分析
CPS的单糖组成采用PMP衍生法,根据Wang等[23]的方法略加修改。首先将CPS进行酸水解,取100 µL水解后样品加入100 µL 0.6 mol/L NaOH。取100 µL上述混合液,并加入100 µL 0.5 mol/L的PMP甲醇溶液,混匀后置于70 ℃水浴加热100 min,冷却后加100 µL 0.3 mol/L HCl中和反应液。反应混合物旋转蒸发至干,加1 mL蒸馏水和1 mL氯仿,混匀吸取上层(水层),弃氯仿层,重复三次,0.45 µm滤膜过滤后上机检测。分析采用Agilent 1260 II HPLC型液相色谱进行。色谱条件如下:检测柱,ODS-C18柱(4.6×250 nm,5 μm);柱温,30 ℃;流动相,0.1 mol/L PBS(pH6.7)和乙腈比例(v/v)为83:17,流速0.9 mL/min,进样量为20 μL,检测波长245 nm。利用单糖标品对样品的单糖组成进行定量定性分析。
1.2.4.2 紫外和红外光谱分析
将CPS以1 mg/mL浓度溶于去离子水,用UV-1601紫外可见分光光度计在190~700 nm范围内进行扫描分析。
取1 mg CPS粉末与100 mg KBr粉末进行混合,混匀后压片。然后采用Bruker Tensor-27型傅里叶变换红外光谱仪在400~4000 cm−1范围内进行扫描分析。
1.2.5 CPS对RAW264.7细胞免疫活性分析
1.2.5.1 RAW264.7细胞的培养
细胞的培养及传代参照Wang等[12]的方法进行。将RAW246.7细胞在含有10%胎牛血清和1%双抗(青/链霉素)的DMEM培养基中培养,于37 ℃、5% CO2条件下生长传代,取对数生长期的细胞进行实验。
1.2.5.2 细胞活力
采用MTT比色法测定细胞活力[24]。将RAW264.7细胞(2×105个/mL)接种于96孔板,每孔100 μL,培养24 h后,弃去上清液,分别用对照组(不含CPS)、31.25、62.5、125、250和500 μg/mL的CPS处理细胞24 h,设置未接种细胞的孔为空白组。弃去培养基,每孔加入100 μL的MTT(1 mg/mL)溶液处理4 h,吸去上清液,每孔中加入100 μL DMSO溶液,轻微振荡以溶解结晶,室温放置10 min,用酶联免疫检测仪于490 nm波长下测定吸光度OD值。细胞存活率参照公式计算:
细胞存活率(%)=样品OD值−空白OD值对照OD值−空白OD值×100 1.2.5.3 细胞吞噬能力
采用中性红法测定细胞吞噬能力[5]。按照1.2.5.2中的细胞培养与分组的方式设置空白组和实验组,以1 μg/mL的LPS为阳性对照组进行操作。培养结束后弃上清,每孔加入100 μL体积分数0.1%的中性红染液,置于37 ℃后孵育2 h后,使用0.1 mol/L PBS洗涤3次以去除过量的中性红溶液。最后,向每个孔中添加100 μL细胞裂解液在540 nm处测定吸光度OD值。吞噬率参照公式计算:
吞噬率(%)=样品组OD值−空白组OD值对照组OD值−空白组OD值×100 1.2.5.4 酸性磷酸酶活性
参照Yuan等[25]的方法略加修改进行测定。按照1.2.5.3中的方法进行细胞培养及分组。培养结束后,弃上清每孔加入40 μL 1% Triton X-100,置于37 ℃孵育10 min,然后按照试剂盒说明书进行操作,在405 nm处测定OD值。酸性磷酸酶活性指数参照公式计算:
酸性磷酸酶活性指数=样品组OD值对照组OD值 1.2.5.5 一氧化氮(NO)和细胞因子分泌水平
按照1.2.5.3中的方法对细胞进行分组及培养。培养结束后,每孔吸取50 μL上清液于96孔板中,NO和细胞因子(TNF-α、IL-6、IL-1β)分泌量均按照试剂盒说明书进行操作。
1.2.6 CPS对线虫抗衰老活性影响的研究
1.2.6.1 T-AOC、超氧化物歧化酶(T-SOD)活力的测定
线虫的培养、传代和同期化操作参照Wang等[12]的研究方法进行。线虫匀浆液的制备:将同期化生长至L4期的成虫全部转移到含有不同浓度多糖(0、31.25、62.5、125、250 μg/mL)和基础食物OP50及终浓度50 μmol/L 5-氟尿嘧啶的线虫生长培养基(Nematode Growth Medium,NGM)平板上,培养4 d,每天更换平板。用M9冲洗平板,收集线虫。将洗净的虫体转移至离心管中,用微量匀浆器匀浆,用0.8%的Chaps缓冲液定容至500 μL,使用冷冻离心机12000 r/min离心10 min,取上清作为待测样品。根据试剂盒说明书进行T-AOC和T-SOD活性的测定。增长率参照公式计算:
增长率(%)=(1−实验组对照组)×100 1.2.6.2 线虫寿命实验
将同期化至L4线虫转移到含有不同浓度CPS(0、31.25、62.5和125 μg/mL)的NGM平板中,每板大约40条,每天转移到新的NGM培养皿中并计数。待线虫全部死亡后采用SPSS软件绘制生存曲线,并对线虫的生存情况进行分析。线虫寿命延长率参照公式计算:
延长率(%)=(1−实验组对照组)×100 1.2.6.3 氧化应激实验
将同期化长至L4期的线虫用不同浓度CPS(0、31.25、62.5和125 μg/mL)处理4 d,然后转移到含有15 mmol/L叔丁基过氧化氢的NGM平板中于23 ℃下继续培养,每板大约40条,2 h计算一次线虫的死亡数。直至所有线虫全部死亡。
1.2.6.4 热应激实验
将同期化后L4期的线虫用不同浓度CPS(0、31.25、62.5和125 μg/mL)处理4 d,然后按照每板大约40条的数量转移至NGM平板上,于35℃下培养。每隔2 h计算一次线虫死亡条数。待线虫全部死亡后,采用SPSS软件绘制生存曲线,并对线虫的生存情况进行分析。
1.2.6.5 生殖能力
将5条同期化长至L4期的线虫转移到不同CPS浓度(0、31.25、62.5和125 μg/mL)的NGM平板上,每24 h转移到新的NGM平板中,直到产卵结束,计算每天产卵数量。
1.3 数据处理
采用SPSS 25.0对数据进行统计分析。Duncan's ANONA 进行多重比较,不同处理之间 P<0.05表明差异性显著。
2. 结果与分析
2.1 CPS的产量、常规组成成分、分子量及单糖组成分析
经酶解法提取所得CPS的产量为235 mg/L。对其常规组成成分进行分析,表明CPS中性糖、蛋白质、硫酸基、糖醛酸的含量分别为93.25%±0.86%、0.03%±0.02%、1.37%±0.02%、1.87%±0.07%。
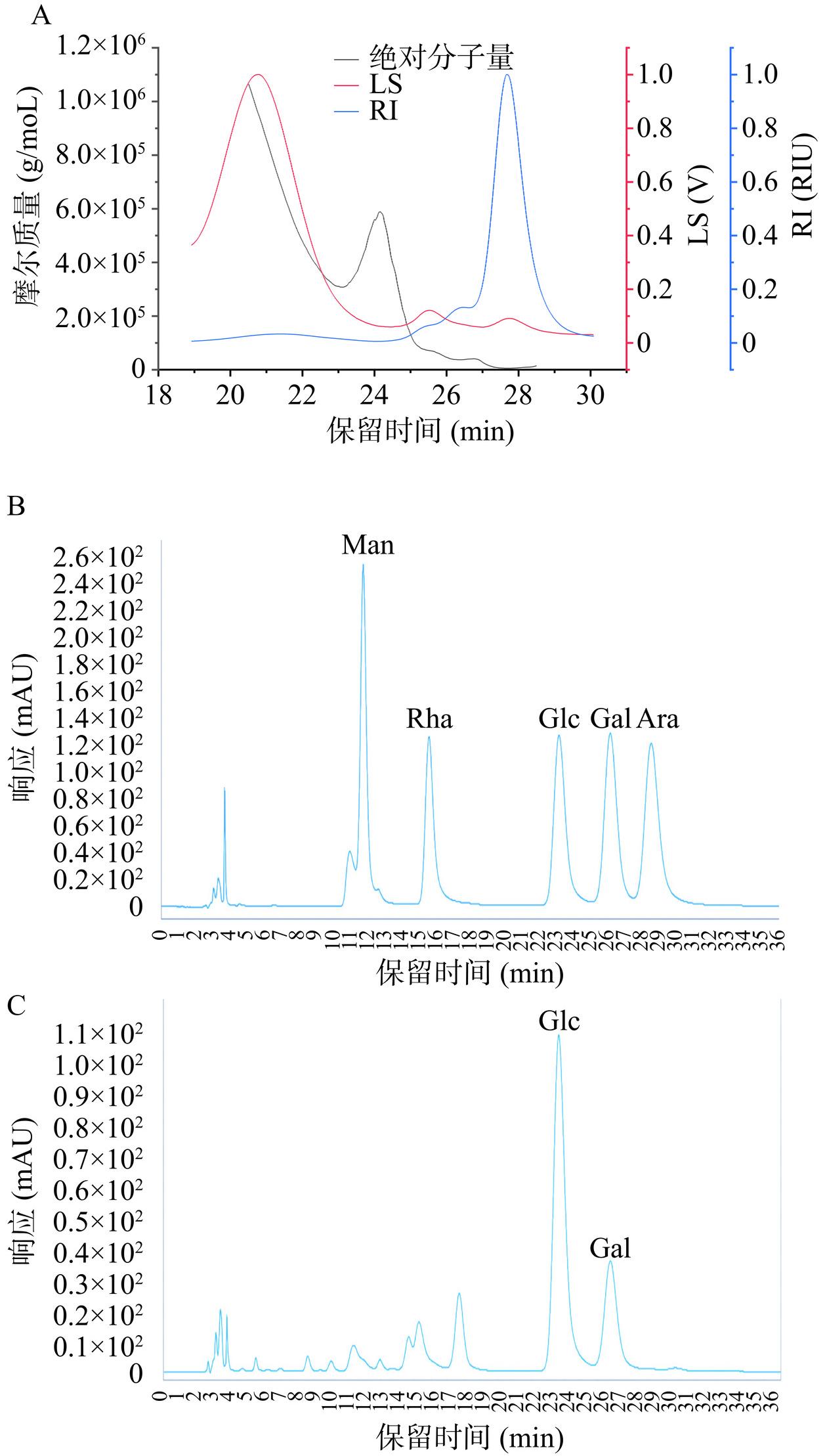
CPS的凝胶渗透色谱分析结果如图1A所示,CPS的示差检测色谱峰主要为一个相对对称的尖峰(保留时间约为27.7 min),表明其分子量组成相对比较集中。经估算其平均分子量为5.49×104 Da。这一分子量高于植物乳杆菌KX041(3.867×104 Da)[26]的EPS,但低于瑞士乳杆菌LZ-R-5(5.41×105 Da)[5]和瑞士乳杆菌MB2-1的EPS(1.83×105 Da)[27],以及植物乳杆菌70810(1.69×105 Da)[22]和发酵乳杆菌S1的CPS(7.19×105 Da)[28]。
![]() 图 1 CPS的凝胶渗透色谱图(A)、单糖标准品(B)和CPS单糖组成(C)液相色谱图注:图1A中红线代表多角度激光光散射信号(即LS,单位是V),蓝色代表示差信号(即RI,单位是RIU),黑线是由两种信号拟合出的摩尔质量(g/moL);甘露糖(Man)、鼠李糖(Rha)、葡萄糖(Glc)、半乳糖(Gal)和阿拉伯糖(Ara)。Figure 1. Gel permeation chromatogram of CPS (A), liquid chromatogram of monosaccharide standard (B) and CPS monosaccharide composition (C)
图 1 CPS的凝胶渗透色谱图(A)、单糖标准品(B)和CPS单糖组成(C)液相色谱图注:图1A中红线代表多角度激光光散射信号(即LS,单位是V),蓝色代表示差信号(即RI,单位是RIU),黑线是由两种信号拟合出的摩尔质量(g/moL);甘露糖(Man)、鼠李糖(Rha)、葡萄糖(Glc)、半乳糖(Gal)和阿拉伯糖(Ara)。Figure 1. Gel permeation chromatogram of CPS (A), liquid chromatogram of monosaccharide standard (B) and CPS monosaccharide composition (C)单糖组成分析(图1B~图1C)显示CPS主要由葡萄糖和半乳糖组成,其摩尔比为3.12:1。该CPS的单糖组成明显不同于之前报道的其他乳酸菌CPS。例如,瑞士乳杆菌MB2-1的CPS主要由葡萄糖、甘露糖和半乳糖组成,摩尔比为3.12:1.01:1.00[27]。发酵乳杆菌S1的CPS主要由甘露糖、鼠李糖、葡萄糖和半乳糖组成,其摩尔比为1.00:3.81:7.96:5.23[28]。植物乳杆菌70810的CPS主要由半乳糖组成[22]。植物乳杆菌LCC-605产生的CPS主要由半乳糖、葡萄糖、甘露糖、核糖、半乳糖醛酸和葡萄糖醛酸组成,其摩尔比为46.7:47.2:4.3:1.1:0.3:0.4[29]。鼠李糖乳杆菌JAAS8的CPS由摩尔比为5:1的半乳糖和N-乙酰葡萄糖胺组成[30]。表明乳酸菌CPS的单糖组成具有菌株特异性,这与文献[24]报道的一致。
2.2 红外光谱与紫外光谱分析
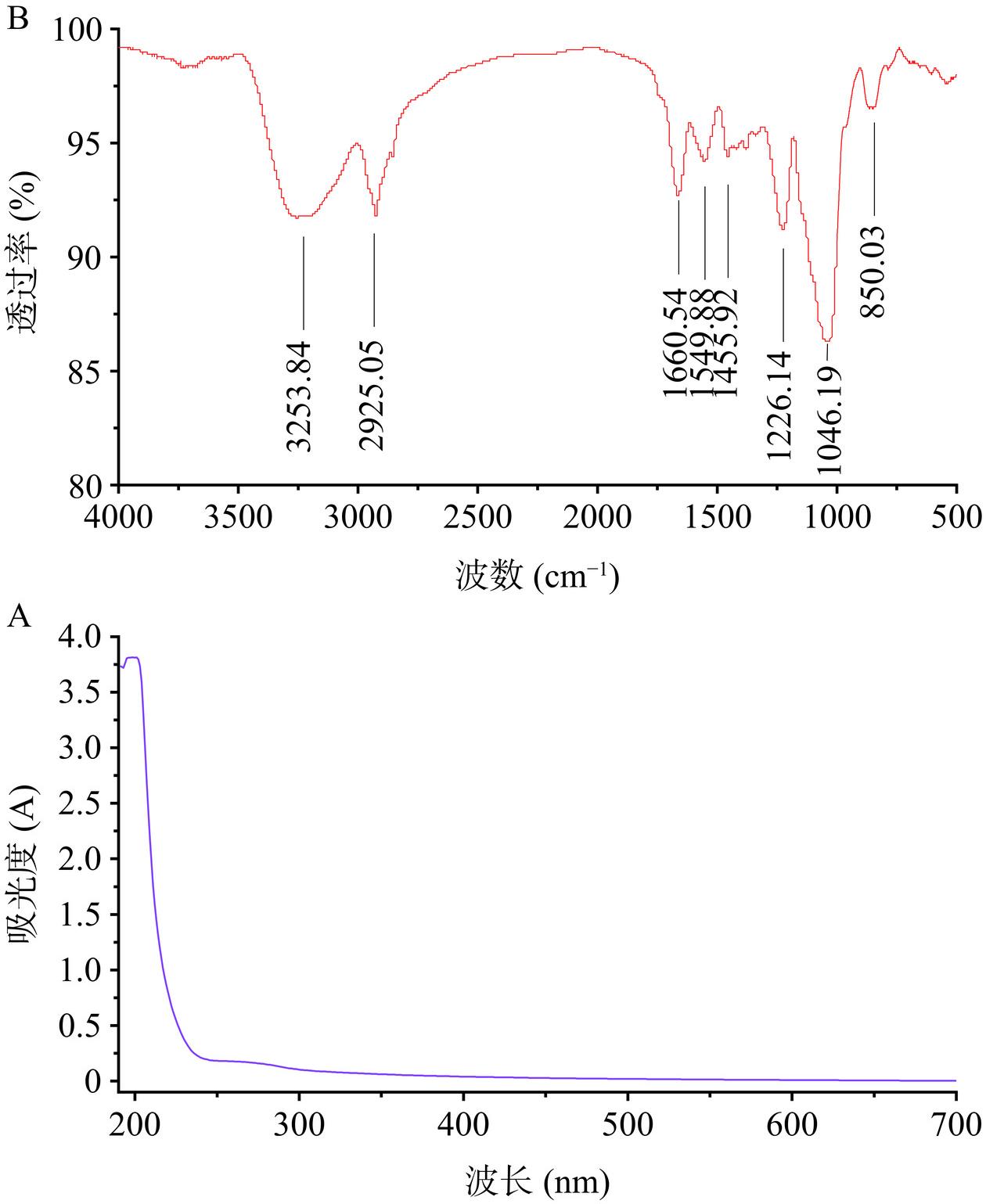
CPS紫外全波长扫描结果如图2A所示,CPS在280 nm处有一定的吸收峰,表明CPS含有少量的蛋白质,这与常规组成成分的结果相符合。
CPS的红外光谱如图2B所示。CPS在4000~500 cm−1范围内具有多糖典型的特征吸收峰[22]。在3253.84 cm−1处的吸收峰为-OH的伸缩振动;2925.05 cm−1处的峰是C-H、C-O键伸缩振动产生的;1660.54、1549.88 cm−1处的峰为C=O和N-H键伸缩振动产生的,表明CPS中可能存在少量的蛋白和糖醛酸;1455.92 cm−1处峰为-CH3伸缩振动峰;1226.14 cm−1处的峰为S=O的吸收峰,表明CPS中可能存在SO42−;而1046.19 cm−1处的峰为吡喃环中-C-O-C-产生的吸收峰;850.03 cm−1处为α构型吡喃环产生的吸收峰,表明CPS的糖环结构主要为α-构型[31]。
2.3 免疫活性分析
2.3.1 细胞活力
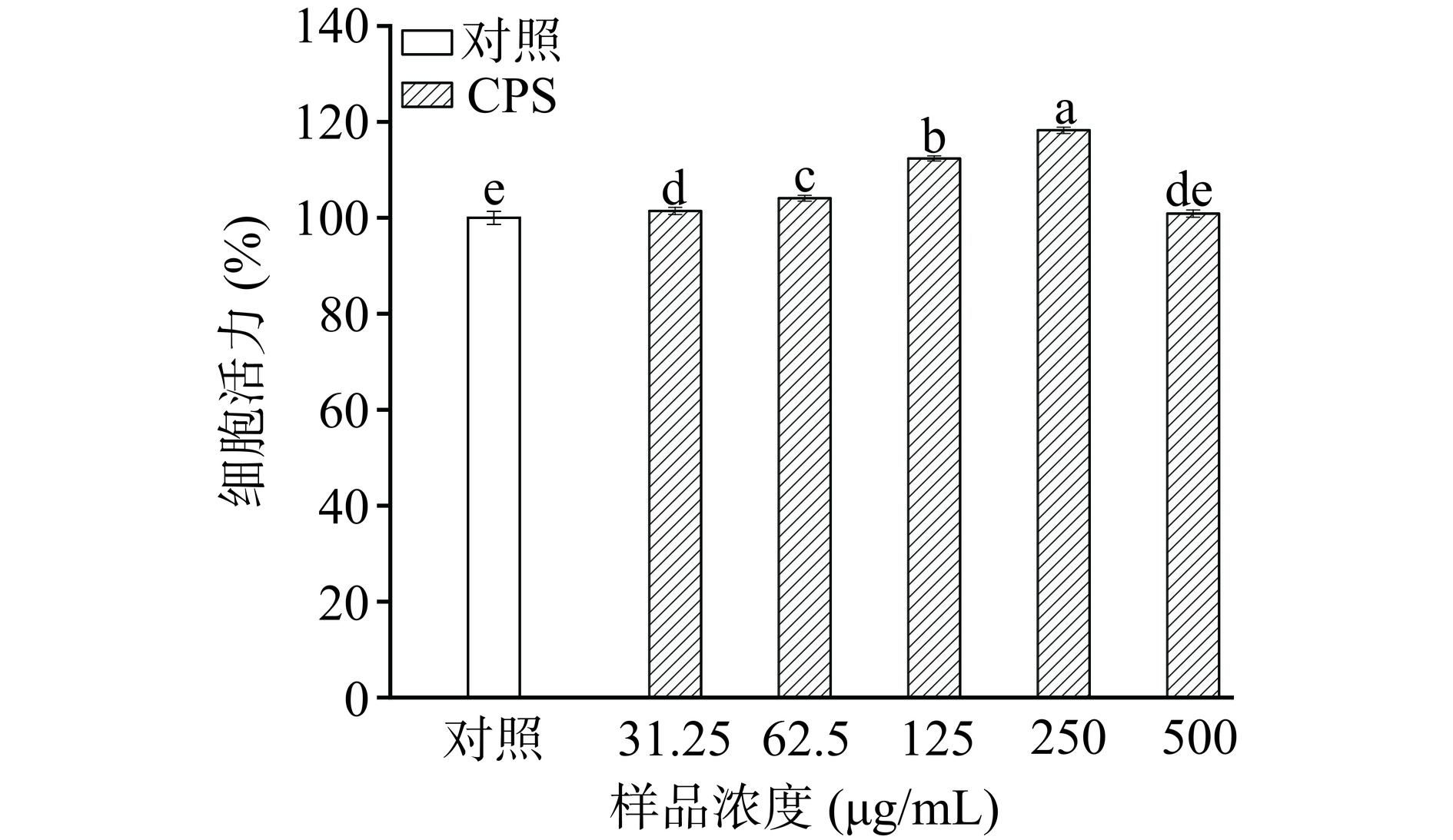
巨噬细胞广泛分布于人体内,在先天和适应性免疫中发挥着重要作用[32]。如图3所示,与对照组相比,经31.25~250 μg/mL CPS处理后的RAW264.7细胞的细胞活力显著增强(P<0.05),且在250 μg/mL时细胞活力达到最大值110.27%。但随着剂量增加至500 μg/mL,细胞活力显著降低(P<0.05),但与对照组差异不显著(P>0.05)。基于安全考虑,本研究选择31.25~250 μg/mL的剂量来继续评估CPS的免疫调节活性。
2.3.2 吞噬作用
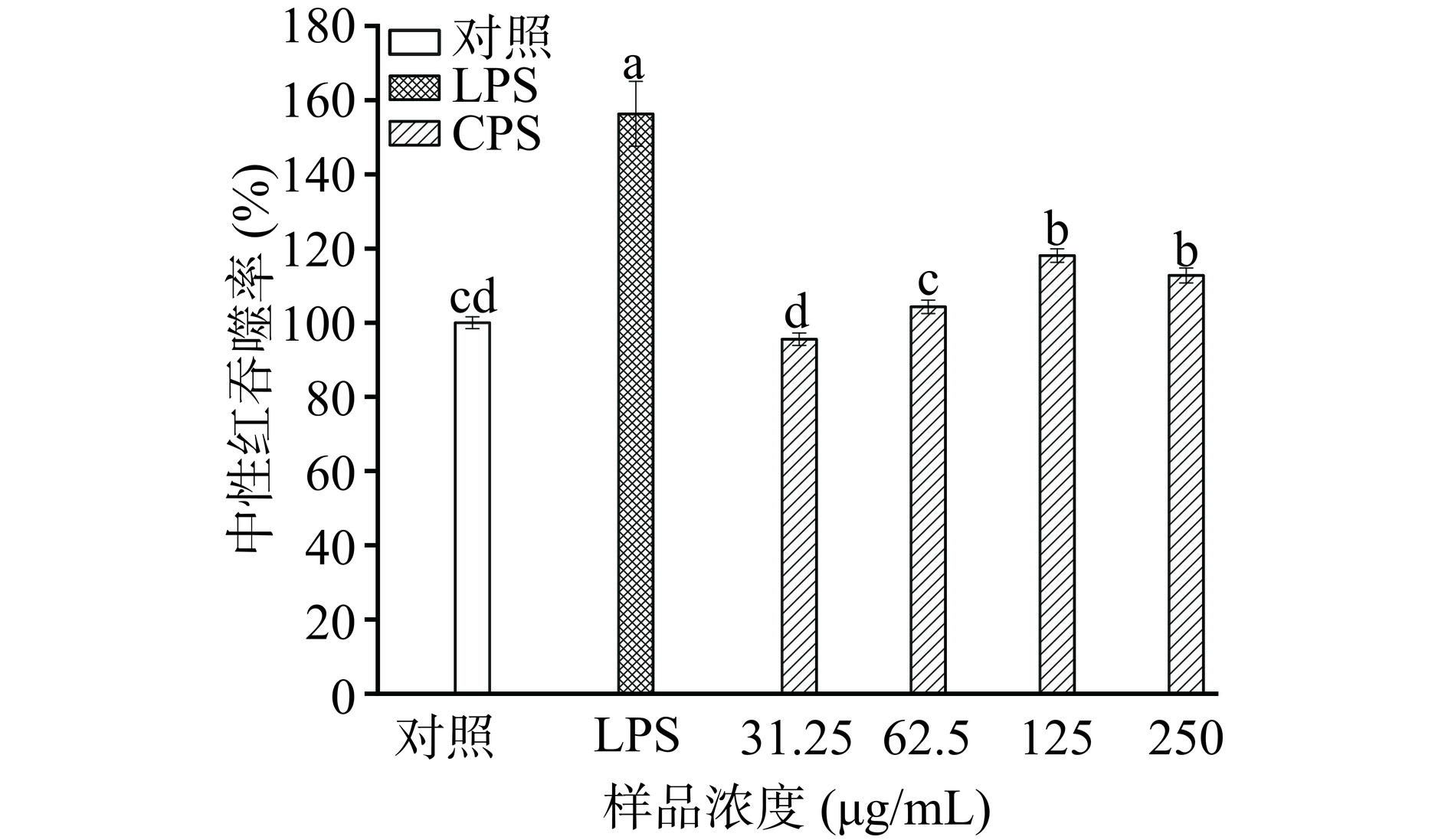
吞噬活性是评价巨噬细胞免疫活性的指标之一,它代表了免疫反应中第一道防御[33]。本研究采用中性红法来评价RAW264.7细胞对中性红的吞噬能力,如图4所示,LPS组的中性红吞噬率达到对照组的156.29%,说明LPS显著增强了RAW264.7细胞的吞噬活性(P<0.05)。CPS在62.5~250 μg/mL浓度范围内,对RAW264.7细胞的激活作用具有差异显著性(P<0.05),当CPS浓度125 μg/mL时吞噬率达到最大值为118.1%±1.84%,比对照组高0.18倍。表明CPS在适宜浓度范围内能够激活RAW264.7细胞并显著增强其吞噬活性,从而提高其免疫活性。其他乳酸菌源的EPS也有类似的现象,如发酵乳杆菌GBJ CPS[12]、植物乳杆菌JLAU103 EPS[4]均能显著增强巨噬细胞的吞噬活性。
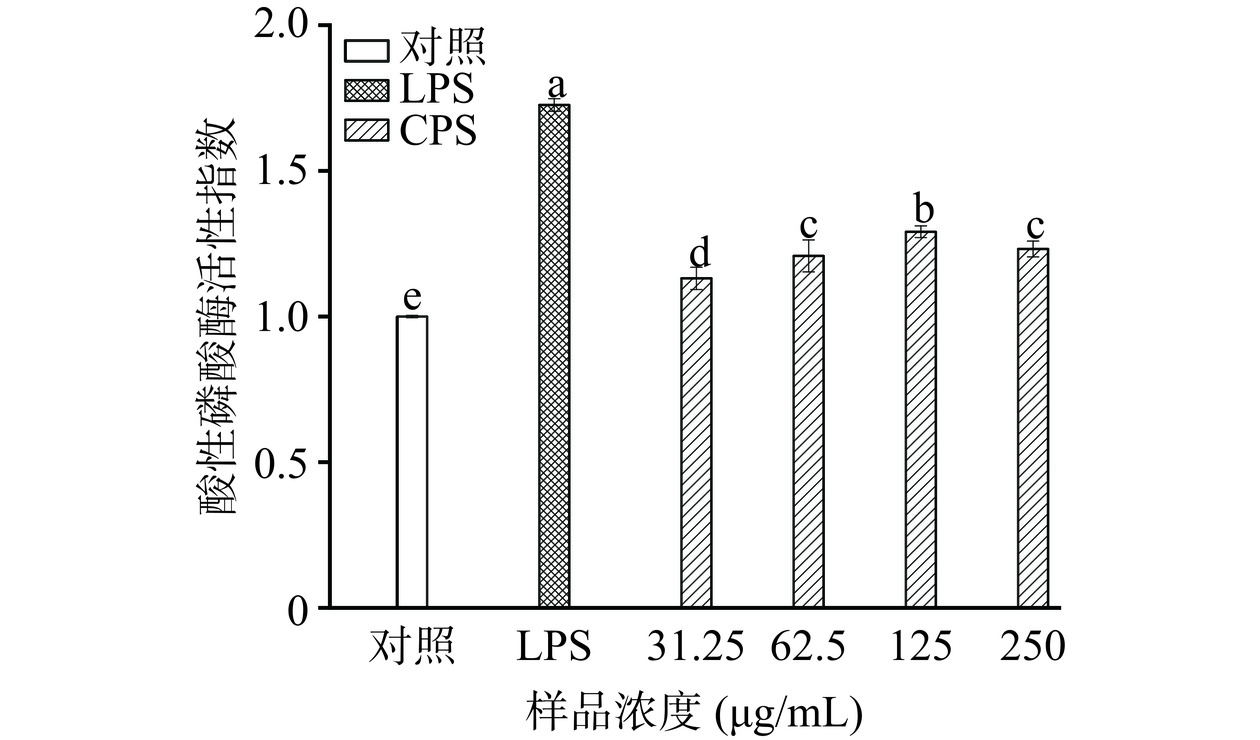
2.3.3 酸性磷酸酶活性
酸性磷酸酶是溶酶体的标记酶,是巨噬细胞活化的一种信号酶[25]。如图5所示,LPS和CPS处理均能显著增强巨噬细胞的酸性磷酸酶活性(P<0.05)。其中,LPS组的增幅最大,为对照组的0.7倍。样品组的酶活提升效果随浓度先增加后降低,在125 μg/mL时活性指数达到最高,为1.29。这接近于L. helveticus LZ-R-5多糖(200 μg/mL)和Sinonovacula constricta多糖(100 μg/mL)的最佳活性指数(约1.4)[5,25],说明CPS对巨噬细胞酸性磷酸酶活性有较强的增强作用。此外,上述两种多糖在低剂量下都表现出增强酸性磷酸酶活性的作用,而高剂量则倾向于减弱这种作用,这也与本研究结果相符合。
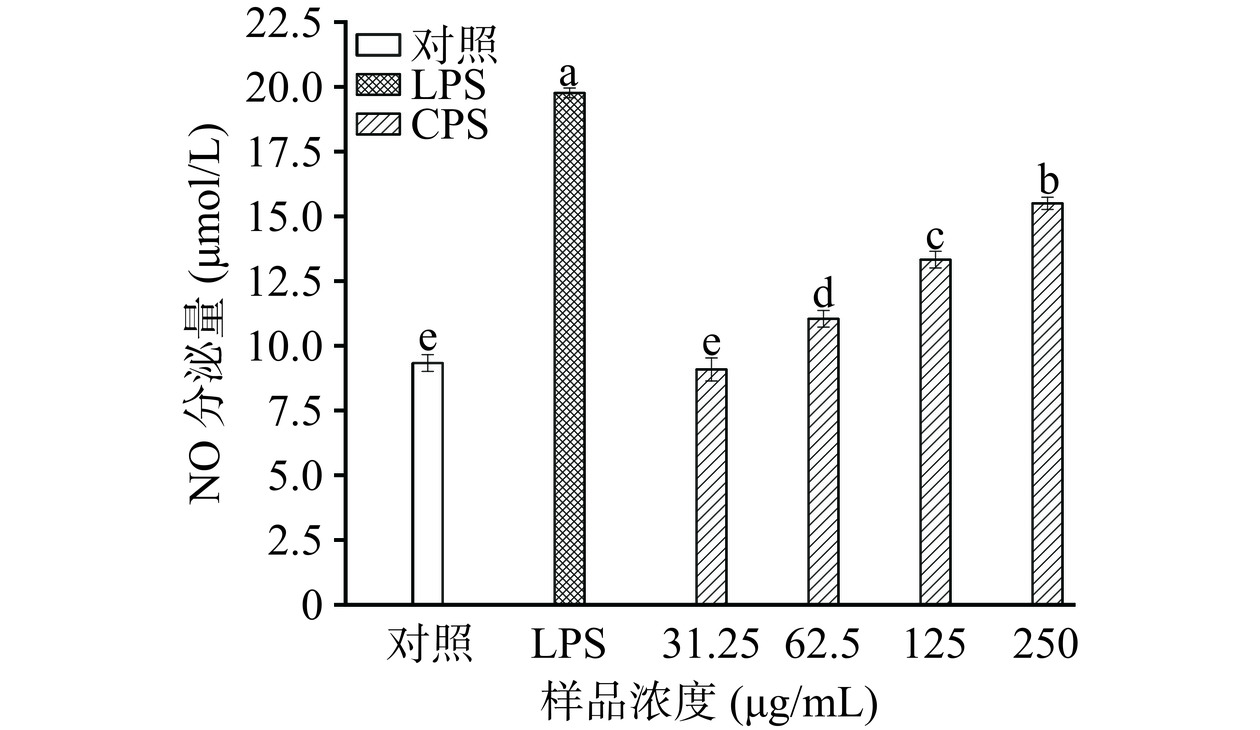
2.3.4 NO分泌水平
活化的巨噬细胞不仅会发生形态学变化,而且还能产生多种免疫反应,释放NO和细胞免疫因子,从而促进肿瘤细胞的凋亡[34]。如图6所示,CPS在62.5~250 μg/mL范围内,呈剂量依赖性提高巨噬细胞NO的分泌量。250 μg/mL处理组NO分泌量显著上升(P<0.05)至15.50 μmol/L,是对照组的1.66倍,但低于LPS组,从而避免引发巨噬细胞的过度炎症反应。这与You等[5]的研究结果一致,他们的研究发现经400.0 μg/mL瑞士乳杆菌LZ-R-5的EPS处理后,RAW264.7细胞的NO分泌量达到13.05 μmol/L,分泌量显著高于对照组。这说明CPS可以通过刺激RAW264.7细胞NO分泌而增强免疫调节活性。
2.3.5 细胞因子分泌水平
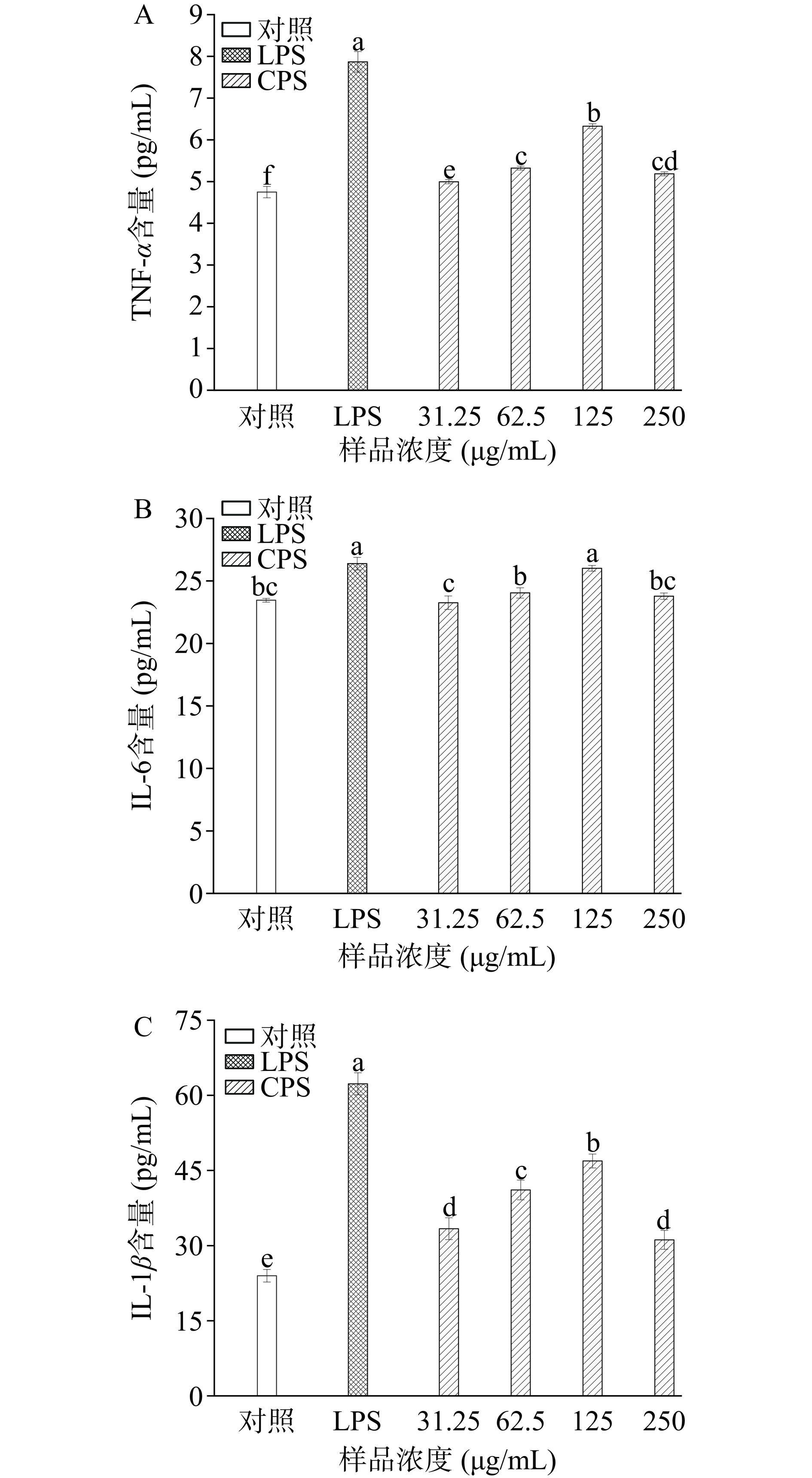
活化后的巨噬细胞会分泌大量的细胞因子参与免疫调节。促炎细胞因子(如TNF-α、IL-6和IL-1β)在免疫调节过程中能发挥很多作用,尤其是免疫细胞释放的细胞因子可以刺激先天免疫反应,促进免疫调节[35]。都是由活化的巨噬细胞产生,并在免疫应答中发挥着不可或缺的作用。
如图7A~图7C所示,CPS对细胞因子(TNF-α、IL-6和IL-1β)的分泌具有显著的诱导作用。与对照组比,经31.25~125 μg/mL CPS处理后,RAW264.7细胞的TNF-α、IL-6和IL-1β的分泌量呈剂量依赖性显著增加(P<0.05),而在250 μg/mL时有所下降。CPS浓度为125 μg/mL时,TNF-α、IL-6、IL-1β的分泌量分别是对照组的1.26倍、1.11倍、1.96倍,表明CPS可通过增加细胞因子分泌发挥免疫调节作用。其他多糖也有类似的结果,如瑞士乳杆菌LZ-R-5 EPS可以通过增强RAW264.7细胞的增殖、吞噬能力、NO和细胞因子分泌,从而发挥免疫调节作用[5]。此外,戊糖乳杆菌LZ-R-17 EPS也被证明可以促进巨噬细胞分泌细胞因子[6]。He等[36]发现铁皮石斛多糖(DOP-1-1)通过诱导THP-1细胞产生细胞因子(TNF-α,IL-1β)来发挥免疫调节活性。据报道,多糖的生物活性受其理化性质、分子量、链构象和结构构型等因素的影响[5]。通常分子量在104~106 Da之间的多糖,被认为具有良好的免疫活性[6]。例如,Wang等[12]发现发酵乳杆菌GBJ CPS平均分子量为377 kDa,由半乳糖和葡萄糖两种单糖组成,并且体外细胞试验表明其具有良好的免疫调节活性。但是也有人提出多糖中糖醛酸含量越高,生物活性就越高[37]。在本研究中,CPS的Mw约为54.9 kDa,由半乳糖和葡萄糖两种单糖组成,并含有少量的糖醛酸,符合具有免疫调节特性多糖的特征。因此,CPS今后可作为一种潜在的免疫刺激剂应用于食品或药品行业中。
2.4 CPS对线虫抗衰老活性的影响
2.4.1 体内抗氧化活性
SOD在氧化和抗氧化的平衡中起着重要的作用。它可以去除超氧阴离子,保护细胞免受损伤[38]。由表1可知,线虫体内T-AOC和SOD活力均随着CPS浓度的增加而呈现先上升后下降的趋势。当CPS浓度为125 μg/mL时,T-AOC和SOD活力均达到最大值,分别为17.49±0.58、67.56±0.23 U/mg prot,相比于对照组分别增长了206.84%±0.10%、68.86%±0.58%。当浓度为250 μg/mL时,线虫的T-AOC和SOD活力均有所下降,这可能是由于高剂量的CPS对线虫抗氧化能力产生了一定抑制作用,这与Wang等[12]的研究结果一致。综上所述,CPS可在一定程度上提高线虫体内的抗氧化能力,具有激活线虫体内抗氧化防御系统的能力。
表 1 CPS对线虫体内抗氧化活性的影响Table 1. Effects of CPS on antioxidant activity in C. elegans样品 浓度
(μg/mL)T-AOC能力
(U/mg prot)增长率
(%)T-SOD酶活力
(U/mg prot)增长率
(%)CPS 0 5.70±0.40d − 40.01±0.16e − 31.25 10.50±0.96c 84.21±0.17d 48.73±0.22d 21.79±0.55d 62.5 12.62±0.48b 121.40±0.84b 56.96±0.18b 42.36±0.46b 125 17.49±0.58a 206.84±0.10a 67.56±0.23a 68.86±0.58a 250 12.10±0.48b 110.53±0.85c 56.18±0.39c 40.41±0.96c 注:同列不同字母表示差异显著(P<0.05)。 2.4.2 CPS对线虫寿命的影响
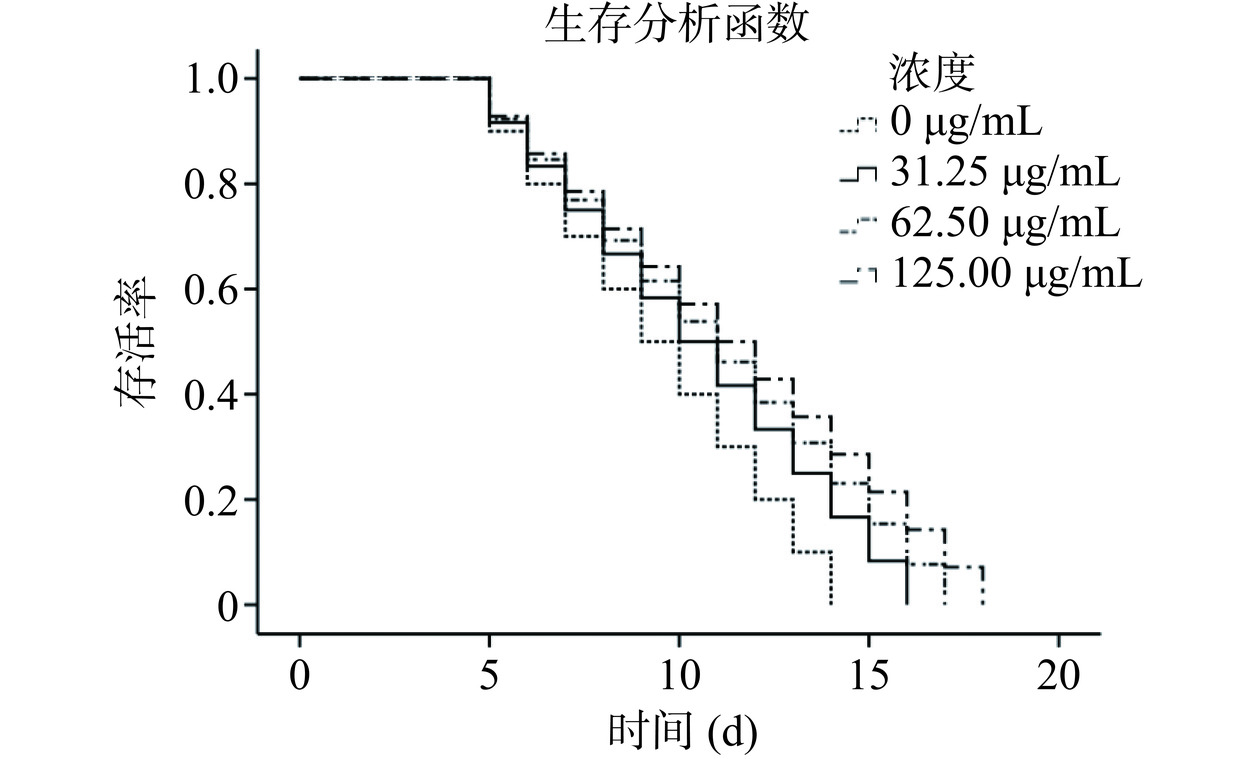
如图8所示,喂食CPS线虫的生存曲线发生一定程度的右移,并且右移程度与CPS浓度有关,具有浓度依赖性。说明CPS处理对线虫寿命有延长作用。与对照组相比,31.25、62.5和125 μg/mL的CPS对线虫寿命的延长率分别为10.53%±0.68%、15.79%±0.66%和21.05%±0.21%(表2),线虫最大寿命分别延长至16 d、17 d和18 d。这些结果表明,CPS在正常培养条件下可提高线虫的存活率并延长其最大寿命。之前也有报道过类似的结果,植物乳杆菌70810产生的CPS能显著(P<0.05)延长线虫的寿命,用25、50和125 μg/mL的CPS处理线虫后,线虫的平均寿命分别提高了10.44%、13.34%和1.27%[39]。发酵乳杆菌GBJ的CPS-2也能显著延长线虫的寿命,在62.5 μg/mL的CPS-2处理下可将线虫的寿命延长率提升16.61%[12]。
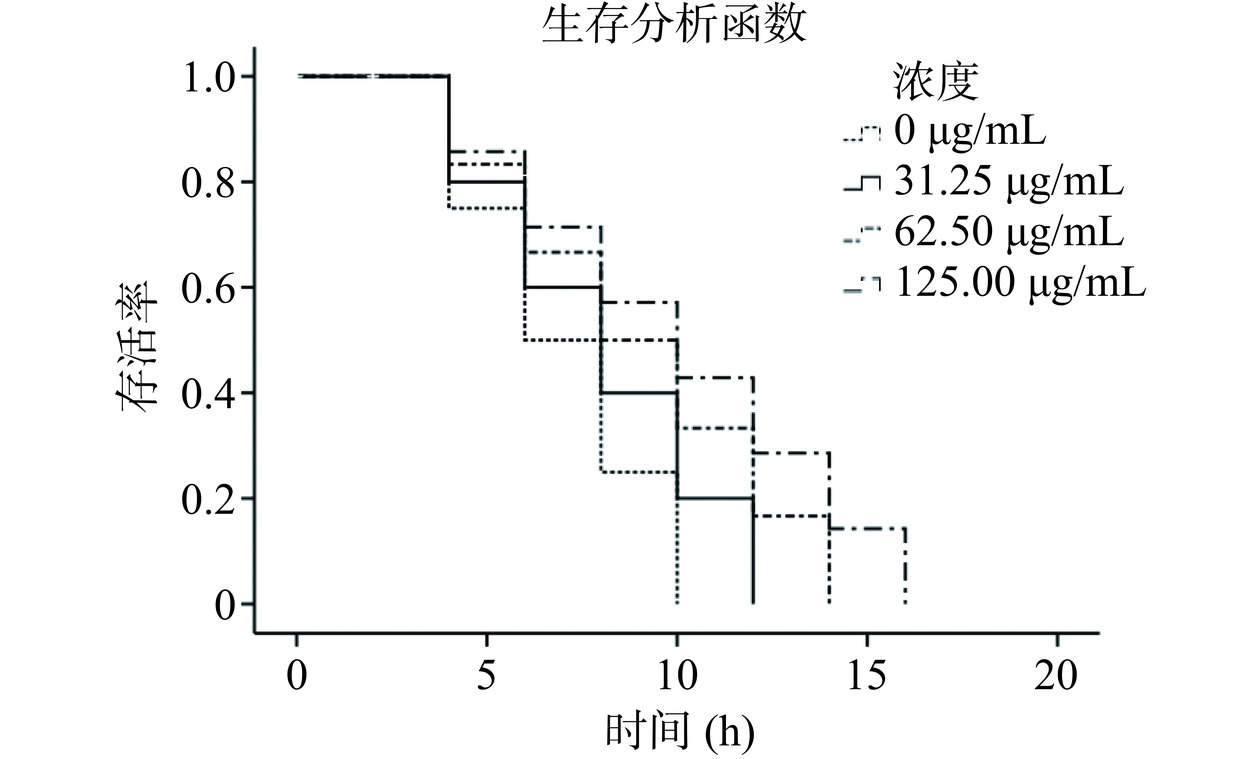
2.4.3 CPS对线虫氧化应激能力的影响
氧化损伤是衰老过程中非常重要的一部分,也是体内自由基水平的一种表现。自由基的过度积累会引起机体氧化损伤[18]。由图9可知,随着CPS浓度的增加,线虫生存曲线发生明显的右移,且右移程度呈剂量依赖性。与对照组相比,在CPS浓度为62.5和125 μg/mL时,线虫的平均寿命分别延长了28.57%±0.29%和42.86%±0.27%(表3),寿命延长效果显著提升(P<0.05)。这一结果表明CPS可提高线虫的氧化应激耐受性,增强线虫在氧化应激条件下的适应能力。这与黄少杰等[17]报道的铁皮石斛多糖的研究结果一致,他们发现高剂量组(2 mg/mL)的铁皮石斛多糖能增强线虫抵抗氧化应激的能力;Hui等[18]也发现百合根多糖能延长在正常、热和氧化应激环境下线虫的平均寿命,并且表明其主要通过提高线虫抗氧化防御系统和自由基清除率来提高对热和氧化的抗逆性,从而延长线虫的寿命。因此,植物乳杆菌W1的CPS对线虫氧化应激能力的提升可能与其抗氧化活性有关。
表 3 不同浓度CPS对秀丽隐杆线虫氧化应激能力的影响Table 3. Effects of different concentrations of CPS on oxidative stress of C. elegans多糖浓度(μg/mL) 平均寿命(h) 寿命延长率(%) 0 7.00±1.29c − 31.25 8.00±1.41bc 14.29±0.15c 62.5 9.00±1.53ab 28.57±0.29b 125 10.00±1.63a 42.86±0.27a 2.4.4 CPS对线虫热应激能力的影响
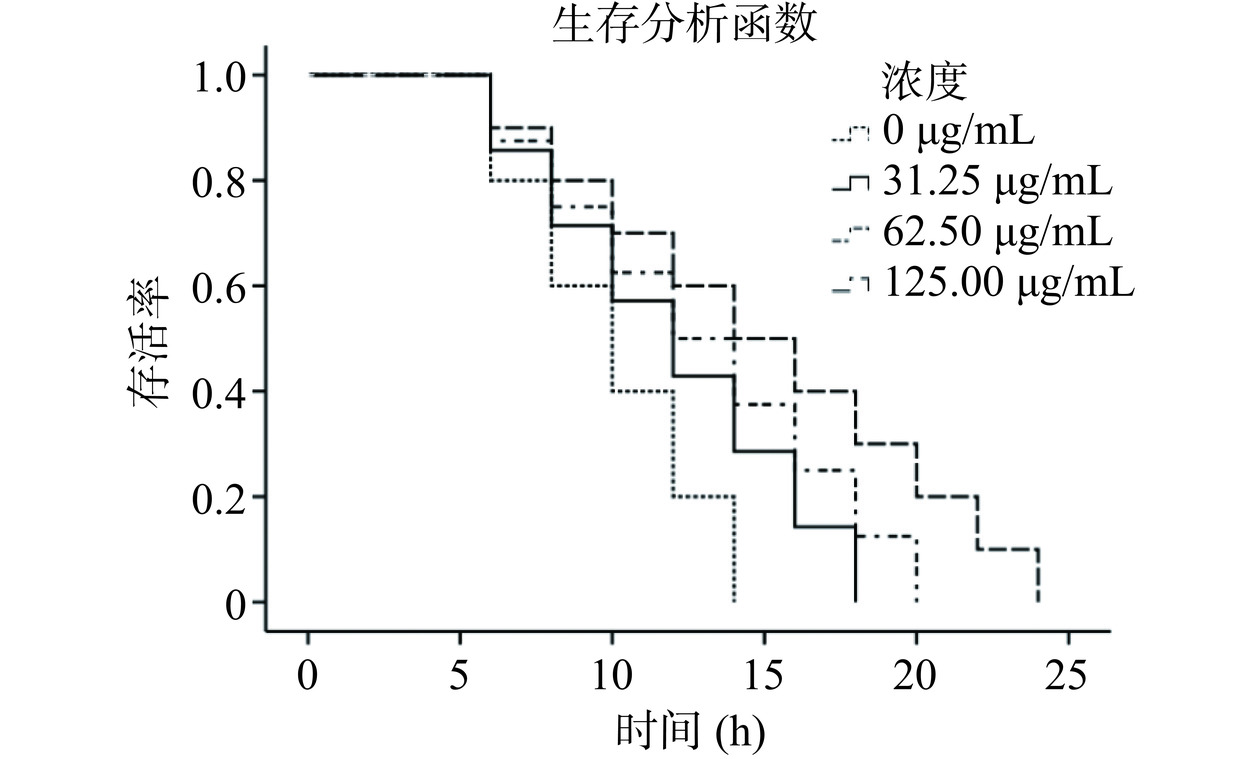
一般来说,机体的耐受性与其寿命相关。耐受性越高,其寿命就越长[18]。由图10可清楚看出,经不同浓度CPS处理后线虫的生存曲线均发生右移,并且右移程度呈剂量依赖性。与对照组相比,31.25、62.5和125 μg/mL CPS的线虫平均寿命分别延长了20.00%±0.33%、30.00%±0.63%、50.00%±0.27%(表4),显著提升了线虫的寿命(P<0.05),这一结果高于黄花菜多糖。Zou等[40]研究发现浓度为1200 μg/mL的黄花菜多糖能在热应激条件下将线虫的寿命延长至8.44 h,比空白对照组高17.71%,并且推测其作用机制可能与提高过氧化氢酶(CAT)和SOD的活性,降低活性氧(ROS)水平以及调节相关基因有关。以上研究结果表明,植物乳杆菌W1 CPS可以在一定程度上提高线虫在热应激条件下的寿命。
表 4 不同浓度 CPS对秀丽隐杆线虫热应激能力的影响Table 4. Effects of different concentrations of CPS on heat stress ability of C. elegans多糖浓度(μg/mL) 平均寿命(h) 寿命延长率(%) 0 10.00±1.41c − 31.25 12.00±1.63b 20.00±0.33c 62.5 13.00±1.73b 30.00±0.63b 125 15.00±0.92a 50.00±0.27a 2.4.5 CPS对线虫生殖能力的影响
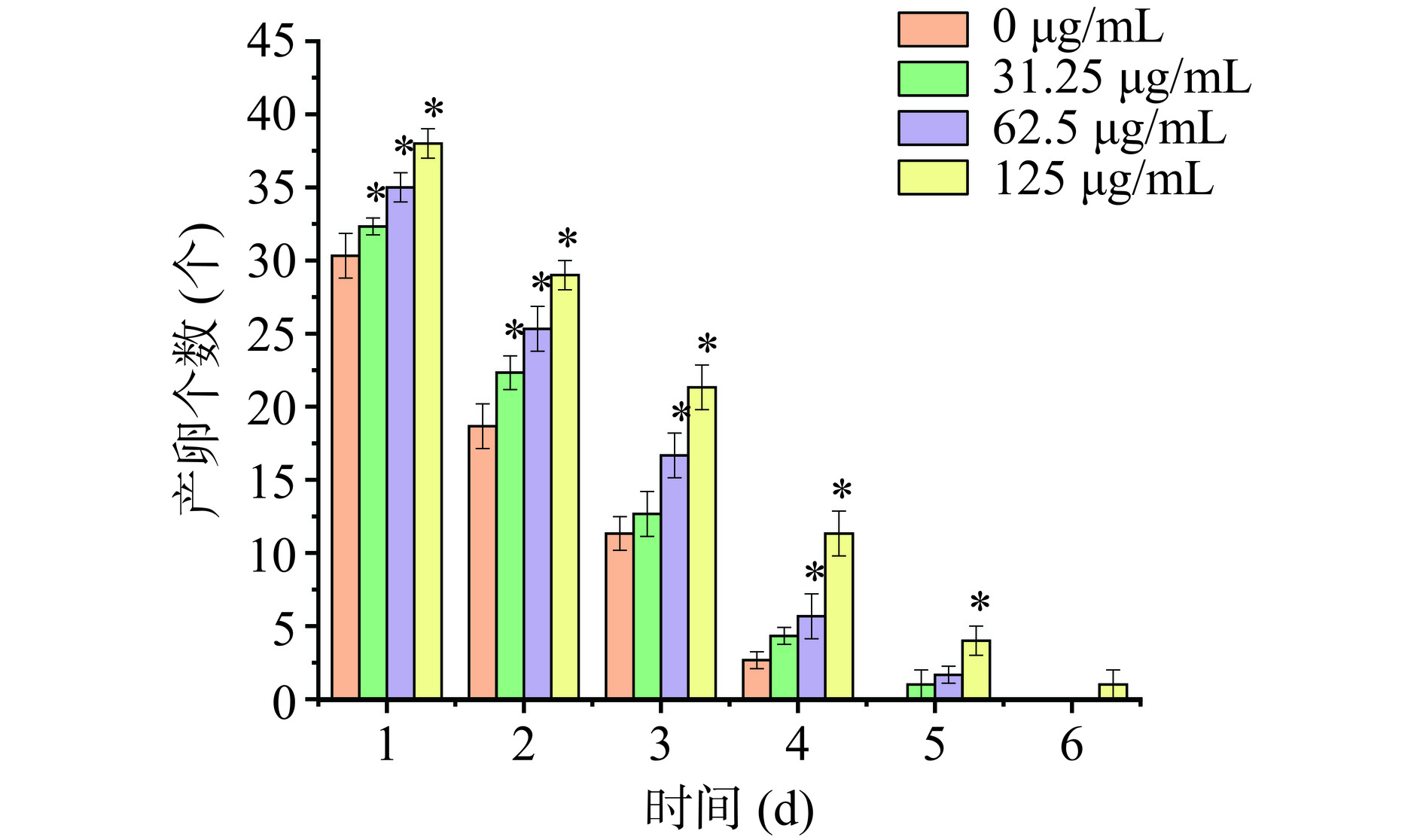
研究表明线虫寿命的延长大多与繁殖能力的下降有关[41]。因此,本实验对植物乳杆菌W1 CPS对线虫生殖能力的影响进行了研究。如图11所示,与对照组相比,添加CPS可以提升线虫产卵的数量,并且呈剂量依赖性。对照组和31.25、62.5、125 μg/mL CPS实验组的6 d平均产卵数分别为59.67、65.67、76.67和88.33。其中,31.25 μg/mL CPS组6 d产卵的总数量与对照组线虫的产卵数没有显著差异(P>0.05),而62.25和125 μg/mL CPS组6 d线虫产卵的总数量比对照组显著增加了28.49%和48.03%(P<0.05)。这表明,CPS对线虫寿命的延长并不损害其繁殖能力。
3. 结论
本研究以植物乳杆菌W1为发酵菌株,从植物乳杆菌W1中分离得到一种CPS,并对其结构进行了表征,发现其是由葡萄糖和半乳糖组成的一种酸性杂多糖,其摩尔比为3.12:1,平均分子量为5.49×104 Da;紫外全波长结果显示CPS含有微量的蛋白质;红外光谱分析显示其在4000~500 cm−1范围内具有多糖的典型吸收峰。体外细胞实验表明CPS能有效激活RAW264.7细胞,通过增强RAW264.7细胞的增殖能力、吞噬作用和酸性磷酸酶活力,促进其NO和细胞因子的分泌来达到免疫调节作用。同时,125 μg/mL的CPS不仅能提高线虫体内的抗氧化酶活性,还能增强其抗氧化应激和抗热休克能力从而延长寿命。本研究表明,CPS具有良好的免疫和抗衰老活性,可开发为功能性辅料应用于食品生产。这些研究可为乳酸菌源CPS的开发和利用提供理论基础。
-
图 1 CPS的凝胶渗透色谱图(A)、单糖标准品(B)和CPS单糖组成(C)液相色谱图
注:图1A中红线代表多角度激光光散射信号(即LS,单位是V),蓝色代表示差信号(即RI,单位是RIU),黑线是由两种信号拟合出的摩尔质量(g/moL);甘露糖(Man)、鼠李糖(Rha)、葡萄糖(Glc)、半乳糖(Gal)和阿拉伯糖(Ara)。
Figure 1. Gel permeation chromatogram of CPS (A), liquid chromatogram of monosaccharide standard (B) and CPS monosaccharide composition (C)
表 1 CPS对线虫体内抗氧化活性的影响
Table 1 Effects of CPS on antioxidant activity in C. elegans
样品 浓度
(μg/mL)T-AOC能力
(U/mg prot)增长率
(%)T-SOD酶活力
(U/mg prot)增长率
(%)CPS 0 5.70±0.40d − 40.01±0.16e − 31.25 10.50±0.96c 84.21±0.17d 48.73±0.22d 21.79±0.55d 62.5 12.62±0.48b 121.40±0.84b 56.96±0.18b 42.36±0.46b 125 17.49±0.58a 206.84±0.10a 67.56±0.23a 68.86±0.58a 250 12.10±0.48b 110.53±0.85c 56.18±0.39c 40.41±0.96c 注:同列不同字母表示差异显著(P<0.05)。 表 2 不同浓度CPS对秀丽隐杆线虫寿命的影响
Table 2 Effects of different concentrations of CPS on lifespan of C. elegans
表 3 不同浓度CPS对秀丽隐杆线虫氧化应激能力的影响
Table 3 Effects of different concentrations of CPS on oxidative stress of C. elegans
多糖浓度(μg/mL) 平均寿命(h) 寿命延长率(%) 0 7.00±1.29c − 31.25 8.00±1.41bc 14.29±0.15c 62.5 9.00±1.53ab 28.57±0.29b 125 10.00±1.63a 42.86±0.27a 表 4 不同浓度 CPS对秀丽隐杆线虫热应激能力的影响
Table 4 Effects of different concentrations of CPS on heat stress ability of C. elegans
多糖浓度(μg/mL) 平均寿命(h) 寿命延长率(%) 0 10.00±1.41c − 31.25 12.00±1.63b 20.00±0.33c 62.5 13.00±1.73b 30.00±0.63b 125 15.00±0.92a 50.00±0.27a -
[1] 蒋光阳, 田永强. 乳酸菌产胞外多糖的发酵条件优化及其抗氧化活性研究[J]. 中国酿造,2023,42(4):187−195. [JIANG G Y, TIAN Y Q. Optimization of fermentation condition of lactic acid bacteria with high-yield exopolysaccharides and its antioxidant activity[J]. China Brewing,2023,42(4):187−195.] JIANG G Y, TIAN Y Q. Optimization of fermentation condition of lactic acid bacteria with high-yield exopolysaccharides and its antioxidant activity[J]. China Brewing, 2023, 42(4): 187−195.
[2] ISMALI B, NAMPOOTHIR K M. Production, purification and structural characterization of an exopolysaccharide produced by a probiotic Lactobacillus plantarum MTCC 9510[J]. Archives of Microbiology,2010,192(12):1049−1057. doi: 10.1007/s00203-010-0636-y
[3] ABARQUERO D, RENES E, FRESNO J. M, et al. Study of exopolysaccharides from lactic acid bacteria and their industrial applications:A review[J]. International Journal of Food Science & Technology,2022,57(1):16−26.
[4] WANG J, FANG X, WU T, et al. In vitro immunomodulatory effects of acidic exopolysaccharide produced by Lactobacillus planetarium JLAU103 on RAW264.7 macrophages[J]. International Journal of Biological Macromolecules,2020,156(1):1308−1315.
[5] YOU X, LI Z, MA K, et al. Structural characterization and immunomodulatory activity of an exopolysaccharide produced by Lactobacillus helveticus LZ-R-5[J]. Carbohydrate polymers,2020,235(1):115977.
[6] YOU X, YANG L, ZHAO X, et al. Isolation, purification, characterization and immunostimulatory activity of an exopolysaccharide produced by Lactobacillus pentosus LZ-R-17 isolated from Tibetan kefir[J]. International Journal of Biological Macromolecules,2020,158(7):408−419.
[7] 胡彦波, 王思琪, 石曾卉, 等. 水溶性豆渣酸性多糖对RAW264.7细胞的免疫调节作用及其机制[J]. 食品科学,2022,43(3):160−177. [HU Y B, WANG S Q, SHI Z H, et al. Immunomodulatory effect and mechanism of soluble acidic polysaccharides from soybean dregs on RAW264.7 cells[J]. Food Science,2022,43(3):160−177.] HU Y B, WANG S Q, SHI Z H, et al. Immunomodulatory effect and mechanism of soluble acidic polysaccharides from soybean dregs on RAW264.7 cells[J]. Food Science, 2022, 43(3): 160−177.
[8] 陈洪亮, 李伯涛, 张家祥, 等. 免疫活性多糖的免疫调节作用及机制研究进展[J]. 中国药理学通报,2002(3):249−252. [CHEN H L, LI B T, ZHANG J X, et al. Research development on the immumodulatory effect of polysaccharide and its mechanism[J]. Chinese Pharmacological Bulletin,2002(3):249−252.] doi: 10.3321/j.issn:1001-1978.2002.03.003 CHEN H L, LI B T, ZHANG J X, et al. Research development on the immumodulatory effect of polysaccharide and its mechanism[J]. Chinese Pharmacological Bulletin, 2002(3): 249−252. doi: 10.3321/j.issn:1001-1978.2002.03.003
[9] STEELE C, RAPAKA RR, METZ A, et al. The beta-glucan receptor dectin-1 recognizes specific morphologies of Aspergillus fumigatus[J]. PLoS Pathog,2005,1(4):323−334.
[10] OPANASOPIT P, HIGUCHI Y, KAWAKAMI S, et al. Involvement of serum mannan binding proteins and mannose receptors in uptake of mannosylated liposomes by macrophages[J]. Biochimica et Biophysica Acta (BBA)-BiomemBranes,2001,1511(1):134−145. doi: 10.1016/S0005-2736(01)00267-X
[11] GARCIA-VELLO P, SHARMA G, SPECIALE I, et al. Structural features and immunological perception of the cell surface glycans of Lactobacillus plantarum:A novel rhamnose-rich polysaccharide and teichoic acids[J]. Carbohydrate Polymers,2020,233(1):115857−115866.
[12] WANG K, SUN J C, ZHAO J, et al. Immunomodulatory activity and protective effect of a capsular polysaccharide in Caenorhabditis elegans, isolated from Lactobacillus fermentum GBJ[J]. International Journal of Biological Macromolecules,2023,253(7):127443−127456.
[13] MOLINA-GARCÍA L, BARRIOS A. Animal behaviour:Shifting attention in order to disperse[J]. Current Biology,2021,31(20):1397−1400. doi: 10.1016/j.cub.2021.08.017
[14] DOLESE D A, JUNOT M P, GHOSH B, et al. Degradative tubular lysosomes link pexophagy to starvation and early aging in C. elegans[J]. Autophagy,2022,18(7):1522−1533. doi: 10.1080/15548627.2021.1990647
[15] HOBERT O. Homeobox genes and the specification of neuronal identit[J]. Nature Reviews Neuroscience,2021,22(10):627−636. doi: 10.1038/s41583-021-00497-x
[16] MUDD N, LICEAGA A M. Caenorhabditis elegans as an in vivo model for food bioactives:A review[J]. Current Research in Food Science,2022,5(1):845−856.
[17] 黄少杰, 陈宏著, 钟淳菲, 等. 铁皮石斛叶多糖对秀丽隐杆线虫体内抗衰老作用[J]. 食品科学,2022,43(21):203−208. [HUANG S J, CHEN H Z, ZHONG C F, et al. Anti-aging effect of polysaccharide from dendrobium officinale leaves in Caenorhabditis elegans[J]. Food Science,2022,43(21):203−208.] doi: 10.7506/spkx1002-6630-20211202-031 HUANG S J, CHEN H Z, ZHONG C F, et al. Anti-aging effect of polysaccharide from dendrobium officinale leaves in Caenorhabditis elegans[J]. Food Science, 2022, 43(21): 203−208. doi: 10.7506/spkx1002-6630-20211202-031
[18] HUI H, XIN A, CUI H, et al. Anti-aging effects on Caenorhabditis elegans of a polysaccharide, O-acetyl glucomannan, from roots of Lilium davidii var. unicolor Cotton[J]. International Journal of Biological Macromolecules,2020,155:846−852. doi: 10.1016/j.ijbiomac.2020.03.206
[19] FENG S, CHENG H, XU Z, et al. Panax notoginseng polysaccharide increases stress resistance and extends lifespan in Caenorhabditis elegans[J]. Journal of Functional Foods,2018,45:15−23. doi: 10.1016/j.jff.2018.03.034
[20] ZHANG Y, LIU Z, ZHANG Y, et al. A reversible and selective luminescent probe for Cu2+ detection based on a ruthenium (II) complex in aqueous solution[J]. Sensors and Actuators B:Chemical,2015,211:449−455. doi: 10.1016/j.snb.2015.01.116
[21] UEMURA Y, MATSUMOTO M. Chemical structure of the cell wall-associated polysaccharide of Bifidobacterium animalis subsp. lactis LKM512[J]. Glycoconjugate Journal,2014,31(8):555−561. doi: 10.1007/s10719-014-9534-x
[22] WANG K, LI W, RUI X, et al. Characterization of a novel exopolysaccharide with antitumor activity from Lactobacillus plantarum 70810[J]. International Journal of Biological Macromolecules,2014,63:133−139. doi: 10.1016/j.ijbiomac.2013.10.036
[23] WANG K, NIU M M, WU Y, et al. Physicochemical characterization and antioxidant activity of cell-bound exopolysaccharides from Lactobacillus fermentum S1 obtained by two extraction methods[J]. Process Biochemistry,2019,85:195−205. doi: 10.1016/j.procbio.2019.06.017
[24] 崔石阳, 姜帆, 韩建春, 等. 北五味子多糖对RAW264.7细胞的免疫调节作用[J]. 食品科学,2017,38(19):201−205. [CUI S Y, JIANG F , HAN J C, et al. Immunomodulatory effect of schisandra chinensis polysaccharides on RAW264.7 macrophages[J]. Food Science,2017,38(19):201−205.] CUI S Y, JIANG F , HAN J C, et al. Immunomodulatory effect of schisandra chinensis polysaccharides on RAW264.7 macrophages[J]. Food Science, 2017, 38(19): 201−205.
[25] YUAN Q, ZHAO L, CHA Q, et al. Structural characterization and immunostimulatory activity of a homogeneous polysaccharide from Sinonovacula constricta[J]. Journal of Agricultural and Food Chemistry,2015,63(36):7986−7994. doi: 10.1021/acs.jafc.5b03306
[26] WANG X, SHAO C, LIU L, et al. Optimization, partial characterization and antioxidant activity of an exopolysaccharide from Lactobacillus plantarum KX041[J]. International Journal of Biological Macromolecules,2017,103:1173−1184. doi: 10.1016/j.ijbiomac.2017.05.118
[27] LI W, XIA X, TANG W, et al. Structural characterization and anticancer activity of cell-bound exopolysaccharide from Lactobacillus helveticus MB2-1[J]. Journal of Agricultural and Food Chemistry,2015,63(13):3454−3463. doi: 10.1021/acs.jafc.5b01086
[28] WANG K, NIU M M, YAO D, et al. Physicochemical characteristics and in vitro and in vivo antioxidant activity of a cell-bound exopolysaccharide produced by Lactobacillus fermentum S1[J]. International Journal of Biological Macromolecules:Structure, Function and Interactions,2019,139:252−261.
[29] SHI X, GU R, GUO Y, et al. Capsular polysaccharide-amikacin nanoparticles for improved antibacterial and antibiofilm performance[J]. International Journal of Biological Macromolecules, 2023:125325.
[30] YANG Z, LI S, ZHANG X, et al. Capsular and slime-polysaccharide production by Lactobacillus rhamnosus JAAS8 isolated from Chinese sauerkraut:Potential application in fermented milk products[J]. Journal of Bioscience & Bioengineering, 2010, 110(1):53−57.
[31] DONG Z, ZHANG M, LI H, et al. Structural characterization and immunomodulatory activity of a novel polysaccharide from Pueraria lobata (Willd.) Ohwi root[J]. International Journal of Biological Macromolecules,2020,154(1):1556−1564.
[32] SHI Z, AN L, ZHANG S, et al. A heteropolysaccharide purified from leaves of Ilex latifolia displaying immunomodulatory activity in vitro and in vivo[J]. Carbohydrate Polymers,2020,245(1):116469−116479.
[33] ZHAO P, ZHOU H, ZHAO C, et al. Purification, characterization and immunomodulatory activity of fructans from Polygonatum odoratum and P. cyrtonema[J]. Carbohydrate Polymers,2019,214(15):44−52.
[34] GU J, ZHANG H, ZHANG J, et al. Preparation, characterization and bioactivity of polysaccharide fractions from Sagittaria sagittifolia L[J]. Carbohydrate Polymers,2020,229(2):115355−115376.
[35] LIU Z, LIU Z, LI L, et al. Immunomodulatory effects of the polysaccharide from Sinonovacula constricta on RAW264. 7 macrophage cells[J]. Food Science & Nutrition, 2022, 10(4):1093−1102.
[36] HE T B, HUANG Y P, YANG L, et al. Structural characterization and immunomodulating activity of polysaccharide from Dendrobium officinale[J]. International Journal of Biological Macromolecules,2016,83:34−41. doi: 10.1016/j.ijbiomac.2015.11.038
[37] JI X, GUO J, CAO T, et al. Review on mechanisms and structure-activity relationship of hypoglycemic effects of polysaccharides from natural resources[J]. Food Science and Human Wellness,2023,12(6):1969−1980. doi: 10.1016/j.fshw.2023.03.017
[38] HUANG H, CHEN F, LONG R, et al. The antioxidant activities in vivo of bitter gourd polysaccharide[J]. International Journal of Biological Macromolecules,2020,145:141−144. doi: 10.1016/j.ijbiomac.2019.12.165
[39] 王坤. 植物乳杆菌胞外多糖结构鉴定、化学修饰及生物活性研究[D]. 南京:南京农业大学, 2015. [WANG K. Strucure chearacterization, emical modification and bioactivity of exopolysaccharides from Lactobacilus plantarum[D]. Nanjing:Nanjing Agricultural University, 2015.] WANG K. Strucure chearacterization, emical modification and bioactivity of exopolysaccharides from Lactobacilus plantarum[D]. Nanjing: Nanjing Agricultural University, 2015.
[40] ZOU Y, QIN X, WANG W, et al. Anti-aging effect of hemerocallis citrina baroni polysaccharide-rich extract on Caenorhabditis elegans[J]. International Journal of Molecular Sciences,2024,25(1):655−677. doi: 10.3390/ijms25010655
[41] VAYNDORF E M, LEE S S, LIU R H. Whole apple extracts increase lifespan, healthspan and resistance to stress in Caenorhabditis elegans[J]. Journal of Functional Foods,2013,5(3):1236−1243.





 下载:
下载:
 下载:
下载:



