Optimization of Flaxseed Meal Protein Extraction Process and Study of Protein Structure and Functional Properties
-
摘要: 为提高亚麻籽粕蛋白(flaxseed meal protein,FPI)的利用价值,以亚麻籽粕(flaxseed meal,FM)为原料,采用碱溶酸沉法提取FPI,通过单因素和响应面试验优化FPI的提取工艺,表征FPI的结构并分析其功能特性。结果表明,提取FPI的最佳工艺为:浸提pH10、浸提温度45 ℃、浸提时间90 min、料液比1:25 g/mL,该条件下蛋白提取率为22.69%。与FM相比,FPI的β-折叠和α-螺旋相对含量分别降低了10.57%和0.61%,其微观结构呈典型的冻干板状和不规则的鳞片状。此外,FPI的功能特性对pH具有高度依赖性,远离FPI等电点(pH4)时,FPI的功能特性显著提升。pH8时FPI的溶解度(99.52%)、持水性(8.87 g/g)、乳化性(8.92 m2/g)以及乳化稳定性(122.58 min)最佳。pH7时,FPI的起泡性(48.65%)和起泡稳定性(94.94%)最优,FPI凝胶的硬度(137.03 g)、弹性(0.829)和持水性(99.29%)最大,凝胶特性最佳。本研究为FPI作为乳化剂或凝胶剂在食品或医药领域的开发利用提供了一定的理论基础,有利于提高FPI的利用价值。Abstract: To enhance the utilization value of flaxseed meal protein (FPI), alkali solubilization and acid precipitation method was used to extract FPI from flaxseed meal (FM). The extraction process of FPI was optimized through single-factor and response surface methodology experiments. The structure of FPI was characterized, and the functional properties of FPI was analyzed. The results showed that the optimal extraction conditions of FPI were as follows: Extraction pH10, extraction temperature 45 ℃, extraction time 90 min, and material-liquid ratio 1:25 g/mL. At these conditions, the protein extraction rate was 22.69%. Compared with FM, the relative content of β-sheet and α-helix in FPI decreased by 10.57% and 0.61% respectively, and its microstructure exhibited typical freeze-dried plate-like structure and irregular scale-like structure. In addition, the functional properties of FPI were highly dependent on pH, when the pH away from the isoelectric point of FPI (pH4), there was a significant improvement in its functional properties. At pH8, FPI exhibited optimal solubility (99.52%), water-holding capacity (8.87 g/g), emulsifying activity (8.92 m2/g), and emulsion stability (122.58 min). At pH7, the foaming capacity (48.65%) and foaming stability (94.94%) of FPI were optimal, while the FPI gel showed maximal hardness (137.03 g), elasticity (0.829), and water holding capacity (99.29%), indicating its optimal gel properties. This study provides a theoretical basis for the development and utilization of FPI as emulsifier or gel in food or medicine, and is conducive to improving the utilization value of FPI.
-
Keywords:
- flaxseed meal /
- protein /
- extraction process /
- structure /
- functional properties
-
亚麻籽粕(flaxseed meal,FM)是未脱壳的亚麻籽冷榨油后的副产物,富含35%~40%的粗蛋白质[1],作为低成本的蛋白质补充剂,常被广泛应用于动物饲料或肥料领域。亚麻籽粕蛋白(flaxseed meal protein,FPI)富含必需氨基酸,尤其是天冬氨酸、谷氨酸和精氨酸[2],具有降低胆固醇、调节血糖、预防便秘以及抗肿瘤等功效[3]。随着全球对健康饮食的关注,植物蛋白替代动物蛋白的趋势越来越明显,FPI因其营养价值丰富、经济效益高而受到消费者的青睐,因此提高FPI的提取效率,将FM作为蛋白质的宝贵来源势在必行。
FPI可以通过多种方法提取,如碱溶酸沉法、酶法辅助、盐溶法和胶束法等[4],然而不同原料来源、料液比、温度、pH等条件都会影响FPI的提取率。碱溶酸沉法能够满足大规模工业化生产以获得高产率的蛋白质[5]。Kaushik等[6]对亚麻籽脱胶三次,粉碎过筛后通过碱溶酸沉法提取亚麻籽蛋白,60 ℃条件下蛋白回收率为20.29%。马德坤等[7]确定亚麻籽蛋白最佳工艺参数,料液比1:15,碱液浸提pH9.0,酸沉pH4.2~4.6,亚麻籽蛋白含量为98.86%,提取率为47.20%。由于不同提取因素的共同影响,FPI的提取率仍处于较低水平,本文通过单因素和响应面法进一步优化碱溶酸沉法提取FPI的工艺参数,以提高其提取率。
蛋白质提取过程中不同的工艺参数也会影响其结构和功能特性,蛋白质的功能特性是指蛋白质对食品质地、感官属性等理化性质的影响。蛋白质的溶解度、凝胶特性、起泡特性、乳液特性以及持水能力是蛋白质在食品应用中最重要的功能特性,其主要受原料类型、提取方法以及处理环境等因素的影响[8]。Julakanti等[9]研究表明,大麻籽蛋白的持水性、乳化特性随着pH(8~10)的增加显著增加,在等电点(pH5)附近,大麻籽蛋白的溶解度最低。张金凤等[10]的研究表明,随着豌豆蛋白等电点(pH5)两侧酸碱度的增加,豌豆蛋白的功能特性均显著增加。受工业化生产的限制,国内外关于FPI功能特性的研究有限,因此应结合FPI的理化性质及结构对其功能特性进行较为全面的分析,以扩大FPI在食品领域的加工和应用。
本研究旨在通过单因素和响应面试验对碱溶酸沉法提取FPI的工艺进行优化,以提高蛋白质提取率,同时,对提取的FPI进行表征,包括粒径、Zeta电位、热稳定性、二级结构、微观结构,并系统分析FPI的功能特性,为提高亚麻籽副产物的附加值以及FPI在功能性食品领域的深入研究和应用提供一定的理论依据。
1. 材料与方法
1.1 材料与仪器
脱脂亚麻籽粕 呼和浩特市维拓食品有限公司;大豆油 益海嘉里食品营销有限公司;果胶酶(酶活力:500 U/g) 上海源叶生物科技有限公司;牛血清蛋白、考马斯亮蓝 北京索莱宝科技有限公司;氢氧化钠、盐酸、浓硫酸、十二烷基硫酸钠均为分析纯 天津市北方天医化学试剂厂。
FE28 pH计 梅特勒-托利多仪器(上海)有限公司;TGL-16M高速冷冻离心机 上海卢湘仪离心机仪器有限公司;FD-1A-50真空冷冻干燥机 北京博医康试验仪器有限公司;Synergy HTX多功能酶标仪 美国博腾公司;Zetasizer Lab纳米粒度及Zeta电位分析仪 英国 Malvern Panalytical 公司;Q200F3差示扫描量热仪 德国NETZSCH公司;NICOLET IS50傅里叶红外光谱仪 德国Thermo Scientific公司;SU1510扫描电子显微镜 日本Hitachi公司;TE32 TA.XT.Plus质构仪 英国 Stable Micro System。
1.2 实验方法
1.2.1 FM脱胶处理
参考宋喜霞等[11]的方法并稍作修改,具体如下:使用高速粉碎机将脱脂FM粉碎后过80目筛,按料液比1:15(g/mL)溶于蒸馏水中,并调节pH至7,加入果胶酶(500 U/g)在34 ℃ 酶解3 h后离心(4 ℃,4000 r/min,20 min),取离心后的沉淀进行真空冷冻干燥(−40 ℃)后得到脱胶FM。
1.2.2 FPI的提取
参考马德坤等[7]的方法提取FPI,具体如下:将脱脂脱胶的FM过80目筛,按照合适的料液比(g/mL)溶于蒸馏水中,使用1 mol/L NaOH调至合适pH,并在一定温度下搅拌浸提一段时间后离心(4 ℃,4000 r/min,15 min),使用1 mol/L HCl溶液调节上清液pH至4后再次离心(4 ℃,4000 r/min,25 min),最后,将沉淀进行真空冷冻干燥(−40 ℃),粉碎过筛后在4 ℃下保存备用。按照国标GB/T 5009.5-2016中凯氏定氮法测定蛋白质含量,蛋白质折算系数为6.25。FPI的提取率根据公式计算。
X(%)=B×m2A×m1×100 式中:X表示FPI的提取率,%;A表示脱脂脱胶FM中的蛋白质含量,g/100 g;B表示提取的FPI中蛋白质含量,g/100 g;m1表示脱脂脱胶FM的质量,g;m2表示提取的FPI质量,g。
1.2.3 FPI提取工艺单因素实验
1.2.3.1 浸提pH对FPI提取率的影响
将浸提温度固定为45 ℃,浸提时间固定为60 min,料液比固定为1:30 g/mL,探究不同pH(7、8、9、10、11)对蛋白质提取率的影响。
1.2.3.2 浸提温度对FPI提取率的影响
将浸提pH固定为10,浸提时间固定为60 min,料液比固定为1:30 g/mL,探究不同浸提温度(25、35、45 、55、65 ℃)对FPI提取率的影响。
1.2.3.3 浸提时间对FPI提取率的影响
将浸提pH固定为10,浸提温度固定为45 ℃,料液比固定为1:30 g/mL,探究不同浸提时间(30、60、90、120、150 min)对FPI提取率的影响。
1.2.3.4 料液比对FPI提取率的影响
将浸提pH固定为10,浸提温度固定为45 ℃,浸提时间固定为60 min,探究不同料液比(1:15、1:20、1:25、1:30、1:35 g/mL)对FPI提取率的影响。
1.2.4 FPI提取工艺响应面优化试验
根据单因素实验结果,本研究选取了浸提pH(A)、浸提温度(B)、浸提时间(C)以及料液比(D)作为自变量,FPI提取率作为响应值(Y)。为了进一步优化提取工艺,设计四因素三水平的响应面试验。具体试验设计见表1。
表 1 试验因素和水平编码表Table 1. Experimental factors and levels coding table因素 编码水平 −1 0 1 A浸提pH 9 10 11 B浸提温度(℃) 35 45 55 C浸提时间(min) 60 90 120 D料液比(g/mL) 1:20 1:25 1:30 1.2.5 基本成分测定
蛋白质含量:FPI和FM粉末中蛋白质含量按照国标GB/T 5009.5-2016中凯氏定氮法测定,蛋白质折算系数为6.25;水分含量:FPI和FM粉末中水分含量按照国标GB/T 5009.3-2016中直接干燥法测定;灰分含量:FPI和FM粉末中灰分含量按照国标GB 5009.4-2016中总灰分测定法测定;粗脂肪含量:FPI和FM粉末中粗脂肪含量按照国标GB 5009.6-2016中索氏抽提法测定;粗纤维含量:FPI和FM粉末中粗纤维含量按照GB 5009.10-2003植物类食品中粗纤维的测定中的方法进行测定。
总糖含量:参考Zhou等[12]的方法并稍作修改以测定FPI和FM的总糖含量。具体如下:分别取0.1 mg/mL葡萄糖标准溶液0、0.2、0.4、0.6、0.8、1 mL于玻璃试管中,补充蒸馏水至总体积为1 mL,随后各加入1 mL 6%苯酚溶液和5 mL浓硫酸,振荡混匀后室温静置10 min,沸水浴15 min,降温后测定各试管中的溶液在490 nm 处的吸光度。将FPI和FM粉末溶解为0.1 mg/mL的溶液,取1 mL按照上述方法处理后测定溶液的吸光度值。根据标准曲线计算FPI和FM的总糖含量,计算公式如下:
C(%)=XN×100 式中:C为FPI或FM中总糖含量占其总基本成分的百分比,X为样品组吸光度值代入标准曲线后所得值;N为样品稀释倍数。
1.2.6 理化性质测定及结构表征
1.2.6.1 粒径及Zeta电位
参考Yu等[13]的方法测定FPI的粒径及Zeta电位。将FPI溶于蒸馏水中制备1 mg/mL的FPI溶液,并使用0.5 mol/L NaOH和HCl将其分别调节至pH2、3、4、5、6、7、8、9、10、11。在25 ℃条件下使用纳米粒度电位分析仪对FPI分散体的粒径和Zeta电位进行测定。
1.2.6.2 热特性
使用差示扫描量热法(DSC)测定FPI的热特性。精确称取约5~10 mg的FPI,将其置于坩埚中密封,以30 ℃/min的加热速率将样品从30 ℃加热至150 ℃,使用差示扫描量热仪记录FPI的热谱图。在此过程中,密封的空坩埚作为参比。
1.2.6.3 二级结构
取FPI冻干粉末(1 mg)完全混合到溴化钾颗粒中(150 mg),使用压片机压成薄片后,以空气为采集背景,使用傅里叶红外光谱仪(FTIR)在4000~500 cm–1波数范围内扫描64次,使用软件Peak fit 4.12软件拟合分析FPI酰胺Ӏ带中二级结构的含量。
1.2.6.4 微观结构
取适量FPI和FM冻干粉末分别用导电胶固定于扫描电子显微镜(SEM)样品台上,用离子溅射机喷洒金原子涂层,在加速电压为5 kV、放大倍数为200×和500×下观察样品的微观结构。
1.2.7 功能特性
1.2.7.1 溶解度
根据Tirgar等[14]的方法并稍作修改,测定FPI的溶解度(solubility,S)。将FPI粉末溶解在蒸馏水中室温下磁力搅拌过夜以制备10 mg/mL的FPI分散液。使用1 mol/L HCl或NaOH将FPI分散体分别调节至不同的pH(2~11),搅拌15 min后离心(室温,8000 r/min,10 min)。将FPI粉末以10 mg/mL的浓度溶解在0.1 mol/L NaOH溶液中,以上述相同条件离心测定总可溶性蛋白质含量。使用Bradford蛋白测定法(595 nm)定量上清液(包括对照和样品)在不同pH下的可溶性蛋白质含量。FPI的溶解度按照以下公式计算:
S(%)=W2W1×100 式中:W1表示总可溶性蛋白含量,mg/mL;W2表示样品可溶性蛋白含量,mg/mL。
1.2.7.2 持水性
FPI的持水性(water holding capacity,WHC)参考Das等[15]的方法并稍作修改。取1 g FPI样品加入含有10 mL蒸馏水的离心管中,然后对混合物进行涡旋处理,10 min后将溶液分别调节至不同的pH(2~11)后离心(常温,8000 r/min,10 min),弃去上清液并重新称重。FPI的WHC计算公式如下:
WHC(g/g)=m1−m2m0 式中:m0表示样品的质量,g;m1表示离心前样品和离心管的质量,g;m2表示离心后样品和离心管的质量,g。
1.2.7.3 起泡特性
FPI的起泡能力(foaming capacity,FC)和起泡稳定性(foaming stability,FS)参考Yu等[13]的方法测定。取20 mL 10 mg/mL的 FPI分散体用1 mol/L HCl或NaOH分别调至不同的pH(2~11),并分别转移至离心管中,使用高速剪切分散均质机分别均质(10000 r/min,1 min)以产生泡沫,在均质前后,记录分散体的体积。FPI的FC和FS按照以下公式计算:
FC(%)=V1V0×100 FS(%)=V2V1×100 式中:V0表示均质前FPI分散体的体积,mL;V1表示均质1 min后的泡沫体积,mL;V2表示均质30 min后的泡沫体积,mL。
1.2.7.4 乳化特性
FPI的乳化活性(emulsifying activity,EAI)和乳化稳定性(emulsifying stability,ESI)参照Shao等[16]的方法测定。将10 mg/mL的FPI分散体调至不同pH(2~11)后与大豆油(1:1(v/v))混合并均质(10000 r/min,2 min)。随后,将200 μL的混合乳液(取自乳液中间位置)迅速加入到5 mL十二烷基硫酸钠(SDS)(1 mg/mL)中混合均匀,随后立即在500 nm处测定样品的吸光度值,间隔10 min后再次测定。EAI和ESI根据以下公式计算:
EAI(m2/g)=2×2.303×A0×N×10−4θ×L×C ESI(min)=A0×ΔTA0−A10 式中:N表示乳液的稀释度,50;C表示蛋白质的质量浓度,10 mg/mL;θ表示油相的体积分数,0.5;L表示比色皿的光路长度,1 cm;ΔT表示样品均质后再次测定的时间差,min;A0和A10分别表示0 min和10 min时样品在500 nm处测定的吸光度值。
1.2.7.5 凝胶特性
FPI凝胶的制备参考Langton等[17]的方法并稍作修改,将FPI溶于蒸馏水中并搅拌过夜制成蛋白质浓度为11%(w/v)的FPI分散体,充分水合后使用 1 mol/L的NaOH或HCl将FPI分散体分别调至不同的pH(2~11)并磁力搅拌5 min,随后转移至玻璃瓶中密封,在90 ℃条件下水浴30 min,立即冰浴后在4 ℃条件下储存20 h备用。
色度测定:通过分光测色仪测定凝胶的色度。测定前,使用黑白标准化板校准仪器,将凝胶样品切成薄片(厚度为 5 mm)置于透明培养皿中,在相同位置测定样品的L*、a*、b*值。
质构测定:质构测定参考Min等[18]的方法并稍作修改,选择P/100 探头使用质地分析仪测定FPI凝胶的质构特性(直径20 mm,高度20 mm),测前速度 5 mm/s、测试和测试后速度均为 1 mm/s,触发力 5 g,压缩比为50%。
持水性测定:凝胶的持水性(WHC)参考Alavi等[19]的方法测定。将约5 g的凝胶置于50 mL离心管中,精确记录初始质量。然后在室温下8000 r/min 离心20 min。除去释放的水后用滤纸小心擦拭样品表面,再次称量凝胶的质量。凝胶的持水性按照以下公式计算:
WHC(%)=W3−W1W2−W1×100 式中:W1表示50 mL离心管的质量,g;W2表示离心前凝胶和离心管的质量,g;W3表示离心后凝胶和离心管的质量,g。
1.3 数据处理
本研究中,所有实验均重复三次进行,数据表示为平均值±标准差。使用SPSS 26软件进行单因素方差分析(ANOVA),然后采用沃尔德-邓肯法对数据的显著性进行分析,结果为P<0.05时具有统计学显著性,利用 Origin 2018 软件绘制数据图。
2. 结果与分析
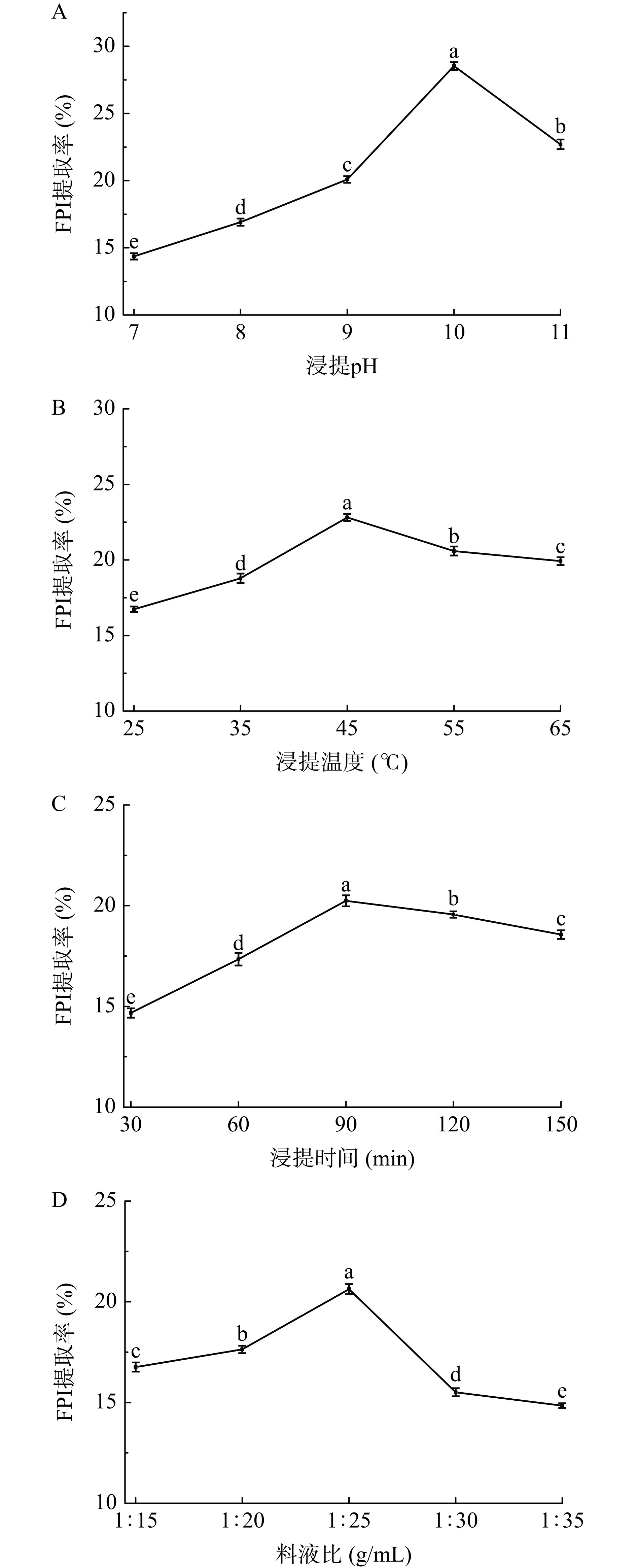
2.1 单因素条件对FPI提取率的影响
不同单因素条件对FPI提取率的影响见图1。如图1(A)所示,当浸提pH从7增加到10时,FPI的提取率显著增加(P<0.05),pH10条件下,FPI的提取率最大,而pH继续增加(pH11)时,提取率则下降。较高的pH会促进蛋白质分子的展开,这是由于静电荷的增加引起了强烈的静电斥力,该过程可能导致蛋白质肽链的断裂,从而破坏了蛋白质的结构,降低了蛋白质提取率[20]。因此,选择浸提pH9、pH10和pH11进行后续响应面试验。
如图1(B)所示,随着浸提温度的增加,FPI的提取率呈现先上升后下降的趋势,浸提温度为45 ℃时提取率最高。浸提温度的升高有利于蛋白质结构的展开,更多的蛋白质溶于水中,进而增加了蛋白质的提取率,而过高的浸提温度会使较多的亚麻籽胶溶出,蛋白质的溶解度降低[21],导致FPI的提取率下降。因此,选择浸提温度35、45和55 ℃进行后续响应面试验。
如图1(C)所示,浸提时间为90 min时FPI的提取率最高,当浸提时间继续增加时,FPI的提取率显著降低(P<0.05)。因为蛋白质的水合作用需要一定时间,而长时间的加热和浸提会使部分蛋白质吸附至空气界面,破坏了蛋白质的结构[16],使蛋白质提取率降低。因此,选择浸提时间60、90和120 min进行后续响应面试验。
如图1(D)所示,提取FPI的最佳料液比为1:25 g/mL。随着料液比从1:15 g/mL增加到1:25 g/mL,FPI提取率呈现上升的趋势,因为增加料液比有助于降低液体的粘度,有利于蛋白质的溶解。当料液比超过1:25 g/mL时,蛋白质提取率则下降。由于FM中亚麻籽胶的存在,低于1:25 g/mL的料液比会使浸提液的黏度增加,影响蛋白质的溶解和沉淀效率;而料液比过高会导致酸沉时球蛋白在上清液中溶解,使蛋白质的提取率降低[22]。因此,选择料液比1:20、1:25和1:30 g/mL进行后续响应面试验。
2.2 碱溶酸沉法提取FPI的工艺优化
2.2.1 响应面设计及结果
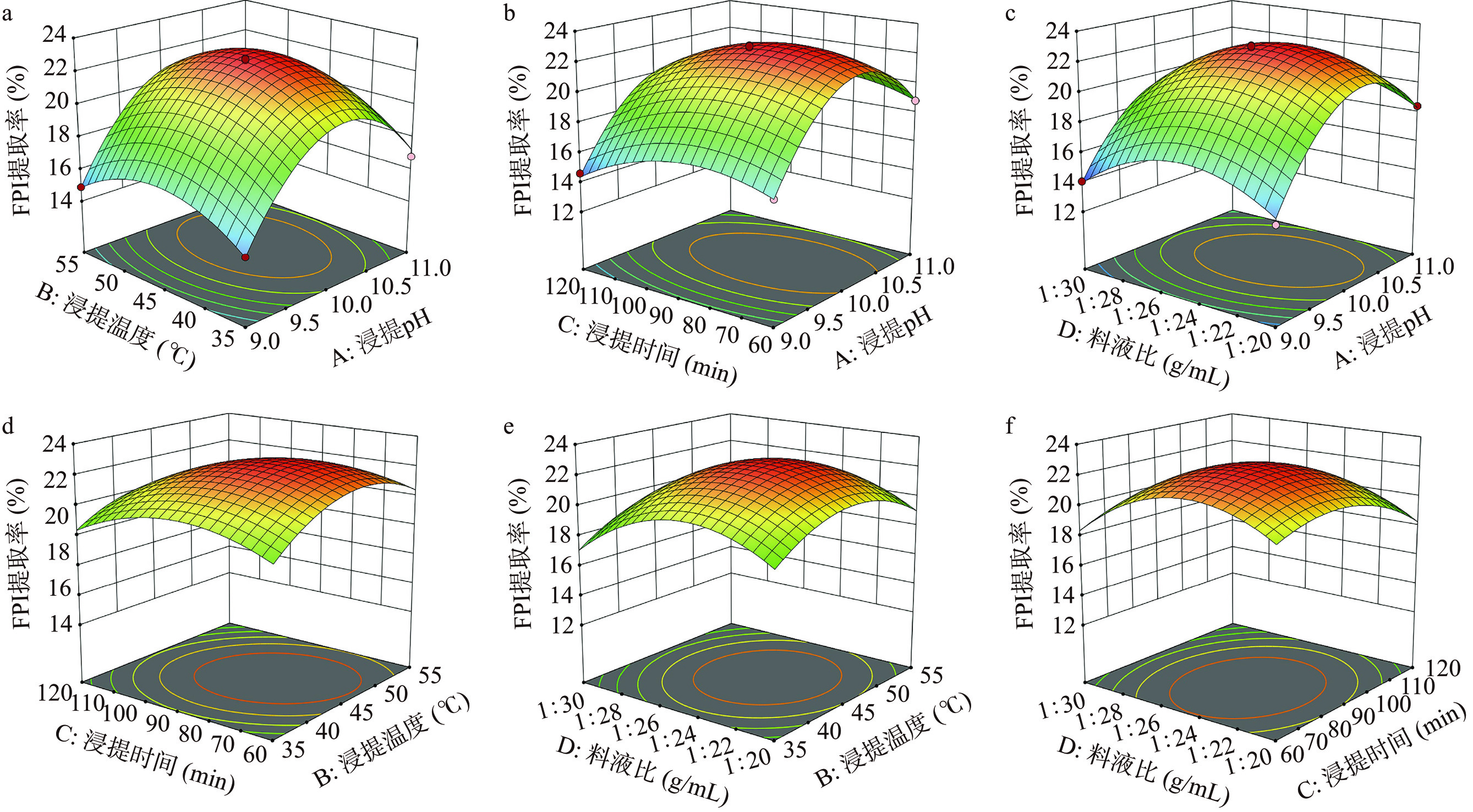
表2为响应面试验设计及结果,通过多元回归拟合得到二次多项式的回归模型,其数学表达式如下:Y(%)=22.60+1.52A+0.3100B−0.7158C−0.6750D+0.25AB+0.0625AC−0.27AD−0.4975BC+0.0575BD+0.1325CD−4.72A2−2.01B2−1.65C2−2.45D2。
表 2 响应面试验设计及结果Table 2. Response surface experiment design and results试验号 A浸提pH B浸提温度 C浸提时间 D料液比 FPI提取率(%) 1 0 1 0 −1 19.35 2 0 1 −1 0 20.64 3 0 0 −1 1 17.78 4 0 0 0 0 21.97 5 0 0 1 −1 18.53 6 0 −1 0 1 17.03 7 −1 0 0 1 14.07 8 −1 0 1 0 14.62 9 0 0 0 0 22.76 10 0 0 0 0 22.81 11 0 0 1 1 16.91 12 0 0 −1 −1 19.93 13 0 −1 −1 0 19.42 14 1 −1 0 0 16.83 15 0 −1 1 0 18.44 16 0 1 1 0 17.67 17 −1 −1 0 0 14.75 18 1 1 0 0 17.97 19 0 −1 0 −1 18.47 20 1 0 0 −1 18.45 21 −1 0 0 −1 14.37 22 0 0 0 0 22.69 23 −1 0 −1 0 15.93 24 0 1 0 1 18.14 25 1 0 0 1 17.07 26 0 0 0 0 22.75 27 1 0 −1 0 18.82 28 −1 1 0 0 14.89 29 1 0 1 0 17.76 2.2.2 回归模型的方差及显著性分析
如表3所示,回归模型差异性极显著(P<0.0001),失拟性不显著(P=0.2923>0.05),表明该二次模型成立。此外,该二次回归方程的一次项A、C、D以及二次项均表现出极显著影响(P<0.01),一次项B和交互项AB表现出显著影响(P<0.05)。由F值可知,影响FPI提取率的因素依次为A>C>D>B,即浸提pH>浸提时间>料液比>浸提温度。由图2响应面3D图可知,两变量交互作用中AB曲面最陡峭,则表明浸提pH和浸提温度交互作用(图2a)对FPI提取率的影响最显著,该结果与回归模型中方差分析结果一致。
表 3 回归模型方差及显著性分析Table 3. Regression model variance and significance analysis方差来源 平方和 自由度 均方 F值 P值 显著性 回归模型 185.92 14 13.28 66.81 <0.0001 ** A-浸提pH 27.82 1 27.82 139.94 <0.0001 ** B-浸提温度 1.15 1 1.15 5.80 0.0304 * C-浸提时间 6.15 1 6.15 30.93 <0.0001 ** D-料液比 5.47 1 5.47 27.51 0.0001 ** AB 0.2500 1 0.2500 4.98 0.0425 * AC 0.0156 1 0.0156 1.26 0.2810 AD 0.2916 1 0.2916 1.47 0.2459 BC 0.9900 1 0.9900 0.0786 0.7833 BD 0.0132 1 0.0132 0.3533 0.8002 CD 0.0702 1 0.0702 0.0665 0.5617 A2 118.09 1 118.09 594.07 <0.0001 ** B2 26.15 1 26.15 131.57 <0.0001 ** C2 17.70 1 17.70 89.03 <0.0001 ** D2 38.79 1 38.79 195.16 <0.0001 ** 残差 2.78 14 0.1988 失拟差 2.29 10 0.2286 1.84 0.2923 不显著 纯误差 0.4971 4 0.1243 总差 188.70 28 注:*表示影响显著,P<0.05;**表示影响极显著,P<0.01。 2.2.3 FPI提取条件优化
通过回归模拟得到碱溶酸沉法提取FPI的最佳工艺条件为浸提pH10.203、浸提温度46.734 ℃、浸提时间89.417 min、料液比1:25.023 g/mL,结合实际操作调整FPI的最佳提取条件为:浸提pH10、浸提温度45 ℃、浸提时间90 min、料液比1:25 g/mL,按照该条件提取FPI,实际测得的FPI的提取率为22.69%,与理论值22.81%相差0.12%,因此建立的二次型模型与实际情况相吻合。
2.3 基本成分分析
FPI的基本成分分析见表4。由表4可知,FM中蛋白质的含量为42.22%±1.89%,经过工艺优化后提取的FPI蛋白质含量为68.64%±2.56%,FPI的蛋白质含量显著高于FM(P<0.05),且高于Lan等[1]报告的值(61.38%)。此外,提取的FPI的基本成分中含有9.10%的总糖,研究表明这些多糖的存在会改善蛋白质的持水性、吸油性、乳化特性等功能特性[23]。
表 4 FM和FPI的基本成分分析Table 4. Basic composition of FM and FPI样品 水分(%) 灰分(%) 粗脂肪(%) 蛋白质(%) 总糖含量(%) 粗纤维含量(%) FM 5.84±0.37b 3.65±0.22a 7.48±0.16a 42.22±1.89b 26.21±2.93a 9.89±0.73a FPI 6.99±0.24a 2.44±0.18b 2.63±0.07b 68.64±2.56a 9.10±1.05b 4.36±0.08b 注:同列不同小写字母表示差异显著(P<0.05)。 2.4 FPI的理化性质及结构表征
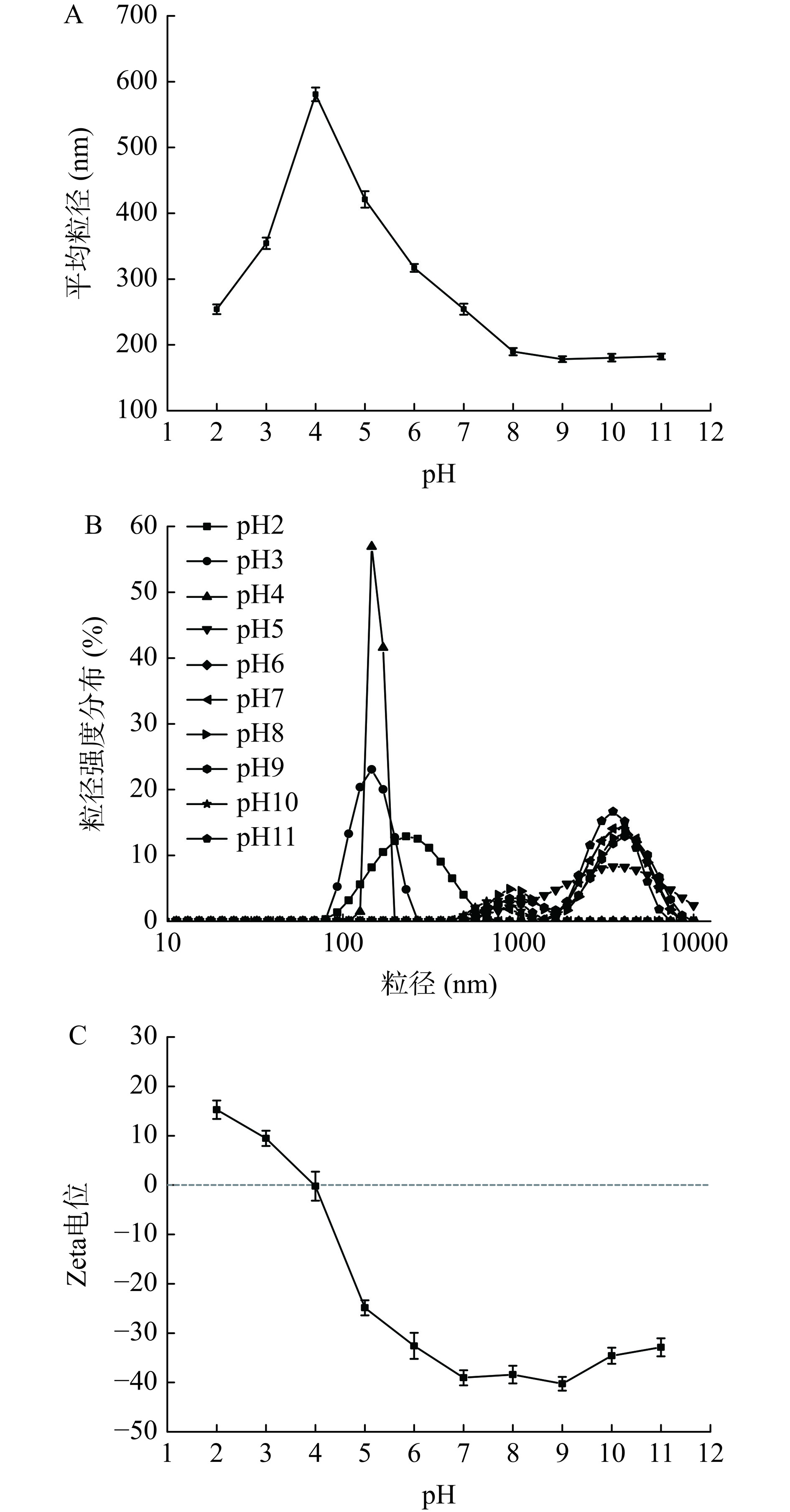
2.4.1 粒径和Zeta电位
不同pH环境下,FPI的Zeta电位变化如图3(C)所示。在pH9时观察到最大的负电荷数量,此时蛋白质表面暴露出更多的阴离子基团。当pH从7降至4时,FPI表面电荷的绝对值也随之减小,pH为4时电荷降为0,此时pH被认为是FPI的等电点(isoelectric point,IEP)。由图3(A)可知,不同pH条件下,FPI的粒径主要分布在100~600 nm之间,在pH4时FPI的平均粒径最大,约为580 nm。如图3(B)所示,pH4时FPI粒径强度分布百分比最高,这可能归因于pH4为蛋白质的IEP,该环境下蛋白质分子间容易发生聚集,导致FPI的平均粒径及粒径分布强度显著增加。当pH远离FPI的IEP时,更多的负电荷产生,静电斥力主导了范德华吸引力,导致带电粒子相互分离表现出较高的溶解度和稳定性[24],因此FPI的平均粒径减小。
2.4.2 热特性
FPI在不同温度条件下的热谱图如图4所示。由图4可知,FPI的热谱图中有一个显著的吸热峰,FPI的变性温度(Td)为84.6 ℃,与先前报道的结果(83~115 ℃)一致[25−26],并且明显高于动物蛋白(如乳清蛋白[27],65.6 ℃)和部分植物蛋白(如豌豆蛋白[28],77.8 ℃)。变性焓值(ΔH)指蛋白质变性需要吸收的热量,通过计算FPI热谱图中吸热峰的面积得到FPI的ΔH为3.06 J/g。FPI表现出较好的热稳定性是由于在提取FPI过程中亚麻籽蛋白-亚麻籽胶之间的静电相互作用增强了FPI的蛋白质结构[29]。
2.4.3 二级结构
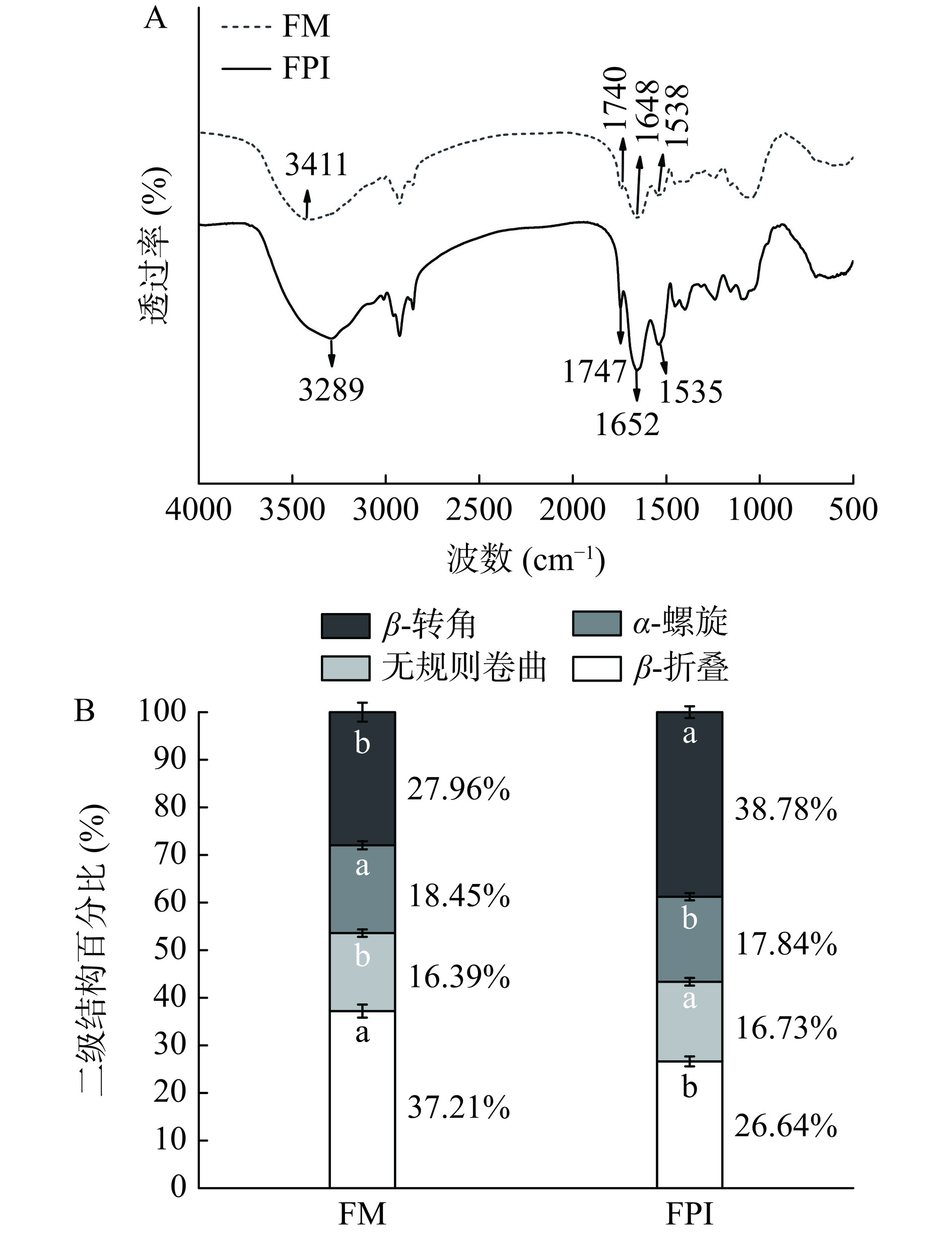
使用FTIR表征FM和FPI的二级结构,对蛋白质的酰胺I带进行反卷积处理并拟合分析其二级结构的变化。如图5(A)所示,与FM相比,FPI的吸收峰发生了位置变化,在3289、1652和1535 cm −1处表现出典型的吸收峰,分别对应于O–H拉伸振动、酰胺I和酰胺II带的羰基(C=O)拉伸和N-H弯曲振动[13]。此外,FPI在1747 cm−1处表现出明显的峰值对应于C=O不对称拉伸振动,该峰值通常在多糖中观察到[30−31]。如图5(B)所示,与FM相比,FPI中β-转角的相对含量增加,而β-折叠和α-螺旋结构的相对含量降低,无规则卷曲相对含量增加。有研究表明,蛋白质中α-螺旋和β-折叠提供蛋白质紧密且稳定的结构[32],而二者含量的降低可能归因于提取过程中极端酸碱环境导致蛋白质构象发生变化,如FPI结构的展开并与亚麻籽胶发生络合[33],最终导致了FPI的二级结构的变化。
2.4.4 微观结构
通过SEM在不同放大倍数下观察的FM和FPI的微观结构,如图6所示,FM的微观结构呈无规则的碎片状结构且相对聚集,而通过碱溶酸沉法提取的FPI结构松散,孔隙较大,呈现典型的冻干板状结构和不规则的鳞片状结构,这可能是FPI提取过程中酸碱环境的变化导致蛋白质结构展开和聚集的结果。FPI的微观结构与Akbarbaglu等[34]和Fang等[35]通过碱溶酸沉法分别提取的亚麻籽蛋白和其他油料蛋白(大麻籽分离蛋白)微观结构相似。
2.5 FPI的功能特性
2.5.1 溶解度
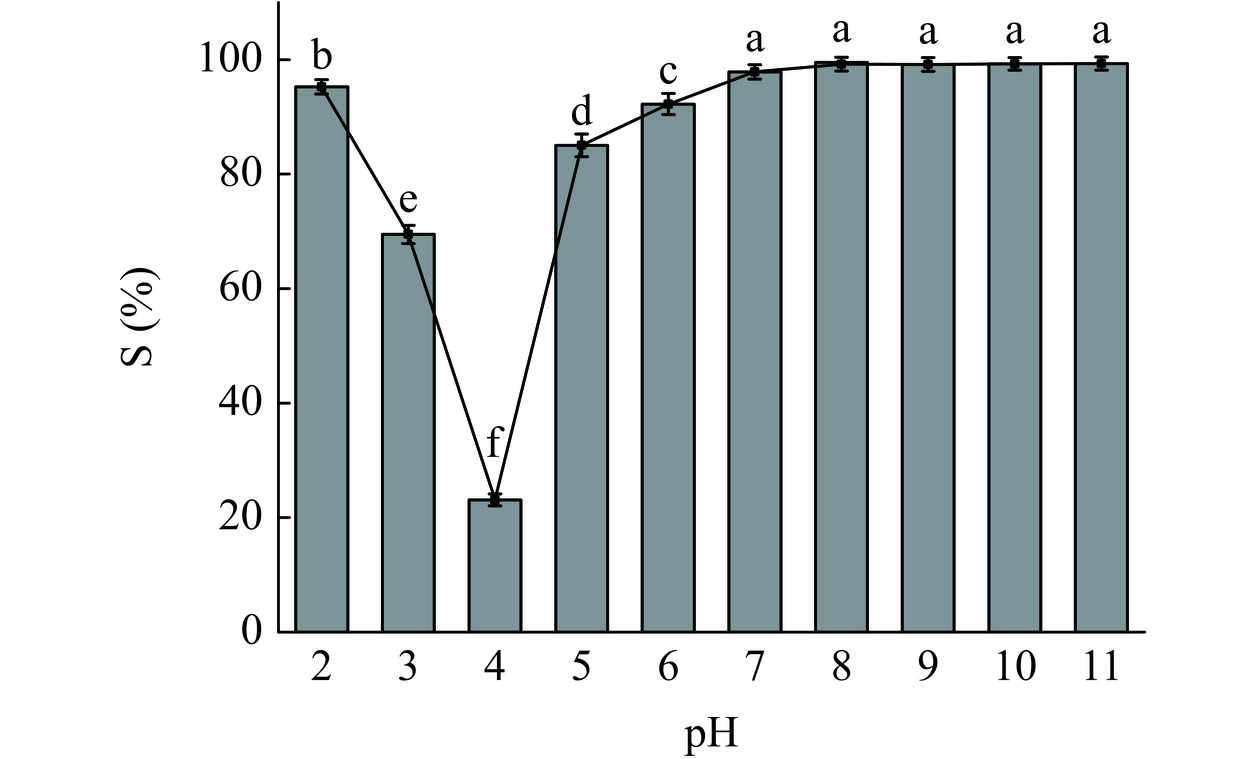
溶解度(S)是蛋白质的关键特性之一,它与蛋白质的起泡特性、乳化特性和凝胶特性密切相关。如图7所示,蛋白质的溶解度曲线基本接近“V”形,且高度依赖于pH的变化。特别是在pH4.0时,蛋白质的溶解度最低(23.09%)。在等电点附近,蛋白质分子间的静电斥力减弱,导致蛋白质通过疏水相互作用发生聚集或沉淀,该结果与图3(C)中FPI的Zeta电位结果一致。远离FPI的IEP时,随着pH的升高,FPI的溶解度先增加后逐渐趋于平衡,在pH8时达到最大值(99.52%)。pH的增加促进了溶液中静电斥力增加,使绝大多数蛋白质处于溶解状态。此外,FPI与亚麻籽胶可以通过静电相互作用形成可溶性络合物,进一步促进了蛋白质的溶解。有研究在其他油籽蛋白(大麻籽蛋白)中也观察到随着pH增加蛋白质溶解度增加的现象[36]。
2.5.2 持水性
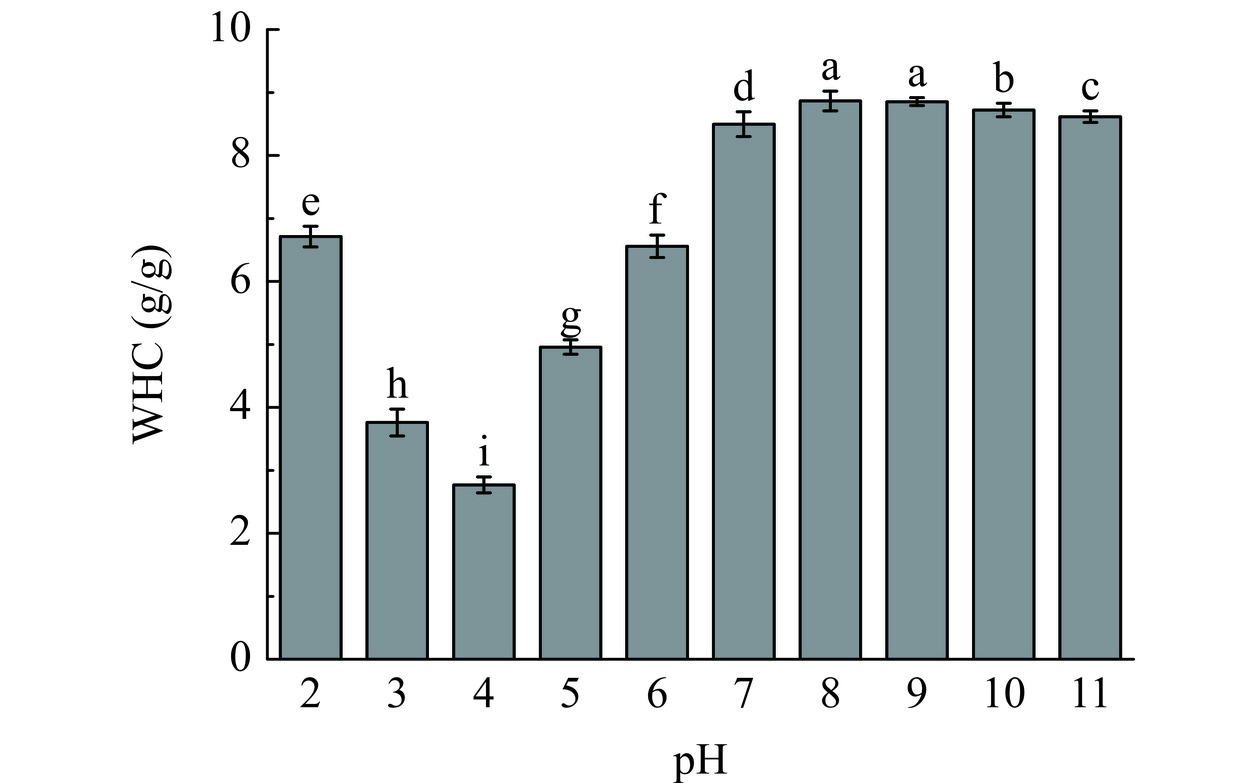
蛋白质的持水性(WHC)与蛋白质粒径和溶解度密切相关,并且依赖于pH的变化。如图8所示,随着pH增加,FPI的WHC呈现先降低后增加的趋势。远离FPI的IEP时(pH5~8),FPI的粒径显著减小(图3(A)),溶解度的增加(图7)促进蛋白质的水合作用,因此FPI的WHC显著增加(P<0.05),pH8时达到最大值8.87 g/g。首先,较小的粒径能够使蛋白质与水分子作用的面积增大并捕获更多的水分子[9],从而增加蛋白质的WHC,其次,WHC含量随着溶解度的增加而增加,这是由于蛋白质形成致密的网络结构可以捕获更多水分子进一步增加FPI的WHC。此外,FPI表现出比大豆蛋白(3.55~8.75 g/g)[37]更高的WHC可能归因于亚麻籽胶的存在增加了蛋白质的亲水性。
2.5.3 起泡特性
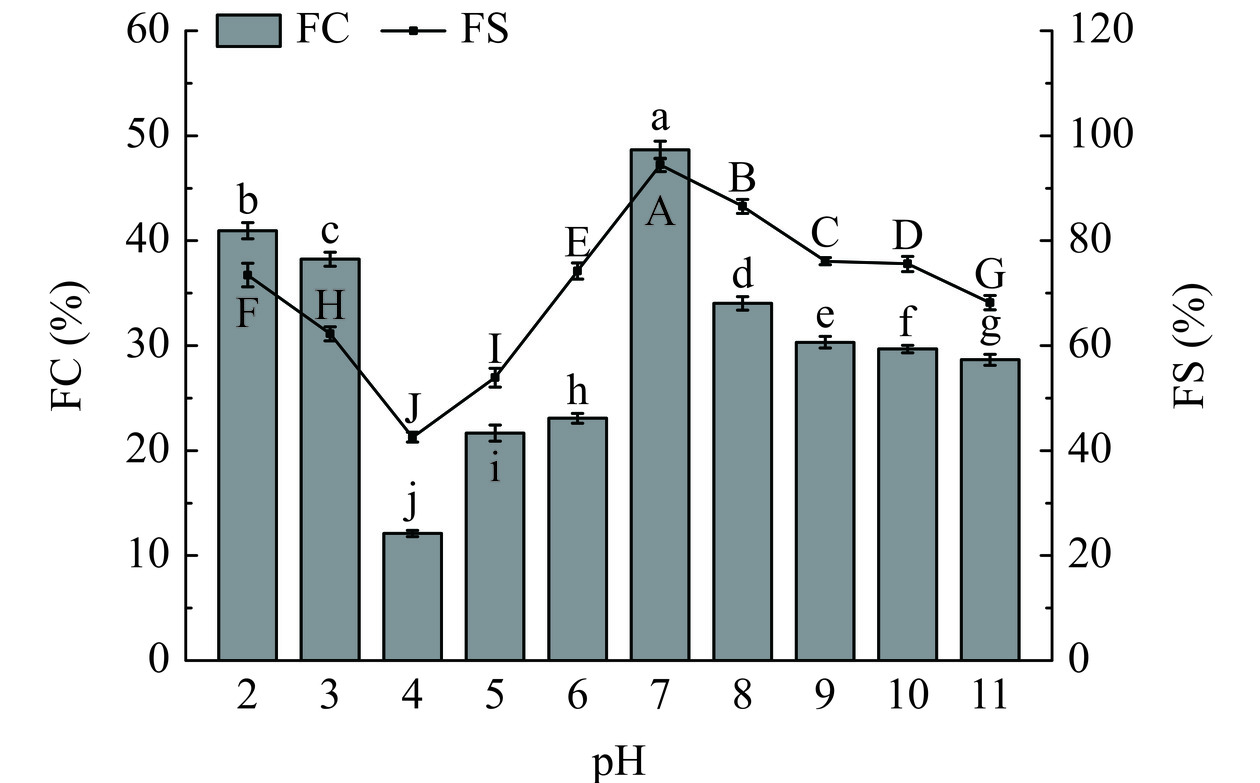
如图9所示,pH对FPI的起泡性(FC)和起泡稳定性(FS)具有显著影响(P<0.05)。随着pH的增加,FPI的FC和FS呈现先降低后增加再降低的趋势,FPI等电点时,FPI的FC和FS最弱,中性环境下(pH7)FPI的FC和FS最强,因为远离蛋白质等电点时,蛋白质结构展开、溶解度增加,有利于蛋白质在气-液界面快速捕获空气形成多层蛋白膜,从而形成更多更稳定的蛋白泡沫,Herneke等[38]也发现了类似的结果。
2.5.4 乳化特性
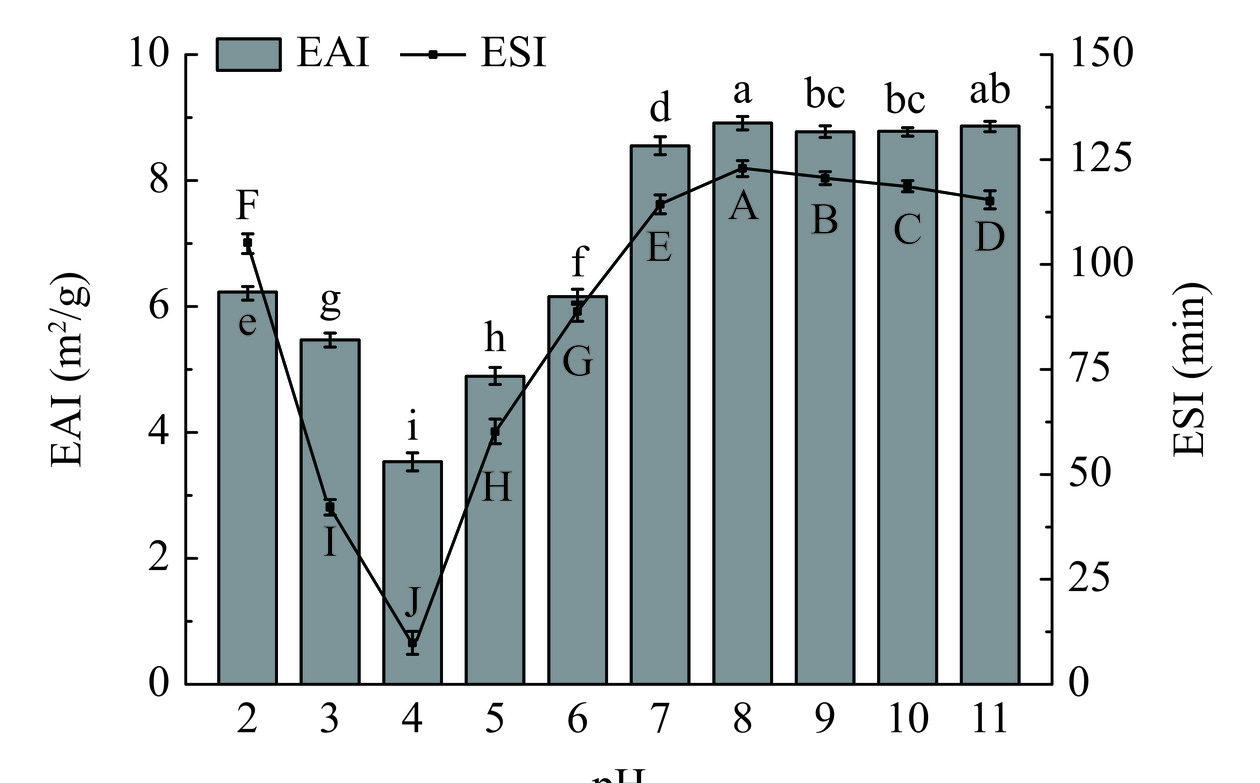
乳化活性(EAI)表示蛋白质在油水界面被吸附的能力,乳化稳定性(ESI)表示形成乳液吸附层的稳定性。如图10所示,随着pH的增加,FPI的EAI先降低后增加,在pH8时达到最大值(8.91 m2/g),因为此时FPI具有较多的表面电荷和较高的溶解度。此外,蛋白质-溶剂相互作用也会促进蛋白质分子更快地扩散并重新排列形成油水界面,Fang等[35]关于大麻籽蛋白的研究也证实了溶解度较高的蛋白质具有更大的EAI。pH4.0时,蛋白质表面净电荷含量降低,静电斥力减弱,导致形油滴聚集现象出现,因此EAI和ESI均降低,且ESI与EAI的变化趋势相似,该结果与马德坤等[7]的研究结果一致。FPI较高的ESI(122.58 min)表明其在碱性环境(pH8)下能够形成更稳定的乳液,具有作为食品乳化剂的潜力。
2.5.5 凝胶特性
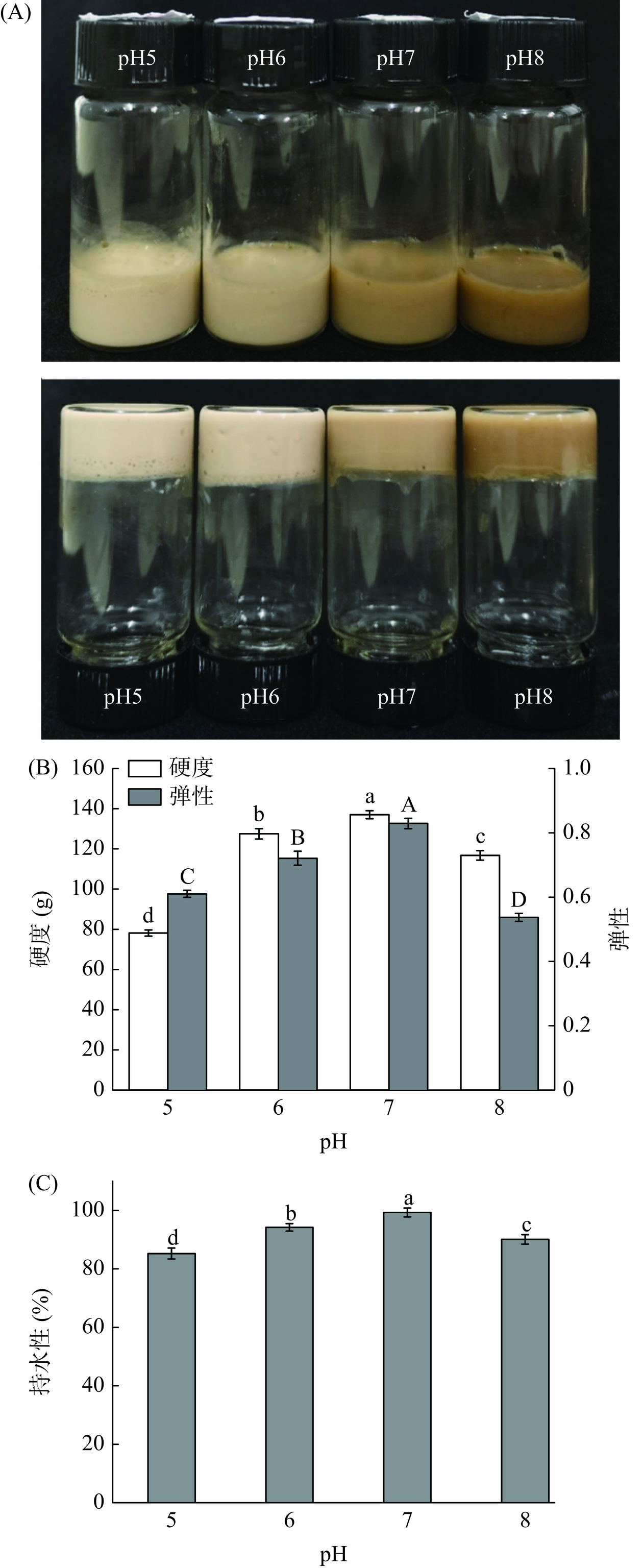
凝胶特性是蛋白质的重要特性之一,在食品加工中具有增稠、胶凝和保水等作用[39]。FPI凝胶的色度、表观图以及凝胶特性如表5和图11所示。在本研究设定的pH条件下(pH2~11),由于强酸(pH2~4)和强碱环境(pH9~11)导致FPI分散体分别呈分层状态和溶融状态,无法形成凝胶,FPI分散体仅在pH(5~8)时形成了具有自支撑力的凝胶,因此选择pH(5~8)条件下形成的FPI凝胶进行后续凝胶特性研究。
表 5 不同pH条件下FPI凝胶的色度Table 5. Color of FPI gels at different pH凝胶样品 L* a* b* pH5 41.52±0.58a 3.94±0.09d 12.79±0.23a pH6 41.12±0.39b 4.76±0.17c 11.42±0.18b pH7 28.89±0.35c 5.32±0.12b 10.34±0.20c pH8 22.74±0.29d 5.95±0.15a 9.97±0.14d 注:不同小写字母表示不同pH条件下样品间差异显著(P<0.05)。 表5和图11(A)所示分别为FPI凝胶的色度和表观图,随着pH的增加,FPI凝胶的颜色发生显著变化。其中L*值随着pH的增加而显著降低(P<0.05),表明凝胶的颜色逐渐由亮色转变为暗色,a*值显著增加(P<0.05)表明凝胶越接近红色;b*值显著降低(P<0.05)表明凝胶的黄色加深。与酸性环境相比,FPI凝胶在中性和碱性环境下(pH7和pH8)的颜色显著加深,逐渐转变为褐色。这可能归因于FPI中亚麻籽胶的存在,温度和pH的增加有利于蛋白质与多糖(亚麻籽胶)之间发生美拉德反应[40]以及蛋白质中含有的酚类化合物的快速氧化[41],因此形成的FPI凝胶发生褐变,颜色加深。
如图11(B)和(C)所示,FPI凝胶的硬度、弹性和持水性随着pH的增加呈现先增加后降低的趋势(P<0.05),且均在pH7条件下具有最大值,分别为137.03 g、0.829和99.29%,该结果与Tang等[42]的研究结果一致。该结果表明在pH7条件下形成的FPI凝胶具有最佳的凝胶特性,此时FPI凝胶具有较好的“刚性”,更均匀、更致密的结构,因此可以捕获更多的水分子。pH8时,FPI凝胶的硬度、弹性和持水性降低可能归因于碱性环境破坏了蛋白质的二级结构,导致蛋白质结构稳定性降低,蛋白质结构孔隙较大。此外,随着pH的变化,FPI凝胶性能的改善可能归因于蛋白质结构的展开,蛋白质-蛋白质之间发生相互作用,以及二硫键含量的变化[43]。
3. 结论
采用碱溶酸沉法提取FPI,最佳工艺参数为:浸提pH10、浸提温度45 ℃、浸提时间90 min、料液比1:25 g/mL,在此条件下蛋白质的提取率为22.69%。FPI变性温度为(84.6 ℃),与FM相比,其β-折叠和α-螺旋相对含量分别降低了10.57%和0.61%,微观结构呈典型的冻干板状结构和不规则的鳞片状。FPI的功能特性对pH具有高度依赖性,远离FPI等电点(pH4)时,FPI的功能特性显著改善。pH8时FPI的溶解度(99.52%)、持水性(8.87 g/g)、乳化性(8.92 m2/g)以及乳化稳定性(122.58 min)最佳。pH7时,FPI的起泡性(48.65%)和起泡稳定性(94.94%)最优,FPI凝胶的硬度(137.03 g)、弹性(0.829)和持水性(99.29%)最大,凝胶特性最佳。
本研究为FPI作为乳化剂或凝胶剂在食品或医药领域的开发利用提供了一定的理论基础,有利于提高FPI的利用价值。由于蛋白质的结构变化会影响其功能特性,因此在后续工作中将进一步深入研究FPI结构的变化与其功能特性之间的关系。
-
表 1 试验因素和水平编码表
Table 1 Experimental factors and levels coding table
因素 编码水平 −1 0 1 A浸提pH 9 10 11 B浸提温度(℃) 35 45 55 C浸提时间(min) 60 90 120 D料液比(g/mL) 1:20 1:25 1:30 表 2 响应面试验设计及结果
Table 2 Response surface experiment design and results
试验号 A浸提pH B浸提温度 C浸提时间 D料液比 FPI提取率(%) 1 0 1 0 −1 19.35 2 0 1 −1 0 20.64 3 0 0 −1 1 17.78 4 0 0 0 0 21.97 5 0 0 1 −1 18.53 6 0 −1 0 1 17.03 7 −1 0 0 1 14.07 8 −1 0 1 0 14.62 9 0 0 0 0 22.76 10 0 0 0 0 22.81 11 0 0 1 1 16.91 12 0 0 −1 −1 19.93 13 0 −1 −1 0 19.42 14 1 −1 0 0 16.83 15 0 −1 1 0 18.44 16 0 1 1 0 17.67 17 −1 −1 0 0 14.75 18 1 1 0 0 17.97 19 0 −1 0 −1 18.47 20 1 0 0 −1 18.45 21 −1 0 0 −1 14.37 22 0 0 0 0 22.69 23 −1 0 −1 0 15.93 24 0 1 0 1 18.14 25 1 0 0 1 17.07 26 0 0 0 0 22.75 27 1 0 −1 0 18.82 28 −1 1 0 0 14.89 29 1 0 1 0 17.76 表 3 回归模型方差及显著性分析
Table 3 Regression model variance and significance analysis
方差来源 平方和 自由度 均方 F值 P值 显著性 回归模型 185.92 14 13.28 66.81 <0.0001 ** A-浸提pH 27.82 1 27.82 139.94 <0.0001 ** B-浸提温度 1.15 1 1.15 5.80 0.0304 * C-浸提时间 6.15 1 6.15 30.93 <0.0001 ** D-料液比 5.47 1 5.47 27.51 0.0001 ** AB 0.2500 1 0.2500 4.98 0.0425 * AC 0.0156 1 0.0156 1.26 0.2810 AD 0.2916 1 0.2916 1.47 0.2459 BC 0.9900 1 0.9900 0.0786 0.7833 BD 0.0132 1 0.0132 0.3533 0.8002 CD 0.0702 1 0.0702 0.0665 0.5617 A2 118.09 1 118.09 594.07 <0.0001 ** B2 26.15 1 26.15 131.57 <0.0001 ** C2 17.70 1 17.70 89.03 <0.0001 ** D2 38.79 1 38.79 195.16 <0.0001 ** 残差 2.78 14 0.1988 失拟差 2.29 10 0.2286 1.84 0.2923 不显著 纯误差 0.4971 4 0.1243 总差 188.70 28 注:*表示影响显著,P<0.05;**表示影响极显著,P<0.01。 表 4 FM和FPI的基本成分分析
Table 4 Basic composition of FM and FPI
样品 水分(%) 灰分(%) 粗脂肪(%) 蛋白质(%) 总糖含量(%) 粗纤维含量(%) FM 5.84±0.37b 3.65±0.22a 7.48±0.16a 42.22±1.89b 26.21±2.93a 9.89±0.73a FPI 6.99±0.24a 2.44±0.18b 2.63±0.07b 68.64±2.56a 9.10±1.05b 4.36±0.08b 注:同列不同小写字母表示差异显著(P<0.05)。 表 5 不同pH条件下FPI凝胶的色度
Table 5 Color of FPI gels at different pH
凝胶样品 L* a* b* pH5 41.52±0.58a 3.94±0.09d 12.79±0.23a pH6 41.12±0.39b 4.76±0.17c 11.42±0.18b pH7 28.89±0.35c 5.32±0.12b 10.34±0.20c pH8 22.74±0.29d 5.95±0.15a 9.97±0.14d 注:不同小写字母表示不同pH条件下样品间差异显著(P<0.05)。 -
[1] LAN Y, OHM J B, CHEN B, et al. Physicochemical properties and aroma profiles of flaxseed proteins extracted from whole flaxseed and flaxseed meal[J]. Food Hydrocolloids,2020,104:105731. doi: 10.1016/j.foodhyd.2020.105731
[2] NIU D, ZHANG M, MUJUMDAR A S, et al. Investigation of 3D printing of toddler foods with special shape and function based on fenugreek gum and flaxseed protein[J]. International Journal of Biological Macromolecules,2023,253:127203. doi: 10.1016/j.ijbiomac.2023.127203
[3] KAUSER S, HUSSAIN A, ASHRAF S, et al. Flaxseed (Linum usitatissimum); phytochemistry, pharmacological characteristics and functional food applications[J]. Food Chemistry Advances,2024,4:100573. doi: 10.1016/j.focha.2023.100573
[4] WU S, WANG X, QI W, et al. Bioactive protein/peptides of flaxseed:A review[J]. Trends in Food Science & Technology,2019,92:184−193.
[5] ZHANG R, FANG X, FENG Z, et al. Protein from rapeseed for food applications:Extraction, sensory quality, functional and nutritional properties[J]. Food Chemistry,2024,439:138109. doi: 10.1016/j.foodchem.2023.138109
[6] KAUSHIK P, DOWLING K, MCKNIGHT S, et al. Preparation, characterization and functional properties of flax seed protein isolate[J]. Food Chemistry,2016,197:212−220. doi: 10.1016/j.foodchem.2015.09.106
[7] 马德坤, 王汝华, 吕筱, 等. 亚麻籽蛋白特性及营养价值分析[J]. 食品科学,2022,43(6):257−264. [MA D K, WANG R H, LÜ X, et al. Physicochemiacl and functional properties and nutritional value of flaxseed protein[J]. Food Science,2022,43(6):257−264.] doi: 10.7506/spkx1002-6630-20210331-402 MA D K, WANG R H, LÜ X, et al. Physicochemiacl and functional properties and nutritional value of flaxseed protein[J]. Food Science, 2022, 43(6): 257−264. doi: 10.7506/spkx1002-6630-20210331-402
[8] MA X, HUANG C, ZHENG C, et al. Effect of oil extraction methods on walnut oil quality characteristics and the functional properties of walnut protein isolate[J]. Food Chemistry,2024,438:138052. doi: 10.1016/j.foodchem.2023.138052
[9] JULAKANTI S, CHARLES A P R, ZHAO J, et al. Hempseed protein (Cannabis sativa L.):Influence of extraction pH and ball milling on physicochemical and functional properties[J]. Food Hydrocolloids,2023,143:108835. doi: 10.1016/j.foodhyd.2023.108835
[10] 张金凤, 韩燕红, 王宇慧, 等. pH值对清水河春箭筈豌豆分离蛋白功能特性的影响[J]. 草学,2023(6):29−34. [ZHANG J F, HAN Y H, WANG Y H, et al. Effect of pH value on the functional characteristics of the spring common vetch variety "Qingshuihe" isolate protein[J]. Herbology,2023(6):29−34.] doi: 10.3969/j.issn.2096-3971.2023.06.005 ZHANG J F, HAN Y H, WANG Y H, et al. Effect of pH value on the functional characteristics of the spring common vetch variety "Qingshuihe" isolate protein[J]. Herbology, 2023(6): 29−34. doi: 10.3969/j.issn.2096-3971.2023.06.005
[11] 宋喜霞, 张莉莉, 陈晶, 等. 亚麻籽酶解脱胶工艺研究[J]. 黑龙江农业科学,2017(12):67−69. [SONG X X, ZHANG L L, CHEN J, et al. Study on degumming process of flaxseed by enzymatic hydrolysis[J]. Agricultural Science of Heilongjiang,2017(12):67−69.] SONG X X, ZHANG L L, CHEN J, et al. Study on degumming process of flaxseed by enzymatic hydrolysis[J]. Agricultural Science of Heilongjiang, 2017(12): 67−69.
[12] ZHOU S, HUANG G, CHEN G. Extraction, structural analysis, derivatization and antioxidant activity of polysaccharide from Chinese yam[J]. Food Chemistry,2021,361:130089. doi: 10.1016/j.foodchem.2021.130089
[13] YU X, DUAN Z Q, QIN X P, et al. Elucidation of the structure, antioxidant, and interfacial properties of flaxseed proteins tailored by microwave treatment[J]. Journal of Integrative Agriculture,2023,22(5):1574−1589. doi: 10.1016/j.jia.2023.04.021
[14] TIRGAR M, SILCOCK P, CARNE A, et al. Effect of extraction method on functional properties of flaxseed protein concentrates[J]. Food Chemistry,2017,215:417−424. doi: 10.1016/j.foodchem.2016.08.002
[15] DAS D, MIR N A, CHANDLA N K, et al. Combined effect of pH treatment and the extraction pH on the physicochemical, functional and rheological characteristics of amaranth (Amaranthus hypochondriacus) seed protein isolates[J]. Food Chemistry,2021,353:129466. doi: 10.1016/j.foodchem.2021.129466
[16] SHAO J, YANG J, JIN W, et al. Regulation of interfacial mechanics of soy protein via co-extraction with flaxseed protein for efficient fabrication of foams and emulsions[J]. Food Research International,2024,175:113673. doi: 10.1016/j.foodres.2023.113673
[17] LANGTON M, EHSANZAMIR S, KARKEHABADI S, et al. Gelation of faba bean proteins-Effect of extraction method, pH and NaCl[J]. Food Hydrocolloids,2020,103:105622. doi: 10.1016/j.foodhyd.2019.105622
[18] MIN C, ZHANG C, CAO Y, et al. Rheological, textural, and water-immobilizing properties of mung bean starch and flaxseed protein composite gels as potential dysphagia food:The effect of astragalus polysaccharide[J]. International Journal of Biological Macromolecules,2023,239:124236. doi: 10.1016/j.ijbiomac.2023.124236
[19] ALAVI F, EMAM-DJOMEH Z, MOMEN S, et al. Fabrication and characterization of acid-induced gels from thermally-aggregated egg white protein formed at alkaline condition[J]. Food Hydrocolloids,2020,99:105337. doi: 10.1016/j.foodhyd.2019.105337
[20] 李朝阳, 李良玉, 刁静静. pH和温度对蛋白结构和功能特性影响的研究进展[J]. 科学技术创新,2019(18):59−60. [LI C Y, LI L Y, DIAO J J. Advances in the study of the effects of pH and temperature on the structural and functional properties of proteins[J]. Technological and Scientific Innovation,2019(18):59−60.] doi: 10.3969/j.issn.1673-1328.2019.18.034 LI C Y, LI L Y, DIAO J J. Advances in the study of the effects of pH and temperature on the structural and functional properties of proteins[J]. Technological and Scientific Innovation, 2019(18): 59−60. doi: 10.3969/j.issn.1673-1328.2019.18.034
[21] POHJANHEIMO T A, HAKALA M A, TAHVONEN R L, et al. Flaxseed in breadmaking:Effects on sensory quality, aging, and composition of bakery products[J]. Journal of Food Science,2006,71(4):343−348.
[22] 杨文清, 罗凯, 陈耀兵. 山桐子蛋白提取工艺优化及功能特性研究[J]. 中国粮油学报,2024,39(3):89−97. [YANG W Q, LUO K, CHEN Y B. Optimization of the extraction process and functional properties of Idesia polycarpa Maxim. protein[J]. Journal of the Chinese Cereals and Oils Association,2024,39(3):89−97.] YANG W Q, LUO K, CHEN Y B. Optimization of the extraction process and functional properties of Idesia polycarpa Maxim. protein[J]. Journal of the Chinese Cereals and Oils Association, 2024, 39(3): 89−97.
[23] 赵荣敏. 亚麻籽胶浓度对大豆分离蛋白功能特性的影响[J]. 中国饲料,2022(9):42−46. [ZHAN R M. Effect of flaxseed gum concentration on the functional characteristics of soy protein isolate[J]. China Feed,2022(9):42−46.] ZHAN R M. Effect of flaxseed gum concentration on the functional characteristics of soy protein isolate[J]. China Feed, 2022(9): 42−46.
[24] DO D T, YE A, SINGH H, et al. Protein bodies from hemp seeds:Isolation, microstructure and physicochemical characterization[J]. Food Hydrocolloids,2024,149:109597. doi: 10.1016/j.foodhyd.2023.109597
[25] BEKHIT A E-D A, SHAVANDI A, JODJAJA T, et al. Flaxseed:Composition, detoxification, utilization, and opportunities[J]. Biocatalysis and Agricultural Biotechnology,2018,13:129−152. doi: 10.1016/j.bcab.2017.11.017
[26] RIAZI F, TEHRANI M, LAMMERS V, et al. Unexpected morphological modifications in high moisture extruded pea-flaxseed proteins:Part I, topological and conformational characteristics, textural attributes, and viscoelastic phenomena[J]. Food Hydrocolloids,2023,136:108304. doi: 10.1016/j.foodhyd.2022.108304
[27] LI L, LAI B, YAN J N, et al. Characterization of complex coacervation between chia seed gum and whey protein isolate:Effect of pH, protein/polysaccharide mass ratio and ionic strength[J]. Food Hydrocolloids,2024,148:109445. doi: 10.1016/j.foodhyd.2023.109445
[28] TANGER C, ENGEL J, KULOZIK U. Influence of extraction conditions on the conformational alteration of pea protein extracted from pea flour[J]. Food Hydrocolloids,2020,107:105949. doi: 10.1016/j.foodhyd.2020.105949
[29] NIU F, KOU M, FAN J, et al. Structural characteristics and rheological properties of ovalbumin-gum arabic complex coacervates[J]. Food Chemistry,2018,260:1−6. doi: 10.1016/j.foodchem.2018.03.141
[30] LIANG S, LIAO W, MA X, et al. H2O2 oxidative preparation, characterization and antiradical activity of a novel oligosaccharide derived from flaxseed gum[J]. Food Chemistry,2017,230:135−144. doi: 10.1016/j.foodchem.2017.03.029
[31] MUHOZA B, XIA S, CAI J, et al. Gelatin and pectin complex coacervates as carriers for cinnamaldehyde:Effect of pectin esterification degree on coacervate formation, and enhanced thermal stability[J]. Food Hydrocolloids,2019,87:712−722. doi: 10.1016/j.foodhyd.2018.08.051
[32] JEONG M S, CHO S J. Effect of pH-shifting on the water holding capacity and gelation properties of mung bean protein isolate[J]. Food Research International,2024,177:113912. doi: 10.1016/j.foodres.2023.113912
[33] KAUSHIK P, DOWLING K, BARROW C J, et al. Complex coacervation between flaxseed protein isolate and flaxseed gum[J]. Food Research International,2015,72:91−97. doi: 10.1016/j.foodres.2015.03.046
[34] AKBARBAGLU Z, MAHDI JAFARI S, SARABANDI K, et al. Influence of spray drying encapsulation on the retention of antioxidant properties and microstructure of flaxseed protein hydrolysates[J]. Colloids and Surfaces B:Biointerfaces,2019,178:421−429. doi: 10.1016/j.colsurfb.2019.03.038
[35] FANG B, CHANG L, OHM J B, et al. Structural, functional properties, and volatile profile of hemp protein isolate as affected by extraction method:Alkaline extraction–isoelectric precipitation vs salt extraction[J]. Food Chemistry,2023,405:135001. doi: 10.1016/j.foodchem.2022.135001
[36] XU P W, YUAN X F, ZHAO B. A study on pH-mediated variations and differences in the structure and function of hemp seed albumin, globulin, and protein isolate[J]. Food Bioscience,2023,56:103452. doi: 10.1016/j.fbio.2023.103452
[37] ZHANG L, LI Q, ZHANG W, et al. Different source of commercial soy protein isolates:Structural, compositional, and physicochemical characteristics in relation to protein functionalities[J]. Food Chemistry,2024,433:137315. doi: 10.1016/j.foodchem.2023.137315
[38] HERNEKE A, KARKEHABADI S, LU J, et al. Protein nanofibrils from mung bean:The effect of pH on morphology and the ability to form and stabilise foams[J]. Food Hydrocolloids,2023,136:108315. doi: 10.1016/j.foodhyd.2022.108315
[39] TANG Q, ROOS Y H, MIAO S. Structure, gelation mechanism of plant proteins versus dairy proteins and evolving modification strategies[J]. Trends in Food Science & Technology,2024,147:104464.
[40] ZHANG Y, ZHANG Z, FU Y, et al. Effects of different pH on properties of heat-induced Auricularia auricula-judae polysaccharide-whey protein isolate composite gels[J]. Food Structure,2023,36:100317. doi: 10.1016/j.foostr.2023.100317
[41] ALY'DATT M H, RABABAH T, EREIFEJ K, et al. Phenolic–protein interactions in oilseed protein isolates[J]. Food Research International,2013,52(1):178−184. doi: 10.1016/j.foodres.2013.03.010
[42] TANG Q, ROOS Y H, MIAO S. Comparative studies of structural and thermal gelation behaviors of soy, lentil and whey protein:A pH-dependency evaluation[J]. Food Hydrocolloids,2024,146:109240. doi: 10.1016/j.foodhyd.2023.109240
[43] TANG Q, ROOS Y H, VAHEDIKIA N, et al. Evaluation on pH-dependent thermal gelation performance of chickpea, pea protein, and casein micelles[J]. Food Hydrocolloids,2024,149:109618. doi: 10.1016/j.foodhyd.2023.109618





 下载:
下载:


 下载:
下载:



