Effect of Ozone Combined with 1-MCP on the Color and Quality of Nectarines during Postharvest Storage
-
摘要: 为探究臭氧调控方式对经1-甲基环丙烯(1-MCP)处理后的油桃在冷藏过程中的色泽和品质变化的影响,以油桃为试材,采后用1 μL/L 1-MCP熏蒸24 h以及1-MCP熏蒸分别结合臭氧水雾化和臭氧气体熏蒸30 min后包装,然后于0±0.5 ℃条件下贮藏,定期测定相关理化指标。结果表明,1-MCP联合臭氧处理能有效抑制呼吸速率和乙烯产量。单独1-MCP处理抑制果肉中花青素的积累,阻碍了果肉的红色着色,而1-MCP联合臭氧处理在贮藏后期促进了果肉的红色着色。与单独1-MCP组相比,1-MCP联合臭氧处理组在贮藏后期花青素含量、矢车菊素-3-O-葡萄糖苷、矢车菊素-3-O-芸香糖苷含量和花青素代谢相关酶活性较高,同时,臭氧气体熏蒸的方式更有利于贮藏后期花青素的积累,果肉红色度更高。该研究为改善果实采后色泽调控以及优化1-MCP在采后保鲜中的应用提供了新的思路。Abstract: In order to investigate the effect of ozone regulation on the color and quality changes of nectarine treated with 1-methylcyclopropylene (1-MCP) during cold storage, nectarine test materials were fumigated with 1 μL/L 1-MCP for 24 h after postharvest, combined with ozone water atomization and ozone gas fumigation for 30 min, then packaged and stored at 0±0.5 ℃. The relevant physicochemical indexes were determined regularly. Results showed that 1-MCP combined with ozone treatment could effectively inhibit respiration rate and ethylene release, 1-MCP alone inhibited anthocyanin accumulation in pulp, hindering its red coloring, and 1-MCP combined with ozone treatment promoted red coloring in pulp at the later stage of storage. Compared with 1-MCP group alone, 1-MCP group combined with ozone treatment had higher anthocyanin content, centaurin-3-O-glucoside content, centaurin-3-O-rutin content and enzyme activity related to anthocyanin metabolism at the later stage of storage. Meanwhile, ozone gas fumigation was more conducive to anthocyanin accumulation at the later stage of storage, and the flesh red degree was higher. This study provides a new idea for improving the control of postharvest color and optimizing the application of 1-MCP in postharvest preservation.
-
Keywords:
- nectarine /
- 1-MCP /
- ozone /
- anthocyanin metabolism /
- color control
-
油桃(Prunus persica L. Batsch, var. nectarine)富含纤维、多酚、维生素C、氨基酸和胡萝卜素,果面鲜红,肉质鲜美,深受市场欢迎,我国油桃年产量约1500万吨[1−2]。果肉和果皮的颜色是影响消费者接受度的关键因素,而果实的变色与色素的积累密切相关[3]。花青素是植物重要的次生代谢物,其通过羟基与不同的糖结合,以糖苷的形式存在并赋予水果蓝色、橙色、紫色和红色[4−5]。桃中的花青素主要包括矢车菊素-3-O-葡萄糖苷和矢车菊素-3-O-芸香糖苷,二者使果肉具有良好的红色。此外,花青素在结构上包含多个酚羟基,具有抗氧化和保护作用,可增强对非生物和生物胁迫的耐受性[6]。花青素的生物合成和稳定性受温度、光照、乙烯等多种环境因子的调控,其中乙烯是一个重要的调节因子[7]。果实在成熟后期会发生各种不可逆的变化,乙烯会加速水果的呼吸速率,导致过熟和品质劣变,同时乙烯会导致果肉的颜色变化,诱导花青素积累,增加果实的红色[8]。因此,乙烯清除剂/抑制剂在成熟过程中的应用对保持采后果实品质起着重要作用。
1-MCP是一种内源性乙烯抑制剂,它通过阻断乙烯受体结合位点发挥作用[9],被广泛用于水果、蔬菜、花卉等园艺产品的延缓成熟和品质维持[10]。然而,相关研究表明,1-MCP处理会减少果实花青素的生物合成,延缓了果肉在贮藏过程中的变红,导致油桃和李子的外观和营养特性变差[10−11]。也有研究指出1-MCP处理会加剧桃子、梨和杏的病害和生理失调[12−14]。因此,有必要采用1-MCP协同处理方式,在不抑制花青素合成的情况下调节乙烯水平,确保果实具有较高的品质和商品性。
臭氧(O3)是另一种乙烯清除剂,其具有较强的氧化能力、乙烯氧化能力和广谱杀菌性,在果蔬采后商品化处理过程中应用广泛[15]。臭氧处理通过抑制AdACO1和AdACS1表达以及降低ACC氧化酶(ACO)和ACC合成酶(ACS)酶活性来抑制呼吸跃变型猕猴桃呼吸过程中乙烯产生[16]。O3处理通过上调苹果McF3H、McANR、McCHI和McANS基因的表达来促进花青素的积累,从而提高其对非生物胁迫的抗性[8]。截止目前,对1-MCP处理对油桃采后贮藏花青素生物合成和调控机制鲜有报道,本研究旨在探讨应用O3对1-MCP处理后油桃果肉变色和花青素积累的影响,为弥补1-MCP对油桃果实色泽的不良影响,提高果实商品性提供依据。
1. 材料与方法
1.1 材料与仪器
油桃 产自中国河北省秦皇岛市的果园,选取无病征、无机械损伤、形状、大小、颜色均匀的果实进行试验;1-MCP 有效成分含量3.3%,咸阳西秦生物科技有限公司;酚酞、乙醇、氢氧化钠、氯化钡、草酸、邻苯二甲酸氢钾、福林酚、硫代巴比妥酸、考马斯亮蓝、无水乙醇、二甲苯、环保型脱蜡透明液、番红固绿(植物)染液 分析纯,北京索莱宝科技有限公司;矢车菊素-3-O-葡萄糖苷、矢车菊素-3-O-芸香糖苷标准品 北京索莱宝科技有限公司。
FL-803A便携式臭氧发生器 深圳市飞立电器科技有限公司;XY-SJ-5 臭氧水雾化机 广州心宇机电设备有限公司;GT-903-O3 泵吸式臭氧检测仪、ST-GX10 果蔬呼吸速率测试仪 山东三体仪器有限公司;GC-2014 气相色谱仪 日本岛津公司;GY-4果实硬度计 山东莱恩德智能科技有限公司;PAL-3折光仪 日本爱拓公司;FD-1-A-50 冷冻干燥机 上海达洛科学仪器有限公司;UV759紫外可见分光光度计 广州沪瑞明仪器有限公司;CR-400色差计 杭州柯盛仪器有限公司;HT-TE023 冷冻离心机 上海徽涛自动化设备有限公司;ML1203电子天平 厦门莱斯德科学仪器有限公司;ECLIPSE E100 正置光学显微镜、DS-U3 成像系统 日本尼康公司;JB-P5 包埋机 武汉俊杰电子有限公司;RM2016 病理切片机 上海徕卡仪器有限公司;1260 Infinity II高效液相色谱仪 美国安捷伦公司。
1.2 实验方法
1.2.1 1-MCP结合臭氧处理
油桃样品采收后立即运输到实验室,果实采用塑料框装并被随机分成三组,每组处理30 kg,分别为设置为处理1:对照组(1-MCP),处理2:1-MCP联合臭氧水雾化组(1-MCP+AtO3),处理3:1-MCP联合臭氧气体熏蒸组(1-MCP+FuO3)。三个处理分别设计3个处理大帐(体积约1.5 m3),大帐内含有微型循环风扇(风速的循环风速为0.6±0.1 m/s)的大帐内进行1-MCP熏蒸处理。处理1只进行1 μL/L 1-MCP室温(18±1 ℃)熏蒸处理24 h;处理2大帐外接雾化管道,在进行1 μL/L 1-MCP熏蒸处理24 h的过程中,进行臭氧水雾化处理(浓度20 μL/L,雾化时间30 min);处理3在进行1 μL/L 1-MCP熏蒸处理24 h的过程中,进行臭氧气体熏蒸处理(浓度20 μL/L,熏蒸时间30 min)。处理24 h后,各个处理组的果实采用0.03 mm厚的聚乙烯袋包装,然后置于冷库(温度0±0.5 ℃、湿度90%~95% RH)下贮藏,在第0、6、12、18、24和30 d取样测定相关理化指标,每个处理重复3次。
1.2.2 测定指标和方法
1.2.2.1 呼吸速率
采用果蔬呼吸速率测试仪测定,参考Du等[12]的方法测定。
X=(W2−W1) × V × M × 1000V0× m × t 式中,X表示呼吸速率(mg CO2/(kg·h));M表示CO2的摩尔质量(g/mol);V为呼吸室总容积(L);W1、W2分别为空白呼吸室总CO2(%)和测量后呼吸室总CO2(%);t表示测量时间(h),m表示新鲜油桃重量(kg);V0为一定温度下CO2摩尔体积(L/mol)。
1.2.2.2 乙烯产量
采用气相色谱仪测定,参照Jia等[17]的方法测定。
1.2.2.3 失重率
参考Jia等[17]的方法测定,分3个重复进行失重率测定,每个重复800 g/袋。
失重率(%)=Wi−WfWi×100 式中,Wf为油桃贮藏期的重量(g),Wi为贮藏0 d时油桃初始重量(g)。
1.2.2.4 可溶性固形物(SSC)
SSC采用PAL-3手持折光仪进行测定,方法参考Jia等[17]的方法测定。
1.2.2.5 可滴定酸(TA)
采用碱滴定法测定,参考Jia等[17]的方法测定,单位以%计。
1.2.2.6 硬度
采用GY-4果实硬度计测定,参考Jia等[17]的方法测定,结果以N表示。
1.2.2.7 色差
由精密色差仪(CR-400)测定,沿果皮赤道面上相对两个部位测定果实色差值,以L*、a*、b*表示。
1.2.2.8 细胞形态观察
参照Ban等[18]的方法,采用正置光学显微镜(Eclipse E100)对油桃组织的细胞形态进行观察。将果肉组织标本切成2×2 mm,固定在福尔马林-乙酸-乙醇溶液(FAA)中,然后采用石蜡切片番红固绿经过固定、脱水、透明、浸蜡、染色、封片等系列过程制作切片并观察。
1.2.2.9 总花青素含量
参照Zhou等[7]的方法,通过比对矢车菊素-3-O-葡萄糖苷氯化物进行定量,结果以每kg果肉含矢车菊素-3-O-葡萄糖苷氯化物当量的重量表示。
1.2.2.10 矢车菊素-3-O-葡萄糖苷和矢车菊素-3-O-芸香糖苷含量的测定
根据Zhou等[7]的方法,采用高效液相色谱仪测定,用10 mL萃取液(甲酸:甲醇=1.6:98.4,V/V)在4 ℃、黑暗条件下提取2 g油桃果肉7 h。取上清液,8000×g离心25 min,用高效液相色谱系统分析,液相色谱仪采用520 nm的二极管阵列检测器(DAD)测定,C18色谱柱(Zorbax SB,5 μm,4.6 mm×250 mm)梯度洗脱法进行分离。自动进样器进样量为20 μL,柱箱温度为35℃。色谱柱流速0.6 mL/min。以矢车菊素-3-O-葡萄糖苷和矢车菊素-3-O-芸香糖苷作为主要花青素的定量分析,花青素含量以mg/kg鲜重表示。
1.2.2.11 花青素生物合成相关酶活性
参照Zhang等[11]的方法采用试剂盒进行测定,包括苯丙氨酸解氨酶(PAL)、4-香豆酸辅酶A连接酶(4CL)、肉桂酸-4-羟基化酶(C4H)和二氢黄酮醇4-还原酶(DFR)的活性,结果均以U/mg蛋白表示。
1.3 数据处理
所有数据均以平均数±标准差表示。采用SPSS 22.0软件进行单因素方差分析,进行统计学显著性检验。数据采用邓肯多重比较分析,P<0.05表示差异显著。每个处理设3个平行重复。
2. 结果与分析
2.1 臭氧调控方式对1-MCP处理后油桃贮藏呼吸强度和乙烯产量的影响
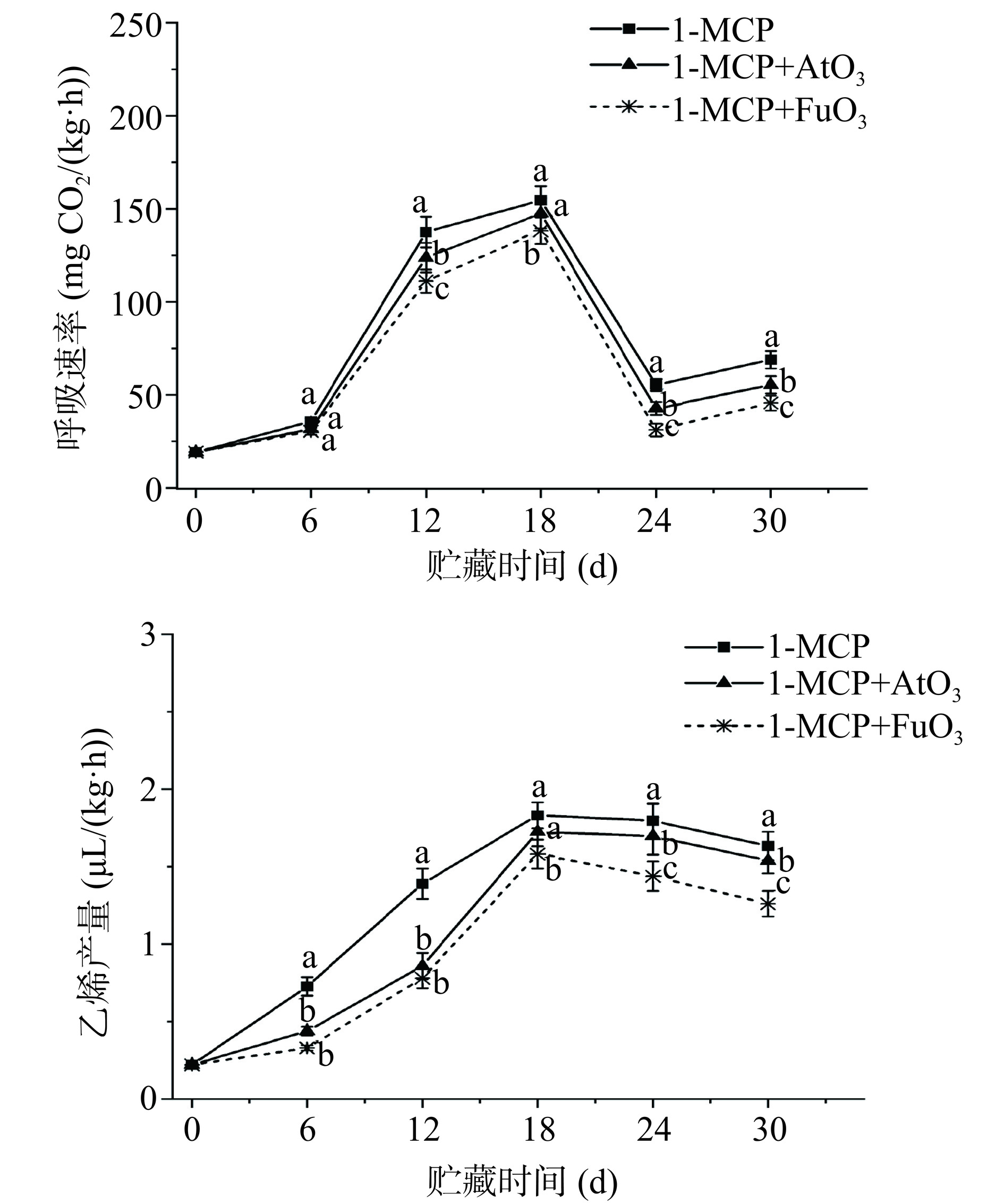
各个处理组油桃的呼吸速率和乙烯生成速率呈先增加后降低的趋势,且在第18 d呼吸达到峰值,如图1。与单独1-MCP处理相比,1-MCP+AtO3和1-MCP+FuO3处理的油桃在贮藏18 d时呼吸高峰分别降低了4.57%和10.57%,在贮藏30 d时分别降低了19.60%和33.83%。同时,1-MCP+AtO3和1-MCP+FuO3处理均能显著抑制乙烯产生(P<0.05),贮藏第12 d时的乙烯产量分别降低了38.32%和43.83%,贮藏24 d的乙烯产量分别降低了5.50%和22.79%。在贮藏6~30 d期间,本研究发现1-MCP联合臭氧水雾化和臭氧气体熏蒸比单独使用1-MCP更能减缓呼吸和乙烯的产生,并且1-MCP联合O3气体熏蒸的方式能更有效的抑制呼吸速率和乙烯生成。相关研究表明,O3及其阴离子处理对内源性乙烯有降解作用[19]。O3可以有效抑制圣女果贮藏过程中呼吸强度[20]。
2.2 臭氧调控方式对1-MCP处理后油桃硬度、失重率、SSC和TA含量的影响
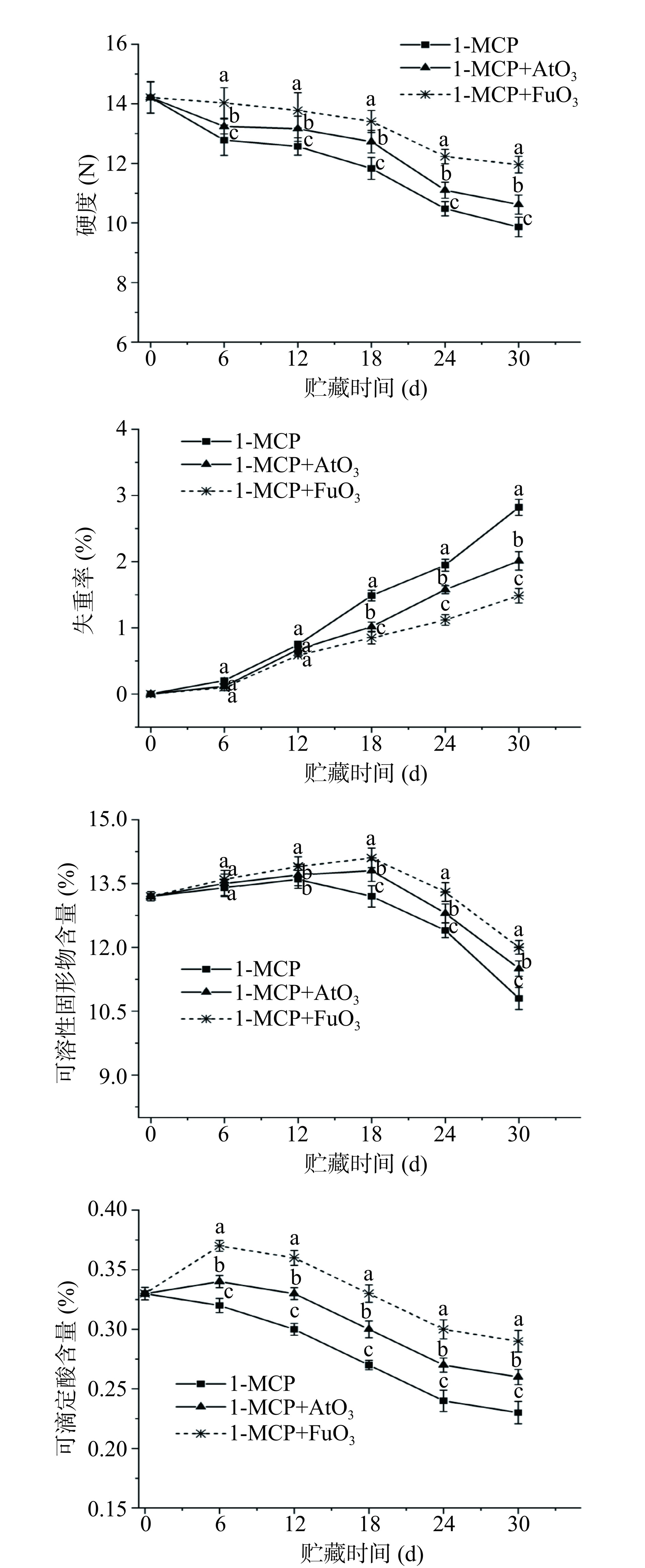
随着贮藏期的延长,所有处理的油桃硬度都有所下降(图2)。与单独1-MCP组油桃相比,无论何种臭氧处理方式与1-MCP联用都能显著抑制油桃在冷藏期间硬度的下降。贮藏30 d后,1-MCP+AtO3和1-MCP+FuO3处理后的果实硬度分别比单独1-MCP处理提高7.6%和21.22%(P<0.05)。贮藏6~30 d的贮藏期内,1-MCP+FuO3处理组的油桃果实硬度最大。结果表明,施用臭氧水雾化和臭氧气体熏蒸与1-MCP处理之间的互作效应显著延缓了果实的软化(P<0.05)。1-MCP+AtO3和1-MCP+FuO3均能降低油桃的失重。0 ℃处理30 d后,单独1-MCP处理组油桃果实失重率最高,为2.82%,而1-MCP+AtO3和1-MCP+FuO3处理果实失重率分别为2.01%和1.48%。1-MCP+AtO3和1-MCP+FuO3处理油桃TA含量较高,且在贮藏期内显著高于1-MCP处理组(P<0.05)。贮藏24 d时,可溶性固形物含量在18 d前呈现增加趋势,之后呈下降趋势。与单独1-MCP相比,1-MCP+AtO3和1-MCP+FuO3提高了贮藏18 d后的SSC水平。
失重率是影响果实品质并且反映贮藏特性的重要指标之一。与其他两个处理组相比,1-MCP+FuO3处理的油桃果实在贮藏30 d内失重率较低,这可能是因为蒸腾和呼吸生理活动导致的水分消耗[15]。1-MCP结合O3联合处理失重率较低,主要是因为其对呼吸速率和乙烯产生速率抑制作用。此外,TA、SSC和硬度被认为是油桃重要的理化品质指标,决定了油桃的保质期和商业价值[21]。1-MCP+AtO3和1-MCP+FuO3维持了果实在贮藏过程中的TA和SSC值,延缓了果实的软化,先前有报道表明,臭氧可以通过抑制果胶代谢物的降解和下调乙烯产生的相关基因来延缓哈密瓜采后贮藏过程中的软化[11]。
2.3 臭氧调控方式对1-MCP处理后油桃微观结构的影响
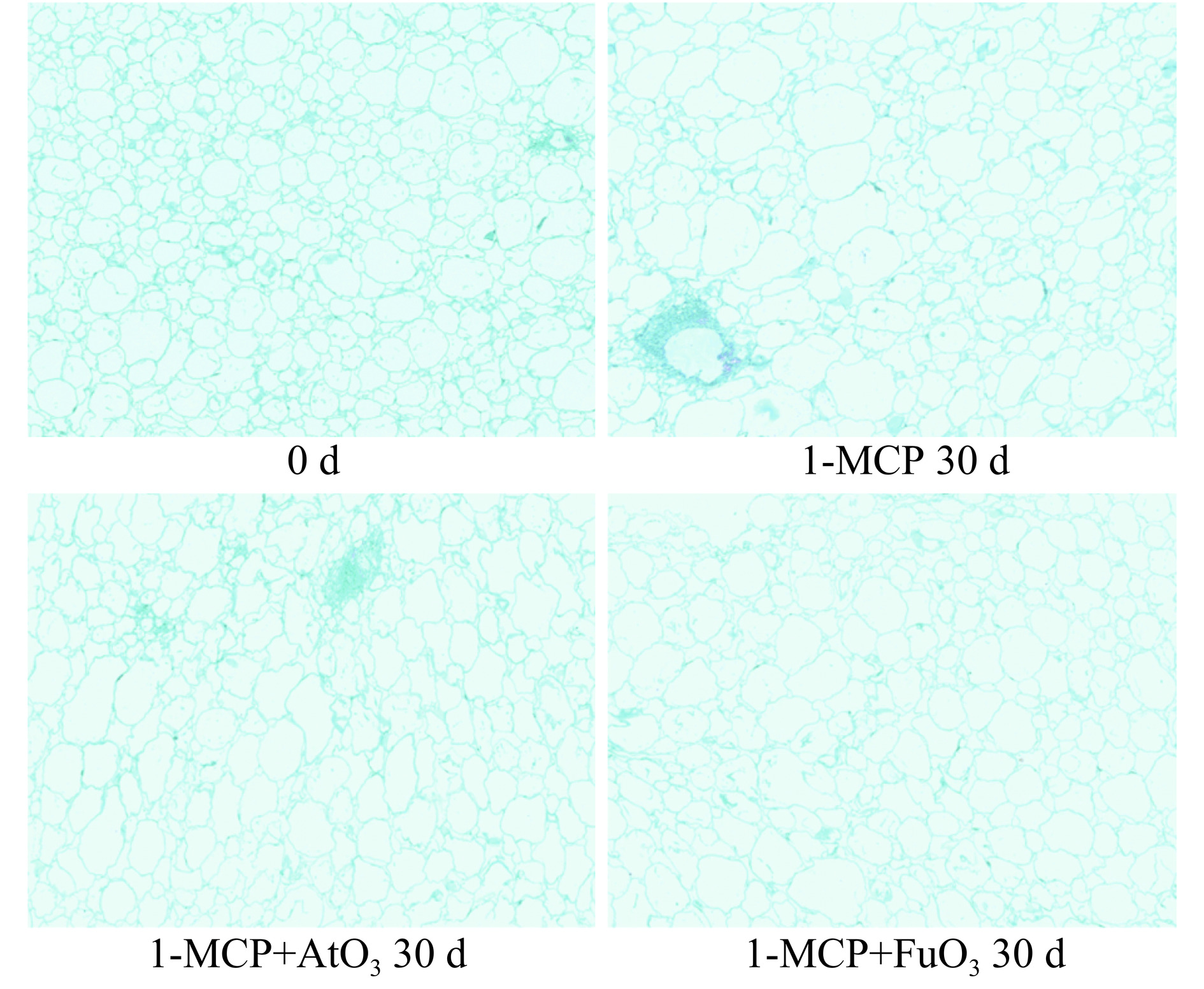
油桃果肉的细胞平面超微结构如图3所示,油桃果肉结构为薄壁细胞,在采收当天细胞壁呈规则、棱角分明、完整,果实中细胞平面形态呈现小而致密、结构均匀。随着贮藏时间的延长,果实组织逐渐出现形状不规则,细胞间收缩,细胞间隙增大的现象,在贮藏第30 d时,单独1-MCP处理组的样品部分出现边缘溶解、肿胀和松动现象,1-MCP+AtO3和1-MCP+FuO3两个处理组较单独1-MCP处理组的果肉结构保持的较好,细胞结构致密、完整,细胞结构的石蜡切片结果表明,1-MCP联合臭氧雾化和气体熏蒸均可以有效延缓油桃果实细胞组织结构的降解,保持果肉组织结构的完整性,且1-MCP联合O3气体熏蒸方式对果实细胞结构的保持要优于1-MCP联合臭氧水雾化。Du等[12]也证明了1-MCP+O3可以延缓桃子果实软化,保持组织结构的完整性,且与臭氧延缓成熟以及防止侵染有关。
2.4 臭氧调控方式对1-MCP处理后油桃色泽的影响
不同处理后油桃果肉色泽的变化如表1,与单独1-MCP相比,1-MCP+AtO3和1-MCP+FuO3促进了油桃果实的亮度(L*值)和红度(a*值)的发育,在贮藏期的6~30 d内,L*值和a*值均高于单独1-MCP处理组,b*值低于1-MCP处理组。贮藏30 d时,1-MCP+AtO3和1-MCP+FuO3两个处理组的a*值分别比单独1-MCP处理组高47.98%和146.44%。刚采后的“中油13号”油桃果肉呈白色,随着存放时间的延长,由于花青素在成熟后期积累会使果肉呈红色[11]。1-MCP对贮藏期花青素积累有抑制作用,其a*值增加较慢,而1-MCP联合O3处理组果实a*值在贮藏18 d后增加幅度较大,且显著高于单独1-MCP处理组,这可能与臭氧能够促进花青素的积累有关。
表 1 臭氧调控方式对1-MCP处理后油桃贮藏期色泽的影响Table 1. Effects of ozone regulation on color of nectarine after 1-MCP treatment during storage指标 处理 贮藏时间(d) 0 6 12 18 24 30 L* 1-MCP 70.85±2.65a 65.14±1.52b 62.81±0.97b 60.61±1.18b 59.21±1.92b 54.43±2.55b 1-MCP+AtO3 70.23±1.34a 69.81±0.62a 67.68±3.54a 66.95±2.59a 65.41±2.68a 61.52±1.84a 1-MCP+FuO3 70.56±0.95a 70.52±2.73a 69.91±2.88a 68.08±1.74a 64.75±2.33a 63.66±3.26a a* 1-MCP −2.45±0.14a 0.60±0.03a 0.84±0.06b 0.93±0.05b 2.45±0.14c 3.23±0.17c 1-MCP+AtO3 −2.38±0.08a 0.63±0.09a 0.90±0.01b 0.96±0.03b 3.44±0.09b 4.78±0.07b 1-MCP+FuO3 −2.27±0.07a 0.68±0.04a 1.12±0.00a 2.56±0.06a 6.46±0.02a 7.96±0.25a b* 1-MCP 5.03±0.32a 7.32±0.45a 8.66±0.67a 8.91±0.58a 10.39±0.61a 12.36±0.72a 1-MCP+AtO3 5.17±0.28a 5.33±0.38b 8.31±0.21a 8.67±0.44a 9.36±0.72a 11.78±0.56a 1-MCP+FuO3 5.06±0.19a 7.57±0.54a 9.28±0.77a 9.94±0.63a 10.41±0.35a 10.63±0.82b 注:不同小写字母表示同一贮藏时间不同处理组存在显著性差异(P<0.05)。 2.5 臭氧调控方式对1-MCP处理后油桃花青素含量的影响
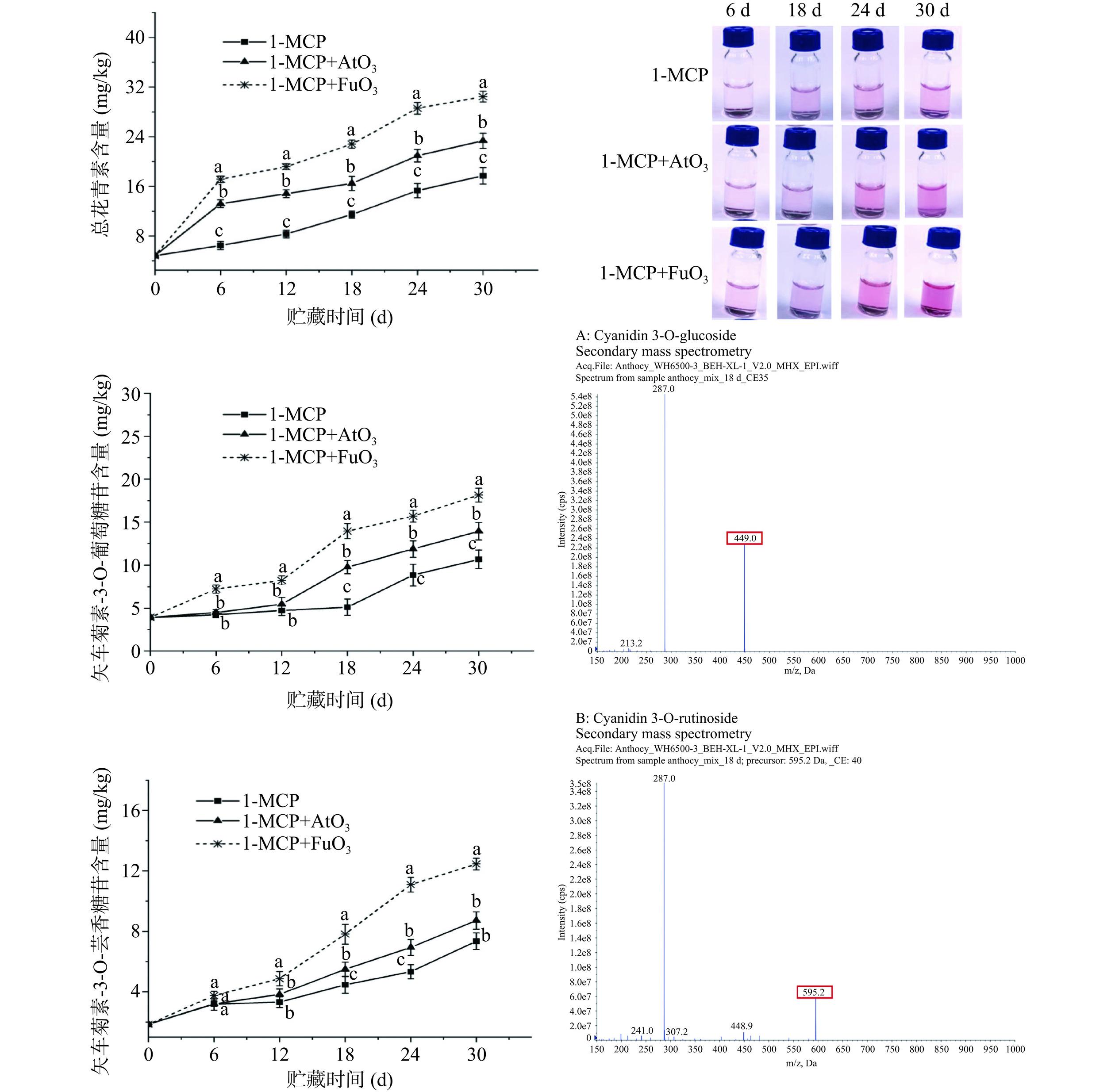
从图4可以看出,贮藏期6~30 d内,油桃果实中的总花青素含量、矢车菊素-3-O-葡萄糖苷和矢车菊素-3-O-芸香糖苷含量均呈增加趋势,1-MCP+AtO3和1-MCP+FuO3两个处理组的矢车菊素-3-O-葡萄糖苷和矢车菊素-3-O-芸香糖苷含量在18 d后增长速度显著大于1-MCP处理组,且1-MCP处理组的上述三种物质含量均显著低于1-MCP+AtO3和1-MCP+FuO3两个处理组(P<0.05)。贮藏第30 d时,1-MCP+FuO3处理组花青素含量、矢车菊素-3-O-葡萄糖苷和矢车菊素-3-O-芸香糖苷含量最高,分别为30.46、18.14和12.46 mg/kg。提取液的颜色与花青素含量表现出相同的趋势。在果实变红的成熟过程中会产生乙烯,从而诱导花青素积累[22]。相关的研究指出1-MCP可以抑制油桃[11]和李子[10]果肉发红和花青素的积累,本研究发现单独1-MCP处理组的花青素含量增加速度较慢,果肉红色程度低,可能是由于1-MCP处理降低了果实的乙烯产量。而1-MCP联合臭氧雾化和熏蒸处理在贮藏18 d后能够显著加速花青素的积累,促进果肉红色程度加重,促进了油桃的着色。已有研究表明,一定剂量的臭氧处理可以增强植物的抗性,导致树莓在贮藏期间花青素含量增加[23]。本研究结果表明O3能够抵消1-MCP在贮藏后期对花青素积累的抑制作用,且使用臭氧气体熏蒸的方式效果较佳。
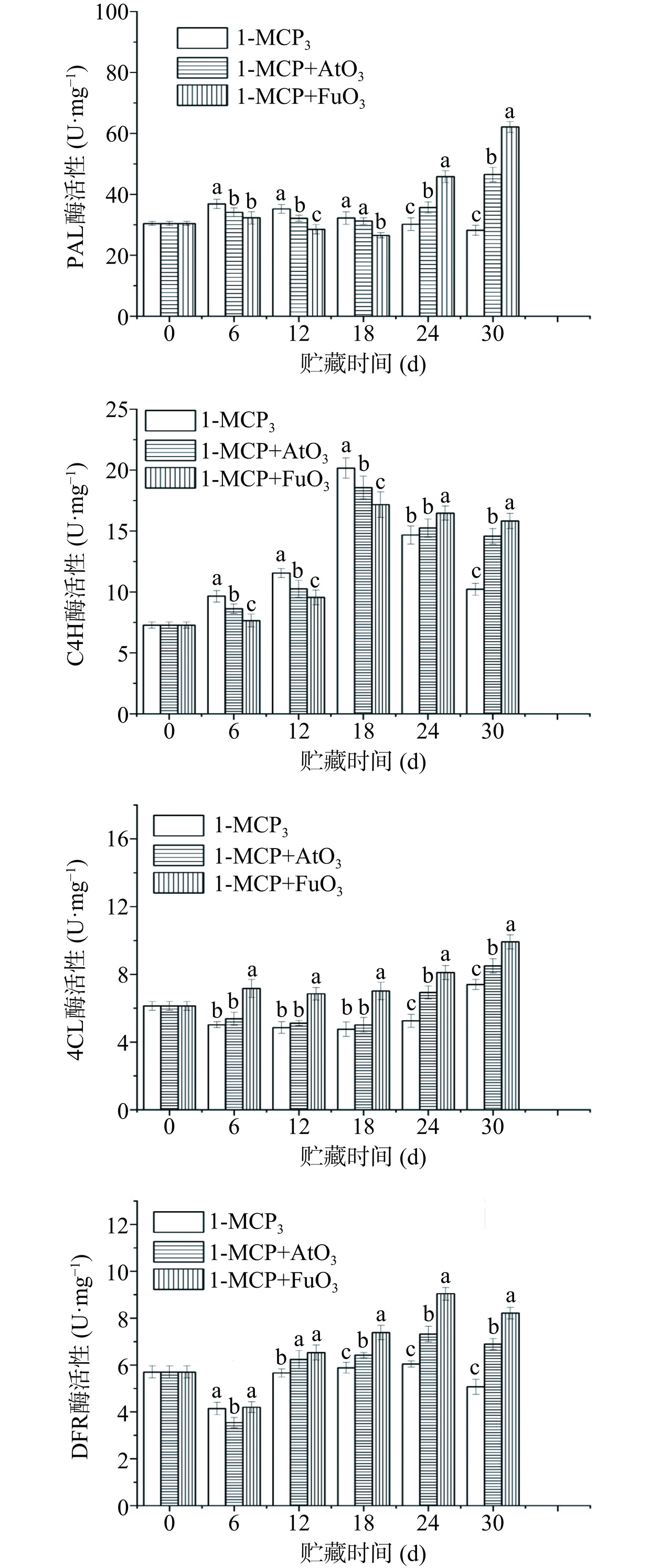
2.6 外源乙烯调控方式对1-MCP处理后油桃花青素代谢酶活性的影响
从图5可以看出,三个处理组的油桃的PAL活性在第0~18 d呈现先升高后降低的趋势, 但是1-MCP+FuO3处理组的PAL酶活性显著低于单独1-MCP处理组(P<0.05)。在贮藏初期,经1-MCP处理后的油桃C4H酶活性被显著提升。1-MCP结合臭氧处理的C4H酶活性在贮藏24~30 d要显著高于单独1-MCP处理组(P<0.05)。在24~30 d范围内1-MCP+AtO3和1-MCP+FuO3处理组的果实的PAL酶活性显著提高(P<0.05)。除了第12 d和第18 d分别出现下降外,所有处理的4CL酶活性都随着贮藏时间的延长而增加。与单独1-MCP处理组相比,1-MCP结合不同形式的臭氧处理在24~30 d内4CL酶活性显著提高(P<0.05)。各处理油桃C4H酶活性均在贮藏第18 d达到峰值,之后呈下降趋势。各处理组的油桃的DFR活性在贮藏期24 d内呈现增加趋势,24 d后显著下降,在贮藏第30 d时,1-MCP+FuO3处理组的果实的DFR活性显著高于其他两个处理组(P<0.05)。
花青素的合成代谢与苯丙烷代谢途径密切相关[11]。由莽草酸途径产生的苯丙氨酸在细胞质中被苯丙氨酸解氨酶(PAL)脱胺,转化为反式肉桂酸,然后通过肉桂酸4-羟化酶(C4H)产生对香豆酸,对香豆酸通过4-香豆酸-辅酶a连接酶(4CL)转化为对香豆酰辅酶a[24]。1-MCP、1-MCP+AtO3和1-MCP+FuO3对早期贮藏中PAL、4CL、C4H和DFR活性均有抑制作用,说明1-MCP与O3联合处理对酶活性的抑制作用与1-MCP单独处理相似。但在贮藏24~30 d期间,1-MCP联合臭氧处理显著提高了PAL、C4H和4CL的活性,表明臭氧参与了苯丙素途径的调控,相关的研究表面臭氧处理水果中PAL活性的增加可能与酚类化合物和花青素水平的含量以及高活性氧清除能力有关[25]。DFR是与花青素合成相关的关键酶,主要负责黄烷酮柚皮素转化为花青素3-O-糖苷,被认为是稳定的水溶性色素[24],三个处理组均抑制油桃贮藏早期DFR活性,与油桃花青素含量、矢车菊素-3-O-葡萄糖苷和矢车菊素-3-O-芸香糖苷含量降低相对应,说明在贮藏前期(0~18 d)三个处理阻断油桃早期花青素的生物合成。而在贮藏后期(24~30 d),1-MCP+AtO3和1-MCP+FuO3处理组显著诱导DFR活性,提高贮藏后期花青素含量,且采用气体熏蒸形式的1-MCP+FuO3处理组DFR活性最高。因此,1-MCP联合臭氧处理通过增加苯丙烷代谢途径中关键酶的活性,诱导了贮藏后期果实中花青素的生物合成。
3. 结论
油桃的红色是影响其商品性的重要因素,研究表明,油桃1-MCP结合臭氧水雾化和臭氧熏蒸均能有效降低油桃贮藏过程中呼吸速率、乙烯产量和果实失重,维持TA和SSC,延缓果实软化,保持较好的细胞形态。而1-MCP联合臭氧处理在贮藏后期通过增加苯丙烷代谢途径中关键酶的活性,诱导了贮藏后期果实中花青素的生物合成,提高了花青素、矢车菊素-3-O-葡萄糖苷和矢车菊素-3-O-芸香糖苷含量,提高了果实红色着色程度,同时,臭氧气体熏蒸的方式,处理效果由于臭氧水雾化。本研究为改善油桃果实贮藏中的色泽保持和发育提供了一种可行的方法。
-
表 1 臭氧调控方式对1-MCP处理后油桃贮藏期色泽的影响
Table 1 Effects of ozone regulation on color of nectarine after 1-MCP treatment during storage
指标 处理 贮藏时间(d) 0 6 12 18 24 30 L* 1-MCP 70.85±2.65a 65.14±1.52b 62.81±0.97b 60.61±1.18b 59.21±1.92b 54.43±2.55b 1-MCP+AtO3 70.23±1.34a 69.81±0.62a 67.68±3.54a 66.95±2.59a 65.41±2.68a 61.52±1.84a 1-MCP+FuO3 70.56±0.95a 70.52±2.73a 69.91±2.88a 68.08±1.74a 64.75±2.33a 63.66±3.26a a* 1-MCP −2.45±0.14a 0.60±0.03a 0.84±0.06b 0.93±0.05b 2.45±0.14c 3.23±0.17c 1-MCP+AtO3 −2.38±0.08a 0.63±0.09a 0.90±0.01b 0.96±0.03b 3.44±0.09b 4.78±0.07b 1-MCP+FuO3 −2.27±0.07a 0.68±0.04a 1.12±0.00a 2.56±0.06a 6.46±0.02a 7.96±0.25a b* 1-MCP 5.03±0.32a 7.32±0.45a 8.66±0.67a 8.91±0.58a 10.39±0.61a 12.36±0.72a 1-MCP+AtO3 5.17±0.28a 5.33±0.38b 8.31±0.21a 8.67±0.44a 9.36±0.72a 11.78±0.56a 1-MCP+FuO3 5.06±0.19a 7.57±0.54a 9.28±0.77a 9.94±0.63a 10.41±0.35a 10.63±0.82b 注:不同小写字母表示同一贮藏时间不同处理组存在显著性差异(P<0.05)。 -
[1] 熊子璇, 吴志蒙, 黄华, 等. 不同保鲜袋包装对采后油桃果实贮藏品质的影响[J]. 包装工程,2022,43(3):78−86. [XIONG Zixuan, WU Zhimeng, HUANG Hua, et al. Effects of different storage bags on storage quality of postharvest nectarine fruit[J]. Packaging Engineering,2022,43(3):78−86.] XIONG Zixuan, WU Zhimeng, HUANG Hua, et al. Effects of different storage bags on storage quality of postharvest nectarine fruit[J]. Packaging Engineering, 2022, 43(3): 78−86.
[2] CONESA M R, CONEJERO W, VERA J, et al. Irrigation management practices in nectarine fruit quality at harvest and after cold storage[J]. Agricultural Water Management,2021,243:106519. doi: 10.1016/j.agwat.2020.106519
[3] 刘昌来, 熊星, 李天帅, 等. 基于转录组分析色膜覆盖下月月竹竹青变色机制[J/OL]. 植物生理学报: 1−16[2024-12-19]. http://kns.cnki.net/kcms/detail/31.2055.Q.20231222.1158.003.html. [LIU Changlai, XIONG Xing, LI Tianshuai, et al. Transcriptome-based analysis of the discoloration mechanism of Phyllodendron chinensis under color film coverage[J/OL]. Chinese Journal of Plant Physiology: 1−16[2024-12-19]. http://kns.cnki.net/kcms/detail/31.2055.Q.20231222.1158.003.html.] LIU Changlai, XIONG Xing, LI Tianshuai, et al. Transcriptome-based analysis of the discoloration mechanism of Phyllodendron chinensis under color film coverage[J/OL]. Chinese Journal of Plant Physiology: 1−16[2024-12-19]. http://kns.cnki.net/kcms/detail/31.2055.Q.20231222.1158.003.html.
[4] JAAKOLA L. New insights into the regulation of anthocyanin biosynthesis in fruits[J]. Trends in Plant Science,2013,18:477−483. doi: 10.1016/j.tplants.2013.06.003
[5] ZHANG J K, WANG Y C, MAO Z L, et al. Transcription factor McWRKY71 induced by ozone stress regulates anthocyanin and proanthocyanidin biosynthesis in Malus crabapple[J]. Ecotoxicology and Environmental Safety,2022,232:113274. doi: 10.1016/j.ecoenv.2022.113274
[6] ZHOU D D, LIU Q, PENG J, et al. Metabolic analysis of phenolic profiles reveals the enhancements of anthocyanins and procyanidins in postharvest peach as affected by hot air and ultraviolet C[J]. Postharvest Biology and Technology,2020,167:111227. doi: 10.1016/j.postharvbio.2020.111227
[7] ZHOU D D, LI R, ZHANG H, et al. Hot air and UV-C treatments promote anthocyanin accumulation in peach fruit through their regulations of sugars and organic acids[J]. Food Chemistry,2020,309:125726. doi: 10.1016/j.foodchem.2019.125726
[8] ZHANG Y T, LING J, ZHOU H S, et al. 1-Methylcyclopropene counteracts ethylene inhibition of anthocyanin accumulation in peach skin after harvest[J]. Postharvest Biology and Technology,2022,183:111737. doi: 10.1016/j.postharvbio.2021.111737
[9] TOKALA V Y, SINGH Z, et al. 1H-cyclopropabenzene and 1H-cyclopropa naphthalene fumigation downregulates ethylene production and maintains fruit quality of controlled atmosphere stored ‘Granny Smith’ apple[J]. Postharvest Biology and Technology,2021,176:111499.
[10] XU Y, LI S E, HUAN C, et al. Effects of 1methylcyclopropene treatment on quality and anthocyanin biosynthesis in plum (Prunus salicina cv. Taoxingli) fruit during storage at a non-chilling temperature[J]. Postharvest Biology and Technology,2020,169:111291. doi: 10.1016/j.postharvbio.2020.111291
[11] ZHANG W L, JIANG H T, ZHANG Y Q, et al. Synergistic effects of 1-MCP and hot air treatments on delaying softening and promoting anthocyanin biosynthesis in nectarines[J]. Postharvest Biology and Technology,2021,180:111598. doi: 10.1016/j.postharvbio.2021.111598
[12] DU M, JIA X, LI J K, et al. Regulation effects of 1-MCP combined with flow microcirculation of sterilizing medium on peach shelf quality[J]. Scientia Horticulturae,2020,260:108867. doi: 10.1016/j.scienta.2019.108867
[13] LATT T T, LWIN H P, SEO H J, et al. 1-Methylcyclopropene delays degradation of peel greenness but induces internal physiological disorders in cold-stored fruit of interspecific pears[J]. Scientia Horticulturae,2023,312:111852. doi: 10.1016/j.scienta.2023.111852
[14] LIANG C C, CUI X Z, SUN C C, et al. Synergistic and antagonistic effects of preharvest salicylic acid and postharvest 1-methylcyclopropene treatments on the storage quality of apricot[J]. Food Chemistry,2023,405:134764. doi: 10.1016/j.foodchem.2022.134764
[15] TOKALA V Y, SINGH Z, KYAW P N. Postharvest fruit quality of apple influenced by ethylene antagonist fumigation and ozonized cold storage[J]. Food Chemistry,2021,341:128293. doi: 10.1016/j.foodchem.2020.128293
[16] MINAS I S, VICENTE A R, DHANAPAL A P, et al. Ozone-induced kiwifruit ripening delay is mediated by ethylene biosynthesis inhibition and cell wall dismantling regulation[J]. Plant Science,2014,229:76−85. doi: 10.1016/j.plantsci.2014.08.016
[17] JIA X Y, LI J K, DU M J, et al. Combination of low fluctuation of temperature with TiO2 photocatalytic/ozone for the quality maintenance of postharvest peach[J]. Foods,2020,9:234. doi: 10.3390/foods9020234
[18] BAN Q Y, HAN Y, HE Y H, et al. Functional characterization of persimmon β-galactosidase gene DkGAL1 in tomato reveals cell wall modification related to fruit ripening and radicle elongation[J]. Plant Science,2018,274:109−120. doi: 10.1016/j.plantsci.2018.05.014
[19] HAWKINS M, KOHLMILLER C K, ANDREWS L. Matrix infrared spectra and photolysis and pyrolysis of isotopic secondary ozonides of ethylene[J]. Journal of Physical Chemistry,2021,86:3154−3166.
[20] 李昌宝, 辛明, 孙宇, 等. 组合保鲜技术对圣女果保鲜效果的影响[J]. 食品研究与开发,2019,41(3):123−129. [LI Changbao, XIN Ming, SUN Yu, et al. Effect of combination preservation technology on preservation effect of Cherry Tomatoes[J]. Food Research and Development,2019,41(3):123−129.] LI Changbao, XIN Ming, SUN Yu, et al. Effect of combination preservation technology on preservation effect of Cherry Tomatoes[J]. Food Research and Development, 2019, 41(3): 123−129.
[21] 安娜, 赵志永, 贾晓昱, 等. 1-甲基环丙烯结合茉莉酸甲酯雾化熏蒸对石榴采后品质的影响[J]. 食品安全质量检测学报,2019,14(15):287−296. [AN Na, ZHAO Zhiyong, JIA Xiaoyu, et al. Effects of atomized fumigation with 1-methylcyclopropylene combined with methyl jasmonate on postharvest quality of pomegranate[J]. Journal of Food Safety and Quality Inspection,2019,14(15):287−296.] AN Na, ZHAO Zhiyong, JIA Xiaoyu, et al. Effects of atomized fumigation with 1-methylcyclopropylene combined with methyl jasmonate on postharvest quality of pomegranate[J]. Journal of Food Safety and Quality Inspection, 2019, 14(15): 287−296.
[22] CHENG Y D, LIU L Q, YUAN C, et al. Molecular characterization of ethylene-regulated anthocyanin biosynthesis in plums during fruit ripening[J]. Plant Molecular Biology Reporter,2016,34:777−785. doi: 10.1007/s11105-015-0963-x
[23] PIECHOWIAK T, GRZELAK-BŁASZCZYK K, SÓJKA M, et al. Changes in phenolic compounds profile and glutathione status in raspberry fruit during storage in ozone-enriched atmosphere[J]. Postharvest Biology and Technology,2020,168:111277. doi: 10.1016/j.postharvbio.2020.111277
[24] CHAVES-SILVA S, SANTOS A L D, CHALFUN-JÚNIOR A, et al. Understanding the genetic regulation of anthocyanin biosynthesis in plants–Tools for breeding purple varieties of fruits and vegetables[J]. Phytochemistry,2018,153:11−27. doi: 10.1016/j.phytochem.2018.05.013
[25] PIECHOWIAK T, BALAWEJDER M. Impact of ozonation process on the level of selected oxidative stress markers in raspberries stored at room temperature[J]. Food Chemistry,2019,298:125093. doi: 10.1016/j.foodchem.2019.125093





 下载:
下载:
 下载:
下载:



