Preparation and Characterization of Rosa roxburghii Tratt Polyphenol-Sodium Alginate-Soy Protein Isolate Nanocomposites and Their Antioxidant Activity
-
摘要: 为了探究大豆分离蛋白(Soy protein isolates,SPI)与海藻酸钠(Sodium alginate,SA)、刺梨多酚(Rosa roxburghii Tratt polyphenols,RRTP)形成的二元复合物(SPI-SA、SPI-RRTP)和三元复合物(SPI-SA-RRTP)的稳定性与功能特性。以SPI、SA、RRTP为原料制备复合物,利用单因素实验和响应面试验优化制备条件。通过粒径、分散性系数(PDI)、Zeta电位、荧光光谱、表面疏水性、差示扫描量热仪、傅里叶红外光谱等分析手段对复合物进行表征,同时运用分子对接技术进行理论验证。结果表明,最适条件为SPI添加量为2.95%、SA添加量为0.036%、RRTP添加量为0.25%、pH为7.57,此时粒径为140.41 nm。实验上验证了理论结合。其中SPI-SA-RRTP三元复合物平均粒径(140.93±0.32 nm)、PDI(0.155±0.004)最小、Zeta电位(−31.06±2.20 mV)绝对值最大,三元复合物稳定性最好。相比于SPI和二元复合物,三元复合物结合紧密程度、亲水性、热稳定性、抗氧化性等都显著提高。本研究以期能使SPI-SA-RRTP纳米复合物广泛地应用在食品行业,为其应用提供新的思路和方向。Abstract: To investigate the stability and functional properties of binary (SPI-SA, SPI-RRTP) and ternary (SPI-SA-RRTP) complexes of soy protein isolates (SPI) with sodium alginate (SA) and Rosa roxburghii Tratt polyphenols (RRTP). SPI, SA and RRTP were used as raw materials to prepare the complexes, and the preparation conditions were optimized by single factor and response surface experiments. The complexes were characterized by particle size, polymer dispersity index (PDI), Zeta potential, fluorescence spectrum, surface hydrophobicity, differential scanning calorimetry (DSC) and Fourier transform infrared spectroscopy (FTIR). Molecular docking technology was applied for theoretical verification. The results showed that the optimal conditions were: SPI addition was 2.95%, SA addition was 0.036%, RRTP addition was 0.25%, pH was 7.57, and the particle size was 140.41 nm. The theoretical combination was experimentally verified. The SPI-SA-RRTP ternary complex had the smallest particle size (140.93±0.32 nm) and PDI (0.155±0.004), the largest Zeta potential (−31.06±2.20 mV) absolute value and the best stability. Compared with SPI and binary complexes, ternary complexes had significantly improved binding tightness, hydrophilicity, thermal stability and oxidation resistance. SPI-SA-RRTP nanocomposite can be widely used in food industry, and provide new ideas and directions for its application.
-
纳米复合物相比传统乳剂有着显著的优势,它具有更小的液滴和更低的油水界面张力,能有效避免液滴聚集和重力分离的问题。与单一体系相比,多元复合物通常具有更出色的稳定性。已有研究成功制备出稳定复合物,如酯化大豆蛋白-壳聚糖[1],豌豆分离蛋白-卡拉胶[2],乳铁蛋白、表没食子儿茶素没食子酸酯和低甲酯果胶[3]等。在食品工业中,纳米复合物具有广泛的应用,不仅可以作为人造奶油的优质替代品,还可以作为活性物质的有效载体系统。
大豆分离蛋白(Soy protein isolates,SPI)含有多种必需氨基酸[4],氨基酸组成合理,有利于人体吸收利用,是一种天然的乳化剂或表面活性剂[5]。然而,由于加工过程中的部分变性,SPI表现出较差的溶解度、稳定性和乳化性能。近年来,虽然通过多种方法可以改变SPI的空间结构,但传统的蛋白质修饰方法可能会带来一些负面影响。海藻酸钠是一种线性聚阴离子天然多糖[6]。具有增稠、稳定和无毒的特性[7]。它能通过静电相互作用、空间位阻和氢键作用等方式与SPI相互作用,从而提高其稳定性。刺梨多酚(Rosa roxburghii Tratt polyphenols,RRTP)是从刺梨(Rosa roxburghii Tratt)中提取的活性成分。将RRTP引入到复合物中不仅可以增加其稳定性,还能提升功能活性。多酚不仅具有强大的抗氧化和自由基清除能力[8],还具有对蛋白质的络合特性。这些特性使得多酚在改善各种疾病,如炎症或癌症方面具有潜在的应用前景,同时也可用于食品配方抗衰老和营养方面的应用。
为此,本研究拟以刺梨多酚、海藻酸钠、大豆分离蛋白为原料,采用单因素响应面制备形成纳米复合物。对纳米复合物进行表征,并进行理论层次的分子对接技术模拟。本研究旨在将SPI-SA-RRTP纳米复合物广泛应用于食品行业,为其应用提供新的思路和方向。
1. 材料与方法
1.1 材料与仪器
刺梨 贵州龙里;大豆分离蛋白(蛋白质含量≥90%)、8-苯胺基-1-萘磺酸钠(分析纯) 上海源叶生物科技有限公司;海藻酸钠(≥90%) 上海麦克林生物科技有限公司;ABTS、K2S2O8、K3[Fe(CN)6]、FeCl3、C2HCl3O2 以上均为分析纯,天津市科密欧化学试剂有限公司。
NS-90Z纳米粒度及电位分析仪 珠海欧美克仪器有限公司;Multiskan SkyHigh酶标仪 ThermoFisher Scientific科技(中国)有限公司;SRH超高压均质机 上海申鹿均质机有限公司;ZEISS LSM 900 with Airyscan 2激光共聚焦显微镜 德国Carl Zeiss AG公司;SCIENTZ-18N冷冻干燥机 宁波新芝生物科技股份有限公司;F-320荧光分光光度计 天津港东科技股份有限公司;DSC 4000热流型差示扫描量热仪、Spectrum Two傅里叶变换衰减全反射红外光谱仪 PrekinElmer企业管理(上海)有限公司。
1.2 实验方法
1.2.1 刺梨多酚提取与纯化
参考王慧竹[9]和朱延胜等[10]的方法。将新鲜刺梨果去籽切片,烘干后打碎过筛。称取处理好的刺梨粉末20 g于锥形瓶,加入10倍量80%乙醇,超声温度50 ℃,功率400 W,提取完一次后,离心取上清液,滤渣再提取一次,每次40 min。合并两次提取液,减压回收溶剂,定容至100 mL,冷冻干燥后备用。刺梨多酚含量按式(1)计算:
刺梨多酚含量(%)=C×N×VM×106×100 (1) 式中,C为提取液稀释后多酚含量,μg/mL;N为稀释倍数;V为提取液体积,mL;M为刺梨粉质量,g。
2倍量95%乙醇,浸泡AB-8大孔树脂24 h充分溶胀,用水冲洗至无白色浑浊物,再用蒸馏水冲洗至无醇味,存放于蒸馏水中备用。上样液质量浓度为2.92 mg/mL,上样液pH为5(用NaOH调配),静态吸附3 h,先用蒸馏水冲洗至无微黄色为止,后用150 mL,70%乙醇作为洗脱液,洗脱液流速为2 mL/min,收集中间段的洗脱液,进行3次平行实验。
1.2.2 SPI、SA、RRTP分子对接模拟
在SPI中7S球蛋白与11S球蛋白占据了70%以上,其中又以11S球蛋白居多[11]。从蛋白质数据库(https://www.rcsb.org)下载Soybean 7S globulin(PDB ID:3AUP)和Soybean 11S globulin(PDB ID:1OD5)的蛋白大分子晶体结构。从(https://pubchem.ncbi.nIm.nih.gov)平台下载Catechin(PubChem CID:9064)、sodium alginate(PubChem CID:5102882)、gallic acid(PubChem CID:370)、Protocatechuic aldehyde(PubChem CID:8768)、P-coumaric acid(PubChem CID:637542)和Protocatechuic acid(PubChem CID:72),随后将小分子.sdf格式用OpenBable软件转化为.mol2格式。将蛋白大分子导入Pymol中去除水分子与原配体,保存为.pdb格式备用。
1.2.2.1 分子对接
利用AutodockTools1.5.6软件对大分子进行加氢处理、电荷计算以及刚性类型的确定,并将结果保存为PDBQT格式以备后续使用。将大分子与小分子一并打开,使用Grid Box将整个大分子三维结构包裹,计算机会自动计算大分子的活性区域,对整个区域大分子所有位点与小分子进行试对接,从中选择较低的能量与最有可能的位点,使用Autogrid4进行运算。随后使用Docking进行正式对接,在参数选择中选择genetic algorithm,该算法是最精确,也是比较耗时的遗传算法。计算完毕后进行分析,会出现结合能以及结合的位点,我们选择最低能量来进行结合,保存文件为PDBQT格式备用。
1.2.2.2 对接结果可视化
启动Pymol软件,然后导入已经对接完成的文件。为了更好地区分大分子,需要调整配体的颜色。接下来,展示氢键以及氢键的长度,同时显示蛋白质残基的棍状结构和残基名称。最后,降低大分子的颜色亮度,至此,可视化过程完成。
1.2.3 SPI-SA-RRTP复合物制备
1.2.3.1 单因素实验
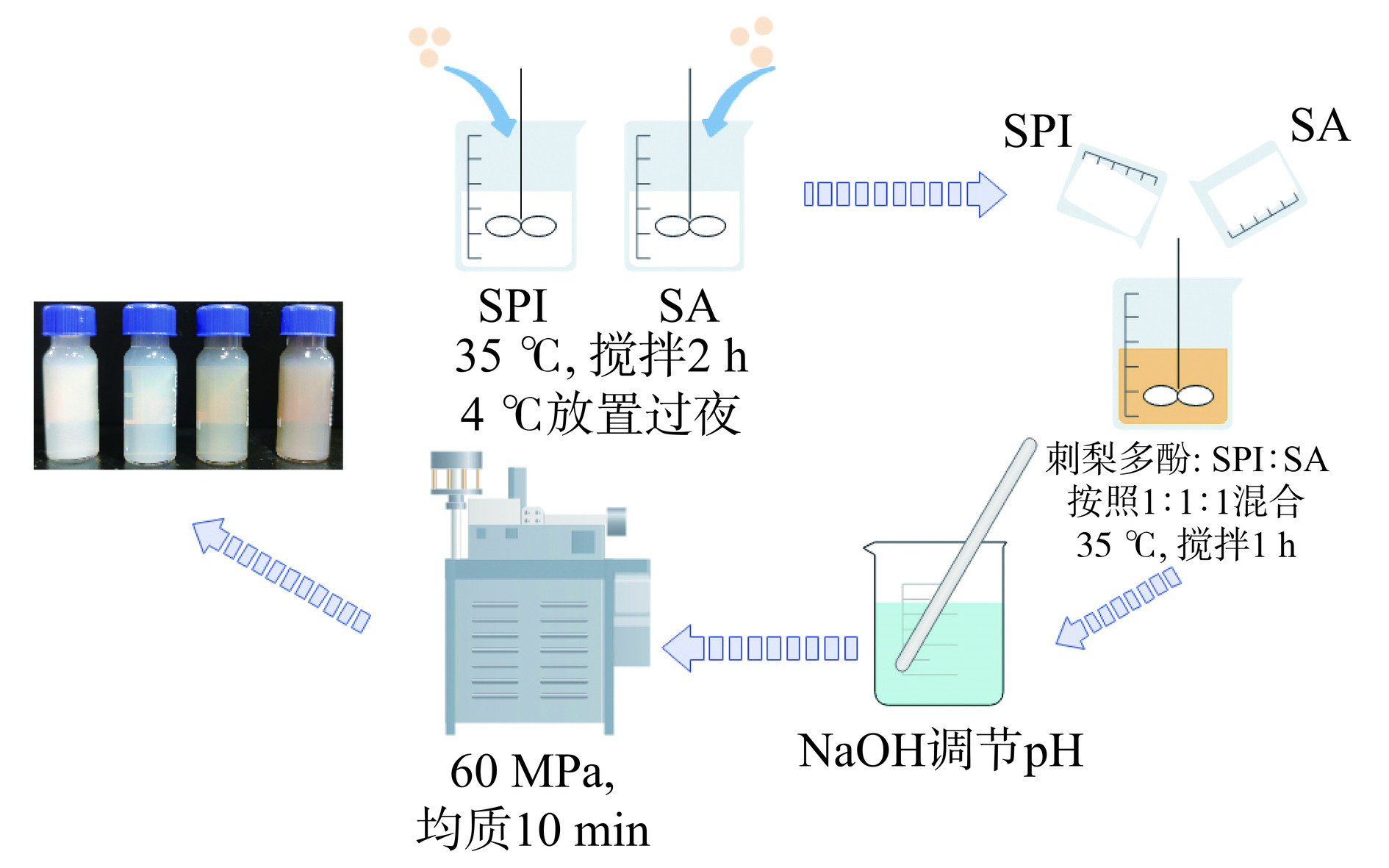
参考WANG等[12]的方法,稍加修改。如图1,用去离子水配制质量分数2.5%、3.0%、3.5%、4.0%、4.5%的SPI溶液,配制质量分数0.02%、0.04%、0.06%、0.08%、0.1%的SA溶液,分别在35 ℃下磁力搅拌2 h,直到生物聚合物完全溶解。然后将两种原液在4 ℃下保存过夜,以获得完全的水合作用。去离子水配制0.02%、0.04%、0.06%、0.08%、0.1%的RRTP溶液。然后将RRTP溶液、SPI溶液、SA溶液以体积比1:1:1混合,35 ℃下磁力搅拌1 h,用HCl或NaOH调节pH为5.5、6.0、6.5、7.0、7.5。以粒径和PDI为指标,找到最优条件。使用去离子水将SPI-SA-RRTP复合物稀释600倍,在25 ℃下测其粒径和PDI。
1.2.3.2 响应面试验
在单因素实验的基础上,选取pH、RRTP、SPI、SA添加质量分数四个因素为自变量,以粒径为响应值,进行响应面试验,探究SPI-SA-RRTP复合物最佳工艺配方。响应面优化试验设计如表1,其中A、B、C、D分别表示SPI、SA、RRTP、pH。
表 1 响应面优化试验设计的因素与水平Table 1. Factors and levels of response surface optimization experimental design水平 A SPI(%) B SA(%) C RRTP(%) D pH −1 2.5 0.02 0.18 7.0 0 3.0 0.04 0.24 7.5 1 3.5 0.06 0.30 8.0 1.2.4 粒径、PDI、Zeta电位测定分析
参考CHEN等[13]的方法,稍加修改。采用纳米粒度及电位分析仪,测量SPI及其复合物平均粒径、Zeta电位和多分散性指数(PDI)。在测定前,用超纯水将复合物稀释600倍,并摇匀,以避免多重散射和液滴尺寸分布的影响。每次测量在25 ℃下重复进行。
1.2.5 内源性荧光光谱分析
参考TONG等[14]的方法,稍加修改。用去离子水将SPI及其复合物配置成0.05 mg/mL。采用荧光分光光度计在激发波长为295 nm,发射波长为200~600 nm时测量本征荧光光谱,狭缝宽度为5 nm。
1.2.6 表面疏水性测定
采用ANS疏水荧光探针法测定蛋白质疏水性变化。用去离子水配制SPI及其复合物为质量浓度0.01 mg/mL,然后将100 µL 8 mmol 8-苯胺基-1-萘磺酸钠(8-anilino-1-naphthalene sulfonate,ANS)溶液加入8 mL样品溶液中,摇匀,避光放置10 min。采用荧光分光光度计在激发波长为390 nm,发射波长为200~600 nm,狭缝宽度为5 nm下测量样品的荧光强度。
1.2.7 傅里叶变换衰减全反射红外光谱(ATR-FTIR)分析
参考LÜ等[15]的方法,稍加修改。采用ATR-FTIR光谱法分析SPI及其复合物的结构特征。将冻干的样品直接上样测试,光谱在400~4000 cm−1范围内的64次扫描获得,分辨率为4 cm−1。ATR-FTIR光谱数据使用OMNIC软件进行分析。
1.2.8 差示扫描量热法(DSC)分析
参考YI等[16]的方法,稍加修改。测量SPI及其复合物的热性能。将冻干的样品(约6.5 mg)密封在铝锅中,然后在惰性气体(50 mL/min N2)的条件下,以10 ℃/min的速度从20到200 ℃加热,空铝锅作为空白对照。
1.2.9 激光共聚焦扫描显微镜(CLSM)观察
样品使用ZEISS LSM 900激光共聚焦扫描显微镜进行观测,使用Ar/Kr可见光单模激光器在25 ℃下检测样品的结构。将样品放在显微镜载玻片上,轻轻盖上盖玻片,采用514 nm的氩离子激光器放大630倍,发射波长为617 nm。
1.2.10 SPI-SA-RRTP复合物抗氧化活性
1.2.10.1 ABTS+自由基清除率测定
参考蔡苗苗等[17]的方法,稍加修改。配制7 mmol/L的ABTS溶液与4.9 mmol/L K2S2O8水溶液,将两者按照体积比1:1混合后避光放置12~16 h,用0.2 mol/L PBS缓冲液(pH7.4)稀释至在波长为734 nm下A=0.700±0.020的ABTS溶液。吸取样品液30 μL和ABTS溶液200 μL混合为A1。ABTS溶液200 μL和蒸馏水30 μL混合为A0。反应5 min后,于734 nm处测定其吸光度。参照式(2)计算清除率:
ABTS+自由基清除率(%)=A0−A1A0×100 (2) 式中,A0为蒸馏水在734 nm处的吸光度,A1为样品在734 nm处的吸光度。
1.2.10.2 铁离子还原力测定
参考陈薛[18]的方法,稍加修改。配制1% K3[Fe(CN)6]水溶液、0.1% FeCl3水溶液和10% C2HCl3O2水溶液。将样品液、0.2 mol/L PBS和1% K3[Fe(CN)6]各取1 mL,在50 ℃条件下反应20 min,加1 mL C2HCl3O2终止反应,取上清液。取100 μL上清液、80 μL蒸馏水和20 μL FeCl3为A1样液,取180 μL蒸馏水和20 μL FeCl3为A0液,在700 nm处测定其吸光度。参照式(3)计算还原力:
还原力=A1−A0 (3) 1.3 数据处理
每组实验重复3次,其结果以均值±标准差表示,实验结果使用IBM SPSS Statistics 26软件进行单因素方差分析(ANONA),P<0.05时差异显著。采用Excel统计全文数据、Design-Expert 13进行响应面优化、Origin 2022图形绘制、AutoDock和Pymol进行分子对接及可视化、OMNIC进行傅里叶红外光谱图处理。
2. 结果与分析
2.1 分子对接结果
天然化合物虚拟筛选中常采用分子对接技术,这种技术涉及研究分子间(如配体和受体)的相互作用,预测它们的结合模式和亲合力,旨在实现分子间的空间匹配和能量匹配[19]。采用AutoDock与Pymol将SPI、SA、RRTP进行分子对接,并预测其结合能(binding energy,kJ/mol)。结合能的降低意味着SPI-SA-RRTP三元复合物构象更加稳定,其结合也更牢固,亲和力更强。当结合能低于0 kJ/mol时,表示SPI、SA、RRTP之间存在结合活性;而当结合能低于−29.29 kJ/mol时,则表明SPI、SA、RRTP之间具有相当强的结合能力[20]。
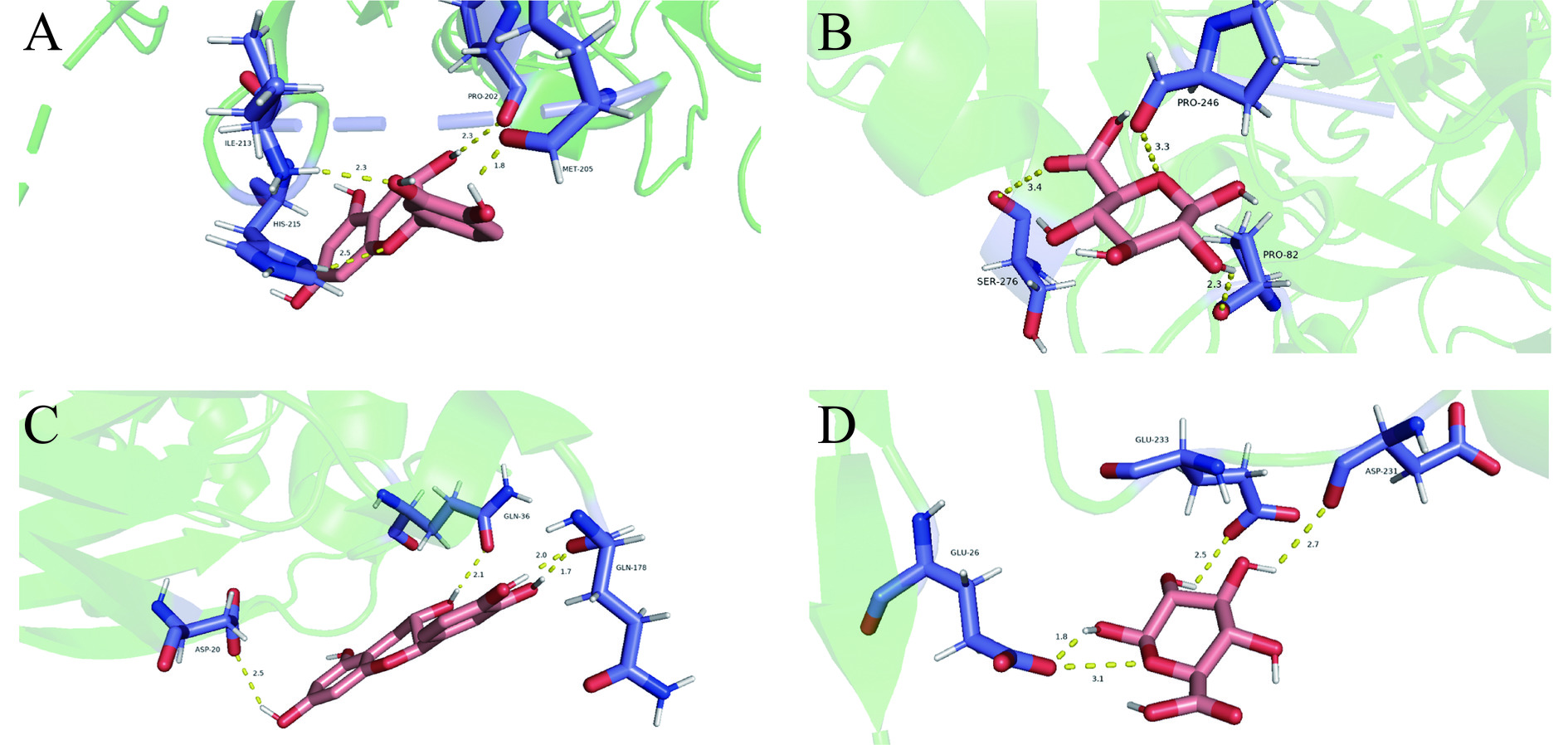
在SPI中,7S球蛋白与11S球蛋白占据了70%以上,其中以11S球蛋白为主。因此,本次研究预模拟了7S球蛋白-SA-RRTP(儿茶素)三元复合物的结合情况,同时以11S球蛋白作为主体,模拟其与SA、RRTP中五种小分子的结合情况。其中小分子由研究者测定得出,包括儿茶素、没食子酸、原儿茶醛、对香豆酸和原儿茶酸[21−22]。并且也模拟了11S球蛋白-SA-多酚(儿茶素)三元复合物是否能结合。结果表明,大豆7S球蛋白和大豆11S球蛋白均能与儿茶素、海藻酸钠结合形成复合物(如表2所示)。其中儿茶素与11S球蛋白的结合性最好,结合能为−12.134 kJ/mol,有4条氢键,可与Ile-213、His-215、Met-205、Pro-202四个氨基酸残基相连;其中海藻酸钠与11S球蛋白的结合性最低,有4条氢键,可与Glu-26、Asp-231、Glu-233三个氨基酸残基相连。7S、11S球蛋白的残基结合图见图2。
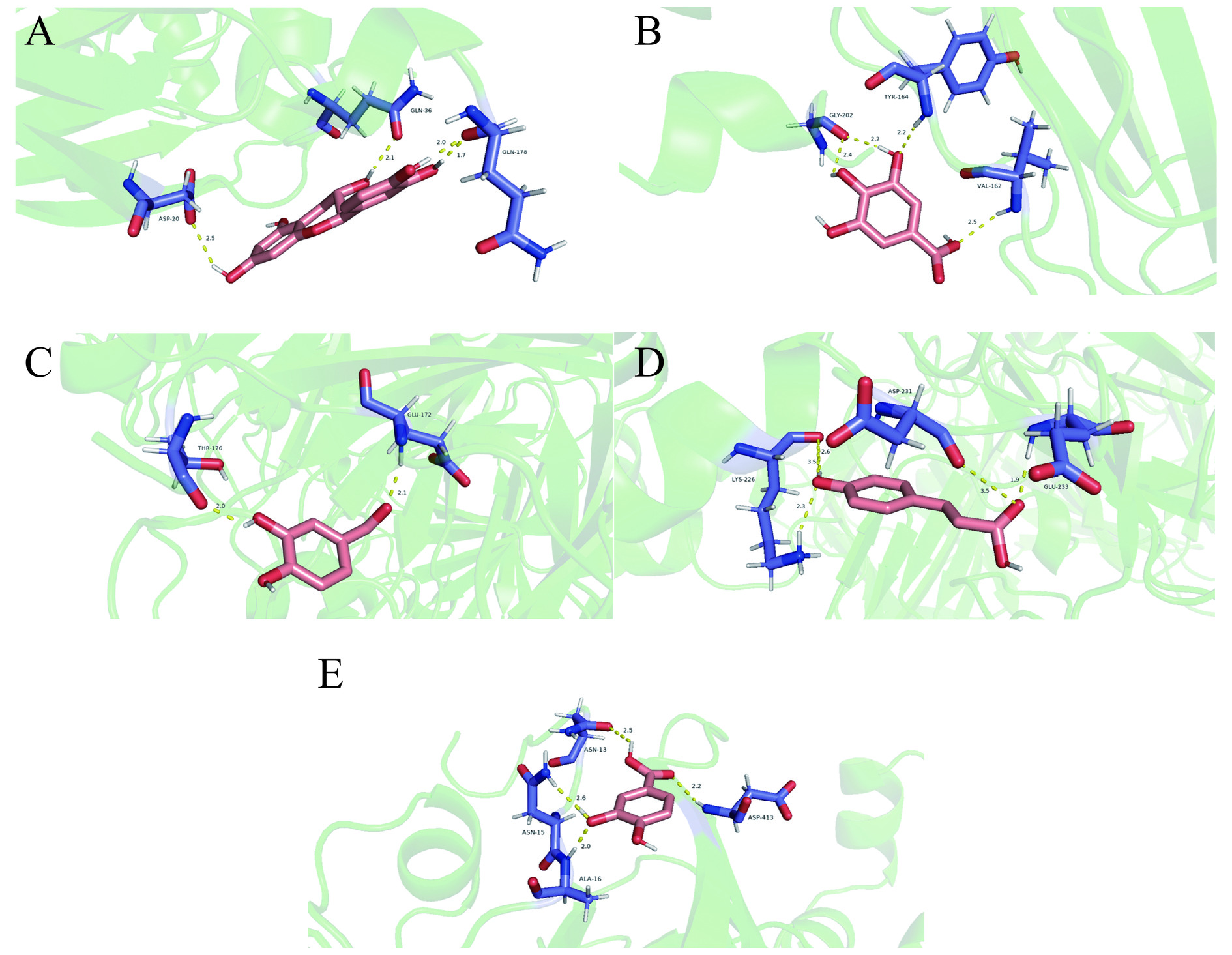
表 2 大豆分离蛋白与儿茶素、海藻酸钠的三元复合物分子对接结果Table 2. Molecular docking results of ternary complexes of soy protein isolate with catechins and sodium alginate化合物 结合能(kJ/mol) 氢键数 键长(Å) 氢键作用残基 大豆7S球蛋白/儿茶素 −10.878 4 2.3、2.5、1.8、2.3 Ile-213、His-215、Met-205、Pro-202 大豆7S球蛋白/海藻酸钠 −7.071 3 3.3、3.4、2.3 Pro-246、Ser-276、Pro-82 大豆11S球蛋白/儿茶素 −12.134 4 2.5、1.7、2.0、2.1 Asp-20、Gln-178、Gln-36 大豆11S球蛋白/海藻酸钠 −5.272 4 1.8、3.1、2.5、2.7 Glu-26、Asp-231、Glu-233 由于大豆11S球蛋白是SPI中含量最多的蛋白,在对比了7S球蛋白结合儿茶素、SA成三元复合物后,利用11S球蛋白对多酚其他五种小分子进行模拟结合(表3)。其中对香豆酸形成的氢键数最多,为5个,可以与Asp-231、Lys-226和Glu-233三个氨基酸残基相连。儿茶素结合能最低(−12.134 kJ/mol),与Asp-20、Gln-178、Gln-36残基形成的键长分别为2.5、1.7、2.0、2.1,其结合性最好。没食子酸结合能最高(−7.531 kJ/mol),结合性最低。11S球蛋白与配体的残基结合图如图3。
表 3 大豆11S球蛋白与化合物分子对接结果Table 3. Molecular docking results of soybean 11S globulin and compounds化合物 结合能(kJ/mol) 氢键数 键长(Å) 氢键作用残基 儿茶素 −12.134 4 2.5、1.7、2.0、2.1 Asp-20、Gln-178、Gln-36 没食子酸 −7.531 4 2.2、2.2、2.4、2.5 Tyr-164、Gly-202、Val-162 原儿茶醛 −10.878 2 2.0、2.1 Thr-176、Glu-172 对香豆酸 −11.297 5 2.6、3.5、2.3、1.9、3.5 Asp-231、Lys-226、Glu-233 原儿茶酸 −8.619 4 2.5、2.6、2.0、2.2 Asn-13、Asn-15、Ala-16、Asp-413 由以上配体与蛋白的结合能表明,分子对接的结果从理论上验证了RRTP、SA与SPI具有一定的结合活性,验证了三者可以形成复合物,并明确了可能进行结合的具体位点。
2.2 SPI-SA-RRTP复合物制备结果
2.2.1 单因素实验
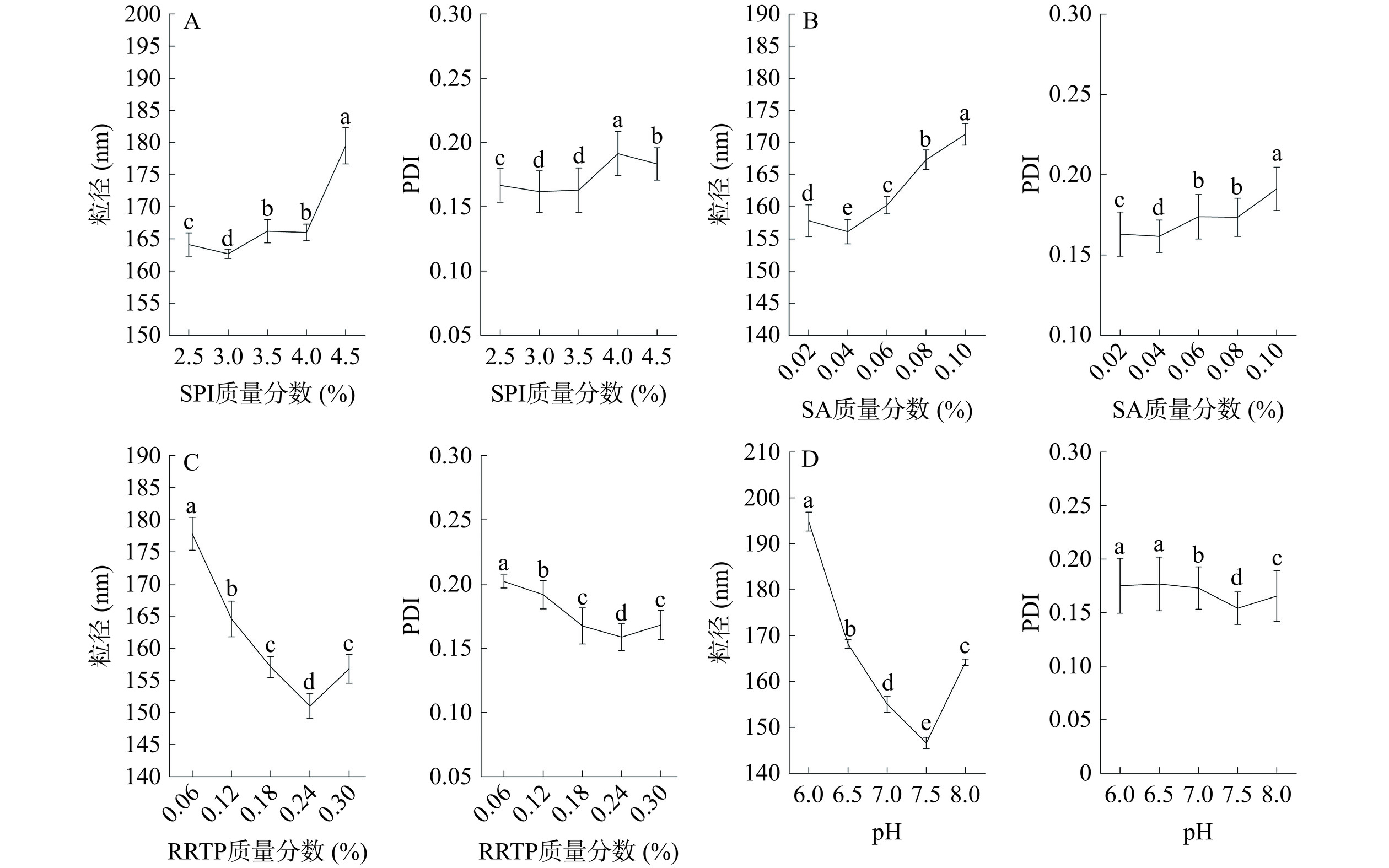
如图4A所呈现规律可能是蛋白质浓度增大后降低吸附的有效性,多余的蛋白质分子间还会发生电荷排斥作用,使复合物的稳定性遭到破坏[23]。从图4B可以看出,SA能够通过静电相互作用、空间位阻、氢键作用与SPI相互作用,形成胶束,这会提高分散度并减少分子聚集[24],然而,当SA添加量过多时,粘性增加会导致复合物的粒径增大。如图4C,复合物粒径在多酚质量分数为0.24%时达到最小值,而过量的多酚类化合物会引起蛋白析出和凝聚,所以应注意添加量。如图4D所示,随着pH接近7,粒径逐渐减小直至最小值。SPI的等电点(isoelectric point,pI)约为pH4.5~5.5,pH偏离其pI时,分子之间的静电排斥增加且相互作用减少,使分子更难聚合,从而影响微粒的粒径。在pH6.0时与等电点接近,蛋白质聚沉,粒径偏大;而pH大于8.0后,蛋白质过酸或过碱可能导致其变质,粒径增大。
2.2.2 响应面试验
2.2.2.1 响应面试验结果
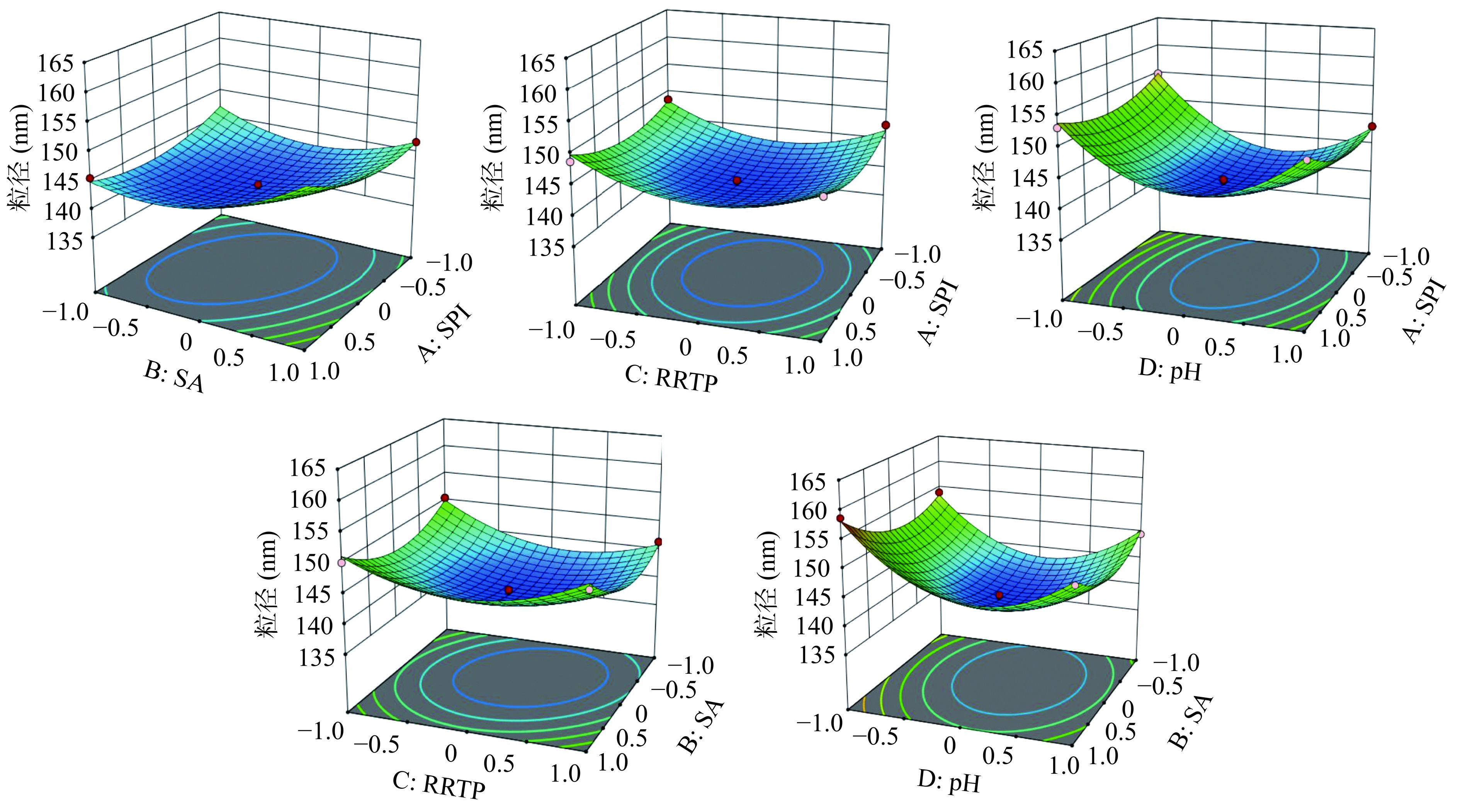
用Design-Expert 12对表4数据进行分析,得二次多项回归方程:粒径(nm)=140.85+0.7333A+1.70275B−0.891667C−2.28892D+1.7665A×B−0.0085A×C+1.275A×D+1.13325B×C−0.6085B×D−1.45025C×D+2.66712×A2+4.15449×B2+4.71287×C2+8.59199×D2。
表 4 响应面分析试验设计及结果Table 4. Response surface analysis experimental design and results试验号 A SPI B SA C RRTP D pH 粒径(nm) 1 0 −1 −1 0 150.47 2 1 −1 0 0 145.57 3 1 1 0 0 153.93 4 0 0 −1 −1 156.23 5 −1 0 0 1 148.07 6 0 1 −1 0 150.17 7 −1 −1 0 0 145.60 8 0 0 0 0 141.63 9 0 0 0 0 140.10 10 −1 0 −1 0 148.60 11 0 1 1 0 150.70 12 1 0 −1 0 148.77 13 0 −1 1 0 146.47 14 −1 0 0 −1 154.87 15 −1 1 0 0 146.90 16 0 0 0 0 140.23 17 1 0 0 −1 153.07 18 1 0 0 1 151.37 19 0 −1 0 1 149.60 20 0 0 0 0 141.77 21 −1 0 1 0 147.57 22 0 0 −1 1 155.30 23 0 1 0 −1 158.67 24 0 0 1 −1 156.57 25 0 −1 0 −1 154.03 26 1 0 1 0 147.70 27 0 0 1 1 149.83 28 0 0 0 0 140.50 29 0 1 0 1 151.80 2.2.2.2 回归模型方差分析
从表5可知,模型的F值为41.25,整体模型P<0.0001,说明该模型极显著,且失拟项=0.2104>0.05不显著,表明该模型拟合程度较好[25]。对该回归方程系数(R2=0.9763)进行分析显著性检验结果可知,影响极显著的有:B、D、AB、A2、B2、C2、D2,影响显著的有:A、C、AD、CD。从F值来看,影响粒径的四个因素依次为D>B>C>A,即pH>SA>RRTP>SPI。
表 5 响应面试验方差分析Table 5. Analysis of variance in response surface experiments方差来源 平方和 自由度 均方 F值 P值 显著性 模型 719.82 14 51.42 41.25 <0.0001 ** A 6.45 1 6.45 5.18 0.0391 * B 34.79 1 34.79 27.92 0.0001 ** C 9.54 1 9.54 7.66 0.0151 * D 62.87 1 62.87 50.44 <0.0001 ** AB 12.48 1 12.48 10.02 0.0069 ** AC 0.0003 1 0.0003 0.0002 0.9881 AD 6.5 1 6.5 5.22 0.0385 * BC 5.14 1 5.14 4.12 0.0618 BD 1.48 1 1.48 1.19 0.2941 CD 8.41 1 8.41 6.75 0.0211 * A² 46.14 1 46.14 37.02 <0.0001 ** B² 111.96 1 111.96 89.83 <0.0001 ** C² 144.07 1 144.07 115.6 <0.0001 ** D² 478.85 1 478.85 384.21 <0.0001 ** 残差 17.45 14 1.25 失拟项 14.93 10 1.49 2.37 0.2104 纯误差 2.52 4 0.6299 误差和 737.27 28 注:“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)。 2.2.2.3 交互作用分析
根据图5,AB、AD、CD有较好的相互作用。在实验操作中,应充分考虑因素之间的交互作用,将各个因素添加量与pH控制好,以保证复合物粒径。
2.2.2.4 响应面验证实验
根据响应面优化试验得到最适条件为:SPI添加量为2.95%、SA添加量为0.036%、RRTP添加量为0.25%、pH为7.57,此时粒径为140.41 nm。按上述结果重复实验,得到粒径为140.93±0.32 nm,与模型预测值相近,说明拟合效果良好。
2.3 粒径、PDI、Zeta(ζ)电位测定分析
复合物稳定性受平均粒径影响显著,而PDI则用于量化粒度分布的宽度,是一个无量纲值。通常,较小的平均粒径和较小的PDI(<0.3)表明粒子的分布更加均匀,复合物的稳定性较好[26]。见表6,只有SPI的体系是不稳定的,在加入SA或RRTP后,体系的粒径与PDI都有一定程度的下降。在均质机施加压力为60 MPa下,所有组的粒径均小于500 nm。因此,经过高压均质化后,SPI-SA-RRTP可以形成纳米级复合物。高压均质化技术能够产生强烈的湍流、振动、空化和液压剪切,提供了将液滴分解成纳米级滴的所需能量[27]。在中性pH条件下,阴离子SA和SPI之间的带正电荷区域可能通过静电吸引形成微量的复合物。由于SPI和SA具有相似的净负电荷,它们可能会相互竞争吸附并表现出优良的乳化性能。多酚和SPI之间形成共价相互作用,多糖通过插入到多酚和SPI的分子中实现吸附,多糖被覆盖在蛋白质分子的外层[28]。
表 6 SPI及其复合物平均粒径、PDI、Zeta电位Table 6. Average particle size, PDI, Zeta potential of SPI and its composites样品名称 平均粒径(nm) PDI Zeta电位(mV) SPI 173.47±1.42a 0.196±0.004a −14.867±0.586a SPI-SA 148.27±0.72c 0.166±0.003c −18.1±0.6b SPI-RRTP 158.77±0.42b 0.176±0.002b −19.1±0.954c SPI-SA-RRTP 140.93±0.32d 0.155±0.004d −31.067±2.203d 注:同列不同字母表示不同组别之间差异显著,P<0.05,表7同。 Zeta电位是蛋白质表面电荷密度的一个指标,它提供了一个指示乳液体系潜在稳定性的指标[29]。如表6所示,SA的加入增加了复合物的电负性和静电斥力,提高了稳定性。RRTP中和了SPI的正电荷,导致蛋白质上暴露的正电荷少,带负电荷的蛋白质更多。与阴离子多糖混合的复合物显示出较高的绝对Zeta电位值,表明SA的添加诱导了蛋白质与带电表面的相互作用,并通过静电吸附形成聚集体[30]。
2.4 内源性荧光光谱分析
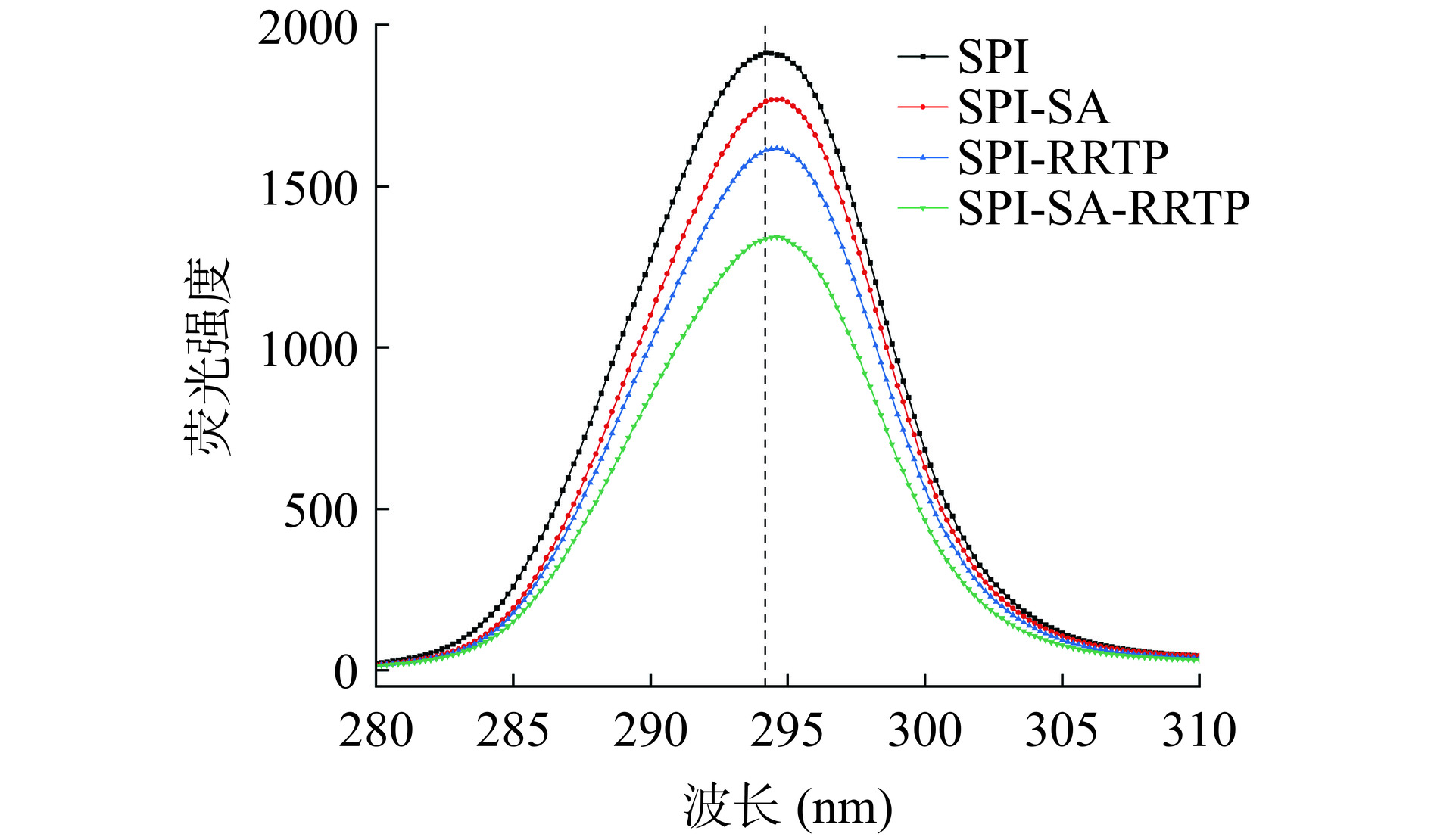
荧光光谱法可以反映蛋白质结构和构象的变化,常用于研究蛋白质与小分子的结合特性。蛋白质的内源性荧光主要来自于芳香族氨基酸,色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)残基[31]。如图6所示,SPI具有较高的荧光强度,SA、RRTP与SPI复合后会降低其荧光强度,表明它们之间存在相互作用。进一步发现,在相同条件下,SPI-SA、SPI-RRTP和SPI-SA-RRTP微粒的荧光强度较低,说明RRTP诱导SPI的荧光基团发生猝灭[32]。而SA和SPI之间的相互作用在极性区域中存在,非极性区域则形成了色氨酸残基的疏水环境,导致SPI-SA微粒的荧光强度减弱。此外,复合物的λmax还会向较长波方向发生轻微的红移,代表色氨酸等残基向亲水环境移动。最后,与小分子结合还可能导致蛋白构象变化,氨基酸残基电子环境改变,从而使最大发射波长发生红移,导致“静态猝灭”现象的出现[33]。
2.5 表面疏水性分析
表面疏水性在蛋白质分子的聚集和蛋白质、SA、RRTP的界面特性中起着至关重要的作用。由表7可知,复合物表面疏水性明显下降,亲水性升高,这是因为复合物的形成掩蔽了一些疏水基团[34]。RRTP的结合会增加羟基、羧基等极性基团的数量,从而改变周围环境的极性[35],使蛋白质的亲水性增强。此外,多酚容易与蛋白质表面游离的疏水氨基酸残基发生相互作用,导致疏水残基数量减少,从而降低了蛋白质的疏水性[36]。当双亲性蛋白质与多糖反应时,疏水性减弱,使复合物稳定性增强。
表 7 SPI及其复合物表面疏水性Table 7. Surface hydrophobicity of SPI and its composites样品名称 疏水性(×H03) SPI 121.507a SPI-SA 109.241b SPI-RRTP 94.436c SPI-SA-RRTP 64.807d 2.6 傅里叶变换衰减全反射红外光谱(ATR-FTIR)分析
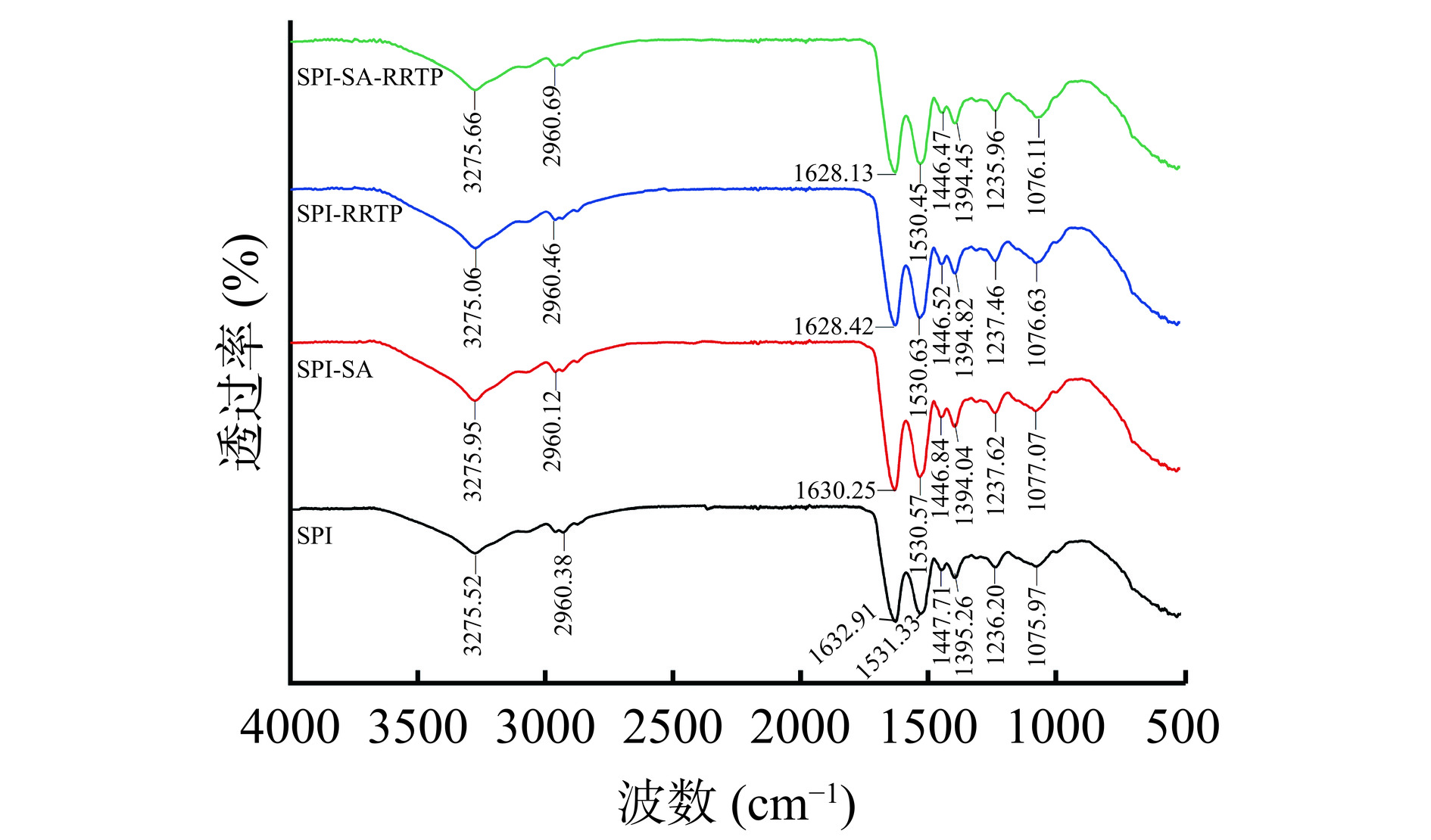
ATR-FTIR常用于表征分子相互作用,并分析蛋白质二级结构[37]。通过分析ATR-FTIR条带获得的蛋白质的一些侧基团和微环境的变化,可以确定新的化合物或官能团的形成,以及分子间力的类型[38]。如图7,SPI微粒在1632.91 cm−1处的特征峰是由于酰胺I区与C=O的拉伸振动引起的,在1531.33 cm−1处的吸收峰是酰胺II区的C-N拉伸和N-H,-CH和-CH3的振动吸收峰分别出现在1447.71 cm−1和1395.26 cm−1[39]。复合物的吸收峰微粒在3000~3700 cm−1处发生位移,出现了明显较宽的条带,表明SPI及其复合物相互作用形成氢键[40]。在2960.12、2960.46、2960.69 cm−1处的特征峰分别对应于二元、三元复合物之间的疏水相互作用引起的C-H拉伸振动的变化。与SPI微粒相比,SPI-SA、SPI-RRTP、SPI-SA-RRTP复合物的SPI特征峰有轻微的蓝移。振动频率增加,SPI与这几种物质结合后,局部共振发生增强,蓝移则意味着化学键发生增强,SPI与其他物质的结合比较紧密,说明SPI和SA之间存在静电吸引。因此,SPI及其复合物微粒的形成是氢键、疏水相互作用和静电相互作用的结果。
2.7 差示扫描量热法(DSC)分析
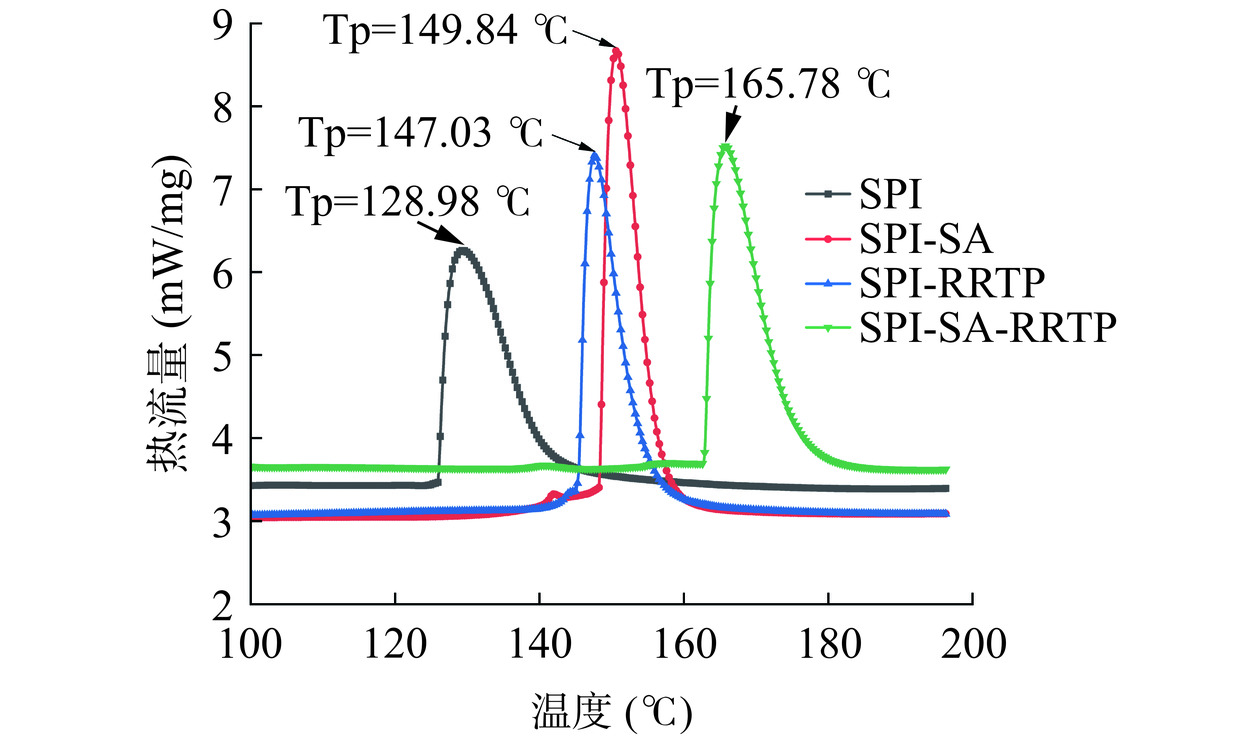
食物中蛋白质的热稳定性决定了食物的加工条件与储存时间。如图8所示,在广泛的温度范围(从20到200 ℃)内,SPI及其复合物表现出了吸热峰,其变性集中在120~170 ℃之间。其中,随着SPI添加入SA和RRTP,其峰值温度(TP)都大幅度增加,较大的TP通常意味着更好的热稳定性。SPI结合SA后,分子中的疏水和静电相互作用增加了蛋白质结构的稳定性和热稳定性。RRTP对SPI的修饰提高了其热稳定性,这可能是因为SPI经过RRTP修饰之后,二级结构发生变化。SPI-SA-RRTP三元复合物的最高变性温度(165.78 ℃)相对于SPI微粒大幅提高了36.8 ℃,这远高于SPI-SA与SPI-RRTP提高的温度,说明三者结合后其复合物的热稳定性能得到较大程度的提高,三元复合物更有利于储存与加工。LEE等[41]的研究结果表明,壳聚糖可以诱导α-乳白蛋白形成稳定的结构,从而提高其热变性温度。LIU等[42]研究发现乳铁蛋白与绿原酸共价后其变性温度提高了4.29 ℃。
2.8 激光共聚焦扫描显微镜(CLSM)观察
通过使用CLSM进行微观结构分析,获得了有关SPI及其复合物微观结构的信息。图9A中液滴尺寸最大,分布不均匀,表明液滴稳定性最低。图9B和图9C相对于图9A在粒径分布上也更加均匀。但是,SPI-RRTP微粒的粒径呈长条形,粒径也相对较大。SPI-SA的微粒分布更为均匀一些,但也有少许大颗粒联结。图9D粒径大小适中,微粒分布均匀,是理想的纳米复合物,具有较高的稳定性。
2.9 刺梨多酚-SA-SPI复合物抗氧化活性
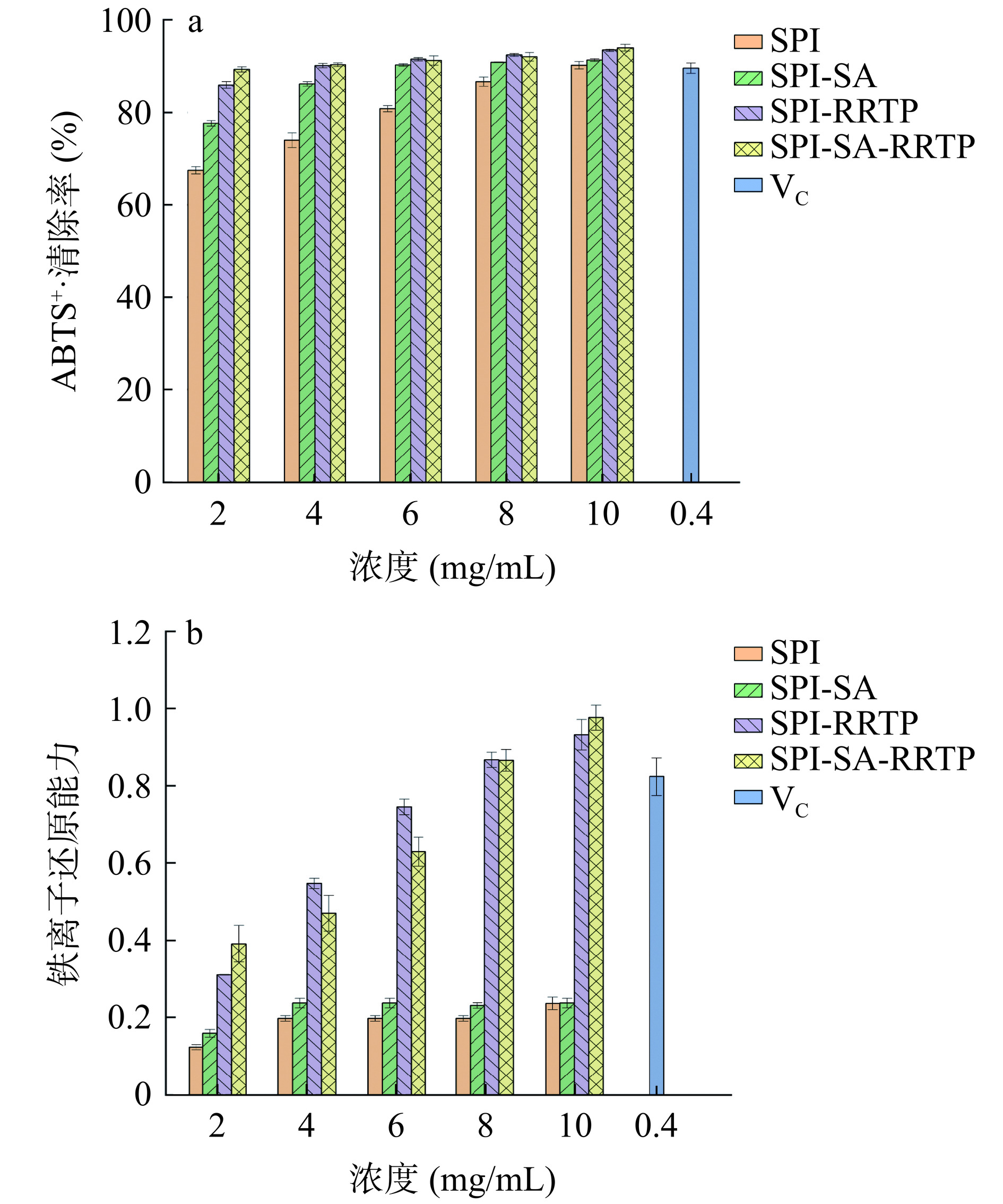
如图10a所示为SPI及其复合物对ABTS+·的清除率,不同浓度的复合物均有较好的抗氧化活性,其中浓度越大清除率越高。在相同浓度下,SPI-SA-RRTP复合物的ABTS+·清除率都高于其他三组。如图10b所示为SPI及其复合物的还原能力大小,随着浓度升高,其还原能力都逐渐增大。在浓度为4、6、8 mg/mL时,SPI-多酚复合物的还原能力均大于其他几组,这可能是SPI与多酚结合,引入更多羟基的分子具有增强物质抗氧化能力的作用,因为羟基对抗氧化具有重要贡献。与相同浓度的SPI-RRTP溶液相比,三元复合物的抗氧化能力较低,这可能与多糖、蛋白和多酚之间的反应机制有关,这些反应消耗了多酚中的一部分羟基。此外,空间位阻也会导致共价结合的多糖、蛋白-酚类化合物的抗氧化能力下降[43]。然而,综合考虑这两种抗氧化机制,SPI-SA-RRTP三元复合物展现出强大的抗氧化性能。研究表明,蛋白质与还原糖通过美拉德反应产生具有抗氧化性质的产物[44]。SPI-多酚和多糖反应过程中生成的中间还原酮化合物能够中断自由基链反应,被认为是自由基链反应的终止剂[45]。这可能是提高三元复合物抗氧化活性的关键原因。因此,三元复合物可作为食品中有效的抗氧化剂。
3. 结论
本研究通过超声波辅助醇提法从刺梨中提取了RRTP,AB-8大孔树脂分离纯化RRTP。以SPI、SA、RRTP为原料,制备了SPI-SA-RRTP纳米复合物。在SPI添加量为2.95%、SA添加量为0.036%、多酚添加量为0.25%、pH为7.57的条件下,粒径和PDI最小,Zeta电位绝对值最大。与SPI和二元复合物相比,三元复合物具有更小的粒径和PDI,其稳定性、结合度和抗氧化性等方面表现更好数值。此外,由于SPI、SA和RRTP具有不同的功能活性,将三者结合在一起可以发挥各自作用,产生协同效应。在后期试验中,复合物中加入具有各种特性的油或功能物质,可作为人造奶油替代物、运载各类活性物质、作为化妆品乳化剂等。本研究旨在使SPI-SA-RRTP纳米复合物在食品与化妆品行业中得到广泛应用,为其应用提供新的思路和方向。
-
表 1 响应面优化试验设计的因素与水平
Table 1 Factors and levels of response surface optimization experimental design
水平 A SPI(%) B SA(%) C RRTP(%) D pH −1 2.5 0.02 0.18 7.0 0 3.0 0.04 0.24 7.5 1 3.5 0.06 0.30 8.0 表 2 大豆分离蛋白与儿茶素、海藻酸钠的三元复合物分子对接结果
Table 2 Molecular docking results of ternary complexes of soy protein isolate with catechins and sodium alginate
化合物 结合能(kJ/mol) 氢键数 键长(Å) 氢键作用残基 大豆7S球蛋白/儿茶素 −10.878 4 2.3、2.5、1.8、2.3 Ile-213、His-215、Met-205、Pro-202 大豆7S球蛋白/海藻酸钠 −7.071 3 3.3、3.4、2.3 Pro-246、Ser-276、Pro-82 大豆11S球蛋白/儿茶素 −12.134 4 2.5、1.7、2.0、2.1 Asp-20、Gln-178、Gln-36 大豆11S球蛋白/海藻酸钠 −5.272 4 1.8、3.1、2.5、2.7 Glu-26、Asp-231、Glu-233 表 3 大豆11S球蛋白与化合物分子对接结果
Table 3 Molecular docking results of soybean 11S globulin and compounds
化合物 结合能(kJ/mol) 氢键数 键长(Å) 氢键作用残基 儿茶素 −12.134 4 2.5、1.7、2.0、2.1 Asp-20、Gln-178、Gln-36 没食子酸 −7.531 4 2.2、2.2、2.4、2.5 Tyr-164、Gly-202、Val-162 原儿茶醛 −10.878 2 2.0、2.1 Thr-176、Glu-172 对香豆酸 −11.297 5 2.6、3.5、2.3、1.9、3.5 Asp-231、Lys-226、Glu-233 原儿茶酸 −8.619 4 2.5、2.6、2.0、2.2 Asn-13、Asn-15、Ala-16、Asp-413 表 4 响应面分析试验设计及结果
Table 4 Response surface analysis experimental design and results
试验号 A SPI B SA C RRTP D pH 粒径(nm) 1 0 −1 −1 0 150.47 2 1 −1 0 0 145.57 3 1 1 0 0 153.93 4 0 0 −1 −1 156.23 5 −1 0 0 1 148.07 6 0 1 −1 0 150.17 7 −1 −1 0 0 145.60 8 0 0 0 0 141.63 9 0 0 0 0 140.10 10 −1 0 −1 0 148.60 11 0 1 1 0 150.70 12 1 0 −1 0 148.77 13 0 −1 1 0 146.47 14 −1 0 0 −1 154.87 15 −1 1 0 0 146.90 16 0 0 0 0 140.23 17 1 0 0 −1 153.07 18 1 0 0 1 151.37 19 0 −1 0 1 149.60 20 0 0 0 0 141.77 21 −1 0 1 0 147.57 22 0 0 −1 1 155.30 23 0 1 0 −1 158.67 24 0 0 1 −1 156.57 25 0 −1 0 −1 154.03 26 1 0 1 0 147.70 27 0 0 1 1 149.83 28 0 0 0 0 140.50 29 0 1 0 1 151.80 表 5 响应面试验方差分析
Table 5 Analysis of variance in response surface experiments
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 719.82 14 51.42 41.25 <0.0001 ** A 6.45 1 6.45 5.18 0.0391 * B 34.79 1 34.79 27.92 0.0001 ** C 9.54 1 9.54 7.66 0.0151 * D 62.87 1 62.87 50.44 <0.0001 ** AB 12.48 1 12.48 10.02 0.0069 ** AC 0.0003 1 0.0003 0.0002 0.9881 AD 6.5 1 6.5 5.22 0.0385 * BC 5.14 1 5.14 4.12 0.0618 BD 1.48 1 1.48 1.19 0.2941 CD 8.41 1 8.41 6.75 0.0211 * A² 46.14 1 46.14 37.02 <0.0001 ** B² 111.96 1 111.96 89.83 <0.0001 ** C² 144.07 1 144.07 115.6 <0.0001 ** D² 478.85 1 478.85 384.21 <0.0001 ** 残差 17.45 14 1.25 失拟项 14.93 10 1.49 2.37 0.2104 纯误差 2.52 4 0.6299 误差和 737.27 28 注:“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)。 表 6 SPI及其复合物平均粒径、PDI、Zeta电位
Table 6 Average particle size, PDI, Zeta potential of SPI and its composites
样品名称 平均粒径(nm) PDI Zeta电位(mV) SPI 173.47±1.42a 0.196±0.004a −14.867±0.586a SPI-SA 148.27±0.72c 0.166±0.003c −18.1±0.6b SPI-RRTP 158.77±0.42b 0.176±0.002b −19.1±0.954c SPI-SA-RRTP 140.93±0.32d 0.155±0.004d −31.067±2.203d 注:同列不同字母表示不同组别之间差异显著,P<0.05,表7同。 表 7 SPI及其复合物表面疏水性
Table 7 Surface hydrophobicity of SPI and its composites
样品名称 疏水性(×H03) SPI 121.507a SPI-SA 109.241b SPI-RRTP 94.436c SPI-SA-RRTP 64.807d -
[1] 王柏棋, 陈菲, 马一帆, 等. 酯化大豆蛋白-壳聚糖复合物乳化性及抑菌性[J]. 精细化工,2022,39(8):1674−1681. [WANG Baiqi, CHEN Fei, MA Yifan, et al. Emulsification and antibacterial properties of esterified soy protein chitosan complex[J]. Fine Chemicals,2022,39(8):1674−1681.] WANG Baiqi, CHEN Fei, MA Yifan, et al. Emulsification and antibacterial properties of esterified soy protein chitosan complex[J]. Fine Chemicals, 2022, 39(8): 1674−1681.
[2] 沈可洁, 李兴飞, 华欲飞, 等. 豌豆分离蛋白/卡拉胶复合物乳液的性质研究[J]. 中国油脂,2023,48(2):36−40. [SHEN Kejie, LI Xingfei, HUA Yufei, et al. Study on the properties of pea protein isolate/carrageenan complex lotion[J]. China Oil and Fats,2023,48(2):36−40.] SHEN Kejie, LI Xingfei, HUA Yufei, et al. Study on the properties of pea protein isolate/carrageenan complex lotion[J]. China Oil and Fats, 2023, 48(2): 36−40.
[3] 徐班萌, 梁新红, 李波, 等. 乳铁蛋白、EGCG和低甲酯果胶三元凝聚体稳定的高内相Pickering乳液构建[J]. 食品科学,2023,44(10):82−89. [XU Banmeng, LIANG Xinhong, LI Bo, et al. Construction of high internal phase Pickering lotion stabilized by lactoferrin, EGCG and low methyl pectin ternary aggregates[J]. Food Science,2023,44(10):82−89.] XU Banmeng, LIANG Xinhong, LI Bo, et al. Construction of high internal phase Pickering lotion stabilized by lactoferrin, EGCG and low methyl pectin ternary aggregates[J]. Food Science, 2023, 44(10): 82−89.
[4] MATSUMURA Y, SIRISON J, ISHI T, et al. Soybean lipophilic proteins-origin and functional properties as affected by interaction with storage proteins[J]. Current Opinion in Colloid & Interface Science,2017,28:120−128.
[5] HUANG C, XU Y H, CHEN J L. Cross-linking soybean protein into periodate oxidized cotton fabrics and their physical properties[C]. Advanced Materials Research. 2013, 796:385−389.
[6] 冯稳稳. 基于乳清分离蛋白-海藻酸钠复合载体的活性物质的包埋研究[D]. 无锡:江南大学, 2018. [FENG Wenwen. Study on the embedding of active substances based on whey protein isolate sodium alginate composite carrier[D]. Wuxi:Jiangnan University, 2018.] FENG Wenwen. Study on the embedding of active substances based on whey protein isolate sodium alginate composite carrier[D]. Wuxi: Jiangnan University, 2018.
[7] 汤秋冶, 潘道东, 孙杨赢, 等. ε-聚赖氨酸/海藻酸钠抗菌复合膜的制备及性能研究[J]. 中国食品学报,2016,16(12):101−107. [TANG Qiuye, PAN Daodong, SUN Yangying, et al. ε-Preparation and performance study of polylysine/sodium alginate antibacterial composite membrane[J]. Journal of Chinese Institute of Food Science and Technology,2016,16(12):101−107.] TANG Qiuye, PAN Daodong, SUN Yangying, et al. ε-Preparation and performance study of polylysine/sodium alginate antibacterial composite membrane[J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(12): 101−107.
[8] 魏倩婷. 香菇酚类物质的提取及功能学特性的研究[D]. 福州:福建农林大学, 2011. [WEI Qianting. Extraction and functional characteristics of phenolic substances from mushrooms[D]. Fuzhou:Fujian A&F University, 2011.] WEI Qianting. Extraction and functional characteristics of phenolic substances from mushrooms[D]. Fuzhou: Fujian A&F University, 2011.
[9] 王慧竹. 刺梨有效成分分析及其体外生物活性研究[D]. 长春:吉林大学, 2018. [WANG Huizhu. Analysis of active ingredients and in vitro biological activity of prickly pear[D]. Changchun:Jilin University, 2018.] WANG Huizhu. Analysis of active ingredients and in vitro biological activity of prickly pear[D]. Changchun: Jilin University, 2018.
[10] 朱延胜, 魏明, 钱森, 等. 紫山药多酚分离纯化及其对α-葡萄糖苷酶活性的抑制作用[J]. 食品与发酵工业,2022,48(16):182−187. [ZHU Yansheng, WEI Ming, QIAN Sen, et al. Separation and purification of polyphenols from purple yam and their effects on α-The inhibitory effect of glucosidase activity[J]. Food and Fermentation Industries,2022,48(16):182−187.] ZHU Yansheng, WEI Ming, QIAN Sen, et al. Separation and purification of polyphenols from purple yam and their effects on α-The inhibitory effect of glucosidase activity[J]. Food and Fermentation Industries, 2022, 48(16): 182−187.
[11] 张逸婧, 刘永祥, 陈思远, 等. 脱脂溶剂对大豆分离蛋白、7S和11S球蛋白提取率及纯度的影响[J]. 中国油脂,2016,41(2):30−33. [ZHANG Yijing, LIU Yongxiang, CHEN Siyuan, et al. The effect of defatting solvents on the extraction rate and purity of soy protein isolate, 7S and 11S globulin[J]. China Oils and Fats,2016,41(2):30−33.] doi: 10.3969/j.issn.1003-7969.2016.02.008 ZHANG Yijing, LIU Yongxiang, CHEN Siyuan, et al. The effect of defatting solvents on the extraction rate and purity of soy protein isolate, 7S and 11S globulin[J]. China Oils and Fats, 2016, 41(2): 30−33. doi: 10.3969/j.issn.1003-7969.2016.02.008
[12] WANG S, YANG J, SHAO G, et al. Soy protein isolated-soy hull polysaccharides stabilized O/W emulsion:Effect of polysaccharides concentration on the storage stability and interfacial rheological properties[J]. Food Hydrocolloids,2020,101:105490. doi: 10.1016/j.foodhyd.2019.105490
[13] CHEN W, JU X, ALUKO R E, et al. Rice bran protein-based nanoemulsion carrier for improving stability and bioavailability of quercetin[J]. Food Hydrocolloids,2020,108:106042. doi: 10.1016/j.foodhyd.2020.106042
[14] TONG X, CAO J, TIAN T, et al. Changes in structure, rheological property and antioxidant activity of soy protein isolate fibrils by ultrasound pretreatment and EGCG[J]. Food Hydrocolloids,2022,122:107084. doi: 10.1016/j.foodhyd.2021.107084
[15] LÜ B, WANG H, SWALLAH M S, et al. Structure, properties and potential bioactivities of high-purity insoluble fibre from soybean dregs (Okara)[J]. Food Chemistry,2021,364:130402. doi: 10.1016/j.foodchem.2021.130402
[16] YI J, LAM T I, YOKOYAMA W, et al. Beta-carotene encapsulated in food protein nanoparticles reduces peroxyl radical oxidation in Caco-2 cells[J]. Food Hydrocolloids,2015,43:31−40. doi: 10.1016/j.foodhyd.2014.04.028
[17] 蔡苗苗, 陈胜军, 杨贤庆, 等. 舌状蜈蚣藻蛋白质的提取及其抗氧化活性研究[J]. 南方水产科学,2020,16(2):99−106. [CAI Miaomiao, CHEN Shengjun, YANG Xianqing, et al. Extraction and antioxidant activity of protein from tongue shaped centipede algae[J]. South China Fisheries Science,2020,16(2):99−106.] doi: 10.12131/20190232 CAI Miaomiao, CHEN Shengjun, YANG Xianqing, et al. Extraction and antioxidant activity of protein from tongue shaped centipede algae[J]. South China Fisheries Science, 2020, 16(2): 99−106. doi: 10.12131/20190232
[18] 陈薛. 不同茶树品种鲜叶多糖的理化性质和抗氧化活性比较研究[D]. 杭州:浙江大学, 2022. [CHEN Xue. Comparative study on the physicochemical properties and antioxidant activity of fresh leaf polysaccharides from different tea tree varieties[D]. Hangzhou:Zhejiang University, 2022.] CHEN Xue. Comparative study on the physicochemical properties and antioxidant activity of fresh leaf polysaccharides from different tea tree varieties[D]. Hangzhou: Zhejiang University, 2022.
[19] 王丽萍, 高彩雯, 冯海月, 等. 基于分子对接及酶抑制动力学探究红景天提取物体外α-葡萄糖苷酶抑制活性[J]. 天然产物研究与开发, 2022, 34(12):2018-2025. [WANG Liping, GAO Caiwen, FENG Haiyue, et al. Exploring extracts of rhodiola based on molecular docking and enzyme inhibition dynamicsα-glucosidase inhibitory activity[J]. Natural Product Research and Development, 2022, 34(12):2018-2025.] WANG Liping, GAO Caiwen, FENG Haiyue, et al. Exploring extracts of rhodiola based on molecular docking and enzyme inhibition dynamics α-glucosidase inhibitory activity[J]. Natural Product Research and Development, 2022, 34(12): 2018-2025.
[20] 林先佳, 宋健, 王医, 等. 基于网络药理学和分子对接的潜在治疗化疗所致恶心呕吐中药成分筛选及分析[J]. 药物评价研究,2023,46(6):1175−1184. [LIN Xianjia, SONG Jian, WANG Yi, et al. Screening and analysis of potential therapeutic components of traditional Chinese medicine for chemotherapy-induced nausea and vomiting based on network pharmacology and molecular docking[J]. Drug Evaluation Research,2023,46(6):1175−1184.] LIN Xianjia, SONG Jian, WANG Yi, et al. Screening and analysis of potential therapeutic components of traditional Chinese medicine for chemotherapy-induced nausea and vomiting based on network pharmacology and molecular docking[J]. Drug Evaluation Research, 2023, 46(6): 1175−1184.
[21] 樊卫国, 周禹佳. 刺梨叶、花瓣和果实的多酚及三萜组分、含量及其提取物的抗氧化特性[J]. 贵州大学学报(自然科学版),2022,39(5):13−21. [FAN Weiguo, ZHOU Yujia. Polyphenol and triterpenoid components, content, and antioxidant properties of prickly pear leaves, petals, and fruits[J]. Journal of Guizhou University (Natural Science Edition),2022,39(5):13−21.] FAN Weiguo, ZHOU Yujia. Polyphenol and triterpenoid components, content, and antioxidant properties of prickly pear leaves, petals, and fruits[J]. Journal of Guizhou University (Natural Science Edition), 2022, 39(5): 13−21.
[22] 杨笙. 刺梨多酚提取物的抗氧化评价及机制研究[D]. 贵阳:贵州大学, 2022. [YANG Sheng. Antioxidant evaluation and mechanism study of prickly pear polyphenol extract[D]. Guiyang:Guizhou University, 2022.] YANG Sheng. Antioxidant evaluation and mechanism study of prickly pear polyphenol extract[D]. Guiyang: Guizhou University, 2022.
[23] 李慧娜, 田少君, 章绍兵. 大豆分离蛋白和浓缩蛋白乳液体系稳定性的比较[J]. 河南工业大学学报(自然科学版),2017,38(4):6−13. [LI Huina, TIAN Shaojun, ZHANG Shaobing. Comparison of stability of soy protein isolate and protein concentrate lotion systems[J]. Journal of Henan University of Technology (Natural Science Edition),2017,38(4):6−13.] LI Huina, TIAN Shaojun, ZHANG Shaobing. Comparison of stability of soy protein isolate and protein concentrate lotion systems[J]. Journal of Henan University of Technology (Natural Science Edition), 2017, 38(4): 6−13.
[24] GHORBANI G E, WAHEED A, LUDWIG R, et al. Complex coacervation of milk proteins with sodium alginate[J]. Journal of Agricultural and Food Chemistry,2018,66(12):3210−3220. doi: 10.1021/acs.jafc.7b03915
[25] 王自凡, 卢永仲, 张振. 响应面优化白芨多糖提取工艺及流变性研究[J]. 中国调味品,2022,47(7):58−63. [WANG Zifan, LU Yongzhong, ZHANG Zhen. Response surface optimization of extraction process and rheological properties of Bai Ji polysaccharide[J]. China Condiment,2022,47(7):58−63.] doi: 10.3969/j.issn.1000-9973.2022.07.011 WANG Zifan, LU Yongzhong, ZHANG Zhen. Response surface optimization of extraction process and rheological properties of Bai Ji polysaccharide[J]. China Condiment, 2022, 47(7): 58−63. doi: 10.3969/j.issn.1000-9973.2022.07.011
[26] 岳晓月, 吴佳蓉, 王艳秋, 等. 海藻酸锌纳米凝胶超声雾化吸入安全性评价[J]. 天津中医药,2019,36(9):909−915. [YUE Xiaoyue, WU Jiarong, WANG Yanqiu, et al. Safety evaluation of ultrasonic atomization inhalation of zinc alginate nano gel[J]. Tianjin Journal of Traditional Chinese Medicine,2019,36(9):909−915.] YUE Xiaoyue, WU Jiarong, WANG Yanqiu, et al. Safety evaluation of ultrasonic atomization inhalation of zinc alginate nano gel[J]. Tianjin Journal of Traditional Chinese Medicine, 2019, 36(9): 909−915.
[27] 史亚濛. 花椒精油纳米乳液的制备、特性表征及其应用研究[D]. 无锡:江南大学, 2022. [SHI Yameng. Preparation, characterization and application of Zanthoxylum bungeanum essential oil nano lotion[D]. Wuxi:Jiangnan University, 2022.] SHI Yameng. Preparation, characterization and application of Zanthoxylum bungeanum essential oil nano lotion[D]. Wuxi: Jiangnan University, 2022.
[28] ZHAO Y, WANG X, LI D, et al. Effect of anionic polysaccharides on conformational changes and antioxidant properties of protein-polyphenol binary covalently-linked complexes[J]. Process Biochemistry,2020,89:89−97. doi: 10.1016/j.procbio.2019.10.021
[29] 费扬, 张吴昊, 霍艳荣, 等. 预加热处理对甘薯蛋白乳化特性的影响[J]. 中国粮油学报,2023,38(5):88−95. [FEI Yang, ZHANG Wuhao, HUO Yanrong, et al. The effect of pre heating treatment on the emulsifying properties of sweet potato protein[J]. Journal of the Chinese Cereals and Oils Association,2023,38(5):88−95.] FEI Yang, ZHANG Wuhao, HUO Yanrong, et al. The effect of pre heating treatment on the emulsifying properties of sweet potato protein[J]. Journal of the Chinese Cereals and Oils Association, 2023, 38(5): 88−95.
[30] 楼丽. 酪蛋白酸钠/ε-聚赖氨酸复合纳米颗粒构建及其在Pickering乳液中的应用[D]. 杭州:浙江工商大学, 2022. [LOU Li. Sodium caseinate/ε-Construction of polylysine composite nanoparticles and its application in Pickering lotion[D]. Hangzhou:Zhejiang Technology and Business University, 2022.] LOU Li. Sodium caseinate/ε-Construction of polylysine composite nanoparticles and its application in Pickering lotion[D]. Hangzhou: Zhejiang Technology and Business University, 2022.
[31] SINGH R, AMAMCHARLA J K. Effect of pH on heat-induced interactions in high-protein milk dispersions and application of fluorescence spectroscopy in characterizing these changes[J]. Journal of Dairy Science,2021,104(4):3899−3915. doi: 10.3168/jds.2020-19304
[32] 王艳红, 田少君, 张争全, 等. 大豆分离蛋白-黄原胶-茶多酚复合物的制备及其乳液性质表征[J]. 中国油脂,2021,46(4):38−42. [WANG Yanhong, TIAN Shaojun, ZHANG Zhengquan, et al. Preparation of soy protein isolate xanthan gum tea polyphenol complex and characterization of its lotion properties[J]. Chinese Journal of Oils and Fats,2021,46(4):38−42.] WANG Yanhong, TIAN Shaojun, ZHANG Zhengquan, et al. Preparation of soy protein isolate xanthan gum tea polyphenol complex and characterization of its lotion properties[J]. Chinese Journal of Oils and Fats, 2021, 46(4): 38−42.
[33] 刘丽莉, 于影, 苏克楠, 等. 植物多酚-牛血清白蛋白相互作用及对蛋白质结构的影响[J]. 农业工程学报,2023,39(13):290−298. [LIU Lili, YU Ying, SU Kenan, et al. The interaction between plant polyphenols and bovine serum albumin and its effect on protein structure[J]. Transactions of the Chinese Society of Agricultural Engineering,2023,39(13):290−298.] LIU Lili, YU Ying, SU Kenan, et al. The interaction between plant polyphenols and bovine serum albumin and its effect on protein structure[J]. Transactions of the Chinese Society of Agricultural Engineering, 2023, 39(13): 290−298.
[34] 崔娜, 文鹏程, 郭慧媛, 等. 蔗糖对酪蛋白结构及其乳化性影响的光谱学分析[J]. 光谱学与光谱分析,2017,37(10):3127−3132. [CUI Na, WEN Pengcheng, GUO Huiyuan, et al. Spectral analysis of the effect of sucrose on the structure and emulsifying properties of casein[J]. Spectroscopy and Spectral Analysis,2017,37(10):3127−3132.] CUI Na, WEN Pengcheng, GUO Huiyuan, et al. Spectral analysis of the effect of sucrose on the structure and emulsifying properties of casein[J]. Spectroscopy and Spectral Analysis, 2017, 37(10): 3127−3132.
[35] 周思多. 膳食多酚与大豆蛋白相互作用及其复合物功能性质研究[D]. 南京:南京农业大学, 2019. [ZHOU Siduo. Study on the interaction between dietary polyphenols and soy protein and the functional properties of their complexes[D]. Nanjing:Nanjing Agricultural University, 2019.] ZHOU Siduo. Study on the interaction between dietary polyphenols and soy protein and the functional properties of their complexes[D]. Nanjing: Nanjing Agricultural University, 2019.
[36] KROLL J, RAWEL H M, ROHN S. Reactions of plant phenolics with food proteins and enzymes under special consideration of covalent bonds[J]. Food Science and Technology Research,2003,9(3):205−218. doi: 10.3136/fstr.9.205
[37] LAN Y, OHM J B, CHEN B, et al. Phase behavior and complex coacervation of concentrated pea protein isolate-beet pectin solution[J]. Food Chemistry,2020,307:125536. doi: 10.1016/j.foodchem.2019.125536
[38] MÅGE I, BÖCKER U, WUBSHET S G, et al. Fourier-transform infrared (FTIR) fingerprinting for quality assessment of protein hydrolysates[J]. LWT,2021,152:112339. doi: 10.1016/j.lwt.2021.112339
[39] LIU F, MA C, MCCLEMENTS D J, et al. A comparative study of covalent and non-covalent interactions between zein and polyphenols in ethanol-water solution[J]. Food Hydrocolloids,2017,63:625−634. doi: 10.1016/j.foodhyd.2016.09.041
[40] WANG W, SHEN M, JIANG L, et al. Influence of Mesona blumes polysaccharide on the gel properties and microstructure of acid-induced soy protein isolate gels[J]. Food Chemistry, 2020, 313:126125.
[41] LEE A C, HONG Y H. Coacervate formation of α-lactalbumin–chitosan and β-lactoglobulin–chitosan complexes[J]. Food Research International, 2009, 42(5-6):733-738.
[42] LIU F, MA C, MCCLEMENTS D J, et al. Development of polyphenol-protein-polysaccharide ternary complexes as emulsifiers for nutraceutical emulsions:Impact on formation, stability, and bioaccessibility of β-carotene emulsions[J]. Food Hydrocolloids, 2016, 61:578-588.
[43] ROHN S, RAWEL H M, KROLL J. Antioxidant activity of protein-bound quercetin[J]. Journal of Agricultural and Food Chemistry,2004,52(15):4725−4729. doi: 10.1021/jf0496797
[44] GUMUS C E, DAVIDOV-PARDO G, MCCLEMENTS D J. Lutein-enriched emulsion-based delivery systems:Impact of maillard conjugation on physicochemical stability and gastrointestinal fate[J]. Food hydrocolloids,2016,60:38−49. doi: 10.1016/j.foodhyd.2016.03.021
[45] SHON M Y, KIM T H, SUNG N J. Antioxidants and free radical scavenging activity of Phellinus baumii (Phellinus of Hymenochaetaceae) extracts[J]. Food Chemistry,2003,82(4):593−597.





 下载:
下载:

 下载:
下载:



