Structural Characterization and Antioxidant Activity in Vivo of Polysaccharides from the Leaves of Hippophae rhamnoides L.
-
摘要: 本文以新疆大果沙棘叶为研究对象,对沙棘叶多糖(Hippophae rhamnoides leaf polysaccharide,HRLP)成分进行分离纯化、结构鉴定及体内抗氧化活性研究。通过水提醇沉法提取HRLP,采用DEAE-650M阴离子交换柱层析法制备均一多糖(HRLP-2),通过液相色谱、气相色谱、紫外、红外光谱、圆二色谱、刚果红实验以及部分酸水解、高碘酸氧化和Smith降解等方法对HRLP-2进行了结构鉴定,并评价了HRLP的体内抗氧化活性。结果表明HRLP-2是由摩尔比为10.26:49.37:3.09:2.24:4.50:30.53的鼠李糖(Rha)、阿拉伯糖(Ara)、木糖(Xyl)、甘露糖(Man)、葡萄糖(Glc)及半乳糖(Gal)组成的均一多糖,其中,HRLP-2的主链可能主要由Gal及Ara组成,末端或支链主要由Rha、Ara及Glc组成。刚果红试验结果表明HRLP-2具有三螺旋结构。与模型组相比,中剂量组HRLP的总超氧化物歧化酶、谷胱甘肽过氧化物酶及过氧化氢酶活力显著上升(P<0.05),丙二醛含量显著降低(P<0.05)。苏木精-伊红(hematoxylin-eosin,HE)染色表明HRLP对小鼠肝及肾组织细胞及结构损伤具有保护作用。中剂量组的HRLP能够提高小鼠肠道菌群物种数,促进机体短链脂肪酸合成。综上所述,HRLP可能通过改善D-半乳糖诱导小鼠的氧化应激水平及肠道微生物菌群而起抗氧化活性。此研究将为沙棘叶资源的综合利用及沙棘叶多糖构效关系的研究提供参考。Abstract: This paper as the leaves of Xinjiang Hippophae rhamnoides L. was the research object, and the isolation, structure elucidation, and antioxidant activity in vivo of the polysaccharides from the leaves of Hippophae rhamnoides L. (Hippophae rhamnoides leaf polysaccharide, HRLP) were performed. HRLP were extracted by water extraction and alcohol precipitation method, and homogeneous polysaccharide (HRLP-2) was obtained through DEAE-650M anion exchange column chromatography. The structure of HRLP-2 was identified based on the analysis of liquid chromatography, gas chromatography, UV, infrared spectroscopy, circular dichroism, Congo red experiment, as well as partial acid hydrolysis, periodate oxidation, and Smith degradation methods. Meanwhile, the antioxidant activity in vivo of HRLP was evaluated. The results showed that HRLP-2 was a homogenous polysaccharide composed of rhamnose, arabinose, xylose, mannose, glucose, and galactose with a molar ratio of 10.26:49.37:3.09:2.24:4.50:30.53. Among them, the backbone of HRLP-2 was probably composed of galactose and arabinose, while rhamnose, arabinose, and glucose were for terminals or branched chains. Congo red test results showed that HRLP-2 had a triple helix structure. Compared with the model group, the total superoxide dismutase, glutathione peroxidase, and catalaseactivities of HRLP in the medium dose group were significantly increased (P<0.05), while the content of malondialdehyde was significantly decreased (P<0.05). The HE staining results indicated that HRLP had protective effect on liver and kidney tissue cells and structure damage in mice. The medium dose group of HRLP could increase the number of gut microbiota species in mice and promote the synthesis of short-chain fatty acids in the body. In a word, HRLP may exhibit antioxidant activity by improving oxidative stress and gut microbiota in D-galactose-induced mice. This study provides a reference for the comprehensive utilization of Hippophae rhamnoides L. resources and the structure-activity relationship of Hippophae rhamnoides L. polysaccharides.
-
沙棘(Hippophae rhamnoides L.)为胡颓子科植物的干燥成熟果实,在我国有5个亚种,分布于我国华北、西北及四川、云南、西藏等地,主产于内蒙古及新疆[1]。沙棘记载于中国药典2020年第一部,主要用于脾虚食少、食积腹痛、咳嗽痰多、跌扑淤肿等的治疗[2]。沙棘中富含黄酮、油脂、多糖、萜类、维生素及鞣质等成分[3−6],具有免疫调节、抗炎、抗氧化、保肝、抗衰老、抗肿瘤、改善肠道菌群等活性[7−11]。多糖为沙棘果实及叶子的主要生物活性成分之一,李芳亮等[12]通过分级沉淀法制备的沙棘叶多糖显出较好的自由基清除能力。Wei等[13]研究表明沙棘果实多糖能够降低小鼠血清中MDA含量、增加SOD及GSH-Px活性。氧化过程中一般会产生自由基,从而引起连锁反应,当连锁反应发生在细胞内时,其会侵蚀细胞膜,导致细胞完整性的丧失,从而成为各种疾病和衰老的根源。活性氧是机体正常氧代谢的副产物,在细胞信号转导和维持机体正常功能中起着重要作用[14−15]。目前,来源于植物、动物和微生物的天然多糖已显示出潜在的抗氧化活性。多糖在自然界广泛存在于动物、植物及藻类等,天然的动植物多糖具有多种生物活性,已在食品、药品及化妆品行业具有广阔的应用前景。植物果实及叶中富含多糖类成分,且显出抗氧化、抗炎、免疫及肠道菌群调节等生物活性[16−19]。
多糖的生物活性与其结构密切相关,化学结构是其生物活性的基础。多糖结构的复杂使其能够更好的传递生物信息,研究多糖构效关系,寻找其活性片段受到研究者们广泛的关注。多糖的结构与其生物活性密切相关,多糖的含量、分子量及单糖组成等均对多糖的生物活性影响较大。除此,糖苷键的链接方式、支链的链接位置、糖环的构型等也对多糖的生物活性起重要作用。有关于沙棘植物多糖的研究主要集中于其果实多糖的分离分析及活性筛选,有关副产物资源沙棘叶多糖的研究尚处于初始阶段。
目前有关于沙棘多糖的研究主要集中于其果实,除了药用部位沙棘果实外,沙棘皮渣、沙棘籽粕及叶子等副产物利用率较低,被当做废弃物丢弃,从而导致资源的浪费。关于沙棘叶多糖的研究主要集中于多糖提取工艺优化及粗提物生物活性筛选,有关其体内生物活性,尤其是抗氧化活性研究报道鲜见。基于沙棘叶多糖抗氧化活性,解析其化学结构、有望从中发现新的抗氧化活性片段为沙棘叶多糖的推广应用具有重要意义。因此,本文基于多种经典化学方法,包括完全酸水解、部分酸水解、高碘酸氧化和Smith降解等结合气相色谱(GC)、高效液相色谱(HPLC)、红外吸收光谱(FT-IR)及圆二色谱(CD)等现代仪器分析方法对沙棘叶酸性均一多糖进行结构鉴定。同时,以D-半乳糖诱导的氧化损伤小鼠为模型,评价沙棘叶多糖的抗氧化作用。文章旨在为沙棘叶多糖构效关系及药效物质基础的研究提供实验基础。
1. 材料与方法
1.1 材料与仪器
SPF级昆明小鼠 60只,雄性,体重18~22 g,由新疆医科大学医学动物实验中心提供,动物生产许可证号:SCXK(新)2018-0002。所有动物都被喂养在无病原体的环境中,并遵守所有适用的有关动物伦理使用的机构和政府法规;沙棘叶 购买于药材市场;DEAE-650M 购买于日本TOSHO公司;透析袋(3500 Da)、赤藓醇、中性树胶 购买于北京索莱宝公司;三氟乙酸 购买于上海麦克林生化科技有限公司;标准单糖 购买于上海蓝季公司;石油醚、无水乙醇、甲醇、乙二醇、乙酸酐、吡啶、氢氧化钠、盐酸羟胺等 均为分析纯,购买于天津市鑫铂特化工有限公司;刚果红、高碘酸钠、溴酚甲紫 均为分析纯,购买于天津市致远化学试剂有限公司厂;多聚甲醛、二甲苯、氯化钠、二水合磷酸二氯钠、盐酸、碘化钠、十二水合硫酸铝钾、一水合柠檬酸、冰醋酸、氨水等 均为分析纯,购买于国药集团化学试剂有限公司;伊红γ(醇溶) 分析纯,购买于西亚试剂;苏木素 分析纯,购买于Sigma公司;三氟乙醛(水合) 购买于阿拉丁生化科技股份有限公司。
UV2550型紫外分光光度计、LC-20高效液相色谱仪、GC-2014C型气相色谱仪、IR-Affinity1型红外光谱仪 日本SHIMADZU公司;Chirascan型圆二色谱仪 英国Applied photophysics公司;Multiskan FC酶标仪 赛默飞世尔(上海)仪器有限公司;CX21普通光学显微镜、倒置白光/荧光拍照显微镜、正置白光拍照显微镜 日本OLYMPUS公司。
1.2 实验方法
1.2.1 预处理
沙棘叶经晒干、粉碎、过筛(100目)备用。按料液比为1:5(g/mL)加入石油醚进行脱脂至石油醚层无色,抽滤,将粉末自然风干。脱脂后的粉末按料液比为1:5(g/mL)使用85%的乙醇进行脱色至乙醇层颜色较淡,抽滤,将粉末自然风干,备用。
1.2.2 多糖的提取
预处理后的沙棘叶粉末在料液比1:20 g/mL、提取温度90 ℃、提取时间2 h条件下进行提取。待提取完毕,提取液冷却至室温,过滤,将上清液浓缩至原体积的1/3,用四倍体积的无水乙醇沉淀,于4 ℃放置12 h,室温离心(5000 r/min,10 min),沉淀复溶,冷冻干燥,得沙棘叶子多糖,命名为HRLP。
1.2.3 多糖的分离纯化
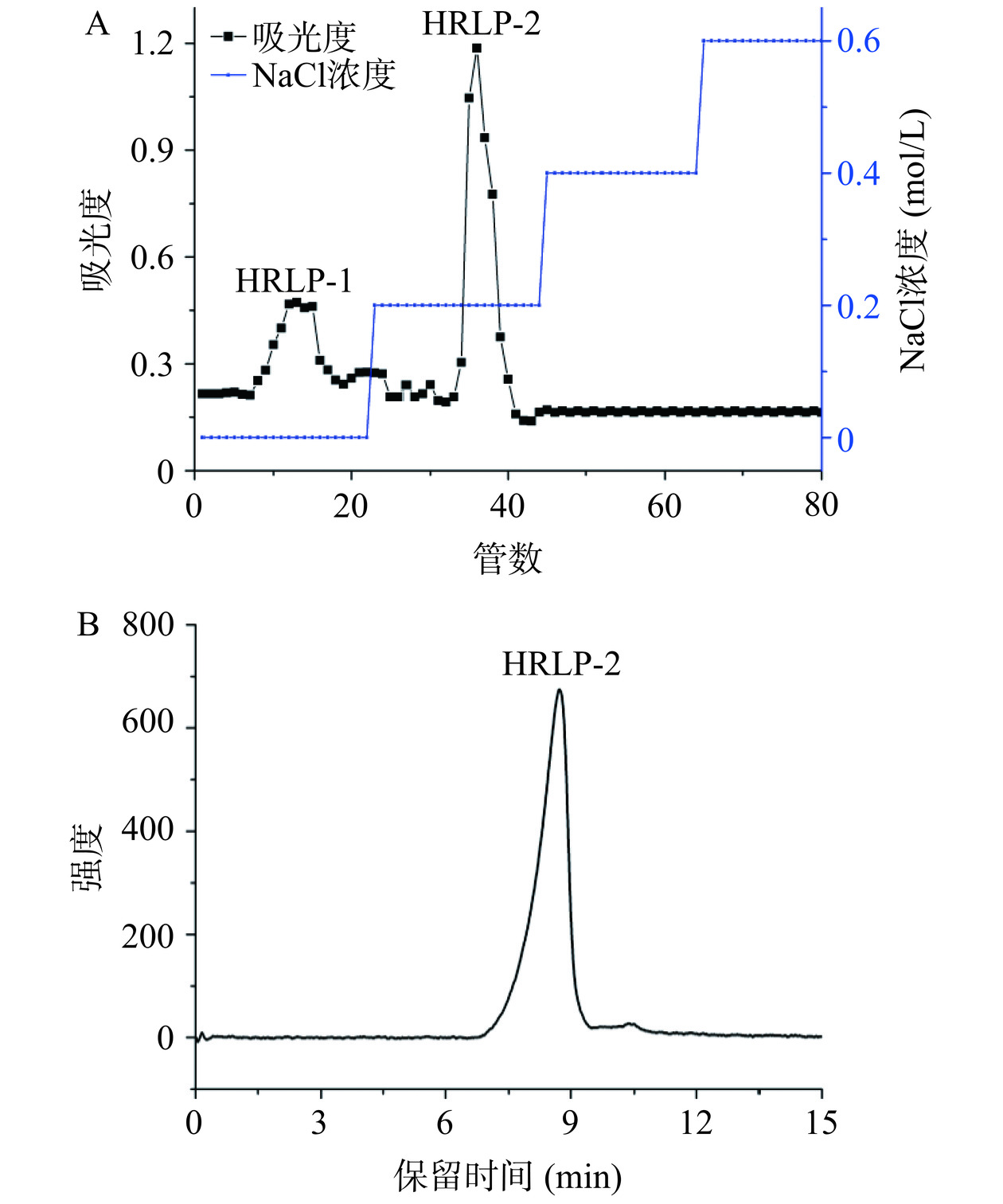
称取300 mg HRLP粗多糖,溶解在30 mL蒸馏水中,室温离心(5000 r/min,10 min)、过0.45 μm水系过滤膜,经DEAE-650M阴离子交换柱(36.6×207 mm)层析法进行分离纯化,分别以蒸馏水、0.2、0.4、0.6 mol/L的NaCl溶液为洗脱剂进行洗脱,流速2 mg/mL,用自动收集器收集,并用蒽酮-硫酸法检测,绘制洗脱曲线。按洗脱峰的位置收集样品,浓缩,NaCl溶液洗脱部位经透析(截留量3500 Da)48 h再冻干。
1.2.4 多糖的结构鉴定
1.2.4.1 单糖组成的测定
按照本课题组前期研究报道测定HRLP-2的单糖组成方法进行测定[20]。分别称取5 mg鼠李糖(Rha)、阿拉伯糖(Ara)、木糖(Xyl)、甘露糖(Man)、葡萄糖(Glc)及半乳糖(Gal)标准品,分别加入8 mg盐酸羟胺及0.5 mL吡啶,于90 ℃水浴反应30 min。取出,冷却至室温,分别加入0.5 mL乙酸酐,于90 ℃水浴反应30 min。待反应完毕,将反应液吹干,加入1 mL三氯甲烷,过0.22 μm有机系滤膜,供气相色谱检测。称取5 mg HRLP-2,加入3 mL三氟乙酸(2 mol/L),于120 ℃水解6 h。待水解完毕,加入3~4 mL甲醇将溶液旋干,重复三次。按照单糖标准品衍生化方法进行衍生化,供气相色谱检测。气相色谱条件:进样口温度270 ℃、检测器温度250 ℃、进样量2 µL、程序升温条件如下:160 ℃保持3 min,以3 ℃/min的速率加热到190 ℃,保留3 min,最后以2 ℃/min的速率加热到230 ℃,保留10 min。
1.2.4.2 纯度测定
配制浓度为2 mg/mL的HRLP-2水溶液,过0.22 μm水系滤膜,备用。通过配备TSK-GEL G4000 PWxL(300 mm×7.8 mm,i.d.)色谱柱及RID-10A示差检测器的HPLC进行测定。流动相为超纯水,用流动相平衡柱子,流速0.6 mL/min,柱温25 ℃,进样体积20 μL。
1.2.4.3 紫外及红外吸收光谱
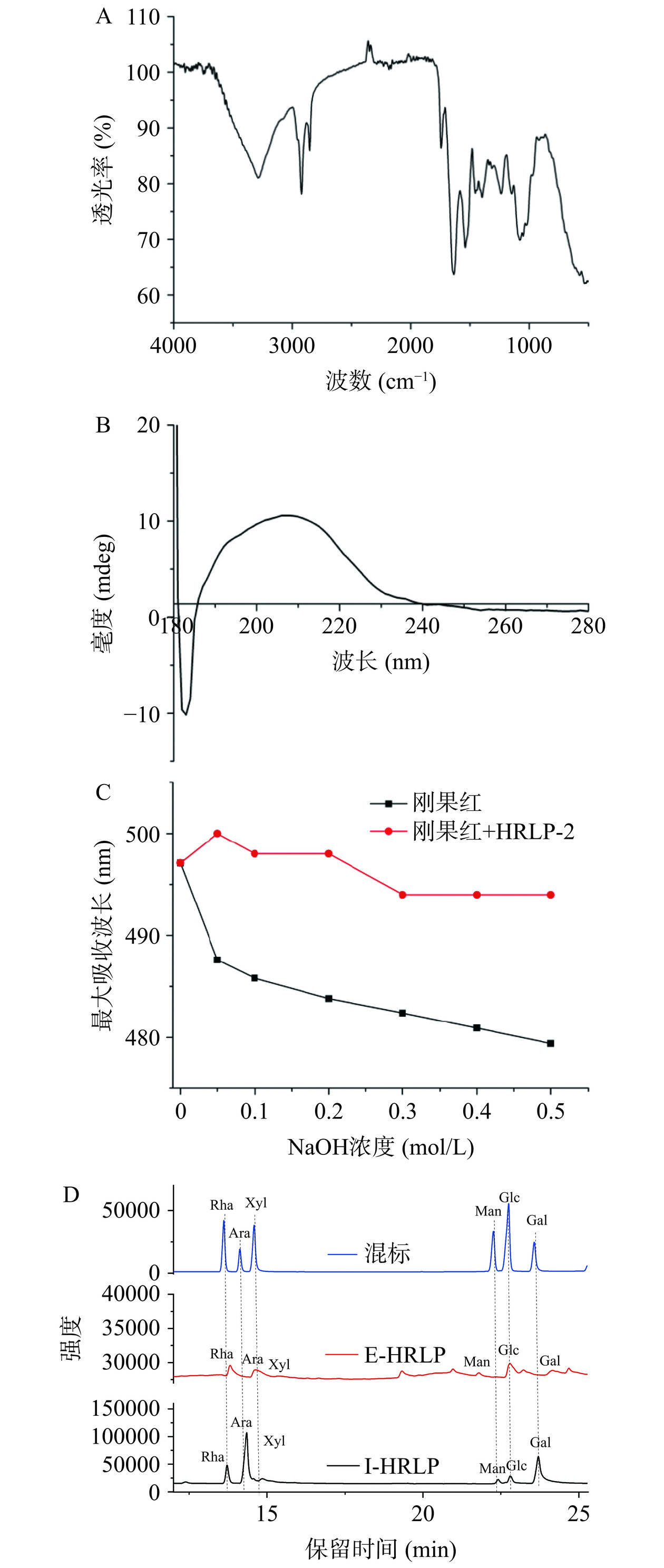
配制浓度为1 mg/mL的HRLP-2水溶液,通过紫外分光光度计进行其在200~400 nm范围内的全波长扫描。取少许HRLP-2,加入适量溴化钾进行压片,通过红外吸收光谱仪测定4000~500 cm−1范围内的红外谱图。
1.2.4.4 圆二色谱
配制浓度为2 mg/mL的HRLP-2的PBS(磷酸缓冲溶液,pH5.4,0.2 mmol/L)溶液,离心,取上清,通过圆二色谱仪测定样品溶液在180~260 nm范围内的吸收情况。
1.2.4.5 刚果红试验
配制浓度为2 mg/mL的HRLP-2水溶液,准确量取6份1 mL的溶液于离心管中,加入1 mL刚果红试剂(0.2 mmol/L)和不同体积的NaOH溶液(1 mol/L),使溶液中NaOH的最终浓度分别为0.5、0.4、0.3、0.2、0.1、0.05 mol/L,室温反应5 min。用紫外分光光度计测定反应液在400~700 nm范围内的最大吸收波长(λmax)。以NaOH浓度为横坐标,λmax为纵坐标绘制HRLP-2刚果红络合物的λmax随着NaOH浓度变化的曲线[21]。
1.2.4.6 部分酸水解
20 mg HRLP-2溶解在4 mL三氟乙酸(0.2 mol/L)中,于110 ℃水解2 h。待水解完毕,加入3~4 mL甲醇将溶液旋干,重复三次。加水复溶,透析24 h(截留量3500 Da),分别收集透析袋内外溶液,浓缩,冻干,按照1.2.4.1单糖衍生化方法进行衍生化,供气相色谱检测[22]。
1.2.4.7 高碘酸氧化及Smith降解
配制浓度为30 mmol/L的高碘酸钠溶液(现配现用),取100 μL定容至25 mL,测定其在223 nm处的吸光度,吸光度大于0.6即可使用。准确量取0.5、1、1.5、2、4 mL的高碘酸钠标准溶液于离心管中并加水至4 mL,分别取100 μL定容至25 mL,测定223 nm处的吸光度,以高碘酸钠浓度为横坐标,溶液吸光度为纵坐标绘制标准曲线(Y=7.6269X−0.0091,R2=0.9994)。25 mg HRLP-2溶解在12.5 mL 30 mmol/L的高碘酸钠标准溶液中,用蒸馏水定容至25 mL的棕色容量瓶中。每隔6或12 h取100 μL溶液定容至25 mL测定吸光度,至达到平衡,按照高碘酸钠标准曲线测定高碘酸的消耗量。待吸光度稳定,加2 mL乙二醇终止反应。取2 mL上述溶液,加100 μL溴酚甲紫,用已标定浓度的NaOH溶液(0.00495 mol/L)进行滴定,计算甲酸生成量。将高碘酸氧化产物透析24 h(截留量3500 Da),取出后加入30 mg硼氢化钠室温反应12 h,待反应结束将pH调至5.5,透析48 h(3500 Da),冻干,衍生化后供气相色谱检测[23]。
1.2.5 动物实验
1.2.5.1 动物分组及样品采集
将60只健康昆明雄性小鼠随机分为6组,每组10只,分别为空白组、模型组、VC阳性对照组、沙棘多糖低剂量组(100 mg/kg·BW)、沙棘多糖中剂量组(200 mg/kg·BW)以及沙棘多糖高剂量组(400 mg/kg·BW)(本实验建模参考文献[24])。适应性喂养5 d后,空白组每天腹腔注射生理盐水(0.1 mL/10 g),给药组和模型组每天腹腔注射D-半乳糖(1000 mg/kg·BW)。空白组和模型组小鼠每天灌胃生理盐水(0.1 mL/10 g),阳性对照组每天灌胃VC(100 mg/kg·BW),沙棘多糖低、中、高剂量组每天灌胃沙棘多糖溶液,连续30 d,每3~5 d称一次体重。末次给药,禁食不禁水16 h,利用摘眼球采血法收集血清,室温静置3 h,5000 r/min离心20 min分离血清,−80 ℃保存备用。
1.2.5.2 脏器指数的测定
30 d后,对小鼠称重记为终末体重,收集完血清处死解剖。摘除肝、肾、心、脑、脾,并用生理盐水冲洗,吸干水分后称重,按下式(1)计算各脏器指数。
脏器指数(%)=脏器质量小鼠体重×100 (1) 1.2.5.3 沙棘多糖对血清抗氧化指标的影响
取小鼠血清,按ELISA试剂盒操作说明书测定小鼠血清中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)活力及丙二醛(MDA)含量。
1.2.5.4 组织病理切片
处死小鼠后,取部分肝脏和肾脏,用甲醛进行固定。经过乙醇梯度脱水、二甲苯透明、石蜡包埋、切片机切片等步骤后,使用常规的苏木精-伊红(HE)染色进行处理。最终,将切片放在中性树脂中封存,并在显微镜下观察并拍照记录。观察沙棘叶粗多糖对小鼠肝脏和肾脏组织形态的影响。
1.2.5.5 沙棘多糖对小鼠肠道菌群的影响
肠粪便放于−20 ℃冰箱中待后续检测肠道微生物及短链脂肪酸(SCFAs)。将准备好的空白组(Control)、低、中、高药物组和阳性对照的样品进行DNA提取,根据保守区设计得到引物,在引物末端加上测序接头,进行PCR扩增并对其产物进行纯化、定量和均一化形成测序文库,建好的文库先进行文库质检,质检合格的文库用Illumina NovaSeq 6000进行测序,由北京百迈客生物科技有限公司进行肠道微生物及SCFAs相关指标的检测。
1.3 数据处理
通过Origin 2021对数据进行绘图和处理。每次试验设置三组平行实验,数据以平均值±标准偏差表示。采用One-Way ANOVA进行显著性分析,显著性水平(P)设为0.05,P<0.05为显著,P<0.01为极显著。
2. 结果与分析
2.1 沙棘多糖的分离纯化及组成分析
沙棘叶多糖经分离纯化后得到了一种中性多糖和一种酸性多糖(图1A),命名为HRLP-1和HRLP-2,按产率选择HRLP-2对其进行结构初探。经HPGPC法检测得出一个对称吸收峰(图1B),说明HRFL-2为均一多糖,其由摩尔比为10.26:49.37:3.09:2.24:4.50:30.53的Rha、Ara、Xyl、Man、Glc及Gal组成。
Liu等[25]报道经水提醇沉(料液比1:60 g/mL、提取时间4 h、温度90 ℃)及DEAE纤维素阴离子交换柱层析法从沙棘叶粗多糖中分离得到了6种组分,主要由Man、Rha、Gal、Ara及Glc组成,含有少量的Xyl、氨基葡萄糖、核糖、葡萄糖醛酸、半乳糖醛酸及岩藻糖等组成,其中主要组成为Glc、Gal及Ara。与本文相比,HRLP-2的主要单糖为Ara、Gal及Rha。虽然经不同方法制备的沙棘多糖的主要单糖种类一致,但各单糖摩尔比差距较大,其可能是因不同的提取分离条件引起的。魏晨业等[26]通过超声辅助提取法及DEAE-52阴离子交换柱层析法对沙棘果实多糖进行分离纯化得到了三种均一多糖;经GC-MS分析得出三种纯化后的沙棘多糖组分由不同摩尔比的Ara、Xyl、Man、Glc及Gal组成,由于单糖组成的不同三者显出不同强弱的抗氧化活性。田晓艳等[27]通过醇沉及DEAE-Sephadex A-50柱层析法对沙棘果实多糖进行分离纯化得到了一种均一多糖组分,其由摩尔比为1:1.06:1.13的Xyl、Man及Glc组成。结果表明沙棘植物的不同部位之间单糖组成差距较大,可知同种药材不同部位及提取分离方法等均对多糖结构有较大的影响。同时,单糖组成直接影响多糖的结构,从而导致显出不同的生物活性。研究报道显示单糖种类与多糖的抗氧化活性紧密相关[28−29],Tang等[30]发现多糖的抗氧化活性与Ara、Glc及Xyl的相关,沙棘果实多糖叶得到了同样的结果。
2.2 沙棘多糖的结构表征
2.2.1 紫外及红外吸收光谱结果
经紫外全波长扫描可知,HRLP-2在280、220 nm处无吸收峰,表明不含蛋白质及肽或含量较低。HRLP-2在4500~500 cm−1范围内显出典型的红外吸收峰(图2A)。其中,3280 cm−1附近的峰因羟基O-H伸缩振动而引起,2900 cm−1附近的吸收峰为-CH3的C-H伸缩振动峰[31]。1745 cm−1处的吸收峰为C=O伸缩振动峰,表明HRLP-2糖醛酸的存在[32],1630 cm−1附近的吸收峰为糖类水合振动峰,1200~1000 cm−1范围内的3个弱吸收峰表明HRLP-2是吡喃多糖,830及920 cm−1处的吸收峰表明HRLP-2中均存在α及β型糖苷键[33−34]。
2.2.2 圆二色谱结果
圆二色谱(CD)可用于检测具有光学活性基团的生物大分子的二级结构[35]。一般,糖类物质对紫外光没有吸收特性,在CD谱谱图上没有明显的Cotton效应。然而,多糖在远紫外光区,尤其是190 nm附近有较强的吸收峰,同时由于多糖在水溶液中分子间的相互作用而呈现折叠、翻转、缠绕和无规则形态,因此也会产生不对称性,从而导致Cotton效应[36]。HRLP-2的CD图如图2B所示,其在206及182 nm附近各有一个强度较大的正负Cotton效应,说明其具有光学活性。
2.2.3 刚果红试验结果
在不同NaOH浓度下,HRLP-2刚果红络合物的λmax变化如下图2C所示。分子结构中含有三螺旋结构的多糖在碱性条件下与刚果红试剂反应形成络合物,且该络合物的λmax会发生红移[37]。如图所示,与刚果红相比,HRLP-2的λmax均往长波方向移动,出现了红移,且随着氢氧化钠浓度的升高,λmax逐渐降低,表明其含有三螺旋结构,并随着氢氧化钠浓度的升高三螺旋结构被破坏。研究表明,具有三螺旋结构的多糖具有较为显著的生物活性[38],沙棘叶多糖的三螺旋结构可能说明其具有潜在的生物活性。
2.2.4 部分酸水解结果
通过部分酸水解可初步判断糖链中位于支链、末端及主链的单糖种类。HRLP-2的透析袋内部分别进行单糖组成分析,结果如图2D所示,HRLP-2的透析袋内部(I-HRLP-2)由摩尔比为16.02:42.67:1.37:3.07:4.31:32.56的Rha、Ara、Xyl、Man、Glc及Gal组成,主要是Ara及Gal。透析袋外部(E-HRLP-2)由摩尔比为27.95:33.11:33.59:5.35的Rha、Ara、Glc及Gal组成,主要组成单糖为Rha、Ara及Glc,且袋外部分未发现Xyl及Man。通过以上的结论可初步推出HRLP-2的主链主要由Gal及Ara组成,末端或支链主要由Rha、Ara及Glc组成。
2.2.5 高碘酸氧化及Smith降解结果
当HRLP-2与高碘酸反应60 h后吸光度基本稳定(OD223=0.360),进一步使用已标定好的NaOH溶液进行滴定,得到HRLP-2被高碘酸氧化过程中所消耗的高碘酸量与甲酸的生成量0.075 mmol与0.021 mmol。甲酸的生成表明HRLP-2中存在1→或1→6等既能消耗高碘酸又能生成甲酸的糖苷键。同时,HRLP-2中高碘酸的消耗量与甲酸的生成量比例远远大于2,说明可能含有1→2、1→2,6、1→4、1→4,6等大量消耗高碘酸而不生成甲酸的糖苷键。HRLP-2的Smith降解产物单糖组成结果显示其中含有甘油、赤藓醇、Ara、Gal等,甘油及赤藓醇的生成说明HRLP-2中可能含有1→、1→6、1→2、1→2,6、1→4、1→4,6等糖苷键;Ara及Gal等中性糖的存在表明HRLP-2中有一部分糖残基可能以不被高碘酸氧化的糖苷键形式存在的,如1→3、1→3,6等[39]。
2.3 沙棘叶多糖的抗氧化活性
2.3.1 HRLP对小鼠体重变化的影响
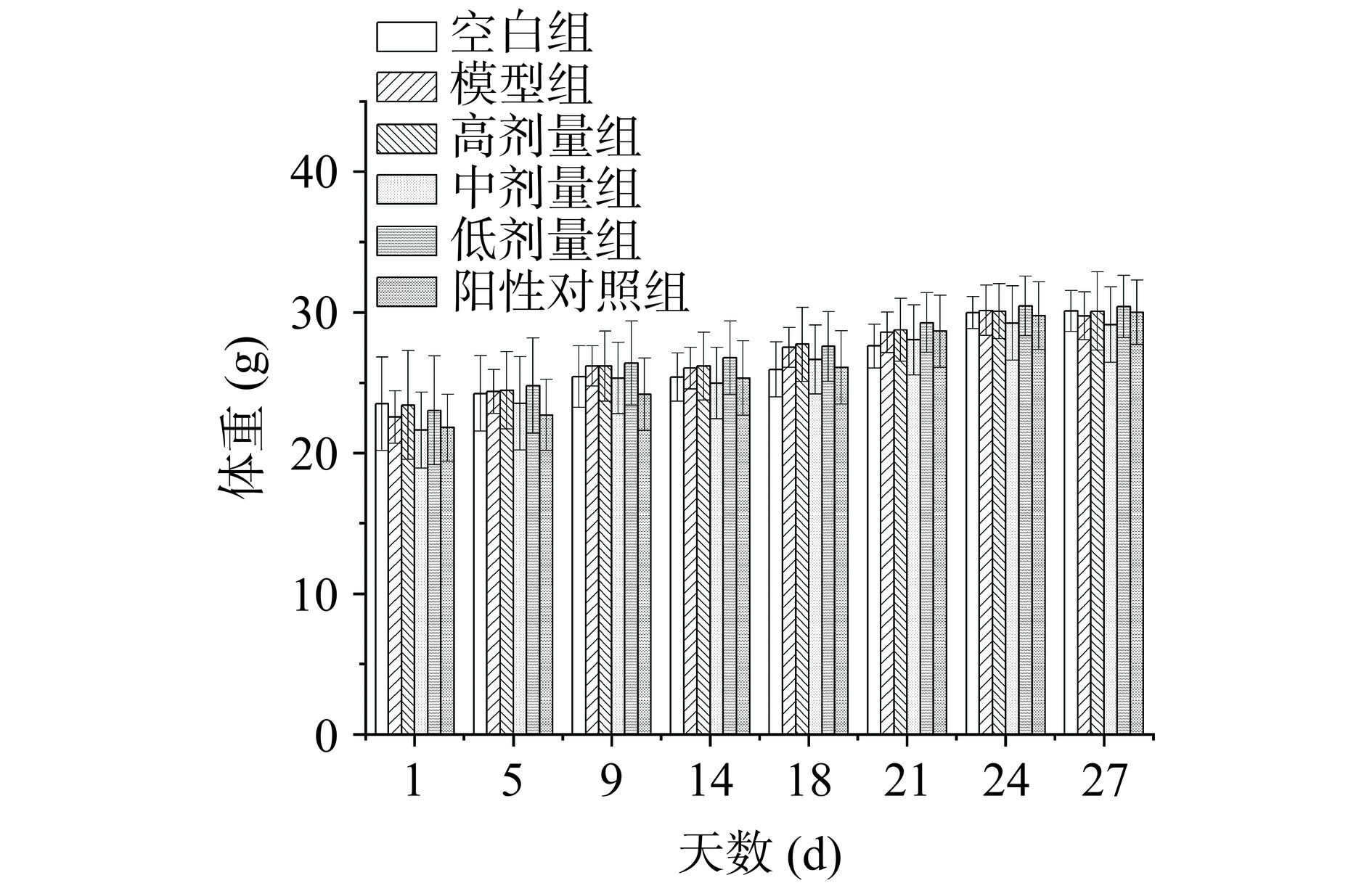
体重能够在一定程度上反映出生物体的健康状况,样品饲喂期间各组小鼠的体重变化如图3所示。经测定小鼠体重,发现其体重持续增加,各组试验小鼠体重的变化保持接近状态,无显著性差异(P>0.05)。结果表明HRLP能够有效改善D-半乳糖诱导的氧化损伤小鼠体重下降的情况。
2.3.2 HRLP对小鼠脏器指数的影响
脏器指数可用以评估动物的功能状态,反映实验动物的环境适应度、生理状况和生长发育阶段等,为实验动物重要的生物学特性。各组小鼠给药后对脏器指数的影响如表1所示。与空白组相比,模型组小鼠的各脏器指数均下降,说明D-半乳糖导致小鼠肝、肾、心、脾和脑等脏器的萎缩,造模成功。给药处理后,阳性对照组及高、中剂量HRLP组小鼠各脏器指数均有不同程度的上升,尤其是对脾脏及脑的影响较为显著(P<0.05)。结果表明HRLP能够改善D-半乳糖诱导的氧化损伤小鼠器官损伤的情况。
表 1 HRLP对小鼠脏器指数的影响Table 1. Effects of HRLP on mice organ index组别 肾脏 脾脏 心脏 脑 肝脏 空白组 1.60±0.23a 0.15±0.02b 0.49±0.04a 1.49±0.16a 4.39±0.45a 模型组 1.49±0.16a 0.14±0.02b 0.47±0.02a 1.23±0.20b 3.86±0.17a 高剂量组 1.59±0.09a 0.22±0.04a 0.52±0.11a 1.31±0.16a 3.98±0.28a 中剂量组 1.57±0.13a 0.22±0.04a 0.56±0.10a 1.37±0.22a 3.87±0.26a 低剂量组 1.42±0.06b 0.21±0.05a 0.52±0.09a 1.21±0.19b 3.78±0.18a 阳性对照组 1.53±0.11a 0.24±0.03a 0.58±0.08a 1.27±0.08ab 3.93±0.29a 注:同一列不同字母表示有显著差异(P<0.05)。 2.3.3 HRLP对血清抗氧化指标的影响
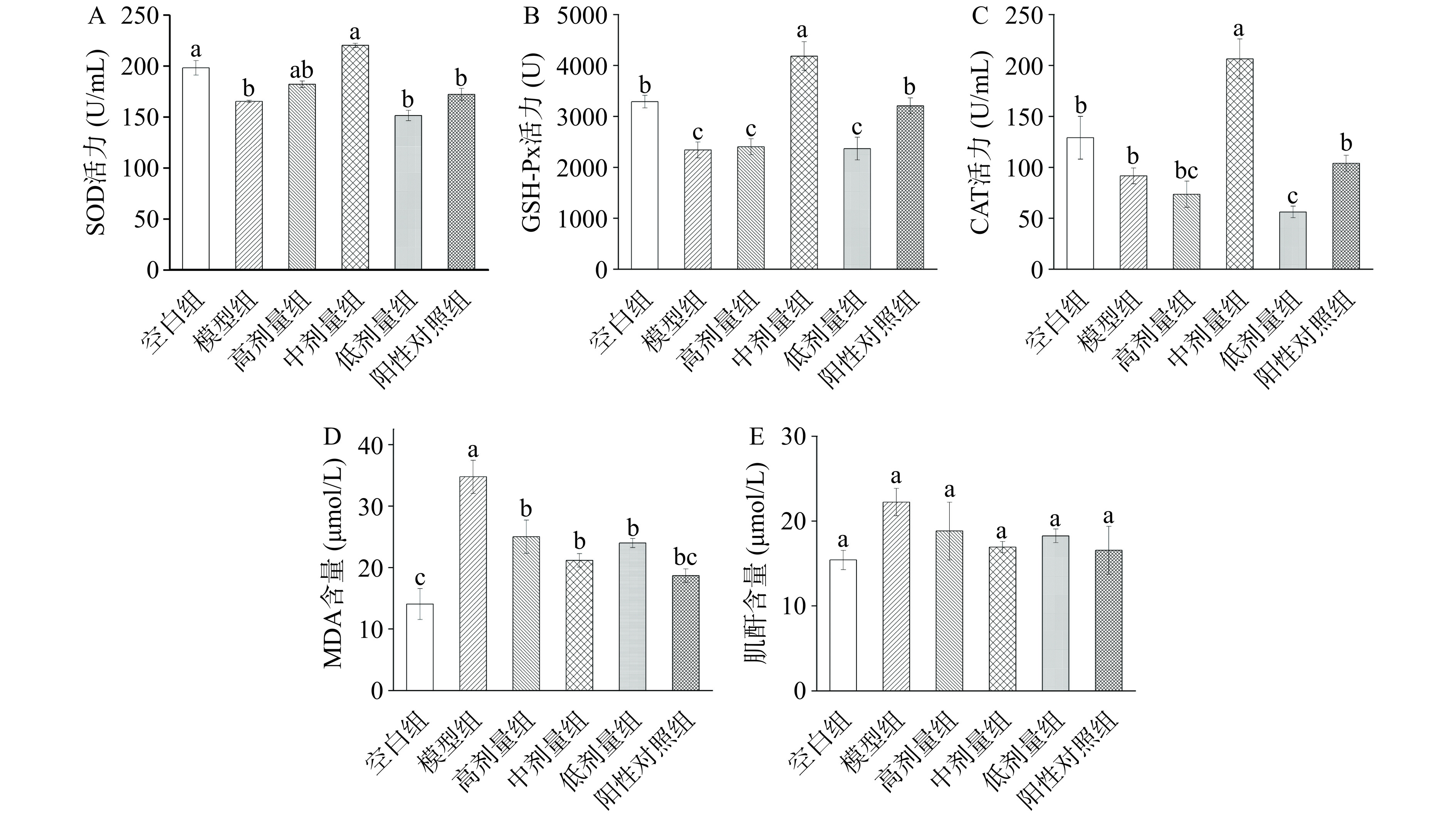
HRLP对D-半乳糖诱导的氧化损伤小鼠的影响如图4所示。与空白组相比,模型组小鼠血清中SOD、GSH-Px活力及CAT含量均显著降低(P<0.05),MDA含量显著上升(P<0.05),说明氧化损伤模型建模成功。经给药处理后阳性对照组及中剂量的HRLP组均能升高小鼠血清中SOD、GSH-Px活力和CAT含量,降低MDA含量。本实验结果表明,HRLP作用于D-半乳糖诱导的氧化损伤小鼠模型动物后,小鼠血清中SOD、GSH-Px、CAT及MDA水平的变化说明HRLP通过改善酶活性增强细胞稳定性,表现出对衰老动物的抗氧化作用。包晓玮等[40]研究报道显示沙棘果实多糖能够改善D-半乳糖致衰老小鼠血清中SOD、GSH-Px及MDA含量,从而显出较好的抗氧化作用。本实验结果同样表明作为沙棘植物副产物的沙棘叶多糖也表现出较好的抗氧化活性,为沙棘资源的充分利用和科学应用提供技术支撑。
![]() 图 4 HRLP对血清抗氧化指标的影响注:A:SOD活力;B:GSH-Px活力;C:CAT活力;D:MDA含量;E:肌酐含量;不同字母表示有显著差异(P<0.05),图8同。Figure 4. Effects of HRLP on the serum antioxidant indicators
图 4 HRLP对血清抗氧化指标的影响注:A:SOD活力;B:GSH-Px活力;C:CAT活力;D:MDA含量;E:肌酐含量;不同字母表示有显著差异(P<0.05),图8同。Figure 4. Effects of HRLP on the serum antioxidant indicators2.3.4 HRLP对小鼠肾脏功能的影响
肌酐(Cr)是肌肉代谢产物,主要通过肾脏排泄,当肾功能不全或功能异常时Cr含量将升高。因此,可通过血清Cr值反映肾脏的功能状态。HRLP对小鼠血清肾脏功能的影响如图4E所示。建模后,与空白组小鼠血清Cr含量相比,模型组小鼠血清Cr含量小幅度上升,说明D-半乳糖诱导后小鼠的肾脏功能受到一定的影响。经给药处理后,虽然并未达到空白组血清中Cr含量,但阳性对照组及不同剂量的HRLP组均能不同程度地降低小鼠血清Cr含量,相互之间无统计学意义(P>0.05)。
2.3.5 HRLP对小鼠小鼠肝、肾脏组织形态的影响
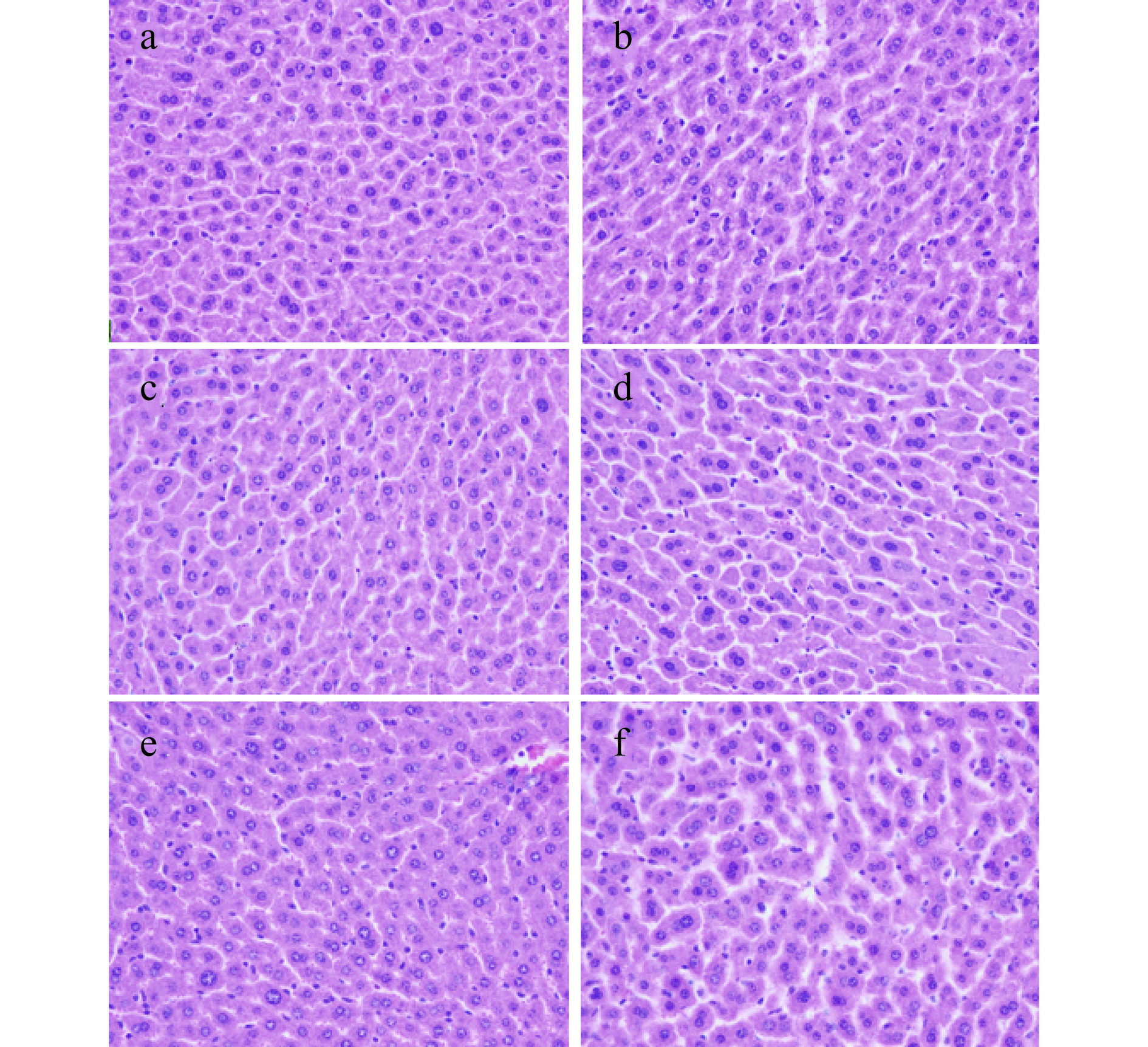
小鼠肝脏组织HE染色结果如图5所示,空白组小鼠(图5a)肝细胞核大而圆,并位于细胞中央,肝细胞形态完整,中央静脉无明显异常,肝索有规律的整齐排列,肝血窦无扩张[41];模型组小鼠(图5b)肝细胞形态出现异常,肝细胞变大,胞核增大,染色增强,且出现明显的双核肝细胞,肝细胞之间连接松散,肝血窦扩张明显;而经过VC处理的小鼠(图5c)和高剂量组小鼠(图5d)肝索排列整齐紧密,少量肝细胞可见双核,肝血窦扩张明显缩小;中剂量组小鼠(图5e)和低剂量组小鼠(图5f)对比模型组小鼠肝细胞肿胀也有轻微缓解,胞核染色恢复正常,核结构较清晰。结果表明,沙棘叶粗多糖能够缓D-半乳糖诱导的衰老模型小鼠的肝脏组织病变现象[42]。
![]() 图 5 D-半乳糖损伤小鼠肝脏的HE染色图(400×)注:a:空白组;b:模型组;c:阳性对照组;d:高剂量组;e:中剂量组;f:低剂量组,图6同。Figure 5. HE staining of liver in D-galactose damaged mice (400×)
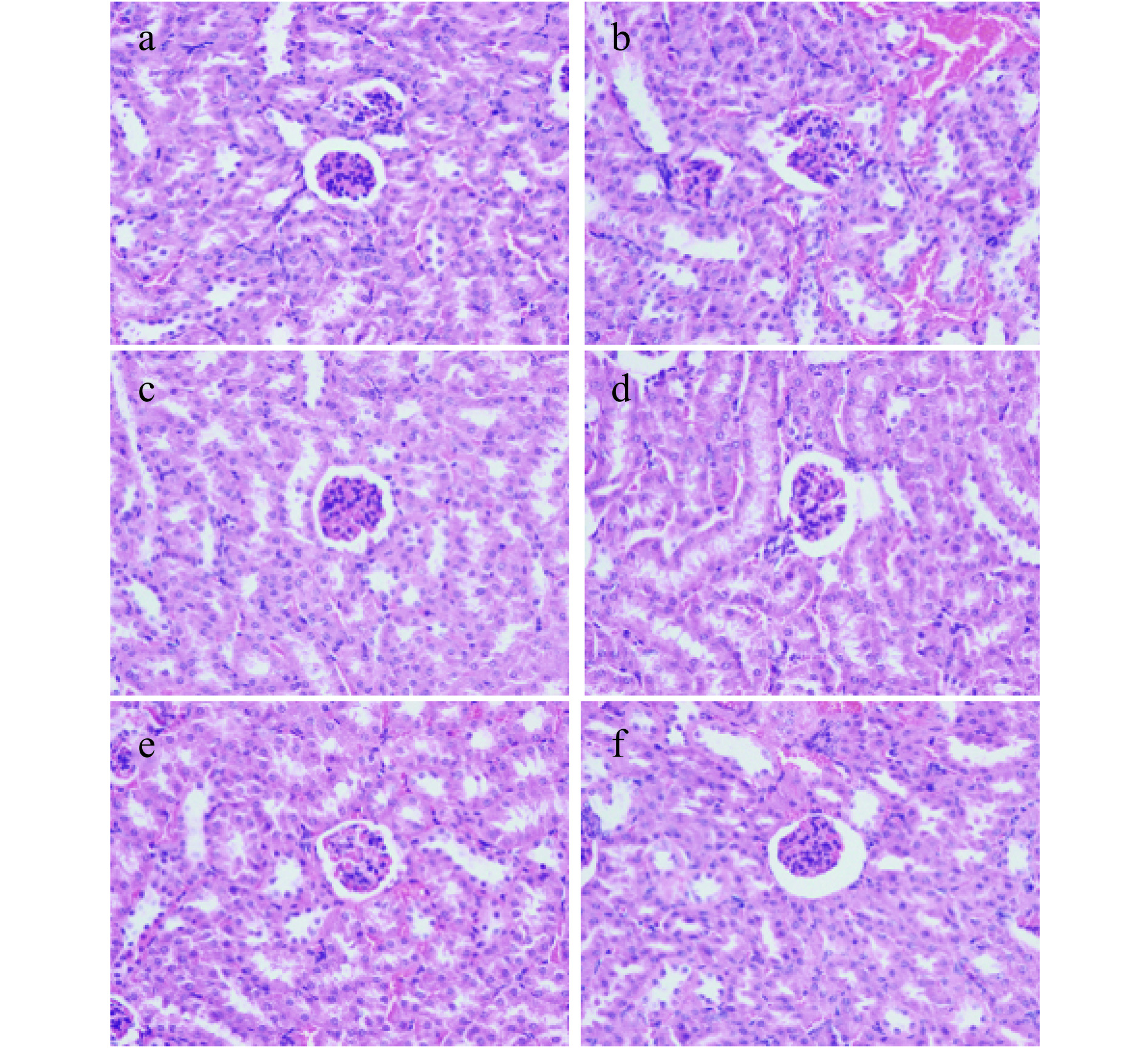
图 5 D-半乳糖损伤小鼠肝脏的HE染色图(400×)注:a:空白组;b:模型组;c:阳性对照组;d:高剂量组;e:中剂量组;f:低剂量组,图6同。Figure 5. HE staining of liver in D-galactose damaged mice (400×)小鼠肾脏组织HE染色结果如图6所示,空白组小鼠(图6a)肾小球大小、形态正常,肾小管未见异常,球囊间隙适中,未发现炎细胞浸润;模型组小鼠(图6b)部分肾小球肿胀,部分肾小球缩小,但球囊间隙都基本消失,管腔狭窄,核密度增高,结构不清晰,出现明显病变现象;而经过VC处理的小鼠(图6c)和高剂量组小鼠(图6d)肾小管上皮细胞未见明显肿胀,管腔正常,肾小球大小、形态未见异常,病变现象明显改善;中剂量组小鼠(图6e)和低剂量组小鼠(图6f)对比模型组小鼠管腔缩小明显,肾小管肿胀程度缓解,病变现象得到改善[43]。结果表明,沙棘叶粗多糖能够缓D-半乳糖诱导的衰老模型小鼠的肾脏组织病变现象。
2.3.6 HRLP对小鼠肠道菌群多样性及丰富度的影响
2.3.6.1 ASV/OUT花瓣图分析
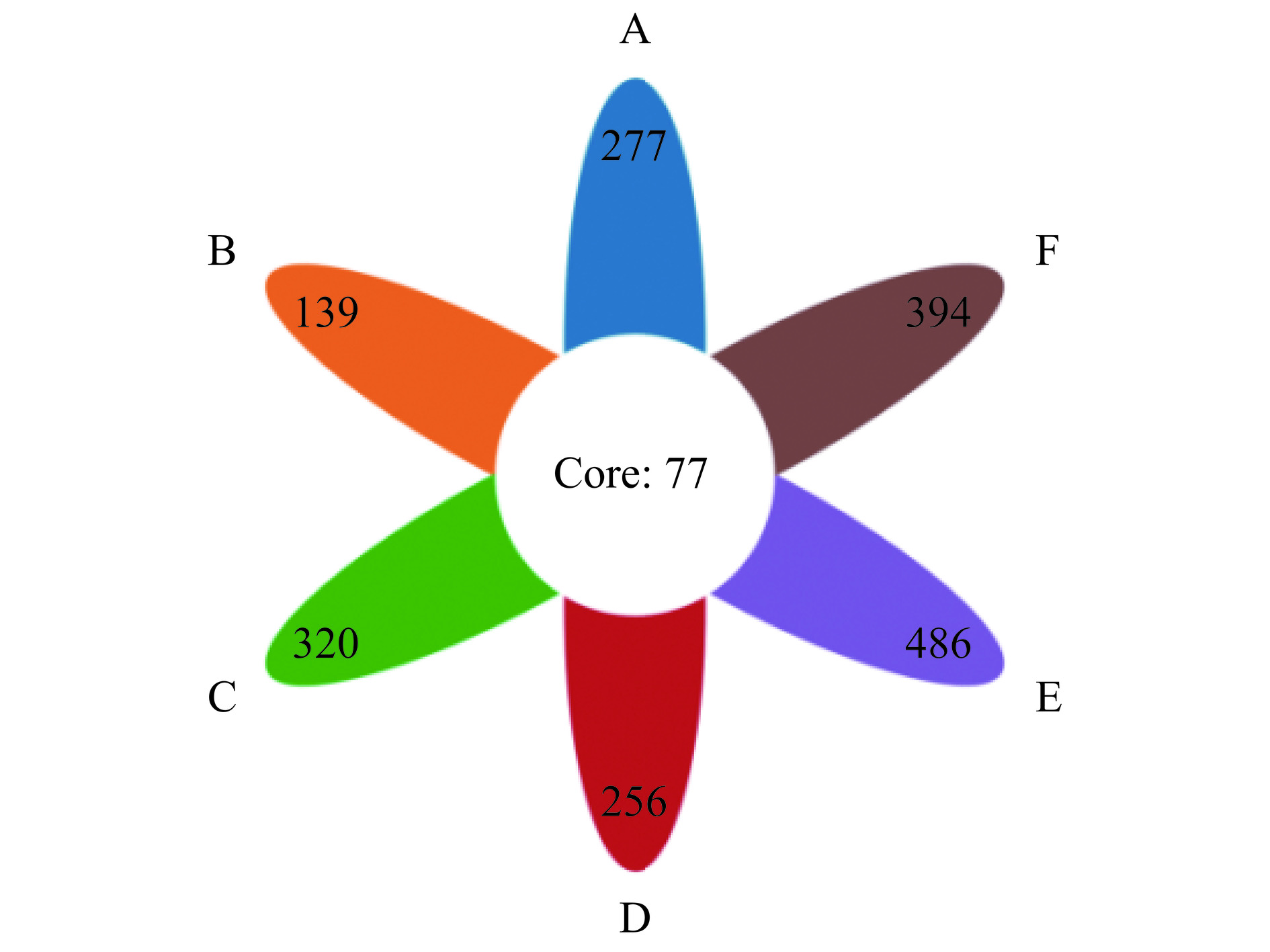
花瓣图中的每一个椭圆代表一组的样本,中间重叠区域为所有组共有的ASV/OUT。如图7所示,空白组、模型组、高、中、低剂量组及阳性对照组的ASV/OUT数目分别为277、139、256、486、394及320,所有组共有的ASV/OUT数目为77。与空白组相比,模型组的ASV/OUT的数量下降,表明D-半乳糖诱导造成了小鼠机体内肠道菌群发生了显著的变化;经HRLP及阳性对照干预后使各组ASV/OUT数目均上升,其中,中剂量组的ASV/OUT数目最高,说明该组中肠道菌群丰富度最高。
2.3.6.2 HRLP对小鼠肠道菌群α-多样性分析
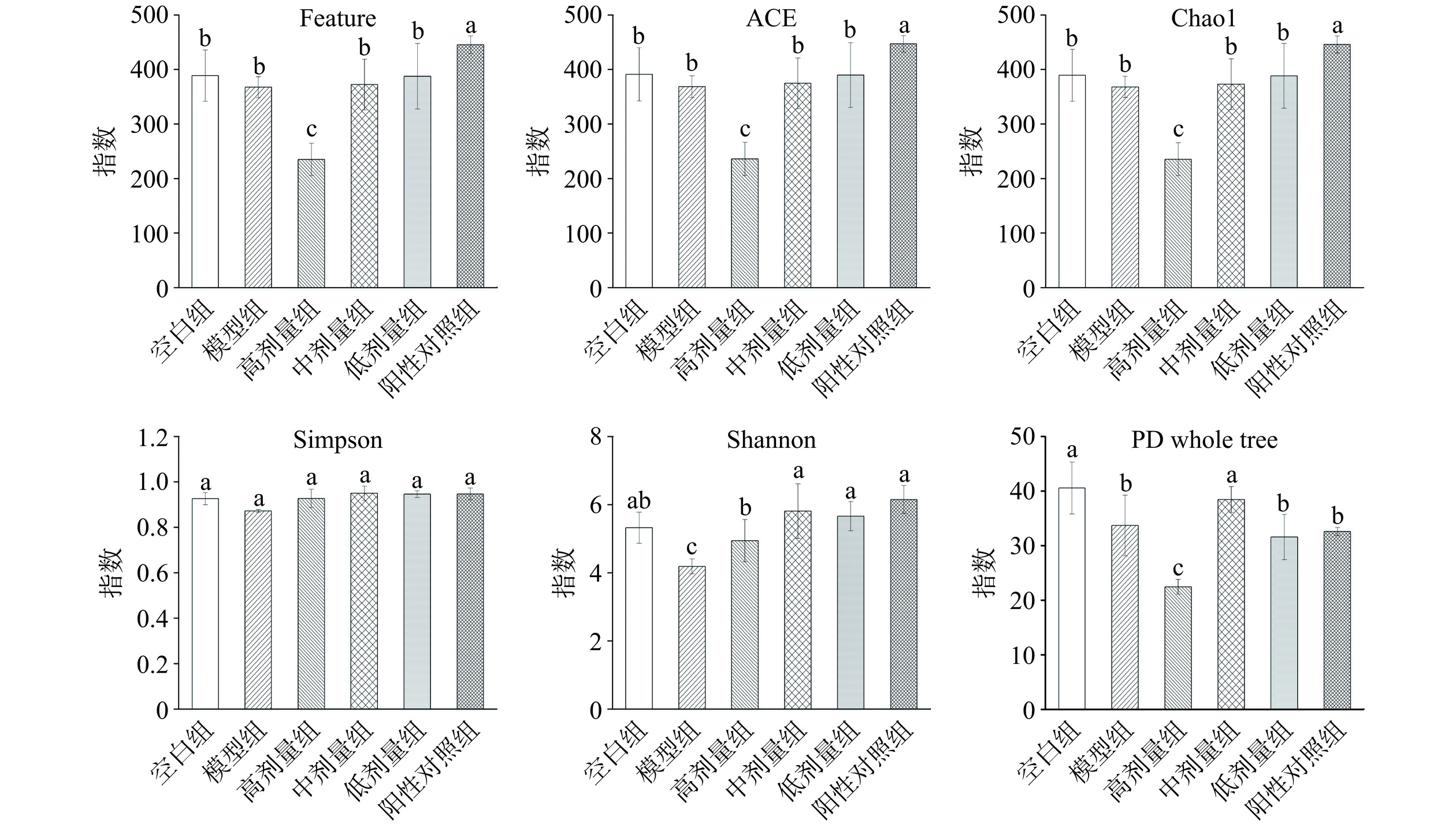
α-多样性反映的是单个样品物种丰富度及物种多样性,有多种衡量指标:Chao1、ACE、Shannon、Simpson、Coverage、PD whole tree等。Chao1和ACE指数衡量物种丰富度即物种数量的多少。Shannon和Simpson指数用于衡量物种多样性,受样品群落中物种丰富度和物种均匀度的影响。如图8所示,与空白组相比,模型组的物种丰富度(Chao1和ACE)及物种多样性(Simpson)均降低,但无统计学意义(P>0.05),而物种多样性(Shannon)呈显著下降趋势(P<0.05),表明D-半乳糖的诱导降低了小鼠肠道微生物群落的α-多样性。经HRLP及阳性对照干预后,均发生不同程度的变化。其中,中剂量组小鼠的丰富度及多样性均高于模型组;然而,高剂量组小鼠的Chao1和ACE显著低于模型组,Shannon指数显著高于模型组(P<0.05)。同时,统计了覆盖率(Coverage),均为0.9999,其数值越高,则样本中物种被测出的概率越高,而没有被测出的概率越低,该指数反映本次测序结果是否代表了样本中微生物的真实情况。以上结果说明不同剂量组的HRLP对小鼠肠道菌群的丰富度及多样性有不同的影响,中剂量组的HRLP可提高小鼠肠道菌群丰富度(P>0.05)及多样性(P<0.05)。
2.3.7 HRLP对小鼠粪便中SCFAs的影响
SCFAs是肠道微生物的主要产物,对维持肠道健康至关重要。HRLP对D-半乳糖诱导的氧化损伤小鼠粪便中SCFAs的影响结果如表2所示。各组小鼠粪便中乙酸、丁酸及丙酸的含量较高,且显著高于异丁酸、异戊酸和戊酸(P<0.05)。研究表明乙酸能够通过激活G蛋白偶联受体调节肠道菌群环境,并能够作为周围组织的能量来源[44],丁酸与结肠细胞的抗炎和抗肿瘤作用相关[45]。如表2所示,与空白组相比,模型组的乙酸、丙酸、丁酸、异戊酸及戊酸含量显著降低(P<0.05)。经阳性对照及不同剂量组HRLP给药处理后,中剂量组小鼠粪便中各SCFAs均有不同程度的上升,都高于模型组。实验结果表明HRLP能够促进短链脂肪酸的合成。
表 2 HRLP对SCFAs的影响Table 2. Effect of HRLP on SCFAs种类 空白组 模型组 高剂量组 中剂量组 低剂量组 阳性对照组 乙酸 1327.46±40.56a 610.36±140.72bc 733.64±39.22b 1230.13±79.15a 839.99±15.97b 744.19±108.68b 丙酸 381.77±38.86a 331.14±38.50a 249.98±54.06a 437.08±25.22a 363.45±145.27a 288.64±141.94a 异丁酸 66.81±11.46a 46.23±6.44a 25.74±3.27a 81.13±9.99a 61.28±33.61a 46.75±17.29a 丁酸 740.37±103.05a 213.39±93.11b 412.47±91.30a 836.41±0.65a 632.98±95.34a 232.97±145.50b 异戊酸 69.34±9.27a 38.21±7.98b 35.92±12.06b 93.91±5.03a 38.39±21.03b 54.67±21.58c 戊酸 95.76±6.34a 49.45±17.33b 54.18±5.71b 136.99±13.79a 45.35±19.89b 40.57±14.05b 注:同一行内不同字母表示有显著差异(P<0.05)。 3. 结论
本文通过HPLC、GC、UV、FT-IR、CD等现代仪器分析方法结合刚果红染色法、部分酸水解、高碘酸氧化及Smith降解等经典化学方法对沙棘叶均一多糖HRLP-2进行了结构鉴定,并从氧化应激及肠道微生物角度探讨了沙棘叶多糖对D-半乳糖诱导的氧化损伤小鼠的改善作用。HRLP-2是一种主要由Ara、Gal及Rha组成的杂多糖,其主链主要由Gal及Ara组成,末端或支链主要由Rha、Ara及Glc组成。HRLP能够明显升高小鼠血清中SOD、GSH-Px及CAT活力,显著降低MDA含量(P<0.05),在一定剂量范围内能够有效缓解脏器组织的病理症状。同时,能够提高小鼠肠道菌群物种数,促进机体短链脂肪酸合成。由于多糖结构的复杂性,其显出多种生物活性。目前,有关于沙棘多糖的研究报道较少,构效关系研究尚处于初始阶段,本文将为沙棘叶多糖的构效关系研究提供一定的物质基础参考。进一步研究中将制备沙棘叶多糖活性片段,结合多糖活性结构片段与空间结构进而为全面阐明多糖的构效关系,同时能够为新药筛选提供更为全面参考依据。
-
图 4 HRLP对血清抗氧化指标的影响
注:A:SOD活力;B:GSH-Px活力;C:CAT活力;D:MDA含量;E:肌酐含量;不同字母表示有显著差异(P<0.05),图8同。
Figure 4. Effects of HRLP on the serum antioxidant indicators
图 5 D-半乳糖损伤小鼠肝脏的HE染色图(400×)
注:a:空白组;b:模型组;c:阳性对照组;d:高剂量组;e:中剂量组;f:低剂量组,图6同。
Figure 5. HE staining of liver in D-galactose damaged mice (400×)
表 1 HRLP对小鼠脏器指数的影响
Table 1 Effects of HRLP on mice organ index
组别 肾脏 脾脏 心脏 脑 肝脏 空白组 1.60±0.23a 0.15±0.02b 0.49±0.04a 1.49±0.16a 4.39±0.45a 模型组 1.49±0.16a 0.14±0.02b 0.47±0.02a 1.23±0.20b 3.86±0.17a 高剂量组 1.59±0.09a 0.22±0.04a 0.52±0.11a 1.31±0.16a 3.98±0.28a 中剂量组 1.57±0.13a 0.22±0.04a 0.56±0.10a 1.37±0.22a 3.87±0.26a 低剂量组 1.42±0.06b 0.21±0.05a 0.52±0.09a 1.21±0.19b 3.78±0.18a 阳性对照组 1.53±0.11a 0.24±0.03a 0.58±0.08a 1.27±0.08ab 3.93±0.29a 注:同一列不同字母表示有显著差异(P<0.05)。 表 2 HRLP对SCFAs的影响
Table 2 Effect of HRLP on SCFAs
种类 空白组 模型组 高剂量组 中剂量组 低剂量组 阳性对照组 乙酸 1327.46±40.56a 610.36±140.72bc 733.64±39.22b 1230.13±79.15a 839.99±15.97b 744.19±108.68b 丙酸 381.77±38.86a 331.14±38.50a 249.98±54.06a 437.08±25.22a 363.45±145.27a 288.64±141.94a 异丁酸 66.81±11.46a 46.23±6.44a 25.74±3.27a 81.13±9.99a 61.28±33.61a 46.75±17.29a 丁酸 740.37±103.05a 213.39±93.11b 412.47±91.30a 836.41±0.65a 632.98±95.34a 232.97±145.50b 异戊酸 69.34±9.27a 38.21±7.98b 35.92±12.06b 93.91±5.03a 38.39±21.03b 54.67±21.58c 戊酸 95.76±6.34a 49.45±17.33b 54.18±5.71b 136.99±13.79a 45.35±19.89b 40.57±14.05b 注:同一行内不同字母表示有显著差异(P<0.05)。 -
[1] 中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京:科学出版社, 1983:64. [Editorial Committee of Flora of China, Chinese Academy of Sciences. Flora of China[M]. Beijing:Science Press, 1983:64.] Editorial Committee of Flora of China, Chinese Academy of Sciences. Flora of China[M]. Beijing: Science Press, 1983: 64.
[2] 国家药典委员会. 中国药典[M]. 北京:中国医药科技出版社, 2020:191−192. [Chinese Pharmacopoeia Commission. Chinese pharmacopoeia[M]. Beijing:China Medical Technology Press, 2020:191−192.] Chinese Pharmacopoeia Commission. Chinese pharmacopoeia[M]. Beijing: China Medical Technology Press, 2020: 191−192.
[3] NI W H, GAO T T, WANG H L, et al. Anti-fatigue activity of polysaccharides from the fruits of four Tibetan plateau indigenous medicinal plants[J]. Journal of Ethnopharmacology,2013,150:529−535. doi: 10.1016/j.jep.2013.08.055
[4] ZHANG W, ZHANG X H, ZOU K, et al. Seabuckthorn berry polysaccharide protects against carbon tetrachloride-induced hepatotoxicity in mice via anti-oxidative and anti-inflammatory activities[J]. Food & Function,2017,8:3130−3138.
[5] REN R, LI N, SU C, et al. The bioactive components as well as the nutritional and health effects of sea buckthorn[J]. RSC Advances,2020,10:44654−44671. doi: 10.1039/D0RA06488B
[6] 李晓华, 宋绪磊. 沙棘黄酮类物质的提取及纯化工艺[J]. 食品工业,2021,42(5):67−70. [LI X H, SONG X L. Extraction and purification of flavonoids from Hippophae rhamnoides[J]. Food Industry,2021,42(5):67−70.] LI X H, SONG X L. Extraction and purification of flavonoids from Hippophae rhamnoides[J]. Food Industry, 2021, 42(5): 67−70.
[7] ZHAO L, GENG T T, SUN K C, et al. Proteomic analysis reveals the molecular mechanism of Hippophae rhamnoides polysaccharide intervention in LPS-induced inflammation of IPEC-J2 cells in piglets[J]. International Journal of Biological Macromolecules,2020,164:3294−3304. doi: 10.1016/j.ijbiomac.2020.08.235
[8] ZHAO L, LI M Y, SUN K C, et al. Hippophae rhamnoides polysaccharides protect IPEC-J2 cells from LPS-induced inflammation, apoptosis and barrier dysfunction in vitro via inhibiting TLR4/NF-κB signaling pathway[J]. International Journal of Biological Macromolecules,2020,155:1202−1215. doi: 10.1016/j.ijbiomac.2019.11.088
[9] 王蓉, 李胜男, 陈春, 等. 沙棘多糖对巨噬细胞和免疫抑制小鼠的免疫调节作用研究[J]. 中南药学,2020,18(3):384−388. [WANG R, LI S N, CHEN C, et al. Immunomodulatory effect of Hippophae rhamnoides polysaccharide on the macrophages and cyclophosphamide-induced immunocompromised mice[J]. Central South Pharmacy,2020,18(3):384−388.] doi: 10.7539/j.issn.1672-2981.2020.03.009 WANG R, LI S N, CHEN C, et al. Immunomodulatory effect of Hippophae rhamnoides polysaccharide on the macrophages and cyclophosphamide-induced immunocompromised mice[J]. Central South Pharmacy, 2020, 18(3): 384−388. doi: 10.7539/j.issn.1672-2981.2020.03.009
[10] WANG X, LIU J, ZHANG X, et al. Seabuckthorn berry polysaccharide extracts protect against acetaminophen induced hepatotoxicity in mice via activating the Nrf-2/HO-1-SOD-2 signaling pathway[J]. Phytomedicine,2018,38:90−97. doi: 10.1016/j.phymed.2017.11.007
[11] ROZI P, ABUDUWAILI A, MUTAILIFU P, et al. Sequential extraction, characterization and antioxidant activity of polysaccharides from Fritillaria pallidiflora Schrenk[J]. International Journal of Biological Macromolecules,2019,131:97−106. doi: 10.1016/j.ijbiomac.2019.03.029
[12] 李芳亮, 王锐, 高杨, 等. 沙棘叶水溶性多糖分级组分抗氧化活性的研究[J]. 黑龙江农业科学,2011(6):63−66. [LI F L, WANG R, GAO Y, et al. Study on the antioxidation activities of rating water soluble polysaccharides by alcohol from foliage of Hippophae Rhamnoides L doi: 10.3969/j.issn.1002-2767.2011.06.023 J]. Heilongjiang Agricultural Sciences,2011(6):63−66. doi: 10.3969/j.issn.1002-2767.2011.06.023
[13] WEI E, YANG R, ZHAO H, et al. Microwave-assisted extraction releases the antioxidant polysaccharides from seabuckthorn (Hippophae rhamnoides L.) berries[J]. International Journal of Biological Macromolecules,2019,123:280−290.
[14] ZOU Z, XI W P, HU Y, et al. Antioxidant activity of Citrus fruits[J]. Food Chemistry,2016,196:885−896. doi: 10.1016/j.foodchem.2015.09.072
[15] YUAN S W, WANG J H, LI X, et al. Study on the structure, antioxidant activity and degradation pattern of polysaccharides isolated from lotus seedpod[J]. Carbohydrate Polymers, 2023, 316: 121065.
[16] HUANG Y G, YE Y L, XU D P, et al. Structural characterization and anti-inflammatory activity of a novel neutral polysaccharide isolated from Smilax glabra Roxb[J]. International Journal of Biological Macromolecules,2023,234:123559. doi: 10.1016/j.ijbiomac.2023.123559
[17] SU S Y, DING X, HOU Y L, et al. Structure elucidation, immunomodulatory activity, antitumor activity and its molecular mechanism of a novel polysaccharide from Boletus reticulatus Schaeff[J]. Food Science and Human Wellness,2023,12:647−661. doi: 10.1016/j.fshw.2022.07.067
[18] XIA Q, ZHAO Q, ZHU H, et al. Physicochemical characteristics of Ganoderma lucidum oligosaccharide and its regulatory effect on intestinal flora in vitro fermentation[J]. Food Chemistry:X,2022,15:100421.
[19] 刘荣瑜, 王昊, 张子依, 等. 多糖与肠道菌群相互作用的研究进展[J]. 食品科学,2022,43(5):363−373. [LUI R Y, WANG H, ZHANG Z Y. et al. Research progress on the interaction between polysaccharides and intestinal microbiota[J]. Food Science,2022,43(5):363−373.] doi: 10.7506/spkx1002-6630-20201113-147 LUI R Y, WANG H, ZHANG Z Y. et al. Research progress on the interaction between polysaccharides and intestinal microbiota[J]. Food Science, 2022, 43(5): 363−373. doi: 10.7506/spkx1002-6630-20201113-147
[20] 阿衣吐逊·阿布都外力, 帕尔哈提·柔孜, 高彦华, 等. 伊贝母多糖的提取工艺优化及结构表征[J]. 中国药房,2020,31(3):276−281. [ADUWAILI A, ROZI P, GAO Y H. et al. Study on extraction technology optimization and structural characterization of Fritillaria pallidiflora polysaccharides[J]. China Pharmacy,2020,31(3):276−281.] doi: 10.6039/j.issn.1001-0408.2020.03.05 ADUWAILI A, ROZI P, GAO Y H. et al. Study on extraction technology optimization and structural characterization of Fritillaria pallidiflora polysaccharides[J]. China Pharmacy, 2020, 31(3): 276−281. doi: 10.6039/j.issn.1001-0408.2020.03.05
[21] ROZI P, ABUDUWAILI A, MA S J, et al. Isolations, characterizations and bioactivities of polysaccharides from the seeds of three species Glycyrrhiza[J]. International Journal of Biological Macromolecules,2020,145:364−371. doi: 10.1016/j.ijbiomac.2019.12.107
[22] ABUDUWAILI A, MUTAILIFU P, NUERXIATI R, et al. Structure and biological activity of polysaccharides from Nitraria sibirica pall fruit[J]. Food Bioscience,2021,40:100903. doi: 10.1016/j.fbio.2021.100903
[23] CHEN Z Y, ZHAO Y, ZHANG M K, et al. Structural characterization and antioxidant activity of a new polysaccharide from Bletilla striata fibrous roots[J]. Carbohydrate Polymers, 2020, 227.
[24] 李晓丽, 苏建青, 李莹, 等. 硒化刺五加多糖对D-半乳糖诱导小鼠氧化损伤的保护作用[J]. 食品工业科技,2024,45(16):368−375. [LI X L, SU J Q, LI Y. et al. Protective effect of selenated Acanthopanax senticosus polysaccharide against D-galactose-induced oxidative damage in mice[J]. Food Industry Technology,2024,45(16):368−375.] LI X L, SU J Q, LI Y. et al. Protective effect of selenated Acanthopanax senticosus polysaccharide against D-galactose-induced oxidative damage in mice[J]. Food Industry Technology, 2024, 45(16): 368−375.
[25] LIU Y, RAN L M, WANG Y H, et al. Basic characterization, antioxidant and immunomodulatory activities of polysaccharides from sea buckthorn leaves[J]. Fitoterapia, 2023, 169: 105592.
[26] 魏晨业, 包晓玮, 王娟, 等. 沙棘多糖分离纯化及抗氧化活性[J]. 食品科学,2021,42(4):227−232. [WEI C Y, BAO X W, WANG J, et al. Isolation, purification and antioxidant activity of polysaccharides from the fruit of Hippophae rhamnoides[J]. Food Science,2021,42(4):227−232.] doi: 10.7506/spkx1002-6630-20191015-133 WEI C Y, BAO X W, WANG J, et al. Isolation, purification and antioxidant activity of polysaccharides from the fruit of Hippophae rhamnoides[J]. Food Science, 2021, 42(4): 227−232. doi: 10.7506/spkx1002-6630-20191015-133
[27] 田晓艳, 刘延吉, 祝寰宇, 等. 沙棘多糖HRPⅠa纯化及鉴定[J]. 食品与生物技术学报,2010,29(1):23−26. [TIAN X Y, LIU Y J, ZHU H Y, et al. Purification, identification of polysaccharide HRPIa of Hippophae rhamnoides L J]. Journal of Food and Biotechnology,2010,29(1):23−26.
[28] MUTAILIFU P, NUERXIATI R, LU C F, et al. Extraction, purification, and characterization of polysaccharides from Alhagi pseudoalhagi with antioxidant and hypoglycemic activities[J]. Process Biochemistry,2022,121:339−348. doi: 10.1016/j.procbio.2022.06.026
[29] HUO J Y, WU Z Y, ZHAO H, et al. Structure-activity relationship of antioxidant polysaccharides from Huangshui based on the HPLC fingerprint combined with chemometrics methods[J]. LWT-Food Science and Technology,2022,159:113201. doi: 10.1016/j.lwt.2022.113201
[30] TANG Y Y, HE X M, LIU G M, et al. Effects of different extraction methods on the structural, antioxidant and hypoglycemic properties of red pitaya stem polysaccharide[J]. Food Chemistry,2023,405:134804. doi: 10.1016/j.foodchem.2022.134804
[31] ZHANG X, CAI Z Y, MAO H Y, et al. Isolation and structure elucidation of polysaccharides from fruiting bodies of mushroom Coriolus versicolor and evaluation of their immunomodulatory effects[J]. International Journal of Biological Macromolecules,2021,166:1387−1395. doi: 10.1016/j.ijbiomac.2020.11.018
[32] LI H P, FENG Y B, SUN W X, et al. Antioxidation, anti-inflammation and anti-fibrosis effect of phosphorylated polysaccharides from Pleurotus djamor mycelia on adenine-induced chronic renal failure mice[J]. International Journal of Biological Macromolecules,2021,170:652−663. doi: 10.1016/j.ijbiomac.2020.12.159
[33] HU T G, ZOU Y X, LI E N, et al. Effects of enzymatic hydrolysis on the structural, rheological, and functional properties of mulberry leaf polysaccharide[J]. Food Chemistry, 2021, 355.
[34] ZHAN Q P, WANG Q, LIN R G, et al. Structural characterization and immunomodulatory activity of a novel acid polysaccharide isolated from the pulp of Rosa laevigata Michx fruit[J]. International Journal of Biological Macromolecules,2020,145:1080−1090. doi: 10.1016/j.ijbiomac.2019.09.201
[35] ZHANG W J, HUANG J, WANG W, et al. Extraction, purification, characterization and antioxidant activities of polysaccharides from Cistanche tubulosa[J]. International Journal of Biological Macromolecules,2016,93:448−458. doi: 10.1016/j.ijbiomac.2016.08.079
[36] FORGET A, PIQUE RA, AHMADI V, et al. Mechanically tailored agarose hydrogels through molecular alloying with β‐Sheet polysaccharides[J]. Macromolecular Rapid Communications,2014,36:196−203.
[37] CHEN H Y, ZENG J S, WANG B, et al. Structural characterization and antioxidant activities of Bletilla striata polysaccharide extracted by different methods[J]. Carbohydrate Polymers,2021,266:118149. doi: 10.1016/j.carbpol.2021.118149
[38] PAN L C, ZHU Y M, ZHU Z Y, et al. Chemical structure and effects of antioxidation and against α-glucosidase of natural polysaccharide from Glycyrrhiza inflata Batalin[J]. International Journal of Biological Macromolecules,2020,155:560−571. doi: 10.1016/j.ijbiomac.2020.03.192
[39] LI C, LI X S, YOU L J, et al. Fractionation, preliminary structural characterization and bioactivities of polysaccharides from Sargassum pallidum[J]. Carbohydrate Polymers,2017,155:261−270. doi: 10.1016/j.carbpol.2016.08.075
[40] 包晓玮, 李建瑛, 任薇, 等. 沙棘多糖对D半乳糖致衰老小鼠的抗氧化作用[J]. 食品工业科技,2020,41(4):293−297,306. [BAO X W, LI J Y, REN W, et al. Antioxidant effects of Hippophae rhamnoides polysaccharide on aging mouse induced by D-galactose[J]. Food Industry Technology,2020,41(4):293−297,306.] BAO X W, LI J Y, REN W, et al. Antioxidant effects of Hippophae rhamnoides polysaccharide on aging mouse induced by D-galactose[J]. Food Industry Technology, 2020, 41(4): 293−297,306.
[41] CHEN Z, ZHU Y P, LU M T, et al. Effects of Rosa roxburghii Tratt glycosides and quercetin on D-galactose-induced aging mice model[J]. Journal of Food Biochemistry, 2022, 46.
[42] 张润祥, 白玉婷, 张颖蕾, 等. 绞股蓝多糖对D-半乳糖致衰老小鼠肝脏抗氧化能力的影响[J]. 中国畜牧兽医,2022,49(2):462−47. [ZHANG R X, BAI Y T, ZHANG Y L, et al. The effect of polysaccharides from Gynostemma pentaphyllum on the antioxidant capacity of the liver in D-galactose-induced aging mice[J]. Chinese Animal Husbandry and Veterinary Medicine,2022,49(2):462−47.] ZHANG R X, BAI Y T, ZHANG Y L, et al. The effect of polysaccharides from Gynostemma pentaphyllum on the antioxidant capacity of the liver in D-galactose-induced aging mice[J]. Chinese Animal Husbandry and Veterinary Medicine, 2022, 49(2): 462−47.
[43] 杨同攀. 大豆皂苷对D-半乳糖诱导衰老小鼠肾脏抗氧化作用的影响[D]. 延吉:延边大学, 2017. [YANG T P. The effect of soy saponins on the antioxidant effect of D-galactose-induced aging mice kidneys[D]. Yanji:Yanbian University. 2017.] YANG T P. The effect of soy saponins on the antioxidant effect of D-galactose-induced aging mice kidneys[D]. Yanji: Yanbian University. 2017.
[44] 赵越, 程艳芬, 郝晨阳, 等. 绣球菌多糖对免疫低下小鼠盲肠短链脂肪酸、G蛋白偶联受体及免疫因子的调节[J]. 食品科技,2022,47(4):231−238. [ZHAO Y, CHEN Y F, HAO C Y, et al. Regulation of Sparassis latifolia polysaccharide on short chains fatty acids, G protein-coupled receptors and immune factors in cecum of immunocompromised mice[J]. Food Technology,2022,47(4):231−238.] doi: 10.3969/j.issn.1005-9989.2022.4.spkj202204033 ZHAO Y, CHEN Y F, HAO C Y, et al. Regulation of Sparassis latifolia polysaccharide on short chains fatty acids, G protein-coupled receptors and immune factors in cecum of immunocompromised mice[J]. Food Technology, 2022, 47(4): 231−238. doi: 10.3969/j.issn.1005-9989.2022.4.spkj202204033
[45] ENCARNAO J C, ANA S P, AMARAL R A, et al. Butyrate, a dietary fiber derivative that improves irinotecan effect in colon cancer cells[J]. The Journal of Nutritional Biochemistry,2018,56:183. doi: 10.1016/j.jnutbio.2018.02.018





 下载:
下载:
 下载:
下载:



