Lipidomics Analysis of Lipid Changes in Grass Fish during Cold Storage
-
摘要: 为探明草鱼肉在低温冷藏过程中脂质劣变生物标记物,采用基于超高效液相色谱串联傅里叶变换质谱的脂质组学技术研究草鱼肉4 ℃下冷藏不同时间(3、6和9 d)的脂质谱,通过多元统计分析和单因素方差分析筛选其冷藏过程中的差异脂质,并结合KEGG数据库富集差异脂质分子参与的代谢通路。结果表明,草鱼肉冷藏过程中pH逐渐下降,而硫代巴比妥酸值、游离脂肪酸含量和挥发性盐基总氮逐渐上升,冷藏第9 d时分别达到0.82 µg/kg、168.22 µg/10 g和23.63 mg/100 g。冷藏草鱼肉中共鉴定出1265种脂质分子,分属5个大类和35个亚类,甘油磷脂(GP)和甘油酯(GL)是草鱼肉脂质的主要组分。冷藏3 d、6 d的草鱼肉与新鲜草鱼肉脂质轮廓无明显差异,冷藏9 d草鱼肉脂质组成出现明显变化。脂肪酰(FA)及鞘脂类(SP)是冷藏前期(3~6 d)主要差异脂质,GP是冷藏后期(6~9 d)明显变化的脂类。多元统计学差异分析筛选得到20种差异脂质分子,主要为GP和GL,其中磷脂酰乙醇胺(PE)(16:1e/22:6)呈极显著变化(P<0.01),甘油三酯(TG)(4:0/18:0/22:5)、磷脂酰胆碱(PC)(18:1/20:3)和TG(18:0/16:0/20:4)呈显著变化(P<0.05),可作为冷藏草鱼肉脂质劣变生物标记物。KEGG通路富集分析发现鞘脂代谢和甘油磷脂代谢参与了整个冷藏期间的脂质代谢,是影响冷藏草鱼肉劣变脂质谱的重要代谢途径。本文阐述了草鱼肉冷藏劣变过程中脂质谱差异和脂质劣变分子标记物及其涉及的代谢通路,为冷藏草鱼脂质劣变的机制探索及预测脂质劣变措施提供理论参考。Abstract: In order to identify biomarkers of lipid deterioration in grass carp (Ctenopharyngodon idella) muscle during cold storage, the lipid profile change of the grass carp muscle stored at 4 ℃ for different periods (3, 6, and 9 d) was investigated by UPLC-Q Exactive HF-X. Multivariate statistical analysis and one-way ANOVA were used to screen the differential lipids during the cold storage, and then to enrich the metabolic pathways involved in the differential lipids through the KEGG database. The results showed that the pH in grass carp muscle decreased gradually, while the thiobarbituric acid reactive substance, total free fatty acid content, and volatile base total nitrogen increased gradually, reaching 0.82 µg/kg, 168.22 µg/10 g and 23.63 mg/100 g, respectively, on the 9 d of cold storage. A total of 1265 lipid molecules belonging to 5 categories and 35 subclasses were identified in the chilled grass carp muscle. Glycerol phospholipids (GP) and glycerol esters (GL) were the main components of lipids in grass carp muscle. There was no significant difference in lipid profile between grass carp muscle refrigerated for 3~6 days (P>0.05), but there were significant changes in lipid composition when refrigerated for 9 days. Fatty acyl (FA) and sphingolipids (SP) were the major different lipids in the early stage of refrigeration (3~6 days), and GP was the main lipids with significant changes in the late stage of refrigeration (6~9 days). A total of 20 different lipid molecules were screened from multivariate statistical difference analysis, and they were mainly glycerol ester and glycerol phospholipid, among which PE (16:1e/22:6) showed significant differences (P<0.01). TG (4:0/18:0/22:5), PC (18:1/20:3), and TG (18:0/16:0/20:4) showed significant differences (P<0.05), which could be used as a marker of lipid deterioration in grass carp muscle during the cold storage. Enrichment analysis of the KEGG pathway showed that sphingolipid metabolism and glycerophospholipid metabolism were involved in lipid metabolisms during the cold storage (9 d), which were essential metabolic pathways affecting the deteriorated lipid profile of chilled grass carp. In this study, the differences in lipid profiles, molecular markers of lipid degradation, and their metabolic pathways involved in lipid deterioration of grass carp muscle during cold storage were described. It would provide theoretical guidance for exploring the mechanism of lipid change and related anti-lipid degradation research.
-
Keywords:
- grass carp /
- deterioration /
- lipidomics /
- differential lipids /
- metabolism pathway
-
草鱼(Ctenopharyngodon idella)属鲤形目鲤科雅罗鱼亚科草鱼属,俗称草鲩,是我国养殖规模最大的淡水经济鱼类,2022年草鱼以年养殖量576万吨居于养殖淡水鱼之首[1]。草鱼营养丰富,脂质含量达到5.2 g/100 g。草鱼被捕获后在冷藏、运输及加工过程中,容易发生一系列生化反应,导致质地、风味品质劣化,严重影响其加工和分销。脂质氧化是造成鱼肉品质变化的重要因素之一[2],通常由助氧化剂引发,如不饱和脂肪酸、血红素、过渡金属元素和氧化酶等,诱导活性氧产生自由基产生链式反应,生成过氧化物,并进一步裂解产生醇类、醛类、酮类和酸类等挥发性化合物影响草鱼肉风味[2,3]。Cao等[4]发现冷藏草鱼中羰基含量和游离脂肪酸含量随冷藏时间延长显著提升。Fu等[5]报道草鱼脂质的酸价、硫代巴比妥酸值(Thiobarbituric acid reactive substance,TBARs)在冷藏期间持续升高。然而,目前对于草鱼冷藏期间脂质氧化的研究大多局限于基本生化指标测定和脂肪酸组成分析,全面描述草鱼肉在冷藏过程中的脂质分子变化尚未报道。
脂质组学是一门新兴检测技术,是“代谢组学”的分支,被用于量化食品中的所有脂质,从而实现质量评估和脂质成分分析。脂质组学已在食品研究领域如油脂掺假鉴定[6]、食材溯源[7]和食品鲜度的评价[8]等方面有良好的应用效果。因此,越来越多的研究开始使用脂质组学技术探索动植物源食品中脂质谱的化学变化。Fang等[9]利用脂质组学研究了带鱼冷冻储藏期间肌肉的脂质谱变化,发现脑磷脂、卵磷脂、甘油三酯和甘油二酯是发生氧化/水解的主要脂质。Chang等[10]采用脂质组技术报道冷藏鱼肉新鲜度下降可能与α-亚麻酸、二十二碳六烯酸、花生四烯酸和亚油酸参与脂质水解以及十二烷基肉碱参与脂肪酸代谢有关。因此,利用脂质组技术解析冷藏水产品脂质谱变化,是深入认识水产脂质变化的可行性研究策略。然而,利用脂质组学对草鱼冷藏期间的脂质分子图谱变化的研究目前鲜有报道。超高效液相色谱-四极杆-静电场轨道阱高分辨质谱(UPLC-Q-Exactive-Orbitrap-MS)适合脂质组学分析,是理想的筛选平台,其特异性远超三重四极杆、Q-TOF或Q-Trap检测水平,具有高分辨率、高灵敏度、高通量和高可靠性的优势[11]。
本研究以新鲜草鱼肉为对象,冷藏不同天数(3、6和9 d),采用基于Q Exactive UPLC-MS/MS脂质组学技术对冷藏草鱼肉的脂质分子进行全面鉴定,结合多元统计学和单因素方差分析筛选差异脂质分子,通过KEGG富集差异脂质涉及的代谢途径,寻找冷藏草鱼肉脂质劣变的潜在生物标记物及其相关代谢途径,为阐明冷藏草鱼肉脂质劣化机制提供参考。
1. 材料与方法
1.1 材料与仪器
新鲜活草鱼(1.25~1.50 kg/尾) 购于南昌市南昌县长胜大市场;食盐 符合国家食品卫生标准,江西省盐业集团股份有限公司;三氯甲烷、甲醇、氢氧化钠 天津市大茂化学试剂厂;正己烷 广州西陇化工有限公司;乙腈 美国Fisher Chemic公司;甲酸 德国CNW公司;2-丙醇 德国Merck公司;甲基叔丁基醚 上海泰坦科技股份有限公司;乙酸铵 西格玛奥德里奇(上海)贸易有限公司;所用化学试剂均为分析纯。
Q-Exactive HF-X质谱仪、Vanquish Horizon system UPLC超高效液相色谱系统 美国Thermo Scientific;LNG-T88台式快速离心浓缩干燥器 太仓市华美生化仪器厂;HR-10B高速组织匀浆机 沪析仪器;Wonbio-96c多样品冷冻研磨仪 上海万柏生物科技有限公司;Centrifuge 5430R Centrifuge 5424 R冷冻离心机 德国Eppendorf;NewClassic MS 105DU电子天平 上海楚柏实验室设备有限公司。
1.2 实验方法
1.2.1 样品制备
新鲜的活草鱼头部敲晕、屠宰、清洗,并去除鳞片、内脏、头部、尾部和开放的切片。从背部取出鱼片,用流动的自来水淋洗鱼片以除去表面的杂质和血迹。沥干表面水分,切至约5.0 cm×1.0 cm×2.5 cm(15±2.5 g)的鱼片。将样品放置在密封的聚乙烯袋(不透明)中,并在4 ℃下储存,用于取样(3、6和9 d,分别命名为D3_0、D6_0、D9_0,新鲜草鱼肉为con组)和后续分析。整个样品制备过程在10 ℃以下的冷库中进行。
1.2.2 理化指标测定
pH的测定参照GB 5009.237-2016《食品pH值的测定》方法。
采用氯仿:甲醇(2:1,v/v)法提取草鱼肌肉样品中的脂肪,然后按照Yu等[12]方法,将游离脂肪酸(FFA)从脂质中分离出来,计算FFA总含量。
参照国家标准GB 5009.181-2016测定样品中的TBARs值。
挥发性盐基氮(TVB-N)的测定参考GB 5009.228-2016《食品安全国家标准 食品中挥发性盐基氮的测定》。
1.2.3 脂质组学测定
1.2.3.1 脂质提取
脂质提取方法根据Li等[13]方法,稍作修改。精确称取50 mg样品至2 mL离心管中,加入280 µL提取液(甲醇:水=2:5),400 µL MTBE,1颗研磨珠(6 mm)。冷冻研磨6 min(−10 ℃,50 Hz)后低温超声提取30 min(5 ℃,40 KHz),−20 ℃静置30 min;4 ℃,13000×g离心15 min,取350 µL上清用氮气吹干,加入100 µL复溶液(异丙醇:乙腈=1:1)复溶。涡旋混匀30 s后,冰水浴中40 KHz超声5 min,4 ℃,13000×g离心10 min,取上清液上机分析。以等体积的所有样本代谢物混合制备成质控样本(QC),每10个样本中插入一个QC,以考察整个分析过程的重复性。
1.2.3.2 UPLC-MS/MS分析
脂质组学UPLC-MS/MS检测条件根据Wang等[14]方法,稍作修改。采用赛默飞公司的超高效液相色谱串联四极杆-静电场轨道阱高分辨质谱(配备Thermo Accucore C30柱,100 mm×2.1 mm×2.6 µm),参考Huang等[15]的方法进行UPLC-MS/MS分析。
色谱条件:流动相A:10 mmol/L乙酸铵50%乙腈水溶液(0.1%甲酸),流动相B:2 mmol/L乙酸铵乙腈/异丙醇/水(10/88/2,含0.02%甲酸)。梯度洗脱:0~4 min,35%~60% B;4~12 min,60%~85% B;12~15 min,85%~100% B;15~17 min,100% B;17~18 min,100%~35% B;18~20 min,35% B。进样量2 µL,流速0.40 mL/min,柱温为40 ℃。
质谱条件:采用正负离子扫描模式,正离子模式喷雾电压为3000 V,负离子模式喷雾电压为−3000 V,质量扫描范围m/z:200~2000。鞘气60 psi,辅助加热气20 psi,离子源加热温度370 ℃,20-40-60 V循环碰撞能,DDA正离子和负离子模式采集数据,提高脂质覆盖率。
1.3 数据处理
采用LipidSearch(Thermo,CA)软件对UPLC-MS原始数据进行处理,得到含有脂质名称、保留时间、质荷比和峰强度的数据矩阵。采用特征峰搜库鉴定,将MS和MS/MS质谱信息与代谢数据库进行匹配,MS质量误差小于10 ppm,根据二级质谱匹配得分鉴定代谢物。
数据矩阵用80%规则来去除缺失值,即保留至少一组样品中非零值80%以上的变量,再进行空缺值填补(原始矩阵中最小值填补空缺值)。用总和归一化法对质谱峰的响应强度进行归一化,减小样品制备及仪器不稳定带来的误差,删除QC样本相对标准偏差(RSD)>30%的变量,并进行log10对数化处理,得到的数据矩阵用于后续分析。
预处理后的矩阵文件进行差异分析。R软件包ropls 1.6.2进行主成分分析(PCA)和偏最小二乘法判别分析(PLS-DA),置换校验次数为200,进行Student’s t检验和差异倍数分析。差异代谢物的选择基于OPLS-DA模型得到的变量权重值(VIP)和Student’s t检验P值来确定,VIP>1,P<0.05的代谢物为差异代谢物。
通过KEGG数据库(https://www.kegg.jp/kegg/pathway.html)进行差异代谢物的代谢通路注释。Python软件包scipy.stats进行通路富集分析,并通过Fisher精确检验获得与实验处理最相关的生物学代谢途径。
所有实验平行3次。使用SPSS 26.0软件进行数据统计分析。采用单因素方差分析显著性差异(ANOVA),P<0.05,差异显著;P<0.01,差异极显著。结果数据表示为mean±sd。
2. 结果与分析
2.1 草鱼肉冷藏过程中的理化指标变化
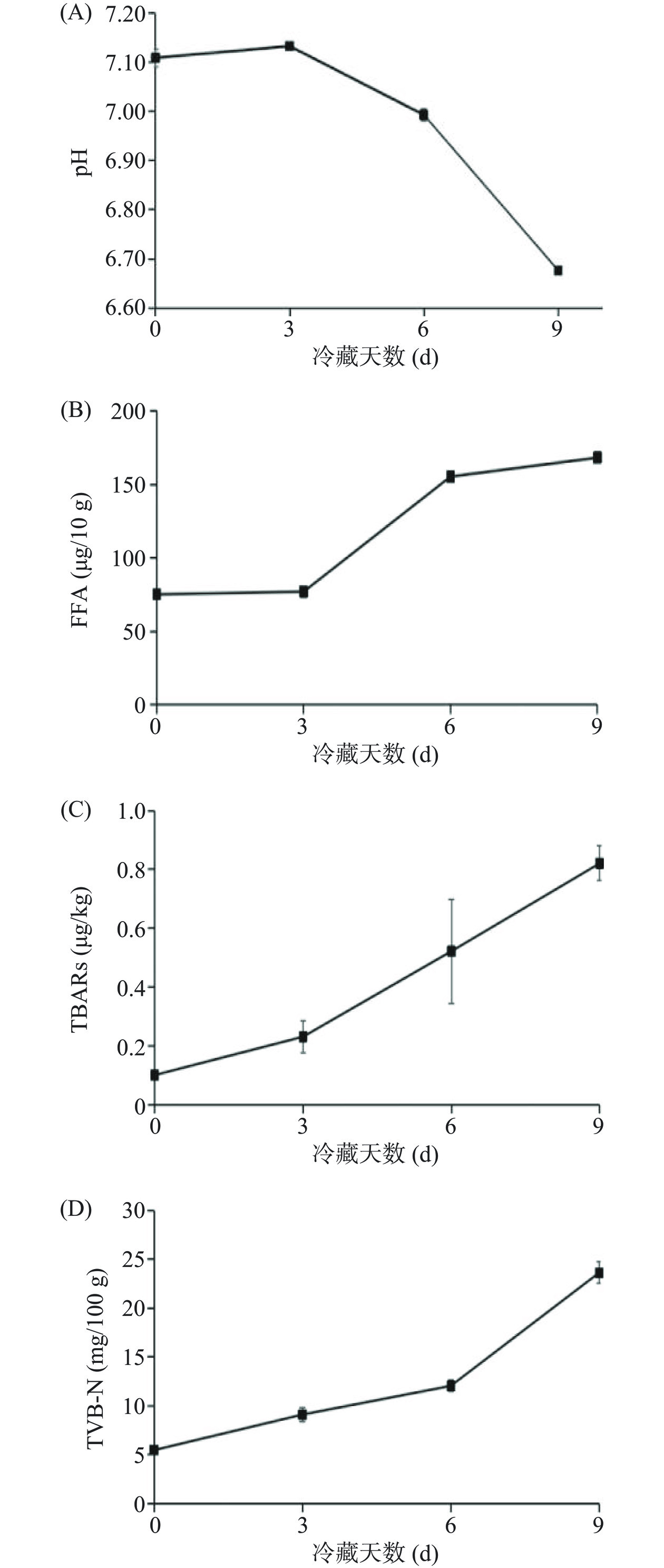
草鱼肉冷藏过程中部分理化指标变化,如pH、游离脂肪酸、TBARs和TVB-N值,结果如图1所示。pH是水产品品质劣化的重要检测指标之一。生鲜草鱼肉的pH为7.11±0.02,随着冷藏时间进行,草鱼肉pH呈现下降趋势。冷藏第6 d,草鱼肉pH为6.99±0.01,而冷藏第9 d pH下降至6.68±0.01。肉类贮藏期间pH变化范围小于0.1个单位为一级品质,0.1~0.2个单位范围则仍可食用,变化范围大于0.2个单位为腐败变质。pH结果表明,草鱼肉冷藏6 d时仍可食用,冷藏9 d已腐败变质不可食用。游离脂肪酸结果显示,FFA含量在冷藏过程中呈现上升趋势,FFA从冷藏第3 d的77.07±3.68 µg/10 g显著性(P<0.05)上升至第6 d的155.32±2.02 µg/10 g,随后略微上升至第9 d的168.22±0.50 µg/10 g。TBARs结果显示,草鱼肉的TBARs随着冷藏呈现上升趋势,冷藏第9 d达到0.82 µg/kg。草鱼肉TVB-N值随着冷藏的进行逐渐上升,新鲜草鱼肉的TVB-N值为5.46±0.24 mg/100 g,冷藏3、6、9 d时分别达到9.10±0.70、12.04±0.56和23.63±1.09 mg/100 g。根据GB 2733-2015《鲜、冻动物性水产品》规定,TVB-N值二级鲜度不大于20 mg/100 g[16]。草鱼肉冷藏6 d仍处在二级鲜度,冷藏9 d超出可食用范围。综上,低温冷藏草鱼肉货架期可达到6 d,但不超过9 d。
2.2 草鱼肉冷藏过程中的脂质变化
QC样本RSD<0.3时,峰所占的累积比例接近80%,说明LC-MS/MS仪器在整个样品检测和分析过程中具有良好的校准信号,试验中获得的脂质谱差异可以反映样本间自身的生物信息学差异。
草鱼肌肉中共检测到1265种脂质分子种类,分属5大类和35个亚类。依据LIPID MAPS(Lipid Metabolites and Pathways Strategy)的脂质分类法,将鉴定到的脂质分为脂肪酰(FA,占1.41%)、甘油酯(GL,占33.41%)、甘油磷脂(GP,占62.60%)、鞘脂类(SP,占2.56%)和固醇脂(ST,占0.02%)。GP是草鱼肉脂质的主要组分,其次为GL和SP。不同鱼类中各类脂质占比存在差异,GP是多种鱼类如美鳐(Mottled skate)等的主要脂质[17]。然而,在胡瓜鱼(Shishamo smelt)等鱼类中,GL是占比最高的脂类[18]。此外,有研究报道,ST(主要为聚胆固醇酯)是日本沙丁鱼中的主要脂质[19]。
2.2.1 PCA分析
采用PCA模型分析冷藏不同时间的草鱼肉样品(con、D3_0、D6_0和D9_0)的脂质谱差异,PCA得分结果如图2A所示。PC1贡献率为48.60%,PC2贡献率为18.10%,总和达到66.70%。D3_0组与D6_0组较为聚集,D3_0与con组在PC1存在部分重叠,但与con组在PC2明显分离。D9_0组与con组在PC1和PC2明显分离。结果表明冷藏3 d后草鱼脂质变化较小,继续冷藏至6 d,草鱼脂质组成与第3 d差异不显著,当冷藏9 d时,草鱼肉脂质组成发生明显变化,与新鲜草鱼、冷藏3、6 d的草鱼脂质均有明显差异。姜杨等[20]利用微生物计数、pH、TVB-N含量、呈味核苷酸K值及电子鼻等综合评价了冷藏草鱼肉的货架期为8 d。脂质组成PCA分析结果表明草鱼肉的脂质谱变化可以初步反映冷藏期限。
2.2.2 PLS-DA分析
偏最小二乘法判别分析(PLS-DA)作为一种监督判别分析方法,有助于分析样本分类变量。不同组别草鱼肉脂质组成的PLS-DA得分图如图2B所示。PC1与PC2的贡献率分别为53.6%和17.2%。R2Y(cum)为0.992,Q2(cum)为0.857,均接近1.0,回归线性良好,说明模型可靠。图2B中,con组、D3_0组和D6_0组在X轴上有重叠,而D9_0组与con组、D3_0组和D6_0组在X轴上显著分离(P<0.05),说明冷藏3 d和6 d的草鱼肉脂质组成和新鲜鱼肉差异不显著(P>0.05),而冷藏9 d后的草鱼肉脂质组成明显变化,与新鲜组、冷藏3 d和6 d的草鱼肉脂质组成均存在明显差异,研究与PCA分析结果一致。
2.3 草鱼肉冷藏过程中的差异脂质
2.3.1 多元统计学分析筛选的差异代谢物
依据变量投影重要性(VIP>1)结合显著性分析(P<0.05)筛选草鱼肉冷藏3、6、9 d时的差异脂质分子(TOP代谢物=30),VIP评分结果如图3所示。
相比于con组,D3_0组中,18种脂质上调,包括6种FA:AEA(22:5,16:0,20:1,18:2,18:0,18:1);3种SP:Cer(18:0/20:4,18:1/20:4,d18:0/18:1);2种GL:TG(20:4e/18:1/20:4,18:0/16:0/20:4);6种GP:PE(33:0/18:2,32:1/22:6)、PEt(14:1e/22:6)、MePC(17:1/20:4,17:0/20:4)、LPE(18:3)和1种ST:ZyE(22:5)。12种脂质下调,包括7种GL:TG(14:0/12:1/14:1,18:1/22:6/24:1,16:0/16:1/18:1,16:0/20:5/22:6,19:1/18:2/18:3,18:1/18:1/24:1)和DG(16:2e/18:1);4种GP:PE(36:0/20:1,18:3/20:5,12:1e/10:4)和dMePE(4:0/16:0)和1种FA:AcCa(18:1)。
D6_0组中12种脂质上调,包括6种FA:AEA(22:5,20:1,16:0,18:1,18:2,18:0);3种SP:Cer(18:0/20:4,18:1/20:4,d18:0/18:1);2种GL:TG(20:4e/18:1/20:4,18:0/16:0/20:4)和1种GP:PEt(14:1e/22:6)。18种脂质下调,包括17种GP:LPE(20:5,20:1e,20:2e);TG(14:0/12:1/14:1,19:1/16:0/18:1);PS(16:1/18:3);PE(26:1/11:2);MLCL(14:2/15:0/15:0,11:2/16:1/22:5,18:2/15:0/20:4);PE(12:1e/10:4);dMePE(4:0/16:0);LdMePE(18:1e);LPC(18:2e、18:1e、20:5、16:1)和1种FA:AcCa(18:1)。
D9_0组中17种脂质上调,包括14种GP:PMe(16:1/18:1)、PS(16:1/18:3,16:1/18:2)、PE(20:4e/13:0、16:0/16:1、16:1/18:1、16:1/16:1、16:1/14:0、33:0/18:2)、PC(16:1/13:0),dMePE(16:1/14:0)、PEt(14:1e/22:6)、PG(16:0/16:1,16:1/18:2);1种GL:TG(20:4e/18:1/20:4);1种FA:AEA(22:5)和1种SP:Cer(18:0/20:4)。13种脂质下调,均为GP:LPC(22:1,16:0)、LdMePE(16:0)、LPE(17:0,20:0,22:2)、MLCL(14:2/16:0/16:0,19:0/15:1/18:1,18:2/15:0/20:4,10:3/20:1/22:6)、LPC(20:1,17:1,17:0)。
综上,GP在差异脂质分子中占比较高,为主要差异脂质。GP作为细胞膜的主要组分,是草鱼肌肉中的主要脂类,这与沙丁鱼中的结果一致[17]。随冷藏时间的延长,差异脂质的种类逐渐趋于单一,冷藏至9 d时,GP是主要的差异脂质。30个差异代谢物中,14种GP上调,13种GP下调。N-酰基乙醇胺(AEA)和神经酰胺(Cer)在草鱼冷藏过程中仅表现为上调,且在冷藏前期(3 d、6 d)是主要的上调脂质,而溶血磷脂在冷藏过程中主要表现为下调。Fang等[9]也发现带鱼肌肉在冷藏过程中Cer明显上调。神经酰胺作为复合鞘脂的前体,是鞘脂生物合成和分解代谢的中心[21],因此,鞘脂分解可能是神经酰胺上调的原因。AEA作为重要的生物活性脂质信号分子,其上调可能与草鱼宰杀后的免疫调节相关[22]。溶血磷脂的下调可能与其抗氧化活性相关,因此脂质氧化可能是草鱼肉脂质谱变化的重要原因[23]。其他脂质分子如TG、PE等在冷藏过程中存在上调同时存在下调。研究报道,含有脂肪酸C16:0和C18:1的TG、GP分子,以及含有脂肪酸C18:2、C20:4的PC、PE磷脂分子贮存过程中更容易被分解,可能是由于磷脂酶的水解作用和不饱和脂肪酸易氧化[10]。此外,由于冷藏后期鱼肉肌肉结构被破坏,PE、PC及PS作为细胞膜的重要组分,可能在冷藏后由于细胞损伤而被释放,丰度增加[24]。
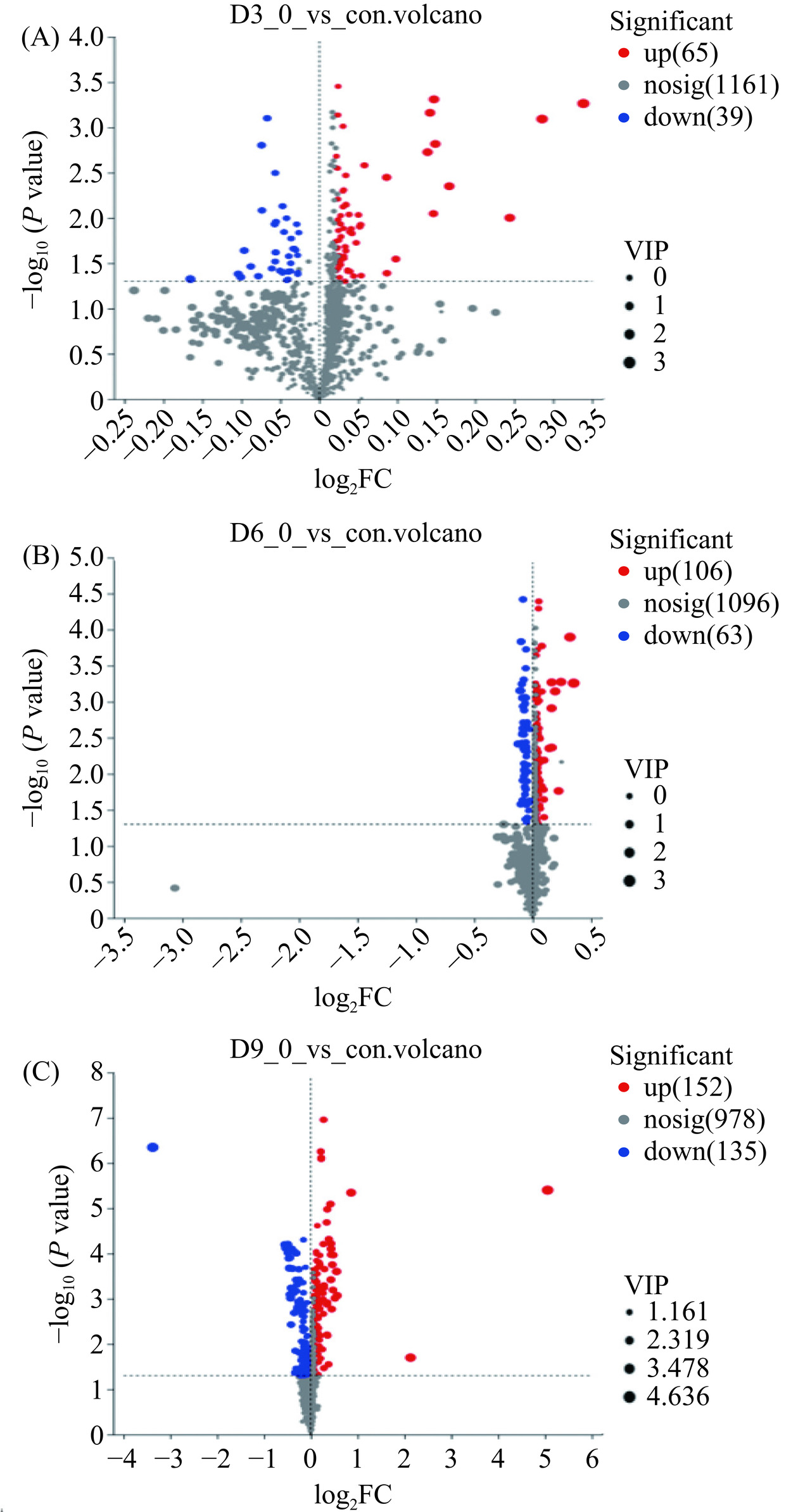
2.3.2 单因素方差分析筛选的差异脂质
通过比较正负离子模式下脂质的峰面积对脂质分子进行相对定量,并对冷藏鱼肉的单个脂质进行含量分析。依据丰度显著不同,分析冷藏3、6和9 d后鱼肉中显著变化的脂质分子,绘制火山图(图4A、图4B、图4C)。图中横轴为差异倍数(FC)的log2 FC值,纵坐标轴为P的对数值。横坐标的绝对值越大,两个样本之间表达量的FC越大;纵坐标值越大,差异表达越显著(P<0.05),筛选出的分子越可靠。灰色表示无显著差异的脂质分子,红色圆点为显著增多的脂质(P<0.05),蓝色圆点为显著减少的脂质(P<0.05)。草鱼肉在冷藏3、6和9 d后,分别检测到104种(65种上调,39种下调)、169种(106种上调,63种下调)和287种(152种上调,135种下调)丰度差异脂质。结果表明,随着冷藏时间的延长,草鱼肉中发生变化的脂质逐渐增加,冷藏鱼肉脂质变化主要表现为前期上调、后期下调。研究说明在草鱼冷藏过程中,脂质分子上发生了一系列复杂的反应,如水解、氧化,并诱导脂质之间发生转化和生成其他脂质[25]。
结合三种分析方式(VIP>1,P<0.05,FC<0.8或FC>1.2)筛选冷藏草鱼肉中重要的差异脂质分子作为脂质代谢的潜在代谢劣变生物标记物,结果如表1所示。冷藏草鱼肉中共检测出57个目标脂质分子,其中D3_0/con与D6_0/con获得2个上调的脂质分子,即AEA(22:5)和Cer(d18:0/20:4),分别属于FA和SP。D9_0/con获得55个目标脂质分子,分属于GP、GL、FA和SP,下调脂质均为GP,LPC(22:1)下调最为显著(P<0.05),FC达0.0964;而PMe(16:1/18:1)是上调最显著(P<0.05)的脂质分子,FC达33.2762。结果表明,单因素方差分析结果与多元统计学分析结果类似,草鱼肉冷藏过程中脂质的下调主要发生在冷藏6 d后到冷藏9 d时,PC、TG和PE均存在明显下调,PC是主要的下调的脂质。前人研究表明,PC为容易发生氧化的脂质,而长链不饱和脂肪酸不稳定、易氧化,可能是冷藏PC、TG和PE下调的原因[26−27]。同时有研究报道,冷藏会增加磷脂酶的活性,从而催化降解肉制品中的PC[28−29]。
表 1 冷藏草鱼肉中潜在的脂质代谢标记物Table 1. Potential lipid metabolism markers in refrigerated grass carp muscle组间 脂质 种类 分组 脂质中文名称 VIP_PLS-DA FC P值 调控 D3_0/con AEA(22:5) FA AEA N-酰基乙醇胺 3.7911 1.2647 5.44 up Cer(d18:0/20:4) SP Cer 神经酰胺 3.2907 1.2191 8.08×10−4 up D6_0/con AEA(22:5) FA AEA N-酰基乙醇胺 3.5417 1.2758 5.52×10−4 up Cer(d18:0/20:4) SP Cer 神经酰胺 3.2592 1.2477 1.27×10−4 up D9_0/con PMe(16:1/18:1) GP PMe 磷脂酰甲醇 4.5274 33.2762 3.97×10−6 up PS(16:1/18:3) GP PS 磷脂酰丝氨酸 3.9043 4.3749 2.01×10−2 up PS(16:1/18:2) GP PS 磷脂酰丝氨酸 3.2654 1.8165 4.53×10−6 up TG(20:4e/18:1/20:4) GL TG 甘油三酯 2.7092 1.4783 8.53×10−4 up PE(20:4e/13:0) GP PE 磷脂酰乙醇胺 2.8693 1.4648 2.51×10−4 up PC(16:1/13:0) GP PC 磷脂酰胆碱 2.8689 1.4645 2.49×10−4 up PEt(14:1e/22:6) GP PEt 磷脂酰乙醇 2.5074 1.4293 9.73×10−4 up PG(16:1/18:2) GP PG 磷脂酰甘油 2.3904 1.3954 1.08×10−4 up PE(16:1/14:0) GP PE 磷脂酰乙醇胺 2.4487 1.387 6.41×10−4 up PG(16:0/16:1) GP PG 磷脂酰甘油 2.4754 1.3742 1.77×10−4 up PE(33:0/18:2) GP PE 磷脂酰乙醇胺 2.4018 1.3622 1.70×10−3 up AEA(22:5) FA AEA N-酰基乙醇胺 2.5429 1.3527 1.06×10−4 up PE(16:0/16:1) GP PE 磷脂酰乙醇胺 2.5853 1.3487 7.89×10−5 up dMePE(16:1/14:0) GP dMePE 二甲基磷脂酰乙醇胺 2.5853 1.3487 7.89×10−5 up PE(16:1/16:1) GP PE 磷脂酰乙醇胺 2.5218 1.3464 6.04×10−5 up PE(16:1/18:1) GP PE 磷脂酰乙醇胺 2.5412 1.3458 3.80×10−4 up Cer(d18:0/20:4) SP Cer 神经酰胺 2.4398 1.3372 8.08×10−6 up Cer(d18:0/18:1) SP Cer 神经酰胺 2.2623 1.3056 4.81×10−5 up TG(18:1e/20:4/22:6) GL TG 甘油三酯 2.0335 1.2994 2.82×10−2 up DLCL(18:4/20:4) GP DLCL 心磷脂 2.065 1.2807 6.51×10−3 up PMe(16:1/16:1) GP PMe 磷脂酰甲醇 2.067 1.2771 1.21×10−3 up PG(16:1/16:1) GP PG 磷脂酰甘油 2.1886 1.2757 1.06×10−5 up PE(14:0e/11:2) GP PE 磷脂酰乙醇胺 2.1587 1.2739 1.34×10−3 up PE(8:1e/8:0) GP PE 磷脂酰乙醇胺 2.182 1.2709 6.25×10−3 up Cer(d18:1/20:4) SP Cer 神经酰胺 2.1564 1.2648 2.06×10−5 up OAHFA(22:5/22:4) FA OAHFA (O-酰基)-1-羟基脂肪酸 2.0164 1.2239 2.21×10−4 up PE(18:1e/24:2) GP PE 磷脂酰乙醇胺 2.033 1.2165 5.68×10−4 up Co(Q9) FA Co 辅酶 2.03 1.2155 5.06×10−4 up LPE(16:1) GP LPE 溶血磷脂酰乙醇胺 1.9021 1.2123 3.42×10−2 up AEA(20:1) FA AEA N-酰基乙醇胺 2.0867 1.2079 1.11×10−7 up PE(16:1/18:2) GP PE 磷脂酰乙醇胺 1.9988 1.2041 6.20×10−5 up PE(16:0/18:3) GP PE 磷脂酰乙醇胺 1.8228 1.2041 2.16×10−3 up MLCL(14:2/15:0/15:0) GP MLCL 心磷脂 1.9567 0.7946 1.41×10−2 down LPC(20:3) GP LPC 溶血磷脂酰胆碱 2.3021 0.7931 4.29×10−2 down MLCL(10:4/18:0/20:4) GP MLCL 心磷脂 2.2275 0.7842 9.14×10−5 down MLCL(14:2/20:1/20:1) GP MLCL 心磷脂 2.1923 0.7836 7.22×10−4 down LdMePE(20:1) GP LdMePE 溶血二甲基磷脂酰乙醇胺 2.088 0.7818 2.06×10−3 down LPI(18:0) GP LPI 溶血磷脂酰肌醇 2.3388 0.7611 2.16×10−4 down LPE(19:0) GP LPE 溶血磷脂酰乙醇胺 2.2728 0.7558 7.92×10−5 down MLCL(14:2/16:0/16:0) GP MLCL 心磷脂 2.5654 0.7533 5.96×10−4 down LPC(17:0) GP LPC 溶血磷脂酰胆碱 2.398 0.7483 5.77×10−4 down MLCL(10:1/15:1/20:3) GP MLCL 心磷脂 2.2225 0.7465 3.73×10−3 down LPC(19:0) GP LPC 溶血磷脂酰胆碱 2.3496 0.7439 8.69×10−4 down LPC(16:0) GP LPC 溶血磷脂酰胆碱 2.6246 0.7409 9.66×10−4 down LPC(20:1) GP LPC 溶血磷脂酰胆碱 2.5234 0.7355 8.10×10−4 down LPE(22:1) GP LPE 溶血磷脂酰乙醇胺 2.3036 0.7346 7.98×10−5 down LPC(17:1) GP LPC 溶血磷脂酰胆碱 2.4618 0.7326 1.25×10−4 down LdMePE(16:0) GP LdMePE 溶血二甲基磷脂酰乙醇胺 2.6012 0.7283 2.10×10−4 down MLCL(18:2/15:0/20:4) GP MLCL 心磷脂 2.4237 0.722 1.28×10−4 down MLCL(10:3/
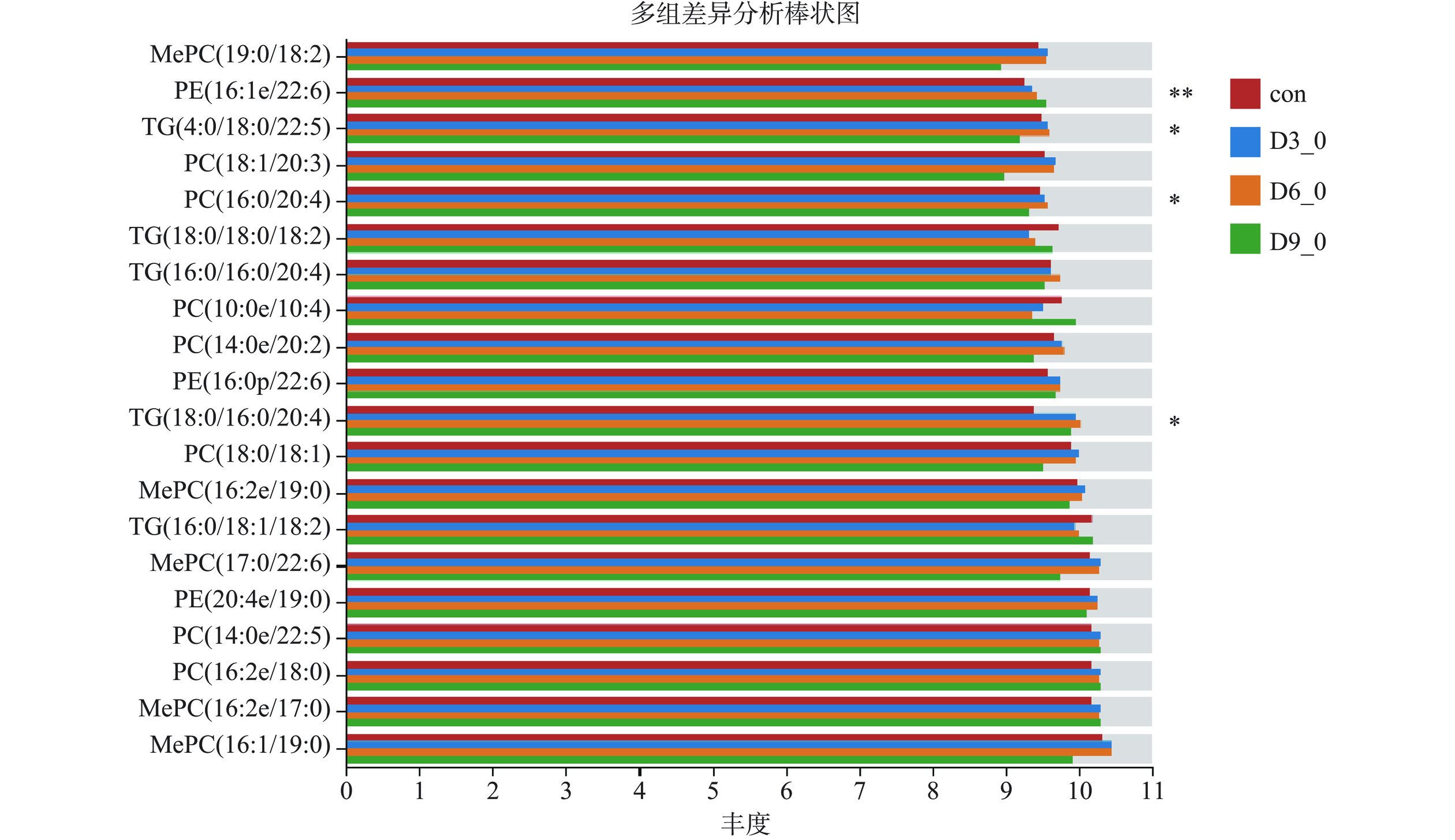
20:1/22:6)MLCL(10:3/20:1/22:6) GP MLCL 心磷脂 2.3642 0.721 8.96×10−5 down LPE(20:0) GP LPE 溶血磷脂酰乙醇胺 2.4025 0.7118 6.25×10−5 down LPE(22:2) GP LPE 溶血磷脂酰乙醇胺 2.3907 0.7115 9.59×10−5 down MLCL(19:0/15:1/18:1) GP MLCL 心磷脂 2.5042 0.6893 7.65×10−5 down LPE(17:0) GP LPE 溶血磷脂酰乙醇胺 2.6044 0.6806 6.37×10−5 down LPC(22:1) GP LPC 溶血磷脂酰胆碱 4.3586 0.0964 4.50×10−7 down 采用单因素方差(Post-hoc检验,scheffe>0.95)分析冷藏草鱼肉con、D3_0、D6_0与D9_0组的脂质谱,差异test bar plot分析结果如图5所示。由图可知,草鱼肉在冷藏期间共筛选出20种脂质差异分子(P<0.05,FC<0.8或FC>1.25),包括7种PC(18:1/20:3,16:0/20:4,10:0e/10:4,14:0e/20:2,18:0/18:1,14:0e/22:5,16:2e/18:0),5种TG(4:0/18:0/22:5,18:0/18:0/18:2,16:0/16:0/20:4,18:0/16:0/20:4,16:0/18:1/18:2),5种MePC(19:0/18:2,16:2e/19:0,17:0/22:6,16:2e/17:0,16:1/19:0)和3种PE(16:1e/22:6,16:0p/22:6,20:4e/19:0)。共检测到4种显著性差异脂质(P<0.05),分别为2种TG(4:0/18:0/22:5和18:0/16:0/20:4),1种PE(16:1e/22:6)和1种PC(16:0/20:4)。其中PE(16:1e/22:6)呈极显著差异(P<0.01),其余三种脂质呈显著差异(P<0.05)。
2.4 草鱼肉冷藏过程中脂质代谢途径
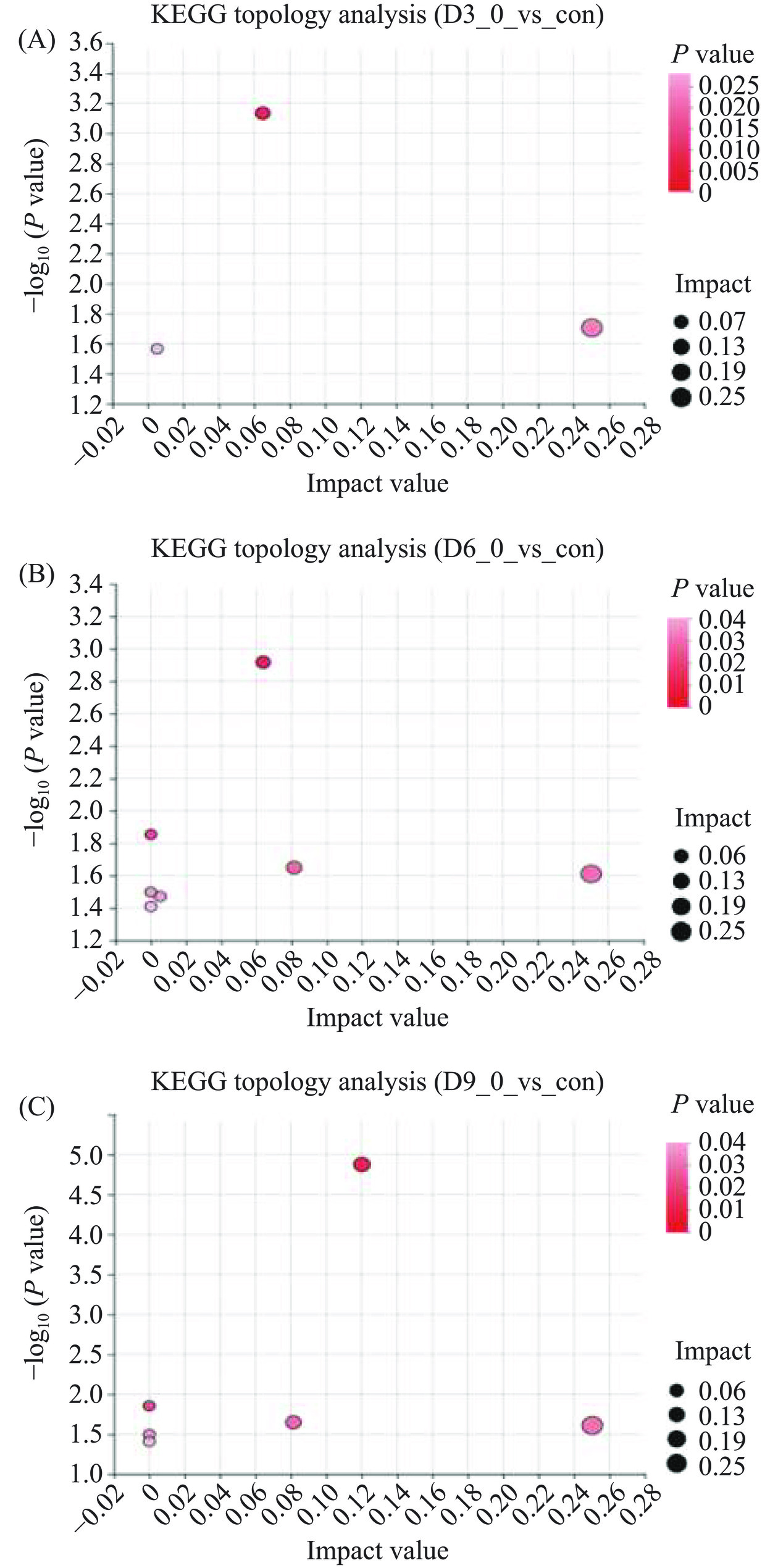
为进一步分析冷藏草鱼脂质的变化,从KEGG数据库获取冷藏草鱼肉差异脂质代谢途径,结合P值和通路相对重要性(Impact value)通过拓扑分析识别显著富集的通路。草鱼肉冷藏3 d、6 d、9 d差异脂质分子KEGG富集途径如表2所示,对应的KEGG拓扑分析气泡图如图6所示。结果发现,从D3_0、D6_0和D9_0中分别富集到3、7和6条脂质代谢通路,包括鞘脂代谢、甘油磷脂代谢、乙醚脂质代谢、甘油酯代谢、亚油酸代谢和α-亚麻酸代谢。其中,鞘脂代谢和甘油磷脂代谢在冷藏3 d时即发生,并参与了草鱼肉整个冷藏过程中的脂质代谢。冷藏6 d后,乙醚脂质代谢、甘油酯代谢、亚油酸代谢和α-亚麻酸代谢发生。由表1中参与代谢途径的脂质分子数目可知,在冷藏过程中,参与代谢的脂质分子逐渐增多,表明随冷藏时间延长,脂质代谢加剧。由P值和Impact value可知,鞘脂代谢是参与冷藏草鱼脂质代谢的最重要的代谢途径。此外,乙醚脂质代谢、甘油磷酯代谢、甘油酯代谢、也对冷藏草鱼肉的脂质谱产生了重要影响。此部分脂质代谢相关通路可能导致草鱼肉冷藏不同时间的脂质分子差异。Chen等[26]在冷藏三文鱼(Salmo salar L.)的研究中报道了α-亚麻酸代谢、亚油酸代谢、花生四烯酸代谢和甘油磷脂代谢是重要的脂质代谢途径。草鱼肉低温冷藏期间肌内沉脂的差异可能由脂肪酸、甘油脂质和甘油磷脂代谢途径差异引起。综上所述,脂质代谢随冷藏时间延长而加剧,鞘脂代谢、甘油磷脂代谢参与了整个冷藏期间的脂质代谢,是影响冷藏草鱼脂质劣变的重要代谢途径。
表 2 草鱼肉冷藏3、6、9 d差异脂质分子KEGG途径富集Table 2. KEGG pathway enrichment of differential lipid molecules in grass carp chunks after 3, 6, and 9 d of refrigeration组间 通路_ID 通路描述 一级分类 二级分类 代谢物数目 通路综合重要性得分 P值 D3_0 Vs con map00600html 鞘脂代谢 Metabolism 脂质代谢 2 0.25037 0.01970 map00564html 甘油磷脂代谢 Metabolism 脂质代谢 4 0.08150 0.00073 D6_0 Vs con map00600html 鞘脂代谢 Metabolism 脂质代谢 5 0.25037 0.02450 map00565html 乙醚脂质代谢 Metabolism 脂质代谢 1 0.08150 0.02241 map00564html 甘油磷脂代谢 Metabolism 脂质代谢 16 0.06387 0.00121 map00561html 甘油酯代谢 Metabolism 脂质代谢 1 0.00530 0.03383 map00591html 亚油酸 Metabolism 脂质代谢 4 0 0.01397 map00592html α-亚麻酸代谢 Metabolism 脂质代谢 4 0 0.03177 D9_0 Vs con map00600html 鞘脂代谢 Metabolism 脂质代谢 7 0.25037 0.02450 map00564html 甘油磷脂代谢 Metabolism 脂质代谢 18 0.12023 0.00001 map00565html 乙醚脂质代谢 Metabolism 脂质代谢 1 0.08150 0.02241 map00591html 亚油酸 Metabolism 脂质代谢 7 0 0.01397 map00592html α-亚麻酸代谢 Metabolism 脂质代谢 7 0 0.03177 3. 结论
本研究利用非靶向脂质组学技术对草鱼肉冷藏过程中的脂质分子进行了全面鉴定。草鱼肉含有丰富的脂质,GP是主要的脂质分子,其次是GL和SP。草鱼肉冷藏过程中pH逐渐下降,而硫代巴比妥酸值、游离脂肪酸含量和挥发性盐基总氮逐渐上升。草鱼肉的冷藏货架期在6~9 d之间。长期冷藏会导致草鱼肉脂质谱发生显著变化,而短期冷藏(3~6 d)时,草鱼肉脂质谱与新鲜草鱼肉脂质图谱差异不明显。草鱼肉冷藏过程中主要的差异脂类为GP、GL、SP和FA,其中GP(Cer)及FA(AEA)在冷藏初期(3 d)显著增加,GP是冷藏后期(6~9 d)主要的显著差异脂类。对比新鲜草鱼肉,冷藏9 d草鱼肉中胆碱及溶血磷脂等显著下调。草鱼肉冷藏不同时间丰度前20的脂质存在4种显著差异分子,分别为PE(16:1e/22:6),TG(4:0/18:0/22:5)、PC(18:1/20:3)和TG(18:0/16:0/20:4),可作为冷藏草鱼肉脂质劣变潜在的生物标记物。差异脂质的代谢途径富集分析表明,鞘脂代谢、甘油磷脂代谢参与了整个冷藏期间的脂质代谢,是影响冷藏草鱼脂质谱的重要代谢途径,乙醚脂质代谢、甘油磷酯代谢和甘油酯代谢对冷藏草鱼的脂质谱产生了重要影响。研究旨在揭示草鱼肉在冷藏过程中脂质组成变化,有助于后期更好地阐明草鱼肉冷藏过程中脂质的劣变机制,为冷藏草鱼肉脂质水解/氧化研究提供理论参考。
-
表 1 冷藏草鱼肉中潜在的脂质代谢标记物
Table 1 Potential lipid metabolism markers in refrigerated grass carp muscle
组间 脂质 种类 分组 脂质中文名称 VIP_PLS-DA FC P值 调控 D3_0/con AEA(22:5) FA AEA N-酰基乙醇胺 3.7911 1.2647 5.44 up Cer(d18:0/20:4) SP Cer 神经酰胺 3.2907 1.2191 8.08×10−4 up D6_0/con AEA(22:5) FA AEA N-酰基乙醇胺 3.5417 1.2758 5.52×10−4 up Cer(d18:0/20:4) SP Cer 神经酰胺 3.2592 1.2477 1.27×10−4 up D9_0/con PMe(16:1/18:1) GP PMe 磷脂酰甲醇 4.5274 33.2762 3.97×10−6 up PS(16:1/18:3) GP PS 磷脂酰丝氨酸 3.9043 4.3749 2.01×10−2 up PS(16:1/18:2) GP PS 磷脂酰丝氨酸 3.2654 1.8165 4.53×10−6 up TG(20:4e/18:1/20:4) GL TG 甘油三酯 2.7092 1.4783 8.53×10−4 up PE(20:4e/13:0) GP PE 磷脂酰乙醇胺 2.8693 1.4648 2.51×10−4 up PC(16:1/13:0) GP PC 磷脂酰胆碱 2.8689 1.4645 2.49×10−4 up PEt(14:1e/22:6) GP PEt 磷脂酰乙醇 2.5074 1.4293 9.73×10−4 up PG(16:1/18:2) GP PG 磷脂酰甘油 2.3904 1.3954 1.08×10−4 up PE(16:1/14:0) GP PE 磷脂酰乙醇胺 2.4487 1.387 6.41×10−4 up PG(16:0/16:1) GP PG 磷脂酰甘油 2.4754 1.3742 1.77×10−4 up PE(33:0/18:2) GP PE 磷脂酰乙醇胺 2.4018 1.3622 1.70×10−3 up AEA(22:5) FA AEA N-酰基乙醇胺 2.5429 1.3527 1.06×10−4 up PE(16:0/16:1) GP PE 磷脂酰乙醇胺 2.5853 1.3487 7.89×10−5 up dMePE(16:1/14:0) GP dMePE 二甲基磷脂酰乙醇胺 2.5853 1.3487 7.89×10−5 up PE(16:1/16:1) GP PE 磷脂酰乙醇胺 2.5218 1.3464 6.04×10−5 up PE(16:1/18:1) GP PE 磷脂酰乙醇胺 2.5412 1.3458 3.80×10−4 up Cer(d18:0/20:4) SP Cer 神经酰胺 2.4398 1.3372 8.08×10−6 up Cer(d18:0/18:1) SP Cer 神经酰胺 2.2623 1.3056 4.81×10−5 up TG(18:1e/20:4/22:6) GL TG 甘油三酯 2.0335 1.2994 2.82×10−2 up DLCL(18:4/20:4) GP DLCL 心磷脂 2.065 1.2807 6.51×10−3 up PMe(16:1/16:1) GP PMe 磷脂酰甲醇 2.067 1.2771 1.21×10−3 up PG(16:1/16:1) GP PG 磷脂酰甘油 2.1886 1.2757 1.06×10−5 up PE(14:0e/11:2) GP PE 磷脂酰乙醇胺 2.1587 1.2739 1.34×10−3 up PE(8:1e/8:0) GP PE 磷脂酰乙醇胺 2.182 1.2709 6.25×10−3 up Cer(d18:1/20:4) SP Cer 神经酰胺 2.1564 1.2648 2.06×10−5 up OAHFA(22:5/22:4) FA OAHFA (O-酰基)-1-羟基脂肪酸 2.0164 1.2239 2.21×10−4 up PE(18:1e/24:2) GP PE 磷脂酰乙醇胺 2.033 1.2165 5.68×10−4 up Co(Q9) FA Co 辅酶 2.03 1.2155 5.06×10−4 up LPE(16:1) GP LPE 溶血磷脂酰乙醇胺 1.9021 1.2123 3.42×10−2 up AEA(20:1) FA AEA N-酰基乙醇胺 2.0867 1.2079 1.11×10−7 up PE(16:1/18:2) GP PE 磷脂酰乙醇胺 1.9988 1.2041 6.20×10−5 up PE(16:0/18:3) GP PE 磷脂酰乙醇胺 1.8228 1.2041 2.16×10−3 up MLCL(14:2/15:0/15:0) GP MLCL 心磷脂 1.9567 0.7946 1.41×10−2 down LPC(20:3) GP LPC 溶血磷脂酰胆碱 2.3021 0.7931 4.29×10−2 down MLCL(10:4/18:0/20:4) GP MLCL 心磷脂 2.2275 0.7842 9.14×10−5 down MLCL(14:2/20:1/20:1) GP MLCL 心磷脂 2.1923 0.7836 7.22×10−4 down LdMePE(20:1) GP LdMePE 溶血二甲基磷脂酰乙醇胺 2.088 0.7818 2.06×10−3 down LPI(18:0) GP LPI 溶血磷脂酰肌醇 2.3388 0.7611 2.16×10−4 down LPE(19:0) GP LPE 溶血磷脂酰乙醇胺 2.2728 0.7558 7.92×10−5 down MLCL(14:2/16:0/16:0) GP MLCL 心磷脂 2.5654 0.7533 5.96×10−4 down LPC(17:0) GP LPC 溶血磷脂酰胆碱 2.398 0.7483 5.77×10−4 down MLCL(10:1/15:1/20:3) GP MLCL 心磷脂 2.2225 0.7465 3.73×10−3 down LPC(19:0) GP LPC 溶血磷脂酰胆碱 2.3496 0.7439 8.69×10−4 down LPC(16:0) GP LPC 溶血磷脂酰胆碱 2.6246 0.7409 9.66×10−4 down LPC(20:1) GP LPC 溶血磷脂酰胆碱 2.5234 0.7355 8.10×10−4 down LPE(22:1) GP LPE 溶血磷脂酰乙醇胺 2.3036 0.7346 7.98×10−5 down LPC(17:1) GP LPC 溶血磷脂酰胆碱 2.4618 0.7326 1.25×10−4 down LdMePE(16:0) GP LdMePE 溶血二甲基磷脂酰乙醇胺 2.6012 0.7283 2.10×10−4 down MLCL(18:2/15:0/20:4) GP MLCL 心磷脂 2.4237 0.722 1.28×10−4 down MLCL(10:3/
20:1/22:6)MLCL(10:3/20:1/22:6) GP MLCL 心磷脂 2.3642 0.721 8.96×10−5 down LPE(20:0) GP LPE 溶血磷脂酰乙醇胺 2.4025 0.7118 6.25×10−5 down LPE(22:2) GP LPE 溶血磷脂酰乙醇胺 2.3907 0.7115 9.59×10−5 down MLCL(19:0/15:1/18:1) GP MLCL 心磷脂 2.5042 0.6893 7.65×10−5 down LPE(17:0) GP LPE 溶血磷脂酰乙醇胺 2.6044 0.6806 6.37×10−5 down LPC(22:1) GP LPC 溶血磷脂酰胆碱 4.3586 0.0964 4.50×10−7 down 表 2 草鱼肉冷藏3、6、9 d差异脂质分子KEGG途径富集
Table 2 KEGG pathway enrichment of differential lipid molecules in grass carp chunks after 3, 6, and 9 d of refrigeration
组间 通路_ID 通路描述 一级分类 二级分类 代谢物数目 通路综合重要性得分 P值 D3_0 Vs con map00600html 鞘脂代谢 Metabolism 脂质代谢 2 0.25037 0.01970 map00564html 甘油磷脂代谢 Metabolism 脂质代谢 4 0.08150 0.00073 D6_0 Vs con map00600html 鞘脂代谢 Metabolism 脂质代谢 5 0.25037 0.02450 map00565html 乙醚脂质代谢 Metabolism 脂质代谢 1 0.08150 0.02241 map00564html 甘油磷脂代谢 Metabolism 脂质代谢 16 0.06387 0.00121 map00561html 甘油酯代谢 Metabolism 脂质代谢 1 0.00530 0.03383 map00591html 亚油酸 Metabolism 脂质代谢 4 0 0.01397 map00592html α-亚麻酸代谢 Metabolism 脂质代谢 4 0 0.03177 D9_0 Vs con map00600html 鞘脂代谢 Metabolism 脂质代谢 7 0.25037 0.02450 map00564html 甘油磷脂代谢 Metabolism 脂质代谢 18 0.12023 0.00001 map00565html 乙醚脂质代谢 Metabolism 脂质代谢 1 0.08150 0.02241 map00591html 亚油酸 Metabolism 脂质代谢 7 0 0.01397 map00592html α-亚麻酸代谢 Metabolism 脂质代谢 7 0 0.03177 -
[1] 刘新中, 崔利锋, 王欣太, 等. 《2023中国渔业统计年鉴》[J]. 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会, 2023. [LIU X Z, CUI L F, WANG X T, et al. China Fishery Statistical Yearbook[J]. Fishery and Fishery Administration Bureau of the Ministry of Agriculture and Rural Affairs, National Aquaculture Technology Promotion Station, Chinese Fisheries Society, 2023.] LIU X Z, CUI L F, WANG X T, et al. China Fishery Statistical Yearbook[J]. Fishery and Fishery Administration Bureau of the Ministry of Agriculture and Rural Affairs, National Aquaculture Technology Promotion Station, Chinese Fisheries Society, 2023.
[2] 林森森, 廖明涛, 刘书臣, 等. 鲣鱼4 ℃贮藏期间色素物质及脂质氧化的变化[J]. 中国食品学报,2014,14(7):87−94. [LIN S S, LIAO M T, LIU S C, et al. Changes of pigments and lipid oxidation of Skipjack tuna during 4 oC storage[J]. Journal of Chinese Institute of Food Science and Technology,2014,14(7):87−94.] LIN S S, LIAO M T, LIU S C, et al. Changes of pigments and lipid oxidation of Skipjack tuna during 4 oC storage[J]. Journal of Chinese Institute of Food Science and Technology, 2014, 14(7): 87−94.
[3] JONGBERG S, SKOV S H, TORNGREN M A, et al. Effect of white grape extract and modified atmosphere packaging on lipid and protein oxidation in chill stored beef patties[J]. Food Chemistry, 2011, 128(2):276–283.
[4] CAO Q J, DU H Y, HUANG Y, et al. The inhibitory effect of chlorogenic acid on lipid oxidation of grass carp (Ctenopharyngodon idellus) during chilled storage[J]. Food and Bioprocess Technology,2019,12:2050−2061. doi: 10.1007/s11947-019-02365-0
[5] FU L L, RU Y, HONG Q L, et al. Active packaging coatings based on Agarose caffeate:Preparation, characterisation, and application in grass carp (Ctenopharyngodon idellus) preservation[J]. Food Packaging and Shelf Life,2023,37:101089. doi: 10.1016/j.fpsl.2023.101089
[6] KOZUB A, NIKOLAICHUK H, PRZYKAZA K, et al. Lipidomic characteristics of three edible cold-pressed oils by LC/Q-TOF for simple quality and authenticity assurance[J]. Food Chemistry,2023,415:135761. doi: 10.1016/j.foodchem.2023.135761
[7] LIU Z Q, ZHAO M T, WANG X W, et al. Investigation of oyster Crassostrea gigas lipid profile from three sea areas of China based on non-targeted lipidomics for their geographic region traceability[J]. Food Chemistry,2022,386:132748. doi: 10.1016/j.foodchem.2022.132748
[8] WANG H F, WU Y Y, XIANG H, et al. UHPLC-Q-Exactive Orbitrap MS/MS-based untargeted lipidomics reveals molecular mechanisms and metabolic pathways of lipid changes during golden pomfret (Trachinotus ovatus) fermentation[J]. Food Chemistry,2022,396:133676. doi: 10.1016/j.foodchem.2022.133676
[9] FANG C D, CHEN H S, YAN H B, et al. Investigation of the changes in the lipid profiles in hairtail (Trichiurus haumela) muscle during frozen storage using chemical and LC/MS-based lipidomics analysis[J]. Food Chemistry,2022,390:133140. doi: 10.1016/j.foodchem.2022.133140
[10] CHANG W C W, WU H Y, YEH Y, et al. Untargeted foodomics strategy using high-resolution mass spectrometry reveals potential indicators for fish freshness[J]. Analytica Chimica Acta,2020,1127:98−105. doi: 10.1016/j.aca.2020.06.016
[11] WANG L, ZANG M W, CHENG X Y, et al. Evaluation of changes in the lipid profiles of dried shrimps (Penaeus vannamei) during accelerated storage based on chemical and lipidomics analysis[J]. LWT,2024,191:115564. doi: 10.1016/j.lwt.2023.115564
[12] YU Yuanrui, WANG Guiying, SUN Yuehui, et al. Changes in physicochemical parameters, free fatty acid profile and water-soluble compounds of Yunnan dry-cured beef during processing[J]. Journal of Food Processing and Preservation,2020,44(4):e14380.
[13] LI S L, WANG J Y, LI B B, et al. Exploring the effects of Lactobacillus acidophilus GIM 1. 208 on browning and flavor quality of Paojiao based on nontargeted metabolomics and GC-MS[J]. LWT, 2023, 187:115324.
[14] WANG Y Y, CAI Z C, SANG X H, et al. LC-MS-based lipidomics analyses of alterations in lipid profiles of Asian sea bass (Lates calcarifer) induced by plasma-activated water treatment[J]. Food Research International,2023,177:113866.
[15] HUANG C Y, LI Y, WANG K T, et al. Analysis of lipidomics profile of Carya cathayensis nuts and lipid dynamic changes during embryonic development[J]. Food Chemistry,2022,370:130975. doi: 10.1016/j.foodchem.2021.130975
[16] 刘俊霞, 赵萍, 金晶, 等. 基于气相色谱-离子迁移谱结合化学计量学分析大鲵肉冷藏期间挥发性成分[J]. 食品与发酵工业,2022,48(22):269−278. [LIU J X, ZHAO P, JIN J, et al. Analysis of volatile components in giant salamander meat during cold storage based on gas chromatography-ion mobility spectrometer and chemometrics[J]. Food and Fermentation Industries,2022,48(22):269−278.] LIU J X, ZHAO P, JIN J, et al. Analysis of volatile components in giant salamander meat during cold storage based on gas chromatography-ion mobility spectrometer and chemometrics[J]. Food and Fermentation Industries, 2022, 48(22): 269−278.
[17] GOWDA S G B, MINAMI Y, GOWDA D, et al. Detection and characterization of lipids in eleven species of fish by non-targeted liquid chromatography/mass spectrometry[J]. Food Chemistry,2022,393:133402. doi: 10.1016/j.foodchem.2022.133402
[18] COPEMAN L, SPENCER M, HEINTZ R, et al. Ontogenetic patterns in lipid and fatty acid biomarkers of juvenile polar cod (Boreogadus saida) and saffron cod (Eleginus gracilis) from across the Alaska arctic[J]. Polar Biology,2020,43:1121−1140. doi: 10.1007/s00300-020-02648-9
[19] VORONIN V P, NEMOVA N N, RUOKOLAINEN T R, et al. Into the deep:New data on the lipid and fatty acid profile of redfish Sebastes mentella inhabiting different depths in the Irminger sea[J]. Biomolecules,2021,11(5):704. doi: 10.3390/biom11050704
[20] 姜杨, 李婷婷, 晋高伟, 等. 草鱼冷藏过程中新鲜度的综合评价[J]. 食品科学,2014,35(20):281−285. [JIANG Y, LI T T, JIN G W, et al. Comprehensive freshness evaluation of grass carp (Ctenopharyngodon idellus) during refrigerated storage[J]. Food Science,2014,35(20):281−285.] doi: 10.7506/spkx1002-6630-201420055 JIANG Y, LI T T, JIN G W, et al. Comprehensive freshness evaluation of grass carp (Ctenopharyngodon idellus) during refrigerated storage[J]. Food Science, 2014, 35(20): 281−285. doi: 10.7506/spkx1002-6630-201420055
[21] 黄铃月, 谭亲友. 神经酰胺酶在鞘脂代谢和肿瘤中的作用[J]. 科技视界,2021(34):127−129. [HUANG L Y, TAN Q Y. The role of ceramidase in sphingolipid metabolism and tumor[J]. Science & Technology Vision,2021(34):127−129.] HUANG L Y, TAN Q Y. The role of ceramidase in sphingolipid metabolism and tumor[J]. Science & Technology Vision, 2021(34): 127−129.
[22] FUNK C D. Prostaglandins and leukotrienes:Advances in eicosanoid biology[J]. Science,2001,294(5548):1871−1875. doi: 10.1126/science.294.5548.1871
[23] ZHANG M, SU R, CORAZZIN M, et al. Lipid transformation during postmortem chilled aging in Mongolian sheep using lipidomics[J]. Food Chemistry,2023,405:134882. doi: 10.1016/j.foodchem.2022.134882
[24] WANG Y Y, ZHANG H. Tracking phospholipid profiling of muscle from Ctennopharyngodon idellus during storage by shotgun lipidomics[J]. Journal of Agricultural and Food Chemistry,2011,59(21):11635−11642. doi: 10.1021/jf2030852
[25] CHAO M, DONALDSON E A, WU W, et al. Characterizing membrane phospholipid hydrolysis of pork loins throughout three aging periods[J]. Meat Science,2020,163:108065. doi: 10.1016/j.meatsci.2020.108065
[26] CHEN J, KONG Q, SUN Z T, et al. Freshness analysis based on lipidomics for farmed Atlantic salmon (Salmo salar L.) stored at different times[J]. Food Chemistry,2022,373:131564. doi: 10.1016/j.foodchem.2021.131564
[27] MARIUTTI L R B, BRAGAGNOLO N. Influence of salt on lipid oxidation in meat and seafood products:A review[J]. Food Research International,2017,94:90−100. doi: 10.1016/j.foodres.2017.02.003
[28] CHEN Q S, WANG X C, CONG P X, et al. Mechanism of phospholipid hydrolysis for oyster Crassostrea plicatula phospholipids during storage using shotgun lipidomics[J]. Lipids,2017,52(12):1045−1058. doi: 10.1007/s11745-017-4305-7
[29] WANG J, HUANG X H, ZHANG Y Y, et al. Mechanism of salt effect on flavor formation in lightly-salted large yellow croaker by integrated multiple intelligent sensory and untargeted lipidomics analyses[J]. Food Chemistry,2024,435:137542. doi: 10.1016/j.foodchem.2023.137542





 下载:
下载:


 下载:
下载:



