Nutritional and Flavor Characteristics of Lactobacillus rhamnosus Fermented Goji Berry Juice and Its Antioxidant Activity and in Vitro Inhibition of Xanthine Oxidase Activity
-
摘要: 本文以药食同源的宁夏枸杞干果(Lycium barbarum L.)为原料,利用鼠李糖乳杆菌对其进行发酵,以黄嘌呤氧化酶抑制率为评价指标,通过单因素实验和响应面实验优化发酵工艺,并对发酵枸杞汁的发酵特性、营养和风味特性以及抗氧化活性进行研究。结果表明,鼠李糖乳杆菌发酵枸杞汁的最佳发酵工艺为发酵时间28 h、发酵温度34 ℃、接种量4%,在此条件下,发酵枸杞汁对黄嘌呤氧化酶的抑制率为79.40%,pH为4.44±0.04,活菌数可达9.5±0.005 lg CFU/mL。与未发酵枸杞汁相比,发酵枸杞汁的可溶性蛋白、总酚和总黄酮含量显著降低(P<0.05),总糖含量增加。此外,GC-IMS分析结果表明发酵后枸杞汁有较多醇类物质产生,增加其独有的发酵香气。体外抗氧化活性分析结果表明发酵后枸杞汁的DPPH自由基清除能力显著提高了186.5%(P<0.05)。Abstract: The dried fruit of Ningxia goji berry (Lycium barbarum L.) with the homology of medicine and food was used as raw material, and fermented by Lactobacillus rhamnosus to prepare fermented goji berry juice in this study. The fermentation process was optimized by one-way and response surface experiments using the inhibition rate of xanthine oxidase as the evaluation index. The fermentation characteristics, nutritional and flavor properties, and antioxidant activities of the fermented goji berry juice were investigated. The results showed that the optimal fermentation process for the fermentation of goji berry juice by Lactobacillus rhamnosus was 28 h of fermentation time, 34 ℃ of fermentation temperature and 4% of inoculum. Under these conditions, the inhibition rate of xanthine oxidase by fermented goji berry juice was 79.40%, the pH value of fermented goji berry juice was 4.44±0.04, and the number of viable bacteria could reach 9.5±0.005 lg CFU/mL. Compared with unfermented goji berry juice, the content of soluble protein, total phenols, and total flavonoids in fermented goji berry juice was significantly reduced (P<0.05), while the total sugar content was increased. In addition, the GC-IMS analysis results showed that more alcohol substances were produced in goji berry juice after fermentation, which increased its unique fermentation aroma. The results of in vitro antioxidant activity analysis showed that the DPPH free radical scavenging ability of fermented goji berry juice significantly increased by 186.5% (P<0.05).
-
Keywords:
- goji berry /
- Lactobacillus rhamnosus /
- xanthine oxidase /
- antioxidant capacity /
- flavor substances
-
宁夏枸杞(Lycium barbarum L.)果实中含有丰富的营养物质,主要包括多糖、多肽、生物碱、黄酮类、萜烯类、有机酸、木脂素、酚酰胺、类胡萝卜素等多种化合物,研究表明多糖、黄酮类、有机酸等有修复肠道屏障、抗炎、抗氧化、调节肠道菌群等功能[1]。然而,目前枸杞加工产业中存在产品同质化严重、附加产值低、精深加工程度不高等问题,导致枸杞加工产品市场竞争力不足。因此,亟需研发提高枸杞产品竞争力的加工方法和策略。
益生菌发酵技术能够丰富生物活性化合物,从而推动发酵过程产生具有抗氧化、抗炎和抗肿瘤特性的功能性产物[2]。此外,益生菌发酵有利于食物基质中小分子物质及营养物质的释放[3]。Xie等[4]研究了植物乳杆菌发酵枸杞汁理化特性及代谢产物的变化,结果表明,枸杞汁经植物乳杆菌发酵后总酚、总黄酮和抗氧化活性显著增加。发酵改变了枸杞汁的代谢物谱,并增加了枸杞汁中生物活性物质的水平。Liu等[5]研究了鼠李糖乳杆菌、植物乳杆菌和乳酸杆菌多菌种在枸杞汁中的发酵能力和抗氧化能力,发现发酵提高了枸杞汁中乳酸、蛋白质、挥发性化合物和酚类物质的含量,果汁中酚酸和黄酮类化合物的转化受发酵影响,显著提高了抗氧化能力。这些研究提供了益生菌发酵枸杞汁对挥发性化合物和酚类物质的影响。
黄嘌呤氧化酶(Xanthine oxidase,XOD)是调控尿酸生成的关键酶。血液中尿酸含量增加会导致高尿酸血症(Hyperuricemia,HUA)[6]。目前,药物治疗是高尿酸血症的一种主要治疗策略[7],但常用小分子药物治疗会产生副作用[8],如非布司他可能会引起肾脏的损伤。植物天然产物中蕴含着大量具有XOD抑制活性的组分和结构的单体化合物,如多糖类和有机酸类化合物等均能较好地抑制XOD活性,同时具有降血糖、抗炎、抗氧化和抗肿瘤等作用[9]。李小欢等[10]研究发现桑黄发酵产物多糖可能通过降低体内肝脏XOD的活性从而控制尿酸的升高。姚江奇[11]制备了一种口感独特且能够抑制尿酸升高的功能性精酿啤酒,发现添加蒲公英提高了啤酒的抗氧化活性和体外XOD抑制活性。孙丽君[12]研究了葡萄蒸馏酒中微量成分对黄嘌呤氧化酶的抑制作用,通过高效液相色谱法体外筛选出苯乙酸乙酯、2,4-二叔丁基苯酚和壬酸乙酯对黄嘌呤氧化酶具有一定的抑制作用。因此,针对高尿酸血症的缓解作用,研发更天然、更有效、更安全的功能健康产品具有重要意义。枸杞中富含大量的活性成分如多糖、多酚和黄酮类物质,可能在一定程度上具有对黄嘌呤氧化酶的抑制作用,然而利用益生菌发酵技术制备发酵枸杞汁是否会增加对黄嘌呤氧化酶的抑制作用,目前相关研究较少。
本研究以宁夏枸杞干果为原料,以黄嘌呤氧化酶抑制率为评价指标,通过单因素实验和响应面试验优化鼠李糖乳杆菌发酵枸杞汁的最佳工艺,并对发酵枸杞汁的发酵特性、营养特性、风味物质和体外抗氧化活性进行研究,为高附加值和功能靶向明确的枸杞健康产品研发提供理论支撑。
1. 材料与方法
1.1 材料与仪器
鼠李糖乳杆菌(Lactobacillus rhamnosus CICC6161) 本实验室前期保存菌种;枸杞干果品种为宁杞10号 由宁夏中宁枸杞产业创新研究院有限公司提供;MRS肉汤培养基、MRS固体培养基 青岛高科技工业园海博生物技术有限公司;尿酸对照品、别嘌呤醇、黄嘌呤、黄嘌呤氧化酶(0.5 U/mg)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picryl-hydrazyl radical,DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonicacid),ABTS]、考马斯亮蓝、牛血清蛋白 北京索莱宝科技有限公司;芦丁、抗坏血酸、异抗坏血酸钠、果胶酶(5000 U/g)、没食子酸 上海源叶生物科技有限公司;无水乙醇、水杨酸、过氧化氢、硫酸亚铁、硝酸铝、硝酸钠、福林酚、苯酚、硫酸、葡萄糖均为国产分析纯 天津市大茂化学试剂公司。
BSP-250型生化培养箱、HHS21-8数显恒温水浴锅 上海博讯实业有限公司医疗设备厂;SW-CJ-2D型双人单面(垂直)净化工作台 江苏通净净化设备有限公司;BioTek Epoch 2型微孔板分光光度计 安捷伦科技有限公司;TD-45型数显糖度计 浙江托普云农科技股份有限公司;PHSJ-3F型pH计 上海雷磁传感器科技有限公司;L18-Y66型九阳榨汁机 九阳股份有限公司;Essentia LC-16型高效液相色谱仪 日本岛津公司;FlavourSpec®气相离子迁移谱、VOCal数据处理软件(0.4.03) 德国G.A.S.Dortmund公司;CTC-PAL型静态顶空自动进样装置 瑞士CTC Analytics AG公司。
1.2 实验方法
1.2.1 原料预处理
1.2.1.1 菌种的活化
参考刘巧玲[13]的方法,将储存在−80 ℃冰箱内的鼠李糖乳杆菌室温解冻后,以2%的接种量(v/v)接入已冷却至室温的10 mL MRS肉汤培养基中活化两代,培养13 h后经8000 r/min、4 ℃离心10 min,菌体沉淀经生理盐水洗涤2次,调整菌体浓度约为7 lg CFU/mL备用。
1.2.1.2 枸杞汁的制备及发酵工艺
挑选粒大且色泽饱满的枸杞干果,用自来水清洗枸杞表皮。室温晾干后以无菌蒸馏水与枸杞干果的质量比为5:1(g/g)加水,并加入0.05%的异抗坏血酸钠进行护色,浸泡9~10 h后加入0.15%的果胶酶,打浆,之后用4层无菌纱布过滤除去残渣,添加适量柠檬酸缓冲液调整pH约为6.0,分装于玻璃瓶中。采用巴氏杀菌法(65 ℃,30 min)进行杀菌[14]。冷却后,将菌液以5%的接种量(v/v)接种到枸杞汁中,在37 ℃下进行发酵。未接种菌液的枸杞汁作为未发酵枸杞汁。
1.2.2 单因素实验设计
1.2.2.1 发酵时间的确定
在鼠李糖乳杆菌接种量为5%、发酵温度为37 ℃的条件下,考察发酵时间20、24、28、32、36 h对黄嘌呤氧化酶抑制率的影响。
1.2.2.2 发酵温度的确定
在鼠李糖乳杆菌接种量为5%、发酵时间为28 h的条件下,考察发酵温度31、34、37、40、43 ℃对黄嘌呤氧化酶抑制率的影响。
1.2.2.3 鼠李糖乳杆菌接种量的确定
在发酵时间为28 h、发酵温度为37 ℃的条件下,考察鼠李糖乳杆菌接种量3%、4%、5%、6%、7%对黄嘌呤氧化酶抑制率的影响[15]。
1.2.3 响应面试验设计
在单因素实验结果基础上,以发酵枸杞汁的黄嘌呤氧化酶抑制活性为评价指标,利用响应面试验考察发酵时间、发酵温度、接种量3个因素对枸杞汁发酵工艺条件的综合影响。根据Box-Behnken试验设计,采用Design Expert 13软件对枸杞汁的发酵条件进行优化。试验因素水平及其编码见表1。
表 1 Box-Behnken试验设计的因素水平Table 1. Factors and levels for Box-Behnken experimental design水平 A 发酵时间(h) B 发酵温度(℃) C 发酵接种量(%) −1 26 31 3 0 28 34 4 1 30 37 5 1.2.4 发酵枸杞汁的黄嘌呤氧化酶抑制活性测定
利用高效液相色谱法测定其黄嘌呤氧化酶抑制率[16]。将50 µL枸杞汁样品和50 µL黄嘌呤氧化酶工作液(0.05 U/mL)在25 ℃下保持10 min后,加入150 µL黄嘌呤溶液(1 mmol/L)启动酶促反应。之后在25 ℃下反应30 min,加入100 µL 1 mol/L HCl溶液终止反应。随后将反应液混匀,用超纯水稀释10倍,经微孔尼龙滤膜(0.22 µm)过滤后上机测定。
色谱条件:流动相为pH为7.4的0.02 mol/L磷酸盐缓冲溶液与1%甲醇溶液,等梯度洗脱10 min,流速设定为1.0 mL/min,检测波长设为290 nm,柱温为室温,进样量20 µL,计算XOD抑制活性,公式如下所示。
XOD抑制率(%)=(阴性对照酶促反应实验中尿酸峰面积−样品酶促反应实验中尿酸峰面积)/阴性对照酶促反应实验中尿酸峰面积×100 式中:阴性对照为磷酸缓冲溶液代替枸杞汁样品进行酶促反应。
1.2.5 活菌数的测定
参考GB 4789.2-2022《食品安全国家标准 食品微生物学检验 菌落总数测定》进行样品活菌数测定。
1.2.6 pH的测定
利用pH计测定样品的pH。
1.2.7 可溶性固形物含量的测定
利用糖度计测定样品中可溶性固形物含量。
1.2.8 可溶性蛋白含量的测定
参照黄宁馨[17]的方法测定样品中可溶性蛋白含量。
1.2.9 总酚含量的测定
采用福林酚法测定样品中总酚含量[18]。
1.2.10 总黄酮含量的测定
参考冯琳[19]的方法测定样品中总黄酮含量。稍作修改,用10 µL芦丁溶液作为标准品,分别加入30 µL 10%硝酸铝溶液,30 µL 5%硝酸钠溶液反应6 min后加入200 µL 1 mol/L NaOH反应15 min。用酶标仪在510 nm处测定反应混合物的吸光度。芦丁标准曲线:y=0.3347x+0.0553(R2=0.9937)。结果以每毫升样品的毫克芦丁当量(RE)表示。
1.2.11 总糖含量的测定
采用苯酚-硫酸法测定样品中总糖含量[20]。
1.2.12 风味物质测定
参考Wang等[21]的方法测定样品的挥发性成分,将大约3 mL的枸杞汁加入到顶空玻璃取样瓶中。样品在50 ℃下孵育15 min后,将500 µL的样品顶空自动注入GC-IMS仪器,每个样品测定3组平行。进样口温度:85 ℃,载气:高纯氮气(纯度≥99.999%),色谱柱温度:60 ℃。程序升压:初始流量2 mL/min保持2 min,在8 min内线性增至10 mL/min,在10 min内线性增至100.00 mL/min,在20 min内增至130.00 mL/min。风味分析使用VOCal分析谱图,并通过气相色谱保留指数和离子迁移时间对挥发性化合物进行定性分析。
1.2.13 DPPH自由基清除率的测定
参考Szydłowska-Czerniak等[22]方法测定样品的DPPH自由基清除能力,并稍作修改。将DPPH粉末配成浓度为0.2 mmol/L DPPH无水乙醇溶液,与枸杞汁样品1:1混匀后于室温下避光反应30 min。517 nm处测定吸光度值。每组样品平行测定3次取平均值。DPPH自由基清除率按公式计算如下:
DPPH自由基清除率(%)=(1−A1−A2A0)×100 式中:A1表示样品溶液吸光度值;A2表示样品与无水乙醇混合反应测得的吸光度值;A0表示无水乙醇与DPPH工作液混合反应测得的吸光度值。
1.2.14 ABTS+自由基清除率的测定
参考高庆超等[23]方法测定样品的ABTS+自由基清除能力,并稍作修改。用7.4 mmol/L的ABTS水溶液和2.6 mmol/L的K2S2O8水溶液等体积混合配制ABTS工作液。混合均匀后静置暗处12 h,用无水乙醇稀释至0.7±0.02吸光度,在734 nm处测定ABTS稀释液与样品混合的混合液的吸光值,记为A,用无水乙醇代替样品测定吸光度值,记为A0。每组样品平行测定3次取平均值。ABTS+自由基清除能力计算公式如下:
ABTS+自由基清除率(%)=(1−AA0)×100 式中:A表示样品混合的混合液的吸光值;A0表示样品空白组吸光度值。
1.2.15 羟基自由基清除率的测定
参考Arise等[24]的方法测定样品的羟基自由基清除能力。将样品(1 mL)加入1 mL水杨酸溶液(9 mmol/L)中。混合后,分别加入硫酸亚铁溶液(9 mmol/L,1 mL)和1 mL(30%,v/v)过氧化氢溶液。然后,在37 ℃孵育30 min后,在510 nm处读取混合物的吸光度。羟基自由基清除率计算公式如下:
羟基自由基清除率(%)=(1−A1−A2A0)×100 式中:A1表示样品溶液吸光度值;A2表示样品对照组(蒸馏水代替过氧化氢溶液)吸光度值;A0表示空白对照组(蒸馏水代替样品)吸光度值。
1.3 数据处理
所有实验均重复3次,实验结果以平均值±标准差表示。利用SPSS 27统计分析实验数据,利用OriginPro 2024进行绘图。不同处理间比较采用单因素方差分析,多重比较采用Duncan法,当P<0.05时,判定为显著性差异,P<0.01,判定为极显著差异。
2. 结果与分析
2.1 单因素实验结果分析
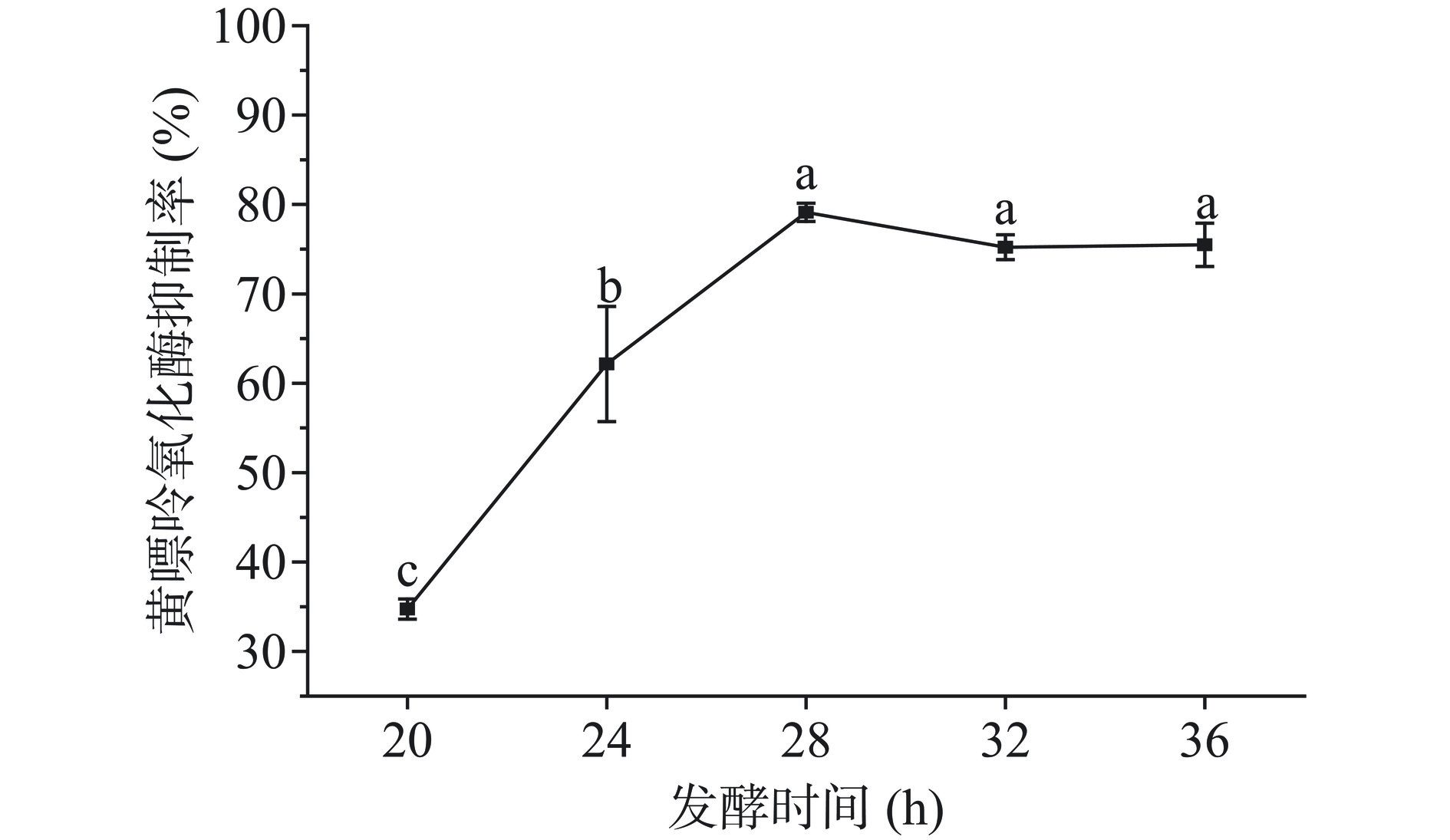
2.1.1 发酵时间对枸杞汁黄嘌呤氧化酶抑制率的影响
由图1可知,随着发酵时间增加,发酵枸杞汁的黄嘌呤氧化酶抑制率出现迅速上升后又趋于平缓的趋势,当发酵时间为28 h时,黄嘌呤氧化酶抑制率显著增加(P<0.05),达到最大值,为79.10%。当发酵时间继续增加时,抑制率降低但趋于稳定。可能因为益生菌发酵在代谢过程中可促进底物基质中相关物质的转化与生成,降低或增加原有物质含量或产生新的化合物,已有研究表明,益生菌发酵产生的阿魏酸、咖啡酸等酚酸类物质[25]可显著抑制黄嘌呤氧化酶的活性[26]。
2.1.2 发酵温度对枸杞汁黄嘌呤氧化酶抑制率的影响
从图2中可知,随着发酵温度升高,发酵枸杞汁的黄嘌呤氧化酶抑制率呈现出先升高后降低的趋势。当温度为34 ℃时,黄嘌呤氧化酶的抑制活性达到最高,为73.78%,当发酵温度继续升高直至37 ℃时,其抑制活性略有下降但未表现出明显差异。之后随着发酵温度的继续升高,其抑制活性有所降低。这可能与鼠李糖乳杆菌的最适生长温度有关[27],乳酸菌的生长受环境中温度影响较大,不同乳酸菌其最适生长温度存在一定差异。温度过低或过高时会影响发酵枸杞汁的品质。
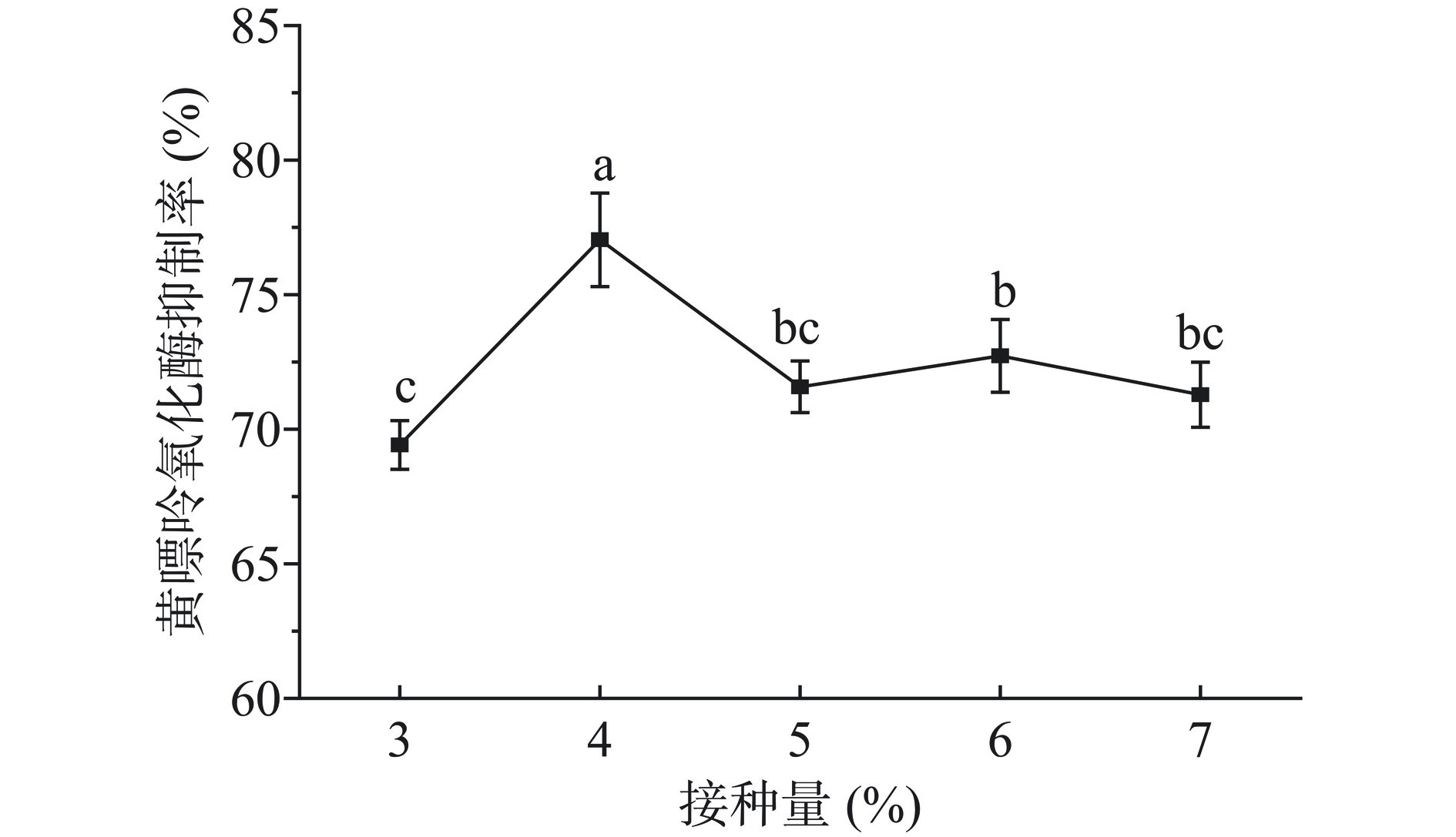
2.1.3 接种量对枸杞汁黄嘌呤氧化酶抑制率的影响
由图3可知,随着接种量的增加,发酵枸杞汁的黄嘌呤氧化酶抑制率呈现先迅速增加后又显著下降的趋势(P<0.05)。当接种量为4%时,其黄嘌呤氧化酶抑制活性达到最高值为77.00%。接种量过低会降低发酵速度,使得发酵时间延长。从图3中可以看出,接种量为5%~7%时,对黄嘌呤氧化酶的抑制活性影响无显著性差异(P>0.05)。接种量过大,果汁中的乳酸菌可能超过可容纳最适值,加速乳酸菌死亡,而导致感官特性下降[28]。
2.2 响应面试验结果分析
根据Box-Behnken设计原理进行响应面优化试验,以发酵时间、发酵温度、接种量三个因素为自变量,以黄嘌呤氧化酶抑制率为响应值,试验方案及结果见表2。
表 2 响应面试验设计与结果Table 2. Response surface experimental design and results试验号 A B C 黄嘌呤氧化酶抑制率(%) 1 −1 −1 0 70.44 2 1 −1 0 72.48 3 −1 1 0 70.84 4 1 1 0 73.63 5 −1 0 −1 72.16 6 1 0 −1 72.67 7 −1 0 1 72.55 8 1 0 1 74.56 9 0 −1 −1 74.21 10 0 1 −1 73.15 11 0 −1 1 73.17 12 0 1 1 75.64 13 0 0 0 79.91 14 0 0 0 78.73 15 0 0 0 78.43 16 0 0 0 78.88 17 0 0 0 79.27 采用 Design−Expert13 对黄嘌呤氧化酶抑制率结果进行拟合,得到回归方程如下:Y=79.04+0.9185A+0.3711B+0.4652C+0.1887AB+0.3754AC+0.8815BC−4.13A2−3.07B2−1.93C2。
方差分析结果见表3。由表3可知,该模型F值为58.16(P<0.0001),具有统计学意义,失拟项不显著(P=0.5685>0.05),证明该模型是合适的。决定系数R2=0.9868,校正决定系数R2Adj=0.9698,表明该方程拟合程度较好,利用该模型预测确定最佳工艺条件是可行的。回归模型中一次项A对结果有极显著影响(P<0.01),一次项C和交互项BC对结果有显著影响(P<0.05),二次项A2、B2、C2对结果具有极显著影响(P<0.01),根据F值大小可反映出各因素对响应值的贡献率为A>C>B,即发酵时间>接种量>发酵温度。
表 3 回归模型的方差分析Table 3. ANOVA of the regression model来源 平方和 自由度 均方 F值 P值 显著性 模型 153.72 9 17.08 58.16 <0.0001 ** A 6.75 1 6.75 22.98 0.002 ** B 1.1 1 1.1 3.75 0.094 C 1.73 1 1.73 5.89 0.0456 * AB 0.1424 1 0.1424 0.4849 0.5087 AC 0.5636 1 0.5636 1.92 0.2085 BC 3.11 1 3.11 10.58 0.014 * A² 71.68 1 71.68 244.06 <0.0001 ** B² 39.67 1 39.67 135.07 <0.0001 ** C² 15.72 1 15.72 53.54 0.0002 ** 残差 2.06 7 0.2937 失拟项 0.7517 3 0.2506 0.7685 0.5685 不显著 净误差 1.3 4 0.326 总和 155.77 16 注:**:对实验结果有极显著影响(P<0.01);*:对实验结果有显著性影响(P<0.05)。 图4是根据回归方程绘出的响应面和等高线图,显示了各因素相互作用发酵枸杞汁对黄嘌呤氧化酶抑制活性的影响。响应面的坡度可以表示各因素对黄嘌呤氧化酶抑制率的影响大小,坡度越陡峭表示影响越大。交互作用的强弱可由等高线的形状体现,椭圆表示交互作用显著,越接近圆形表明越不显著。由图4中的f图可以看出,发酵温度与发酵接种量之间的等高线图呈椭圆形,因此对黄嘌呤氧化酶的抑制活性影响显著。由图4中a和c的响应面图可知,随发酵时间增加黄嘌呤氧化酶抑制率呈明显增加而后下降的趋势,表明发酵时间对黄嘌呤氧化酶抑制率的影响明显高于其他因素,但发酵时间与其余各因素交互作用不显著(PAB>0.05、PAC>0.05)。这与表3中结果一致。
2.3 发酵枸杞汁最佳工艺条件的预测及验证
利用Design Expert 13预测发酵最佳工艺条件为发酵时间28.24 h,发酵温度34.26 ℃,接种量4.15%,预测黄嘌呤氧化酶抑制率为79.15%,为了便于实践操作,对优化条件的参数取整后得到发酵时间28 h,发酵温度34 ℃,接种量4%。以此条件发酵枸杞汁进行验证,得到实际黄嘌呤氧化酶抑制率约为79.40%。发酵枸杞汁实际测定值与预测值接近,表明优化得到的工艺条件是可靠的。
2.4 发酵枸杞汁的发酵特性分析
在鼠李糖乳杆菌发酵时间为28 h,发酵温度34 ℃和接种量为4%的工艺条件下制备发酵枸杞汁。与未发酵枸杞汁相比,由图5可知,发酵后枸杞汁的pH显著降低(P<0.05),可能是因为在发酵液中营养物质充足,菌体大量繁殖,在发酵过程中产生了醋酸和乳酸等代谢物[29]。有机酸在溶液中会解离出氢离子,使发酵后的pH降低,有助于抑制腐败微生物[30]。
乳酸菌的存活是其发挥益生作用的重要前提[31]。图5中显示枸杞汁发酵后,其活菌数能够达到9.5 lg CFU/mL(P<0.05),表明枸杞汁中含有的糖类、氨基酸等营养成分可满足鼠李糖乳杆菌的基本生长需求。
2.5 发酵枸杞汁的营养特性分析
发酵果汁能最大限度地保留水果的营养成分,且发酵过程会产生较多的营养物质。微生物的代谢作用会使果汁中的酚类含量、酶系组成等发生变化[32]。由表4可知,发酵前与发酵后其可溶性固形物含量变化无明显差异,这与邓诗源等[33]研究益生菌发酵火龙果饮料中可溶性固形物含量的变化结果相一致,表明发酵后的果汁可溶性固形物保存良好。由表4可知,发酵后枸杞汁中可溶性蛋白含量显著降低(P<0.05),这与王越等[34]研究结果一致,可能是因为菌种在发酵的过程中消耗了样品中的蛋白质来满足自身生存需要。吴彩云等[35]研究发现益生菌在发酵过程中可降解蛋白质形成生物活性肽。此外,郄雪娇等[36]研究指出食品中多酚类物质可能与食品中的蛋白质发生反应,使得蛋白质被消耗导致含量降低,从而影响其生物利用性。这可能也是本研究中发酵枸杞汁中可溶性蛋白含量降低的原因之一。
表 4 发酵枸杞汁的营养特性Table 4. Nutritional characteristics of fermented goji berry juice样品 可溶性固形物含量
(%)可溶性蛋白含量
(mg/mL)总酚
(mg/mL)总糖
(mg/mL)总黄酮
(mg/mL)未发酵枸杞汁 10.80±0.000a 0.11±0.004a 0.04±0.001a 0.21±0.007a 0.82±0.113a 发酵枸杞汁 10.83±0.057a 0.06±0.007b 0.03±0.002b 0.22±0.008a 0.33±0.006b 注:同列不同小写字母表示差异显著,P<0.05。 另外,由表4可知,与未发酵枸杞汁相比,发酵枸杞汁的总酚与总黄酮含量显著降低(P<0.05),这与Zhou等[37]的研究结果一致,其发现发酵后荔枝汁中总酚和总黄酮含量均有不同程度降低,可能是由于益生菌利用荔枝汁中的营养物质参与其降解代谢途径,使得活性化合物可以生物转化为其他代谢物或合成新化合物,造成了总酚和黄酮等成分的动态变化。易媛等[38]研究指出总酚含量的降低可能是由于酚类化合物与固形物、蛋白质结合或吸附,导致了酚类化合物含量的下降。发酵后枸杞汁中总黄酮物质含量的降低与周颖等[39]研究结果类似,这可能是枸杞汁中黄酮类化合物与葡萄糖反应生成了黄酮苷,使得发酵后总黄酮含量降低。发酵后枸杞汁中总糖含量增加,但没有明显差异。
2.6 发酵枸杞汁的风味物质分析
图6显示了发酵与未发酵枸杞汁样品在风味物质上的差异。与未发酵枸杞汁对比,发酵枸杞汁风味物质相对差异较大。图6a显示了未发酵与发酵样品挥发性物质谱图,图中以蓝色为背景,横坐标和纵坐标分别代表样品中物质分离时相对于反应离子峰(RIP)的漂移时间(ms)和气相保留时间(s),横坐标1.0处竖线为RIP峰,RIP峰两侧的斑点代表物质,斑点的有无和颜色的深浅表示物质的积累和分解程度,颜色由白色到红色表示浓度由低到高[40]。根据斑点变化可知样品在离子峰的位置、数量、强度和时间上均有差异。说明样品在挥发性物质组成上存在明显差异,鼠李糖乳杆菌发酵枸杞汁对风味物质产生显著影响。
由图6b可以看出,从样品中共分离出24种挥发性物质。根据特征性物质的保留时间和迁移时间,包括酮类(7种)、醇类(3种)、醛类(7种)、酯类(2种)、吡嗪类(2种)及其他类(戊环、呋喃类等3种)。比较发酵前后枸杞汁的二维谱图,从图中发酵前后的枸杞汁样品的颜色深浅可以看出未发酵与发酵样品中挥发性风味物质种类及浓度存在显著差异。
图中A区域为未发酵样品的特征峰区域,包括2-甲基-3-甲硫基吡嗪、戊醛(二聚体)、2-甲基-3-甲硫基吡嗪二聚体、己醛(二聚体)、庚醛、戊醛、2-戊基呋喃、己醛、2-甲基丙烯醛、6-甲基-5-庚烯-2-酮、乙酸对甲基苄酯、2,3-丁二醇、乙酸对甲基苄酯(二聚体)、2,3-戊二酮(二聚体)、2,3-戊二酮。图中B区域为发酵样品的特征峰区域,包括2-丁酮、4-甲基戊醇、3-羟基-2-酮、正丁醛、2,4-二甲基-1,3-二氧戊环、2,3-丁二酮、2,3-丁二酮、2-正戊基呋喃、2-丁醇。发酵后枸杞汁可产生新的挥发性物质,如4-甲基戊醇、2-丁醇。未发酵样品中未见醇类物质出现,同时发酵后酮类物质含量也明显增加,醛类物质含量显著降低。发酵后醇类物质的增加,赋予了枸杞汁特有的发酵香味,醇类物质一般是乳酸菌通过氨基酸代谢产生的[41]。发酵后醛类物质明显减少,高浓度的醛酮类物质会带来异味,并且在微生物作用下是不稳定的化合物,可见乳酸菌发酵可以平衡化合物的含量,对于改善枸杞汁的风味起到重要作用。
2.7 发酵枸杞汁的抗氧化活性分析
由图7可知,与未发酵枸杞汁对比,发酵枸杞汁的DPPH自由基清除能力大幅增加,其清除能力增加了186.5%(P<0.05),这与Li等[42]的研究结果一致。这可能因为发酵可使枸杞汁中的活性成分更好地溶出,发酵产生的酚类化合物有利于提高DPPH的自由基清除活性。然而与发酵前相比,发酵枸杞汁的ABTS+自由基与羟基自由基清除能力显著降低(P<0.05),分别降低了8.6%和12.4%。Wu等[43]在发酵蓝莓和黑莓果汁中研究发现,果汁在发酵后具有较强抗氧化能力的花青素类物质含量降低,酚酸类物质含量增加,但这些酚酸的抗氧化活性弱且含量低,导致ABTS+等自由基清除活性发生微小变化。枸杞汁在发酵过程中的生物活性成分及代谢产物会发生变化,产生的活性成分抗氧化活性弱或含量降低,这可能是ABTS+自由基和羟基自由基清除能力降低的原因。
3. 结论
本研究以药食同源的宁夏枸杞干果为原料,利用鼠李糖乳杆菌对其进行发酵,以黄嘌呤氧化酶抑制率为评价指标,通过单因素实验和响应面试验优化发酵工艺,研究得出鼠李糖乳杆菌发酵枸杞汁的最佳发酵工艺为发酵时间28 h、发酵温度34 ℃、接种量4%,在最佳发酵工艺条件下,发酵枸杞汁对黄嘌呤氧化酶抑制率为79.40%,pH为4.44±0.04,活菌数可达9.5±0.005 lg CFU/mL。与未发酵枸杞汁相比,发酵枸杞汁的可溶性蛋白、总酚和总黄酮含量显著降低(P<0.05),总糖含量增加。此外,GC-IMS分析结果表明发酵后枸杞汁有较多醇类物质产生,增加其独有的发酵香气。体外抗氧化能力分析结果表明发酵后枸杞汁的DPPH自由基清除能力显著提高186.5%(P<0.05)。这些研究结果可为发酵枸杞汁作为功能性食品开发提供理论依据。
-
表 1 Box-Behnken试验设计的因素水平
Table 1 Factors and levels for Box-Behnken experimental design
水平 A 发酵时间(h) B 发酵温度(℃) C 发酵接种量(%) −1 26 31 3 0 28 34 4 1 30 37 5 表 2 响应面试验设计与结果
Table 2 Response surface experimental design and results
试验号 A B C 黄嘌呤氧化酶抑制率(%) 1 −1 −1 0 70.44 2 1 −1 0 72.48 3 −1 1 0 70.84 4 1 1 0 73.63 5 −1 0 −1 72.16 6 1 0 −1 72.67 7 −1 0 1 72.55 8 1 0 1 74.56 9 0 −1 −1 74.21 10 0 1 −1 73.15 11 0 −1 1 73.17 12 0 1 1 75.64 13 0 0 0 79.91 14 0 0 0 78.73 15 0 0 0 78.43 16 0 0 0 78.88 17 0 0 0 79.27 表 3 回归模型的方差分析
Table 3 ANOVA of the regression model
来源 平方和 自由度 均方 F值 P值 显著性 模型 153.72 9 17.08 58.16 <0.0001 ** A 6.75 1 6.75 22.98 0.002 ** B 1.1 1 1.1 3.75 0.094 C 1.73 1 1.73 5.89 0.0456 * AB 0.1424 1 0.1424 0.4849 0.5087 AC 0.5636 1 0.5636 1.92 0.2085 BC 3.11 1 3.11 10.58 0.014 * A² 71.68 1 71.68 244.06 <0.0001 ** B² 39.67 1 39.67 135.07 <0.0001 ** C² 15.72 1 15.72 53.54 0.0002 ** 残差 2.06 7 0.2937 失拟项 0.7517 3 0.2506 0.7685 0.5685 不显著 净误差 1.3 4 0.326 总和 155.77 16 注:**:对实验结果有极显著影响(P<0.01);*:对实验结果有显著性影响(P<0.05)。 表 4 发酵枸杞汁的营养特性
Table 4 Nutritional characteristics of fermented goji berry juice
样品 可溶性固形物含量
(%)可溶性蛋白含量
(mg/mL)总酚
(mg/mL)总糖
(mg/mL)总黄酮
(mg/mL)未发酵枸杞汁 10.80±0.000a 0.11±0.004a 0.04±0.001a 0.21±0.007a 0.82±0.113a 发酵枸杞汁 10.83±0.057a 0.06±0.007b 0.03±0.002b 0.22±0.008a 0.33±0.006b 注:同列不同小写字母表示差异显著,P<0.05。 -
[1] 李旭阳, 刘慧燕, 潘琳, 等. 宁夏自然发酵泡菜中乳酸菌的分离鉴定及其在枸杞汁发酵中的应用[J]. 食品工业科技,2021,42(23):126−134. [LI X Y, LIU H Y, PAN L, et al. Isolation and identification of lactic acid bacteria from naturally fermented pickles from Ningxia and its application in goji berry juice fermentation[J]. Science and Technology of Food Industry,2021,42(23):126−134.] LI X Y, LIU H Y, PAN L, et al. Isolation and identification of lactic acid bacteria from naturally fermented pickles from Ningxia and its application in goji berry juice fermentation[J]. Science and Technology of Food Industry, 2021, 42(23): 126−134.
[2] LI L, WANG L, FAN W, et al. The application of fermentation technology in traditional Chinese medicine:A review[J]. The American Journal of Chinese Medicine,2020,48(4):899−921. doi: 10.1142/S0192415X20500433
[3] WANG M, OUYANG X, LIU Y, et al. Comparison of nutrients and microbial density in goji berry juice during lactic acid fermentation using four lactic acid bacteria strains[J]. Journal of Food Processing and Preservation,2021,45(1):e15059.
[4] XIE H, GAO P, LU Z M, et al. Changes in physicochemical characteristics and metabolites in the fermentation of goji juice by Lactiplantibacillus plantarum[J]. Food Bioscience,2023,54:102881. doi: 10.1016/j.fbio.2023.102881
[5] LIU Y, CHENG H, LIU H, et al. Fermentation by multiple bacterial strains improves the production of bioactive compounds and antioxidant activity of goji juice[J]. Molecules,2019,24(19):3519. doi: 10.3390/molecules24193519
[6] 张瑛毓, 普布多吉, 卢聪, 等. 基于黄嘌呤氧化酶活性抑制和斑马鱼高尿酸血症模型的降尿酸功效食药材筛选[J]. 食品工业科技,2021,42(12):334−339. [ZHANG Y Y, PUBU D J, LU C, et al. Screening of uric acid-lowering food and medicinal materials based on inhibiting xanthine oxidase activity and zebrafish hyperuricemia model[J]. Science and Technology of Food Industry,2021,42(12):334−339.] ZHANG Y Y, PUBU D J, LU C, et al. Screening of uric acid-lowering food and medicinal materials based on inhibiting xanthine oxidase activity and zebrafish hyperuricemia model[J]. Science and Technology of Food Industry, 2021, 42(12): 334−339.
[7] 赵克芳, 肖阳, 邢东旭, 等. 桑黄游离酚提取物体外降尿酸活性研究[J]. 食品与发酵工业,2024,50(10):119−126. [ZHAO K F, XIAO Y, XING D X, et al. Study on uric acid-lowering activity of Sanghuangporus sanghuang[J]. Food and Fermentation Industries,2024,50(10):119−126.] ZHAO K F, XIAO Y, XING D X, et al. Study on uric acid-lowering activity of Sanghuangporus sanghuang[J]. Food and Fermentation Industries, 2024, 50(10): 119−126.
[8] WANG R, LIN F, YE C, et al. Multi-omics analysis reveals therapeutic effects of bacillus subtilis-fermented Astragalus membranaceus in hyperuricemia via modulation of gut microbiota[J]. Food Chemistry,2023,399:133993. doi: 10.1016/j.foodchem.2022.133993
[9] 姜楠, 张晓琳, 田金英, 等. 具有黄嘌呤氧化酶抑制作用的天然产物之研究进展[J]. 药学学报,2021,56(5):1229−1237. [JANG N, ZHANG X L, TIAN J Y, et al. Recent studies on the natural products with xanthine oxidase inhibitory effect[J]. Acta Pharmaceutica Sinica,2021,56(5):1229−1237.] JANG N, ZHANG X L, TIAN J Y, et al. Recent studies on the natural products with xanthine oxidase inhibitory effect[J]. Acta Pharmaceutica Sinica, 2021, 56(5): 1229−1237.
[10] 李小欢, 步洪石, 王佳, 等. 桑黄发酵产物多糖对高尿酸血症小鼠的治疗作用[J]. 中成药,2023,45(7):2368−2373. [LI X H, BU H S, WANG J, et al. Therapeutic effects of polysaccharides from fermentation products of Sanghuang on hyperuricemic mice[J]. Chinese Traditional Patent Medicine,2023,45(7):2368−2373.] doi: 10.3969/j.issn.1001-1528.2023.07.045 LI X H, BU H S, WANG J, et al. Therapeutic effects of polysaccharides from fermentation products of Sanghuang on hyperuricemic mice[J]. Chinese Traditional Patent Medicine, 2023, 45(7): 2368−2373. doi: 10.3969/j.issn.1001-1528.2023.07.045
[11] 姚江奇. 蒲公英精酿啤酒开发及其抑制小鼠尿酸升高的功效研究[D]. 杨凌:西北农林科技大学, 2022. [YAO J Q. Development of dandelion craft beer and its efficacy in inhibiting the increase of uric acid in mice[D]. Yangling:Northwest A&F University, 2022.] YAO J Q. Development of dandelion craft beer and its efficacy in inhibiting the increase of uric acid in mice[D]. Yangling: Northwest A&F University, 2022.
[12] 孙丽君. 葡萄蒸馏酒中微量成分对黄嘌呤氧化酶的抑制作用[D]. 洛阳:河南科技大学, 2022. [SUN L J. Inhibitory effect of trace components in grape distilled spirits on xanthine oxidase[D]. Luoyang:Henan University of Science and Technology, 2022.] SUN L J. Inhibitory effect of trace components in grape distilled spirits on xanthine oxidase[D]. Luoyang: Henan University of Science and Technology, 2022.
[13] 刘巧玲. 发酵枣粉的制备及品质评价研究[D]. 泰安:山东农业大学, 2019. [LIU Q L. Study on preparation and quality evaluation of fermented jujube powder[D]. Taian:Shandong Agricultural University, 2019.] LIU Q L. Study on preparation and quality evaluation of fermented jujube powder[D]. Taian: Shandong Agricultural University, 2019.
[14] LIU Y, FANG H, LIU H, et al. Goji berry juice fermented by probiotics attenuates dextran sodium sulfate-induced ulcerative colitis in mice[J]. Journal of Functional Foods,2021,83:104491. doi: 10.1016/j.jff.2021.104491
[15] 胡明珍. 副干酪乳杆菌NXU-19004发酵枸杞汁的条件优化及其对小鼠便秘的改善作用研究[D]. 银川:宁夏大学, 2021. [HU M Z. Optimization of fermentation conditions of goji berry juice by Lactobacillus paracasei NXU-19004 and its improvement on constipation in mice[D]. Yinchuan:Ningxia University, 2021.] HU M Z. Optimization of fermentation conditions of goji berry juice by Lactobacillus paracasei NXU-19004 and its improvement on constipation in mice[D]. Yinchuan: Ningxia University, 2021.
[16] 王晓. 核桃壳中黄嘌呤氧化酶抑制活性物质的分离鉴定及构效关系的研究[D]. 广州:华南理工大学, 2015. [WANG X. Study on isolation, identification and structure-activity relationship of the constituents with xanthine oxidase inhibitory activities in walnut (Juglans regia L.) shell [D]. Guangzhou:South China University of Technology, 2015.] WANG X. Study on isolation, identification and structure-activity relationship of the constituents with xanthine oxidase inhibitory activities in walnut (Juglans regia L.) shell [D]. Guangzhou: South China University of Technology, 2015.
[17] 黄宁馨. 复合乳酸菌发酵枸杞汁的工艺优化及其营养品质变化研究[D]. 武汉:华中农业大学, 2021. [HUANG N X. Study on the optimization of fermentation process of goji juice by combined lactic acid bacteria and the changes of nutritional quality[D]. Wuhan:Huazhong Agricultural University, 2021.] HUANG N X. Study on the optimization of fermentation process of goji juice by combined lactic acid bacteria and the changes of nutritional quality[D]. Wuhan: Huazhong Agricultural University, 2021.
[18] LIU Y, SHENG J, LI J, et al. Influence of lactic acid bacteria on physicochemical indexes, sensory and flavor characteristics of fermented sea buckthorn juice[J]. Food Bioscience,2022,46:101519. doi: 10.1016/j.fbio.2021.101519
[19] 冯琳. 发酵枸杞汁的制备及解酒护肝功能的评价[D]. 无锡:江南大学, 2021. [FENG L. Preparation of fermented Lycium barbarum juice and its evaluation of anti-alcoholism and liver-protection[D]. Wuxi:Jiangnan University, 2021.] FENG L. Preparation of fermented Lycium barbarum juice and its evaluation of anti-alcoholism and liver-protection[D]. Wuxi: Jiangnan University, 2021.
[20] 郝心. 益生菌发酵沾化冬枣饮料的加工工艺研究[D]. 泰安:山东农业大学, 2019. [HAO X. Processing technology of fermented Ziziphus jujuba Zhanhua juice beverage by probiotics[D]. Taian:Shandong Agricultural University, 2019.] HAO X. Processing technology of fermented Ziziphus jujuba Zhanhua juice beverage by probiotics[D]. Taian: Shandong Agricultural University, 2019.
[21] WANG Z, MI S, WANG X, et al. Characterization and discrimination of fermented sweet melon juice by different microbial strains via GC-IMS-based volatile profiling and chemometrics[J]. Food Science and Human Wellness,2023,12(4):1241−1247. doi: 10.1016/j.fshw.2022.10.006
[22] SZYDLOWSKA-CZERNIAK A, TROKOWSKI K, KARLOVITS G, et al. Determination of antioxidant capacity, phenolic acids, and fatty acid composition of rapeseed varieties[J]. Journal of Agricultural and Food Chemistry,2010,58(13):7502−7509. doi: 10.1021/jf100852x
[23] 高庆超, 常应九, 马蓉, 等. 黑果枸杞酵素发酵前后主要成分分析及其体外抗氧化活性研究[J]. 食品与发酵工业,2020,46(5):275−283. [GAO Q C, CHANG Y J, MA R, et al. Analysis of main components and antioxidant activity in vitro for Lycium ruthenicum Murr. Jiaosu before and after fermentation[J]. Food and Fermentation Industries,2020,46(5):275−283.] GAO Q C, CHANG Y J, MA R, et al. Analysis of main components and antioxidant activity in vitro for Lycium ruthenicum Murr. Jiaosu before and after fermentation[J]. Food and Fermentation Industries, 2020, 46(5): 275−283.
[24] ARISE A K, ALASHI A M, NWACHUKWU I D, et al. Antioxidant activities of bambara groundnut (Vigna subterranea) protein hydrolysates and their membrane ultrafiltration fractions[J]. Food & Function,2016,7(5):2431−2437.
[25] DENG H, JIA P, JIANG J, et al. Expression and characterisation of feruloyl esterases from Lactobacillus fermentum JN248 and release of ferulic acid from wheat bran[J]. International Journal of Biological Macromolecules,2019,138:272−277. doi: 10.1016/j.ijbiomac.2019.07.086
[26] NILE S H, KO E Y, KIM D H, et al. Screening of ferulic acid related compounds as inhibitors of xanthine oxidase and cyclooxygenase-2 with anti-inflammatory activity[J]. Revista Brasileira de Farmacognosia,2016,26:50−55. doi: 10.1016/j.bjp.2015.08.013
[27] 陈梓琦, 汪彩云, 李紫宁, 等. 乳酸菌的生长特性及其功能性质与应用综述[J]. 农产品加工,2020(12):80−83. [CHEN Z Q, WANG C Y, LI Z N, et al. A review of the growth characteristics, functional properties and applications of Lactic acid bacteria[J]. Agricultural Products Processing,2020(12):80−83.] CHEN Z Q, WANG C Y, LI Z N, et al. A review of the growth characteristics, functional properties and applications of Lactic acid bacteria[J]. Agricultural Products Processing, 2020(12): 80−83.
[28] 黄帆, 林军, 袁洪燕, 等. 益生菌脐橙全果汁工艺优化及香气成分分析[J]. 中国食品学报,2023,23(1):228−239. [HUANG F, LIN J, YUAN H Y, et al. Process optimization and aroma component analysis of probiotic navel orange whole juice[J]. Journal of Chinese Institute of Food Science and Technology,2023,23(1):228−239.] HUANG F, LIN J, YUAN H Y, et al. Process optimization and aroma component analysis of probiotic navel orange whole juice[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(1): 228−239.
[29] SHARNMA H, OZOGUL F, BARTKIENE E, et al. Impact of lactic acid bacteria and their metabolites on the techno-functional properties and health benefits of fermented dairy products[J]. Critical Reviews in Food Science and Nutrition,2023,63(21):4819−4841. doi: 10.1080/10408398.2021.2007844
[30] MUHIALDIN B J, KADUM H, ZAREI M, et al. Effects of metabolite changes during lacto-fermentation on the biological activity and consumer acceptability for dragon fruit juice[J]. LWT,2020,121:108992. doi: 10.1016/j.lwt.2019.108992
[31] DABBAGH MOGHADDAM A, GARAVAND F, RAZAVI S H, et al. Production of saffron-based probiotic beverage by lactic acid bacteria[J]. Journal of Food Measurement and Characterization,2018,12:2708−2717. doi: 10.1007/s11694-018-9888-z
[32] 马路凯, 卢晓丽, 何秋璇, 等. 发酵果汁的研究进展与展望[J]. 食品研究与开发,2021,42(18):182−189. [MA L K, LU X L, HE Q X, et al. Research progress and prospect of fermented juice[J]. Food Research and Development,2021,42(18):182−189.] doi: 10.12161/j.issn.1005-6521.2021.18.027 MA L K, LU X L, HE Q X, et al. Research progress and prospect of fermented juice[J]. Food Research and Development, 2021, 42(18): 182−189. doi: 10.12161/j.issn.1005-6521.2021.18.027
[33] 邓诗源, 黄烁翔, 刘丰玮等. 益生菌发酵火龙果饮料工艺优化及抗氧化活性研究[J/OL]. 重庆工商大学学报(自然科学版), 1−9[2024-10-11]. http://kns.cnki.net/kcms/detail/50.1155.N.20230726.1832.008.html. [DENG S Y, HAUNG S X, LIU F W, et al. Process optimization and antioxidant activity of probiotic fermented dragon fruit beverage[J/OL]. Journal of Chongqing Technology and Business University(Natural Science Edition), 1−9 [2024-10-11]. http://kns.cnki.net/kcms/detail/50.1155.N.20230726.1832.008.html.] DENG S Y, HAUNG S X, LIU F W, et al. Process optimization and antioxidant activity of probiotic fermented dragon fruit beverage[J/OL]. Journal of Chongqing Technology and Business University(Natural Science Edition), 1−9 [2024-10-11]. http://kns.cnki.net/kcms/detail/50.1155.N.20230726.1832.008.html.
[34] 王越, 赵文谨, 谢云飞, 等. 强化发酵对诺丽果成分的影响及抗氧化活性研究[J]. 食品工业科技,2020,41(15):143−149,157. [WANG Y, ZHAO W J, XIE Y F, et al. Effects of intensified fermentation on the components of noni fruit and its antioxidant activity[J]. Science and Technology of Food Industry,2020,41(15):143−149,157.] WANG Y, ZHAO W J, XIE Y F, et al. Effects of intensified fermentation on the components of noni fruit and its antioxidant activity[J]. Science and Technology of Food Industry, 2020, 41(15): 143−149,157.
[35] 吴彩云, 张晓荣, 徐怀德, 等. 益生菌发酵果蔬汁生物活性成分及功能特性研究进展[J]. 中国食品学报,2021,21(12):323−334. [WU C Y, ZHANG X R, XU H D, et al. Progress on bioactive components and functional properties of probiotic fermented fruit and vegetable juices[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(12):323−334.] WU C Y, ZHANG X R, XU H D, et al. Progress on bioactive components and functional properties of probiotic fermented fruit and vegetable juices[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(12): 323−334.
[36] 郄雪娇, 程亚, 曾茂茂, 等. 食品多酚与蛋白相互作用及其对多酚生物可利用性影响的研究进展[J]. 食品与发酵工业,2019,45(8):232−237. [QIE X J, CHENG Y, ZENG M M, et al. Advances in food polyphenol-protein interactions and their impact on polyphenol bioavailability[J]. Food and Fermentation Industries,2019,45(8):232−237.] QIE X J, CHENG Y, ZENG M M, et al. Advances in food polyphenol-protein interactions and their impact on polyphenol bioavailability[J]. Food and Fermentation Industries, 2019, 45(8): 232−237.
[37] ZHOU Y, WANG R, ZHANG Y, et al. Biotransformation of phenolics and metabolites and the change in antioxidant activity in kiwifruit induced by Lactobacillus plantarum fermentation[J]. Journal of the Science of Food and Agriculture,2020,100(8):3283−3290. doi: 10.1002/jsfa.10272
[38] 易媛, 赵敏惠, 左勇, 等. 桑葚酵素发酵过程中活性物质与抗氧化能力的相关性研究[J]. 食品与发酵工业, 2022, 48 (9):117−122. [YI Y, ZHAO M H, ZUO Y, et al. Correlation between active substances and mulberry Jiaosu fermentationJ]. Food and Fermentation Industries, 2022, 48(9):117−122.] YI Y, ZHAO M H, ZUO Y, et al. Correlation between active substances and mulberry Jiaosu fermentationJ]. Food and Fermentation Industries, 2022, 48(9): 117−122.
[39] 周颖, 韦仕静, 葛亚中, 等. 生姜酵素发酵过程中生物活性成分含量及其抗氧化活性的变化[J]. 食品工业科技,2018,39(18):39−44. [ZHOU Y, WEI S J, GE Y Z, et al. Changes of bioactive components and antioxidant activities about ginger Jiaosu during the fermentation process[J]. Science and Technology of Food Industry,2018,39(18):39−44.] ZHOU Y, WEI S J, GE Y Z, et al. Changes of bioactive components and antioxidant activities about ginger Jiaosu during the fermentation process[J]. Science and Technology of Food Industry, 2018, 39(18): 39−44.
[40] 李可, 朱永清, 邬应龙, 等. 基于GC-IMS解析植物乳杆菌发酵对猕猴桃果汁挥发性物质的影响[J]. 现代食品科技, 2022, 38(5):254-260, 182. [LI K, ZHU Y Q, WU Y L, et al. Effect of Lactobacillus plantanum fermentation on the flavor of kiwifruit juice by GC-IMS [J] Modern Food Science and Technology, 2022, 38(5):254-260, 182.] LI K, ZHU Y Q, WU Y L, et al. Effect of Lactobacillus plantanum fermentation on the flavor of kiwifruit juice by GC-IMS [J] Modern Food Science and Technology, 2022, 38(5): 254-260, 182.
[41] 张江宁, 叶峥, 张爱凤. 基于GC-IMS技术解析青枣不同菌种发酵关键风味物质差异[J]. 中国调味品,2023,48(11):37−42. [ZHANG J N, YE Z, ZHANG A F. Analysis of differences of key flavor substances in green jujube fermented by different strains based on GC-IMS technology[J]. China Condiment,2023,48(11):37−42.] doi: 10.3969/j.issn.1000-9973.2023.11.007 ZHANG J N, YE Z, ZHANG A F. Analysis of differences of key flavor substances in green jujube fermented by different strains based on GC-IMS technology[J]. China Condiment, 2023, 48(11): 37−42. doi: 10.3969/j.issn.1000-9973.2023.11.007
[42] LI Z, TENG J, LYU Y, et al. Enhanced antioxidant activity for apple juice fermented with Lactobacillus plantarum ATCC14917[J]. Molecules,2018,24(1):51. doi: 10.3390/molecules24010051
[43] WU Y, LI S, TAO Y, et al. Fermentation of blueberry and blackberry juices using Lactobacillus plantarum, Streptococcus thermophilus and Bifidobacterium bifidum:Growth of probiotics, metabolism of phenolics, antioxidant capacity in vitro and sensory evaluation[J]. Food Chemistry,2021,348:129083. doi: 10.1016/j.foodchem.2021.129083





 下载:
下载:





 下载:
下载:



