Impact of Different Aspergillus Fermentation Combinations on the Quality Components and Color of Summer and Autumn Tea Infusion
-
摘要: 为提升夏秋茶的经济附加值,本研究通过接种黑曲霉和米曲霉对夏秋茶汤进行单独和混合液态发酵,并详细分析了发酵过程中品质成分和颜色的变化,以及茶色素与pH、色度值的相关性。结果表明,单独接种黑曲霉对茶多酚和咖啡碱的降解作用最显著(P<0.05),其中,茶多酚含量减少了1261.17 μg/mL,咖啡碱含量减少了61.52 μg/mL;而单独接种米曲霉有助于保留更多的儿茶素和没食子酸;混合发酵有利于茶褐素的合成,48 h后茶褐素的含量高达1779.12 μg/mL。感官评价和色度值的测定结果表明,曲霉发酵能够促使茶汤颜色快速转化,从浅黄色转变为深红褐色,L*明显降低,而a*、b*显著升高(P<0.05)。相关性分析显示,茶黄素仅与L*呈显著正相关(P<0.05);茶红素同样与L*呈显著正相关,但与a*和b*显著负相关(P<0.05);与此相反,茶褐素与L*呈现显著负相关,但与a*和b*显著正相关(P<0.05),表明茶褐素含量的增加会导致茶汤亮度降低,并增强红褐色调。此外,pH与茶褐素呈显著正相关(P<0.05),表明pH的增加有助于促进茶褐素的合成。综上,本研究为夏秋茶多样化产品的开发提供了科学依据,对促进茶产业的可持续发展具有重要意义。Abstract: To enhance the economic value-added of summer and autumn teas, this study conducted separate and combined liquid-state fermentation of the tea infusions using Aspergillus niger and Aspergillus oryzae, followed by a detailed analysis of changes in quality components and color during fermentation, as well as the correlation between tea pigments, pH, and chroma values. The results indicated that the individual inoculation of Aspergillus niger had the most significant degradation effect on tea polyphenols and caffeine (P<0.05), with a reduction of 1261.17 μg/mL in tea polyphenols and 61.52 μg/mL in caffeine content. Whereas the individual inoculation of Aspergillus oryzae helped to preserve more catechins and gallic acid. Mixed fermentation was conducive to the synthesis of theabrownin, with its content reaching up to 1779.12 μg/mL after 48 hours. Sensory evaluation and chroma value measurements showed that Aspergillus fermentation could rapidly transform the tea infusion color from light yellow to dark reddish-brown, with a significant decrease in L* and a marked increase in a* and b* (P<0.05). Correlation analysis revealed that theaflavins were significantly and positively correlated with L* (P<0.05). Thearubigins were also significantly and positively correlated with L*, but significantly and negatively correlated with a* and b* (P<0.05). In contrast, theabrownin showed a significant negative correlation with L*, but a significant positive correlation with a* and b* (P<0.05), indicating that an increase in theabrownin content would reduce the brightness of the tea infusion and enhance the reddish-brown tone. Furthermore, pH was significantly and positively correlated with theabrownin synthesis (P<0.05), indicating that an increase in pH was beneficial for promoting the synthesis of theabrownin. In summary, this study provides a scientific basis for the development of diversified products of summer and autumn teas and is of significant importance for promoting the sustainable development of the tea industry.
-
茶叶作为全球广受欢迎的饮品,以其独特的风味品质和健康益处深受消费者青睐。茶叶中复杂的化学成分对其品质起着决定性作用,而这些成分的含量和组成受到茶树品种、采摘季节、加工技术等多种因素的影响[1−3]。相较于春茶,夏秋茶通常含有较高水平的茶多酚、咖啡碱和儿茶素,导致其味道偏苦涩[4],市场价值相对较低,造成资源的极大浪费。由于夏秋茶的产量占全年总产量的60%以上[5],因此,对夏秋茶进行精深加工不仅能够减少资源的浪费,还能满足市场对多样化茶产品的需求,对提升夏秋茶经济附加值具有重要意义。
近年来,固态和液态发酵技术已成为夏秋茶精深加工的有效手段。陈琳琳等[6]利用冠突散囊菌固态发酵夏秋茶,发现成品茶展现出橙黄明亮的茶汤色泽和浓郁的菌香;发酵过程中,茶多酚、氨基酸、可溶性糖分别下降了3.14%、0.66%、1.64%;儿茶素成分变化明显,其中特定儿茶素减少,表儿茶素和表没食子儿茶素增加,咖啡碱含量上升了5.53%。Xiao等[7]研究了Eurotium cristatum(MF800948)对秋绿茶品质成分的影响,发现发酵后秋绿茶中氨基酸、儿茶素、生物碱、多酚、类黄酮、碳水化合物和茶色素的含量发生了显著性变化。刘亚兵等[8]发现接种灵芝菌的夏秋黑毛茶综合感官品质提升,大部分氨基酸含量增加,茶多酚、色差值及pH降低。尽管固态发酵能够提升夏秋茶品质和改变品质成分,但生产周期较长且难以精准控制。相比之下,液态发酵作为一种创新技术,可通过微生物作用改变茶汤品质成分,从而提升茶汤风味。此外,液态发酵技术具有生产周期短、污染率低、易于工业化生产等优势。李春燕等[9]利用红茶菌对夏秋茶进行发酵,发现整个发酵过程中,茶多酚含量逐渐降低,茶氨酸含量逐渐增加,发酵后的茶汤香气浓郁、滋味酸甜。另外,Wang等[10]研究了夏秋茶提取物在纯发酵(冠突散囊菌)和混合发酵(冠突散囊菌、黑曲霉和草酸青霉菌)中关键化学成分的变化,发现混合发酵条件下氨基酸含量提高了14.3%,而茶多酚在纯发酵中的降低速度明显快于混合发酵。综上,不同功能微生物液态发酵会显著影响茶汤的品质和化学成分。因此,选择合适的功能微生物对茶汤的液态发酵至关重要。
黑曲霉和米曲霉作为两种常见的曲霉属真菌,在茶叶加工领域有着广泛应用[11−13]。黑曲霉主要用于制作传统黑茶,促进多酚类物质转化及纤维素、果胶等成分的分解[14],而米曲霉更有利于促进蛋白酶的产生,可以改善茶叶的鲜爽度和香气,更有助于茶汤品质的提升[15]。目前,已有研究将黑曲霉应用于茶汤液态发酵中,以提升低档茶产品品质[16−17]。然而,米曲霉单独接种及与黑曲霉混合接种在茶汤液态发酵中的作用尚未见报道。因此,本研究通过不同组合曲霉发酵,比较其对夏秋茶汤的品质成分和颜色的影响,旨在为夏秋茶精深加工提供科学依据,对开发夏秋茶多样化系列产品和推动茶产业的可持续发展具有重要的意义。
1. 材料与方法
1.1 材料与仪器
夏秋晒青毛茶原料 由云南省临沧市临翔区蚂蚁堆茶厂提供;黑曲霉(Aspergillus niger)、米曲霉(Aspergillus oryzae) 均分离自普洱茶发酵过程茶样,保藏于华中科技大学生命科学与技术学院资源生物学与生物技术研究所;没食子酸(Gallic acid,GA)、咖啡碱(Caffeine,CAF)、可可碱(Theobromine)、茶碱(Theophylline)、8种儿茶素,包括没食子儿茶素-3-没食子酸酯(Epigallocatechin-3-gallate,EGCG)、没食子儿茶素-3-没食子酸酯(Epigallocatechin,EGC)、没食子儿茶素-3-没食子酸酯(Epicatechin-3-gallate,ECG)、表儿茶素(Epicatechin,EC)、没食子儿茶素-3-没食子酸酯(Gallocatechin-3-gallate,GCG)、没食子儿茶素(Gallocatechin,GC)、没食子儿茶素-3-没食子酸酯(Catechin-3-gallate,CG)、没食子儿茶素(Catechin,C)标准品 色谱纯,上海源叶生物科技有限公司;葡萄糖、草酸、乙二胺四乙酸(Edetic acid,EDTA) 分析纯,国药集团化学试剂有限公司;乙腈、乙酸 色谱纯,上海麦克林生化科技有限公司;甲醇、正丁醇、无水乙醇、福林酚 分析纯,上海麦克林生化科技有限公司;琼脂 石狮市环球琼胶工业有限公司;马铃薯 临沧市临翔区马玛特超市。
Agilent 1260高效液相色谱仪 美国安捷伦公司;UV-1600紫外分光光度计 上海美普达仪器有限公司;HACA-3000高精度分光测色仪 杭州远方光电信息股份有限公司;FE20-FiveEasy Plus pH计 上海梅特勒-托利多仪器有限公司。
1.2 实验方法
1.2.1 PDA培养基配制
马铃薯200 g,葡萄糖20 g,琼脂20 g,加水至1000 mL,pH自然。
1.2.2 晒青毛茶汤和曲霉孢子悬浮液制备
晒青毛茶汤制备:将晒青毛茶粉碎,过筛,121 ℃灭菌20 min。然后,以1:50(g/mL)的茶水比在无菌水中浸提2 h,用8层纱布过滤,去除茶渣,收集上清液,得到晒青毛茶汤(SGT)。以上浸提、过滤等操作均在超净工作台中完成。曲霉孢子悬浮液制备:将黑曲霉和米曲霉接种于PDA培养基中,在28 ℃条件下培养5~7 d。使用适量无菌水制备成孢子悬浮液,使孢子个数的浓度约为1×107 CFU/mL。
1.2.3 曲霉液态发酵
曲霉单独发酵:分别将黑曲霉和米曲霉孢子悬浮液添加到晒青毛茶汤中(接种量为5%),在37 ℃,150 r/min发酵48 h,分别标记为ANFT和AOFT。每个样品做3个平行。曲霉混合发酵:按1:1的菌种比例接种黑曲霉和米曲霉孢子悬浮液(接种量为5%),在37 ℃,150 r/min发酵48 h,标记为AONFT。以未接种茶汤作为对照组(CK),发酵条件与接种发酵组相同。每个样品做3个平行。
1.2.4 品质成分测定
采用分光光度法测定茶多酚(Tea polyphenols,TP)、总游离氨基酸(Free amino acids,FAAs)和茶色素的含量。其中,采用福林酚法测定TP含量[10];采用茚三酮比色法测定FAAs含量[10]。参考Hua等[18]报道的实验方法测定茶黄素(Theaflavins,TFs)、茶红素(Thearubigins,TRs)和茶褐素(Theabrownin,TB)的含量。
1.2.5 8种儿茶素、GA、CAF、可可碱和茶碱的含量测定
色谱条件:色谱柱:C18-Aq柱(4.6 mm i.d.×250 mm,5 μm);流动相:流动相A为含1%乙酸的EDTA溶液,流动相B为乙腈;梯度程序,5% B,0~5 min;5%~10% B,5~20 min;10%~20% B,20~25 min;20%~10% B,25~32 min;10%~40% B,35~40 min;进样量,10 μL;检测波长:278 nm;流速:1 mL/min;柱温:35 ℃。
1.2.6 pH测定
取25 mL茶汤,用pH计测定其pH。
1.2.7 茶汤颜色感官审评方法
参照国家标准GB/T 23776-2018《茶叶感官审评方法》和GB/T 14487-2017《茶叶感官审评术语》按照标准规定的审评程序,通过5名专业审评人员(3男2女,22~35岁)评定茶汤颜色。
1.2.8 茶汤颜色测定
将25 mL茶汤样品置于比色玻璃杯中(内径10 mm×50 mm),使用色度仪自带软件HACASuite_V1.00.500进行颜色测定分析。L*(0~100)表示亮度,a*(0~100)和−a*(−100~0)分别表示红色和绿色,b*(0~100)和−b*(−100~0)分别表示黄色和蓝色。以纯净水作为空白对照。
1.3 数据处理
使用SPSS 26.0软件进行单因素方差分析(ANOVA),P<0.05为显著性差异。使用OriginPro 2024(学生版)生成折线图、柱状图和热图。
2. 结果与分析
2.1 曲霉液态发酵对茶汤中品质成分的影响
2.1.1 曲霉液态发酵对茶多酚的影响
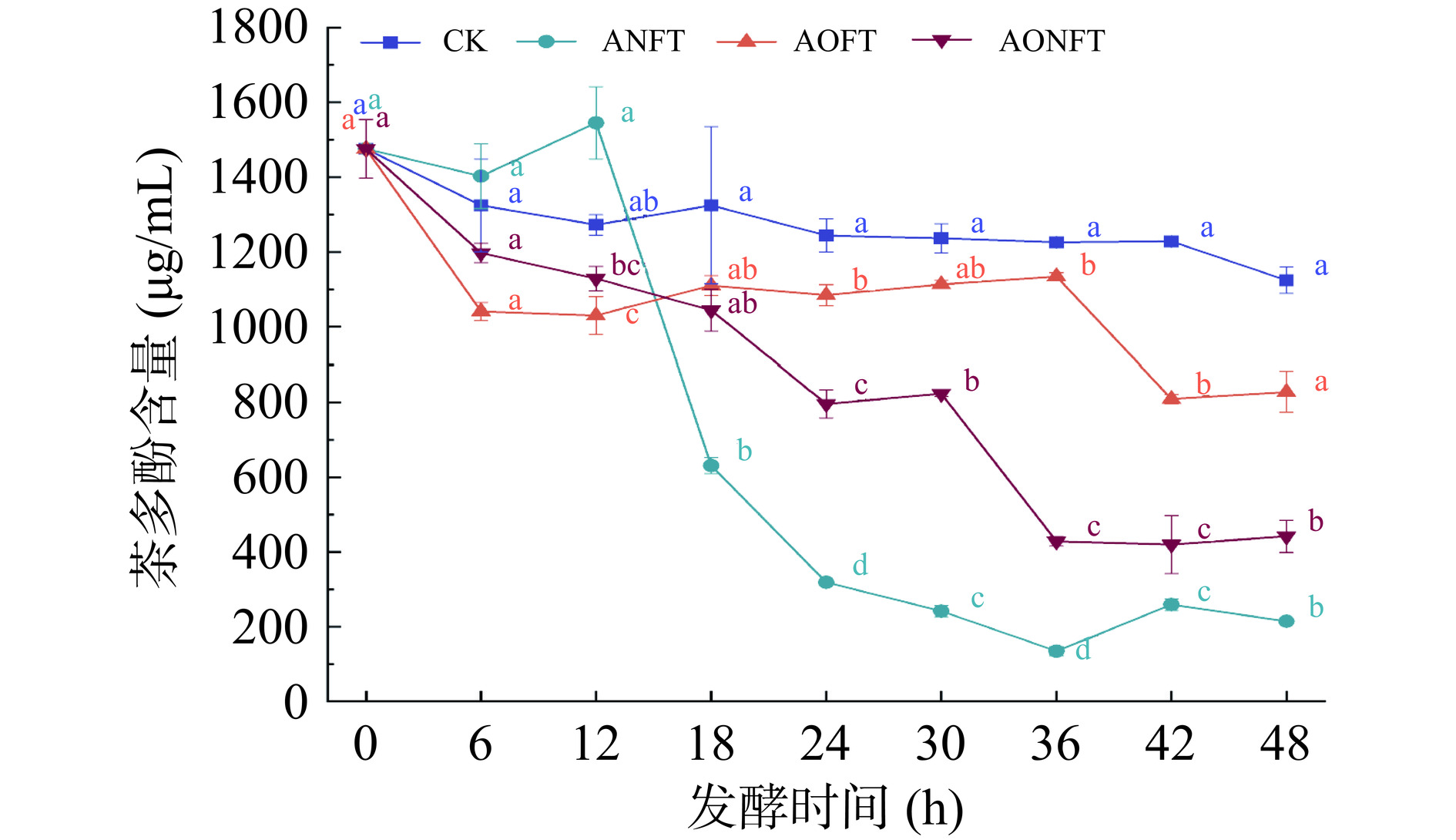
TP不仅是茶叶口感和品质形成的关键物质基础,也是TFs、TRs和TB形成的关键底物[19],其在发酵过程中的含量变化如图1所示。发酵48 h后,未接种茶汤中TP的含量为1124.18 μg/mL,低于初始晒青毛茶汤(1475.68 μg/mL),说明无菌空气与茶汤接触,一定程度上促使了TP的氧化,与已报道结果一致[18]。单独接种黑曲霉、米曲霉和混合发酵茶汤的TP含量均显著低于未接种茶汤(P<0.05),且与初始晒青毛茶汤相比分别降低了1261.17、647.99和1067.77 μg/mL。TP含量降低的主要原因是多酚氧化酶将其氧化为TFs、TRs、TB等茶色素物质[20]。相对于单独接种米曲霉和混合发酵,单独接种黑曲霉发酵消耗和转化了更多TP。这一现象的可能原因包括:首先,黑曲霉在特定条件下(37 ℃、150 r/min)能够更快速地生长繁殖,能更高效地将TP转化为营养源[21];其次,在混合发酵环境中,米曲霉和黑曲霉之间可能发生竞争和相互抑制,这种相互作用关系可能导致黑曲霉的生长速度受到限制,进而减缓了TP的降解速率。此外,黑曲霉产生的多酚氧化酶和过氧化物酶可能更加有效地促进TP向茶色素等物质的转化,使得发酵过程更为彻底。
![]() 图 1 曲霉液态发酵对茶多酚含量的影响注:不同小写字母表示同一时间不同组间存在显著差异(P<0.05),图2同。Figure 1. Effect of liquid fermentation of Aspergillus on the content of tea polyphenol
图 1 曲霉液态发酵对茶多酚含量的影响注:不同小写字母表示同一时间不同组间存在显著差异(P<0.05),图2同。Figure 1. Effect of liquid fermentation of Aspergillus on the content of tea polyphenol2.1.2 曲霉液态发酵对总游离氨基酸的影响
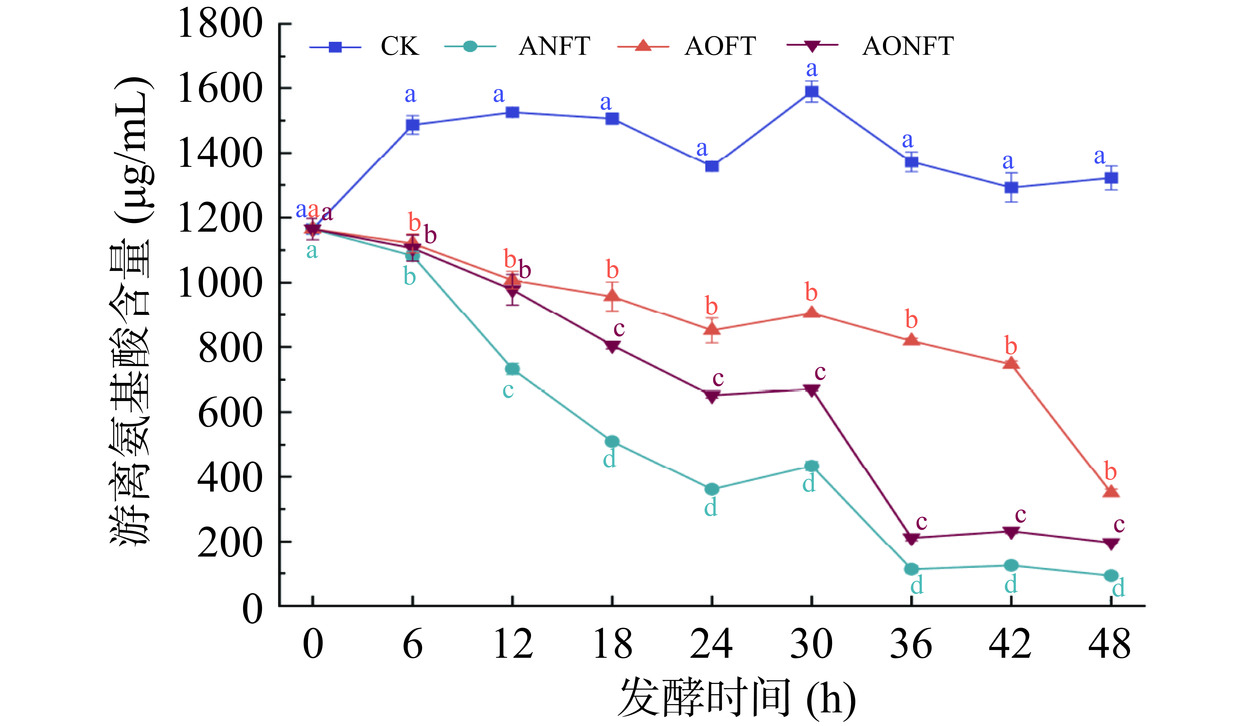
FAAs是茶叶中主要的鲜味和香气成分[22]。如图2所示,初始晒青毛茶汤中总游离氨基酸的含量为1164.61 μg/mL。发酵48 h后,FAAs含量在未接种茶汤中保持稳定,而在接种发酵茶汤中含量均显著降低(P<0.05)。主要原因可能是曲霉将FAAs用作氮源,或酶促水解脱胺和产生羧酸类化合物[23]。此外,单独接种黑曲霉发酵茶汤FAAs降低量最大为1071.68 μg/mL,而单独接种米曲霉发酵茶汤降低量最小为815.04 μg/mL。因此,相比于米曲霉,黑曲霉可能具有更强的产酶能力,导致更多的FAAs被分解或转化为其他物质。
2.1.3 曲霉液态发酵对茶色素的影响
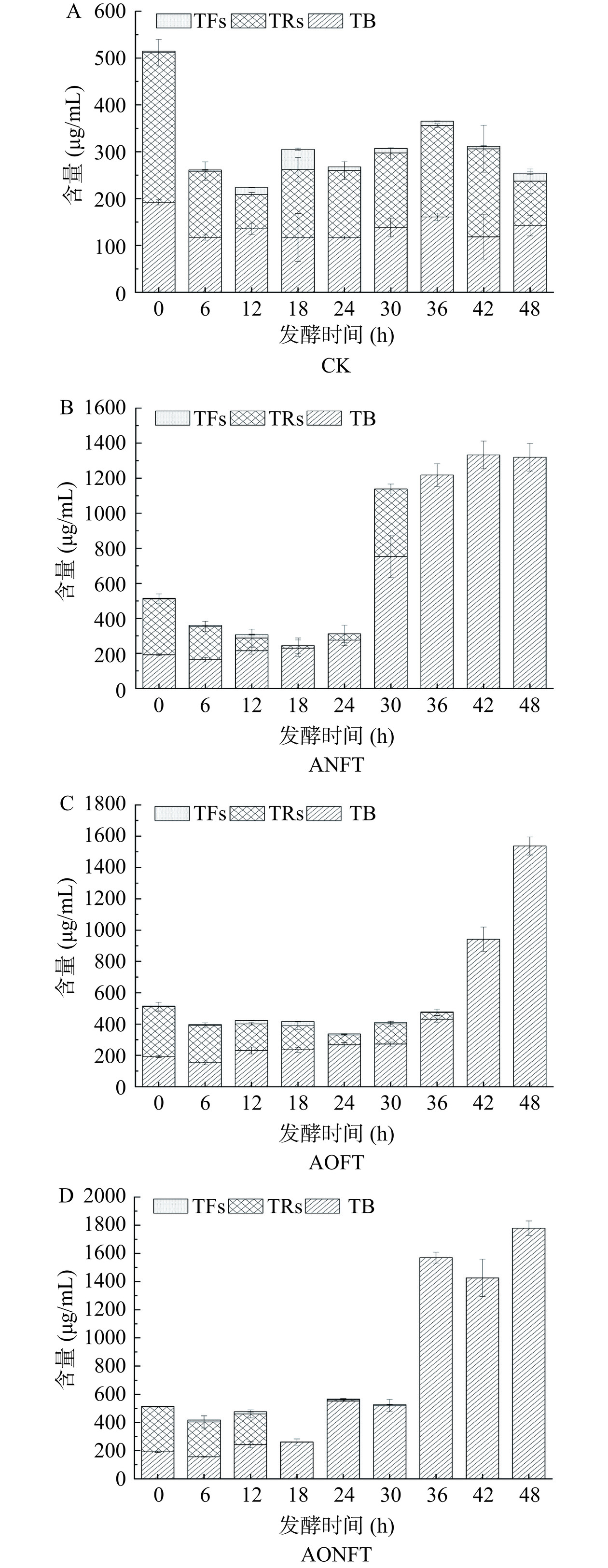
TFs、TRs和TB是茶多酚在茶汤中的氧化产物。现有研究普遍认为,TFs是最初的氧化产物,随后进一步氧化形成TRs,最终转化为TB[24]。在本研究中,发酵48 h后,与原始的晒青毛茶汤相比,未接种的茶汤中TFs含量略有上升,TRs含量则明显减少,而TB含量未出现明显变化(图3A)。这一现象可能是由于空气中的氧气促使TP转化为TFs,与未接种茶汤中TP含量的下降相吻合。在发酵过程中,无论是单独接种黑曲霉、米曲霉,还是采用混合发酵方式,均观察到TFs含量先增后减,TRs含量波动,而TB含量逐渐上升的趋势(图3B~D)。其中,在单独接种黑曲霉和混合发酵的茶汤中,TFs含量在12 h达到峰值,而单独接种米曲霉的茶汤则在18 h达到最高TFs含量。发酵36 h时,黑曲霉和混合发酵的茶汤中已无法检测到TFs和TRs,而米曲霉接种的茶汤在发酵42 h后TFs和TRs含量也降至检测限以下。尽管米曲霉在转化TFs和TRs方面的速率较慢,但其最终产生的TB含量(1537.67 μg/mL)却超过了黑曲霉发酵的茶汤(1319.75 μg/mL)。混合发酵条件下,TB含量在48 h后达到最高值1779.12 μg/mL。综上,黑曲霉、米曲霉和其混合发酵均能有效促进TB的合成,但其生成速率有所不同,而黑曲霉和米曲霉协同作用能够更有效促进TB的合成。
2.1.4 曲霉液态发酵对没食子酸、儿茶素和嘌呤生物碱的影响
GA是广泛存在于茶叶中的一种重要酚酸类物质,是绿茶和普洱茶的特征成分之一,具有良好的抗氧化、抗炎、抗菌等生物活性[25]。发酵48 h后,与晒青毛茶汤相比,未接种茶汤中GA含量无明显变化,而曲霉发酵茶汤中GA含量均显著降低(P<0.05),结果如图4所示。0~48 h,GA含量在接种发酵茶汤中均呈现先升高后降低的趋势,其中,单独接种黑曲霉和米曲霉发酵茶汤的GA含量均在12 h时达到最大值,混合发酵在24 h时达到最大值,单独接种发酵比混合接种发酵生成GA的速率更快。GA含量的升高主要来源于以下两个方面:一是没食子单宁在曲霉分泌的单宁酶作用下发生分解作用,产生GA[25];二是酯类儿茶素发生水解反应形成简单儿茶素和GA[26]。发酵48 h后,单独接种黑曲霉、米曲霉和混合发酵茶汤中GA的含量分别降低了189.16、46.79和192.40 μg/mL,发酵中后期GA含量降低可能与没食子酸衍生物的形成有关。总的来说,单独接种米曲霉发酵可保留较多的GA,而混合发酵时,黑曲霉和米曲霉协同作用促进了GA的降解。
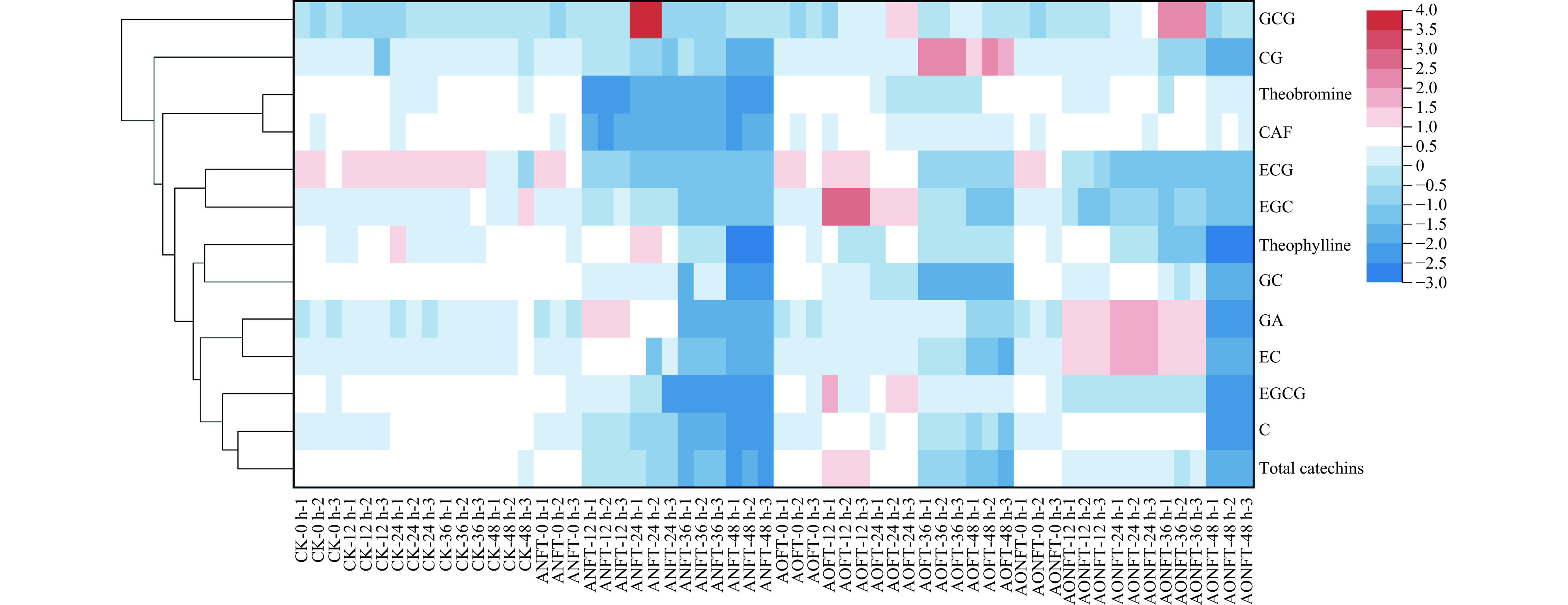
儿茶素作为TP的重要组成部分,在茶叶品质形成中扮演着重要角色。在本研究中,晒青毛茶汤中儿茶素的总量为485.55 μg/mL。发酵48 h后,接种发酵茶汤中儿茶素总量均显著下降(P<0.05),与未接种茶汤(436.81 μg/mL)相比有显著降低(P<0.05)。具体来讲,单独接种黑曲霉、米曲霉以及混合发酵处理后的茶汤中,总儿茶素含量分别减少了476.24、388.78和467.99 μg/mL(图4)。这一结果与曲霉对茶多酚的降解作用一致。然而,8种儿茶素的含量变化表现出明显的多样性。其中,在单独接种米曲霉的发酵茶汤中,除了CG含量呈现出不规则的变化,其他7种儿茶素的含量均呈现出先增后减的趋势。而在单独接种黑曲霉的发酵茶汤中,GCG含量经历了先增后减的变化,其他7种儿茶素的含量则持续下降。在混合发酵的茶汤中,ECG和EGCG的含量呈现下降趋势,而其他6种儿茶素则先增后减。这些结果揭示了不同曲霉对儿茶素含量影响的差异性可能源于它们的生长速度和代谢活性,即在三组茶汤中单独接种黑曲霉的生长代谢速度最强,混合发酵次之,单独接种米曲霉最弱。
嘌呤生物碱是茶叶中重要的苦味和功能活性物质[27],主要包括CAF、茶碱和可可碱。如图4所示,发酵48 h后,单独接种黑曲霉的发酵茶汤中CAF含量显著下降(P<0.05),相较于晒青毛茶汤,CAF含量降低了61.52 μg/mL,这一变化在未接种的茶汤以及接种米曲霉和混合发酵的茶汤中并未观察到。此外,与晒青毛茶汤相比,未接种茶汤和单独接种米曲霉的发酵茶汤中茶碱含量保持稳定,而单独接种黑曲霉和混合发酵的茶汤中茶碱含量降至检测水平以下。值得一提的是,所有发酵组中可可碱的含量均未发生显著变化。这些结果表明,不同的微生物通过其特有的代谢途径,能够对CAF和茶碱的含量产生不同程度的影响[28]。特别地,黑曲霉展现出较强的降解CAF和茶碱的能力,而米曲霉对这些嘌呤生物碱的降解作用则不明显。
2.2 曲霉液态发酵对茶汤pH的影响
pH是衡量发酵过程的关键指标,能够反映茶汤的发酵程度及微生物的代谢情况[29]。如图5,初始晒青毛茶汤中pH为5.31。发酵48 h后,未接种的茶汤显示出显著的酸化趋势,pH降至4.82(P<0.05),这可能是由于无菌空气作用下茶汤中有机酸等代谢产物的生成,导致了pH的下降。相反,在接种了曲霉的发酵茶汤中,随着发酵的进行,pH呈现波动上升趋势,并最终达到较高水平。其中,单独接种黑曲霉的茶汤pH最高,为8.03,单独接种米曲霉为7.07,混合发酵为7.46。pH的升高主要归因于发酵过程中有机酸类物质与茶汤中其他化学成分相互作用,发生水解或者氧化聚合反应[30−31]。
![]() 图 5 曲霉液态发酵过程中pH的变化分析注:不同小写字母表示同一组间不同时间存在显著差异(P<0.05),图7同。Figure 5. Analysis of pH changes during liquid fermentation of Aspergillus
图 5 曲霉液态发酵过程中pH的变化分析注:不同小写字母表示同一组间不同时间存在显著差异(P<0.05),图7同。Figure 5. Analysis of pH changes during liquid fermentation of Aspergillus2.3 曲霉液态发酵对茶汤颜色的影响
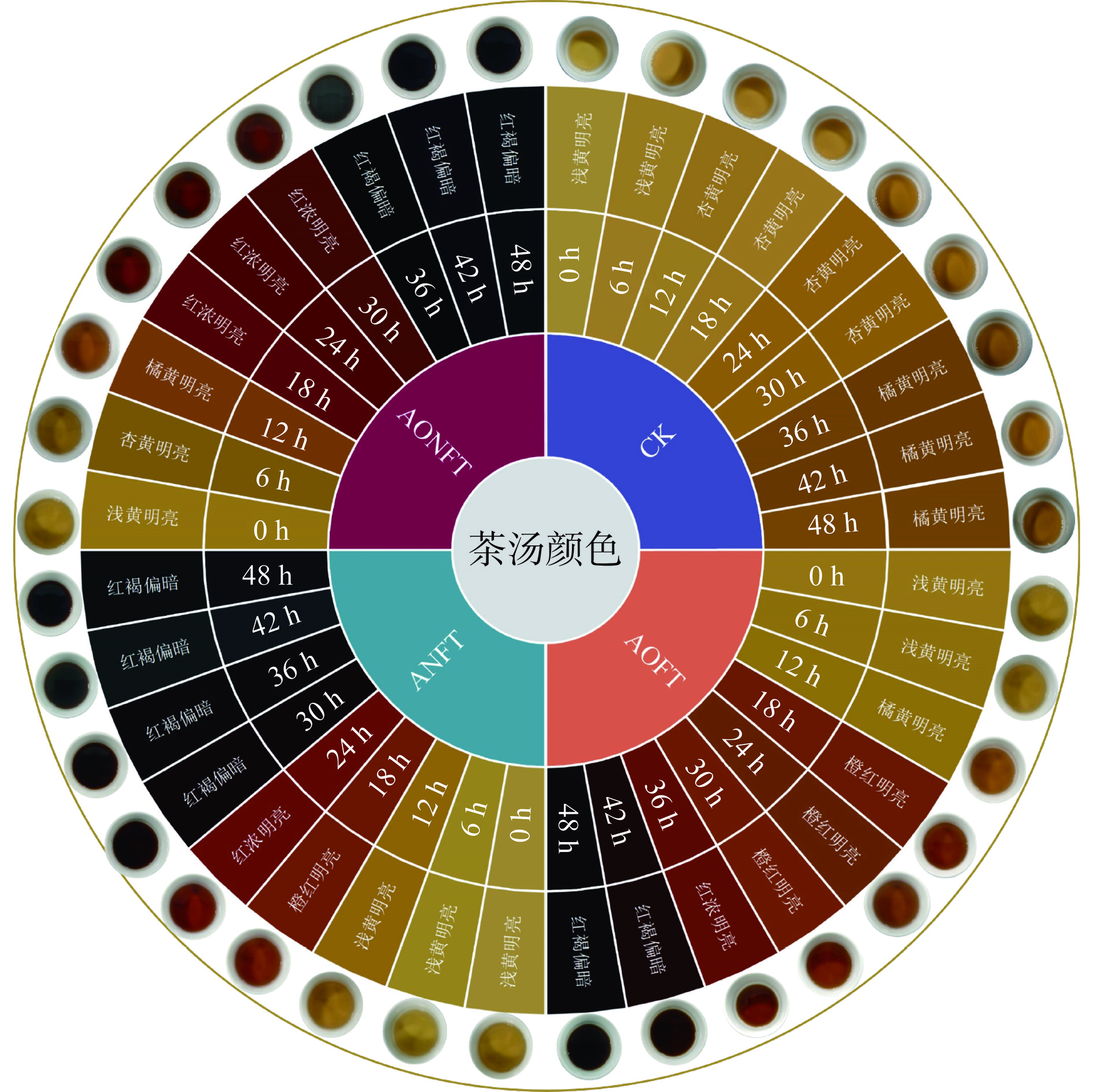
2.3.1 曲霉液态发酵过程中茶汤颜色感官变化分析
相同的茶叶原料在经历不同微生物发酵后,其最终产品的品质特性呈现出差异性[32]。因此,本研究对黑曲霉和米曲霉单独以及混合液态发酵处理后,茶汤的感官颜色变化进行了详细分析,如图6所示。发酵48 h后,未接种的茶汤颜色从最初的浅黄色逐渐转变为深黄色;而经过接种发酵的茶汤则从浅黄色转变为红褐色并且偏暗。在不同的发酵阶段,三种处理方式下的茶汤颜色变化存在明显差异。具体来说,单独接种黑曲霉的茶汤在30 h后迅速转变为红褐色,混合发酵的茶汤在36 h后呈现相似的颜色变化,而单独接种米曲霉的茶汤则需要更长时间,即42 h后才达到类似的颜色转变。这一结果表明,不同微生物对茶汤颜色的影响存在显著差异,且黑曲霉在促进茶汤颜色转变方面更为迅速和有效。
2.3.2 曲霉液态发酵对茶汤色度值的影响
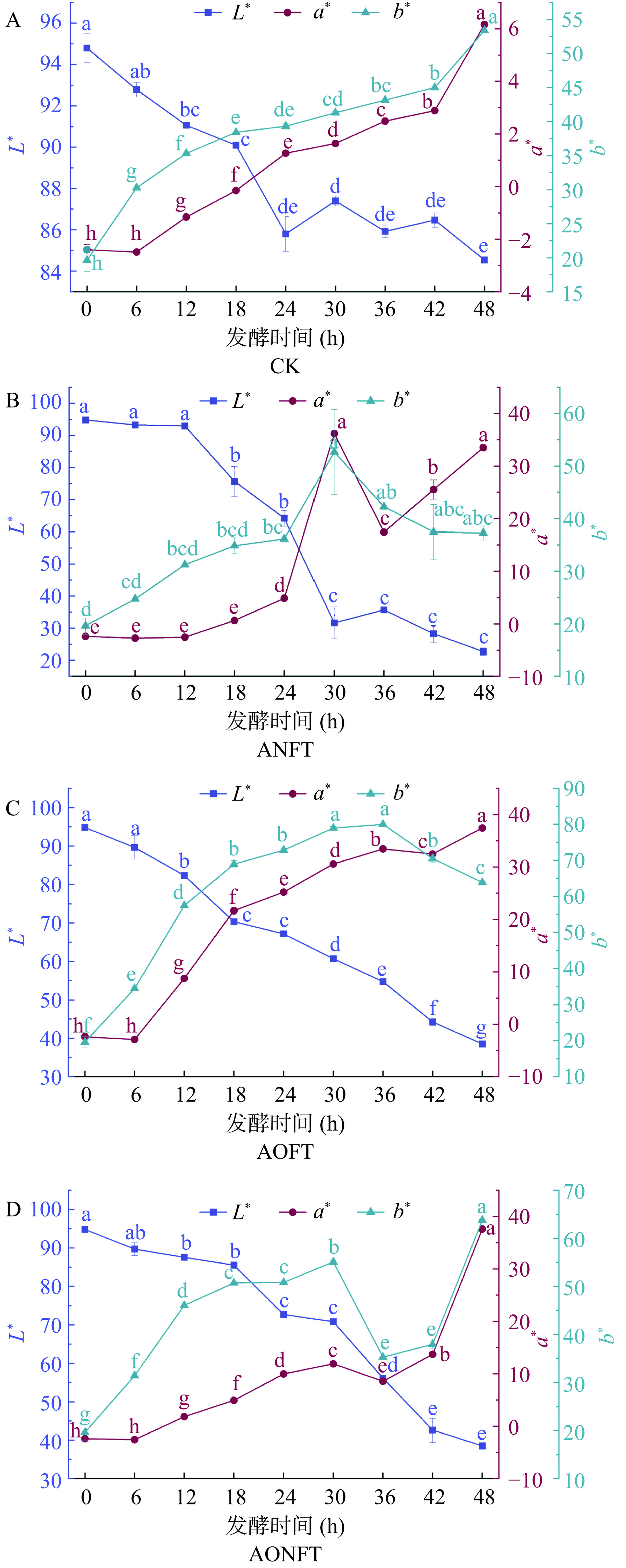
为了深入理解黑曲霉和米曲霉对茶汤颜色的具体影响,本研究对发酵过程中各组茶汤的色度值(L*、a*、b*)进行了精确测量,结果如图7。初始晒青毛茶汤中L*、a*和b*分别为94.8,−2.60,17.99。发酵48 h后,未接种茶汤中L*显著下降,而a*和b*则显著上升(P<0.05);对于接种发酵的茶汤,L*同样呈显著下降趋势(P<0.05),而a*和b*呈波动变化趋势,最终均显著上升(P<0.05)。结合感官分析,单独接种黑曲霉的茶汤在30 h时迅速转变为红褐色,L*为31.63,a*为36.18,b*为52.67。混合接种发酵的茶汤在36 h时变为红褐色,L*为56.16,a*为8.57,b*为35.28。相比之下,单独接种米曲霉的茶汤颜色变化最慢,需42 h才转变为红褐色,此时L*为44.25,a*为32.49,b*为70.53。尽管三种处理的茶汤在30、36和42 h时均呈现红褐色,但其色度值L*、a*、b*之间存在显著差异(P<0.05),这表明不同种类的曲霉对茶汤中茶色素的含量及其组成产生了不同的影响。因此,本研究进一步探讨了茶色素含量与茶汤色度值之间的相关性,以期为发酵过程中调控茶汤的色度提供科学依据。
2.4 茶色素含量与茶汤色度值相关性分析
在茶叶发酵过程中,茶汤的颜色和亮度变化主要受TFs、TRs和TB含量和组成变化的驱动[33]。其中,TFs的含量直接影响茶汤的亮度[34],TRs的含量对茶汤的红黄色调起着关键作用[35],而TB的含量则决定了茶汤的红褐色调[36]。本研究对黑曲霉和米曲霉单独以及混合发酵条件下茶汤的色度值(L*、a*、b*)与茶色素含量之间的相关性进行了深入分析,如图8所示。结果表明,TFs含量与L*呈显著正相关关系(P<0.05),相关系数为0.29,这与已有研究的发现相吻合[18]。同时,TRs、TB含量与L*、a*、b*均表现出显著的相关性(P<0.05),具体来讲,TRs与L*呈正相关,相关系数为0.43,而与a*、b*均呈负相关;相反,TB与L*呈负相关,相关系数为−0.84,与a*和b*均呈正相关。在未接种茶汤中,发酵48 h后,仍保留了一定量的TFs和TRs,因此茶汤呈深黄色。在接种发酵组中,42 h后TFs和TRs几乎消失,而TB的含量显著增加,导致茶汤的亮度降低,颜色转变为红褐色。综合上述分析,TFs和TRs的含量增加会使茶汤亮度提高,而TB含量的增加则会使茶汤的亮度降低,同时加深红褐色调。
2.5 茶色素合成与pH相关性分析
本实验室前期研究发现普洱茶固态发酵过程中TB的合成与pH呈显著正相关[37]。然而,对于液态发酵过程中茶色素合成与pH之间的关系,目前尚缺乏明确的认识。因此,本研究对黑曲霉和米曲霉单独以及混合发酵条件下茶汤的pH变化及其与茶色素形成的关系进行了深入探讨。如图8所示,TFs、TRs含量与pH呈现出负相关性,而TB的含量则与pH呈现显著正相关性(P<0.05)。在单独接种黑曲霉、米曲霉和混合发酵茶汤中,TB的合成分别在24、36和30 h进入快速阶段,此时对应的pH分别为7.48、6.57和6.67,并呈现持续上升的趋势。最终,三种发酵条件下的茶汤中pH分别为8.03、7.07和7.46,相应的TB含量分别达到最大值为1319.75、1537.67和1779.12 μg/mL。综合分析结果表明,pH的增加可能有助于促进TB的合成。因此,可以通过调节pH来控制茶色素的生成,从而调整茶汤颜色。这一发现为深入了解茶汤液态发酵过程中茶色素合成的调控机制提供了新视角,对于优化茶叶发酵工艺具有重要的指导意义。
3. 结论
本研究通过不同组合曲霉液态发酵夏秋茶汤,系统分析了发酵过程中茶汤品质成分和颜色的变化,确定了黑曲霉和米曲霉单独及混合发酵对茶汤品质成分的作用。其中,单独接种黑曲霉对TP的降解效果最为显著(P<0.05),TP含量减少了1261.17 μg/mL,而单独接种米曲霉则在一定程度上保留了更多的儿茶素和GA。此外,单独接种黑曲霉发酵能够显著降低茶汤中的CAF和茶碱含量(P<0.05),CAF含量降低了61.52 μg/mL,茶碱含量则降低至检测限以下,表明单独接种黑曲霉具有更强的转化CAF和茶碱代谢能力。在茶色素方面,单独接种黑曲霉、米曲霉和混合发酵后TB含量分别达到了1319.75、1537.67、1779.12 μg/mL,说明混合发酵有利于TB的合成。在茶汤颜色方面,单独接种黑曲霉发酵茶汤的颜色变化最快,其次是混合发酵,而单独接种米曲霉发酵茶汤的颜色变化最慢。色度值测定结果显示,三组茶汤中L*均明显降低,而a*、b*均显著升高(P<0.05)。相关性分析显示,TFs与L*呈显著正相关(P<0.05),说明TFs含量的增加会导致茶汤亮度的提升;TRs同样与L*呈显著正相关,但与a*和b*显著负相关(P<0.05),意味着TRs含量的增加在提升亮度的同时,会减少茶汤的红色调和黄色调;与此相反,TB与L*呈现显著负相关,但与a*和b*显著正相关(P<0.05),表明TB含量的增加会导致茶汤亮度降低,并增强红褐色调。此外,pH与TB合成呈显著正相关(P<0.05),表明pH的增加有助于促进TB的合成。综上,本研究为夏秋茶的精深加工和多样化茶产品的开发提供了重要的理论支持和实践指导。未来研究将进一步探索曲霉在液态发酵过程中的代谢机制,以及如何通过优化发酵工艺实现对夏秋茶汤品质和风味的精准调控,进一步为提升夏秋茶的品质和市场竞争力指明方向。
-
图 1 曲霉液态发酵对茶多酚含量的影响
注:不同小写字母表示同一时间不同组间存在显著差异(P<0.05),图2同。
Figure 1. Effect of liquid fermentation of Aspergillus on the content of tea polyphenol
图 5 曲霉液态发酵过程中pH的变化分析
注:不同小写字母表示同一组间不同时间存在显著差异(P<0.05),图7同。
Figure 5. Analysis of pH changes during liquid fermentation of Aspergillus
-
[1] CHEN D Q, JI W B, GRANATO D, et al. Effects of dynamic extraction conditions on the chemical composition and sensory quality traits of green tea[J]. LWT,2022,169:113972. doi: 10.1016/j.lwt.2022.113972
[2] ZAMAN F, ZHANG E, XIA L, et al. Natural variation of main biochemical components, morphological and yield traits among a panel of 87 tea [Camellia sinensis (L.) O. Kuntze] cultivars[J]. Horticultural Plant Journal,2023,9(3):563−576. doi: 10.1016/j.hpj.2022.08.007
[3] ESTEKI M, MEMARBASHI N, SIMAL-GANDARA J. Classification and authentication of tea according to their harvest season based on FT-IR fingerprinting using pattern recognition methods[J]. Journal of Food Composition and Analysis,2023,115:104995. doi: 10.1016/j.jfca.2022.104995
[4] 王奕, 罗红玉, 陈善敏, 等. 夏秋茶苦涩味的物质基础及其在加工中的变化[J]. 南方农业,2022,16(21):157−161. [WANG Y, LUO H Y, CHEN S M, et al. The material basis of the bitter and astringent flavor of summer and autumn tea and its changes in processing[J]. South China Agriculture,2022,16(21):157−161.] WANG Y, LUO H Y, CHEN S M, et al. The material basis of the bitter and astringent flavor of summer and autumn tea and its changes in processing[J]. South China Agriculture, 2022, 16(21): 157−161.
[5] 夏长杙, 蒲璐璐, 王敏, 等. 发酵对夏秋茶品质的研究及发展趋势[J]. 贵茶,2022(4):31−34. [XIA C Y, PU L L, WANG M, et al. Research and development trend of fermentation on summer and autumn tea quality[J]. Journal of Guizhou Tea,2022(4):31−34.] XIA C Y, PU L L, WANG M, et al. Research and development trend of fermentation on summer and autumn tea quality[J]. Journal of Guizhou Tea, 2022(4): 31−34.
[6] 陈琳琳, 邱树毅, 罗小叶, 等. 夏秋茶发花工艺及发花过程中主要物质成分变化[J]. 食品工业,2017,38(9):71−75. [CHEN L L, QIU S Y, LUO X Y, et al. The fungus growth processing of summer-autumn tea and the changes of main components during the fungus growing[J]. The Food Industry,2017,38(9):71−75.] CHEN L L, QIU S Y, LUO X Y, et al. The fungus growth processing of summer-autumn tea and the changes of main components during the fungus growing[J]. The Food Industry, 2017, 38(9): 71−75.
[7] XIAO Y, LI M Y, LIU Y, et al. The effect of Eurotium cristatum (MF800948) fermentation on the quality of autumn green tea[J]. Food Chemistry,2021,358:129848. doi: 10.1016/j.foodchem.2021.129848
[8] 刘亚兵, 戴宇樵, 王敏, 等. 夏秋灵芝菌茶的制备及内含物质分析研究[J]. 食品安全质量检测学报,2023,14(6):319−328. [LIU Y B, DAI Y Q, WANG M, et al. Study on the preparation and content analysis of Ganoderma lucidum tea in summer and autumn[J]. Journal of Food Safety & Quality,2023,14(6):319−328.] LIU Y B, DAI Y Q, WANG M, et al. Study on the preparation and content analysis of Ganoderma lucidum tea in summer and autumn[J]. Journal of Food Safety & Quality, 2023, 14(6): 319−328.
[9] 李春燕, 王瑜, 杨莹, 等. 凤冈锌硒夏秋茶发酵饮品发酵过程动态评价[J]. 食品科技,2023,48(2):68−76. [LI C Y, WANG Y, YANG Y, et al. Dynamic evaluation of the fermentation process of Fenggang Zinc-Se summer-autumn tea fermentation beverage[J]. Food Science and Technology,2023,48(2):68−76.] LI C Y, WANG Y, YANG Y, et al. Dynamic evaluation of the fermentation process of Fenggang Zinc-Se summer-autumn tea fermentation beverage[J]. Food Science and Technology, 2023, 48(2): 68−76.
[10] WANG X, LI X X, LIU B, et al. Comparison of chemical constituents of Eurotium cristatum-mediated pure and mixed fermentation in summer-autumn tea[J]. LWT,2021,143:111132. doi: 10.1016/j.lwt.2021.111132
[11] 姚粟, 王鹏辉, 白飞荣, 等. 中国传统发酵食品用微生物菌种名单研究(第二版)[J]. 食品与发酵工业,2022,48(1):272−285. [YAO S, WANG P H, BAI F R, et al. Research on the inventory of microbial food cultures in Chinese traditional fermented foods (2nd edition)[J]. Food and Fermentation Industries,2022,48(1):272−285.] YAO S, WANG P H, BAI F R, et al. Research on the inventory of microbial food cultures in Chinese traditional fermented foods (2nd edition)[J]. Food and Fermentation Industries, 2022, 48(1): 272−285.
[12] KIM M J, JOHN K M M, CHOI J N, et al. Changes in secondary metabolites of green tea during fermentation by Aspergillus oryzae and its effect on antioxidant potential[J]. Food Research International,2013,53(2):670−677. doi: 10.1016/j.foodres.2012.12.053
[13] MA C, MA B, ZHOU B, et al. Pile-fermentation mechanism of ripened Pu-erh tea:Omics approach, chemical variation and microbial effect[J]. Trends in Food Science & Technology,2024,146:104379.
[14] MA Y, LING T J, SU X Q, et al. Integrated proteomics and metabolomics analysis of tea leaves fermented by Aspergillus niger, Aspergillus tamarii and Aspergillus fumigatus[J]. Food Chemistry,2021,334:127560. doi: 10.1016/j.foodchem.2020.127560
[15] 杨希. 普洱茶纯菌发酵过程中活性组分的变化[D]. 大连:大连工业大学, 2015. [YANG X. The variation of the active component in Pu'er tea fermentation process with pure mould[D]. Dalian:Dalian Polytechnic University, 2015.] YANG X. The variation of the active component in Pu'er tea fermentation process with pure mould[D]. Dalian: Dalian Polytechnic University, 2015.
[16] JIANG J, ZHANG M, AN T, et al. Preparation of instant dark tea by liquid-state fermentation using sequential inoculation with Eurotium cristatum and Aspergillus niger:Processes optimization, physiochemical characteristics and antioxidant activity[J]. LWT,2022,162:113379. doi: 10.1016/j.lwt.2022.113379
[17] CHEN Q, ZHANG M, CHEN M, et al. Influence of Eurotium cristatum and Aspergillus niger individual and collaborative inoculation on volatile profile in liquid-state fermentation of instant dark teas[J]. Food Chemistry,2021,350:129234. doi: 10.1016/j.foodchem.2021.129234
[18] HUA J J, XU Q, YUAN H B, et al. Effects of novel fermentation method on the biochemical components change and quality formation of Congou black tea[J]. Journal of Food Composition and Analysis,2021,96:103751. doi: 10.1016/j.jfca.2020.103751
[19] DENG S J, ZHANG G, OLAYEMI ALUKO O, et al. Bitter and astringent substances in green tea:Composition, human perception mechanisms, evaluation methods and factors influencing their formation[J]. Food Research International,2022,157:111262. doi: 10.1016/j.foodres.2022.111262
[20] WANG Q P, GONG J S, CHISTI Y, et al. Fungal isolates from a Pu-erh type tea fermentation and their ability to convert tea polyphenols to theabrownins[J]. Journal of Food Science,2015,80(4-5-6):M809−M817.
[21] 谢美华, 陈华红, 陈玉红, 等. 几种普洱茶发酵微生物对茶多酚代谢的初步研究[J]. 食品科技,2013,38(5):82−85. [XIE M H, CHEN H H, CHEN Y H, et al. A primary study on tea polyphenol metabolism of some fungi strains isolated from Pu-er tea[J]. Food Science and Technology,2013,38(5):82−85.] XIE M H, CHEN H H, CHEN Y H, et al. A primary study on tea polyphenol metabolism of some fungi strains isolated from Pu-er tea[J]. Food Science and Technology, 2013, 38(5): 82−85.
[22] 谢佳, 缪德仁. 大叶种茶叶中矿质元素的含量对鲜甜味氨基酸含量的影响[J]. 昆明学院学报,2022,44(3):49−52. [XIE J, LIAO D R. Effect of mineral elements on fresh and sweet amino acid contents in largeleaf tea leaves[J]. Journal of Kunming University,2022,44(3):49−52.] XIE J, LIAO D R. Effect of mineral elements on fresh and sweet amino acid contents in largeleaf tea leaves[J]. Journal of Kunming University, 2022, 44(3): 49−52.
[23] ZHU Y C, LUO Y H, WANG P P, et al. Simultaneous determination of free amino acids in Pu-erh tea and their changes during fermentation[J]. Food Chemistry,2016,194:643−649. doi: 10.1016/j.foodchem.2015.08.054
[24] HUANG F J, ZHENG X J, MA X, et al. Theabrownin from Pu-erh tea attenuates hypercholesterolemia via modulation of gut microbiota and bile acid metabolism[J]. Nature Communications,2019,10(1):4971. doi: 10.1038/s41467-019-12896-x
[25] 吴桢. 普洱茶渥堆发酵过程中主要生化成分的变化[D]. 重庆:西南大学, 2008. [WU Z. The variation of chemical components during the fermentation procedure of Pu'er tea[D]. Chongqing:Southwest University, 2008.] WU Z. The variation of chemical components during the fermentation procedure of Pu'er tea[D]. Chongqing: Southwest University, 2008.
[26] QIN J H, LI N, TU P F, et al. Change in tea polyphenol and purine alkaloid composition during solid-state fungal fermentation of post-fermented tea[J]. Journal of Agricultural and Food Chemistry,2012,60(5):1213−1217. doi: 10.1021/jf204844g
[27] YE J H, YE Y, YIN J F, et al. Bitterness and astringency of tea leaves and products:Formation mechanism and reducing strategies[J]. Trends in Food Science & Technology,2022,123:130−143.
[28] ZHOU B X, MA C Q, WANG H Z, et al. Biodegradation of caffeine by whole cells of tea-derived fungi Aspergillus sydowii, Aspergillus niger and optimization for caffeine degradation[J]. BMC Microbiology,2018,18(1):53. doi: 10.1186/s12866-018-1194-8
[29] 李雯雯, 陈雄, 宋姗姗, 等. 绿茶茶汤发酵过程中理化性质及香气成分变化分析[J]. 香料香精化妆品,2019(3):12−16. [LI W W, CHEN X, SONG S S, et al. Analysis of the changes in physicochemical properties and aroma components of green tea during fermentation[J]. Flavour Fragrance Cosmetics,2019(3):12−16.] doi: 10.3969/j.issn.1000-4475.2019.03.004 LI W W, CHEN X, SONG S S, et al. Analysis of the changes in physicochemical properties and aroma components of green tea during fermentation[J]. Flavour Fragrance Cosmetics, 2019(3): 12−16. doi: 10.3969/j.issn.1000-4475.2019.03.004
[30] 曹艳妮. 不同储存时间普洱茶的理化分析和抗氧化性研究[D]. 广州:华南理工大学, 2011. [CAO Y N. Analysis of physicochemical components and antioxidant activity of puer teas stored at different years[D]. Guangzhou:South China University of Technology, 2011.] CAO Y N. Analysis of physicochemical components and antioxidant activity of puer teas stored at different years[D]. Guangzhou: South China University of Technology, 2011.
[31] 胡帅. 基于微生物组学及代谢组学技术的青砖茶渥堆过程品质形成机制研究[D]. 武汉:华中农业大学, 2020. [HU S. Study on the quality formation mechanism of Qinzhuan tea pile fermentation based on microbiome and metabolomics[D]. Wuhan:Huazhong Agricultural University, 2020.] HU S. Study on the quality formation mechanism of Qinzhuan tea pile fermentation based on microbiome and metabolomics[D]. Wuhan: Huazhong Agricultural University, 2020.
[32] CUI Y Q, LAI G P, WEN M C, et al. Identification of low-molecular-weight color contributors of black tea infusion by metabolomics analysis based on UV–visible spectroscopy and mass spectrometry[J]. Food Chemistry,2022,386:132788. doi: 10.1016/j.foodchem.2022.132788
[33] ASIL M H, RABIEI B, ANSARI R H. Optimal fermentation time and temperature to improve biochemical composition and sensory characteristics of black tea[J]. Australian Journal of Crop Science,2012,6(3):550−558.
[34] HE H F. Research progress on theaflavins:Efficacy, formation, and preparation[J]. Food & Nutrition Research,2017,61:1344521.
[35] YASSIN G H, KOEK J H, KUHNERT N. Model system-based mechanistic studies of black tea thearubigin formation[J]. Food Chemistry,2015,180:272−279. doi: 10.1016/j.foodchem.2015.01.108
[36] WANG Q P, BELSCAK-CVITANOVIC A, DURGO K, et al. Physicochemical properties and biological activities of a high-theabrownins instant Pu-erh tea produced using Aspergillus tubingensis[J]. LWT-Food Science and Technology,2018,90:598−605. doi: 10.1016/j.lwt.2018.01.021
[37] 杨子玺, 朱圆敏, 谢燕霞, 等. 基于pH高效定量判断普洱茶发酵程度的研究[J]. 食品安全质量检测学报,2023,14(1):74−80. [YANG Z X, ZHU Y M, XIE Y X, et al. Study on the quantitative and efficient determination of the degree of fermentation of Pu-erh tea based on pH[J]. Journal of Food Safety & Quality,2023,14(1):74−80.] doi: 10.3969/j.issn.2095-0381.2023.1.spaqzljcjs202301010 YANG Z X, ZHU Y M, XIE Y X, et al. Study on the quantitative and efficient determination of the degree of fermentation of Pu-erh tea based on pH[J]. Journal of Food Safety & Quality, 2023, 14(1): 74−80. doi: 10.3969/j.issn.2095-0381.2023.1.spaqzljcjs202301010
-
期刊类型引用(2)
1. 李梦,席婉婷,胡竞月,岳芽,戢得蓉. 马铃薯全粉在粗粮发酵饼干中的应用. 农产品加工. 2023(10): 6-11 .  百度学术
百度学术
2. 江冠宇,田晓菊,张惠玲. 不同干燥方法对欧李叶袋泡茶的影响. 食品工业. 2022(06): 116-121 .  百度学术
百度学术
其他类型引用(1)
-
其他相关附件
-
PDF格式
EI Certificate 44KB
-





 下载:
下载:


 下载:
下载:



