Advances in Research on the Interaction of Food-derived Polysaccharide and Polyphenol
-
摘要: 多糖和多酚是许多食品及其原料中的重要活性物质,它们的相互作用既可能影响各自的理化性质与功能活性,也可能影响食品的营养、感官品质。本文介绍了食源性多糖和多酚相互作用的表征手段,包括傅里叶变换红外光谱、核磁共振光谱等,同时对酶催化反应、自由基接枝等相互作用机理进行了总结。此外,本文重点阐述了浓度、pH、温度和离子强度等因素对多糖与多酚相互作用的影响,并进一步概述了相互作用下多糖和多酚的溶解性、结晶度等理化特性以及抗氧化、抗菌等生物活性的改变情况。众多研究成果表明,多糖-多酚相互作用形成的复合物具有优良的生物活性和稳定性,在食品工业、医疗保健等领域有广泛的应用前景。Abstract: Polysaccharides and polyphenols are important active substances in many foods and their raw materials. The interaction of polysaccharide and polyphenol may affect their physicochemical properties and functional activity respective, which also alter the nutritional and sensory qualities of food. This paper describes the means of characterizing food-derived polysaccharide and polyphenol interactions, including Fourier transform infrared (FT-IR) spectroscopy and nuclear magnetic resonance (NMR) spectroscopy, and interaction mechanisms such as enzyme-catalyzed reactions and free radical-induced reactions was also summarized. In addition, this paper focuses on the effects of concentration, pH, temperature and ionic strength on the interaction between polysaccharides and polyphenols, and further generalizes the alteration of physicochemical properties such as solubility and crystallinity, as well as bioactivities such as antioxidant and antimicrobial activities of polysaccharides and polyphenols under the interaction. Numerous research indicated that the formation of polysaccharide-polyphenol complexes had excellent biological activity and stability, promising good application prospects in food industry, healthcare, and other fields.
-
Keywords:
- polysaccharide /
- polyphenol /
- interaction mechanisms /
- influencing factors /
- functional properties
-
多酚是一类含有多个酚基团的化合物,酚基团数量可以从两个到数百个不等[1]。多酚广泛存在于许多高等植物叶片、果实及植物性食物资源中,包括谷物、水果、蔬菜、茶、咖啡和葡萄酒[2−4]。多酚具有多种生物活性,主要包括抗氧化剂、抗菌剂、抗糖尿病剂、抗炎剂和其他代谢调节等特性[5−6]。
多糖是由10个以上的单糖单位通过糖苷键连接在一起的高分子碳水化合物,在自然界中分布广泛,存在于植物、动物、藻类和微生物中[7]。多糖具有优秀的物理性质,已作为增稠剂、胶凝剂和成膜剂在许多食品中广泛使用[8],一些生物活性多糖还具有抗菌、抗氧化、抗肿瘤等作用[9]。
在食品加工过程中,细胞破碎后多糖与多酚等分子间接触会通过非共价和共价相互作用发生结合,从而改变多酚和多糖的结构、功能和活性,进而对食品的感官及营养品质产生重要影响[8],这种不受控制的结合条件对食品来说具有不利的影响,例如会导致茶饮料[10]、苹果汁[11]和葡萄酒[12]产生混浊现象。近年来通过探究多酚与多糖间的相互作用,改变它们之间相互作用的条件(如pH、温度和离子强度等)进而调控食品品质成为了食品科学的研究热点。这种人为干预的方式使得多酚与多糖的结合产生有益的效果。例如研究人员将多酚与多糖结合后增强了多糖的乳化性能[13−14],多酚能够与食品中的主要营养物质,如多糖、蛋白质形成共价或非共价化合物,这种结合将增加其物理稳定性、抗氧化活性和生物利用度。本文综述了多酚与多糖之间相互作用的机制、影响因素以及相互作用对各自的理化性质和生物活性的影响,以期为避免食品加工过程中多酚与多糖结合的有害方面,发展多酚与多糖结合的有益方面提供理论参考。
1. 多糖与多酚的相互作用
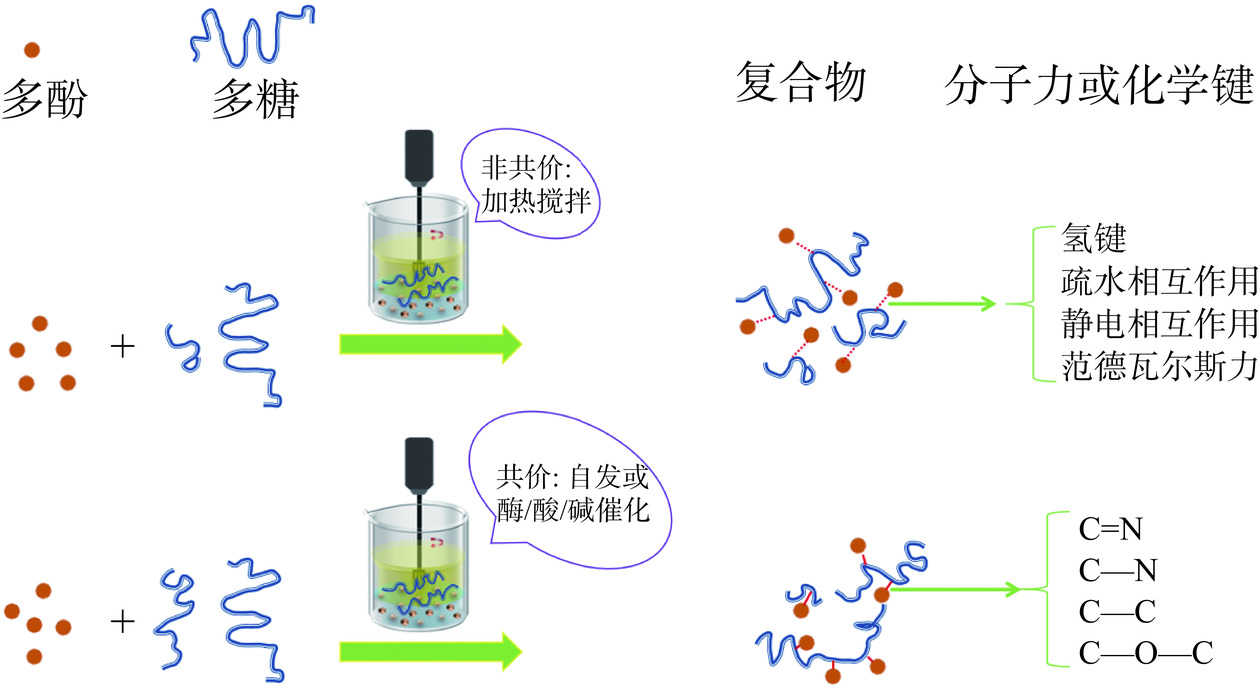
多糖和多酚之间可以通过非共价和共价相互作用发生结合,其多糖和多酚之间的非共价和共价相互作用的实例见表1。分子间相互作用的研究一般分为结构表征、分子量表征、显微观察和物质的定量分析。表2总结了多糖和多酚相互作用的研究方法以及它们的优缺点。对多糖-多酚复合物进行结构表征的方法主要有紫外-可见光谱、红外光谱、荧光光谱、核磁共振光谱和X射线衍射;进行显微观察的仪器主要有扫描电镜和原子力显微镜;分子量表征一般用凝胶渗透色谱法;物质的定量分析主要有气相色谱法和液相色谱法[15−16]。其中薄层色谱法分析在将来可用于监测多糖-多酚复合物的反应过程,原子力显微镜将来也可以作为一种辅助技术来揭示多糖-多酚复合物的构象。各种热力学方程和等温模型,如Langmuir、Freundlich方程和Clausius-Clapeyron方程,可被用来量化多酚和多糖之间的非共价相互作用[17]。
表 1 多糖和多酚之间的非共价和共价相互作用Table 1. Non-covalent and covalent interactions between polysaccharides and polyphenols多糖类型 多酚类型 结合方式 参考文献 非共价相互作用 苹果细胞壁 表儿茶素、根皮苷、绿原酸 氢键 [18] 原花青素 疏水相互作用、氢键 [19]
果胶多糖绿原酸、根皮苷、原花青素 静电相互作用、疏水相互作用、氢键 [20−21] 单宁、花青素和聚合物色素 氢键 [22]
莲藕多糖阿魏酸、绿原酸 氢键和疏水相互作用 [23] 没食子酸、表没食子儿茶素 氢键 [24] 山慈菇多糖 核桃多酚 静电相互作用 [25] 蓝莓果胶 花青素 静电相互作用、疏水相互作用、氢键 [17] 阿拉伯胶、葡聚糖和柑橘果胶 香蕉缩合单宁 静电相互作用、疏水相互作用、氢键 [26] 白葡萄皮和红葡萄皮中获得的可溶性多糖 黄烷-3-醇 疏水相互作用、氢键 [27] 羟丙基壳聚糖 海藻酸钠 静电相互作用、氢键 [28] 可溶性膳食纤维 姜黄素 氢键 [29] 共价相互作用 壳聚糖 表儿茶素、表没食子酸盐 自由基介导反应 [30−31] 羧甲基壳聚糖 没食子酸、原儿茶酸 EDC介导的偶联反应 [32] 凝胶多糖 阿魏酸 自由基介导反应 [33] 阿糖基木聚糖 儿茶素 自由基介导反应 [34] 阿拉伯树胶 阿魏酸 漆酶介导反应 [35] 淀粉 槲皮素 CDI介导反应 [36] 果胶 橙皮素 自由基介导反应 [37] 葡聚糖 儿茶素 自由基介导反应 [38] 结冷胶 姜黄素、柚皮素 DCC介导偶联反应 [39] 注:EDC:N-(3-dimethylaminopropyl)-N-ethylcarbodiimide hydrochloride,1-乙基-3-(3-二甲基氨基丙基)碳二亚胺;CDI:N,N -carbonyldiimidazole,N,N-羰基二咪唑;DCC:dicyclo-hexylcarbodiimide,二环己基碳二亚胺。 表 2 多糖和多酚相互作用的研究方法以及优缺点Table 2. Methods of studying polysaccharide and polyphenol interactions and their advantages and disadvantages研究方法 研究内容 优点 缺点 参考文献 紫外-可见光谱法 用于结构表征及检测合成效果。识别共轭、某些特征官能团和异构体 最常用的定性方法,成本低,
简单方便多糖在有限波长中没有明显的吸收带 [34] 傅里叶变换红外光谱 用于结构表征及检测合成效果。区分不同相互作用和不同接枝率的复合物 非共价和共价连接的复合物都能显示多糖和多酚的所有特征峰 成本较高,操作较繁琐 [40] 荧光光谱法 可根据合成前后发射光谱的红移或蓝移证明合成成功,检测合成效果 分析速度快,操作简单 研究非常有限 [41] 核磁共振光谱法 可用于结构表征及检测合成效果,预测多糖和多酚之间的结合位置,可以得到动力学信息 可直接提供详细的结合部位信息和相互作用机理,无需完整地测定复合物的空间结构;可以得到动力学信息 成本高,检测灵敏度较低,需要较高浓度和较高稳定性的样品 [42] X射线衍射法 通过分析材料的X射线衍射图案获取有关材料成分、内部原子结构或形态的信息。可以基于XRD峰的形状来确定材料是否是晶体材料 无损检测、高精度、速度快、波长范围广和穿透能力强 样品用量大,设备较复杂
成本高[43] 扫描电镜 常用于观察样品的形态特征,可对比多酚、多糖和复合物之间的形态特征 可以获得高度三维和真实的样品表面微观结构信息 对于样品内部结构分析较
困难[44] 原子力显微镜 通过探针与被测样品之间微弱的相互作用力(原子力)来获得物质超微结构及表面信息,进而对样品的表面结构进行观察 可在多种环境下直接实时观测;图像分辨率高;基底选择性强 操作繁琐,成本高,
分析困难[45] 凝胶渗透色谱法 测量多糖和多酚结合前后分子量的变化 分离效率高,保留时间短 分子量的变化受反应条件的影响很大,分子量的变化只能用作缀合反应的额外指示 [34] 气相色谱法 可用于分离各组分、定量分析、可挥发的多糖类衍生物的分析 分辨率高 操作复杂,只能检测具有一定挥发性的物质 [46] 液相色谱法 对物质的分离纯化、组成分析、定量分析 能够高效分离混合物 分离时间长,转换率低 [47] 薄层色谱法 用于分离或纯化化合物的混合物 方便、经济和易于使用的优点,并且不需要大量的有机溶剂 分离效果不理想,在分离生物高分子方面存在局限性 [48] 1.1 非共价相互作用
对于非共价相互作用,多酚可以通过表面吸附多糖或通过多糖的链排列形成疏水空腔包裹多酚来形成复合物[25]。其形成复合物的分子间作用力包括氢键、疏水相互作用、范德瓦尔斯力和静电相互作用。多糖和多酚之间的非共价相互作用主要是由多酚的疏水性和多糖上极性基团的存在所驱动。当多酚在水溶液中聚集以尽量减少与水分子的接触时就会发生疏水作用[49]。多糖可以作为这些聚集物的稳定剂,通过氢键或静电相互作用在它们周围形成一个保护层[50]。当多酚通过其羟基与多糖形成分子间桥时,就会发生氢键作用;当多酚与多糖上的带电基团(如羧基或硫酸盐)结合时,就会发生静电相互作用[51]。
1.2 共价相互作用
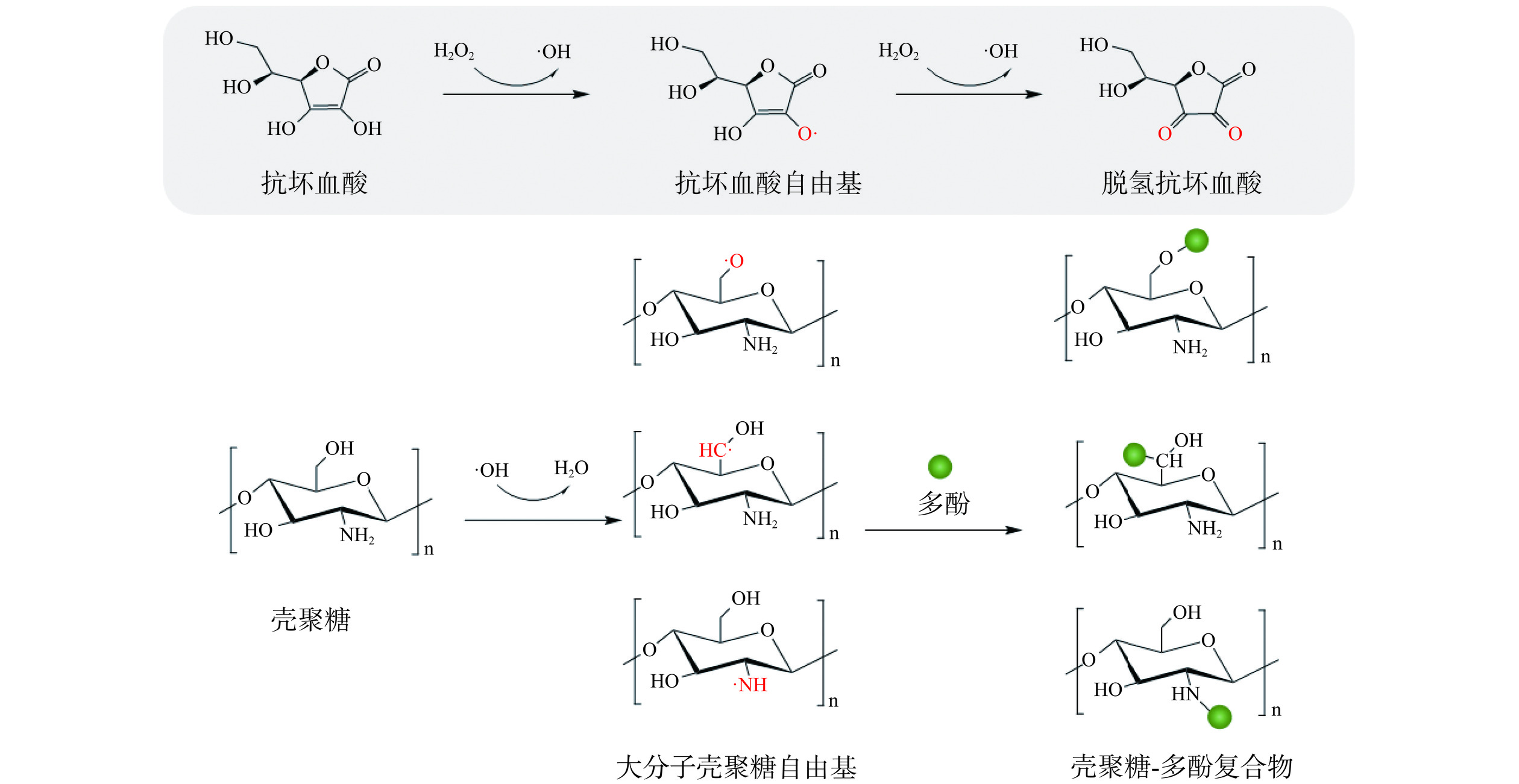
多糖和多酚之间的共价相互作用可以自发发生,也可以在酶、酸、碱或金属离子的催化下进行[8]。其共价相互作用涉及它们之间新的化学键的形成,主要连接的化学键为C=N、C—N、C—C和C—O—C键。这些键可以通过多种机制形成,主要包括酶催化、EDC介导、自由基介导和酸缩合反应。制备多糖和多酚复合物的方法如图1所示。酶催化法主要是由漆酶和酪氨酸酶等多酚氧化酶催化的氧化反应,主要基于氧化多酚和含氨基的多糖之间的交联。多酚在有氧条件下被多酚氧化酶氧化,产生半醌自由基和邻醌活性中间体。然后中间体通过含氨基的多糖,如壳聚糖(Chitosan,CS)进行非酶促亲核攻击,形成迈克尔型加合物和席夫碱产物[35,52],而多糖中的羟基可以与多酚氧化物中的羟基和羧基形成醚键或酯键的共价连接[53]。自由基介导法是由自由基诱导体系形成自由基,如抗坏血酸可被H2O2氧化诱导形成自由羟基[40]。形成的羟基自由基从多糖分子的反应性氨基或羟基中提取氢原子,生成多糖大自由基[42]。紧邻反应位点的多酚成为多糖大分子自由基的受体形成复合物。图2为利用自由基引发的接枝反应将多酚共价连接到壳聚糖上的机制示意图。EDC介导机制主要由EDC与含羧酸基团的多酚如阿魏酸(FerulicAcid,FA)、没食子酸(Gallic acid,GA)等,反应并形成高度反应性的中间体,中间体可与含胺或羟基的多糖反应形成多糖-多酚复合物[54]。酸缩合反应主要基于氧化多糖和多酚的醛基在酸介导的缩合下共轭[41]。
不同作用机制对于复合物的合成有不同的优点或缺点,酶催化反应简单且经济,但该反应会导致多酚氧化,从而对最终产品的生物活性可能产生负面影响[52]。通过EDC介导的反应过程非常复杂,尤其涉及多酚的复杂胺化。此外,通过EDC介导的反应其复合物的取代度太低,且昂贵试剂的大量使用不利于成本控制、产品安全和环境保护[54]。自由基介导的反应方法简单且经济,更重要的是,该方法对多糖具有非特异性选择性,也是应用最广泛的一种方法,但形成的复合物具有低的产物产率和取代度[40]。酸缩合反应产生的复合物显示出最高的取代度,且合成工艺简单,但成本相对较高。其中酸缩合反应是一种新的有希望取代自由基介导合成多糖-多酚复合物的方法。
2. 多糖与多酚相互作用的影响因素
多糖和多酚的结合状态是一个复杂而动态的过程,不同的合成条件对于复合物的理化性质(如取代度和结合亲和力等)具有显著的影响。影响多糖与多酚相互作用的因素可分为内源性和外源性因素。
2.1 内源性因素
内源性因素包括多糖和多酚的组成、结构和浓度。多糖的酯化类型和程度会影响复合物的结合亲和力。Fernandes等[20]研究了不同酯化程度和类型的果胶与矢车菊素-3-O-葡萄糖苷的相互作用,酯化程度和果胶类型对复合物的结合常数有显著影响,低甲酯化的果胶参与的相互作用结合常数最高,其次是酰胺化的果胶。甲酯化程度较高的果胶导致复合物的结合亲和力较低。多糖的酯化程度同样影响多糖和多酚的相互作用。Fernandes等[21]评估了阿拉伯聚糖分支程度与多酚相互作用的影响,结果表明较高的酯化度限制了阿拉伯聚糖与多酚的相互作用,降低了复合物的得率。可能是分支程度低的多糖更有利于通过聚合物缠结形成疏水空腔包裹多酚。果胶作为一种带负电的多糖可以与多酚类化合物(如原花青素)形成氢键和静电相互作用,同时果胶本身的支化程度(酯化、甲基化和乙酰化程度)会影响它与多酚的相互作用[55]。Liu等[56]研究发现,苹果果胶优先与高聚合的原花青素相互作用,并且线性果胶对原花青素具有更好的亲和力,此外,具有较高的摩尔质量、固有粘度和流体动力学半径的果胶多糖更有助于增加对原花青素的吸附。多酚的结构能够影响复合物的取代度和结合亲和力,例如儿茶素B环上的羟基数量对多糖-儿茶素复合物的取代度有很大影响,表儿茶素没食子酸酯(Epicatechin gallate,ECG)对多糖的亲和力相对较高[41,44]。黄酮类化合物是多酚的一大类,环上有不同数量和位置的羟基,影响了极性和形成氢键的能力,同时影响多酚对多糖的吸附能力。研究发现,具有更多羟基的类黄酮往往与多糖的相互作用更强[57−58]。在类黄酮异构体中,对燕麦β-葡聚糖吸附能力的强弱排序为:黄酮醇>顺序黄酮>黄酮>异黄酮[57]。
不同多糖中单糖的类型和比例构成不同,这同样影响多糖多酚间的相互作用[59]。不同的单糖有不同的极性,可以调节与多酚的相互作用。例如,阿拉伯糖和半乳糖比木糖和葡萄糖的极性更大,因此可以与多酚形成更强的氢键[60]。猕猴桃果胶比苹果果胶和甜菜果胶的同型半乳糖醛酸含量更高,与原花青素之间存在更多的氢键,故优先与原花青素结合[56]。
多酚的浓度会影响复合物的取代度。例如在儿茶素与多糖的反应体系中,儿茶素的浓度是影响多糖-儿茶素复合物取代度的最重要因素。当反应体系中儿茶素的浓度增加时,多糖-儿茶素复合物的取代度通常呈现增加的趋势[61−63]。然而,过量的儿茶素对多糖-儿茶素复合物的取代度有不利影响[64−65]。因此,应该优化并严格控制反应体系中多酚的浓度。而多糖的浓度会影响复合物的流变性。例如Dridi等[49]研究了多糖浓度对多糖-多酚相互作用的影响,结果表明向不同浓度的多糖(瓜尔胶、β-葡聚糖和黄原胶)溶液中添加酚类化合物(香草醛、咖啡酸、GA和表没食子儿茶素没食子酸酯)之后,溶液的流动性指数增加、流动一致性指数降低。以上效果会随着多糖浓度的变化而变化,尤其在多糖浓度为0.6×C*和1.4×C*时以上效果最明显,其中C*表示每种多糖的临界重叠浓度。
2.2 外源性因素
外源性因素是环境条件,如pH、温度、离子强度和其他成分(蛋白质等)的存在[66]。这些因素可以调节分子间结合亲和力和相互作用的热力学,以及复合物的形成和稳定性[67]。pH会影响多糖和多酚的电离状态,进而影响静电相互作用。较低的pH可能有利于带负电的多糖(如果胶)和带正电或质子化的多酚(如花青素)之间形成复合物,而较高的pH可能有利于带正电的多糖(如CS)和带负电或去质子的多酚(如GA)之间形成复合物[68]。Liu等[56]在pH2.0条件下提取的去分支果胶与原花青素的亲和力和聚集能力高于其他pH条件下提取的果胶。Phan等[69]发现,pH3~7是影响纤维素与一些多酚(花青素-3-葡萄糖苷,FA,(+/-)-儿茶素)之间结合的最主要因素,且影响的程度取决于多酚的类型。Wu等[70]也表明,当pH从3变化到7时,茶多酚(Tea polyphenols,TP)在pH为6时对燕麦β-葡聚糖的吸附最大。矢车菊素-3-葡萄糖苷与花青素的结合强度会随着pH从3到5而增加,然后随着pH从5到7而降低。这可能是由于花青素在不同pH下的结构变化所导致[71]。因此,pH对多糖和多酚的相互作用效应可能在很大程度上取决于多酚的类型。
温度会影响多糖和多酚的动能和分子流动性,这反过来又会影响它们的扩散速度和碰撞频率[58]。较高的温度可能会增加多糖和多酚之间形成复合物的速度,但也会增加复合物的解离或降解的速度。Li等[72]在加热含有单宁酸(Gallotannic acid,TA)和β-葡聚糖复合物的水溶液时,复合物水溶液的浊度从约 20 ℃ 到 30 ℃ 时急剧下降,从 30 ℃ 至 70 ℃ 保持相对较低,然后从 70 ℃ 至 90 ℃ 略微增加。浊度的这种显著变化可能是由于TA和β-葡聚糖之间的氢键随着温度的升高而减弱。氢键对温度高度敏感,若主要通过非共价相互作用形成的复合物就很容易受到温度的影响。He等[73]研究了不同pH、温度和尿素浓度下TA与不同分子量的魔芋葡甘聚糖(Konjac glucomannan,KGM)之间的相互作用。研究表明在25 ℃,pH为7、40 ℃,pH为3.8或加入尿素时,等温滴定量热的信号完全消失,KGM与TA形成复合物对pH、温度、尿素浓度有很强的依赖性。
离子强度的不同也会改变对多糖表面的电荷产生屏蔽作用的强弱,从而影响多糖与多酚之间的静电相互作用[74]。Gao等[75]发现,将NaCl和乙醇浓度增加至0.5 mol/L时,表没食子儿茶素没食子酸酯与燕麦β-葡聚糖的结合呈线性下降,表明离子强度会显著影响这种相互作用。Zhang等[76]采用平衡透析法研究了富含阿拉伯聚糖的果胶多糖(Arabinoglycan-rich pectin polysaccharides,ARPP)对FA的吸附性能。研究表明了吸附能力与离子强度呈负相关。离子强度的增加对FA在ARPP上的吸附产生了两种竞争机制。一方面,缓冲溶液中离子的水合作用有利于FA与ARPP的亲和性,从而提高了吸附能力。另一方面,离子强度的增加增强了ARPP表面上的负电荷水平,导致吸附位点的占用,最终导致吸附能力降低。因此盐的添加可能改变多酚和多糖分子之间的疏水相互作用,也可能改变复合物之间的静电排斥。Gao等[75]也使用了与Zhang等[76]同样的方法测定了燕麦β-葡聚糖对TP单体的选择性吸附,测定了吸附量和吸附效率。使用PBS缓冲溶液时,随着离子强度的增加,吸附量的值逐渐降低,表明疏水相互作用在吸附中起着至关重要的作用,离子强度可以通过改变疏水相互作用来影响吸附率。
综上所述,能够影响多糖与多酚相互作用的影响因素众多,其中以多糖和多酚的结构、反应体系所处的pH对相互作用的影响较大,主要影响多糖和多酚复合物的取代度、结合亲和力和产品收率[15,77]。目前一些合成多糖和多酚复合物的方法仍然存在一些缺陷,例如相对较高的成本和较低的产品收率。因此,迫切需要寻找新的替代方法以低成本高效合成多糖-多酚复合物,这需要对于复合物的合成条件进行更深入的研究。同时,多糖与多酚在不同条件下合成复合物的功能活性是否有显著差别并不清楚,相互作用的条件与复合物功能活性之间的关系也需要进一步研究。
3. 多糖与多酚相互作用对多酚或多糖特性的影响
多酚与多糖的相互作用对多酚或多糖的理化特性(溶解性、稳定性、结晶度和乳化性等)和生物活性(抗氧化性、抗癌活性、抗菌活性和抗炎活性等)均有显著影响。
3.1 对多酚理化特性的影响
多酚想要发挥出优秀的功能活性,其良好的溶解性和稳定性必不可少。然而,一般多酚化合物的水溶性低且稳定性受着多种因素的影响,包括但不限于光照、高温、以及环境的酸碱度。据报道聚合物中任何阻碍分子间缔合的结构特征,例如支化结构和带电基团的数目等,都能导致聚合物拥有较高的水溶性,多酚结合到多糖分子上可能阻碍分子间缔合[78]。多酚能够与食品中的主要营养物质,如多糖、蛋白质结合成复合物,这种结合将增加其物理稳定性[79]。因此,研究者们都热衷于将多酚与多糖通过共价与非共价的方式结合生成复合物,从而提升多酚的溶解性和稳定性。例如,由于存在N-Ac基团,CS的溶解度受pH影响,N-Ac基团在pH7下几乎不溶。然而,CS-多酚复合物表现出较好的溶解性,并且CS-酚酸复合物的溶解性与接枝率和反应条件有关[80−81]。四种结构不同的多酚(三种带儿茶酚基团和一种不含儿茶酚基团)偶联到果胶大分子上均表现出分别比多酚和果胶更高的稳定性[82]。Liu等[83]也提出,槲皮素-淀粉复合物的热稳定性优于白首乌淀粉和槲皮素,这可能是由于结合后结晶度增加所致。然而,多酚与多糖的结合也可能降低它们的热稳定性。例如,将FA连接到CS分子上却降低了它们的热稳定性,可能归因于阿魏酸的干扰即阿魏酸相对较低的分解温度导致了氢键结合减少[54]。
3.2 对多糖理化特性的影响
多糖的理化特性包括粘度、结晶度、流变性、乳化性和稳定性等特性。近年来,多糖与多酚的相互作用对多糖的理化特性的影响没有像对酚类化合物的性质的影响那样受到关注[84],尤其是专门关注多糖-多酚复合物对多糖溶液物理性质的影响的研究极少。在粘度和流变性方面,少数研究发现多糖和多酚结合能导致多糖溶液粘度降低和假塑性行为降低[72,85−86]。Guo等[34]报告称,由于自由基对多糖链的降解作用,通过自由基介导的反应产生的阿拉伯木聚糖-儿茶素复合物的粘度低于阿拉伯木聚糖,且阿拉伯木聚糖-儿茶素复合物的粘度随着取代度的增加而增加,因为儿茶素增加了阿拉伯木聚糖链的分子间摩擦。因此,推测通过酸缩合反应产生的多糖-儿茶素复合物的粘度可能会下降[34,52]。在结晶度方面,Liu等[87]通过X射线衍射测量了儿茶素、菊粉和儿茶素-菊粉复合物的结晶度,结果表明儿茶素-菊粉复合物具有最高的结晶度。然而,Yong等[36]研究发现,与原始淀粉和多酚相比,接枝淀粉的结晶度降低。在其它物理性质方面,Jin等[88]证明了在淀粉的情况下,酚酸也可以影响多糖物理性质的能力,咖啡酸和FA(但不包括GA)与马铃薯淀粉的结合降低了淀粉峰粘度、热糊粘度和冷糊粘度。花青素类化合物与淀粉结合后能够提高淀粉的糊化温度,降低淀粉的糊化焓值、消化速率、老化焓和老化率,进而改变淀粉的热力学等理化特性[89]。
多糖与多酚结合后由于结构、物理性质的改变,进一步会影响到它们的功能特性。许多研究也已经证实,多糖-多酚复合物具有更好的乳化能力和乳液稳定性[33,90]。Patel等[91]在甲基纤维素和TA之间的相互作用中直接观察到这种结合对多糖功能的影响,即经过等温量热滴定对非共价相互作用进行表征后,确定TA可降低胶凝温度,增强甲基纤维素的泡沫和乳液稳定性。今后,可从合成方法、取代度、多酚类型和多糖性质这几个因素去研究多糖-多酚复合物的理化特性。
3.3 对多酚和多糖生物活性的影响
3.3.1 抗氧化活性
据相关文献报道,人体在正常的代谢状态下会产生活性氧,包括O2−·、·OH、HO2−等自由基,人体正常状态下所产生的低水平活性氧对人体是有益的。然而,当人体失去平衡产生过量的活性氧就可能对靶细胞成分(如DNA、蛋白质和脂质)产生有害影响,从而引发如癌症、高脂血症、糖尿病、动脉粥样硬化、阿尔茨海默病、肾炎等疾病[92−93]。虽然酚类物质具有一定的抗氧化性,但是酚类化合物具有局限性,水溶性低、生物利用度低、在上胃肠道和肝脏中快速分解以及通过泌尿系统快速排泄,当酚类物质由口服摄入时,这些问题都将降低酚类物质的抗氧化活性[94]。这些问题能够通过与多糖的物理或化学结合来缓解,增强其抗氧化功能。Bermúdez-Oria等[95]研究了橄榄油提取过程中酚类和果胶多糖的相互作用,与从新鲜的橄榄果中提取的纯多酚或多糖相比,从橄榄果中所得的多糖-多酚复合物在体外对结肠癌Caco-2细胞表现出更高的抗氧化活性。刘秋兰等[96]研究了莲藕多糖与FA的非共价相互作用,相比莲藕多糖,其复合物具有更强的DPPH自由基清除活性。
多酚因其独特的化学结构(羟基的数量和排列),能够作为抗氧化剂清除自由基,从而保护细胞免受氧化应激的伤害,当多酚与多糖结合时,其抗氧化活性可能会因结合位点的不同而有所变化。例如,若多酚的酚羟基与多糖结合,可能导致其复合物的抗氧化能力弱于多酚[80];相反,若多酚与多糖形成更稳定的复合物,这可能有助于提高其在体内的稳定性和生物利用度,进而增强其抗氧化效果[97]。这种相互作用也可以改变乳液中的抗氧化活性,因为多酚可能被吸附到乳化剂或油滴表面,或者被包裹在多糖分子中,从而影响其与自由基的反应。总的来说,多糖-多酚复合物的抗氧化性主要来自于多酚,其多糖主要用于稳定及协同多酚抗氧化[98]。
3.3.2 抗菌活性
一些多糖-多酚复合物目前被用作有效的抗微生物剂以防止食品污染。多糖-多酚复合物的抗菌活性可以通过对细菌细胞壁和细胞质膜的不可逆损伤来实现,这是由于苯酚接枝增强了疏水性,该特性有利于与磷脂层(细菌膜的主要成分之一)相互作用,从而增加膜渗透性[99−100]。与单独的多糖和多酚相比,多糖-多酚复合物对大肠杆菌、金黄色葡萄球菌、假单胞菌、枯草芽孢杆菌、粪肠球菌等抑制生长的能力更强[36,101−102]。Wang等[103]制备了一种基于海藻酸钠和魔芋葡甘露聚糖与TP复合的新型包装膜。研究表明TP可以通过氢键嵌入到海藻酸钠-魔芋葡甘露聚糖复合膜的网络结构中,加入TP后多糖复合膜的抗菌性能得到了有效改善,该膜抗菌活性增强的原因是基于TP可以通过与肽聚糖作用来(破坏)影响细菌的细胞壁。张鹏敏等[104]将CS与姜黄素混合制作成了一种复合涂膜,其中CS与姜黄素由非共价相互作用形成复合物,比较了复合涂膜与姜黄素各自光动力的抑菌效果。结果表明该涂膜由于CS利用离子相互作用显著增强了姜黄素光动力的抑菌效果。CS发挥了纽带作用,增强了姜黄素和细菌的结合能力,这有利于光动力处理产生的活性氧直接破坏细菌的细胞膜,进而使活性氧与细菌内的多种分子相互作用,抑制细菌生长。然而,多酚和多糖的复合物与纯物质相比,其抑菌效果不一定更好。根据Yong等[36]的研究,淀粉-槲皮素复合物的抗菌活性比淀粉强,但比槲皮素弱,复合物的抗微生物活性主要归因于槲皮素部分。Mundlia等[102]报告称,柚皮素-果胶复合物对金黄色葡萄球菌、表皮葡萄球菌、枯草芽孢杆菌、大肠杆菌和铜绿假单胞菌的最小抑菌浓度分别为2.5、12、11.5、12.5和12.5 μg/mL,其单独柚皮素对这些细菌的最小抑菌浓度分别为6.5、24.5、12.5、12.5和23.5 μg/mL。由上述研究可以看出多酚和多糖的结合能改变各自的抑菌效果,但复合物的抑菌能力因细菌菌株和接枝多酚的类型而异。
3.3.3 抗糖尿病活性
糖尿病主要归因于胰岛素分泌(I型)、胰岛素作用(II型)或两者的缺陷,导致碳水化合物、脂质和蛋白质代谢异常[105]。多糖和多酚的相互作用能在一定程度上改变多糖或多酚的抗糖尿病活性。例如Zeng等[106]报道,单宁-菊粉复合物可通过静态猝灭机制猝灭α-淀粉酶和α-葡萄糖苷酶的荧光,其猝灭效果显著高于单宁和菊粉,说明结合后抗糖尿病活性增强。Zhu等[107]研究了CS-儿茶素复合物的抗糖尿病活性,与单独儿茶素和CS相比,复合物对α-葡萄糖苷酶的抑制率最高(72.45%),表现出更强的抗糖尿病活性。然而多糖与多酚的结合也有可能降低多糖或多酚的抗糖尿病活性。例如Campos等[108]研究了葡萄渣中多糖-多酚复合物的抗糖尿病作用,其多糖-多酚复合物是由果胶与花青素结合而成。与葡萄渣中游离的花青素相比,其复合物的抗糖尿病活性更弱。由此可知,多糖与多酚复合物主要降低II型糖尿病的风险。多糖和多酚的相互作用不一定能提高它们的抗糖尿病活性,其复合物抗糖尿病活性的强弱可能与多糖和多酚的种类以及相互作用的类型、强弱有关,这需要研究人员进一步探索。
3.3.4 其他生物活性
多酚和多糖的相互作用除了可以改变多酚或多糖的抗氧化活性、抗菌活性、抗糖尿病活性等几种主要的生物活性外,还能改变如糖脂代谢调节、神经保护、抗癌、抗炎等其他多种生物活性。多酚和多糖相互作用后因一些功能基团发生改变,与肠道微生物作用时对特定微生物的调节作用、产生的代谢产物种类及产量、细胞因子异于单独组分,因此可通过肠道微生物及其功能代谢产物介导,调控糖脂代谢,其复合物的糖脂代谢调节通常优于单独组分[109]。有学者评估了儿茶素-CS复合物对谷氨酸诱导的PC12细胞死亡的神经保护作用,儿茶素-CS复合物对谷氨酸引起的兴奋性毒性有较好的抑制作用,增大了PC12细胞的存活率。相反,不同浓度的CS对PC12细胞的存活没有显著影响,说明CS接枝儿茶素后增强了神经保护活性[110]。Wang等[111]发现乌龙茶中的TP和多糖复合物可以协同抑制肝细胞癌在体外和体内的增殖。姜黄素结合CS所形成的微球抗炎活性增强,且在预防皮肤感染方面具有潜在的应用价值[112]。
4. 多糖和多酚相互作用在食品中的应用
多糖和多酚之间的相互作用可以对食品质量和安全产生有益或有害的影响,具体的影响取决于多糖与多酚的类型以及合成条件等。大多数研究表明多酚-淀粉复合后能够降低淀粉的消化率[113−116]。但Adam等[117]研究发现谷物纤维素与FA复合后反而会降低FA的生物利用率,原因可能是谷物纤维素中的阿拉伯木聚糖和木质素与FA发生交联反应。另外,葡萄酒中的多糖与唾液蛋白竞争浓缩的单宁底物,抑制蛋白质-单宁相互作用,从而降低红葡萄酒的涩味,使得葡萄酒风味的平衡被打破[118]。
目前多糖和多酚的相互作用在食品领域主要应用于食品包装和功能性食品成分的封装,在食品包装方面主要用于制作保鲜膜。例如陶永元等[119]研究发现TP与CS复合物能显著降低草莓的失重率、腐烂指数、呼吸强度,减缓草莓维生素C、可滴定酸、可溶性糖含量的下降,由此保持较好的感官品质。项昭保等[120]以CS为成膜基质,抗氧化活性单体芦丁为功效物质制备了复合膜,研究表明该复合膜具有良好抗氧化活性,且与单独的CS膜相比,复合膜的断裂伸长率、抗紫外线能力和水蒸汽的透过性均更强。Ma等[121]以淀粉、马铃薯皮多酚和CS纳米颗粒为原料制备了缓释抗氧化膜,将马铃薯皮CS-多酚复合物加入到淀粉薄膜中后其复合膜表现出优异的抗氧化活性,且与单独的淀粉薄膜相比其柔韧性和结晶度都有所提高。对于功能性食品成分的封装主要体现在将多糖-多酚复合物微/纳米胶囊化。例如Ding等[122]研究了由麦芽糊精、CS和儿茶素形成复合物制成乳液后包埋油体(大豆细胞中存储豆油的细胞器)的效果。与麦芽糊精和CS制成的乳液相比,复合物制成的乳液包封率最高,且释放速度最慢。
尽管多糖-多酚复合物在食品工业中表现出良好的应用潜力,但复合物的应用仍面临一些挑战。首先,基于多糖-多酚复合物包装材料的生产成本高于市售塑料包装材料,寻求更经济的方法来制备复合物是必要的。第二,基于多糖-多酚复合物的包装材料通常在实验室中通过耗时且不连续的溶剂浇铸方法生产,这不适于工业生产。
5. 结语
近年来,经过大量学者的研究,证明多酚与多糖之间的相互作用能够改善多酚和多糖的结构、功能及其生物活性,进而调控食品的品质,如减少葡萄酒、果汁和茶饮料出现的浑浊现象,降低淀粉的消化率等。将多糖和多酚经过物理或化学连接形成的复合物可用于开发针对具有高风险健康问题人群的食品,例如,II型糖尿病、肥胖症、心血管疾病等。因此,复合物在功能性食品开发中显示出巨大的潜力,能够广泛应用于食品工业、医疗保健、生物膜材料等多个领域。
然而,多酚与多糖之间的相互作用研究仍然存在以下几个方面的问题:a.现有的合成方法还不能满足大规模生产的要求,所合成的复合物批次之间不一致,限制了其商业应用,需要探索出多酚与多糖之间相互作用的新机制,以及合适的合成条件;b.大多数关于复合物生物活性的证据都来自体外研究,新的多糖-多酚复合物可能具有安全性问题,还可能产生有害的中间物质,安全性方面的报道比较少,需要在商业化之前进行体内实验和毒性检测;c.多糖与多酚的相互作用对多糖理化性质的影响研究比较少,因此,需要增加多酚和多糖的相互作用对多糖理化性质方面的研究;d.大多数研究只表征了多糖和多酚复合物功能特性和生物活性的变化,对于产生这种变化的原因没有进行结构特征和分子机制方面的深入研究,阻碍了构效关系的建立。之后的研究可以试着运用QSAR模型、计算机辅助设计和高通量筛选技术来研究复合物的化学结构与生物活性之间的定量和定性关系。
-
表 1 多糖和多酚之间的非共价和共价相互作用
Table 1 Non-covalent and covalent interactions between polysaccharides and polyphenols
多糖类型 多酚类型 结合方式 参考文献 非共价相互作用 苹果细胞壁 表儿茶素、根皮苷、绿原酸 氢键 [18] 原花青素 疏水相互作用、氢键 [19]
果胶多糖绿原酸、根皮苷、原花青素 静电相互作用、疏水相互作用、氢键 [20−21] 单宁、花青素和聚合物色素 氢键 [22]
莲藕多糖阿魏酸、绿原酸 氢键和疏水相互作用 [23] 没食子酸、表没食子儿茶素 氢键 [24] 山慈菇多糖 核桃多酚 静电相互作用 [25] 蓝莓果胶 花青素 静电相互作用、疏水相互作用、氢键 [17] 阿拉伯胶、葡聚糖和柑橘果胶 香蕉缩合单宁 静电相互作用、疏水相互作用、氢键 [26] 白葡萄皮和红葡萄皮中获得的可溶性多糖 黄烷-3-醇 疏水相互作用、氢键 [27] 羟丙基壳聚糖 海藻酸钠 静电相互作用、氢键 [28] 可溶性膳食纤维 姜黄素 氢键 [29] 共价相互作用 壳聚糖 表儿茶素、表没食子酸盐 自由基介导反应 [30−31] 羧甲基壳聚糖 没食子酸、原儿茶酸 EDC介导的偶联反应 [32] 凝胶多糖 阿魏酸 自由基介导反应 [33] 阿糖基木聚糖 儿茶素 自由基介导反应 [34] 阿拉伯树胶 阿魏酸 漆酶介导反应 [35] 淀粉 槲皮素 CDI介导反应 [36] 果胶 橙皮素 自由基介导反应 [37] 葡聚糖 儿茶素 自由基介导反应 [38] 结冷胶 姜黄素、柚皮素 DCC介导偶联反应 [39] 注:EDC:N-(3-dimethylaminopropyl)-N-ethylcarbodiimide hydrochloride,1-乙基-3-(3-二甲基氨基丙基)碳二亚胺;CDI:N,N -carbonyldiimidazole,N,N-羰基二咪唑;DCC:dicyclo-hexylcarbodiimide,二环己基碳二亚胺。 表 2 多糖和多酚相互作用的研究方法以及优缺点
Table 2 Methods of studying polysaccharide and polyphenol interactions and their advantages and disadvantages
研究方法 研究内容 优点 缺点 参考文献 紫外-可见光谱法 用于结构表征及检测合成效果。识别共轭、某些特征官能团和异构体 最常用的定性方法,成本低,
简单方便多糖在有限波长中没有明显的吸收带 [34] 傅里叶变换红外光谱 用于结构表征及检测合成效果。区分不同相互作用和不同接枝率的复合物 非共价和共价连接的复合物都能显示多糖和多酚的所有特征峰 成本较高,操作较繁琐 [40] 荧光光谱法 可根据合成前后发射光谱的红移或蓝移证明合成成功,检测合成效果 分析速度快,操作简单 研究非常有限 [41] 核磁共振光谱法 可用于结构表征及检测合成效果,预测多糖和多酚之间的结合位置,可以得到动力学信息 可直接提供详细的结合部位信息和相互作用机理,无需完整地测定复合物的空间结构;可以得到动力学信息 成本高,检测灵敏度较低,需要较高浓度和较高稳定性的样品 [42] X射线衍射法 通过分析材料的X射线衍射图案获取有关材料成分、内部原子结构或形态的信息。可以基于XRD峰的形状来确定材料是否是晶体材料 无损检测、高精度、速度快、波长范围广和穿透能力强 样品用量大,设备较复杂
成本高[43] 扫描电镜 常用于观察样品的形态特征,可对比多酚、多糖和复合物之间的形态特征 可以获得高度三维和真实的样品表面微观结构信息 对于样品内部结构分析较
困难[44] 原子力显微镜 通过探针与被测样品之间微弱的相互作用力(原子力)来获得物质超微结构及表面信息,进而对样品的表面结构进行观察 可在多种环境下直接实时观测;图像分辨率高;基底选择性强 操作繁琐,成本高,
分析困难[45] 凝胶渗透色谱法 测量多糖和多酚结合前后分子量的变化 分离效率高,保留时间短 分子量的变化受反应条件的影响很大,分子量的变化只能用作缀合反应的额外指示 [34] 气相色谱法 可用于分离各组分、定量分析、可挥发的多糖类衍生物的分析 分辨率高 操作复杂,只能检测具有一定挥发性的物质 [46] 液相色谱法 对物质的分离纯化、组成分析、定量分析 能够高效分离混合物 分离时间长,转换率低 [47] 薄层色谱法 用于分离或纯化化合物的混合物 方便、经济和易于使用的优点,并且不需要大量的有机溶剂 分离效果不理想,在分离生物高分子方面存在局限性 [48] -
[1] HALAKE K, LEE J. Functional hyaluronic acid conjugates based on natural polyphenols exhibit antioxidant, adhesive, gelation, and self-healing properties[J]. Journal of Industrial and Engineering Chemistry,2017,54:44−51. doi: 10.1016/j.jiec.2017.04.018
[2] GANGOPADHYAY N, RAI D K, BRUNTON N P, et al. Antioxidant-guided isolation and mass spectrometric identification of the major polyphenols in barley (Hordeum vulgare) grain[J]. Food Chemistry,2016,210:212−220. doi: 10.1016/j.foodchem.2016.04.098
[3] LIU J, PU H, LIU S, et al. Synthesis, characterization, bioactivity and potential application of phenolic acid grafted chitosan:A review[J]. Carbohydrate Polymers,2017,174:999−1017. doi: 10.1016/j.carbpol.2017.07.014
[4] HU Q C, ZHANG W W, FENG W, et al. Human diet-derived polyphenolic compounds and hepatic[J]. Phytotherapy Research, 2024, 38(1):280-304.
[5] KHAN H, SUREDA A, BELWAL T, et al. Polyphenols in the treatment of autoimmune diseases[J]. Autoimmunity Reviews,2019,18(7):647−657. doi: 10.1016/j.autrev.2019.05.001
[6] LIU J, BAI R, LIU Y, et al. Isolation, structural characterization and bioactivities of naturally occurring polysaccharide-polyphenolic conjugates from medicinal plants-A reivew[J]. International Journal of Biological Macromolecules, 2018, 107(Pt B):2242 −2250.
[7] YANG X, LI A Q, LI X X, et al. An overview of classifications, properties of food polysaccharides and their links to applications in improving food textures[J]. Trends in Food Science & Technology,2020,102(C):1−15.
[8] GUO Q, XIAO X, LU L, et al. Polyphenol-polysaccharide complex:Preparation, characterization, and potential utilization in food and health[J]. Annual Review of Food Science and Technology,2022,13:59−87. doi: 10.1146/annurev-food-052720-010354
[9] LIU J, WANG X, YONG H, et al. Recent advances in flavonoid-grafted polysaccharides:Synthesis, structural characterization, bioactivities and potential applications[J]. International Journal of Biological Macromolecules,2018,116:1011−1025. doi: 10.1016/j.ijbiomac.2018.05.149
[10] 祝琳, 吴龙, 陈小强, 等. 茶多酚与多糖的相互作用:作用机理及功能特性变化研究进展[J]. 茶叶科学,2019,39(2):203−210. [ZHU L, WU L, CHEN X Q, et al. Interaction between tea polyphenols and polysaccharides:Progress on the mechanism of action and changes in functional properties[J]. Tea Science,2019,39(2):203−210.] doi: 10.3969/j.issn.1000-369X.2019.02.013 ZHU L, WU L, CHEN X Q, et al. Interaction between tea polyphenols and polysaccharides: Progress on the mechanism of action and changes in functional properties[J]. Tea Science, 2019, 39(2): 203−210. doi: 10.3969/j.issn.1000-369X.2019.02.013
[11] MILLET M, POUPARD P, LE QUERE J M, et al. Haze in apple-based beverages:Detailed polyphenol, polysaccharide, protein, and mineral compositions[J]. Journal of Agricultural and Food Chemistry,2017,65(31):6404−6414. doi: 10.1021/acs.jafc.6b05819
[12] YACCO R S, WATRELOT A A, KENNEDY J A. Red wine tannin structure-activity relationships during fermentation and maceration[J]. Journal of Agricultural and Food Chemistry,2016,64(4):860−869. doi: 10.1021/acs.jafc.5b05058
[13] WANG R, ZHOU J. Waxy maize starch nanoparticles incorporated tea polyphenols to stabilize Pickering emulsion and inhibit oil oxidation[J]. Carbohydrate Polymers,2022,296:119991. doi: 10.1016/j.carbpol.2022.119991
[14] LI R, PENG S, ZHANG R, et al. Formation and characterization of oil-in-water emulsions stabilized by polyphenol-polysaccharide complexes:Tannic acid and beta-glucan[J]. Food Research International,2019,123:266−275. doi: 10.1016/j.foodres.2019.05.005
[15] YONG H, LIU J. Polysaccharide-catechin conjugates:Synthesis methods, structural characteristics, physicochemical properties, bioactivities and potential applications in food industry[J]. Trends in Food Science & Technology,2024,145:104353.
[16] ZHANG W, SUN J, LI Q, et al. Free radical-mediated grafting of natural polysaccharides such as chitosan, starch, inulin, and pectin with some polyphenols:Synthesis, structural characterization, bioactivities, and applications-A Review[J]. Foods,2023,12(19):3688. doi: 10.3390/foods12193688
[17] KOH J, XU Z, WICKER L. Binding kinetics of blueberry pectin-anthocyanins and stabilization by non-covalent interactions[J]. Food Hydrocolloids,2020,99:105354. doi: 10.1016/j.foodhyd.2019.105354
[18] LIU D, LOPEZ-SANCHEZ P, MARTINEZ-SANZ M, et al. Adsorption isotherm studies on the interaction between polyphenols and apple cell walls:Effects of variety, heating and drying[J]. Food Chemistry,2019,282:58−66. doi: 10.1016/j.foodchem.2018.12.098
[19] LE BOURVELLEC C, BAGANO V B P, LEPERCQ P, et al. Procyanidin-cell wall interactions within apple matrices decrease the metabolization of procyanidins by the human gut microbiota and the anti-inflammatory effect of the resulting microbial metabolome in vitro[J]. Nutrients,2019,11(3):664. doi: 10.3390/nu11030664
[20] FERNANDES A, OLIVEIRA J, FONSECA F, et al. Molecular binding between anthocyanins and pectic polysaccharides–Unveiling the role of pectic polysaccharides structure[J]. Food Hydrocolloids,2020,102:105625. doi: 10.1016/j.foodhyd.2019.105625
[21] FERNANDES P, LE BOURVELLEC C, RENARD C, et al. Interactions of arabinan-rich pectic polysaccharides with polyphenols[J]. Carbohydrate Polymers,2020,230:115644. doi: 10.1016/j.carbpol.2019.115644
[22] WEILACK I, MEHREN L, SCHIEBER A, et al. Grape-derived pectic polysaccharides alter the tannin and pigment composition of cabernet sauvignon red wines[J]. Current Research in Food Science,2023,6:100506. doi: 10.1016/j.crfs.2023.100506
[23] LIU Q, ZOU X, YI Y, et al. Physicochemical and functional changes in lotus root polysaccharide associated with noncovalent binding of polyphenols[J]. Foods,2023,12(5):1049. doi: 10.3390/foods12051049
[24] PENG K, LI Y, SUN Y, et al. Lotus root polysaccharide-phenol complexes:Interaction, structure, antioxidant, and anti-inflammatory activities[J]. Foods,2023,12(3):577. doi: 10.3390/foods12030577
[25] ZHOU P, FENG R, LUO Z, et al. Synthesis, identification and bioavailability of Juglans regia L. polyphenols-Hohenbuehelia serotina polysaccharides nanoparticles[J]. Food Chemistry,2020,329:127158. doi: 10.1016/j.foodchem.2020.127158
[26] PU Y, CHEN L, HE X, et al. Soluble polysaccharides decrease inhibitory activity of banana condensed tannins against porcine pancreatic lipase[J]. Food Chemistry,2023,418:136013. doi: 10.1016/j.foodchem.2023.136013
[27] MANJON E, LI S, DUENAS M, et al. Effect of the addition of soluble polysaccharides from red and white grape skins on the polyphenolic composition and sensory properties of Tempranillo red wines[J]. Food Chemistry,2023,400:134110. doi: 10.1016/j.foodchem.2022.134110
[28] HAIYUN T, SHUJUAN Y, JIE C, et al. Interfacial characterization of an oxidative pickering emulsion stabilized by polysaccharides/polyphenol complex nanogels via a multiscale study[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2023,660:130791.
[29] HU Q D, MA R Y, TANG X X, et al. Self-assembled nanoparticles of curcuminoids and soluble dietary fibers:Characterization and mechanism[J]. LWT, 2023, 173:114375.
[30] MITTAL A, SINGH A, BENJAKUL S, et al. Composite films based on chitosan and epigallocatechin gallate grafted chitosan:Characterization, antioxidant and antimicrobial activities[J]. Food Hydrocolloids, 2020, 111:106384.
[31] YAN H, XU Y, DAI Z, et al. Comparative study of the properties of lutein nanoliposomes coated with chitosan/(-)-epigallocatechin- 3-gallate (EGCG) complexes[J]. Journal of the Science of Food and Agriculture,2023,103(7):3306−3314. doi: 10.1002/jsfa.12484
[32] XU C, GUAN S, XU J, et al. Preparation, characterization and antioxidant activity of protocatechuic acid grafted carboxymethyl chitosan and its hydrogel[J]. Carbohydrate Polymers,2021,252:117210. doi: 10.1016/j.carbpol.2020.117210
[33] YU Y B, CAI W D, WANG Z W, et al. Emulsifying properties of a ferulic acid-grafted curdlan conjugate and its contribution to the chemical stability of β-carotene[J]. Food Chemistry,2020,339:128053.
[34] GUO Q, XIAO X, LI C, et al. Catechin-grafted arabinoxylan conjugate:Preparation, structural characterization and property investigation[J]. International Journal of Biological Macromolecules,2021,182:796−805. doi: 10.1016/j.ijbiomac.2021.03.190
[35] VUILLEMIN M E, MICHAUX F, ADAM A A, et al. Physicochemical characterizations of gum Arabic modified with oxidation products of ferulic acid[J]. Food Hydrocolloids, 2020, 107:105919.
[36] YONG H, BAI R, BI F, et al. Synthesis, characterization, antioxidant and antimicrobial activities of starch aldehyde-quercetin conjugate[J]. International Journal of Biological Macromolecules,2020,156:462−470. doi: 10.1016/j.ijbiomac.2020.04.035
[37] REN Y, YU D, WU J, et al. Preparation and physicochemical properties characterization of hesperetin-grafted pectin conjugate[J]. International Journal of Biological Macromolecules,2023,243:124887. doi: 10.1016/j.ijbiomac.2023.124887
[38] GU L P, YAO X, MCCLEMENTS D J, et al. Fabrication, characterization, and application of catechin-dextran-egg white protein conjugates:Novel antioxidant emulsifiers[J]. LWT, 2023, 173:114268.
[39] MUNDLIA J, AHUJA M, KUMAR P. Enhanced biological activity of polyphenols on conjugation with gellan gum[J]. International Journal of Polymeric Materials,2020,70(10):1−18.
[40] WANG C, CAI W D, YAO J, et al. Conjugation of ferulic acid onto pectin affected the physicochemical, functional and antioxidant properties[J]. Journal of the Science of Food and Agriculture,2020,100(15):5352−5362. doi: 10.1002/jsfa.10583
[41] YONG H, HU H, WANG Z, et al. Structure, stability and antioxidant activity of dialdehyde starch grafted with epicatechin, epicatechin gallate, epigallocatechin and epigallocatechin gallate[J]. Journal of the Science of Food and Agriculture,2022,102(14):6373−6386. doi: 10.1002/jsfa.12003
[42] CAI W D, ZHU J, WU L X, et al. Preparation, characterization, rheological and antioxidant properties of ferulic acid-grafted curdlan conjugates[J]. Food Chemistry,2019,300:125221. doi: 10.1016/j.foodchem.2019.125221
[43] LIU J, YONG H M, LIU Y P, et al. Recent advances in the preparation, structural characteristics, biological properties and applications of gallic acid grafted polysaccharides[J]. International Journal of Biological Macromolecules,2019,156:1539−1555.
[44] WANG Z Y, HUANG J B, YUN D W, et al. Antioxidant packaging films developed based on chitosan grafted with different catechins:Characterization and application in retarding corn oil oxidation[J]. Food Hydrocolloids,2022,133:107970. doi: 10.1016/j.foodhyd.2022.107970
[45] 蔡蕊, 万鹏, 徐强, 等. 原子力显微镜-扫描电子显微镜共定位表征系统的研发与应用[J]. 分析测试技术与仪器,2024,30(1):53−57. [CAI R, WAN P, XU Q, et al. Development and application of an atomic force microscope-scanning electron microscope co-localization characterization system[J]. Analytical Testing Techniques and Instruments,2024,30(1):53−57.] CAI R, WAN P, XU Q, et al. Development and application of an atomic force microscope-scanning electron microscope co-localization characterization system[J]. Analytical Testing Techniques and Instruments, 2024, 30(1): 53−57.
[46] 杨亚楠, 周佳楠, 刘桂香. 气相色谱法检测食品中甜蜜素的条件优化[J]. 轻工科技,2024,40(2):27−30. [YANG Y N, ZHOU J N, LIU G X, et al. Optimization of conditions for the determination of sweeteners in foods by gas chromatography[J]. Light Industrial Science and Technology,2024,40(2):27−30.] YANG Y N, ZHOU J N, LIU G X, et al. Optimization of conditions for the determination of sweeteners in foods by gas chromatography[J]. Light Industrial Science and Technology, 2024, 40(2): 27−30.
[47] 羊洁芳, 楼美娟, 卢力, 等. 高效液相色谱法测定化妆品中类视黄醇含量[J]. 分析测试技术与仪器,2023,29(4):421−428. [YANG J F, LOU M J, LU L, et al. Determination of retinoids in cosmetics by high performance liquid chromatography[J]. Analytical Testing Techniques and Instruments,2023,29(4):421−428.] YANG J F, LOU M J, LU L, et al. Determination of retinoids in cosmetics by high performance liquid chromatography[J]. Analytical Testing Techniques and Instruments, 2023, 29(4): 421−428.
[48] JUN L, HUIMIN P, CHONG C, et al. Reaction mechanisms and structural and physicochemical properties of caffeic acid grafted chitosan synthesized in ascorbic acid and hydroxyl peroxide redox system[J]. Journal of Agricultural and Food Chemistry,2018,66(1):279−289. doi: 10.1021/acs.jafc.7b05135
[49] DRIDI W, BORDENAVE N. Influence of polysaccharide concentration on polyphenol-polysaccharide interactions[J]. Carbohydrate Polymers,2021,274:118670. doi: 10.1016/j.carbpol.2021.118670
[50] SHAO P, FENG J, SUN P, et al. Recent advances in improving stability of food emulsion by plant polysaccharides[J]. Food Research International,2020,137:109376. doi: 10.1016/j.foodres.2020.109376
[51] RENARD C M G C, WATRELOT A A, LE BOURVELLEC C. Interactions between polyphenols and polysaccharides:Mechanisms and consequences in food processing and digestion[J]. Trends in Food Science & Technology,2017,60:43−51.
[52] KIM S, REQUEJO K I, NAKAMATSU J, et al. Modulating antioxidant activity and the controlled release capability of laccase mediated catechin grafting of chitosan[J]. Elsevier,2017,59:65−76.
[53] 赵文红, 冯丽然, 关二旗. 麦麸阿魏酸低聚糖酯组分的结构表征及其对美拉德反应产物抑制作用研究[J]. 中国粮油学报,2021,36(7):33−39. [ZHAO W H, FENG L R, GUAN E Q. Structural characterization of the ferulic acid oligosaccharide ester fraction of wheat bran and its inhibition of meladic reaction products[J]. Chinese Journal of Cereals and Oils,2021,36(7):33−39.] doi: 10.3969/j.issn.1003-0174.2021.07.008 ZHAO W H, FENG L R, GUAN E Q. Structural characterization of the ferulic acid oligosaccharide ester fraction of wheat bran and its inhibition of meladic reaction products[J]. Chinese Journal of Cereals and Oils, 2021, 36(7): 33−39. doi: 10.3969/j.issn.1003-0174.2021.07.008
[54] WANG D, MAO L K, DAI L, et al. Characterization of chitosan-ferulic acid conjugates and their application in the design of β-carotene bilayer emulsions with propylene glycol alginate[J]. Food Hydrocolloids,2018,80:281−291. doi: 10.1016/j.foodhyd.2017.11.031
[55] QIU P, XU L, GAO L, et al. Exploring pyrimidine-substituted curcumin analogues:Design, synthesis and effects on EGFR signaling[J]. Bioorganic & Medicinal Chemistry,2013,21(17):5012−5020.
[56] LIU X W, RENARD CATHERINE M G C, ROLLAND-SABATE A, et al. Exploring interactions between pectins and procyanidins:Structure-function relationships[J]. Food Hydrocolloids,2021,113:106498. doi: 10.1016/j.foodhyd.2020.106498
[57] WANG Y, LIU J, CHEN F, et al. Effects of molecular structure of polyphenols on their noncovalent interactions with oat beta-glucan[J]. Journal of Agricultural and Food Chemistry,2013,61(19):4533−4538. doi: 10.1021/jf400471u
[58] 李梦杰, 胡坦, 潘思轶. 食品体系组成及加工方式对植物次生代谢物生物利用度的影响研究进展[J]. 食品科学,2022,43(5):328−337. [LI M J, HU T, PAN S Y, et al. Advances in the study of the effects of food system composition and processing methods on the bioavailability of plant secondary metabolites[J]. Food Sciences,2022,43(5):328−337.] doi: 10.7506/spkx1002-6630-20210719-223 LI M J, HU T, PAN S Y, et al. Advances in the study of the effects of food system composition and processing methods on the bioavailability of plant secondary metabolites[J]. Food Sciences, 2022, 43(5): 328−337. doi: 10.7506/spkx1002-6630-20210719-223
[59] 聂少平, 唐炜, 殷军艺, 等. 食源性多糖结构和生理功能研究概述[J]. 中国食品学报,2018,18(12):1−12. [NIE S P, TANG W, YIN J Y, et al. Overview of studies on the structure and physiological function of food-borne polysaccharides[J]. Journal of Chinese Institute of Food Science and Technology,2018,18(12):1−12.] NIE S P, TANG W, YIN J Y, et al. Overview of studies on the structure and physiological function of food-borne polysaccharides[J]. Journal of Chinese Institute of Food Science and Technology, 2018, 18(12): 1−12.
[60] 梁媛媛, 肖安红. 柑橘渣水不溶性膳食纤维的性质研究[J]. 粮食与油脂,2019,32(4):28−31. [LIANG Y Y, XIAO A H. Studies on the properties of water-insoluble dietary fiber from citrus pomace[J]. Grain and Oils,2019,32(4):28−31.] doi: 10.3969/j.issn.1008-9578.2019.04.009 LIANG Y Y, XIAO A H. Studies on the properties of water-insoluble dietary fiber from citrus pomace[J]. Grain and Oils, 2019, 32(4): 28−31. doi: 10.3969/j.issn.1008-9578.2019.04.009
[61] XIN H, MIN H, LI W, et al. Bioadhesive and antibacterial edible coating of EGCG-grafted pectin for improving the quality of grapes during storage[J]. Food Hydrocolloids, 2023, 136: 108255.
[62] MITTAL A, SINGH A, ALUKO R E, et al. Pacific white shrimp (Litopenaeus vannamei) shell chitosan and the conjugate with epigallocatechin gallate:Antioxidative and antimicrobial activities[J]. Journal of Food Biochemistry,2021,45(1):e13569.
[63] SINGH A, BENJAKUL S, HUDA N, et al. Preparation and characterization of squid pen chitooligosaccharide-epigallocatechin gallate conjugates and their antioxidant and antimicrobial activities[J]. Rsc Advances,2020,10(55):33196−33204. doi: 10.1039/D0RA05548D
[64] HU H, YONG H, YAO X, et al. Highly efficient synthesis and characterization of starch aldehyde-catechin conjugate with potent antioxidant activity[J]. International Journal of Biological Macromolecules,2021,173:13−25. doi: 10.1016/j.ijbiomac.2021.01.119
[65] ZHANG C, YU X, DIAO Y, et al. Free Radical grafting of epigallocatechin gallate onto carboxymethyl chitosan:Preparation, characterization, and application on the preservation of grape juice[J]. Food and Bioprocess Technology,2020,13(5):1−11.
[66] 舒心, 郭擎, 高彦祥. 以蛋白质为基础物质的姜黄素传递体系研究进展[J]. 中国食品学报,2022,22(5):383−398. [SHU X, GUO Q, GAO Y X. Advances in curcumin delivery system with protein-based substances[J]. Journal of Chinese Institute of Food Science and Technology,2022,22(5):383−398.] SHU X, GUO Q, GAO Y X. Advances in curcumin delivery system with protein-based substances[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(5): 383−398.
[67] 王翠萍, 晁琛, 王书军. 基于分子动力学模拟研究淀粉与脂质和蛋白质的相互作用:现状分析与未来趋势[J]. 食品与生物技术学报,2022,41(7):44−56. [WANG C P, YAO T, WANG S J. Molecular dynamics simulation-based study of starch interactions with lipids and proteins:Current analysis and future trends[J]. Journal of Food and Biotechnology,2022,41(7):44−56.] doi: 10.3969/j.issn.1673-1689.2022.07.005 WANG C P, YAO T, WANG S J. Molecular dynamics simulation-based study of starch interactions with lipids and proteins: Current analysis and future trends[J]. Journal of Food and Biotechnology, 2022, 41(7): 44−56. doi: 10.3969/j.issn.1673-1689.2022.07.005
[68] GEORGE D, MAHESWARI P U, BEGUM K. Chitosan-cellulose hydrogel conjugated with L-histidine and zinc oxide nanoparticles for sustained drug delivery:Kinetics and in-vitro biological studies[J]. Carbohydrate Polymers,2020,236:116101. doi: 10.1016/j.carbpol.2020.116101
[69] PHAN A D T, D B R, ARCY, et al. Polyphenol–cellulose interactions:Effects of pH, temperature and salt[J]. International Journal of Food Science & Technology,2016,51(1):203−211.
[70] WU Z, LI H, MING J, et al. Optimization of adsorption of tea polyphenols into oat beta-glucan using response surface methodology[J]. Journal of Agricultural and Food Chemistry,2011,59(1):378−385. doi: 10.1021/jf103003q
[71] LIN Z, FISCHER J, WICKER L. Intermolecular binding of blueberry pectin-rich fractions and anthocyanin[J]. Food Chemistry,2016,194:986−993. doi: 10.1016/j.foodchem.2015.08.113
[72] LI R, ZENG Z, FU G, et al. Formation and characterization of tannic acid/beta-glucan complexes:Influence of pH, ionic strength, and temperature[J]. Food Research International,2019,120:748−755. doi: 10.1016/j.foodres.2018.11.034
[73] HE Y, WANG S, LI J, et al. Interaction between konjac glucomannan and tannic acid:Effect of molecular weight, pH and temperature[J]. Food Hydrocolloids,2019,94:451−458. doi: 10.1016/j.foodhyd.2019.03.044
[74] 蔡燕萍, 游寅寅, 刘建华, 等. 大豆蛋白凝胶性及其改良方法的研究进展[J]. 食品与发酵工业,2021,47(15):298−306. [CAI Y P, YOU Y Y, LIU J H, et al. Progress in the study of soy protein gelation and its modification methods[J]. Food and Fermentation Industry,2021,47(15):298−306.] CAI Y P, YOU Y Y, LIU J H, et al. Progress in the study of soy protein gelation and its modification methods[J]. Food and Fermentation Industry, 2021, 47(15): 298−306.
[75] GAO R, LIU H, PENG Z, et al. Adsorption of ()-epigallocatechin-3-gallate (EGCG) onto oat β-glucan[J]. Food Chemistry,2012,132(4):1936−1943. doi: 10.1016/j.foodchem.2011.12.029
[76] ZHANG D, ZHU J, YE F, et al. Non-covalent interaction between ferulic acid and arabinan-rich pectic polysaccharide from rapeseed meal[J]. International Journal of Biological Macromolecules,2017,103:307−315. doi: 10.1016/j.ijbiomac.2017.05.053
[77] LIU X W, LE BOURVELLEC C, RENARD C M G C. Interactions between cell wall polysaccharides and polyphenols:Effect of molecular internal structure.[J]. Comprehensive Reviews in Food Science and Food Safety,2020,19(6):3574−3617. doi: 10.1111/1541-4337.12632
[78] GUO M Q, HU X, WANG C, et al. Polysaccharides:Structure and solubility[J]. Solubility of Polysaccharides,2017,2:8−21.
[79] LU X N, SHENG Q, WU X H, et al. Research progress of protein complex systems and their application in food:A review[J]. International Journal of Biological Macromolecules, 2024:130987.
[80] RUI L, XIE M, HU B, et al. Enhanced solubility and antioxidant activity of chlorogenic acid-chitosan conjugates due to the conjugation of chitosan with chlorogenic acid[J]. Carbohydrate Polymers,2017,170:206−216. doi: 10.1016/j.carbpol.2017.04.076
[81] XIE M, HU B, WANG Y, et al. Grafting of gallic acid onto chitosan enhances antioxidant activities and alters rheological properties of the copolymer[J]. Journal of Agricultural and Food Chemistry,2014,62(37):9128−9136. doi: 10.1021/jf503207s
[82] AHN S, HALAKE K, LEE J. Antioxidant and ion-induced gelation functions of pectins enabled by polyphenol conjugation[J]. International Journal of Biological Macromolecules,2017,101:776−782. doi: 10.1016/j.ijbiomac.2017.03.173
[83] LIU J, WANG X, YONG H, et al. Preparation, characterization, digestibility and antioxidant activity of quercetin grafted Cynanchum auriculatum starch[J]. International Journal of Biological Macromolecules,2018,114:130−136. doi: 10.1016/j.ijbiomac.2018.03.101
[84] DOBSON C C, MOTTAWEA W, RODRIGUE A, et al. Impact of molecular interactions with phenolic compounds on food polysaccharides functionality[J]. Adv Food Nutr Res,2019,90:135−181.
[85] TUDORACHE M, BORDENAVE N. Phenolic compounds mediate aggregation of water-soluble polysaccharides and change their rheological properties:Effect of different phenolic compounds[J]. Food Hydrocolloids,2019,97:105193. doi: 10.1016/j.foodhyd.2019.105193
[86] TUDORACHE M, MCDONALD J L, BORDENAVE N. Gallic acid reduces the viscosity and water binding capacity of soluble dietary fibers[J]. Food & Function,2020,11(7):5866−5874.
[87] LIU J, LU J F, KAN J, et al. Synthesis, characterization and in vitro anti-diabetic activity of catechin grafted inulin[J]. International Journal of Biological Macromolecules,2014,64:76−83. doi: 10.1016/j.ijbiomac.2013.11.028
[88] JIN U H, CHENG Y, PARK H, et al. Short chain fatty acids enhance aryl hydrocarbon (Ah) responsiveness in mouse colonocytes and Caco-2 human colon cancer cells[J]. Scientific Reports,2017,7(1):10163. doi: 10.1038/s41598-017-10824-x
[89] 李斌, 王琳, 岳健, 等. 花青素类化合物影响淀粉理化性质研究进展[J]. 食品工业科技,2024,45(1):343−351. [LI B, WANG L, YUE J, et al. Progress in the study of anthocyanin analogs affecting the physicochemical properties of starch[J]. Food Industry Science and Technology,2024,45(1):343−351.] LI B, WANG L, YUE J, et al. Progress in the study of anthocyanin analogs affecting the physicochemical properties of starch[J]. Food Industry Science and Technology, 2024, 45(1): 343−351.
[90] LEI F, WANG X, LIANG C, et al. Preparation and functional evaluation of chitosan‐EGCG conjugates[J]. Journal of Applied Polymer Science,2014,131(3).
[91] PATEL A R, SEIJEN TEN-HOORN J, HAZEKAMP J, et al. Colloidal complexation of a macromolecule with a small molecular weight natural polyphenol:Implications in modulating polymer functionalities[J]. Soft Matter,2013,9(5):1428−1436. doi: 10.1039/C2SM27200H
[92] PATLEVIC P, VASKOVA J, SVORC P J, et al. Reactive oxygen species and antioxidant defense in human gastrointestinal diseases[J]. Integrative Medicine Research,2016,5(4):250−258. doi: 10.1016/j.imr.2016.07.004
[93] DE FARIAS C C, MAES M, BONIFACIO K L, et al. Highly specific changes in antioxidant levels and lipid peroxidation in Parkinson's disease and its progression:Disease and staging biomarkers and new drug targets[J]. Neuroscience Letters,2016,617:66−71. doi: 10.1016/j.neulet.2016.02.011
[94] PAINI M, ALIAKBARIAN B, CASAZZA A A, et al. Chitosan/dextran multilayer microcapsules for polyphenol co-delivery[J]. Materials Science & Engineering C-Materials for Biological Applications,2015,46:374−380.
[95] BERMUDEZ-ORIA A, RODRIGUEZ-JUAN E, RODRIGUEZ-GUTIERREZ G, et al. Effect of the olive oil extraction process on the formation of complex pectin-polyphenols and their antioxidant and antiproliferative activities[J]. Antioxidants,2021,10(12):1858. doi: 10.3390/antiox10121858
[96] 刘秋兰, 邹晓琴, 易阳, 等. 莲藕多糖和阿魏酸的非共价相互作用及其复合物特性[J]. 中国食品学报,2023,23(7):26−36. [LIU Q L, ZOU X Q, YI Y, et al. Non-covalent interactions between lotus root polysaccharides and ferulic acid and their complex properties[J]. Journal of Chinese Institute of Food Science and Technology,2023,23(7):26−36.] LIU Q L, ZOU X Q, YI Y, et al. Non-covalent interactions between lotus root polysaccharides and ferulic acid and their complex properties[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(7): 26−36.
[97] NTULI S, LEUSCHNER M, BESTER M J, et al. Stability, morphology, and effects of in vitro digestion on the antioxidant properties of polyphenol inclusion complexes with beta-cyclodextrin[J]. Molecules,2022,27(12):3808. doi: 10.3390/molecules27123808
[98] MERCADO-MERCADO G, DE LA ROSA L A, ALVAREZ-PARRILLA E. Effect of pectin on the interactions among phenolic compounds determined by antioxidant capacity[J]. Journal of Molecular Structure,2020,1199:126967. doi: 10.1016/j.molstruc.2019.126967
[99] ALJAWISH A, CHEVALOT I, JASNIEWSKI J, et al. Laccase-catalysed functionalisation of chitosan by ferulic acid and ethyl ferulate:Evaluation of physicochemical and biofunctional properties[J]. Food Chemistry,2014,161:279−287. doi: 10.1016/j.foodchem.2014.03.076
[100] LI K, GUAN G, ZHU J, et al. Antibacterial activity and mechanism of a laccase-catalyzed chitosan–gallic acid derivative against Escherichia coli and Staphylococcus aureus[J]. Food Control,2019,96:234−243. doi: 10.1016/j.foodcont.2018.09.021
[101] CHATTERJEE N S, PANDA S K, NAVITHA M, et al. Vanillic acid and coumaric acid grafted chitosan derivatives:Improved grafting ratio and potential application in functional food[J]. Journal of Food Science and Technology,2015,52(11):7153−7162. doi: 10.1007/s13197-015-1874-4
[102] MUNDLIA J, AHUJA M, KUMAR P, et al. Improved antioxidant, antimicrobial and anticancer activity of naringenin on conjugation with pectin[J]. 3 Biotech,2019,9(8):312. doi: 10.1007/s13205-019-1835-0
[103] WANG S, LI M, HE B, et al. Composite films of sodium alginate and konjac glucomannan incorporated with tea polyphenols for food preservation[J]. International Journal of Biological Macromolecules, 2023, 242(Pt 1):124732.
[104] 张鹏敏, 王文秀, 孙剑锋, 等. 壳聚糖/姜黄素光动力复合涂膜对金黄色葡萄球菌的抑菌效果及机理[J]. 食品科学,2024,45(6):233−243. [ZHANG P M, WANG W X, SUN J F, et al. Inhibitory effect and mechanism of chitosan/curcumin photodynamic composite coating on Staphylococcus aureus[J]. Food Science,2024,45(6):233−243.] doi: 10.7506/spkx1002-6630-20230429-284 ZHANG P M, WANG W X, SUN J F, et al. Inhibitory effect and mechanism of chitosan/curcumin photodynamic composite coating on Staphylococcus aureus[J]. Food Science, 2024, 45(6): 233−243. doi: 10.7506/spkx1002-6630-20230429-284
[105] DELVECCHIO M. New advances in diabetes genetics[J]. International Journal of Molecular Sciences,2023,24(6):5591. doi: 10.3390/ijms24065591
[106] ZENG X, DU Z, DING X, et al. Preparation, characterization and in vitro hypoglycemic activity of banana condensed tannin-inulin conjugate[J]. Food & Function,2020,11(9):7973−7986.
[107] ZHU W, ZHANG Z. Preparation and characterization of catechin-grafted chitosan with antioxidant and antidiabetic potential[J]. International Journal of Biological Macromolecules,2014,70:150−155. doi: 10.1016/j.ijbiomac.2014.06.047
[108] CAMPOS F, PEIXOTO A F, FERNANDES P, et al. The antidiabetic effect of grape pomace polysaccharide-polyphenol complexes[J]. Nutrients,2021,13(12):4495. doi: 10.3390/nu13124495
[109] 师英春, 廖森泰, 杨琼, 等. 植物多酚和多糖经肠道微生态途径互作调节糖脂代谢的研究进展[J]. 食品安全质量检测学报,2023,14(8):109−118. [SHI Y C, LIAO S T, YANG Q, et al. Progress of plant polyphenols and polysaccharides interacting via intestinal microecological pathways to regulate glycolipid metabolism[J]. Journal of Food Safety and Quality Testing,2023,14(8):109−118.] SHI Y C, LIAO S T, YANG Q, et al. Progress of plant polyphenols and polysaccharides interacting via intestinal microecological pathways to regulate glycolipid metabolism[J]. Journal of Food Safety and Quality Testing, 2023, 14(8): 109−118.
[110] XU C, GUAN S, WANG B, et al. Synthesis of protocatechuic acid grafted chitosan copolymer:Structure characterization and in vitro neuroprotective potential[J]. International Journal of Biological Macromolecules,2018,109:1−11. doi: 10.1016/j.ijbiomac.2017.12.019
[111] WANG J, LIU W, CHEN Z, et al. Physicochemical characterization of the oolong tea polysaccharides with high molecular weight and their synergistic effects in combination with polyphenols on hepatocellular carcinoma[J]. Biomedicine & Pharmacotherapy,2017,90:160−170.
[112] SARANYA T S, RAJAN V K, BISWAS R, et al. Synthesis, characterisation and biomedical applications of curcumin conjugated chitosan microspheres[J]. International Journal of Biological Macromolecules,2018,110:227−233. doi: 10.1016/j.ijbiomac.2017.12.044
[113] ZHENG Y, TIAN J, KONG X, et al. Physicochemical and digestibility characterisation of maize starch–caffeic acid complexes[J]. LWT,2020,121:108857. doi: 10.1016/j.lwt.2019.108857
[114] WANG S, WU T, CUI W, et al. Structure and in vitro digestibility on complex of corn starch with soy isoflavone[J]. Food Science & Nutrition,2020,8(11):6061−6068.
[115] HAN M, BAO W, WU Y, et al. Insights into the effects of caffeic acid and amylose on in vitro digestibility of maize starch-caffeic acid complex[J]. International Journal of Biological Macromolecules,2020,162:922−930. doi: 10.1016/j.ijbiomac.2020.06.200
[116] ZHANG Y, GLADDEN I, GUO J, et al. Enzymatic digestion of amylose and high amylose maize starch inclusion complexes with alkyl gallates[J]. Food Hydrocolloids, 2020, 108:106009.
[117] ADAM A, CRESPY V, LEVRAT-VERNY M A, et al. The bioavailability of ferulic acid is governed primarily by the food matrix rather than its metabolism in intestine and liver in rats[J]. Journal of Nutrition,2002,132(7):1962−1968. doi: 10.1093/jn/132.7.1962
[118] R J M H, E J R, MATTEO M, et al. The interactions of wine polysaccharides with aroma compounds, tannins, and proteins, and their importance to winemaking[J]. Food Hydrocolloids,2022,110:107150.
[119] 陶永元, 舒康云, 吴加美, 等. 茶多酚与壳聚糖复配对草莓保鲜效果的影响[J]. 中国食品添加剂,2012(5):224−230. [TAO Y Y, SHU K Y, WU J M et al. Influence of tea polyphenols and chitosan complex on the preservation of strawberry freshness[J]. China Food Additives,2012(5):224−230.] doi: 10.3969/j.issn.1006-2513.2012.05.030 TAO Y Y, SHU K Y, WU J M et al. Influence of tea polyphenols and chitosan complex on the preservation of strawberry freshness[J]. China Food Additives, 2012(5): 224−230. doi: 10.3969/j.issn.1006-2513.2012.05.030
[120] 项昭保, 刘岩, 张琳婧. 芦丁-壳聚糖抗氧化食品保鲜膜的制备与表征[J/OL]. 重庆工商大学学报(自然科学版), 1−13 [2024-11-22]. http://kns.cnki.net/kcms/detail/50.1155.N.20240109.1018.002.html. [XIANG Z B, LIU Y, ZHANG L J. Preparation and characterization of rutin-chitosan antioxidant food cling film[J/OL]. Journal of Chongqing Technology and Business University (Natural Science Edition), 1−13 [2024-11-22]. http://kns.cnki.net/kcms/detail/50.1155.N.20240109.1018.002.html.] XIANG Z B, LIU Y, ZHANG L J. Preparation and characterization of rutin-chitosan antioxidant food cling film[J/OL]. Journal of Chongqing Technology and Business University (Natural Science Edition), 1−13 [2024-11-22]. http://kns.cnki.net/kcms/detail/50.1155.N.20240109.1018.002.html.
[121] MA Y J, ZHAO H Q, MA Q Y, et al. Development of chitosan/potato peel polyphenols nanoparticles driven extended-release antioxidant films based on potato starch[J]. Food Packaging and Shelf Life, 2022, 31:100793.
[122] DING J, XU Z J, QI B K, et al. Fabrication and characterization of soybean oil bodies encapsulated in maltodextrin and chitosan-EGCG conjugates:An in vitro digestibility study[J]. Food Hydrocolloids,2019,94:519−527. doi: 10.1016/j.foodhyd.2019.04.001





 下载:
下载:
 下载:
下载:



