Isolation and Identification of Four High Glycosidase-producing Strains from Xinhuichenpi and Their Probiotics Properties and Fermentation Effect Analysis
-
摘要: 为扩充促进新会陈皮发酵陈化的益生菌种质资源,本研究从新会陈皮中分离鉴定出4株细菌,并对其产酶能力、益生特性、安全性以及发酵新会陈皮的效果进行了评价。4株细菌均属于芽孢杆菌属,其中菌株L7具有最高的产滤纸酶、羧甲基纤维素酶、β-葡萄糖苷酶和果胶酶能力,酶活分别达到1.84、0.79、1.6和1.24 U/mL。所有菌株均能在胃肠道环境下良好的存活,具有较强的抑菌性和共聚集性,无溶血性,且对多种抗生素敏感,表现出良好的益生特性和安全性。L7发酵新会陈皮效果最佳。经L7发酵后,新会陈皮结合态黄酮组分被有效地转化成游离态形式释放,特别是橙皮苷、川陈皮素和桔皮素,较未发酵新会陈皮分别提高了34.8%、93.7%以及102.7%。此外,L7发酵后的新会陈皮表现出更强的抗氧化活性,这与其具有更高的柚皮素和橙皮素含量密切相关。本研究结果为新会陈皮健康产品的开发和加速陈化技术的建立提供了参考。Abstract: To expand the probiotic germplasm resources for promoting the fermentation and aging of Xinhuichenpi (XHCP), four strains from XHCP were isolated and identified, and evaluated from the perspective of their enzyme-producing capabilities, probiotic characteristics, safety, and XHCP fermentation effect. All four strains belonged to the Bacillus sp. Strain L7 had the highest capacity of producing filter paperlyase, carboxymethyl cellulase, β-glucosidase and pectinase, which reached 1.84, 0.79, 1.6 and 1.24 U/mL, respectively. All four strains could survive in the gastrointestinal environment, exhibiting strong antibacterial and co-aggregation properties, non-hemolytic activity, and antibiotic sensitivity, indicating of great probiotic characteristics and safety. Besides, L7 demonstrated the best fermentation effect on XHCP. The bound flavonoid components of XHCP were effectively converted into free form and released, especially hesperidin, nobiletin and tangeretin, increasing 34.8%, 93.7% and 102.7%, respectively, compared to the unfermented XHCP. Additionally, L7 fermented XHCP showed stronger antioxidant activity, which was closely related to its higher naringenin and hesperetin content. The results of this study can provide valuable references for the development of healthy products of XHCP and the establishment of accelerated aging techniques.
-
Keywords:
- Xinhuichenpi /
- Bacillus /
- glycosidase /
- probiotics properties /
- fermentation effect
-
新会陈皮产于广东省江门市新会区,是我国道地中药材,富含黄酮、挥发油、多糖和生物碱等多种活性成分,具有化痰止咳、顺气理中、抗氧化、抗炎和改善呼吸道疾病等多种药理作用[1]。新会陈皮由新鲜新会柑皮经自然陈化加工获得。在此过程中,新鲜柑皮的活性成分经复杂的物理、化学和微生物作用发生释放、转化以及积累,导致新会陈皮药理功效及香气风味增强。因此民间认为新会陈皮陈化时间越长,质量越佳[2]。然而,新会陈皮陈化过程缓慢复杂,条件敏感,陈化过程中极易引发虫蛀、霉变等问题,导致陈化过程失败,造成巨大的经济损失[3]。因此,亟需探究有效的新会陈皮加工方法以促进新会陈皮活性成分的释放和转化,加快陈皮陈化速度。
目前已报道的新会陈皮加速陈化方法主要分为物理法和生物法。物理法主要通过改变新会柑皮存储的温度、湿度、氧气等条件加快活性成分的氧化作用,进而改善新会陈皮活性成分组成[4]。Chen等[5]通过短时蒸煮处理提高了柑橘果皮陈化过程中橙皮苷、川陈皮素、桔皮素和辛弗林含量。然而,物理方法设备要求高,活性成分转化速度慢。此外,温度、湿度、氧气等环境条件的改变易滋生霉菌,影响陈皮陈化效果。研究发现,不同年份陈皮表面均含有丰富的微生物群落[6],猜测新会陈皮活性成分的转化与微生物作用密切相关,因此,微生物发酵可能是加快新会陈皮陈化过程的有效手段。微生物发酵过程中分泌的酶(如纤维素酶、果胶酶、β-葡萄糖苷酶等)不仅能够破坏植物组织结构,促进活性成分释放,还可水解黄酮糖苷类成分中的糖苷键,将其转化为小分子黄烷酮苷元类成分,提高陈皮的食用价值[7]。然而新会陈皮发酵微生物种质资源匮乏,严重阻碍了发酵在新会陈皮加速陈化中的应用。已报道的可用于陈皮发酵的微生物多为真菌,如黑曲霉、黄曲霉、青霉、巴西曲霉等[8−9],本团队也曾通过红曲霉和酿酒酵母固态发酵的方式促进了新会陈皮游离态活性成分的释放和转化[7]。然而,多数真菌不属于可食用菌,且发酵过程中易产生真菌毒素,在食品应用中存在安全隐患。相较于真菌,细菌中可食用益生菌种类更多,安全性更强。已报道的陈皮发酵细菌有乳酸芽孢杆菌、植物乳杆菌以及枯草芽孢杆菌[10−12],但可能是由于这些细菌均不是自陈皮中筛选分离,其对陈皮活性成分的转化效果有限。He等[13]从新会陈皮中筛选出8株具有降胆固醇潜力的益生菌细菌,但其能否转化新会陈皮活性成分尚不可知。张莎[14]从新会陈皮分离出3株细菌,但仅在发酵饲料中有所应用。因此,从新会陈皮中筛选可促进新会陈皮活性成分释放和转化的功能益生菌对构建新会陈皮加速陈化发酵工艺极为必要。
目前,尚未有关于利用新会陈皮源益生菌细菌发酵改善新会陈皮活性成分组成和药理功效的报道。因此,本研究从新会陈皮中分离筛选多株高产纤维素酶、果胶酶和β-葡萄糖苷酶的细菌,并对其进行菌种鉴定;考察筛选菌株的益生特性和安全性;评估筛选菌株对新会陈皮的发酵效果。本研究旨在扩充新会陈皮益生菌种质资源库,并为新会陈皮加速陈化工艺建立提供参考。
1. 材料与方法
1.1 材料与仪器
新会陈皮 2022年11月采收自广东省江门市新会区三江镇,陈化年份为1年; Escherichia coli CGMCC1.3373、Staphylococcus aureus CGMCC 1.6750 中国普通微生物菌种保藏管理中心;血平板 广东环凯生物科技有限公司;甲酸(色谱级)、乙腈(色谱级)、胃蛋白酶(>3000 U/mg)、胰蛋白酶(130 U/mg) 上海麦克林生化科技股份有限公司;细菌DNA提取试剂盒 生工生物工程(上海)股份有限公司;其余未提到试剂均为分析纯 国药集团化学试剂有限公司。
LTQ-Orbitrap-Elite超高分辨液质联用仪 美国赛默飞公司;SunFire C18柱(250 mm×4.6 mm,5 μm) 美国Waters公司;KQ-400KDE超声仪 昆山市超声仪器有限公司;SpectraMax Plus全自动酶标仪 美国Molecular Devices公司;5804R冷冻高速离心机 德国艾本德公司;SP510全自动高压灭菌锅 日本Yamato公司;LRH-150B生化培养箱 韶关市泰宏医疗器械有限公司。
1.2 实验方法
1.2.1 培养基配制
产纤维素酶选择性富集培养基:氯化钠5 g/L,纤维素二钠5 g/L,滤纸2 g/L,碳酸钙1 g/L,酵母膏1 g/L,蛋白胨5 g/L,pH7.6,121 ℃灭菌20 min。
产果胶酶选择性富集培养基:果胶5 g/L,硫酸镁2 g/L,磷酸氢二钾1 g/L,硫酸铵0.4 g/L,硫酸亚铁0.01 g/L,pH7.0,121 ℃灭菌20 min。
产β-葡萄糖苷酶选择性富集培养基:橙皮苷5 g/L,蛋白胨10 g/L,酵母膏5 g/L,氯化钠10 g/L,磷酸二氢钾1 g/L,硫酸镁0.2 g/L,pH7.0,121 ℃灭菌20 min。
产纤维素酶固体培养基:产纤维素酶选择性富集培养基中加入2.0 g/L刚果红及20 g/L琼脂,121 ℃灭菌20 min。
产果胶酶固体培养基:产果胶酶选择性富集培养基中加入2.0 g/L刚果红及20 g/L琼脂,121 ℃灭菌20 min。
产β-葡萄糖苷酶固体培养基:产β-葡萄糖苷酶选择性富集培养基中加入20 g/L琼脂,121 ℃灭菌20 min。
1.2.2 高产酶微生物的分离筛选
将1.5 g新会陈皮分别接种于50 mL三种产酶选择性富集培养基中,于30 ℃、180 r/min的条件下培养24 h。随后,将三种产酶选择性富集菌液稀释涂布于对应的固体筛选培养基表面,于30 ℃条件下培养48 h。通过比较透明圈大小,挑选产酶能力较强的微生物继续在固体筛选培养基上多次划线,验证其产酶能力,并获得纯种单菌落。将纯种单菌落接种于LB培养基中,于30 ℃、180 r/min的条件下培养24 h,随后保藏在甘油管中。
1.2.3 微生物菌株鉴定
1.2.3.1 形态学鉴定
将筛选出的微生物接种于LB固体培养基上,于30 ℃培养24 h,观察菌落形态。
1.2.3.2 微生物生理生化指标检测
对筛选的微生物进行革兰氏染色、水解试验(淀粉、酪蛋白、明胶)、V.P试验、吲哚试验、柠檬酸盐试验、甲基红试验等生理生化试验[15]。
1.2.3.3 分子生物学鉴定
通过细菌DNA提取试剂盒提取筛选微生物的DNA。利用细菌通用引物27F(5'-AGAGTTTGATCMTGGCTCAG-3')以及1492R(5'-TACGGYTACCTTGTTACGACTT-3')对微生物DNA进行PCR扩增。PCR条件:94 ℃预变性3 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃终延伸10 min[16]。将PCR扩增产物送至生工生物工程(上海)有限公司进行测序,测序结果提交至NCBI数据库进行BLAST比对。利用Mega7.0软件通过邻接法构建系统发育树。
1.2.4 微生物产酶能力测定
将筛选出的菌种分别接种于三种产酶选择性富集培养基中,于30 ℃、180 r/min的条件下培养24 h。随后,将菌液在4 ℃、6000 r/min条件下离心20 min,测定上清液(即粗酶液)中的纤维素酶、果胶酶以及β-葡萄糖苷酶活性[7]。
1.2.4.1 纤维素酶酶活的测定
本研究通过测定滤纸酶和羧甲基纤维素酶的活性综合评估纤维素酶的活性[17]。
滤纸酶酶活的测定:将1 mL粗酶溶液和1 mL磷酸盐缓冲液(50 mmol/L,pH4.8)均匀混合,加入滤纸片(1 cm×1 cm),将混合物在50 ℃下酶解60 min。随后加入3 mL 3,5-二硝基水杨酸(DNS)溶液,煮沸10 min,迅速冷却至室温后在540 nm处测定反应液的吸光度。
羧甲基纤维素酶酶活的测定:将1 mL粗酶液与1 mL 2%(m/v)羧甲基纤维素钠(CMC-Na)溶液均匀混合,50 ℃下酶解60 min。随后加入3 mL DNS溶液,煮沸10 min,迅速冷却至室温后在540 nm处测定反应液的吸光度。一个酶活单位的滤纸酶或羧甲基纤维素酶活性定义为在测定条件下每分钟释放1 µmol葡萄糖所需的酶量。
1.2.4.2 果胶酶酶活的测定
将1 mL粗酶液和2 mL 2%(m/v)果胶溶液均匀混合,50 ℃下酶解60 min。随后加入3 mL DNS溶液,煮沸10 min,迅速冷却至室温后在520 nm处测定反应液的吸光度。一个酶活单位的果胶酶活性定义为在测定条件下每分钟释放1 mg半乳糖醛酸所需的酶量。
1.2.4.3 β-葡萄糖苷酶酶活的测定
将200 μL粗酶液、800 μL醋酸盐缓冲液(50 mmol/L,pH5.0)和100 μL 9 mmol/L的对硝基苯基-β-D-吡喃葡糖苷溶液均匀混合,50 ℃下酶解60 min。随后加入500 μL 1 mol/L Na2CO3溶液终止反应,在420 nm处测定吸光度。一个酶活单位的β-葡萄糖苷酶活性定义为测定条件下每分钟释放1 µmol 对硝基酚所需的酶量。
1.2.5 微生物益生特性及安全性测定
1.2.5.1 微生物的活化
将筛选微生物接种于LB培养基中,30 ℃、180 r/min培养24 h,得活化微生物菌液。
1.2.5.2 自聚集性测定
微生物的自聚集性参考文献中报道的方法测定[18]。将活化后的微生物菌液在4 ℃、6000 r/min条件下离心10 min,收集沉淀并加入磷酸盐缓冲液(50 mmol/L,pH7.5)复溶,使溶液的OD600达到0.4±0.05。随后在37 ℃下静置培养2、4、6和24 h,测定OD600,以初始吸光值A0为对照。
自聚集性(%)=(1−A2,4,6or24hA0h)×100 1.2.5.3 微生物胃肠液耐受性测试
微生物的胃肠液耐受性参考文献中报道的方法测定[16]。将活化后的微生物菌液在4 ℃、6000 r/min条件下离心15 min,收集沉淀并加入磷酸盐缓冲液(50 mmol/L,pH2.5)复溶,再次用相同条件离心后向沉淀中加入10 mL人工胃液(包含4000 U/mL胃蛋白酶和2 mg/mL NaCl溶液)混匀,于37 ℃、150 r/min下培养4 h。
将活化后的微生物菌液在4 ℃、6000 r/min条件下离心15 min,收集沉淀并加入磷酸盐缓冲液(50 mmol/L,pH8.0)复溶,再次用相同条件离心后向沉淀中加入10 mL人工肠液(包含3 mg/mL胆盐和200 U/mL胰蛋白酶)混匀,于37 ℃、150 r/min下培养6 h。
将胃、肠培养液用无菌水适当稀释后涂布于LB固体培养基上,于37 ℃培养24 h后对菌落进行计数。
菌落存活率(%)=胃培养液或肠培养液菌落数初始菌液菌落数×100 1.2.5.4 抑菌性和共聚集性测定
以E. coli及S. aureus作为指示菌,测定微生物的抑菌性和共聚集性[19]。将指示菌接种于LB液体培养基中培养24 h,随后用磷酸缓冲液(50 mmol/L,pH7.4)稀释菌悬液至浓度约为108 CFU/mL,标准对照为0.5号麦氏比浊管。
将活化后的微生物菌液在4 ℃、8000 r/min条件下离心10 min,上清液经0.22 μm滤膜过滤备用。向2 mL LB液体培养基中加入500 μL上述过膜后的菌株上清液和500 μL指示菌液,混匀后于30 ℃、180 r/min条件下培养24 h,测定OD600。以无菌水代替筛选菌株上清液作为阳性对照组,空白培养基为阴性对照组。
抑菌率(%)=OD阳性对照−OD实验组OD阳性对照×100 分别测定活化后的微生物菌液以及浓度为108 CFU/mL的指示菌液的OD600,分别记为A1和A2。随后,将微生物菌液和指示菌液按1:1(v:v)的比例混匀后于30 ℃、180 r/min条件下培养24 h,测定其OD600,记为A3。
共聚集性(%)=[(A1+A2)/2−A3]/[(A1+A2)/2]×100 1.2.5.5 溶血性测定
按Lee等[20]的方法测定筛选的微生物的溶血性。将筛选的微生物接种于含70%羊血的血平板上,在30 ℃下培养24 h后观察现象,若在菌落周围出现1~2 mm的草绿色带则认为其具有α-溶血性,若形成清晰的溶血圈则认为其具有β-溶血性,菌落周围未产生任何区域的分离物则认为其不具有溶血性。
1.2.5.6 药敏性测定
选择青霉素、氨苄西林、头孢氨苄、庆大霉素、四环素、诺氟沙星、克林霉素和氯霉素这8种抗生素药敏纸片进行药敏性测试[21]。活化后的微生物菌液用磷酸缓冲液(50 mmol/L,pH7.4)稀释至浓度约为108 CFU/mL,均匀涂抹于LB固体培养基表面,将药敏纸片置于培养基中心,随后于30 ℃条件下培养24 h,测量抑菌圈直径。根据微生物药敏性评估标准(表1)判断菌株对8种抗生素的敏感程度。
表 1 微生物药敏性评估标准Table 1. Microbial susceptibility assessment criteria药物名称 规格(μg/disc) 抑菌圈直径(mm) 耐药R 中介I 敏感S 青霉素 10 ≤28 28~29 ≥29 氨苄西林 10 ≤15 15~16 ≥16 头孢氨苄 30 ≤15 15~17 ≥17 庆大霉素 10 ≤13 13~14 ≥14 四环素 30 ≤15 15~18 ≥18 诺氟沙星 10 ≤13 13~16 ≥16 克林霉素 2 ≤16 16~18 ≥18 氯霉素 30 ≤12 13~17 ≥18 1.2.6 陈皮固态发酵
陈皮固态发酵培养基由米粉(25%,w/w)和新会陈皮(75%,w/w)组成[7]。将米粉在121 ℃下灭菌20 min,然后将新会陈皮在紫外线照射下灭菌60 min,将米粉和陈皮在250 mL三角瓶中混匀。将不同微生物种子液(浓度约为2×109 CFU/mL)分别以1:1(v/w)的比例接种到陈皮固态发酵培养基中,在30 ℃、70%相对湿度的条件下发酵10 d。发酵后,收集样品,在40 ℃条件下干燥24 h,随后保存在4 ℃冰箱中,以未发酵新会陈皮作为对照组。
1.2.7 陈皮黄酮类化合物提取及测定
陈皮游离态黄酮和结合态黄酮提取方法详见参考文献[22]。通过AlCl3比色法测定样品黄酮类化合物含量[20]。使用Thermo Scientific LC-HRESI-MS/MS系统和SunFire C18柱(250 mm×4.6 mm,5 μm)分析黄酮成分。液相条件如下:柱温为30 ℃;流速为0.8 mL/min;流动相A为0.1%(v/v)的甲酸溶液,流动相B为乙腈;梯度洗脱条件为:0 min 5%B;10 min 10%B;25 min 20%B;40 min 40%B;65 min 90%B;70 min 5%B;进样体积为5 µL;质谱条件如下:质量范围为150~800 Da、碰撞能量为30 eV;电喷雾电离(ESI)源温度300 ℃,鞘气30 arb,辅助气10 arb,离子传输管温度300 ℃,正离子模式的离子喷雾电压3.2 kV。使用Compound Discoverer软件(3.0版)处理化合物的准确分子量、保留行为和特征离子碎片数据。使用mzCloud网络数据库、本地高分辨率中药成分质谱数据库(mzVault)以及对应的标准品对化合物进行定性定量分析。
1.2.8 抗氧化活性测定
通过1,1-二苯基-2-苦基肼(DPPH)自由基清除活性、2,2-连氮基-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)阳离子自由基清除活性以及铁离子还原能力(FRAP)评估样品的抗氧化活性[23]。
将50 μL黄酮提取液(0、0.1、0.2、0.3、0.4和0.5 mg DW/mL)或Trolox标准品溶液(10、20、30、40、50、60、70和80 μg/mL)与400 μL DPPH溶液(60 μmol/L)在30 ℃避光条件下反应30 min,在515 nm处测定反应溶液的吸光度。
将ABTS(7 mmol/L)和过硫酸钾(2.45 mmol/L)在30 ℃黑暗条件下反应16 h,生成ABTS自由基阳离子。随后,用蒸馏水稀释ABTS溶液至吸光度为0.70±0.05(734 nm)。将50 μL黄酮提取液(0、0.1、0.2、0.3、0.4和0.5 mg DW/mL)或Trolox标准品溶液(10、20、40、60、80和100 μg/mL)与400 μL ABTS溶液在30 ℃条件下避光反应10 min,在734 nm处测定反应溶液的吸光度。
将10 mL乙酸盐缓冲液(30 mmol/L,pH3.6)、1 mL 2,4,6-三(2-吡啶基)三嗪(TPTZ)溶液(包含10 mmol/L TPTZ和40 mmol/L HCl)和1 mL氯化铁溶液(20 mmol/L)混匀,制备FRAP工作溶液。将10 μL黄酮提取液(0、0.1、0.2、0.3、0.4和0.5 mg DW/mL)或Trolox标准品溶液(10、20、40、60、80和100 μg/mL)与300 μL FRAP工作液在30 ℃条件下避光反应30 min,在593 nm处测定反应液的吸光度。
结果以每克陈皮干物质量相当于Trolox质量的毫克数表示,即mg TE/g DW。IC50代表抑制50%自由基所需的样品量。
1.3 数据处理
所有实验均进行三次重复;利用Origin 2023和SPSS Statistics 22.0软件分析实验数据;通过单因素方差分析方法进行显著性差异分析,P<0.05代表差异显著。
2. 结果与分析
2.1 新会陈皮高产糖苷酶益生菌的鉴定
2.1.1 形态学观察
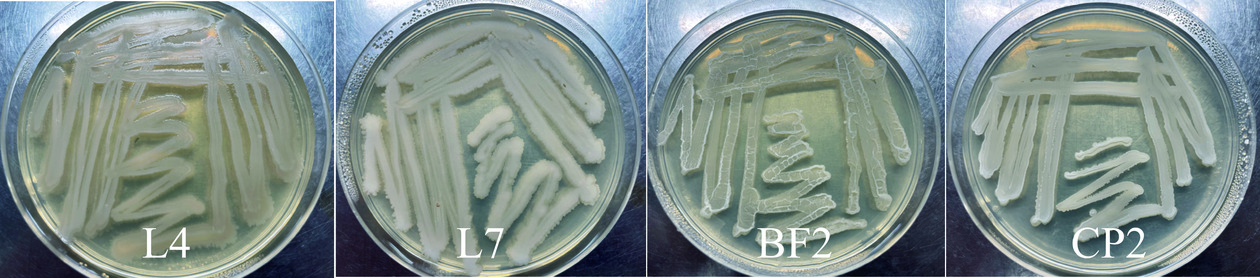
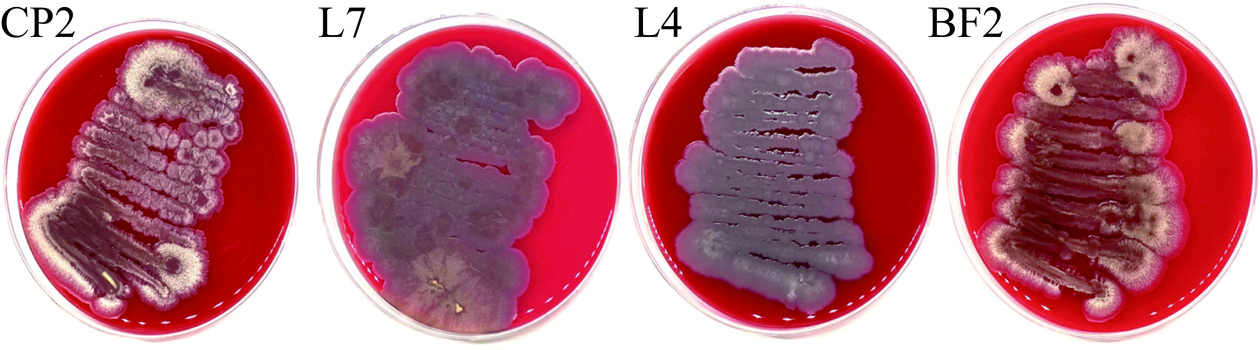
由图1可见,4株菌株菌落较大,均呈乳白色不透明状,菌体表面干燥、粗糙、无光泽,边缘处有褶皱和突起,菌落挑起时呈现黏稠状,这与《伯杰氏系统细菌学手册》中芽孢杆菌的形态特征描述相似,因此初步判断该4株菌株属于芽孢杆菌属。
2.1.2 生理生化指标
由表2可见,4株微生物革兰氏染色均为阳性,能够分解淀粉、酪蛋白以及明胶。此外,V.P试验、吲哚试验以及柠檬酸盐试验均呈阳性,甲基红试验呈阴性。根据《伯杰氏系统细菌学手册》中的相关描述以及微生物菌落的特征形态,初步鉴定筛选的4株微生物为芽孢杆菌属。
表 2 生理生化鉴定结果Table 2. Results of physiological and biochemical identification项目 L4 L7 BF2 CP2 革兰氏染色 + + + + 淀粉水解 + + + + 酪蛋白水解 + + + + 明胶水解 + + + + V.P试验 + + + + 吲哚试验 + + + + 甲基红试验 – – – – 柠檬酸盐试验 + + + + 注:“+”代表阳性,“–”代表阴性。 2.1.3 分子生物学鉴定
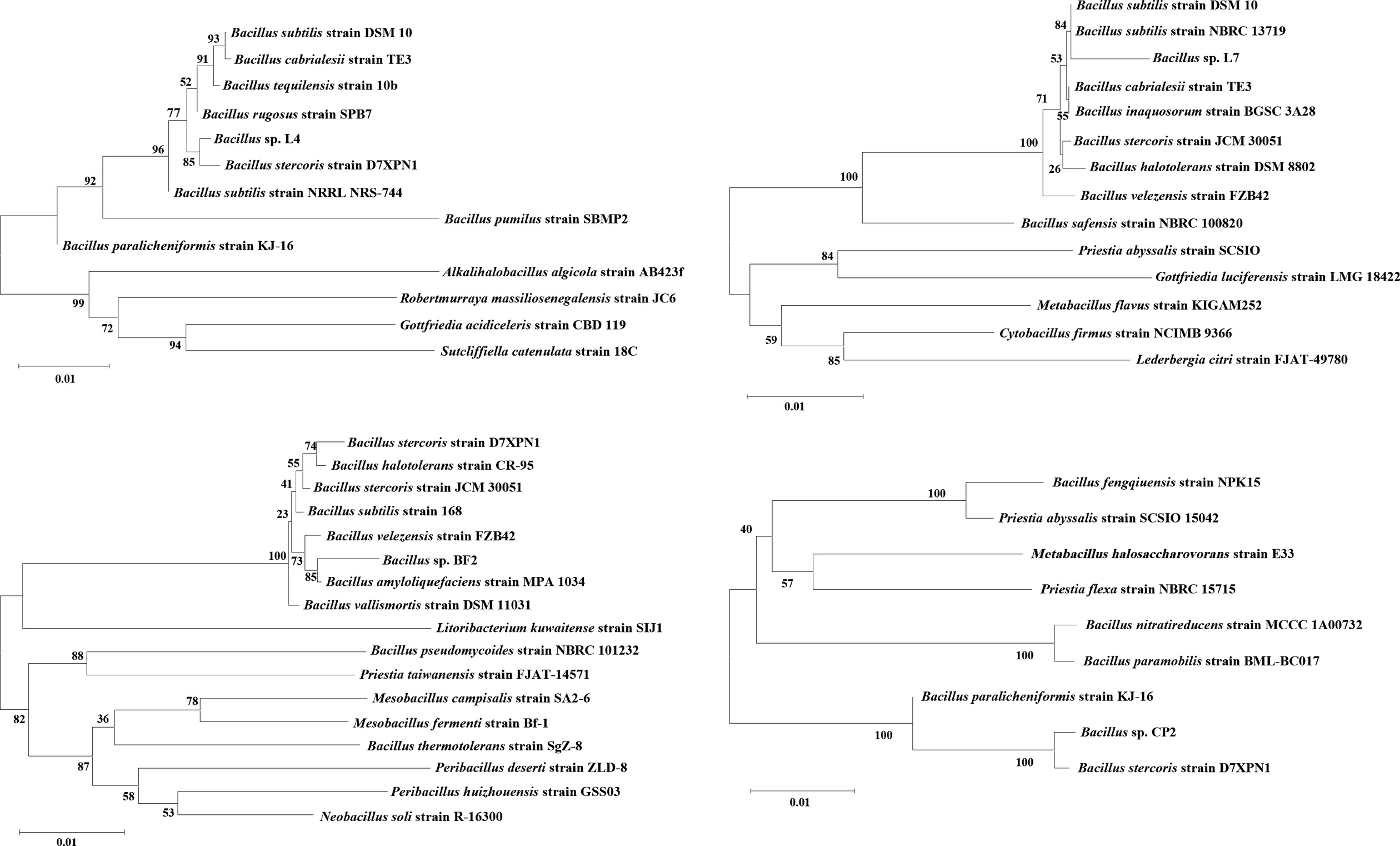
经多次筛选分离,成功从新会陈皮中筛选出四株高产酶菌株,并对其进行了16S rDNA基因测序,4株菌株的系统发育树如图2所示。菌株L4与Bacillus stercoris strain D7XPN1(99.52%,NR_181952.1)的序列相似性较高。菌株L7与Bacillus subtilis strain DSM 10(99.79%,NR_027552.1)和Bacillus subtilis strain NBRC 13719(99.79%,NR_112629.1)的序列相似性较高。菌株BF2与Bacillus amyloliquefaciens strain MPA 1034(99.44%,NR_117946.1)的序列相似性较高。菌株CP2与Bacillus stercoris strain D7XPN1(99.97%,NR_181952.1)序列相似性较高。因此,4株菌被归类为芽孢杆菌属。
2.2 菌株产酶能力
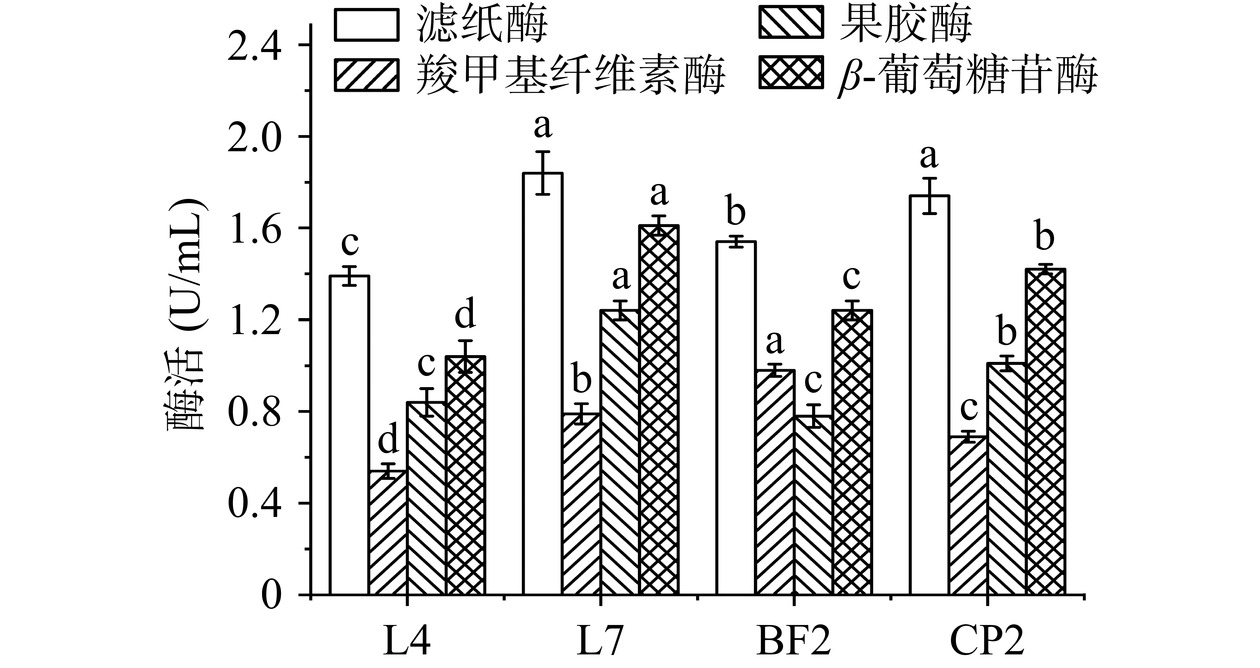
由图3可见,4株芽孢杆菌均能分泌滤纸酶、羧甲基纤维素酶、果胶酶和β-葡萄糖苷酶,其中L7的滤纸酶、果胶酶和β-葡萄糖苷酶的酶活最高,分别达到1.84、1.24和1.6 U/mL,而羧甲基纤维素酶酶活(0.79 U/mL)仅次于BF2(0.98 U/mL),这表明L7的产酶能力最强。纤维素、半纤维素、木质素和果胶相互交联形成致密的网状结构,导致新会陈皮活性成分难以释放和转化[24]。滤纸酶和羧甲基纤维素酶通过内切或外切的方式将植物细胞壁间连接的纤维多糖链末端水解成葡萄糖或纤维二糖,果胶酶能够将果胶水解成半乳糖醛酸,β-葡萄糖苷酶可通过水解大分子黄酮成分结构之间的糖苷键,将其转化成小分子黄酮组分[7],因此,微生物分泌上述4种酶的能力越强,其潜在的发酵陈皮的效果越佳。上述结果表明4株芽孢杆菌中,L7具有最高的陈皮发酵潜力。
2.3 菌株益生特性和安全性
2.3.1 自聚集性
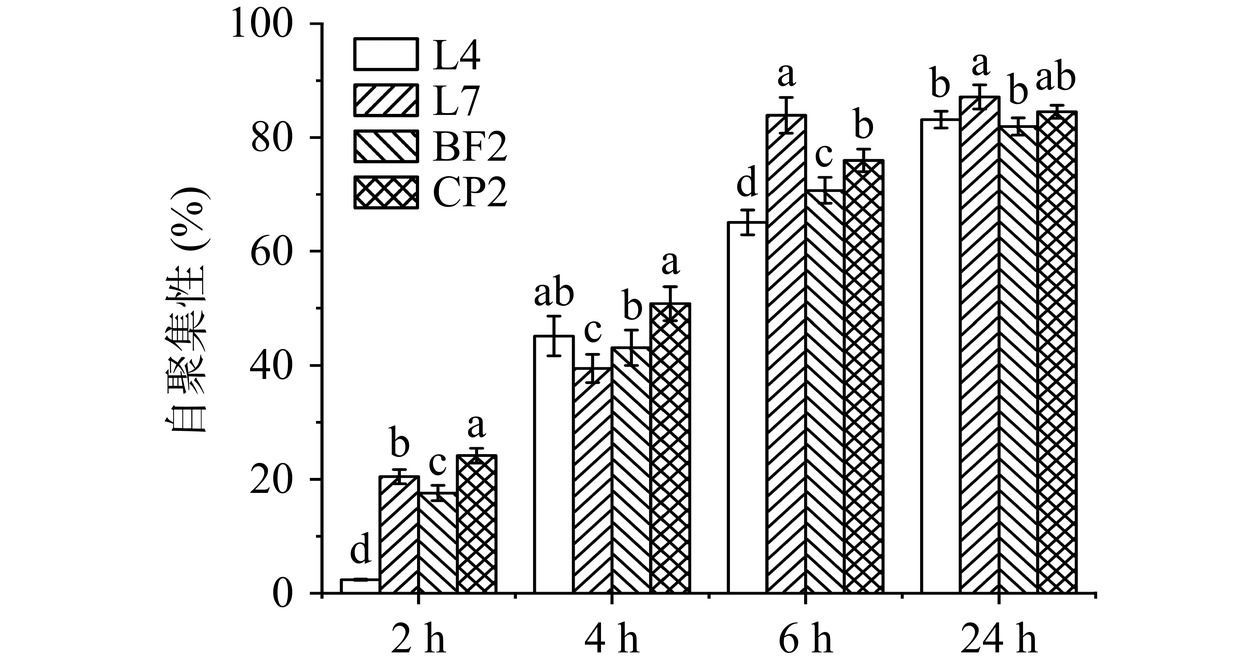
自聚集性可用于评估微生物的黏附能力,自聚集性越高,其在胃肠道中的定植和黏附能力越强[25]。由于微生物表面的特异性,不同微生物2 h内的自聚集性结果差异显著(P<0.05)(图4)。2~6 h内,所有菌株的自聚集性迅速提高,其中L7菌株的自聚集能力最强,达到83.9%;随着时间的进一步延长,菌株自聚集性缓慢上升,且菌株间的差异逐渐减小,但L7菌株的自聚集性在24 h后仍处于较高水平(88.4%)。研究显示,食物在人体肠道内的停留时间约为6~8 h[26],因此前6 h自聚集性表现最好的L7菌株进入宿主肠道后能更快、更好地黏附在肠道上皮细胞上,发挥益生作用。
2.3.2 胃肠液耐受性
经胃肠道环境后菌株的存活能力是评估其在宿主体内定植的必要条件[27]。由表3可见,4株芽孢杆菌在模拟胃肠液环境中的存活率均高于60%,展现出较强的耐受性。其中L7在人工胃液和人工肠液中的存活率显著高于其他菌株(P<0.05),分别达到94.3%和87.1%,表明其对宿主体内的极端酸性环境、消化酶以及胆盐具有良好的耐受能力,因此能更好地在宿主体内定植,发挥益生效果。之前有文献也曾报道芽孢杆菌具有良好的胃肠液耐受性,这可能与其孢子的抗胆盐和酸盐的能力有关[28]。
表 3 菌株的胃肠液耐受性(%)Table 3. Gastrointestinal tolerance of strains (%)模拟环境 L4 L7 BF2 CP2 人工胃液 85.8±2.1b 94.3±3.2a 65.4±3.3d 72.6±2.4c 人工肠液 78.3±3.2b 87.1±4.2a 71.1±2.7c 81.1±4.1b 注:同一行中的不同字母上标表示差异显著(P<0.05)。 2.3.3 抑菌性和共聚集性
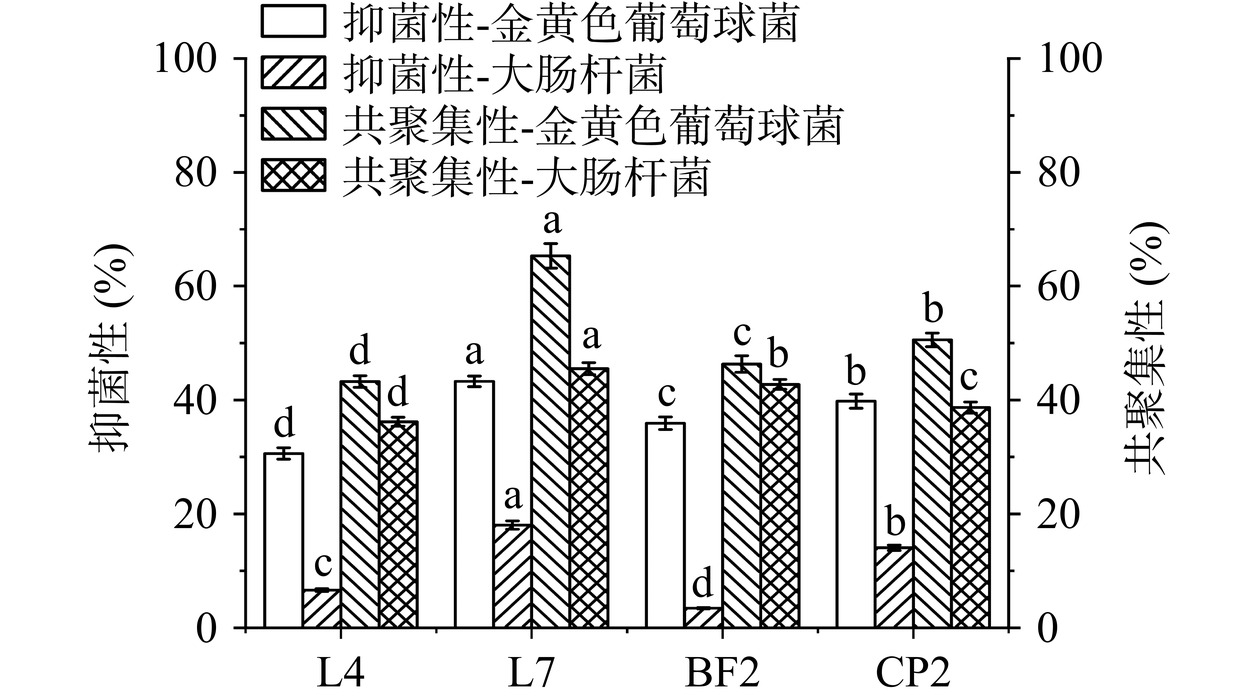
菌株良好的抑菌性是预防宿主感染病原菌的保障。由图5可见,4株芽孢杆菌均对S. aureus具有较强的抑制作用,而对E. coli的抑制作用较弱。其中L7对E. coli及S. aureus的抑菌活性最高,分别达到18.1%和43.2%,展现出较好的抑菌能力。研究显示,微生物对病原菌拮抗作用的差异可能与其分泌的有机酸、多肽以及多糖等抑菌物质有关[29]。此外,4株芽孢杆菌对指示菌展现出较强的共聚集能力,其中L7对E. coli及S. aureus的共聚集能力最强,分别达到45.5%和65.3%。据报道具有高共聚集性的菌株能够与病原菌竞争肠上皮细胞结合位点,阻止其在肠道中的黏附[30]。因此,上述结果表明L7菌株可通过抑制病原菌生长或与病原菌共聚集干扰病原菌在宿主体内的定植,降低宿主被病原菌感染的风险。
![]() 图 5 菌株的抑菌性和共聚集性注:不同字母表示相同指标下不同菌种间差异显著(P<0.05);图7同。Figure 5. Antibacterial activity and co-aggregation ability of strains
图 5 菌株的抑菌性和共聚集性注:不同字母表示相同指标下不同菌种间差异显著(P<0.05);图7同。Figure 5. Antibacterial activity and co-aggregation ability of strains2.3.4 溶血性
为了保证筛选的微生物能够安全地应用于陈皮食品加工,对4株菌株的溶血性进行了测试,结果如图6所示,4株芽孢杆菌菌落周围均未出现草绿色色带或无色透明圈,表明4株微生物不具备α-溶血性和β-溶血性,安全性良好。
2.3.5 药敏性
部分微生物含有潜在的耐药基因,这些基因在宿主体内可能被转移到病原菌内,使其产生耐药性,因此,测定微生物的药敏性是评估其安全性的重要部分。由表4可见,4株芽孢杆菌均对头孢氨苄、四环素及氯霉素敏感,且每株芽孢杆菌至少对4种及以上的抗生素具有敏感性,表明这4株芽孢杆菌在耐药性方面具有较好的安全性。所有菌株均对青霉素和克林霉素耐药,这可能与这两种抗生素的抑菌谱较窄有关。此外,4株菌株中仅L7对庆大霉素敏感,表明其或许可用于缓解由庆大霉素对肠道微生物菌群的破坏而引起的腹泻作用[31]。上述结果表明从新会陈皮中筛选出的4株芽孢杆菌产酶能力强,且具有一定的益生特性和安全性,符合益生菌筛选标准,因此,后续将用4株芽孢杆菌发酵陈皮并比较其发酵效果。
表 4 菌株的药敏性Table 4. Drug sensitivity of strains药物名称 L4 L7 BF2 CP2 青霉素 R R R R 氨苄西林 S S S I 头孢氨苄 S S S S 庆大霉素 R S R I 四环素 S S S S 诺氟沙星 S S R S 克林霉素 R R R R 氯霉素 S S S S 注:R代表耐药,I代表中介,S代表敏感。 2.4 不同菌株发酵对新会陈皮黄酮成分的影响
2.4.1 游离态黄酮和结合态黄酮含量变化
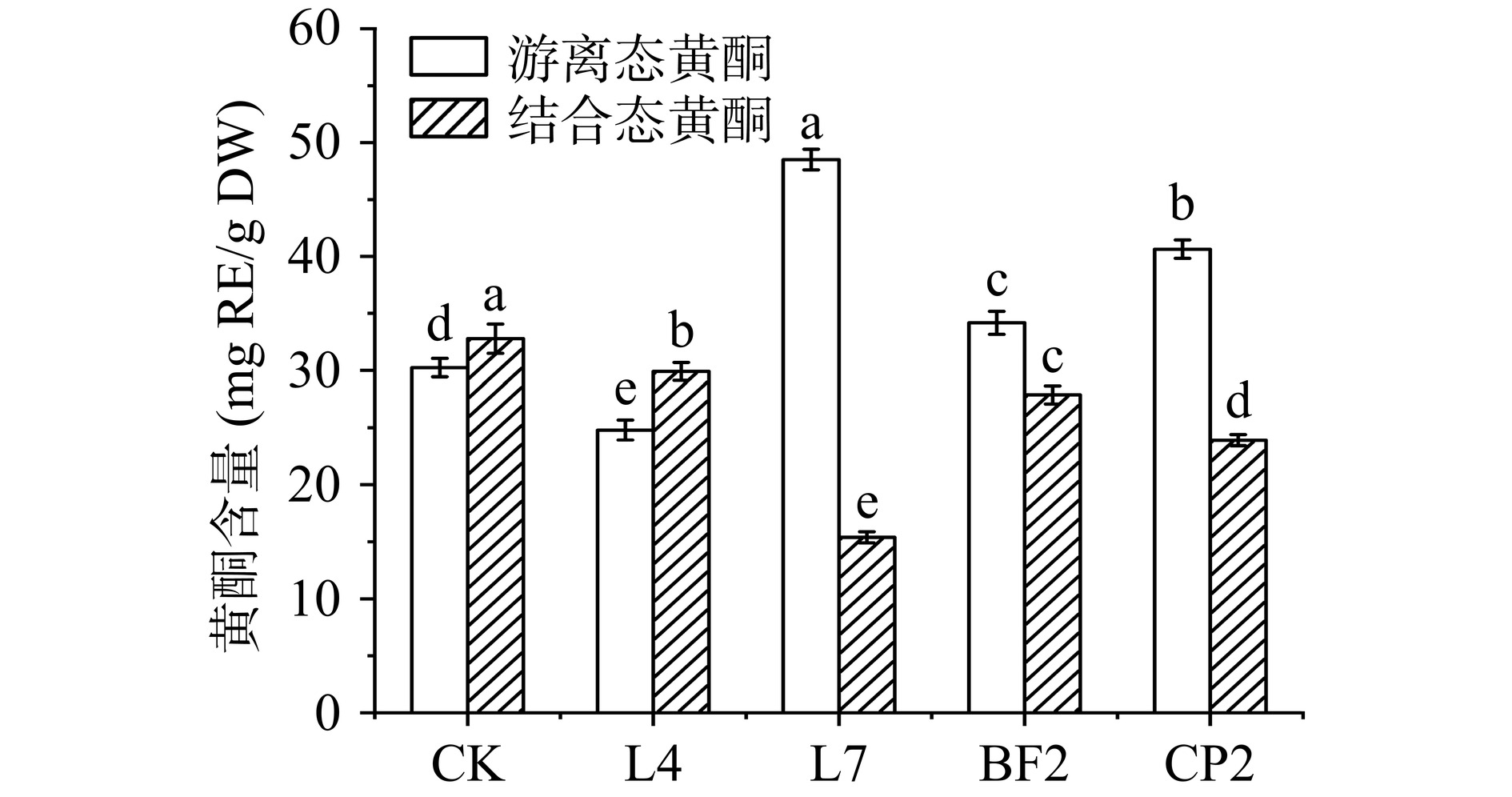
植物中的黄酮类成分常以游离态和结合态的形式存在[32],因此对发酵后的新会陈皮的两种形态的黄酮含量进行了测定。由图7可见,新会陈皮经L7发酵后,其游离态黄酮含量较对照组提高了60.4%,而结合态黄酮含量则下降了53.1%,其变化显著高于其他组(P<0.05)。这与其较高的产滤纸酶、羧甲基纤维素酶、果胶酶和β-葡萄糖苷酶能力有关。发酵过程中L7分泌的高活性水解酶不仅能够破坏新会陈皮植物细胞壁的结构,促进其胞内游离态的黄酮代谢产物的释放,还能够水解结合态黄酮与植物组织中的纤维素、蛋白质、果胶之间形成的共价键,将其转化为游离态形式,进而提高游离态黄酮含量[33−34]。
2.4.2 主要黄酮类化合物组分含量变化
为了进一步了解发酵后新会陈皮黄酮组分的变化,对游离态黄酮和结合态黄酮的组成进行了分析,结果如表5和表6所示。不同发酵样品中游离态黄酮和结合态黄酮成分组成一致,均包含黄酮糖苷类(柚皮苷和橙皮苷)、黄酮苷元类(柚皮素和橙皮素)以及聚甲氧基黄酮类(川陈皮素和桔皮素)成分,但不同成分含量差异显著(P<0.05),其中橙皮苷、川陈皮素和桔皮素含量最高,这与前人研究结果一致[35]。整体来看,经L7发酵后,新会陈皮中游离态黄酮中柚皮苷、橙皮苷、柚皮素、橙皮素、川陈皮素和桔皮素含量较未发酵新会陈皮分别提高了44.4%、34.8%、128.5%、185.7%、93.7%以及102.7%,而结合态黄酮中这6种组分分别较未发酵新会陈皮下降了60.4%、62.8%、66.7%、64.2%、56.2%和57.4%,这表明发酵有效地将结合态黄酮成分转化成游离态形式释放,这与图7结果一致。
表 5 新会陈皮黄酮成分LC-HRESI-MS/MS鉴定结果Table 5. LC-HRESI-MS/MS identification results of flavonoids composition of Xinhuichenpi序号 分子离子 ([M+H]+, m/z) MS/MS离子碎片 ([M+H]+, m/z) 分子量 分子式 化合物名称 参考依据 1 581.19 581.19, 563.18, 545.17, 527.15, 459.13, 435.13, 419.13, 417.12, 400.81, 383.11, 339.09, 315.09, 273.08 580 C27H32O14 柚皮苷 mzCloud数据库、mzVault数据库和标准品 2 611.20 611.20, 593.19, 575.18, 557.17, 539.16, 491.16, 489.14, 465.15, 449.14, 446.90, 431.13, 413.12, 369.10, 345.10, 303.09 610 C28H34O15 橙皮苷 mzCloud数据库、mzVault数据库和标准品 3 273.08 273.08, 255.07, 231.06, 189.05, 179.03, 163.07, 153.02, 147.04, 121.06 272 C15H12O5 柚皮素 mzCloud数据库、mzVault数据库和标准品 4 303.09 303.09, 285.08, 261.08, 219.07, 201.05, 193.09, 179.03, 177.05, 153.02, 145.03 302 C16H14O6 橙皮素 mzCloud数据库、mzVault数据库和标准品 5 403.14 403.14, 388.12, 373.09, 370.11, 355.08, 342.11, 327.09 402 C21H22O8 川陈皮素 mzCloud数据库、mzVault数据库和标准品 6 373.13 373.13, 358.10, 343.08, 325.09, 312.10, 297.08, 284.11, 266.90 372 C20H20O7 桔皮素 mzCloud数据库、mzVault数据库和标准品 表 6 不同菌株发酵新会陈皮游离态和结合态黄酮成分含量Table 6. Free and bound flavonoids composition content of fermented Xinhuichenpi using different strains化合物名称 游离态黄酮组成 (mg/g) 结合态黄酮组成 (mg/g) CK L4 L7 BF2 CP2 CK L4 L7 BF2 CP2 柚皮苷 0.27±0.017D 0.32±0.027C 0.39±0.013B 0.24±0.009E 0.43±0.008A 0.48±0.008a 0.36±0.012b 0.19±0.007d 0.32±0.14c 0.14±0.005e 橙皮苷 20.31±0.16C 13.07±0.19E 27.37±0.36A 19.74±0.18D 24.23±0.18B 18.73±0.23a 14.06±0.33b 6.96±0.12e 11.32±0.15d 13.08±0.11c 柚皮素 0.07±0.006D 0.094±0.006C 0.16±0.005A 0.079±0.004D 0.13±0.006B 0.12±0.003a 0.11±0.003b 0.04±0.001e 0.07±0.002d 0.09±0.002c 橙皮素 0.07±0.002E 0.085±0.008D 0.20±0.009A 0.13±0.006C 0.17±0.01B 0.14±0.008a 0.08±0.009b 0.05±0.001c 0.08±0.006b 0.08±0.004b 川陈皮素 4.47±0.11D 5.72±0.29C 8.66±0.43A 6.39±0.23B 4.53±0.053D 7.06±0.12a 5.63±0.27b 3.09±0.15d 5.43±0.12b 4.27±0.10c 桔皮素 2.88±0.13CD 2.99±0.17C 5.84±0.18A 4.51±0.21B 3.22±0.15C 5.59±0.25a 4.58±0.14b 2.38±0.21d 4.78±0.29b 3.04±0.41c 注:同一行中的不同大写字母上标表示不同样品组之间游离态黄酮组成的差异显著性(P<0.05);同一行中的不同小写字母上标表示不同样品组之间结合态黄酮组成的差异显著性(P<0.05)。 进一步对两种形态不同类型的黄酮类组分含量进行分析,发现新会陈皮经L7发酵后,游离态和结合态黄酮中柚皮苷和橙皮苷这两种黄酮糖苷含量总量(0.58和34.33 mg/g)均低于未发酵的新会陈皮(0.75和39.04 mg/g),这可能是由于发酵过程中随着易被利用的营养成分的减少,部分游离态橙皮苷和柚皮苷被微生物当作碳源代谢消耗[36]。然而,两种形态的黄酮苷元柚皮素和橙皮素总量(0.20和0.25 mg/g)却明显高于未发酵新会陈皮(0.19和0.21 mg/g),这表明损失的柚皮苷和橙皮苷还可能被微生物分泌的水解酶水解脱除两个糖苷分子而转化成橙皮素和柚皮素[37]。在聚甲氧基黄酮含量变化方面,L7发酵后的新会陈皮的两种形态的川陈皮素和桔皮素总量和未发酵新会陈皮相似,这表明发酵后游离形态的川陈皮素和桔皮素含量的提高主要归因于结合态形式向游离态形式的转化[34]。据报道,橙皮苷、川陈皮素、桔皮素等成分具有抑菌、抗炎、抗氧化等多种药理功效[1],因此,这些成分含量的提高可显著增强新会陈皮的食、医用价值。
2.5 不同菌株发酵陈皮的抗氧化活性分析及其特征成分筛选
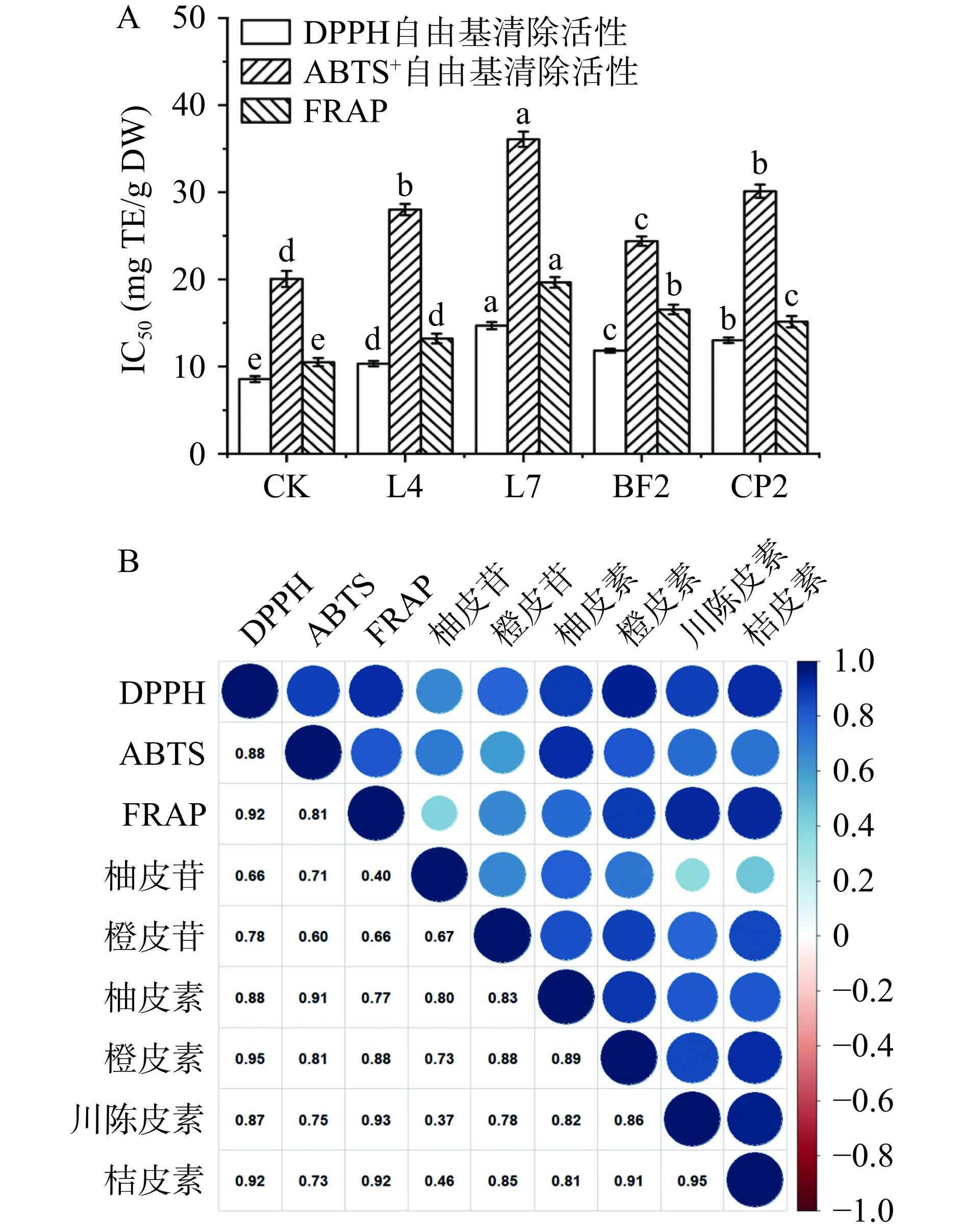
由图8A可见,L7发酵后的新会陈皮的DPPH自由基清除活性、ABTS+自由基清除活性以及FRAP的IC50值分别达到14.6、36.1和19.66 mg TE/g DW,较未发酵新会陈皮分别提高了71.7%、79.6%和87.4%,表明L7发酵能够显著增强新会陈皮的抗氧化活性(P<0.05)。Wang等[38]曾通过黑曲霉发酵新会陈皮,将其DPPH自由基清除活性、ABTS+自由基清除活性以及FRAP分别提高了63.1%、36.2%和90.5%,提升效果低于本研究结果,这可能是由于其所用的菌种黑曲霉来源于土壤,不属于新会陈皮自身微生物菌种。
抗氧化活性的变化与其黄酮成分的含量及组成密切相关。因此,对黄酮组分含量和抗氧化活性进行了Pearson相关性分析以进一步了解引起抗氧化活性增强的特征黄酮类成分。由图8B可见,6种黄酮组分和抗氧化活性之间均呈正相关。其中,柚皮素和橙皮素对DPPH自由基清除活性、ABTS+自由基清除活性和FRAP的相关性系数分别为0.88、0.91、0.77和0.95、0.81、0.88,均高于柚皮苷和橙皮苷对3种抗氧化活性的相关性系数,这表明柚皮素和橙皮素对抗氧化活性的变化影响更大。黄酮类化合物结构中的羟基数量和羟基的糖基化程度与抗氧化活性密切相关,柚皮素和橙皮素(均含有3个OH基)比橙皮苷和柚皮苷(均含有2个OH基)具有更多的OH基,且其7-OH基团取代了柚皮苷和橙皮苷的鼠李糖苷和葡萄糖苷,因此其抗氧化活性更强[39−40]。此外,羟基位置也是影响黄酮类化合物抗氧化活性的重要因素。Sghaier等[41]发现B环结构上的3’-或4’-羟基基团能提高ABTS+自由基清除能力,因此柚皮素(4’-羟基基团)ABTS+自由基清除活性高于橙皮素(5’-羟基基团)。值得注意的是,虽然聚甲氧基黄酮川陈皮素和桔皮素也对3种抗氧化活性显示出极强的相关性,但已有研究证实聚甲氧基黄酮因不具备羟基基团而表现出极低的抗氧化活性[42],因此本研究中抗氧化活性的变化与川陈皮素和桔皮素无关。此外,发酵过程中可能还产生了一些氨基酸、有机酸等物质,这些成分也会对抗氧化活性的增强起到促进作用[43]。
3. 结论
本研究成功从新会陈皮中筛选分离出4株产纤维素酶、果胶酶和β-葡萄糖苷酶能力突出的芽孢杆菌。所有菌株均有较强的自聚集性和胃肠道环境耐受性,可黏附在宿主体内,发挥益生作用。此外,筛选的菌株还具备良好的抑菌特性以及抗生素敏感性,可初步判定为符合益生菌标准的安全菌株。4株芽孢杆菌中L7发酵新会陈皮的效果最佳。L7菌株通过分泌高活性水解酶促进新会陈皮结合态黄酮转化为游离态形式释放,极大地提高主要黄酮类成分柚皮苷、橙皮苷、柚皮素、橙皮素、川陈皮素及桔皮素的含量。此外,经L7发酵后的新会陈皮抗氧化活性显著增强(P<0.05),这主要与其柚皮素和橙皮素含量的提高密切相关。本研究不仅扩充了新会陈皮益生菌种质资源库,同时为新会陈皮深加工技术以及功能食品的开发奠定了基础。
-
图 5 菌株的抑菌性和共聚集性
注:不同字母表示相同指标下不同菌种间差异显著(P<0.05);图7同。
Figure 5. Antibacterial activity and co-aggregation ability of strains
表 1 微生物药敏性评估标准
Table 1 Microbial susceptibility assessment criteria
药物名称 规格(μg/disc) 抑菌圈直径(mm) 耐药R 中介I 敏感S 青霉素 10 ≤28 28~29 ≥29 氨苄西林 10 ≤15 15~16 ≥16 头孢氨苄 30 ≤15 15~17 ≥17 庆大霉素 10 ≤13 13~14 ≥14 四环素 30 ≤15 15~18 ≥18 诺氟沙星 10 ≤13 13~16 ≥16 克林霉素 2 ≤16 16~18 ≥18 氯霉素 30 ≤12 13~17 ≥18 表 2 生理生化鉴定结果
Table 2 Results of physiological and biochemical identification
项目 L4 L7 BF2 CP2 革兰氏染色 + + + + 淀粉水解 + + + + 酪蛋白水解 + + + + 明胶水解 + + + + V.P试验 + + + + 吲哚试验 + + + + 甲基红试验 – – – – 柠檬酸盐试验 + + + + 注:“+”代表阳性,“–”代表阴性。 表 3 菌株的胃肠液耐受性(%)
Table 3 Gastrointestinal tolerance of strains (%)
模拟环境 L4 L7 BF2 CP2 人工胃液 85.8±2.1b 94.3±3.2a 65.4±3.3d 72.6±2.4c 人工肠液 78.3±3.2b 87.1±4.2a 71.1±2.7c 81.1±4.1b 注:同一行中的不同字母上标表示差异显著(P<0.05)。 表 4 菌株的药敏性
Table 4 Drug sensitivity of strains
药物名称 L4 L7 BF2 CP2 青霉素 R R R R 氨苄西林 S S S I 头孢氨苄 S S S S 庆大霉素 R S R I 四环素 S S S S 诺氟沙星 S S R S 克林霉素 R R R R 氯霉素 S S S S 注:R代表耐药,I代表中介,S代表敏感。 表 5 新会陈皮黄酮成分LC-HRESI-MS/MS鉴定结果
Table 5 LC-HRESI-MS/MS identification results of flavonoids composition of Xinhuichenpi
序号 分子离子 ([M+H]+, m/z) MS/MS离子碎片 ([M+H]+, m/z) 分子量 分子式 化合物名称 参考依据 1 581.19 581.19, 563.18, 545.17, 527.15, 459.13, 435.13, 419.13, 417.12, 400.81, 383.11, 339.09, 315.09, 273.08 580 C27H32O14 柚皮苷 mzCloud数据库、mzVault数据库和标准品 2 611.20 611.20, 593.19, 575.18, 557.17, 539.16, 491.16, 489.14, 465.15, 449.14, 446.90, 431.13, 413.12, 369.10, 345.10, 303.09 610 C28H34O15 橙皮苷 mzCloud数据库、mzVault数据库和标准品 3 273.08 273.08, 255.07, 231.06, 189.05, 179.03, 163.07, 153.02, 147.04, 121.06 272 C15H12O5 柚皮素 mzCloud数据库、mzVault数据库和标准品 4 303.09 303.09, 285.08, 261.08, 219.07, 201.05, 193.09, 179.03, 177.05, 153.02, 145.03 302 C16H14O6 橙皮素 mzCloud数据库、mzVault数据库和标准品 5 403.14 403.14, 388.12, 373.09, 370.11, 355.08, 342.11, 327.09 402 C21H22O8 川陈皮素 mzCloud数据库、mzVault数据库和标准品 6 373.13 373.13, 358.10, 343.08, 325.09, 312.10, 297.08, 284.11, 266.90 372 C20H20O7 桔皮素 mzCloud数据库、mzVault数据库和标准品 表 6 不同菌株发酵新会陈皮游离态和结合态黄酮成分含量
Table 6 Free and bound flavonoids composition content of fermented Xinhuichenpi using different strains
化合物名称 游离态黄酮组成 (mg/g) 结合态黄酮组成 (mg/g) CK L4 L7 BF2 CP2 CK L4 L7 BF2 CP2 柚皮苷 0.27±0.017D 0.32±0.027C 0.39±0.013B 0.24±0.009E 0.43±0.008A 0.48±0.008a 0.36±0.012b 0.19±0.007d 0.32±0.14c 0.14±0.005e 橙皮苷 20.31±0.16C 13.07±0.19E 27.37±0.36A 19.74±0.18D 24.23±0.18B 18.73±0.23a 14.06±0.33b 6.96±0.12e 11.32±0.15d 13.08±0.11c 柚皮素 0.07±0.006D 0.094±0.006C 0.16±0.005A 0.079±0.004D 0.13±0.006B 0.12±0.003a 0.11±0.003b 0.04±0.001e 0.07±0.002d 0.09±0.002c 橙皮素 0.07±0.002E 0.085±0.008D 0.20±0.009A 0.13±0.006C 0.17±0.01B 0.14±0.008a 0.08±0.009b 0.05±0.001c 0.08±0.006b 0.08±0.004b 川陈皮素 4.47±0.11D 5.72±0.29C 8.66±0.43A 6.39±0.23B 4.53±0.053D 7.06±0.12a 5.63±0.27b 3.09±0.15d 5.43±0.12b 4.27±0.10c 桔皮素 2.88±0.13CD 2.99±0.17C 5.84±0.18A 4.51±0.21B 3.22±0.15C 5.59±0.25a 4.58±0.14b 2.38±0.21d 4.78±0.29b 3.04±0.41c 注:同一行中的不同大写字母上标表示不同样品组之间游离态黄酮组成的差异显著性(P<0.05);同一行中的不同小写字母上标表示不同样品组之间结合态黄酮组成的差异显著性(P<0.05)。 -
[1] YU X, SUN S, GUO Y, et al. Citri reticulatae pericarpium (Chenpi):Botany, ethnopharmacology, phytochemistry, and pharmacology of a frequently used traditional Chinese medicine[J]. Journal of Ethnopharmacology,2018,220:265−82. doi: 10.1016/j.jep.2018.03.031
[2] BIAN X, XIE X, CAI J, et al. Dynamic changes of phenolic acids and antioxidant activity of citri reticulatae pericarpium during aging processes[J]. Food Chemistry, 2022, 373: 131399.
[3] ZHANG W, YANG R, FANG W, et al. Characterization of thermophilic fungal community associated with pile fermentation of Pu-erh tea[J]. International Journal of Food Microbiology,2016,227:29−33. doi: 10.1016/j.ijfoodmicro.2016.03.025
[4] 张鑫. 基于真菌与陈皮药效物质相关性研究陈皮陈化机制[D]. 成都:成都中医药大学, 2017. [ZHANG X. Study on the aging mechanism of citri reticulatae pericarpium based on the correlation between fungal and effective substance[D]. Chengdu:Chengdu University of Traditional Chinese Medicine, 2017.] ZHANG X. Study on the aging mechanism of citri reticulatae pericarpium based on the correlation between fungal and effective substance[D]. Chengdu: Chengdu University of Traditional Chinese Medicine, 2017.
[5] CHEN S, CHEN Z, ROTHENBERG D O N, et al. Short-term steaming during processing impacts the quality of citri reticulatae 'Chachi' peel[J]. Food Chemistry,2024,447:138964. doi: 10.1016/j.foodchem.2024.138964
[6] HE J, CHEN C, HE Q, et al. The central bacterial community in pericarpium citri reticulatae 'Chachiensis'[J]. Food Research International,2019,125:108624. doi: 10.1016/j.foodres.2019.108624
[7] SHEN F, WANG T, ZHANG R, et al. Metabolism and release of characteristic components and their enzymatic mechanisms in pericarpium citri reticulatae co-fermentation[J]. Food Chemistry,2024,432:137227. doi: 10.1016/j.foodchem.2023.137227
[8] 刘素娟, 张鑫, 王智磊, 等. 陈皮表面优势真菌的分离鉴定及其对药效物质的影响[J]. 世界科学技术-中医药现代化,2017,19(4):618−622. [LIU S J, ZHANG X, WANG Z L, et al. Separation and identification of surface preponderant fungi on citri reticulatae pericarpium and its influence on effective substance[J]. World Science and Technology/Modernization of Traditional Chinese Medicine and Materia Medica,2017,19(4):618−622.] doi: 10.11842/wst.2017.04.012 LIU S J, ZHANG X, WANG Z L, et al. Separation and identification of surface preponderant fungi on citri reticulatae pericarpium and its influence on effective substance[J]. World Science and Technology/Modernization of Traditional Chinese Medicine and Materia Medica, 2017, 19(4): 618−622. doi: 10.11842/wst.2017.04.012
[9] 刘丽娜. 基于微生物代谢对陈皮陈化活性物质转化机制的研究[D]. 湛江:广东海洋大学, 2019. [LIU L N. Study on the mechanism of the active substance transformation of citri reticulatae pericarpium aging based on microbial metabolism[D]. Zhanjiang:Guangdong Ocean University, 2019.] LIU L N. Study on the mechanism of the active substance transformation of citri reticulatae pericarpium aging based on microbial metabolism[D]. Zhanjiang: Guangdong Ocean University, 2019.
[10] 马天颖, 蔡俊. 植物乳杆菌发酵马齿苋陈皮工艺优化及发酵液抗氧化活性分析[J]. 食品研究与开发,2023,44(8):143−148. [MA T Y, CAI J. Optimization of fermentation process of Portulaca oleracea L. and citri reticulatae pericarpium by Lactobacillus plantarum and antioxidant activity of fermentation broth[J]. Food Research and Development,2023,44(8):143−148.] doi: 10.12161/j.issn.1005-6521.2023.08.021 MA T Y, CAI J. Optimization of fermentation process of Portulaca oleracea L. and citri reticulatae pericarpium by Lactobacillus plantarum and antioxidant activity of fermentation broth[J]. Food Research and Development, 2023, 44(8): 143−148. doi: 10.12161/j.issn.1005-6521.2023.08.021
[11] 吕晨豪, 李俊健, 高杰贤, 等. 陈皮乳酸芽孢杆菌发酵过程中风味与理化性质的变化规律[J]. 中国现代中药,2022,24(11):2109−2118. [LÜ C H, LI J J, GAO J X, et al. Changing patterns of flavor and physical and chemical properties of citri reticulatae pericarpium during fermentation with Bacillus sp J]. Modern Chinese Medicine,2022,24(11):2109−2118.
[12] 段志芳, 张少平, 付莉, 等. 枯草芽孢杆菌发酵陈皮对其提取物抗氧化活性的影响[J]. 食品科技,2018,43(5):259−264. [DUAN Z F, ZHANG S P, FU L, et al. The antioxidative activities of extracts from pericarpium citri reticulatae fermented by Bacillus subtilis[J]. Food Science and Technology,2018,43(5):259−264.] DUAN Z F, ZHANG S P, FU L, et al. The antioxidative activities of extracts from pericarpium citri reticulatae fermented by Bacillus subtilis[J]. Food Science and Technology, 2018, 43(5): 259−264.
[13] HE Q, LI J, MA Y, et al. Probiotic potential and cholesterol-lowering capabilities of bacterial strains isolated from pericarpium citri reticulatae 'Chachiensis'[J]. Microorganisms,2021,9(6):1224. doi: 10.3390/microorganisms9061224
[14] 张莎. 柑橘皮陈化过程中的微生物功能及剩余皮渣资源化研究[D]. 重庆:重庆大学, 2022. [ZHANG S. Study on microbial function in the aging process of citrus peel and resource utilization of residual citrus dregs[D]. Chongqing:Chongqing University, 2022.] ZHANG S. Study on microbial function in the aging process of citrus peel and resource utilization of residual citrus dregs[D]. Chongqing: Chongqing University, 2022.
[15] 布坎南R E, 吉本斯N E. 伯杰细菌鉴定手册(中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组译)[M]. 北京:科学出版社, 1984:729−740. [BUCHANAN R E, GIBBONS N E. Bergey’s manual of determinative bacteriology (Translated by the translation team of Bergey’s manual of determinative bacteriology, Institute of Microbiology, Chinese Academy of Sciences)[M]. Beijing:Science Press, 1984:729−740.] BUCHANAN R E, GIBBONS N E. Bergey’s manual of determinative bacteriology (Translated by the translation team of Bergey’s manual of determinative bacteriology, Institute of Microbiology, Chinese Academy of Sciences)[M]. Beijing: Science Press, 1984: 729−740.
[16] 何倩娴. 广陈皮源功能细菌菌株的筛选与鉴定[D]. 广州:华南理工大学, 2021. [HE Q X. Screening and characterization of beneficial bacterial strains isolated from Pericarpium Citri Reticulatae 'Chachiensis'[D]. Guangzhou:South China University of Technology, 2021.] HE Q X. Screening and characterization of beneficial bacterial strains isolated from Pericarpium Citri Reticulatae 'Chachiensis'[D]. Guangzhou: South China University of Technology, 2021.
[17] ZHANG G, DONG Y. Design and application of an efficient cellulose-degrading microbial consortium and carboxymethyl cellulase production optimization[J]. Frontiers in Microbiology,2022,13:957444.
[18] JEON H L, YANG S J, SON S H, et al. Evaluation of probiotic Bacillus subtilis P229 isolated from cheonggukjang and its application in soybean fermentation[J]. Lwt-Food Science and Technology,2018,97:94−99. doi: 10.1016/j.lwt.2018.06.054
[19] SOMASHEKARAIAH R, SHRUTHI B, DEEPTHI B V, et al. Probiotic properties of lactic acid bacteria isolated from neera:A naturally fermenting coconut palm nectar[J]. Frontiers in Microbiology,2019,10:1382.
[20] LEE S, LEE J, JIN Y I, et al. Probiotic characteristics of Bacillus strains isolated from Korean traditional soy sauce[J]. LWT-Food Science and Technology,2017,79:518−524. doi: 10.1016/j.lwt.2016.08.040
[21] 雷文平, 周辉, 陈绮, 等. 具有透明质酸酶抑制活性益生菌的体外筛选及鉴定[J]. 食品科学,2021,42(2):151−157. [LEI W P, ZHOU H, CHEN Q, et al. Screening and identification of probiotics with hyaluronidase inhibitory activity in vitro[J]. Food Science,2021,42(2):151−157.] LEI W P, ZHOU H, CHEN Q, et al. Screening and identification of probiotics with hyaluronidase inhibitory activity in vitro[J]. Food Science, 2021, 42(2): 151−157.
[22] OBOH G, ADEMILUYI A O, AKINYEMI A J, et al. Inhibitory effect of polyphenol-rich extracts of jute leaf (Corchorus olitorius) on key enzyme linked to type 2 diabetes (α-amylase and α-glucosidase) and hypertension (angiotensin I converting) in vitro[J]. Journal of Functional Foods,2012,4(2):450−458. doi: 10.1016/j.jff.2012.02.003
[23] 王露. 番石榴叶活性多酚组分快速鉴别及发酵释放与转化机制[D]. 广州:华南理工大学, 2018. [WANG L. Quick identification and the mechanism in the release and transformation by fermentation of active phenolics components in guava leaves[D]. Guangzhou:South China University of Technology, 2018.] WANG L. Quick identification and the mechanism in the release and transformation by fermentation of active phenolics components in guava leaves[D]. Guangzhou: South China University of Technology, 2018.
[24] WANG H, CHEN G, FU X, et al. Effects of aging on the phytochemical profile and antioxidative activity of pericarpium citri reticulatae 'Chachiensis'[J]. RSC Advances,2016,6(107):105272−105281. doi: 10.1039/C6RA22082G
[25] COLLADO M C, SURONO I, MERILUOTO J, et al. Indigenous dadih lactic acid bacteria:Cell-surface properties and interactions with pathogens[J]. Journal of Food Science,2007,72(3):89−93.
[26] BYAKIKA S, MUKISA I M, BYARUHANGA Y B, et al. A review of criteria and methods for evaluating the probiotic potential of microorganisms[J]. Food Reviews International,2019,35(5):427−466. doi: 10.1080/87559129.2019.1584815
[27] CHALAS R, JANCZAREK M, BACHANEK T, et al. Characteristics of oral probiotics:A review[J]. Current Issues in Pharmacy and Medical Sciences,2016,29(1):8−10. doi: 10.1515/cipms-2016-0002
[28] VECCHIONE A, CELANDRONI F, MAZZANTINI D, et al. Compositional quality and potential gastrointestinal behavior of probiotic products commercialized in Italy[J]. Frontiers in Medicine,2018,5:59.
[29] CHOI A R, PATRA J K, KIM W J, et al. Antagonistic activities and probiotic potential of lactic acid bacteria derived from a plant-based fermented food[J]. Frontiers in Microbiology,2018,9:1963−1975. doi: 10.3389/fmicb.2018.01963
[30] SARANIYA A, JEEVARATNAM K. In vitro probiotic evaluation of phytase producing Lactobacillus species isolated from Uttapam batter and their application in soy milk fermentation[J]. Journal of Food Science and Technology,2015,52(9):5631−5640. doi: 10.1007/s13197-014-1686-y
[31] DAS D J, SHANKAR A, JOHNSON J B, et al. Critical insights into antibiotic resistance transferability in probiotic Lactobacillus[J]. Nutrition,2020,69:110567−1105673. doi: 10.1016/j.nut.2019.110567
[32] KIM H J, CHEN F, WANG X, et al. Effect of methyl jasmonate on phenolics, isothiocyanate, and metabolic enzymes in radish sprout (Raphanus sativus L.)[J]. Journal of Agricultural and Food Chemistry,2006,54(19):7263−7269. doi: 10.1021/jf060568c
[33] 陈东方. 酶解提高燕麦粉抗氧化活性的作用机制[D]. 咸阳:西北农林科技大学, 2016. [CHEN D F. Mechanism of enhancement of antioxidant activity of oat flour after enzymatic hydrolysis[D]. Xianyang:Northwest A&F University, 2016.] CHEN D F. Mechanism of enhancement of antioxidant activity of oat flour after enzymatic hydrolysis[D]. Xianyang: Northwest A&F University, 2016.
[34] WANG L, BEI Q, WU Y N, et al. Characterization of soluble and insoluble-bound polyphenols from Psidium guajava L. leaves co-fermented with Monascus anka and Bacillus sp and their bio-activities[J]. Journal of Functional Foods,2017,32:149−159. doi: 10.1016/j.jff.2017.02.029
[35] ZHANG J, WU X, QU J, et al. Comprehensive comparison on the chemical profile of Guang Chen Pi at different ripeness stages using untargeted and pseudotargeted metabolomics[J]. Journal of Agricultural and Food Chemistry,2020,68(31):8483−8495. doi: 10.1021/acs.jafc.0c02904
[36] YANG J, LAGISHETTY V, KURNIA P, et al. Microbial and chemical profiles of commercial kombucha products[J]. Nutrients,2022,14(3):670. doi: 10.3390/nu14030670
[37] FERREIRA L R, MACEDO J A, RIBEIRO M L, et al. Improving the chemopreventive potential of orange juice by enzymatic biotransformation[J]. Food Research International,2013,51(2):526−535. doi: 10.1016/j.foodres.2013.01.018
[38] WANG F, CHEN L, CHEN S, et al. Microbial biotransformation of pericarpium citri reticulatae (PCR) by Aspergillus niger and effects on antioxidant activity[J]. Food Science & Nutrition,2021,9(2):855−865.
[39] HEIM K E, TAGLIAFERRO A R, BOBILYA D J. Flavonoid antioxidants:Chemistry, metabolism and structure-activity relationships[J]. The Journal of Nutritional Biochemistry,2002,13(10):572−584. doi: 10.1016/S0955-2863(02)00208-5
[40] CHEN J W, ZHU Z Q, HU T X, et al. Structure-activity relationship of natural flavonoids in hydroxyl radical-scavenging effects[J]. Acta Pharmacologica Sinica,2002,23(7):667−672.
[41] SGHAIER M B, SKANDRANI I, NASR N, et al. Flavonoids and sesquiterpenes from Tecurium ramosissimum promote anti-proliferation of human cancer cells and enhance antioxidant activity:A structure-activity relationship study[J]. Environmental Toxicology and Pharmacology,2011,32(3):336−348. doi: 10.1016/j.etap.2011.07.003
[42] GARCIA B F, TORRES A, MACIAS F A. Synergy and other interactions between polymethoxyflavones from Citrus byproducts[J]. Molecules,2015,20(11):20079−20106. doi: 10.3390/molecules201119677
[43] GAO H, WANG W, XU D, et al. Taste-active indicators and their correlation with antioxidant ability during the Monascus rice vinegar solid-state fermentation process[J]. Journal of Food Composition and Analysis,2021,104:104133. doi: 10.1016/j.jfca.2021.104133





 下载:
下载:
 下载:
下载:



